Chia sẻ một số xu hướng mới trong tim mạch can thiệp
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
PGS.TS.BS. Phạm Mạnh Hùng
ThS.BSNT. Lê Xuân Thận
TS.BSNT. Phan Tuấn Đạt
ThS.BSNT. Trần Bá Hiếu
ThS.BSNT. Trần Ngọc Cầm
ThS.BSNT. Nguyễn Văn Thành
ThS.BS. Hoàng Phi Điệp
ThS.BSNT. Lê Võ Kiên
ThS.BSNT. Phùng Đình Thọ
ThS.BSNT. Nguyễn Văn Hiếu
Trungtamthuoc.com - Xã hội ngày càng phát triển thì các phát minh về máy móc, thiết bị và các xu hướng điều trị mới trong y học nói chung và trong tim mạch can thiệp nói riêng ngày càng đổi mới. Vậy nhứng xu hướng mới trong tim mạch can thiệp hiện nay có những gì? Hãy cùng Trung Tâm Thuốc Central Pharmacy tìm hiều trong bài viết dưới đây.
1 Xu hướng kết hợp đa chuyên nghành - nhóm " Heart team"
Cho đến gần đây, bệnh nhân vẫn được đánh giá và điều trị bởi các chuyên ngành riêng biệt. Với sự phát triển của các kỹ thuật hybrid đã kết hợp các chuyên khoa tạo ra một nhóm đa chuyên khoa. Hay gặp nhất của heart team là trong điều trị bệnh van tim phức tạp như TAVI, tuy nhiên khái niệm “heart team” cũng được sử dụng trong điều trị các bệnh tim mạch khác như hội chứng chủ cấp và rối loạn nhịp tim. Mặc dù nhóm đa chuyên khoa trong điều trị bệnh nhân ung thư và vận chuyển bệnh nhân đã được áp dụng từ lâu, gần đây mới phát triển và phổ biến trong điều trị bệnh tim mạch phức tạp.
Nhóm “Heart team” bao gồm bác sĩ nội khoa tim mạch, bác sĩ siêu âm tim, phẫu thuật viên tim mạch, bác sĩ can thiệp tim mạch, chuyên gia về bệnh van tim và siêu âm tim, bác sĩ gây mê tim mạch, điều dưỡng,…Sự kết hợp đa chuyên khoa sẽ giúp phân tích đánh giá bệnh nhân và lựa chọn phương án tốt nhất cho người bệnh, bệnh nhân được tư vấn đầy đủ thông tin, chăm sóc lấy bệnh nhân làm trung tâm.
2 Phòng mổ Hybrid trong tim mạch can thiệp
Sự đồng thuận của các chuyên gia đã nhấn mạnh sự tiếp cận của nhóm “heart team” trong quyết định điều trị ở bệnh nhân hẹp van động mạch chủ và là khuyến cáo loại 1 ở những bệnh nhân mạch vành. Sự tiếp cận đa chuyên khoa sẽ giúp tối ưu hoá điều trị bệnh nhân và giúp xem xét liệu hybrid có thích hợp cho một bệnh nhân cụ thể. Phòng mổ hybrid là hình thức điển hình của sự tiếp cận đa chuyên khoa “heart team”.
Can thiệp tim mạch hybrid tích hợp kỹ thuật can thiệp tim mạch với phẫu thuật tim mạch, mục đích để tối ưu hoá hiệu quả trong khi xâm lấn tối thiểu. Những ví dụ như: thay van động mạch chủ qua đường ống thông (TAVI), can thiệp nội mạch động mạch chủ ngực (TEVAR) và động mạch chủ bụng (EVAR), kết hợp can thiệp động mạch vành qua da với can thiệp bệnh tim cấu trúc. Một số can thiệp như TAVI, TEVAR và EVAR hiện nay đã trở thành phương pháp điều trị tiêu chuẩn cho những bệnh nhân phù hợp. Do đã được chứng minh giúp cải thiện tiên lượng, chỉ định của các phương pháp điều trị hybrid ngày càng mở rộng.
Mặc dù một vài thủ thuật mới này có thể thực hiện ở phòng mổ truyền thống hoặc phòng can thiệp, tuy nhiên các thiết kế phòng này không thích hợp để thực hiện hầu hết các can thiệp hybrid khác. Phòng hybrid đòi hỏi: phòng mổ với máy chụp mạch độ phân giải cao hoặc phòng can thiệp có khả năng mổ – “phòng mổ hybrid”.
2.1 Thiết kế của phòng mổ hybrid
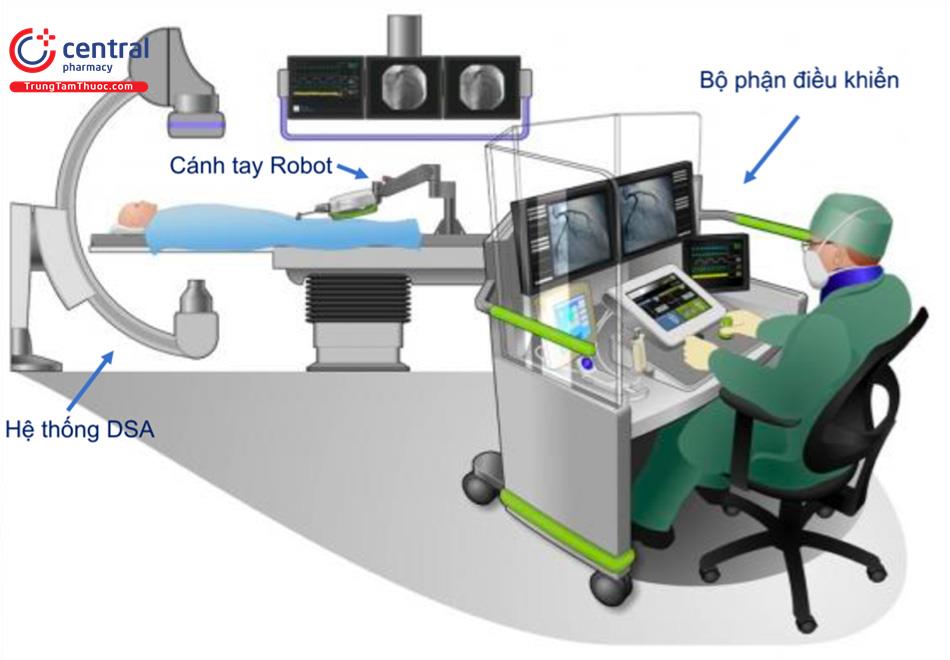
Phòng mổ hybrid bao gồm các thiết bị hình ảnh tiên tiến trong 1 phòng mổ đầy đủ chức năng. Mặc dù nhiều phẫu thuật hybrid có thể thực hiện trong phòng mổ truyền thống với C-arm hoặc trong phòng can thiệp. Trong thực hành lâm sàng, phòng mổ hybrid bao gồm phòng mổ được trang bị đầy đủ với máy chụp số hoá xoá nền chất lượng cao và một bàn mổ thích hợp với cả chụp mạch và mổ mở. Các thiết bị khác như hệ thống chụp mạch 2 bình diện, máy siêu âm, có thể kết hợp với hệ thống hình ảnh khi thích hợp. Một vùng điều khiển cho các kỹ thuật viên hình ảnh được tích hợp.
Phòng mổ hybrid tim mạch được sử dụng bởi các phẫu thuật viên tim mạch và các bác sĩ can thiệp tim mạch cũng như đội ngũ gây mê, điều dưỡng, kỹ thuật viên hình ảnh. Do yêu cầu thêm diện tích cho các thiết bị hình ảnh, do đó phòng mổ hybrid sẽ có diện tích lớn hơn đáng kể phòng mổ truyền thống – tầm 93 m2 hoặc lớn hơn. Phòng mổ cũng yêu cầu phải chuẩn bị cẩn thận vị trí đặt các thiết bị. Phòng mổ hybrid phải linh hoạt cho các cuộc mổ trong tương lai. Cuối cùng, cần thiết kế một mô hình vị trí các thiết bị, bao gồm các yêu cầu đi kèm như hệ thống khí, đường dây điện để đảm bảo tính khả thi của phẫu thuật. Phụ thuộc vào hệ thống hình ảnh được sử dụng thì vị trí của đèn phẫu thuật, monitor có thể rất thay đổi. Hệ thống huỳnh quang treo tường phải tính đến luồng thông khí của phòng mổ. Khi sơ đồ giả định được tạo ra, người sử dụng trong tương lai (bao gồm các chuyên khoa khác nhau) phải đảm bảo rằng phù hợp với thao tác công việc.
2.2 Lợi thế của phòng mổ hybrid so với phòng can thiệp truyền thống và phòng mổ truyền thống
Trên thực tế thủ thuật hybrid như TAVI và TEVAR được tiến hành ở phòng cathlab truyền thống hoặc phòng mổ hơn là phòng chuyên dụng cho hybrid. Tuy nhiên điều này có thể ảnh hưởng không tốt đến bệnh nhân. Theo thông thường thì việc chuyển phòng ban đầu khẩn cấp sang thành phòng phẫu thuật có thể làm nảy sinh ra nhiều vấn đề. Ánh sáng kém, thiếu dụng cụ phẫu thuật, máy hút và tiếp cận kém với máy tim phổi nhân tạo gây ra thảm họa phẫu thuật. Các thiết bị gây mê cũng cần một khoảng diện tích trong phòng can thiệp. Phòng can thiệp hybrid sẽ cung cấp đầy đủ những yêu cầu chuyển đổi đó. Mặc dù ít phải làm thủ thuật có cần chuyển đổi này nhưng chúng ta cũng nên ngăn cản bớt những biến chứng làm cho phẫu thuật không được tối ưu. Ngoài ra việc áp dụng các vấn đề về vô khuẩn nghiêm ngặt hơn và theo luật so với trong các phòng chỉ can thiệp truyền thống. Việc vô khuẩn có thể không chặt chẽ nhiều như thủ thuật can thiệp động mạch vành qua da (PCI) nhưng với các phẫu thuật như thay van thì cần phải nghiêm ngặt hơn nhiều.
Cũng như các quy trình nâng cao được thực hiện trong phòng can thiệp truyền thống, một số thiết bị C-arm di động ở các phòng mổ được sử dụng để thực hiện các thủ thuật như TAVI hoặc TEVAR. Như đã đề cập trước đó thì máy nội soi huỳnh quang cố định hiện đại với máy dò màn hình phẳng có khả năng đánh giá vượt xa các thiết bị di động dẫn đến sẽ làm tăng khả năng thành công cho thủ thuật. Và cũng ít gây nguy cơ nhiễm bức xạ hơn cho bệnh nhân cũng như nhân viên trong khi lại cung cấp hình ảnh tối ưu vượt trội. Hơn nữa, những máy móc này có thể xoay quanh bệnh nhân và cung cấp các mặt cắt ngang và dựng lên các dữ liệu 3D. Máy chụp cắt lớp vi tính C-arm 3 chiều có thể thu hình ảnh trong vài phút và hỗ trợ việc định vị cho thay van qua đường ống thông hoặc đặt stent graft ĐMC. Những dữ liệu này có thể bổ sung cho các hình ảnh 2D và định hướng giải phẫu. Điều này hạn chế dùng nhiều chất cản quang trong các thủ thuật can thiệp phình ĐM chủ phức tạp với nhiều nhánh graft bên. Như vậy, nên đầu tư cho các phòng mổ hybrid hơn là thỏa hiệp với các phòng can thiệp cũ, để có thể đạt được lợi ích an toàn hơn cho bệnh nhân.
2.3 Các kỹ thuật sử dụng trong phòng “hybrid”
2.3.1 Thay van qua đường ống thông
Thay van động mạch chủ qua đường ống thông (TAVI) được thực hiện đầu tiên năm 2002, một van nhân tạo sinh tạo có stent làm từ màng ngoài tim được đặt vào dưới màn huỳnh quang tăng sáng qua đường động mạch đùi. Hiện nay chỉ có hai loại van là van Edwards Sapien và van Medtronic Corevalve được FDA chấp thuận sử dụng trên lâm sàng. Một vài các van khác đang được thử nghiệm trên lâm sàng.
Trong lúc thay van, màn hình huỳnh quang tăng sáng là công cụ chính được sử dụng để xác định vị trí van và giải phẫu vòng van. Do đó, hình ảnh có độ phân giải cao được yêu cầu và không nên thực hiện với màn hình huỳnh quang di động. Do đó, thủ thuật này nên được thực hiện ở phòng mổ hybrid hoặc phòng can thiệp tim mạch.
TAVI qua đường đùi có thể thực hiện trong phòng can thiệp tim mạch hoặc phòng mổ hybrid, các đường vào khác (qua mỏm hoặc qua động mạch chủ) phù hợp hơn với phẫu thuật hybrid bởi vì nó liên quan đến phẫu thuật. Đường vào qua mỏm tim thường được thực hiện qua mở ngực và đường vào qua động mạch được thực hiện qua mở xương ức tối thiểu hoặc mở ngực phải.
2.3.2 Can thiệp nội mạch động mạch chủ
Can thiệp nội mạch động mạch chủ được sử dụng cho cả động mạch chủ ngực (TEVAR) và động mạch chủ bụng (EVAR). TEVAR và EVAR là một trong những thủ thuật được thực hiện phổ biến nhất trong phòng mổ hybrid. Chỉ định phổ biến nhất của TEVAR/EVAR là phình động mạch chủ, ngoài ra còn có các chỉ định khác như tách thành động mạch chủ, chấn thương mạch chủ, loét xuyên thành động mạch chủ. Phẫu thuật hybrid debranching là phẫu thuật bypass mở được thực hiện để tạo landing zone cho stent graft ở những trường hợp phức tạp như phình quai động mạch chủ và phình cả động mạch chủ ngực và chủ bụng.
Kỹ thuật nội mạch và hybrid được áp dụng cho tách động mạch chủ. Mặc dù một vài thử nghiệm lâm sàng cho thấy TEVAR không giúp cải thiện sống còn so với điều trị nội khoa đơn thuần ở những bệnh nhân tách động mạch chủ type B, TEVAR vẫn là điều trị chính cho tách động mạch chủ type B có biến chứng (vỡ, giảm tưới máu, tăng kích thước, tăng huyết áp khó kiểm soát, đau khó kiểm soát).
TEVAR cũng được sử dụng trong trường hợp chấn thương động mạch chủ. Các nghiên cứu lớn đã cho thấy tỷ lệ tử vong và liệt 2 chân sau can thiệp thấp hơn so với mổ mở. Hội Phẫu thuật mạch máu đã đưa ra hướng dẫn về can thiệp nội mạch đối với chấn thương động mạch chủ và đưa ra khuyến cáo mức độ 2: “can thiệp nội mạch cho chấn thương động mạch chủ đi kèm với tăng tỷ lệ sống còn và giảm nguy cơ thiếu máu tuỷ, tổn thương thận, nhiễm trùng so với mổ mở hoặc không phẫu thuật”. Hướng can thiệp này cho phép nhanh chóng điều trị các tổn thương khác đi kèm.
Ở các phòng mổ hybrid hiện đại, máy CT 3D được tích hợp với màn huỳnh quang cho phép xác định sớm và điều trị các endoleak mà màn huỳnh quang tăng sáng thông thường không phát hiện được. Kỹ thuật này còn giúp đặt nhánh bên hoặc tạo cửa sổ graft mà tốn ít thuốc cản quang hơn.
2.3.3 Hybrid trong tái tưới máu mạch vành
Hybrid trong tái tưới máu mạch vành kết hợp phẫu thuật bắc cầu chủ vành (CABG) và can thiệp động mạch vành qua da (PCI) trong bệnh nhiều nhánh động mạch vành. Các thử nghiệm lâm sàng đã cho thấy ưu điểm của CABG so với PCI ở bệnh nhân tổn thương thân chung nguy cơ cao, bệnh 3 thân mạch vành, giảm chức năng thất trái, đái tháo đường. Lợi thế của CABG dường như xuất phát từ cầu nối động mạch vú trong trái (LIMA) với động mạch liên thất trước (LAD). Cầu nối LIMA tới LAD vẫn còn thông sau 20 năm ở hơn 95% bệnh nhân và có lợi thế về sống còn so với cầu nối tĩnh mạch hiển. Ngược lại, cầu nối tĩnh mạch hiển sau 10-15 năm chỉ còn thông ở 50-60% bệnh nhân vì vậy không ưu điểm hơn so với stent phủ thuốc.
Tái tưới máu mạch vành hybrid mang ưu điểm của CABG với cầu nối LIMA tới LAD mà không cần liệt tim, vì vậy cho phép can thiệp nội mạch các mạch vành khác. Thủ thuật này có thể thực hiện một thì trong phòng mổ hybrid hoặc thực hiện hai thì. Thường cầu nối LIMA với LAD được thực hiện trước để bảo vệ LAD trong lúc can thiệp và tránh nguy cơ chảy máu gây ra bởi thuốc kháng kết tập tiểu cầu.
Các nghiên cứu hồi cứu nhỏ đã ghi nhận tỷ lệ tử vong 30 ngày và tái hẹp stent thấp. Tuy nhiên, dữ liệu về theo dõi dài hạn còn thiếu, cần có các thử nghiệm lâm sàng để so sánh hiệu quả với CABG truyền thống.
2.3.4 Phẫu thuật hybrid điều trị rối loạn nhịp tim
Trong rung nhĩ cơn, vùng thủ phạm thường xung quanh chỗ nối của tĩnh mạch phổi và nhĩ trái. Đốt rung nhĩ qua đường ống thông cho kết quả thành công lên đến > 80%, và trở thành lựa chọn đầu tiên khi thất bại với các thuốc kiểm soát nhịp, nhưng đi kèm với tỷ lệ tái phát cao và phải thực hiện thủ thuật nhiều lần. Phẫu thuật Maze cho hiệu quả cao hơn nhưng xâm lấn hơn. Sự phát triển của các dụng cụ đốt trong phẫu thuật cho phép ứng dụng các kỹ thuật xâm lấn tối thiểu với sự giúp đỡ của camera khi mở ngực. Tuy nhiên nó có những hạn chế như khó tạo ra được các tổn thương liên tục hoặc xuyên thành.
Kỹ thuật hybrid trong rung nhĩ kết hợp ưu điểm của tiếp cận nội mạc qua đường tĩnh mạch và tiếp cận ngoại mạc qua nội soi ngực. Về lý thuyết, tiếp cận cả nội mạc và ngoại mạc tạo ra được các tổn thương xuyên thành nhiều hơn. Lập bản đồ trong lúc phẫu thuật do phép tiếp cận với nội mạc tốt hơn. Phương pháp hybrid cũng cho phép đốt nội mạc ở vùng eo van hai lá (thường khó tiếp cận bằng phẫu thuật) và hạn chế các biến chứng của đường tĩnh mạch như tổn thương thần kinh hoành, tổn thương thực quản và tràn dịch màng tim. Thời gian đầu, phương pháp hy- brid này được thực hiện hai thì (thì nội mạc và ngoại mạc được tách riêng), gần đây việc sử dụng phòng mổ hybrid phương pháp này có thể làm trong một thì. Phẫu thuật được thực hiện trong vòng một thì cho thấy tỷ lệ thành công > 93% cho rung nhĩ cơn và 90% cho rung nhĩ dai dẳng ở thời điểm 1 năm. Mặc dù phẫu thuật hybrid điều trị rung nhĩ đang ở thời kì mới phát triển, phương pháp này có thể giúp khắc phục nhược điểm của phẫu thuật hoặc can thiệp nội mạch khi được thực hiện riêng biệt.
2.3.5 Phẫu thuật hybrid tim bẩm sinh
Phẫu thuật hybrid cũng đóng vai trò trong phẫu thuật tim bẩm sinh. Phẫu thuật hybrid một thì trong hội chứng thiểu sản tim trái được áp dụng nhiều nhất, bao gồm kỹ thuật thắt động mạch phổi 2 bên thông qua mở xương ức và đặt stent ống động mạch. Tuy nhiên kỹ thuật này ngày càng ít được áp dụng do gặp phải một số vấn đề. Phẫu thuật hybrid cung cấp oxy cho não thấp hơn so với phẫu thuật Norwood truyền thống (phẫu thuật nối động mạch chủ với thất phải), xuất hiện hẹp eo động mạch chủ, tiên lượng kém hơn so với phẫu thuật Norwood truyền thống.
Một số phẫu thuật tim bẩm sinh khác có thể áp dụng phẫu thuật hybrid như: sửa tắc nghẽn tĩnh mạch phổi sau khi phẫu thuật chuyển vị đại động mạch, đặt stent động mạch phổi trong hẹp phổi trong khi sửa chữa. Tuy nhiên những phương pháp này mới chỉ dừng lại ở báo cáo các ca lâm sàng, còn thiếu các dữ liệu để áp dụng dụng rộng rãi các phương pháp này. Tuy nhiên, nhiều khả năng phẫu thuật hybrid sẽ phát triển trong phẫu thuật tim bẩm sinh do nhu cầu xâm lấn tối thiểu ở nhóm bệnh nhân này.
2.3.6 Ứng dụng khác của phẫu thuật hybrid
Phẫu thuật hybrid có thể được sử dụng kết hợp phẫu thuật điều trị kết hợp với chẩn đoán. Chụp động mạch vành trước phẫu thuật được thực hiện tại bàn mổ trong lúc phẫu thuật. Việc này sẽ làm giảm thời gian nằm viện chụp mạch vành trước mổ. Bệnh nhân phẫu thuật CABG (bắc cầu nối chủ vành) có thể được chụp mạch ngay tại bàn mổ để đánh giá các cầu nối.
Phẫu thuật van hybrid bao gồm sửa hoặc đặt van kết hợp PCI (can thiệp động mạch vành qua da). Nhìn chung, phương pháp hybrid cho phép phẫu thuật van tim được thực hiện với sự xâm lấn tối thiểu thông qua đường mổ nhỏ và tổn thương mạch vành được PCI trong cùng một thì trong phòng mổ hybrid hoặc hai thì. Phương pháp này có thể được sử dụng ở bệnh nhân mổ lại van hai lá với bệnh mạch vành đi kèm. Phẫu thuật xâm lấn tối thiểu thông qua đường mở ngực nhỏ bên phải sẽ cho phép tiếp cận rộng trong khi hạn chế phải mở xương ức và nguy cơ tổn thương đến cầu nối cũ. Tổn thương mới hoặc tái phát bệnh mạch vành có thể được xử lý bởi PCI.
2.3.7 Tương lai của phẫu thuật hybrid
Ứng dụng của phẫu thuật hybrid hy vọng sẽ phát triển trong tương lai cùng với sự phát triển của công nghệ. Số lượng các ca TAVI, TEVAR và EVAR ngày càng tăng sẽ yêu cầu ngày càng nhiều phòng mổ hybrid. Sự phát triển của dụng cụ sẽ cho phép ứng dụng hybrid cho nhiều đối tượng bệnh nhân hơn. Trong thời gian ngắn tới, ứng dụng kỹ thuật hình ảnh mới cho phép định hướng 3D (syngo DynaCT, Heart Navigator) giúp đặt dụng cụ được chính xác và dễ dàng hơn. Trong tương lai xa, tích hợp các kỹ thuật hình ảnh hiện đại (hơn là chỉ màn huỳnh quang) sẽ giúp tăng khả năng điều trị dựa trên hướng dẫn của hình ảnh học. Thêm vào đó, tiến bộ tương lai của thiết bị hybrid (C-arm không dây, thiết bị nhỏ hơn) sẽ tạo ra không gian làm việc rộng rãi hơn và môi trường làm việc hiệu quả hơn cho nhóm “heart team”.
Phòng mổ tim mạch hybrid là một phòng mổ có sự hướng dẫn của hình ảnh học. Trong thực hành lâm sàng ngày nay, phòng mổ hybrid bao gồm một màn huỳnh quang và một phòng mổ đầy đủ chức năng. Với sự phát triển của hình ảnh học, phẫu thuật hybrid vẫn có những đặc điểm riêng. Thứ nhất, nó sử dụng hình ảnh học để tối thiểu hoá xâm lấn của phẫu thuật truyền thống. Thứ hai và quan trọng nhất là nó giúp kết hợp đa chuyên khoa. Các kỹ thuật hy- brid mới trong điều trị bệnh van tim, bệnh mạch vành, động mạch chủ, rối loạn nhịp tim và tim bẩm sinh đang được phát triển.
3 Ứng dụng Robot trong can thiệp
Can thiệp động mạch vành qua da (PCI) đã chứng kiến sự phát triển mạnh mẽ về mặt công nghệ trong vòng 4 thập kỷ qua. Mặc dù có những sự cải thiện về hiệu quả và an toàn đối với bệnh nhân, các bác sĩ tim mạch can thiệp vẫn phải đối mặt với những độc hại nghề nghiệp đáng kể như phơi nhiễm với phóng xạ, đục thủy tinh thể, tổn thương về cơ xương khớp. Các hệ thống định vị từ xa bằng ro- bot đã được phát triển để làm giải quyết các rủi ro và các thách thức về mặt quy trình trong thực hành PCI. Sự phát triển các hệ thống định vị điều khiển từ xa bằng robot đại diện cho sự bắt đầu của kỷ nguyên mới trong tim mạch can thiệp.
Ernst và cộng sự đã mô tả ứng dụng đầu tiên của robot trong tim mạch với một hệ thống định vị từ xa được phát triển để lập bản đồ điện sinh lý và đốt bằng sóng cao tần (Niobe, Stereotaxis Inc., St Louis, MO, USA). Sử dụng từ trường bên ngoài và phần mềm lập thể để xác định vị trí chính xác của ống thông, hệ thống có thể kiểm soát hướng của đầu ống thông được từ tính hóa, đưa ống thông tiến lên và rút ống thông dựa vào một hệ thống truyền động, đồng thời cho phép điều hướng ống thông từ xa mà không cần người làm thủ thuật ở cạnh bàn can thiệp.
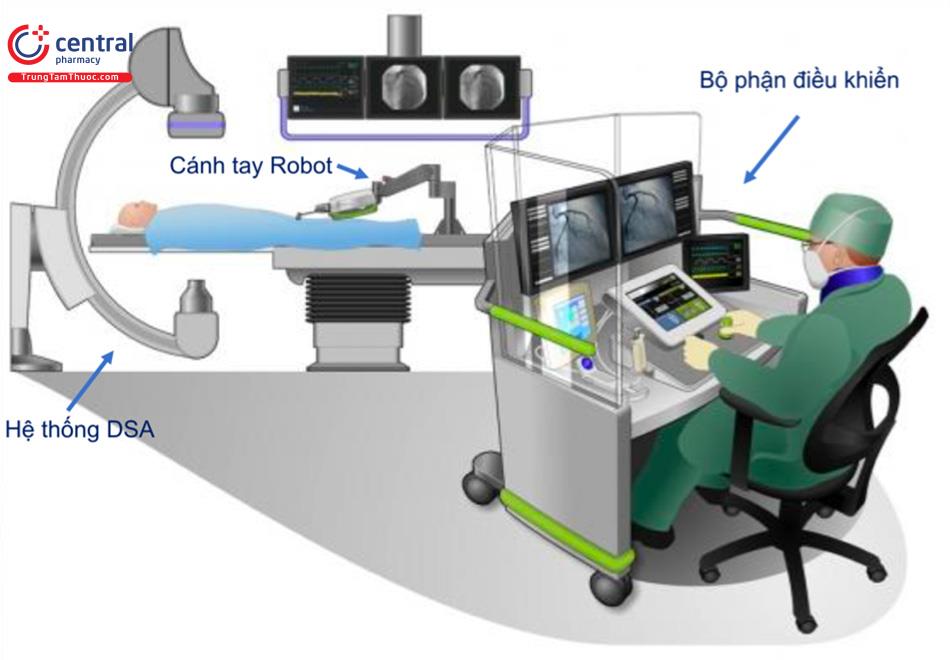
Sau khi cải tiến và sửa đổi, “hệ thống định vị robot” thử nghiệm đã được phát triển và thiết kế lại với tên gọi Hệ thống CorPath 200, tiếp theo là CorPath GRX (Corindus Vascular Robotics, Waltham, MA, USA). Hệ thống CorPath cho phép các bác sĩ can thiệp thực hiện PCI điều khiển từ xa khi ngồi trong buồng lái thiết kế phù hợp cho cá nhân và được che chắn khỏi bức xạ, buồng lái này có thể đặt trong phòng thông tim hoặc phòng điều khiển, trong trường hợp này các bác sĩ không cần đeo tấm chắn chì nặng nề. Giao diện người vận hành là một sự kết hợp giữa bảng điều khiển màn hình cảm ứng, cần điều khiển để điều khiển guiding catheter và điều chỉnh các thiết bị trong lòng mạch, hệ thống vận chuyển chất cản quang điều kh- iển từ xa. Hình ảnh huỳnh quang, điện tâm đồ và các thông số huyết động được đưa vào màn hình trong buồng lái. Một cánh tay có khớp nối gắn trên thành bàn can thiệp có chứa một động cơ rô-bốt. Cánh tay robot sẽ điều khiển guiding catheter, dây dẫn cỡ 0,014’’ và các thiết bị nong mạch bằng bộ con lăn có động cơ.
Nghiên cứu đầu tiên trên người bằng cách sử dụng hệ thống robot CorPath 200 đã mang lại những kết quả đầy hứa hẹn. Hệ thống đã triển khai thành công tất cả các thiết bị can thiệp và cho thấy tỷ lệ thành công về mặt kỹ thuật tổng thể là 97,9%. Tất cả các ca được đặt stent thành công với dòng chảy động mạch vành TIMI 3 và không có tái hẹp đáng kể. Không có các biến cố lớn về tim mạch trong viện hoặc trong vòng 30 ngày. Phơi nhiễm bức xạ của bệnh nhân vẫn trong giới hạn bình thường ở 2,1 Gy, nhưng tổng lượng bức xạ tiếp xúc với người vận hành trong buồng lái thấp hơn 97% so với vị trí thông thường ở bàn làm thủ thuật (1,8 so với 61,6 μGy; P = 0,012).
Nghiên cứu PRECISE mang lại thông tin chi tiết bổ sung về tính an toàn và hiệu quả của hệ thống CorPath 200. Tất cả 40 bệnh nhân được tiếp nhận ở một trung tâm duy nhất được so sánh với 80 bệnh nhân liên tiếp có PCI thông thường (thủ công) và đáp ứng các tiêu chí tiếp nhận/ loại trừ như nhau. PCI bằng robot có liên quan đến xu hướng giảm thời gian dùng đèn huỳnh quang (10,1 ± 4,7 phút so với 12,3 ± 7,6 phút; P = 0,05), liều bức xạ thấp hơn (1389 ± 599 mGy so với 1665 ± 1026 mGy; P = 0,07) và liều thuốc cản quang (121 ± 47 mL so với 137 ± 62 mL; P = 0,11). Những phát hiện này rất quan trọng để chứng minh rằng PCI robot không liên quan đến việc tăng tiếp xúc với chất cản quang và bức xạ cho bệnh nhân, và có vẻ có lợi thế hơn so với cách tiếp cận truyền thống.
Campbell và cộng sự đã chứng minh tác động của việc đo chiều dài chính xác với robot đối với việc lựa chọn chiều dài stent và các phân nhánh của nó để tiết kiệm stent. Sáu mươi bệnh nhân liên tiếp được đặt stent bằng robot đã được đánh giá. Chiều dài tổn thương được ước lượng bằng mắt thường, sau đó đo chính xác tổn thương bằng hệ thống robot được sử dụng để lựa chọn chiều dài stent. Chiều dài stent ước tính trực quan được coi là ngắn hoặc dài nếu chúng có độ dài thấp hoặc cao hơn stent do ro- bot lựa chọn. Kết quả: chỉ 35% (21/60) tổn thương được ước lượng bằng mắt là chính xác, trong khi 33% và 32% của stent được ước lượng bằng mắt lần lượt được xếp loại là dài và ngắn. 32% trường hợp “ngắn’’ này đại diện cho các trường hợp thường phải sử dụng thêm stent sau khi toàn bộ tổn thương không được bao phủ đầy đủ bởi một stent. Hơn nữa, việc đo lường các tổn thương bằng robot có thể giảm sai số đo và giảm việc sử dụng thêm stent trong 8,3% trường hợp. Đây là một lợi ích quan trọng đối với bệnh nhân. Với việc cải thiện độ chính xác của phép đo tổn thương mạch vành, người thực hiện có thể giảm thiểu chiều dài stent và tránh chồng stent. Chiều dài stent tăng lên và chồng stent có liên quan đến tỷ lệ tái hẹp và huyết khối tăng lên, vì vậy việc đánh giá tổn thương chính xác có thể ảnh hưởng đến kết quả lâu dài.
Một nghiên cứu thử nghiệm đã chứng minh tính khả thi của PCI từ xa. Bệnh nhân được thực hiện PCI do robot hỗ trợ với người vận hành ở trong một phòng riêng biệt biệt lập bên ngoài phòng thông tim của bệnh nhân. Giao tiếp giữa bác sĩ vận hành và nhân viên phòng vận hành thông qua các thiết bị viễn thông cung cấp kết nối âm thanh và hình ảnh theo thời gian thực. Việc sử dụng PCI có sự hỗ trợ của robot có thể cho phép các chuyên gia can thiệp khẩn cấp với sự điều khiển từ xa bởi các chuyên gia nhiều kinh nghiệm.
Sự phát triển của hệ thống định vị điều khiển từ xa bằng robot mới đại diện cho buổi bình minh của kỷ nguyên tim mạch can thiệp mới. Cho đến nay, các kinh nghiệm với hệ thống robot CorPath 200 cho thấy tính khả thi, an toàn và hiệu quả của PCI điều khiển từ xa, không có các biến cố tim mạch hoặc biến chứng xung quanh quá trình làm thủ thuật.
Các công nghệ robot làm giảm sự phơi nhiễm của người vận hành với bức xạ ion hóa và giảm các nguy cơ nghề nghiệp. Hệ thống robot cung cấp khả năng hiển thị hình ảnh cao hơn cho người vận hành, với khả năng đo và đặt chính xác các stent. Các hệ thống này có thể cải thiện đáng kể tiêu chuẩn hóa, độ chính xác, an toàn và thành công của PCI. Cuối cùng, trong thập kỷ tới, công nghệ điều hướng bằng robot có thể được tích hợp liền mạch vào thực tế hàng ngày và có thể làm thay đổi tiêu chuẩn trong tim mạch can thiệp.
Gần đây, các can thiệp ngoại vi dưới đầu gối với hệ thống CorPath 200 đã được báo cáo. Trong trường hợp này, dây dẫn cỡ 0,014’’ đã được sử dụng, giúp cho quy trình kỹ thuật tương tự như can thiệp mạch vành.
4 Xu hướng các biện pháp can thiệp điều trị tăng huyết áp
Trong thập kỷ qua, những nỗ lực nhằm cải thiện việc kiểm soát huyết áp đã vượt ngoài các phương pháp tiếp cận thông thường về điều chỉnh lối sống và điều trị bằng thuốc đến áp dụng các phương pháp điều trị can thiệp. Hiện tại có khá nhiều thuốc và biện pháp phối hợp thuốc trong điều trị kiểm soát tăng huyết áp (THA). Bên cạnh đó, nhu cầu không phải dùng thuốc từ ban đầu mà vẫn kiểm soát được huyết áp hoặc có những trường hợp tăng huyết áp khó kiểm soát bằng thuốc khiến cho việc liên tục tìm kiếm các phương pháp thay thế hoặc phối hợp thuốc để điều trị kiểm soát tốt THA là một hướng ngày càng được quan tâm. Gần đây, một loạt các kĩ thuật can thiệp điều trị huyết áp mới được phát triển và đã chứng minh được sự hiệu quả trong hạ huyết áp.
4.1 Triệt đốt thần kinh giao cảm mạch thận qua đường ống thông
Tăng hoạt động thần kinh giao cảm đã được chứng minh rõ ràng ở những người THA và gần đây, sự tăng hoạt động giao cảm động mạnh thận một cách rõ rệt cũng đã được ghi nhận ở những bệnh nhân THA kháng trị. Phần lớn các dây thần kinh hướng tâm của thận bắt nguồn từ đoạn gần niệu quản, xung quanh các mạch máu lớn và trong tuyến và lớp cơ trơn của bể thận. Nhờ đó, có thể ứng dụng bằng con đường tiếp cận trong lòng mạch thận qua đường ống thông để triệt đốt làm gián đoạn tín hiệu của hệ thống thần kinh giao cảm khi đi qua đây để đến tận cùng trong mô thận. Các dây thần kinh ly tâm truyền tín hiệu từ não bộ đến thận lại chủ yếu là thần kinh giao cảm, với sự giải phóng noradrenalin từ đầu mút dây thần kinh giao cảm làm trung gian dẫn đến sự co mạch thận cũng như tái hấp thu natri và nước tại các tế bào biểu mô ống thận và giải phóng renin từ các tế bào cầu thận.
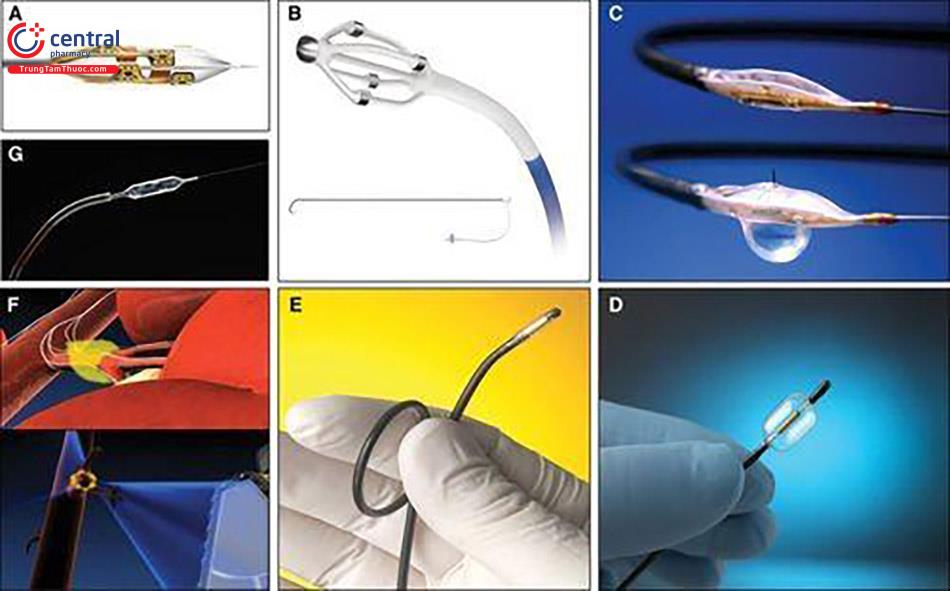
A, Boston Scientific V2 Renal Denervation System. B, Hệ thống RND đa điện cực của St. Jude Medical. C, Hệ thống triệt đốt theo bản đồ MedSystems. D, Hệ thống triệt đốt giao cảm qua da ReCor Medical PARADISE. E, Hệ thống sóng âm triệt đốt giao cảm. F, Hệ thống triệt đốt giao cảm bằng sóng âm Kona Medical. G, Hệ thống triệt đốt trên bóng Covidien-Maya.
Phương pháp triệt đốt giao cảm mạch thận (Renal dener- vation – RDN) có hiệu quả trên một số bệnh lý tim mạch hoặc chuyển hóa có liên quan đến quá trình tăng hoạt động thần kinh giao cảm thông qua điều hòa hệ thống thần kinh tự động như suy tim, suy thận mạn, rối loạn nhịp tim. Những kết quả đầy hứa hẹn này cần có thêm bằng chứng từ các nghiên cứu được thiết kế cẩn thận, có đối chứng, kết hợp làm mù để đánh giá tính hiệu quả và mức độ an toàn… Cuối cùng, các phương pháp tiếp cận mới đối với RDN (ví dụ, áp lạnh, cắt bỏ vi sóng) ra đời có những lợi thế về công nghệ chuyên biệt đang được khám phá và củng cố sự quan tâm trong lĩnh vực này.
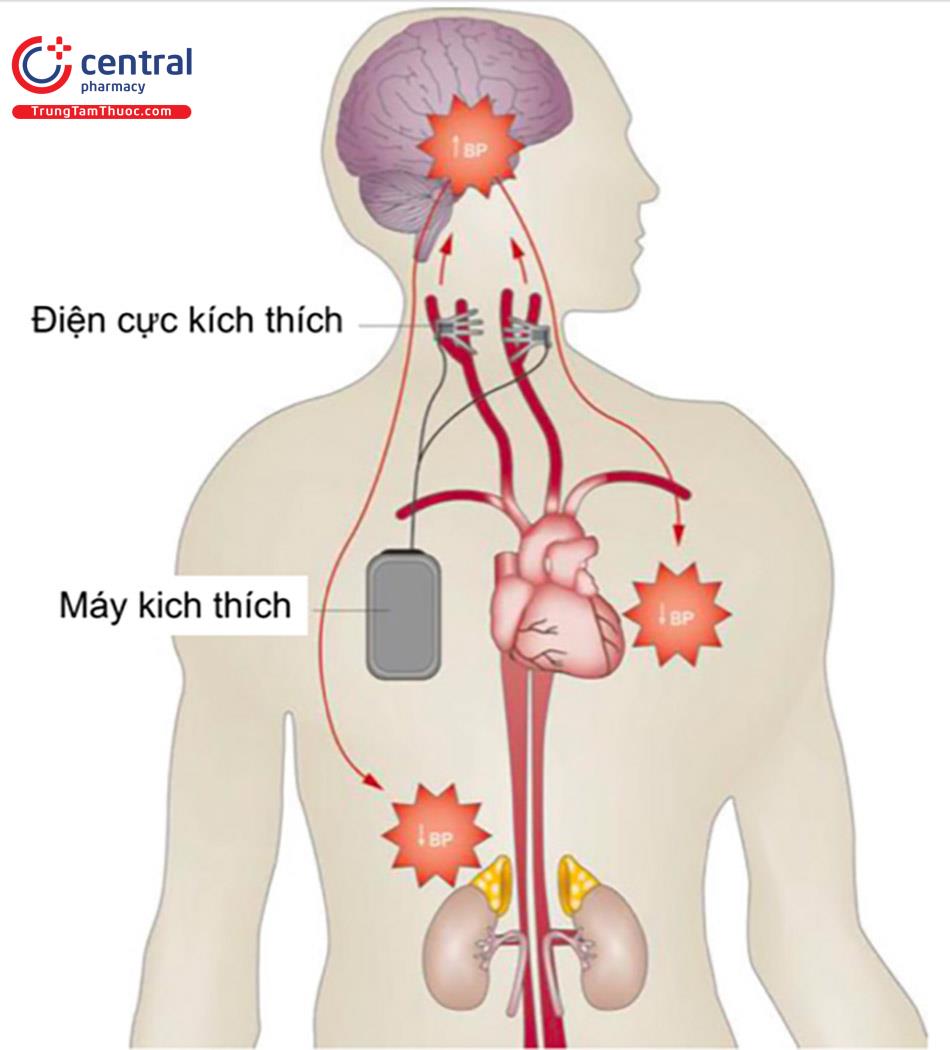
4.2 Liệu pháp kích hoạt thụ thể nhận cảm áp lực (BAT)
Liệu pháp kích thích thủ thể nhận cảm áp lực (BAT) dựa trên vai trò của các thụ thể nhận cảm áp lực tại xoang động mạch cảnh và cung động mạch chủ để đáp ứng với sự tăng HA động mạch trong thời gian tâm thu, sau đó gửi các xung thần kinh hướng tâm vào nhân xám thần kinh trung ương. Dẫn đến các sợi thần kinh ly tâm của hệ thần kinh giao cảm (SNS) đến tim, mạch ngoại vi và thận, dẫn đến giảm co mạch, gây giãn mạch và giảm tiết renin. Thiết bị Rheos thế hệ đầu tiên bao gồm các điện cực hai bên và một máy phát xung. Vị trí tối ưu của các điện cực có thể được xác định bằng đáp ứng hạ huyết áp trong khi thực hiện thủ thuật cấy máy.
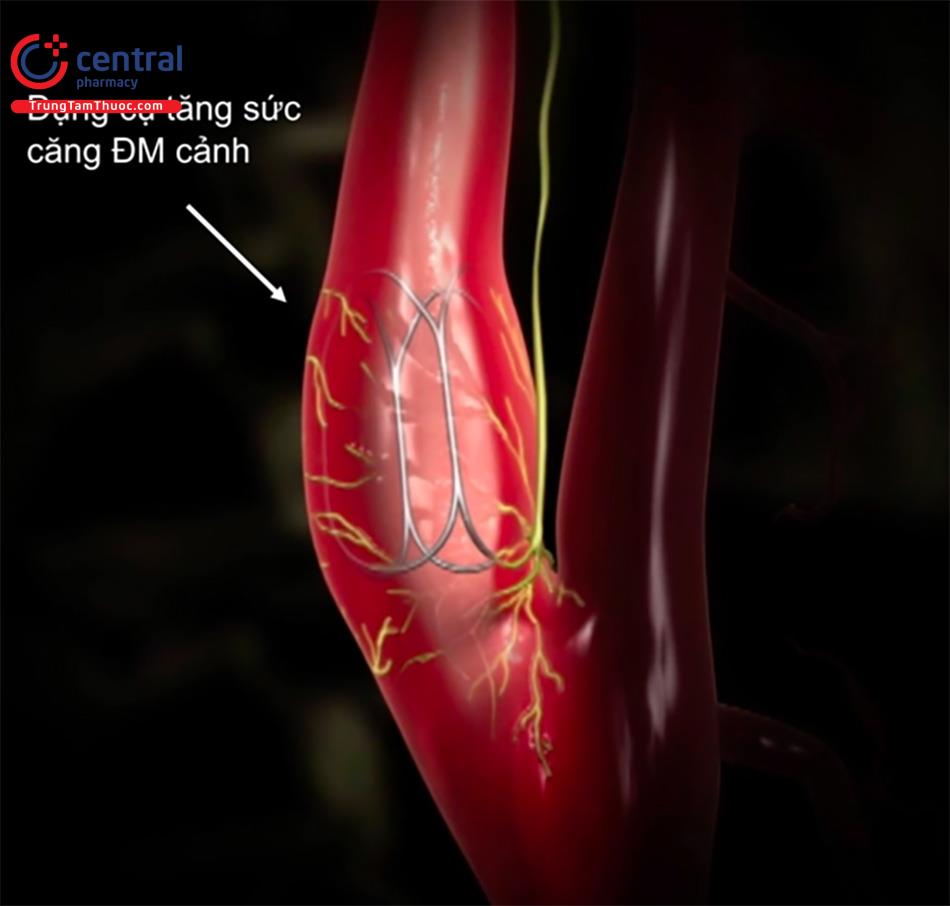
4.3 Khuếch đại thụ thể nhận cảm áp lực nội mạch
Phương pháp làm gia tăng sức căng thành trong xoang động mạch cảnh được cảm nhận bởi các thụ thể áp lực khi tăng áp lực, dẫn đến kích hoạt xung động hướng tâm dẫn đến việc giảm xung động giao cảm trung ương và hạ áp.
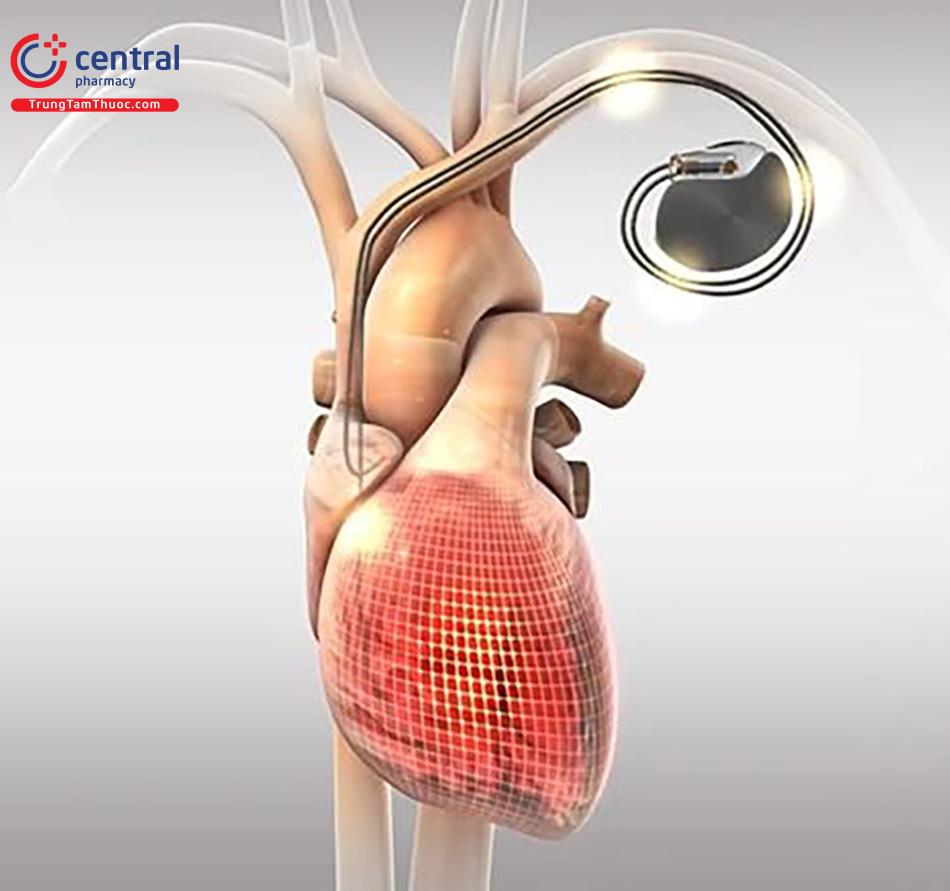
4.4 Máy tạo nhịp 2 buồng rút ngắn thời khoảng nhĩ thất giúp hạ huyết áp
Áp lực của tim phụ thuộc vào tiền gánh thất trái, và được điều chỉnh một phần do co bóp tâm nhĩ vào thất trái. Đối với những bệnh nhân có nhịp xoang bình thường, các thay đổi của thời gian trễ giữa nhĩ thất được cho là có tác dụng điều chỉnh đổ đầy thất trái. Điều chỉnh tiền tải thất trái bằng cách thay đổi khoảng nhĩ thất, do đó, có thể đại diện cho một phương tiện để hạ huyết áp.
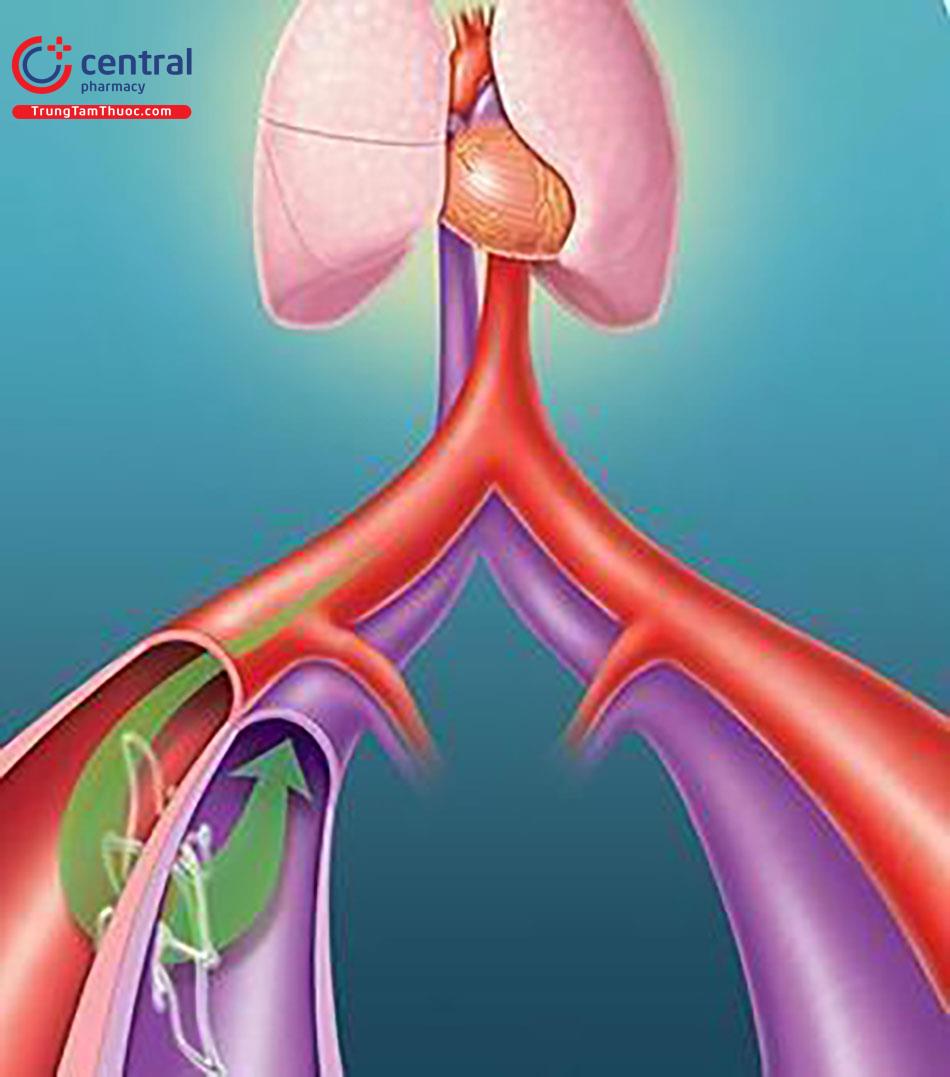
4.5 Cầu nối thông động tĩnh mạch chậu
Sử dụng một thiết bị giống stent nitinol, được cấy ghép một cách tỉ mỉ, dẫn đến sự hình thành của ống dẫn 4mm giữa động mạch chậu ngoài và tĩnh mạch. Hệ tuần hoàn tĩnh mạch từ đó làm giảm bền vững cả huyết áp tâm thu (HATT) và huyết áp tâm trương (HATTr) mà không làm tăng nhịp tim.
5 Điều trị suy tim bằng các dụng cụ can thiệp qua đường ống thông
Công nghệ nhằm giảm nhẹ triệu chứng và tỉ lệ nhập viện, trong khi một số khác giúp cải thiện chất lượng cuộc sống và có thể ảnh hưởng đến tỉ lệ tử vong.
5.1 Tái tạo thất qua đường ống thông
Hệ thống tăng cường tâm thất qua đường ống thông Revivent TC (BioVentrix) làm giảm thể tích thất trái bằng cách sử dụng các neo vi mô để loại trừ vùng sẹo cơ tim phía trước khỏi các mô còn sống, từ đó giảm thể tích, bán kính và sức căng thành tim và khôi phục hình thái kiểu hình nón của thất trái.
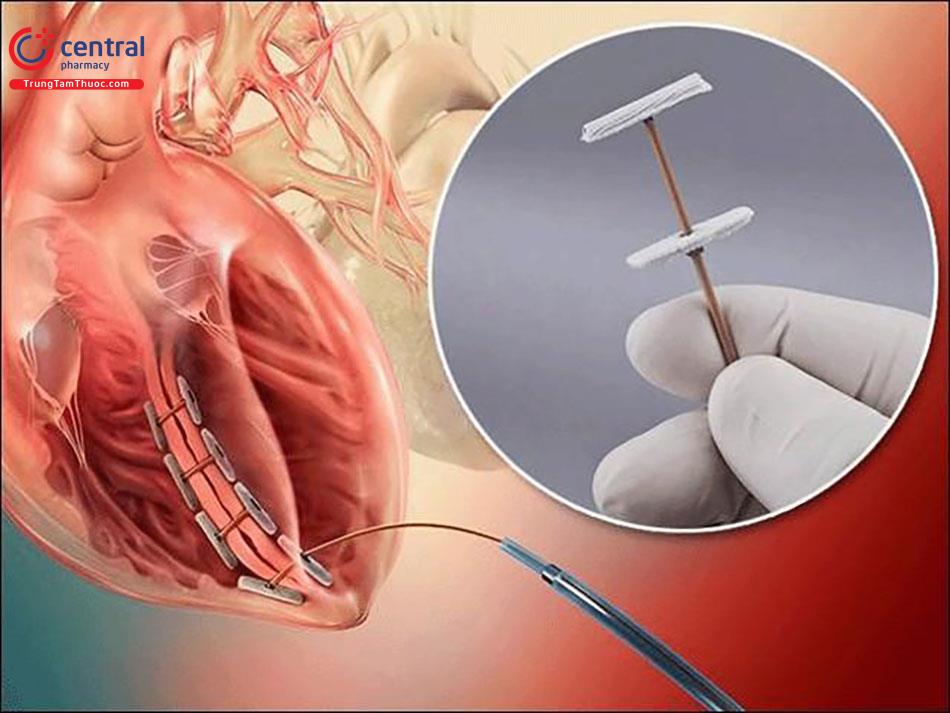
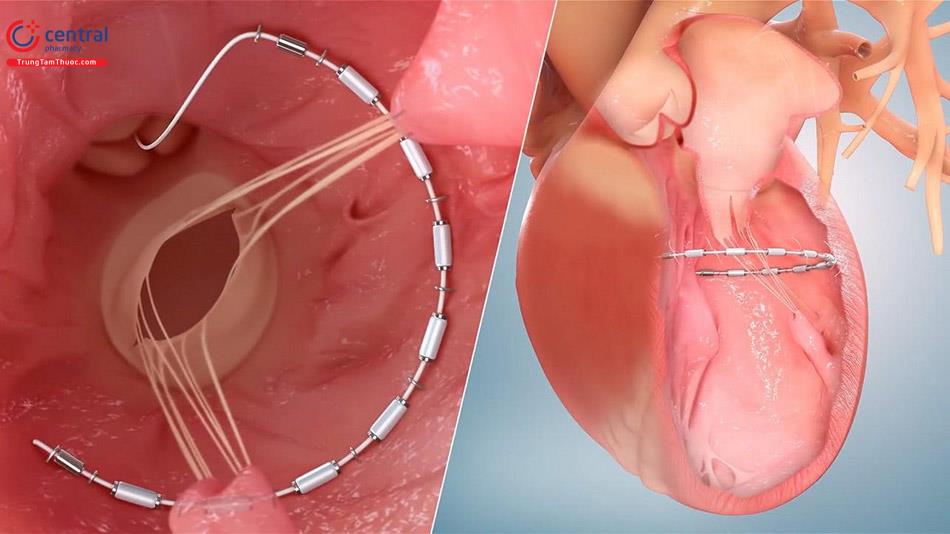
Hệ thống tái tạo tâm thất AccuCinch (Ancora Heart) được phát triển để cải thiện biến dạng cơ tim gây hở van hai lá chức năng ở bệnh nhân suy tim EF giảm có nguy cơ phẫu thuật cao. Trong quá trình cấy ghép, bác sĩ tiếp cận thất trái bằng phương pháp ngược dòng qua động mạch chủ. Tiếp đó, bác sĩ can thiệp đưa dây dẫn vào sau dây chằng van hai lá để tiếp cận với TracCath (Ancoa Heart) – dụng cụ này hoạt động như mỏ neo. Sau đó, qua hệ thống đường ray này, một loạt mỏ neo và miếng đệm nối với một sợi cáp để khóa hệ thống vào thành thất trái ở vị trí 1-2 cm dưới van hai lá có tác dụng thu nhỏ thất trái.
5.2 Hệ thống bơm tăng tưới máu động mạch thận và mạch ngoại biên
Hệ thống hỗ trợ tuần hoàn qua da Aortix (Procyrion) là một máy bơm dòng hướng tâm được đưa vào trong động mạch chủ xuống, gần động mạch thận qua đường đùi. Mục đích của thiết bị này là tăng cường cấp máu từ tim, từ đó tăng tưới máu thận và toàn thân. Thiết bị này cũng làm giảm hậu gánh và tăng cung lượng tim ở tốc độ thấp, với tốc độ bơm cao hơn, Aortix có thể tăng áp lực động mạch phổi trung bình, do tăng dòng hồi lưu tĩnh mạch.
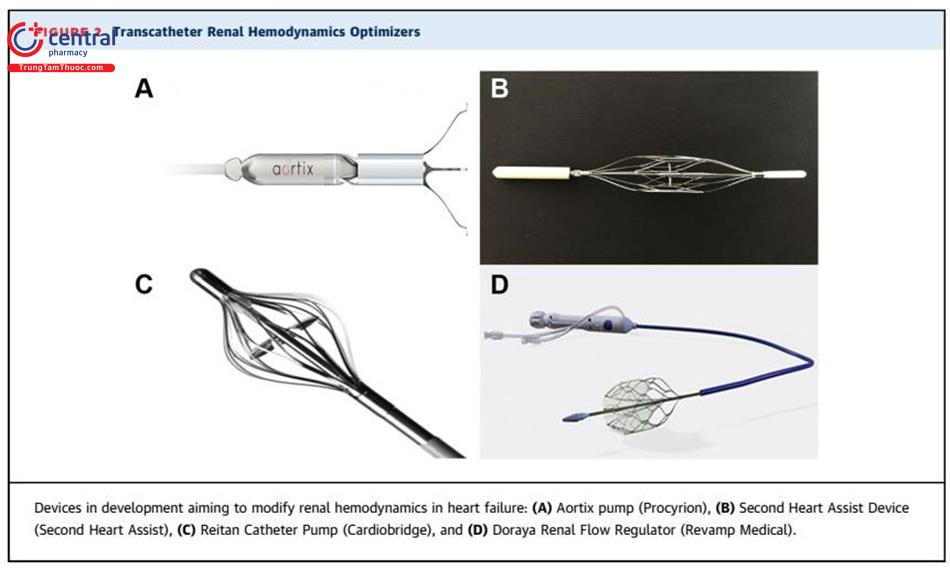
(A) Bơm Aortix (Procyrion); (B) Thiết bị Second Heart Assist (Second Heart Assist); (C) Bơm Catheter Reitan (Cardiobridge) và (D) Bộ điều chỉnh lưu lượng thận Dorya (Revamp Medical)
Thiết bị hỗ trợ tim thứ hai (Second Heart Assist) là một thiết bị được cấp nguồn không dây cũng đang được phát triển để sử dụng lâu dài ở bệnh nhân suy tim mạn. Cốt lõi của cả hai là bơm hướng tâm nằm trong stent có thể đóng mở phù hợp với mạch đập đặt trong động mạch chủ. Thiết bị này được thiết kế để dễ dàng đưa vào qua đường đùi và đặt trong động mạch chủ xuống. Khi thiết bị được đến động mạch chủ xuống, gần động mạch thận thì stent sẽ làm giãn động mạch chủ (1-2 mm) để cố định thiết bị mà không cần mỏ neo gây xâm lấn. Lồng stent này giúp bảo vệ thành động mạch chủ khỏi các cánh bơm. Máy bơm làm tăng lưu lượng máu đến thận, cải thiện tưới máu thận và lượng nước tiểu, có khả năng giảm nhu cầu dùng thuốc lợi tiểu và giảm số lần tái nhập viện vì suy tim.
Bơm Catheter Reitan (Cardiobridge) là một thiết bị hỗ trợ tâm thất qua da khác giúp điều trị bệnh nhân bị suy tim mất bù cấp tính và hội chứng tim thận. Nó bao gồm một bơm có đầu xa gắn với ống thông và đầu gần là một cánh quạt có thể gập lại, một lồng xung quanh, một đơn vị giao diện và một thiết bị bên ngoài giúp điều khiển. Mục đích của thiết bị này là giúp tăng bơm máu từ tim và tăng áp lực tưới máu ngoại vi.
5.2.1 Điều hòa áp lực tĩnh mạch thận
Áp lực tĩnh mạch trung tâm, với tình trạng co thắt tĩnh mạch thận, làm suy giảm chức năng thận trong tình trạng suy tim mất bù, dẫn đến những thay đổi về thần kinh thể dịch. Người ta đã phát triển một số thiết bị nhằm giảm hậu gánh của thận để tăng dòng chảy đến thận, tăng số lượng nước tiểu, tăng đào thải muối và cải thiện đáp ứng với thuốc lợi tiểu.
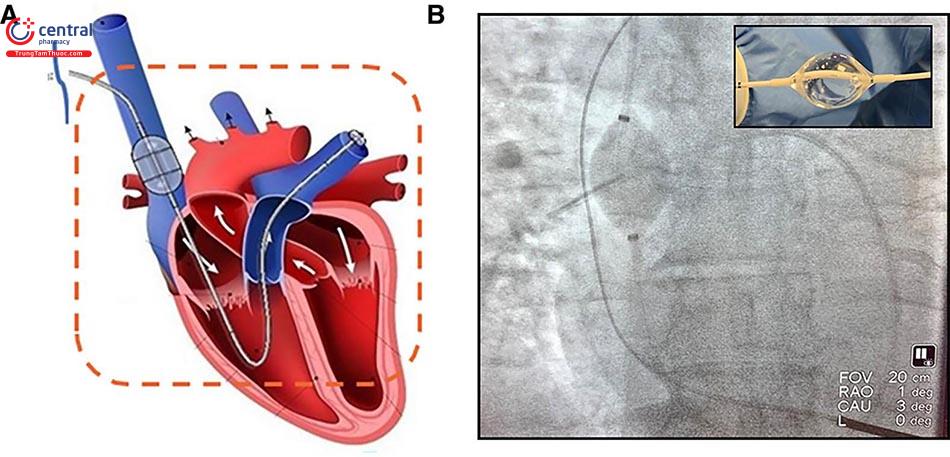
A, Sơ đồ cơ chế hoạt động của hệ thống bóng tĩnh mạch chủ trên. B, Ảnh hoạt động của bóng tĩnh mạch chủ trên.
Hệ thống preCARDIA gồm một bảng điều khiển bơm và một ống thông được đưa vào động mạch phổi thông qua tĩnh mạch cảnh trong. Phía đầu nhọn của ống thông có gắn một quả bóng đặt trong tĩnh mạch chủ trên, ngay phía trên nhĩ phải. Quả bóng này được sử dụng để tạo tình trạng tắc nghẽn cơ học ngắt quãng. Trái với tĩnh mạch chủ dưới, làm tắc tĩnh mạch chủ trên giúp giảm tiền gánh và lượng máu về tim mà không làm giảm huyết áp toàn thân hoặc cung lượng tim. Hệ thống này giúp giảm áp lực tĩnh mạch trung tâm và duy trì huyết áp trung bình, do đó cải thiện huyết động và tưới máu thận.
Bộ điều chỉnh lưu lượng thận Dorya (The Doraya Renal Flow Regulator) là một hệ thống điều chỉnh lưu lượng tĩnh mạch tạm thời qua da đặt trong tĩnh mạch chủ dưới, xa các tĩnh mạch thận để hạn chế một phần lưu lượng tĩnh mạch và giảm áp lực lên tĩnh mạch thận. Thiết bị được đưa vào cơ thể qua tĩnh mạch đùi, gồm một khung nitinol 25mm gắn ở đầu xa của ống thông. Khi điều chỉnh độ mở của khung này sẽ gây tắc một phần của tĩnh mạch, từ đó giảm tiền gánh và tạo chênh áp giữa tĩnh mạch chậu và tĩnh mạch trung tâm là 5 mmHg. Như vậy, hệ thống có thể cải thiện áp lực tưới máu đến thận, giảm áp lực của thất trái để giảm áp lực đổ đầy và áp lực lên thành tim.
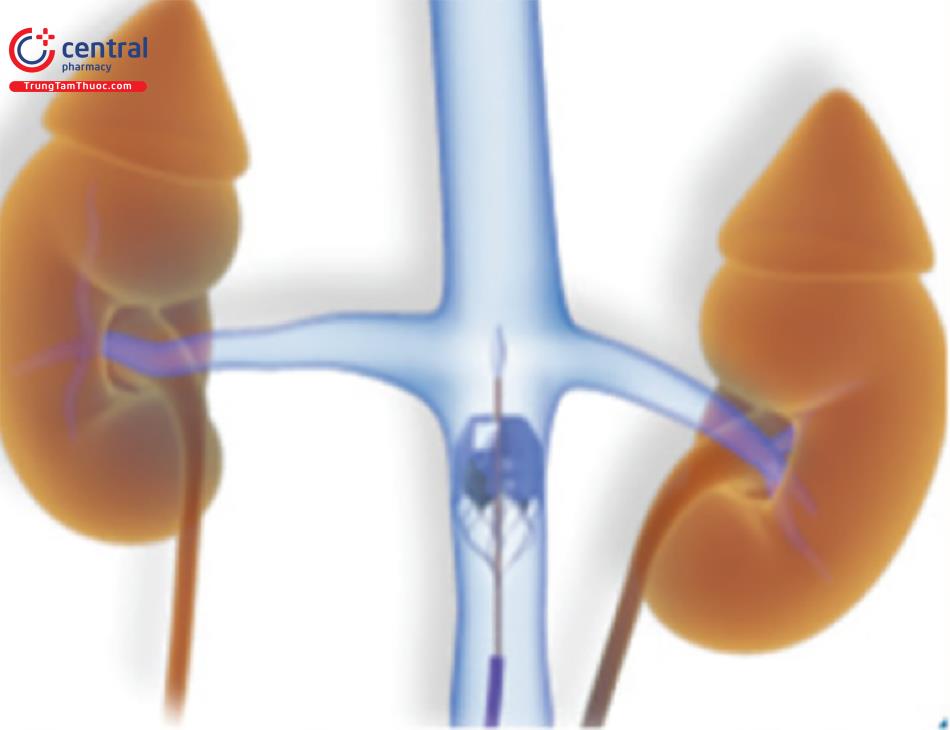
5.2.2 Tạo shunt thông liên nhĩ để giảm áp lực mao mạch phổi bít (PCWP) khi gắng sức
Bệnh nhân suy tim (dù phân suất tống máu EF có bảo tồn hay giảm), áp lực mao mạch phổi bít (PCWP) và áp lực cuối tâm trương thất trái luôn tăng đáng kể khi gắng sức. Tạo một shunt giữa hai tâm nhĩ để giảm thiểu tình trạng tăng PCWP khi gắng sức để giúp cải thiện khả năng gắng sức.

Hệ thống V-Wave Shunt (V-Wave) là một thiết bị nhân tạo, gồm 1 stent tự nở bằng nitinol hình đồng hồ cát có một “cổ” ở trong, được đặt xuyên qua lỗ bầu dục.
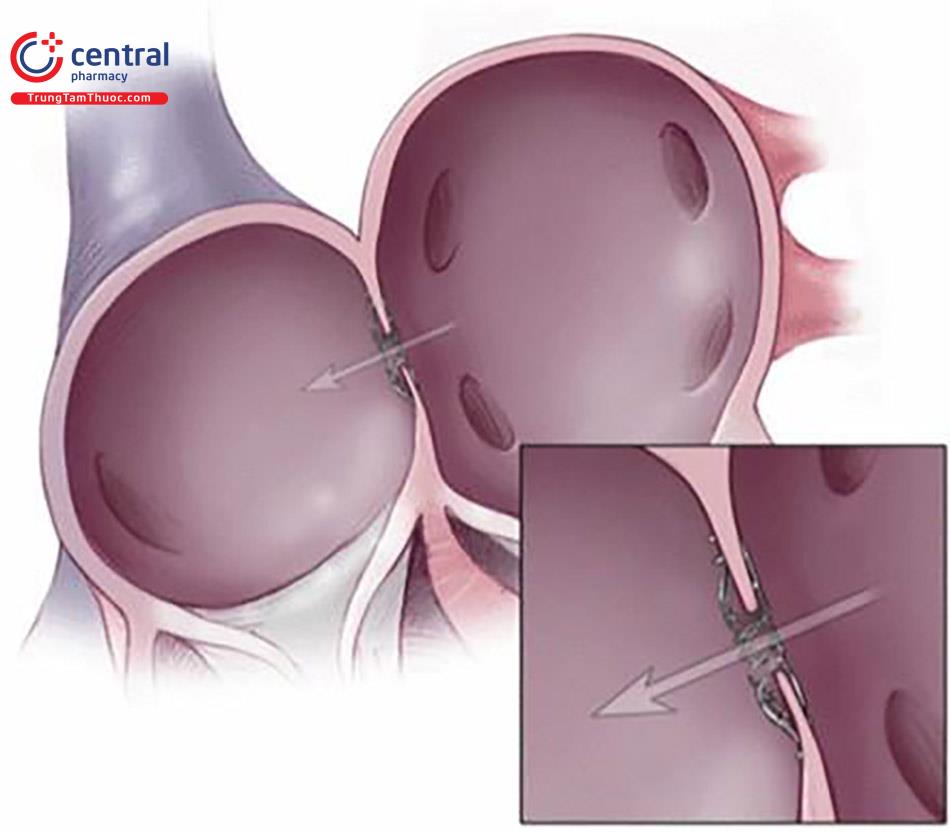
Hệ thống IASD (Corvia Medical) gồm một khung bằng ni- tinol có đường kính ngoài 19 mm để tạo ra một ống thông liên nhĩ vĩnh viễn có đường kính 8 mm.
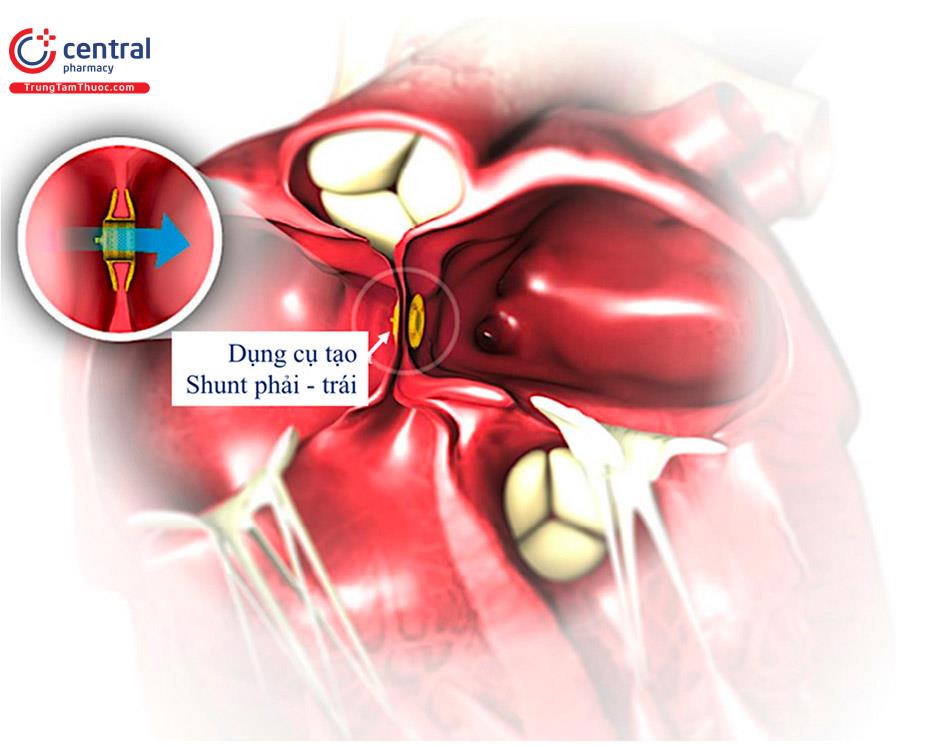
Bộ điều chỉnh lưu lượng tâm nhĩ (Atrial Flow Regulator) (Occlutech) là một thiết bị tạo shunt thông liên nhĩ được thiết kế với mục đích giảm áp lực nhĩ trái. Thiết bị này gồm một thiết bị lưới bằng nitinol có 2 đĩa phẳng và một cổ nối dầy 1-2 mm với một cửa sổ ở trung tâm cho phép tạo dòng chảy hai chiều. Thiết bị này được sản xuất với các kích thước cửa sổ khác nhau (6,8 hoặc 10 mm). Trước khi cấy thiết bị vào vách liên nhĩ, cần sử dụng bóng để làm rách vách liên nhĩ.
5.2.3 Hệ thống theo dõi huyết động xâm lấn
Áp lực mao mạch phổi bít (PCWP) cung cấp thông tin huyết động phản ánh áp lực nhĩ trái. Dựa vào đó, người ta xây dựng thiết bị theo dõi áp lực động mạch phổi từ xa bằng phương pháp xâm lấn để phát hiện sớm quá tải thể tích. Từ đó, điều chỉnh điều trị hoặc hành vi của bệnh nhân suy tim.
Hệ thống cảm biến áp lực Cordella PA (Endotronix) được thiết kế để đo, ghi và truyền chỉ số áp suất động mạch phổi của các bệnh nhân suy tim sung huyết NHYA III đến bác sĩ lâm sàng để đánh giá và quản lý, với mục tiêu cải thiện kết quả lâm sàng – chủ yếu là tử vong do mọi nguyên nhân và các trường hợp nhập viện do suy tim hoặc các lần khám tại khoa cấp cứu. Thiết bị được cấy ghép trong quá trình thông tim phải, sử dụng đường vào từ tĩnh mạch đùi và bộ cảm biến được đạt ở điểm uốn ở thành sau dưới động mạch phổi phải.
Hệ thống theo dõi áp lực nhĩ trái V-LAP (Vectorious Med- ical Technologies) được cấy xuyên qua vách liên nhĩ, dưới sự hướng dẫn của chụp mạch và siêu âm tim. Các thông tin về huyết động được truyền đến một nền tảng dựa trên đám mây cho phép theo dõi từ xa.
6 Ứng dụng liệu pháp tế bào gốc trong điều trị các bệnh lý tim mạch nan giải
Các tiến bộ trong Y sinh học đặc biệt là tế bào gốc đã thúc đẩy một hướng tiếp cận mới trong điều trị những vấn đề nan giải trên với giả thiết là liệu pháp này có thể làm tăng sinh, khôi phục tế bào cơ tim, mạch máu nuôi tim đã bị mất chức năng không.
Đã 18 năm kể từ khi Strauer và cộng sự đã lần đầu tiên ứng dụng công nghệ tế bào gốc trên người, cho một bệnh nhân nam 46 tuổi bị suy tim sau nhồi máu cơ tim cấp. Cho tới nay, đã có hàng trăm nghiên cứu với các quy mô khác nhau được tiến hành trên hàng triệu bệnh nhân tim mạch sử dụng nhiều loại tế bào gốc có nguồn gốc đa dạng. Bước đầu cho thấy tính an toàn của biện pháp điều trị này, tuy nhiên tính hiệu quả còn nhiều tranh cãi, các nhà khoa học vẫn đang trên con đường tìm kiếm loại tế bào gốc nào là tối ưu, cũng như liều lượng, đường đưa vào cơ thể nào giúp đạt kết quả tốt nhất.
Liệu pháp tế bào gốc là một hướng tiếp cận có rất nhiều hứa hẹn trong điều trị các bệnh tim mạch nan giải (suy tim sau nhồi máu cơ tim cấp, đau ngực kháng trị ở bệnh nhân bị hội chứng mạch vành mạn tính, suy tim mạn, bệnh cơ tim giãn, bệnh động mạch chi dưới giai đoạn thiếu máu chi trầm trọng,…).
Tuy vậy, các kết quả trong các nghiên cứu còn chưa thống nhất do vẫn còn nhiều câu hỏi về những vấn đề mấu chốt như: nên lựa chọn loại tế bào gốc nào, mật độ/số lượng tế bào tối ưu, đường cấy, thời gian cấy, vùng mô đích hiện vẫn đang được nghiên cứu, thử nghiệm.
6.1 Tế bào gốc điều trị suy tim sau nhồi máu cơ tim cấp
Các thử nghiệm về hiệu quả của tế bào gốc trong điều trị các bệnh lý tim mạch đã được tiến hành trên động vật cách đây hơn 20 năm. Sau thành công trên đối tượng động vật thí nghiệm, nghiên cứu thử nghiệm lâm sàng đầu tiên áp dụng trên người được công bố năm 2002 tại Đức. Tác giả Strauer và cộng sự đã tiến hành cấy ghép tế bào gốc tủy xương tự thân tiêm vào động mạch vành cho 10 bệnh nhân suy tim sau nhồi máu cơ tim, so sánh với 10 bệnh nhân nhóm chứng chỉ được can thiệp động mạch vành (ĐMV) qua da thường quy. Kết quả sau 3 tháng theo dõi, ở nhóm được cấy ghép tế bào gốc diện nhồi máu được cải thiện trên kỹ thuật chụp thất đồ (từ 30 ± 13 giảm còn 12 ± 7%, p=0,005), và sự cải thiện ở nhóm bệnh nhân này nhiều hơn nhóm chứng một cách có ý nghĩa thống kê (p=0,04).
Cũng trong năm 2002, thử nghiệm TOPCARE-AMI, tiến hành trên 59 bệnh nhân nhồi máu cơ tim được tiêm tế bào gốc tủy xương tự thân sau khoảng 4,9 ± 1,5 ngày sau can thiệp ĐMV. Sau 4 tháng theo dõi, bệnh nhân được chụp buồng thất trái và cho kết quả phân số tống máu thất trái (EF) cải thiện rõ rệt và có ý nghĩa thống kê (50 ± 10% tới 58 ± 10%; p<0,001) và thể tích cuối tâm thu thất trái giảm (từ 54 ± 19 mL xuống còn 44 ± 20 mL; p<0,001). Năm 2004, thử nghiệm lâm sàng ngẫu nhiên có đối chứng BOOST thực hiện trên 30 bệnh nhân được cấy ghép tế bào gốc tự thân sau can thiệp NMCT và 30 bệnh nhân nhóm chứng. Cộng hưởng từ tim cũng là phương pháp chẩn đoán hình ảnh được lựa chọn để đánh giá sự thay đổi của chức năng tâm thu thất trái sau 6 tháng. Kết quả cho thấy: EF tăng thêm 6,7% so với nhóm chứng chỉ tăng 0,7% (p=0,0026). Trong số những thử nghiệm sử dụng tế bào gốc từ máu hoặc tủy xương, thử nghiệm có đối chứng, mù đôi REPAIR – AMI đã mang lại một dấu ấn quan trọng cho những thử nghiệm về liệu pháp tế bào trên lâm sàng. Đây là một trong những thử nghiệm có số lượng bệnh nhân lớn với 204 bệnh nhân nhồi máu cơ tim đã được can thiệp ĐMV qua da thành công. Sau 3-7 ngày, người bệnh sẽ được lựa chọn ngẫu nhiên vào nhóm được tiêm tế bào gốc tủy xương tự thân vào động mạch vành hoặc nhóm chỉ tiêm giả dược. Phân số tống máu thất trái được đánh giá lại sau 4 tháng, kết quả cho thấy ở nhóm được cấy ghép tế bào gốc tự thân sự cải thiện khoảng 2,5% hơn so với nhóm chứng (5,5 ± 7,3% so với 3,0 ± 6,5%, 95% CI, 0,5 – 4,5, p = 0,01). Trong năm 2014, tác giả Jay H. Traverse và cộng sự đã tiến hành cấy ghép tế bào gốc vào động mạch vành ở 67 bệnh nhân và có 53 bệnh nhân được tuyển chọn vào nhóm chứng. Sự cải thiện thông số LVEF ở nhóm tế bào gốc đã thể hiện rõ ngay sau 6 tháng (46,2% (95% CI, 43,9% – 48,5%) – 50,1% (95% CI, 47,2% – 53,0%)), nhiều hơn có ý nghĩa thống kê so với nhóm chứng (46,3% (95% CI, 43,3% – 49,3%) – 51,5% (95% CI, 47,5% – 55,5%) (p < 0,001).
Một số nghiên cứu gộp đã được thực hiện để tổng hợp các kết quả nghiên cứu lâm sàng về tác dụng của liệu pháp tế bào trên bệnh nhân nhồi máu cơ tim cấp. Đại đa số các báo cáo cho thấy tiêm tế bào tủy xương trong mạch vành là an toàn và cải thiện tương đối phân số tống máu (2-3%) và làm giảm thể tích thất trái.
Makkar và cộng sự đã thực hiện nghiên cứu CArdiosphere-Derived aUtologous stem CElls to reverse ventricUlar dysfunction (CADUCEUS), một nghiên cứu ngẫu nhiên, pha I đầu tiên đánh giá hiệu quả của tế bào gốc tim nội sinh trong điều trị nhồi máu cơ tim cấp. Trong đó, các bệnh nhân mới nhồi máu cơ tim cấp có LVEF 25-45% được lựa chọn ngẫu nhiên vào nhóm điều trị tế bào gốc tim nội sinh (n=23) hoặc sử dụng liệu pháp thông thường (n = 8). Các liều tế bào gốc khác nhau đã được tiêm vào động mạch vành sau nhồi máu cơ tim xấp xỉ 65 ngày. Sau 6 và 12 tháng nghiên cứu, không thấy có bệnh nhân tử vong hay xuất hiện khối u tim. Tuy nhiên, sau 12 tháng có 1 bệnh nhân bị nhồi máu cơ tim không ST chênh lên và một ca khác phải can thiệp mạch vành. Mặc dù diện tích sẹo nhồi máu giảm đáng kể, kèm theo tăng khả năng sống còn và cải thiện chức năng vận động vùng sau điều trị tế bào gốc nhưng không có sự cải thiện đáng kể về chức năng tâm thu toàn bộ hay chất lượng cuộc sống.
Một số nghiên cứu về thời gian tối ưu để tiêm tế bào ở bệnh nhân nhồi máu cơ tim cấp chưa mang lại kết quả như mong đợi. Đặc biệt, các nghiên cứu TIME, lateTIME và gần đây là REGENERATE-AMI đã không thể chứng minh lợi ích của việc tiêm sớm (3-7 ngày) và/hoặc muộn (2-3 tuần) tế bào gốc trong điều trị nhồi máu cơ tim cấp.
Với mong muốn tìm những chiến lược khác để nâng cao tác dụng của liệu pháp tế bào, các nhà nghiên cứu đã sử dụng yếu tố kích thích bạch cầu hạt từ tủy xương (G-CSF). Trong nghiên cứu STEM-AMI thì liệu pháp sử dụng G-CSF đơn độc làm giảm tái cấu trúc thất trái sau 3 năm ở bệnh nhân nhồi máu cơ tim cấp có ST chênh lên thành trước. Nghiên cứu này đã cung cấp nền tảng cho một nghiên cứu ngẫu nhiên, có đối chứng lớn nhất để đánh giá tác dụng của tiêm sớm G-CSF ở bệnh nhân nhồi máu cơ tim cấp có rối loạn chức năng thất trái dai dẳng sau khi được can thiệp tái tưới máu thành công (nghiên cứu STEM-AMI OUTCOME).
6.2 Tế bào gốc điều trị đau ngực kháng trị ở bệnh nhân bị hội chứng mạch vành mạn
Các bệnh nhân đau ngực kháng trị do hội chứng mạch vành mạn tính không thể thực hiện can thiệp tái tưới máu có thể hưởng lợi từ liệu pháp tế bào gốc. Losordo và cộng sự đã công bố thử nghiệm pha I/IIa đầu tiên đánh giá tính an toàn và hiệu quả của tiêm tế bào gốc CD34+ tự thân vào cơ tim của 24 bệnh nhân đau ngực kháng trị. Mặc dù kết quả không có ý nghĩa thống kê do cỡ mẫu nhỏ nhưng cũng ghi nhận được sự cải thiện về tình trạng đau ngực và thời gian gắng sức ở nhóm điều trị tế bào gốc và về tính an toàn. Trong một nghiên cứu theo dõi với cỡ mẫu lớn hơn (n = 167) đã cho kết quả thấy nhóm điều trị tế bào gốc có ít cơn đau ngực hơn và cải thiện khả năng gắng sức. Tuy nhiên, cả nhóm điều trị và nhóm chứng đều tăng các men tim sau khi huy động tế bào bằng G-CSF. Kết quả tương tự cũng được Wang và cộng sự báo cáo khi bơm tế bào gốc tiền thân nội mạc tiêm vào động mạch vành.
6.3 Tế bào gốc điều trị suy tim trong hội chứng vành mạn
Cơ chế nội sinh ban đầu khiến bệnh cơ tim do hội chứng vành mạn tính trở thành một chỉ định hấp dẫn của liệu pháp tế bào gốc, nhằm mục đích thay thế các tế bào cơ tim bị mất. Trong một nghiên cứu pilot năm 2003, Perin và cộng sự đã lựa chọn ngẫu nhiên 27 bệnh nhân bị hội chứng mạch vành mạn tính vào nhóm tiêm tế bào đơn nhân tủy xương qua nội tâm mạc hoặc giả dược. Sau 4 tháng, phân suất tống máu thất trái (LVEF) cải thiện đáng kể ở nhóm điều trị so với nhóm chứng (29% so với 20%, p = 0,003) mà không có sự khác biệt về các tác dụng phụ. Nghiên cứu này đã khẳng định tính an toàn của liệu pháp tiêm tế bào đơn nhân tủy xương qua nội tâm mạc, tạo tiền đề cho hai nghiên cứu lớn đối với tế bào đơn nhân tủy xương trên hội chứng mạch vành mạn tính.
Trong nghiên cứu TOPCARECHD (Transplantation Of Progenitor Cells And REcovery of LV function in patients with Chronic ischemic Heart Disease), Assmus và cộng sự lựa chọn ngẫu nhiên các bệnh nhân bị hội chứng mạch vành mạn tính vào nhóm tiêm tế bào đơn nhân tủy xương vào động mạch vành và nhóm tiêm “tế bào tiền thân tuần hoàn-CPCs” từ máu ngoại vi và nhóm giả dược. Theo đó, trái ngược với kết quả thu được từ tế bào tiền thân tuần hoàn và giả dược, tế bào đơn nhân tủy xương làm cải thiện LVEF sau 3 tháng. Mức độ cải thiện còn khiêm tốn nhưng có ý nghĩa thống kê. Một vài nghiên cứu đã so sánh hiệu quả của tế bào đơn nhân tủy xương và tế bào gốc mô đệm. Năm 2014, Heldman và cộng sự công bố nghiên cứu pha I/II đối với tiêm tế bào đơn nhân tủy xương vào nội tâm mạc so với tế bào gốc mô đệm tự tân so với giả dược trên bệnh nhân hội chứng mạch vành mạn tính có LVEF < 50%. Mặc dù cỡ mẫu nhỏ nhưng vẫn có sự cải thiện có ý nghĩa đối với triệu chứng suy tim, diện nhồi máu và chức năng cơ tim theo vùng ở bệnh nhân điều trị tế bào gốc mô đệm. Vì cần thời gian chuẩn bị tế bào gốc mô đệm từ tủy xương, Hare và cộng sự đã thực hiện nghiên cứu so sánh tính an toàn và hiệu quả của sử dụng tế bào cùng loại và tế bào tự thân trong một nghiên cứu không có đối chứng, ngẫu nhiên và tăng liều (Nghiên cứu POSEIDON). Mặc dù cả 2 loại tế bào gốc đều làm giảm diện nhồi máu nhưng chỉ có tế bào gốc mô đệm tự thân cải thiện điểm chất lượng cuộc sống và nghiệm pháp đi bộ 6 phút. Gần đây, Perin và cộng sự đã báo cáo có sự cải thiện về khả năng gắng sức với đỉnh VO2 cao hơn nhưng không tăng LVEF ở 27 bệnh nhân hội chứng mạch vành mạn tính được tiêm tế bào gốc mô đệm từ mô mỡ. Điều này gợi ý rằng các tế bào gốc mô đệm có thể thúc đẩy tăng sinh mạch thông qua tác dụng cận tiết. Khi các tế bào tiền thân vạn năng tại tim được giới thiệu, nghiên cứu Stem Cell Infusion in Patients with Ischemic ardiOmyopathy (SCIPIO) đã được thực hiện để sử dụng loại tế bào này trên hội chứng mạch vành mạn tính. Trong nghiên cứu pha I này, các tế bào gốc được tách từ tiểu nhĩ phải tại thời điểm làm phẫu thuật bắc cầu nối chủ vành. Sau đó các tế bào được đưa vào động mạch vành của bệnh nhân (trung bình là 113 ngày sau phẫu thuật). Các kết quả công bố cho thấy bệnh nhân có cải thiện về LVEF, vận động vùng và triệu chứng suy tim khi so sánh giữa nhóm có điều trị và nhóm không điều trị.
6.4 Bệnh động mạch chi dưới mạn tính giai đoạn thiếu máu chi trầm trọng
Tế bào gốc tủy xương, tế bào gốc mô mỡ và tế bào gốc nhau thai là những dòng tế bào được sử dụng trong điều trị bệnh động mạch chi dưới. Trong đó, tế bào gốc tủy xương tự thân được sử dụng rộng rãi nhất do việc thu nhận đơn giản, đa dạng nhiều dòng tế bào có thể biệt hoá thành các thành phần khác nhau.
Tế bào gốc được đưa vào cơ thể qua đường tiêm động mạch hoặc tiêm trong cơ hay tiêm dưới da. Các nghiên cứu đã chứng minh đường tiêm trong cơ và tiêm vào động mạch có tác dụng và hiệu quả tương đương. So sánh những bệnh nhân có đáp ứng với phương pháp điều trị này với những bệnh nhân không đáp ứng cho thấy, ở nhóm có đáp ứng: tỷ lệ tế bào CD34+ cao hơn trong tuỷ xương (29 so với 17 × 106), nồng độ CRP thấp hơn (18 so với 100 mg/L) và số lượng bạch cầu thấp hơn (8,3 so với 12,3 × 109/L).
Những năm gần đây, một số Trung tâm mạch máu trên thế giới đã ứng dụng của tế bào gốc trong điều trị bệnh động mạch (ĐM) ngoại biên giai đoạn thiếu máu chi trầm trọng và đã thu được những kết quả ban đầu khá khả quan.
Một loạt các nghiên cứu sử dụng tế bào gốc tủy xương tự thân cho thấy hiệu quả trong điều trị bệnh động mạch chi dưới giai đoạn thiếu máu chi trầm trọng mà không còn chỉ định tái thông mạch (phẫu thuật hay can thiệp), thể hiện qua sự cải thiện chỉ số ABI, tăng quãng đường đi bộ tối đa, tình trạng đau chi lúc nghỉ,… Trong một nghiên cứu tổng quan hệ thống gần đây, tổng hợp từ 12 thử nghiệm lâm sàng so sánh kết quả thu được giữa hai nhóm: được điều trị thường quy kết hợp với tiêm tế bào gốc tủy xương với nhóm chứng chỉ được dùng placebo. Kết quả cho thấy, tỷ lệ cắt cụt chi giảm rõ rệt ở nhóm được điều trị bằng tế bào gốc so với nhóm chứng (RR 0,58, 95% CI 0,4-0,84). Ngoài ra ở nhóm bệnh còn được ghi nhận có sự cải thiện thang điểm đau, quãng đường đi bộ tối đa, chỉ số ABI, TcO2.
Tuy nhiên, cũng có những nghiên cứu cho kết quả âm tính. Thử nghiệm lâm sàng có đối chứng với giả dược (JUVENTAS) cho thấy không có sự khác biệt về tỷ lệ cắt cụt chi ở nhóm được điều trị bằng tế bào gốc qua đường tiêm động mạch so với nhóm chứng.
Bảng 65.1. Tổng hợp các nghiên cứu sử dụng liệu pháp tế bào gốc trong điều trị bệnh động mạch chi dưới giai đoạn thiếu máu chi trầm trọng
| TÁC GIẢ | N | LOẠI TB GỐC | ĐƯỜNG DÙNG | KẾT QUẢ |
|---|---|---|---|---|
| Benoit E. (2011) | 48 | BM-MNC | Trong cơ | Không thay đổi ABI, tỷ lệ sống còn không phải cắt cụt chi |
| Gupta PK.(2013) | 20 | Allogenic BM-MSC | Trong cơ | Cải thiện ABI |
| Huang P.(2005) | 28 | G-CSF mobilized PB-MNC | Trong cơ | Cải thiện tỷ lệ cắt cụt chi và lành vết loét |
| Kirana S.(2012) | 24 | TRC,BM-MNC | Trong cơ, trong ĐM | Không có sự khác biệt giữa các loại tế bào gốc được điều trị |
| Losordo DW.(2013) | 28 | CD34+ PB-MNC | Trong cơ | Xu hướng giảm cắt cụt chi (liên quan đến liều dùng, không ý nghĩa) |
| Lu D (2011) | v | BM-MSC, BM-MNC | Trong cơ | Cải thiện ABI, TpO2, thời gian đi bộ. Loét chi liền nhanh hơn (MB-MSC > MB-MNC > placebo) |
| Mohammadzadeh L. (2013) | 21 | G-CSF mobilized PB-MNC | Trong cơ | Cải thiện ABI, tỷ lệ cắt cụt chi |
| Ozturk A. (2012) | 40 | G-CSF mobilized PB-MNC | Trong cơ | Cải thiện ABI, điểm đau |
| Perin EC.(2011) | 21 | ALDH+BM-MNC | Trong cơ | Xu hướng giảm cắt cụt chi (không ý nghĩa, phụ thuộc liều) |
| Prochazka (2010) | 96 | BM-MNC | Trong cơ | Giảm tỷ lệ cắt cụt chi |
| Tateishi-Yuyama E. (2002) | 22 | BM-MNC | Trong cơ | Cải thiện ABI, TpO2, đau khi nghỉ, thời gian đi bộ |
| Walter DH.(2011) | 40 | BM-MNC | Trong cơ | Cải thiện điểm đau, nhanh liền vết loét |
Chú thích: BM-MNC: tế bào đơn nhân tủy xương; BM-MSC: tế bào gốc trung mô tủy xương; PB-MNC: tế bào đơn nhân máu ngoại vi; G-CSF: yếu tố kích thích bạch cầu hạt; ALDH: enzyme aldehyde dehydrogenase.
Mặc dù tiêu chuẩn đánh giá hiệu quả của tế bào gốc đối với bệnh ĐM chi dưới giai đoạn cuối còn chưa thống nhất, kết quả nghiên cứu của một số thử nghiệm lâm sàng còn một số tranh cãi, Hội Tim mạch châu Âu trong Khuyến cáo điều trị bệnh động mạch chi dưới đã giới thiệu tế bào gốc và trị liệu gen là những công nghệ mới trong điều trị bệnh lý này.
6.5 Bệnh cơ tim giãn
Cơ chế tác động của tế bào gốc trong sự tái tạo các vùng sẹo cơ tim thiếu máu đã rõ ràng, trong khi ở bệnh cơ tim giãn giải phẫu bệnh chủ yếu là các vùng cơ tim bị xơ hoá, cơ chế tác động của tế bào gốc ra sao vẫn còn chưa thật sự sáng tỏ.
Nghiên cứu đầu tiên ứng dụng công nghệ tế bào gốc trong điều trị bệnh cơ tim giãn là TOPCARE-DCM, đây là một nghiên cứu đoàn hệ, với 33 bệnh nhân (không có nhóm chứng). Đối tượng nghiên cứu là những bệnh nhân được chẩn đoán bị bệnh cơ tim giãn, có EF ≤ 40%, NYHA 1-3. Tế bào gốc đơn nhân tủy xương được truyền vào động mạch vành. Sau 3 tháng, kết quả cho thấy có sự cải thiện phân suất tống máu thất trái, vận động vùng và chức năng vi mạch.
7 Can thiệp nội mạch bệnh lý độngmachj chủ phức tạp
7.1 Ứng dụng công nghệ in 3D hỗ trợ thiết kế và lập kế hoạch can thiệp động mạch chủ phức tạp
Dựa trên hình ảnh cắt lớp vi tính đa dãy (MSCT) tái tạo cấu trúc động mạch chủ kết hợp công nghệ in 3D giúp tạo nên cấu trúc động mạch chủ mô phỏng theo đúng kích thước và hình thái động mạch chủ của người bệnh từ đó sẽ thiết kế hệ thống Stent graft phù hợp với cấu trúc giải phẫu của người bệnh. Công nghệ in 3D rất có ý nghĩa đối với các tổn thương động mạch chủ phức tạp liên quan đến các nhánh bên để thiết kế hệ thống Stent graft có nhánh, có lỗ bên phù hợp với giải phẫu bệnh nhân.
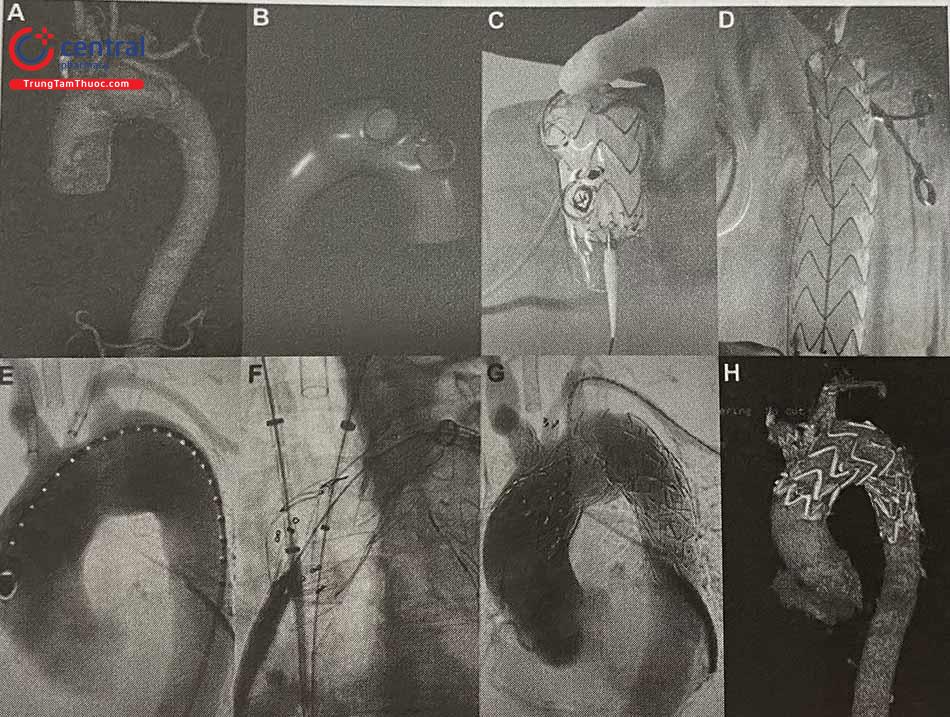
(A) Hình ảnh 3D trước can thiệp; (B) Mô hình in 3D; (C) Đặt Stent trong mô hình 3D xác định vị trí mở cửa sổ; (D) Làm thay đổi phần đầu Stent graft; (E) Chụp DSA quai động mạch chủ; (F) Đặt Stent có cửa sổ theo thiết kế; (G) Chụp quai ĐMC; (H) Hình ảnh 3D động mạch chủ sau can thiệp.
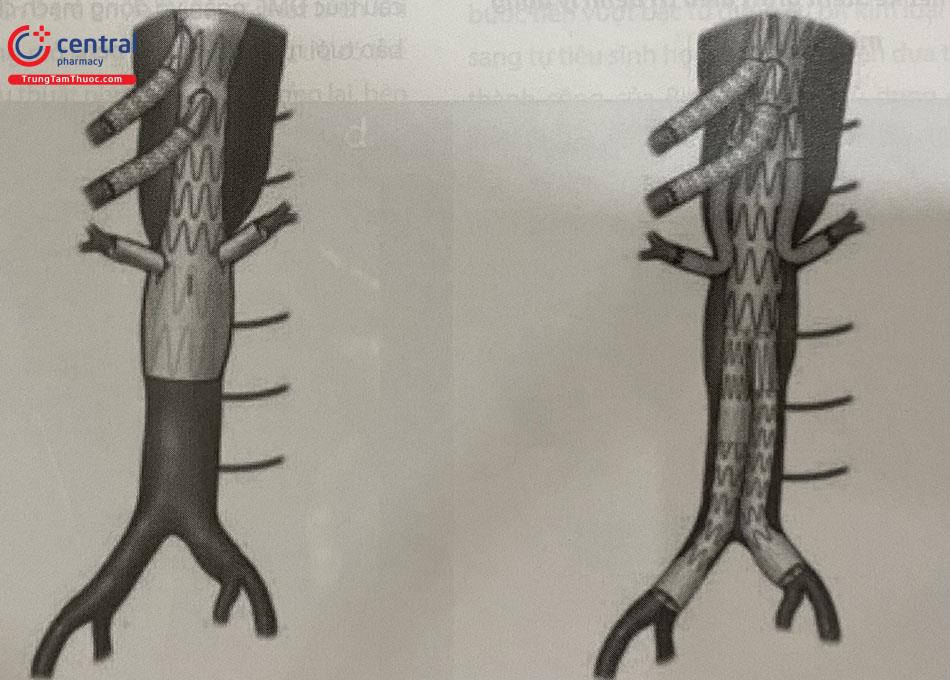
7.2 Thiết kế Stent graft có nhánh điều trị bệnh lý động mạch chủ phức tạp
Các bệnh lý động mạch chủ liên quan đến động mạch chủ ngực bụng hiện vẫn là thách thức trong can thiệp nội mạch. Thiết kế Stent graft có nhiều nhánh bên phù hợp với mỗi bệnh nhân phình ĐMC ngực bụng.
7.3 Thiết kế Stent graft điều trị bệnh lý động mạch chủ lên, vùng quai động mạch chủ
Các thiết kế Stent graft có cấu tạo để có thể thực hiện điều trị đối với bệnh lý động mạch chủ lên, vùng quai động mạch chủ.
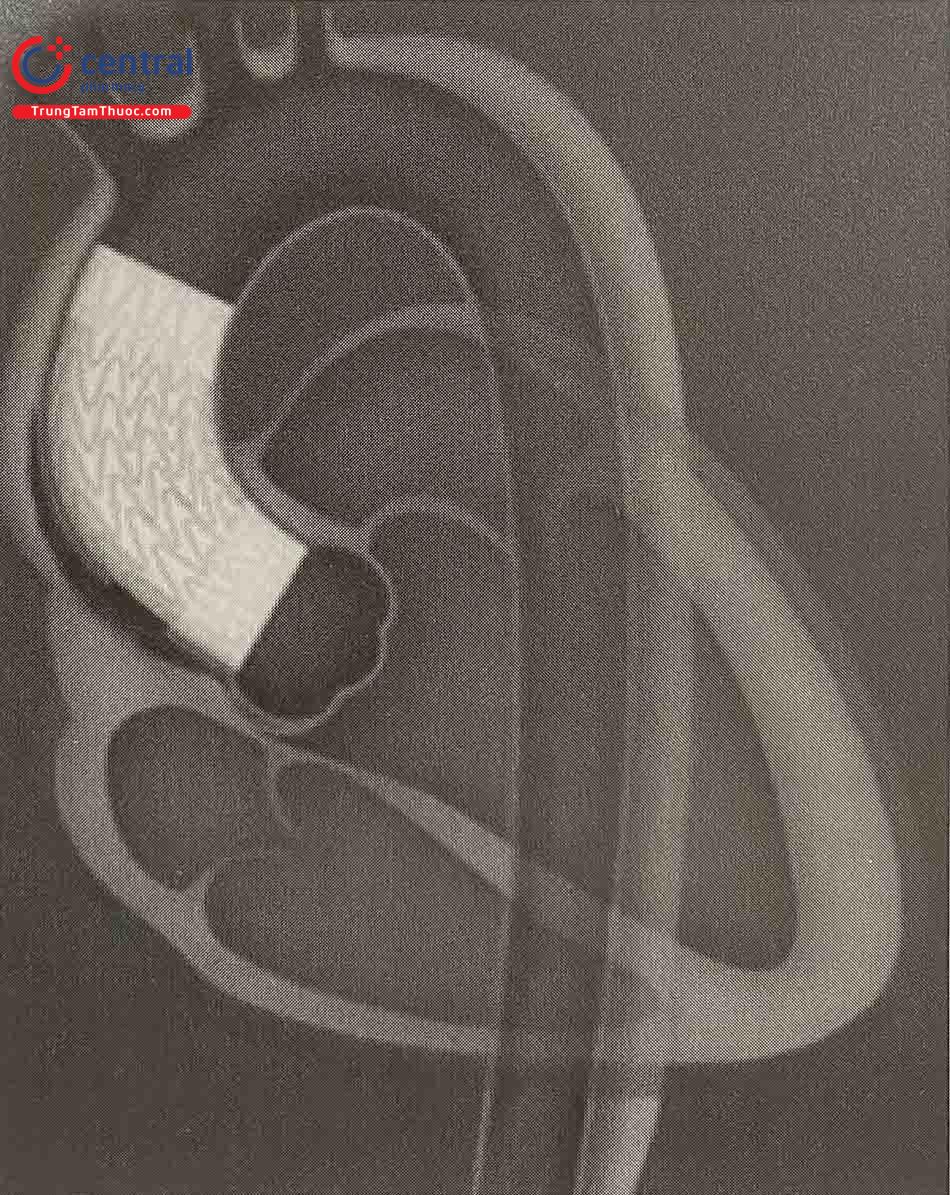

7.4 Ứng dụng Stent nhiều lớp hướng dòng chảy trong điều trị bệnh lý động mạch chủ
Với thiết kế Stent với nhiều lớp có tác dụng hướng dòng chảy làm giảm áp lực lên thành động mạch chủ giúp tái cấu trúc ĐMC ngăn vỡ động mạch chủ đồng thời vẫn đảm bảo tưới máu các nhánh bên.
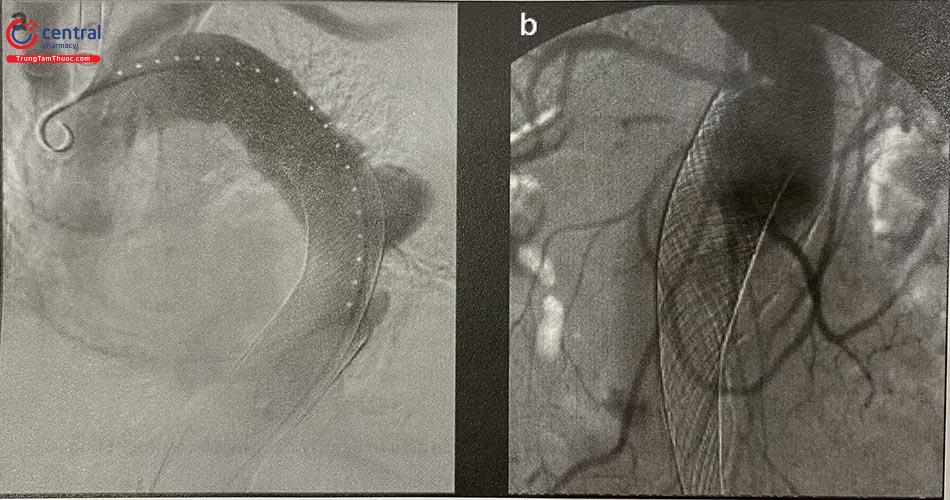
8 Xu hướng tương lai trong can thiệp tim bẩm sinh
Các biện pháp thông tim can thiệp để điều trị hoặc giảm nhẹ ở trẻ sơ sinh, trẻ em và người lớn mắc bệnh tim bẩm sinh đã phát triển nhanh chóng về cả cải tiến kỹ thuật và phát triển thiết bị trong ba thập kỷ trở lại đây. Bằng cách xem xét cải tiến mới hoặc sự phát triển của các thiết bị và kỹ thuật, chúng ta có thể bàn luận về tương lai can thiệp tim bẩm sinh trong thập kỷ tới.
Những phát kiến có thể kể đến gần đây: các thiết bị và stent có thể phân hủy sinh học, thay van động mạch phổi ở bệnh nhân có đường ra thất phải tự nhiên và các can thiệp có hướng dẫn của MRI đã tiến triển nhanh chóng với kết quả tốt, sử dụng tế bào gốc ở trẻ sơ sinh… Những cải tiến trên sẽ được giới thiệu và phổ biến dần trong vòng thập kỷ tới mặc dù thực tế vẫn còn những thách thức lâm sàng cần vượt qua.
8.1 Stent và dụng cụ tự tiêu sinh học
8.1.1 Stent tự tiêu sinh học
Với bệnh tim bẩm sinh, stent tự tiêu sinh học sẽ có nhiều lợi ích, đặc biệt ở trẻ sơ sinh và trẻ nhỏ. Stent kim loại nở bằng bóng là phương pháp can thiệp chủ yếu để điều trị hẹp mạch máu. Tuy nhiên, các yếu tố hạn chế chính khi sử dụng stent kim loại trần ở trẻ em là thiếu sự phát triển khi trẻ lớn lên và tiềm năng mở rộng hạn chế, do đó trẻ có thể trải qua can thiệp phẫu thuật phức tạp trong tương lai, bên cạnh các biến chứng phổ biến khác như huyết khối trong stent và tái hẹp muộn trong stent. Thiết kế stent tự tiêu sinh học (BDS) giúp thay thế cho stent kim loại trần, ở bệnh nhân tim bẩm sinh người lớn và trẻ em.
BDS có một số ưu điểm so với các thiết kế stent kim loại trần hiện có: Đầu tiên là sau khi được tự tiêu sinh học, sẽ có khả năng để lại một mạch máu tự nhiên trong đó nội mạc đã được chữa lành với khả năng phát triển về sau; hơn nữa, BDS có thể hoạt động như một nền tảng tương tự như các stent kim loại, cho thuốc hoặc gen để thúc đẩy sự phát triển của mạch; cuối cùng, BDS dễ dàng tương thích với chụp cộng hưởng từ và cắt lớp vi tính.
8.1.2 Dụng cụ bít tự tiêu sinh học
Can thiệp bít thông liên nhĩ bằng dụng cụ qua đường ống thông là biện pháp điều trị tiêu chuẩn hiện nay. Các thiết bị hiện tại sử dụng một khung kim loại để hỗ trợ vật liệu kẹp vách liên nhĩ để đóng lỗ thông vĩnh viễn. Tuy nhiên, sự có mặt lâu dài của một lượng kim loại đáng kể trong tim có thể dẫn đến các biến chứng hiếm gặp nhưng nặng nề như loét thành, rối loạn nhịp tim và hình thành huyết khối và rất có thể liên quan đến nội mô không hoàn chỉnh. Ngoài ra, dụng cụ khiến cho việc vượt qua vách ngăn để tiếp cận bên tim trái trở nên khó khăn cho các can thiệp trong tương lai, điều này làm giảm đáng kể các lựa chọn điều trị trong tương lai cho những bệnh nhân nói trên. Do đó, các dụng cụ bít có tính năng tự tiêu sinh học đã trở thành một nhu cầu thực tế trên một nhóm bệnh nhân nhất định.
Ngay từ năm 2003, dụng cụ bít có thể tự tiêu một phần đầu tiên, BioSTAR (NMT Medical, Boston, MA, USA) với khung vĩnh viễn bằng kim loại (MP35N) và màng hấp thụ sinh học được làm từ Collagen ruột, đã được giới thiệu. Một bước tiến vượt bậc từ dụng cụ bít kim loại không phân hủy sang tự tiêu sinh học được thực hiện dựa trên sự phát triển thành công của BioSTAR, mặc dù dụng cụ này đã bị rút khỏi thị trường do biến chứng đứt dây và phản ứng viêm cục bộ liên quan đến vật liệu sinh học của màng. Hiện tại, một số dụng cụ bít tự tiêu sinh học một phần hoặc hoàn toàn đang được phát triển và đã ở các giai đoạn thử nghiệm lâm sàng hoặc thử nghiệm trên động vật hoặc trên người (Hình 65.2

8.2 Thay van động mạch phổi qua đường ống thông ở bệnh nhân có đường ra thất phải sau mổ tự nhiên
Hở van động mạch phổi sau phẫu thuật sửa chữa tứ chứng Fallot (Fallot 4) là biến chứng thường gặp và trước đây các bác sĩ phải phẫu thuật lại để thay van động mạch phổi. Năm 2000, thay van động mạch phổi qua đường ống thông (PPVI) với van có thể giãn nở bằng bóng đã thay thế phương pháp phẫu thuật ở một nhóm bệnh nhân đủ tiêu chuẩn. Tuy nhiên, PPVI với các van giãn nở bằng bóng có trên thị trường có những hạn chế vì kích thước của chúng và hiện có thể áp dụng cho các trường hợp có conduit (ống nối có van) nối động mạch phổi-thất phải hoặc van sinh học, đồng thời được coi là không phù hợp với các trường hợp đường ra thất phải bị giãn tự nhiên sau kỹ thuật sửa chữa bằng miếng vá, chiếm khoảng 70–75% bệnh nhân Fallot 4 được phẫu thuật.
Hiện nay, thế hệ van động mạch phổi tự giãn nở thế hệ mới được phát triển như: van chữ P Venus (Venus Medtech, Thượng Hải, Trung Quốc); van Pulsta (TaeWoong Medical Co., Ltd., Gimpo-si, Gyeonggi-do, Hàn Quốc); van động mạch phổi Harmony (Medtronic, Minneapolis, MN, Hoa Kỳ), đã được phát triển cho đối tượng bệnh nhân có đường ra thất phải tự nhiên.
Tất cả các van nói trên cấu tạo chung gồm van mô màng ngoài tim lợn được gắn trên một khung nitinol tự giãn nở và có các loe ở gần và xa để neo van trong đường ra thất phải. Hiện tại, van P-van Venus có đường kính từ 16 đến 36 mm với gia tăng số 2 mm, với mỗi đường kính có các chiều dài đoạn thẳng 20, 25, 30 và 35 mm. Van có thể được đặt vào đường ra thất phải, trong đó đường kính hẹp nhất lên đến 33–34 mm, van có đường kính lớn nhất lên đến 36 mm – cũng là van có đường kính lớn nhất hiện nay.
Với những phát triển của công nghệ mới, sẽ có nhiều bệnh nhân thể tránh lặp lại phẫu thuật cắt bỏ đường giữa và giảm nguy cơ phải phẫu thuật lại cho phần lớn bệnh nhân Fallot 4. Trong tương lai không xa, nếu thiết kế van qua da làm có kích thước lớn với lá van được phát triển từ công nghệ tế bào gốc tự thân trở thành hiện thực, có thể giúp bệnh nhân tránh được việc phải mổ lại (Xem thêm mục 4. Can thiệp tim thai và sử dụng tế bào gốc).
8.3 Cộng hưởng từ (MRI) hướng dẫn can thiệp
Thông tim và can thiệp thường được sử dụng trong chẩn đoán và điều trị bệnh tim bẩm sinh. Tuy nhiên, việc sử dụng bức xạ trong quá trình thông tim can thiệp dưới hướng dẫn tia X, lặp đi lặp lại nhiều lần đã dẫn đến những lo ngại liên quan đến nguy cơ mắc các khối u về sau, và cũng là điều cần chú ý đặc biệt ở trẻ em, khi cơ thể tăng độ nhạy với bức xạ nhất là các trường hợp phơi nhiễm lặp đi lặp lại. Trong khi đó chụp cộng hưởng từ (MRI) không chỉ tránh phơi nhiễm với bức xạ mà còn có ưu điểm là có thể cung cấp hình ảnh và thông tin huyết động giá trị hơn như đặc điểm mô cơ quan, giúp định lượng thể tích buồng thất và đánh giá huyết động.
Trong quy trình thông tim dưới hướng dẫn MRI sẽ kết hợp của kỹ thuật chụp Xquang, trong đó ban đầu phương pháp soi tia X dưới màn huỳnh quang để hướng dẫn vị trí đưa ống thông, sau đó chụp MRI để đánh giá giải phẫu và huyết động.
Về mặt can thiệp, đã có một số nghiên cứu trên động vật cho thấy tính an toàn và hiệu quả của cộng hưởng từ tim mạch can thiệp (CMR) đối với các thủ thuật tim bẩm sinh. CMR can thiệp trên động vật đã được sử dụng để tạo điều kiện thuận lợi cho các thủ thuật như nong động mạch bằng bóng trong trường hợp hẹp động mạch, chọc thông liên nhĩ, cũng như đặt stent động mạch phổi, nong hẹp eo động mạch chủ và can thiệp tĩnh mạch chủ. Thiết bị đóng thông liên nhĩ, cũng như các nghiên cứu sâu hơn trên động vật cũng đưa ra các biện pháp can thiệp tiềm năng trong điều trị bệnh tim bẩm sinh như can thiệp thay van tim, đóng lỗ thông liên thất qua đường ống thông… Dựa trên các nghiên cứu tiền lâm sàng được với kết quả đáng khích lệ, việc áp dụng các biện pháp can thiệp hiện đã được mở rộng trên cơ thể người. Hiện đã có những báo cáo can thiệp tim bẩm sinh chỉ dưới hướng dẫn của MRI đầu tiên ở người, với các ca nong van động mạch phổi bằng bóng và nong hẹp eo động mạch chủ, cho thấy kết quả đầy hứa hẹn.
8.4 Can thiệp tim thai và sử dụng tế bào gốc ở thai hoặc trẻ sơ sinh
8.4.1 Can thiệp tim thai
Với những tiến bộ trong sàng lọc tim thai, hơn 50% các tổn thương tim bẩm sinh đáng kể có thể được xác định trong giai đoạn trước sinh. Từ đó, các kỹ thuật can thiệp tim thai dần phát triển, cũng cho thấy sự tiến bộ trong can thiệp tim bẩm sinh, với ca nong van hẹp khít van động mạch chủ bằng bóng vào năm 1991. Các báo cáo khác về can thiệp trong bào thai bao gồm nong hẹp khít van động mạch phổi, chọc vách liên nhĩ ở bệnh nhân thiểu sản tim trái…
Mặc dù phương pháp can thiệp tim bẩm sinh có thể thực hiện được trong thai kỳ để cải thiện chức năng tim của thai nhi, tăng cường khả năng sửa chữa hai thất sau khi sinh và khả năng sống sót của trẻ sơ sinh. Tuy nhiên cần có một nhóm đa ngành được đào tạo bài bản với trang thiết bị tinh vi để nâng cao tỷ lệ thành công về mặt kỹ thuật và kết quả sau can thiệp, cũng như cần nhiều nghiên cứu lâm sàng để lựa chọn đối tượng phù hợp. Do đó, mặc dù có những hứa hẹn nhưng vẫn còn nhiều thách thức để phát triển các trung tâm can thiệp tim thai trong tương lai.
8.5 Sử dụng tế bào gốc ở bào thai hoặc trẻ sơ sinh
Một hướng tiếp cận cho thấy nhiều hứa hẹn khác là sử dụng tế bào gốc ở bào thai hoặc ở trẻ sơ sinh trong việc tạo ra các vật liệu sinh học tự thân, hỗ trợ việc can thiệp hoặc phẫu thuật về sau.

(Nguồn: Avolio E et al. Stem cell therapy and tissue engineering for correction of congenital heart disease. Front Cell Dev Biol. 2015)
Các tế bào gốc có thể lấy từ các nguồn sau:
Trường hợp bệnh nhân tim bẩm sinh được chẩn đoán trước sinh, tế bào thai nhi có thể được chủ động lấy và lưu trữ.
Bên cạnh đó, tế bào gốc dây rốn có thể được phân lập và lưu trữ ngay khi trẻ mới sinh.
Đồng thời, khi chẩn đoán xác định tim bẩm sinh và ở những trẻ cần phẫu thuật giảm nhẹ ngay sau khi sinh, tế bào gốc có thể được phân lập từ mô của của tim được lấy ra.
Các loại tế bào gốc nói trên sẽ cho phép nuôi cấy, tạo ra mô ghép từ tế bào gốc tự thân, giúp phát triển các mô tự thân, tạo ra các vật liệu sinh học cần thiết cho việc sửa chữa dứt điểm các khuyết tật tim về sau thông qua phẫu thuật hoặc tạo ra van tim tự thân cho phương pháp can thiệp thay van về sau.
9 Xu hướng tương lại trong lĩnh vực tạo nhịp và điện sinh lý tim
9.1 Bóng phát năng lượng có tần số radio nhằm cô lập tĩnh mạch phổi trong triệt đốt rung nhĩ
Những năm gần đây, hãng Biosense Webster (Hoa Kỳ) đã thiết kế ra loại dụng cụ có bóng ở đầu (HeliostarTM) dùng để triệt đốt cô lập tĩnh mạch (TM) phổi bằng năng lượng sóng có tần số radio (RF). Trên bề mặt bóng bố trí 10 điện cực phát RF làm bằng vàng, kèm theo các lỗ tưới nước. Điện cực dạng vòng nhẫn để ghi điện đồ trong TM phổi được đưa xuyên qua lòng ống thông của bóng để vào TM phổi. Khi bóng đã được lái tiếp xúc với chu vi phần mô nhĩ ở quanh lỗ đổ vào TM phổi, năng lượng RF có thể được phát ở toàn bộ 10 điện cực RF trên thân bóng để triệt đốt toàn bộ chu vi phần mô nhĩ tiếp xúc với bóng nhằm cô lập TM phổi. Bác sĩ làm thủ thuật cũng có thể chỉ lựa chọn phát năng lượng RF ở một số điện cực nào đó trong số 10 điện cực RF này để cô lập một khu vực nào đó đang nhắm tới. Ưu điểm của loại bóng RF là triệt đốt cô lập TM phổi nhanh chóng, đôi khi chỉ bằng một lần đốt duy nhất, giúp rút ngắn thời gian thủ thuật và tăng khả năng cô lập hoàn toàn kín vòng. Trước đây, với ống thông triệt đốt thông thường, bác sĩ làm thủ thuật cần phải mất nhiều thời gian để lái ống thông đốt lần lượt từng điểm để cô lập kín chu vi phần mô nhĩ quanh lỗ đổ vào TM phổi. Phương pháp truyền thống này mất nhiều thời gian hơn và đòi hỏi kỹ năng, kinh nghiệm của thủ thuật viên nhiều hơn để hạn chế các điểm đốt chưa đủ hiệu quả.
Bóng RF đã được chứng minh tính hiệu quả và an toàn qua một số nghiên cứu mới công bố gần đây và đang kỳ vọng được thử nghiệm và áp dụng rộng rãi hơn nữa ở nhiều trung tâm trên thế giới.

9.2 Triệt đốt cô lập tĩnh mạch phổi bằng bóng áp lạnh (Cryoablation) của hãng Medtronic (Minneapolis, MN, USA)
Phương pháp triệt đốt cô lập TM phổi bằng bóng áp lạnh Arctic Front Advance của hãng Medtronic đã được ứng dụng khá phổ biến ở các nước đi đầu về nghiên cứu và phát triển trên thế giới. Tuy nhiên, tại các nước đang phát triển, trong đó có Việt Nam, do vấn đề chi phí, bóng áp lạnh mới bắt đầu được giới thiệu và triển khai gần đây ở một số ca bệnh đầu tiên.
Phương pháp này sử dụng một quả bóng áp sát vào phần mô nhĩ quanh lỗ TM phổi và thay vì sử dụng năng lượng RF, bóng sẽ được làm lạnh sâu để gây tổn thương ngay toàn bộ mô nhĩ quanh lỗ TM phổi, nhằm cô lập nhĩ trái với các TM phổi về mặt điện học.
Ưu điểm của phương pháp này là thời gian thủ thuật ngắn, có thể làm trực tiếp với hệ thống soi chiếu Xquang thông thường, không cần trợ giúp của hệ thống lập bản đồ ba chiều buồng tim. Một số nghiên cứu cho thấy hiệu quả và tính an toàn của bóng áp lạnh không hề kém hơn so với triệt đốt cô lập TM phổi truyền thống bằng RF sử dụng loại catheter đốt lần lượt từng điểm. Nhiều trung tâm lớn trên thế giới ở các nước phát triển đã sử dụng phương pháp này để cô lập TM phổi trong rung nhĩ cơn kịch phát. Một số trung tâm đang nghiên cứu ứng dụng phương pháp này trong triệt đốt rung nhĩ bền bỉ.
Nhược điểm của phương pháp này là giá thành còn cao và trong một số trường hợp không cô lập được kín chu vi TM phổi do kỹ năng lái bóng của thủ thuật viên hoặc gặp phải các cản trở về mặt cấu tạo giải phẫu, ngay cả ở những ca bệnh được coi là có giải phẫu TM phổi khá lý tưởng. Một điểm yếu khác là một khi đã phát năng lượng làm lạnh, năng lượng sẽ tỏa đều khắp chu vi bóng, gây tổn thương cả các vùng mô không mong muốn, nên ta không thể chủ định triệt đốt một vùng đích nhỏ nào đó mà ta đang nhắm tới khi dùng loại bóng áp lạnh này.
Mặc dù có một số nhược điểm nhất định, tuy nhiên, với những ưu điểm của nó, hy vọng phương pháp bóng áp lạnh sẽ được ứng dụng rộng rãi trong tương lai ở Việt Nam để triệt đốt cô lập TM phổi cho những bệnh nhân rung nhĩ có chỉ định phù hợp.

9.3 Hệ thống lập bản đồ ba chiều nội mạc buồng tim tự động định vị cơ chất rối loạn nhịp
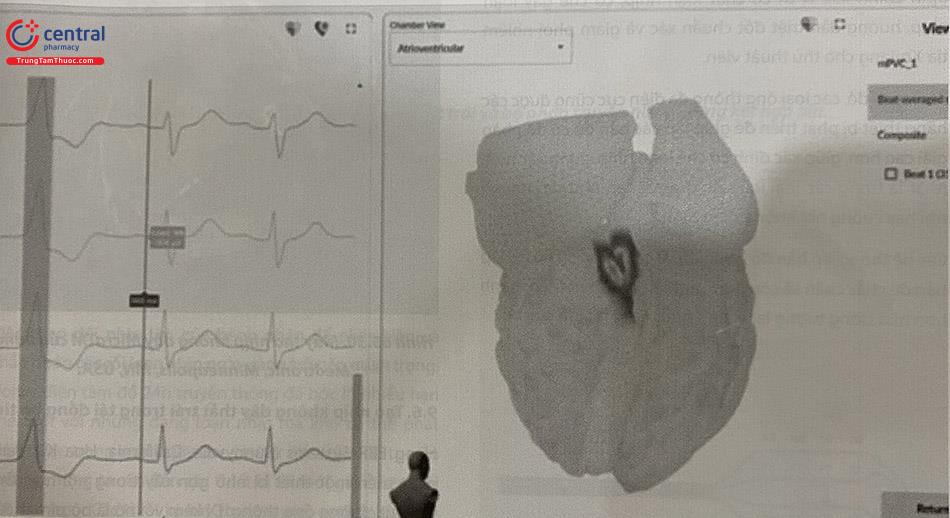
Gần đây, các nhà khoa học ở San Diego Health thuộc Trường Đại học tổng hợp California – Hoa Kỳ đã phát triển một hệ thống tự động dựng bản đồ ba chiều buồng tim và định vị khu vực cơ chất rối loạn nhịp với dữ liệu đầu vào chỉ dùng điện tâm đồ 12 chuyển đạo. Với cách thức truyền thống như trước đây, bác sĩ làm thủ thuật cần phải lái catheter khắp buồng tim, dựa vào hình thái QRS trên điện tâm đồ 12 chuyển đạo để dự đoán sơ bộ khu vực khởi phát rối loạn nhịp và dùng các phương pháp lập bản đồ khác để khu trú lại chính xác vị trí cơ chất loạn nhịp.
Phương pháp sử dụng trí tuệ nhân tạo mới này hứa hẹn sẽ rút ngắn rất nhiều thời gian định vị cơ chất rối loạn nhịp và từ đó tiết kiệm nhiều công sức và thời gian thủ thuật, thời gian chiếu tia Xquang cho thủ thuật viên. Khi đã có sẵn bản đồ định vị vùng rối loạn nhịp với độ chính xác cao, bác sĩ làm thủ thuật hầu như chỉ cần đưa ống thông triệt đốt vào khu vực đã được đánh dấu sẵn, tinh chỉnh thêm cho chính xác và tiến hành triệt đốt ngay.
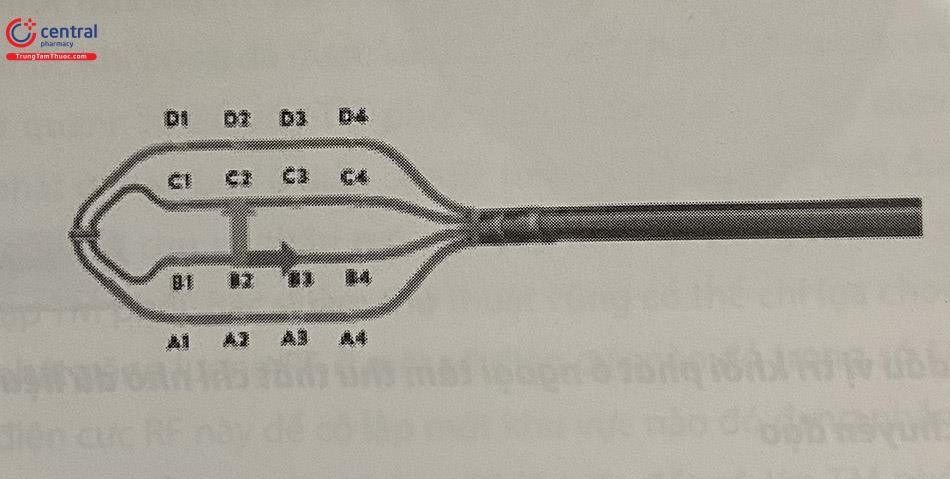
9.4 Các hệ thống lập bản đồ và điện cực phục vụ lập bản đồ có độ chính xác cao
Các hệ thống lập bản đồ giải phẫu – nội mạc ba chiều buồng tim ngày càng được ứng dụng rộng rãi trong triệt đốt mọi loại rối loạn nhịp, bất kể là các loại rối loạn nhịp phức tạp như rung nhĩ, cuồng nhĩ hay các loại rối loạn nhịp truyền thống như ngoại tâm thu thất, tim nhanh trên thất. Một vài hệ thống tiêu biểu như Ensite PrecisionTM của hãng Abbott, Hoa Kỳ; Carto 3® của hãng Biosense Webster, Hoa Kỳ; RhythmiaTMcủa hãng Boston Scientific, Hoa Kỳ.
Việc ứng dụng các hệ thống lập bản đồ ba chiều giúp xác định chính xác vị trí cơ chất loạn nhịp, cơ chế gây loạn nhịp, hướng dẫn triệt đốt chuẩn xác và giảm phơi nhiễm tia Xquang cho thủ thuật viên.
Bên cạnh đó, các loại ống thông đa điện cực cũng được các hãng thiết bị phát triển để giúp lập các bản đồ có độ phân giải cao hơn, giúp xác định cơ chế loạn nhịp chính xác hơn, nhất là trong các loại loạn nhịp phức tạp như tim nhanh nhĩ hay cuồng nhĩ không điển hình.
Các hệ thống lập bản đồ ba chiều và các dụng cụ hỗ trợ lập bản đồ chắc chắn sẽ còn được nghiên cứu phát triển mạnh hơn nữa trong tương lai vì tính hữu dụng rất lớn của nó.
9.5 Máy tạo nhịp không dây
Máy tạo nhịp không dây và các thiết bị không dây nói chung đang hứa hẹn mang lại những bước ngoặt lớn trong tương lai chuyên ngành tạo nhịp tim.
Ưu điểm của máy tạo nhịp không dây là nhỏ gọn, đặt hoàn toàn trong buồng tim, hạn chế được rất nhiều nguy cơ nhiễm trùng. Hiện nay, các máy tạo nhịp không dây mới đang dừng lại ở phương thức tạo nhịp một buồng thất. Số lượng bệnh nhân có chỉ định phù hợp cho tạo nhịp không dây một buồng thất còn tương đối hạn chế. Các nhà khoa học đang liên tục nghiên cứu, cải tiến và phát triển dần các loại thiết bị tạo nhịp không dây mới trong tương lai có thể đáp ứng mọi phương thức tạo nhịp tim và chỉ định rộng rãi hơn cho nhiều đối tượng bệnh nhân.
9.6 Tạo nhịp không dây thất trái trong tái đồng bộ tim
Hãng EBR Systems (Sunnyvale, California, Hoa Kỳ) đang phát triển một thiết bị nhỏ gọn cấy trong nội mạc thất trái qua đường ống thông. Đi kèm với nó là bộ pin và đầu thu phát năng lượng cấy ở dưới da vùng mỏm tim và cạnh sườn. Thiết bị này đóng vai trò tạo nhịp thất trái và sẽ được kết nối qua tín hiệu không dây với máy tạo nhịp truyền thống với dây điện cực thất phải (kèm hoặc không kèm phá rung). Bộ vi xử lý sẽ điều hành để tạo nhịp một cách đồng bộ ở dây điện cực thất phải truyền thống và thiết bị trong nội mạc thất trái.
Thiết bị này giúp khắc phục các hạn chế của dây điện cực xoang vành truyền thống của phương pháp đặt máy tái đồng bộ tim.

Thiết bị này có thể được phối hợp với máy tạo nhịp hoặc máy phá rung truyền thống để nhằm tạo nhịp đồng bộ 2 thất cho bệnh nhân.
9.7 Các thiết bị theo dõi nhịp tim thay thế cho Holter điện tim 24h truyền thống, tích hợp theo dõi từ xa
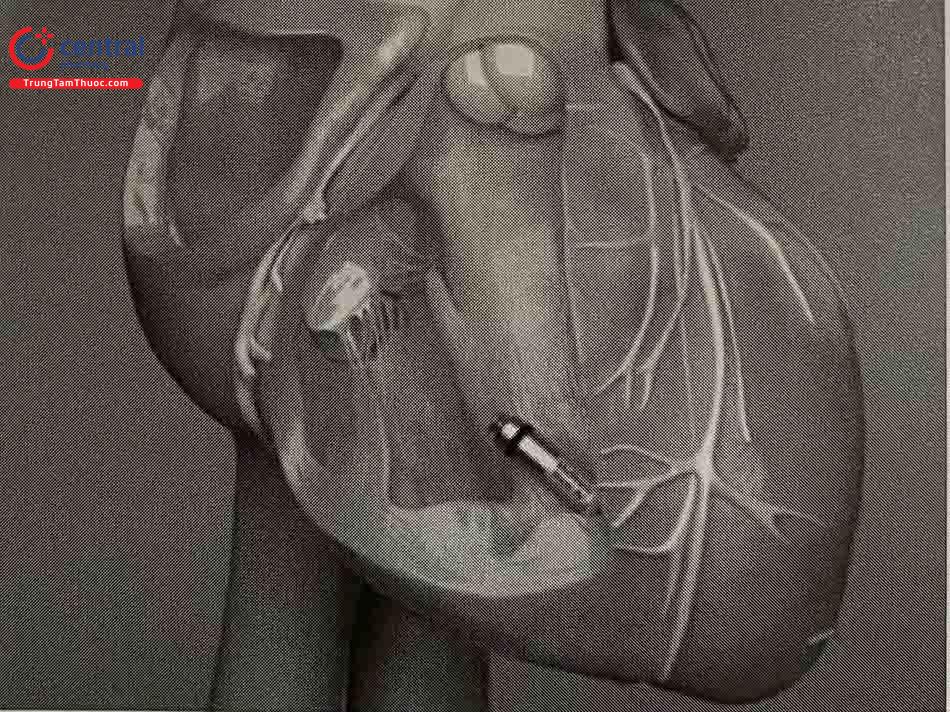
Việc theo dõi nhịp tim của bệnh nhân để phát hiện và chẩn đoán các rối loạn nhịp ngày càng trở nên quan trọng. Holter điện tâm đồ 24h truyền thống đã bộc lộ nhiều hạn chế. Đối với những dạng loạn nhịp mà khó có thể phát hiện được trong một ngày đeo Holter điện tâm đồ truyền thống, chúng ta cần đến các thiết bị có thời gian theo dõi dài hạn hơn. Các thiết bị này thường nhỏ gọn, có thể cấy dưới da của bệnh nhân, không gây cản trở sinh hoạt cho bệnh nhân. Dữ liệu điện tim mà các thiết bị này ghi được có thể được thu thập thông qua máy tính lập trình truyền thống hoặc có thể được theo dõi từ xa. Các loạn nhịp mà bệnh nhân có hoàn toàn có thể được chẩn đoán chính xác nhờ dữ liệu thu thập được từ các thiết bị theo dõi điện tim này.
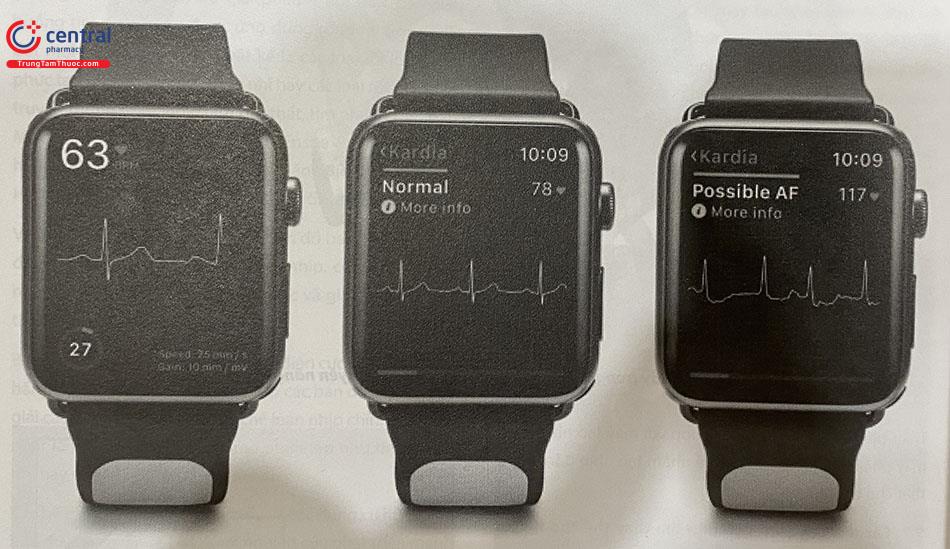
9.8 Đồng hồ thông minh theo dõi nhịp tim
Hiện nay nhiều hãng trên thế giới đang phát triển và hoàn thiện các loại đồng hồ thông minh có khả năng ghi được điện tim của bệnh nhân trên cơ sở tạo lập một chuyển đạo ghi điện tim ngoại biên nào đó. Các loại đồng hồ thông minh này có thể giúp phát hiện và chẩn đoán sớm các cơn loạn nhịp nhanh như tim nhanh trên thất, cơn rung nhĩ/ cuồng nhĩ. Từ đó, bệnh nhân có thể được can thiệp kịp thời bằng thuốc hoặc bằng các biện pháp can thiệp khác. Các loại loạn nhịp chậm như đoạn ngừng xoang hay block nhĩ thất từng lúc cũng có thể được phát hiện nhờ các loại đồng hồ thông minh có khả năng ghi nhận nhịp tim và điện tim ngoại biên này.
10 Tài liệu tham khảo
1. Tomohito Kogure & Shakeel A. The Future of Pediatric Heart Interventions: Where Will We Be in 2030?. Qureshi Current Cardiology Re- ports volume 22, Article number: 158 (2020).
2. Damien Kenny and Ziyad M. Hijazi. Current Status and Future Potential of Transcatheter Interventions in Congenital Heart Disease. Circulation Research. 2017;120:1015–1026.
3. Avolio E, Caputo M, Madeddu Stem cell therapy and tissue engineering for correction of congenital heart disease.Front Cell Dev Biol. 2015; 3:39. doi: 10.3389/fcell.2015.00039.
4. Nallamothu BK, Cohen DJ – No “I” in Heart Team – Incentivizing Multidisciplinary Care in Cardiovascular Circ Cardiovasc Qual Outcomes. 2012;5:410–13.
5. Kaladji A, Daoudal A, Clochard E, Gindre J, Cardon A, Castro M, et al. Interest of fusion imaging and modern navigation tools with hybrid rooms in endovascular aortic procedures. J Cardiovasc Surg (Torino) 2017;58:458–466.
6. Kaneko T, Davidson MJ. Use of the hybrid operating room in cardiovascular medicine. Circulation. 2014;130:910–917
7. Grodanz E. Robotic mitral valve repair. J Cardiovasc Nurs. 2015;30:325–31.
8. Wang N, Zhou JJ, Phan S, Yan TD, Phan K. Robot-assisted hybrid coronary revascularisation: systematic review. Heart Lung Circ. 2015;24:1171–9.
9. Bonatti J, Vetrovec G, Riga C, Wazni O, Stadler Robotic technology in cardiovascular medicine. Nat Rev Cardiol. 2014;11:266–75
10. Abraham WT, Zile MR, Weaver FA, Butter C, Ducharme A, Halbach M, Klug D, Lovett EG, Müller-Ehmsen J, Schafer JE, Senni M, Swarup V, Wachter R, Little WC. Baroreflex Activation Therapy for the Treatment of Heart Failure With a Reduced Ejection Fraction. JACC Heart Fail. 2015 Jun;3(6):487-496.
11. Lauder L, Mahfoud Pacemaker-Based Cardiac Neuromodulation Therapy for the Treatment of Hypertension: The New Kid on the Block. J Am Heart Assoc. 2021 Aug 17;10(16):e022622.
12. Yang B, Wang Y, Zhang F, Ju W, Chen H, Mika Y, Aviv R, Evans SJ, Burkhoff D, Wang J, Chen Rationale and evidence for the development of a durable device-based cardiac neuromodulation therapy for hypertension. J Am Soc Hypertens. 2018 May;12(5):381-391
13. Hennig F, Klein C, Knosalla C, Mladenow A, Solowjowa N, Knierim J, Krakau M, Kelle S. Minimally invasive left ventricular reconstruction of a postinfarction, anterior left ventricular scar (BioVentrix Revivent TC procedure). Multimed Man Cardiothorac Surg. 2020 Nov 20;2020.
14. Vora AN, Schuyler Jones W, DeVore AD, Ebner A, Clifton W, Patel MR. First-in-human experience with Aortix intraaortic pump. Catheter Cardiovasc Interv. 2019 Feb 15;93(3):428-433.
15. Đỗ Doãn Lợi Nguyễn Lân Việt, Phạm Mạnh Hùng và cộng sự (2010), Kết quả bước đầu điều trị thử nghiệm tế bào gốc tự thân từ tủy xương cho bệnh nhân bị suy tim sau nhồi máu cơ tim, Tạp chí Tim mạch học Việt Nam 52: 53-63.
16. Li Y, Xie Y, Li B, Xie Z, Shen J, Wang S, Zhang Z. Initial Clinical Experience with the Biodegradable AbsnowTM Device for Percutaneous Closure of Atrial Septal Defect: A 3-Year Follow-Up. J Interv 2021 Jul 30;2021:6369493.
17. Dhillon GS, Honarbakhsh S, Di Monaco A, Coling AE, Lenka K, Pizzamiglio F, Hunter RJ, Horton R, Mansour M, Natale A, Reddy V, Grimaldi M, Neuzil P, Tondo C, Schilling RJ. Use of a multi-electrode radiofrequency balloon catheter to achieve pulmonary vein isolation in patients with paroxysmal atrial fibrillation: 12-Month outcomes of the RADIANCE study. J Cardiovasc Electrophysiol. 2020 Jun;31(6):1259-1269.

