Giải phẫu chức năng của mô kẽ phổi và đại cương bệnh mô kẽ phổi

TS. BS. NGUYỄN VĂN THÀNH
Tải PDF TẠI ĐÂY
1 Tóm tắt:
1.1 MÔ KẼ PHỔI
Cấu trúc phổi của động vật có vú được tối ưu hóa để phục vụ chức năng chính của nó là trao đổi khí. Quá trình này diễn ra ở vùng phế nang (nhu mô), nơi không khí và máu được đưa đến gần nhau trên một bề mặt lớn. Không khí đến lòng phế nang thông qua một cây đường dẫn khí. Máu chảy trong một mạng lưới mao mạch nằm trong vách ngăn giữa các phế nang. Hàng rào giữa không khí và máu bao gồm biểu mô phế nang liên tục (một khảm của các tế bào biểu mô phế nang loại I và loại II), nội mạc mao mạch liên tục và lớp mô liên kết ở giữa.
Các chuyển động hô hấp khiến phổi phải chịu được những thách thức về mặt cơ học trong suốt cuộc đời. Các phế nang phải được bảo vệ khỏi tình trạng căng quá mức cũng như không bị xẹp lại. Sự ổn định về mặt cơ học của nhu mô được đảm bảo bởi hai thành phần: mạng lưới sợi mô liên kết nằm trong mô kẽ (trục, trong tiểu thùy phổi, dưới màng phổi) và hệ thống chất diện hoạt. Các sợi mô liên kết tạo thành xương sống của phổi, căng liên tục. Chất diện hoạt là sản phẩm tiết của tế bào biểu mô phế nang loại II và bao phủ biểu mô phế nang như một lớp màng mỏng, liên tục và có hoạt tính sinh học.
1.2 BỆNH MÔ KẼ PHỔI
Bệnh phổi kẽ (ILD) là thuật ngữ chung dùng để chỉ một nhóm lớn các bệnh gây ra sẹo (xơ hóa) phổi. Sẹo gây ra tình trạng cứng ở phổi khiến việc thở và đưa oxy vào máu trở nên khó khăn. Tổn thương phổi do ILD thường không thể phục hồi và nặng dần theo thời gian.
Bất kỳ ai cũng có thể mắc bệnh phổi kẽ, bao gồm cả trẻ em. Nhiều yếu tố có thể làm tăng nguy cơ mắc hoặc gây ra ILD bao gồm phơi nhiễm ô nhiễm khí thở, di truyền, một số loại thuốc hoặc phương pháp điều trị y tế như xạ trị hoặc hóa trị. Những người mắc các bệnh tự miễn như bệnh sarcoidosis hoặc viêm khớp dạng thấp cũng có nguy cơ mắc ILD cao hơn. Thật không may, trong nhiều trường hợp, chẳng hạn như xơ phổi tự phát, nguyên nhân có thể không được biết rõ.
Triệu chứng phổ biến nhất của tất cả các ILD là khó thở. Triệu chứng này thường kèm theo ho khan, khó chịu ở ngực, mệt mỏi và đôi khi là sụt cân. Trong hầu hết các trường hợp, khi các triệu chứng xuất hiện thì phổi đã bị tổn thương nên điều quan trọng là phải được chẩn đoán ngay. Để chẩn đoán ILD, bên cạnh thông tin về tiền sử sức khỏe là rất quan trọng còn cần các xét nghiệm, nhất là chẩn đoán hình ảnh, chức năng hô hấp và có thể cần các thủ thuật xâm lấn hơn, như nội soi phế quản hoặc sinh thiết phổi.
Phương pháp điều trị ILD khác nhau tùy thuộc vào loại ILD được chẩn đoán và mức độ nặng. Tổn thương phổi do ILD thường không thể phục hồi và tiến triển dần, vì vậy phương pháp điều trị thường tập trung vào việc làm giảm các triệu chứng, cải thiện chất lượng cuộc sống và làm chậm quá trình tiến triển của bệnh. Thuốc, chẳng hạn như corticosteroid, có thể được sử dụng để giảm viêm ở phổi. Bên cạnh đó, bệnh nhân cũng cần các trị liệu không thuốc như liệu pháp oxy, phục hồi chức năng phổi. Trong những trường hợp xấu nhất có thể xem xét ghép phổi.
2 ĐẶT VẤN ĐỀ
Nếu so với phế quản, nhu mô phổi, thì khoảng kẽ phổi (lung interstitium) là khu vực được cho là khá yên tĩnh và không được chú ý nhiều cả trong học thuật lẫn thực hành. Thực ra khoảng kẽ đóng vai trò rất quan trọng trong hoạt động sinh lý phổi, phế quản. Thể tích và áp suất khoảng kẽ là yếu tố chính tham gia vào nhiều quá trình sinh lý bệnh, cấp, bán cấp hoặc mạn tính.
Bệnh phổi kẽ (Interstitial lung disease, ILD) là thuật ngữ chung cho khoảng 200 loại bệnh khác nhau có thể dẫn đến tình trạng viêm và xơ hóa mô phổi. Hình ảnh ILD đặc trưng gồm tình trạng khó thở tiến triển, ho, thiếu oxy, giảm chức năng phổi, thâm nhiễm lan tỏa hai bên trên hình ảnh X-quang ngực, viêm, xơ hóa, hạn chế khả năng vận động và giảm chất lượng cuộc sống. Hầu hết các trường hợp ILD là do một yếu tố nguyên nhân, chẳng hạn như tiếp xúc với chất gây dị ứng, vật liệu độc hại, amiăng, thuốc hoặc bệnh tự miễn dịch tiềm ẩn.
Sự hình thành bệnh lý ở những trường hợp này là một quá trình phức tạp, chịu ảnh hưởng của nhiều yếu tố, bao gồm cả các đặc điểm di truyền của cá nhân người bệnh và việc tiếp xúc với các chất ô nhiễm từ môi trường. Xơ phổi tự phát (Idiopathic pulmonary fibrosis, IPF) là dạng ILD hung hãn nhất, gây ra tình trạng xơ phổi tiến triển và vĩnh viễn. Bệnh này gây ra bệnh phổi mạn tính và không thể phục hồi, tiên lượng xấu, với thời gian sống sót trung bình là 3-5 năm sau khi chẩn đoán nếu không được điều trị [1-3]. Mặc dù hai loại thuốc chống xơ hóa đã chứng minh được sự giảm đáng kể tỷ lệ tiến triển của bệnh, nhưng vẫn khó có thể dự đoán tiên lượng đối với từng bệnh nhân [1-3].
Thuật ngữ ILD cùng với các chữ viết tắt của nó thường gây nhầm lẫn cho các bác sĩ lâm sàng và có một số sự mơ hồ, thiếu chính xác có thể phản ánh sự hiểu biết không đầy đủ về nhiều quá trình trong nhóm bệnh lý này [4]. Bản thân thuật ngữ bệnh phổi kẽ cũng có phần không chính xác. Mô kẽ là thuật ngữ rộng để chỉ các cấu trúc nằm ngoài tế bào và mạch máu ở phổi, tuy nhiên nhiều bệnh được phân loại là ILD thường liên quan đến khoảng không khí phế nang cũng như mô kẽ gian phế nang [5,6], khiến cho sự phân biệt này trở nên khó khăn và có phần tùy tiện [4]. Các thuật ngữ thay thế cho ILD bao gồm bệnh nhu mô phổi lan tỏa (diffuse parenchymal lung disease) và bệnh phổi lan tỏa (diffuse lung disease), tuy nhiên, những thuật ngữ này có lẽ cũng không chính xác và chưa được áp dụng rộng rãi.
Mục đích của tổng quan này là đề cập khái quát tới khái niệm mô kẽ, nhất là mô kẽ vách gian phế nang và bệnh phổi kẽ (ILD), đặc biệt nhấn mạnh vào định nghĩa, phân loại, nguyên nhân.
3 GIẢI PHẪU VÀ CHỨC NĂNG MÔ KẼ PHỔI
3.1 Mô kẽ phổi (Pulmonary interstitium)
Như trên đã nói, khoảng kẽ phổi, nằm giữa các mạch máu và tế bào, cung cấp môi trường chất lỏng và cấu trúc xung quanh các tế bào đó. Với ý niệm như vậy có thể hình dung cấu trúc mô kẽ phổi là thành phần ở 3 khu vực: Mô quanh phế quản - mạch máu (còn gọi là mô kẽ trục, axial), mô vách gian phế nang (còn gọi là mô kẽ trong tiểu thùy - intralobular hay mô kẽ nhu mô - parenchimal) và mô dưới màng phổi (hay ngoại vi - periferal). Mô kẽ ở ba khu vực này có sự kết nối liên tục với nhau và hình thành một cấu trúc khung của phổi với trương lực ổn định (Hình 1).
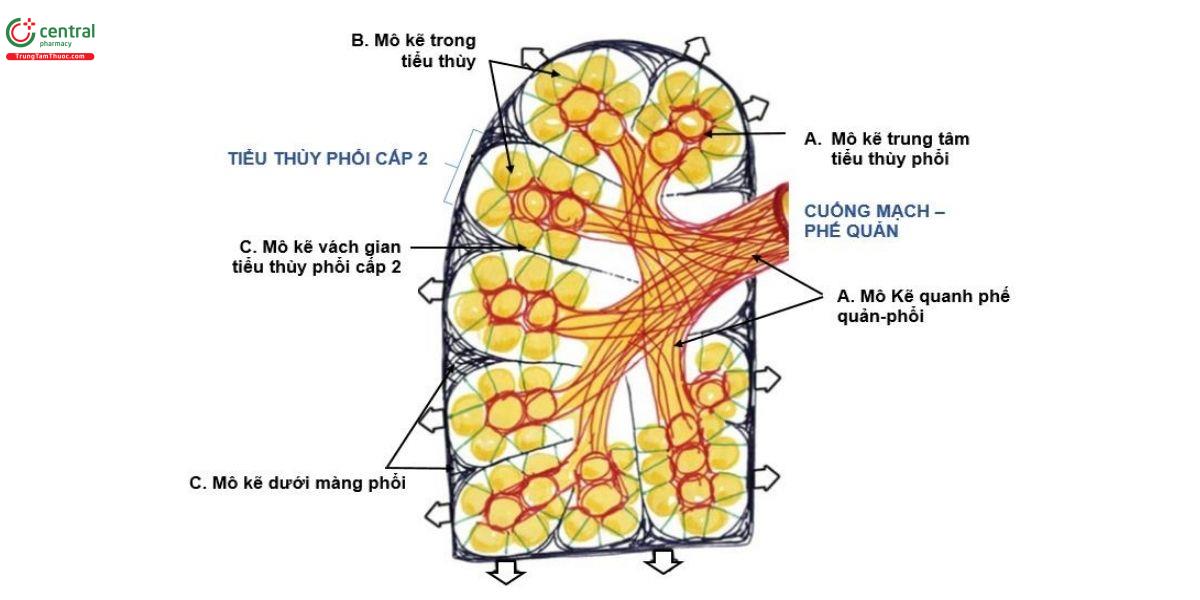
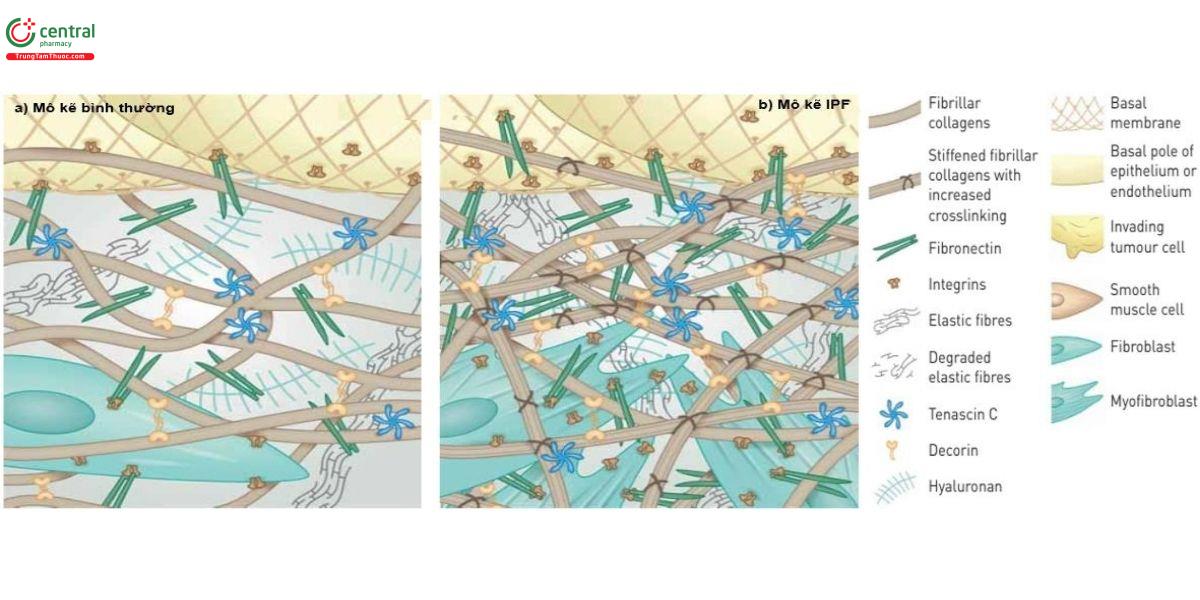
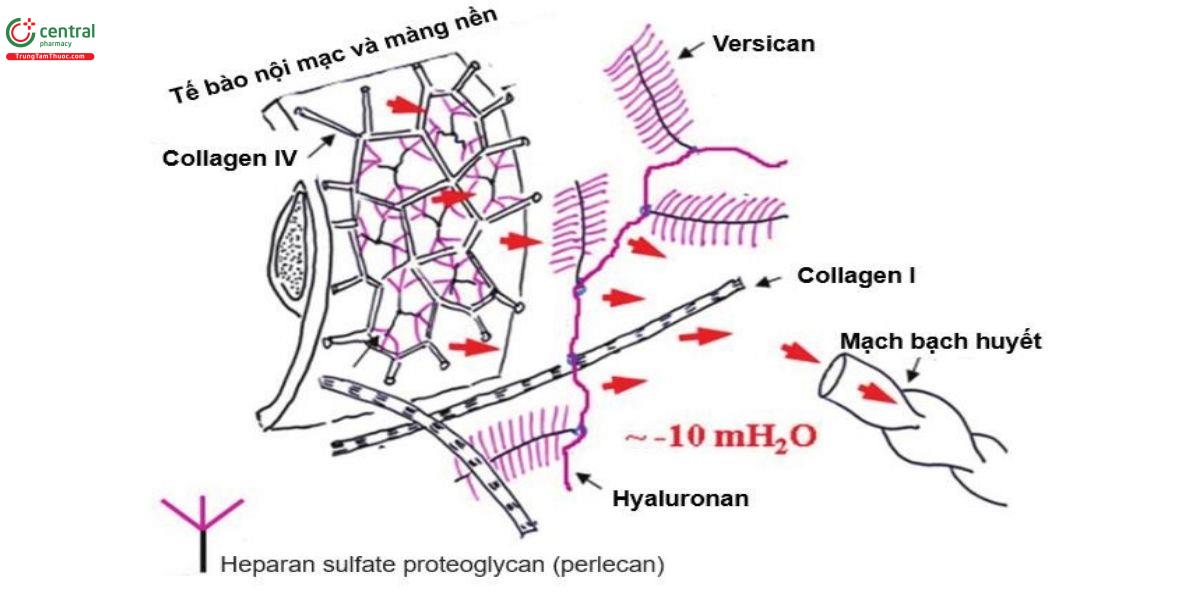
Thành phần cấu trúc của mô kẽ, được gọi chung là cấu trúc nền ngoại bào (hay ma trận ngoại bào, extracellular matrix, ECM), chủ yếu bao gồm các sợi Collagen (loại I, III), sợi đàn hồi (elastin), vi sợi (microfibrils) và glycosaminoglycan (GAG). Các GAG được sulfat hóa (heparin/heparan sulfat, chondroitin/dermatan sulfat và keratan sulfat) và không sulfat (hyaluronan). Các GAG sulfat liên kết cộng hóa trị với khung protein tạo ra một đại phân tử được gọi là proteoglycan. Các GAG sulfat này mang điện tích âm và do đó có khả năng thu hút và liên kết các cation, chẳng hạn như các ion natri [7,8]. Các thành phần cấu trúc kẽ này tạo ra những đóng góp cơ học riêng biệt cho mối quan hệ giữa thể tích kẽ và áp suất dịch kẽ. Khi nuôi cấy nguyên bào sợi in vitro trong gel collagen, các nguyên bào sợi bám vào các sợi collagen và bằng cách tạo ra lực căng lên các điểm bám đó, làm giảm thể tích gel [9]. Sự nén gel qua trung gian nguyên bào sợi này được tăng cường in vitro bởi yếu tố tăng trưởng có nguồn gốc từ tiểu cầu và bị ức chế bởi các chất trung gian gây viêm, IL-1a và PGE2 [10-12]. Một hiệu ứng tương tự trong cấu trúc ngoại bào của mô liên kết lỏng lẻo được tìm thấy trên khắp cơ thể, nơi các nguyên bào sợi bám vào nhiều sợi collagen thông qua các kết nối integrin và nén chặt ma trận cấu trúc này (Hình 2). Hiệu ứng của tác động như trên, phối hợp với mạng lưới vi sợi, có tác dụng làm giảm thể tích kẽ và tăng áp lực kẽ. Ngược lại, GAG, đặc biệt là hyaluronan, tạo ra áp suất thấm tương tự như một miếng bọt biển có tác dụng làm tăng thể tích kẽ và giảm áp lực dịch kẽ. Mối quan hệ áp suất - thể tích dịch kẽ phản ánh sự tương tác giữa hai lực cơ học cân bằng (Hình 3). Ba chức năng cơ bản của mô kẽ là tạo ra tác động lực lên phổi, thăng bằng dịch và tham gia vào cơ chế viêm, sửa chữa cấu trúc.
3.2 Mô kẽ gian phế nang
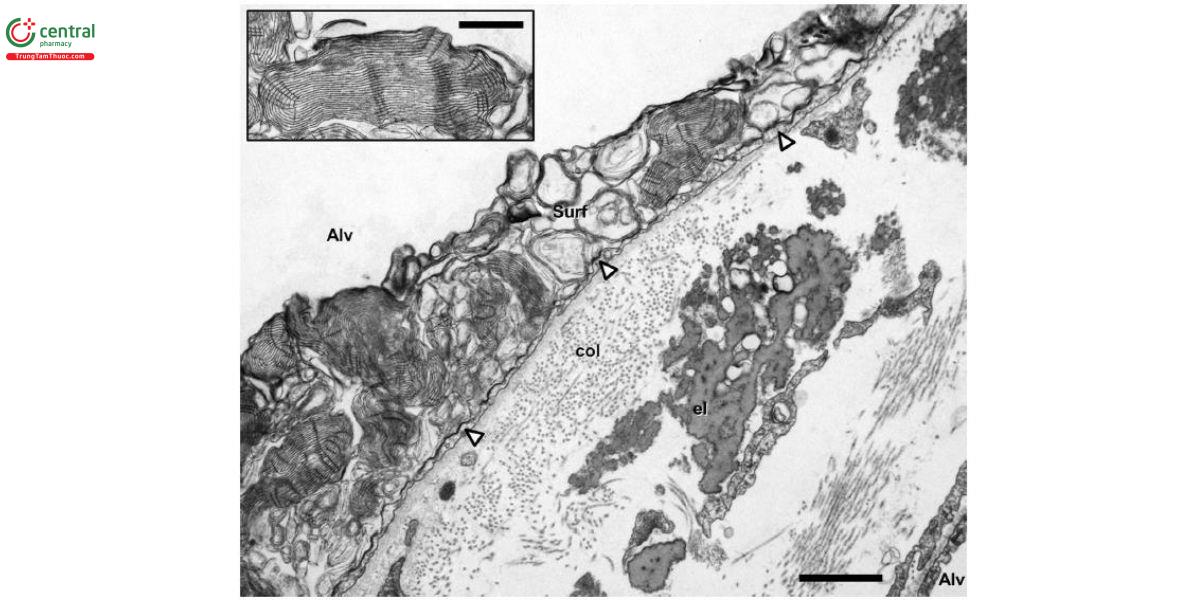
Mô kẽ gian phế nang, tức là khoảng giới hạn giữa biểu mô phế nang và màng đáy nội mạc mao mạch (nằm trong phân nhóm mô kẽ trong tiểu thùy phổi), chứa các tế bào và mạng lưới ngoại bào gồm các sợi đàn hồi (elastin) và các bó sợi tạo keo (collagen) dạng dải. Các tế bào có mặt phong phú nhất trong mô kẽ là nguyên bào sợi (fibroblast). Chúng là quần thể tế bào không đồng nhất. Trong khi các nguyên bào sợi "cổ điển" sản xuất và duy trì cấu trúc nền ngoại bào, thì nhiều nguyên bào sợi trong số chúng chủ yếu có đặc tính co rút. Các nguyên bào sợi cơ này chứa các sợi đi qua qua vách ngăn phế nang, do đó kết nối hai mặt biểu mô của vách ngăn và gia cố không gian kẽ. Thông qua các lỗ ở màng đáy, nguyên bào sợi cơ có thể liên kết trực tiếp biểu mô phế nang và nội mạc mao mạch. Do đó, hàng rào máu - khí có những phần dày nơi tập trung nhân tế bào và mạng lưới sợi (do đó cung cấp khả năng tái tạo và độ ổn định cơ học) và những phần mỏng nơi biểu mô phế nang và nội mạc mao mạch chia sẻ một màng đáy chung (do đó ngăn ngừa sự tích tụ chất lỏng và giảm thiểu độ dày của hàng rào khuếch tán xuống mức nhỏ hơn đáng kể, <1μm ở khu vực này) (Hình 4). Trong phổi người, khoảng một nửa tổng bề mặt hàng rào khuếch tán là cấu trúc mỏng.
3.3 Chức năng mô kẽ trong điều kiện bình thường
Trong hoạt động hô hấp, hiện tượng co dãn của phổi làm cho các khoảng khí xa của nhu mô phổi liên tục chịu những thay đổi về thể tích và áp lực mà trong đó có vai trò quan trọng của mô kẽ phổi tham gia chi phối và điều hòa.
Một mạng lưới sợi được thiết kế hiệu quả để phục vụ cho việc ổn định các khoảng không khí xa trong việc chống chịu và truyền các thay đổi liên quan đến lực co hồi của phổi (áp lực xuyên phế nang). Trong cơ thể sống, áp suất tại bề mặt màng phổi so với áp suất khí quyển thường là âm và chủ yếu dựa trên lực đàn hồi của phổi có nền tảng trong mạng lưới sợi đàn hồi và sức căng bề mặt. Các sợi trun (elastin) có mối quan hệ ứng suất - biến dạng (stress-strain relationship) tuyến tính trong một phạm vi biến dạng rộng, cho phép tăng gấp đôi chiều dài ban đầu của nó (khoảng 200%) để các sợi này góp phần vào sự co lại hay giãn ra tạo sự ổn định nhu mô phổi ở các thể tích phổi thấp hơn. Các sợi collagen (sợi tạo keo) có dạng cong xoắn nhiều hay ít ở các thể tích phổi thấp và thẳng ở các thể tích phổi lớn hơn và có mối quan hệ ứng suất - biến dạng không tuyến tính cao và có độ cứng cao.
Lớp tế bào biểu mô phế nang có khả năng co giãn thấp nhưng vẫn đảm bảo khả năng thu nhỏ và giãn ra trong hoạt động hô hấp là nhờ chúng tạo thành những nếp gấp ở vùng thành mỏng. Màng đáy của lớp biểu mô phế nang kết dính cục bộ với cấu trúc nền ngoại bào bên dưới và do vậy chịu tác động trực tiếp lực của mô kẽ mà trong đó vai trò quan trọng nhất là sợi đàn hồi (elastin) và sợi collagen. Mật độ và tính chất phân bố của các sợi này thay đổi trong quá trình lão hóa và một số tình huống bệnh lý (hình 2).
Như vậy, cùng với khả năng đàn hồi của lớp biểu mô phế nang và chất diện hoạt (surfactant), cấu trúc mô kẽ có vai trò quan trọng trong việc đảm bảo sự cân bằng thể tích và áp lực nhu mô phổi để duy trì hiệu quả của quá trình trao đổi khí và tuần hoàn. Trong hầu hết các tình huống, chất lỏng được lọc liên tục từ các mạch máu nhỏ vào khoảng kẽ và không được tái hấp thu [13]. Chất lỏng ở khoảng kẽ sẽ được loại bỏ thông qua dẫn lưu bạch huyết và trở lại tuần hoàn tĩnh mạch (Hình 3). Ở phổi, dịch kẽ còn được lọc qua bề mặt thanh mạc khoang màng phổi và sau đó cũng được đưa vào hệ thống bạch huyết. Nếu có một quá trình nào làm thay đổi sự thăng bằng này sẽ dẫn tới mất cân bằng của các ứng suất trong nhu mô phổi, làm rối loạn đặc tính cơ học phổi từ đó làm rối loạn thông khí, trao đổi khí và tuần hoàn phổi bình thường.
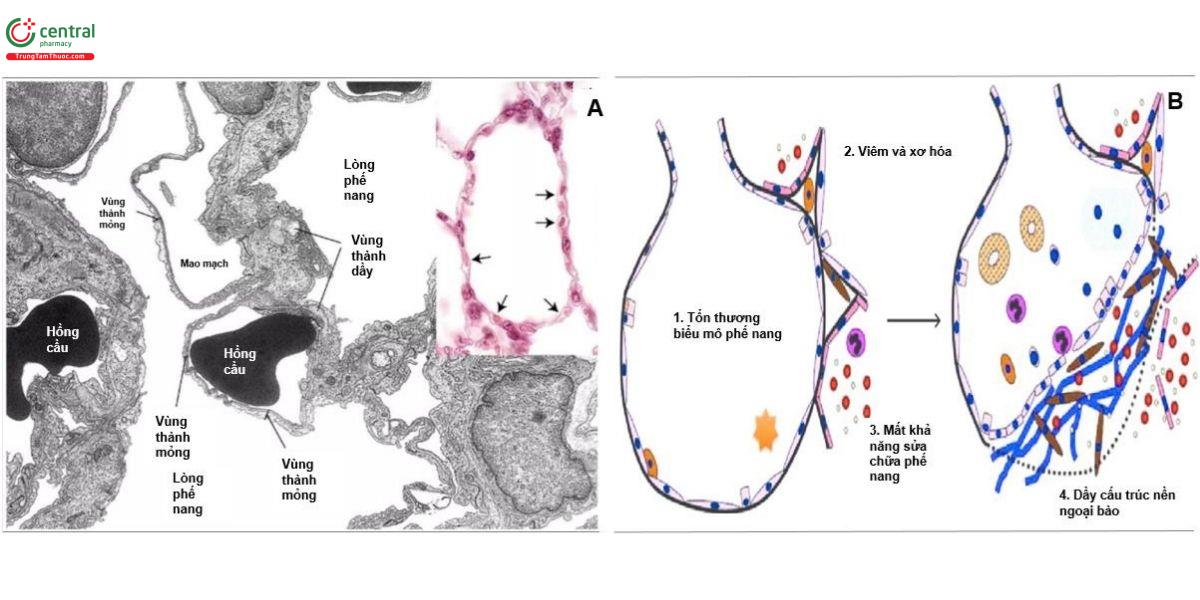
3.4 Rối loạn chức năng mô kẽ: tổn thương phổi và xơ hóa
Các bệnh lý phổi do tổn thương phổi cấp tính hay mạn tính có thể gây trở ngại nghiêm trọng cho thông khí đồng nhất. Thông khí không đồng nhất xảy ra trong bối cảnh rối loạn chức năng chất diện hoạt, xẹp phế nang, phù phế nang, viêm, tái tạo xơ hóa khu trú hay lan tỏa.
Viêm là yếu tố chính trong quá trình phát triển xơ phổi. Tổn thương phổi cấp tính (Acute lung injury, ALI) và biểu hiện nặng hơn của nó, hội chứng suy hô hấp cấp tính (acute respiratory distress syndrome, ARDS), là các dạng viêm phổi cụ thể, đặc trưng bởi sự thay đổi lan tỏa của phế nang, phù phổi không do tim, viêm tại chỗ và toàn thân, dẫn đến suy phổi tiến triển và giảm oxy máu. Hàng năm, hơn 3 triệu người trên thế giới bị ảnh hưởng bởi ARDS, trong khi tỷ lệ tử vong dao động từ 35% đến 46% [14,15]. Yếu tố góp phần đáng kể nhất vào tỷ lệ mắc bệnh và tử vong do ARDS trong những năm gần đây là đại dịch do vi-rút corona gây ra. Tuy nhiên, một số lượng lớn các kích thích và bệnh tật cũng có thể đóng vai trò là các yếu tố nguyên nhân gây raALI và ARDS, bao gồm viêm phổi do vi khuẩn hay do các loại vi-rút khác (Influenza A virus hoặc Rhinovirus), thở máy liên tục, hóa chất, thuốc lá điện tử, chấn thương não cấp tính, nhiễm trùng huyết, viêm tụy cấp tính và nhiều bệnh lý khác.
Cấu trúc nền ngoại bào (Extracellular matrix, ECM) là một cấu trúc hỗ trợ cơ học cho kiến trúc phổi ở trạng thái cân bằng động giữa quá trình phá hủy và tái tạo. Như đã trình bày ở trên, thành phần ECM gồm nhiều loại protein và glycoprotein, trong đó có protein cấu trúc (collagen và elastin), protein kết dính (fibronectin và tenascin) và glycosaminoglycan proteoglycan. Các sợi collagen, bao gồm các loại collagen I, II, III, V và IX, là các thành phần phổ biến nhất của ECM trong phổi, một mặt hỗ trợ tạo hình và kích thước phổi, mặt khác cung cấp độ đàn hồi và co giãn của phổi [16]. Các protein kết dính của ECM, chẳng hạn như fibronectin và tenascin, là các phối tử của thụ thể kết dính tế bào, trong khi glycosaminoglycan và proteoglycan là các thành phần cấu trúc chính của ECM, tạo thành chất nền của hầu hết các loại mô, có vai trò lắp ráp, tu sửa. Trong điều kiện sinh lý, protein ECM cung cấp hỗ trợ về mặt cấu trúc và cơ học cho mô phổi, tạo thành cơ sở cho hoạt động bình thường của tế bào, chẳng hạn như kết dính, di chuyển và tăng sinh. Tuy nhiên, trong điều kiện bệnh lý, ECM trở thành một trong những yếu tố dẫn đến sự khởi phát và tiến triển của xơ hóa. ECM, mô thu được từ những bệnh nhân bị xơ phổi, có hiện tượng biệt hóa nguyên bào sợi bình thường thành nguyên bào sợi cơ, ngay cả khi không có thành phần tế bào và cytokine. Bên cạnh đó, sự tăng tổng hợp các thành phần ECM, được kích hoạt bởi nguyên bào sợi cơ, có thể làm giảm độ đàn hồi của ECM, kích thích sinh tạo protein liên kết Hippo Yes nhạy cảm với cơ học (YAP-1), dẫn đến gia tăng sự lắng đọng thành phần ECM và làm giảm thêm độ đàn hồi của phổi, tạo thành một trong những vòng luẩn quẩn của xơ hóa [17]. Sự tăng hiện diện của các protein ECM là một trong những dấu hiệu rõ ràng về những thay đổi không thể đảo ngược trong mô phổi, dẫn đến sự phát triển của xơ phổi ở những bệnh nhân mắc các bệnh lý phổi có nền tản viêm mạn tính như hen, bệnh phổi tắc nghẽn mạn tính (COPD) và IPF. Trong IPF, COPD và ARDS, có sự tăng sinh các thành phần ECM khác nhau như collagen loại I, III và V, fibronectin, tenascin và proteoglycan (lumican và biglycan) và các tế bào chịu trách nhiệm về việc này (như nguyên bào sợi, tế bào cơ trơn đường thở) cũng tăng sinh. Đây là đặc điểm chính ở đường thở ở những bệnh nhân bị xơ phổi và COPD [18,19].
Sự phát triển và tồn tại dai dẳng của tình trạng viêm đường thở, do nhiều bệnh viêm khác nhau gây ra, dẫn đến những thay đổi biểu hiện của các matrix metalloproteinase enzyme, men chịu trách nhiệm cho quá trình phân hủy protein ECM, nhưng vai trò của chúng trong sự phát triển của xơ phổi vẫn chưa rõ ràng. Bên cạnh chức năng phân giải protein, matrix metalloproteinase tham gia vào quá trình xử lý và kích hoạt các protein không liên kết trực tiếp với ECM (nhiều yếu tố tăng trưởng, chemokine, thụ thể tế bào), điều chỉnh chức năng bạch cầu, phòng vệ kháng khuẩn, di chuyển tế bào và các quá trình khác, vừa kích thích vừa ức chế sự phát triển xơ hóa ở phổi [20,21]. Sự phong phú của các tế bào viêm và sự suy giảm chức năng của matrix metalloproteinase dẫn đến rối loạn điều hòa ECM, từ đó kích thích sự tăng sinh tế bào cơ trơn, hoạt hóa nguyên bào sợi và tích tụ collagen. Biểu hiện α-SMA (sợi actin của nguyên bào sợi cơ) là dấu hiệu biệt hóa nguyên bào sợi thành dạng hoạt động của chúng - nguyên bào sợi cơ. Nguyên bào sợi cơ biểu hiện α-SMA cũng tích cực tổng hợp các thành phần ECM, dẫn đến sự phá hủy dần dần và không thể đảo ngược của cấu trúc phổi bình thường để thay thế nó bằng mô liên kết và hậu quả cuối cùng là rối loạn trao đổi khí và suy phổi.
4 BỆNH MÔ KẼ PHỔI
4.1 Phân loại và đặc điểm bệnh học
Bệnh phổi kẽ (ILD) và xơ phổi (pulmonary fibrosis) bao gồm nhiều loại bệnh phổi thường gây nhầm lẫn cho cả bác sĩ lâm sàng, đa khoa và chuyên khoa. Một trong những lĩnh vực dễ gây nhầm lẫn trong ILD là vô số thuật ngữ, từ viết tắt và từ viết tắt áp dụng cho các dạng hình ảnh, xét nghiệm mô bệnh học và chẩn đoán lâm sàng.
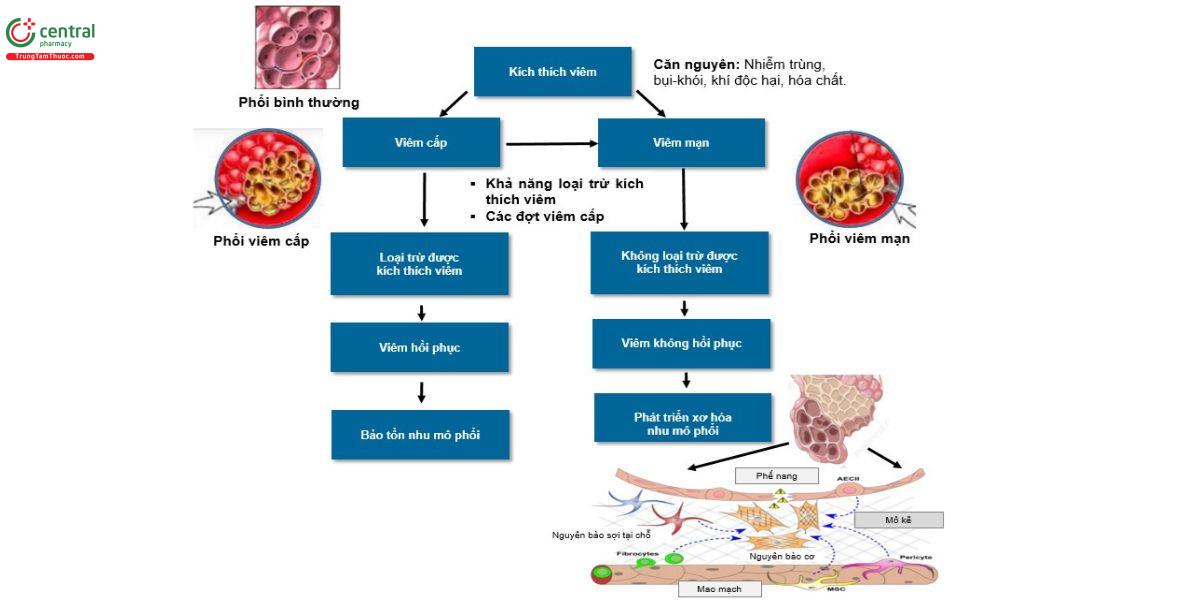
ILD và xơ phổi là một nhóm bệnh phổi bao gồm sự kết hợp của viêm và xơ hóa nhu mô phổi (Hình 7). Có nhiều nguyên nhân khác nhau gây ra ILD, thường là do yếu tố phơi nhiễm với môi trường, nghề nghiệp hoặc sử dụng thuốc hoặc có thể là do một trong nhiều bệnh tự miễn hệ thống hoặc bệnh mô liên kết (connective tissue diseases, CTD) [22,23]. Một dạng ILD đặc biệt được gọi là xơ hóa phổi tự phát (Idiopathic Pulmonary Fibrosis IPF) và IPF thường được coi là một trong những ILD phổ biến và quan trọng nhất do nguyên nhân chưa rõ, tiên lượng chung xấu và đáp ứng khiêm tốn với các biện pháp can thiệp điều trị (24-26]. Liệu pháp điều trị ILD và xơ phổi đôi khi có thể phức tạp, nhưng về nguyên tắc hầu như luôn dựa trên nguyên lý tác động vào nguyên nhân có khả năng xảy ra nhất của ILD. Với vai trò quan trọng trong sinh bệnh học trong ILD, xác định yếu tố phơi nhiễm là quan trọng nhất trong chẩn đoán ILD (5,27).
Sáu phân nhóm cơ bản bệnh ILD được phân biệt bởi lâm sàng, X-quang, xét nghiệm và mô bệnh học, bao gồm: Bệnh phổi kẽ liên quan tới thuốc lá (Smoking Related-ILD), Viêm phổi quá mẫn cảm (Hypersensitivity Pneumonitis), Bệnh có liên quan tới mô liên kết (Connective Tissue Disease-Associated ILD), Bệnh có liên quan tới nghề nghiệp (Occupation-Related ILD), Bệnh có liên quan tới sử dụng thuốc (Medication-Induced ILD), bệnh xơ hóa phổi tự phát. Tóm tắt phân biệt sáu phân nhóm bệnh này trong bảng 1.
.jpg)
Bảng 1. Đặc điểm phân biệt 6 phân nhóm ILD (Nguồn trích dẫn: Or Kalchiem-Dekel et al. Interstitial Lung Disease and Pulmonary Fibrosis: A Practical Approach for General Medicine Physicians with Focus on the Medical History. J. Clin. Med. 2018, 7, 476).
| Phân nhóm ILD | Gợi ý từ tiền sử | X - quang | Mô học | Lượng giá huyết thanh tự miễn | Xem xét điều trị |
| ILD liên quan tới thuốc lá | Hút thuốc hay phơi nhiễm khói sinh khối | GGO, khí phế thũng với xơ hóa, mờ dạng khảm | RB, DIP, PLCH, khí phế thũng, xơ hóa | Bình thường hoặc không phản ứng | Bỏ thuốc lá, loại bỏ phơi nhiễm, liệu pháp chống viêm ở giai đoạn nặng |
| Viêm phổi quá mẫn cảm | Tiếp xúc với các kháng nguyên hữu cơ trong môi trường (protein chim, nấm mốc, liên quan đến nông nghiệp) | GGO, mờ dạng khảm, xơ hóa thùy trên, nốt trung tâm tiểu thùy | U hạt không điển hình với các tế bào khổng lồ đa nhân | Bình thường hoặc không phản ứng; Xem xét kháng thể kết tủa huyết thanh | Loại bỏ phơi nhiễm, chống viêm và/hoặc liệu pháp ức chế miễn dịch ở giai đoạn nặng |
| ILD liên quan tới mô liên kết | Có các triệu chứng thể chất như đau khớp / viêm khớp, phát ban, hiện tượng Raynaud | GGO, mờ dạng lưới, đông đặc, xơ hóa tôn trọng nhu mô vùng ngoại vi | Viêm mạn tính, UIP, NSIP hoặc OP | Khuyến cáo đánh giá tự miễn dịch | Liệu pháp chống viêm và/hoặc ức chế miễn dịch |
| ILD liên quan tới nghề nghiệp | Phơi nhiễm bụi-khói nghề nghiệp | GGO, mờ dạng lưới, xơ hóa, nốt, mảng (plaques) màng phổi (amiăng) | Viêm mạn tính, UIP, NSIP, OP hoặc viêm u hạt | Bình thường hoặc không phản ứng; Xét nghiệm tăng sinh tế bào lympho nếu nghi ngờ phơi nhiễm beryllium | Loại bỏ phơi nhiễm |
| ILD liên quan tới sử dụng thuốc | Sử dụng thuốc có thể gây hại | GGO, mờ dạng lưới, đông đặc, các nốt, xơ hóa | Viêm mạn tính, UIP, NSIP, OP hoặc viêm u hạt | Bình thường hoặc không phản ứng | Ngừng sử dụng thuốc nếu có thể, liệu pháp chống viêm và/hoặc ức chế miễn dịch ở giai đoạn nặng |
| Xơ hóa phổi tự phát | Ưu thế nam, lớn tuổi (60-80), tiền sử phơi nhiễm thuốc lá, bụi-khói, có yếu tố gia đình | Xơ hóa ngoại biên và đáy phối với hình tổ ong | UIP | Bình thường hoặc không phản ứng | Xem xét các liệu pháp chống xơ hóa, đánh giá ghép phổi ở một số bệnh nhân chọn lọc |
Viết tắt: GGO, ground-glass opacities; RB, respiratory bronchiolitis; DIP, desquamative interstitial pneumonia; PLCH, pulmonary Langerhans cell histiocytosis; UIP, usual interstitial pneumonia; NSIP, nonspecific interstitial pneumonia; OP, organizing pneumonia
4.2 Sinh bệnh học
ILD được công nhận là một nhóm bệnh đặc trưng bởi sự kết hợp của (a) tình trạng viêm mạn tính trong phổi, bao gồm sự tích tụ của các tế bào viêm mạn tính (chủ yếu là tế bào lympho và đại thực bào) và mức độ tăng của nhiều cytokine, chemokine và các phân tử bề mặt tế bào tiền viêm; và (b) các mức độ xơ hóa phổi khác nhau [28,29]. Do đó, như thể hiện trong hình 7, bất kỳ dạng ILD cụ thể nào cũng. Có thể biểu hiện chủ yếu là bệnh phổi viêm, với ít hoặc không có các đặc điểm của xơ hóa và phản ứng chung có lợi với các phương pháp điều trị chống viêm hoặc ức chế miễn dịch; Có thể biểu hiện chủ yếu là bệnh phổi xơ hóa, với tiên lượng chung kém và các liệu pháp hiệu quả hạn chế; Hoặc có thể biểu hiện với các mức độ viêm và xơ hóa khác nhau. Ngoại lệ duy nhất là IPF, vì IPF được coi là hình mẫu bệnh phổi xơ hóa, với các phương pháp điều trị chống viêm hoặc ức chế miễn dịch không hiệu quả và đôi khi có hại. Thuật ngữ xơ hóa thường ám chỉ về mặt mô học là sự lắng đọng quá mức của collagen [28,30], nhưng đã có nhiều báo cáo trái ngược nhau trong nhiều năm về các thành phần mô bệnh học chính xác của xơ hóa phổi được công nhận trên lâm sàng (31-33]. Mặc dù có sự không chắc chắn này, xơ phổi có thể được nhận biết một cách đáng tin cậy trên hình ảnh chụp CT ngực bằng các phát hiện đặc trưng của nó (xem phần X-quang bên dưới).
4.3 Lâm sàng
Bệnh phổi kẽ là một nhóm bệnh lý phổi không đồng nhất với các biểu hiện lâm sàng có thể giống nhau, không đặc hiệu.
Phân tích một cách toàn diện tiền sử sức khỏe của người bệnh, như đã đề cập ở trên, có tầm tầm quan trọng đặc biệt trong chẩn đoán ILD. Trong đó cần đầy đủ và toàn diện tiền sử phơi nhiễm môi trường sống, nghề nghiệp và sử dụng thuốc. Cần phải hỏi chi tiết những điều sau: Sử dụng chất gây nghiện dạng hít (bao gồm thuốc lá, xi-gà, cần sa, cocaine hoặc các loại ma túy hít khác). Môi trường gia đình, đặc biệt chú ý đến sự thẩm ẩm của nước, sự hiện diện của nấm mốc có thể nhìn thấy. Thường xuyên tiếp xúc với chim hoặc protein chim. Các sở thích khác, bao gồm những sở thích liên quan đến nhạc cụ hơi, đồ gốm, môi trường bụi khác hoặc động vật. Tiền sử nghề nghiệp toàn diện, bao gồm việc tiếp xúc với bất kỳ chất độc phổi, bụi, khí hoặc khói. Tiền sử sử dụng thuốc trị liệu toàn diện, bao gồm cả thuốc thảo dược và bất kỳ liệu pháp nào được sử dụng để điều trị bệnh ác tính (5,27). Ngoài ra, tiền sử gia đình chi tiết rất hữu ích đối với những bệnh nhân mắc ILD. Hai nhóm gen rộng được xác định trong các gia đình mắc bệnh di truyền là những gen liên quan đến sinh học telomere [34] và quá trình xử lý protein chất diện hoạt [35,36]. Công việc tìm hiểu này là khá công phu.
4.4 Mô tế bào học
Không thể không nói rằng đối với nhiều thầy thuốc thực hành, các thuật ngữ và viết tắt liên quan đến mô bệnh học trong ILD rất phức tạp và dễ lẫn lộn.
.jpg)
Các hình (A, B) biểu thị tình trạng viêm phổi kẽ thông thường (UIP). Độ phóng đại thấp biểu thị sự thay đổi xơ hóa dày đặc và phá hủy cấu trúc phổi bình thường ở phía bên phải của hình (A) và phổi tương đối bình thường ở phía
bên trái của hình (A). Có những vùng rộng lớn thay đổi dạng nang tổ ong được quan sát thấy ở các khu vực xơ hóa,
như được thấy ở cả độ phóng đại thấp và cao.
Các hình (C. D) biểu thị tình trạng viêm phổi kẽ không đặc hiệu (NSIP). Độ phóng đại thấp cho thấy sự dày lên đồng đều của các thành phố nang (tức là mô kẽ phổi) lan tỏa khắp phổi, và độ phóng đại cao cho thấy sự kết hợp của tỉnh trạng viêm tế bào (tế bào lympho và đại thực bào) cũng như sự lắng đọng collagen trong các thành bị dày lên này.
Các hình (E, F) cho thấy tinh trạng viêm phổi tổ chức hóa (OP). Độ phóng đại thấp cho thấy sự bảo tồn cấu trúc phổi tổng thể nhưng có các ổ lớn bất thường phổi (dấu hoa thị trong hình E); Ở độ phóng đại cao cho thấy những ở bất thường này là các vùng mô bị tổ chức hóa (mũi tên trong hình F). Các hình (G, H) cho thấy viêm tạo u hạt (granulomatous inflammation). Độ phóng đại thấp cho thấy các vùng nhỏ viêm tập trung xung quanh các đường thở nhỏ, và độ phóng đại cao cho thấy nhiều vùng của tỉnh trạng viêm này chứa mô hạt kém định dạng và các tế bảo khổng lồ đa nhân (mũi tên trong hình H). (Nguồn trích dẫn: Or Kalchiem-Dekel et al. Interstitial Lung Disease and Pulmonary Fibrosis: A Practical Approach for General Medicine Physicians with Focus on the Medical History. J. Clin. Med. 2018, 7, 476).
Ba mô hình mô bệnh học chính trong tổn thương phổi ở ILD là viêm phổi kẽ thông thường (Usual
Interstitial Pneumonia, UIP), viêm phổi kẽ không đặc hiệu (Non-specific Interstitial Pneumonia NSIP) và viêm phổi tổ chức hóa (organizing pneumonia OP), những mô hình này được minh họa trong Hình 8.
UIP được nhận biết qua kính hiển vi bằng các vùng không đồng nhất xơ hóa dày xen kẽ với các vùng có cấu trúc phổi tương đối bình thường [24,26], trong đó có sự hiện diện của các thay đổi dạng nang tổ ong (đó là các nang vi thể ở trong nhu mô phổi được lót bằng biểu mô hô hấp trưởng thành, chứa đầy chất nhầy) và sự hiện diện của các ỗ nguyên bào sợi, là các vùng hình bầu dục hoặc tròn vi thể của cấu trúc nền (hay ma trận) ngoại bào và nguyên bào sợi, thường nằm cạnh các nang tổ ong.
NSIP được nhận biết qua kính hiển vi bằng tình trạng viêm tế bào lan tỏa và/hoặc xơ hóa trong mô kẽ phổi xảy ra theo mô hình đồng nhất về mặt không gian trên khắp phổi, và trong đó cấu trúc phổi tổng thể được bảo tồn [27,28].
OP, hoặc khu vực mô phổi bị tổ chức hóa, được nhận biết qua kính hiển vi bằng nhiều lớp lắng đọng nhuộm màu nhạt, hình tròn hoặc hình bầu dục bao gồm các protein cấu trúc nền ngoại bào và nguyên bào sợi hình thoi hoặc nguyên bào sợi cơ [6,38,39].
Lưu ý các đặc điểm phân biệt của UIP và NSIP, trong đó UIP cho thấy các vùng không đồng nhất của xơ hóa dày xen kẽ với phổi bình thường, trong khi NSIP cho thấy tổn thương đồng nhất về mặt không gian trên khắp phổi [25,40]. Mặc dù có thể có sự chồng chéo, nhưng nhìn chung ba kiểu này có thể được phân biệt được nếu có kinh nghiệm chẩn đoán về mô bệnh học của ILD. Viêm tạo u hạt là một kiểu tổn thương phổi bổ sung, bao gồm các tập hợp đặc trưng của tế bào lympho và mô bảo (histiocyte), và thường đi kèm với sự hiện diện của các tế bào khổng lồ đa nhân. Viêm u hạt hạt là đặc trưng của viêm phổi quá mẫn (hypersensitivity pneumonitis, HP), ngoài ra còn được thấy trong bệnh sarcoidosis. U hạt trong bệnh sarcoidosis thường có xu hướng định dạng rõ, thường được phân định bằng các vành xơ hóa đồng tâm xung quanh, trong khi u hạt ở HP thường có định dạng kém. Một số phát hiện bệnh lý mô học cụ thể hơn được tìm thấy trong ILD liên quan đến hút thuốc sẽ được thảo luận trong phần cụ thể bên dưới.
Mặc dù việc xác định mô hình bệnh lý học trong ILD có thể hữu ích, những chiến lược điều trị và tiên lượng của từng bệnh nhân có thể phụ thuộc nhiều hơn vào nguyên nhân cụ thể của ILD. Mỗi mô hình bệnh lý học UIP, NSIP và OP có thể được nhìn thấy trong nhiều dạng ILD khác nhau, nhiều trong số đó có tiên lượng khác nhau rõ rệt và phản ứng khác nhau rõ rệt với trị liệu [22,23]. Ví dụ, UIP là mô hình bệnh lý học đặc trưng được quan sát thấy trong IPF (bệnh xơ hóa phổi tự phát), một căn bệnh có tiên lượng nói chung kém và phản ứng kém với liệu pháp chống viêm [24]. Tuy nhiên, mô hình bệnh lý học UIP cũng có thể được thấy ở những bệnh nhân mắc ILD liên quan đến bệnh mô liên kết và những bệnh nhân này thường có tiên lượng tốt hơn và phản ứng tốt hơn với liệu pháp chống viêm so với bệnh nhân IPF mặc dù có dạng tổn thương mô bệnh học giống hệt nhau [41]. Những quan sát này cho thấy rằng các kiểu tổn thương phổi không đặc hiệu và củng cố khái niệm rằng phản ứng điều trị và tiên lượng lâm sàng có thể phụ thuộc nhiều hơn vào nguyên nhân và thời gian của tổn thương phổi (đã ngừng hay còn tiếp tục) hơn là một kiểu mô bệnh học cụ thể.
Mặc dù sinh thiết phổi qua nội soi phế quản rất hữu ích trong các bệnh phổi ác tính và truyền nhiễm, nhưng nhìn chung, nó không hữu ích trong hầu hết các dạng ILD do mô sinh thiết có kích thước nhỏ [26], ngoại trừ một số bệnh như bệnh sarcoidosis [42]. Do đó, liệu bệnh nhân mắc ILD có nên sinh thiết phổi bằng phẫu thuật (surgical lung biopsy, SLB) hay không thường là một trong những chủ đề gây tranh cãi. Ưu điểm của SLB là xác định chính xác kiểu mô bệnh học, nhưng như đã đề cập ở trên, điều trị và tiên lượng trong ILD có nhiều khả năng được xác định bởi nguyên nhân của ILD hơn là một kiểu mô học cụ thể. Nhược điểm của SLB liên quan đến rủi ro của quy trình can thiệp, và ngoài những rủi ro thông thường của quy trình phẫu thuật xâm lấn, có thể xảy ra tình trạng suy giảm đáng kể về tình trạng phổi hoặc thậm chí tử vong sau SLB ở nhiều dạng ILD khác nhau thứ phát sau cái được gọi là "đợt cấp của ILD" [43,44]. Do đó, quyết định tiến hành SLB luôn cần được cân nhắc tính đến rủi ro so với lợi ích, bệnh đi kèm và mong muốn của người bệnh [4].
4.5 X-quang
Các bác sĩ X-quang và bệnh học cần cố gắng xác định các tiêu chuẩn chẩn đoán chính xác. Thông thường, hình ảnh và sự phân bố tổn thương của bệnh cho phép thu hẹp các chẩn đoán có thể, những mối tương quan với biểu hiện lâm sàng là điều cần thiết. Các bác sĩ X-quang và bệnh học đã cố gắng xác định các tiêu chuẩn chẩn đoán chính xác. Thông thường, dạng tổn thương và sự phân bố của bệnh cho phép thu hẹp các chẩn đoán có thể, nhưng xác định mối tương quan với biểu hiện lâm sàng luôn là điều cần thiết. Các dạng tổn thương cơ bản trên X-quang là Nốt (nodular), Vách ngăn (Septal), Nang (Cystic), Phế nang (kính mờ - ground-glass), Lưới (Reticular), Tổ ong (Honeycombing).
Các dạng tổn thương X-quang trên hình ảnh chụp CT ngực là phần bổ sung thiết yếu cho thông tin về tiền sử sức khỏe để đưa ra chẩn đoán ILD chính xác. Cũng giống như mô tả mô học của ILD, các phát hiện bằng chụp CT ngực cũng có những thuật ngữ mô tả riêng và có thể làm tăng thêm tính phức tạp của ILD, vốn là thuật ngữ mô bệnh học. Ví dụ, các dạng tổn thương thấy được trên chụp CT ngực có thể được mô tả là đại diện cho mẫu UIP, NSIP hoặc OP dựa trên hình ảnh bệnh lý mô học có thể có của phổi (45).
.jpg)
and Pulmonary Fibrosis: A Practical Approach for General Medicine Physicians with Focus on the Medical History. J. Clin. Med. 2018, 7, 476).
.jpg)
and Pulmonary Fibrosis: A Practical Approach for General Medicine Physicians with Focus on the Medical History. J. Clin. Med. 2018, 7, 476).
Ba dạng hình ảnh của chụp CT ngực được thể hiện trong Hình 9.
Đầu tiên, cần xác định vị trí, tính chất phân bố các vùng mờ trong nhu mô phổi: (a) chiếm ưu thế ở thùy trên hay thủy dưới; (b) ở ngoại vi hay trung tâm (trung tâm cũng được gọi là quanh tiểu phế quản); và (c) có xâm lấn vùng ngoại vi phổi hay không. Không có sự giải thích chính xác cho những phân bố khác nhau này nhưng các dạng ILD cụ thể có phân bố đặc trưng của vùng mờ trên hình ảnh CT. Ví dụ, viêm phổi quá mẫn thường là bệnh chiếm ưu thế ở thủy trên [46], trong khi IPF thường là bệnh chiếm ưu thế ở thùy dưới [26,26]. Các hình ảnh dựng lại theo trục đứng hoặc ngang hỗ trợ nhiều cho việc xác định phân bố ưu thế của tổn thương.
Tiếp theo, cần xác định tổn thương dạng xơ, gồm: (a) mờ dạng lưới là các vệt mờ dạng đường cong nhỏ, thường nằm ở ngoại vi của phổi; (b) giãn phế quản do kéo, biểu hiện bằng hình ảnh các phế quản và tiểu phế quản bị giãn, biến dạng, và có hình dạng không đều phát triển do các cấu trúc phế nang xung quanh bị xơ hóa co lại; (c) thay đổi dạng tổ ong, tương tự như mô tả mô bệnh học, trên X- quang thấy được các cụm nang (cysts) nhỏ nằm ở ngoại vi phổi, có khả năng là biểu hiện của các đầu tận cùng tiểu phế quản nhỏ bị giãn (45,47] và gọi như vậy là do giống với tổ ong; và (d) mắt thể tích, xảy ra khi xơ hóa dẫn đến mắt khi mô và thể tích. Hình ảnh này có thể dễ dàng nhận biết nhất bằng sự dịch chuyển bất thường của các rãnh liên thùy lớn và nhỏ trong phổi. Cần lưu ý rằng giãn phế quản do kéo [48,49] và dạng tổ ong [50] có khả năng biểu thị các giai đoạn tiến triển xơ hóa và báo hiệu tiên lượng xấu bất kể nguyên nhân cơ bản là gì.
Thứ ba, cần nhận biết sự hiện diện của các tổn thương dạng kính mờ (ground glass opacities, GGO) và/hoặc đông đặc. GGO là một vùng phổi mờ nhạt mà mạch máu bên dưới vẫn có thể nhìn thấy, trong khi sự đông đặc là một vùng phổi mở đậm hơn không còn hình mạch máu nhưng có thể thấy hình phế quản hơi hay còn gọi là phế quản đồ. GGO và đông đặc được xem là có bản chất viêm và có khả năng hồi phục nhiều hơn so với các phát hiện xơ hóa [45].
4.6 CHẨN ĐOÁN
Chẩn đoán chính xác là điều cần thiết để đảm bảo tiên lượng bệnh thuận lợi nhất cho bệnh nhân. Do đó, việc tuân theo các hướng dẫn quốc tế và các con đường chẩn đoán dựa trên bằng chứng có thể cứu sống bệnh nhân. Các hướng dẫn cập nhật đã thay đổi cách chẩn đoán ILD, từ việc chủ yếu dựa vào điều tra mô bệnh học sang phương pháp tiếp cận bằng làm việc nhóm đa chuyên ngành (multidisciplinary team, MDT). Các nghiên cứu đã chứng minh rằng phương pháp tiếp cận MDT giúp tăng cường độ chính xác trong quyết định cuối cùng giữa các chuyên gia về ILD (Hình 11).
Như mô tả ở Hình 11, thảo luận MDT cần có đủ dữ liệu, thông tin của người bệnh như đã trình bày ở trên về lâm sàng, tiền sử và các kết quả xét nghiệm (máu, X-quang, chức năng phổi) đã có. Chụp cắt lớp vi tính ngực độ phân giải cao (HRCT) có thể giúp xác định bất kỳ bất thường về cấu trúc hoặc bệnh phổi kẽ nào có thể góp phần gây ra các triệu chứng của bệnh nhân [1]. Nếu vẫn chưa thể xác định được chẩn đoán, các kỹ thuật chẩn đoán xâm lấn hơn sẽ được xem xét.
.jpg)
Wijsenbeek M, Suzuki A, Maher TM. Interstitial lung diseases. Lancet. (2022) 400:769–86).
Sau khi chẩn đoán, bước tiếp theo cần làm bao gồm đánh giá mức độ nặng của bệnh, thường là bằng các xét nghiệm đặc hiệu bệnh. Các xét nghiệm này giúp xác định phân nhóm ILD và mức độ nặng liên quan. Thông tin do bệnh nhân cung cấp cũng được thu thập để hiểu tác động của bệnh theo quan điểm của bệnh nhân và giúp ích cho việc hướng dẫn các bước chiến lược quản lý tiếp theo. Ngoài các biện pháp đã đề cập, việc xác định và quản lý các biến chứng và bệnh đi kèm là rất quan trọng. Phương pháp tiếp cận MDT này đảm bảo rằng không chỉ điều trị ILD chính mà còn giải quyết các tình trạng hoặc biến chứng hiện có khác
4.7 ĐIỀU TRỊ VÀ TIÊN LƯỢNG
Xử tri ILD thường theo các bước đánh giá và lộ trình điều trị. Bước đầu tiên là cần loại trừ các yếu tố nguy cơ có thể là căn nguyên gây bệnh. Tiếp theo, cần nỗ lực để giảm nhẹ triệu chứng, có thể bao gồm nhiều chiến lược khác nhau, chẳng hạn như phục hồi chức năng phổi và hỗ trợ tâm lý. Sau khi giảm nhẹ triệu chứng, bước tiếp theo là đánh giá khả năng dung nạp của bệnh nhân và hiệu quả của bất kỳ loại thuốc nào đang sử dụng. Những trường hợp nặng mà điều trị thuốc không hiệu quả, có thể cân nhắc chuyển ghép phổi.
Xử trí ILD bao gồm các trị liệu thuốc đã được FDA (Hoa kỳ) chấp thuận, chẳng hạn như nintedanib và pirfenidone và các loại thuốc kháng viêm duy trì như corticosteroid đường uống (bao gồm Prednisone), Mycophenolate mofetil (CellCeptR), Azathioprine (ImuranR) và Cyclophosphamide (CytoxanR) [51,52]. Quản lý bệnh không dùng thuốc bao gồm tiêm vắc-xin (bao gồm cả vắc-xin cúm hàng năm), phục hồi chức năng, oxy trị liệu và ghép phổi.
Tiên lượng và mức độ nặng của ILD phụ thuộc vào loại ILD và các yếu tố như bệnh đi kèm, tốc độ suy giảm chức năng phổi, tình trạng hút thuốc, tuổi tác và sức khỏe tổng thể của từng cá nhân. Hiệu quả điều trị và diễn biến của bệnh phổi kẽ, bao gồm khả năng phục hồi, các biến chứng tiềm ẩn và thời gian kéo dài, rất khác nhau giữa các bệnh nhân. Phân loại bệnh, mức độ nặng và đặc điểm nhân khẩu học đóng vai trò quan trọng trong việc dự đoán tiên lượng bệnh.
Cũng cần phải quản lý các bệnh đi kèm, điều này có thể ảnh hưởng đáng kể đến tỷ lệ sống còn bệnh nhân mắc ILD [53]. Ví dụ, ở những bệnh nhân mắc IPF, tử vong thường do các nguyên nhân không liên quan đến hô hấp, như ung thư, suy tim, đột quỵ và bệnh động mạch vành. Gần đây, một tổng quan hệ thống kết hợp phân tích gộp xem xét tiền lương của đã báo cáo tỷ lệ sống sót là 88% sau 1–2 năm và 31% sau >5 năm ở những bệnh nhân được chẩn đoán mắc IPF [54].
Để hiểu rõ hơn về diễn biến và tiên lượng của ILD, cần thiết phải đánh giá các thông số sinh lý chính và các chỉ số chức năng. Đối với bệnh nhân mắc bệnh phổi IPF, nhiều yếu tố đã được chứng minh là chỉ bảo tiên lượng xấu và ảnh hưởng tiêu cực đến chất lượng cuộc sống. Bao gồm:
- Giảm quãng đường đi bộ 6 phút (6 MW) hơn 150m trong vòng 4 năm.
- Giảm dung tích sống gắng sức (FVC) hơn 10% trong vòng 6 tháng.
- Giảm khả năng khuếch tán carbon monoxide (DLCO) hơn 15% trong vòng 6 tháng.
Nghiên cứu về tiên lượng đã đã thiết lập mối liên hệ đáng kể giữa sự suy giảm FVC ở bệnh nhân IPF và tỷ lệ tử vong tăng, đặc biệt là trong những trường hợp có mức suy giảm FVC tuyệt đối là 10%-15% [55]. Tuy nhiên, vẫn còn thiếu các dấu ấn sinh học xác nhận cho sự tiến triển của bệnh [56] và việc đo không thường xuyên dung tích sống gắng sức (FVC) để theo dõi vẫn là một thực tế phổ biến [57]
Tác giả không có mâu thuẫn lợi ích cần khai báo.
5 Tài liệu tham khảo
5.1 Tài liệu tham khảo 1
1. Raghu G, Remy-Jardin M, Richeldi L, Thomson CC, Inoue Y, Johkoh T, et al. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: an official ATS/ERS/JRS/ALAT clinical practice guideline. Am J Respir Crit Care Med. (2022) 205:e18-47
2. Richeldi L, Du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl JMed. (2014) 370:2071-82.
3. Richeldi L, Kolb M, Jouneau S,WuytsWA, Schinzel B, Stowasser S, et al. Efficacy and safety of nintedanib in patients with advanced idiopathic pulmonary fibrosis. BMC Pulm Medicine. (2020) 20:3
4. Or Kalchiem-Dekel et al. Interstitial Lung Disease and Pulmonary Fibrosis: A Practical Approach for General Medicine Physicians with Focus on the Medical History. J. Clin. Med. 2018, 7, 476
5. Leslie, K.O. My approach to interstitial lung disease using clinical, radiological and histopathological patterns. J. Clin. Pathol. 2009, 62, 387-401
6. Visscher, D.W.; Myers, J.L. Histologic spectrum of idiopathic interstitial pneumonias. Proc. Am. Thorac. Soc. 2006, 3, 322-329
7. Schaefer L, Schaefer RM. Proteoglycans: from structural compounds to signaling molecules. Cell Tissue Res. (2010) 339:237-46.
8. Titze J, Shakibaei M, Schafflhuber M, Schulze-Tanzil G, Porst M, Schwind KH, et al. Glycosaminoglycan polymerization may enable osmotically inactive Na+ storage in the skin. Am J Physiol Heart Circul Physiol. (2004) 287:H203-8.
9. Grinnell F, Lamke CR. Reorganization of hydrated collagen lattices by human skin fibroblasts. J Cell Sci. (1984) 66:51-63.
10. Ehrlich HP, Wyler DJ. Fibroblast contraction of collagen lattices in vitro: inhibition by chronic inflammatory cell mediators. J Cell Physiol. (1983) 116:345-51. doi: 10.1002/jcp.1041160312
11. Gullberg D, Tingström A, Thuresson AC, Olsson L, Terracio L, Borg TK, et al. b1 Integrin-mediated collagen gel contraction is stimulated by PDGF. Exp Cell Res. (1990) 186:264-72.
12. Tingstrom A, Heldin CH, Rubin K. Regulation of fibroblast-mediated collagen gel contraction by platelet-derived growth factor, interleukin-1 alpha and transforming growth factor-beta 1. J Cell Sci. (1992) 102:315-22.
13. Levick JR, Michel CC. Microvascular fluid exchange and the revised starling principle. Cardiovasc Res. (2010) 87:198-210. doi: 10.1093/cvr/cvq062
14. Bellani, G.; Laffey, J.G.; Pham, T.; Fan, E.; Brochard, L.; Esteban, A.; Gattinoni, L.; Van Haren, F.M.P.; Larsson, A.; McAuley, D.F.; et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA J. Am. Med. Assoc. 2016, 315, 788-800.
15. Fan, E.; Brodie, D.; Slutsky, A.S. Acute respiratory distress syndrome advances in diagnosis and treatment. JAMA J. Am. Med. Assoc. 2018, 319, 698-710
5.2 Tài liệu tham khảo 2
1. Raghu G, Remy-Jardin M, Richeldi L, Thomson CC, Inoue Y, Johkoh T, et al. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: an official ATS/ERS/JRS/ALAT clinical practice guideline. Am J Respir Crit Care Med. (2022) 205:e18-47
2. Richeldi L, Du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. (2014) 370-2071-82.
3. Richeldi L, Kolb M, Jouneau S, WuytsWA, Schinzel B, Stowasser S, et al. Efficacy and safety of nintedanib in patients with advanced idiopathic pulmonary fibrosis. BMC Pulm Medicine. (2020) 20:3
4. Or Kalchiem-Dekel et al. Interstitial Lung Disease and Pulmonary Fibrosis: A Practical Approach for General Medicine Physicians with Focus on the Medical History. J. Clin. Med. 2018, 7, 478
5. Leslie, K.O. My approach to interstitial lung disease using clinical, radiological and histopathological patterns. J. Clin. Pathol. 2009, 62, 387-401
6. Visscher, D.W.; Myers, J.L. Histologic spectrum of idiopathic interstitial pneumonias. Proc. Am. Thorac. Soc. 2006, 3, 322-329
7. Schaefer L, Schaefer RM. Proteoglycans: from structural compounds to signaling molecules. Cell Tissue Res. (2010) 339:237-46.
8. Titze J, Shakibaei M. Schafflhuber M, Schulze-Tanzil G. Porst M, Schwind KH, et al. Glycosaminoglycan polymerization may enable osmotically inactive Na+ storage in the skin. Am J Physiol Heart Circul Physiol. (2004) 287:H203-8.
9. Grinnell F. Lamke CR. Reorganization of hydrated collagen lattices by human skin fibroblasts. J Cell Sci. (1984)
10. Ehrlich HP, Wyler DJ. Fibroblast contraction of collagen lattices in vitro: inhibition by chronic inflammatory cell mediators. J Cell Physiol. (1983) 118:345-51. doi: 10.1002/jcp.1041160312
11. Gullberg D, Tingström A, Thuresson AC, Olsson L, Terracio L, Borg TK, et al. b1 Integrin-mediated collagen gel contraction is stimulated by PDGF. Exp Cell Res. (1990) 186:264-72.
12. Tingstrom A, Heldin CH, Rubin K. Regulation of fibroblast-mediated collagen gel contraction by platelet-derived growth factor, interleukin-1 alpha and transforming growth factor-beta 1. J Cell Sci. (1992) 102:315-22.
13. Levick JR, Michel CC. Microvascular fluid exchange and the revised starling principle. Cardiovasc Res. (2010) 87:198-210. doi: 10.1093/cvr/cvq062
14. Bellani, G.; Laffey, J.G.; Pham, T.; Fan, E.; Brochard, L.; Esteban, A.; Gattinoni, L.; Van Haren, F.M.P.; Larsson, A.; McAuley, D.F.; et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA J. Am. Med. Assoc. 2016, 315, 788-800.
15. Fan, E.; Brodie, D.; Slutsky, A.S. Acute respiratory distress syndrome advances in diagnosis and treatment. JAMA J. Am. Med. Assoc. 2018, 319, 698-710
16. Thunnissen, E.; Motoi, N.; Minami, Y.; Matsubara, D.; Timens, W.; Nakatani, Y.; Ishikawa, Y.; Baez-Navarro, X.; Radonic, T.; Blaauwgeers, H.; et al. Elastin in pulmonary pathology: Relevance in tumours with a lepidic or papillary appearance. A comprehensive understanding from a morphological viewpoint. Histopathology 2022, 80, 457-487.
17. Liu, F.; Lagares, D.; Choi, K.M.; Stopfer, L.; Marinkovic, A.; Vrbanac, V.; Probst, C.K.; Hiemer, S.E.; Sisson, T.H.; Horowitz, J.C.; et al. Mechanosignaling through YAP and TAZ drives fibroblast activation and fibrosis. Am. J. Physiol. Lung Cell. Mol. Physiol. 2015, 308, L344-L357
18. Patel, N.M.; Lederer, D.J.; Borczuk, A.C.; Kawut, S.M. Pulmonary hypertension in idiopathic pulmonary fibrosis. Chest 2007, 132, 998-1006.
19. Zheng, M.; Hong, W.; Gao, M.; Yi, E.; Zhang, J.; Hao, B.; Liang, C.; Li, X.; Li, C.; Ye, X.; et al. Long noncoding RNA COPDA1 promotes airway smooth muscle cell proliferation in chronic obstructive pulmonary disease. Am. J. Respir. Cell Mol. Biol. 2019, 61, 584-596.
20. Gill, S.E.; Parks,W.C. Metalloproteinases and their inhibitors: Regulators of wound healing. Int. J. Biochem. Cell Biol. 2008, 40, 1334-1347.
21. Parks, W.C.; Wilson, C.L.; López-Boado, Y.S. Matrix metalloproteinases as modulators of inflammation and innate immunity. Nat. Rev. Immunol. 2004, 4, 617-629
22. American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. This joint statement of the American Thoracic Society (ATS). and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS Executive Committee, June 2001. Am. J. Respir. Crit. Care Med. 2002, 165, 277-304 23. Bradley, B.; Branley, H.M.; Egan, J.J.; Greaves, M.S.; Hansell, D.M.; Harrison, N.K.; Hirani, N.; Hubbard, R.; Lake, F.; Millar, A.B.; et al. Interstitial lung disease guideline: The British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax 2008, 63 (Suppl. 5), v1-v58
24. Raghu, G.; Collard, H.R.; Egan, J.J.; Martinez, F.J.; Behr, J.; Brown, K.K.; Colby, T.V.; Cordier, J.-F.; Flaherty. K.R.; Lasky, J.A.; et al. An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis. Evidence-based guidelines for diagnosis and management. Am. J. Respir. Crit. Care Med. 2011, 183, 788-82
25. Raghu, G.; Rochwerg. B.; Zhang, Y.; Garcia, C.A.C.; Azuma, A.; Behr, J.; Brozek, J.L.; Collard, H.R.; Cunningham, W.; Homma, S.; et al. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline. Am. J. Respir. Crit. Care Med. 2015, 192, e3-e19.
26. Raghu, G.; Remy-Jardin, M.; Myers, J.L.; Richeldi, L.; Ryerson, C.J.; Lederer, D.J.; Behr, J.; Cottin, V.; Danoff, S.K.; Morell, F.; et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am. J. Respir. Crit. Care Med. 2018, 198, e44-e68
27. Kinder, B.W.; Wells, A.U. The art and science of diagnosing interstitial lung diseases. Am. J. Respir. Crit. Care Med. 2009, 179, 974-975.
28. Todd, N.W.; Luzina, I.G.; Atamas, S.P. Molecular and cellular mechanisms of pulmonary fibrosis. Fibrogenesis Tissue Repair. 2012, 5, 11.
29. Bagnato, G.; Harari, S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur. Respir. Rev. 2015, 24, 102-114.
30. Wynn, T.A.; Ramalingam, T.R. Mechanisms of fibrosis: Therapeutic translation for fibrotic disease. Nat. Med. 2012, 18, 1028-1040
31. Myers, J.L.; Katzenstein, A.L. Epithelial necrosis and alveolar collapse in the pathogenesis of usual interstitial pneumonia. Chest. 1988, 94, 1309-1311.
32. Todd, N.W.; Atamas, S.P.; Luzina, I.G.; Galvin, J.R. Permanent alveolar collapse is the predominant mechanism in idiopathic pulmonary fibrosis. Expert Rev. Respir. Med. 2015, 9, 411-418. 33. Lutz, D.; Gazdhar, A.; Lopez-Rodriguez, E.; Ruppert, C.; Mahavadi, P.; Gunther, A.; Klepetko, W.; Bates, J.H.; Smith, B.; Geiser, T.; et al. Alveolar derecruitment and collapse induration as crucial mechanisms in lung injury and fibrosis. Am. J. Respir. Cell Mol. Biol. 2015, 52, 232-243.
34. Armanios, M.Y.; Chen, J.J.-L.; Cogan, J.D.; Alder, J.K.; Ingersoll, R.G.; Markin, C.; Lawson, W.E.; Xie, M.; Vulto, I.; Phillips, J.A., 3rd; et al. Telomerase mutations in families with idiopathic pulmonary fibrosis. Engl. J. Med. 2007, 356, 1317-1326.
35. Maitra, M.;Wang, Y.; Gerard, R.D.; Mendelson, C.R.; Garcia, C.K. Surfactant protein A2 mutations associated with pulmonary fibrosis lead to protein instability and endoplasmic reticulum stress. J. Biol. Chem. 2010, 285, 22103- 22113.
36. Van Moorsel, C.H.M.; van Oosterhout, M.F.M.; Barlo, N.P.; de Jong, P.A.; van der Vis, J.J.; Ruven, H.J.T.; van Es, H.W.; van den Bosch, J.M.M.; Grutters, J.C. Surfactant protein C mutations are the basis of a significant portion of adult familial pulmonary fibrosis in a dutch cohort. Am. J. Respir. Crit. Care Med. 2010, 182, 1419-1425
37. Visscher, D.W.; Myers, J.L. Histologic spectrum of idiopathic interstitial pneumonias. Proc. Am. Thorac. Soc. 2006, 3, 322-329
38. Todd, N.W.; Marciniak, E.T.; Sachdeva, A.; Kligerman, S.J.; Galvin, J.R.; Luzina, I.G.; Atamas, S.P.; Burke, A.P. Organizing pneumonia/non-specific interstitial pneumonia overlap is associated with unfavorable lung disease progression. Respir. Med. 2015, 109, 1460-1468.
39. Cordier, J.F. Organising pneumonia. Thorax 2000, 55, 318-328.
40. Flaherty, K.R.; Travis,W.D.; Colby, T.V.; Toews, G.B.; Kazerooni, E.A.; Gross, B.H.; Jain, A.; Strawderman, R.L.; Flint, A.; Lynch, J.P.; et al. Histopathologic variability in usual and nonspecific interstitial pneumonias. Am. J. Respir. Crit. Care Med. 2001, 164, 1722-1727.
41. Park, J.H.; Kim, D.S.; Park, I.-N.; Jang, S.J.; Kitaichi, M.; Nicholson, A.G.; Colby TV Pr1 Park, J.H.; Kim, D.S.; Park, I.-N.; Jang, S.J.; et al. Prognosis of fibrotic interstitial pneumonia: Idiopathic versus collagen vascular disease- related subtypes. Am. J. Respir. Crit. Care Med. 2007, 175, 705-711.
42. Leslie, K.O.; Gruden, J.F.; Parish, J.M.; Scholand, M.B. Transbronchial biopsy interpretation in the patient with diffuse parenchymal lung disease. Arch. Pathol. Lab. Med. 2007, 131, 407-423
43. Utz, J.P.; Ryu, J.H.; Douglas,W.W.; Hartman, T.E.; Tazelaar, H.D.; Myers, J.L.; Allen, M.S.; Schroeder, D.R. High short-term mortality following lung biopsy for usual interstitial pneumonia. Eur. Respir. J. 2001, 17, 175-179.
44. Collard, H.R.; Moore, B.B.; Flaherty, K.R.; Brown, K.K.; Kaner, R.J.; King, T.E.J.; Lasky, J.A.; Loyd, J.E.; Noth, I.; Olman, M.A.; et al. Acute exacerbations of idiopathic pulmonary fibrosis. Am. J. Respir. Crit. Care Med. 2007, 176, 636-643
45. Strollo, D.C.; Franks, T.J.; Galvin, J.R. The idiopathic interstitial pneumonias: Histology and imaging. Semin. Roentgenol. 2015, 50, 8-15.
46. Silva, C.I.S.; Churg, A.; Muller, N.L. Hypersensitivity pneumonitis: Spectrum of high-resolution CT and pathologic findings. AJR Am. J. Roentgenol. 2007, 188, 334-344
47. Staats, P.; Kligerman, S.; Todd, N.; Tavora, F.; Xu, L.; Burke, A. A comparative study of honeycombing on high resolution computed tomography with histologic lung remodeling in explants with usual interstitial pneumonia. Pathol. Res. Pract. 2015, 211, 55-81
48. Sumikawa, H.; Johkoh, T.; Colby. T.V.; Ichikado, K.; Suga, M.; Taniguchi, H.; Kondoh, Y.; Ogura, T.; Arakawa, H.; Fujimoto, K.; et al. Computed tomography findings in pathological usual interstitial pneumonia: Relationship to survival. Am. J. Respir. Crit. Care Med. 2008, 177, 433-439.
49. Walsh, S.L.F.; Sverzellati, N.; Devaraj, A.; Wells, A.U.; Hansell, D.M. Chronic hypersensitivity pneumonitis: High resolution computed tomography patterns and pulmonary function indices as prognostic determinants. Eur. Radiol. 2012, 22, 1872-1879.
50. Walsh, S.L.F.; Sverzellati, N.; Devaraj, A.; Keir, G.J.; Wells, A.U.; Hansell, D.M. Connective tissue disease related fibrotic lung disease: High resolution computed tomographic and pulmonary function indices as prognostic determinants. Thorax 2014, 69, 216-222. [
51. Richeldi L, Varone F. Bergna M, de Andrade J, Falk J, Hallowell R, et al. Pharmacological management of progressive-fibrosing interstitial lung diseases: a review of the current evidence. Eur Respir Rev. (2018) 27:180074. doi: 10.1183/16000617.0074-2018
52. Rozenberg D, Sitzer N, Porter S.Weiss A, Colman R, Reid WD, et al. Idiopathic pulmonary fibrosis: a review of disease, pharmacological, and nonpharmacological strategies with a focus on symptoms, function, and health-related quality of life. J Pain Symptom Manage. (2020) 59:1362-78. doi: 10.1016/j.jpainsymman.2019. 12.364
53. Tomassetti S, Gurioli C, Ryu JH, Decker PA, Ravaglia C, Tantalocco P. et al. The impact of lung cancer on survival of idiopathic pulmonary fibrosis. Chest. (2015) 147:157-64. doi: 10.1378/chest.14-0359
54. Khor YH, Ng Y. Barnes H. Goh NS, McDonald CF, Holland AE. Prognosis of idiopathic pulmonary fibrosis without anti-fibrotic therapy: a systematic review. Eur Respir Rev. (2020) 29:190158.
55. Du Bois RM, Weycker D. Albera C, Bradford WZ. Costabel U, Kartashov A, et al. Forced vital capacity in patients with idiopathic pulmonary fibrosis: test properties and minimal clinically important difference. Am J Respir Crit Care Med. (2011) 184:1382-9
56. Xiaochen D. Emmanuela G, Alan DL. Evolution of the global smoking epidemic over the past half century: strengthening the evidence base for policy action. Tob Control. (2022) 31:129.
57. Flaherty KR, Martinez FJ, Flaherty KR, Martinez FJ. The role of pulmonary function testing in pulmonary fibrosis. Curr Opin Pulm Med. (2000) 6:404-10.

