Kỹ thuật lấy mẫu và bảo quản các mẫu bệnh phẩm xét nghiệm

Trường Đại Học Y Hà Nội - Bộ môn Khoa học xét nghiệm
Chủ biên PGS.TS.BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ
Các tác giả tham gia biên soạn
PGS. TS. BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ, TS. BS. Nguyễn Thúy Hương, TS. BS. Nguyễn Thị Thanh Hải
ThS. Đặng Quang Huy, Ths. BSNT. Nguyễn Quỳnh Giao, Ths. BSNT. Vũ Đức Anh, ThS. Trịnh Thị Phương Dung
Ths. BSNT. Lê Văn Toàn, Ths. BSNT. Ngô Diệu Hoa, BSNT. Phạm Thị Hương Trang, Ths. BSNT. Nguyễn Thị Thu Thảo
Ths. BS. Nguyễn Thị Hảo, CKI. Đỗ Thị Hường, CKI. Nguyễn Thúy Hà, ThS. Vũ Thị Bích Hồng
CN. Lê Thanh Thảo, CN. Nguyễn Hữu Hùng
Thu thập và xử lý mẫu bệnh phẩm là bước đầu tiên và cũng là một bước quan trọng trong quá trình xét nghiệm. Kết quả xét nghiệm được các bác sỹ lâm sàng sử dụng rộng rãi như một công cụ đắc lực, hỗ trợ cho chẩn đoán xác định, điều trị, theo dõi cũng như tiên lượng cho bệnh nhân. Do đó chất lượng mẫu bệnh phẩm cần đảm bảo để thu được kết quả xét nghiệm chính xác. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc thông tin về kỹ thuật lấy mẫu và bảo quản các bệnh phâm xét nghiệm.
1 Nguyên tắc khi tiếp xúc bệnh nhân
Nhân viên lấy mẫu bệnh phẩm đóng một vai trò quan trọng, là người đầu tiên tương tác giữa bệnh nhân với với phòng xét nghiệm. Nhiều bệnh nhân thường đánh giá chất lượng chăm sóc sức khỏe của cơ sở khám chữa bệnh từ những ấn tượng về những nhân viên y tế tiếp xúc ban đầu. Tác phong, cách ứng xử chuyên nghiệp sẽ giúp bệnh nhân đạt được tâm lý thoải mái và tạo một môi trường tướng tác tích cực.
1.1 Tính chuyên nghiệp
1.1.1 Hình thức, tác phong
Ấn tượng mà người lấy mẫu khi lần đầu tiên tiếp xúc với bệnh nhân sẽ tạo tiền đề cho một cảm giác tin tưởng, an tâm sau đó. Đồng phục gọn gàng đúng quy định và đeo biển tên đầy đủ. Móng tay để ngắn, đầu tóc gọn gàng?
1.1.2 Thái độ
Khi tiếp đón bệnh nhân thái độ phải lịch sự, nhanh nhẹn, nhẹ nhàng, hòa nhã biểu hiện sự quan tâm, yêu thương, cảm thông, chia sẻ. Cán bộ y tế cần quan sát bệnh nhân một cách kín đáo và lịch sự đê’ tìm hiểu và phát hiện mọi biếu hiện không lời và biểu hiện phản ứng của người bệnh, cần phải tập trung quan sát để phát hiện ra những điểm không phù hợp giữa ngôn ngũ’ không lời và có lời.
sẵn sàng giúp đỡ bệnh nhân dù chỉ là những hành động, cử chỉ giúp đỡ rất nhỏ đối với bệnh nhân sẽ tạo được những thiện cảm từ ban đầu. Những cử chỉ của như gật đầu, mỉm cười... sẽ có tác dụng tích cực tới cuộc giao tiếp, vì nó thể hiện sự hài lòng, khuyến khích người bệnh cung cấp thông tin.
Tránh những cử chỉ không tôn trọng bệnh nhân như hất hàm, phẩy tay, động tác thô bạo, không giơ tay quá đầu, không đập bàn mạnh, không khua tay trước mặt bệnh nhân, không chỉ tay vào bệnh nhân, ...
1.1.3 Kỹ năng giao tiếp
Kỹ năng giao tiếp là một nền tảng vô cùng quan trọng đối với nhân viên y tế. Biết lắng nghe, giao tiếp tốt bằng ngôn ngữ, diễn đạt dễ hiểu khi tiếp xúc với bệnh nhân.
1.2 Sự đồng ý của bệnh nhân và các vấn đề bảo mật
Tất cả các thủ thuật được thực hiện trên bệnh nhân đều cần sự đồng ý của bệnh nhân. Các thủ thuật đặc biệt hoặc những thủ thuật có rủi ro biến chứng cao, cần sự giải thích chi tiết cho bệnh nhân và nhận được sự đồng ý của bệnh nhân. Trong một số trường hợp phải có sự đồng ý bằng văn bản. Ví dụ dịch vụ xét nghiệm HIV cần phải tư vấn và được sự đồng ý của bệnh nhân. Trẻ nhỏ, vị thành niên cần có sự đồng ý của bố, mẹ hoặc người giám hộ, người thân đi cùng. Trong những trường hợp khẩn cấp có thể chấp nhận thực hiện các thủ thuật cần thiết, có lợi nhất cho bệnh nhân. Nên có sự riêng tư trong quá trình tiếp nhận và lấy mẫu, phù hợp với các thông tin được yêu cầu trong lấy mẫu.
Nhân viên y tế phải tuân thủ giữ bí mật tất cả thông tin riêng tư của bệnh nhân. Hiện này các thông tin có thể dễ dàng được lưu trữ và truy câp trên các hệ thống phần mềm công nghệ thông tin, do đó cần những hệ thống dữ liệu, cơ sở phải đảm bảo bảo mật tuyệt đối thông tin của bệnh nhân.
1.3 Kiểm soát nhiễm khuẩn
Các biện pháp phòng ngừa tiêu chuẩn phải được thực hiện nghiêm ngặt để ngăn ngừa sự nhiễm trùng, bao gồm việc sử dụng thiết bị bảo vệ cá nhân (personal protective equipment - PPE) khi lấy hoặc xử lý mẫu bệnh phẩm và tuân thủ các quy trình vệ sinh tay thích hợp. Có thể bổ sung các yêu cầu phòng lây nhiễm đối với bệnh nhân, như đeo khẩu trang (với các tác nhân lây qua đường không khí, giọt nhỏ hoặc tiếp xúc).
- Bảo hộ cá nhân: cần có áo choàng bảo hộ phòng xét nghiệm (áo blouse) và găng tay cho các quy trình lấy mẫu bệnh phẩm và trong quá trình xử lý và xử lý
mẫu bệnh phấm. Có thé căn mặt nạ hoặc kính che chắn, khấu trang khi lẩy màu bệnh phẩm từ những bệnh nhân mắc hoặc nghi ngờ mắc một số bệnh truyền nhiêm, đặc biệt các bệnh lây qua đường khi dung, giọt bắn.
- Vệ sinh tay: vệ sinh tay đúng cách là cách quan trọng nhất để ngăn ngừa sự lây lan của các tác nhân gây bệnh là vi sinh vật. Bàn tay phải được khử nhiêm thường xuyên, kể cả sau khi tháo găng tay. Các chất tấy rửa, sát trùng gốc cồn có thé sừ dụng thay vì rửa tay nếu tay không bị dính các vết bẩn.
- Cách ly: cần có quy trình sàng lọc, cách ly tách một số bệnh nhân mang những màm bệnh có khà năng lây nhiễm cao khỏi những người khác và hạn chế tiếp xúc cùa họ với nhân viên bệnh viện và các bệnh nhân khác.
2 Các loại mẫu bệnh phẩm máu, dịch, nước tiểu
2.1 Mẫu bệnh phẩm máu
2.1.1 Hệ thống mạch máu
Các loại mẫu bệnh phẩm máu phổ biến hay sử dụng trên lâm sàng theo thứ tự: máu tình mạch, máu mao mạch và máu động mạch. Mỗi loại mẫu máu có đặc điểm:
Máu tĩnh mạch: được dùng phổ biến cho hầu hết các xét nghiệm, thành mạch thường mỏng hơn và áp lực máu thường thấp hơn so với động mạch cùng kích thước. Thành phần máu tình mạch bị ảnh hưởng bởi hoạt động trao đổi chất của mô và thay đổi tùy theo vị trì. Máu tĩnh mạch có hàm lượng oxy thấp hơn, nhưng nồng độ clorua, glucose, pH, CO2, Acid Lactic và amoniac khác so với máu động mạch. Lưu lượng máu bị suy giảm có thể ảnh hưởng đển các chất phân tích khác.
Máu mao mạch: được sử dụng sàng lọc các bệnh trước sinh, test chẩn đoán nhanh (point ofcare tests), có thê dùng khi làm xét nghiệm khí máu nếu không lấy được máu động mạch, và mẫu máu mao mạch cũng được lấy khi cần một thể tích máu nhỏ. Khi lấy máu mao mạch cần lưu ý loại bỏ giọt máu đầu có chứa dịch mô. Máu mao mạch chứa máu động mạch và tĩnh mạch cộng với dịch mô. Đường máu mao mạch thường cao hơn; calci, Kali và tổng số protein thường thấp hơn. Tuy nhiên, ép chặt hoặc ga rô chặt ngay vị trí lấy máu có thể làm tăng giả tạo nồng độ kali trong máu.
Máu động mạch: thường đồng nhất trong toàn bộ cơ thể. Khi được lấy bằng kim tiêm với áp suất bình thường, máu động mạch thường có xu hướng bơm theo nhịp co bóp của tâm thất. Máu động mạch thường có màu đỏ tươi do chứa máu giàu oxy. Tuy nhiên, vì kỹ thuật chọc dò động mạch rất khó và có khả năng nguy hiểm, chủ yếu được dành để đánh giá khí máu, tình trạng thăng bằng kiềm toan của máu trong các tình huống khấn cấp nhất định và chỉ được thực hiện bởi những người được đào tạo bài bản về kỹ thuật thực hiện. Cần lưu ý trong trường hợp bệnh nhân có tình trạng rối loạn huyết động trong các bệnh lý cấp cứu có kèm theo sốc giảm thế tích, áp lực máu động mạch có thể không đủ mạnh, màu sắc có thể đỏ sẫm, do đó càn lưu ý phân biệt có lấy nhầm máu tình mạch hay không.
.jpg)
(McCall R, Tankersley c, 2008)
2.1.2 Lấy máu tĩnh mạch liên quan đến cấu trúc giải phẫu
Các tĩnh mạch chính để lấy máu tĩnh mạch nằm ở vùng trước của cánh tay - khuỷu tay. Tại vị trí này, một số tĩnh mạch lớn nằm gàn bề mặt, giúp chúng định vị và lấy máu dễ dàng hơn. Mặc dù các vị trí chính xác khác nhau ở mỗi người, tuy nhiên có hai kiểu cơ bản trong đó các tĩnh mạch nông tạo thành hình dạng của chữ "H" hoặc chữ "M" (Hình 1.2).
2.1.2.1 Dạng tĩnh mạch H
Dạng H chiếm 70% dân số bao gồm các tĩnh mạch:
- Tĩnh mạch giữa khuỷu (tĩnh mạch trụ trung gian): Đây là loại tĩnh mạch được ưa chuộng để lấy máu tĩnh mạch theo dạng tĩnh mạch chữ H vì tĩnh mạch này thường lớn, gần bề mặt và nổi rõ nhất, ít gây đau nhất và ít có khả năng bị bầm tím nhất.
- Tĩnh mạch đầu: đây là tĩnh mạch được lựa chọn thứ hai trong mẫu H. Mặc dù thường khó sờ hơn so với tĩnh mạch giữa đầu. Tuy nhiên, đây là tĩnh mạch có thế cảm nhận rõ hơn so với các tĩnh mạch khác ở bệnh nhân béo phì.
- Tĩnh mạch nền: là sự lựa chọn cuối cùng. Mặc dù bình thường lớn và dễ sờ thấy, nhưng tĩnh mạch nền không được cố định tốt, dễ dịch chuyển theo cử động và tư thế, làm tăng nguy cơ đâm vào nhánh thần kinh giữa hoặc động mạch cánh tay gần đó. Khuyến cáo không nên lấy máu từ tĩnh mạch nền trừ khi không cảm nhận được máu tĩnh mạch nào khác ở cả hai cánh tay nổi rõ hơn.
.jpg)
(McCall R, Tankersley c, 2008.)
A. Dạng chữ H; B. Dạng chữ M
1. Tĩnh mạch đấu, 2. Tĩnh mạch nền, 3. Tĩnh mạch giữa khuỷu, 4. Tĩnh mạch giữa đầu,
5. Tĩnh mạch giữa nền, 6. Tĩnh mạch giữa cẳng tay
2.1.2.2 Dạng tĩnh mạch M
- Tỉnh mạch giữa cẳng tay: nằm ở chính giữa của cẳng tay. Đây là tĩnh mạch được lựa chọn đàu tiên theo dạng tĩnh mạch hình chữ M vì nó được cố định tốt, có xu hướng ít đau hơn và không gần các dây thần kinh hoặc động mạch chính; do đó, an toàn nhất để lấy mẫu.
- Tĩnh mạch giữa đẵu: các nhánh từ tĩnh mạch giữa cẳng tay đi đến mặt bên của cánh tay. Đây là loại tĩnh mạch theo dạng tĩnh mạch hình chữ M thứ hai dễ tìm thấy, ít đau hơn, nằm đủ xa các dây thần kinh hoặc động mạch chính và nói chung là an toàn để lấy mẫu.
- Tĩnh mạch giữa nền: các nhánh từ tĩnh mạch giữa cẳng tay đi đến mặt giữa của cánh tay. Đây là lựa chọn thứ ba trong dạng chữ M bởi vì, mặc dù có vẻ dễ tiếp cận hơn, nhưng nó nằm gàn các nhánh trước và sau của dây thần kinh bì cẳng tay trong.
2.1.2.3 Các tĩnh mạch khác
Mặc dù các tĩnh mạch cánh tay, cẳng tay là những tĩnh mạch nông phổ biến được lựa chọn để lấy máu, các tĩnh mạch trên mu bàn tay và cổ tay cũng có thể được sử dụng để lấy máu tĩnh mạch. Tĩnh mạch ở mặt dưới của cố tay không nên lựa chọn để lấy máu tĩnh mạch, vì nguy cơ chọc vào động mạch. Các tĩnh mạch ở chân, mắt cá chân và bàn chân đôi khi được lựa chọn trong các trường hợp khó lấy máu từ các tĩnh mạch khác, nên hạn chế do có nguy cơ xảy ra các biến chứng y khoa nghiêm trọng. Trong một số tình huống khẩn cấp, có thể lấy máu ở những tĩnh mạch dưới đòn, tĩnh mạch đùi... tuy nhiên cần phải có sự giám sát của các bác sỹ chuyên khoa.
2.1.3 Loại bệnh phâm máu
Bất kể từ loại mạch nào, thành phần máu có khoảng 55% chất lỏng và 45% tế bào máu. Các xét nghiệm có thể được thực hiện trên huyết thanh hoặc huyết tương, hoặc trên máu toàn phần. Loại mẫu xét nghiệm được lựa chọn thực hiện phụ thuộc vào loại xét nghiệm, mức độ khẩn cấp của kết quả và thiết bị được sử dụng. Huyết thanh/huyết tương là phần dịch nồi màu vàng trong thu được sau khi ly tâm máu toàn phần.
- Huyết thanh: là một chất lỏng trong suốt, màu vàng nhạt (huyết thanh lấy ngay sau bữa ăn có thể bị đục do lipid) được tách ra khỏi cục máu đông bằng cách ly tâm.
- Huyết tương: là một chất lỏng trong suốt đến đục rất nhẹ, màu vàng nhạt, tách ra khỏi tế bào khi máu trong ống chứa chất chống đông sau khi ly tâm. Huyết tương chứa fibrinogen; huyết thanh không chứa, vì fibrinogen đã được sử dụng để hình thành cục máu đông.
- Nhiều xét nghiệm có thể được thực hiện trên huyết thanh hoặc huyết tương. Các xét nghiệm khẩn cấp và các xét nghiệm khác đòi hỏi thời gian trả kết quả nhanh, thường được lấy bằng các ống có chứa chất chống đông heparin vì chúng có thể được ly tâm ngay lập tức để lấy huyết tương.
- Máu toàn phẵn: chứa cả các tế bào máu và huyết tương, giống như máu trong cơ thể. Giống như huyết tương, cần phải sử dụng một số chất chống đông không hình thành cục máu đông. Máu toàn phần được sử dụng cho hầu hết các xét nghiệm huyết học và nhiều xét nghiệm tại điểm chăm sóc (POCT), đặc biệt là trong các tình huống chăm sóc cấp tính và chỉ số.
2.1.4 Các dụng cụ lấy máu tĩnh mạch
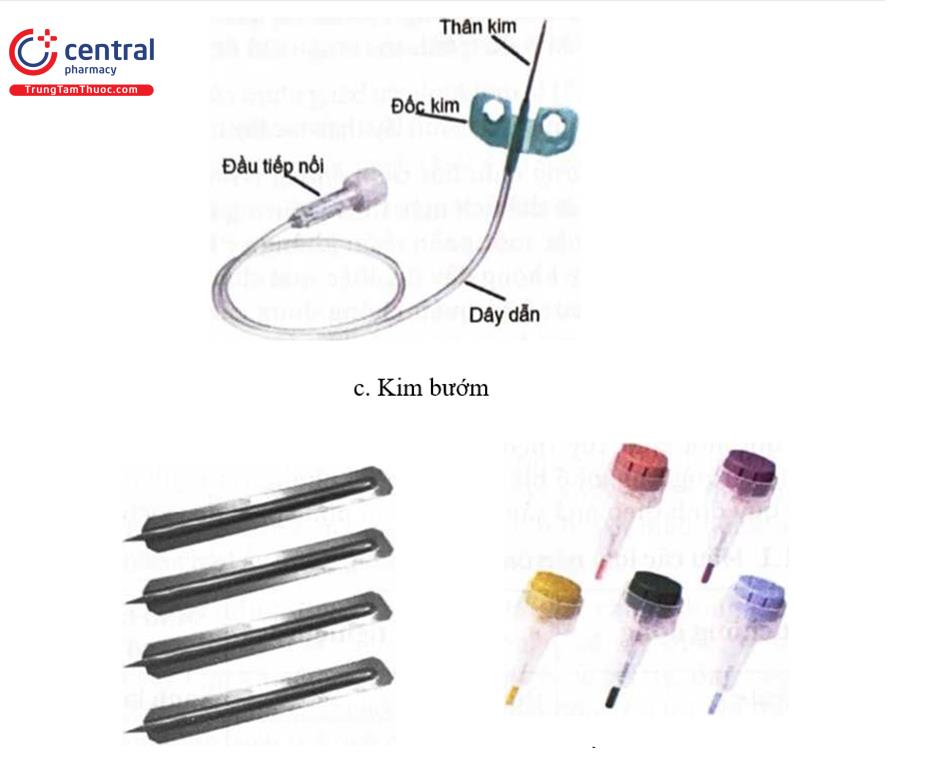
Tùy theo vị trí lấy máu có thể được thực hiện bằng ba phương pháp cơ bản bao gồm hệ thống lấy máu chân không (evacuated tube system - ETS), bơm kim tiêm, kim bướm (Hình 1.3]. ETS là phương pháp được ưa chuộng vì máu được lấy trực tiếp từ tĩnh mạch vào một ống kín, giảm thiểu nguy cơ tạp nhiễm. Mặc dù không được khuyến khích do các vấn đề về an toàn và chất lượng mẫu bệnh phẩm, tuy nhiên bơm kim tiêm truyền thống đôi khi được sử dụng trên các tĩnh mạch nhỏ, dễ vỡ. Bộ kim bướm có thể được sử dụng với ETS hoặc bơm tiêm và thường được sử dụng để lấy máu từ trẻ sơ sinh và trẻ em, từ các tĩnh mạch tay và trong các tình huống khó lấy máu khác. Trường hợp cần lấy máu mao mạch có thể sử dụng kim chích máu. Kim lấy máu là dụng cụ vô khuẩn, chỉ dùng một lần.
Garô ¡ấy máu: sử dụng để cuốn vừa đủ chặt quanh cánh tay của bệnh nhân trong khi lấy máu tĩnh mạch, vừa để hạn chế dòng chảy tĩnh mạch (nhưng không chặt tới mức cản trở dòng chảy máu động mạch), làm cho tĩnh mạch nổi rõ hơn và dễ tìm thấy hơn; đồng thời kéo giãn thành mạch mỏng hơn và dễ đâm xuyên hơn. Garô không được để quá 60 giây vì chất lượng mẫu máu có thể bị ảnh hưởng.
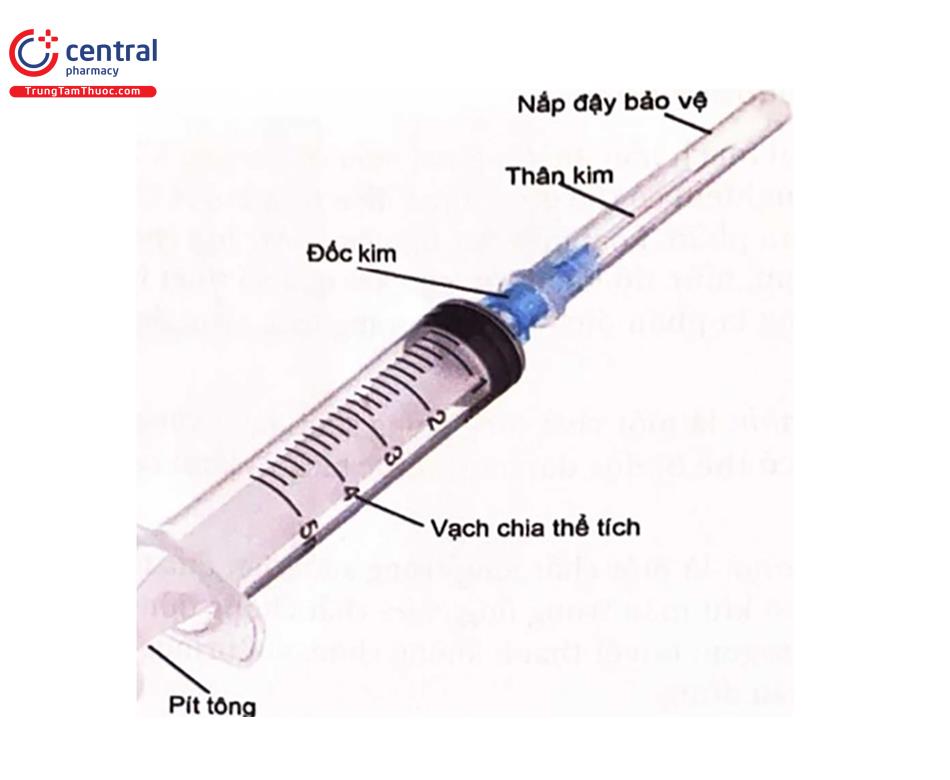
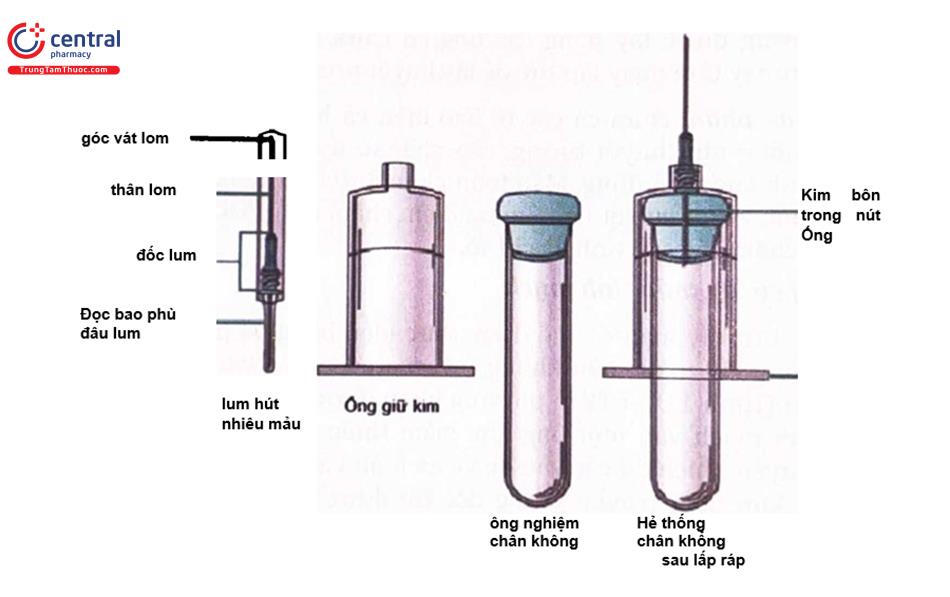
Kim Ịấy máu: phải đảm bảo vô trùng, dùng một lần và có chiều dài và độ lớn của kim riêng nhất định. Lựa chọn độ dài tùy thuộc vào độ sâu của tĩnh mạch và thói quen của người lấy mẫu. Độ lớn của kim (Gauge) là số liên quan đến đường kính kim. Độ lớn của kim và đường kính có quan hệ tỷ lệ nghịch (tức là độ lớn G của kim càng lớn thì đường kính của kim càng nhỏ). Độ lớn của kim được lựa chọn cho kích thước và tình trạng của tĩnh mạch và lượng máu cần thiết cho xét nghiệm, do đó độ lớn thích hợp là rất quan trọng. Nếu quá lớn, kim có thể làm tổn thương tĩnh mạch. Nếu nó quá nhỏ, máu được bơm qua một thiết diện nhỏ, tạo một áp suất lớn và rất dễ gây vỡ hồng cầu. Kim lấy máu tĩnh mạch có độ lớn từ G21 đến G23, độ lớn G21 được coi là tiêu chuẩn và thường được lựa chọn lấy máu tĩnh mạch thông thường. Kim được mã hóa theo màu sắc để dễ nhận biết, mặc dù màu sắc có thể khác nhau tùy theo nhà sản xuất.
Hệ thống kim hút chân không - ETS có ba thành phần cơ bản: một kim hút nhiều mẫu, một giá đỡ ống và các loại ống nghiệm hút chân không khác nhau.
- Kim hút nhiều mẫu (Hình 1.3) cho phép thu thập nhiều ống trong quá trình lấy máu tĩnh mạch. Gần phía đầu cắm vào ống xét nghiệm chân không có rcn đê’ có thể vặn vào giá đỡ ống và có một điếm vát ờ mỗi đầu. Đầu phía kim cắm vào các
ống nghiệm được bao phủ bởi một ống Cao Su co dãn khi nó xuyên qua nút, cho phép máu chảy và che phủ kim để tránh rò rỉ máu khi ống được rút ra.
- Giá đỡ ống (Hình 1.3) là một hình trụ bằng Nhựa có một lỗ nhỏ để lắp và cố định kim hút mẫu vào giá. Giá đỡ giúp quá trình lấy thao tác lấy máu được thuận lợi hơn.
- Các ống nghiệm đựng mẫu hút chân không (Hình 1.3) bên trong ống được hút chân không, tự động hút thể tích máu tương đương thể tích được ghi trên nhãn. Một ống bị mất toàn bộ hoặc một phần chân không sẽ không thể đủ áp lực để hút được máu hoặc thế tích lấy không đầy đủ. Việc mất chân không (mất áp lực âm) có thể xảy ra nếu các ống được bảo quản không đúng cách, bị mở, bị rơi hoặc nâng quá xa vào kim trước khi rút hoặc nếu mũi kim lùi ra ngoài da trong khi rút. Nắp đậy ống được mã màu để xác định loại chống đông tương ứng, không có chống đông hoặc đặc tính ống đặc biệt. Mặc dù nói chung là phổ biến, mã hóa màu sắc nắp ống thay đổi một chút tùy theo nhà sản xuất. Bảng dưới đây liệt kê một số chất chống đông tương ứng, phổ biến sử dụng tại phòng xét nghiệm, hình dạng và màu ống được quy định theo nhà sản xuất, khi sử dụng phải đọc kỹ hướng dẫn.
Bảng 1. Màu các loại nắp ống, chất chống đông và loại xét nghiệm tương ứng
| Chất chống đông | Loại xét nghiệm | Màu nắp ống theo một số nhà sản xuất |
| Natri Citrate | Đông máu | Xanh lam nhạt |
Không chống đông hoặc chứa các hạt làm tăng đông | Hóa sinh, miễn dịch | Đỏ |
Lithium Heparin Natri Heparin | Hóa sinh, miễn dịch | Xanh lá cây / đen / hồng |
| EDTA | Huyết học | Tím |
Natri fluoride + Kali oxalate Natri fluoride + EDTA Natri fluoride | Hóa sinh (đường máu) | Xám |
Sodium polyanethol sulfonate (SPS) | Vi sinh | Màu vàng |
Acid citrate dextrose (ACD) | Huyết học (truyền máu/ tế bào dòng chảy...) |
Bơm kim tiêm: Phương pháp lấy máu tĩnh mạch được ưu tiên là phương pháp chân không (Hình 3), bao gồm một ống tiêm nhựa kèm theo kim tiêm với kích cỡ tương ứng,
- Kim tiêm có nhiều loại và độ dài cho nhiều mục đích sử dụng khác nhau. Những loại thích hợp để lấy máu tĩnh mạch là từ 21G đến 23G, vô trùng.
- Ống tiêm có sẵn với nhiều kích cỡ khác nhau được lựa chọn tùy theo kích thước và tình trạng của tĩnh mạch và lượng máu càn thiết. Bơm tiêm với các vạch chia độ bằng mililit (mL) và một pit tông. Trong quá trình lấy máu tĩnh mạch, pit tông từ từ được kéo lại, tạo ra một khoảng chân không kéo máu vào thân bơm tiêm.
Kim bướm: là một kim ngắn có phần nhựa giống như cánh bướm và liên tiếp với một ống nối để sử dụng ống tiêm hoặc sử dụng với ETS (Hình 1.3). Chúng có nhiều loại G khác nhau, với kích cỡ 23G phổ biến nhất được sử dụng cho lấy máu tĩnh mạch. Trong quá trình sử dụng, các cánh nhựa thường được giữ cùng với ngón cái và ngón trỏ, cho phép người dùng đạt được góc kim nông càn thiết để tiếp cận các tĩnh mạch nhỏ. Kim nhỏ hơn làm tăng nguy cơ tán huyết mẫu bệnh phẩm. Kim bướm dùng để lấy máu tĩnh mạch phải có thiết bị an toàn.
Các loại chất chống đông: Nếu ống nghiệm là chất chống đông máu, máu sẽ không bị vón cục và bệnh phẩm sẽ là máu toàn phần, có thể được ly tâm để lấy huyết tương. Tất cả các ống không chứa chất chống đông (ví dụ, ống nắp màu đỏ) tạo ra các mẫu huyết thanh. Một chất chống đông hoạt động tối ưu khi thể tích máu được lấy vào ống đến đúng vạch thể tích được đánh dấu trên ống và đảo ngược nhẹ nhàng ngay sau khi lấy để trộn đều chất chống đông với máu. Chất lượng mẫu bệnh phẩm có thể bị ảnh hưởng nếu thể tích mẫu quá ít hoặc quá nhiều so với lượng chất chống đông cho phép, đặc biệt với xét nghiệm đông máu. Lắc hoặc trộn mạnh có thể làm tan máu. Lắc trộn không đều có thế xuất hiện cục máu đông, ảnh hưởng đến các xét nghiệm thực hiện trên mẫu máu toàn phần. Chỉ sử dụng các ống chống đông còn hạn sử dụng, nên kiểm tra và loại bỏ các ống hết hạn.
Các chất chống đông phổ biến nhất được phân loại như sau. Chất chống đông máu ngăn máu đông và bao gồm acid ethylenediaminetetraacetic (EDTA), citrat, heparin và oxalat. Mỗi loại được thiết kế để sử dụng trong một số loại xét nghiệm nhất định và điều quan trọng là phải sử dụng đúng. Các ống nghiệm được sử dụng hiện nay có thể là loại ống hút chân không hoặc loại ống bình thường không hút chât không.
Oxalat:
- Natri, kali, ammonium, lithium, sử dụng phổ biến nhất là kali oxalat (K2C2O4.H2O) nồng độ 1 - 2 mg/mL máu vì không làm co tế bào hông cầu. Trong khi các oxalat khác kéo nước từ tế bào hồng cầu ra huyết tương gây thay đổi điện tích và các thành phần khác trên màng tế bào làm sai lệch các thông số xét nghiệm: hematocrit giảm 10%, thành phàn khác giảm 5%.
- Cơ chế chống đông: các chất chống đông tạo phức hợp với ion Ca++ trong máu, nên quá trình đông máu không thực hiện được.
- Không dùng để định lượng Calci (Ca), Alkaline phosphatase (hay phosphatase kiềm - ALP), Amylase, lactate dehydrogenase (LDH).
Citrat:
- Thường dùng dung dịch nồng độ 34 - 38 g/L với tỷ lệ: 1 thể tích (V) chống đông/9 thể tích máu.
- Cơ chế chống đông: các chất chống đông tạo phức hợp với ion Ca++ trong máu, nên quá trình đông máu không thực hiện được. Dung dịch hay được dùng trong truyền máu để bảo quản hồng cầu là ACD (acid citric-citrat-dextrose), cũng là một dạng chống đông của citrat.
Natri florua:
- Hay được dùng trong xét nghiệm đường huyết; nồng độ 8 g/L với tỷ lệ 0,2 V/1,5 V máu; có thể sấy khô ở nhiệt độ dưới 100°C.
- Cơ chế chống đông: chất chống đông liên kết với ion Ca2+, ngăn cản quá trình đông máu. Natri florua còn có tác dụng ức chế hiện tượng phân hủy glucose do tạo phức với ion Mg++ cần thiết cho hoạt lực của một trong số những enzym tham gia con đường đường phân, có thể làm giảm nồng độ glucose lên đến 10 mg/dL (0,55 mmol/L) mỗi giờ. Có thể bảo quản glucose đến 3 ngày và ức chế sự phát triển của vi khuẩn. Natri florua thường được kết hợp với chất chống đông kali oxalat để cung cấp bệnh phẩm huyết tương. Ngoài glucose, natri florua được sử dụng để thu thập các mẫu Ethanol để ngăn chặn sự gia tăng rượu do vi khuẩn lên men. Chống đông bằng florua không dùng để định lượng ure bằng phương pháp urease.
Heparin: chất chống đông chủ yếu dùng trong các xét nghiệm sinh hóa
- Dạng hay dùng là lithium, natri, kali, muối ammonium; 0,2 mg/mL máu.
- Cơ chế chống đông là ức chế Prothrombin chuyển thành Thrombin.
- Thrombin
- Fibrinogen———► Fibrin
EDTA (Ethylen diamin tetra acetic):
- Thường dùng dưới dạng muối di natri hoặc di kali của EDTA; nồng độ: 1 - 2 mg/lmL máu.
- Cơ chế chống đông: tạo phức họp với ion Ca++ ức chế hiện tượng đông máu.
- EDTA không dùng để chống đông cho các xét nghiệm Ca, K, Fe, phosphatase kiềm (ALP), bilirubin, cerulophasmin. EDTA còn giữ ổn định hình thái của các tế bào, đặc biệt là tế bào hồng cầu trong một thời gian nhất định.
Các ống không chống đông hoặc chứa chất làm tăng đông:
- Chất hoạt hóa cục máu đông là các yếu tố đông máu như thrombin và các chất như hạt thủy tinh (silica) và đất sét trơ như diatomit (celite) giúp tăng cường đông máu bằng cách cung cấp nhiều bề mặt hơn cho hoạt hóa tiểu cầu. Các chất hoạt hóa cục máu đông trong các ống tách gel và các ống nhựa màu đỏ trên cùng thường là silica.
- Chất tách gel thixotropic là các chất trơ được chứa trong hoặc gần đáy của một số ống nhất định. Trong quá trình ly tâm, gel nằm giữa tế bào và chất lỏng, tạo thành một hàng rào vật lý ngăn tế bào chuyển hóa các chất trong huyết thanh hoặc huyết tương.
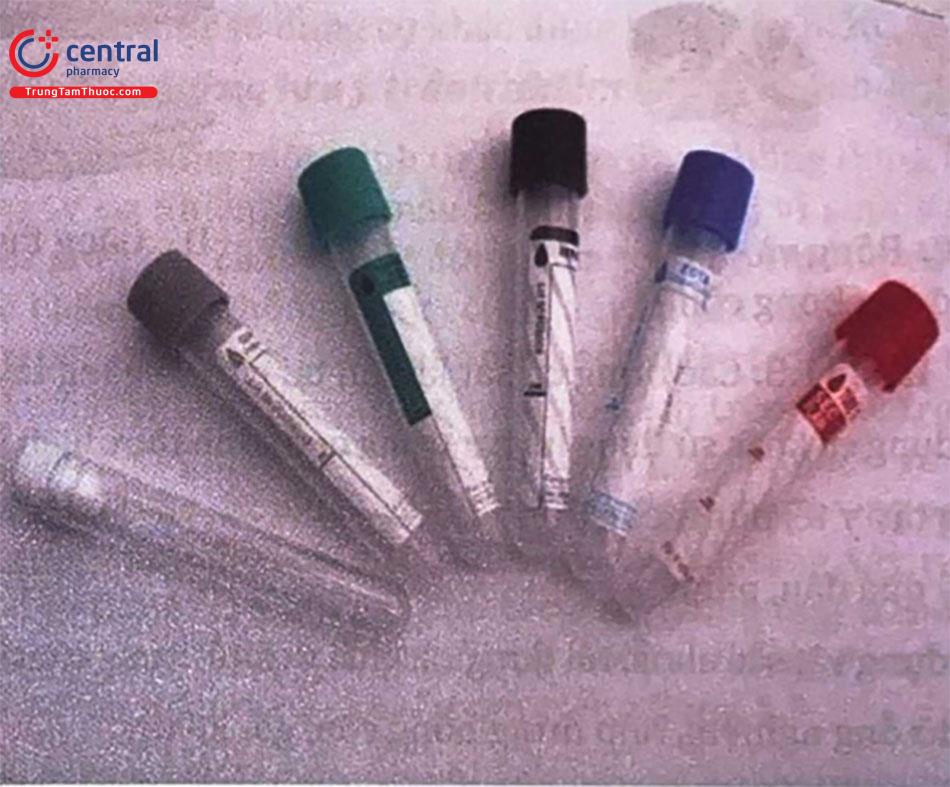
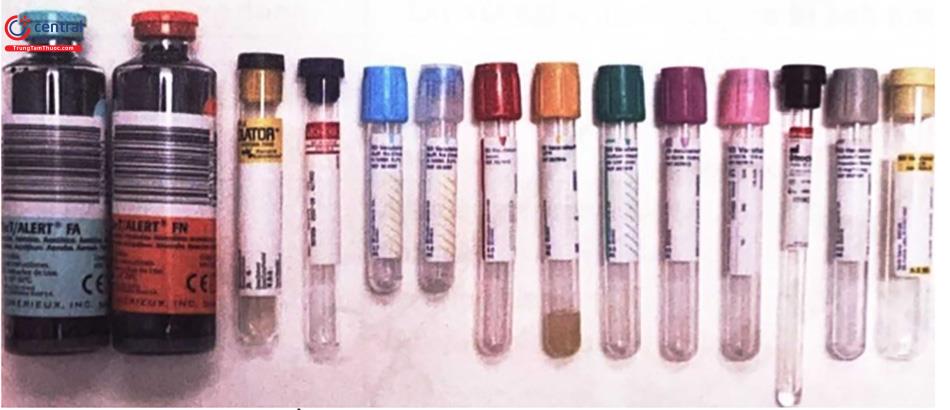
Hình 4. Các loại ống nghiệm trong phòng xét nghiệm
.jpg)
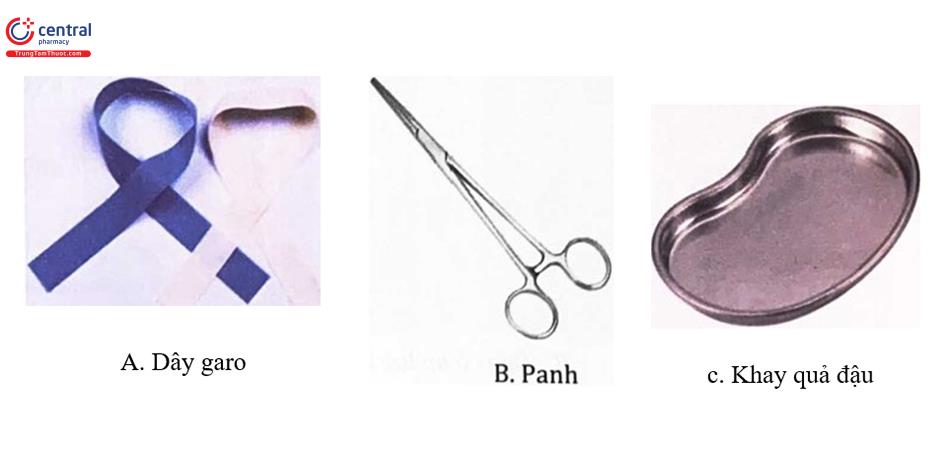
Một số dụng cụ khác sử dụng hỗ trợ trong quá trình thực hiện lấy mẫu bệnh phẩm.
- Găng tay y tế, bông, cồn 70°.
- Khay quả đậu, panh.
- Hộp đựng vật sắc nhọn, túi đựng rác thải y tế, túi đựng rác thải thông thường
- Giá đỡ ống nghiệm, hộp đựng bông cồn, gối kê tay.
- Mã vạch, bút dạ kính, urgo...

2.1.5 Thứ tự lấy máu và những lưu ý tránh nhiễm chéo chất chông đông
Thứ tự lấy máu theo đúng một trình tự các loại ống, chống đông là bước quan trọng nhắm giảm nguy cơ nhiễm chéo mẫu bệnh phẩm bởi vi sinh vật (ví dụ, cấy máu) và nhiễm chéo giữa các chất chống đông, dẫn tới ảnh hưởng đến một số xét nghiệm. Việc nhiễm chéo chất chống đông có thế xảy ra khi chất chống đông trong ống chạm vào kim trong quá trình lấy máu tĩnh mạch hoặc trong quá trình chuyển từ ống tiêm. Sau đó, chất chống đông trong máu có dính trên hoặc trong kim tiêm có thể được chuyển sang ống tiếp theo. Nhiễm EDTA gây ra nhiều vấn đề hơn bất kỳ chất chống đông nào khác. Heparin gây ít ảnh hưỏTig nhất trong xét nghiệm vì nó cũng xuất hiện trong máu một cách tự nhiên. ít có khả năng xảy ra hiện tượng nhiễm chéo chất chống đông hơn khi giữ cho các chất trong ống tránh xa kim. Các xét nghiệm thông thường bị ảnh hưởng bởi sự nhiễm chống đông được liệt kê trong Bảng 2. Thứ tự lấy máu theo khuyến cáo trong Bảng 3.
| Nhiễm chất chống đông | Các xét nghiệm có nguy cơ bị ảnh hưởng |
| Citrate | Alkaline phosphatase (ALP) Calcium Phosphorus |
| EDTA | Alkaline phosphatase (ALP) Calcium Creatine kinase (CK) Thromboplastin bán phần Kali Protime Điện giải đồ Natri |
Heparin (tất cả các dạng) | Thời gian hoạt hóa cục máu đông Acid phosphatase Calcium (trong một số phương pháp nhất định) Thromboplastin bán phần Protime Lithium (các loại lithium) |
| Oxalate | Acid phosphatase Alkaline phosphatase Amylase Calcium Lactate dehydrogenase (LDH) Thromboplastin bán phần Kali Protime Hình thái tế bào hồng cầu |
| Silica (tăng hoạt hóa đông máu) | Thromboplastin bán phần Protime |
| NaF | Natri Ure |
| Thứ tự lấy mẫu | Màu nắp ống | Giải thích cho việc lẩy đúng thứ tự |
| 1. Ống vô trùng | SPS màu vàng Lọ chứa mẫu vô trùng | Hạn chế tối thiếu nguy cơ nhiễm vi sinh vật |
| 2. Ống đông máu (citrat) | Màu xanh lam nhạt | Bởi vì tất cả các chất chống đông khác ảnh hưởng tới xét nghiệm đông máu |
| 3.1. Ống không chứa chất chống đông | Đỏ | Ngăn nhiễm chéo chất chống đông vào các ống khác phía sau |
| 3.2. Ống có chứa chất tăng hoạt hóa cục đông hoặc tách huyết thanh | Đỏ | Sử dụng sau các ống đông máu vì các hạt silica hoạt hóa qua trình đông máu và ảnh hưởng đến xét nghiệm đông máu. Nhiễm các hạt hoạt hóa cục đông có thề gây ảnh hưởng tới các chất chông đông khác. |
| 4. Ống Heparin | Màu xanh lá cây | Heparin ảnh hường đến các xét nghiệm đông máu và sử dụng để lấy mẫu huyết thanh; ít gây nhiễu nhất trong các thử nghiệm khác ngoài các thử nghiệm đông máu |
| 5. Ống EDTA | Màu tím | Hầu hết sự ảnh hưởng nhiễm chéo đều làm tăng nồng độ Na+, K+ và làm giảm nồng độ Fe, Ca; tăng kết qủa PT, PTT |
| 6. Ống Oxalate/ fluoride | Màu xám | Tăng nồng độ Na+, K+, nên sau ống xét nghiệm công thức máu vì oxalate làm phá hủy màng tế bào, dẫn tới kết quả hình thái hồng càu bất thường. Oxalate cũng tác động đến một số phản ứng enzym. |
2.1.6 Quá trình thực hiện lấy máu trên bệnh nhân
Quy trình lấy máu tĩnh mạch phụ thuộc: sử dụng bộ dụng cụ lấy máu chân không ETS, hay kim bướm, hay bơm kim tiêm thông thường sẽ có các bước thực hiện cần thiết để có thể thu được những mẫu bệnh phấm máu tĩnh mạch đảm bảo chất lượng.
Chuẩn bị bệnh nhân
- Bệnh nhân thường được lấy máu vào buổi sáng, khi đã nhịn đói từ ít nhất 8 tiếng, lúc này nồng độ các chất phản ánh tương đối trung thực các thông số thực tế của bệnh nhân, đồng thời tránh các yếu tố có thể gây sai số.
- Nếu có thể cho bệnh nhân nên ngưng các loại thuốc trước khi làm xét nghiệm 2 - 3 ngày tránh các ảnh hưởng của thuốc lên các thông số xét nghiệm.
- Bệnh nhân không thực hiện tất cả các hình thức vận động nặng 24 - 48 giờ trước khi lấy máu. Bệnh nhân nên được nghỉ ngơi 15 - 20 phút trước khi lấy máu.
- Bệnh nhân được lấy mẫu bệnh phẩm ở tư thế thích hợp, thực hiện kiểm tra đối chiếu phiếu chỉ định xét nghiệm và bệnh nhân: tên, tuổi, mã số bệnh nhân, ngày tháng năm sinh... Cần xác định xem đã đúng bệnh nhân cần lấy máu hay không. Hỏi tên để bệnh nhân tự trả lời thông tin cá nhân. So sánh đối chiếu, xác định đúng bệnh nhân.
- Thông báo và giải thích cho bệnh nhân biết rõ về việc lấy máu xét nghiệm đối với bệnh nhân tỉnh, hoặc giải thích cho người nhà bệnh nhân đối với bệnh nhi và bệnh nhân hôn mê.
Lấy máu tĩnh mạch
Lấy máu tĩnh mạch bỏng bơm kim tiêm
- Hướng dần bệnh nhân ngòi hoặc nằm thoải mái trên giường, nếu là trẻ nhỏ phàỉ có người giữ đé trẻ khỏi giày giụa: Trấn an bệnh nhân, luôn đế tay bệnh nhân ở vị trí thoải mái.
- Lựa chọn ống nghiệm theo chỉ định.
- Dán mâ vạch vào phiếu chỉ định và các ống nghiệm tương ứng. Cách dán mã vạch lên ống nghiệm: Dán mã vạch từ trên xuống cách đáy ống nghiệm từ Is- 1,5 cm, dán mã thắng, không di lệch, không làm nhăn mã vạch, dán 1/3 nhãn ống và 2/3 thân ổng.
- Ghi tên, tuổi, mã số bệnh nhân, khoa phòng của người bệnh vào ống nghiệm.
- Sát khuẩn tay nhanh.
Mang găng sạch, luôn dùng găng sạch cho mỗi bệnh nhân và mỗi quy trình mói.
- Chọn vị trí lấy máu thích hợp. Nếu không quan sát thấy tĩnh mạch có thể dùng đàu ngón trỏ đế nắn tình mạch, ước lượng kích thước và độ sâu của tình mạch.
- Sát khuẩn vị trí lấy máu bằng bông cồn 70° hai lần, từ trong ra ngoài theo hình trôn ốc đường kính 10 mm, để da khô tự nhiên, không sờ vào vị trí lấy máu sau khi sát khuẩn.
- Buộc dây ga rô trên chỗ lấy máu 5-10 cm. Lưu ý: chỉ garo khi cần thiết, không nên garo quá lâu.
- Kiếm tra bơm kim tiêm: Xé vỏ bơm kim tiêm, kéo pít tông kiểm tra độ trơn của bơm tiêm.
- Đâm kim: Một tay căng da, một tay từ từ đưa kiêm nghiêng 15° - 30° qua da vào tĩnh mạch, kéo nhẹ bơm tiêm nếu thấy máu ở đốc kim chứng tỏ kim đã vào tĩnh mạch. Hạ thấp kim, luôn kim song song với mặt da đến 1/2 chiều dài kim.
- Tháo dây garo, kéo nhẹ pít tông lấy đủ lượng máu cần thiết, tránh tạo bọt khí.
- Rút kim nhanh, một tay căng da, đặt bông khô lên vị trí lấy máu, băng urgo cầm máu cho bệnh nhân.
- Tháo kim khỏi bơm tiêm cho vào hộp đựng rác thải sắc nhọn. Bơm máu vào với thành ống nghiệm một góc 45°. Bơm máu từ từ dọc theo thành ống nghiệm tránh vỡ hông cãu (nếu lấy máu có chất chống đông thì lắc nhẹ nhàng trong 30 giây).
- Đế tránh nhiễm chéo giữa những chất chống đông trong các ống và để giữ vô trùng, khi lấy máu khuyến cáo bơm máu vào các ống theo thứ thự như khuyến cáo Bảng 1.3.
- Xếp ống nghiệm đựng máu vào giá ống nghiệm theo đúng số thứ tự.
- Ghi đày đủ thông tin trên phiếu chỉ định xét nghiệm: thời gian lấy máu, thể tích lấy, loại xét nghiệm, người lấy.
- Thu dọn dụng cụ và phân loại rác thải theo quy định.
- Gửi bệnh phẩm và giấy chỉ định xét nghiệm đến phòng xét nghiệm. Lấy máu tĩnh mạch bằng ống chân không
- Thực hiện tương tự lấy máu bằng bơm kim tiêm đến bước garo.
- Kiểm tra bơm kim tiêm: Tháo phần chuôi kim lấy máu lắp vào tay cầm.
- Đâm kim: Một tay căng da, một tay từ từ đưa kiêm nghiêng 15° - 30° qua da vào tĩnh mạch. Dùng tay cố định tay cầm và lắp ống nghiệm vào tay cầm.
- Tháo dây garo khi thấy máu chảy vào ống nghiệm.
- Thay ống nghiệm tiếp theo khi máu ngừng chảy hoặc đã lấy đủ lượng máu.
- Tiếp tục lấy máu vào các ống nghiệm theo chỉ định cho đến ống nghiệm cuối cùng (nếu lấy máu có chất chống đông thì lắc nhẹ nhàng trong 30 giây). Thứ tự các ống nghiệm giống với lấy máu bằng bơm kim tiêm.
- Rút kim nhanh, một tay căng da, đặt bông khô lên vị trí lấy máu, băng urgo cầm máu cho bệnh nhân.
- Lắc đều nhẹ tay với ống nghiệm vừa lấy.
- Xếp ống nghiệm đựng máu vào giá ống nghiệm theo đúng số thứ tự.
- Tháo kim khỏi tay cầm cho vào hộp đựng rác thải sắc nhọn.
- Ghi đầy đủ thông tin trên phiếu chỉ định xét nghiệm: thời gian lấy máu, thể tích lấy, loại xét nghiệm, người lấy.
- Thu dọn dụng cụ và phân loại rác thải theo quy định.
- Gửi bệnh phẩm và giấy chỉ định xét nghiệm đến phòng xét nghiệm.
Lấy máu mao mạch
Thường lấy ở đầu ngón tay áp út hoặc gót chân, thể tích lấy < 0,5 mL máu. Đầu ngón tay áp út (ít vận động) được dùng trong chỉ định khí máu, test nhanh tại chỗ. Gót chân dùng trong sàng lọc sơ sinh xác định một số rối loạn bẩm sinh: thiểu năng tuyến giáp, thiếu hụt men G6PD...
- Làm ấm vị trí lấy máu đế mao mạch hóa động mạch.
- Dùng bông thấm cồn 70° sát khuẩn vị trí lấy máu.
- Nắm nhẹ nhàng và căng vừa phải đầu ngón tay. cầm kim chích đâm nhanh vào cạnh đầu ngón tay sâu 2 mm. Vùng này ít gây sự đau đớn đối với bệnh nhân hơn ở vùng đỉnh và bề mặt đầu ngón tay vì ít có các dây thần kinh cảm giác.
- Lau bỏ giọt máu đầu bằng bông vì có thể bị lẫn dịch tố chức.
- Lẩy máu từ giọt thứ 2 trở đi, làm đầy ống mao quản để tránh bọt khí và mẫu máu bị đông. Không nên nắn bóp vì sẽ lẫn nhiều dịch tố chức vào mẫu máu, vuốt nhẹ nhàng các đầu ngón tay cách xa vị trí lấy máu.
- Nhanh chóng nút kín các đầu ống mao quản khi lấy đủ lượng máu cần thiết.
- Đặt ống mao quản vào dụng cụ chứa mẫu thích hợp. Ghi nhãn với tối thiếu 2 thông tin bệnh nhân: họ tên, mã số bệnh nhân.
- Ghi đầy đủ thông tin trên phiếu chỉ định xét nghiệm: thời gian lấy máu, thể tích lấy, loại xét nghiệm, người lấy.
- Gửi bệnh phẩm và giãy xét nghiệm đến phỏng xét nghiệm trong vòng 15 phút sau lấy máu. Nếu trì hoãn, phải đặt trong hộp bảo quản lạnh 2 - 8°c và vận chuyến trong vòng 1 giờ sau lấy mẫu.
Lấy máu động mạch
Thường lấy ở động mạch (ĐM) quay hoặc động mạch bẹn. Việc lấy máu động mạch tương đối phức tạp, có thể gây nguy hiểm cho bệnh nhân vì vậy chỉ những bác sỹ, kỹ thuật viên có kinh nghiệm mới nên tiến hành thủ thuật này. Khi lấy máu động mạch chỉ nên dùng bơm tiêm để máu tự động chảy vào bơm tiêm, không nên tạo áp lực âm trong bơm tiêm. Bơm tiêm cần được tráng đều bằng heprin Lấy máu phải đảm bảo không có bọt khí, trộn đều nhẹ nhàng để tránh bị đông (không được lắc mạnh).
Thực hiện nghiệm pháp Allen trước khi lấy máu:
- Ãn chặt hai vị trí động mạch quay và động mạch trụ, lòng bàn tay có dấu hiệu thiếu máu. Khi bỏ vị trí ấn ĐM trụ, giữ tay ấn ĐM quay, bàn tay trở lại hông hào thời gian dưới 5 phút là tuần hoàn tốt, cho phép lấy máu, nếu bàn tay không hồng hào trở lại, không được phép lấy máu tại vị trí động mạch quay bên tay đó.
- Mang khẩu trang, rửa tay, mang găng.
- Xác định vị trí lấy máu. Sát khuẩn vị trí lấy máu nhiều lần.
- Dùng kim nhỏ đưa vào ĐM góc nghiêng 30 - 45° tại nếp gấp cổ tay. Đẩy kim vào từ từ đến khi máu đày ống, rút kim ấn chặt 5 phút sau đó băng ép.
- Ghi nhãn ống xet nghiệm.
- Dọn dẹp dụng cụ, rửa tay, ghi hồ sơ.
- Vận chuyển ngay mẫu bệnh phấm đến phòng XN để phân tích. Nếu mẫu chưa được vận chuyển ngay, mẫu phải được bảo quản và vận chuyển đến phòng xét nghiệm ở điều kiện 1- 4°c (có thể sử dụng hộp xốp chứa đá), mẫu có thể ổn định trong 1 giờ.
2.1.7 Tách các thành phân của máu
.jpg)
Để tách huyết thanh, máu sau khi lấy vào ống không chứa chất chống đông cần để nhiệt độ phòng trong cho quá trình đông máu xảy ra; đem ly tâm 3000 - 3500 vòng/phút, trong 5 phút, sau đó ly tâm tiếp để nhanh chóng tách được huyết thanh ra khỏi cục máu đông. Nếu cần thiết, sử dụng pipet bán tự động tách phần dịch nổi ở trên cho vào ống nghiệm.
Máu sau khi lấy vào ống có chất chống đông mang ly tâm ngay 3000 - 3500 vòng/phút, trong 5 phút, chắt dịch trong ở trên thu được huyết tương. Huyết tương là bệnh phẩm phổ biến trong phòng xét nghiệm hơn so với huyết thanh. Tuỳ từng loại xét nghiệm có thể dùng các chất chống đông khác nhau:
2.1.8 Bảo quản bệnh phẩm
Máu lấy xong nên ly tâm ngay để tách riêng các thành phần hữu hình. Không để máu toàn phần quá 4 giờ. Huyết thanh, huyết tương sau khi tách được, cần làm xét nghiệm ngay, nếu chưa thực hiện xét nghiệm bảo quản ở nhiệt độ phòng/4 giờ, 4°C/24 giờ hoặc -24°C/ 24 giờ.
Các bệnh phẩm khi lấy từ tủ đông lạnh ra phải để cho tan đông từ từ và lắc đều nhẹ nhàng trước khi làm xét nghiệm.
Huyết thanh để 4 - 8°C/5 ngày hoạt lực enzym giảm = 10%. Riêng LDH hoạt lực giảm nhanh. Xét nghiệm bilirubin nên làm trên huyết thanh tươi, nếu chưa làm được ngay thì phải cất huyết thanh vào tủ lạnh, để tối, tránh ánh sáng. Một số xét nghiệm đặc biệt, các xét nghiệm hormon cần xem các tài liệu hướng dẫn bảo quản riêng.
2.1.9 Các yếu tố ảnh hưởng đến kết quả xét nghiệm
Quá trình xét nghiệm được chia thành 3 giai đoạn: trước, trong và sau xét nghiệm, biến thiên kỹ thuật bao gồm các sai sót về mặt kỹ thuật ở cả 3 giai đoạn nói trên. Tuy nhiên trong phạm vi bài sẽ đề cập tới các biến thiên kỹ thuật ở giai đoạn trước xét nghiệm (do lấy, xử lý, bảo quản và vận chuyển bệnh phấm). Các thay đối này ứng với độ lặp lại của xét nghiệm biếu thị dưới dạng hệ số biến thiên. Đối với
nhiều xét nghiệm hệ số biến thiên kỹ thuật chấp nhận được là dưới 5%, đối với xét nghiệm khác như enzym dưới 10%.
Biến thiên sinh học bao gồm biến thiên cá thể và biến thiên quần thể.
Biến thiên kỷ thuật
Tư thế của bệnh nhân:
Tư thế khác nhau của bệnh nhân khi lấy máu (nằm hay đứng) cũng có thể làm thay đổi nồng độ một số chất trong máu. Để lấy máu của bệnh nhân ngoại trú tốt nhất bệnh nhân cần được ngồi nghỉ 10 phút trước khi lấy máu. Thay đổi nông độ của một số chất trong máu khi thay đổi tư thế bệnh nhân từ nằm sang ngôi có thể làm giảm thể tích huyết tương lên tới 10%. Do đó hầu hết nồng độ các chất khuếch tán tự do không ảnh hưởng bởi thay đồi tư thế, trong khi các chất gắn với protein nông độ đều giảm ví dụ như: aldosteron, bilirubin, các tế bào máu, calci, cholesterol, sắt, protein toàn phần và renin.
- Thay đổi từ nằm sang đứng có thể tăng các loại lipid máu: 15% cholesterol toàn phần và HDL và khoảng 10-12% nồng độ triglycerid. Nhưng bệnh nhân suy tim hoặc bệnh lý về gan biểu hiện tăng lipid máu rõ rệt hơn.
- Renin và aldosteron thay đổi chậm nhưng có thể tăng gấp đôi sau một giờ. Trước khi lấy mẫu bệnh phẩm thực hiện các xét nghiệm này cần để bệnh nhân nằm ít nhất 30 phút.
- Bệnh nhân đứng ít nhất 15 phút, hồng cầu cao hơn trạng thái bình thường và ngược lại với tư thế nằm (do tình trạng thiếu máu giả tạo liên quan đến tư thế).
Do đó để giải thích đúng các kết quả xét nghiệm, cần phải thu thập các mẫu bệnh phẩm cùng một tư thế. Hoặc tối ưu nhất là thiết lập được giải tham chiếu tương ứng.
Thời gian gara:
Sự cô đặc máu ở thời gian 3 phút sau khi buộc garó cao hơn so với thời điểm 1 phút Ở thời điểm 3 phút, sự ứ đọng máu làm tăng sự phân hủy yếm khí glucose máu và làm giảm pH máu cùng sự tích tụ của lactat. Hiện tượng thiếu oxy dẫn đến sự giải phóng kali từ tế bào. Có sự tăng nồng độ ion Ca++ và Mg++ ở máu trong thòi gian buộc garô. Tốt hơn hết là cởi garô ngay sau khi kim đã vào tĩnh mạch. Nếu buộc garo quá 6 phút gây tăng ALT, AST, ALP, GGT, LDH, Albumin, protein toàn phần... Giảm kali, Cl, glucose, creatnin, ure...
Thời gian nhịn ăn trước khi lấy máu:
Thời gian nhịn ăn kéo dài 48h làm tăng nồng độ bilirubin huyết thanh và làm giảm nông độ albumin, prealbumin và transferrin. Nên lẩy máu ở thời gian đói qua đêm, thường là 12h trước khi lấy máu vì nồng độ triglycerid máu có thể bị ảnh hưởng bởi bữa ăn ở thời điểm 9 giờ trước khi lấy máu. Sau khi ăn một số chất như glucose, cholesterol, triglycerid, các acid amin, sắt... tăng lên trong máu.
Chât chống đông và chất báo quán:
- Tuỳ từng loại xét nghiệm khác nhau mà dùng các chất chống đông thích hợp. Ví dụ:
+ Glucose dùng natri florua.
+ Đông máu dùng natri citrat...
+ pH, điện giải, calci, Magie, sắt, protein toàn phần... dùng heparin.
+ Công thức máu dùng EDTA.
- Nếu dùng không đúng loại sẽ dẫn đến sai số. Ví dụ:
+ Calci, kali: không dùng chất chống đông là EDTA.
+ Đông máu không dùng heparin.
Lưu giữ máu:
Khoảng thời gian từ khi lấy máu tới khi máu được xét nghiệm (thời gian lưu giữ máu) làm thay đổi nồng độ chất của máu. Máu để đo khí máu, nếu không được giữ trong nước đá sẽ bị giảm chất lượng đáng kể trong vòng 15 phút Lưu giữ máu ở nhiệt độ phòng sẽ làm giảm đáng kể pH, CO2, và PO2. Glucose nếu không tách huyết thanh hoặc huyết tương ngay sẽ giảm 100 mg/L (0,56 mmol/L) mỗi giờ tại 25°C (17% & tốc độ giảm nhanh hơn trong trẻ sơ sinh, trẻ đẻ non và trong bệnh bạch cầu cấp vì ở các tế bào hồng cầu trẻ sơ sinh, trẻ đẻ non, tế bào máu trắng các hoạt động trao đổi chất tăng rõ rệt. Lưu giữ máu trong nước đá hoặc trong tủ lạnh (0 - 4°C) làm chậm quá trình giảm chất lượng đi 10 lần.
Tan huyết:
Nồng độ của một số chất trong hồng cầu và trong huyết tương rất khác nhau nên khi mẫu máu bị vỡ hồng cầu, ngoài việc các phản ứng so màu bị ảnh hưởng (Hemoglobin tăng có gây nhiễu trong một vài phương pháp xét nghiệm mà độ hấp thụ được được đo ở bước sóng gần với độ hấp thụ tối đa của oxyhemoglobin 410, 540, 580 nm), một số chất có thể tăng một cách giả tạo, có thể làm cho các thầy thuốc chuẩn đoán sai, dẫn đến những xử trí sai lệch có hại cho người bệnh. Vì vậy, nếu bắt buộc phải xét nghiệm trên mẫu máu vỡ hồng cầu, phải ghi vào phiếu tình trạng mẫu máu để tránh những chuẩn đoán và xử lý sai đáng tiếc.
Ví dụ: K+, AST, LDH trong hồng cầu cao hơn trong huyết thanh nhiều lãn, do đó nếu máu bị vỡ hồng cầu (2,5 g/L) thì xét nghiệm: K+ tăng 14%, AST tăng 35%, LDH tăng 149%
Tác dụng của tiêm truyền:
- Nông độ glucose máu có thể tăng rất cao nếu máu được lấy ở cùng tay đang được truyền glucose. Vì vậy bao giờ máu cũng phải được lấy ở tay khác với tay đang truyền.
- Tiêm bắp, hoặc các thủ thuật có thể gây tổn thương cơ và làm tăng nồng độ CK, LDH. Nếu bệnh nhân có thủ thuật tiêm bắp, cần lấy máu trước khi tiêm hoặc sau tiêm bắp một giờ.
Biến thiên sinh học
Biến thiên cá thể:
Do nhịp điệu sinh học, quá trình trưởng thành, trạng thái dinh dưỡng. Muốn xác định điều kiện sinh học cá thể, người ta xác định liên tiếp một thông số trên cùng một người trong một thời gian. Thường chỉ được thực hiện trên rất hiếm người vì khó thuyết phục nhiều người chịu xét nghiệm lặp đi lặp lại nhiều lần trong ngày hoặc trong nhiều ngày. Biến thiên quần thể: là những trị số của một thông số sinh học ở những người khác nhau thường khác nhau, quần thể càng không thuần nhất thì sai khác càng lớn. Có nhiều yếu tố ảnh hưởng: tuổi, giới, hoạt động dinh dưỡng... Những thông số sinh học nào càng chứa nhiều yếu tố ảnh hưởng càng có hệ số biến thiên sinh học quần thể càng lớn.
Giới tính
Nông độ của một số chất trong máu và nước tiểu có khác nhau giữa nam và nữ khỏe mạnh, bình thường. Ví dụ nữ có nông độ Hemoglobin máu bình thường thấp hơn nam. Có sự khác nhau hiển nhiên giữa nam và nữ về nồng độ các hormon sinh dục. Khối lượng cơ của nam giới lớn hơn nên creatinin ở nam cũng cao hơn nữ. Một số thành phần có nồng độ thay đổi không đáng kể theo giới như urê, glucose, phosphatase kiềm. Nồng độ của một số chất và hoạt độ của một số enzym giữa nam và nữ (trong máu hoặc huyết thanh).
- Phụ nữ có thai: albumin, calci, Vitamin C, globulin miễn dịch, hồng cầu và urê giảm, phosphatase kiềm tăng 2 đến 3 lần do xuất hiện phosphatase kiềm nhau thai, alpha fetoprotein, a-antitrypsin, amylase, cholesterol, triglycerid, cortisol cũng tăng.
- Chu kỳ kinh nguyệt và mãn kinh ở phụ nữ: trong chu kỳ kinh nguyệt có những thay đỗi về hormon (FSH, LH, Progesterone, estrogen và aldosteron), acid amin, Acid Ascorbic, cholesterol, creatinkinase và magiê. Khi mãn kinh phosphatase kiềm, calci, phosphate và uric tăng, estrogen và 17-cetosteroid giảm.
Tuổi
Nồng độ của một số chất, thành phẵn trong máu thay đổi tùy theo tuổi. Ví dụ, công thức máu, giá trị hồng cầu (red blood cell - RBC) và bạch càu (white blood cell - WBC) ở trẻ sơ sinh thường cao hơn ở người lớn; công thức bạch càu có sự khác nhau phụ thuộc lứa tuổi từ khi mới sinh cho đến tuổi dậy thì, trưởng thành. Một số chức năng sinh lý như chức năng thận giảm dần theo tuổi. Nồng độ hormon cũng có thể thay đổi theo tuổi. Những thay đổi này nếu không được lưu ý có thể dẫn đến nhầm lẫn khi biện luận kết quả xét nghiệm.
Ví dụ: Trẻ sơ sinh có nồng độ:
- Bilirubin, phosphatase kiềm bình thường cao hơn so với người lớn.
- Ure, creatinin huyết tương, protein toàn phần, glucose máu thấp hơn so với người lớn (do thể tích huyết cau tăng ở trẻ sơ sinh nên glucose được chuyến hóa nhanh chóng).
- Nồng độ một số chất cũng thay đổi theo tuổi từ người trưởng thành đến người cao tuổi, rõ rệt nhất là sự thay đổi của creatinin, cholesterol và phosphatase kiềm huyết thanh: creatinin vắ choíesterol huyết thanh bình thường ở người cao tuổi cao hơn so với ở người trưởng thành.
- Một số hormon, ví dụ estrogen và hormone tăng trưởng (grovvth hormon - GH) giảm khi tuổi cao.
Chế độ ăn - uống
Một số chất trong máu phụ thuộc vào số lượng, loại thức ăn, đô uống và khoảng thời gian từ lúc ăn cho tới thời điểm được lấy mẫu. Bệnh nhân thường được yêu cầu nhịn ăn từ 8 đến 12 giờ, tùy thuộc xét nghiệm.
Bệnh nhân có thể uống nước trước thời điểm lấy mẫu bệnh phẩm, trừ một số trường hợp thực hiện thủ thuật (ví dụ nội soi gây mê cần đặt nội khí quản). Hạn chế uống nước khi nhịn ăn có thể dẫn tới tình trạng mất nước, cô đặc máu, ảnh hưởng tới một số xét nghiệm; đồng thời cũng có thể làm việc lấy máu trở nên khó khăn hơn.
- Amoniac, ure và acid uric có thể tăng ở những bệnh nhân có chế độ ăn giàu đạm.
- Nồng độ cortisol và ACTH tăng sau khi uống đồ uống chứa caffein.
- Nồng độ glucose máu tăng đột ngột khi ăn các thức ăn chứa thành phần carbohydrat, hoặc các đồ ăn, uống chưa nhiều đường, tuy nhiên đường máu sẽ trở lại bình thường trong vòng 2 giờ nếu bệnh nhân không mắc các bệnh lý rối loạn chuyển hóa glucose. Ngoài ra, nồng độ Insulin cũng tăng trong những trường hợp trên.
- Nồng độ Hemoglobin và thăng bằng điện giải có thể bị giảm khi uống quá nhiều nước, hoặc các loại đồ uống.
- Nồng độ lipid máu tăng sau khi ăn các thực phẩm như: bơ thực vật, phô mai, kem... Lipid trong máu có thể tôn tại đến 12 giờ, đó là lý do nên xét nghiệm triglycerid (một loại lipid) lúc bệnh nhân nhịn đói 12 giờ. Khi đói, rất hiếm khi huyết thanh hoặc tuyết tương của bệnh nhân bị đục. Với những trường hợp bệnh nhân không nhịn ăn trước khi lấy máu hoặc mắc các rối loạn chuyến hóa lipid, nồng độ lipid trong máu tăng cao và khiến cho huyết tương hoặc huyết thanh sau ly tâm đục.
- Nồng độ triglycerid, glucose máu, các enzym gan và các thông số chức năng gan khác tăng trong các trường hợp nghiện rượu mạn tính, hoặc uống một lượng lớn đồ uống có cồn trong thời gian gần.
- Khi mất nước do nôn mửa hoặc tiêu chảy kéo dài dẫn tới cô đặc máu, gây bất thường các thành phần hông cầu, các enzym, Sắt (Fe), calci, natri và các yếu tố đông máu.
Tập luyện về thể lực
Có thể gây tăng một số thành phần trong máu tùy thuộc vào tình trạng thể chất, thời gian và cường độ hoạt động. Tuy nhiên các hoạt động thế lực từ vừa phải đến gắng sức đều gây ảnh hưởng các nồng độ một số thông số và các sẽ sớm trở về bình thường khi dừng tập luyện. Ví dụ một số thành phần thay đổi khi có tập luyện thế lực.
- pH và PaCOz máu động mạch giảm.
- Tập luyện thế lực có thể gây ra sự thay đổi đáng kể về hoạt động enzym của cơ và một số thành phẵn như creatin phosphokinase (CK), Creatinin, glucose, insulin, acid lactic.
- Khi hoạt động thể lực mạnh, đột ngột, nồng độ cholesterol có thể tăng trên 6% và vẫn tăng cao đến tận 1 giờ sau khi đã dừng. Nồng độ kali cũng tăng cao, tuy nhiên sẽ trở về bình thường khi dừng hoạt động mạnh một vài phút.
- Hemoglobin niệu có thể xuất hiện sau khi luyện tập nặng, ví dụ sau khi chạy đường dài, đua ngựa và tất cả những quá trình luyện tập nặng về thể lực. Sự luyện tập nặng kéo dài cũng dẫn đến sự tăng đáng kể một số hormon trong đó có adrenalin và những hormon sinh dục. Sự gia tăng đáng kể số lượng cụm tiểu cầu ở các vận động viên chạy đường dài cũng đã được ghi nhận.
- Haptoglobin, transferin và ure tăng trong máu sau hoạt động thể lực cùng với LDH.
Stress
- Cảm xúc mạnh như lo lắng, sợ hãi hoặc chấn thương có thể gây ra sự gia tăng bạch cầu nhất thời (tồn tại trong thời gian ngắn). Ví dụ, các nghiên cứu về trẻ sơ sinh quấy khóc đã chứng minh số lượng bạch cầu tăng rõ rệt, số lượng bạch cầu (WBC) này trở lại bình thường trong vòng 1 giờ sau khi ngừng khóc. Do đó, mẫu WBC trên trẻ sơ sinh lý tưởng là được lấy sau khi trẻ đã ngủ hoặc nghỉ ngơi yên tĩnh ít nhất 30 phút. Nếu mẫu máu được thu thập trong khi trẻ sơ sinh đang khóc, cần được ghi nhận thông tin.
- Làm giảm nồng độ sắt; tăng nông độ hormone vỏ thượng thận (ACTH), catecholamine và cortisol. Các hormone khác có thể bị ảnh hưởng bao gồm aldosterone, TSH, và GH ở trẻ em. Vì vậy phải chú ý trạng thái tâm lý của bệnh nhân khi lấy máu nhất là với những bệnh nhân quá lo lắng.
Nhiệt độ:
- Lấy máu lúc bệnh nhân đang sốt: pH giảm, pCO2, pO2 tăng và ngược lại.
- Sốt làm giảm glucose máu dẫn tới tăng nồng độ insulin, glucagon. Sốt cũng làm tăng nông độ cortisol và làm ảnh hường tới nhịp sinh lý ngày đêm của hormon này.
Nhịp điệu ngày đêm:
Nồng độ của nhiều thành phần trong máu thường thay đổi hoặc dao động trong ngày hoặc theo chu kỳ sinh học. Các yếu tố đóng vai trò trong sự thay đổi trong ngày bao gồm tư thế, hoạt động, ăn uống, ánh sáng ban ngày và ban đêm, thức hay ngủ... Ví dụ:
- Melatonin bị ảnh hưởng bởi ánh sáng; tăng vào ban đêm, khi trời tối và giảm vào ban ngày.
- Renin và hormone kích thích tuyến giáp (TSH) tăng cao nhất thường vào những giờ đầu của buổi sáng trong khi ngủ.
- Trong khi nồng độ cortisol cao nhất thưòng vào buổi sáng, khoảng 8 giờ sáng.
- Các thành phần máu khác biểu với nồng độ cao nhất xảy ra vào buổi sáng bao gồm aldosterone, bilirubin, cortisol, hemoglobin, insulin, sắt, kali, testosteron và hồng cầu.
- Số lượng bạch cầu ái toan, nồng độ creatinin, glucose, hormon tăng trưởng (GH), triglycerid và phosphat trong máu thường thấp nhất vào buổi sáng.
- Sự thay đổi trong ngày có thể rất lớn. Ví dụ, nồng độ cortisol, TSH và sắt có thể chênh lệch nhau từ 50% trở lên giữa buổi sáng và buổi chiều muộn (khoảng 8 giờ sáng - 8 giờ tối).
Thuốc:
Tùy thuộc vào cơ chế tác động và tác dụng phụ của thuốc lên chức năng sinh lý của cơ thể, một số thuốc có ảnh hưởng đến các chất phân tích trong máu. Tốt nhất là ngưng thuốc một vài ngày trước khi lấy máu làm xét nghiệm (trừ những nhóm thuốc điều trị bắt buộc hàng ngày như điều trị tăng huyết áp, đái tháo đường...). Do đó người lấy mẫu bệnh phẩm có vai trò quan trọng trong việc khai thác tiền sử dùng thuốc của bệnh nhân và ghi chú thông tin trước lấy mẫu.
- Nhiều nhóm thuốc gây độc và tổn thương tế bào gan, dẫn tới tăng các enzym gan như: AST, ALP, LDH và giảm sản xuất các yếu tố đông máu. Erythromycin và Acetaminophen (Paracetamol) là ví dụ khi sử dụng không đúng liều lượng dẫn tới tổn thương gan, tăng ALT và bilirubin bất thường.
- Các loại thuốc gây nghiện (opiat) như Morphin làm tăng cả enzym gan và tụy.
- Thuốc tranh thai cũng có thể ảnh hưởng tới nhiều xét nghiệm, ví dụ: tăng tốc độ máu lắng, giảm nồng độ Vitamin B12...
- Steroid và thuốc lợi tiểu có thể gây viêm tụy và tăng amylase, Lipase máu. Thuốc lợi tiểu Thiazide làm tăng nồng độ calci, glucose và giảm natri, kali máu.
- Dùng Lithium, Propanolon có thể làm xét nghiệm calci máu bị giảm.
- Một số thuốc đông y, tây y có thể gây tăng nồng độ ALT, nếu ngừng thuốc, xét nghiệm sẽ trở về bình thường.
Vàng da
Tình trạng đặc trưng của tăng bilirubin trong máu (sản phẩm thoái hóa của hòng càu), dẫn tói huyết thanh, huyết tương có màu vàng nâu bất thường. Dần tới ảnh hường hàu hết các xét nghiệm thực hiện bằng phương pháp đo quang (hầu hết xét nghiệm hóa sinh) và phương pháp so màu (ví dụ xét nghiệm tống phân tích nước tiểu).
Độ cao
Một số chất trong máu có sự thay đổi đang kê’ khi ở những vùng địa lý núi đôi, những vùng cao hơn so với mực nước biển. Càng lên cao, oxy trong không khí càng giảm, dẫn tới số lượng hồng cẵu (RBC), nồng độ hemoglobin và hematocrit càng cao. Nông độ protein phản ứng c (CRP) và acid uric cũng tăng, trong khi nồng độ creatinin niệu và renin huyết tương giảm.
Hút thuốc
Một số thành phần của máu bị ảnh hưởng bởi hút thuốc. Mức độ của những tác động này phụ thuộc vào số lượng thuốc lá hút.
- Những bệnh nhân hút thuốc trước khi lấy bệnh phẩm có thể bị tăng nông độ cholesterol, cortisol, glucose, hormon GH và triglycerid cũng như số lượng bạch cầu.
- Hút thuốc lá mãn tính thường dẫn đến giảm chức năng phổi và tăng số lượng hồng cẵu và nồng độ hemoglobin.
- Hút thuốc cũng có thể ảnh hưởng đến phản ứng miễn dịch của cơ thể, điển hình là làm giảm nồng độ của các globulin miễn dịch IgA, IgG và IgM nhưng làm tăng nồng độ IgE.
2.2 Nước tiểu
Đa phần việc mẫu nước tiểu bệnh nhân nội trú đều do các điều dưỡng lấy. Với bệnh nhân ngoại trú, nhân viên lấy mẫu bệnh phẩm phải giải thích rõ ràng, sử dụng ngôn từ dễ hiểu về các bước lấy mẫu bệnh phẩm nước tiểu.
2.2.1 Mẩu nước tiểu ngẫu nhiên
Mẩu nước tiểu ngẫu nhiên được coi là bệnh phẩm phổ biến trong phòng xét nghiệm vì tính thuận tiện, đơn giản, thường được sử dụng trong các xét nghiệm định tính, bán định lượng các thành phần trong nước tiểu.
Nước tiểu ngẫu nhiên là mẫu nước tiểu được lấy vào bất kỳ thời điểm nào trong ngày, tuy nhiên tốt nhất là lấy vào buổi sáng sớm khi mới ngủ dậy. Mầu nước tiếu này được tích tụ lâu trong bàng quang qua đêm nên không phụ thuộc vào chế độ ăn uống và sự hoạt động của cơ thể lúc ban ngày. Hơn nữa nước tiểu được cô đặc sau một đêm ngủ, các thành phần bất thường bệnh lý, hoặc vi khuẩn niệu sẽ có tỷ lệ cao nên dễ phát hiện.
- Chỉ định: Tổng phân tích nước tiểu, định tính protein niệu, vi khuẩn niệu và các thành phần hữu hình trong nước tiếu.
- Cách tiến hành: Sáng sớm, bệnh nhân vệ sinh bộ phận sinh dục-tiết niệu trước khi lấy nước tiếu. Đi tiếu bỏ phần đầu dòng, hứng nước tiểu giữa dòng vào 1 hoặc 2 ống nghiệm (theo yêu cầu) mỗi ống từ 5 - 10 mL gửi đến phòng xét nghiệm, không lẩy nước tiếu cuối dòng.
- Dụng cụ đựng nước tiểu phải sạch để không bị lẫn tạp chất và vỉ khuẩn lên men thổi.
- Các mẫu nước tiểu lấy xong nên làm xét nghiệm ngay trong 30 phút kể từ khi lấy mẫu. Nếu chưa có điều kiện làm ngay thì nên đậy kín, để nơi thoáng mát.
2.2.2 Nước tiểu 24 giờ
Nước tiểu 24 giờ là toàn bộ số lượng nước tiểu trong một ngày đêm (đủ 24 giờ). Một số xét nghiệm định lượng, nhất là đối với bệnh nhân đang được theo dõi, điều trị tiến hành lấy nước tiểu 24 giờ. Ví dụ: ure, creatinin, protein, cathecholamin.
Cách lấy nước tiểu 24 giờ:
- Chuẩn bị bình đựng nước tiểu sạch, tráng 5 mL dung dịch HCl đậm đặc để sát khuẩn (hoặc sử dụng một số chất bảo quản khác ví dụ Acid Boric...).
- Vệ sinh sạch bộ phận sinh dục-tiết niệu sạch sẽ.
- Ấn định vào một giờ nhất định: Ví dụ 7 giờ sáng bệnh nhân đi tiểu, bỏ bãi nước tiểu đầu, và bắt đầu ghi thời gian. Thu thập tất cả các bãi nước tiểu sau đó kể cả phần nước tiểu khi đi đại tiện (lưu ý dặn bệnh nhân nếu có cảm giác muốn đi đại tiện, cần lấy mẫu nước tiểu trước đó), 7 giờ sáng hôm sau đi tiểu làn cuối cùng vào bô sạch.
- Mẩu nước tiểu được bảo quản lạnh hoặc thùng đá lạnh và được đậy chặt, tránh bay hơi hoặc bội nhiễm.
- Đo thể tích mẫu nước tiểu (mL) tương ứng với thể tích nước tiểu 24h, ghi vào giấy xét nghiệm.
- Lấy một lượng nước tiểu đủ theo yêu cầu của khoa xét nghiệm. Sau đó gửi mẫu bệnh phẩm có tên, tuổi đúng với phiếu xét nghiệm. Trên phiếu xét nghiệm cần ghi:
+ Họ, tên bệnh nhân, mã số bệnh nhân.
+ Khoa, phòng, giường nằm.
+ Chỉ định xét nghiệm.
2.2.3 Bảo quản mẫu nưác tiểu
Các mẫu bệnh phẩm nước tiểu sau khi được lấy, cần đưa tới phòng xét nghiệm càng sớm càng tổt. Nếu chưa phân tích ngay thì có thể giữ nước tiểu ở 2 - 8° C/3 ngày hoặc -20°C lớn hơn 3 ngày.
Lưu ý: việc hướng dẫn bệnh nhân lấy đúng và đủ bệnh phấm nước tiểu là vô cùng quan trọng, nhằm đảm bảo chất lượng của mẫu nước tiểu ban đầu hạn chế bị bội nhiễm hoặc biến tính do bảo quản không đúng cách với mẫu nước tiểu 24 giờ.
2.3 Các dịch chọc dò
2.3.1 Dịch não tủy
Là lớp dịch ở trong các khoang dưới màng nhện bao bọc xung quanh não tủy, ờ trong ống nội tủy, não thất, bảo vệ cho trung ương thần kinh đổi với các biến đổi về áp lực, sang chấn. Thường là một chất lỏng trong suốt, không màu, có nhiều thành phần giống như huyết tương.
Mỗi thương tổn dù nhỏ của não tủy đều ảnh hưởng đến tính chất của dịch não tủy. Phân tích những biến đổi đó có thể chẩn đoán được một số bệnh về thần kinh, theo dõi sự tiến triển của bệnh.
Mẩu dịch não tủy do các bác sĩ lâm sàng có kinh nghiệm lấy mẫu, dịch não tủy được hứng trực tiếp vào các ống nghiệm có nấp xoáy và đảm bảo vô trùng. Lấy tối thiểu 0,5 mL dịch não tủy trong một ống nghiệm và thu thập 3 ống nghiệm riêng biệt
Thứ tự cho các xét nghiệm: ống thực hiện xét nghiệm hóa sinh, miễn dịch trước, ống thứ hai cho các xét nghiệm vi sinh và ống thứ ba phân tích các xét nghiệm tế bào bởi vì ít bị ảnh hưởng bởi các tế bào do thủ thuật chọc hút.
Dịch não tủy được bảo quản 4°c, vận chuyển ngay đến phòng thí nghiệm càng sớm càng tốt. Nếu trong vòng 24 giờ không thể vận chuyển đến phòng thí nghiệm, phải bảo quản dịch não tủy ở nhiệt độ âm sâu, tối thiểu là -20°C, dịch não tủy dùng cho phân lập virus bảo quản tốt nhất -80°C, đá khô hoặc nitơ lỏng.
2.3.2 Dịch khác
Bao gồm dịch màng phổi, dịch màng bụng, dịch màng tim, dịch khớp... Mầu dịch này do bác sỹ lâm làng chọc dò rồi cho vào 3 ống với thể tích 5 mL vào ống nghiệm sạch. Sau đó mẫu được gửi ngay đến phòng xét nghiệm càng sớm càng tốt.
3 Mẫu bệnh phẩm vi sinh
Việc giải thích các kết quả xét nghiệm vi sinh phụ thuộc phần lớn vào chất lượng của các mẫu bệnh phẩm. Do đó, việc quản lý thích hợp đối với mẫu bệnh phẩm vi sinh là vô cùng cần thiết cho chẩn đoán, điều trị, tiên lượng bệnh. Các hội chứng lâm sàng và tác nhân gây bệnh có thể liên quan đến không chỉ loại mẫu bệnh phẩm được lấy, mà còn có thể liên quan đến quy trình lấy, cách thức vận chuyển, bảo quản và xử lý mẫu bệnh phẩm; là thông tin hữu ích giúp các phòng xét nghiệm vi sinh có thể áp dụng các kỹ thuật xét nghiệm một cách hiệu quả hơn.
3.1 Một số nguyên tắc khi thực hiện lấy mẫu bệnh phẩm vi sinh
- Lấy mẫu bệnh phẩm dựa vào những vị trí có nhiều khả năng sẽ tìm thấy tác nhân gây bệnh.
- Lẩy bệnh phẩm vào thời điểm tối ưu (ví dụ: đờm vào buổi sáng sớm để tìm trực khuẩn lao).
- Lấy mẫu cấy trước khi dùng kháng sinh bất cứ khi nào có thể.
- Thu thập đủ thể tích mẫu bệnh phẩm. Lượng bệnh phẩm không đủ có thể thu được kết quả âm tính gia.
- Sử dụng thiết bị vô trùng và các kỹ thuật vô trùng đê thu thập mau bệnh phâm nhằm ngăn ngừa sự xâm nhập của vi sinh vật ngoại lai trong quá trình tiến hành lấy mẫu bệnh phẩm
- Ghi nhãn rõ ràng mẫu bệnh phẩm bao gồm thông tin cụ thể về vị trí lấy mâu (ví dụ: máu lấy qua lòng ống thông (catheter) tĩnh mạch trung tâm bên phải) và hoàn thiện đầy đủ quy trình.
- Xác định chính xác nguồn gốc của mẫu bệnh phẩm và/hoặc vị trí cụ thể để kỹ thuật viên phòng xét nghiệm có thể lựa chọn các phương pháp xử lý và môi trường nuôi cấy thích hợp.
- Nếu bệnh phẩm được lấy qua tổ chức da còn nguyên vẹn, trước tiên hãy làm sạch da bằng cồn 70%, sau đó là dung dịch iod (ví dụ như povidone-iod) hoặc kết hợp chlorxidine/cồn. Nếu sử dụng iod, loại bỏ Iod còn dư sau khi mẫu đã được thu thập.
- Hướng dẫn rõ ràng các bước, các lưu ý cho bệnh nhân trong các trường hợp họ phải tự lấy mẫu xét nghiệm (ví dụ, nước tiểu hoặc phân sạch) để thu được mẫu bệnh phẩm đảm bảo, đồng thời tránh gây tâm lý lo lắng, bất an ờ bệnh nhân.
- Vận chuyển bệnh phẩm tới phòng xét nghiệm càng sớm càng tốt. Bảo quản ở nhiệt độ phù hợp, trong các dụng cụ vận chuyển thích hợp.
- Tất cả các trường hợp tiếp xúc với bệnh nhân, càn phải chú ý đến việc vệ sinh tay và sử dụng các phương tiện bảo hộ cá nhân thích hợp (ví dụ như các bệnh lây truyền qua đường hô hấp như cúm, SARS-CoV-2...).
- Nắm rõ cách sử dụng và các vấn đề an toàn phòng xét nghiệm đối với một số loại trang thiết bị, dụng cụ để hạn chế những các sự cố gây ra bởi vật sắc nhọn gây tổn thương dẫn tới nguy cơ cao phơi nhiễm với các mẫu bệnh phẩm chứa vi sinh vật.
3.2 Lấy, bảo quản và vận chuyển mẫu bệnh phẩm vi sinh
3.2.1 Mẫu máu, dịch chọc dò, nước tiểu nuôi cấy
Lấy mẫu máu, các dịch chọc dò tương tự như thực hiện lấy mẫu xét nghiệm hóa sinh - miễn dịch. Tuy nhiên phải đảm bảo tuyệt đối vô khuẩn khi thao tác thực hiện lấy mẫu. Nếu không lấy được máu, dịch trong lần đầu, phải loại bỏ kim lấy mẫu và sử dụng kim lấy mẫu mới.
Mầu cây máu, nên lấy thời điểm bệnh nhân chưa sử dụng kháng sinh, đang trong cơn sốt. Nếu đã sử dụng kháng sinh, phải lấy vào thời điểm dừng thuốc ít nhât 24 giờ.
Sừ dụng các chai cấy máu chuyên dụng, sát khuẩn nắp chai trước khi thực hiện lẫy máu vào chai cấy.
Với mẫu nước tiểu nuôi cấy, phải hướng dẫn kỹ lưỡng bệnh nhân cách lẩy nước tiểu giữa dòng. Dặn bệnh nhân đi tiểu thẳng vào lọ nhựa, tránh không chạm vào bên trong hoặc vành của lọ nhựa để giảm thiểu nguy cơ lây nhiễm từ vi sinh vật tren dạ. Đoi VƠI những bệnh nhân ở bệnh viện hoặc bệnh nhân yếu có thể rửa cơ quan sinh dục ngoài bằng xà phòng và nước sạch để giảm nguy cơ lây nhiễm. Nếu xa phong va nước sạch không bảo đảm vệ sinh thì phải rửa bằng nước muối. Sau đó dùng gạc lau khô trước khi lấy mẫu.
3.2.2 Mẫu phân
Trong xét nghiệm vi sinh vật, mẫu phân rất có giá trị trong chẩn đoán. Mầu phân cần được thu thập càng sớm càng tốt ngay sau khỉ xuất hiện tiêu chảy (48 giờ/virus và 4 ngày/vi khuẩn), trước khi dùng kháng sinh, có thể thu thập hai đến ba lần trong các ngày khác nhau.
Đối với trẻ sơ sinh, có thể dùng tăm bông vô khuẩn đưa vào trực tràng để lấy phân. Nhưng nhìn chung, không khuyến cáo lấy mẫu phân bằng tăm bông phết trực tràng vì không đủ lượng bệnh phẩm để nuôi cấy và phân lập vi khuẩn.
Chuẩn bị dụng cụ
- Lọ đựng mẫu có nắp xoáy sạch, khô và không thấm nước.
- Để vận chuyển mẫu bệnh phẩm lấy bằng tăm bông trực tràng cần dùng môi trường vận chuyển.
Tiến hành
- Lấy khoảng 5 mL chất lỏng (khoảng 1 thìa cà phê) hoặc 5 gam chất rắn (bằng hạt lạc) cho vào lọ đựng mẫu, chú ý lấy phần phân nhầy máu vì có khả năng chứa nhiều vi khuẩn gây bệnh. Trường hợp bệnh nhân táo bón, bơm Glycerin để dễ đại tiện.
- Dán nhãn lọ hoặc tuýp đựng bệnh phẩm cốc có đầy đủ tên, tuổi, địa chỉ bệnh nhân hoặc mã hoá của bệnh nhân.
- Mang tới phòng xét nghiệm.
Phương pháp lấy mẫu phân trực tràng đối vời trẻ em
- Làm ẩm tăm bông bằng nước muối sinh lý.
- Đưa tăm bông nhẹ nhàng qua cơ tròn vào đến trực tràng và xoay nhẹ.
- Kéo nhẹ tăm bông ra, chú ý kiểm tra chắc chắn có mẫu phân thấm vào đầu tăm bông.
- Cho tăm bông vào trong cốc đựng bệnh phẩm có chứa môi trường vận chuyển thích hợp.
- Bẻ phàn que thừa, đậy chặt nắp, chú ý không làm que thừa chạm vào miệng lọ hoặc tuýp đựng bệnh phẩm
- Dán nhãn cốc đựng bệnh phẩm có đầy đủ tên tuổi, địa chỉ bệnh nhân.
Vận chuyển và bảo quản mẫu
- Bệnh phẩm phải được vận chuyển ngay đến phòng xét nghiệm không quá 2 giờ. Nếu đê quá lâu, số lượng vi khuẩn phân lập trong mẫu phân sẽ giảm đi do độ pH của mau phân giảm dần theo thời gian.
- Trường hợp soi cấy tìm vi khuẩn tả phải chuyến ngay đến phòng xét nghiệm trong vòng 30 phút. Mẩu phân bảo quản ở 4 - 8°c trong quá trình vận chuyển tới phòng xét nghiệm.
- Nếu không chuyển mẫu đến phòng xét nghiệm trong thời gian quy định thì phải giữ mẫu phân trong môi trường chuyên chở. Các môi trường thường được dùng là Stuart’s, Cary-Blair... Mẩu phân tả cần giữ trong môi trường alkaline pepton.
- Khi mẫu phân tới phòng xét nghiệm thì phải được xử lý ngay theo thường quy xét nghiệm của mỗi loại tác nhân gây bệnh.
3.3 Bệnh phẩm đường hô hấp
3.3.1 Bệnh phẩm đường hô hấp trên
Chuẩn bị dụng cụ
- Lọ, tuýp đựng mẫu có sẵn môi trường vận chuyển.
- Tăm ngoáy họng có đầu bằng Polyester.
- Nước muối sinh lý.
- Đè lưỡi.
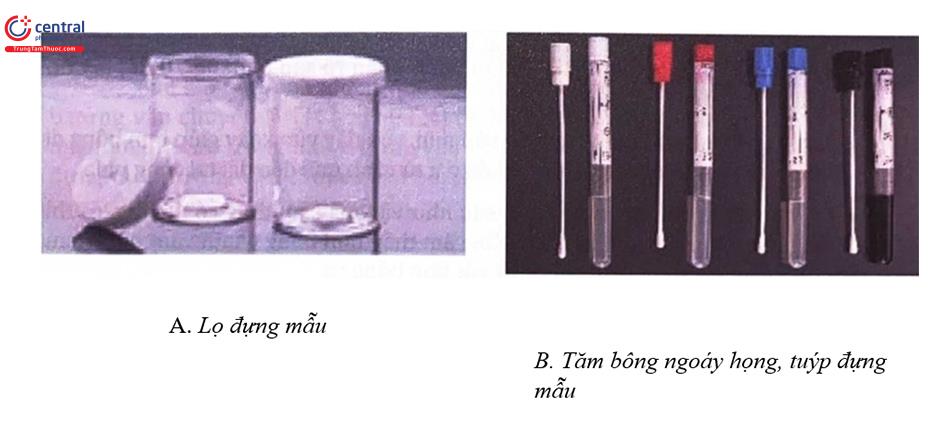
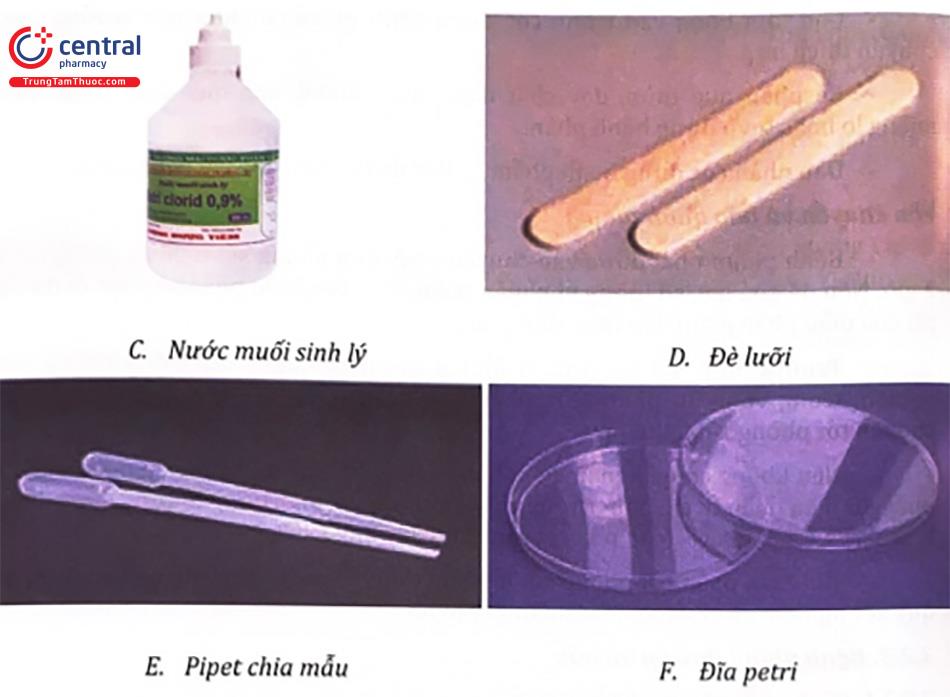
Tiến hành
Dịch tỵ hầu
- Môi trường vận chuyển: MEM, DMEM, M199, bổ sung thêm kháng sinh penicillin, Streptomycin và fungizon, chia 2-3 mL cho vào tuýp có nắp xoáy, bảo quản -20°C hoặc 4°c trong vòng 4 tuần.
- Thực hiện:
+ Yêu cầu bệnh nhân ngồi yên, mặt hơi ngửa, trẻ nhỏ thì phải có người lớn giữ.
+ Người lấy bệnh phẩm nghiêng đầu bệnh nhân ra sau khoảng 70 độ, tay đỡ phía sau cổ bệnh nhân.
+ Tay kia đưa nhẹ nhàng tăm bông vào mũi, vừa đẩy vừa xoay giúp tăm bông đi dễ dàng vào sâu khoảng bằng 1/2 độ dài từ cánh mũi đến dái tai cùng phía.
Lưu ý: nếu chưa đạt được được độ sâu như vậy mà cảm thấy có lực cản rõ thì rút tăm bông ra và thử lấy mũi bên kia. Khi cảm thấy tăm bông chạm vào thành sau họng mũi thì dừng lại, xoay tròn rồi từ từ rút tăm bông ra.
- Giữ tăm bông tại chỗ lấy mẫu trong vòng 5 giây đảm bảo dịch thấm tối đa.
- Từ từ xoay và rút tăm bông ra.
- Đặt đầu tăm bông vào tuýp đựng bệnh phấm có chứa môi trường vận chuyển và bẻ cán tăm bông tại điểm đánh dấu để có độ dài phù hợp với độ dài của tuýp chứa môi trường vận chuyển. Que tăm bông sau khi lấy dịch ngoáy mũi sẽ được để chung vào tuýp môi trường chứa que tăm bông lấy dịch ngoáy họng.
- Đóng nắp, xiết chặt, bọc ngoài bằng giấy parafín (nếu có).
- Bảo quản mẫu trong điều kiện nhiệt độ 2 - 8°c trước khỉ chuyển về phòng xét nghiệm. Nếu bệnh phẩm không được vận chuyển đến phòng xét nghiệm trong vòng 72 giờ kể từ khi lấy mẫu, các mẫu bệnh phẩm phải được bảo quản trong âm 70°C (-70°C) và sau đó phải được giữ đông trong quá trình vận chuyển đến phòng xét nghiệm.
Lưu ý: Đối với trẻ nhỏ đặt ngồi trên đùi của cha/mẹ, lưng của trẻ quay về phía ngực cha mẹ. Cha/mẹ càn ôm trẻ giữ chặt cơ thể và tay trẻ. Yêu cầu cha/mẹ đỡ đầu trẻ ngả ra phía sau.

Dịch ngoáy họng
- Yêu cầu bệnh nhân há miệng to.
- Dùng dụng cụ đè nhẹ nhàng lưỡi bệnh nhân.
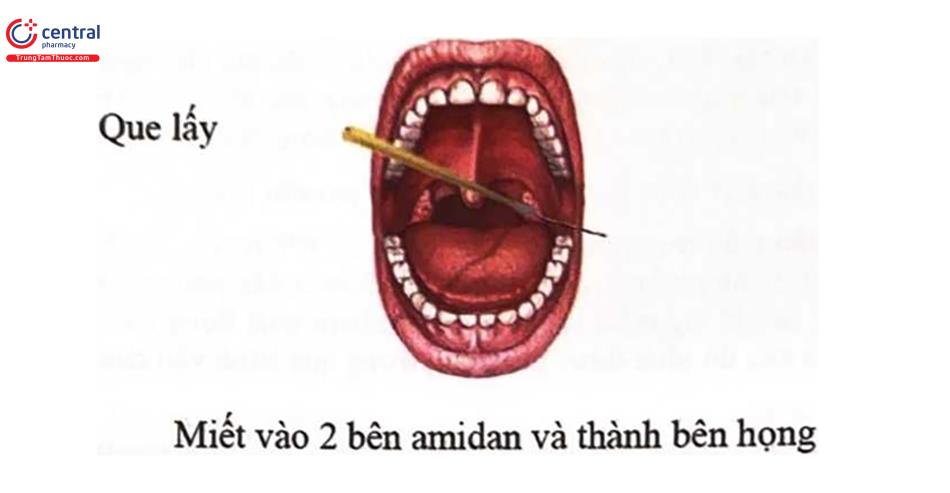
- Đưa tăm bông vào vùng hầu họng miết và xoay tròn nhẹ 3 đến 4 lần tại khu vực 2 bên vùng hạch amidan và thành sau họng để lấy được dịch và tế bào vùng họng.
- Sau khi lấy bệnh phẩm, que tăm bông được chuyển vào tuýp chứa 3mL môi trường vận chuyển (VTM hoặc UTM) để bảo quản. Lưu ý, đầu tăm bông phải nằm ngập hoàn toàn trong môi trường vận chuyển, và nếu que tăm bông dài hơn tuýp đựng môi trường vận chuyển cần bẻ/cắt cán tăm bông cho phù hợp với độ dài của tuýp chứa môi trường vận chuyển.
3.3.1.1 Bệnh phẩm đường hô hấp dưới
Đờm
Đờm là chất tiết của nhiễm khuẩn đường hô hấp dưới. Có nhiều các để lấy bệnh phẩm đờm, dưới đây là hướng dẫn lấy bệnh phẩm đờm bằng cách khạc:
+ Dụng cụ chứa bệnh phẩm: lọ nhựa vô trùng có nắp xoáy. Trên dụng cụ chứa phải được dán nhãn có đầy đủ thông tin đúng bệnh nhân, ngày và thời điểm lấy bệnh phẩm.
+ Thời điểm lấy đờm khạc: tốt nhất là lấy đờm vào buổi sáng sau khi bệnh nhân ngủ dậy. Hoặc khi bệnh nhân đến khám.
+ Tiến hành:
+ Cho bệnh súc miệng bằng nước muối sinh lý vô trùng, không súc miệng bằng nước có chất sát trùng.
+ Hướng dẫn bệnh nhân ngồi thẳng lưng, hít sâu để nín hơi vài làn, sau đó ho mạnh đờm dãi vào cốc đựng bệnh phẩm. Không lấy nước bọt và dịch mũi sau. Tốt nhất là lấy được khoảng 1 mL bệnh phẩm. Có thể giúp bệnh nhân khạc đờm bằng cách vỗ nhẹ vào lưng.
+ Nếu không lấy được đờm, kích thích ho để BN khạc đờm.
+ Dán nhãn, ghi thông tin lên lọ đựng bệnh phẩm
+ Điền đầy đủ thông tin vào mẫu phiếu lấy bệnh phẩm.
+ Vận chuyển và bảo quản.
+ Bảo quản 4°c chuyển về phòng xét nghiệm càng sớm càng tốt. Nếu chưa gửi ngay, bảo quản ở nhiệt độ 2 - 4°c nhưng không quá 4 tiếng.
+ Trong trường hợp nghi ngờ chứa các tác nhân nguy hiểm như SARS, cúm A HsNi... phải tuân thủ nghiêm ngặt quy trình đóng gói, bảo quản và vận chuyển mẫu.
Dịch rửa phế quản.
+ Thường được lấy khi thực hiện thủ thuật nội soi rửa phế quản.
+ Các yêu càu về lấy, bảo quản và vận chuyển bệnh phẩm tương tự như các loại dịch hô hấp khác.
3.3.2 Bệnh phẩm ngoài da
3.3.2.1 Chuẩn bị dụng cụ
- Nước muối sinh lý.
- Tăm bông vô trùng và môi trường vận chuyển.
- Lọ vô trùng có nắp xoáy.
- Kim chích hoặc kim tiêm.
- Lọ đựng mẫu bệnh phẩm nắp xoáy có miệng rộng (bệnh phẩm sinh thiết).
- Lam kính, hộp đựng lam kính.
3.3.2.2 Tiến hành
Dịch mụn nước
- Dùng kim vô trùng chích thủng nốt phỏng.
- Dùng tăm bông vô trùng thấm dịch chảy ra từ nốt phỏng. Cố gắng lấy được càng nhiều dịch càng tốt.
- Lấy lam kinh sạch đã đánh dấu mã số bệnh phẩm, phết tăm bông vào vùng giữa của lam kính tạo thành một đường tròn bằng đồng xu. Mỗi mẫu làm hai lam kính là tốt nhất. Để khô lam kính tự nhiên.
- Cho tăm bông trực tiếp vào môi trường vận chuyển virus, bảo quản lạnh 4°c trong quá trình vận chuyển.
- Dán nhãn vào chai hay ống nghiệm đựng mẫu.
- Khi lam kính đã khô, đặt lam kính vào hộp đựng lam kính, vận chuyển ở nhiệt độ thường.
Mụn vảy
- Nhẹ nhàng bóc lớp vảy bằng kim tiệt trùng hoặc mũi kéo hoặc panh kẹp.
- Cho khoảng 5-10 vảy vào lọ nhựa có nắp xoáy.
- Dán nhãn lọ đựng mẫu.
- Bỏ kim chích, kéo vào hộp chứa có vỏ cứng. Không sử dụng kẹp đã sử dụng cho bệnh nhân khác.
Mủ
- Lau sạch vùng da lành xung quanh với cồn 70°.
- Lau sạch mủ trên vết thương bằng gạc vô khuẩn thấm nước muối sinh lý 0,9% vô khuấn.
- Dùng tăm bông (que gòn) vô khuẩn lấy mẫu đế phết lấy mủ, chất dập nát, hay mô cho vào lọ lấy bệnh phẩm vô khuẩn ròi gửi ngay đến phòng xét nghiệm để được nuôi cấy.
- Nếu chưa gửi ngay, cho tăm bông (que gòn) đã phết mủ vào môi trường bảo quản Stuart hay Amies.
- Lưu ý: phải ghi lại chính xác vị trí lấy mẫu bệnh phẩm vì kết quả xét nghiệm sẽ được lý giải khác nhau giữa những mẫu thu thập từ các vết thương ở các vị trí khác nhau.
4 Mẫu bệnh phẩm giải phẫu bệnh
4.1 Lấy, bảo quản vận chuyển mẫu bệnh phẩm giải phẫu bệnh
Với mẫu bệnh phẩm thuộc chuyên ngành Giải phẫu bệnh: bệnh phẩm sau khi được lấy ra khỏi cơ thể càn được cố định ngay bằng dung dịch cố định. Tùy theo mẫu bệnh phẩm được chỉ định xét nghiệm tế bào hay mô bệnh học mà sử dụng dung dịch cố định khác nhau.
Bệnh phẩm được chỉ định xét nghiệm tế bào (bệnh phẩm đã được dàn trên lam kính) dung dịch cố định thường dùng là cồn tuyết đối (cồn 96°). Bệnh phẩm (sinh thiết, phẫu thuật, chất nạo) được chỉ định xét nghiệm mô bệnh học dung dịch cố định thường dùng là Formol trung tính 10% và thể tích dung dịch gấp > 30 lần thể tích bệnh phẩm.
Bệnh phẩm xét nghiệm tế bào phải được đựng trong hộp đựng tiêu bản có rãnh và nếu chưa gửi được đến phòng xét nghiệm phải được bảo quản trong ngăn mát tủ lạnh với nhiệt độ 2-8°C/l tuần. Bệnh phẩm được chỉ định xét nghiệm mô bệnh học phải được chứa trong hộp chuyên dụng, có nắp đậy kín để đảm bảo trong quá trình di chuyển không bị chảy dịch ra ngoài. Bệnh phẩm sau khi được cố định cần chuyến tới phòng xét nghiệm.
4.2 Các yếu tố ảnh hưởng tới kết quả xét nghiệm Giải phẫu bệnh
Các yếu tố ảnh hưởng đến chất lượng của xét nghiệm Giải phẫu bệnh bao gòm:
- Trước xét nghiệm: Lấy mẫu - Cố định - Bảo quản - Vận chuyển.
- Trong xét nghiệm: Chuyển - Đúc (vùi) - cắt tiêu bản - Nhuộm tiêu bản.
- Sau xét nghiệm: bảo quản - lưu trữ tiêu bản, khối nến.
Trong bài này chỉ nêu các yếu tố ảnh hưởng tớí quá trình trước xét nghiệm.
- Lấy mẫu: lấy mẫu phải tuân theo nguyên tắc là lấy trúng và lấy đủ.
- Cố định: dung dịch cố định phải đảm bảo chất lượng, nồng độ cũng như số lượng dung dịch. Quá trình cố định rất quan trọng đây là khâu then chốt. Nếu quá trình cố định sai sẽ ảnh hưởng tới chất lượng của xét nghiệm.
- Bảo quản và vận chuyển bệnh phẩm: thời gian bảo quản, nhiệt độ, dụng cụ chứa bệnh phẩm.
5 Mẫu bệnh phẩm sinh học phân tử
Các xét nghiệm sinh học phân tử, giống như bất kỳ xét nghiệm nào trong phòng thí nghiệm lâm sàng, các yêu cầu xử lý mẫu bệnh phẩm cần tối ưu đế có kết quả xét nghiệm chính xác và nhất quán. Sự thành công của một quy trình xét nghiệm bị ảnh hưởng bởi tuổi, loại và tình trạng của mẫu bệnh phẩm. Do đó, việc thu thập, vận chuyển và xử lý bệnh phẩm sinh học phân tử cần được lưu ý nghiêm ngặt, đặc biệt các xét nghiệm yêu cầu tính toàn vẹn của nhiễm sắc thể, DNA, RNA.
5.1 Một số nguyên tắc khi thực hiện lấy mẫu
- Với các mẫu bệnh phẩm có khả năng lây nhiễm, như tác nhân gây bệnh là các vi sinh vật gây bệnh truyền nhiễm, cần sư dụng các biện pháp phòng ngừa bằng cách sử dụng thiết bị bảo hộ cá nhân thích hợp (PPE) để ngăn ngừa lây truyền bệnh. Đối với các tác nhân lây nhiễm qua đường không khí, cần có thêm các trang thiết bị bảo hộ cá nhân như mặt nạ phòng độc, kính chắn giọt bắn, khẩu trang có độ lọc cao, áo bảo hộ.
- Cần có thiết bị bảo vệ mắt, khẩu trang trong trường hợp mô đông lạnh đang được xử lý hoặc khi mẫu có thể xảy ra hiện tượng phun hoặc bắn tung tóe.
- Găng tay rất quan trọng, không chỉ là một phần của các biện pháp phòng ngừa tiêu chuẩn mà còn để bảo vệ acid nucleic khỏi sự phân hủy bởi nuclease, đặc biệt là RNA. DNA ít bị suy thoái do nhiễm các DNase; tuy nhiên, việc xử lý mẫu nhiều làn mà không có găng tay sẽ ảnh hưởng xấu đến tính toàn vẹn của DNA theo thời gian.
- Thao tác của kỹ thuật viên càn phải thận trọng, tránh lây nhiễm chéo giữa các mẫu, đặc biệt khi thực hiện lấy và xử lý mẫu ban đầu bằng pipet. Mẩu đã được lấy, tuyệt đối không đưa trở lại ống hoặc bình chứa ban đàu.
- Heparin gây ức chế hoạt động của DNA polymerase, do đó không nên sử dụng với các phản ứng khuếch đại DNA, cDNA.
- Các mẫu bệnh phẩm phẫu thuật (mẫu mô tươi) được chỉ định cho xét nghiệm sinh học phân tử, nếu không được xử lý ngay lập tức, nên được đông lạnh nhanh trong nitơ lỏng.
- Với các mẫu bệnh phẩm mô đúc hoặc tiêu bản giải phẫu bệnh cần có sự xác định, khoanh vùng khu vực mô đích cần thực hiện (ví dụ khoanh vùng các tế bào u).
- Lấy được đúng và đủ mẫu bệnh phẩm là một trong những yếu tố quan trọng hàng đầu.
5.2 Lấy, bảo quản và vận chuyển mẫu bệnh phẩm sinh học phân tử
Xét nghiệm sinh học phân tử mang tính đặc thù liên quan chủ yếu tới vật chất di truyền như DNA, RNA, protein của các tác nhân gây bệnh là vi sinh vật, nấm hoặc là vật chất di truyền của người với các bệnh di truyền, ung thư... cũng có thể các mẫu dịch trong một số xét nghiệm đặc biệt, như dịch ối, dịch não tủy, dịch rửa phế
quản... Do vậy mẫu bệnh phấm cũng rất đa dạng, từ máu, dịch thể, mô mềm, mô xưong, tóc, móng... Tuỳ theo mục đích của xét nghiệm sẽ yêu càu lấy loại mẫu nào và phương pháp ra sao.
Các mẫu máu, dịch được lấy tương tự như các mẫu hóa sinh, vỉ sinh. Chất chống đông sử dụng cho các xét nghiệm sinh học phân tử với mẫu máu, tủy thường là EDTA (ống nắp tím) hoặc acid citrate dextrose (ACD - ống nắp vàng). Các chất chống đông heparin (ống nắp xanh lá cây) thường sử dụng cho các xét nghiệm di truyền tế bào.
Các phương pháp lai huỳnh quang tại chỗ (FISH - fluorescent in situ hybridization) và các xét nghiệm xác định nhiễm sắc thế (karyotyping) hoặc nuôi cấy tế bào đòi hỏi các mẫu bệnh phẩm phải nguyên vẹn cấu trúc tế bào hoặc phải là mẫu tươi.
Phần lớn các xét nghiệm sinh học phân tử không cần tính toàn vẹn của tế bào, mà chỉ yêu cầu tính toàn vẹn của DNA, RNA... khi mẫu được thu thập và lưu trữ trong điều kiện thích hợp. Ví dụ máu hoặc tủy xương để xét nghiệm RNA ờ người phải được xử lý trong vòng 24 giờ. Các mẫu máu và tủy xương được gửi đến các phòng thí nghiệm để làm các xét nghiệm sinh học phân tử có thể được để qua đêm ở nhiệt độ phòng hoặc với túi đá lạnh. Tốt nhất nên vận chuyển mô được đông lạnh trên đá khô.
DNA phân lập có đủ độ tinh khiết có thế được bảo quản ở nhiệt độ phòng trong vài tháng hoặc ít nhất 1 năm trong tủ lạnh. DNA đã tinh sạch có thể được bảo quản ở nhiệt độ tủ đông (-20°C đến -70°C) trong các ống kín có thể lên đến 10 năm hoặc lâu hơn. Nhiệt độ tủ đông được ưu tiên đế bảo quản lâu dài; tuy nhiên, chế phẩm DNA sạch nếu được sử dụng thường xuyên tốt hơn nên được bảo quản trong tủ lạnh đế tránh làm hỏng DNA do nhiều chu kỳ đông lạnh/rã đông.
Mẩu RNA sau khi phân lập kém ổn định ở nhiệt độ môi trường và nhiệt độ tủ lạnh. Thường chỉ được 1 tháng ở điều kiện -70°C. Tuy nhiên cũng như đối với DNA, sự tôn tại lâu dài của RNA phụ thuộc vào chất lượng của việc phân lập và xử lý mẫu ban đầu.
Các điều kiện bảo quản được khuyến cáo theo bảng dưới.
| Acid nucleic | Loại mẫu | Nhiệt độ bảo quản | Thời gian ổn định |
| DNA | Máu toàn phần, bạch cầu đã phân lập* , tủy xương, các loại dịch | 22°C -25°C 2°C - 8°C -20°C -70°C | 24 giờ 72 giờ Ít nhất 1 năm Nhiều hơn 1 năm |
| Mẫu mô | 22°C- 25°c 2°C - 8°C -20°C -70°C | Không khuyến cáo 24 giờ Ít nhất 2 tuần Ít nhất 2 năm | |
| Vi sinh vật nuôi cấy ** | 22°C - 25°C 2°C - 8°C -20°C -70°C | 24 giờ 72 giờ 2-4 tuần Nhiều hơn 1 năm | |
| RNA | Máu toàn phần, bạch cầu đã phân lập, tủy xương, các loại dịch | 22°C - 25°C 2°C - 8° 2°c - 8°c -20°C -70°C -20°C -70°C | Không khuyến cáo*** 2 - 4 giờ 2- 4 tuần Nhiều hơn 1 năm |
| Các loại dịch | 22°C-25°C | 5 ngày | |
| Ống bảo vệ RNA | 2°C - 8°C -20°C -70°C | 7 ngày 2- 4 tuần ít nhất 7 tháng | |
| Mẫu mô | 22°C - 25°C 2°C - 8°C -20°C -70°C -140°C (nitơ lỏng) | Không khuyến cáo Không khuyến cáo Không khuyến cáo ít nhất 2 năm Ít nhất 2 năm | |
| Vi sinh vật nuôi cấy | 22°C-25°C 2°C - 8°C -20°C -70°C | 24 giờ 72 giờ 2-4 tuần Nhiều hơn 1 năm | |
| Tế bào ly giải trong các dung dịch lưu trữ RNA (Ambion) | 22°C-25°C 2°C - 8°C -20°C | 1 tuần 1 tháng Nhiều hơn 1 năm |
Ghi chú:
(*) Mẩu phân tách bạch cầu được khuyến cáo nhằm hạn chế sự ức chế của hemoglobin do vỡ hồng câu.
(**) Acid nucleic từ các sinh vật nuôi cấy tốt nhất nên được phân lập ngay lập tức khi thu hoạch các mẫu cấy tươi.
(***) Tình trạng RNA phụ thuộc vào loại tế bào hoặc mô và gene đang được xét nghiệm.
6 Tài liệu tham khảo
1. Bishop, M. L., Fody, E. p., & Schoeff, L. E. (2018). Clinical chemistry: principles, techniques, and correlations. Eighth edition. Philadelphia: Wolters Kluwer.
2. McCall, R. E., & Tankersley, c. M. (2016). Phlebotomy essentials. Sixth edition. Philadelphia: Wolters Kluwer.
3. Bộ môn Hóa sinh, Trường Đại học Y Hà Nội (2003). Thực tập Hóa sinh. Nhà xuất bản Y học
4. PGS. TS. BS. Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ (2023). “Bệnh phẩm xét nghiệm”. Kỹ thuật và thiết bị xét nghiệm y học. Nhà xuất bản y học, trang 12-53. Tải bản pdf tại đây.

