Kiểm nghiệm nhanh thực phẩm: vai trò và phương pháp
Trường ĐH Dược Hà Nội - Khoa hóa phân tích và kiểm nghiệm thuốc
Chủ biên GS.TS. Thái Nguyễn Hùng Thu
Các tác giả tham gia biên soạn
PGS.TS. Phạm Thị Thanh Hà
PGS.TS. Lê Thị Hồng Thảo
GS.TS. Thái Nguyễn Hùng Thu
Việc kiểm nghiệm nhanh thực phẩm là một vấn đề cần thiết trong quản lý chất lượng cũng như giám sát thực phẩm trong tiêu dùng hàng ngày để đảm bảo thực phẩm an toàn, nhằm bảo vệ sức khỏe của nhân dân. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc các kỹ thuật đánh giá nhanh thực phẩm.
1 Tầm quan trọng của kiểm nghiệm nhanh thực phẩm

Xã hội phát triển, xu hướng sử dụng thức ăn nhanh và thực phẩm chế biến sẵn ngày càng tăng. Các bệnh do thực phẩm gây nên cũng như ngộ độc thực phẩm là vấn đề cấp bách không những ở các nước đang phát triển mà còn ở các nước đã phát triển. Việc kiểm nghiệm nhanh thực phẩm là một vấn đề cần thiết trong quản lý chất lượng cũng như giám sát thực phẩm trong tiêu dùng hàng ngày để đảm bảo thực phẩm an toàn, nhằm bảo vệ sức khỏe của nhân dân. Kiểm nghiệm nhanh để kịp thời cảnh báo nguy cơ mất an toàn đối với sản phẩm đã và đang lưu thông. Một bộ kiểm nghiệm nhanh thực phẩm được quy định bao gồm các dụng cụ, hóa chất hoặc môi trường nuôi cấy được chuẩn bị sẵn, đồng bộ đủ điều kiện để kiểm nghiệm một hoặc nhiều chỉ tiêu vệ sinh an toàn thực phẩm nhất định, rút ngắn thời gian cho kết quả sau quá trình thử nghiệm. Các kỹ thuật đánh giá nhanh an toàn thực phẩm được lưu hành và đã được sử dụng khá rộng rãi từ những kỹ thuật rất đơn giản đến những kỹ thuật có độ chính xác cao để từ đó có thể giúp cho người sản xuất ngay lập tức điều chỉnh, thay đổi cách thức sản xuất và giúp cho người tiêu dùng có thể kiểm soát được một phần mối nguy trong thực phẩm sử dụng ngay tại hiện trường.
Khi sử dụng các bộ thử nhanh, cần chú ý đến độ nhạy, độ đặc hiệu của phép thử đã dùng để đưa ra nhận định kết quả đúng đắn
2 Kỹ thuật kiểm nghiệm nhanh vệ sinh thực phẩm
2.1 Một số xét nghiệm kiểm tra nhanh chất lượng rửa bát đĩa
Mục đích của kiểm nghiệm này dùng để đánh giá chất lượng của việc rửa bát đĩa ở cơ sở ăn uống công cộng, từ đó nhắc nhở và giúp cho các cơ sở này thực hiện đúng các quy tắc thực hành vệ sinh.
2.1.1 Phát hiện nhanh tinh bột
* Nguyên tắc:
Tinh bột gặp Iod cho màu xanh.
Tinh bột dưới dạng chín chuyển sang dạng amylodextrin (cơm, phở, cháo) hoặc erythrodextrin (bánh mì nướng) tác dụng với iod cho màu xanh tím.
* Cách tiến hành:
- Cho 15 giọt iod 0,1 N hoặc dung dịch Lugol, láng đều khắp bề mặt bát, đĩa cần kiểm tra
- Để sau 10 giây đọc kết quả.
- Mon - Nếu có vết màu xanh, đó là phản ứng dương tính. Tùy vào độ đậm nhạt của màu xuất hiện mà có thể đánh giá mức độ bẩn “+”, “++”, “+++”.
2.1.2 Phát hiện nhanh chất béo
* Nguyên tắc:
Chất béo còn lại ở bát đĩa, do rửa không sạch, dễ bị oxy hóa thành các chất có phân tử lượng thấp hơn như aldehyd, ceton và các ceton acid. Những chất này khi gặp các thuốc thử kiềm như: đỏ fuchsin, tím gentian, Sudan III, xanh methylen sẽ bắt màu như cơ chế nhuộm vi khuẩn trong vi sinh vật.
* Hóa chất
Thuốc thử Sudan III: hòa tan 0,2 g Sudan III và 0,05 g xanh methylen vào 70 mL cồn ethylic 96° đã đun ở nhiệt độ 60°C. Cho thêm 10 mL amoniac 20 - 25% (có tác dụng bảo quản dung dịch). Sau đó cho thêm 20 mL nước cất.
* Cách tiến hành:
Cách 1:
Cho vào bát đĩa cần kiểm tra khoảng 5 mL dung dịch Sudan III, láng đều khắp bề mặt bát, đĩa. Để 10 giây rồi đem rửa dưới vòi nước nhẹ hoặc tráng vào chậu nước sạch. Sau đó đọc kết quả.
- Nếu chỉ có những vệt màu xanh hoặc ánh hồng của Sudan III: bát đĩa sạch.
- Nếu có những đám bẩn màu gạch cua: bát đĩa bẩn, chưa rửa sạch dầu mỡ. Tùy theo mức độ nhiều hay ít của những đám bẩn mà có thể đánh giá mức độ bẩn “+”, “++”, "+++".
Cách 2:
Lau bát đĩa bằng miếng giấy lọc 15 × 15 cm.
Nhỏ 5 giọt thuốc thử Sudan III lên miếng giấy lọc đó. Đợi sau 10 giây và đọc kết quả như trên, có màu gạch cua là dương tính.
2.1.3 Phát hiện nhanh đường
* Nguyên tắc:
Đường saccarose + a-naphtol trong môi trường acid mạnh cho màu tím.
* Hóa chất.
Dung dịch a-naphtol 10% trong cồn 96°, dung dịch H2SO4 hoặc HCl nguyên chất, đậm đặc.
* Cách tiến hành:
Cho lần lượt vào cốc, chén cần kiểm tra các dung dịch:
2 giọt dung dịch a-naphtol 10%.
2 - 3 mL dung dịch H2SO4 hoặc HCl nguyên chất, đậm đặc.
Đợi sau 10 giây đọc kết quả.
Nếu cốc, chén còn dù chỉ một vài tinh thể đường sẽ xuất hiện màu tím. Tùy theo mức độ đậm, nhạt của màu tím mà đánh giá mức độ bẩn “+”, “++”, “+++”
Nếu cốc, chén được rửa sạch sẽ giữ nguyên màu của dung dịch.
Chú ý:
Khi làm các test kiểm tra trên phải lấy 10 chiếc mỗi chủng loại, trong đó 5 chiếc mang rửa sạch theo đúng phương pháp vệ sinh và 5 chiếc để nguyên làm test thử ngay.
2.2 Kiểm tra nhanh nước uống
Để đảm bảo vệ sinh ăn uống, nước dùng để uống, pha trà hoặc cho khách uống phải là nước đã được đun sôi kỹ. Nhưng có những cửa hàng ăn uống công cộng không đảm bảo việc ăn chín, uống sôi, nên trách nhiệm của các đoàn kiểm tra về an toàn thực phẩm ăn uống cần phải kiểm tra tra thường xuyên, đột xuất các cơ sở phục vụ ăn uống, xem nước dùng cho khách hàng đã được đun sôi kỹ hay chưa.
* Nguyên tắc:
Các nguồn nước thông dụng (nước máy, nước giếng...) khi đi qua các địa tầng kéo theo nhiều hợp chất khoáng hòa tan như muối sulfat, nitrat, clorid, bicarbonat... Các Muối Khoáng này thường là các muối bicarbonat kiềm và kiềm thổ. Đây là những muối của acid yếu, dưới tác dụng của carbonic. Do đó, nước khi đun sôi, các muối bicarbonat được biến đổi như sau: Ca(HCO3)2 → CaCO3 + CO2 + H2O
Mg(HCO3)2 → MgCO3 + CO2 + H2O
2Na(HCO3) → Na2CO3 + CO2 + H2O
Kết quả sẽ hình thành các muối carbonat có tính kiềm mạnh hơn, hòa và một số kết tủa lắng xuống làm nước đun sôi có tính kiềm mạnh hơn.
Các nguồn nước thông dụng thường có pH khoảng 7,2 - 7,6, sau khi dun sôi kỹ, nước có pH tăng lên trên 8,2 nằm trong vùng chuyển màu của các chỉ thị màu:
Cresolphatalein có pH vùng chuyển màu 8,2 - 9,8
Xanh thymol có pH vùng chuyển màu 8,0 - 9,6
Phenolphtalein có pH vùng chuyển màu 8,3 - 9,6
* Dụng cụ, hóa chất
- Dụng cụ: 2 ống nghiệm 15 mL.
- Hóa chất: Phenolphtalein 1% trong cồn ethylic: cân 1 g phenolphtalein cho vào bình định mức 100 mL, cho thêm 50 mL cồn ethylic 90°, lắc cho tan hết, thêm nước cất ngay cho đủ 100 mL. Dung dịch pha xong phải trong suốt, không màu (nếu không trong thì phải lọc bỏ cặn).
Xanh bromothymol 1% trong cồn ethylic 90°: cân 1 g xanh bromothymol cho vào bình định mức 100 mL, thêm 50 mL cồn ethylic 90°, lắc cho tan hết, cho tiếp cho đủ 100 mL bằng nước cất. Dung dịch pha xong phải có màu đỏ, trong.
* Tiến hành:
Lấy 5 mL nước cần kiểm tra cho vào ống nghiệm 10 - 15 mL.
Đồng thời lấy 5 mL nước, từ nguồn nước (vòi nước, thùng đựng nước, xô, chậu...) đem đun sôi kỹ để làm đối chứng, cho vào một ống nghiệm khác cùng dung tích.
Cho vào mỗi ống nghiệm nói trên 1 - 2 giọt phenolphtalein 1% và quan sát
* Đánh giá kết quả:
Nước chưa đun sôi sẽ không đổi màu thuốc thử.
Nước đã đun sôi: có màu hồng tới đỏ sẫm tùy theo nguồn nước có ít hay nhiều muối bicarbonat kiềm hay kiềm thổ.
Nếu nước chỉ đun nóng già 70°C: không đổi màu. Trong trường hợp nghi ngờ có thể đun lại ống nước này trên ngọn lửa đèn cồn, nước sôi sau ít phút và màu đỏ lại xuất hiện.
Chú ý:
- Cá biệt có nguồn nước có pH dưới mức thông thường, acid hơn một chút (pH = 6 - 7,6) thì dùng phenolphtalein 1% giỏ vào nước đã đun sôi không thấy màu đỏ - M, một chút hồng. Trong trường hợp này, giỏ tiếp vào hai ống thử nói trên, mỗi ống từ 1 - 2 giọt xanh bromothymol 1%, kết quả ống nước đối chứng chưa đun có màu vàng hoặc xanh lá mạ, còn ống nước đã đun sôi có màu tùy theo hàm lượng muối khoáng. Nếu ống nước thử vẫn chỉ có màu như ống nước chứng thì nước đó là nước chưa đun sôi.
- Trường hợp cá biệt khác là nguồn nước khi chưa đun đã có độ kiềm lớn hơn pH = 8 (hiếm gặp) thì có thể dùng chỉ thị màu có vùng chuyển màu ở độ kiềm cao hơn như thymolphtalein 1% trong cồn 95° có vùng chuyển màu từ 9,4 - 10,6 từ không màu trở thành màu xanh lơ.
- Nước lã (chưa đun sôi) chứa ở chum lâu: nước có nhiều bicarbonat kiềm, kiềm pH = 7,6 - 7,8 để lâu trong chum, phơi nóng ở ngoài nắng khi thử với phenolphtalein 1% cũng có màu phớt hồng, nhưng khi đun sôi màu sẽ thành đỏ sẫm hoặc cũng có thể dùng chỉ thị màu có vùng chuyển màu kiềm cao hơn.
- Nước đun sôi rồi để trữ lâu ngày: để lâu độ 2 - 3 tuần, khí CO2 ngoài không khí có thể hòa vào nước làm biến đổi các muối carbonat, làm nước giảm độ kiềm (so với lúc nước đun sôi) nên khi thử với phenolphtalein thì màu chỉ phớt hồng hay không màu. Tuy nhiên, các trường hợp này rất cá biệt, hạn hữu. Thông thường, các nguồn nước thông dụng khi đun sôi để nguội đều dùng được phương pháp này.
2.3 Phương pháp phát hiện nhanh các chất màu tổng hợp trong chè
* Nguyên tắc:
Chè chỉ khuếch tán màu nhanh chóng trong nước nóng, còn phẩm nhuộm có thể cho thêm vào chè hòa tan trong nước lạnh.
* Dụng cụ:
- Giấy lọc: 1 chiếc.
- Rây: 1 chiếc.
- Ống đong: 1 chiếc.
* Cách tiến hành:
+ Cách 1:
Rải một ít chè cần kiểm tra lên trên một tờ giấy lọc đã thấm ướt bằng nước lạnh. Nếu giấy lọc bị nhuộm màu nhanh chóng chứng tỏ có mặt của phẩm đã nhuộm.
+ Cách 2:
Đổ chè vào rây. Giữ rây trên cốc có mỏ và đổ nước lạnh qua lớp chè trong rây. Nếu dịch lọc nhuộm màu tức là chè có phẩm nhuộm.
+ Cách 3:
Đổ nước lạnh vào ống đong đến cách miệng ống 2 cm. Rắc chè lên mặt nước. Nếu màu tạo thành vệt chìm xuống chứng tỏ có mặt của phẩm nhuộm.
3 Một số kỹ thuật phát hiện nhanh chất độc hại trong thực phẩm
.jpg)
Để phát hiện nhanh các chất độc hại, nhiều kỹ thuật khác nhau đã được sử dụng rộng rãi. Nguyên tắc là dựa vào các phản ứng làm thay đổi tính chất hóa học của chất phân tích cần phát hiện với nhận dạng là sự thay đổi màu của chất chỉ thị mà mắt thường có thể nhận biết được hoặc dùng kỹ thuật sắc ký ái lực miễn dịch tạo ra các que tính đặc hiệu và chính xác cao để định tính và bán định lượng.
3.1 Các kỹ thuật phát hiện nhanh dựa trên thay đổi về tính chất hóa học
3.1.1 Phương pháp phát hiện nhanh phẩm màu kiềm
Phẩm màu kiềm dẫn xuất từ than đá có tính chất độc hại, theo quy định của Bộ Y tế nhóm phẩm màu này không được phép sử dụng trong thực phẩm.
* Nguyên tắc:
Phẩm màu dẫn xuất than đá có tính kiềm tan được trong nước hay trong cồn. Dung dịch phẩm màu này nếu cho tác dụng với amoniac sẽ làm giải phóng chất màu kiềm của phẩm màu.
Nếu chất màu kiềm này cho sản phẩm chiết có màu (chromobase) sẽ hòa tan được trong ether và nhuộm màu ether. Trái lại sản phẩm chiết không màu (leucobase) tuy cũng hòa tan được trong ether nhưng không nhuộm màu ether.
Dung dịch ether có chứa chất màu kiềm nếu cho tác dụng với acid acetic loãng, chất màu ban đầu lại chuyển sang dung dịch acid và nhuộm màu dung dịch acid này dù chất màu kiềm có gốc leucobase hay chromobase.
* Phạm vi áp dụng:
Phát hiện phẩm màu kiềm trong bánh, kẹo, các loại mứt, hạt dưa, nước uống.
* Tiến hành:
Mẫu thuộc dạng rắn như mứt, ô mai, các loại hạt... lấy 5 - 10 g cắt nhỏ thành cỡ hạt ngô (kích thước 5 × 5 mm).
Đối với các loại hạt nhỏ như hạt dưa, hạt bí có thể để nguyên.
Mẫu thuộc dạng chất lỏng, dạng kem lấy 1 - 2 mL.
Mẫu rắn tiến hành ngâm mẫu trong 5 mL cồn/nước, thỉnh thoảng lắc nhẹ khoảng 2 phút để chất màu tan vào dung dịch. Gạn dịch chiết sang ống nghiệm khác thêm vài giọt dung dịch amoniac 25% và 5 mL ether thường lắc kỹ khoảng 2 phút, để yên cho phân lớp. Rót lớp ether sang ống nghiệm khác, bỏ phần nước.
Hút lấy lớp dung môi phía trên cho từ từ vào ống nghiệm đã có chứa sẵn 5 mL dung dịch acid acetic 10%. Lắc nhẹ ống, sau đó để yên để đọc kết quả.
* Đọc kết quả:
Nếu dung dịch phía dưới ống nghiệm có màu: phẩm màu thuộc loại kiềm - không được phép sử dụng.
Chú ý:
- Khi thao tác cần nhanh để tránh hít phải hơi dung môi.
- Kết quả của test thử chỉ có tính sàng lọc.
3.1.2 Phương pháp phát hiện nhanh nitrat và nitrit
* Tinh chất và độc tính của nitrat và nitrit:
Nitrat công thức hóa học là NO3- và nitrit công thức hóa học NO2- . Trong thực tế thường sử dụng dưới dạng muối Kali nitrat (với tên thương mại là diêm tiêu) và kali nitrit hay các muối natri nitrat, natri nitrit.
Nitrat và nitrit thường được dùng trong bảo quản thịt nguội, thịt xông khói, patê, lạp xường. Có tác dụng giữ thịt màu đỏ, sát khuẩn thịt và cá. Cũng có thể do thực phẩm còn tồn dữ nhiều nitrat do phân bón mà chủ yếu là các loại rau ăn lá, củ như: rau dền, cần, xà lách, cải xanh, khoai, cà rốt....
Nitrit là chất có thể gây ung thư dạ dày. Bản thân nitrat không gây hại nhưng lại dễ biến thành nitrit.
Sử dụng nước ăn, đồ uống có hàm lượng nitrit cao có ảnh hưởng nhiều đến sức khỏe của con người. Giới hạn nồng độ nitrit trong nước cho phép là 3 ppm.
Gần đây người ta nghiên cứu thấy nitrit kết hợp với các amin tạo các nitrosamin là thư, đặc biệt gây đột biến quái thai. Trong thí nghiệm trên động vật, một số nhà khoa học đã thấy rằng nitrosamin có thể gây tổn thương gan, hình thành khối u ác tính và di căn.
Khi vào cơ thể nitrat chuyển thành nitrit bởi vi khuẩn đường ruột. Nitrit chuyển hemoglobin thành methemoglobin do đó không vận chuyển được oxy cho tế bào gây nên các triệu chứng ngộ độc như: nhức đầu, chóng mặt, buồn nôn, nôn mửa dữ dội, tiêu chảy, da và niêm xe tím tái... Nếu không được cấp cứu kịp thời sẽ ngạt thở, hôn mê và chết.
Nitrat trong thực phẩm có hai nguồn gốc chính: dư lượng có sẵn trong nông sản nguyên liệu và việc dùng muối nitrat (kali hoặc natri) để bảo quản thực phẩm. Sử dụng thực phẩm có lượng nitrat cao có ảnh hưởng nhiều đến sức khỏe. Giới hạn cho phép trong nước là 50 ppm, trong thực phẩm là 500 ng/kg.
Khuyến cáo: Không nên chọn các thực phẩm có dùng nitrat, nitrit trong quá trình chế biến. Không sử dụng mỡ chảy ra từ thịt xông khói để chiên xào tiếp. Không nên chế biến thực phẩm ở nhiệt độ cao trong thời gian dài.
* Phương pháp phát hiện nhanh nitrit
+ Nguyên tắc:
Ở pH khoảng 2 - 2,5 nitrit sẽ diazo hóa acid sulfanilic (Griess A) và sau đó kết hợp với a naphtylamin cho hợp chất naphtylamino azobenzen sulfonic (Griess B) có màu đỏ (bền ở 15 độ C, không bền ở nhiệt cao).
Phản ứng rất nhạy cho màu đỏ, nếu không có nitrit phản ứng không có màu đỏ.
+ Phạm vi áp dụng:
Bán định lượng nitrit trong nước sinh hoạt, đồ uống không màu.
+ Tiến hành:
Dùng ống Nessler, cho vào 50 mL nước lọc trong, thêm 1 mL Griess A và 1 mL Griess B, lắc đều. So màu với thang màu chuẩn bằng mắt thường.
+ Đọc kết quả:
Sau 5 phút dung dịch chuyển màu hồng.
Để ở trạng thái tự nhiên, so màu dung dịch với thang màu chuẩn, chọn vạch màu có màu tương ứng với màu dung dịch trong túi và đọc giá trị nồng độ tương ứng: 0,1 ppm, 1 3 1 ppm, 3 ppm và 5 ppm.
Nếu nồng độ từ 3 ppm trở xuống (màu dung dịch tương tự vạch màu 3 ppm hoặc nhạt hơn) nồng độ nitrit ở mức cho phép. Cao hơn 3 ppm là vượt mức cho phép.
Chú ý:
- Giới hạn phát hiện trong nước là 0,1 ppm.
- Không đọc kết quả sau 10 phút vì có thể màu phản ứng thay đổi.
- Nếu nồng độ nitrit quá cao có thể xuất hiện kết tủa màu nâu.
- Nước đục chứa nhiều chất lơ lửng ảnh hưởng đến kết quả. Cần phải lọc nước trước khi phân tích hoặc làm trong bằng phèn nhôm.
* Phương pháp phát hiện nhanh nitrat:
+ Nguyên tắc:
Trong môi trường acid acetic có mặt của Kẽm (Zn) và Kali iodid (KI), nitrat sẽ bị khử thành nitrit và KI sẽ bị oxy hóa để giải phóng iod tự do. Iod giải phóng được phát hiện bằng màu xanh tím nhờ chỉ thị hồ tinh bột. Tùy theo hàm lượng nitrat có trong sản phẩm nhiều hay ít, iod giải phóng cũng sẽ nhiều hay ít, nhanh hay chậm.
+ Phạm vi áp dụng:
Bán định lượng nitrat trong thịt ướp, xúc xích, dưa muối, nước giải khát không màu.
+ Tiến hành:
Thực phẩm dạng rắn: lấy khoảng 2 g cắt nhỏ cỡ hạt đậu cho vào cốc, thêm 15 mL nước sạch, ngâm trong 15 phút, trộn đều sau đó gạn lấy phần dịch trong để tiến hành thí nghiệm.
Mẫu nước: lấy 4 mL.
Cho vào ống nghiệm có chia vạch 4 mL mẫu.
Tiến hành thêm hỗn hợp thuốc thử acid acetic có mặt của kẽm (Zn) và kali (KI), lắc đều trong 1 phút.
Thêm tiếp dung dịch hồ tinh bột lắc đều chờ đọc kết quả.
+ Đọc kết quả:
So màu của phản ứng với thang màu chuẩn của mẫu chuẩn.
Với mẫu nước đọc kết quả sau 30 phút. Kết quả đọc là dương tính nếu màu của dung dịch phản ứng trong túi tương đương hoặc nhạt hơn vạch màu 50 ppm in trên nhãn. Nếu màu đậm hơn hàm lượng nitrat cao hơn mức cho phép.
Với mẫu phẩm đọc kết quả ngay sau 3 - 4 phút. Nếu màu dung dịch phản ứng trong túi tương đương hoặc nhạt hơn vạch màu 500 ppm thì hàm lượng nitrat có trong mẫu ở mức cho phép, nếu đậm hơn thì hàm lượng nitrat cao hơn mức cho phép.
Chú ý:
- Giới hạn phát hiện trong thực phẩm là 50 ppm.
- Nếu mẫu thực phẩm có tinh bột thì sau khi thêm thuốc thử màu dung dịch có thể xuất hiện màu xanh, màu này không ảnh hưởng đến kết quả xét nghiệm.
- NO2- có thể ảnh hưởng đến kết quả phản ứng.
3.1.3 Phương pháp phát hiện nhanh acid vô cơ
Dấm ăn có thành phần chính là acid acetic, được sản xuất chủ yếu bằng công nghệ lên men vi sinh do vậy dễ bị hỏng bởi quá trình lên men thối hoặc nhiễm nấm (có váng). Tại một số cơ sở sản xuất người ta cho thêm acid vô cơ để cho dấm trong, tăng độ chua và không bị váng, thối. Các acid này ảnh hưởng đến sức khỏe của người sử dụng. Theo quy định của Bộ Y tế, acid vô cơ không được sử dụng trong dấm ăn.
* Nguyên tắc:
Dung dịch acid hữu cơ loãng có pH > 2, nếu có acid vô cơ pH dung dịch sẽ hạ xuống pH < 2 có thể xác định bằng các chỉ thị màu thích hợp như tím methyl.
* Phạm vi áp dụng: Kiểm tra nhanh acid vô cơ trong các loại dấm ăn.
* Tiến hành
Đổ mẫu dấm cần kiểm tra vào ống nghiệm.
Thêm dung dịch thuốc thử hiện màu tím methyl, lắc đều.
* Đọc kết quả:
Dương tính: nếu dung dịch chuyển sang màu xanh lơ nhạt (giống màu chuẩn dương tính) tức là trong mẫu dấm có acid vô cơ.
m tính: nếu dung dịch có màu tím (giống màu chuẩn âm tính).
Chú ý: Giới hạn phát hiện khoảng 0,2%.
3.1.4 Phương pháp kiểm tra nhanh độ ôi khét trong dầu mỡ
Dầu mỡ là một môi trường thuận lợi cho một số vi khuẩn, nấm men, nấm mốc phát triển. Ngoài ra, còn một số yếu tố khác như nhiệt độ, ánh sáng, nước, kim loại, oxy... tác động đến các mạch liên kết không no của carbon không bão hòa làm cho dầu mỡ biến chất.
Dầu mỡ bị oxy hóa có mùi ôi khét, khó chịu do hình thành một số chất như aldehyd, peroxyd, ceton.
Quá trình oxy hóa là một quá trình phức tạp do men, nấm mốc và các yếu tố lý hóa (ánh sáng, nước, kim loại, không khí...) gây nên.
Tùy mức độ oxy hóa nhiều hay ít mà dầu ăn có thể sử dụng tiếp hay không.
* Nguyên tắc:
Trong dung dịch acid hydrocloric đậm đặc, aldehyd tác dụng với dung dịch phoroglucinol trong ether sẽ sinh ra một phức màu tan trong dung dịch acid làm nhuộm màu acid từ màu hỗng đến màu đỏ tùy theo aldehyd ít hay nhiều.
* Phạm vi áp dụng:
Kiểm tra nhanh độ ôi khét của dầu ăn, mỡ động vật thực phẩm.
* Tiến hành:
Dầu, mỡ ở dạng đông cần làm tan thành dạng lỏng.
Cho dầu hoặc mỡ vào ống nghiệm có vạch. Dầu, mỡ dạng lỏng lấy đến vạch định mức thứ nhất.
Thêm acid hydrocloric đậm đặc lắc nhẹ.
Tiếp tục thêm dung dịch phoroglucinol trong ether lắc nhẹ và quan sát sự chuyển màu.
* Đọc kết quả:
Nếu dung dịch phía dưới không xuất hiện màu hồng, dầu mỡ chưa bị ôi khét.
Nếu xuất hiện màu hồng nhạt: dầu đã bị oxy hóa nhẹ cần sử dụng ngay.
Nếu dung dịch phía dưới xuất hiện màu hồng đậm dầu mỡ đã bị hỏng không nên sử dụng.
Chú ý:
Tùy thuộc vào mức độ ôi khét của dầu mỡ mà màu sắc của lớp dung dịch sẽ có màu hồng ở mức độ khác nhau.
3.1.5 Phương pháp phát hiện nhanh salicylic
Acid salicylic là hóa chất thường sử dụng để chống nấm mốc. Đây là hóa chất không được sử dụng trong thực phẩm vì chúng rất độc qua đường ăn uống. Bộ Y tế đã cấm sử dụng acid salicylic trong thực phẩm.
* Nguyên tắc:
Acid salicylic khi có mặt của Sắt III clorid sẽ tạo ra phức màu nâu tím.
* Phạm vi áp dụng
Kiểm tra phát hiện salicylic trong rau quả ngâm, dưa bao tử muối, ngô ngâm, đậu Hà Lan ngâm, sấu ngâm, mơ, mận ngâm.
* Tiến hành:
Cho mẫu nước ngâm rau quả cần kiểm tra vào ống nghiệm.
Thêm thuốc thử sắt III clorid lắc đều.
* Đọc kết quả:
Dương tính: nếu dung dịch thử có màu nâu tím giống màu chuẩn.
Âm tính: nếu dung dịch không xuất hiện màu nâu tím.
Chú ý:
- Giới hạn phát hiện là 100 ppm
- Màu của phản ứng tùy thuộc vào nồng độ salicylic trong mẫu.
3.1.6 Phương pháp phát hiện nhanh formaldehyd
3.1.6.1 Tính chất và độc tính của formaldehyd:
Formaldehyd là chất hữu cơ rất độc, được sử dụng khá rộng rãi trong công nghiệp thường tồn tại ở hai dạng:
- Thể khí là chất khí không màu, mùi xốc đặc trưng, dễ tan trong nước.
- Khi tan trong nước cho dung dịch formol, formalin là dung dịch formol đậm đặc.
Formaldehyd là chất dễ cháy, dễ bay hơi ở nhiệt độ thường. Trong môi trường tự nhiên formaldehyd có trong khói xe ô tô, hầm lò đốt củi, khói thuốc lá. Trong công nghiệp, formaldehyd thường được điều chế từ rượu methylic thường được sử dụng để sản xuất thuốc nhuộm, keo dán, Nhựa, Cao Su, thuốc nổ...
Formaldehyd dễ dàng kết hợp với protein tạo thành những hợp chất bền không thối rữa, không ôi thiu nhưng rất khó tiêu hóa. Vì tính chất này mà người ta đã lạm dụng formol để bảo quản thực phẩm như bánh phở, bún, bánh cuốn...
Trong y học, formol có tính sát trùng nên được áp dụng để diệt khuẩn và là dung môi bảo vệ các tổ chức, các vật phẩm, các mẫu thí nghiệm, các cơ quan trong cơ thể con người. Người ta đã dùng nó trong việc ướp xác.
Con người nếu tiếp xúc với formol kể cả hàm lượng thấp mà kéo dài thời gian cũng bị ảnh hưởng tới sức khỏe nghiêm trọng. Formol có gây ngộ độc cấp hoặc ung thư.
* Triệu chứng ngộ độc cấp tính:
- Kích thích gây tổn thương niêm mạc mắt, đỏ mắt.
- Kích thích đường hô hấp trên gây chảy mũi, viêm thanh quản, viêm đường hô hấp, hen phế quản, viêm phổi, gây ngạt thở
- Formol là tác nhân gây viêm da, nổi mày đay.
- Tác hại trên đường tiêu hóa: làm chậm tiêu, rối loạn tiêu hóa, viêm loét dạ dầy, viêm đại tràng.
- Khi tiếp xúc hoặc ăn phải với một lượng lớn có thể gây tử vong.
* Tác nhân gây ung thư:
- Làm tăng tỷ lệ ung thư xoang mũi, ung thư đường hô hấp đặc biệt là mũi họng, ung thư đường tiêu hóa.
- Formol là một trong những yếu tố có khả năng gây ra biến dị, sai lệch nhiễm sắc thể nên đễ ảnh hưởng tới thai nhi.
Do tính độc hại của formol mà hiện nay người ta đã cấm việc sử dụng nó trong quá trình bảo quản thực phẩm.
3.1.6.2 Phương pháp phát hiện nhanh formaldehyd
* Nguyên tắc:
Có mặt của vết codein hay Morphin ở môi trường acid sulfuric, formaldehyd sẽ cho phức màu tím đỏ.
* Phạm vi áp dụng:
Thịt ướp muối, dưa cà có dùng formol để bảo quản.
Sản phẩm chế biến từ tinh bột có thêm phụ gia là formol.
Khả năng phát hiện 8 ppm tính theo formaldehyd.
* Tiến hành:
Mẫu thực phẩm dạng rắn: lấy khoảng 10 g cắt nhỏ, cho thêm 20 mL nước sạch khuấy kỹ sau đó gạn lấy nước chiết để làm thí nghiệm.
Mẫu là dạng lỏng lấy 10 mL.
Thêm acid sulfuric lắc đều cho đến khi dung dịch có màu vàng đều.
Thêm thuốc thử lên màu codein hoặc morphin và quan sát sự chuyển màu của dung dịch.
* Đọc kết quả:
Nếu dung dịch chuyển từ màu vàng sang màu đỏ lựu thì mẫu thực phẩm có chứa formol.
Nếu thấy dung dịch vẫn giữ nguyên màu vàng: mẫu thực phẩm không có formol.
3.1.7 Phương pháp phát hiện nhanh hàn the
3.1.7.1 Tính chất và độc tính của hàn the:
Hàn the là chất hóa học có tên khoa học và công thức là natri tetraborat Na2B4O7 hoặc Acid Boric H3BO3. Hàn the là chất không màu dễ tan trong nước, có tính sát khuẩn nên thường được dùng trong chế biến thực phẩm hay bảo quản thực phẩm được coi như là chất phụ gia. Ví dụ trong sản phẩm tôm, cua, cá... hàn the có mặt sẽ có tác dụng kìm hãm sự phát triển của vi khuẩn làm thực phẩm lâu bị phân hủy và lẩu thối.
Với sự có mặt của hàn the thực phẩm có thể duy trì được màu sắc tự nhiên của thịt, cá do nó có khả năng làm giảm tốc độ khử oxy của các sắc tố myoglobin trong các sợi cơ của thịt nạc.
Đặc biệt, hàn the còn làm cứng các mạch peptid làm khả năng phân hủy protein thành các acid amin bị chậm lại cũng như làm cứng các mạch amylose do các gốc Glucose gắn vào nhau nên làm giảm tốc độ phân hủy amylose thành glucose nên người ta sử dụng hàn the làm cho thực phẩm dẻo, dai và cứng. Ví dụ, người ta sử dụng nó vào sản xuất giò, chả, bánh phu thê...
Mặc dù có tác dụng như trên nhưng gần đây người ta đã nghiên cứu và thấy rằng hàn the có khả năng tích tụ trong cơ thể gây tổn thương thoái hóa cơ quan sinh dục, có thể gây ngộ độc cấp tính làm tổn thương đến hệ thần kinh trung ương, gan, tim, thận, ruột.
Với những phụ nữ mang thai, hàn the còn đào thải qua sữa và nhau thai gây ngộ độc thai nhi. Khi ăn hàn the, cơ thể chỉ có khả năng đào thải ra ngoài khoảng 80%, còn lại nó được tích tụ trong cơ thể.
Ngoài ra, hàn the có trong cơ thể còn có khả năng kết hợp với các mạch peptid cũng như các mạch amylose làm cản trở quá trình tiêu hóa và hấp thu dẫn đến hiện tượng khó tiêu hóa và chán ăn.
Hàn the có thể gây ngộ độc cấp tính, hiện tượng có thể xảy ra sau khi ăn khoảng 5 giờ với các triệu chứng buồn nôn, nôn, tiêu chảy, đau, co cứng cơ, vật vã, động kinh, có thể có dấu hiệu của suy thận, nhịp tim nhanh, các dấu hiệu về não hay màng não như co giật và hôn mê. Tỷ lệ tử vong do ngộ độc cấp tính khoảng 50%. Với hàm lượng từ 3 - 5 g/ngày sẽ gây rối loạn tiêu hóa chán ăn, ăn không ngon, người mệt mỏi, khó chịu, giảm khả năng làm việc. Với hàm lượng trên 5 g mỗi ngày sẽ gây ra suy dinh dưỡng, chậm phát triển, giảm trí nhớ, tổn thương đến tế bào gan.
Ngộ độc mạn tính: do tích lũy trong cơ thể gây ảnh hưởng đến quá trình tiêu hóa hấp thụ thức ăn, ảnh hưởng đến quá trình chuyển hóa và chức phận của thận, với các triệu chứng chán ăn, nôn, mẩn đỏ da, rụng tóc, suy thận, da xanh, suy nhược không hồi phục, cơn động kinh...
Để phòng ngộ độc do hàn the gây ra, hiện nay Bộ Y tế đã không cho phép các nhà sản xuất chế biến thực phẩm sử dụng hàn the làm chất phụ gia thực phẩm.
3.1.7.2 Phương pháp phát hiện nhanh hàn the
* Nguyên tắc:
Natri borat trong môi trường acid (HCI) sẽ tác dụng với Curcumin tạo ra rosocyamin có màu đỏ. Căn cứ vào sự thay đổi màu của giấy nghệ để xác định nhanh hàn the.
* Phạm vi áp dụng:
Kiểm tra hàn the trong các thực phẩm như thịt, cá tươi và các sản phẩm từ thịt (giò. chả, xúc xích...), các sản phẩm chế biến từ tinh bột như bánh đúc, bánh phu thê, bánh cuốn, bánh đa...
* Tiến hành:
Thực phẩm dạng rắn: lấy khoảng 2 g mẫu cắt nhỏ cỡ hạt đậu, cho vào cốc, nhỏ 20 giọt dung dịch HCl vào mẫu, dầm nát, bằng đũa thủy tinh. Để yên sau 5 - 10 phút, lấy phần dịch để tiến hành thử nghiệm.
Thực phẩm dạng lỏng: rót ra cốc khoảng 20 mL dung dịch mẫu.
Lấy một thẻ giấy nghệ.
Nhỏ 1 giọt dung dịch từ lọ dung dịch đệm lên thẻ giấy nghệ sao cho phần giấy ướt đều.
Nhúng ngập phần giấy thử phía dưới vào cốc mẫu vừa xử lý (chỉ nhúng phần giấy thủ phía dưới vào mẫu).
Lấy thẻ lên chờ đọc kết quả.
* Đọc kết quả:
Dương tính: nếu giấy thử phía dưới chuyển màu (từ màu vàng nghệ sang màu đỏ nâu) khác với giấy phía trên.
Âm tính: nếu cả hai phần giấy thử có màu giống nhau.
Chú ý:
Tùy thuộc hàm lượng hàn the có trong mẫu mà thời gian đọc kết quả có thể dài ngắn khác nhau.
3.1.8 Phương pháp phát hiện nhanh methanol trong rượu
Aldehyd và methanol là hai sản phẩm phụ của quá trình lên men rượu. Với các loại rượu sản xuất thủ công người ta không thể loại bỏ được aldehyd và methanol. Methanol là chất lỏng không màu, dễ bốc cháy, độc, sôi ở 64,5°C, dễ tan trong nước, ether và cồn ethylic. Khi vào cơ thể, methanol thường tập trung ở mắt, với lượng ít làm cho hoa mắt, với lượng nhiều hơn khiến người bị nhiễm độc không nhận ra màu sắc, gây mù và có thể gây tử vong.
* Nguyên tắc:
Trong môi trường acid dưới tác dụng của KMnO4 methanol sẽ bị oxy hóa thành formaldehyd, rồi cho tác dụng với acid cromotropic trong môi trường acid để tạo ra sản phẩm có màu xanh tím.
* Phạm vi áp dụng:
Phát hiện methanol trong các loại cồn, rượu không màu.
* Tiến hành:
Lấy đúng 0,5 mL rượu cần thử cho vào ống nghiệm.
Thêm dung dịch KMnO4.
Lắc đều, dung dịch có màu tím của KMnO4.
Thêm NaHSO3 khan và lắc đến khi dung dịch mất màu hoàn toàn.
Thêm thuốc thử lên màu acid cromotropic và thêm H2SO4.
* Đọc kết quả:
Dương tính: nếu dung dịch trong ống chuyển sang màu xanh tím đậm hơn màu trong mẫu chuẩn tương ứng với nồng độ 0,06%.
Âm tính: nếu dung dịch trong không chuyển sang màu xanh tím hoặc có màu tương đương mức 0,06% hay nhạt hơn.
3.2 Kiểm tra nhanh chất độc trong thực phẩm bằng sắc ký miễn dịch
3.2.1 Nguyên tắc
Kỹ thuật sắc ký miễn dịch thường được chia làm hai loại chính là sắc ký miễn dịch kẹp đôi và sắc ký miễn dịch cạnh tranh.
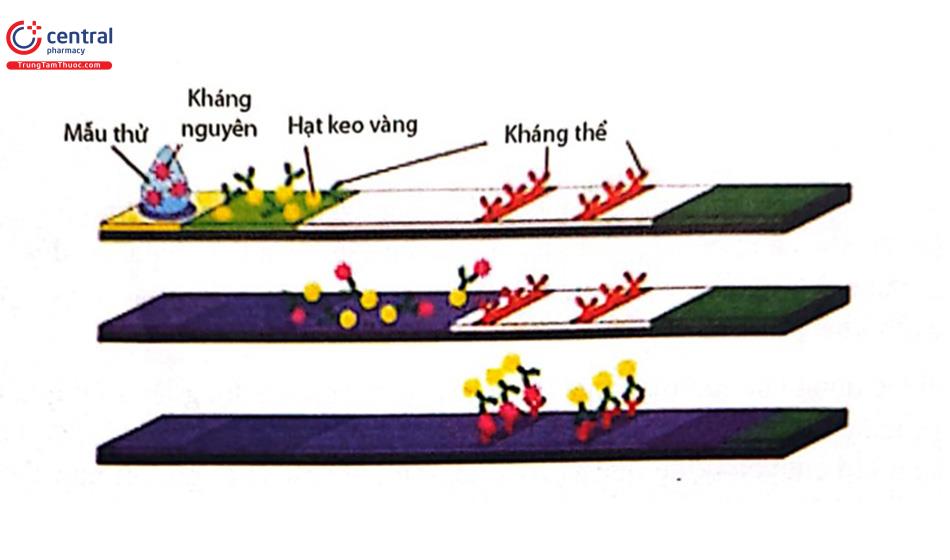
3.2.1.1 Sắc ký miễn dịch kẹp đôi
Tại vị trí vạch thử nghiệm, cố định một kháng thể thứ hai (khác với kháng thể cộng hợp có màu) có khả năng bắt cặp với kháng nguyên cần phân tích. Nếu các độc tố có mặt trong mẫu phân tích, chúng sẽ tương tác với kháng thể cộng hợp tạo thành phức hợp kháng nguyên-kháng thể cộng hợp có màu.
Dưới tác dụng của lực mao quản, dung dịch sẽ chuyển động lên trên que thử đi về phía vùng chứa các kháng thể và kháng nguyên cố định. Phức hợp kháng nguyên - kháng thể cộng hợp khi chuyển động đến vị trí vạch thử nghiệm sẽ bị giữ lại nhờ liên kết của kháng thể vạch thử nghiệm với kháng nguyên. Sự xuất hiện của vạch thử nghiệm đồng nghĩa với việc mẫu thử chứa độc tố. Như vậy, trong trường hợp dương tính (có độc tố trong mẫu phân tích) sẽ xuất hiện hai vạch màu. Ngược lại trường hợp âm tính chỉ có một vạch màu. Ưu điểm của sắc ký miễn dịch kẹp đôi là độ nhạy và độ đặc hiệu cao do sử dụng tới hai kháng thể có khả năng bắt cặp đặc hiệu với kháng nguyên ở những vị trí khác nhau mà không gây cản trở về mặt không gian.
3.2.1.2 Sắc ký miễn dịch cạnh tranh
+ Dạng 1:
Tại vị trí vạch thử nghiệm, kháng nguyên (hoặc một biến thể của kháng nguyên) được cố định. Nếu độc tố có mặt trong mẫu phân tích, chúng sẽ tương tác với kháng thể cộng hợp tạo thành phức hợp kháng nguyên - kháng thể cộng hợp. Dưới tác dụng của lực mao quản, dung dịch sẽ chuyển động lên trên que thử đi về phía vùng chứa kháng nguyên cố định. Phức hợp kháng nguyên - kháng thể cộng hợp khi chuyển động đến vị trí vạch thử nghiệm sẽ không bị giữ lại do các vị trí liên kết đặc hiệu của kháng thể đã bị bão hòa bởi kháng nguyên trong mẫu phân tích. Do đó, sự không xuất hiện của vạch thử nghiệm đồng nghĩa với việc mẫu thử chứa độc tố. Như vậy, trong trường hợp dương tính, có độc tố mẫu phân tích, thì sẽ xuất hiện một vạch màu ở vị trí vạch kiểm chứng. Ngược lại, mẫu âm tính sẽ có hai vạch màu ở cả vị trí vạch thử nghiệm và vạch kiểm chứng.
+ Dạng 2:
Tại vị trí vạch thử nghiệm một kháng thể có khả năng bắt cặp với kháng nguyên cần phân tích được cố định. Trong trường hợp này, đối tượng cộng hợp sẽ là kháng nguyên gắn với hạt nano vàng hoặc nano carbon. Nếu độc tố không có mặt trong mẫu phân tích thì khi dung dịch chuyển động lên trên que thử đi về phía vùng chứa các kháng thể cố định, kháng nguyên cộng hợp sẽ tương tác với kháng thể tạo thành phức hợp kháng thể - kháng nguyên cộng hợp có màu ở vị trí vạch thử nghiệm. Sự xuất hiện vạch thử nghiệm đồng nghĩa với việc mẫu thử không chứa độc tố cần phân tích. Ngược lại, nếu trong mẫu phân tích có độc tố cần phân tích thì chúng cạnh tranh với kháng nguyên cộng hợp trong việc được giữ lại ở vị trí vạch thử nghiệm. Chính vì vậy, sự không xuất hiện vạch màu đồng nghĩa với việc mẫu thử có chứa độc tố.
3.2.2 Các bộ phận chính của dụng cụ thử
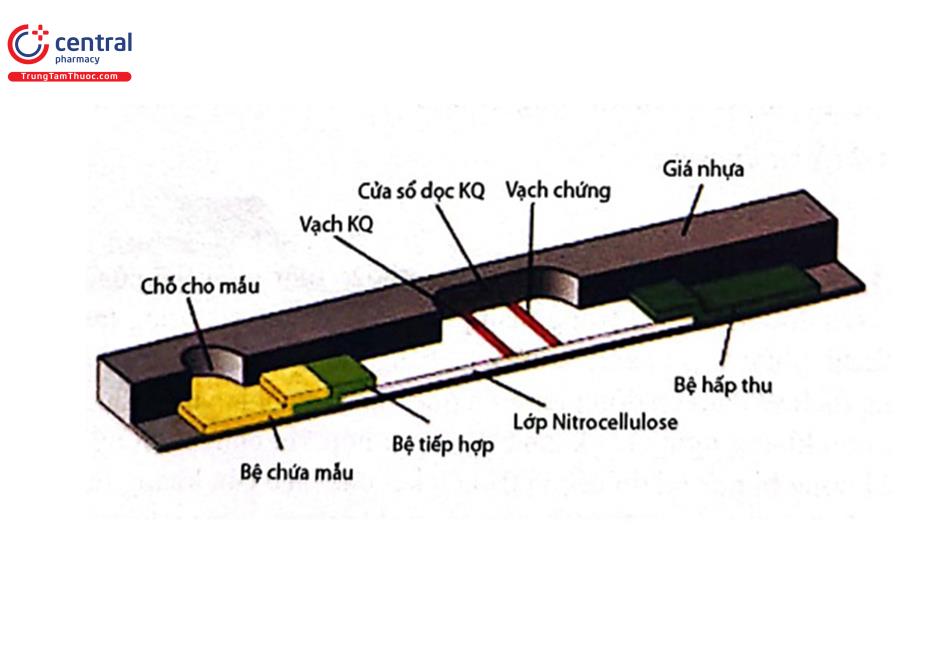
Dùng kỹ thuật sinh hóa để phát hiện kháng thể hay kháng nguyên trong mẫu cần phân tích, hiện được sử dụng rộng rãi trong nhiều lĩnh vực như y học, nông nghiệp và đặc biệt trong các quy trình kiểm tra an toàn chất lượng các sản phẩm thực phẩm. Thị trường tiềm năng hiện nay của phương pháp này là lĩnh vực kiểm soát dư lượng kháng sinh, hormon trong thực phẩm, các độc tố mycotoxin, độc tố vi sinh...
Nguyên tắc chung của phương pháp là đều dựa trên sự kết hợp đặc hiệu giữa kháng nguyên và kháng thể, trong đó kháng thể được gắn với một enzym. Phương pháp có ưu điểm nhanh, thao tác đơn giản, dễ thực hiện, không cần nhân viên chuyên môn cao, chi phí kiểm nghiệm mẫu thấp. Tuy nhiên, do đây là sinh phẩm nên một số hóa chất phải bảo quản lạnh và có hạn sử dụng nhất định, độ chính xác không cao bằng các phương pháp hóa lý như phương pháp sắc ký vì thế chỉ thích hợp với các phân tính sàng lọc hơn là các phân tích định lượng.
Dưới đây là một số dạng que thử được sử dụng trong kiểm nghiệm thực phẩm:
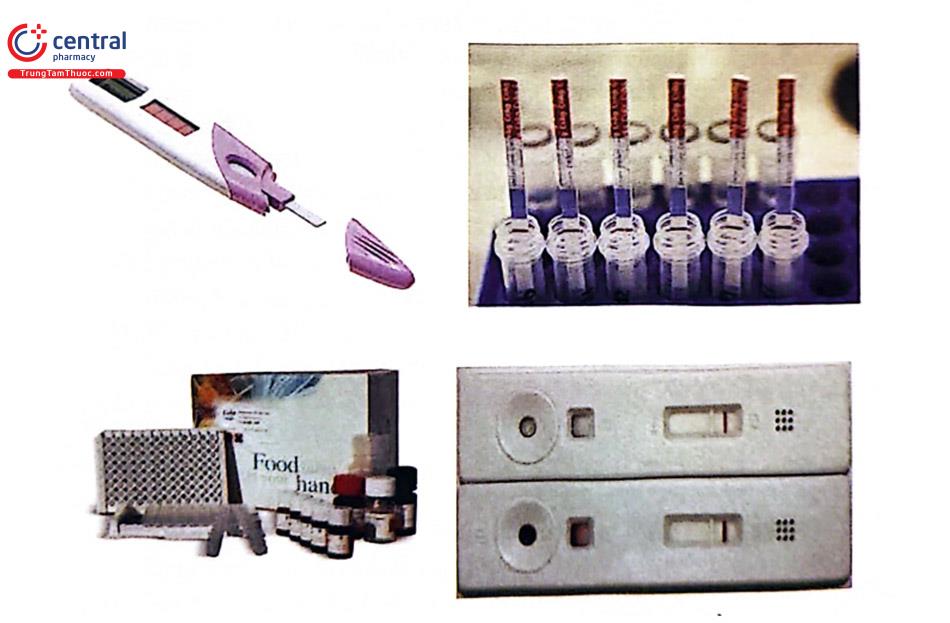
4 Tài liệu tham khảo
- Thái Nguyễn Hùng Thu, Phạm Thị Thanh Hà, Lê Thị Hồng Hảo (2023), "Một số kỹ thuật đánh giá nhanh thực phẩm", Kiểm Nghiệm Thực Phẩm. Nhà xuất bản Y học, trang 129 - 145. Tải bản PDF tại đây.
- Lê Huy Chính (2007), Vi sinh vật y học, Nhà xuất bản Y học, Hà Nội.
- Trần Đáng (2004), Mối nguy vệ sinh an toàn thực phẩm - Chương trình kiểm soát GMP, GHP và hệ thống quản lý chất lượng vệ sinh an toàn thực phẩm HACCP, Nhà xuất bản Y học, Hà Nội.
- Nguyễn Công Khẩn, Hà Thị Anh Đào (2007), Bảng thành phần thực phẩm Việt Nam Vietnamese Food Composition Table, Nhà xuất bản Y học, Hà Nội.
- Nguyễn Công Khẩn (2008), Dinh dưỡng cộng đồng và an toàn vệ sinh thực phẩm, Nhà xuất bản Giáo dục.
- Hà Duyên Tư (2009), Phân tích hóa học thực phẩm, NXB Khoa học Kỹ thuật, Hà Nội.
- Codex Alimentarius International Food Standards, General Standard for Food Additives Codex Stan 192 - 1995, revision 2014.
- Emerton V., Choi E. (2008), Essential Guide to Food Additives, Letherhead Publishing, Royal Society of Chemistry, Cambridge, UK.
- Hurst W.J. (2008), Methods of Analysis for Functional Foods And Nutraceuticals, CRC Press, Taylor and Francis Group, Florida, USA.
- James M. Jay (1996). Modern food Microbiology. 5 th edition. CBS publishers and distributors, Dehli, India.
- Lightfoot N.F., Maier E.A. (1998), Microbiological Analysis of Food and Water, Elsevier Science B.V., Asmterdam, The Netherlands.
- Marwaha K. (2010), Control and Analysis For Food and Agricultural Products, Gene-Tech Books, New Dehli, India.
- Newton D.E. (2007), Food Chemistry, Library of Congress, Infobase Publishing, New York.
- Nielsen S.S. (2010), Food Analysis, 4th Edition (Food Science Texts Series), Springer, London, England.
- Nollet L.M.L. (2009), Fidel Toldra Handbook of Dairy Foods Analysis, CRC Press, Taylor and Francis Group, Florida, USA.
- Nollet L.M.L. (2010), Fidel Toldra Safety Analysis of Foods of Animal Origin, CRC Press, Taylor and Francis Group, Florida, USA.
- Rita Cornelis, Caruso J.A., Crews H., Heumann K.G. (2003), Handbook of Elemental Speciation: Techniques and Methodology, Chapter II. Techniques and Methodology for Sample Preparation, John Wiley & Sons Ltd., Chichester England.
- Wong R.C., Tse H.Y. (2009), Lateral Flow Immunoassay, Springer, Humana Press, New York, USA.

