Kích thích buồng trứng - Phương pháp hỗ trợ trong sinh sản
Nguồn: Các vấn đề trọng yếu trong hỗ trợ sinh sản
Chủ biên: PGS.TS.BS. Lê Minh Tâm
Tham gia soạn biên
GS.TS.BS. Cao Ngọc Thành
ThS.BS. Trần Thị Như Quỳnh
ThS.BS. Nguyễn Đắc Nguyên
Kích thích buồng trứng là việc sử dụng các thuốc khác nhau theo nhiều phác đồ khác nhau nhằm tăng sự phát triển nang noãn, tăng trưởng thành và phóng noãn. Đồng thời kích thích buồng trứng cũng giúp điều chỉnh các rối loạn phóng noãn, thiểu năng giai đoạn hoàng thể. Với những hiểu biết ngày càng sâu về nội tiết phụ khoa, người ta hiểu thêm nhiều về các cơ chế kích thích buồng trứng giúp tạo ra nhiều loại thuốc với nhiều cách sử dụng khác nhau, thu được nhiều nang noãn hơn, tăng tỷ lệ thành công trong hỗ trợ sinh sản.
1 Chỉ định kích thích buồng trứng
1.1 Chỉ định kích thích buồng trứng
Rối loạn phóng noãn gồm không phóng noãn và ít phóng noãn, những trường hợp giai đoạn nang noãn kéo dài, không có đỉnh estradiol phù hợp, không có đỉnh LH phù hợp, thiểu năng giai đoạn hoàng thể.
Kích thích buồng trứng trong hỗ trợ sinh sản nhằm tăng số lượng nang noãn phát triển, trưởng thành và phóng noãn tự nhiên hay chọc hút.
1.2 Phân loại của Tổ chức Y tế thế giới về rối loạn phóng noãn
1.2.1 Nhóm I: Suy vùng dưới đồi - tuyến yên
Nhóm này gồm những bệnh nhân được chẩn đoán là vô kinh do suy vùng dưới đồi, gồm vô kinh do stress, chán ăn thần kinh và các biến thể, hội chứng Kallman (không có tế bào chế tiết GnRH), và khiếm khuyết gonadotropin độc lập. Những bệnh nhân này biểu hiện thiểu năng tuyến sinh dục do thiểu năng tuyến yên (hypogonadotropic hypogonadism) với nồng độ gonadotropin và estrogen thấp, nồng độ prolactin bình thường, thử nghiệm progestins âm tính.
1.2.2 Nhóm II: Rối loạn chức năng vùng dưới đồi - tuyến yên
Nhóm này bao gồm những người có nồng độ gonadotropin bình thường, estrogen bình thường, không phóng noãn, kinh thưa. Hội chứng buồng trứng đa nang cũng được xếp vào nhóm này.
1.2.3 Nhóm III: Suy buồng trứng
Bệnh nhân nhóm này gồm những người thiểu năng tuyến sinh dục với cường chức năng tuyến yên, nồng độ estrogen thấp. Các biến thể của suy buồng trứng và kháng buồng trứng cũng thuộc nhóm này. Trường hợp rối loạn phóng noãn tăng prolactin máu được điều trị đặc hiệu riêng.
2 Nguyên lý kích thích buồng trứng
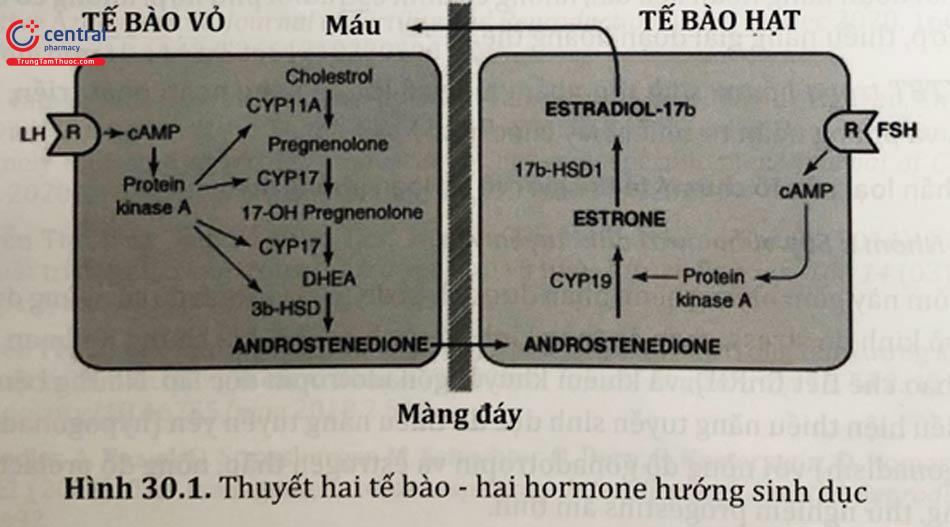
2.1 Thuyết hai tế bào - hai gonadotropins
Sự phát triển của nang noãn thường diễn ra trong khoảng 12 tuần, bắt đầu với quá trình chiêu mộ khoảng vài trăm nang nguyên thuỷ cho mỗi chu kỳ. Đến đầu chu kỳ kinh cuối cùng, các nang noãn được chiêu mộ đi vào quá trình phát triển phụ thuộc hormone, chủ yếu là FSH và LH của tuyến yên để trải qua các giai đoạn chọn lọc, vượt trội, thoái hoá, phát triển và phóng noãn. Sự phát triển tiếp theo này có được do sự hoạt động hiệu quả của hệ thống hai tế bào - tế bào vỏ và tế bào hạt của nang noãn buồng trứng - đáp ứng lại các kích thích của FSH và LH tuyến yên.
LH gắn vào thụ thể của nó trên tế bào vỏ nang noãn, kích thích chế tiết androgen, chủ yếu là androstenedione và testosterone. Androgen này được hấp thu vào dịch nang. Sự gắn kết của FSH vào thụ thể của nó trên tế bào hạt sẽ truyền tín hiệu thúc đẩy quá trình thơm hoá các androgens thành estrone và estradiol. Estradiol có tác dụng kích thích nang noãn phát triển, hiệp đồng với FSH gia tăng và duy trì số lượng các thụ thể của FSH trên tế bào hạt, hình thành thụ thể của LH trên tế bào hạt, đồng thời hồi tác dương vào giữa chu kỳ gây nên đỉnh LH phóng noãn.
2.2 Nguyên lý kích thích buồng trứng
Với quá trình phát triển như trên, để có được nhiều nang noãn trưởng thành mỗi chu kỳ, cần tác động vào các biến số sau:
Gia tăng số lượng các nang noãn nhỏ phát triển đến giai đoạn trưởng thành bằng cách tăng cường quá trình chiêu mộ nang noãn.
Tăng số nang noãn vượt qua giai đoạn chọn lọc và vượt trội.
Giảm quá trình thoái hoá nang noãn
Chuẩn bị nội mạc tử cung thuận lợi cho phôi làm tổ bằng nồng độ estradiol do tế bào hạt tiết ra ở các nang noãn phát triển.
2.3 Vai trò FSH và LH trong sự phát triển nang noãn
FSH và LH đóng vai trò cực kỳ quan trọng trong sự phát triển của nang noãn và phóng noãn. LH đảm nhiệm 3 chức năng cơ bản trong mối liên hệ với hoạt động của FSH: LH thúc đẩy tổng hợp androgen ở tế bào vỏ, làm tiền chất cho sự tổng hợp estrogen, kích thích sự trình diện thụ thể trên tế bào hạt và ức chế quá trình chết theo lập trình của các tế bào hạt giúp duy trì hoàng thể. FSH thúc đẩy quá trình thơm hoá tổng hợp estrogen. Khi nang noãn phát triển, FSH giúp hình thành thụ thể LH trên tế bào hạt vào cuối pha nang noãn. Vào giữa chu kỳ, đáp ứng với đỉnh estradiol, đỉnh LH xuất hiện gây phóng noãn và hoàng thể hoá.
Nghiên cứu hoạt động của FSH và LH, người ta nhận thấy ý nghĩa của FSH và LH trong lâm sàng liên quan đến “giá trị ngưỡng” và “giá trị trần”. Sự phát triển hoàn thiện và phóng noãn của nang cũng như khả năng thụ tinh của noãn chỉ xảy ra khi FSH vượt qua giá trị ngưỡng và LH không nên vượt qua giá trị trần cần thiết. Nếu FSH thấp hơn giá trị ngưỡng sẽ làm nang noãn kém phát triển và giảm sản xuất estradiol tế bào hạt. Khi nồng độ LH vượt qua giá trị trần sẽ gây tăng thoái hoá nang, ảnh hưởng chất lượng noãn và tần suất sẩy thai sớm tăng.
2.3.1 “Giá trị ngưỡng” của FSH
Sự phát triển của nang noãn cần thiết có sự kích thích của FSH.
Khi vượt qua giá trị ngưỡng nhất định, FSH thúc đẩy sự phát triển và trưởng thành về mặt chức năng tế bào hạt (hoạt động thơm hoá, hình thành thụ thể LH, tổng hợp inhibin...)
Nang noãn đáp ứng nhạy hơn với FSH (ngưỡng thấp hơn) khi nang càng phát triển và trưởng thành.
Trong quá trình kích thích buồng trứng, nồng độ FSH nên vượt qua giá trị ngưỡng FSH của nang noãn trưởng thành nhất.
2.3.2 “Giá trị trần” của LH
Sự phát triển của nang noãn cần thiết có sự kích thích của LH.
Khi vượt qua giá trị trần nhất định, LH làm giảm sự tăng trưởng của nang noãn, khởi phát quá trình thoái hoá (các nang nhỏ, không vượt trội) hay gây hoàng thể hoá sớm (các nang vượt trội, nang trước phóng noãn).
Nang noãn trưởng thành càng đề kháng nhiều hơn với LH (giá trị trần cao hơn) so với các nang nhỏ.
Trong quá trình kích thích buồng trứng, nồng độ LH không nên vượt qua giá trị trần LH của nang noãn trưởng thành nhất.
3 Các thuốc và phác đồ kích thích buồng trứng
Các thuốc và phác đồ sử dụng trong kích thích buồng trứng có thể phân thành các nhóm
Thuốc uống: Clomiphene citrate, Aromatase inhibitor.
Gonadotropins: gồm các nhóm:
- Human Menopausal Gonadotropin (hMG) chiết xuất từ nước tiểu phụ nữ mãn kinh (chứa đồng thời FSH và LH).
- Follicle Stimulating Hormone (FSH) tái tổ hợp (rFSH), hoặc từ nước tiểu tinh khiết cao.
- Luteinizing Hormone (LH) tái tổ hợp.
- Human Chorionic Gonadotropin (hCG) chiết xuất từ nước tiểu thai phụ hoặc tải tổ hợp.
Gonadotropin releasing hormone (GnRH) agonists/ antagoinsts:
GnRH agonists: gồm Leuprolide acetate, Nafarelin acetate, Buserelin acetate, Goserelin acetate, Triptorelin acetate.
GnRH antagonists: gồm Cetrorelix acetate và Ganirelix acetate.
3.1 Thuốc uống
Các chế phẩm thuốc uống nhằm kích thích giải phóng gonadotropin nội sinh theo các cách khác nhau.
Clomiphene citrate Clomiphene citrate được tổng hợp năm 1956, thử nghiệm lâm sàng năm 1960 và được dùng trong lâm sàng ở Hoa Kỳ từ năm 1967. Đây là một loại nonsteroid đường uống gốc triphnylethylene có cấu trúc tương tự như diethylstilbestrol. Clomiphene citrate là một hỗn hợp của hai đồng phân hoá học dạng cis và trans, được gọi là zuclomiphene và enclomiphene citrate.
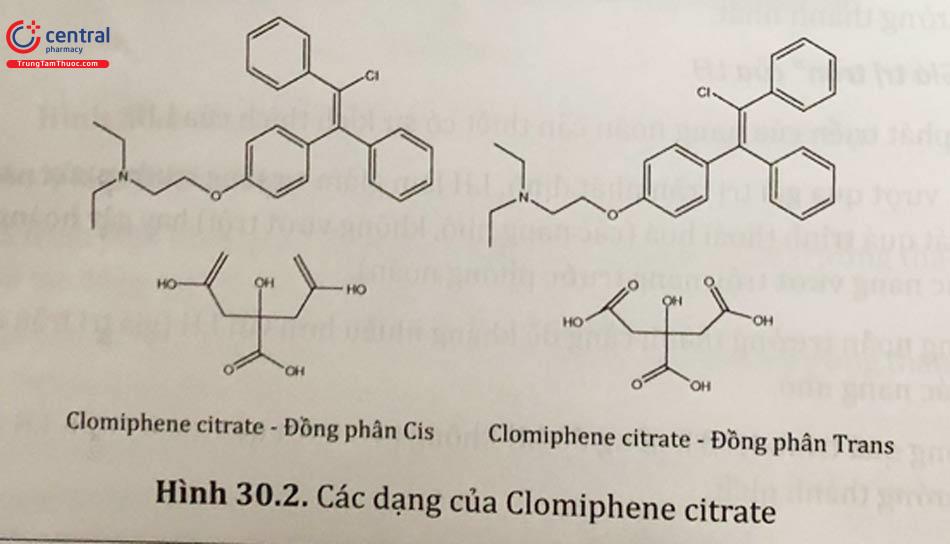
Tin Clomiphene biểu hiện hoạt tính estrogenic rất yếu. Nhờ cấu trúc tương tự với estrogen mà nó có thể gắn lên các thụ thể của estrogen. Clomiphene có thể gắn vào thụ thể nhân trong một thời gian dài, đến vài tuần lễ, làm thay đổi hoạt động của vùng dưới đồi bằng cách ảnh hưởng nồng độ các thụ thể estrogen nội bào. Đặc biệt, nồng độ thụ thể estrogen giảm đi do quá trình “phục hồi” bị ức chế.
Vì thế, khi tiếp xúc với clomiphene, vùng dưới đồi - tuyến yên không thể nhận biết nồng độ estrogen nội sinh thật sự trong tuần hoàn, do số thụ thể giảm đi và tín hiệu “giả” về nồng độ estrogen tuần hoàn đang rất thấp, cơ chế hồi tác âm tính bị mất tác dụng làm hoạt hoá sự chế tiết GnRH. Trong chu kỳ có dùng clomiphene, người ta nhận thấy tần số LH và FSH tăng lên (nhưng không tăng cường độ), chứng tỏ có sự tăng tần số GnRH tương ứng. Nồng độ FSH và LH nội sinh tăng lên kích thích nang noãn phát triển và phóng noãn. Như vậy, clomiphene không trực tiếp kích thích nang noãn mà nó giúp thúc đẩy chuỗi các sự kiện diễn ra theo sinh lý của chu kỳ bình thường.
Do có hoạt tính estrogenic, khi có hiện diện estrogen, clomiphene tăng đáp ứng của tuyến yên với GnRH, thúc đẩy chế tiết FSH, tác động trực tiếp lên buồng trứng. Khi không có hiện diện của estrogen, clomiphene hoạt động như một đồng vận của estrogen, thúc đẩy trực tiếp sự kích thích của FSH trong việc hình thành thụ thể LH trên tế bào hạt.
Đối với tử cung, cổ tử cung và âm đạo, clomiphene biểu hiện hoạt tính kháng estrogen. Nó tác động đối vận làm mỏng biểu mô âm đạo, chất nhầy cổ tử cung ít và đặc, nội mạc tử cung kém phát triển, ảnh hưởng đến sự di chuyển của tinh trùng, khả năng làm tổ và phát triển của phôi.
Clomiphene không có tác dụng progestational, corticotropic, androgenic hay antiandrogenic. Nó không liên quan đến chức năng tuyến thượng thận hay tuyến giáp. Sau khi uống clomiphene 5 ngày, thì chỉ có 51% bị đào thải, nồng độ đáng kể đồng phân zuclomiphene citrate có thể phát hiện trong huyết thanh đến 1 tháng sau uống và trong phân đến 6 tuần lễ.
Về cách sử dụng clomiphene citrate (CC), có nhiều quan điểm khác nhau, thường bắt đầu với liều thấp (50 mg/ngày) dùng trong 5 ngày kể từ ngày thứ 2, 3, 4, hoặc ngày 5 của vòng kinh. Quan điểm bắt đầu dùng CC sớm trong chu kỳ nhằm tăng số nang noãn chiêu mộ tiếp tục phát triển và vượt trội. Nếu bắt đầu từ ngày thứ 5 đến ngày 9, gonadotropin tăng lên do CC sẽ tương ứng với thời gian các nang noãn chọn lọc và vượt trội, thường vào ngày 7 chu kỳ. Tuy nhiên sự khác biệt về hiệu quả khi bắt đầu dùng CC ở những thời điểm khác nhau không rõ ràng.
Nếu liều thấp CC không thành công, những chu kỳ sau có thể tăng liều mỗi 50 mg, liều tối đa 250 mg/ngày trong 5 ngày, có thể lặp lại đến 3 - 4 tháng với liều cao nhất trước khi được xem là thất bại với CC. Tuy nhiên, người ta nhận thấy khi tăng liều CC trên 150 mg/ngày thường hiệu quả không rõ ràng, mà lúc này nên đổi phác đồ kích thích hơn là tiếp tục tăng liều CC.
Liều sử dụng CC có liên quan chặt chẽ với cân nặng bệnh nhân. Clomiphene không bị tích luỹ trong mô mỡ, nhưng ở những phụ nữ béo nên dùng liều cao hơn. Điều này có thể do nồng độ androgen cao hơn ở những người này làm tăng đề kháng trục dưới đồi - tuyến yên - buồng trứng.
Một số tác dụng phụ của Clomiphene được ghi nhận: nóng bừng (10%), căng bụng (5%), đau ngực (2%), buồn nôn (2,2%), mờ mắt (1,5%), nhức đầu (1,3%), rụng tóc (0,5%)... Tuy nhiên các triệu chứng thường biểu hiện nhẹ và tự khỏi sau vài ngày, ít khi phải ngưng điều trị vì tác dụng phụ. Clomiphene citrate hiện có trên thị trường dạng viên nén hàm lượng 50mg như Clomid (Merrell), Serophene (Serono) hay ovofar (Organon), Clomhexal (Hexal), Duinum...
3.1.1 Chất ức chế men thơm hoá (Aromatase inhibitor)
Aromatase là thành viên của họ enzyme chứa heamoprotein P450 cytochrome (P450arom) xúc tác quá trình thơm hoá sản xuất estrogen, cụ thể là chuyển androstenedione và Testosterone tương ứng thành estrone và estradiol. Hoạt động thơm hoá diễn ra ở nhiều loại mô khác nhau như mô buồng trứng, não, mỡ, gan, cơ, mô vú. Nguồn estrogen chủ yếu lưu hành ở phụ nữ độ tuổi sinh sản là từ buồng trứng, phụ nữ sau mãn kinh là từ mô mỡ.
Trong hơn 20 năm qua, nhiều loại ức chế men thơm hóa (AI) được tổng hợp và nghiên cứu lâm sàng. Nhóm AI thế hệ 3 là nhóm thành công nhất được chấp nhận dùng điều trị ung thư vú.

AI thế hệ thứ ba hiện có trên thị trường là hai thuốc nhóm nonsteroid - anastrozole và letrozole; và một thuốc có nhân steroid - exemestane. Anastrozle và letrozole là thuốc ức chế men thơm hoá và Exemestane là thuốc bất hoạt men thơm hoá. Các thuốc ức chế men thơm hoá thế hệ thứ ba có nhiều ưu điểm như: tác động ức chế men thơm hóa mạnh, rất đặc hiệu trong ức chế men thơm hoá, không ức chế tổng hợp các hormone steroid khác, dùng đường uống và dung nạp tốt, hoạt tính sinh học 100% sau khi uống, thanh thải nhanh (thời gian bán huỷ 30 - 60 giờ, trung bình 45 giờ), không tích tụ thuốc và các sản phẩm chuyển hoá, ít tác dụng phụ, rất an toàn, không có chống chỉ định đáng kể và không đắt tiền.
Quá trình thơm hoá là bước cuối cùng trong sinh tổng hợp estrogen. Khi sử dụng AI, đặc biệt là Al thế hệ thứ ba, vào đầu chu kỳ kinh nguyệt, nó sẽ ngăn chặn sản xuất estrogen do ức chế quá trình thơm hoá. Vì thế nồng độ estrogen trong tuần hoàn giảm đi thật sự. Vùng dưới đồi và tuyến yên lúc này không còn bị ức chế do hồi tác âm tính của estrogen sẽ tăng hoạt động, kích thích sản xuất gonadotropin nội sinh. Ở ngoại biên, Al tác động lên buồng trứng gây tăng nhạy cảm của nang noãn với FSH. Đây có thể là do sự tích tụ androgen trong nang noãn do quá trình thơm hoá bị ngăn chặn trước đó.
AI được dùng để kích thích buồng trứng bắt đầu từ ngày 2 của chu kỳ, kéo dài trong 5 ngày. Liều đề nghị Letrozole (Femara 2,5 mg, Norvatis) 2,5 - 5 mg/ngày hoặc Anastrozole (Arimidex 1 mg, Astra Zeneca) liều 2 - 5 mg/ngày.
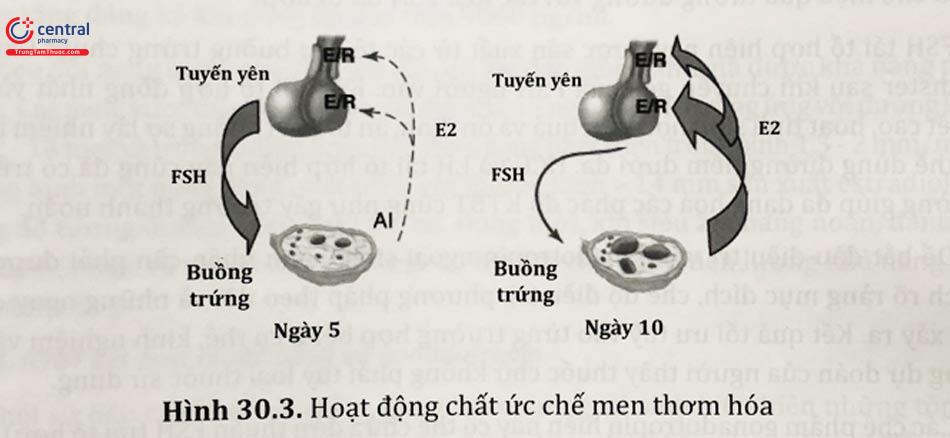
Các nghiên cứu ban đầu về tác dụng của AI cho thấy, AI có tác dụng kích thích buồng trứng ở bệnh nhân không rụng trứng gia tăng rụng trứng ở bệnh nhân có rụng trứng, kích thích buồng trứng ở những bệnh nhân thất bại với CC và giảm liều FSH trong kích thích buồng trứng. So với clomiphene citrate, AI có thời gian bán huỷ ngắn nên không tích luỹ trong cơ thể, không có tác dụng điều hoà giảm thụ thể estrogen tại mô đích do không có tác dụng kháng estrogen, không gây các tác động bất lợi như làm mỏng nội mạc tử cung hay giảm chất nhầy cổ tử cung. Một số nghiên cứu cho thấy, dù nồng độ E2 khi dùng AI có thể thấp hơn so với khi dùng CC, nhưng nội mạc tử cung dày hơn và tỷ lệ có thai có vẻ như cải thiện hơn so với CC. Tuy nhiên, thời gian bán huỷ ngắn cũng là một khuyết điểm của AI khi không thể duy trì tác dụng được lâu sau khi ngừng thuốc, nhưng nếu dùng kéo dài sẽ làm thiếu estrogen.
Nghiên cứu của chúng tôi, so sánh với CC, kích thích buồng trứng bằng AI cho các trường hợp vô sinh có HCBTĐN, số ngày chu kỳ tính đến khi nang trưởng thành trong nhóm AI ngắn hơn (15,1 ± 2,9) so với nhóm CC (16,5 ± 2,8) có ý nghĩa thống kê. Số nang trưởng thành 2 nhóm không có sự khác biệt với tỷ lệ 81,3% (AI) và 84,4% (CC) nhưng tỷ lệ đơn nang cao hơn trong nhóm AI (71,9%) so với nhóm CC (65,7%) và không có trường hợp nào có 3 - 4 nang trưởng thành trong nhóm AI. Tỷ lệ nội mạc mỏng (<8mm) trong nhóm AI (25%) thấp hơn có ý nghĩa thống kê so với nhóm CC (53,1%) và tỷ lệ phóng noãn cao hơn (68,8%) so với nhóm CC (56,3%) nhưng chưa thấy ý nghĩa thống kê.
3.2 Chế phẩm chứa Gonadotropins ngoại sinh
Các thuốc uống có tác dụng tăng nồng độ gonadotropin nội sinh từ tuyến yên. Tuy nhiên, trong nhiều trường hợp, sự chế tiết của tuyến yên hạn chế và hiệu quả của kích thích vì thế cũng không tối ưu. Với tác dụng trực tiếp của gonadotropin ngoại sinh đưa từ bên ngoài vào việc cải thiện khả năng phát triển nang noãn tốt hơn.
Gonadotropin bị bất hoạt khi uống mà chỉ có thể dùng đường ngoại biên. Những năm gần đây các chế phẩm FSH nước tiểu tinh khiết cao đã tách bỏ phần lớn lượng LH có thể tiêm dưới da. Các nghiên cứu tổng hợp đã cho thấy hiệu quả điều trị với hMG cho hiệu quả tương đương với các loại FSH tái tổ hợp.
FSH tái tổ hợp hiện này được sản xuất từ các tế bào buồng trứng chuột Chinese Hamster sau khi chuyển gen của FSH người vào. FSH tái tổ hợp đồng nhất và tinh khiết cao, hoạt tính sinh học hiệu quả và ổn định, an toàn vì không sợ lây nhiễm bệnh, có thể dùng đường tiêm dưới da. HCG và LH tái tổ hợp hiện nay cũng đã có trên thị trường giúp đa dạng hoá các phác đồ kích thích buồng trứng cũng như gây trưởng thành noãn.
Để bắt đầu điều trị với gonadotropin ngoại sinh, bệnh nhân cần phải được giải thích rõ ràng mục đích, chế độ điều trị, phương pháp theo dõi và những nguy cơ có thể xảy ra. Kết quả tối ưu tuỳ vào từng trường hợp bệnh cụ thể, kinh nghiệm và khả năng dự đoán của người thầy thuốc chứ không phải tuỳ loại thuốc sử dụng.
Các chế phẩm gonadotropin hiện nay có thể chứa đơn thuần FSH (tái tổ hợp), một số chứa cả FSH và LH với tỷ lệ bằng nhau, hoặc FSH kèm hCG thay vì LH. Các sản phẩm này có sẵn trong lọ dưới dạng bột đông khô, được pha loãng với dung môi trước khi tiêm. FSH, LH hay hCG tái tổ hợp hiện nay đều có sẵn, dưới dạng lọ đa liều, ống tiêm hoặc bút tiêm. Các thuốc tái tổ hợp giúp loại bỏ các protein gây kèm theo trong nước tiểu, đồng nhất và hoạt tính sinh học chính xác (75 IU FSH = 5,5 kg protein).
3.2.1 Kích thích buồng trứng với gonadotropin ngoại sinh
Trong các chu kỳ kích thích phóng noãn để thụ tinh nhân tạo (Intrauterine insemination - IUI), liều khởi đầu thông thường của gonadotropin là 75 IU mỗi ngày, tăng lên 150 IU nếu không đạt được đáp ứng của buồng trứng như mong đợi. Khi sử dụng gonadotropins, nên theo dõi chặt chẽ đáp ứng nang noãn và sử dụng liều khởi đầu thấp nhất để giảm thiểu nguy cơ đa thai và quá kích buồng trứng.
Trong thụ tinh ống nghiệm, liều lượng thuốc sử dụng rất khác nhau, thay đổi giữa các bệnh nhân, cũng như trên cùng một bệnh nhân ở những thời điểm khác nhau trong đó liều khởi đầu là một yếu tố quan trọng. Liều FSH dựa trên dự đoán đáp ứng buồng trứng: đáp ứng bình thường, đáp ứng kém hay đáp ứng cao. Các chỉ báo đáp ứng buồng trứng chủ yếu dựa vào tuổi đời, chỉ số nang thứ cấp (AFC) và AMH, cùng với một số yếu tố tham khảo khác như BMI, tiền sử đáp ứng buồng trứng trước đây, FSH và estradiol cơ bản. Thường bắt đầu kích thích buồng trứng với FSH từ ngày 2 - 3 chu kỳ kinh, dùng liên tục và đánh giá đáp ứng của bệnh nhân vào ngày 7 chu kỳ qua hình ảnh siêu âm nang noãn đầu dò âm đạo, quan sát số lượng và kích thước của nang noãn. Việc xét nghiệm estradiol hay điều chỉnh liều FSH sau ngày 7 được chứng minh là ít có giá trị trong cải thiện hiệu quả của kích thích buồng trứng. Thời gian kích thích buồng trứng để đạt nang noãn trưởng thành thường sau 8 - 10 ngày dùng gonadotropin. Khi có ít nhất 1 nang đường kính từ 18 mm hoặc 2 nang từ 17 mm trở lên thì có thể gây trưởng thành nang noãn bằng hCG hoặc GnRH agonist. r
Định lượng nồng độ estrogen có thể giúp tham khảo trong theo dõi đáp ứng nang noãn và dự phòng quá kích buồng trứng trước khi tiêm hCG. Nguy cơ quá kích buồng trứng tăng đáng kể khi nồng độ này trên 4000 pg/ml.
Theo dõi nang noãn qua siêu âm đầu dò âm đạo giúp đánh giá được khả năng phát triển. Các nang vượt trội có thể quan sát được sau 5 ngày kích thích buồng trứng, tương ứng với đường kính từ 12 - 14 mm và trong những ngày tiếp theo, nang phát triển trung bình 1,5 - 2 mm/ngày. Trung bình một nang đang phát triển với đường kính > 14 mm sản xuất estradiol với nồng độ tương đương 200 - 400 pg/ml. Đồng thời, khi siêu âm nang noãn, đánh giá độ dày nội mạc tử cung cũng như mật độ hồi âm cho phép tiên lượng khả năng làm tổ thành công.
3.2.2 Kích thích buồng trứng kết hợp thuốc uống và gonadotropin
Thật sự bên cạnh các ưu điểm, gonadotropin ngoại sinh biểu hiện những tồn tại như là nguy cơ quá kích cao và giá thành tốn kém. Để khắc phục nhược điểm này, người ta có thể kết hợp thuốc uống clomiphene citrate hay Al với gonadotropin. CC hay Al được sử dụng vào đầu chu kỳ làm tăng nồng độ FSH nội sinh, tăng chiêu mộ nang noãn, sau đó FSH ngoại sinh sẽ được bổ sung vào nhằm duy trì và thúc đẩy sự phát triển hơn nữa các nang noãn.
CC thường được sử dụng đường uống với liều 100 mg bắt đầu từ ngày 2 - 6 chu kỳ, hoặc AI dùng đường uống liều 5 mg/ngày cũng từ ngày 2 - 6. FSH được dùng tiêm dưới da vào ngày 5 và ngày 7 liều từ 50 - 150 IU/ngày. Đánh giá sự đáp ứng của bệnh nhân vào ngày 8 qua siêu âm và điều chỉnh liều FSH cho phù hợp với sự phát triển nang noãn. Nói chung, khi nang noãn lớn nhất đạt đến 18 mm và nội mạc tử cung trên 8 mm có thể cho hCG. Phương pháp này cho phép giảm đi khoảng 50% lượng gonadotropin so với khi dùng gonadotropin đơn thuần. Tuy nhiên nguy cơ đa thai và quá kích buồng trứng không cải thiện đáng kể.
3.2.3 Phác đồ tăng liều dần
FSH được bắt đầu với liều thấp, khoảng 37,5 - 50 IU/ngày liên tục trong 14 ngày. Siêu âm và xét nghiệm nội tiết đánh giá lần đầu vào ngày 14. Nếu có đáp ứng vẫn duy trì liều cũ đến khi cho hCG. Nếu chưa có đáp ứng, nang nhỏ dưới 10 mm, có thể tăng 37,5 IU/tuần. Liều tối đa 200 IU/ngày và không quá 35 ngày cho toàn bộ chu kỳ điều trị.
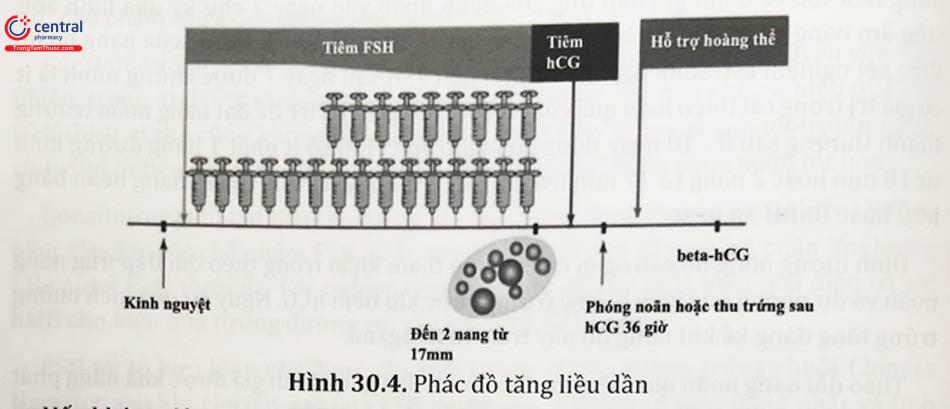
Nếu không đảm bảo các điều kiện trên (không có nang vượt trội khi dùng liều tối đa 1 tuần hay tổng thời gian điều trị quá 35 ngày) chu kỳ được xem như thất bại và phải ngưng. Ưu điểm phác đồ này là an toàn hơn cho bệnh nhân, liều thuốc sử dụng ít hơn, tuy nhiên thời gian thường kéo dài.
3.2.4 Phác đồ giảm liều dần
Phác đồ này nhằm tạo ra nồng độ FSH trong tuần hoàn giống với sinh lý hơn. Liều cao FSH được sử dụng ngay đầu chu kỳ, thường tham khảo liều tối đa đã thất bại trong phác đồ step-up, có thể bắt đầu với 150 IU/ngày. Liều này được duy trì cho đến khi có nang vượt trội (đường kính trên 10 mm) thì bắt đầu giảm liều. Liều giảm FSH khoảng 37,5 IU/ngày cách mỗi 3 ngày cho đến khi liều dùng còn 50 - 75 IU/ngày và nang noãn đạt chuẩn thì cho hCG.
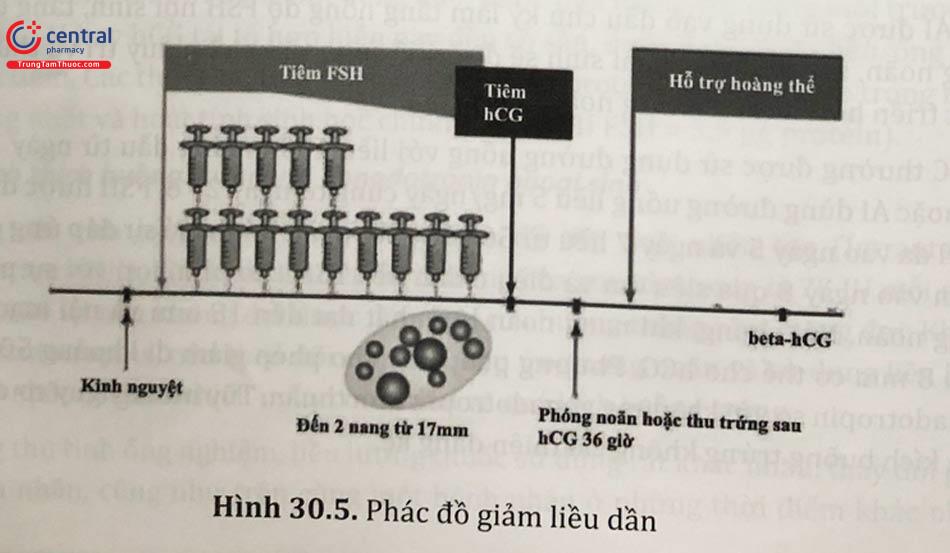
3.2.5 Bổ sung LH trong kích thích buồng trứng
Theo sinh lý buồng trứng, trong khi vai trò FSH từ lâu đã được xác định rõ ràng và có ý nghĩa quyết định, LH và hCG gần đây mới được quan tâm nhiều hơn.
So với FSH chỉ có thụ thể trên tế bào hạt, thụ thể LH hiện diện cả trên tế bào vỏ và tế bào hạt. Trong pha nang noãn sớm, LH tác động trên tế bào vỏ để tổng hợp androgen, là tiền chất cho sự thơm hoá thành estradiol và tăng hiện diện thụ thể FSH trên tế bào hạt. Đồng thời LH tác động trên tế bào hạt từ pha nang noãn muộn giúp tăng sinh tế bào và hạn chế chết tế bào.
Như vậy, sự hiện diện LH là rất cần thiết cho sự phát triển nang noãn bình thường. Tuy nhiên, bằng chứng y văn ghi nhận việc bổ sung thường quy LH cho tất cả các trường hợp có kích thích buồng trứng không mang lại sự khác biệt có ý nghĩa về tỷ lệ sinh sống. Những trường hợp cần bổ sung LH được xác định gồm suy tuyến sinh dục do suy trung ương, thiếu hụt gonadotropin bẩm sinh hoặc mắc phải, thiếu hụt gonadotropin do sử dụng các phác đồ kích thích buồng trứng có sử dụng các đồng dạng GnRH (phác đồ đồng vận dài hoặc phác đồ đối vận), gây suy giảm chức năng tuyến yên (định lượng LH < 1,2 IU/l và FSH < 5 IU/l). Cường độ ức chế theo thời gian nghiêm trọng hơn nồng độ LH huyết thanh tuyệt đối. Những trường hợp phụ nữ lớn tuổi (trên 35 tuổi) cần bổ sung LH do có sự giảm hoạt tính sinh học của gonadotropin, các thụ thể đặc hiệu kém và đồng thời giảm tổng hợp steroids sinh dục. Đặc biệt, một số trường hợp đa hình thụ thể gonadotropin của FSH và làm giảm tác động của gonadotropin nội sinh, cần tăng liều lượng gonadotropin ngoại sinh khi kích thích buồng trứng.
Các nghiên cứu về liều LH tái tổ hợp tối ưu để sử dụng nhằm đạt hiệu quả kích thích buồng trứng tốt nhất mà không vượt qua giá trị trần của LH, đã thống nhất liều LH 75 IU/ngày là vừa đủ cho đa số bệnh nhân. Thời điểm sử dụng LH tái tổ hợp có thể bắt đầu từ ngày đầu tiên kích thích buồng trứng hoặc nửa sau của pha nang noãn.
3.2.6 Bổ sung hCG trong kích thích buồng trứng
hCG và LH có cấu trúc phân tử tương tự nhau, đều thuộc nhóm hormone glycoprotein. Tuy nhiên, hCG chứa một cấu trúc mở rộng bao gồm 24 Amino acid tận cùng khác biệt, dẫn đến thời gian bán huỷ dài hơn. Trong sinh lý, vai trò LH được nhắc đến nhiều về khả năng gây phóng noãn và duy trì hoàng thể trong chu kỳ kinh nguyệt. hCG từ nguồn gốc nhau thai xuất hiện từ khi có sự làm tổ, được chế tiết từ gai nhau giúp duy trì hoàng thể thai kỳ và giữ vai trò quan trọng trong giúp thai phát triển. Tuy nhiên, các bằng chứng nghiên cứu đã xác định tại tuyến yên, GnRH kích thích giải mã đồng thời tiểu đơn vị ßhCG và tiểu đơn vị BLH. Gen quy định BLH/BhCG nằm ở locus 19q13.32 và tín hiệu GnRH từ các tế bào gonadotrophe của tuyến yên trong các chu kỳ tự nhiên kích thích sản sinh cả LH và hCG. Sau dậy thì, LH và hCG được tiết đều đặn trong các chu kỳ kinh ở phụ nữ có phóng noãn với nồng độ tăng dần theo tuổi và tăng cao sau mãn kinh. Mặc dù LH và hCG cùng gắn thụ thể LH/ hCG nhưng hoạt hoá con đường tín hiệu nội bào khác nhau về mặt số lượng và chất lượng: hCG có hiệu lực mạnh hơn gấp sáu lần LH do có thời gian bán huỷ dài hơn và tốc độ phân ly nhanh hơn. Trên cơ sở đó, chế phẩm Gonadotropin có chứa hCG được dùng trong kích thích buồng trứng đã cho thấy có hiệu quả khả quan hơn so với FSH tái tổ hợp đơn thuần. Tỷ lệ thai diễn tiến, tỷ lệ sinh sống sau kích thích buồng trứng của HP-hMG (Highly purified-human menopausal gonadotrophin) trong chuyển phôi tươi cũng như phôi trữ đều tốt hơn so với FSH đơn thuần. Về phương diện phôi học, mặc dù số noãn ít hơn, hình thái phôi nang ngày 5 trong nhóm dùng HP-hMG có vẻ không đẹp như trong nhóm dùng FSH, nhưng tỷ lệ trẻ sinh sống cộng dồn trong 6 tháng tương đương, dù số lần chuyển phôi ít hơn và số phôi chuyển ít hơn và đồng thời tỷ lệ mất thai cộng dồn thấp hơn. Như vậy, việc bổ sung hCG cùng với FSH có thể cải thiện chất lượng noãn và kết cục thai kỳ.
3.3 Vai trò các chất đồng dạng GnRH
3.3.1 Chất đồng vận GnRH
GnRH tự nhiên bị phân huỷ nhanh chóng do các liên kết giữa amino acid 5 - 6, 6 - 7 và 9 - 10 rất dễ bị cắt đứt. Vì thế, bằng cách thay thế các amino acid ở các vị trí này người ta có thể tổng hợp nên các GnRH đồng dạng với các đặc tính khác nhau. Chất đồng vận GnRH (Gonadotropin Releasing Hormone agonist - GnRHa) được tạo ra do thay thế amino acid vị trí thứ 6 hoặc vị trí thứ 10, có ái lực mạnh hơn đối với các thụ thể của GnRH, thời gian bán huỷ dài hơn nên hoạt tính sinh học mạnh hơn gấp 50 - 100 lần.
Ban đầu GnRHa có tác dụng đồng vận (còn gọi là tác dụng flare-up - kích hoạt) làm tăng nồng độ FSH và LH tuần hoàn tương đương với nồng độ các chất này giữa chu kỳ. Tác dụng này thấy rõ trong giai đoạn sớm pha nang noãn. Sau 2 - 3 tuần sử dụng, GnRHa gây nên sự trơ hoá và điều hoà giảm thụ thể GnRH trên tuyến yên dẫn đến tình trạng giảm hoạt động tuyến sinh dục do giảm hoạt động tuyến yên.
Sự chế tiết gonadotropin của tuyến yên không phải mất đi mà vẫn duy trì ở mức độ cơ bản, trừ một số trường hợp tuyến yên bị ức chế quá mức. Hiệu quả quan trọng của GnRH là ngăn chặn sự xuất hiện đỉnh LH sớm khi nang noãn đang phát triển. Tuy nhiên, sau khi ngưng thuốc, sự chế tiết FSH và LH sẽ phục hồi.
Trong kích thích buồng trứng thực hiện hỗ trợ sinh sản, đặc biệt là thụ tinh trong ống nghiệm, GnRHa tỏ ra rất hiệu quả trong cả hai tác dụng kích hoạt và điều hoà giảm khi phối hợp với gonadotropin.
3.3.1.1 Phác đồ cực ngắn
Đây là phác đồ kích thích buồng trứng dựa vào tác dụng flare-up của GnRHa nhằm tăng nồng độ gonadotropin nội sinh phối hợp với gonadotropin ngoại sinh thêm vào tăng khả năng phát triển của nang noãn.
GnRHa được dùng chỉ trong 3 ngày đầu chu kỳ, bắt đầu từ ngày 2 với liều thấp. FSH cũng được cho vào từ ngày 2 song song với GnRH và kéo dài cho đến thời điểm tiêm hCG. Với phác đồ này, tỷ lệ xuất hiện đỉnh LH sớm cao.
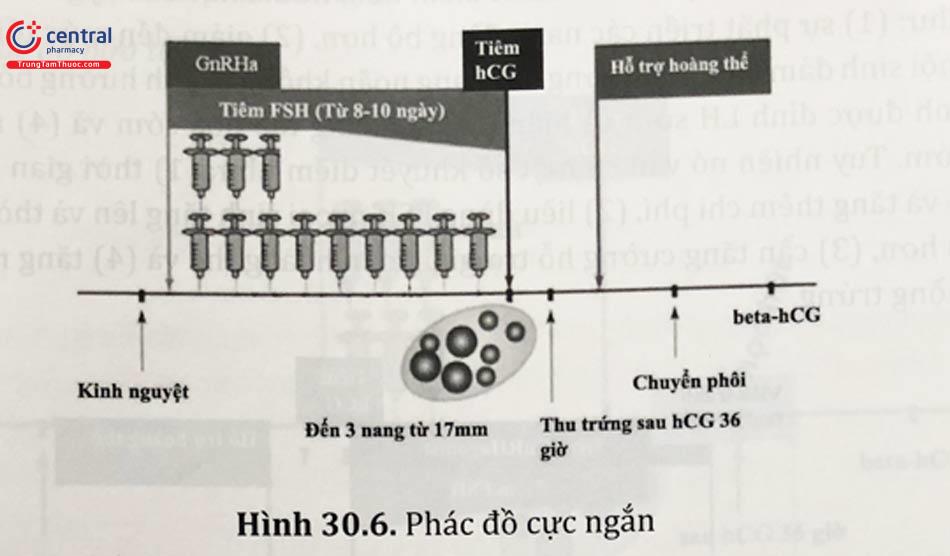
3.3.1.2 Phác đồ ngắn
GnRHa được dùng từ đầu chu kỳ cùng với FSH và kéo dài đến khi tiêm hCG. Phác đồ này tận dụng cả hai hiệu quả hoạt hóa (flare-up) và ức chế (down regulation) của GnRHa. Nói chung hai phác đồ trên có ưu điểm là (1) thời gian cho thuốc ngắn hơn, (2) số lượng thuốc dùng ít hơn và (3) khả năng thành công ở một số phụ nữ lớn tuổi. Tuy nhiên khuyết điểm tồn tại vẫn là nguy cơ cao xuất hiện đỉnh LH sớm, các nang noãn phát triển không đồng bộ.
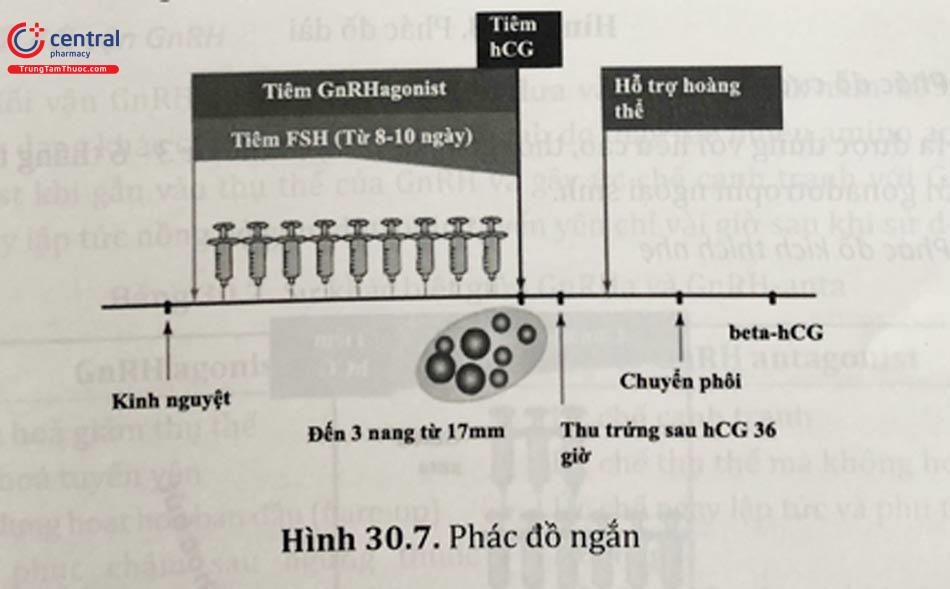
3.3.1.3 Phác đồ dài
Đây là phác đồ trước đây được nhiều trung tâm lựa chọn trong các chu kỳ thụ tinh ống nghiệm. Phác đồ này dùng GnRHa trong 2 - 3 tuần từ chu kỳ trước nhằm đạt được tình trạng trơ hoá của tuyến yên. Thời điểm bắt đầu có thể là đầu chu kỳ trước hoặc từ pha hoàng thể (ngày 21 chu kỳ).
Sau khi khống chế được nồng độ gonadotropin đến mức cơ bản và buồng trứng không có nang chức năng. FSH được cho vào để kích thích nang noãn song song với GnRHa duy trì ở liều thấp cho đến thời điểm tiêm hCG. Phác đồ này tỏ ra có nhiều ưu điểm như: (1) sự phát triển các nang đồng bộ hơn, (2) giảm đến mức tối thiểu nồng độ LH nội sinh đảm bảo chất lượng các nang noãn không bị ảnh hưởng bởi androgen, (3) tránh được đỉnh LH sớm và hiện tượng hoàng thể hoá sớm và (4) ngăn phóng noãn sớm. Tuy nhiên nó vẫn có một số khuyết điểm như: (1) thời gian dùng GnRH kéo dài và tăng thêm chi phí, (2) liều dùng FSH ngoại sinh tăng lên và thời gian dùng kéo dài hơn, (3) cần tăng cường hỗ trợ giai đoạn hoàng thể và (4) tăng nguy cơ quá kích buồng trứng.
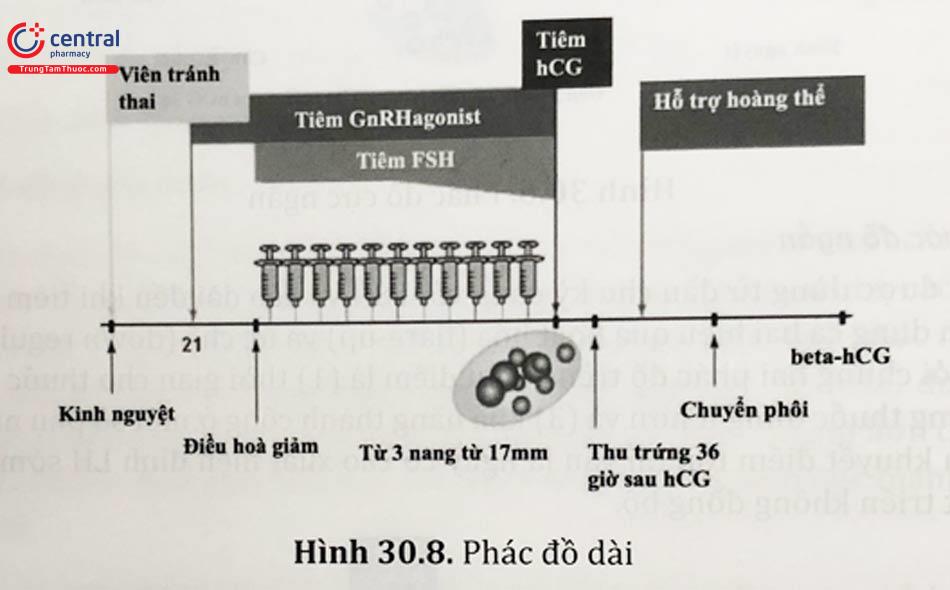
3.3.1.4 Phác đồ cực dài
GnRHa được dùng với liều cao, thời gian kéo dài, có thể từ 3 - 6 tháng trước khi kích thích buồng trứng với gonadotropin ngoại sinh.
3.3.1.5 Phác đồ kích thích nhẹ
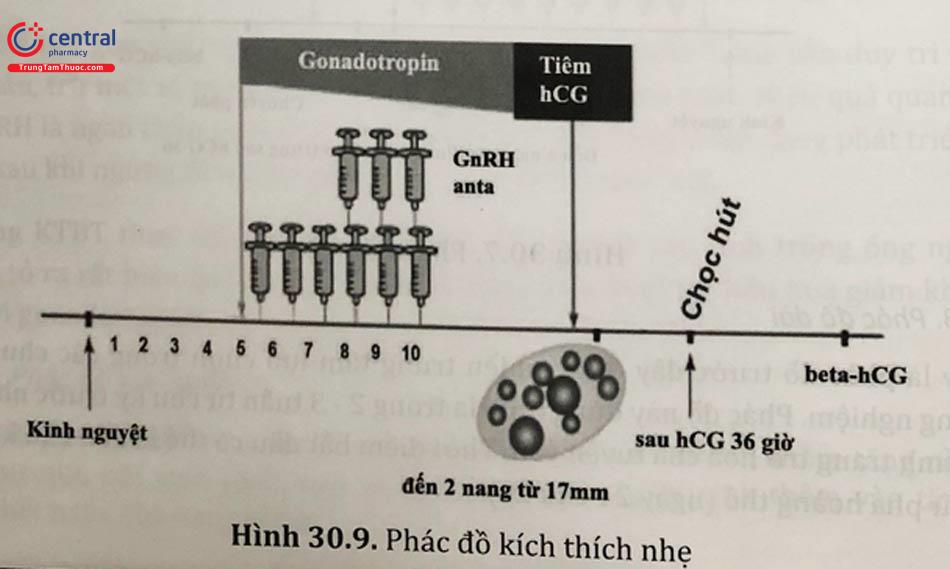
Bắt đầu gonadotropin ngoại sinh sau ngày 5 - 6 chu kỳ để tận dụng tác dụng của gonadotropins nội sinh trước đó. Kết hợp GnRHantagonist khi có nang trội và trigger bằng hCG tương tự như phác đồ ngắn.
3.3.1.6 Phác đồ nửa tự nhiên
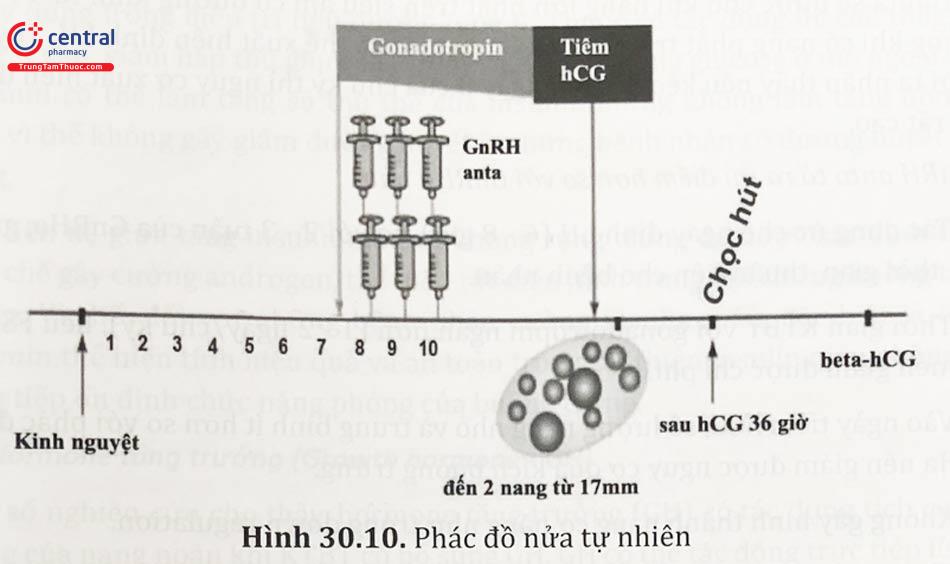
Chỉ định gonadotropins ngoại sinh kết hợp đồng thời với GnRHantagonist chỉ thực hiện trong 2 - 3 ngày khi nang từ 14 mm trở lên, với mục tiêu thu được từ 1 -2 nang trưởng thành.
Chất đối vận GnRH
Chất đối vận GnRH-anta ra đời và được đưa vào sử dụng từ năm 1998. Đây là một đồng dạng khác của GnRH, được tạo thành do thay thế nhiều amino acid. GnRH antagonist khi gắn vào thụ thể của GnRH và gây ức chế cạnh tranh với GnRH, làm giảm ngay lập tức nồng độ gonadotropin tuyến yên chỉ vài giờ sau khi sử dụng.
Dưới đây là bảng phân biệt giữa GnRH angonist và GnRH antagonist
| GnRH angonist | GnRH antagonist |
| Điều hòa giảm thụ thể | Ức chế cạnh tranh |
| Trơ hóa tuyến yên | Ức chế thụ thể mà không hoạt hóa |
| Tác dụng hoạt hóa ban đầu | Ức chế ngay lập tức và không phụ thuộc liều sử dụng |
| Hồi phục chậm sau ngưng thuốc ( trung bình 2 tuần, tối đa 6 tuần ) | Hồi phục nhanh sau khi ngưng thuốc ( trong vòng 2 ngày đối với các loại tác dụng ngắn 0,25mg ) |
GnRHanta có thể được dùng một liều duy nhất hay đa liều, theo thời điểm cố định của chu kỳ kích thích buồng trứng (chương trình hoá) hay theo đáp ứng của từng bệnh nhân. Nếu điều trị theo chương trình, ngày bệnh nhân bắt đầu dùng FSH được tính là ngày 1, thì GnRHanta sẽ cho vào ngày 6 (120 giờ sau FSH), liều duy nhất 3mg tiêm dưới da. Với cách sử dụng đa liều, tiêm dưới da 0,25 mg/ngày. Theo dõi sự phát triển nang noãn và cho hCG như trong phác đồ dài hoặc dùng GnRHa để gây trưởng thành noãn dựa vào tác dụng flare-up của GnRHa. Nếu cho theo đáp ứng bệnh nhân thì GnRHanta sẽ được cho khi nang lớn nhất trên siêu âm có đường kính từ 14 mm, vì thường khi có nang phát triển trên 14 mm mới có thể xuất hiện đỉnh LH. Tuy nhiên người ta nhận thấy nếu kéo dài sau ngày 8 của chu kỳ thì nguy cơ xuất hiện đỉnh LH sớm rất cao.
GnRH anta tỏ ra ưu điểm hơn so với GnRHa như:
- Tác dụng ức chế ngay đỉnh LH (6 - 8 giờ), so với 2 - 3 tuần của GnRHa, giúp tiết kiệm thời gian, thuận tiện cho bệnh nhân.
- Thời gian kích thích buồng trứng với gonadotropin ngắn hơn (1 - 2 ngày/chu kỳ), liều FSH ngắn hơn, nên giảm được chi phí.
- Vào ngày tiêm hCG, số lượng nang nhỏ và trung bình ít hơn so với phác đồ dùng GnRHa nên giảm được nguy cơ quá kích buồng trứng.
- Không gây hình thành nang cơ năng như trong down regulation.
- Khi có nguy cơ quá kích buồng trứng với phác đồ GnRHanta, có thể dùng GnRHa thay cho hCG gây trưởng thành và phóng noãn.
Tuy nhiên, GnRHanta không phải không có những khuyết điểm so với GnRHa:
Sự phát triển của các nang trong chu kỳ không đồng bộ.
Nguy cơ xuất hiện đỉnh LH sớm vẫn cao hơn do việc theo dõi không thể chặt chẽ.
Có thể gây tình trạng thiếu hụt LH trong giai đoạn nang noãn phát triển do tác động ức chế quá mức.
3.4 Các phương pháp khác
3.4.1 Bromocriptin
Nồng độ prolactin trong tuần hoàn cao có thể gây ức chế tiết GnRH vùng dưới đồi, dẫn đến sự giảm chế tiết gonadotropin tuyến yên và ảnh hưởng đến khả năng phóng noãn, bệnh nhân thường kèm theo tiết sữa ở vú và vô kinh.
Bromocriptin là một đồng vận của dopamine, có thể ức chế trực tiếp sự chế tiết prolactin của tuyến yên. Nhờ đó, trục dưới đồi - tuyến yên hồi phục và tăng đáp ứng của buồng trứng. Các biểu hiện khác như tiết sữa, vô kinh vì thế cũng cải thiện khi nồng độ prolactin bình thường. Liều điều trị thường bắt đầu với 2,5 mg uống trước khi ngủ, nếu biểu hiện không dung nạp nên bẻ đôi viên thuốc trước khi uống. Liều thứ hai tiếp tục sau 1 tuần lúc ăn sáng hay ăn trưa. Một số bệnh nhân đáp ứng rất tốt, chỉ với liều bromocriptin rất nhỏ khoảng 0,625 - 1,25 mg. Nếu bệnh nhân quá nhạy cảm, biểu hiện tác dụng phụ (buồn nôn, tiêu chảy, đau đầu, mệt mỏi) của dopaminergic, có thể dùng bromocriptin đặt âm đạo một viên 2,5 mg.
3.4.2 Metformin
Metformin là một biguanide, được hấp thu vào cơ thể quá đường tiêu hoá, từ trước đến nay dùng trong điều trị tiểu đường type II. Thuốc có tác dụng ức chế tổng hợp Glucose ở gan, giảm hấp thu glucose ở ruột và tăng sử dụng glucose ở mô ngoại biên. Metformin có thể làm tăng số thụ thể của Insulin nhưng không làm tăng nồng độ insulin vì thế không gây giảm đường huyết ở những bệnh nhân có đường huyết bình thường.
Mối liên hệ giữa tăng insulin máu và không rụng trứng đã được xác định thông qua cơ chế gây cường androgen, thể hiện rất điển hình trong hội chứng buồng trứng đa nang. Vì thế, đối với những bệnh nhân cường insulin máu, đặc biệt là PCOS, metformin thể hiện tính hiệu quả và an toàn trong cải thiện insulin máu, thông qua đó gián tiếp ổn định chức năng phóng của buồng trứng.
3.4.3 Hormone tăng trưởng (Growth hormone - GH)
Một số nghiên cứu cho thấy, hormone tăng trưởng (GH) có tác dụng tích cực lên đáp ứng của nang noãn khi kích thích buồng trứng có bổ sung GH. GH có thể tác động trực tiếp lên các thụ thể của nó trên tế bào hạt kích thích sự hoạt động các gen qui định yếu tố nội tại IGF, đặc biệt IGF I phụ thuộc GH và liên quan đến khả năng tác động của FSH cả nội sinh và ngoại sinh lên buồng trứng. Vì thế nhiều nhà nghiên cứu đã đánh giá hiệu quả của bổ sung GH trong kích thích nang noãn không những tăng lên rõ rệt mà còn giảm được thời gian kích thích.
3.4.4 Phẫu thuật trên buồng trứng
Phương pháp can thiệp phẫu thuật đầu tiên trên buồng trứng để cải thiện chức năng phóng noãn được Stein và Leventhal đưa ra vào năm 1935 ở những bệnh nhân buồng trứng đa nang. Từ đó đến nay, nhiều phương pháp phẫu thuật cùng những kỹ thuật hiện đại được áp dụng đối với những bệnh nhân này.
Hiện nay, ở một số trung tâm có thể áp dụng phương pháp đốt điểm buồng trứng qua nội soi. Tại bờ tự do của buồng trứng, dùng đầu kim đốt điện đơn cực chuyên dùng (đầu kim Corson) chọc thẳng góc tạo 10 - 15 lỗ trên bề mặt buồng trứng với dòng điện 40W, kéo dài 2 giây ở mỗi điểm. Dù vậy, cơ sở khoa học và hiệu quả của các phương pháp phẫu thuật này đến nay vẫn không rõ ràng, cùng với nhiều biến chứng đáng kể của phẫu thuật làm cho chỉ định phẫu thuật không được rộng rãi. Các dữ liệu y văn cho đến nay không ủng hộ phẫu thuật đốt điểm buồng trứng là một lựa chọn trong điều trị kích thích phóng noãn ở bệnh nhân hội chứng buồng trứng đa nang.
4 Kích thích nhẹ buồng trứng
4.1 Khái niệm kích thích nhẹ
Các phác đồ kích thích buồng trứng được xem là kinh điển trongthụ tinh trong ống nghiệm đã bộc lộ một số nhược điểm như gây hội chứng quá kích buồng trứng, thời gian tiêm thuốc dài ngày, chi phí đắt, ảnh hưởng đến tâm lý và chất lượng cuộc sống cũng như tỷ lệ bỏ trị cao. Từ năm 1996, Edwards và cộng sự đã lần đầu tiên đề xuất khái niệm kích thích “nhẹ” buồng trứng với mục đích nhằm giảm gánh nặng điều trị nhưng không giảm tỷ lệ thành công của kỹ thuậtthụ tinh trong ống nghiệm. Sự xuất hiện của GnRH antagonist giúp phác đồ kích thích buồng trứng thân thiện hơn với bệnh nhân.
Theo Hiệp hội quốc tế về tiếp cận “nhẹ” trong hỗ trợ sinh sản (International Society for Mild Approaches in Assisted Reproduction - ISMAAR), kích thích “nhẹ” buồng trứng được định nghĩa:
Dùng gonadotropin ngoại sinh liều thấp hoặc ngắn ngày kết hợp với GnRH antagonist, hoặc
Sử dụng các thuốc uống (như anti-estrogens, hoặc ức chế men thơm hóa) có - hoặc không kèm theo gonadotrophins trong chu kỳ kích thích buồng trứng dùng antagonist.
Và mục đích của việc kích thích là giới hạn số trứng thu được dưới 8.
4.2 Cơ sở của phác đồ kích thích nhẹ
Sự hiện diện của FSH rõ ràng là một yêu cầu tất yếu cho sự phát triển của các nang thứ cấp. Vào giữa pha nang noãn, nang trưởng thành nhất (nang có số lượng thụ thể FSH nhiều nhất trên tế bào hạt) sẽ vượt trội so với các nang còn lại; cho dù sau đó nồng độ FSH giảm đi, nang trội vẫn tiếp tục phát triển và trưởng thành. Các nang còn lại thoái triển dần và chết theo chương trình. Khoảng thời gian khi nồng độ FSH trong huyết thanh vượt ngưỡng cần thiết để chọn lọc nang được gọi là cửa sổ FSH. Khái niệm này chính là cơ sở để kích thích “nhẹ” buồng trứng nhằm duy trì nồng độ FSH tăng vừa phải nhưng liên tục trong khoảng nửa sau của pha nang noãn, giúp kéo dài cửa sổ FSH và vượt qua sự chọn lọc đơn nang trội như sinh lý, giúp tăng thêm vài nang vượt trội. Trong kích thích “nhẹ” buồng trứng, có thể trì hoãn bổ sung FSH ngoại sinh liều thấp đến giữa pha nang noãn (sau ngày 5 chu kỳ). Mục đích nhằm tận dụng vai trò của FSH nội sinh trong giai đoạn chiêu mộ thứ cấp đầu chu kỳ và ngăn tình trạng giảm nồng độ FSH khi có nang vượt trội sinh lý, nhờ đó giúp nhiều nang phát triển.
Mặc dù trong phác đồ kích thích nhẹ, có thể không bắt buộc sử dụng GnRH antagonist, nhưng trong thực hành lâm sàng điều này vẫn được ưu tiên áp dụng để ức chế ngay sự phóng thích gonadotropins nội sinh từ tuyến yên. Tác động tức thời của GnRH antagonists cho phép ức chế tuyến yên chỉ khi nồng độ estradiol tuần hoàn tăng cao đạt đến ngưỡng có thể hồi tác dương kích hoạt đỉnh LH.
4.3 Hiệu quả sử dụng phác đồ kích thích nhẹ
4.3.1 Ở những phụ nữ có dự trữ buồng trứng bình thường
Số trứng ít trong phác đồ “nhẹ” vẫn thể hiện đáp ứng bình thường, có sự chọn lọc nang (và noãn) rất có thể là cơ hội giúp tạo nên phôi tốt và tăng cơ hội có thai. Liều rFSH thấp chỉ giúp tăng kích thích những nang vượt trội nhất là những nang có thụ thể tối ưu và là cách “chọn lọc” nang chất lượng, tránh thúc đẩy những nang kém chất lượng phát triển một cách “cưỡng ép”.
So với phác đồ “dài” GnRHagonist, phác đồ kích thích “nhẹ” kèm GnRH antagonist có thời gian kích thích ngắn, tổng liều FSH thấp và ít trứng thu được, tỷ lệ có thai trong nhóm kích thích nhẹ tính trên mỗi chu kỳ thấp hơn đáng kể. Tuy nhiên, phác đồ kích thích “nhẹ” dễ áp dụng, chi phí thấp, giảm tỷ lệ bỏ điều trị. Nhờ vậy, tỷ lệ sinh sống cộng dồn tính sau 1 năm điều trịthụ tinh trong ống nghiệm tương đương nhau giữa hai nhóm. Thật sự, những khó chịu cho bệnh nhân được đánh giá dựa trên mức độ căng thẳng, mức độ trầm cảm và thang điểm chất lượng giấc ngủ thấp hơn ở nhóm kích thích bằng phác đồ chuẩn so với nhóm kích thích “nhẹ”. Điều đáng quan tâm là chi phí điều trị khi kích thích “nhẹ” kết hợp chuyển đơn phôi thấp hơn đáng kể liên quan đến liều thuốc và thậm chí cả chi phí điều trị các trường hợp đa thai do chuyển nhiều phôi thông thường.
Nghiên cứu về liên quan liều FSH và di truyền phôi, khi cho noãn chuột phơi nhiễm với nồng độ cao rFSH trong môi trường thí nghiệm làm tăng tần suất bất thường nhiễm sắc thể. Dựa trên cơ sở này, kích thích nhẹ nhằm tiếp cận với những thay đổi mang tính sinh lý hơn có thể giúp cải thiện chất lượng noãn và phôi về mặt di truyền. Tuy nhiên, một số nghiên cứu thử nghiệm khác trên chuột cho thấy, các rối loạn ngoại sinh tác động đến điều hòa tín hiệu trong sinh nang noãn có thể làm thay đổi giai đoạn sau của phát triển noãn, tăng nguy cơ bất thường nhiễm sắc thể do rối loạn giảm phân. Ở người, sinh thiết phôi giai đoạn 8 tế bào để phân tích di truyền đã nhận thấy số phôi bình thường về mặt di truyền ở 2 nhóm là tương đương nhau (1,8/chu kỳ) mặc dù kích thích nhẹ tạo phôi ít hơn. Điều này chứng tỏ là tác động của các thuốc kích thích buồng trứng không phải là yếu tố có thể cải thiện chất lượng phôi so với sinh lý bình thường.
Một hạn chế của phác đồ kích thích “nhẹ” làm ảnh hưởng đến tỷ lệ có thai tính trên chu kỳ điều trị là tỷ lệ hủy chu kỳ còn cao khi chỉ đạt được 1 - 2 nang có đáp ứng (chiếm từ 15 - 20%) khi bắt đầu dùng FSH từ ngày 5. Nếu gặp tình huống này, cần ngưng kích thích và tiếp tục ở chu kỳ khác, có thể bắt đầu sớm hơn ngày 5 (ngày 2 - 4). Cần cân nhắc các yếu tố ảnh hưởng đáp ứng buồng trứng như dự trữ buồng trứng, BMI để quyết định phác đồ “nhẹ” và xây dựng mô hình dự báo để giảm thiểu nguy cơ hủy chu kỳ khi áp dụng.
Hơn nữa, phác đồ kích thích buồng trứng kinh điển thường làm tăng biến đổi nội tiết, đặc biệt nồng độ estradiol gấp 10 lần so với sinh lý bình thường, làm ảnh hưởng đến sự phát triển và khả năng làm tổ của phôi người. Một số nghiên cứu đã cho thấy biểu hiện gen trên nội mạc tử cung ở các chu kỳ kích thích rất thay đổi so với chu kỳ tự nhiên. Một số tác giả nhận thấy sự chấp nhận của nội mạc tử cung cho phôi làm tổ tốt nhất trong chu kỳ tự nhiên và việc kích thích “nhẹ” sẽ làm giảm tác động bất lợi trên niêm mạc tử cung so với kích thích kinh điển. Phác đồ “nhẹ” làm tăng nồng độ estradiol ở mức thấp hơn đáng kể và đây có thể xem như là một “ưu điểm” của việc kích thích “nhẹ”.
4.3.2 Phụ nữ bị giảm dự trữ buồng trứng
Việc kích thích buồng trứng ở những phụ nữ bị giảm dự trữ là một trong những thách thức lớn củathụ tinh trong ống nghiệm và các nỗ lực nhằm cải thiện số noãn thu được ở các trường hợp này chưa thấy hiệu quả. Phác đồ thường sử dụng cho những bệnh nhân này là phác đồ “dài” với liều FSH hằng ngày khoảng 300 FSH IU hoặc hơn. Tuy nhiên, việc tăng liều đối với những người giảm dự trữ buồng trứng cho thấy không đem lại lợi ích. Liều cao gonadotropin có thể giảm nguy cơ hủy chu kỳ nhưng tỷ lệ có thai lâm sàng và sinh sống vẫn thấp và tăng nguy cơ sẩy thai tự nhiên. Liều cao FSH giúp chiêu mộ những nang noãn “sót lại” khỏi thoái triển, nhưng những noãn nằm bên trong các nang này chất lượng thường kém, rất ít cơ hội tạo được phôi tốt. Việc tăng liều gonadotropin khiến cho tổng chi phí chu kỳ điều trị tăng đáng kể mà không đảm bảo sự tăng tương xứng cơ hội thành công điều trị.
Phối hợp Clomiphene citrate (CC), gonadotropins và GnRH antagonists được xem là một lựa chọn kích thích “nhẹ” cho những người đáp ứng kém. CC là một loại thuốc dùng đường uống phổ biến, rẻ tiền và được dùng rộng rãi giúp gây phóng noãn ở những trường hợp không phóng noãn theo WHO nhóm II. Tuy nhiên, chứng cứ y học cho đến nay về hiệu quả của phác đồ “nhẹ”CC/Gn/GnRH antagonist ở bệnh nhân giảm dự trữ buồng trứng vẫn chưa đầy đủ và thuyết phục. Gần đây, AI có thể là một lựa chọn ưu thế hơn thay cho CC. Dù những trường hợp này không sợ nguy cơ quá kích buồng trứng khi dùng liều cao FSH, nhưng việc kích thích “nhẹ” có thể giúp chất lượng noãn và niêm mạc tử cung tốt hơn, dù cần thêm bằng chứng để chứng tỏ những kết quả này.
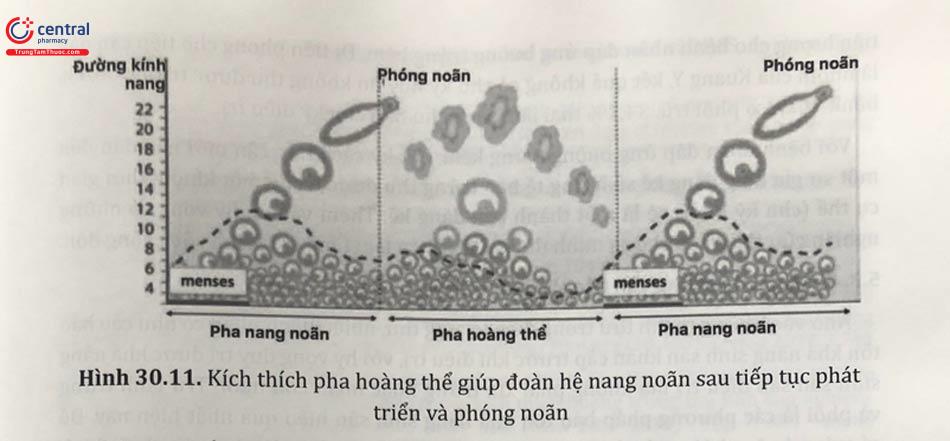
5 Kích thích buồng trứng pha hoàng thể
Kích thích buồng trứng pha hoàng thể thường được bắt đầu sau 2 - 7 ngày phóng noãn tự nhiên hoặc chọc hút trứng. Các phác đồ được sử dụng đa dạng: hMG đơn thuần, hMG kết hợp với clomiphene citrate hoặc letrozole, phác đồ ngắn đồng vận GnRHagonist với rFSH, phác đồ đối vận GnRHantagonist với FSH và phác đồ đối vận GnRHantagonist với FSH kèm LH 75 IU... Sau 5 ngày kể từ ngày kích thích, bắt đầu siêu âm và định lượng nội tiết để theo dõi sự phát triển nang noãn. hCG hoặc GnRHagonist được sử dụng để trưởng thành noãn giai đoạn cuối. Bởi vì sự không đồng bộ của phôi và nội mạc tử cung, phôi được trữ đông và chuyển ở chu kỳ sau.
5.1 Đáp ứng buồng trứng bình thường
Đây là nhóm đối tượng cần được cân nhắc nhiều khía cạnh ưu và nhược điểm khi tiếp cận với chiến lược kích thích buồng trứng pha hoàng thể. Nghiên cứu bệnh chứng của Buendgen NK đã báo cáo ước tính trên mỗi trứng thu được khi kích thích buồng trứng pha hoàng thể, liều FSH tăng gấp gần 3 lần so với kích thích buồng trứng pha nang noãn. Kuang Y và cs. đã tiến hành nghiên cứu tiến cứu thuần tập, cỡ mẫu lớn, liều cố định letrozole 2,5 mg/ngày kèm hMG 225 IU/ngày, kết quả kích noãn và mang thai tối ưu, không có trường hợp nào xảy ra đỉnh LH sớm, không có quá kích buồng trứng vừa và nặng dù 4 số mẫu có hơn 20 trứng được chọc hút, tổng liều Gonadotrophin là cao hơn ở nhóm kích thích buồng trứng pha hoàng thể. Về tỷ lệ thụ tinh, tỷ lệ mang thai, thai tiến triển và sinh sống thì nhóm kích thích buồng trứng pha hoàng thể không khác biệt đáng kể với kích thích nhẹ nhưng tăng có ý nghĩa thống kê so với phác đồ ngắn, kết cục sơ sinh không khác biệt giữa các nhóm.
5.2 Bệnh nhân vô sinh có đáp ứng buồng trứng kém
Đây là đối tượng có thách thức lớn nhất cho các nhà nghiên cứu và lâm sàng, với dễ xảy ra đỉnh LH sớm, rụng trứng sớm, nguy cơ hủy chu kỳ cao, tỷ lệ thai thấp, căng thẳng tâm lý và bỏ điều trị cao. Các báo cáo về kết quả kích thích buồng trứng pha hoàng thể là khả quan. Một số nghiên cứu chỉ đánh giá kết quả kích thích buồng trứng, một số có đánh giá kết quả thai. Tùy theo phác đồ được sử dụng có tương đồng ở nhóm kích thích buồng trứng pha hoàng thể với nhóm kích thích buồng trứng pha nang noãn hay không mà kết quả số trứng thu được không khác biệt hoặc cao hơn của pha hoàng thể so với pha nang noãn. Tỷ lệ thụ tinh, tỷ lệ làm tổ, tỷ lệ thai là không khác biệt giữa kích thích buồng trứng pha hoàng thể so với pha nang noãn ở vài nghiên cứu, tuy nhiên ở nghiên cứu hồi cứu của Wei LH thì tỷ lệ thụ tinh và tỷ lệ thai ở kích thích buồng trứng pha hoàng thể với letrozole kèm hMG cao hơn hẳn kích thích buồng trứng pha nang noãn với phác đồ đối vận và Zhang Q thấy phôi từ pha hoàng thể có tỷ lệ làm tổ cao hơn.
Kích thích buồng trứng pha hoàng thể đã giúp thiết lập kích thích buồng trứng kép, kích thích buồng trứng và thu trứng ở cả 2 pha nang noãn và hoàng thể để tăng cơ hội thu thêm trứng, tạo được nhiều phôi, cải thiện tiên lượng cho bệnh nhân đáp ứng buồng trứng kém. Đi tiên phong cho tiếp cận này là nhóm của Kuang Y, kết quả không có chu kỳ hủy do không thu được trứng, 68,4% bệnh nhân có phôi trữ, 34,2% thai lâm sàng cho mỗi chu kỳ điều trị.
Với bệnh nhân đáp ứng buồng trứng kém, bất kỳ cách tiếp cận mới nào dẫn đến một sự gia tăng đáng kể số lượng tế bào trứng thu được trong một khung thời gian cụ thể (chu kỳ kinh) sẽ là một thành tựu đáng kể. Thêm vào đó hy vọng có những nghiên cứu tiếp theo chứng minh được kích thích buồng trứng kép làm tăng tỷ lệ sinh sống cộng dồn.
5.3 Bệnh nhân ung thư cần bảo tồn khả năng sinh sản khẩn cấp
Nhờ vào những thành tựu trong điều trị ung thư, nhiều bệnh nhân có nhu cầu bảo tồn khả năng sinh sản khẩn cấp trước khi điều trị, với hy vọng duy trì được khả năng sinh sản sau điều trị mà không phải xin trứng hoặc nhận con nuôi. Trữ lạnh trứng và phôi là các phương pháp bảo tồn khả năng sinh sản hiệu quả nhất hiện nay. Để có trứng hoặc phôi trữ lạnh, thường phải kích thích buồng trứng. Với các phác đồ pha nang noãn kinh điển, tùy thuộc vào thời điểm phát hiện ung thư và quyết định bảo tồn khả năng sinh sản mà chậm nhất có thể mất đến 6 tuần để thu được trứng tối ưu. Một sự chậm trễ trong điều trị như vậy là không lý tưởng, đôi khi là nghiêm trọng làm bệnh nhân từ bỏ nỗ lực bảo tồn khả năng sinh sản. kích thích buồng trứng pha hoàng thể đã tạo thêm cơ hội để có thể kích thích buồng trứng ngẫu nhiên tại bất kỳ thời điểm nào của chu kỳ kinh, giúp giảm thiểu tối đa thời gian để có thể thu được trứng từ khi có chẩn đoán ung thư.
6 Kết luận
Kích thích buồng trứng là một can thiệp lâm sàng đặc biệt. Các thuốc và phác đồ chỉ có tính nguyên lý, không thể áp dụng một cách cứng nhắc. Dự trữ buồng trứng và khả năng đáp ứng với kích thích buồng trứng của từng người là khác nhau, do đó, việc quyết định loại thuốc, liều thuốc, phác đồ kích thích và theo dõi trong quá trình kích thích buồng trứng phải được cân nhắc kỹ. Quá trình phát triển nang noãn hoàn chỉnh cần thiết cả FSH và LH/hCG. Nếu chu kỳ điều trị thất bại, thay đổi phác đồ thường mang lại hiệu quả cao hơn so với thay đổi thuốc đang sử dụng. Cá thể hoá là rất quan trọng mang tính quyết định của kích thích buồng trứng trong sự thành công của hỗ trợ sinh sản.
7 Tài liệu tham khảo
1. ACOG Committee Opinion No. 738: Aromatase Inhibitors in Gynecologic Practice. Obstet Gynecol; 131:1.
2. Cao Ngọc Thành, Lê Minh Tâm (2008). Đáp ứng kém với kích thích buồng trứng. Kỷ yếu Hội nghị Phụ sản miền Trung mở rộng lần II. Tạp chí Phụ Sản, tập 7, số 2.
3. Cao Ngọc Thành, Lê Minh Tâm (2005). Kích thích buồng trứng trong điều trị hiếm muộn: Nguyên lý và thực hành. Tạp chí Y học thực hành, số 522: 414-422.
4. Cao Ngọc Thành, Lê Minh Tâm, Nguyễn Vũ Quốc Huy (2012). Đáp ứng kém với kích thích buồng trứng. Tạp chí Y Dược học. Số 7:1-5. DOI: 10.34071/jmp.2012.1.1
5. Delvigne A. Symposium: Update on prediction and management of OHSS. Epidemiology of OHSS. Reprod Biomed Online; 19:8.
6. Devroey P, Boostanfar R, Koper NP, et al (2009). A double- blind, non- inferiority RCT comparing corifollitropin alfa and recombinant FSH during the first seven days of ovarian stimulation using a GnRH antagonist protocol. Hum Reprod; 24:3063.
7. Fauser BC. Reproductive endocrinology: revisiting ovulation induction in PCOS. Nat Rev Endocrinol 2014; 10:704.
8. Fei C, Deroo LA, Sandler DP, Weinberg CR (2012). Fertility drugs and young- onset breast cancer: results from the Two Sister Study. J Natl Cancer Inst; 104:1021.
9. Hồ Thị Thanh Tâm, Lê Minh Tâm, Cao Ngọc Thành (2016). Kích thích buồng trứng kép trong thụ tinh ống nghiệm: liệu có thể là một chiến lược mới cho bệnh nhân đáp ứng buồng trứng kém? Tạp chí Phụ Sản. Tập 14 (03): 08-15. https://doi.org/10.46755/vjog.2016.3.741
10. Hồ Thị Thanh Tâm, Lê Minh Tâm, Trương Quang Vinh, Cao Ngọc Thành (2017). Nghiên cứu giá trị của một số yếu tố tiên lượng trong kích thích buồng trứng thụ tinh ống nghiệm. Tạp chí Y Dược học - Trường Đại học Y Dược Huế. (ISSN 1859-3836) - Tập 7, số 1 - tháng 2/2017: 83-90. DOI: 10.34071/jmp.2017.1.14
11. Lê Minh Tâm (2014). Hiệu quả kích thích phóng noãn của chất ức chế men thơm hóa (AI) ở bệnh nhân vô sinh có hội chứng buồng trứng đa nang. Tạp chí Y Dược học. Vol 21;4(3):86- 93. DOI: 10.34071/jmp.2014.3.12
12. Lê Minh Tâm (2016). Thụ tinh trong ống nghiệm với kích thích nhẹ buồng trứng: có phải là một lựa chọn ưu việt? Sản Phụ Khoa - Từ bằng chứng đến thực hành, Số đặc biệt Tạp chí Phụ Sản. Vol 6: 143-158. Бис
13. Legro RS, Brzyski RG, Diamond MP, et al (2014). Letrozole versus clomiphene for infertility in the polycystic ovary syndrome. N Engl J Med; 371:119.
14. Nguyễn Đắc Nguyên, Lê Minh Tâm, Cao Ngọc Thành (2017). Liệu GnRHagonist có thể thay thế hCG để gây phóng noãn trong chu kỳ thụ tinh nhân tạo? Tạp chí Phụ Sản. Tập 15 (03), :137-141. https://doi.org/10.46755/vjog.2017.3.428
15. Quoc Huy Hoang, Hung Sy Ho, Huong Thuy Do, Tien Viet Nguyen, Hong Phuong Nguyen, Minh Tam Le (2021). Therapeutic effect of prolonged testosterone pretreatment in women with poor ovarian response: A randomized control trial. Reprod Med Biol; 00:1-8. https:// doi.org/ 10.1002/ rmb2.12383 usda
16. Rizzuto I, Behrens RF, Smith LA (2013). Risk of ovarian cancer in women treated with ovarian stimulating drugs for infertility. Cochrane Database Syst Rev; :CD008215.
17. The ESHRE Guideline Group on Ovarian Stimulation. ESHRE guideline: ovarian stimulation for IVF/ ICSI. Hum Reprod Open (2): hoaa009. Published online. doi: 10.1093/ hropen/ hoaa009.
18. Wang R, Li W, Bordewijk EM, et al (2019). First- line ovulation induction for polycystic ovary syndrome: an individual participant data meta- analysis. Hum Reprod Update; 25:717.
19. Weiss NS, Nahuis M, Bayram N, et al (2015). Gonadotrophins for ovulation induction in women with polycystic ovarian syndrome. Cochrane Database Sys

