Cơ chế tác dụng của huyết tương giàu tiểu cầu trong điều trị rụng tóc
Tác giả: Lu Yin, Katerina Svigos, Kristen Lo Sicco và Jerry Shapiro
Dịch: Bs. Trương Tấn Minh Vũ
Tải file PDF tại đây
1 Huyết tương giàu tiểu cầu
Huyết tương giàu tiểu cầu (platelet-rich plasma, PRP) là sản phẩm có nguồn gốc từ máu tự thân với nồng độ tiểu cầu tăng lên do quá trình ly tâm. Tác dụng của PRP được cho là do sự kích hoạt tiểu cầu và các yếu tố tăng trưởng có nguồn gốc từ tiểu cầu (platelet-derived growth factors, PDGF). Phương pháp điều trị ban đầu được sử dụng trong lĩnh vực chỉnh hình và các hệ thống chuẩn bị PRP hiện có chứng nhận thiết bị y tế 510(k) từ Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) để tăng cường các đặc tính xử lý ghép xương trong môi trường phẫu thuật[1].
Tuy nhiên, mặc dù phương pháp điều trị PRP ban đầu được sử dụng trong lĩnh vực chỉnh hình nhưng nhiều cách sử dụng không chính thức được báo cáo trong tài liệu về da liễu. Các ứng dụng da liễu cho PRP bao gồm trẻ hóa khuôn mặt, điều trị các tình trạng tự miễn dịch bao gồm rụng tóc từng vùng (alopecia areata, AA) và bạch biến, kích thích tăng trưởng và ổn định rụng tóc nội tiết tố nam (androgenetic alopecia, AGA), cải thiện thẩm mỹ các vết sẹo và lành thương [2–7]. Trong chương này, chúng tôi tập trung vào điều trị rụng tóc bằng PRP.
2 Cơ chế tác dụng trong điều trị rụng tóc
Cơ chế mà PRP kích thích mọc lại tóc vẫn chưa được hiểu đầy đủ. Người ta tin rằng sự tái phát triển được kích thích bởi các PDGF bao gồm yếu tố tăng trưởng có nguồn gốc tiểu cầu (PDGF), yếu tố tăng trưởng biến đổi β (transforming growth factor β, TGF- β), yếu tố tăng trưởng nội mô mạch máu (vascular endothelial growth factor, VEGF), yếu tố tăng trưởng biểu mô (epithelial growth factor, EGF) và yếu tố tăng trưởng giống Insulin ( insulin-like growth factor, IGF) tác động lên tế bào gốc phình nang tóc. Những yếu tố này được cho là có tác dụng thúc đẩy giai đoạn anagen (giai đoạn tăng trưởng của nang tóc) và tăng cường sự phân bố mạch máu[8, 9]. Siah và cộng sự gần đây báo cáo rằng nồng độ yếu tố thần kinh có nguồn gốc từ tế bào thần kinh đệm (GDNF) trong PRP có mối liên hệ tích cực có ý nghĩa thống kê với sự gia tăng mật độ tóc [10]. Các tác giả nhận xét rằng vai trò của GDNF trong việc điều hoà sự phát triển của tóc vẫn chưa được hiểu rõ, mặc dù một số bằng chứng cho thấy GDNF làm tăng sinh tế bào sừng của nang tóc [11]. GDNF cũng có thể đóng một vai trò trong việc điều hoà chu kỳ tóc, đặc biệt là thời điểm chuyển đổi anagen sang catagen, như bằng chứng cho thấy GDNF có thể ngăn chặn sự chuyển đổi sớm từ giai đoạn anagen sang giai đoạn catagen [11, 12]
Các yếu tố bao gồm tốc độ ly tâm, số lần ly tâm, sự bổ sung các thành phần như MatriStem MicroMatrix® (ACell Inc., Columbia, MD, USA) có nguồn gốc từ bàng quang lợn, việc sử dụng hoạt hóa Canxi và kích thước kim tiêm đều có thể đóng một vai trò nào đó trong hoạt hóa tiểu cầu, hiệu quả điều trị và kết quả của bệnh nhân. Hiện tại, không có phác đồ chuẩn hóa cho việc chuẩn bị PRP cũng như phác đồ điều trị tiêu chuẩn cho các bệnh rụng tóc. Các phần sau đây cung cấp cái nhìn tổng quan về các chuẩn bị PRP và kỹ thuật quy trình cũng như mô tả các phương pháp thực hiện PRP cụ thể của tác giả.
3 Kỹ thuật
3.1 Ly tâm
Nhiều hệ thống chuẩn bị PRP sử dụng phương pháp ly tâm để tách và cô đặc các tiểu cầu có trong máu toàn phần. Các công ty có hệ thống chuẩn bị PRP có bán trên thị trường gồm Regen Lab SA (Le Mont-sur-Lausanne, Thụy Sĩ), Eclipse Aesthetics, LLC (Colony, TX, USA), DTS MG Co., Ltd. (Seoul, Korea), Arthrex, Inc. (Naples, FL, Hoa Kỳ) và Factor Medical, LLC (Langhorne, PA, Hoa Kỳ). Thiết bị thay đổi tùy theo tốc độ quay, lực ly tâm và thời gian quay, cuối cùng dẫn đến nồng độ tiểu cầu khác nhau [13]. Mặc dù có các tài liệu thảo luận về đặc tính của các máy ly tâm khác nhau và sự thay đổi nồng độ tiểu cầu và yếu tố tăng trưởng đối với các hệ thống chuẩn bị PRP khác nhau, nhưng dữ liệu là ít và không có sự đồng thuận về một quy trình tối ưu [13, 14]
Phòng khám của tác giả sử dụng Drucker 642 VFD Plus (Regen Lab, Le Mont-sur-Lausanne, Thụy Sĩ), có lực ly tâm là 1500 g và cho phép thời gian ly tâm là 5 hoặc 9 phút. Phòng khám của tác giả thu nhận khoảng 8–16 mL máu toàn phần thông qua chọc tĩnh mạch, được ly tâm trong 5 phút. Quy trình thu được 5–10 mL PRP và điều trị da đầu với khoảng 50–100 mũi tiêm, mỗi mũi 0,1 mL, với khoảng cách khoảng 1 cm giữa các vị trí tiêm.
3.2 Thêm chất bổ sung
Chất bổ sung cho PRP được cho là để tăng hiệu quả điều trị. Một chất bổ sung như vậy là MatriStem MicroMatrix®, một chất nền ngoại bào (ECM) có nguồn gốc từ bàng quang lợn. Theo tài liệu của công ty, các cơ chế được đề xuất bao gồm tạo điều kiện thuận lợi cho việc tái cấu trúc mô, thúc đẩy quá trình lành thương và giảm sẹo cũng như phục hồi mô chức năng phù hợp tại chỗ. Tuy nhiên, có rất ít thông tin trong tài liệu được bình duyệt về lợi ích của việc thêm MatriStem MicroMatrix® (ACell) vào PRP. Một số nhà cung cấp đưa ACell vào phác đồ điều trị PRP của họ, vì người ta cho rằng ACell có thể có tác dụng hiệp đồng với các yếu tố tăng trưởng trong PRP bằng cách cung cấp ECM để tế bào có thể tái tạo nang tóc. Tuy nhiên, hiện có rất ít bằng chứng trong các tạp chí được bình duyệt ủng hộ các cơ chế được đề xuất này.
Báo cáo duy nhất về việc sử dụng PRP với ACell để điều trị AGA trong tài liệu được bình duyệt thảo luận là trong trường hợp cấy tóc[15]. Báo cáo này mang tính giai thoại và mô tả trải nghiệm của tác giả mà không có bằng chứng khách quan. Tuy nhiên, chưa có nghiên cứu so sánh nào có bằng chứng định lượng khách quan đánh giá hiệu quả và kết quả điều trị khi thêm ACell vào PRP để điều trị rụng tóc. Do đó, phòng khám của tác giả hiện không sử dụng các sản phẩm ACell trong phương pháp điều trị PRP.
Các chất bổ sung tiềm năng khác cho PRP bao gồm các chất kích hoạt như trombin, Collagen, yếu tố kích hoạt tiểu cầu (PAF) và canxi, tạo ra sự giải phóng các yếu tố tăng trưởng từ các hạt tế bào chất [16]. Mặc dù có bằng chứng cho thấy rằng kích hoạt tiểu cầu bằng canxi làm thay đổi quá trình sinh hóa trong các nghiên cứu in vitro [16, 17], nhưng tác dụng cuối cùng của việc kích hoạt tiểu cầu bằng canxi đối với kết quả lâm sàng khi điều trị rụng tóc vẫn chưa được biết rõ.
Escobar và cộng sự phân tích các chỉ dấu bề mặt tế bào và quá trình sản xuất cytokine từ các đại thực bào có nguồn gốc từ bạch cầu đơn nhân ở người sau 24 giờ kích thích bằng PRP tinh khiết khác cá thể (P-PRP) hoặc chất bề mặt của PRP tinh khiết được kích hoạt bằng canxi (S-PRP). Họ không tìm thấy sự khác biệt trong biểu hiện của CD206, một thụ thể mannose có liên quan đến việc giảm viêm, tăng ở cả hai nhóm. Họ cũng thấy sự tăng của CD163, một thụ thể thu dọn haptoglobin-hemoglobin và CD86, một chỉ dấu gây viêm, trong các đại thực bào trong S-PRP so với P-PRP. IL-10, một cytokine chống viêm giúp thúc đẩy quá trình lành thương thông qua kích hoạt sản xuất arginase 1 và ECM [18], được tiết ra với số lượng lớn hơn từ các tế bào được ủ trong P-PRP. Nghiên cứu này bị hạn chế vì nó là nghiên cứu khác cá thể và các đại thực bào và huyết tương không được lấy từ cùng một cá thể. Tuy nhiên, kết quả cho thấy rằng hoạt hóa canxi dẫn đến những khác biệt sinh hóa liên quan đến tác dụng của nó đối với đại thực bào, điều này có thể dẫn đến những khác biệt về kết quả lâm sàng.
Gentile và cộng sự thực hiện một nghiên cứu lâm sàng đánh giá sự phát triển của tóc với PRP không hoạt hóa và PRP được hoạt hóa bằng canxi [19]. Mặc dù nghiên cứu này không so sánh trực tiếp sự phát triển của tóc sau khi điều trị bằng PRP không hoạt hóa và PRP được hoạt hóa bằng canxi, nhưng các tác giả so sánh kết quả sau khi điều trị bằng PRP không hoạt hóa với kết quả được công bố trước đó của họ sau khi điều trị bằng PRP được hoạt hóa bằng canxi [20]. Họ phát hiện ra rằng những bệnh nhân được điều trị bằng PRP không hoạt hóa có mật độ tóc tăng cao hơn so với những bệnh nhân được điều trị bằng PRP được hoạt hóa bằng canxi sau 12 tuần (lần lượt là 65 ± 5 so với 28 ± 4 sợi tóc/cm2 ) (p = 0,003). Các tác giả suy đoán rằng kết quả quan sát được về sự gia tăng mật độ tóc nhiều hơn sau khi PRP không được hoạt hóa có thể là do hoạt hóa trombin của tiểu cầu trong cơ thể và sự khuếch tán vượt trội của thành phần tiểu cầu so với hoạt hóa bằng canxi trong ống nghiệm.
Hơn nữa, tiêm PRP không hoạt hóa có thể dẫn đến sản xuất Thromboxane A2 và sau đó hoạt hóa các tiểu cầu khác [19, 21]
Tuy nhiên, nghiên cứu trên có một số hạn chế. Đáng chú ý, PRP không hoạt hóa và PRP hoạt hóa bằng canxi trong các nghiên cứu này được chuẩn bị bằng các hệ thống chuẩn bị khác nhau. Hơn nữa, việc so sánh kết quả được thực hiện giữa các nghiên cứu khác nhau và các yếu tố này cùng nhau ngăn cản sự so sánh có kiểm soát trong các kết quả tương ứng. Những hạn chế này đòi hỏi phải nghiên cứu sâu hơn để so sánh và đánh giá trực tiếp việc điều trị bằng PRP không hoạt hóa và PRP hoạt hóa bằng canxi. Tóm lại, có vẻ như không có đủ bằng chứng khoa học cho thấy việc hoạt hóa canxi dẫn đến sự cải thiện đáng kể trong việc mọc lại tóc và có thể cản trở việc hoạt hóa tiểu cầu tối ưu.
3.3 Gây tê
Đau là một biến chứng thường gặp của liệu pháp PRP da đầu với các yếu tố góp phần gồm đau tại chỗ tiêm và đau thứ phát do phù nề do lượng huyết tương đưa vào da đầu. Có nhiều lựa chọn gây tê để giảm bớt đau liên quan đến PRP. Một lựa chọn không y khoa là chườm túi nước đá lên da đầu 5–10 phút trước khi tiêm. Ngoài ra, các thiết bị rung (Hình 13.1) có thể được sử dụng trong quá trình thực hiện để giảm thiểu cơn đau thông qua lý thuyết kiểm soát cổng [22]. Lý thuyết này đưa ra giả thuyết rằng các sợi thần kinh đau, xúc giác và rung động điều chỉnh các đầu vào cùng lúc ở sừng sau, do đó rung động cùng lúc làm giảm cảm nhận đau, về mặt lý thuyết làm giảm đau [23].

Kem bôi lidocain 2,5% tại chỗ với prilocain 2,5% (EMLA, Astra Pharmaceuticals, L.P., Wayne, PA, USA) là một lựa chọn gây tê khác. Hướng dẫn của FDA khuyến nghị nên bôi ít nhất một giờ trước khi thực hiện thủ thuật, mặc dù thời gian có thể thay đổi tùy thuộc vào bộ phận cơ thể [24]. Các bài báo trong tài liệu được bình duyệt cũng sử dụng thời gian bôi ngắn hơn là 30 phút, mặc dù điều này có thể dẫn đến tác dụng gây tê ít hơn [25–27] . Hướng dẫn sử dụng của FDA cũng khuyến cáo nên bôi tại chỗ kem lidocain 2,5% với prilocain 2,5% và băng kín sau khi bôi. Tại phòng khám của chúng tôi, bệnh nhân được khuyên bôi thuốc gây tê tại chỗ 30–90 phút trước khi đến khám và chúng tôi thường không khuyến nghị băng kín sau khi bôi thuốc gây tê tại chỗ để thuận tiện cho bệnh nhân. Mặc dù các hướng dẫn chính thức của FDA khuyến nghị nên sử dụng phương pháp băng kín, nhưng ít nhất một bài báo được bình duyệt xuất bản đã báo cáo hiệu quả lâm sàng sau khi bôi tại chỗ kem lidocain 2,5% với prilocain 2,5% mà không băng kín [25]. Không có sự so sánh trực tiếp về việc trạng thái tê sau khi bôi tại chỗ kem lidocain 2,5% với prilocain 2,5% có băng kín và không băng kín.
Mặc dù ít phổ biến hơn, nhưng có thể thực hiện gây tê bằng đường tiêm, như lidocain 1% trong tổn thương. Mặc dù chưa có nghiên cứu nào được thực hiện để so sánh việc sử dụng lidocain không có epinephrine với epinephrine, nhưng tác giả thường tránh sử dụng epinephrine do đặc tính co mạch của nó có thể hạn chế sự khuếch tán PRP và tác dụng tại chỗ. Gây tê trong tổn thương có thể được thực hiện theo kiểu vòng chặn các dây thần kinh sọ và cổ, bao gồm các dây thần kinh trên ổ mắt, trên ròng rọc, gò má thái dương, tai thái dương, và các dây thần kinh chẩm lớn và nhỏ hơn [28]. Mặc dù gây tê vòng da đầu là hữu ích trong các thủ thuật da đầu xâm lấn hơn, nhưng loại gây tê này ít phổ biến hơn khi tiêm PRP. Hơn nữa, phù ở trán cũng có thể là một tác dụng phụ của gây tê vòng, như một cuộc khảo sát trên 31 bệnh nhân nữ được gây tê vòng trước khi tiêm PRP cho thấy số lượng đáng kể bệnh nhân (31/9 hoặc 29%) gặp tình trạng “trán hoặc mặt sưng bất thường” [29].
Mặc dù việc tiêm lidocain cũng có thể gây đau tại chỗ tiêm, nhưng số lượng mũi tiêm cần thiết để gây tê thường ít hơn nhiều so với 50–100 mũi tiêm trong PRP. Tuy nhiên, mặc dù gây tê cục bộ có thể làm giảm đau tại chỗ tiêm nhưng áp lực da đầu tăng lên và đau đầu có thể xảy ra do lượng thuốc được đưa thêm vào da đầu. Cũng cần thận trọng khi thảo luận về việc sử dụng lidocain bôi và tiêm với bệnh nhân trước khi tiêm PRP, vì nó có thể ảnh hưởng đến hiệu quả điều trị theo một nghiên cứu chỉnh hình in vitro cho thấy lidocain dẫn đến giảm kết tập và chức năng tiểu cầu [30].
Giảm đau sau thủ thuật bao gồm 325–1000 mg Acetaminophen mỗi 4–6 giờ nếu cần, với liều tối đa hàng ngày là 4 g ở người lớn khỏe mạnh, với liều lượng thay đổi tùy theo tình trạng bệnh đi kèm của bệnh nhân. Có nguy cơ giảm chức năng tiểu cầu liên quan đến việc sử dụng thuốc chống viêm không steroid (NSAID) trước khi tiêm PRP do tác dụng chống tiểu cầu của những loại thuốc này. Một nghiên cứu so sánh những bệnh nhân đã dùng NSAID trong 2-5 ngày với nhóm đối chứng không dùng NSAID trong hai tuần trước đó và không tìm thấy sự khác biệt có ý nghĩa thống kê về số lượng tiểu cầu ban đầu trong máu toàn phần [31]. Tuy nhiên, phương pháp đo dẫn truyền ánh sáng cho thấy chức năng và sự kết tập tiểu cầu bị suy giảm ở nhóm NSAID so với nhóm đối chứng. Vì vậy, nên tránh dùng NSAID trước PRP và có thể sau thủ thuật để nâng cao hiệu quả điều trị. Những bệnh nhân đang sử dụng NSAID hoặc các loại thuốc kháng tiểu cầu khác nên ngừng sử dụng các loại thuốc đó trong ít nhất một tuần trước khi tiêm PRP nếu có thể. Tham khảo ý kiến bác sĩ kê đơn của bệnh nhân để xác định xem liệu có thể tạm dừng các liệu pháp kháng tiểu cầu trước khi tiêm PRP hay không. Cần nghiên cứu sâu hơn để xác định thời gian thải trừ tối thiểu thích hợp đối với NSAID trước khi tiêm PRP để điều trị rụng tóc.
3.4 Kích thước kim
Kích thước kim được sử dụng trong quá trình thực hiện thủ thuật ảnh hưởng đến cả mức độ đau của thủ thuật và hiệu quả điều trị. Kích thước kim nhỏ hơn ít gây đau hơn khi tiêm [32], tuy nhiên, kim lớn hơn làm giảm nguy cơ về mặt lý thuyết làm rách tiểu cầu trước khi tiêm vào da đầu. Trong phòng khám của tác giả, kích thước kim mặc định được sử dụng để tiêm PRP là kim 27G để giảm thiểu nguy cơ kích hoạt sớm về mặt lý thuyết. Có thể sử dụng kim 30G nhỏ hơn theo yêu cầu của bệnh nhân nếu cơn đau do kim 27G quá mức. Một nghiên cứu trong tài liệu đưa ra bằng chứng cho thấy kim tiêm 30G không tạo ra sự khác biệt đáng kể về số lượng hoặc chất lượng của tiểu cầu đã hoạt hóa so với PRP không tiêm [30].
4 Chương trình điều trị
Hiện tại không có sự đồng thuận về chương trình và phác đồ điều trị khi tiêm PRP để điều trị rụng tóc. Nhiều phác đồ điều trị các chứng rụng tóc khác nhau được báo cáo trong tài liệu [2, 33-43]. Hình 13.2 mô tả phác đồ được sử dụng phổ biến nhất tại phòng khám của tác giả để điều trị AGA và rụng tóc telogen và đôi khi cho rụng tóc AA hoặc rụng tóc có sẹo. Trong thực hành lâm sàng của tác giả, ban đầu, hai đợt tiêm PRP hàng tháng được thực hiện để đánh giá xem bệnh nhân là người đáp ứng hay không đáp ứng. Các đo lường định lượng tóc bằng Folliscope (Lead M, Seoul, Korea) được sử dụng để đánh giá đáp ứng. Chúng tôi xác định đáp ứng tích cực là tăng tối thiểu 10 sợi tóc/cm2, con số được chọn dựa trên kinh nghiệm lâm sàng sâu rộng của tác giả trong điều trị rụng tóc. Chúng tôi đang nỗ lực chuẩn hóa phác đồ điều trị bằng PRP, tuy nhiên cần nghiên cứu thêm để xác định rõ hơn chương trình điều trị tối ưu mang lại kết quả mọc tóc tốt nhất.
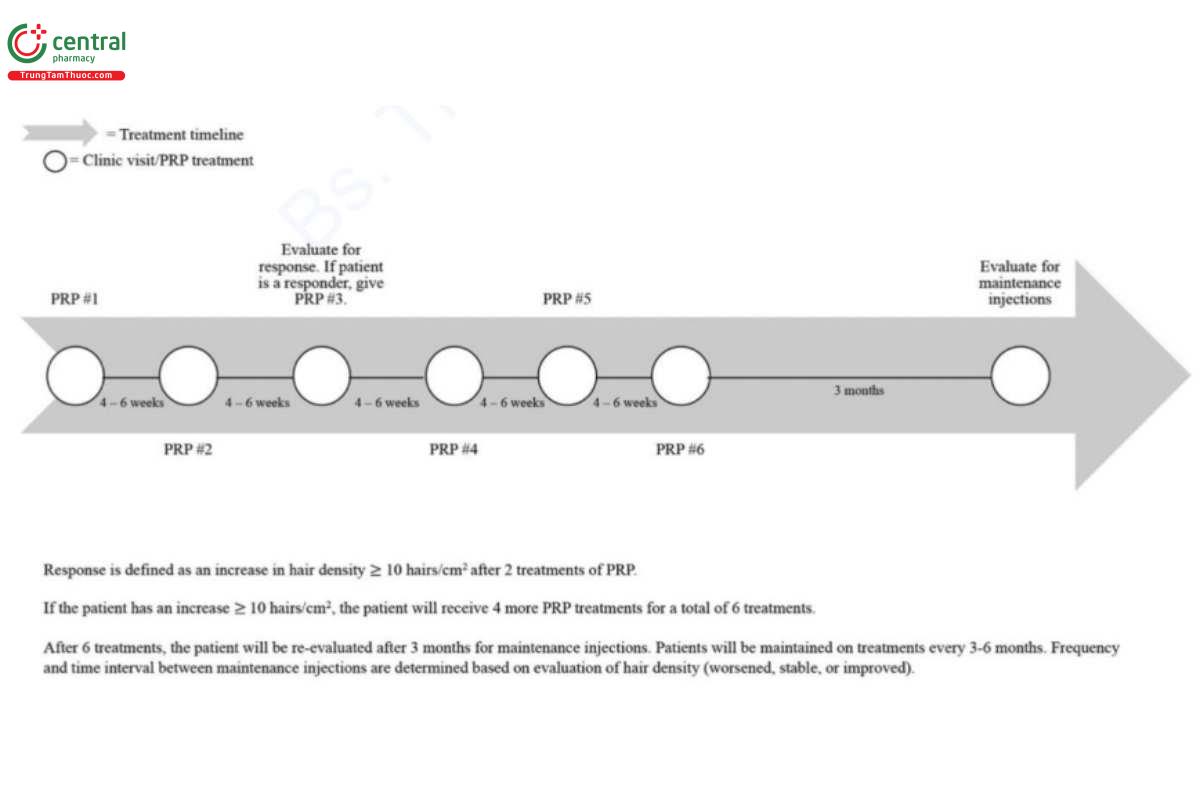
Chúng tôi nhận thấy rằng khoảng 71% bệnh nhân rụng tóc nội tiết tố nam đáp ứng với điều trị bằng PRP (2). Một lý do có thể giải thích cho sự khác biệt giữa các cá nhân trong đáp ứng với điều trị có thể là sự khác biệt về nồng độ yếu tố tăng trưởng sau khi chuẩn bị PRP (10). Có thể có một khoảng thời gian tối ưu trong đó các yếu tố tăng trưởng này tối đa hóa sự mọc lại của tóc, vì nồng độ quả thấp có thể không kích thích tăng trưởng và nồng độ cao của một số cytokine nhất định có thể có tác động tiêu cực, gây độc [10, 44]. Chỉ những bệnh nhận được xác định là có đáp ứng sẽ tiếp tục tiêm thêm bốn mũi PRP hàng tháng với tổng số sáu lần điều trị trong 6 tháng liên tiếp. Sau sáu lần điều trị ban đầu này, liệu pháp duy trì được bắt đầu. Liệu pháp duy trì bao gồm tiêm mỗi 3 đến 6 tháng. Tần suất tiêm duy trì được xác định thông qua đánh giá lâm sàng của từng bệnh nhân bằng cách sử dụng đo lường định lượng tóc để đánh giá đáp ứng bằng cách định lượng mật độ tóc. Những cân nhắc quan trọng khác là sở thích riêng của bệnh nhân và khả năng chịu đựng cơn đau do tiêm khi xác định tần suất điều trị duy trì. Cần nghiên cứu sâu hơn để thiết lập chương trình tối ưu cho liệu pháp duy trì cũng như các yếu tố tiên lượng góp phần tạo nên sự khác biệt trong đáp ứng với liệu pháp duy trì.
4.1 Tác dụng phụ, rủi ro và chống chỉ định
Các tác dụng phụ thường gặp hơn khi tiêm PRP là đau và chảy máu. Cơn đau thường kéo dài trong suốt thời gian tiêm, mặc dù một số bệnh nhân có thể bị đau đầu kéo dài hoặc đau nhói tại chỗ. Cơn đau và nhức đầu thường tự giới hạn và thuyên giảm trong vòng một đến hai ngày. Ngoài ra còn có nguy cơ nhiễm trùng nhỏ và nguy cơ bị sốc rụng tóc, rụng tóc lan tỏa đột ngột, mặc dù đây là một biến chứng hiếm gặp. Một khảo sát trên các bệnh nhân nữ được tiêm PRP để điều trị rụng tóc cho thấy 3% bệnh nhân bị rụng tóc quá nhiều trong 2 ngày sau khi làm thủ thuật và 10% bị rụng tóc quá nhiều sau 2–4 tuần sau khi làm thủ thuật [29]. Các tác dụng phụ nghiêm trọng hơn sau khi tiêm PRP được báo cáo trong tài liệu bao gồm trường hợp bệnh huyết thanh ở bệnh nhân sau khi tiêm PRP để trẻ hóa mặt và cổ (45). Một trường hợp khác được báo cáo là hoại tử mô và tắc nghẽn động mạch mắt, được cho là do tiêm vào động mạch một nút tiểu cầu hoặc gel tách tiểu cầu, dẫn đến mù vĩnh viễn (6). Cần lưu ý rằng trong cả hai trường hợp liên quan đến các tác dụng phụ nghiêm trọng hơn, PRP không được tiêm vào da đầu mà tiêm vào mặt, đặc biệt là vùng gian mày và cổ. Tuy nhiên, bác sĩ nên cẩn thận để tránh tạp chất trong PRP có thể gây ra cục máu đông và thiếu máu cục bộ.
Mặc dù chưa có nghiên cứu nào được thực hiện đánh giá nguy cơ tái phát ung thư da sau khi điều trị PRP tại chỗ, nhưng do cơ chế hoạt động thông qua các yếu tố tăng trưởng, nên thận trọng khi sử dụng ở những bệnh nhân đang mắc hoặc có tiền sử ung thư da liên quan đến da đầu. Cần thận trọng khi xem xét điều trị PRP cho chứng rụng tóc ở những bệnh nhân này, vì về mặt lý thuyết có nguy cơ rằng các yếu tố tăng trưởng được tiêm có thể kích thích tăng sinh tế bào. Cũng cần thận trọng khi điều trị cho những bệnh nhân đang điều trị bằng thuốc kháng tiểu cầu hoặc có số lượng tiểu cầu thấp, vì những tình trạng này có thể làm giảm hiệu quả điều trị. Tuy nhiên, không có nghiên cứu nào đánh giá mối liên quan giữa số lượng tiểu cầu trong huyết thanh của bệnh nhẫn và đáp ứng với việc tiêm PRP. Cuối cùng, hiện chưa rõ tính an toàn của việc tiêm PRP để điều trị rụng tóc ở phụ nữ mang thai. Thành phần máu cũng bị thay đổi trong thời kỳ mang thai, về mặt lý thuyết có thể ảnh hưởng đến hiệu quả điều trị. Trong thời kỳ mang thai, lượng máu tăng lên, và mặc dù lượng Erythropoietin tăng lên bù đắp phần nào cho lượng máu tăng lên, vẫn có một mức độ thiếu máu do pha loãng [47, 48]. Do sự pha loãng và cô lập trong lá lách do lách to, số lượng tiểu cầu cũng giảm (47, 49). Tuy nhiên, chưa có nghiên cứu nào đánh giá liệu những thay đổi sinh lý này có ảnh hưởng đến hiệu quả của PRP hay không. Chúng tôi khuyên các bác sĩ nên cân nhắc lựa chọn điều trị PRP một cách cẩn thận khi điều trị cho bệnh nhân đang mang thai hoặc đang cho con bú về cả tính an toàn và hiệu quả điều trị.
5 Tài liệu tham khảo
1. Beitzel K, Allen D, Apostolakos J, et al. US definitions, current use, and FDA stance on use of platelet- rich plasma in sports medicine. J Knee Surg. 2015;28(1):29-34.
2. Ho A, Sukhdeo K, Lo Sicco K, Shapiro J. Trichologic response of platelet-rich plasma in androgenetic alopecia is maintained during combination therapy. JAAD. 2020;82(2):478-479.
3. Zhang M, Park G, Zhou B, Luo D. Applications and efficacy of platelet-rich plasma in dermatology: A clinical review. J Cosmet Dermatol. 2018;17(5):660-5.
4. Strazzulla LC, Avila L, Lo Sicco K, Shapiro J. An overview of the biology of platelet-rich plasma and microneedling as potential treatments for alopecia areata. J Invest Dermatol Symp Proc. 2018;19(1):S21-S24.
5. Moneib HA, Youssef SS, Aly DG, et al. Autologous platelet-rich plasma versus conventional therapy for the treatment of chronic venous leg ulcers: A comparative study. J Cosmet Dermatol. 2018;17(3):495-501.
6. Ruiz A, Cuestas D, Garcia P, et al. Early intervention in scar management and cutaneous burns with autologous platelet-rich plasma. J Cosmet Dermatol. 2018;17(6):1194-1199.
7. Hesseler MJ, Shyam N. Platelet-rich plasma and its utility in the treatment of acne scars: A systematic review. JAAD. 2019;80(6):1730-1745.
8. Akiyama M, Smith LT, Holbrook KA. Growth factor and growth factor receptor localization in the hair follicle bulge and associated tissue in human fetus. J Invest Dermatol. 1996;106(3):391–396.
9. Cervelli V, Garcovich S, Bielli A, et al. The effect of autologous activated platelet rich plasma (AA- PRP) injection on pattern hair loss: clinical and histomorphometric evaluation. BioMed Res Int. 2014:2014:760709.
10. Siah TW, Guo H, Chu T, et al. Growth factor concentrations in platelet rich plasma for androgenetic alopecia: an intra-subject, randomized, blinded, Placebo controlled, pilot study. Exp Dermatol. 2020.
11. Adly MA, Assaf HA, Pertile P, et al. Expression patterns of the glial cell line-derived neurotrophic factor, neurturin, their cognate receptors GFRα-1, GFRα-2, and a common signal transduction element c-Ret in the human skin hair follicles. 2008;58(2):238–250.
12. Botchkareva NV, Botchkarev VA, Welker P, et al. New Roles for Glial Cell Line-Derived Neurotrophic Factor and Neurturin. 2000;156(3):1041-1053.
13. Weibrich G, Kleis WK, Streckbein P, et al. Comparison of point-of-care methods for preparation of platelet concentrate (platelet-rich plasma). Int J Oral Maxillofac, 2012;27(4):762-769,
14. Gentile P, Calabrese C, De Angelis B, et al. Impact of the different preparation methods to obtain autologous non-activated platelet-rich plasma (a-prp) and activated platelet-rich plasma (aa-prp) in plastic surgery: wound healing and hair regrowth evaluation. Int J Mol Sci. 2020;21(2)
15. Lam SM. Hair transplant and local anesthetics. Clin Plast Surg. 2013;40(4):615-625.
16. Escobar G, Escobar A, Ascui G, et al. Pure platelet-rich plasma and supernatant of calcium-activated P-PRP induce different phenotypes of human macrophages. Regenerative medicine. 2018;13(4):427- 441.
17. Roh YH, Kim W, Park KU, Oh JH. Cytokine-release kinetics of platelet-rich plasma according to various activation protocols. Bone Joint Res. 2016;5(2):37-45.
18. Arango Duque G, Descoteaux A. Macrophage cytokines: involvement in immunity and infectious diseases. Front Immunol. 2014;5:491.
19. Gentile P, Cole JP, Cole MA, et al. Evaluation of not-activated and activated prp in hair loss treatment: role of growth factor and cytokine concentrations obtained by different collection systems. Int J Mol Sci. 2017;18(2).
20. Gentile P, Garcovich S, Bielli A, et al. The effect of platelet-rich plasma in hair regrowth: a randomized placebo-controlled trial. Stem Cells Transl Med. 2015;4(11):1317-1323.
21. Hamberg M, Svensson J, Samuelsson B. Thromboxanes: a new group of biologically active compounds derived from prostaglandin endoperoxides. Proc Natl Acad Sci US A. 1975;72(8):2994-8.
22. Melzack R, Wall PD. Pain mechanisms: a new theory. Science (New York, NY), 1965;150(3699): 971- 979.
23. Randich A, Ness T. Modulation of spinal nociceptive processing. In: Fishman SM, Ballantyne JC, Rathmell JP. (eds). Bonica's Management of Pain. 4th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2009, pp. 48-60.
24. Holmes HS. Choosing a local anesthetic, Dermatol Clin. 1994;12(4):817-823.
25. Guardiano RA, Norwood CW. Direct comparison of EMLA versus Lidocaine for pain control in Nd:YAG 1,064 nm laser hair removal. Dermatol Surg. 2005;31(4):396–398.
26. Carter EL, Coppola CA, Barsanti FA. A randomized, double-blind comparison of two topical anesthetic formulations prior to electrodesiccation of dermatosis papulosa nigra. Dermatol Surg. 2006;32(1):1-6. 27. Friedman PM, Mafong EA, Friedman ES, Geronemus RG. Topical anesthetics update: EMLA and beyond. Dermatol Surg. 2001;27(12):1019-1026.
28. Kerscher C, Zimmermann M, Graf BM, Hansen E. [Scalp blocks. A useful technique for neurosurgery, dermatology, plastic surgery and pain therapy]. Der Anaesthesist. 2009;58(9):949-58; quiz 59–60.
29. Laird ME, Lo Sicco KI, Reed ML, Brinster NK. Platelet-Rich Plasma for the Treatment of Female Pattern Hair Loss: A Patient Survey. Dermatol Surg. 2018;44(1):130–132.
30. Bausset O, Magalon J, Giraudo L, et al. Impact of local anaesthetics and need le calibres used for painless PRP injections on platelet functionality. Muscles, ligaments and tendons journal. 2014;4(1):18-23. 31. Schippinger G, Pruller F, Divjak M, et al. Autologous platelet-rich plasma preparations: influence of nonsteroidal anti-inflammatory drugs on platelet function. Orthop J Sports Med.
2015;3(6):2325967115588896.
32. Rodrigues EB, Grumann A, Jr., Penha FM, et al. Effect of needle type and injection technique on pain level and vitreal reflux in intravitreal injection. J Ocul Pharmacol Th. the official journal of the Association for Ocular Pharmacology and Therapeutics. 2011;27(2):197-203.
33. Gkini MA, Kouskoukis AE, Tripsianis G, et al. Study of platelet-rich plasma injections in the treatment of androgenetic alopecia through an one-year period. J Cutan Aesthet Surg. 2014;7(4):213–219.
34. Alves R, Grimalt R. Randomized placebo-controlled, double-blind, half-head study to assess the efficacy of platelet-rich plasma on the treatment of androgenetic alopecia. Dermatol Surg. 2016;42(4):491–497.
35. Alves R, Grimalt R. Platelet-rich plasma in combination with 5% Minoxidil topical solution and 1 mg. oral finasteride for the treatment of androgenetic alopecia: A randomized placebo-controlled, double- blind, half-head study. Dermatol Surg. 2018;44(1):126-130.
36. Bayat M, Yazdanpanah MJ, Hamidi Alamdari D, et al. The effect of platelet-rich plasma injection in the treatment of androgenetic alopecia. J Cosmet Dermatol. 2019;18(6):1624-1628.
37. Hausauer AK, Jones DH. Evaluating the efficacy of different platelet-rich plasma regimens for management of androgenetic alopecia: A single-center, blinded, randomized clinical trial. Dermatol Surg. 2018;44(9):1191-1200.
38. Tawfik AA, Osman MAR. The effect of autologous activated platelet-rich plasma injection on female pattern hair loss: A randomized placebo-controlled study. J Cosmet Dermatol. 2018;17(1):47-53. 39. Albalat W, Ebrahim HM. Evaluation of platelet-rich plasma vs intralesional steroid in treatment of alopecia areata. J Cosmet Dermatol. 2019.
40. Donovan J. Successful treatment of corticosteroid-resistant ophiasis-type alopecia areata (AA) with platelet-rich plasma (PRP). JAAD Case Rep. 2015;1(5):305-307.
41. Trink A, Sorbellini E, Bezzola P, et al. A randomized, double-blind, placebo- and active-controlled, half-head study to evaluate the effects of platelet-rich plasma on alopecia areata. Br J Dermatol. 2013;169(3):690-694.
42. Bolanca Z, Goren A, Getaldic-Svare B, et al. Platelet-rich plasma as a novel treatment for lichen plano- pillaris. Dermatol Ther. 2016;29(4):233-235.
43. Dina Y, Aguh C. Use of Platelet-Rich Plasma in Cicatricial Alopecia. Dermatol Surg. 2019;45(7):979– 981.
44. Baldo BA. Side effects of cytokines approved for therapy. Drug Safety. 2014;37(11):921-943. 45. Owczarczyk-Saczonek A, Wygonowska E, Budkiewicz M, Placek W. Serum sickness disease in a patient with alopecia areata and Meniere' disease after PRP procedure. Dermatologic therapy. 2019;32(2):e12798.
46. Kalyam K, Kavoussi SC, Ehrlich M, et al. Irreversible Blindness Following Periocular Autologous Platelet-Rich Plasma Skin Rejuvenation Treatment. Ophthalmic Plast Reconstr Surg. 2017;33(38 Suppl 1):S12-$16.
47. Kazma JM, van den Anker J, Allegaert K, et al. Anatomical and physiological alterations of pregnancy. J Pharmacokinet Pharmacodyn, 2020.
48. Goonewardene M, Shehata M, Hamad A. Anaemia in pregnancy. Best Pract Res Clin Obstet Gynaecol. 2012;26(1):3-24.
49. Boehlen F, Hohlfeld P, Extermann P, et al. Platelet count at term pregnancy: a reappraisal of the threshold. Obstet Gynecol. 2000;95(1):29–33.

