Hướng dẫn xử trí tràn khí màng phổi tự phát của hội lồng ngực Anh
M HENRY, TARNOLD VÀ J HARVEY
Đại diện cho nhóm bệnh lý màng phổi BTS-phân nhóm của ủy ban về tiêu chuẩn chăm sóc bệnh BTS
TẢI PDF TẠI ĐÂY
1 GIỚI THIỆU
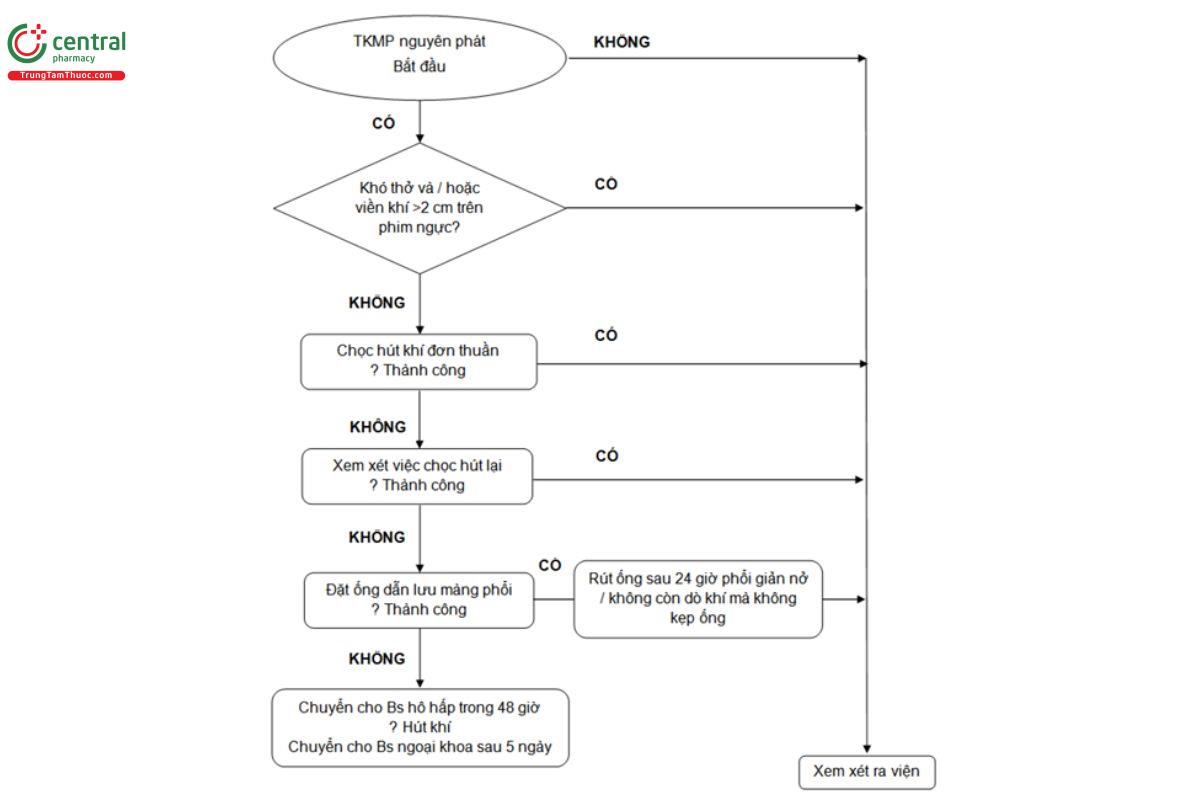
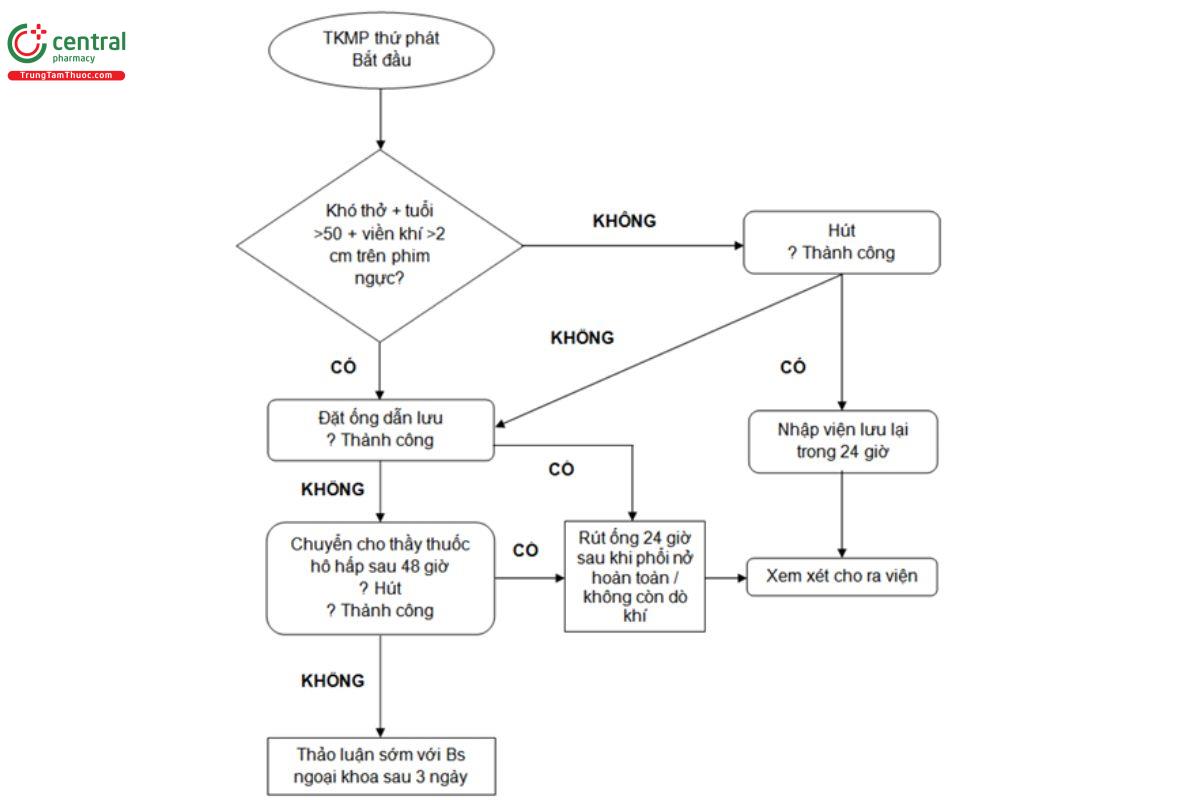
Tràn khí màng phổi (TKMP) được định nghĩa là khi có khí trong khoang màng phổi - đây là khoang nằm giữa phổi và thành ngực(1). TKMP nguyên phát xảy ra ở những người khỏe mạnh mà không bị bất kỳ bệnh phổi gì. TKMP thứ phát xảy ra ở những người có sẵn bệnh lý phổi trước đó. Thuật ngữ TKMP đã được đề cập - đầu tiên vào năm 1802 bởi Itard, một học trò của Laennec (2), và chính Laennec đã mô tả bệnh cảnh lâm sàng của TKMP năm 1819(2). Ông đã mô tả hầu hết TKMP xảy ra ở những bệnh nhân lao phổi, mặc dù ông cũng nhận thấy TKMP cũng xảy ra với những bệnh nhân có phổi khỏe mạnh - được ông mô tả là “TKMP đơn thuần”. Tuy vậy, việc mô tả hiện đại trường hợp TKMP tự phát nguyên phát là do Kjaergard thực hiện năm 1932(3). TKMP nguyên phát vẫn còn vấn đề toàn cầu đáng lưu ý, xảy ra ở những người khỏe mạnh với xuất độ được ghi nhận là 18-28/100 000 người trong năm với nam giới và 1.2-6/100 000 người năm với nữ giới (4,5). TKMP thứ phát liên quan đến bệnh phổi có sẵn từ trước trong khi TKMP nguyên phát thì không. Theo định nghĩa, không có yếu tố thúc đẩy rõ ràng trong cả hai trường hợp TKMP đã đề cập. Tỉ lệ nhập viện cho cả TKMP nguyên phát và thứ phát được ghi nhận tại Anh Quốc là 5,8/100 000 người-năm ở nữ giới và 16,7/100 000 người-năm với nam giới. Tỉ lệ tử vong ở Anh là 0,62/triệu người-năm ở nữ giới và 1,26/triệu người mỗi năm cho nam giới trong khoảng 1991 và 1995 (6). Tài liệu hướng dẫn này mô tả việc xử trí TKMP nguyên phát và thủ phát. Nó không xét đến việc TKMP do chấn thương. Sơ đồ hướng dẫn xử trí TKMP nguyên phát và thứ phát được thể hiện ở hình 1 và 2 (bên dưới).
Cần nhấn mạnh đến mối liên quan giữa việc tái phát TKMP và hút thuốc lá trong nỗ lực khuyến khích bệnh nhân ngừng hút thuốc lá. [B]
Mặc dù ở bệnh nhân TKMP nguyên phát không mắc bệnh lý phổi từ trước, dường như các bóng khí (blebs) dưới màng phổi hay túi khí (bulla) có thể có vai trò trong cơ chế bệnh sinh vì chúng được tìm thấy đến 90% các trường hợp TKMP nguyên phát qua nội soi lồng ngực hay mở ngực và đến 80% trường hợp được phát hiện khi kiểm tra bằng CT ngực (7,8). Tuy nhiên nguyên nhân của thay đổi các túi khí như thế ở phổi khỏe mạnh là không rõ ràng. Không nghi ngờ gì nữa, hút thuốc lá có vai trò quan trọng (9,11); yếu tố nguy cơ suốt đời gây TKMP ở những người đàn ông khỏe mạnh hút thuốc có thể đến 12% so với 0,1% ở những người đàn ông không hút thuốc (11), Khuynh hướng này vẫn hiện diện ở phụ nữ tuy không cao như vậy(11). Không thấy có bất cứ mối liên quan nào giữa khởi phát TKMP và hoạt động thể lực (5). Các đường thở nhỏ bị tắc nghẽn, do gián tiếp từ sự bùng phát của các tế bào viêm, thường là đặc điểm của TKMP và có thể xuất hiện trong những đường thở nhỏ hơn của nam giới vào giai đoạn sớm hơn (12). Bệnh nhân TKMP nguyên phát khuynh hướng có chiều cao cao hơn những bệnh nhân nhóm chứng (13, 14). Sự chênh lệch về áp suất màng phổi tăng từ đáy phổi lên đỉnh phổi (1) vì thế các phế nang tại đỉnh phổi ở những người có chiều cao có áp lực căng cao hơn một cách có ý nghĩa so áp lực phế nang ở đáy phổi, về mặt lý thuyết, tại đỉnh có khuynh hướng hình thành phát triển các bóng khí dưới màng phổi nhiều hơn (15). Cần nhấn mạnh đến tầm quan trọng về mối liên quan giữa việc hút thuốc lá và TKMP trong sự cố gắng để ngăn những người hút thuốc lá bị TKMP từ việc hút thuốc. Tuy có mối quan hệ rõ ràng giữa hút thuốc lá và TKMP, 80-86% những bệnh nhân trẻ vẫn tiếp tục hút thuốc sau lần đầu tiên họ bị TKMP nguyên phát (16). Nguy cơ tái phát trong TKMP nguyên phát là 54% xảy ra trong 4 năm đầu tiên, với các nguy cơ độc lập bao gồm hút thuốc lá, chiều cao ở bệnh nhân nam giới (4,17), và tuổi từ 60 trở đi (17), Yếu tố nguy cơ của TKMP thứ phát tái phát là tuổi tác, xơ phổi và khí phế thũng (171), Trong nỗ lực chuẩn hóa việc điều trị TKMP nguyên phát và thứ phát, năm 1993 Hiệp hội lồng ngực Anh (BTS) đã xuất bản tài liệu hướng dẫn này cho việc điều trị cả 2 loại TKMP (19). Nhiều nghiên cứu cho thấy việc tuân thủ tài liệu hướng dẫn của năm 1993, dù có tiến bộ, vẫn chỉ đạt tỉ lệ 20-40% trong số các khoa không thuộc hô hấp và khoa cấp Cứu (20, 22). Những hướng dẫn về lâm sàng cho thấy những cải tiến trong thực hành lâm sàng (23,24), việc tuân thủ những hướng dẫn có liên quan đến tính phức tạp trong quy trình thực hành được miêu tả (25) và được củng cố nhờ y học chứng cứ (26). Các bước trong tài liệu hướng dẫn năm 1993 có thể cần được làm sáng tỏ các vấn đề bao gồm: (1) chọc hú: khí đơn thuần (thoracocentesis) so với đặt ống dẫn lưu màng phổi (tube thoracostomy) như là bước đầu tiên trong xử trí TKMP nguyên phát và thứ phát, (2) điều trị TKMP ở những bệnh nhân lớn tuổi hay những bệnh nhân đã mắc bệnh phổi trước đó, (3) khi nào sẽ chuyển những bệnh nhân với TKMP khó cho các bác sĩ chuyên khoa lồng ngực hay bác sĩ ngoại lồng ngực cho các trường hợp dò khí dai dẳng hay phổi không giãn nở được, và (4) điều trị TKMP tái phát. Tài liệu hướng dẫn này nhằm đề cập các vấn đề trên. Mục đích của hướng dẫn là cung cấp những xem xét dựa trên chứng cứ một cách đầy đủ và chi tiết về dịch tễ học, nguyên nhân và điều trị TKMP để bổ sung cho tài liệu tóm tắt cho chẩn đoán và điều trị.
2 ĐÁNH GIÁ LÂM SÀNG VÀ HÌNH ẢNH HỌC
Chỉ định chụp phim ngực ở thì thở ra không được khuyến cáo trong việc chẩn đoán TKMP một cách thường quy. [B)
Trong trường hợp phim chụp tia sau-trước là bình thường, nên chụp phim nghiêng hay phim nghiêng-nằm nếu lâm sàng nghi ngờ nhiều đến TKMP. [B]
Chụp CT được khuyến cáo cho chẩn đoán phân biệt TKMP với bệnh lý phổi có túi khí phức tạp, khi nghi ngờ “ống dẫn lưu” dịch chuyển vị trí, và khi phim ngực thông thường bị tràn khí dưới da che lấp. [C]
Bệnh sử lâm sàng không phải là yếu tố đáng tin cậy về mức độ TKMP. [C]
Bệnh sử lâm sàng và khám thực thể luôn gợi ý đến sự hiện diện của TKMP, mặc dù các biểu hiện lâm sàng không phải là dấu hiệu chỉ điểm đáng tin cậy về kích thước trong TKMP (29,30). Nơi chung, triệu chứng lâm sàng kèm theo trong TKMP thứ phát trầm trọng so với các triệu chứng của TKMP nguyên phát, và hầu hết bệnh nhân bị TKMP thứ phát than phiền khó thở mà không tương xứng với kích thước TKMP (31,32). Nhiều bệnh nhân, đặc biệt là những người bị TKMP nguyên phát, không đi thăm khám bác sĩ trong nhiều ngày, 46% chờ đợi hơn 2 ngày có các triệu chứng (9). Điểm này quan trọng bởi vì việc phù phổi do tái giãn nở phổi (RPO) sau khi phải được căng giãn trở lại có thể liên quan đến thời gian phổi bị xẹp là bao lâu (xem phần Hút khí qua ống dẫn lưu, bên dưới) (33,34). Việc đo lường khi máu động mạch thường cho thấy kết quả bất thường ở những bệnh nhân TKMP với áp lực oxy động mạch (PaO2) thấp hơn 10,9 kPa (80 mmHg) trong 75% bệnh nhân 5). Sự tồn tại của bệnh lý phổi có sẵn cùng với kích thước TKMP tiên đoán được mức độ giảm oxy máu (35). PaO2 thấp 7,5 kPa (55 mmHg) và PaCO2 trên 6,9 kPa (50 mmHg) trong 16% trường hợp TKMP thứ phát trong hàng loạt trường hợp được ghi nhận nhiều nhất 30. Các xét nghiệm chức năng phổi là đo lường có độ nhạy thấp về sự hiện diện hay kích thước TKMP và chúng không được khuyến cáo (8)
Trong cả TKMP tự phát nguyên phát hay thứ phát, thông thường việc chẩn đoán TKMP dựa vào phim ngực thẳng. Nói chung, phim chụp khi thở ra chỉ hỗ trợ chút ít và không được chỉ định thường quy, ngay cả đối với trường hợp nghi ngờ TKMP lượng ít ở đỉnh phổi (37, 38), Khi nghi ngờ TKMP nhưng vẫn không xác định được trên phim ngực chuẩn tia sau-trước, việc chụp thêm phim nghiêng cho biết thêm thông tin tăng lên 14 % trường hợp 30, Phim nghiêng ở tư thế nằm cho giá trị cao hơn phim thẳng hay nằm ngửa và được xem là có độ nhạy như CT ngực trong việc phát hiện TKMP (40). Phim nghiêng khi đứng hay nằm về mặt lâm sàng đều hữu ích khi trên phim ngực thẳng tư thế đứng tia sau trước không nhìn thấy TKMP một cách rõ ràng. Trong khi những trường hợp TKMP có thể không có dấu hiệu lâm sàng nổi bật ở những bệnh nhân không bị các bệnh phổi nào khác, ở những bệnh nhân nghi ngờ TKMP thứ phát, thậm chí những trường hợp TKMP lượng ít có thể có những ảnh hưởng đáng kể, lúc này phim nghiêng hoặc phim nghiêng-nằm có thể có giá trị. Ở những bệnh nhân có túi khí trầm trọng CT ngực sẽ phân biệt khí phế thủng dạng túi khí này với TKMP và cứu bệnh nhân khỏi việc chọc hút khí không cần thiết và có khả năng gây nguy hiểm (41).
3 KÍCH THƯỚC TRÀN KHÍ MÀNG PHỔI
Phân loại trước đây về kích thước TKMP có khuynh hướng ước lượng thấp hơn kích thước thật của nó. Trong hướng dẫn mới này, kích thước TKMP được chia thành “it” hay “nhiều” tùy vào phần viền thấy được giữa màng phổi và thành ngực là <2 cm hay >2 cm.
Dùng phim ngực thẳng tia sau-trước để đánh giá kích thước của TKMP là phương pháp không tốt do nó luôn đánh giá thấp hơn thực tế. Các phương pháp chính xác để ước lượng kích thước từ phim ngực tia sau-trước phức tạp và thường chỉ dùng như công cụ trong nghiên cứu 12. Kích thước TKMP, xét về thể tích, thường khó đánh giá chính xác từ phim phổi với hình ảnh 2 chiều. Trong hướng dẫn năm 1993 (19)TKMP được chia thành 3 nhóm:
- “Ít”: được định nghĩa khi “có ít khi chung quanh phổi;
- “Vừa”: được định nghĩa khi phổi “xẹp một nửa hướng về bờ tim";
- “Hoàn toàn”: được định nghĩa khi “phổi toàn khí, tách hẳn khỏi cơ hoành”.
Việc cố gắng để định lượng TKMP có xu hướng đánh giá thấp hơn thể tích thật của TKMP (1), Do thể tích của TKMP tương xứng với tỉ số của tỉ lệ lập phương với đường kính của phổi so với tỉ lệ lập phương của đường kính một ngực, TKMP với viền khi 1 cm trên phim ngực tia sau-trước chiếm 27% thể tích của một bên ngực nếu đo được đường kính của phổi là 9 cm và của 1 bên ngực là 10 cm: (10-9/103 = 27%. Tương tự, nếu trên phim TKMP chiếm 2 cm thì nó sẽ chiếm 49% thể tích một bên ngực với cùng nguyên lý như trên. (hình 3 bên dưới).
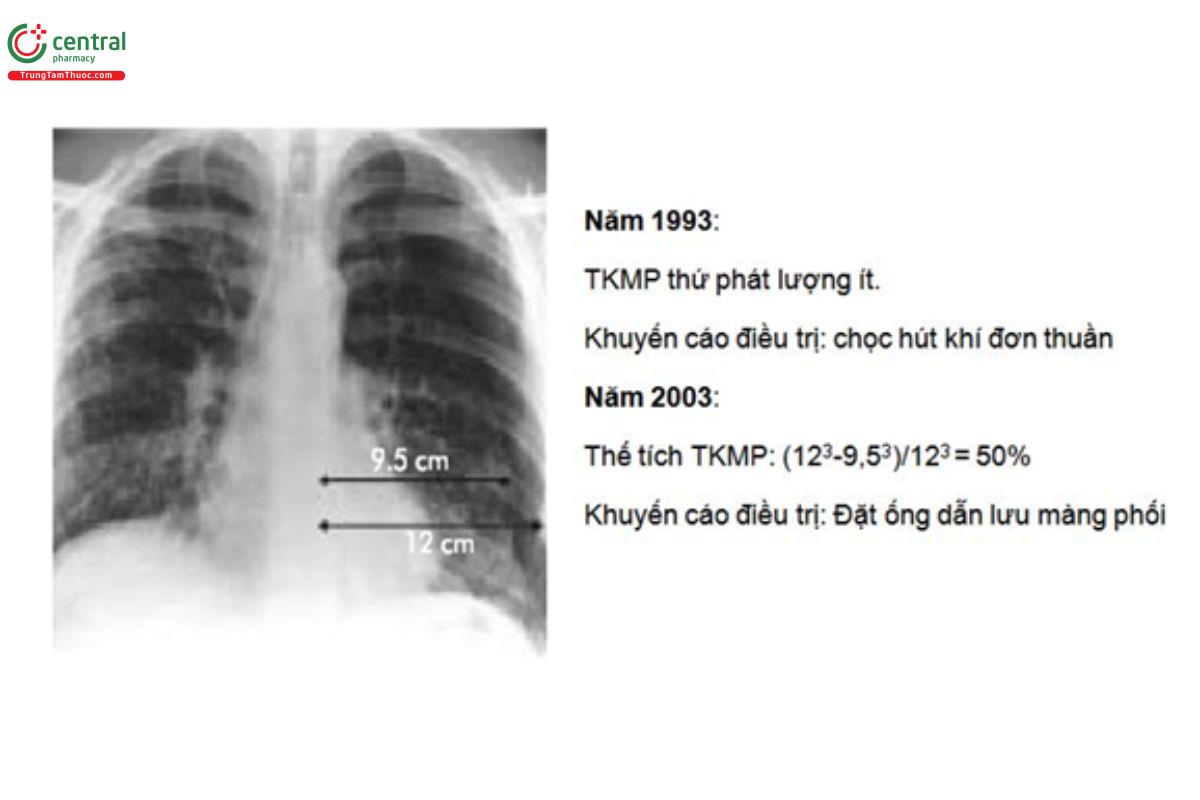
Khi nhìn ở ngoại biên của bề mặt phổi đến thành ngực có TKMP <1 cm, có thể không nên áp dụng việc chọc hút khí bằng kim nhọn. Tuy nhiên, với tình huống mà TKMP là 2 cm tương ứng với TKMP là 50%, nên xem xét đến kích thước và có thể điều trị một cách an toàn bằng chọc hút khi trong điều kiện cho phép.Với mục đích của tài liệu hướng dẫn mới này, TKMP lượng "ít" được xem như khi nó <2 cm và TKMP lượng ‘nhiều khi >2 cm.
Nếu cần đánh giá chính xác kích thước TKMP, chụp CT ngực là phương pháp tốt nhất (43). Nếu không, phương pháp này chỉ nên được áp dụng cho những trường hợp khó như phổi bị che mờ do tràn khí dưới da, hoặc để chẩn đoán phân biệt với trường hợp nghi ngờ túi khí ở bệnh nhân xơ nang phổi phức tạp (44). Việc sử dụng CT ngực thường quy trước phẫu thuật cho bệnh nhân bị TKMP và nghi ngờ khí phế thũng hay nghi ngờ túi khí đơn độc chỉ hỗ trợ chút ít cho phim ngực thẳng tia trước-sau trên quan điểm xử trí bệnh nhân (45)
4 NHỮNG ĐIỀU TRỊ CHỌN LỰA CHO TRÀN KHÍ MÀNG PHỔI TỰ PHÁT
4.1 Theo dõi:
Biện pháp theo dõi nên là lựa chọn đầu tiên trong TKMP ít, kín mà không khó thở đáng kể. [B]
Bệnh nhân TKMP nguyên phát lượng ít (<2 cm) mà không kèm khó thở nên được xem xét cho ra viện và tái khám ngoại trú sớm. Những bệnh nhân này cần nhận được bảng hướng dẫn được viết rõ ràng để quay lại trong trường hợp khó thở nhiều hơn. [B]
Nếu bệnh nhân được lưu lại qua đêm để theo dõi, nên cho họ thở oxy liều cao (10 l/phút), nhưng cần thận trọng với bệnh nhân COPD do có thể nhạy cảm với việc thở oxy liều cao. [B]
Bệnh nhân khó thở nên can thiệp bất kể kích thước TKMP trên XQ ngực như thế nào. [C]
4.1.1 TKMP nguyên phát với triệu chứng tối thiểu:
Việc theo dõi quan sát đơn độc nên được áp dụng cho trường hợp TKMP lượng ít, kín, triệu chứng vừa phải (21,30,46-48). 70-80% TKMP ước tính ít hơn 15% không bị dò khí dai dẳng và tái phát trong những trường hợp được quan sát theo dõi đơn độc ít hơn ở những bệnh nhân điều trị bằng việc đặt ống dẫn lưu màng phổi (48). Những bệnh nhân TKMP nguyên phát ít và có các triệu chứng tối thiểu không cần phải nhập viện, tuy nhiên cần phải nhấn mạnh cho họ biết trước khi về nhà về việc họ cần phải quay lại bệnh viện khi khó thở tăng lên. Hầu hết những bệnh nhân trong nhóm như thế thất bại biện pháp “điều trị” này và họ được đặt ống dẫn lưu màng phổi thì bị tràn khi thứ phát (48)
4.1.2 TKMP thứ phát với triệu chứng tối thiểu:
Quan sát đơn độc chỉ được khuyến cáo ở những bệnh nhân TKMP thứ phát lượng ít, nhỏ hơn 1 cm chiều dày hay TKMP đơn độc ở đỉnh. Những trường hợp này được khuyến cáo nhập viện. Tất cả các trường hợp khác sẽ phải cần can thiệp tích cực (chọc hút khí hay đặt ống dẫn lưu, xem các phần sau).
4.1.3 TKMP nguyên phát hay thứ phát, có triệu chứng:
Theo dõi đơn thuần là không còn phù hợp và cần phải can thiệp tích cực. Khó thở rõ ở một bệnh nhân TKMP it (<2 cm) có thể báo hiệu TKMP áp lực dương (48). Nếu bệnh nhân nhập viện để theo dõi đơn thuần, nên cho bệnh nhân thở oxy liều cao (10l/phút) ở những nơi có thể thực hiện được (49) Thở oxy liều cao có thể làm giảm áp lực khi trong các mao mạch trong khoang màng phổi do làm giảm áp lực riêng phần của nitơ. Điều này có thể làm tăng sự chênh lệch áp suất giữa mao mạch màng phổi và khoang màng phổi. Tốc độ tái hấp thu của TKMP tự phát là 1,25-1,8% thể tích của một bên phổi mỗi 24 giờ (47-50). Trong 1 nhóm gồm 11 bệnh nhân TKMP với thể tích thay đổi từ 16-100%, tốc độ trung bình về sự tái giãn nở là 1,8% mỗi ngày và sự giãn nở phổi hoàn toàn với thời gian trung bình là 3,2 tuần (47). Có 15% trường hợp TKMP cần 8-12 ngày để phục hồi hoàn toàn. Việc bổ sung bằng oxy liệu pháp liều cao cho thấy tốc độ tái hấp thu khí tăng lên 4 lần trong thời gian bệnh nhân sử dụng oxy (49)
4.2 Chọc hút khí đơn thuần:
Chọc hút khí đơn thuần được khuyến cáo là chọn lựa đầu tiên cho tất các tràn khí màng phổi nguyên phát cần có sự can thiệp. (A)
Chọc hút khí đơn giản ít thành công hơn trong TKMP thứ phát. Trong trường hợp này, nó chỉ được khuyến cáo là điều trị ban đầu ở những trường hợp TKMP lượng ít (<2 cm) và khó thở ít ở bệnh nhân dưới 50 tuổi. (B)
Bệnh nhân TKMP thứ phát được điều trị thành công với chục hút khí đơn thuần nên được nhập viện và theo dõi ít nhất 24 giờ trước khi ra viện. [C]
Tài liệu hướng dẫn của BTS năm 1993 (19) đã khuyến cáo việc hút khí đơn thuần là điều trị đầu tay cho tất cả các TKMP nguyên phát khi phổi bị xẹp toàn bộ hay TKMP nguyên phát ít hơn nhưng bệnh nhân lại than phiền về khó thở đáng kể. Chọc hút khí đơn thuần cũng đã được khuyến cáo như điều trị đầu tay ở bệnh nhân TKMP thứ phát khi phổi bị xẹp trung bình hay toàn bộ hoặc TKMP ít hơn nhưng bệnh nhân bị khó thở đáng kể. TKMP lượng ít được định nghĩa là “có ít khí chung quanh phổi", TKMP trung bình là “phổi bị xẹp phân nửa hướng về bờ tim” và hoàn toàn là “toàn bộ khí, tách biệt với cơ hoành”.
Một nghiên cứu mô tả thực hành điều trị TKMP sau tài liệu hướng dẫn năm 1993 cho thấy chỉ có 17 trong số 43 trường hợp được quyết định chọc hút khí từ khoa cấp cứu, có lẽ do không quen với kỹ thuật, và 9 trong số 26 quyết định tương tự bởi khoa nội dường như phù hợp . Một nghiên cứu tương tự được tiến hành ở Scotland và hoàn thành trước khi hướng dẫn năm 1993 ra đời cho thấy chỉ có 3 trong số 38 trường hợp TKMP tự phát (1 nguyên phát và 2 thứ phát) được điều trị ban đầu bằng việc hút khí đơn thuần và tất cả 3 trường hợp này đều thành công (21). Vì thế, hướng dẫn trên về phương diện này dường như nhiều hội đồng y khoa không lưu ý đến, hay do họ không muốn hoặc không thể thực hiện chọc hút khí.
Sau khi chọc hút khí đơn thuần, tỉ lệ phải giãn nở thành công trong trường hợp TKMP thứ phát (33-67%) kém hơn so với TKMP nguyên phát (59-83%) (51-53). Tuy nhiên, hàng loạt các nghiên cứu lớn sử dụng biện pháp chọc hút khí cho thấy 59-73% các trường hợp TKMP cần đến sự can thiệp có thể thành công với việc chọc hút khí (51,52, 54-56). Thành công trong việc chọc hút khí trang những nghiên cứu này phụ thuộc vào tuổi (dưới 50 tuổi: tỉ lệ thành công là 70-81%, trên 50 tuổi: 19-31% thành công), sự hiện diện của bệnh phổi mạn tính (27-67% thành công), và kích thước của TKMP (<3 lít chọc hút: 89% thành công, >3 lít: không thành công; >50% trên phim ngực: 62% thành công, <50% trên phim ngực: 77% thành công). Trong một nghiên cứu tiền cứu ngẫu nhiên so sánh chọc hút đơn thuần và dẫn lưu màng phổi trong trường hợp TKMP, Andrivert và các cộng sự (5) đã thấy tỉ lệ tái phát là 20% trong 3 tháng sau khi chọc hút đơn thuần trong TKMP nguyên phát và 28% tái phát sau khi đặt ống, điều này cho thấy việc chọc hút khí đơn thuần kém hiệu quả về mặt tái phát so với đặt ống dẫn lưu màng phổi là biện pháp can thiệp xâm lấn hơn. Trong một thử nghiệm ngẫu nhiên có kiểm soát khác gần đây Noppen và các cộng sự (53) cho thấy việc chọc hút khí đơn giản thành công trong điều trị ở những bệnh nhân TKMP nguyên phát lần đầu tiên cũng như đặt ống dẫn lưu màng phổi tức thì (59% so 63%). Những bệnh nhân điều trị bằng chọc hút khí đơn thuần có lẽ ít nhập viện và ít bị tái phát TKMP trong 12 tháng sau đó. Harvey và Prescott (56), với danh nghĩa Hiệp Hội Lồng Ngực Anh, xác định rằng việc chọc hút khí đơn thuần trong TKMP nguyên phát có hiệu quả như đặt ống dẫn lưu màng phổi trong trường hợp xem xét sự tái phát TKMP sau 12 tháng là mục tiêu điều trị. Các ưu điểm khác của chọc hút khí đơn thuần so với việc đặt ống dẫn lưu màng phổi là giảm tổng số điểm đau chung trong suốt thời gian nhập viện và thời gian lưu lại tại bệnh viện ngắn hơn (56). Ở những trung tâm được trang bị dụng cụ và có kinh nghiệm, nên xem xét việc sử dụng bộ chọc hút khí với catheter nhỏ để hút khí (xem ở phần dưới) vì cathether có thể đặt lại cho đến khi xác định được phổi giãn nở lại hoàn toàn. Nếu không, chọc hút khí lại hay nối với hệ thống kín có thể được tiến hành dễ dàng qua các cathether nòng nhỏ đã được đặt vào trong.
TKMP thứ phát lượng nhiều (>2 cm), đặc biệt ở những bệnh nhân trên 50 tuổi, nên xem xét đến nguy cơ thất bại cao khi chọc hút đơn thuần và tái phát, do đó việc đặt ống dẫn lưu màng phổi được khuyến cáo như là điều trị ban đầu thích hợp. Nếu chọc hút đơn thuần được xem xét ở những bệnh nhân TKMP thứ phát, bệnh nhân phải được nhập viện theo dõi ít nhất 24 giờ, khi cần thiết có thể đặt ống dẫn lưu màng phổi ngay. Điều trị tích cực bệnh lý phổi sẵn có là hết sức cần thiết.
4.2.1 Chọc hút lại và chọc hút khí bằng catheter trong trường hợp TKMP đơn giản:
Lập lại biện pháp chọc hút khí là hợp lý trong TKMP nguyên phát khi chọc hút khí lần đầu không thành công (ví dụ bệnh nhân vẫn còn triệu chứng) và thể tích khí được hút ra lần đầu <2,5 lít. [B]
Việc chọc hút bằng catheter cho TKMP có thể được tiến hành ở những nơi có dụng cụ và kinh nghiệm. [B]
Bộ catheter cho chọc hút khí với hệ thống van một chiều đồng bộ có thể làm giảm bớt việc lập lại chọc hút khí. [C]
Phổi giãn nở thất bại trong TKMP nguyên phát với chọc hút khí đơn thuần có thể điều trị thành công bằng chọc hút khí lần thứ hai trong hơn 1/3 trường hợp, đặc biệt khi lần đầu tiên thất bại do catheter bị xoắn hay chuyển vị trí (51). Mặc dù thế, khuynh hướng thường gặp là xử trí việc chọc hút thất bại bằng đặt ống dẫn lưu (20,31,32). Việc cố gắng chọc hút khí đơn giản lại lần thứ hai nên được xem xét lại trừ khi ở lần hút khí không thành công lần đầu tiên (56). Bộ cathether chọc hút khí cho TKMP đơn giản bao gồm một catheter nhỏ (8F) qua dây dẫn vào khoang màng phổi. Khóa 3 chiều được gắn vào và khí có thể được hút qua ống hút 50ml. Nó kiểm soát đến 59% tất cả các trường hợp TKMP. Việc thêm vào van Heimlich và bộ hút có thể làm tăng tỉ lệ thành công cao hơn (57-89)
4.3 Đặt ống dẫn lưu màng phổi:
Nếu chọc hút khí đơn thuần hay chọc hút khí bằng catheter cho bất cứ trường hợp TKMP nào mà không kiểm soát được các triệu chứng, cần đặt ống dẫn lưu màng phổi. [B]
Việc đặt ống dẫn lưu màng phổi được khuyến cáo trong TKMP thứ phát trừ những trường hợp bệnh nhân không khó thở và TKMP rất ít (<1 cm hay ở TKMP ở đỉnh). [B]
Không bao giờ kẹp ống dẫn lưu khi ống đang sủi bọt. [B]
Một ống dẫn lưu không ra bọt khí không phải lúc nào cũng nên kẹp ống. [B]
Nếu ống dẫn lưu đặt cho TKMP được kẹp lại, cần phải có sự theo dõi của bác sĩ chuyên khoa hô hấp hay bác sĩ ngoại lồng ngực, bệnh nhân phải được theo dõi trong khoa chuyên biệt với hệ thống điều dưỡng có kinh nghiệm, và bệnh nhân không được rời khỏi khoa. [C]
Nếu bệnh nhân được kẹp ống bị khó thở hay xuất hiện tràn khí dưới da, ngay lập tức ống dẫn lưu phải được mở ra và tham khảo ý kiến chuyên khoa ngay. [C]
Hệ thống dẫn lưu kín (hệ thống bình nước) với ống dẫn lưu ngực được giới thiệu vào năm 1875 (60). Dẫn lưu ống kín được cải tiến lần đầu tiên suốt năm 1917 có dịch cúm xảy ra (61). Dẫn lưu màng phổi bằng ống dẫn hay dẫn lưu kín với kiểu mẫu hiện đại được sử dụng từ năm 1916 khi Kenyon (62) mô tả về phương pháp “ống truyền” để dẫn lưu tràn máu màng phổi do chấn thương. Mặc dù được mô tả là có hiệu quả cực tốt, phương thức điều trị này đã có những bất lợi tiềm tàng thay đổi từ lồng ngực và chấn thương nội tạng bụng từ troca bén do các thủ thuật viên thiếu kinh nghiệm (63) đến sự cồng kềnh của hệ thống dẫn lưu kín vốn phải được giữ thẳng đúng.
Tương tự thế, việc kẹp ống dẫn lưu có thể rất nguy hiểm khi nó vẫn còn sủi bọt khí, do nó có thể biến TKMP đơn thuần thành TKMP áp lực dương đe dọa mạng sống (...). Những tình huống như thể là ít, và không có bằng chứng nào về việc chúng ta nhận thấy kẹp ống dẫn lưu làm cải thiện tỉ lệ thành công hay ngăn chặn tái phát. Hầu hết các tỉ lệ thành công như nhau đều được ghi nhận về sự duy trì của sự tái giãn nở của phổi sau 24 giờ khi ống dẫn lưu đã kẹp và không được rút ống trước đó (30). Tuy nhiên nhiều bác sĩ có kinh nghiệm vẫn còn ủng hộ việc kẹp ống trước khi họ rút ống ra với mục đích phát hiện những trường hợp dò khí ít mà không được dễ dàng thấy tại giường bệnh. Bằng cách kẹp ống dẫn lưu vài giờ và chụp lại phim ngực, có thể phát hiện được việc dò khí ít và không liên tục, nhờ thể có khả năng tránh được việc đặt ống dẫn lưu lại. Trong tuyên bố đồng thuận Delphi ACCP (35) có một nửa nhóm người ủng hộ việc kẹp ống và một nửa còn lại không đồng ý, kết quả này cũng tương tự như ý kiến chung tại Anh. Vì thế, nói chung việc kẹp ống dẫn lưu không được khuyến cáo vì những lý do an toàn cho bệnh nhân, nhưng nó có thể chấp nhận được khi có sự theo dõi của các nhân viên điều dưỡng vốn là những người đã được huấn luyện về việc xử trí ống dẫn lưu và và được hướng dẫn mở ống dẫn lưu trong tình huống có bất kỳ diễn tiến lâm sàng bắt lợi nào. Những bệnh nhẫn được kẹp ống dẫn lưu không bao giờ được phép ra khỏi khu vực hay khoa phòng chuyên biệt.
Mặc dù có những nguy cơ trên, dẫn lưu màng phổi vẫn là phương thức điều trị hiệu quả cho TKMP tuy chưa chứng minh rằng việc đặt ống dẫn lưu có thể được tiến hành như là phương thức điều trị đầu tiên của bất cứ TKMP nào. Chọc hút khí đơn giản nên được xem xét như là phương thức điều trị chủ yếu cho tất cả các loại TKMP cần can thiệp nhưng không được xem là bị áp lực dương. Với bệnh nhân trên 50 tuổi bị TKMP thứ phát và TKMP >50% tỉ lệ thất bại ban đầu về việc chọc hút khi được ước tính đến >50% (51,52,66). Yếu tố tuổi đơn thuần luôn là yếu tố tiên đoán mạnh về sự thất bại của việc chọc hút khí đơn thuần (>50 tuổi, tỉ lệ thành công là 27-67%) (31,62), mặc dù ở những bệnh nhân trên 50 tuổi không có bằng chứng về bệnh phổi đã tồn tại trước đó, không có bằng chứng việc dẫn lưu màng phổi nên được khuyến cáo trước việc chọc hút đơn thuần như là điều trị chính.
Việc sử dụng giảm đau trong việc đặt ống dẫn lưu màng phổi vẫn ít được nghiên cứu đến.Việc tiêm vào khoang màng phổi bằng thuốc tê tại chỗ (20-25 ml = 200-250 mg, 1% lignocaine) tiêm bolus sau đó mỗi 8 giờ là cần thiết trước khi đưa ống vào làm giảm tổng số điểm đánh giá đau một cách đáng kể và an toàn mà không ảnh hưởng đến việc đo lường khí máu động mạch, khi có hay không việc gây dính màng phổi bằng bột talc. Không có số liệu chi tiết nào về xuất độ nhiễm trùng màng phổi do kỹ thuật này 788). Thông thường các ống dẫn lưu (59%) gây ra các vết nứt (99) nhưng những ống dẫn lưu này dường như vẫn còn giữ được tính hiệu quả của nó. Hướng dẫn từng bước một về cách đặt ống dẫn lưu ngực đã được mô tả ở phần khác của các hướng dẫn này (trang ii53).
4.3.1 Các biến chứng của việc đặt ống dẫn lưu màng phổi:
Các biến chứng của việc đặt ống dẫn lưu màng phổi bao gồm thủng các nội tạng lớn như phổi, dạ dày, lách, gan, tim và các mạch máu lớn và có thể dẫn đến tử vong 370-73). Những biến chứng này thường gặp hơn khi sử dụng troca bằng kim loại bén không thích hợp trong quá trình đặt ống (63,72,73)
Trong nghiên cứu lớn nhất về hàng loạt trường hợp TKMP thời gian gần đây nhằm xem xét lại các biến chứng của việc đặt ống dẫn lưu màng phổi, Chan và các cộng sự (4) đã xác định các | biến chứng là 18% trường hợp đặt ống dẫn lưu màng phổi cho tất cả các chỉ định; 64% của những trường hợp đặt ống dẫn lưu ngực (n = 373) đã được thực hiện cho điều trị TKMP. Tuy nhiên, 15% các biến chứng xác định được bao gồm việc thất bại trong điều trị TKMP và chỉ có 4% liên quan đến việc đặt ống sai. Lưu ý, các biến chứng liên quan đến việc dịch chuyển ống xảy ra hầu hết ở các khoa nội. Việc đánh giá bằng CT ngực cho thấy tỉ lệ cao hơn trong việc đặt ống không đúng. Baldt và các cộng sự (75) xác định 3% ống được đặt ngoài lồng ngực và 6% đặt trong phổi trong suốt thời gian điều trị TKMP. Điều này nhẫn mạnh đến sự cần thiết trong việc hưởng dẫn đặt ống dẫn lưu đúng cách. Trong một số tình huống, CT ngực có giá trị để đánh giá vị trí ống dẫn lưu, ví dụ, khi nghi ngờ đặt ống dẫn lưu sai chỗ mà không thể xác định bằng phim thông thường (75)
Nhiễm trùng màng phổi là biến chứng khác của việc đặt ống dẫn lưu. Tỉ lệ mủ màng phổi sau khi đặt ống ước tính khoảng 1% (74). Hàng loạt trường hợp khác báo cáo về xuất độ lên đến 6% trường hợp đặt ống dẫn lưu liên quan đến mủ màng phổi trong các trường hợp chấn thương và gợi ý rằng nên được xem xét việc sử dụng kháng sinh dự phòng, đặc biệt là khi có thể dự đoán việc dẫn lưu khí trong khoảng thời gian kéo dài (76,77). Điều này nhấn mạnh đến sự cần thiết của kỹ thuật sát trùng khi đưa ống vào hay thao tác trên bất cứ hệ thống dẫn lưu ngực nào.
Cuối cùng, tràn khí dưới da là biến chứng đã được biết nhiều trong việc đặt ống dẫn màng phổi (78). Nói chung, biến chứng này là quan trọng chỉ về mặt thẩm mỹ, nó sẽ tự hết trong vài ngày. Việc hình thành tràn khí dưới da liên quan đến TKMP là do khi luồn vào khoảng trắng vốn trước đây không được lưu thông với các mô dưới da, trở thành lưu thông với các mô dưới da. Điều này xảy ra khi ống dẫn lưu có vị trí đặt không tốt, ống bị gập, bị tắc ống hay bị kẹp. Tương tự như thế, ống dẫn lưu nhỏ trong trường hợp lỗ dò lớn có khả năng gây ra tràn khí dưới da. Đôi khi, hậu quả của việc tắc nghẽn đường thở cấp tính hay chèn ép ngực cũng đưa đến tổn thương hô hấp (78,79), Việc điều trị luôn luôn là bảo tồn, nhưng trong các tình huống đe dọa tính mạng, các biện pháp như mở khí quản, ép khí qua rạch da, đưa vào các ống dẫn lưu lớn được biến đổi vào dưới da cũng đã được sử dụng (78)
4.3.2 Kích thước ống dẫn lưu:
Không có bằng chứng cho rằng ống dẫn lưu lớn (20-24 F) tốt hơn ống nhỏ (10-14 F) trong xử lý TKMP. Việc sử dụng ngay ống dẫn lưu lớn (20-24 F) không được khuyến cáo, mặc dù có thể cần thiết trong việc thay thế ống dẫn lưu nhỏ bằng ống dẫn lưu lớn khi có sự dò khí liên tục. [B]
Mặc dù có 1 nghiên cứu gợi ý rằng tỉ lệ thành công trong điều trị TKMP với các ống dẫn lưu nhỏ (13F) là kém và nên dùng các catheter có kích thước lớn hơn 1, các nghiên cứu tiếp sau đó không khẳng định được điều này và gợi ý rằng ống dẫn lưu kích thước nhỏ cũng có hiệu quả như thế (81-84). Tỉ lệ thành công ban đầu là 84-97% đã được ghi nhận trong những nghiên cứu sử dụng ống dẫn lưu 7-9 F gauge. Sự phát triển của kỹ thuật gần đây cho phép dùng thêm van Heimlich với ống dẫn lưu nhỏ cũng như ống lớn hơn.
Các yếu tố có thể góp phần gây thất bại với các ống nhỏ, vì thế có ưu thế trong chọn ống lớn hơn, có thể là sự hiện diện của dịch màng phổi và sự hiện diện của việc khi dò ra nhiều vượt quá khả năng dẫn lưu của các ống nhỏ (82). Việc dùng catheter Teflon nòng nhỏ (2 mm) đưa vào “qua kim và dây dẫn” gắn với van một chiều khi chọc hút một phần khi với bơm tiêm 60ml minh chứng sự thành công ở 27 trong số 28 bệnh nhân với thời gian dẫn lưu trung bình là 48 giờ (59). Việc sử dụng hệ thống ống dẫn lưu màng phổi nhỏ, thời gian dẫn lưu trung bình thay đổi từ 2 đến 4 ngày, rất thuận tiện khi so sánh với hệ thống ống dẫn lưu màng phổi 198283). Những khó khăn về tắc ống không thấy được trong các nghiên cứu này. Gây dính màng phổi bằng hóa chất vẫn có thể thực hiện được với những ống nhỏ hơn bao gồm với hệ thống catheter nằm trong.
Nếu quyết định đặt ống dẫn lưu màng phổi, ban đầu nên chọn hệ thống ống nhỏ (10-14 F) Việc sử dụng cathether qua hệ thống dây hướng dẫn (Kỹ thuật Seldinger) có thể chứng tỏ về tính an toàn và hiệu quả như với các ống có đường kính nhỏ, mặc dù chúng thường đắt tiền hơn. Tần suất về việc sử dụng chúng đang tăng dần, tuy vậy cần có thêm chứng cứ trước khi được khuyến cáo cho việc sử dụng chúng ngay từ lần đầu.
4.4 Chuyển cho các bác sĩ chuyên khoa hô hấp:
TKMP thất bại không giãn nở được trong 48 giờ điều trị nên được chuyển cho bác sĩ chuyên khoa hô hấp. [C]
TKMP mà phải không giãn nở lại được hay khi vẫn thoát ra trong khoảng thời gian quá 48 giờ nên được chuyển ngay cho bác sĩ chuyên khoa hô hấp. Những bệnh nhân như thế có thể cần được đặt ống dẫn lưu duy trì với các xử trí phức tạp với ống dẫn lưu (hút, đặt lại ống vị trí khác) và các quyết định của phẫu thuật lồng ngực. Những vấn đề này sẽ được xử lý tốt hơn bởi các bác sĩ đã được đào tạo chuyên khoa và có kinh nghiệm về những vấn đề trên và đã thiết lập mối
quan hệ với bác sĩ ngoại lồng ngực. Việc xử lý vấn đề dẫn lưu tốt nhất cũng do các điều dưỡng có nhiều kinh nghiệm trong lĩnh vực này.
4.4.1 Hút khí qua ống dẫn lưu:
Việc hút khí qua ống dẫn lưu không nên thực hiện ngay khi đặt ống, nhưng có thể thực hiện sau 48 giờ cho trường hợp tồn tại sự dò khí liên tục hay phổi không giãn nở lại được. [B]
Hệ thống hút với thế tích cao, áp lực thấp (-10 đến - 20 cmH2O). [C]
Những bệnh nhân cần phải hút khí chỉ nên được thực hiện ở những đơn vị hô hấp có có bác sĩ chuyên khoa và các điều dưỡng có kinh nghiệm. [C]
Không có bằng chứng nào ủng hộ việc hút khí qua ống dẫn lưu như một điều trị ban đầu thường quy trong điều trị TKMP tự phát (80,85). Trường hợp dò khí dai dẳng, có hay không tình trạng phổi được giãn nở hoàn toàn trên phim ngực, là lý do thường gặp cho việc ứng dụng việc hút khí qua ống dẫn lưu. Trường hợp dò khi dai dẳng luôn luôn được định nghĩa một cách ngẫu nhiên là việc bọt khí thoát ra liên tục qua ống dẫn lưu màng phổi 48 giờ sau khi đặt ống. Mathur và cộng sự xem xét hồi cứu 142 trường hợp TKMP tự phát cần đặt ống dẫn lưu ngực.Thời gian trung bình đến khi hết khí là 8 ngày (19 ngày ở những bệnh nhân có bệnh lý phổi trước đó), điều này không liên quan đến kích thước ban đầu của ống dẫn lưu cho TKMP. Hầu hết bệnh nhân (30/43) bị dò khi dai dẳng đã được hút khí, nhưng không có tiêu chuẩn nào về mức độ hút khi hay thời điểm bắt đầu (đa số trong 4 ngày đầu). Bình thường, áp lực trong khoang màng phổi là -8 cmH2O trong quá trình hít vào và -3,4 cmH2O trong quá trình thở ra. Trong suốt thời gian đặt ống dẫn lưu màng phổi, nhiều yếu tố khác nhau ảnh hưởng đến lượng khi hút ra trong khoang màng phổi (3.87). Có giả thiết cho rằng, do tầm quan trọng của các yếu tố sinh lý thay đổi, cần thực hiện hút -10 đến - 20 cmHO cho tất cả các trường hợp TKMP mà phải giãn nở chậm, và hệ thống được sử dụng cần có khả năng tăng áp lực hút với lưu lượng thể tích khi 15-20 I/min (88). Cách đây 40 năm, Roe (89) đã nhấn mạnh đến tầm quan trọng về hút thể tích khí cao cho dẫn lưu khí trong khoang màng phổi trong khi bị TKMP. Tuy nhiên, việc ứng dụng hút khi áp lực cao, thể tích cao không được khuyến cáo bởi vì nó dễ thúc đẩy việc hút khí với lưu lượng cao mà điều này có thể dẫn đến việc mất khí, giảm oxy máu hay duy trì việc dò khí (90). Tương tự như thế, nên tránh sử dụng hệ thống áp lực cao, thể tích thấp (64). Hệ thống thể tích cao, áp lực thấp như hệ thống bơm Vernon- Thompson hay hút qua tường với thiết bị tiếp hợp được khuyến cáo sử dụng. Không may là do thiếu các thử nghiệm lâm sàng đối chứng ngẫu nhiên gần đây để xem xét vai trò của việc hút khí qua ống dẫn lưu màng phổi mà chưa thể áp dụng trong các khuyến cáo dựa trên chứng cứ. Thực hành tốt nhất từ những nghiên cứu trước đến nay, như đề cập ở trên, gợi ý rằng việc hút khi nên được áp dụng sau 48 giờ, nhưng việc chuyển bệnh nhân sang ngoại khoa trong trường hợp tồn tại dai dẳng dò khí mà không có bệnh lý phổi trước đó nên được tiến hành vào ngày 5-7. Việc chuyển ngoại khoa sớm hơn (2-4 ngày) cần được xét đến với những bệnh nhân đã có sẵn bệnh lý phải trước đó, dò khí nhiều dai dẳng, hoặc phổi không thể giãn nở được (91-93). Nếu bệnh nhân được hút khí qua ống dẫn lưu màng phổi, bệnh nhân được khuyến cáo nên tiến hành tại nơi sẵn có các điều dưỡng chuyên khoa có kinh nghiệm.
Việc kết hợp hút khí quá sớm sau khi đặt ống dẫn lưu màng phổi, đặc biệt trong những trường hợp TKMP nguyên phát đã xảy ra vài ngày trước đó có thể thúc đẩy biến chứng phù phổi sau khi giãn nở (re-expansion pulmonary oedema - RPO) và điều này là chống chỉ định. RPO có thể xảy ra do tăng tính thấm thành mạch bị tổn thương trong khi bị TKMP. Nó có thể biểu hiện như một phù phổi trong thời gian phải giãn ra do các stress cơ học với các mao mạch đã bị "dò" (4), về mặt lâm sàng, những bệnh nhân biểu hiện các triệu chứng như họ và khó thở hoặc nặng ngực sau khi ống dẫn lưu được đưa vào. Với những bệnh nhân mà triệu chứng vẫn còn tồn tại, phim phổi chụp lại sau 24 giờ thường sẽ cho hình ảnh phù phổi bên phổi bị tràn khí, mặc dù phù phổi vẫn có thể xả ra bên phải đổi bên (95). Xuất độ RPO có thể tăng lên đến 14% và xuất độ này cao hơn ở những bệnh nhân TKMP nguyên phát lượng nhiều và xảy ra với những bệnh nhân trẻ tuổi (<30 tuổi), mặc dù trong hầu hết các trường hợp RPO không tiến triển vượt quá những bất thường trên x quang (96). Tuy nhiên, biểu hiện lâm sàng nổi bật của RPO cần phải được kiểm soát do hậu quả được ghi nhận về tử vong trong hàng loạt trường hợp là 20% trong số 53 trường hợp được ghi nhận là có diễn tiến lâm sàng xấu như biểu hiện của hội chứng RPO (95). Vì thế cần lưu ý đặc biệt trong khi điều trị những bệnh nhân trẻ có TKMP lượng nhiều và không được hút khí ngay lập tức trong điều trị TKMP tự phát. Thậm chí ngay khi hút khi sau đó và với TKMP đã xảy ra trong khoảng thời gian đáng kể, vẫn phải xem xét đến khả năng tiềm tàng xảy ra RPO cho bệnh nhân (96)
4.4.2 Gây dính màng phổi bằng hóa chất:
Gây dính màng phổi bằng hóa chất có thể kiểm soát trường hợp TKMP khó hoặc tái phát [A] nhưng chỉ nên áp dụng khi bệnh nhân không muốn hay không thể phẫu thuật được. [B]
Gây dính màng phổi nội khoa nên được bác sĩ chuyên khoa hô hấp thực hiện. [C]
Gây dính màng phổi bằng hóa chất thường được tiến hành bởi các thầy thuốc lồng ngực qua nội soi lồng ngực.Việc bơm các chất vào khoang màng phổi gây viêm vô trùng với sự bám dày đặc, cuối cùng đưa đến tình trạng dính màng phổi. Tỉ lệ tái phát cao với TKMP nguyên phát và thứ phát và những nỗ lực nhằm giảm tỉ lệ này bởi việc bơm vào các chất gây xơ hóa khác nhau - hoặc qua ống dẫn lưu màng phổi hoặc qua các phương tiện ngoại khoa thường được thực hiện mà không có hướng dẫn rõ ràng cho các thầy thuốc trực tiếp trong điều trị này. Trong đa số trường hợp, khi thích hợp, việc ngăn chặn TKMP tái phát nên được thực hiện bằng các phương pháp ngoại khoa. Tỉ lệ tái phát của TKMP sau can thiệp ngoại khoa do mở ngực hay VATS - có hay không gây dính màng phổi ngoại khoa - ít hơn nhiều so với gây dính màng phổi nội khoa (36,97-99). Một số lượng ít bệnh nhân hoặc quá yếu hay không muốn trải qua bất cứ điều trị ngoại khoa việc gây xơ hóa nội khoa bằng hóa chất có thể thích hợp nhằm ngăn chặn TKMP tái phát trong những trường hợp như thế.
Trong suốt thập kỷ qua, nhiều tác nhân gây dính đã được nghiên cứu (36,97,100-103). Tetracycline được khuyến cáo như chất gây xơ hóa đầu tay trong cả hai loại TKMP nguyên phát và thứ phát. Nó được gợi ý đầu tiên do đã chứng minh hiệu quả gây xơ hóa hiệu quả nhất trên động vật (101,104,105) Gần đây, Tetracycline sử dụng ngoài đường uống dành cho gây dính màng phổi trở nên khó tìm do có những vấn đề trong quá trình sản xuất. Chế phẩm không phải đường uống này hiện tại sẵn có tại Đức và có thể nhập khẩu qua các đại lý quốc tế, các nhà cung cấp này tuyên bố việc cung cấp thuốc được mong đợi và còn có được cho tương lai. Minocycline và Doxycycline đã cho thấy là những chất thay thế hợp lý như tác nhân gây xơ hóa trên mô hình động vật (104,105)
Tỉ lệ TKMP tái phát là điểm báo chính yếu cho sự thành công của bất cứ chất gây xơ hóa nào. Mặc dù Tetracycline đã được chứng minh làm giảm một cách có ý nghĩa xuất độ tái phát sớm, xuất độ tái phát muộn là 10-20% và cao một cách không thể chấp nhận được khi so với việc gây dính màng phổi bằng phương pháp ngoại khoa (97,99,103). Nhiều nghiên cứu lớn ngẫu nhiên có kiểm soát so sánh việc sử dụng tetracycline như một chất gây xơ hóa với sự xử lý chuẩn trong TKMP nguyên phát là cần được xác định có hay không việc tetracycline nên được sử dụng sau khi điều trị trường hợp TKMP nguyên phát lần đầu tiên và không biến chứng nhằm ngăn ngừa tái phát. Tuy nhiên, Tetracycline có thể được khuyến cáo cho TKMP nguyên phát tái phát và TKMP thử phát khi ngoại khoa không được lựa chọn, và bột talc có thể được sử dụng trong cộng đồng chung là tác nhân hiệu quả nhất cho tràn dịch màng phổi ác tính. Có những bằng chứng trái ngược như tetracycline có hiệu quả trong điều trị TKMP giãn nở hoàn toàn với lỗ dò khí dai dẳng (36,106,107). Là nghiên cứu lớn nhất trong số này, nghiên cứu của cơ quan quản lý y tế cựu chiến binh (Mỹ, Veterans Administration study) không ủng hộ việc sử dụng tetracycline đưa vào trong màng phổi để thúc đẩy việc đóng lại lỗ dò (36), Macoviak và cộng sự (107) gợi ý tetracycline trong màng phổi có thể thúc đẩy việc đóng lại lỗ dò khi dai dẳng miễn là phải có thể được giữ cho giãn ra để tình trạng dính vào nhau có thể xảy ra. Tương tự, có những bằng chứng mâu thuẫn về việc tetracycline trong màng phổi làm giảm bớt thời gian điều trị TKMP tại bệnh viện (36,97,103)
Liều lượng tetracycline khoang màng phổi cần phải được xác định rõ. Almind và cộng sự (97) cho thấy việc giảm xuất độ tái phát TKMP trong nhóm sử dụng 500 mg tetracycline qua ống dẫn lưu khi so với những trường hợp chỉ điều trị bằng dẫn lưu màng phổi thông thường đơn độc. Việc giảm xuất độ này là không có ý nghĩa. Nghiên cứu Veterans Administration (36), sử dụng 1500 mg tetracycline cho thấy xuất độ tái phát TKMP giảm có ý nghĩa mà không bị các tai biến đáng lưu ý. Liều lượng tetracycline trong khoang màng phổi này vì thế được khuyến cáo như là liều chuẩn cho xơ hóa màng phổi nội khoa. Trong khi trong nhóm điều trị với liều tetracycline là 1500 mg người ta nhận thấy đau được ghi nhận nhiều hơn (3%), trong nhóm với liều là 500 mg không thấy có hiện tượng đau tăng lên miễn là được dùng thuốc giảm đau thích hợp (97) Giảm đau đủ có thể đạt được với việc sử dùng thuốc tê tại chỗ vào khoang màng phổi. Liều chuẩn (200 mg, 20 ml Dung dịch 1% lignocaine) kém hiệu quả một cách có ý nghĩa so trường hợp dùng với liều lớn hơn (250 mg, 25 ml dung dịch 1% lignocaine). Liều lượng cao hơn cho thấy tăng các giai đoạn không đau, từ 10% đến 70% mà không có độc tính gì thấy rõ (68).
Thủ thuật gây dính màng phổi nội và ngoại khoa với bột talc vẫn còn là biện pháp hiệu quả thay thế với phương pháp dùng bằng tetracycline. Trong điều trị TKMP, không có các thử nghiệm lâm sàng đối chứng để so sánh bột talc và tetracycline như tác nhân gây xơ hóa. Vấn đề sử dụng bột talc trong dày dính màng phổi sẽ được đề cập sau trong mục ngoại khoa của bài tổng quan này do hầu hết các thử nghiệm dùng bột talc có khuynh hướng tập trung vào việc gây dính màng phổi ngoại khoa.
Do việc làm dính màng phổi nội khoa được biết đến như thủ thuật tốt thứ hai và việc áp dụng nó dành cho trường hợp “khó”, thủ thuật này được khuyến cáo chỉ được các bác sĩ chuyên khoa hô hấp thực hiện hay các bác sĩ ngoại khoa lồng ngực.
4.5 Chuyển cho bác sĩ ngoại lồng ngực:
Trong trường hợp dò khi dai dẳng hay phổi không giãn nở được, thầy thuốc chuyên khoa hô hấp nên tham khảo ý kiến của ngoại lồng ngực sớm (3-5 ngày). [C]
Mở ngực hở và cắt màng phổi vẫn là thủ thuật với tỉ lệ tái phát thấp nhất trong những trường hợp TKMP khó hay TKMP tái phát. Các thủ thuật xâm lấn một cách tối thiểu, nội soi lồng ngực (VATS), làm trầy xước màng phổi, và gây dính màng phổi bằng bột talc qua phẫu thuật là các chiến lược thay thế có hiệu quả.
Thời điểm cho việc can thiệp ngoại khoa trong TKMP vẫn đang là thách thức và vẫn còn gây bàn cãi. Không có bằng chứng nào dựa trên sự chứng minh đúng đắn cho quyết định một cách tùy tiện tuy đã được tán thành rộng rãi cho việc chọn điểm cắt là 5 ngày cho phẫu thuật trong trường hợp do khi dai dẳng (46) .Chee và các cộng sự (108) đã cho thấy 100% trường hợp TKMP nguyên phát được điều trị bằng đặt ống dẫn lưu khi có dò khí dai dẳng trên 7 ngày sẽ hết khi trước 14 ngày và 79% trường hợp TKMP thứ phát có dò khi dai dẳng sẽ lành trước 14 ngày mà không có tử vong. Tuy nhiên, khi xem xét về tính hiệu quả và mức độ biến chứng tương đối thấp và tái phát liên quan đến phẫu thuật trong TKMP (109-112), việc can thiệp ngoại khoa sớm được ủng hộ trong trường hợp dò khí dai dẳng hay phổi thất bại trong tái giãn nở, đặc biệt trong những trường hợp TKMP thứ phát (92,113). Nhiều tác giả khuyến cáo chuyển bệnh nhân phẫu thuật/can thiệp sớm ngay ngày thứ 3 mà vẫn dò khí. Tuy nhiên những nghiên cứu này không được đối chứng (91-93), Mặc dù xuất độ của tái phát muộn trong TKMP giảm trong nhiều nghiên cứu, việc chuyển ngoại khoa khi dò khí dai dẳng trong trường hợp TKMP nguyên phát lần đầu tiên trong 4-5 ngày đầu không được sự ủng hộ từ y văn. Tuy nhiên, thực hành tốt nhất gợi ý rằng việc dẫn lưu màng phổi kéo dài là không có lợi cho bệnh nhân. Vì vậy, bệnh nhân TKMP khó được khuyến cáo cần được chăm sóc từ bác sĩ chuyên khoa hô hấp và sớm có ý kiến ngoại lồng ngực trong phần xử trí bệnh nhân.
Dựa vào thống kê và các nguy cơ đã biết cho TKMP tái phát, các chỉ định chấp thuận được cho việc can thiệp phẫu thuật được liệt kê như sau:
- TKMP cùng bên lần thứ hai.
- TKMP đổi bên lần thứ nhất.
- TKMP tự phát 2 bên.
- Dò khí (>5 - 7 ngày đặt ống dẫn lưu; dò khí hay thất bại tái giãn nở phổi hoàn toàn).
- Tràn khí - tràn máu tự phát.
Những nghề nghiệp nguy cơ (ví dụ phi công, thợ lặn) (198,110,114-118)
4.5.1 Các chiến lược ngoại khoa:
Có 2 mục tiêu trong việc xử trí ngoại khoa trong TKMP. Mục tiêu đầu tiên được chấp thuận rộng rãi là việc cắt bỏ các bóng hoặc khâu lại lỗ thủng ở đỉnh phổi để điều trị khiếm khuyết mắc phải. Mục tiêu thứ hai là việc gây dính màng phổi nhằm ngăn ngừa tái phát. Có sự tranh luận giữa những người ủng hộ việc gây dính màng phổi bằng ngoại khoa hoặc gây trầy xước màng phổi đối lập với những người ủng hộ việc cắt một phần hay toàn bộ màng phổi như một điều trị vĩnh viễn để ngăn ngừa TKMP tái phát (109,117,118), mặc dù có một bài tổng quan gần đây tương đối đầy đủ và chi tiết về lĩnh vực này gợi ý về lợi thế nhỏ của việc cắt bỏ màng phổi so với việc làm trầy xước màng phổi với tỉ lệ tái phát TKMP là 0,4% sau phẫu thuật cắt màng phổi (n = 752) và 2,3% sau khi làm trầy xước màng phổi (n = 301) (109). Các kỹ thuật trong phẫu thuật có khuynh hướng giảm thiểu tối đa về xâm lấn trong vài năm qua. Để xem là có hiệu quả, những kỹ thuật này phải mang lại kết quả so sánh với “tiêu chuẩn vàng" là thủ thuật mở phổi hở - đó là tỉ lệ tai biến phẫu thuật là ít hơn 15% và tỉ lệ TKMP tái phát phải nhỏ hơn 1% (37,99,112)
Mở ngực hở:
Năm 1941 Tyson và Crandall (119) đã mô tả việc gây trầy xước màng phổi như là biện pháp điều trị TKMP và vào năm 1956 Gaensler (117) đã giới thiệu việc cắt màng phổi thành cho điều trị TKMP tái phát. Quy trình này gây dính đồng nhất giữa màng phổi và thành ngực. Cả hai kỹ thuật trên tạo ra để làm mất khoang màng phổi bằng cách gây dính giữa 2 màng phổi hay giữa màng phổi tạng và lớp dưới màng phổi, trong trường hợp cắt màng phổi thành. Tuy vậy, nhằm ngăn ngừa tái phát, việc làm bít lại một cách thích hợp lỗ dò khí ở màng phổi là hết sức cần thiết bằng cách đốt, thắt hay may các bóng nhỏ đi kèm (116). Mở ngực có kết quả tái phát thấp nhất sau phẫu thuật. Việc thắt/cắt túi khí, mở ngực với việc làm trầy xước phổi, cắt ở đỉnh hay toàn bộ màng phổi thành có tỉ lệ thất bại dưới 0,5% (48,110) Tỉ lệ bệnh tật do mở ngực trong điều trị TKMP có xuất độ chung là 3,7%, hầu hết là việc đàm bị ứ đọng hay nhiễm trùng hậu phẫu (110). Mở ngực hở thường được tiến hành bằng cách cho thông khí 1 bên phổi, việc mở ngực hạn chế sau bên cho phép cắt màng phổi thành, cắt hay kẹp túi khí hoặc làm trầy xước phổi (120). Việc thông khí phổi tách biệt trong quá trình mở ngực hở tạo điều kiện dễ dàng cho việc quan sát toàn diện màng phổi tạng. Điều này có thể không khả thi trong suốt quá trình thực hiện VATS, do làm tăng nguy cơ bỏ qua túi bị dò khí (121-123). Mở ngực hở có thể có liên quan đến việc tăng tình trạng rối loạn chức năng hô hấp sau phẫu thuật và thời gian nằm viện so với việc thực hiện VATS (120). Điều này gợi đến tỉ lệ thành công với mở ngực hở là cao hơn. Do đó các chuyên gia ngoại khoa đã khuyên mở ngực cho những bệnh nhân bị TKMP thứ phát có thể mắc bệnh lý màng phổi lan tỏa cần cắt phổi rộng, cắt các túi dưới màng phổi hay cần làm trầy xước màng phổi. Gây dính màng phổi ngoại khoa bằng hóa chất: Gây dính màng phổi ngoại khoa bằng hóa chất đạt kết quả tốt nhất với 5 g bột talc vô trùng. Các phản ứng phụ như ARDS hay mủ màng phổi được ghi nhận nhưng hiếm gặp. [A] Việc áp dụng gây dính màng phổi bằng bột talc hiện nay là vấn đề về lợi ích được đề cập trở lại do không có khả năng tìm được tetracycline, giá thành bột talc lại thấp và tỉ lệ gây dính màng phổi thành công được ghi nhận (85-92%) tương đương các thủ thuật nội soi lồng ngực thay thế trong TKMP phức tạp. Trong khi nhũ dịch bột talc được bơm qua ống dẫn lưu dưới quan sát nội khoa dường như ít được ưu ái hơn so với việc phun bột talc qua nội soi màng phổi, cả hai phương pháp trên đều cho thấy có hiệu quả tốt. Tỉ lệ thành công chung của gây dính màng phổi bằng bột talc qua nghiên cứu tổng hợp là 91% (126). Gây dính màng phổi ngoại khoa với tetracycline nói chung không phải là biện pháp thay thế thỏa đáng, tỉ lệ tái phát TKMP là 16% trong nghiên cứu 390 bệnh nhân được gây dính màng phổi ngoại khoa bằng tetracycline.
Không có nghiên cứu lâm sàng đối chứng so sánh đau trong gây dính bằng bột talc với gây dính bằng các tác nhân khác, mặc dù có những ám chỉ về gây dính màng phổi bằng bột talc không khó hơn hay đau hơn việc gây dính màng phổi bằng tetracycline. Liều dùng của bột talc đã được sử dụng từ 2 g đến 10 g, nhưng đề xuất về liều cao hơn có hiệu quả hơn lại không được chứng minh trong các nghiên cứu lâm sàng có đối chứng. Trên nền tảng của một nghiên cứu phân tích tổng hợp với các số liệu không đối chứng, việc dùng 5 g bột talc qua VATS là được khuyến cáo với tỉ lệ thành công là 87%, đây là tỉ lệ rất gần với tỉ lệ thành công của các phương pháp phẫu thuật rộng. Các phản ứng phụ được ghi nhận với gây dính bằng bột talc có 5 trường hợp bị hội chứng suy hô hấp cấp ở người lớn (ARDS), mặc dù nguy cơ ARDS có thể liên quan đến kích thước của phần tử bột talc đã sử dụng (33); mủ màng phổi, tuy hiếm gặp trong khi dùng bột talc vô trùng (126,134,135); viêm phổi và suy hô hấp. Xem xét những nguy cơ tiềm tàng về phản ứng phụ trên, việc dùng bột talc dạng phun hay hòa tan thành nhũ dịch như là điều trị đầu tay chuẩn nên được tiếp cận một cách cẩn thận bởi vì thủ thuật ngoại khoa không phụ thuộc vào việc đưa một tác nhân ngoại lai vào luôn là một sự lựa chọn. Liều thấp 2-5 g nên được sử dụng cho đến khi xác định liều lượng rõ ràng và hiệu quả của nó. Nếu bột talc sử dụng không chứa asbestos thì không gặp vấn đề cho sự an toàn lâu dài. Tỉ lệ thành công khi gây dính màng phổi bằng phun bột talc hay bột talc nhũ dịch là tương tự nhau, do đó các phương pháp này đều được khuyến cáo. Do tỉ lệ thất bại tương đối cao trên 9% khi gây dính màng phổi bằng bột talc khi so với thủ thuật ngoại khoa trên màng phổi, việc gây dính bằng bột talc không nên được xét đến trong điều trị ban đầu cho những trường hợp TKMP nguyên phát tự phát cần được can thiệp ngoại khoa. Ở những bệnh nhân không muốn hay không thể chịu được việc gây mê đều được khuyến cáo áp dụng gây dính màng phổi bằng nội khoa với tetracycline hay bột talc (qua ống dẫn lưu màng phổi)
Mở ngực nhỏ qua nách: Becker và đã tiên phong kỹ thuật này vào những năm 1970. Thủ thuật này được xem là thủ thuật xâm lấn tối thiểu. Vết rạch ở đường nách khoảng 5-6 cm. Có thể thực hiện việc cắt màng phổi vùng đỉnh hay gây trầy xước màng phổi, quan sát cẩn thận vùng đỉnh phổi để kẹp các bóng hay các túi. Nhiều trường hợp nhất về kỹ thuật này ghi nhận thời gian nằm viện trung bình là 6 ngày, tỉ lệ tái phát TKMP là 0,4%, và tỉ lệ biến chứng là 10%, hầu hết là những biến chứng nhẹ. Những kết quả này làm cho thủ thuật trên trở thành biện pháp thực tế thay thế cho mở ngực hở trong điều trị TKMP tự phát phức tạp. Nội soi lồng ngực ngoại khoa có hỗ trợ (VATS): Việc đánh giá VATS trong TKMP tự phát còn hạn chế do còn ít thử nghiệm lâm sàng đối chứng ngẫu nhiên so sánh nó với những phương pháp ngoại khoa thay thế. Cho đến thời điểm này, chỉ có hai nghiên cứu ngẫu nhiên cố gắng xác định vai trò VATS trong điều trị TKMP tự phát. Trong một bài tổng quan đầy đủ và chi tiết, Massard và các cộng sự gợi ý rằng cảm nhận về VATS tốt hơn các thủ thuật mở về khía cạnh bệnh tật, thời gian nằm viện, giá cả có thể không chính xác một cách tổng thể. Thủ thuật ngoại khoa xâm lấn tối thiểu có thể có tỷ lệ biến chứng tương tự như các thủ thuật mở vào khoảng 8-10%. Tỉ lệ tái phát TKMP sau VATS là 5 10%, và cao hơn 1% tỉ lệ ghi nhận được với các thủ thuật mở. Trong khi thủ thuật cắt bỏ túi khí, cắt màng phổi, gây trầy xước màng phổi và gây dính màng phổi ngoại khoa tất cả đều cho tỉ lệ thành công hợp lý khi được thực hiện bằng nội soi lồng ngực, có những quan ngại liên quan đến việc thực hiện với VATS dưới gây tê tại chỗ hỗ trợ thêm bằng việc hít khí oxide nitơ. Những điều này xuất phát từ việc không có khả năng để đạt được việc thông khí một bên phổi cô lập và bao gồm những khó khăn trong việc thám sát toàn bộ bề mặt phổi tạng, làm tăng nguy cơ bỏ sót các bóng khí hay túi khí bị dò. Điều này cũng gợi ý rằng phản ứng viêm của màng phổi ít hơn khi thực hiện bởi VATS dẫn đến việc gây dính màng phổi kém hiệu quả hơn. Nhiều tác giả đã gợi ý rằng VATS mang lại những lợi ích có ý nghĩa hơn là mở ngực hở bao gồm thời gian nằm viện hậu phẫu ngắn hơn, đau khi hậu phẫu giảm hơn một cách có ý nghĩa, và trong thời kỳ hậu phẫu việc trao đổi khí ở phổi cũng tốt hơn. Tuy nhiên Kim và các đồng nghiệp trong nghiên cứu lâm sàng đối chứng ngẫu nhiên của mình không khẳng định thời gian hậu phẫu trong nhóm VATS ngắn hơn. Nhiều nghiên cứu ngẫu nhiên so sánh VATS với mở lồng ngực xuyên qua nách đã được yêu cầu, đến khi những số liệu này có được, VATS chưa thể được xem xét để khẳng định là nó tốt hơn mở lồng ngực. Waller và các đồng nghiệp gợi ý rằng, khi mà VATS có thể là thủ thuật ngoại khoa được ưa chuộng cho bệnh nhân trẻ khỏe kèm biến chứng hay TKMP tái phát, nó ít được tin cậy hơn với những trường hợp TKMP thứ phát. Những trường hợp TKMP thứ phát, mở ngực hở và sửa chữa vẫn là phương pháp được khuyến cáo và VATS nên dành cho những bệnh nhân không dung nạp với phương pháp mở do chức năng hô hấp của họ xấu.
4.6 Ra viện và theo dõi:
Bệnh nhân ra viện nhưng không phải điều trị can thiệp cần tránh vận chuyển bằng đường hàng không cho đến khi trên phim ngực cho thấy không còn TKMP nữa. [C] Bệnh nhân không được lặn sau khi TKMP, trừ khi được bóc tách màng phổi bằng phẫu thuật cả 2 bên. [C] Bệnh nhân TKMP nguyên phát điều trị thành công bằng chọc hút khí đơn thuần nên được theo dõi để đảm bảo tình trạng lâm sàng ổn định trước khi ra viện. TKMP thứ phát đã được điều trị bằng chọc hút khí đơn thuần nên được nằm viện 24 giờ trước khi ra viện nhằm đảm bảo không bị TKMP tái phát. [C] Bệnh nhân TKMP tự phát được điều trị không bằng biện pháp tích cực nên được quay lại tái khám theo dõi phim phổi sau 2 tuần. Những bệnh nhân này cần cẩn thận không được đi máy bay cho đến khi phim ngực theo dõi cho thấy TKMP đã được giải quyết hoàn toàn. Các hãng hàng không dân dụng hiện tại có những lời khuyên không căn cứ rằng nên có khoảng thời gian là 6 tuần từ khi bị TKMP cho đến khi người bệnh đi máy bay. Trên phim phổi hiện tại cần phải không còn thấy TKMP nữa. Bệnh nhân mới bị TKMP kín không nên di chuyển bằng chuyến bay dân dụng. Không có bằng chứng nào cho thấy di chuyển đường hàng không thúc đẩy TKMP tái phát, tuy vậy trong khi bay mà xảy ra TKMP tái phát có thể gây ra những hậu quả nghiêm trọng. Liên đoàn lao động của Hàng không Anh nhấn mạnh rằng bệnh nhân có thể vận chuyển bằng đường hàng không an toàn sau 6 tuần can thiệp phẫu thuật tin cậy hoặc trên phim ngực không còn thầy TKMP nữa. Nếu không, vẫn còn nguy cơ tái phát đáng kể cho đến 1 năm, tùy vào việc bệnh nhân có mắc bệnh phổi kèm theo hay không. Những bệnh nhân đặc biệt là bị TKMP thứ phát, có thể tránh nguy cơ này bằng cách không đi máy bay trong 1 năm khi không có một can thiệp ngoại khoa triệt để. Sau khi bị TKMP, bệnh nhân khuyên ngừng hẳn việc lặn, trừ khi đã có chiến lược dự phòng an toàn vĩnh viễn như đã được thực hiện phẫu thuật cắt màng phổi. Hướng dẫn của BTS về tình trạng phù hợp về khía cạnh hô hấp cho công việc thợ lặn cung cấp đầy đủ các thông tin hơn. Những bệnh nhân TKMP nguyên phát đã được điều trị bằng chọc hút khí đơn thuần nên được theo dõi để đảm bảo lâm sàng ổn định trước khi ra viện. Một ít bệnh nhân TKMP thứ phát và điều trị thành công bằng biện pháp chọc hút đơn thuần nên nhập viện ít nhất là qua đêm và tốt hơn là 24 giờ trước khi xuất viện nhằm bảo đảm không có tái phát TKMP. Tỉ lệ tử vong liên quan đến TKMP thứ phát là 10% và nhiều bệnh nhân tử vong sau khi đã được xử trí TKMP. Hầu hết bệnh nhân TKMP thứ phát cần phải nằm viện lâu hơn, bao gồm việc điều trị bệnh phổi sẵn có.Tất cả những bệnh nhân ra viện sau điều trị tích cực hay không cũng nên được tư vấn bằng lời và bằng văn viết để họ đến khoa cấp cứu ngay nếu họ bị khó thở nhiều hơn.
5 TRÀN KHÍ MÀNG PHỔI VÀ AIDS
Việc điều trị sớm và tích cực TKMP trên những bệnh nhân HIV được khuyến cáo bằng cách kết hợp đặt ống dẫn lưu màng phổi và chuyển ngoại khoa sớm. [B]
Chứng cứ cho thấy hình ảnh lâm sàng của TKMP tự phát có khuynh hướng chiếm ưu thế với các bóng nhỏ dưới màng phổi đã được nhấn mạnh từ các ghi nhận của Kjaergard. Có nhiều báo cáo cho thấy có đến 25% các trường hợp TKMP ở những vùng đô thị rộng lớn với tần suất nhiễm HIV cao có liên quan đến AIDS; 2-5% bệnh nhân AIDS sẽ bị TKMP. Cần phải xem xét nhiễm Pneumocystis carinii như một nguyên nhân hay gặp nhất ở bất cứ bệnh nhân HIV nào bị TKMP, mặc dù việc điều trị bằng phun khí dung pentadimine cũng đã được gợi ý như yếu tố nguy cơ độc lập (151). Viêm phổi do Pneumocycstis carinii (PCP) có liên quan đến viêm phế nang hoại tử dạng nặng trong vùng nhu mô dưới màng phổi được thay thế bằng các kén có thành mỏng hoại tử và các túi khí pneumotoceles. TKMP tự phát liên quan đến AIDS là biến chứng từ dò khí tự nhiên kháng trị vốn có khuynh hướng hay xảy ra viêm phổi dưới màng phổi hoại tử do nhiễm PCP. Sự xuất hiện TKMP ở bệnh nhân AIDS do tương quan giữa TKMP liên quan AIDS và sự hiện diện của P. carinii được xem xét như một dấu hiệu chỉ điểm cho việc điều trị nhiễm P carinii hoạt động. TKMP tự phát liên quan đến AIDS làm cho tỉ lệ tử vong ở bệnh viện cao hơn, cao hơn cả về xuất độ TKMP 2 bên (40%) và TKMP tái phát, và thời gian dò khí cũng lâu hơn. Việc thất bại trong điều trị cũng phản ánh mức độ khả năng miễn dịch của bệnh nhân suy yếu, vốn được phản ánh bởi số lượng CD4. Cũng có thể do việc sử dụng corticoid toàn thân trong điều trị PCP làm tăng nguy cơ mắc bệnh từ TKMP liên quan AIDS. Do tỉ lệ thất bại từ điều trị ban đầu cao và liên quan đền thời gian sống còn ngắn được ghi nhận từ những bệnh nhân như thế, việc điều trị sớm và tích cực TKMP tự phát liên quan đến AIDS - phối hợp đặt ống dẫn lưu màng phổi sớm và xơ hóa màng phổi bằng bột talc, soi màng phổi qua hệ thống video sớm kết hợp phun bột talc, bóc tách màng phổi một hay hai bên là các biện pháp được khuyến cáo.
6 TRÀN KHÍ MÀNG PHỔI VÀ BỆNH XƠ NANG
Điều trị sớm và tích cực TKMP ở bệnh nhân bị xơ nang được khuyến cáo. [C] Nên xem xét đến can thiệp ngoại khoa sau lần đầu tiên tràn khí, miễn là bệnh nhân chịu đựng được việc can thiệp này. [C] Điều trị TKMP ở bệnh nhân bị xơ nang tương tự như bệnh nhân không bị xơ nang. TKMP kết hợp với nhiều thứ bệnh tật nghiêm trọng và có thể đe dọa cả mạng sống. Thời gian sống trung bình sau khi TKMP ở bệnh nhân xơ nang là 30 tháng và sự xuất hiện TKMP phản ảnh mức độ nghiêm trọng của các bệnh nền hơn là yếu tố nguy cơ độc lập. TKMP đối bên xuất hiện chiếm đến 40% bệnh nhân. Có thể điều trị bằng quan sát đơn thuần hay chọc hút khí đơn thuần với TKMP lượng ít mà không có triệu chứng. TKMP nhiều hơn cần phải được điều trị bằng cách đặt ống dẫn lưu màng phổi. Lỗ tràn khí luôn luôn ở thùy trên và việc đặt ống dẫn lưu đúng vị trí hết sức quan trọng. Phổi bị xẹp có thể trở nên cứng và cần mất nhiều thời gian để nó giãn nở trở lại. Việc bắt đầu sử dụng kháng sinh đường tĩnh mạch cũng quan trọng nhằm ngừa đàm ứ đọng vốn có thể làm cản trở sự giãn nở của phổi xẹp. Các biện pháp như cắt màng phổi, gây trầy xước màng phổi, gây dính màng phổi bằng bột talc được ghi nhận thấy tỉ lệ tái phát TKMP thấp hơn với việc điều trị bằng quan sát hay đặt ống dẫn lưu màng phổi đơn thuần-vốn có tỉ lệ tái phát cao không thể chấp nhận được đến 50%. Việc cắt màng phổi một phần có tỉ lệ thành công là 95% kèm theo chức năng phổi bị giảm chút ít liên quan đến phẫu thuật, và thường thì nó được xem như là điều trị chọn lựa ở bệnh nhân xơ nang bị TKMP tái phát và thích hợp được với phẫu thuật . Với những bệnh nhân quá nặng không thể phẫu thuật được, có thể phải cần đến 2-3 tuần cho phổi giãn nở bằng cách đặt ống và hút khí. Ở những bệnh nhân này việc dùng bột talc bơm vào hay bơm lặp lại máu tự thân là biện pháp thay thế có hiệu quả. Mặc dù không có chống chỉ định tuyệt đối cho ghép phổi, các chất xơ hóa có thể làm cho việc ghép trở nên khó khăn hơn. Cần nhiều thời gian hơn trong việc cắt bỏ phổi, kéo dài thời gian thiếu máu trên phổi được cho, và cũng liên quan đến việc chảy máu lượng nhiều
7 TRÀN KHÍ MÀNG PHỔI ÁP LỰC DƯƠNG
Với trường hợp TKMP áp lực dương, nên đặt ngay can-nun với chiều dài thích hợp ở vị trí khoang liên sườn hai, ở đường giữa trung đòn và đặt ở đó đến khi ống dẫn lưu gian sườn hoạt động.
TKMP áp lực dương xảy ra khi áp lực trong khoang màng phổi vượt qua áp lực của khí trời khi thở vào hay thở ra. Điều này xảy ra được cho là có hiện tượng van một chiều vận hành, khí vào trong khoang màng phổi khi hít vào và không thoát ra được khi thở ra. Thường thì khi tiến triển TKMP áp lực dương, tuy không phải luôn luôn, được báo bằng sự suy sụp đột ngột tình trạng tim mạch liên quan đến việc trở về tim của máu tĩnh mạch, giảm cung lượng tim và giảm oxy máu. Diễn tiến của TKMP áp lực dương không phụ thuộc vào kích thước của TKMP và bệnh cảnh lâm sàng của nó có thể tương quan kém với các dấu hiệu thấy được trên phim ngực. Bệnh cảnh lâm sàng là nổi bật. Bệnh nhân nhanh chóng trở nên kiệt sức với hô hấp thở mệt nhọc và nhanh, xanh tím, vã mồ hôi, tim nhanh. Đặc biệt cần nghi ngờ ở những bệnh nhân thông khí cơ học hay thông khí không xâm lấn qua mũi đột ngột trở nặng hay phân ly điện cơ, và thường xuyên bị bỏ qua ở ICU . Nếu TKMP áp lực dương xảy ra, nên cho bệnh nhân thở oxy liều cao và đặt ngay can-nun vào khoang màng phổi, luôn ở vị trí khoang gian sườn thứ hai trước đường trung đòn giữa. Phải dẫn lưu khí ra đến khi không còn ảnh hưởng đến bệnh nhân nữa và ống dẫn lưu màng phổi nên được đặt vào khoang màng phổi như đã mô tả ở trên. Trong hướng dẫn về cấp cứu hồi sức chấn thương nâng cao đã khuyến cáo sử dụng canun có chiều dài từ 3-6 cm để tháo khí bằng kim khi TKMP áp lực dương đe dọa đến tính mạng bệnh nhân . Tuy nhiên 57% bệnh nhân TKMP áp lực dương có chiều dày thành ngực dày hơn 3 cm. Vì thế chiều dài can-nun được khuyến cáo ít nhất là 4,5 cm dùng trong chọc hút khí màng phổi bằng kim khi xảy ra TKMP áp lực dương . Phải lưu can-nun đến khi xác định được bọt khí dưới nước trong hệ thống dẫn khí kín, điều này xác định ống dẫn màng phổi hoàn toàn hoạt động .
8 TRÀN KHÍ MÀNG PHỔI DO THỦ THUẬT CHẨN ĐOÁN VÀ ĐIỀU TRỊ
Xuất độ TKMP loại này còn cao, vượt qua TKMP tự phát trong hàng loạt các nghiên cứu lớn . Chọc hút bằng kim xuyên thành ngực (24%), đặt tĩnh mạch dưới đòn (22%), chọc dịch màng phổi (22%), sinh thiết màng phổi (8%), thông khí cơ học (7%) là năm nguyên nhân hàng đầu . Hai yếu tố nguy cơ chủ yếu liên quan đến việc gây ra tràn khí màng phổi trong chọc hút bằng kim xuyên thành ngực chính là độ sâu của tổn thương và sự hiện diện của COPD . Đến nay không có biện pháp nào ngăn ngừa được TKMP do chọc hút bằng kim xuyên thành ngực / thủ thuật chọc dịch màng phổi. Trong khi việc đặt cho bệnh nhân có tư thế sao cho vùng được sinh thiết được tựa đã được hy vọng có thể làm giảm xuất độ của biến chứng này, chúng vẫn chưa được thấy là đúng. Việc điều trị TKMP do chẩn đoán và điều trị gây ra có chiều hướng đơn giản do khả năng tái phát tràn khí là thấp. Đa số trường hợp sẽ tự lành chỉ với điều trị bằng quan sát thông thường. Nếu cần thiết, có thể áp dụng biện pháp chọc hút khí đơn giản. Delius và các cộng sự đã thực hiện đến 89% trường hợp với catheter Teflon 8F nhỏ mà không cần đến việc đặt ống dẫn lưu. Bệnh nhân COPD bị TKMP do thủ thuật chẩn đoán và điều trị thường cần phải đặt ống dẫn lưu, bệnh nhân bị TKMP khi đang thông khí áp lực dương nên được đặt ống dẫn lưu màng phổi trừ khả năng có thể cai máy tức thì với thông khí áp lực dương vì nó có thể duy trì lỗ dò khí
9 KẾT LUẬN
Tài liệu hướng dẫn BTS 1993 nhấn mạnh đến vai trò của biện pháp quan sát đơn thuần và hút khí, đã nhắc nhở các bác sĩ trẻ những nguy hiểm có thể xảy ra trong việc đặt ống dẫn lưu màng phổi, đã khuyến khích với những điều trị ngắn hơn, an toàn hơn và ít đau. Mặc dù mang đến nhiều lợi ích, những bằng chứng gần đây gợi ý rằng việc tuân thủ những hướng dẫn này có thể chưa đạt mức tối ưu. Sự xét duyệt lại lần này đảm bảo những điểm mạnh chủ yếu của tài liệu hướng dẫn, với những quan sát ở những trường hợp ít nghiêm trọng nhất, việc hút khí đơn giản được xem là lựa chọn điều trị ban đầu, và việc đặt ống dẫn lưu màng phổi là biện pháp cuối cùng. Gần đây, Hiệp hội các bác sĩ lồng ngực đại học Hoa Kỳ (ACCP) đã xuất bản tài liệu hướng dẫn qua phương thức đồng thuận Delphi. Các hướng dẫn của họ tương tự của chúng tôi về nhiều mặt, mặc dù có những sự khác biệt như nhấn mạnh đề cập đến giá trị của việc hút khí đơn giản trong điều trị tràn khí màng phổi nguyên phát. Không nghi ngờ gì nữa, cả 2 bộ hướng dẫn này sẽ còn thúc đẩy các cuộc tranh luận. Bằng chứng của các khuyến cáo BTS gần đây được tập hợp chặt chẽ và cũng đã mô tả các nhược điểm của chúng. Sự xét duyệt này thay đổi ngưỡng trong việc hút khí đơn thuần trong TKMP nguyên phát và gợi ý đến vai trò của việc chọc hút khí lại. Những hạn chế của việc chọc hút khí trong TKMP thứ phát đã được biết đến, và việc đặt ống dẫn lưu ban đầu được khuyến cáo ở những bệnh nhân này khi mà việc hút khí không thể thành công. Các vấn đề này đã được xem xét lại vì “bộ dụng cụ tràn khí màng phổi”mới được thực hiện với kỹ thuật Seldinger và bình chứa Heimlich dạng van một chiều đã được phổ biến. Có lẽ nó sẽ chứng minh là thành công và có thể thay thế cho việc hút khí đơn giản tiếp theo bởi việc rút ngay các catheter như khuyến cáo trong tài liệu hướng dẫn này.
Nhiều khía cạnh trong xử trí TKMP không được đề cập đến, nay đã được đưa vào hướng dẫn này. Đó là vai trò của chụp cắt lớp vi tính trong chẩn đoán, những bệnh nhân nào cần chuyển cho ngoại khoa, thảo luận về các kỹ thuật ngoại khoa và các vấn đề nhưng kích cỡ ống dẫn lưu gian sườn, vai trò của việc hút khí và gây dính màng phổi. Các vấn đề phức tạp như TKMP áp lực dương, tràn khí dưới da, TKMP ở những bệnh nhân HIV và người lớn bị xơ nang cũng đã được thảo luận. Hy vọng rằng những thay đổi xây dựng trên các lợi ích lâm sàng rút ra từ tập tài liệu hướng dẫn đầu tiên - nếu được tuân thủ-qua tính toán, sẽ ngăn ngừa được khoảng 7000 trường hợp dẫn lưu màng phổi bằng ống mỗi năm tại Anh quốc.
Các điểm kiểm tra:
- Tỉ lệ bệnh nhân điều trị bằng (a) quan sát đơn thuần, (b) chọc hút khí, và (c) đặt ống dẫn lưu màng phổi và những vấn đề thích ứng của nó (tương xứng với sự hướng dẫn) và kết quả (xem xét đến tỉ lệ tái phát, biến chứng và thời gian nằm viện).
- Số lượng ống được kẹp và lý do tại sao.
- Tỉ lệ chuyển cho các thầy thuốc và các bác sĩ ngoại khoa, thời điểm phù hợp cho việc chuyển bệnh này.
- Việc sử dụng giảm đau và gây tê tại chỗ.
- Tỉ lệ theo dõi
Các vấn đề tiềm năng tương lai cho nghiên cứu: Các thử nghiệm đối chứng ngẫu nhiên tiền cứu so sánh:
- Quan sát đơn thuần so với chọc hút khí ± dẫn lưu màng phổi trong TKMP nguyên phát với viền khí hơn 2 cm trên phim ngực;
- Sử dụng catheter nhỏ / bộ van Heimlich so với dẫn lưu màng phổi khi thất bại bằng chọc hút khí trong TKMP nguyên phát;
- Chọc hút bằng catheter nhỏ (CASP) so với chọc hút khí thông thường hay đặt ống dẫn lưu;
- VATS so với mở ngực hở trong trường hợp TKMP khó.
- Thực hiện hút khí liên quan đến thời điểm thích hợp và phương thức tối ưu.
- So sánh chiến lược “kẹp” hay “không kẹp” ống dẫn lưu sau khi không còn dò khí.
10 Tài liệu tham khảo
1. Light RW. Pneumothorax. In: Pleural diseases. 3rd ed. Baltimore: Williams and Wilkins, 1995: 242-77.
2. Laennec RTH. Trait de l’auscultation mediate et des maladies des poumons et du coeur. Tome Second. Paris, 1819.
3. Kjaergard H. Spontaneous pneumothorax in the apparently healthy. Acta Med Scand (Suppl) 1932;43:1-159.
4. Melton LJ, Hepper NCG, Offord KP. Incidence of spontaneous pneumothorax in Olmsted County, Minnesota: 1950-1974. Am Rev Respir Dis 1979;29:1379-82. [III]
5. Bense L, Wiman LG, Hedenstierna G. Onset of symptoms in spontaneous pneumothorax: correlations to physical activity. Eur J Respir Dis 1987;71:181-6. [III]
6. Gupta D, Hansell A, Nichols T, et al. Epidemiology of pneumothorax in England. Thorax 2000;55:666-71. [III]
7. Donahue DM, Wright CD, Viale G, et al. Resection of pulmonary blebs and pleurodesis for spontaneous pneumothorax. Chest 1993;104:1767-9. [IIb]
8. Lesur O, Delorme N, Frogamet JM, et al. Computed tomography in the aetiological assessment of idiopathic spontaneous pneumothorax. Chest 1990;98:341-7. [IIa]
9. O’Hara VS. Spontaneous pneumothorax. Milit Med 1978;143:32-5. [III]
10. Jansveld CA, Dijkman JH. Primary spontaneous pneumothorax and smoking. BMJ 1975;4:559-60. [IIa]
11. Bense L, Eklund G, Odont D, et al. Smoking and the increased risk of contracting pneumothorax. Chest 1987;92:1009-12. [IIa]
12. Schramel FM, Meyer CJ, Postmus PE. Inflammation as a cause of spontaneous pneumothorax and emphysematous-like changes: results of bronchoalveolar lavage. Eur Respir J 1995;8:397s. [IIb]
13. Withers JN, Fishback M.E, Kiehl PV, et al. Spontaneous pneumothorax. Am J Surg 1964;108:772-6. [IV] 14. Sadikot RT, Greene T, Meadows K, et al. Recurrence of primary pneumothorax. Thorax 1997;52:805-9. [III]
15. West JB. Distribution of mechanical stress in the lung, a possible factor in localisation of pulmonary disease. Lancet 1971;i:839-41. [IIb]
16. Smit HJM, Chatrou M, Postmus PE. The impact of spontaneous pneumothorax and its treatment on the smoking behaviour of young adult smokers. Respir Med 1998;92:1132-6. [III]
17. Lippert HL, Lund O, Blegrad S, et al. Independent risk factors for cumulative recurrence rate after first spontaneous pneumothorax. Eur Respir J 991;4:324-31. [III]
18. Videm V, Pillgram-Larsen J, Ellingsen Ø, et al. Spontaneous pneumothorax in chronic obstructive pulmonary disease: complications, treatment and recurrences. Eur J Respir Dis 1987;71:365-71. [III]
19. Miller AC, Harvey JE. Guidelines for the management of spontaneous pneumothorax. BMJ. 1993;307:114-6. [IV]
20. Soulsby T. British Thoracic Society guidelines for the management of spontaneous pneumothorax: do we comply with them and do they work? J Accid Emerg Med 1998;15:317-21. [III]
21. Selby CD, Sudlow MF. Deficiencies in the management of spontaneous pneumothoraces. Scot Med J 1994;39:75-6. [III]
22. Yeoh JH, Ansari S, Campbell IA. Management of spontaneous pneumothorax : a Welsh survey. Postgrad Med J 2000;76:496-9. [III]
23. Grimshaw JM, Russell IT. Effect of clinical guidelines on medical practice: a systematic review of rigorous evaluation. Lancet 1993;342:1317-21. [IIb]
24. Bero LA, Grilli R, Grimshaw JM, et al. Closing the gap between research and practice: an overview of systematic reviews of interventions to promote the implementation of research findings. BMJ 1998;317:465-8. [Review]
25. Grilli R, Lomas J. Evaluating the message: the relationship between compliance rate and the subject of a practice guideline. Med Care 1994;32:202-13. [IV]
26. Woolf SH, Grol R, Hutchinson A, et al. Potential benefits, limitations and harms of clinical guidelines. BMJ 1999;318:527-30.
27. Agency for Health Care Policy and Research. Acute pain management, operative or medical procedures and trauma. Clinical practice guidelines. Publication no. 92-0032. Rockville, Maryland, USA: Agency for Healthcare Policy and Research Publications, 1992.
28. Petrie GJ, Barnwell E, Grimshaw J, on behalf of the Scottish Intercollegiate Guidelines Network. Clinical guidelines criteria for appraisal for national use. Edinburgh: Royal College of Physicians, 1995.
29. Vail WJ, Alway AE, England NJ. Spontaneous pneumothorax. Dis Chest 1963;38:512-5. [III] 30. Serementis MG. The management of spontaneous pneumothorax. Chest 1970;57:65-8. [III]
31. Wait MA, Estrera A. Changing clinical spectrum of spontaneous pneumothorax. Am J Surg 1992;164:528-31. [III]
32. Tanaka F, Itoh M, Esaki H, et al. Secondary spontaneous pneumothorax. Ann Thorac Surg 1993;55:372-6. [III]
33. Pavlin DJ, Cheney FW Jr. Unilateral pulmonary edema in rabbits after re-expansion of collapsed lung. J Appl Physiol 1979;46:31-5. [IIb]
34. Miller WC, Toon R, Palat H, et al. Experimental pulmonary edema following re-expansion of pneumothorax. Am Rev Respir Dis 1973;108:664-6. [Ib]
35. Norris RM, Jones JG, Bishop JM. Respiratory gas exchange in patients with spontaneous pneumothorax. Thorax 1968;23:427-33. [IIb]
36. Light RW, O’Hara VS, Moritz TE, et al. Intrapleural tetracycline for the prevention of recurrent spontaneous pneumothorax: results of a Department of Veterans Affairs Co-operative Study. JAMA 1990;264:2224-30. [Ib]
37. Schramel FM, Wagenaar M, Sutedja TA, et al. Diagnosis of pneumothorax not improved by additional roentgen pictures of the thorax in the expiratory phase. Ned Tijdschr Geneesk 1995;139:131-3. [IIb]
38. Schramel FM, Golding RP, Haakman CD, et al. Expiratory chest radiographs do not improve visibility of small apical pneumothoraces by enhanced contrast. Eur Resp J 1996;9:406-9. [IIb]
39. Glazer H, Anderson DJ, Wilson BS, et al. Pneumothorax: appearances on lateral chest radiographs. Radiology 1989;173:707-11. [III]
40. Carr JJ, Reed JC, Choplin RH, et al. Plain and computed radiography for detecting experimentally induced pneumothorax in cadavers: implications for detection in patients. Radiololgy 1992;183:193-9. [IIb]
41. Bourgouin P, Cousineau G, Lemire P, et al. Computed tomography used to exclude pneumothorax in bullous lung disease. J Can Ass Radiol 1985;36:341-2. [IV]
42. Collins CD, Lopez A, Mathie A, et al. Quantification of pneumothorax size on chest radiographs using intrapleural distances: regression analysis based on volume measurements from helical CT. AJR 1995;165:1127-30. [III]
43. Engdahl O, Toft T, Boe J. Chest radiograph: a poor method for determining the size of a pneumothorax. Chest 1993;103:26-9. [IIb]
44. Philips GD, Trotman-Dickenson B, Hodson ME, et al. Role of CT in the management of pneumothorax in patients with complex cystic lung disease. Chest 1997;112:275-8. [IV]
45. Jordan KG, Kwong JS, Flint J, et al. Surgically treated pneumothorax. Radiologic and pathologic findings. Chest 1997;111:280-5. [III]
46. Stradling P, Poole G. Conservative management of spontaneous pneumothorax. Thorax 1966;21:145-9. [III]
47. Flint K, Al-Hillawi AH, Johnson NM. Conservative management of spontaneous pneumothorax. Lancet 1984;ii: 687-8. [III]
48. O’Rourke JP, Yee ES. Civilian spontaneous pneumothorax: treatment options and long term results. Chest 1989;96:1302-6. [III]
49. Northfield TC. Oxygen therapy for spontaneous pneumothorax. BMJ 1971;4:86-8. [IIa] 50. Kirchen LT Jr, Swartzel RL. Spontaneous pneumothorax and its treatment. JAMA 1954;155:24-9. [III]
51. Archer GJ, Hamilton AAD, Upadhyag R, et al. Results of simple aspiration of pneumothoraces. Br J Dis Chest 1985;79:177-82. [III]
52. Ng AWK, Chan KW, Lee SK. Simple aspiration of pneumothorax. Singapore Med J 1994;35:50-2. [IIb]
53. Noppen M, Alexander P, Driesen P, et al. Manual aspiration versus chest tube drainage in first episodes of primary spontaneous pneumothorax. Am J Respir Crit Care Med 2002;165:1240-4. [Ib]
54. Spencer-Jones J. A place for aspiration in the treatment of spontaneous pneumothorax. Thorax 1985;40:66-7. [III]
55. Andrivert P, Djedaim K, Teboul J-L, et al. Spontaneous pneumothorax: comparison of thoracic drainage vs immediate or delayed needle aspiration. Chest 1995;108:335-40. [Ib]
56. Harvey J, Prescott RJ. Simple aspiration versus intercostal tube drainage for spontaneous pneumothorax in patients with normal lungs. BMJ 1994;309:1338-9. [Ib]
57. Vallee P, Sullivan M, Richardson H, et al. Sequential treatment of a simple pneumothorax. Ann Emerg Med 1988;17:936-47. [IIb]
58. Delius RE, Obeid FN, Horst HM, et al. Catheter aspiration for simple pneumothorax. Arch Surg 1989;124:833-6. [IIb]
59. Laub M, Milman N, Müller D. Role of small calibre chest tube drainage for iatrogenic pneumothorax. Thorax 1990;45:748-9. [IIb]
60. Playfair EE. Case of empyema treated by aspiration and subsequently by drainage. BMJ 1875;1:45-50. [IV]
61. Graham EA, Bell RD. Open pneumothorax: its relation to the treatment of em6pyema. Am J Med Sci 1918;156:839-43. [IV]
62. Kenyon JH. Traumatic haemothorax: siphon drainage. Ann Surg 1916;64:728-9. [IV]
63. Symbas PN. Chest drainage tubes. Surg Clin North Am 1989;69:41-6. [IV]
64. Harriss DR, Graham TR. Management of intercostal drains. Br J Hosp Med 1991;45:383-6. [IV]
65. Baumann MH, Strange C, Heffner JE, et al. Management of spontaneous pneumothorax. An American College of Chest Physicians Delphi Consensus Statement. Chest 2001;119:590-602.
66. Seaton D, Yoganathan K, Coady T, et al. Spontaneous pneumothorax: marker gas technique for predicting outcome of manual aspiration. BMJ 1991;302:262-5. [IIb]
67. Engdahl O, Boe J, Sandstedt S. Intrapleural bupivocaine for analgesia during chest drainage treatment for pneumothorax. A randomised double blind trial. Acta Anaesthesiol Scand 1993;37:149-53. [Ib]
68. Sherman S, Ravikrishnan KP, Patel A, et al. Optimum anaesthesia with intrapleural Lidocaine during chemical pleurodesis with tetracycline. Chest 1993;3:533-6. [IIb]
69. Curtin JJ, Goodman LR, Quebbeman EJ, et al. Thoracostomy tubes after acute chest injury: relationship between location in a pleural fissure and function. AJR 1994;163:1339-42. [IIb]
70. Holden MP, ed. Management of intercostal drainage tubes. In: Practice of cardiothoracic surgery. Bristol: John Wright, 1982: 3.
71. Daly RC, Mucha P, Pairolero PC, et al. The risk of percutaneous chest tube thoracostomy for blunt thoracic trauma. Ann Emerg Med 1985;14:865-70. [IV]
72. Iberti TJ, Stern PM. Chest tube thoracostomy. Crit Care Clin 1992;14:879-95. [IV]
73. Miller KS, Sahn FA. Chest tubes: indications, technique, management and complications. Chest 1987;91:258- 64. [Review]
74. Chan L, Reilly KM, Henderson C, et al. Complication rates of tube thoracostomy. Am J Emerg Med 1997;15:368-70. [III]
75. Baldt MM, Bankier AA, Germann PS, et al. Complications after emergency tube thoracostomy: assessment with CT. Radiology 1995;195:539-43. [III]
76. Brunner RG, Vinsant GO, Alexander RH, et al. The role of antibiotic therapy in the prevention of empyema in patients with an isolated chest injury: a prospective study. J Trauma 1990;30:1148-53. [Ib]
77. Nichols RI, Smith JW, Muzik AC, et al. Preventative antibiotic usage in traumatic injuries requiring chest tube thoracostomy. Chest 1994;106:1493-8. [Ib]
78. Maunder RJ, Pierson DJ, Hudson LD. Subcutaneous and mediastinal emphysema. Pathophysiology, diagnosis and management. Arch Intern Med 1984;144:1447-53. [Review]
79. Conetta R, Barman AA, Lakovou C, et al. Acute ventilatory failure from massive subcutaneous emphysema. Chest 1993;104:978-80. [IV]
80. So SY, Yu DY. Catheter drainage of spontaneous pneumothorax: suction or no suction, early or late removal ? Thorax 1982;37:46-8. [IIb]
81. Bevelaqua FA, Aranda C. Management of spontaneous pneumothorax with small lumen catheter manual aspiration. Chest 1982;81:693-5. [III]
82. Conces Jr DJ, Tarrer RD, Cory Gray W, et al. Treatment of pneumothoraces utilising small calibre chest tubes. Chest 1988;94:55-7. [III]
83. Minami H, Saka H, Senda K, et al. Small calibre catheter drainage for spontaneous pneumothorax. Am J Med Sci 1992;304:345-7. [IIb]
84. Tattersall DJ, Traill ZC, Gleeson FV. Chest drains: Does Size Matter? Clin Radiol 2000;55:415-21. [IV]
85. Sharma TN, Agrihotri SP, Jain NK, et al. Intercostal tube thoracostomy in pneumothorax: factors influencing re expansion of lung. Ind J Chest Dis Allied Sci 1988;30:32-5. [III]
86. Mathur R, Cullen J, Kinnear WJM, et al. Time course of resolution of persistent air leak in spontaneous pneumothorax. Respir Med 1995;89:129-32. [IIb]
87. Enerson DM, McIntyre RN. A comparative study of the physiology and physics of pleural drainage systems. J Thorac Cardiovasc Surg 1966;52:40-4. [IIb]
88. Munnell E. Thoracic drainage. Ann Thorac Surg 1997;63:1497-502. [IV]
89. Roe BB. Physiologic principles of drainage of the pleural space. Am J Surg 1958;96:246-9. [Review]
90. Pierson DJ. Persistent bronchopleural air-leak during mechanical ventilation: a review. Respir Care 1982;27:408-15. [Review]
91. Granke K, Fischer CR, Gago O, et al. The efficacy and timing of operative intervention for spontaneous pneumothorax. Ann Thorac Surg 1986;42:540-2. [IIa]
92. Schonenberger RA, Haefeli HA, Weiss P, et al. Timing of invasive procedures for primary and secondary spontaneous pneumothorax. Arch Surg 1991;126:764-66. [III]
93. Shah SS, Cohen AS, Magee PG, et al. Surgery remains a late and under-utilised option in the management of spontaneous pneumothorax: should the British Thoracic Society guidelines be revisited ? Thorax 1998;53(Suppl 4):A52. [III]
94. Pavlin DJ, Nessly MC, Cheney FW. Increased pulmonary vascular permeability as a cause of re-expansion pulmonary edema in rabbits. Am Rev Respir Dis 1981;124:422-7. [IIa]
95. Mafhood S, Hix WR, Aaron BI, et al. Re-expansion pulmonary edema. Ann Thorac Surg 1988;45:340-5. [IV]
96. Matsuura Y, Nomimura T, Nurikami H, et al. Clinical evidence of re-expansion pulmonary edema. Chest 1991;100:1562-6. [III]
97. Almind M, Lange P, Viskum K. Spontaneous pneumothorax: comparison of simple drainage, talc pleurodesis and tetracycline pleurodesis. Thorax 1989;44:627-30. [Ib]
98. Olsen PS, Anderson HO. Long term results after tetracycline pleurodesis in spontaneous pneumothorax. Ann Thorac Surg 1992;53:1015-7. [IIb]
99. Massard G, Thomas P, Wihlm J-M. Minimally invasive management for first and recurrent pneumothorax. Ann. Thorac Surg 1998;66:592-9. [Review]
100. Torre M, Grassi M, Nerli FP, et al. Nd-Yag lasar pleurodesis via thoracoscopy. Chest 1994;106:338-41. [IIb]
101. Vargas FS, Wang N-S, Lee HM, et al. Effectiveness of bleomycin in comparison to tetracycline as pleural sclerosing agents in rabbits. Chest 1993;104:1582-4. [IIb]
102. Van den Brande P, Staelans I. Chemical pleurodesis in primary spontaneous pneumothorax. J Thorac Cardiovasc Surg 1989;37:180-2. [Ib]
103. Alfageme I, Moreno L, Heurtas C, et al. Spontaneous pneumothorax: long term results with tetracycline pleurodesis. Chest; 1994:106:347-50. [IIa]
104. Light RW, Wang N-S, Sassoon CS, et al. Comparison of the effectiveness of tetracycline and minocycline as pleural sclerosing agents in rabbits. Chest 1994;106:577-82. [IIb]
105. Hurewitz AN, Lidonicci K, Wu CL, et al. Histologic changes of doxycycline pleurodesis in rabbits. Chest 1994;106:1241-5. [IIb]
106. Wang YT, Ng KY, Poh SC. Intrapleural tetracycline for spontaneous pneumothorax with persistent air leak. Singapore Med J 1988;29:72-3. [IV]
107. Macoviak JA, Stephenson LW, Ochs R, et al. Tetracycline pleurodesis during active pulmonary-pleural air leak for prevention of recurrent pneumothorax. Chest 1982;81:78-81. [Ib]
108. Chee CB, Abishaganaden J, Yeo JK, et al. Persistent air-leak in spontaneous pneumothorax - clinical course and outcome. Respir Med 1998;92:757-61. [III]
109. Thévenet F, Gamondès JP, Bodzongo D, et al. Spontaneous and recurrent pneumothorax. Surgical review of 278 cases. Ann Chir 1992;46:165-9. [III]
110. Weedon D, Smith GH. Surgical experience in the management of spontaneous pneumothorax, 1972-1982. Thorax 1983;38:737-43. [IV]
111. Körner H, Anderson KS, Strangeland L, et al. Surgical treatment of spontaneous pneumothorax by wedge resection without pleurodesis or pleurectomy. Eur J Cardiothorac Surg 1996;10:656-9. [III]
112. Thomas P, Le Mee F, Le Hors H, et al. Results of surgical treatment of persistent or recurrent pneumothorax. Ann Chir 1993;47:136-40. [III]
113. Waller DA, McConnell SA, Rajesh PB. Delayed referral reduces the success of video-assisted thoracoscopic surgery for spontaneous pneumothorax. Respir Med 1998;92:246-9. [III]
114. Inderbitzi RG, Leiser A, Furrer M, et al. Three years experience in video-assisted thoracic surgery (VATS) for spontaneous pneumothorax. J Thorac Cardiovasc Surg 1994;107:1410-5. [III]
115. Cran IR, Rumball CA. Survey of spontaneous pneumothorax in the Royal Air Force. Thorax 1967;22:462-5. [IV]
116. Parry GN, Juniper ME, Dussek JE. Surgical intervention in spontaneous pneumothorax. Respir Med 1992;86:1- 2. [Review]
117. Gaensler EA. Parietal pleurectomy for recurrent spontaneous pneumothorax. Surg Gynecol Obstet 1956;102:293-308. [IV]
118. Claggett OT. The management of spontaneous pneumothorax. J Thorac Cardiovasc Surg 1968;55:761-2. [IV]
119. Tyson MD, Crandall WB. The surgical treatment of recurrent idiopathic spontaneous pneumothorax. J Thorac Surg 1941;10:566-70. [III]
120. Waller DA, Forty J, Morritt GN. Video-assisted thoracoscopic surgery versus thoracotomy for spontaneous pneumothorax. Ann Thorac Surg 1994;58:373-[IIb]
121. Waller DA. Video-assisted thoracoscopic surgery (VATS) in the management of spontaneous pneumothorax. Thorax 1997;52:307-8. [Review]
122. 122 Naunheim KS, Mack MJ, Hazelrigg SR, et al. Safety and efficacy of video-assisted thoracic surgical techniques for the treatment of spontaneous pneumothorax. J Thorac Cardiovasc Surg 1995;109:1198-204. [III]
123. Horio H, Nomori H, Fuyuno G, et al. Limited axillary thoracotomy vs video-assisted thoracoscopic surgery for spontaneous pneumothorax. Surg Endosc 998;12:1155-8. [III]
124. Simansky DA, Yellin A. Pleural abrasion via axillary thoracotomy in the era of video assisted thoracic surgery. Thorax 1994;49:922-3. [III]
125. Deslauriers J, Beaulieu M, Després JP, et al. Transaxillary pleurectomy for treatment of spontaneous pneumothorax. Ann Thorac Surg 1980;30:567-74. [III]
126. Kennedy L, Sahn SA. Talc pleurodesis for the treatment of pneumothorax and pleural effusion. Chest 1994;106:1215-22. [Ia]
127. Dumont P, Diemont F, Massard G, et al. Does a thorascopic approach for surgical treatment of spontaneous pneumothorax represent progress ? Eur J Cardiothorac Surg 1997;11:22-31. [III]
128. Tschopp JM, Brutsche M, Frey JG. Treatment of complicated pneumothorax by simple talc pleurodesis under thoracoscopy and local anaesthesia. Thorax 997;52:329-32. [III]
129. Liu H-P, Lin PJ, Hsieh M-J, et al. Thoracoscopic surgery as a routine procedure for spontaneous pneumothorax. Chest 1995;107:559-62. [IV]
130. Verschoof AC, TenVelde GP, Greve LH, et al. Thorascopic pleurodesis in the management of spontaneous pneumothorax. Respiration 1988;53:197-200. [IIb]
131. Hansen AK, Nielsen PH, Møller NG, et al. Operative pleurodesis in spontaneous pneumothorax. Scand J Thorac Cardiovasc Surg 1989;23:279-81. [IV]
132. Webb WR, Ozman V, Moulder PV, et al. Iodized talc pleurodesis for the treatment of pleural effusions. J Thorac Cardiovasc Surg 1992;103:881-6. [IV]
133. Rinaldo JE, Owens GR, Roger RM. Adult respiratory distress syndrome following intrapleural instillation of talc. J Thorac Cardiovasc Surg 1983;85:523-6. [IV]
134. Kennedy L, Rusch VW, Strange C, et al. Pleurodesis using talc slurry. Chest 1994;106:342-6. [IV]
135. Hamed H, Fentiman IS, Chaudary MA, et al. Comparison of bleomycin and talc for the control of pleural effusions secondary to carcinoma of the breast. Br J Surg 1989;76:1266-7. [IIb]
136. Becker RM, Munro DD. Transaxillary minithoracotomy: the optimal approach for certain pulmonary and mediastinal lesions. Ann Thorac Surg 1976;22:254-9. [IV]
137. Kim KH, Kim HK, Han JY, et al. Transaxillary minithoracotomy versus video-assisted thoracic surgery for spontaneous pneumothorax. Ann Thorac Surg 996;61:1510-2. [Ib]
138. Mouroux J, Elkaïm D, Padavoni B, et al. Video-assisted thoracoscopic treatment of spontaneous pneumothorax: technique and results of one hundred cases. J Thorac Cardiovasc Surg 1996;112:385-91. [IV]
139. Rämö OJ, Salo JA, Mattila SP. Video-assisted thoracoscopic pleurectomy in the treatment of recurrent spontaneous pneumothorax. Ann Chir Gynaecol 1995;84:272-5. [IIb]
140. Nathanson LK, Shimi SM, Wood RA, et al. Videothorascopic ligation of bullae and pleurectomy for spontaneous pneumothorax. Ann Thorac Surg 1991;52:316-9. [IV]
141. Fosse E, Fjeld NB, Brockmeier V, et al. Thoracoscopic pleurodesis. Scand J Thor Cardiovasc Surg 1993;27:117-9. [IV]
142. Bertrand PC, Regnard JP, Spaggiari L, et al. Immediate and long term results after surgical treatment of primary spontaneous pneumothorax by VATS. Ann Thorac Surg 1996;61:1641-5. [III]
143. 143 Gebhard FT, Becker HP, Gerngross H, et al. Reduced inflammatory response in minimally invasive surgery of pneumothorax. Arch Surg 1996;131:1079-82. [IIb]
144. Cole Jr FH, Cole FH, Khandekar A, et al. Video-assisted thoracic surgery: primary therapy for spontaneous pneumothorax? Ann Thorac Surg 1995;60:931-5. [IIb]
145. Sekine Y, Miyata Y, Yamada H, et al. Video-assisted thoracoscopic surgery does not deteriorate postoperative pulmonary gas exchange in spontaneous pneumothorax patients. Eur J Cardiothorac Surg 1999;16:48-53. [Ib]
146. Waller DA, Forty J, Soni AK, et al. Videothoracoscopic operation for secondary spontaneous pneumothorax. Ann Thorac Surg 1994;57:1612-5. [IV]
147. British Thoracic Society Standards of Care Committee. Managing passengers with respiratory disease planning air travel: British Thoracic Society recommendations. Thorax 2002;57:289-304.
148. Ziser A, Vaananen A, Melamed Y. Diving and chronic spontaneous pneumothorax. Chest 1985;87:264-5. [IV]
149. British Thoracic Society Fitness to Dive Group. BTS guidelines on respiratory aspects of fitness for diving. Thorax 2003;58:3-11.
150. Light RW, Hamm H. Pleural disease and acquired immune deficiency syndrome. Eur Respir J 1997;10:2638-43. [IV]
151. Sepkowitz KA, Telzac EE, Gold JW, et al. Pneumothorax in AIDS. Ann Intern Med 1991;114:455-9. [III]
152. Gerein AN, Brumwell ML, Lawson LM, et al. Surgical management of pneumothorax in patients with acquired immune deficiency syndrome. Arch Surg 1991;126:1272-7. [IV]
153. Delorenzo LT, Huang CT, Maguire GP, et al. Roentgenographic patterns of Pneumocystis carinii in 104 patients with AIDS. Chest 1987;91:323-7. [IV]
154. Suster B, Akerman M, Grenstein M, et al. Pulmonary manifestations of AIDS: review of 106 episodes. Radiology 1986;161:87-93. [IV]
155. Eng RH, Bishburg E, Smith SM. Evidence for destruction of lung tissue during Pneumocystis carinii infection. Arch Intern Med 1987;147:746-9. [IV]
156. Fenerstein IM, Archer A, Pluda JM. Thin walled cavities, cysts and pneumothorax in Pneumocystis carinii pneumonia; further observation and histopathological correlation. Radiology 1990;174:197-202. [IIb]
157. Wait MA, Dal Nogare AR. Treatment of AIDS-related spontaneous pneumothorax: a decade of experience. Chest 1994;106:693-6. [IV]
158. Metersky ML, Colt HG, Olson LK, et al. AIDS-related spontaneous pneumothorax. Risk factors and treatment. Chest 1995;108:946-51. [IIb]
159. Joe L, Gordin F, Parker RH. Spontaneous pneumothorax with Pneumocystis carinii infection. Arch Intern Med 1986;146:1816-7. [IV]
160. Beers MF, Sohn M, Swartz M. Recurrent pneumothorax in AIDS patients with pneumocystis pneumonia. Chest 1990;98:266-70. [IV]
161. Coker RJ, Peters MB, McCarthy M, et al. Pneumothorax in patients with AIDS. Respir Med 1993;87:43-7. [IV]
162. Asboe D, Fisher M, Nelson MR et al. Pneumothorax in AIDS: case reviews and proposed clinical management. Genitourinary Med 1996;72:258-60. [III]
163. Spector ML, Stern SC. Pneumothorax in cystic fibrosis. Ann Thorac Surg 1989;47:204-7. [IV]
164. Tribble G, Selden R, Rodgers B. Talc poudrage in the treatment of spontaneous pneumothoraces in patients with cystic fibrosis. Ann Surg 1986;204:677-80. [III]
165. Davis P, di Santi’Agnese PA. Diagnosis and treatment of cystic fibrosis: an update. Chest 1984;85:802-9. [Review]
166. Schuster SR, McLaughlin J, Matthews WJ, et al. Management of pneumothorax in adults with cystic fibrosis. J Pediatr Surg 1983;18:492-7. [IV]
167. Penketh A, Knight RK, Hodson ME, et al. Management of pneumothorax in cystic fibrosis. Thorax 1982;37:850- 3. [IV]
168. Noyes BE, Orenstein DM. Treatment of pneumothorax in cystic fibrosis in the era of lung transplantation. Chest 1992;101:1187-8. [III]
169. Light RW. Tension pneumothorax. Intensive Care Med 1994;20:468-9. [IV]
170. Baumann MH, Sahn SA. Tension pneumothorax: diagnostic and therapeutic pitfalls. Crit Care Med 1994;22:896. [IV]
171. Tocino IM, Miller MH, Fairfax WR. Distribution of pneumothorax in the supine and semi-recumbent critically ill adult. AJR 1985;144:901-4. [III]
172. American College of Surgeons Committee On Trauma. Thoracic trauma. In: Advanced Trauma Life Support programme for physicians: instructor manual. Chicago: American College of Surgeons, 1993.
173. Britten S, Palmer SH, Snow TM. Needle thoracocentesis in tension pneumothorax: insufficient cannula length and potential failure. Injury 1996;27:321-2. [III]
174. Bristol JB. Harvey JE. Safer insertion of pleural drains. BMJ 1983;286:348-9. [IV]
175. Sassoon CS, Light RW, O’Hara VS, et al. Iatrogenic pneumothorax: aetiology and morbidity. Respiration 1992;59:215-20. [IV]
176. Despars JA, Sassoon CS, Light RW. Significance of iatrogenic pneumothoraces. Chest 1994;105:1147-50. [IV]
177. Poe RH, Kullay MC, Wicks CM, et al. Predicting risk of pneumothorax in needle biopsy of the lung. Chest 1984;85:232-5. [III]
178. Berger R, Smith D. Efficacy of the lateral decubitus position in preventing pneumothorax after needle biopsy of the lung. South Med J 1988;81:1140-3. [IIa]
179. Anderson CL, Crespo JC, Lie TH. Risk of pneumothorax not increased by obstructive lung disease in percutaneous needle biopsy. Chest 1994;105:1705-8. [IV]
180. Pollack MM, Fields AI, Holbrook PR. Pneumothorax and pneumomediastinum during pediatric mechanical ventilation. Crit Care Med 1979;7:536-9. [IV].

