Hướng dẫn sử dụng thuốc vận mạch và thuốc tăng co bóp cho bệnh nhân bị sốc

Trungtamthuoc.com - Sốc là tình trạng suy tuần hoàn đe dọa tính mạng dẫn đến tưới máu và cung cấp oxy cho mô không đủ. Thuốc vận mạch và thuốc tăng co bóp là những thuốc có tác dụng vận mạch, rất quan trọng trong việc tăng sức cản mạch máu hệ thống và khả năng co bóp của tim ở những bệnh nhân bị sốc. Bài viết dưới đây sẽ hướng dẫn cho bạn đọc cách sử dụng thuốc vận mạch và thuốc tăng co bóp khi bệnh nhân bị sốc.
Người dịch: Bác sĩ Danh Bồ Pha – Bệnh viện Quân y 121, Thành phố Cần Thơ
Hiệu đính và biên tập: Dược sĩ Nguyễn Thị Cẩm Trâm, Fanpage Dược sĩ Miloo, Thành phố Hồ Chí Minh
Tải bản gốc PDF TẠI ĐÂY
Tải bản dịch PDF TẠI ĐÂY
Lưu ý (của người dịch): trong bài này sẽ sử dụng tên gọi các thuốc theo bài viết gốc của tác giả: epinephrine và norepinephrine lần lượt thay thế cho adrenalin và noradrenalin (tên thuốc thường được sử dụng trong môi trường y tế Việt Nam hơn).
Tóm tắt Sốc là tình trạng suy tuần hoàn đe dọa tính mạng dẫn đến tưới máu và cung cấp oxy cho mô không đủ. Thuốc vận mạch và thuốc tăng co bóp là những thuốc có tác dụng vận mạch, rất quan trọng trong việc tăng sức cản mạch máu hệ thống và khả năng co bóp của tim ở những bệnh nhân bị sốc. Thành thạo trong việc sử dụng các thuốc này là một kỹ năng quan trọng cần có trong môi trường chăm sóc tích cực, nơi bệnh nhân có thể thường xuyên biểu hiện các triệu chứng sốc. Trong bài tổng quan này, chúng tôi sẽ thảo luận về cơ chế sinh lý bệnh của sốc và đánh giá các bằng chứng hiện tại đằng sau việc kiểm soát sốc, tập trung vào thuốc vận mạch và thuốc tăng co bóp. |
Từ khóa
sốc, thuốc vận mạch, thuốc tăng co bóp, sốc tim, sốc giảm thể tích, sốc phân bố, sốc tắc nghẽn, sốc nhiễm trùng, sốc thần kinh
1 Sinh lý bệnh của sốc
Sốc có thể được phân thành 4 loại chính: phân bố, do tim, giảm thể tích và tắc nghẽn. Mặc dù mỗi loại sốc đều có nguyên nhân riêng nhưng sinh lý bệnh đằng sau mỗi loại sốc đều giống nhau. Các loại sốc có thể được chia nhỏ thành 3 giai đoạn tiến triển bắt đầu bằng sốc còn bù (chưa tiến triển), sốc mất bù (tiến triển) và kết thúc bằng sốc kháng trị (không hồi phục). Trong sốc còn bù, cân bằng nội môi được duy trì thông qua cơ chế bù trừ. Cả cung lượng tim và sức cản mạch máu hệ thống đều tăng để giữ huyết áp trong giới hạn bình thường. Giai đoạn sốc này có thể đảo ngược và biểu hiện lâm sàng phản ánh sự mất cân bằng giữa cung và cầu oxy của mô. 1 Huyết áp sẽ giảm do giảm cung lượng tim (sốc tắc nghẽn/sốc do tim/sốc giảm thể tích) hoặc giảm sức cản mạch máu hệ thống (sốc phân bố). Tuy nhiên, các thụ thể áp suất (baroreceptor) trong xoang cảnh và quai động mạch chủ phản ứng lại sự giảm huyết áp này ngay lập tức thông qua việc kích hoạt hệ thần kinh giao cảm. Sự kích hoạt hệ thống thần kinh giao cảm này dẫn đến co mạch thông qua việc giải phóng epinephrine và norepinephrine (chất co mạch mạnh) từ tủy thượng thận. Hơn nữa, như một biện pháp bù đắp để ngăn ngừa tình trạng chết của các cơ quan quan trọng, lưu lượng máu đến các cơ quan như thận, da, phổi, đường tiêu hóa và gan được chuyển hướng để duy trì lưu lượng máu đến các cơ quan quan trọng hơn như tim và não. Sự giảm lưu lượng máu đến thận này sẽ kích hoạt hệ thống renin-angiotensin-aldosterone (RAAS) dẫn đến giải phóng renin. Renin kích hoạt angiotensin để tạo ra angiotensin I, chất này được chuyển thành angiotensin II. Angiotensin II thúc đẩy sự co mạch trong tuần hoàn động mạch và tĩnh mạch. Ở giai đoạn sốc này, cơ thể có thể bù đắp, và bệnh nhân sẽ hồi phục với rất ít hoặc không có dự hậu nào nếu được điều trị.
Sốc mất bù (tiến triển) xảy ra khi cơ thể không còn khả năng bù đắp cho sự mất cân bằng giữa cung và cầu oxy. Các biện pháp can thiệp tích cực là cần thiết để ngăn ngừa bệnh nhân tiến triển thành hội chứng rối loạn chức năng đa cơ quan và cuối cùng là sốc kháng trị. Đặc điểm nổi bật của loại sốc này là sự giảm tưới máu tế bào liên tục do thay đổi tính thấm của mao mạch. Tính thấm mao mạch bị thay đổi cho phép rò rỉ chất lỏng và protein từ khoang mạch máu vào khoảng kẽ, làm giảm thể tích dịch tuần hoàn và tăng phù nề mô kẽ. Thoát dịch từ lòng mạch ảnh hưởng đến các tạng đặc như gan, lá lách, đường tiêu hóa, phổi và các mô ngoại biên vì nó làm giảm tưới máu hơn nữa các cơ quan này do hậu quả của giảm thể tích nội mạch.
Giai đoạn cuối cùng của sốc là sốc kháng trị (không hồi phục). Nó đặc trưng bởi sự giảm tưới máu do co mạch ngoại biên và giảm cung lượng tim làm trầm trọng thêm quá trình chuyển hóa yếm khí. Axit lactic tích tụ, dẫn đến tăng tính thấm và giãn nở mao mạch. Tính thấm mao mạch tăng lên cho phép dịch rời khỏi lòng mạch và di chuyển vào khoảng kẽ. Máu sẽ ứ đọng trong các mao mạch do sự co thắt của tĩnh mạch và sự giãn nở của động mạch. Việc mất thể tích nội mạch dẫn đến hạ huyết áp và nhịp tim nhanh trầm trọng hơn, làm giảm lưu lượng máu đến động mạch vành. Giảm lưu lượng máu mạch vành làm giảm đáng kể cung lượng tim; kết quả là lưu lượng máu não không thể được duy trì dẫn đến thiếu máu não. Cú sốc không thể đảo ngược, như tên gọi cho thấy, đã qua giai đoạn mà liệu pháp điều trị có thể mang lại lợi ích.
Sốc phân bố, còn gọi là sốc giãn mạch, là do giãn mạch hệ thống dẫn đến lưu lượng máu đến não, tim và thận không đủ, làm tổn thương các cơ quan quan trọng này.2 Sự giãn mạch hệ thống này dẫn đến giảm sức cản mạch máu hệ thống (SVR) và hậu tải. SVR có thể được tính bằng phương trình Poiseuille (Hình 1A). Khi các mạch máu giãn ra, bán kính tăng lên, dẫn đến giảm sức cản thực sự (huyết áp).3 Sốc phân bố cũng có thể dẫn đến mất dịch phù nề vào mô xung quanh, làm giảm huyết áp hơn nữa do sự thay đổi trong phân bố thể tích.2 Nguyên nhân quan trọng của sốc phân bố bao gồm nhiễm trùng huyết, phản vệ và nguyên nhân thần kinh.
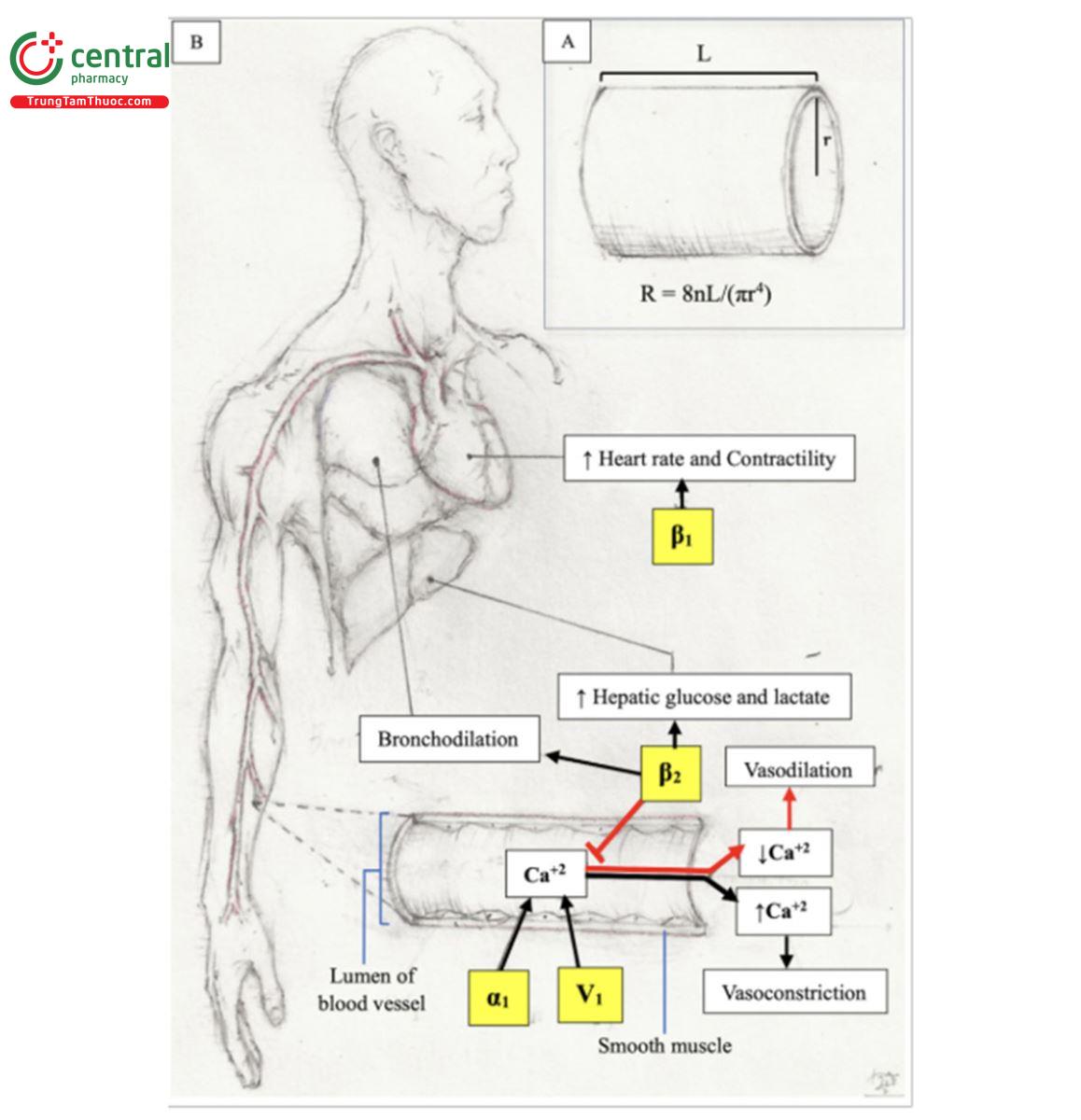
Sốc tim được phân loại rộng rãi là một rối loạn tim đặc trưng bởi sự suy giảm chức năng tâm thất dẫn đến giảm tưới máu cơ quan đích và thiếu oxy mô. Giảm cung lượng tim sẽ kích hoạt dòng thác RAAS đã nói ở trên dẫn đến giữ nước và muối.4 Kích hoạt hệ RAAS dẫn đến một vòng luẩn quẩn mà cuối cùng dẫn đến tình trạng thiếu máu cục bộ mạch vành trầm trọng hơn và tình trạng quá tải thể tích cuối cùng tiến triển dẫn đến trụy tuần hoàn.5 Sốc giảm thể tích là do mất thể tích máu hoặc dịch trong lòng mạch dẫn đến suy tuần hoàn. Sự mất dịch này làm giảm tiền tải, do đó làm giảm cung lượng tim dẫn đến giảm tưới máu mô và thiếu oxy. SVR tăng lên nhằm nỗ lực bù đắp cho sự suy giảm cung lượng tim và huyết áp.3,6
Sốc tắc nghẽn dẫn đến giảm cung lượng tim thường do các nguyên nhân ngoài tim. Sốc tắc nghẽn có thể là do tăng sức cản mạch máu phổi hoặc do sự chèn ép cơ học từ bên ngoài vào tĩnh mạch chủ trên và tĩnh mạch chủ dưới mang máu đến tim. Tăng sức cản mạch máu phổi đặc trưng bởi suy tim thất phải do không có khả năng vượt qua sức cản cao của mạch máu phổi (ví dụ, tắc mạch phổi lớn), trong khi chèn ép cơ học làm giảm tiền tải do giảm hồi lưu tĩnh mạch do chèn ép tĩnh mạch chủ trên và tĩnh mạch chủ dưới (ví dụ, tràn khí màng phổi áp lực). Sốc tắc nghẽn cũng có thể do tắc nghẽn trong tim (ví dụ, bệnh cơ tim phì đại hoặc hẹp động mạch chủ nghiêm trọng) hoặc do sự chèn ép từ chính bên ngoài tim (ví dụ, chèn ép tim hoặc viêm màng ngoài tim co thắt).7
2 Sốc phân bố
2.1 Sốc nhiễm trùng (Septic shock)
Nhiễm trùng huyết (sepsis) là một rối loạn chức năng cơ quan đe dọa tính mạng do rối loạn điều hòa phản ứng của với nhiễm trùng.8 Định nghĩa đồng thuận quốc tế thứ ba về nhiễm trùng huyết và sốc nhiễm trùng (Sepsis-3) xác định nhiễm trùng huyết là một bệnh nhiễm trùng được ghi nhận hoặc nghi ngờ bằng thang điểm Đánh giá suy cơ quan tuần tự (SOFA) ≥2.8 Sốc nhiễm trùng (nguyên nhân gây sốc phổ biến nhất) hiện được định nghĩa là nhiễm trùng huyết đáp ứng các tiêu chí trên ở những bệnh nhân, mặc dù được hồi sức đủ dịch, vẫn cần dùng thuốc vận mạch để duy trì huyết áp trung bình (MAP) ≥65 mm Hg và có nồng độ lactate huyết thanh >2 mmol/L.8-12 Tỷ lệ tử vong tại bệnh viện do sốc nhiễm trùng thường > 40%.8
Chiến dịch sống sót nhiễm trùng huyết (The Surviving Sepsis Campain - SSC) được thành lập vào năm 2004 nhằm cung cấp các hướng dẫn quốc tế về quản lý nhiễm trùng huyết và sốc nhiễm trùng, với các bản cập nhật được xuất bản 4 năm một lần. Phiên bản gần đây nhất của SSC (2021) đã thực hiện 6 thay đổi khuyến cáo chính so với phiên bản 2016: (1) khuyến cáo bắt đầu truyền dịch nhanh 30 mL/kg đã bị hạ xuống mức yếu dựa trên chất lượng bằng chứng thấp, (2) dung dịch muối sinh lý (0.9%) không còn được khuyến cáo để hồi sức dịch; chỉ nên sử dụng dung dịch tinh thể cân bằng, (3) đối với người lớn bị sốc nhiễm trùng, nên bắt đầu dùng thuốc vận mạch ngay cả khi sử dụng đường truyền ngoại vi, (4) SSC đề nghị không sử dụng Vitamin C tiêm tĩnh mạch, (5) corticosteroid tiêm tĩnh mạch được đề xuất cho người lớn bị sốc nhiễm trùng cần điều trị bằng thuốc vận mạch liên tục và (6) khuyến cáo những người trưởng thành sống sót sau nhiễm trùng huyết hoặc sốc nhiễm trùng nên được đánh giá các vấn đề về thể chất, nhận thức và cảm xúc sau khi xuất viện.13 Ngoài những sự thay đổi này, hướng dẫn của SSC năm 2021 không còn khuyến cáo Đánh giá suy tạng tuần tự nhanh (qSOFA) làm công cụ sàng lọc duy nhất đối với nghi ngờ nhiễm trùng huyết do độ nhạy và độ đặc hiệu không cao,14 điều này có thể dẫn đến chẩn đoán bị bỏ sót.13 Những hướng dẫn này không đề xuất tiêu chuẩn chẩn đoán mới cho nhiễm trùng huyết hoặc sốc nhiễm trùng, nhưng đã đưa ra khuyến cáo mức yếu về việc sử dụng nồng độ lactate để giúp sàng lọc nhiễm trùng huyết. Ở những bệnh nhân nghi ngờ nhiễm trùng huyết, sự hiện diện của nồng độ lactate tăng cao làm tăng đáng kể khả năng chẩn đoán cuối cùng về nhiễm trùng huyết.13
Viêm phổi là nguyên nhân gây ra khoảng một nửa số trường hợp nhiễm trùng huyết.12 Các nguyên nhân phổ biến khác của nhiễm trùng huyết bao gồm nhiễm trùng ổ bụng và tiết niệu. Hạ huyết áp, giảm khả năng biến dạng hồng cầu và huyết khối vi mạch là những cơ chế tiềm ẩn góp phần làm giảm lượng oxy cung cấp đến các mô trong sốc nhiễm trùng.15 Hạ huyết áp gặp ở 40% bệnh nhân nhiễm trùng huyết khi đến bệnh viện.16
Khi nghi ngờ sốc nhiễm trùng, việc xử trí ban đầu là quan trọng. Các biện pháp ban đầu bao gồm sử dụng hồi sức bằng dịch truyền qua đường tĩnh mạch (30 mL/kg trong 3 giờ đầu), kháng sinh qua đường tĩnh mạch trong vòng 1 giờ,13 liệu pháp oxy và thở máy nếu có chỉ định lâm sàng.15,17Các khuyến cáo này phù hợp với hướng dẫn của SSC 2021. Sau liều truyền dịch ban đầu là 30 mL/kg, việc theo dõi động học của đáp ứng huyết áp (ví dụ: tăng cung lượng tim xảy ra trong vòng 60 giây sau khi nâng chân thụ động lênmột góc 45°) giúp xác định những bệnh nhân có thể đáp ứng với liệu pháp truyền dịch.18 Người ta cũng khuyên nên sử dụng lactate để đánh giá tưới máu mô (độ thanh thải lactate) và duy trì mục tiêu lượng nước tiểu ≥0,5 mL/kg/giờ.14 Các biện pháp này giúp hướng dẫn hồi sức dịch một cách an toàn đồng thời giảm thiểu tình trạng quá tải dịch. Đáng lưu ý, sự thay đổi cung lượng tim sau khi nâng cao chân thụ động có thể chính xác hơn sự thay đổi áp lực mạch theo hô hấp (IVC) hoặc sử dụng các chỉ số tĩnh như áp lực tĩnh mạch trung tâm (CVP) trong việc dự đoán khả năng đáp ứng dịch ở bệnh nhân huyết động không ổn định.18
Nếu bệnh nhân vẫn hạ huyết áp mặc dù đã được bù dịch, điều trị bằng thuốc vận mạch được chỉ định.12,19 Tuy vậy, ý tưởng chỉ bắt đầu dùng thuốc vận mạch sau khi bệnh nhân không đáp ứng với dịch truyền đã bị thách thức.20 Sử dụng thuốc vận mạch sớm có thể làm giảm tình trạng quá tải dịch từ việc sử dụng quá nhiều dịch,21,22 có khả năng cải thiện quá trình oxy hóa mô và huy động các vi mạch dẫn đến vi tuần hoàn tốt hơn.23,24 Tuy nhiên, một thử nghiệm ngẫu nhiên có đối chứng không mù đôi gần đây (Thử nghiệm CLOVERS) bao gồm 1563 bệnh nhân bị hạ huyết áp do nhiễm trùng huyết không đáp ứng với truyền từ 1 đến 3 L dịch ban đầu, cho thấy chiến lược truyền dịch hạn chế (với việc sử dụng thuốc vận mạch sớm hơn) không khác biệt về tỷ lệ tử vong vào ngày xuất viện thứ 90 so với chiến lược truyền dịch tự do hơn (với việc sử dụng thuốc vận mạch muộn hơn).25 Vì vậy, vẫn chưa rõ liệu việc sử dụng thuốc vận mạch sớmtrong sốc nhiễm trùng có ảnh hưởng đến kết cục hay không.
Thuốc vận mạch hàng đầu được khuyên dùng cho sốc nhiễm trùng là norepinephrine (Bảng 1 và Hình 1B).26-28 Norepinephrine thường được bắt đầu với liều từ 0,01 đến 0,05 μg/kg/phút, có thể tăng dần theo mức từ 0,02 đến 0,04 μg/kg/ phút sau mỗi 5 đến 15 phút cho đến khi đạt được mục tiêu MAP là 65 mmHg hoặc cao hơn.29,30 Vasopressin hoặc hormone chống bài niệu (ADH) được sản xuất trong nhân trên thị và nhân cạnh não thất ở vùng dưới đồi và sau đó được lưu trữ ở vùng sau tuyến yên. Đặc tính co mạch của vasopressin là thông qua việc kích thích thụ thể V1 trong cơ trơn mạch máu.31 Vasopressin liều thấp (0,03 đơn vị/phút) có thể được thêm vào làm thuốc bậc hai nếu mục tiêu MAP ≥65 mmHg không đạt được ở mức liều cao của norepinephrine (> 0,2 μg/kg/phút).32-34 Các nghiên cứu hồi cứu đã cho thấy sự cải thiện liên quan đến tỷ lệ tử vong ở bệnh nhân bị sốc nhiễm trùng khi sử dụng norepinephrine trước khi nhập viện,30 và khi thêm vasopressin vào liều thấp norepinephrine (< 0,25 μg/kg/phút), nhưng không thấy khi dùng kết hợp với norepinephrine ở liều cao (>0,25 μg/kg/phút).35 Tuy nhiên, đó có thể là do nhóm dùng norepinephrine liều cao tình trạng bệnh nặng hơn dẫn đến kết cục xấu hơn. Dường như vasopressin có tác dụng hiệp đồng khi kết hợp với norepinephrine, điều này có thể cho phép giảm liều norepinephrine.36 Ngoài ra, vasopressin vẫn có thể gây co mạch trong tình trạng nhiễm toan (ví dụ, trong sốc nhiễm trùng) khi dùng chất chủ vận α1 (ví dụ như norepinephrine) trở nên kém hiệu quả hơn.37
Epinephrine là một thuốc vận mạch hàng hai khác có thể được sử dụng, đặc biệt nếu nhịp tim hoặc cung lượng tim không đủ (vì nó có cả tác dụng tăng co bóp cơ tim và điều hòa nhịp tim).29 Ngoài ra, epinephrine có thể được thêm vào như một phần của sự kết hợp ba thuốc nếu chưa thấy đáp ứng kịp thời với thuốc vận mạch thứ hai, đặc biệt ở những bệnh nhân có rối loạn chức năng cơ tim đồng thời.33,46 Điều quan trọng cần lưu ý là epinephrine có nguy cơ gây rối loạn nhịp nhanh cao hơn so với norepinephrine.36 Hơn nữa, hướng dẫn SSC năm 2021 đề xuất sử dụng Hydrocortisone 200 mg/ngày (dưới dạng bolus 50 mg mỗi 6 giờ hoặc truyền liên tục) ở bệnh nhân sốc nhiễm trùng cần tiếp tục sử dụng thuốc vận mạch mặc dù đã được hồi sức đủ dịch.13 Lý tưởng nhất là liệu pháp vận mạch được thực hiện thông qua catheter tĩnh mạch trung tâm (CVC) do lo ngại tổn thương mô cục bộ do thuốc vận mạch gây ra (hoại tử mô) khi sử dụng qua ống catheter tĩnh mạch ngoại biên (PVC). Tuy nhiên, nguy cơ hoại tửmô khi sử dụng PVC là hạn chế, đặc biệt khi sử dụng ngắn hạn (<6 giờ) với PVC được đặt gần hố trước khuỷu tay (antecubital fossa).47-50Do đó, có thể tạmthời sử dụng thuốc vận mạch ở ngoại vi cho đến khi đặt CVC,49 ngay cả ở trẻ em.51
Bảng 1. Các loại thuốc vận mạch và tăng co bóp thường dùng trong sốc.29,33,36,38-45
| Thuốc | Liều lượng | Thụ thể liên kết | Tác dụng phụ | Bình luận |
| Norepinephrine (NE) | • Liều ban đầu: 0.01-0.05 μg/kg/phút • Khoảng liều: 0.01–1 μg/kg/phút | α1 > β1 > β2 | Nhịp nhanh, tăng sức cản mạch máu phổi, thiếu máu cục bộ ngoại biên (đầu chi) | Thuốc vận mạch hàng đầu trong sốc nhiễm trùng và sốc tim |
| Epinephrine (EPI) | • Liều ban đầu: 0.01–0.05 μg/kg/phút • Khoảng liều: 0,01-0,3 μg/kg/phút | α1=β1 > β2 | • Nhịp nhanh, thiếu máu cơ tim • Co mạch nội tạng dẫn đến thiếu máu cục bộ cơ quan trong ổ bụng • Tăng lactate máu và tăng đường máu. | • Thuốc vận mạch hàng đầu trong sốc phản vệ và ngừng tim • Tăng lactate máu làm cho lactate trở thành thước đo kém tin cậy hơn trong đánh giá tưới máu cơ quan đích |
| Dopamin (DOPA) | • Liều ban đầu: 2-10 μg/kg/phút • Khoảng liều: 2-20 μg/kg/phúta | DA1>β1 >α1 | Rối loạn nhịp nhanh, thiếu máu cơ tim | • Thuốc tăng co bóp cơ tim bậc hai ở người lớn • Được sử dụng ở những bệnh nhân chọn lọc có nguy cơ thấp bị rối loạn nhịp (nhanh và chậm). |
| Phenylephrin (PHEN) | • Liều ban đầu: 0.1–0.3 μg/kg/phút • Khoảng liều: 0.1-1 μg/kg/phút | α1 | • Nhịp tim chậm phản xạ • Thiếu máu cục bộ ngoại biên nặng | Hữu ích cho rối loạn nhịp nhanh hoặc ở những bệnh nhân có cung lượng tim bình thường nhưng huyết áp thấp kéo dài |
| Vasopressin (VASO) | • Liều ban đầu: 0.01-0.04 IU/kg/phút • Khoảng liều: 0.01-0.06 IU/kg/phút | V1 | Có thể giảm tưới máu đường tiêu hóa do co mạch nội tạng | • Thường được dùng bổ sung cho norepinephrine trong sốc nhiễm trùng • Không làm tăng sức cản mạch máu phổi |
| Dobutamine (DOB) | • Liều ban đầu: 2-5 μg/kg/phút • Khoảng liều: 2-10 μg/kg/phút | β1 > β2 > α1 | Hạ huyết áp, rối loạn nhịp nhanh, lờn thuốc (truyền trên 72 giờ) | • Thuốc tăng co bóp cơ tim đầu tiên cho hầu hết các dạng sốc • Khởi phát tác dụng nhanh |
| Milrinone (MIL) | • Liều ban đầu: 0.1-0.25 μg/kg/phút • Khoảng liều: 0.1-0.5 μg/kg/phút | Chất ức chế Phosphodies-- terase-3 | Hạ huyết áp (gây giãn mạch nhiều hơn DOB), nhịp tim nhanh, xoắn đỉnh | Thuốc tăng co bóp hữu ích ở những bệnh nhân tăng sức cản mạch máu phổi. |
Chữ viết tắt: V1, thụ thể Vasopressin; DA1, thụ thể dopaminergic.
Nguy cơ rối loạn nhịp tim nhanh: DOPA, DOB, EPI > MIL, NE > VASO, PHEN.
aCo mạch ở hầu hết các giường mạch (tác dụng co mạch) được thấy với liều dopamine ≥10 μg/kg/phút.
2.2 Sốc thần kinh
Sốc thần kinh là nguyên nhân quan trọng gây sốc phân bố khi tủy sống bị tổn thương. Tình trạng giảm tưới máu được thấy ở sốc thần kinh là do mất khả năng kiểm soát giao cảm lên trương lực mạch máu thường thấy ở các tổn thương tủy sống trên, đặc biệt là trên mức T6 do các tế bào thần kinh giao cảm chi phối tim nằm từ T1 đến T4.52,53 Phẫu thuật sớm can thiệp (<24 giờ) để giải áp và ổn định cột sống là mấu chốt.52,54 Điều chỉnh tình trạng hạ huyết áp (huyết áp tâm thu <90 mmHg) là quan trọng để ngăn ngừa tổn thương thứ phát của tủy sống do thiếu máu cục bộ sẽ dẫn đến kết cục thần kinh xấu đi.55
Thuốc vận mạch có cả hoạt tính α và β như dopamine hoặc norepinephrine thường được sử dụng để kiểm soát sốc thần kinh khi việc hồi sức dịch truyền không đủ. Một nghiên cứu can thiệp chéo tiến cứu nhỏ trên 11 bệnh nhân cho thấy norepinephrine có thể duy trì MAP mà áp lực trong tủy sống thấp hơn và áp lực tưới máu tủy cao hơn (khoảng 2 mmHg) so với dopamine.56 Một bài tổng quan cho thấy các biến chứng do thuốc vận mạch của dopamine (đặc biệt là rối loạn nhịp tim nhanh) cao hơn so với Phenylephrine ở bệnh nhân chấn thương tủy sống cấp tính.53 Một tổng quan hệ thống gần đây hơn đề xuất rằng trong chấn thương tủy sống cấp tính, norepinephrine có thể là thuốc hàng đầu.57 Tuy nhiên, do thiếu bằng chứng chất lượng cao nên vẫn chưa có sự đồng thuận về liệu pháp vận mạch tối ưu cho sốc thần kinh. Một thuốc thường được sử dụng khác, phenylephrine, có thể gây nhịp tim chậm phản xạ (Bảng 1) có thể nguy hiểm ở những bệnh nhân bị chấn thương cột sống trên T6, những người dễ bị nhịp tim chậm do rối loạn chức năng giao cảm. Do đó, nên sử dụng thuốc co mạch đơn thuần như phenylephrine cho các chấn thương tủy sống dưới (tức là dưới T6).58,59 Ngược lại, norepinephrine hoặc dopamine được sử dụng cho các chấn thương tủy sống trên (tức là bằng hoặc trên T6).59 Tuy nhiên, các thuốc này có thể gây co bóp cơ tim quá mức trong bối cảnh tăng sức cản mạch máu ngoại biên nếu chúng được sử dụng cho các chấn thương tủy sống dưới.53
Các hướng dẫn mới nhất được ban hành năm 2013 khuyến cáo duy trì MAP trong khoảng 85-90 mmHg trong 7 ngày ở bệnh nhân sau chấn thương tủy sống cấp tính.60 Tuy nhiên, chỉ có ít bằng chứng ủng hộ khuyến cáo này. Hơn nữa, việc duy trì các mục tiêu MAP như vậy trong thực hành nói chung là một thách thức.61 Một nghiên cứu hồi cứu gần đây đã cho thấy tỷ lệ phục hồi thần kinh cao hơn một cách nhất quán ở những bệnh nhân duy trì MAP > 85 mmHg trong khoảng thời gian ngắn hơn 5 ngày sau chấn thương tủy sống.62 Thật vậy, một nghiên cứu hồi cứu khác cho thấy rằng mục tiêu MAP trung bình cao hơn có tương quan tốt nhất với phục hồi (vềmặt chức năng thần kinh) trong 2 đến 3 ngày đầu sau chấn thương tủy sống, và mối tương quan này trở nên yếu hơn trong những ngày tiếp theo.63 Nghiên cứu này gợi ý rằng khuyến cáo sử dụng thuốc vận mạch ít hơn 7 ngày có thể không ảnh hưởng tiêu cực đến kết cục về thần kinh. Do đó, duy trì mục tiêu MAP >85 mmHg trong khoảng 5 ngày sau chấn thương tủy sống là hợp lý.
Bệnh nhân cao tuổi (> 65 tuổi) có thể đặc biệt dễ gặp biến chứng khi sử dụng thuốc vận mạch. Các nghiên cứu gần đây đã chỉ ra rằng những bệnh nhân cao tuổi bị chấn thương tủy sống đặc biệt dễ bị biến chứng tim mạch64 do thuốc vận mạch, đặc biệt là với dopamine.53,65,66 Cần có đánh giá lâm sàng để xác định sự cân bằng giữa rủi ro và lợi ích khi sử dụng thuốc vận mạch (đặc biệt là dopamine) ở người cao tuổi đang bị chấn thương tủy sống vốn dĩ thường đã bị gánh nặng bởi các bệnh lý tim mạch mạn tính đi kèm. Nên điều chỉnh giảm mục tiêu MAP, đặc biệt nếu không có cải thiện về thần kinh sau 3 ngày đầu sau chấn thương tủy sống.52 Điều quan trọng cần lưu ý là tăng huyết áp để đạt mục tiêu MAP > 85 mmHg ở bệnh nhân đồng thời bị sốc mất máu, bóc tách động mạch chủ, hoặc xuất huyết nội sọ có thể làm trầm trọng thêm các tình trạng này, vốn không hiếm gặp trong chấn thương.52 Cần có thêm nhiều nghiên cứu tiến cứu không chỉ để xác định thuốc vận mạch tối ưu mà còn để xác định xem mục tiêu MAP <85 mmHg có thể duy trì áp lực tưới máu tủy sống đầy đủ hay không để giảm thiểu nhu cầu sử dụng thuốc vận mạch.
Ở những bệnh nhân có thể dung nạp thuốc uống, Midodrine (một chất chủ vận α1) có thể được dùng 10 mg uống 3 lần mỗi ngày để điều trị dự phòng hoặc điều trị hạ huyết áp tư thế thường thấy khi bị chấn thương tủy sống.67 Điều thú vị là, midodrine đường uống có thể làm giảm nhu cầu sử dụng thuốc vận mạch đường tĩnh mạch cho những bệnh nhân cần hỗ trợ kéo dài sau chấn thương tủy sống cổ.68 Droxidopa (tiền chất tổng hợp của norepinephrine) là một thuốc uống khác có thể được sử dụng để cai thuốc vận mạch nếu bệnh nhân không dung nạp midodrine.69Các loại thuốc khác cần xem xét bao gồm Atropine để điều trị nhịp tim chậm, mà biểu hiện phổ biến nhất là nhịp chậm xoang.53
2.3 Sốc phản vệ (Anaphylatic shock)
Phản vệ (anaphylaxis) là một phản ứng dị ứng nghiêm trọng thường xuất hiện trước tiên với các biểu hiện phát ban (nổi mề đay), ngứa và khó thở.70 Tiêu chuẩn chẩn đoán phản vệ đã được Hội nghị chuyên đề của Viện Dị ứng và Bệnh Truyền nhiễm Quốc gia/ Mạng lưới Dị ứng Thực phẩm và Sốc phản vệ (NIAID/ FAAN) xây dựng năm 2006 (Bảng 2).771
Bảng 2. Tiêu chuẩn chẩn đoán phản vệ.71,72
| Phản vệ rất có thể xảy ra khi đáp ứng một trong 3 tiêu chí sau: |
1. Khởi phát cấp tính liên quan đến mô niêm mạc, da hoặc cả hai (ví dụ: ngứa, đỏ bừng, nổi mề đay toàn thân, phù nề vùng môi - lưỡi - lưỡi gà) VÀ một trong những dấu hiệu sau: A) Suy hô hấp (ví dụ, co thắt phế quản, thở khò khè, khó thở, thở rít, giảm lưu lượng thở ra đỉnh và thiếu oxy), B) Các triệu chứng rối loạn chức năng cơ quan đích (ví dụ: hạ huyết áp, ngất, và không tự chủ bản thân), hoặc huyết áp tâm thu (HATT) <90 mmHg. 2. Tiếp xúc với một chất có khả năng gây dị ứng cho bệnh nhân đó VÀ 2 hoặc nhiều hơn những dấu hiệu sau đây xảy ra nhanh chóng: A) Sự liên quan đến mô da-niêm mạc (ví dụ, phù nề môi - lưỡi - lưỡi gà, nổi mề đay, ngứa và đỏ bừng) B) HATT <90 mmHg hoặc các triệu chứng liên quan (ví dụ: giảm trương lực cơ, ngất và không tự chủ bản thân) C) Suy hô hấp (ví dụ: khó thở, thở khò khè, co thắt phế quản, thở rít, thiếu oxy máu và giảm lưu lượng thở ra đỉnh) D) Các triệu chứng tiêu hóa dai dẳng (ví dụ, buồn nôn/nôn và đau bụng). 3. Hạ huyết áp xảy ra nhanh chóng sau khi tiếp xúc với chất gây dị ứng đã biết ở bệnh nhân đó: A) Người lớn: giảm >30% so với mức HATT nền của người đó hoặc HATT < 90 mmHg B) Trẻ sơ sinh và trẻ em: HA giảm >30% so với HATT nền hoặc HATT thấp theo độ tuổi.* |
*Định nghĩa HATT thấp theo độ tuổi:
• 1 tháng đến 1 tuổi: <70 mmHg
• 1-10 tuổi: dưới (70 mmHg + [2 × tuổi])
• 11-17 tuổi: <90 mmHg
Từ 30% đến 50% bệnh nhân bị phản vệ tiến triển sốc.73,74 Cơ chế sốc phân bố trong phản vệ là do sự giải phóng qua trung gian IgE và không qua trung gian IgE các chất trung gian hoạt mạch (ví dụ, histamine) từ bạch cầu ưa kiềm và tế bào mast dẫn đến hạ huyết áp.72 Các biểu hiện giãn mạch, co thắt phế quản và trụy tim trong sốc phản vệ đều được đảo ngược khi tiêm epinephrine.75 Do đó, epinephrine là thuốc vận mạch hàng đầu trong sốc phản vệ. Cần tiêm bắp ngay [0,3-0,5 mg, 1:1000 (1 mg/mL)] epinephrine vào giữa mặt trước ngoài cơ đùi trong lúc đang thiết lập đường truyền tĩnh mạch.72 Truyền tĩnh mạch epinephrine nên bắt đầu với tốc độ từ 1 đến 10 μg/phút và tăng dần bằng một nửa tốc độ liều khởi đầu cứ sau 2 đến 3 phút để đạt được MAP >65 mmHg.76
Bệnh nhân dùng thuốc chẹn beta có thể không đáp ứng đầy đủ với truyền epinephrine do các thụ thể beta đang bị phong bế làm tác dụng của epinephrine lên tim mạch bị giảm. Glucagon trong trường hợp này có thể hữu ích vì nó làm tăng sức co bóp và nhịp tim mà không cần kích hoạt thụ thể b.76,77 Thật vậy, glucagon nên được dùng cho bất kỳ bệnh nhân nào không đáp ứng với epinephrine bất kể họ có dùng thuốc chẹn beta hay không.78 Đối với người lớn, glucagon 1 đến 5 mg (trẻ em: 20-30 μg/kg) nên được tiêm tĩnh mạch trong vòng 5 phút, sau đó là truyền dịch với tốc độ 5 đến 15 μg/phút.76 Thuốc vận mạch thứ hai (ví dụ, norepinephrine và vasopressin) có thể được thêm vào như thuốc hàng thứ hai nếu epinephrine không đủ.76
3 Sốc tim
Sốc tim là do rối loạn chức năng tim dẫn đến tưới máu mô không đầy đủ. Nhồi máu cơ tim cấp tính là nguyên nhân phổ biến nhất gây sốc tim.5 Bệnh nhân cũng có nguy cơ bị sốc tim sau khi ngừng tim ngoài bệnh viện (out-of-hospital cardiac arrest - OHCA). Không nhất thiết quá trình hồi sức dẫn đến rối loạn chức năng tim (mặc dù tổn thương tim do hồi sức có thể góp phần) nhưng nhiều khả năng là do tưới máu mạch vành kém sau ngừng tim. Một biến cố thiếu máu cơ tim có thể dẫn đến OHCA và sốc tim sau đó. Các dấu hiệu giảm tưới máu trong sốc bao gồm nhịp tim nhanh, thay đổi trạng thái tinh thần, tăng lactate và thiểu niệu (<400 mL/ngày). Độ bão hòa oxy máu tĩnh mạch (Sv02), áp lực tĩnh mạch trung tâm cao, chỉ số tim giảm (2,2 L/phút/m2 ) và những đặc điểm siêu âm tim điển hình (ví dụ, phân suất tống máu giảm và giãn tâm thất) là những đặc điểm giúp phân biệt sốc do tim với các nguyên nhân gây sốc khác.5,9
Mặc dù các phân tích tổng hợp cho thấy epinephrine làm tăng tỉ lệ sống sót khi nhập viện do OHCA, hầu hết trong số này nghiên cứu đánh giá việc sử dụng epinephrine trước khi nhập viện ở bối cảnh ngừng tim và liên quan đến sự quay trở lại của tuần hoàn tự phát (return of spontaneous circulation - ROSC), chứ không phải là sốc tim cụ thể.79-81 Norepinephrine là thuốc vận mạch được khuyến hàng đầu trong sốc tim.17,39 Thời gian và mức độ nghiêm trọng của hạ huyết áp sau hồi sinh tim phổi từ OHCA có liên quan đến kết cục tồi tệ hơn.82 Các nghiên cứu quan sát đã chỉ ra rằng những bệnh nhân sau OHCA bị sốc dùng norepinephrine ít bị tái phát ngừng tim hơn và có tỷ lệ tử vong do mọi nguyên nhân thấp hơn so với bệnh nhân dùng epinephrine.83,84 Norepinephrine tăng MAP mà không ảnh hưởng đáng kể đến nhịp tim.26 Trong sốc tim, norepinephrine gây tác dụng β- adrenergic tối thiểu nên nó ít có khả năng dẫn đến rối loạn nhịp tim hoặc tiêu thụ oxy cơ tim đáng kể.85 Không giống như norepinephrine, epinephrine làm tăng MAP hiệu quả nhưng đánh đổi lại bằng tiêu hao năng lượng của tim gây ra những tác dụng phụ nghiêm trọng hơn (ví dụ, thiếu máu cơ tim).39 Hơn nữa, norepinephrine không làm tăng lactate như epinephrine, cho phép tăng lactate được sử dụng như một dấu hiệu thay thế để theo dõi tiến triển của thiếu máu cơ quan.43 Ngoài ra, epinephrine còn làm tăng lactate máu và tăng đường máu do tác dụng kích thích lên β2 mạnh mẽ (Hình 1B). Nên tránh truyền liên tục epinephrine để duy trì huyết áp ở bệnh nhân sốc tim,38,86 đặc biệt ở những bệnh nhân bị nhồi máu cơ tim cấp.87 Không khuyến cáo sử dụng dopamine cho bệnh nhân sốc tim vì gây tăng nhịp tim và norepinephrine đã được chứng minh là có tác dụng vượt trội trong việc giảm tỷ lệ tử vong.26,88 Nên tránh sử dụng phenylephrine trong hầu hết các tình huống vì nó có thể làm giảm cung lượng tim, làm tình trạng sốc tim trở nên trầm trọng hơn.45 Thuốc tăng co bóp cơ tim (inotrope) cần được xem xét khi suy bơm của tim là một yếu tố góp phần gây thiếu máu cơ quan. Dobutamine hoạt động chủ yếu như chất chủ vận β1 dẫn đến tăng sức co bóp và ít có tác dụng lên huyết áp (Bảng 1).85 Dobutamine là một thuốc tăng co bóp cơ tim thường được sử dụng trong sốc tim, đặc biệt là phối hợp với norepinephrine ở những bệnh nhân cần hỗ trợ cả sức co bóp và vận mạch.39 Milrinone là một inotrope khác giúp cải thiện khả năng co bóp của tim thông qua sự ức chế của phosphodiesterase type-3. Cơ chế hoạt động này cho phép milrinone có thể duy trì hiệu quả khi thụ thể β đang bị phong bế (tức là bệnh nhân đang dùng thuốc chẹn beta).89 Dobutamine khởi phát tác dụng nhanh hơn và tác dụng tăng co bóp cơ tim mạnh hơn so với milrinone.33,90 Trong một thử nghiệm gần đây, 192 bệnh nhân bị sốc tim được phân bố ngẫu nhiên vào nhóm sử dụng dobutamine hoặc milrinone và kết quả cho thấy không có sự khác biệt về kết cục (ví dụ, tử vong trong bệnh viện do mọi nguyên nhân, do đột quỵ, hoặc do các biến cố tim mạch hoặc thận).91 Tuy nhiên, milrinone nên được sử dụng thận trọng trong bệnh nhân bị rối loạn chức năng thận do tăng nguy cơ tích lũy thuốc dẫn đến hạ huyết áp kéo dài.29 Do trước những tác dụng khó lường của thuốc tăng co bóp đối với huyết áp, không nên sử dụng MAP để hướng dẫn chỉnh liều thuốc tăng co bóp. Thay vào đó, việc chỉnh liều nên được hướng dẫn bằng việc đạt được các mục tiêu tưới máu cơ quan đích như lượng nước tiểu > 0,5 mL/kg/h với mức lactate xu hướng giảm hoặc trở về bình thường.29 Chỉnh liều thuốc tăng co bóp để cải thiện các giá trị SvO2 hoặc độ bão hòa oxy máu tĩnh mạch trung tâm (Scv02) cũng có thể hữu ích vì chúng phản ánh sự cân bằng giữa cung và cầu oxy.9,29
Bệnh nhân bị sốc tim do rối loạn chức năng thất trái vẫn có thể được hưởng lợi từ việc truyền dịch và nên đánh giá thích hợp về khả năng đáp ứng dịch (ví dụ, thay đổi cung lượng tim sau khi nâng chân thụ động).9 Tuy nhiên, ở bệnh nhân cao tuổi với nhồi máu thất trái lan rộng, nên tránh hồi sức bằng dịch truyền tích cực.38 Thử nghiệm SHOCK đã chỉ ra rằng tái thông mạch máu khẩn cấp là biện pháp điều trị đặc hiệu trong sốc tim sau nhồi máu cơ tim cấp.92
4 Sốc giảm thể tích
Sốc giảm thể tích dẫn đến việc cung cấp oxy đến các mô không đủ do mất thể tích máu lưu thông hiệu quả. Mất thể tích tuần hoàn có thể là do nguyên nhân không xuất huyết (ví dụ, tổn thương đường tiêu hóa do nôn mửa hoặc tiêu chảy nặng) hoặc nguyên nhân xuất huyết. Nguyên nhân phổ biến nhất của sốc giảm thể tích do xuất huyết là chấn thương.3
Hồi sức dịch là rất quan trọng ở những bệnh nhân bị sốc giảm thể tích không do xuất huyết. Ngoại suy từ các hướng dẫn về nhiễm trùng huyết, bolus 30 mL/kg dịch tinh thể trong 3 giờ đầu cùng với việc bổ sung một lượng dịch thích hợp dựa trên các chỉ dấu của thiếu máu cục bộ cơ quan đích (ví dụ, lượng nước tiểu và độ thanh thải lactate) là hợp lý cho những bệnh nhân bị sốc giảm thể tích không do xuất huyết .3,13 Cần thận trọng hơn khi truyền dịch trong sốc giảm thể tích do xuất huyết (hay sốc mất máu) do nguy cơ làm loãng các yếu tố đông máu và làm trầm trọng thêm tình trạng hạ thân nhiệt và nhiễm toan máu.93,94 Toan máu và hạ thân nhiệt có thể làm giảm hơn nữa chức năng của các yếu tố đông máu dẫn đến mất máu nhiều hơn.95,96
Bảng 3. Phân độ sốc mất máu.93,101
| Nhịp mạch (lần/phút) | Huyết áp | Thời gian làm đầy mao mạcha | Nhịp thở (lần/phút) | Lượng máu mất (% tổng lượng máu cơ thể) | |
| Độ I | <100 | Bình thường | Bình thường | 14-20 | ≤15 |
| Độ II | 100-120 | Bình thường | Tăng | 20-30 | 15-30 |
| Độ III | 120-140 | Giảm | Tăng | 30-40 | 30-40 |
| Độ IV | >140 | Giảm | Tăng | >40 | >40 |
aThời gian làm đầy mao mạch bình thường là ≤ 3 giây
Các nghiên cứu đã chỉ ra rằng bệnh nhân bị vết thương xuyên thấu có kết cục tốt hơn khi họ được hồi sức bằng chiến lược dịch truyền hạn chế97 hoặc trì hoãn.98 Một lưu ý là những kết quả này chỉ có thể áp dụng cho những bệnh nhân bị vết thương xuyên thấu vùng thân mình.98 Tuy nhiên, chăm sóc bệnh nhân sốc mất máu trước khi nhập viện bao gồm hồi sức dịch ở mức hạn chế (đủ để duy trì mạch quay có thể sờ thấy được), giảm thiểu mất máu thêm (ví dụ, đè ép trực tiếp hoặc cầm máu hoặc băng bó các vị trí chảy máu), tránh hạ thân nhiệt và vận chuyển nhanh đến cơ sở y tế để điều trị đặc hiệu.99 Không nên nhấn mạnh quá mức việc vận chuyển bệnh nhân nhanh chóng vì thời gian trung bình dẫn đến tử vong ở một nhóm nghiên cứu đoàn hệ bao gồm 809 bệnh nhân bị sốc giảm thể tích chỉ là 2 giờ.100 Điều quan trọng cần lưu ý là mất máu đáng kể có thể xảy ra với nhưng chỉ ảnh hưởng tối thiểu đến các dấu hiệu sinh tồn như huyết áp, đặc biệt ở bệnh nhi (Bảng 3).101
Một nghiên cứu đoàn hệ hồi cứu cho thấy lợi ích sống sót đáng kể ở những binh sĩ chiến đấu bị thương (thương binh) được truyền chế phẩm máu trước khi nhập viện.102 Những nghiên cứu như vậy làm lóe lên câu hỏi liệu thường dân (không phải binh sĩ) sẽ được hưởng lợi từ phác đồ giống vậy. Một trong những nghiên cứu này bao gồm thử nghiệm đa trung tâm PAMPer vào năm 2018, cho thấy rằng việc sử dụng huyết tương rã đông trước khi nhập viện là an toàn và làm giảm tỷ lệ tử vong trong 30 ngày ở những thường dân bị thương có nguy cơ sốc mất máu so với hồi sức tiêu chuẩn.103 Hơn nữa, phân tích thứ cấp của thử nghiệm này cho thấy lợi ích cải thiện tử vong lớn nhất được thấy ở những bệnh nhân được nhận cả khối hồng cầu đậm đặc (PRBC) và huyết tương trước khi nhập viện. Những bệnh nhân được truyền dịch tinh thể có tỷ lệ sống sót kém nhất.104 Điều này trái ngược với thử nghiệm RePHILL, không cho thấy PRBC trước khi nhập viện và hồi sức bằng huyết tương đông khô tốt hơn Natri clorua 0,9% đối với bệnh nhân trưởng thành bị sốc mất máu do chấn thương.105 Một khi bệnh nhân bị sốc mất máu do chấn thương có mặt tại bệnh viện, việc kích hoạt phác đồ truyền máu số lượng lớn sớm cho phép huy động các sản phẩm máu và các chất cầm máu như axit tranexamic đến đầu giường bệnh nhân. Axit tranexamic (dùng với liều tấn công 1g tiêm tĩnh mạch trong 10 phút, sau đó truyền tĩnh mạch 1g trong 8 giờ) được khuyến cáo là lựa chọn hỗ trợ cầm máu trong sốc mất máu. Nghiên cứu PROMMTT cho thấy việc sử dụng huyết tương và tiểu cầu ở tỷ lệ cao hơn trong hồi sức bệnh nhân bị sốc mất máu do chấn thương làm giảm tỷ lệ tử vong trong giai đoạn ngắn hạn.106 Những phát hiện này sau đó đã được xác nhận trong thử nghiệm lâm sàng ngẫu nhiên PROPPR, cho thấy những bệnh nhân được nhận huyết tương, tiểu cầu, và hồng cầu theo tỷ lệ 1:1:1 so với tỷ lệ 1:1:2 được cải thiện hơn về mặt cầm máu và ít tử vong hơn do mất máu trong 24 giờ.107 Các nghiên cứu CRASH-2 và MATTER đã chỉ ra rằng sử dụng axit tranexamic sớm cải thiện khả năng sống sót ở bệnh nhân chấn thương mất máu.108,109 Một thử nghiệm lâm sàng ngẫu nhiên gần đây (Thử nghiệm PATCH-Trauma) bao gồm 1310 người trưởng thành bị chấn thương nặng được đánh giá là có nguy cơ cao mắc rối loạn đông máu do chấn thương được phân bố ngẫu nhiên thành nhóm sử dụng axit tranexamic (được tiêm tĩnh mạch dưới dạng liều bolus 1 g trước khi nhập viện, sau đó truyền tĩnh mạch 1 g trong 8 giờ sau khi đến bệnh viện) và nhóm sử dụng giả dược trong các trung tâm chấn thương lớn.110 Tương tự như thử nghiệm CRASH-2, phân tích thứ cấp kết quả của thử nghiệm này cho thấy axit tranexamic cải thiện khả năng sống sót sau 24 giờ và 28 ngày sau chấn thương khi so sánh với giả dược. Tuy ra nhiên, câu hỏi về tiêu chí chính, việc sử dụng axit tranexamic không mang lại nhiều bệnh nhân sống sót với kết cục về mặt chức năng (favorable functional outcome) tốt hơn sau 6 tháng so với giả dược. Điều này có lẽ được giải thích bởi thực tế là axit tranexamic đã cứu được nhiều bệnh nhân nguy kịch hơn và bị mất chức năng/ tàn tật nặng nhiều hơn so với giả dược.
Dùng máu toàn phần để điều trị sốc mất máu có ưu điểm là có tất cả các thành phần của máu trong một túi. Sử dụng liệu pháp truyềnmáu từng phần để truyền số lượng lớn cần có nhiều túi để tạo ra tỷ lệ giống với máu toàn phần. Hơn nữa, việc theo dõi tỷ lệ chế phẩm như vậy trong quá trình truyền máu số lượng lớn làm tăng thêm sự phức tạp trong quản lý và tăng nguy cơ sai sót.111 Một thử nghiệm ngẫu nhiên khác đã chỉ ra rằng truyền máu toàn phần ở bệnh nhân sốc mất máu làm giảm lượng máu truyền khi so sánh với liệu pháp truyền máu từng phần.112 Gần đây hơn các nghiên cứu quan sát tiến cứu đã chỉ ra rằng truyền máu toàn phần không chỉ làm giảm việc sử dụng chế phẩm máu113 mà còn cải thiện tỷ lệ tử vong113,114 khi so sánh với liệu pháp truyền từng phần.
Theo truyền thống, việc sử dụng thuốc vận mạch trong sốc giảm thể tích không được khuyến khích do lo ngại làm xấu đi tình trạng tưới máu mô.109,115 Hai nghiên cứu hồi cứu gần đây đã chỉ ra rằng việc sử dụng sớm norepinephrine không ảnh hưởng đến tỷ lệ tử vong ở bệnh nhân chấn thương bị sốc mất máu.116,117 Hơn nữa, sốc mất máu thường liên quan đến tình trạng thiếu hụt Arginine vasopressin.118 Việc bổ sung vasopressin cho những bệnh nhân như vậy có thể hữu ích. Để giúp trả lời câu hỏi này, 2 thử nghiệm ngẫu nhiên có đối chứng cho thấy bệnh nhân chấn thương bị sốc dùng vasopressin so với giả dược cần tổng lượng dịch hồi sức119 và các chế phẩm máu ít hơn đáng kể,120 nhưng tỷ lệ tử vong là tương tự giữa các nhóm nghiên cứu trong cả hai thử nghiệm. Điều này trái ngược với hầu hết các nghiên cứu đoàn hệ hồi cứu trước đây, cho thấy rằng việc sử dụng thuốc vận mạch (bao gồm vasopressin)121 làm tăng tỷ lệ tử vong ở những bệnh nhân chấn thương bị sốc xuất huyết.122-124 Nhìn chung, thuốc vận mạch có vai trò hạn chế trong sốc giảm thể tích vì chúng không khắc phục vấn đề cơ bản của việc mất dịch. Nếu bệnh nhân bị hạ huyết áp đe dọa tính mạng không đáp ứng với các biện pháp khác (ví dụ như truyền dịch, kiểm soát chảy máu và truyền máu), thuốc vận mạch có thể được sử dụng để đạt mục tiêu huyết áp thấp ở mức cho phép (mục tiêu MAP là 50-60 mmHg).125 Vasopressin được sử dụng bằng cách bolus 4 đơn vị và sau đó truyền tĩnh mạch ≤0,04 đơn vị/phút có thể giúp đạt được mục tiêu hồi sức như vậy với ít nhu cầu dịch và/hoặc sản phẩm máu hơn.119,120 Cần nghiên cứu thêm để xác định xem liệu việc sử dụng thuốc vận mạch sớm (đặc biệt là vasopressin) ở bệnh nhân sốc mất máu có cải thiện tỷ lệ tử vong.
5 Sốc tắc nghẽn
Sốc tắc nghẽn ít phổ biến hơn nhiều so với các dạng sốc khác. Ở Đan Mạch, một nghiên cứu đoàn hệ trên dân số kéo dài 12 năm về sốc tuần hoàn cho thấy chỉ có 0,9% đối tượng nhập khoa cấp cứu vì sốc tắc nghẽn.126 Tuy nhiên, điều quan trọng là phải biết khi nào sốc tắc nghẽn có thể xảy ra vì nó có thể ảnh hưởng đến việc điều trị. Nhìn chung, mục tiêu chính của điều trị sốc tắc nghẽn là loại bỏ tắc nghẽn và phục hồi cung lượng tim. Tuy nhiên, liệu pháp truyền dịch và thuốc vận mạch có thể được sử dụng để kiểm soát sốc tắc nghẽn cho đến khi có thể tiếp cận được phương pháp điều trị đặc hiệu hơn.127
Việc sử dụng dịch tinh thể để hồi sức dịch được chỉ định cho sốc tắc nghẽn nếu nguyên nhân cơ bản của tắc nghẽn không thể điều trị được.128 Tuy nhiên, nếu nguyên nhân gây sốc tắc nghẽn là thuyên tắc phổi thì cần lưu ý rằng việc quá tải dịch có thể làm tình trạng sốc trở nên trầm trọng hơn vì truyền dịch qua đường tĩnh mạch có thể gây giãn thất phải dẫn đến giảm huyết áp.129 Nói chung, cần thận trọng khi truyền 500 đến 1000mL nước muối sinh lý trong trường hợp thuyên tắc phổi.130
Thuốc vận mạch được chỉ định nếu việc hồi sức dịch cho sốc tắc nghẽn được chứng minh trở nên không hiệu quả. Norepinephrine được coi là lựa chọn đầu tiên để điều trị, sau đó là việc bổ sung vasopressin.129 Một cân nhắc khác khi sử dụng thuốc vậnmạch để hỗ trợ bệnh nhân bị tắc mạch phổi hoặc tràn khí màng phổi áp lực là để ngăn ngừa tăng sức cản mạch máu phổi (pulmonary vascular resistance - PVR).128 Vasopressin không làm tăng sức cản mạch máu phổi như chất chủ vận α1 (ví dụ norepinephrine), có ích cho những bệnh nhân bị suy tim phải nặng.85,131 Một lựa chọn khác có thể được xem xét nếu vasopressin không hiệu quả là phenylephrine.130
Tùy thuộc vào nguyên nhân gây sốc tắc nghẽn, cách xử lý có thể khác nhau đáng kể. Ví dụ, bệnh nhân bị sốc tắc nghẽn do tắc nghẽn đường ra thất trái (ví dụ, bệnh cơ tim phì đại) có thể được hưởng lợi từ các thuốc co mạch đơn thuần như phenylephrine hoặc vasopressin vì việc tăng co bóp của tim do dùng norepinephrine có thể làm nặng thêm các triệu chứng tắc nghẽn đường ra.39,132 Tuy nhiên, điều quan trọng nhất là điều trị ở những bệnh nhân này là truyền dịch để hỗ trợ tiền tải dẫn đến tăng kích thước thất trái để giảm tắc nghẽn đường ra do giãn vòng van. Không giống như sốc tim, thuốc tăng co bóp cơ tim không có lợi trong việc kiểm soát sốc tắc nghẽn vì nguyên nhân cơ bản là do tắc nghẽn chứ không phải do rối loạn chức năng tim. Thuốc tăng co bóp có thể được sử dụng với dịch truyền tĩnh mạch với hy vọng tăng cung lượng tim tạm thời.128 Dopamine và dobutamine là những thuốc tăng co bóp thuận lợi trong sốc tắc nghẽn do tắc mạch phổi vì chúng làm tăng áp lực động mạch phổi ở mức độ thấp hơn so với tăng cung lượng tim.
6 Các thuốc co mạch và thuốc tăng co bóp mới
6.1 Levosimendan
Levosimendan (hiện không có ở Hoa Kỳ) liên kết với troponin C của tim để tăng độ nhạy cảm của tế bào cơ với canxi dẫn đến cải thiện co bóp cơ tim. Levosimendan cũng gây giãn mạch bằng cách mở các kênh Kali phụ thuộc ATP trong các tế bào cơ trơn mạch máu ngoại biên.85 Thuốc này có thể hữu ích trong việc giảm áp lực đổ đầy tim trong sốc tim, đặc biệt ở những bệnh nhân dùng thuốc chẹn beta.133
6.2 Angiotensin II
Angiotensin II hay Giapreza là một hormone peptide tổng hợp của con người liên kết với các thụ thể angiotensin-1 và -2 gây co mạch, giải phóng vasopressin và tổng hợp aldosterone.17 Giống như vasopressin, angiotensin II gây co mạch mà không có tác dụng tăng co bóp đáng kể. Thuốc này có thể hữu ích ở những bệnh nhân bị sốc phân bố kháng trị và có cung lượng tim phù hợp.33,133 Angiotensin II được truyền tĩnh mạch liên tục liều đầu ở mức 20 ng/kg/phút và có thể tăng liều mỗi 5 phút đến liều tối đa 80 ng/kg/phút trong 3 giờ đầu. Sau đó, có thể sử dụng liều duy trì từ 1,25 đến 40 ng/kg/phút trong tối đa 7 ngày.134,135
7 Tài liệu tham khảo
1. Smith N, Lopez RA, Silberman M. Distributive shock. In: StatPearls. StatPearls Publishing; 2023. Accessed July 30, 2023. http://www.ncbi.nlm.nih.gov/books/NBK470316/
2. Delong C, Sharma S. Physiology, peripheral vascular resistance. In: StatPearls. StatPearls Publishing; 2023. Accessed July 30, 2023. http://www.ncbi.nlm.nih.gov/books/NBK538308/
3. Taghavi S, Nassar AK, Askari R. Hypovolemic shock. In: StatPearls. StatPearls Publishing; 2023. Accessed December 1, 2023. http://www.ncbi.nlm.nih.gov/books/NBK513297/
4. Califf RM, Bengtson JR. Cardiogenic shock. N Engl J Med. 1994;330(24):1724-1730. doi:10.1056/NEJM199406163302406
5. Samsky MD, Morrow DA, Proudfoot AG, Hochman JS, Thiele H, Rao SV. Cardiogenic shock after acute myocardial infarction: a review. JAMA. 2021;326(18):1840-1850. doi:10.1001/jama. 2021.18323
6. Kosaraju A, Pendela VS, Hai O. Cardiogenic shock. In: StatPearls. StatPearls Publishing; 2023. Accessed December 5, 2023. http://www.ncbi.nlm.nih.gov/books/NBK482255/
7. Narayan S, Petersen TL. Uncommon etiologies of shock. Crit Care Clin. 2022;38(2):429-441. doi:10.1016/j.ccc.2021.11.009
8. Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315(8):801. doi:10.1001/jama.2016.0287
9. Vincent JL, De Backer D. Circulatory shock. N Engl J Med. 2013;369(18):1726-1734. doi:10.1056/NEJMra1208943
10. Joynes EL, Martin J, Ross M. Management of septic shock in the remote prehospital setting. Air Med J. 2016;35(4):235-238. doi:10.1016/j.amj.2016.04.001
11. Marik PE, Taeb AM. SIRS, qSOFA and new sepsis definition. J Thorac Dis. 2017;9(4):943-945. doi:10.21037/jtd.2017.03.125
12. Gauer R, Forbes D, Boyer N. Sepsis: diagnosis and management. Am Fam Physician. 2020;101(7):409-418.
13. Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021;47(11):1181- 1247. doi:10.1007/s00134-021-06506-y
14. Serafim R, Gomes JA, Salluh J, Póvoa P. A comparison of the quick-SOFA and systemic inflammatory response syndrome criteria for the diagnosis of sepsis and prediction of mortality: a systematic review and meta-analysis. Chest. 2018;153(3):646-655. doi:10.1016/j.chest.2017.12.015
15. Angus DC, Van Der Poll T. Severe sepsis and septic shock. N Engl J Med. 2013;369(9):840-851. doi:10.1056/NEJMra1208623
16. Balk RA. Severe sepsis and septic shock. Definitions, epidemiology, and clinical manifestations. Crit Care Clin. 2000;16(2):179-192. doi:10.1016/s0749-0704(05)70106-8
17. Russell JA. Vasopressor therapy in critically ill patients with shock. Intensive Care Med. 2019;45(11):1503-1517. doi:10.1007/s00134-019- 05801-z
18. Bentzer P, Griesdale DE, Boyd J, MacLean K, Sirounis D, Ayas NT. Will this hemodynamically unstable patient respond to a bolus of intravenous fluids? JAMA. 2016;316(12):1298-1309. doi:10.1001/jama.2016.12310
19. Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43(3):304-377. doi:10.1007/s00134-017-4683-6
20. Permpikul C, Tongyoo S, Viarasilpa T, Trainarongsakul T, Chakorn T, Udompanturak S. Early use of norepinephrine in septic shock resuscitation (CENSER). A randomized trial. Am J Respir Crit Care Med. 2019;199(9):1097-1105. doi:10.1164/rccm.201806-1034OC
21. Ospina-Tascón GA, Hernandez G, Alvarez I, et al. Effects of very early start of norepinephrine in patients with septic shock: a propensity score-based analysis. Crit Care Lond Engl. 2020;24(1):52. doi:10.1186/s13054-020-2756-3
22. Vincent JL, Sakr Y, Sprung CL, et al. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med. 2006;34(2):344-353. doi:10.1097/01.ccm.0000194725.48928.3a
23. Carlos Sanchez E, Pinsky MR, Sinha S, Mishra RC, Lopa AJ, Chatterjee R. Fluids and early vasopressors in the management of septic shock: do we have the right answers yet? J Crit Care Med Univ Med Si Farm Din Targu-Mures. 2023;9(3):138-147. doi:10.2478/jccm-2023-0022
24. George JF, Hamzaoui O, Chaari A, Maizel J, Richard C, Teboul JL. Restoring arterial pressure with norepinephrine improves muscle tissue oxygenation assessed by near-infrared spectroscopy in severely hypotensive septic patients. Intensive Care Med. 2010;36(11):1882-1889. doi:10.1007/s00134-010- 2013-3
25. The National Heart, Lung, and Blood Institute Prevention and Early Treatment of Acute Lung Injury Clinical Trials Network. Early restrictive or liberal fluid management for sepsis-induced hypotension. N Engl J Med. 2023;388(6):499-510. doi:10.1056/NEJMoa2212663
26. De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med. 2010;362(9):779- 789. doi:10.1056/NEJMoa0907118
27. De Backer D, Aldecoa C, Njimi H, Vincent JL. Dopamine versus norepinephrine in the treatment of septic shock: a metaanalysis*. Crit Care Med. 2012;40(3):725-730. doi:10.1097/ CCM.0b013e31823778ee
28. Avni T, Lador A, Lev S, Leibovici L, Paul M, Grossman A. Vasopressors for the treatment of septic shock: systematic review and meta-analysis. PLoS One. 2015;10(8):e0129305. doi:10.1371/journal.pone.0129305
29. Jentzer JC, Coons JC, Link CB, Schmidhofer M. Pharmacotherapy update on the use of vasopressors and inotropes in the intensive care unit. J Cardiovasc Pharmacol Ther. 2015;20(3):249-260. doi:10. 1177/1074248414559838
30. Jouffroy R, Hajjar A, Gilbert B, et al. Prehospital norepinephrine administration reduces 30-day mortality among septic shock patients. BMC Infect Dis. 2022;22(1):345. doi:10.1186/s12879-022- 07337-y
31. Saad AF, Maybauer MO. The role of vasopressin and the vasopressin type V1a receptor agonist selepressin in septic shock. J Crit Care. 2017;40:41- 45. doi:10.1016/j.jcrc.2017.03.008
32. Russell JA, Walley KR, Singer J, et al. Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med. 2008;358(9):877-887. doi:10.1056/NEJMoa067373
33. Jentzer JC, Hollenberg SM. Vasopressor and inotrope therapy in cardiac critical care. J Intensive Care Med. 2021;36(8):843-856. doi:10.1177/0885066620917630
34. Polito A, Parisini E, Ricci Z, Picardo S, Annane D. Vasopressin for treatment of vasodilatory shock: an ESICM systematic review Mergoum et al 9 and meta-analysis. Intensive Care Med. 2012;38(1):9-19. doi:10. 1007/s00134-011-2407-x
35. Xu J, Cai H, Zheng X. Timing of vasopressin initiation and mortality in patients with septic shock: analysis of the MIMIC-III and MIMIC-IV databases. BMC Infect Dis. 2023;23(1):199. doi:10. 1186/s12879-023-08147-6
36. Kanter J, DeBlieux P. Pressors and inotropes. Emerg Med Clin North Am. 2014;32(4):823-834. doi:10.1016/j.emc.2014.07.006
37. Bangash MN, Kong ML, Pearse RM. Use of inotropes and vasopressor agents in critically ill patients. Br J Pharmacol. 2012;165(7):2015-2033. doi:10.1111/j.1476-5381.2011.01588.x
38. Ellender TJ, Skinner JC. The use of vasopressors and inotropes in the emergency medical treatment of shock. Emerg Med ClinNorth Am. 2008;26(3):759- 786, ix. doi:10.1016/j.emc.2008.04.001
39. Hu K, Mathew R. Inotrope and vasopressor use in cardiogenic shock: what, when and why? Curr Opin Crit Care. 2022;28(4):419-425. doi:10.1097/MCC.0000000000000957
40. Phad N, de Waal K. What inotrope and why? Clin Perinatol. 2020;47(3):529-547. doi:10.1016/j.clp.2020.05.010
41. Majure DT, Teerlink JR. Update on the management of acute decompensated heart failure. Curr Treat Options CardiovascMed. 2011;13(6):570- 585. Published online October 6, 2011. doi:10.1007/s11936-011-0149-2
42. Löllgen H, Drexler H. Use of inotropes in the critical care setting. Crit Care Med. 1990;18(1 Pt 2):S56-S60.
43. Levy B, Gibot S, Franck P, Cravoisy A, Bollaert PE. Relation between muscle Na + K+ ATPase activity and raised lactate concentrations in septic shock: a prospective study. Lancet Lond Engl. 2005;365(9462):871-875. doi:10.1016/S0140- 6736(05)71045-X
44. Garvey AA, Kooi EMW, Dempsey EM. Inotropes for preterm infants: 50 years on are we any wiser? Front Pediatr. 2018;6:88. doi:10.3389/fped.2018.00088
45. Feldman R, Stanton M, Chinn M, Grawey T, Weston B. Choosing a vasopressor for a prehospital emergency medical system: consideration for agent selection and review of pharmacologic profiles, efficacy, and safety in treatment of shock. WMJ Off Publ State Med Soc Wis. 2020;119(4):240-247.
46. Oczkowski S, Alshamsi F, Belley-Cote E, et al. Surviving sepsis campaign guidelines 2021: highlights for the practicing clinician. Pol Arch Intern Med. 2022;132(7-8):16290. doi:10.20452/pamw.16290
47. Lewis T, Merchan C, Altshuler D, Papadopoulos J. Safety of the peripheral administration of vasopressor agents. J Intensive Care Med. 2019;34(1):26-33. doi:10.1177/0885066616686035
48. Medlej K, Kazzi AA, El Hajj Chehade A, et al. Complications from administration of vasopressors through peripheral venous catheters: an observational study. J Emerg Med. 2018;54(1):47- 53. doi:10. 1016/j.jemermed.2017.09.007
49. Cardenas-Garcia J, Schaub KF, Belchikov YG, Narasimhan M, Koenig SJ, Mayo PH. Safety of peripheral intravenous administration of vasoactive medication. J Hosp Med. 2015;10(9):581- 585. doi:10.1002/jhm.2394
50. Hamzaoui O, Goury A, Teboul JL. The eight unanswered and answered questions about the use of vasopressors in septic shock. J Clin Med. 2023;12(14):4589. doi:10.3390/jcm12144589
51. Charbel RC, Ollier V, Julliand S, et al. Safety of early norepinephrine infusion through peripheral vascular access during transport of critically ill children. J Am Coll Emerg Physicians Open. 2021;2(2):e12395. doi:10.1002/emp2.12395
52. Wang TY, Park C, Zhang H, et al. Management of acute traumatic spinal cord injury: a review of the literature. Front Surg. 2021;8:698736. doi:10.3389/fsurg.2021.698736
53. Yue JK, Tsolinas RE, Burke JF, et al. Vasopressor support inmanaging acute spinal cord injury: current knowledge. J Neurosurg Sci. 2019;63(3):308-317. doi:10.23736/ S0390-5616.17.04003-6
54. Agarwal N, Faramand A, Alan N, et al. Lateral lumbar interbody fusion in the elderly: a 10-year experience. J Neurosurg Spine. 2018;29(5):525-529. doi:10.3171/2018.3.SPINE171147
55. Guha A, Tator CH, Rochon J. Spinal cord blood flow and systemic blood pressure after experimental spinal cord injury in rats. Stroke. 1989;20(3):372- 377. doi:10.1161/01.str.20.3.372
56. Altaf F, Griesdale DE, Belanger L, et al. The differential effects of norepinephrine and dopamine on cerebrospinal fluid pressure and spinal cord perfusion pressure after acute human spinal cord injury. Spinal Cord. 2017;55(1):33-38. doi:10.1038/sc.2016.79
57. Menacho ST, Floyd C. Current practices and goals for mean arterial pressure and spinal cord perfusion pressure in acute traumatic spinal cord injury: defining the gaps in knowledge. J Spinal Cord Med. 2021;44(3):350-356. doi:10.1080/10790268.2019.1660840
58. Saadeh YS, Smith BW, Joseph JR, et al. The impact of bloodpressure management after spinal cord injury: a systematic review of the literature. Neurosurg Focus. 2017;43(5):E20. doi:10.3171/2017.8.FOCUS17428
59. Consortium for Spinal Cord Medicine. Early acute managementin adults with spinal cord injury: a clinical practice guideline forhealth-care professionals. J Spinal Cord Med. 2008;31(4):403- 479. doi:10.1043/1079-0268-31.4.408
60. Walters BC, Hadley MN, Hurlbert RJ, et al. Guidelines for themanagement of acute cervical spine and spinal cord injuries: 2013 update. Neurosurgery. 2013;60(CN_suppl_1):82-91. doi:10.1227/01.neu.0000430319.32247.7f
61. Gee CM, Tsang A, Bélanger LM, et al. All over the MAP:Describing pressure variability in acute spinal cord injury. SpinalCord. 2022;60(5):470-475. doi:10.1038/s41393-022-00802-0
62. Dakson A, Brandman D, Thibault-Halman G, Christie SD.Optimization of the mean arterial pressure and timing of surgicaldecompression in traumatic spinal cord injury: a retrospectivestudy. Spinal Cord. 2017;55(11):1033-1038. doi:10.1038/sc.2017.52
63. Hawryluk G, Whetstone W, Saigal R, et al. Mean arterial bloodpressure correlates with neurological recovery after human spinalcord injury: analysis of high frequency physiologic data.J Neurotrauma. 2015;32(24):1958-1967. doi:10.1089/neu.2014.3778
64. Agarwal N, Blitstein J, Lui A, et al. Hypotension requiring vasopressor treatment and increased cardiac complications in elderlyspinal cord injury patients: a prospective TRACK-SCI registrystudy. J Neurosurg Spine. 2023:1-9. Published online March17, 2023. doi:10.3171/2023.2.SPINE221043
65. Readdy WJ, Whetstone WD, Ferguson AR, et al. Complicationsand outcomes of vasopressor usage in acute traumatic centralcord syndrome. J Neurosurg Spine. 2015;23(5):574- 580.doi:10.3171/2015.2.SPINE14746
66. Inoue T, Manley GT, Patel N, Whetstone WD. Medical and surgical management after spinal cord injury: vasopressor usage,early surgeries, and complications. J Neurotrauma.2014;31(3):284-291. doi:10.1089/neu.2013.3061
67. Palma JA, Kaufmann H. Management of orthostatic hypotension. Contin Minneap Minn. 2020;26(1):154-177. doi:10.1212/CON.0000000000000816
68. Sekar A, Datta D, Lakha A, Jena SS, Bansal S, Sahu RN. Oralmidodrine as an adjunct in rapid weaning of intravenous vasopressor support in spinal cord injury. Asian J Neurosurg.2023;18(2):306-311. doi:10.1055/s- 0043-176975510 Journal of Intensive Care Medicine 0(0)
69. Hong CS, Effendi MK, Ammar AA, et al. Use of droxidopa forblood pressure augmentation after acute spinal cord injury: casereports. Acute Crit Care. 2022. Published online December 7,2022. doi:10.4266/acc.2021.01662
70. Brown SGA. Clinical features and severity grading of anaphylaxis. J Allergy Clin Immunol. 2004;114(2):371-376. doi:10.1016/j.jaci.2004.04.029
71. Sampson HA, Muñoz-Furlong A, Campbell RL, et al. Second symposium on the definition and management of anaphylaxis: summaryreport- second National Institute of Allergy and Infectious Disease/ Food Allergy and Anaphylaxis Network symposium. J Allergy ClinImmunol. 2006;117(2):391-397. doi:10.1016/j.jaci.2005.12.1303
72. Whiteside M, Fletcher A. Anaphylactic shock: no time to think.J R Coll Physicians Edinb. 2010;40(2):145-147; quiz 148.doi:10.4997/JRCPE.2010.210
73. Brown SGA. The pathophysiology of shock in anaphylaxis.Immunol Allergy Clin North Am. 2007;27(2):165-175. doi:10.1016/j.iac.2007.03
74. Pumphrey RS. Lessons for management of anaphylaxis from a studyof fatal reactions. Clin Exp Allergy J Br Soc Allergy Clin Immunol.2000;30(8):1144-1150. doi:10.1046/j.1365-2222.2000.00864.x
75. Fisher M. Treating anaphylaxis with sympathomimetic drugs. BrMed J. 1992;305(6862):1107-1108. doi:10.1136/bmj.305.6862.1107
76. McHugh K, Repanshek Z. Anaphylaxis: emergency departmenttreatment. Emerg Med Clin North Am. 2022;40(1):19-32. doi:10.1016/j.emc.2021.08.004
77. Thomas M, Crawford I. Best evidence topic report. Glucagon infusionin refractory anaphylactic shock in patients on beta-blockers. EmergMed J EMJ. 2005;22(4):272-273. doi:10.1136/emj.2005.023507
78. Campbell RL, Li JTC, Nicklas RA, Sadosty AT, Members of theJoint Task Force, Practice Parameter Workgroup. Emergency department diagnosis and treatment of anaphylaxis: a practice parameter.Ann Allergy Asthma Immunol Off Publ Am Coll Allergy AsthmaImmunol. 2014;113(6):599-608. doi:10.1016/j.anai.2014.10.007
79. Aves T, Chopra A, Patel M, Lin S. Epinephrine forout-of-hospital cardiac arrest: an updated systematic reviewand meta-analysis. Crit Care Med. 2020;48(2):225-229. doi:10.1097/CCM.0000000000004130
80. Finn J, Jacobs I, Williams TA, Gates S, Perkins GD. Adrenaline andvasopressin for cardiac arrest. Cochrane Database Syst Rev.2019;2019(1):CD003179. doi:10.1002/14651858.CD003179.pub2
81. Fernando SM, Mathew R, Sadeghirad B, et al. Epinephrine in out-of-hospital cardiac arrest: a network meta- analysis and subgroup analyses of shockable and nonshockable rhythms. Chest.2023;164(2):381- 393. doi:10.1016/j.chest.2023.01.033
82. Smida T, Menegazzi JJ, Crowe RP, Weiss LS, Salcido DD.Association of prehospital hypotension depth and dose with survival following out-of- hospital cardiac arrest. Resuscitation. 2022;180:99- 107. doi:10.1016/j.resuscitation.2022.09.018
83. Wender ER, Counts CR, Van Dyke M, Sayre MR, Maynard C,Johnson NJ. Prehospital administration of norepinephrine andepinephrine for shock after resuscitation from cardiac arrest.Prehosp Emerg Care. 2023:1-6. Published online September14, 2023. doi:10.1080/10903127.2023.2252500
84. Bougouin W, Slimani K, Renaudier M, et al. Epinephrine versusnorepinephrine in cardiac arrest patients with post-resuscitationshock. Intensive Care Med. 2022;48(3):300-310. doi:10.1007/s00134-021-06608-7
85. De Backer D, Arias Ortiz J, Levy B. The medical treatment ofcardiogenic shock: cardiovascular drugs. Curr Opin Crit Care.2021;27(4):426-432. doi:10.1097/MCC.0000000000000822
86. Léopold V, Gayat E, Pirracchio R, et al. Epinephrine and shortterm survival in cardiogenic shock: an individual data metaanalysis of 2583 patients. Intensive Care Med. 2018;44(6):847-856. doi:10.1007/s00134-018-5222-9
87. Levy B, Clere-Jehl R, Legras A, et al. Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction.J Am Coll Cardiol. 2018;72(2):173-182. doi:10.1016/j.jacc.2018.04.051
88. Rui Q, Jiang Y, Chen M, Zhang N, Yang H, Zhou Y. Dopamineversus norepinephrine in the treatment of cardiogenic shock: aPRISMA-compliant meta- analysis. Medicine (Baltimore).2017;96(43):e8402. doi:10.1097/MD.0000000000008402
89. Whitehurst VE, Vick JA, Alleva FR, Zhang J, Joseph X, BalazsT. Reversal of Propranolol blockade of adrenergic receptors andrelated toxicity with drugs that increase cyclic AMP. Proc SocExp Biol Med Soc Exp Biol Med N Y N. 1999;221(4):382- 385.doi:10.1046/j.1525-1373.1999.d01-96.x
90. Colucci WS, Wright RF, Jaski BE, Fifer MA, Braunwald E.Milrinone and dobutamine in severe heart failure: differinghemodynamic effects and individual patient responsiveness.Circulation. 1986;73(3 Pt 2):III175-III183.
91. Mathew R, Di Santo P, Jung RG, et al. Milrinone as comparedwith dobutamine in the treatment of cardiogenic shock. N EnglJ Med. 2021;385(6):516- 525. doi:10.1056/NEJMoa2026845
92. Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenicshock. SHOCK investigators. Should we emergently revascularize occluded coronaries for cardiogenic shock. N Engl J Med.1999;341(9):625-634. doi:10.1056/NEJM199908263410901
93. Cannon JW. Hemorrhagic shock. N Engl J Med. 2018;378(4):370-379. doi:10.1056/NEJMra1705649
94. Maegele M, Lefering R, Yucel N, et al. Early coagulopathy in multiple injury: an analysis from the German trauma registryon 8724 patients. Injury. 2007;38(3):298- 304. doi:10.1016/j.injury.2006.10.003
95. Cosgriff N, Moore EE, Sauaia A, Kenny-Moynihan M, BurchJM, Galloway B. Predicting life-threatening coagulopathy inthe massively transfused trauma patient: hypothermia and acidoses revisited. J Trauma. 1997;42(5):857-861; discussion861-862. doi:10.1097/00005373-199705000-00016
96. Ferrara A, MacArthur JD, Wright HK, Modlin IM, McMillen MA.Hypothermia and acidosis worsen coagulopathy in the patientrequiring massive transfusion. Am J Surg. 1990;160(5):515- 518.doi:10.1016/s0002-9610(05)81018-9
97. Owens TM, Watson WC, Prough DS, Uchida T, Kramer GC.Limiting initial resuscitation of uncontrolled hemorrhagereduces internal bleeding and subsequent volume requirements.J Trauma. 1995;39(2):200-207; discussion 208-209. doi:10.1097/00005373-199508000-00004
98. Bickell WH, Wall MJ, Pepe PE, et al. Immediate versus delayedfluid resuscitation for hypotensive patients with penetrating torsoinjuries. N Engl J Med. 1994;331(17):1105-1109. doi:10.1056/ NEJM199410273311701
99. Cotton BA, Jerome R, Collier BR, et al. Guidelines for prehospital fluid resuscitation in the injured patient. J Trauma.2009;67(2):389-402. doi:10.1097/TA.0b013e3181a8b26f
100. Tisherman SA, Schmicker RH, Brasel KJ, et al. Detailed description of all deaths in both the shock and traumatic brain injuryhypertonic saline trials of the Resuscitation OutcomesConsortium. Ann Surg. 2015;261(3):586-590. doi:10.1097/SLA.0000000000000837Mergoum et al 11
101. Kobayashi L, Costantini TW, Coimbra R. Hypovolemic shockresuscitation. Surg Clin North Am. 2012;92(6):1403- 1423.doi:10.1016/j.suc.2012.08.006
102. Shackelford SA, Del Junco DJ, Powell-Dunford N, et al.Association of prehospital blood product transfusion duringmedical evacuation of combat casualties in Afghanistan withacute and 30-day survival. JAMA. 2017;318(16):1581- 1591.doi:10.1001/jama.2017.15097
103. Sperry JL, Guyette FX, Brown JB, et al. Prehospital plasmaduring air medical transport in trauma patientsat risk for hemorrhagic shock. N Engl J Med. 2018;379(4):315-326. doi:10.1056/NEJMoa1802345
104. Guyette FX, Sperry JL, Peitzman AB, et al. Prehospital blood productand crystalloid resuscitation in theseverely injured patient: a secondary analysis of the prehospital air medical plasma trial. Ann Surg.2021;273(2):358-364. doi:10.1097/SLA.0000000000003324
105. Crombie N, Doughty HA, Bishop JRB, et al. Resuscitation withblood products in patients with trauma-related haemorrhagicshock receiving prehospital care (RePHILL): a multicentre, openlabel, randomised,controlled, phase 3 trial. Lancet Haematol.2022;9(4):e250-e261. doi:10.1016/S2352-3026(22)00040-0
106. Holcomb JB, Del Junco DJ, Fox EE, et al. The prospective, observational, multicenter, major traumatransfusion (PROMMTT) study:comparative effectiveness of a time-varying treatment with competingrisks. JAMA Surg. 2013;148(2):127. doi:10.1001/2013.jamasurg.387
107. Holcomb JB, Tilley BC, Baraniuk S, et al. Transfusion of plasma,platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortalityin patients with severe trauma: the PROPPR randomized clinicaltrial. JAMA. 2015;313(5):471. doi:10.1001/jama.2015.12
108. Morrison JJ. Military application of Tranexamic acid in traumaemergency resuscitation (MATTERs) study. Arch Surg.2012;147(2):113. doi:10.1001/archsurg.2011.287
109. Roberts I, Shakur H, Coats T, et al. The CRASH- 2 trial: a randomised controlled trial and economicevaluation of the effects oftranexamic acid on death, vascular occlusive events and transfusion requirement in bleeding trauma patients. Health TechnolAssess Winch Engl. 2013;17(10):1-79. doi:10.3310/hta17100
110. The PATCH-Trauma Investigators and the ANZICS Clinical TrialsGroup. Prehospital tranexamic acid for severe trauma. N Engl JMed. 2023;389(2):127-136. doi:10.1056/NEJMoa2215457
111. Holcomb JB, Jenkins DH. Get ready: whole blood is back andit’s good for patients. Transfusion (Paris). 2018;58(8):1821-1823. doi:10.1111/trf.14818
112. Cotton BA, Podbielski J, Camp E, et al. A randomized controlledpilot trial of modified whole blood versus component therapy inseverely injured patients requiring large volume transfusions.Ann Surg. 2013;258(4):527-532; discussion 532-533. doi:10.1097/SLA.0b013e3182a4ffa0
113. Brill JB, Tang B, Hatton G, et al. Impact of incorporating wholeblood into hemorrhagic shock resuscitation: analysis of 1,377 consecutive trauma patients receiving emergency-release uncrossmatched blood products. J Am Coll Surg. 2022;234(4):408- 418.doi:10.1097/XCS.0000000000000086
114. Hazelton JP, Ssentongo AE, Oh JS, et al. Use of cold-storedwhole blood is associated with improved mortality in hemostaticresuscitation of major bleeding: a multicenter study. Ann Surg.2022;276(4):579-588. doi:10.1097/SLA.0000000000005603
115. Nordin AJ, Mäkisalo H, Höckerstedt KA. Failure of dobutamineto improve liver oxygenation during resuscitation with a crystalloid solution after experimental haemorrhagic shock. Eur J SurgActa Chir. 1996;162(12):973-979.
116. Gauss T, Richards JE, Tortù C, et al. Association of earlynorepinephrine administration with 24-hour mortalityamong patients with blunt trauma and hemorrhagic shock.JAMA Netw Open. 2022;5(10):e2234258. doi:10.1001/jamanetworkopen.2022.34258
117. Gauss T, Gayat E, Harrois A, et al. Effect of early use of Noradrenaline on in-hospital mortality in haemorrhagic shock aftermajor trauma: a propensity-score analysis. Br J Anaesth.2018;120(6):1237-1244. doi:10.1016/j.bja.2018.02.032
118. Morales D, Madigan J, Cullinane S, et al. Reversal by vasopressin of intractable hypotension in the late phase of hemorrhagic shock. Circulation. 1999;100(3):226-229. doi:10.1161/01.cir.100.3.226
119. Cohn SM, McCarthy J, Stewart RM, Jonas RB, Dent DL,Michalek JE. Impact of low-dose vasopressin on traumaoutcome: prospective randomized study. World J Surg.2011;35(2):430- 439. doi:10.1007/s00268-010-0875-8
120. Sims CA, Holena D, Kim P, et al. Effect of low- dose supplementation of arginine vasopressin on need for blood product transfusions in patients with trauma and hemorrhagic shock: arandomized clinical trial. JAMA Surg. 2019;154(11):994- 1003.doi:10.1001/jamasurg.2019.2884
121. Collier B, Dossett L, Mann M, et al. Vasopressin use is associatedwith death in acute trauma patients with shock. J Crit Care.2010;25(1):173.e9-173.e14. doi:10.1016/j.jcrc.2009.05.003
122. Plurad DS, Talving P, Lam L, Inaba K, Green D, DemetriadesD. Early vasopressor use in critical injury is associated withmortality independent from volume status. J Trauma.2011;71(3):565-570; discussion 570-572. doi:10.1097/TA.0b013e3182213d52
123. Aoki M, Abe T, Saitoh D, Hagiwara S, Oshima K. Use of vasopressor increases the risk of mortality in traumatic hemorrhagic shock: anationwide cohort study in Japan. Crit Care Med. 2018;46(12):e1145- e1151. doi:10.1097/CCM.0000000000003428
124. Fisher AD, April MD, Cunningham C, Schauer SG. Prehospitalvasopressor use is associated with worse mortality in combatwounded. Prehosp Emerg Care. 2021;25(2):268-273. doi:10.1080/10903127.2020.1737280
125. Spahn DR, Bouillon B, Cerny V, et al. The European guidelineon management of major bleeding and coagulopathy followingtrauma: fifth edition. Crit Care Lond Engl. 2019;23(1):98.doi:10.1186/s13054-019-2347-3
126. Gitz Holler J, Jensen HK, Henriksen DP, et al. Etiology of shockin the emergency department: a 12- year population-based cohortstudy. Shock Augusta Ga. 2019;51(1):60-67. doi:10.1097/SHK.0000000000000816
127. Jha A, Zilahi G, Rhodes A. Vasoactive therapy in shock. BJAEduc. 2021;21(7):270-277. doi:10.1016/j.bjae.2021.03.002
128. Zotzmann V, Rottmann FA, Müller-Pelzer K, Bode C, WengenmayerT, Staudacher DL. Obstructive shock, from diagnosis to treatment. RevCardiovasc Med. 2022;23(7):248. doi:10.31083/j.rcm2307248
129. Vyas V, Goyal A. Acute pulmonary embolism. In: StatPearls.StatPearls Publishing; 2023. Accessed December 5, 2023.http://www.ncbi.nlm.nih.gov/books/NBK5605 51/
130. Kucher N, Goldhaber SZ. Management of massive pulmonaryembolism. Circulation. 2005;112(2):e28-e32. doi:10.1161/CIRCULATIONAHA.105.551374
131. Wallace AW, Tunin CM, Shoukas AA. Effects of vasopressin on pulmonary and systemic vascular mechanics. Am JPhysiol. 1989;257(4 Pt 2):H1228- H1234. doi:10.1152/ajpheart.1989.257.4.H122812 Journal of Intensive Care Medicine 0(0)
132. van Diepen S, Katz JN, Albert NM, et al. Contemporary management of cardiogenic shock: a scientific statement from theAmerican Heart Association. Circulation. 2017;136(16):e232-e268. doi:10.1161/CIR.0000000000000525
133. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC guidelines forthe diagnosis and treatment of acute and chronic heart failure. EurHeart J. 2021;42(36):3599-3726. doi:10.1093/eurheartj/ehab368
134. Khanna A, English SW, Wang XS, et al. Angiotensin II for the treatment of vasodilatory shock. N Engl J Med. 2017;377(5):419- 430.doi:10.1056/NEJMoa1704154
135. Angiotensin II. Dosing and indications. In: Columbia BasinCollege Library, ed. Micromedex [Electronic version]. TruvenHealth Analytics; 2023. Accessed December, 2023. http:// www.micromedexsolutions.com/.

