Hướng dẫn siêu âm đánh giá tim thai và cách đại động mạch

CHƯƠNG 11: TIM VÀ CÁC ĐẠI ĐỘNG MẠCH, trang 359 - 425
Biên dịch: BS Vũ Tài
Tải PDF TẠI ĐÂY
1 GIỚI THIỆU
Siêu âm tim thai quý 1 thường tập trung vào việc đánh giá situs cơ thể, 4 buồng tim và các đại động mạch nhằm xác nhận giải phẫu bình thường và loại trừ các dị tật tim bẩm sinh phức tạp (CHD). Nhiều CHD có thể được phát hiện trong ba tháng đầu thai kỳ và sẽ được thảo luận trong chương này. Siêu âm tim thai quý 1 cũng có thể đánh giá các "marker" gián tiếp như hở van ba lá (TR), trục tim bất thường hoặc động mạch dưới đòn phải lạc chỗ (ARSA), và có thể là dấu hiệu gợi ý CHD hoặc lệch bội thai nhi (fetal aneuploidy). Siêu âm đánh giá tim thai và các đại động mạch có thể là một thách thức trong ba tháng đầu thai kỳ vì cần phải có hình ảnh siêu âm 2D thang xám độ phân giải cao và Doppler màu và thường cũng cần phải kết hợp siêu âm qua ngả bụng và âm đạo. Trong chương này, phần phôi thai học của tim sẽ được thảo luận đầu tiên cùng với giải phẫu tim thai bình thường trên siêu âm. Sau đó, các dị tật tim thai khác nhau có thể phát hiện được trong tam cá nguyệt thứ nhất cũng sẽ được trình bày. Để hiểu rõ hơn về các kỹ thuật siêu âm tim thai, các đặc điểm của tim thai bình thường và bất thường, chúng tôi xin giới thiệu cuốn sách Practical Guide to Fetal Echocardiography: Normal and Abnormal Hearts.
2 PHÔI THAI HỌC
Phổ dị tật tim bẩm sinh rất rộng và muốn hiểu rõ hơn thì phải có kiến thức cơ bản về phôi học tim.
Đầu tuần thứ 3 sau khi thụ thai, các cụm tế bào tim tiền thân tạo mạch (angiogenic cardiac precursor cells) phát triển ở trung bì lá tạng bên (lateral splanchnic mesoderm) và di cư về phía trước đường giữa để sáp nhập thành ống tim duy nhất (single heart tube). Có thể thấy nhịp đập của ống tim lần đầu tiên vào khoảng ngày 21 đến 22 sau khi thụ thai (ngày 35 đến 36 tuổi kinh nguyệt, cuối tuần thai thứ 5).
Tim phát triển theo các bước chính được xác định rõ ràng, cụ thể là (1) hình thành ống tim nguyên thủy (primitive heart tube); (2) tạo ra quai tim từ ống tim (looping of the heart tube); và (3) tạo vách ngăn tâm nhĩ, tâm thất và các đường ra (Hình 11.1). Ở ống tim nguyên thủy, đầu dưới kết nối với tĩnh mạch rốn-noãn hoàng (vitello-umbilical veins) và đầu trên kết nối với động mạch chủ lưng (dorsal aortae) và cung họng (pharyngeal arches), và cho thấy các vùng gấp nếp chuyển tiếp (transitional folding zones) chẳng hạn như nếp gấp sơ cấp (primary fold) ở cực động mạch và vòng nhĩ thất (AV) ở cực tĩnh mạch (Hình 11.1). Các vùng chuyển tiếp này sau đó tạo thành vách ngăn và van tim. Hình 11.1 minh họa các bước phát triển này.
Với sự tạo quai và phình ra, tâm thất nguyên thủy (primitive ventricle) di chuyển xuống dưới, sang phải, trong khi tâm nhĩ nguyên thủy di chuyển lên trên và sang trái so với tâm thất nguyên thủy. Trong quai tim này và ở các vị trí khác nhau, có các vách ngăn để phân biệt 2 tâm nhĩ, 2 tâm thất, 2 van AV và 2 đường ra riêng biệt. Cặp động mạch cánh tay (paired branchial arteries) với hai động mạch chủ dần dần thoái triển, dẫn đến cung động mạch chủ trái với các nhánh tương ứng. Về phía tĩnh mạch, các cặp tĩnh mạch khác nhau thoái triển và hợp nhất tạo thành hệ thống tĩnh mạch chủ (systemic venous system) với các tĩnh mạch gan, tĩnh mạch chủ trên và tĩnh mạch chủ dưới.
Tâm nhĩ nguyên thủy (primitive atrium) bị chia thành hai bởi sự hình thành của hai vách ngăn, đó là vách nguyên phát (septum primum) và vách thứ phát (septum secundum). Cả hai vách ngăn đều hợp nhất ngoại trừ lỗ nguyên phát (foramen primum) vẫn mở và trở thành lỗ bầu dục với dòng máu chảy từ tâm nhĩ phải sang tâm nhĩ trái. Sự hình thành vách ngăn tâm thất phức tạp hơn, bao gồm sự hợp nhất các vách ngăn của các vùng không gian khác nhau của tim (vách liên thất, vách ngăn phần nhận (inlet septum) và vách ngăn phần nón (conal septum)), điều này giải thích cho việc thông liên thất (VSD) cho đến nay vẫn là bất thường tim phổ biến nhất (đơn độc và kết hợp). Sự hình thành vách ngăn đường ra bao gồm quá trình xoay xoắn ốc (spiral rotation) gần 180°, dẫn đến tạo thành vách ngăn động mạch chủ-phổi dạng xoắn ốc.
Vách ngăn này, là kết quả của sự hợp nhất hoàn toàn của mào hành tim và mào thân động mạch (bulbus and truncus ridges), chia đường ra thành 2 động mạch, động mạch chủ và động mạch phổi. Do vách ngăn này có dạng xoắn ốc nên động mạch phổi dường như xoắn quanh động mạch chủ lên. Quá trình phát triển của hành tim chịu trách nhiệm tích hợp các đại động mạch vào bên trong tâm thất tương ứng của chúng. Ở tâm thất phải, hành tim là nón động mạch và đó là phần phễu và ở tâm thất trái, hành tim tạo thành các thành của tiền đình động mạch chủ (aortic vestibule), dẫn đến sự liên tục động mạch chủ-vách liên thất và van hai lá-van động mạch chủ.
Để biết thêm chi tiết về quá trình tạo phôi tim, chúng tôi khuyên bạn nên tìm đọc các sách chuyên khảo và bài báo tổng quan về chủ đề này.
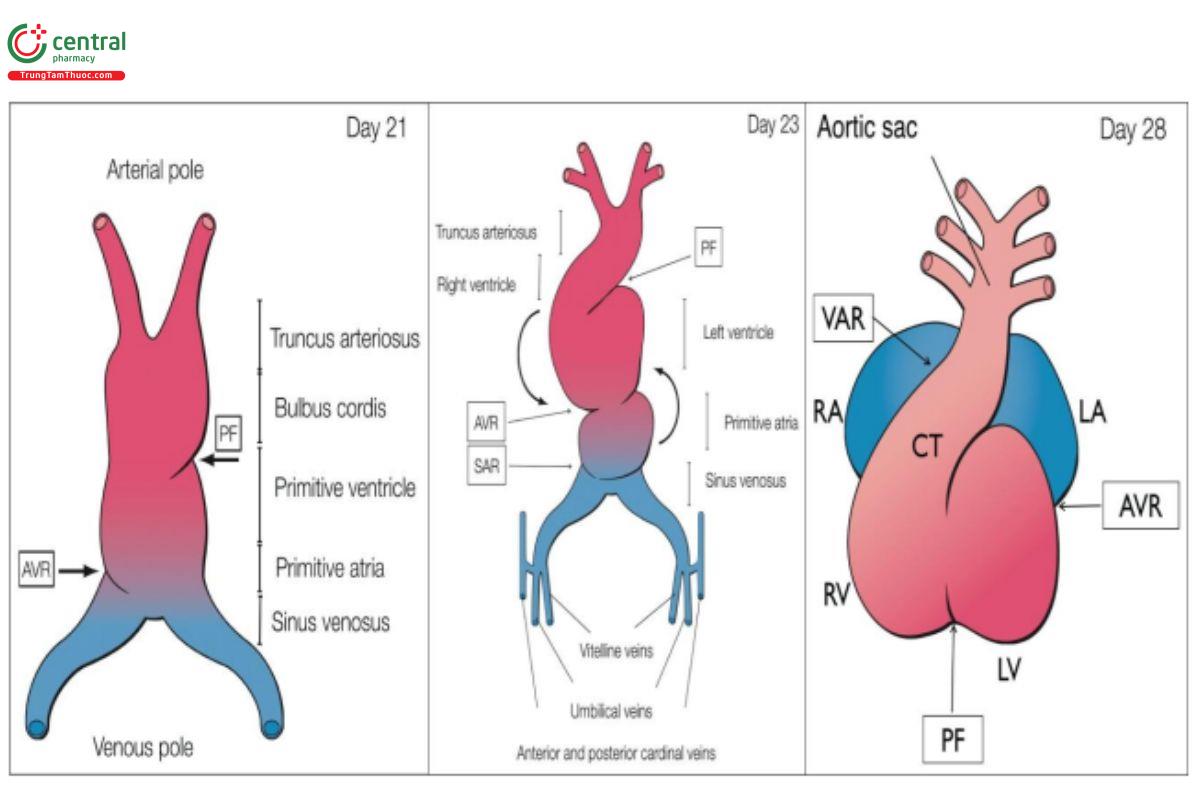
Ở A giai đoạn ống tim nguyên thủy, ở B giai đoạn tạo quai tim và ở C tim cuộn lại trong quá trình hình thành vách ngăn tâm nhĩ, tâm thất và đại động mạch. A: Có thể xác định được 2 vùng chuyển tiếp: vòng nhĩ thất (AVR) tạo thành các van nhĩ thất trong tương lai và nếp gấp sơ cấp (PF) tạo thành vách liên thất trong tương lai. B: Ống tim bắt đầu cuộn lại với sự gấp nếp dọc theo trục dài và xoay sang phải và về phía bụng, dẫn đến quai tim hướng sang phải (D-looped heart). Các buồng tim nguyên thủy được thấy rõ hơn và được ngăn cách bởi các vùng chuyển tiếp như vòng xoang nhĩ (SAR), AVR và PF.
C: Sau khi tạo quai tim, có thể thấy một số vùng chuyển tiếp ngăn cách các buồng tim nguyên thủy, AVR giữa tâm nhĩ chung (màu xanh lam) và tâm thất chung (màu đỏ), PF giữa tâm thất nguyên thủy trái (LV) và phải (RV), và VAR ở vùng thân nón (CT) đường ra của tim. RA: tâm nhĩ phải; LA: tâm nhĩ trái.
3 KỸ THUẬT KHẢO SÁT VÀ GIẢI PHẪU SIÊU ÂM TIM THAI BÌNH THƯỜNG
Quy trình siêu âm tim thai quý 1 không khác gì so với siêu âm tim thai quý 2 và 3, nên tiếp cận tuần tự từng phần có hệ thống. Mặc dù trong tam cá nguyệt thứ hai, có thể chỉ cần siêu âm 2D thang xám khi siêu âm tim thai sàng lọc, nhưng khi siêu âm tim thai quý 1, nên kết hợp cả siêu âm 2D thang xám với Doppler màu, đặc biệt khi đánh giá các đại động mạch.
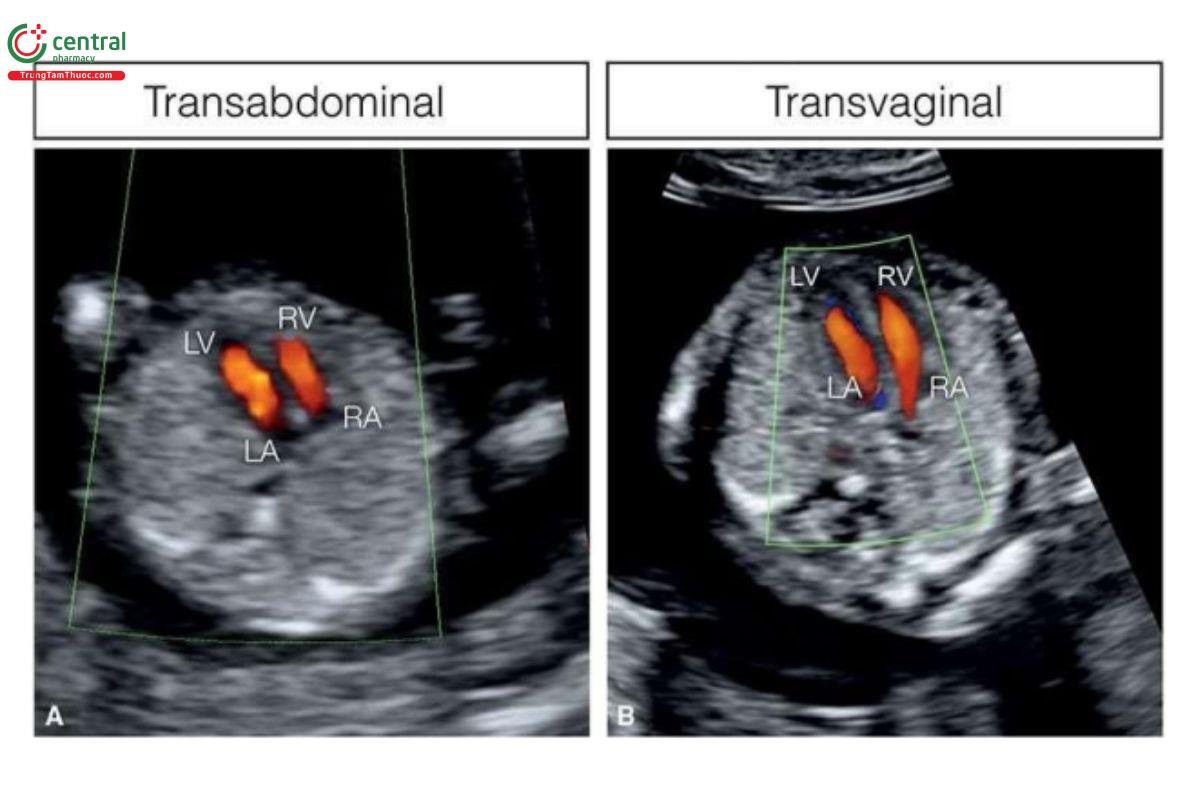
Hiện nay, có thể thu được hình ảnh siêu âm 2D độ phân giải cao bằng đầu dò phẳng qua ngả bụng (transabdominal linear) hoặc đầu dò âm đạo (transvaginal transducers). Theo kinh nghiệm của chúng tôi, khi thai nhi ở tư thế nằm ngang, thấp trong tử cung thì nên tiếp cận qua ngả âm đạo vì khi đó khoảng cách từ đầu dò âm đạo đến ngực thai nhi là ngắn nhất (xem Chương 3). Hơn nữa, nó cũng rất hữu ích ở thai nhi <13 tuần tuổi hoặc khi nghi ngờ dị tật tim.
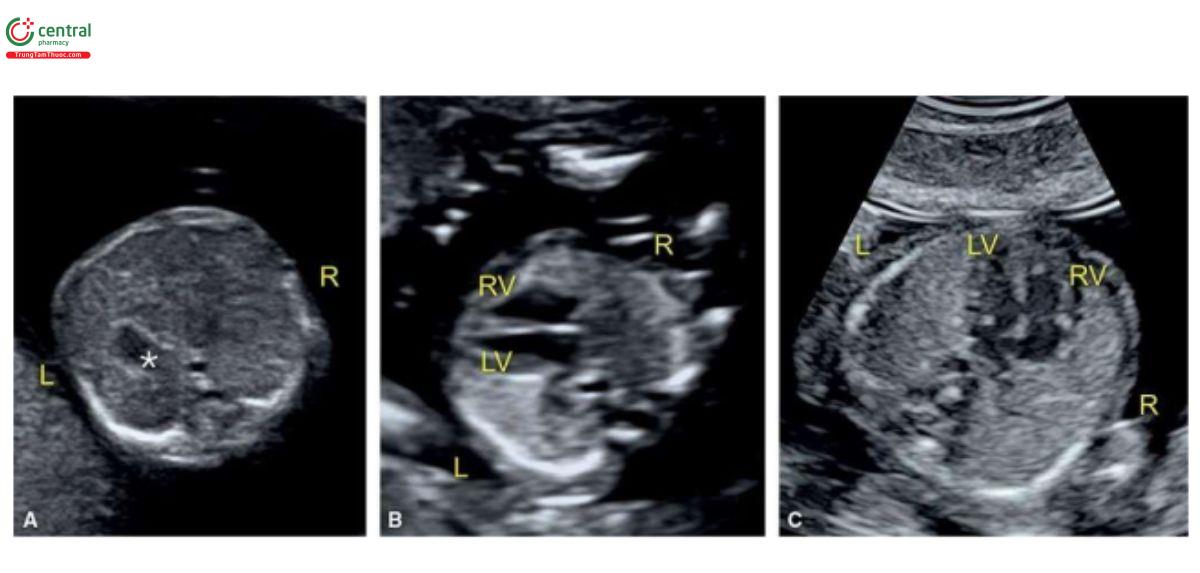
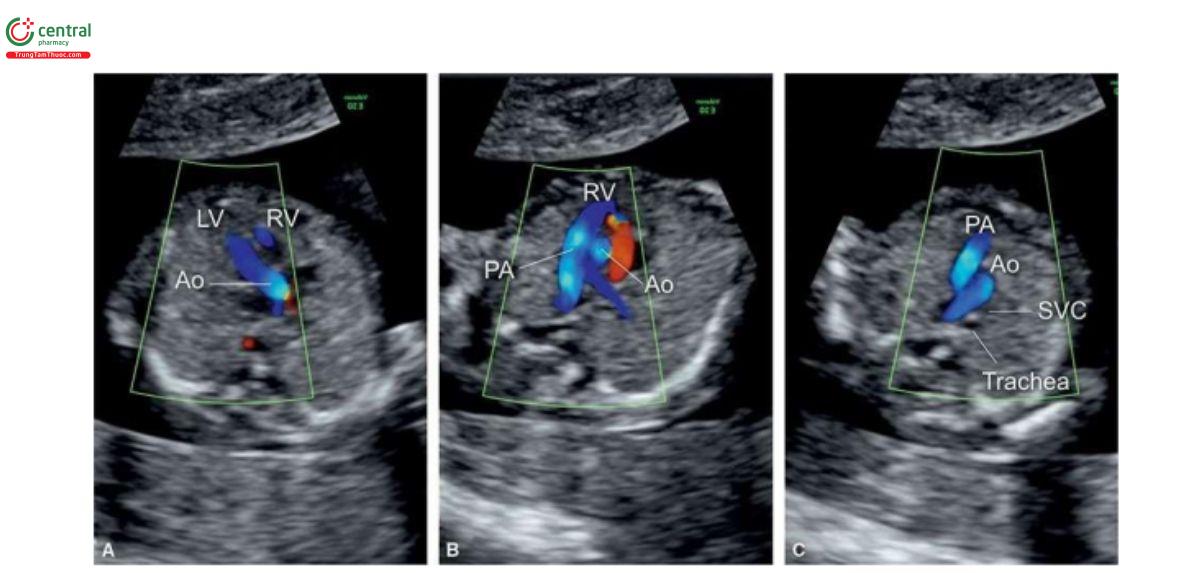
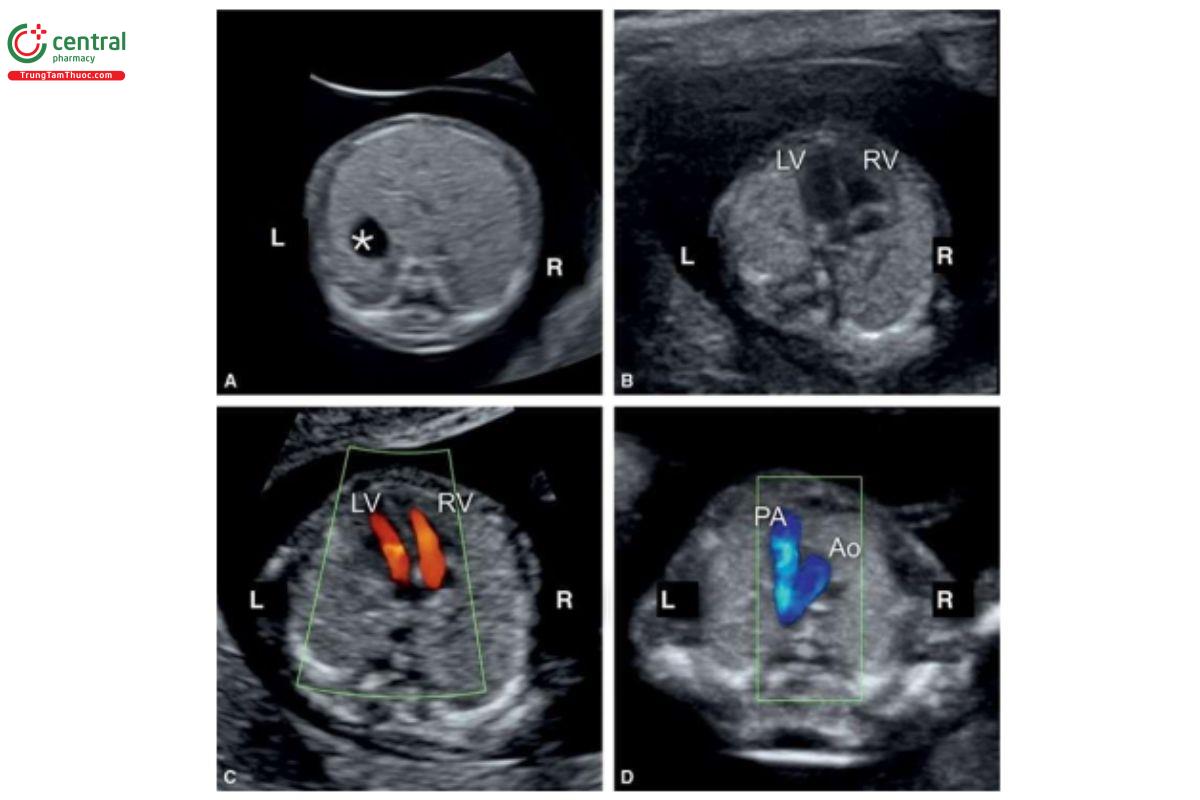
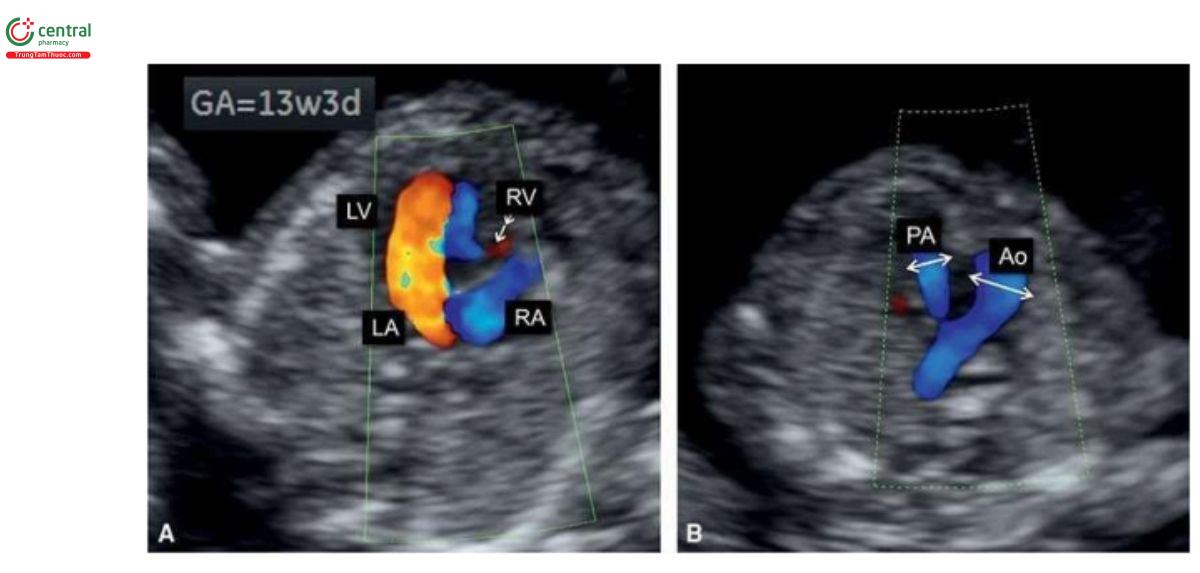
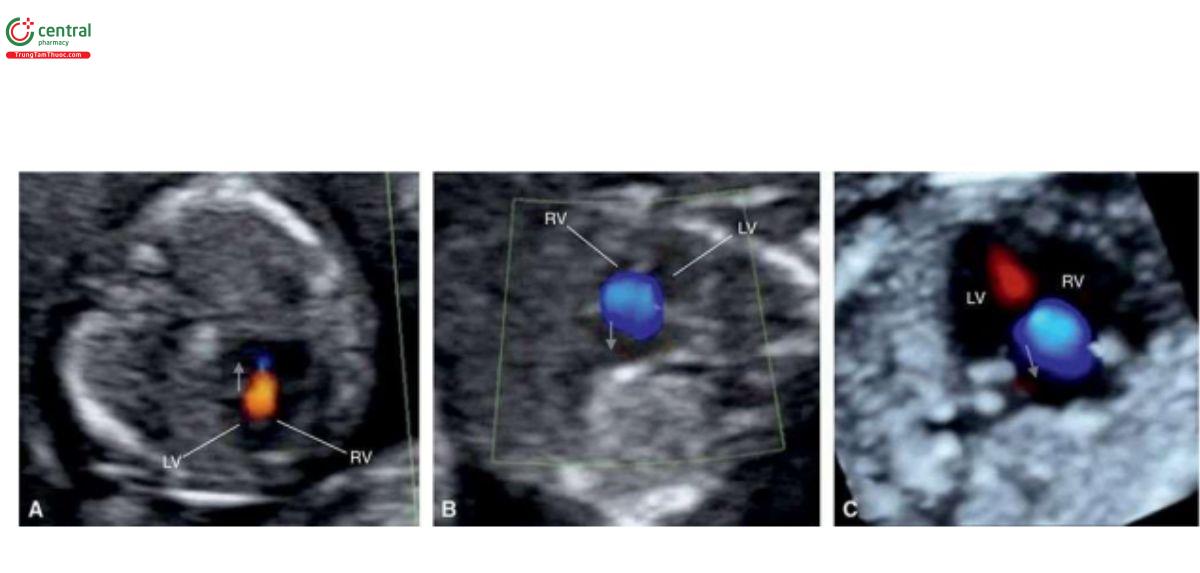
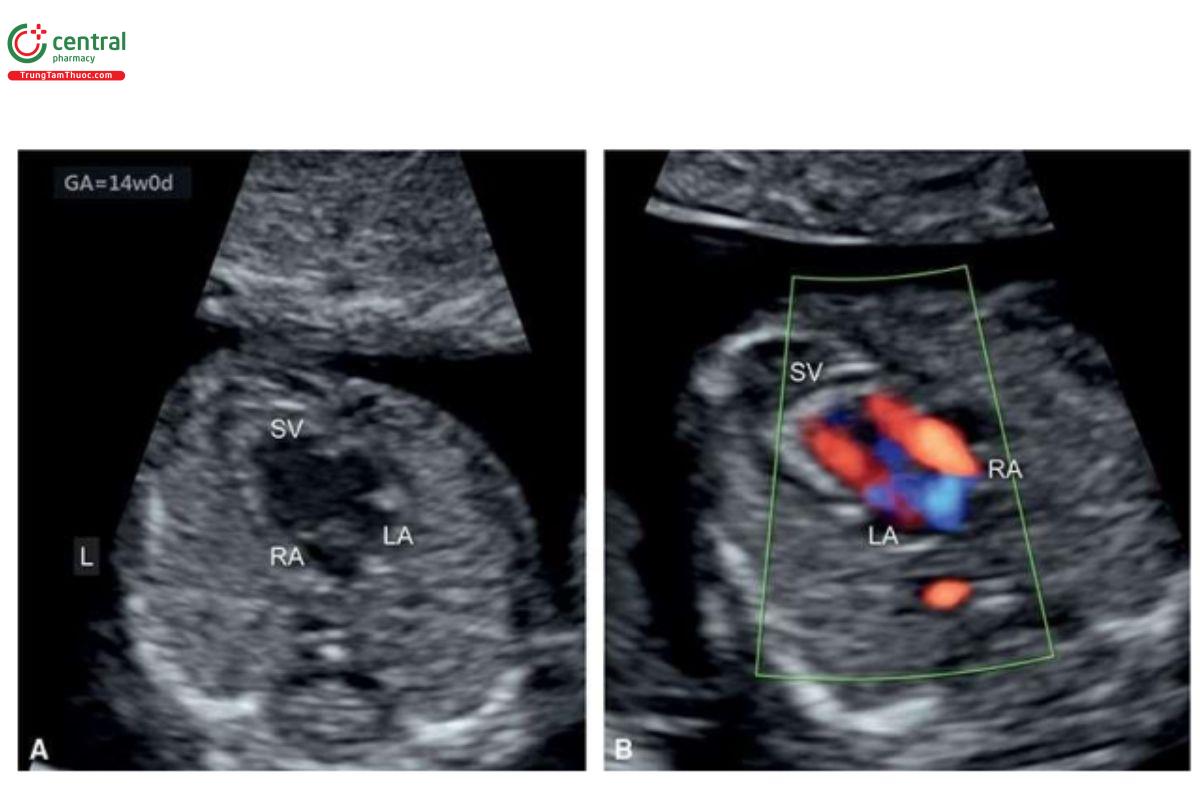
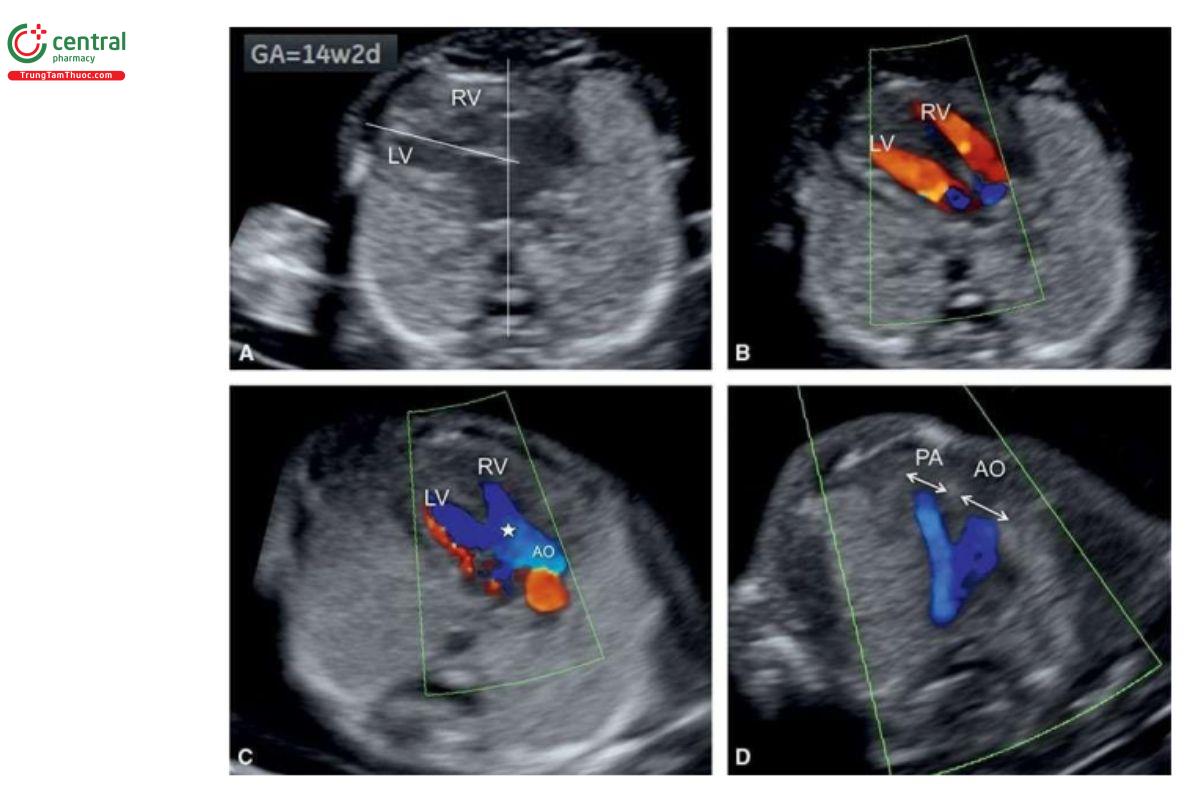
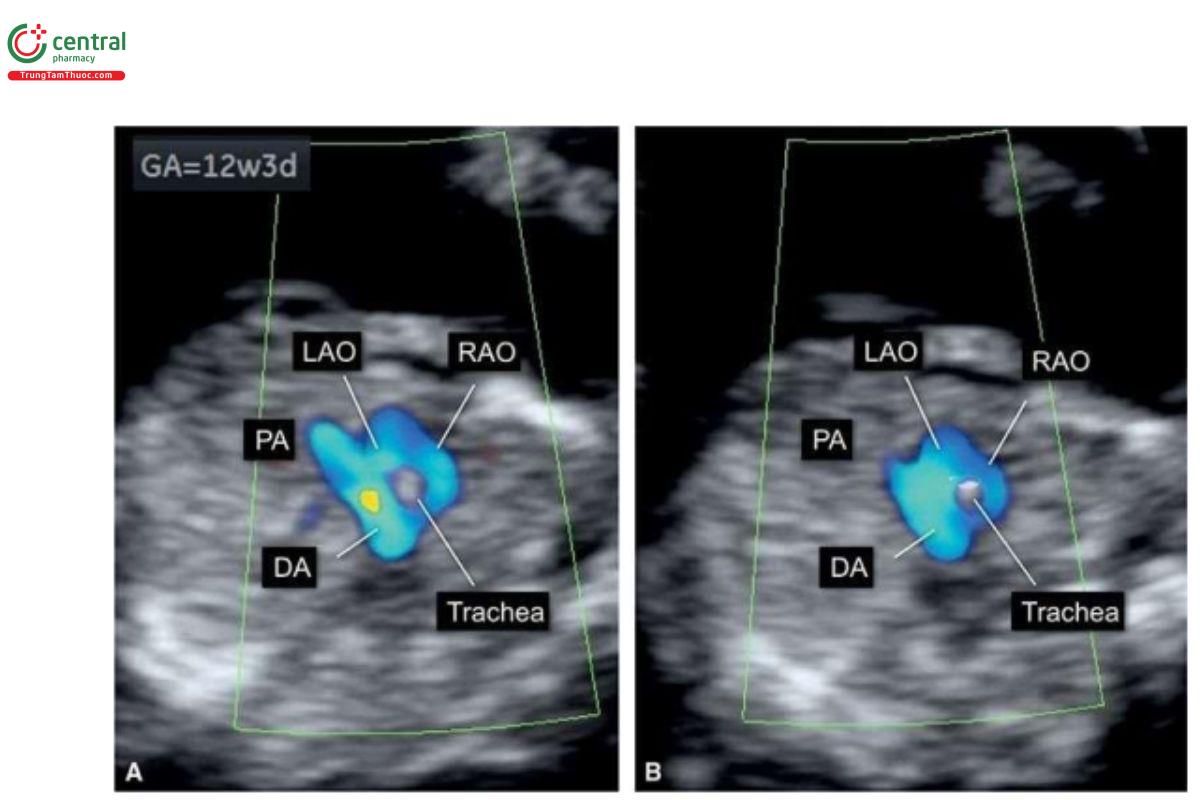
Với siêu âm tim thai sàng lọc, đầu tiên cần thực hiện với siêu âm 2D thang xám, trọng tâm là situs thai nhi cũng như các mặt cắt bốn buồng tim (4CV) từ mỏm và từ bên (Hình 11.2). Bảng 11.1 trình bày cách tối ưu hóa máy siêu âm để thu được hình ảnh siêu âm 2D tốt nhất trong quý 1. Mặc dù có thể thấy rõ bụng thai nhi và 4CV trên siêu âm 2D trong quý 1, nhưng thường không thấy các đường ra thất phải và trái ở thai nhi <14 tuần tuổi vì chúng có kích thước rất nhỏ. Do đó, chúng tôi khuyến khích sử dụng Doppler màu hoặc Doppler độ nét cao (năng lượng) như một công cụ bổ trợ khi siêu âm 2D đánh giá tim thai quý 1, chủ yếu giúp đánh giá gián tiếp hình dạng và kích thước của các buồng tim và các đại động mạch. Cách tối ưu hóa Doppler màu được tóm tắt trong Bảng 11.2. Ứng dụng Doppler màu ở mặt cắt bốn buồng (Hình 11.3) là một bước cực kỳ quan trọng giúp xác định giải phẫu tim bình thường và bất thường, đặc biệt với thai nhi < 14 tuần tuổi. Áp dụng Doppler màu vào các mặt cắt ngang ngực trên bao gồm mặt cắt ba mạch máu-khí quản (3VT) và mặt cắt ngang ống động mạch (Hình 11.4) là vô cùng cần thiết giúp đánh giá các đại động mạch và có ưu thế hơn rất nhiều khi chỉ dùng siêu âm 2D thông thường. Ở mặt cắt 3VT, có thể phát hiện được một số bất thường tim liên quan đến các đường ra trong quý 1. Có thể đánh giá vị trí, kích thước, độ mở thông (patency) và hướng dòng máu của cung động mạch chủ và ống động mạch dễ dàng hơn trong quý với siêu âm Doppler màu (Hình 11.4).
Tất cả các mặt cắt siêu âm được khuyến nghị để đánh giá giải phẫu tim thai trong quý 2 và 3 đều có thể thực hiện được trong quý 1 với điều kiện siêu âm lý tưởng. Tuy nhiên, dựa trên kinh nghiệm của chúng tôi, trong quý 1, cần phải đánh giá 4 mặt cắt thiết yếu - (1) mặt cắt ngang bụng cao, (2) 4CV trên siêu âm 2D, (3) 4CV với Doppler màu, và (4) 3VT với Doppler màu (Hình 11.5) – nhằm cung cấp đủ thông tin để loại trừ hầu hết các bất thường tim lớn (major cardiac malformations).
| Bảng 11.1 • Cách tối ưu hóa siêu âm 2D tim thai trong quý 1 thai kỳ |
|---|
| - Thai nhi ở tư thế nằm ngửa (tư thế đo NT) |
| - Phóng to hình ảnh |
| - Thu hẹp cửa sổ sóng âm (sector width) |
| - Lồng ngực thai nhi chiếm 1/3 hình ảnh siêu âm |
| - Cài đặt hình ảnh có độ tương phản cao |
| - Dụa dò có độ phân giải từ trung bình đến cao |
| - Chùm sóng siêu âm đi từ mỏm tới bên phải tim thai |
| NT: Độ mờ da gáy |
| Bảng 11.2 • Cách tối ưu hóa siêu âm Doppler màu tim thai trong quý 1 thai kỳ |
|---|
| - Tối ưu hóa hình ảnh siêu âm 2D trước khi bật Doppler màu |
| - Hộp Doppler màu hẹp |
| - Thang vận tốc màu - trung bình |
| - Độ lọc thành - trung bình |
| - Độ bền màu từ trung bình đến cao |
| - Gain Doppler màu thấp |
| - Công suất thấp |
| - Doppler màu hai chiều, nếu có |
Bệnh tim bẩm sinh (CHD) là bất thường bẩm sinh nặng phổ biến nhất. Khoảng 1/2 số trường hợp CHD là nặng và chiếm > 1/2 số ca tử vong do bất thường bẩm sinh ở thời thơ ấu. Hơn nữa, CHD dẫn đến chi phí nhập viện tốn kém nhất đối với các dị tật bẩm sinh ở Hoa Kỳ.
Tỷ lệ mắc CHD phụ thuộc vào độ tuổi mà dân số được khám lần đầu và định nghĩa CHD được dùng, với tỷ lệ mắc được báo cáo trong các nghiên cứu dân số lớn từ 8 đến 9 trên 1.000 ca sinh sống. Nhìn chung, trong ba tháng đầu thai kỳ,
kỳ, tỷ lệ mắc CHD cao hơn, vì nhiều thai nhi có bất thường phức tạp đã chết trong tử cung, đặc biệt khi kèm theo bất thường ngoài tim hoặc phù thai sớm. Một trong những dấu hiệu tiên lượng xấu của CHD là kèm theo các bất thường ngoài tim bao gồm cả bệnh di truyền. Do đó, phát hiện bất thường thai nhi là một chỉ định để siêu âm tim thai. Ngay cả khi đơn độc, CHD vẫn có thể liên quan với tình trạng lệch bội hoặc hội chứng. Chẩn đoán CHD trong quý 1 cho phép bác sĩ tư vấn kỹ càng hơn về thai kỳ và có đủ thời gian cho các lựa chọn chẩn đoán và đưa ra quyết định.
Trong ba tháng đầu thai kỳ, có thể nghi ngờ thai nhi mắc CHD khi thấy các dấu hiệu gián tiếp như độ mờ da gáy dày (NT), các bất thường ngoài tim, hoặc đánh giá trực tiếp các bất thường giải phẫu tim và các đại động mạch.
4 BỆNH TIM BẨM SINH TRONG QUÝ 1 THAI KỲ
Bệnh tim bẩm sinh (CHD) là bất thường bẩm sinh nặng phổ biến nhất. Khoảng 1/2 số trường hợp CHD là nặng và chiếm > 1/2 số ca tử vong do bất thường bẩm sinh ở thời thơ ấu. Hơn nữa, CHD dẫn đến chi phí nhập viện tốn kém nhất đối với các dị tật bẩm sinh ở Hoa Kỳ.
Tỷ lệ mắc CHD phụ thuộc vào độ tuổi mà dân số được khám lần đầu và định nghĩa CHD được dùng, với tỷ lệ mắc được báo cáo trong các nghiên cứu dân số lớn từ 8 đến 9 trên 1.000 ca sinh sống. Nhìn chung, trong ba tháng đầu thai kỳ,
kỳ, tỷ lệ mắc CHD cao hơn, vì nhiều thai nhi có bất thường phức tạp đã chết trong tử cung, đặc biệt khi kèm theo bất thường ngoài tim hoặc phù thai sớm. Một trong những dấu hiệu tiên lượng xấu của CHD là kèm theo các bất thường ngoài tim bao gồm cả bệnh di truyền. Do đó, phát hiện bất thường thai nhi là một chỉ định để siêu âm tim thai. Ngay cả khi đơn độc, CHD vẫn có thể liên quan với tình trạng lệch bội hoặc hội chứng. Chẩn đoán CHD trong quý 1 cho phép bác sĩ tư vấn kỹ càng hơn về thai kỳ và có đủ thời gian cho các lựa chọn chẩn đoán và đưa ra quyết định.
Trong ba tháng đầu thai kỳ, có thể nghi ngờ thai nhi mắc CHD khi thấy các dấu hiệu gián tiếp như độ mờ da gáy dày (NT), các bất thường ngoài tim, hoặc đánh giá trực tiếp các bất thường giải phẫu tim và các đại động mạch.
5 CÁC BẤT THƯỜNG NGOÀI TIM LIÊN QUAN
Các bất thường tim thường kèm theo các bất thường ngoài tim như là một phần của một bệnh di truyền đã xác định hoặc đơn độc và bao gồm các bất thường não, bụng, niệu-sinh dục hoặc xương. Ngay cả với CHD đơn độc, vẫn cần siêu âm theo dõi cẩn thận trong quý 2 để tìm kiếm các bất thường ngoài tim liên quan. Dù đơn độc hay kèm theo các bất thường khác, CHD đều có khả năng cao liên quan với tình trạng lệch bội hoặc hội chứng khác. Vẫn chưa rõ tỷ lệ CHD thực sự liên quan với lệch bội nhưng > 20% tổng số CHD được phát hiện trong quý 1 kèm theo bất thường số lượng nhiễm sắc thể. Con số này có thể do ước tính quá mức vì có một tỷ lệ đáng kể CHD trong quý 1 được phát hiện sau khi NT dày đã được chẩn đoán. Các lệch bội liên quan với CHD trong quý 1 bao gồm trisomy 21, 18 và 13, cũng như hội chứng Turner và thể tam bội (triploidy) (xem Chương 6 để biết thêm chi tiết). Cũng có thể gặp các bất thường nhiễm sắc thể khác nhưng thường là ngẫu nhiên. Một bất thường nhiễm sắc thể chính thường liên quan là vi mất đoạn 22q11, nên khi thực hiện thủ thuật xâm lấn cần phải xét nghiệm vi mất đoạn này, đặc biệt khi phát hiện bất thường thân nón (conotruncal anomaly) (xem bên dưới). Hiện nay, tỷ lệ phát hiện vi mất đoạn và vi lặp đoạn ngày càng cao nhờ microarray ngày càng được ứng dụng rộng rãi như một xét nghiệm chẩn đoán sau sinh thiết gai nhau khi CHD được chẩn đoán trong quý 1. Các bệnh đơn gen liên quan với dị tật tim thường không được phát hiện ở tuổi thai nhỏ. Để biết thêm chi tiết về di truyền của các bất thường tim, chúng tôi khuyên bạn nên tìm đọc các sách chuyên khảo và bài báo tổng quan về chủ đề này.
Hội chứng vi mất đoạn 22q11.2 (Hội chứng DiGeorge)
Hội chứng vi mất đoạn 22q11.2 (còn được gọi là hội chứng DiGeorge hoặc CATCH 22) là vi mất đoạn hay gặp nhất ở người và là bất thường nhiễm sắc thể hay gặp thứ hai ở trẻ nhỏ mắc CHD (sau trisomy 21), với tỷ lệ ước tính là 1:2.000 đến 1:4.000 trẻ sinh sống. Từ viết tắt CATCH-22 được dùng để mô tả các đặc điểm của hội chứng DiGeorge bao gồm bất thường tim, khuôn mặt bất thường, thiểu sản tuyến ức, khe hở vòm miệng (cleft palate), hạ Canxi máu và vi mất đoạn trên nhiễm sắc thể 22. Các bất thường về kiểu hình bao gồm các bất thường tim, chủ yếu là các bất thường đường ra kèm theo thiểu sản hoặc bất sản tuyến ức, khe hở vòm miệng (cleft palate), suy hầu họng (velopharyngeal insufficiency) và các đặc điểm khuôn mặt dị dạng. Các rối loạn về xương có thể ảnh hưởng đến các chi và cột sống. Rối loạn tâm thần (mental disorders) được phát hiện ở 30% số người trưởng thành bị vi mất đoạn này.
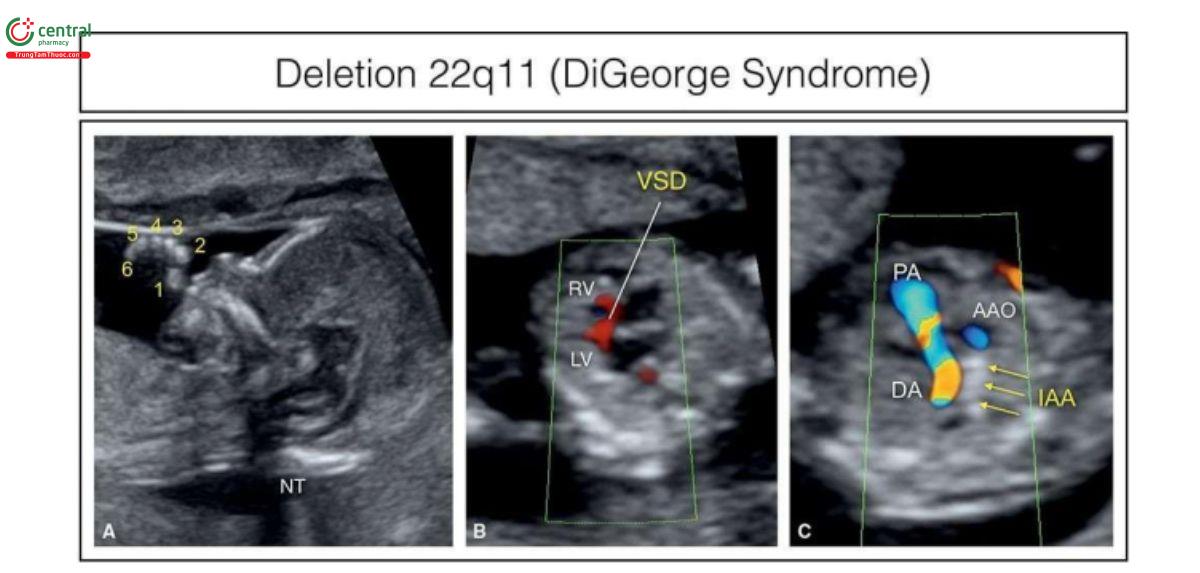
Có thể chẩn đoán vi mất đoạn này bằng kỹ thuật lai huỳnh quang tại chỗ (FISH) hoặc phân tích microarray. Ở thai nhi hoặc trẻ nhỏ bị ảnh hưởng, khi khám cho cha mẹ phát hiện khoảng 6% cha mẹ bị ảnh hưởng có các dấu hiệu kín đáo của hội chứng này và tỷ lệ di truyền cho con cái trong tương lai là 50%. Các bất thường tim gặp trong hội chứng vi mất đoạn 22q11.2 chủ yếu bao gồm các bất thường thân nón như gián đoạn cung động mạch chủ (interrupted aortic arch), thân chung động mạch (common arterial trunk - CAT), hội chứng không van động mạch phổi (absent pulmonary valve syndrome), teo động mạch phổi (pulmonary atresia) kèm VSD, tứ chứng Fallot (TOF) và thông liên thất phần nón (conoventricular septal defects). Cung động mạch chủ bên phải đơn độc hoặc kết hợp với các bất thường tim làm tăng nguy cơ vi mất đoạn 22q11.2. Rất ít báo cáo về việc phát hiện vi mất đoạn 22q11.2 trong quý 1, nhưng theo ý kiến của chúng tôi, điều này chủ yếu là do bỏ sót chẩn đoán các bất thường tim và ngoài tim chứ không phải là do không thể chẩn đoán trong ba tháng đầu thai kỳ. Một số đặc
Điểm siêu âm của vi mất đoạn 22q11.2 được phát hiện trong tam cá nguyệt thứ hai chẳng hạn như tuyến ức nhỏ, hộp vách trong suốt (cavum septi pellucidi) dãn, hoặc đa ối, nhưng không thấy trong tam cá nguyệt thứ nhất. Khuôn mặt bất thường, là một đặc điểm khác của vi mất đoạn 22q11.2, quá kín đáo và tinh tế để có thể là một đặc điểm siêu âm đáng tin cậy, ngay cả trong ba tháng giữa thai kỳ. Khi phát hiện bất thường tim hoặc ngoài tim ở thai nhi trong quý 1, nên tư vấn di truyền xét nghiệm chẩn đoán xâm lấn với sinh thiết gai nhau hoặc chọc ối và do microarray ngày càng được ứng dụng rộng rãi nên tỷ lệ phát hiện vi mất đoạn 22q11.2 sẽ ngày càng cao ở tuổi thai nhỏ. Hình 11.6 cho thấy một thai nhi 13 tuần tuổi bị vi mất đoạn 22q11.2 được phát hiện bằng FISH có mục tiêu do thấy thừa ngón và gián đoạn cung động mạch chủ khi siêu âm quý 1.
6 CÁC DẤU HIỆU GIÁN TIẾP CỦA BẤT THƯỜNG TIM TRONG QUÝ 1
Một số "marker" siêu âm có liên quan với tăng nguy cơ mắc CHD đã được mô tả trong quý 1 thai kỳ và ngày nay đã trở thành một phần của chỉ định siêu âm tim thai sớm như được liệt kê trong Bảng 11.3. Bốn trong số các "marker" siêu âm phổ biến này sẽ được thảo luận ở phần sau.
| Bảng 11.3 • Một số chỉ định siêu âm tim thai trong quý 1 thai kỳ |
|---|
| Chỉ định từ phía mẹ |
| Tăng nguy cơ lệch bội (bao gồm bố hoặc mẹ có chuyển đoạn cân bằng - balanced translocations) |
| Mẹ bị đái tháo đường kiểm soát kém |
| Mẹ bị phơi nhiễm với các chất gây bất thường tim thai |
| Đã từng có con bị dị tật tim phức tạp |
| Chỉ định từ phía thai nhi |
| Độ mờ da gáy dày |
| Trục tim bất thường |
| Dòng chảy ngược trong sống A ống tĩnh mạch |
| Hở van ba lá |
| Thai nhi có bất thường ngoài tim |
| Phù thai trong quý 1 |
Độ mờ da gáy dày
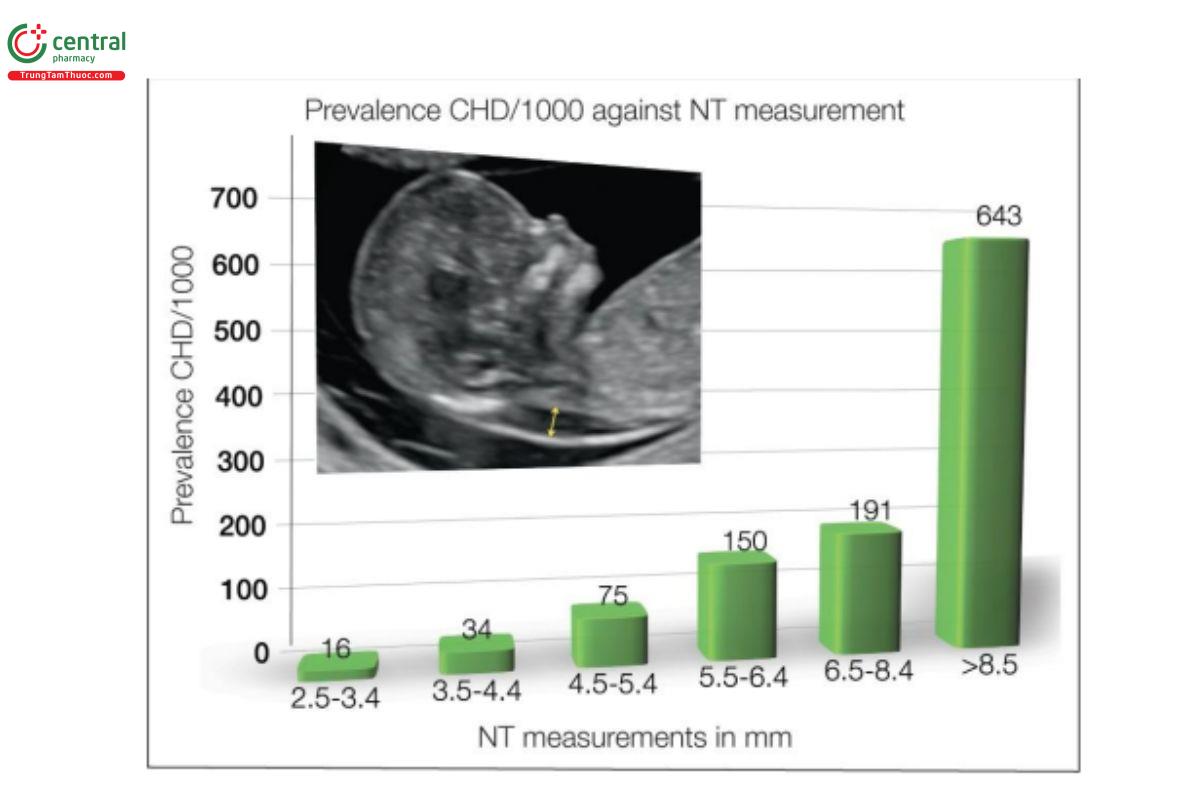
Ngoài các bất thường nhiễm sắc thể, một số báo cáo đã ghi nhận mối liên quan giữa độ mờ da gáy (NT) dày và các dị tật thai lớn, bao gồm cả dị tật tim (Hình 11.7). Các nghiên cứu tiến cứu ở các quần thể sàng lọc hỗn hợp có nguy cơ thấp và cao cho thấy độ nhạy khoảng 21% khi NT > bách phân vị thứ 99. Các nghiên cứu về mối liên quan của NT với CHD cho thấy tỷ lệ mắc dị tật tim nặng tăng theo cấp số nhân với độ dày NT của thai nhi, nhưng không đặc hiệu cho bất kỳ CHD nào. Vẫn chưa hiểu biết đầy đủ cơ chế sinh lý bệnh nền về mối liên quan giữa NT dày với dị tật tim thai.
Sóng A đảo ngược trong ống tĩnh mạch
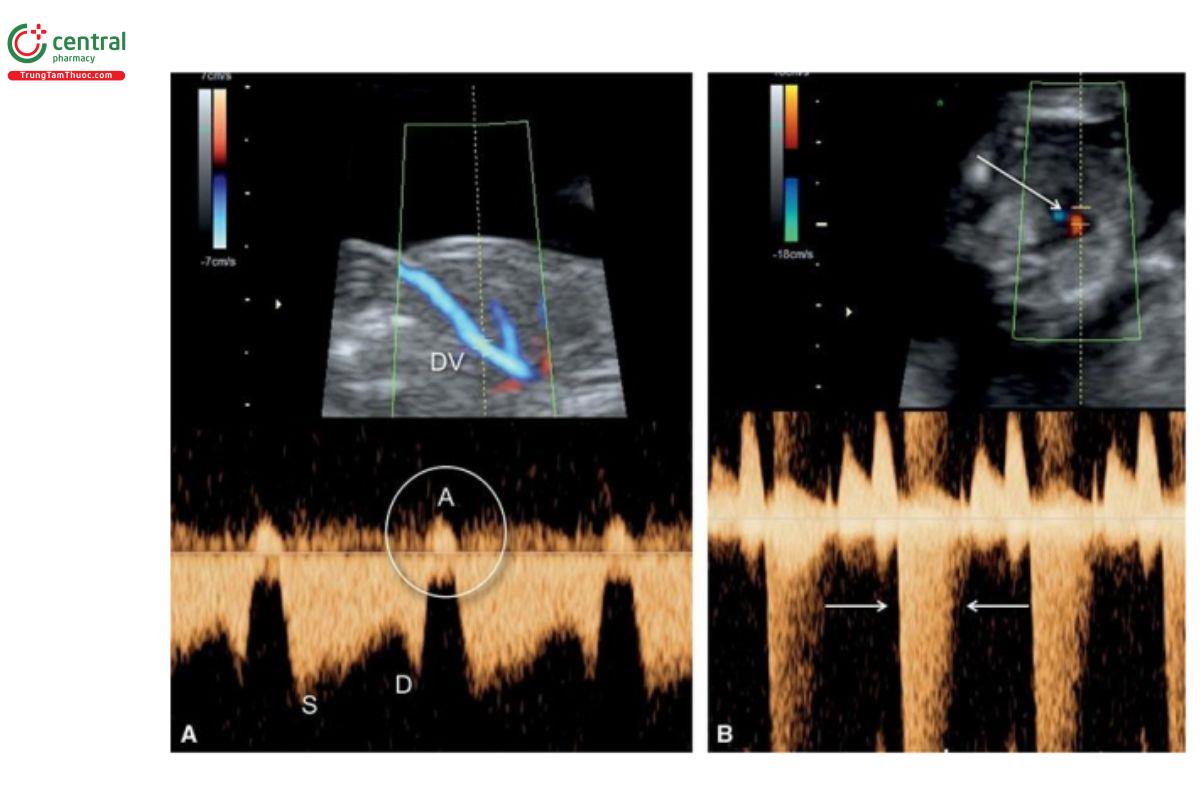
Bình thường, phổ sóng ống tĩnh mạch (DV) có dạng hai pha trong suốt chu chuyển tim. Dạng sóng DV bất thường thường đặc trưng bởi không có hoặc đảo ngược sóng A trong pha nhĩ co bóp của thì tâm trương (Hình 11.8A). Trong quý 1 thai kỳ, dạng dòng chảy này có liên quan với tăng nguy cơ lệch bội. Ở những thai nhi có nhiễm sắc thể bình thường, dạng sóng DV bất thường cũng được chứng minh là có liên quan với các bất thường tim cấu trúc. Vẫn chưa rõ cơ chế sinh lý bệnh nền về mối liên quan giữa sóng A DV đảo ngược với CHD của thai nhi, nhưng tiền tải nhĩ phải tăng do có sự gia tăng về thể tích, áp lực hoặc cả hai trong CHD, và có thể là một trong những cơ chế nền. Phát hiện sóng A đảo ngược trong DV làm tăng nguy cơ mắc CHD ở thai nhi.
Hở van ba lá (Tricuspid Regurgitation - TR)
TR thai nhi có thể xảy ra ở mọi tuần tuổi và có thể thoáng qua. TR lúc 11 đến 13 tuần tuổi là dấu hiệu thường gặp ở thai nhi trisomy 21, 18 và 13 và ở những thai nhi có dị tật tim nặng. TR gặp ở khoảng 1% thai nhi đẳng bội, ở 55% thai nhi trisomy 21, ở 1/3 số thai nhi trisomy 18 và trisomy 13, và ở 1/3 số thai nhi có dị tật tim phức tạp. Một cách tiếp cận tiêu chuẩn hóa giúp chẩn đoán TR là cực kỳ quan trọng và bao gồm những điều sau đây (xem thêm Chương 1): phóng to hình ảnh, mặt cắt bốn buồng từ mỏm tim, cửa sổ Doppler xung từ 2,0 đến 3,0 mm được đặt trên van ba lá và góc hợp bởi hướng của dòng chảy và hướng của vách liên thất < 30 độ. Do đó, TR được chẩn đoán khi thấy ≥ 1/2 thời gian tâm thu với vận tốc > 60 cm/giây. TR làm tăng nguy cơ mắc dị tật tim phức tạp.
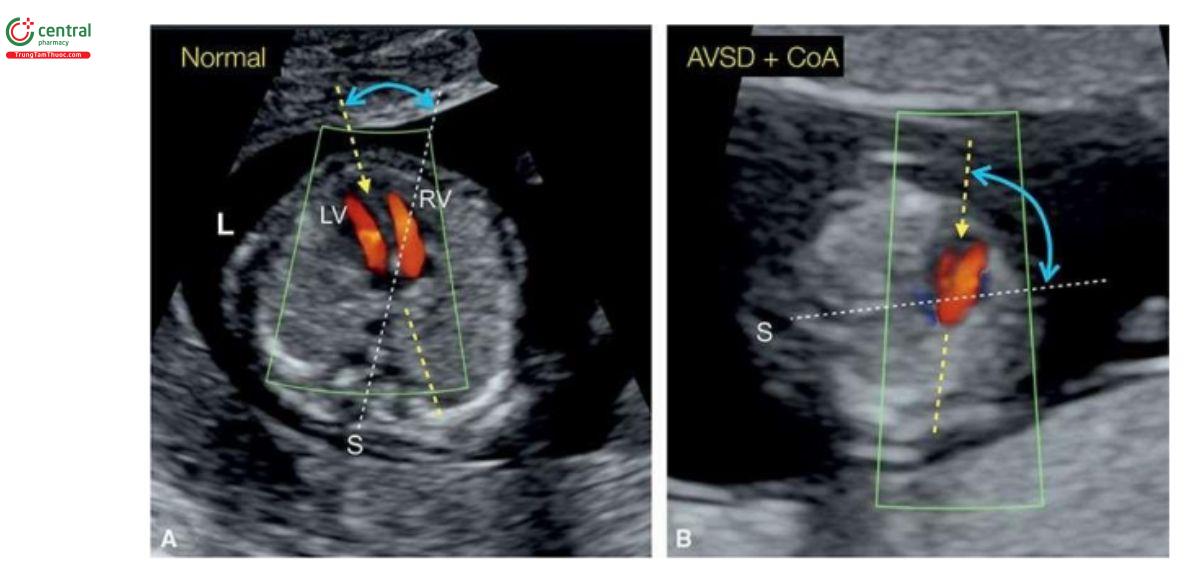
Trục tim ở tuổi thai nhỏ
Một số nghiên cứu đã chứng minh mối liên quan giữa trục tim bất thường và CHD trong quý hai và ba của thai kỳ và gần đây là ở tuổi thai nhỏ. Có thể khó khăn trong việc đo trục tim thai trong quý 1 và cần phải dùng Doppler màu độ nét cao để thấy rõ vách liên thất (Hình 11.9). Gần đây, trong một nghiên cứu bệnh-chứng, chúng tôi đã báo cáo về trục tim thai ở 197 thai nhi mắc CHD đã được xác nhận với tuổi thai từ 11 0/7 đến 14 6/7 tuần, phù hợp với nhóm chứng. Trong nhóm chứng, trục tim trung bình là 44,5 ± 7,4o và không thay đổi đáng kể ở tuổi thai nhỏ. Ở nhóm CHD, 25,9% thai nhi có số đo trục tim trong giới hạn bình thường, với 74,1% có trục tim bất thường. Hiệu suất phát hiện CHD lớn của số đo trục tim tốt hơn đáng kể so với NT, TR hoặc sóng A đảo ngược trong DV khi được sử dụng riêng lẻ hoặc kết hợp.
7 CÁC BẤT THƯỜNG TIM THAI HAY GẶP
Ở các phần sau, chúng tôi sẽ trình bày các CHD có thể chẩn đoán được trong ba tháng đầu thai kỳ. Đối với mỗi bất thường tim thai, chúng tôi sẽ định nghĩa bất thường, mô tả các dấu hiệu siêu âm cùng với các mặt cắt chẩn đoán tối ưu trong quý 1 và liệt kê ngắn gọn các bất thường tim và ngoài tim liên quan. Bảng 11.4 liệt kê các dấu hiệu siêu âm bất thường và các bất thường tim tương ứng trong quý 1 thai kỳ. Để biết thêm thông tin chi tiết về chẩn đoán tim thai và CHD trong quý 1, 2 và 3 của thai kỳ, chúng tôi giới thiệu với độc giả cuốn sách của chúng tôi về chủ đề này.
Bảng 11.4: Dấu hiệu bất thường trên siêu âm và dị tật tim bị nghi ngờ trong quý 1 thai kỳ
| Mặt cắt | Dấu hiệu bất thường |
|---|---|
| Mặt cắt bốn buồng | - Trục tim bất thường (bên trái trong TOF, CAT - ở giữa (mesocardia) trong TGA, DORV - dextrocardia trong dạng dị tật khác). |
| - Hở van ba lá nặng trong bất thường Ebstein. | |
| - Mất tâm thất (Single ventricle) trong AVSD, tim một thất (univentricular heart), HLHS, teo van hai lá kèm VSD. | |
| - Khích thước tim lớn bất thường hoặc giảm động mạch chủ, HLHS, HRHS, teo động mạch phổi kèm VSD, teo van hai lá/van ba lá. | |
| Mặt cắt ba mạch máu- khí quản với Doppler màu | - Kích thước đại động mạch lớn trong trường hợp dòng chảy ngược dòng (retrograde flow) ở mặt cắt ba mạch máu trong TOF, hẹp eo động mạch chủ, teo van ba lá kèm VSD. |
| - Kích thước đại động mạch lớn hoặc dòng chảy ngược ở động mạch chủ, teo động mạch phổi kèm VSD, hẹp eo động mạch chủ. | |
| - Chi thấy mạch phổi nhỏ hơn trong CAT, PA có VSD. | |
| - Chi thấy bất đối xứng mạch chủ khi kích thước bất thường trong TGA hoặc DORV. | |
| - Mất liên tục eo động mạch chủ trong giai đoạn dòng chảy nghịch (retrograde flow). | |
| - Cung động mạch chủ nhìn bên phải đối diện trong trường hợp tĩnh mạch bên phải (RAA) với động mạch bên trái, động mạch chủ nhìn bên phải trong các bệnh: PA (teo phổi), teo động mạch phổi kèm VSD. | |
| TOF, tứ chứng Fallot; CAT, thân chung động mạch; TGA, chuyển vị đại động mạch; DORV, thất phải hai đường ra; AVSD, kênh nhĩ thất; HLHS, hội chứng thiểu sản tim trái; VSD, thông liên thất; HRHS, hội chứng thiểu sản tim phải; PA, teo động mạch phổi. | |
7.1 Hội chứng thiểu sản tim trái (Hypoplastic Left Heart Syndrome)
Định nghĩa
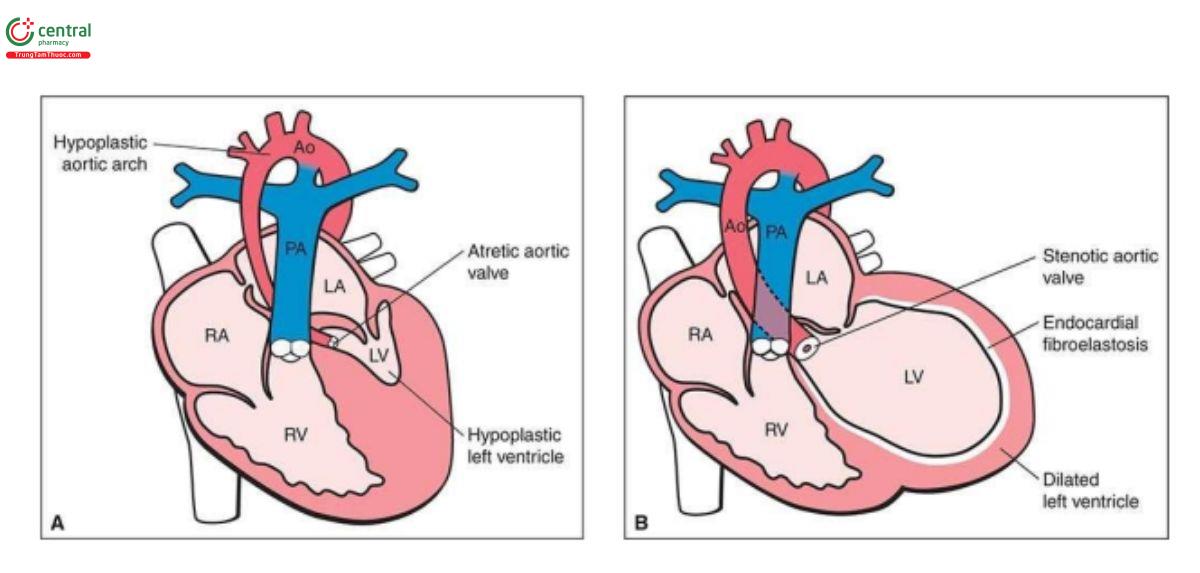
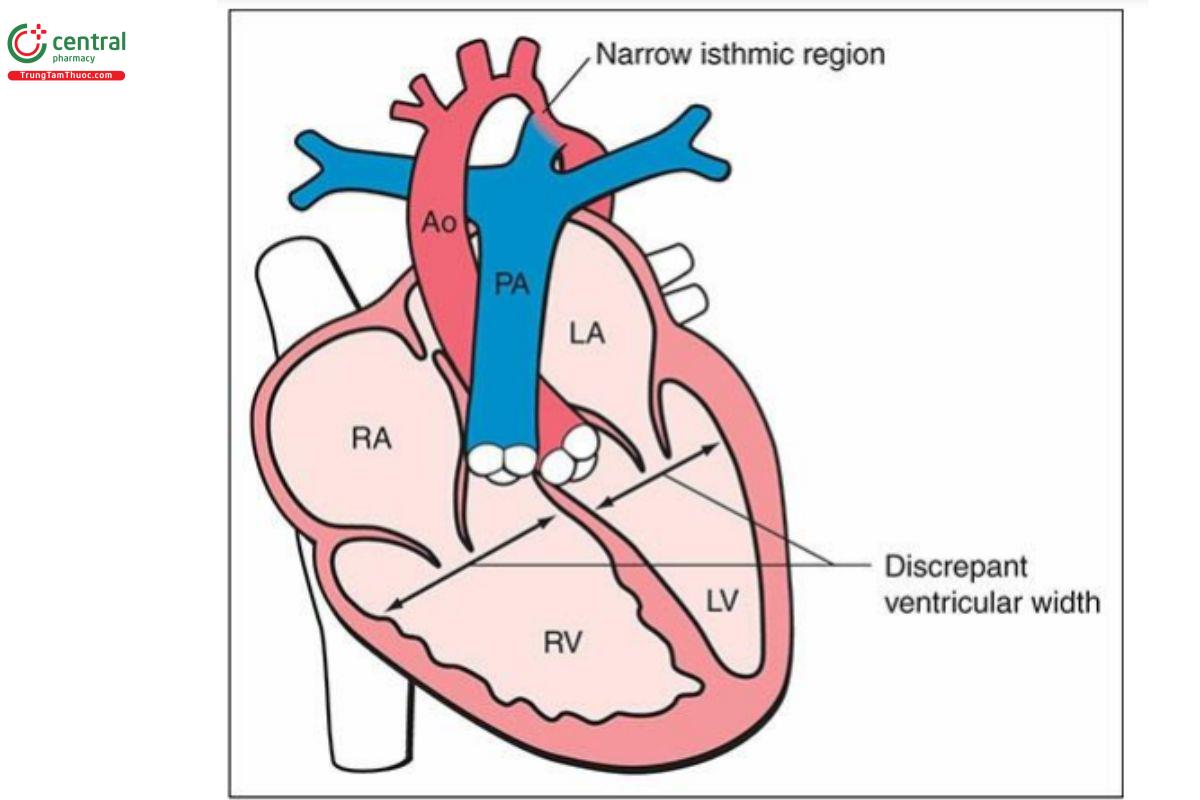
Hội chứng thiểu sản tim trái (HLHS) là một nhóm các dị tật tim phức tạp có điểm chung là thất trái và đường ra thất trái rất kém phát triển, dẫn đến tắc nghẽn cung lượng tim hệ thống. Nhìn chung, có thể gặp 2 dạng kinh điển chính của HLHS trong quý 1: một dạng bao gồm teo cả van động mạch chủ và van hai lá, với thực tế là không có sự thông thương giữa nhĩ trái và thất trái nên thất trái gần như không có hoặc thiểu sản nghiêm trọng (Hình 11.10A), và dạng khác bao gồm vẫn có thể nhìn thấy thất trái, với thành tăng âm, hình cầu và co bóp kém, có liên quan với van hai lá loạn sản nghiêm trọng kết hợp với hẹp động mạch chủ nặng (severe aortic stenosis) hoặc teo động mạch chủ (aortic atresia) (Hình 11.10B). Tỷ lệ HLHS khi sinh được báo cáo là 0,1 đến 0,25 trên 1.000 trẻ sinh sống.
Các dấu hiệu trên siêu âm
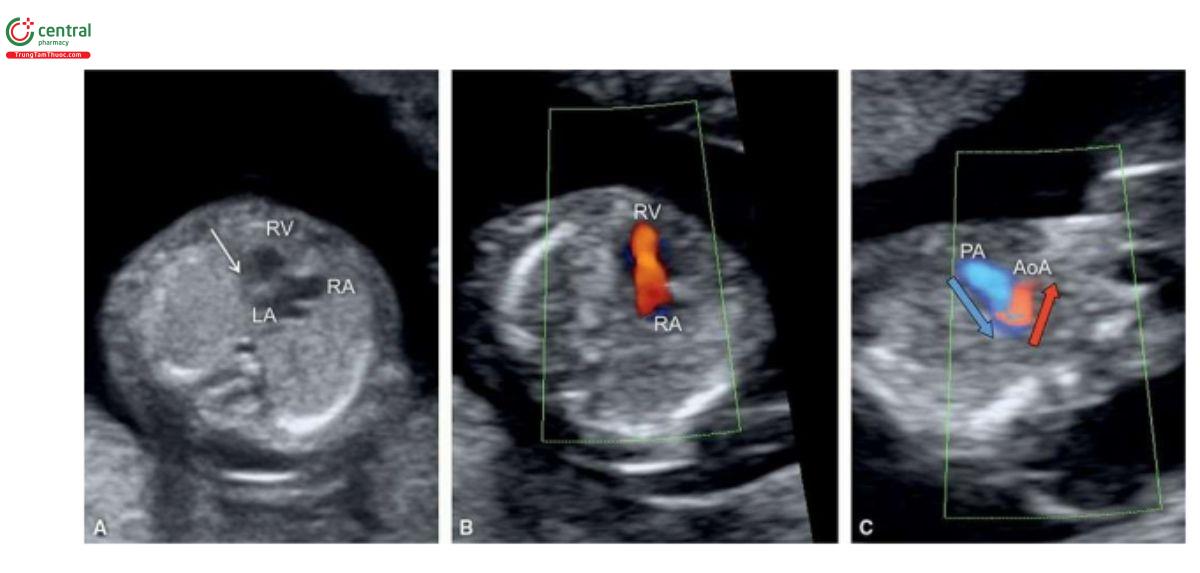
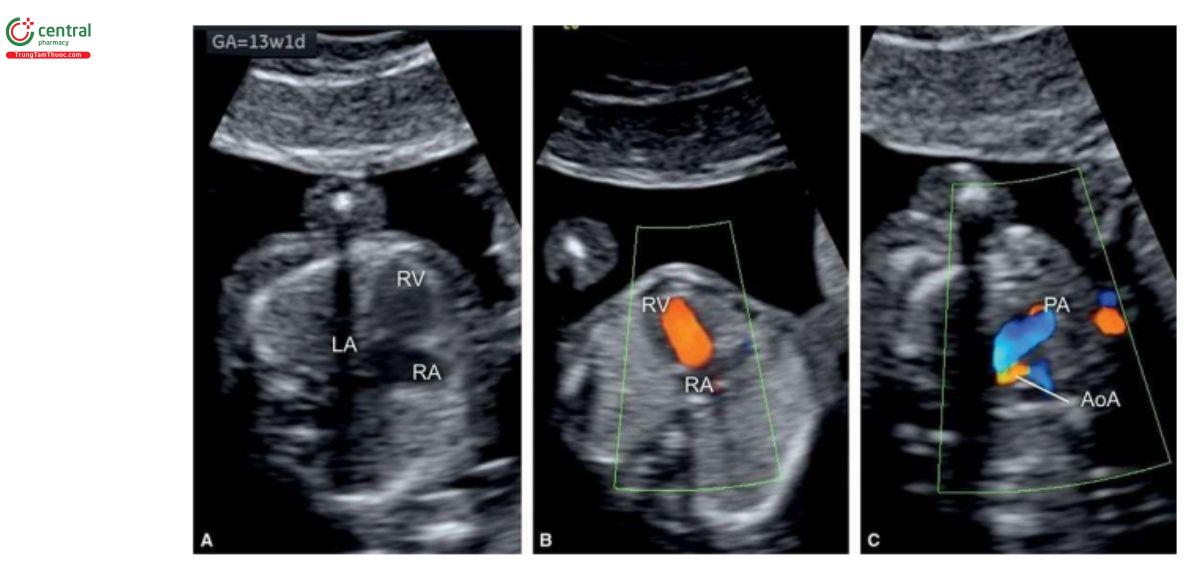
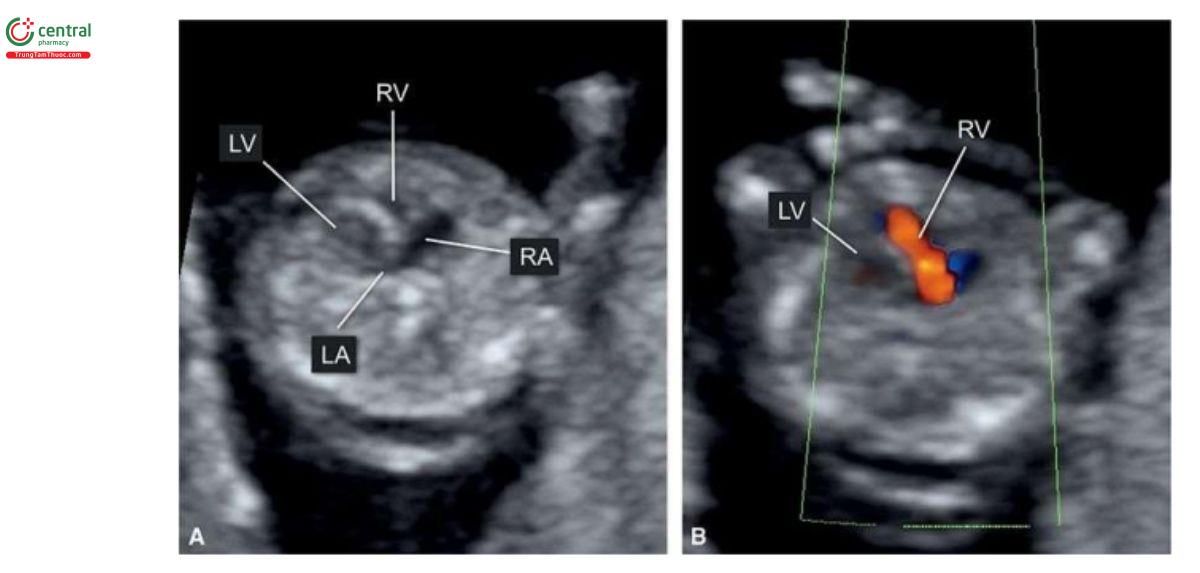
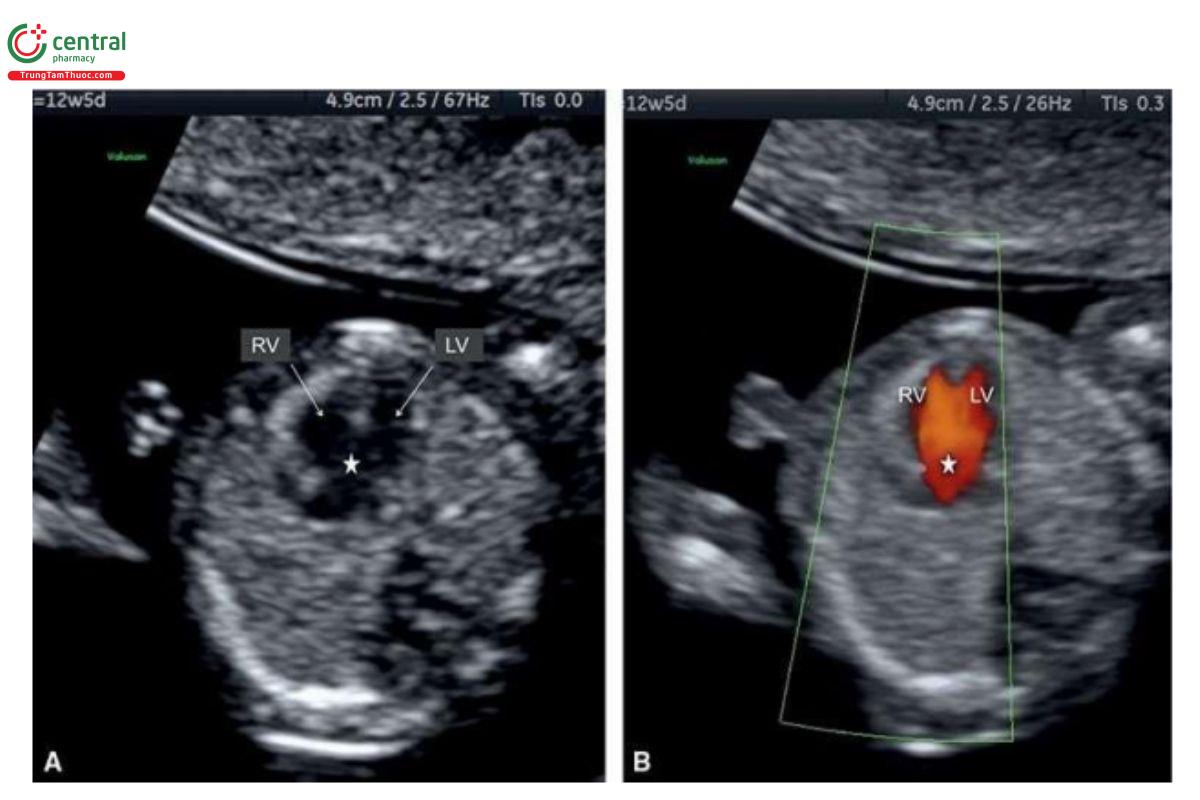
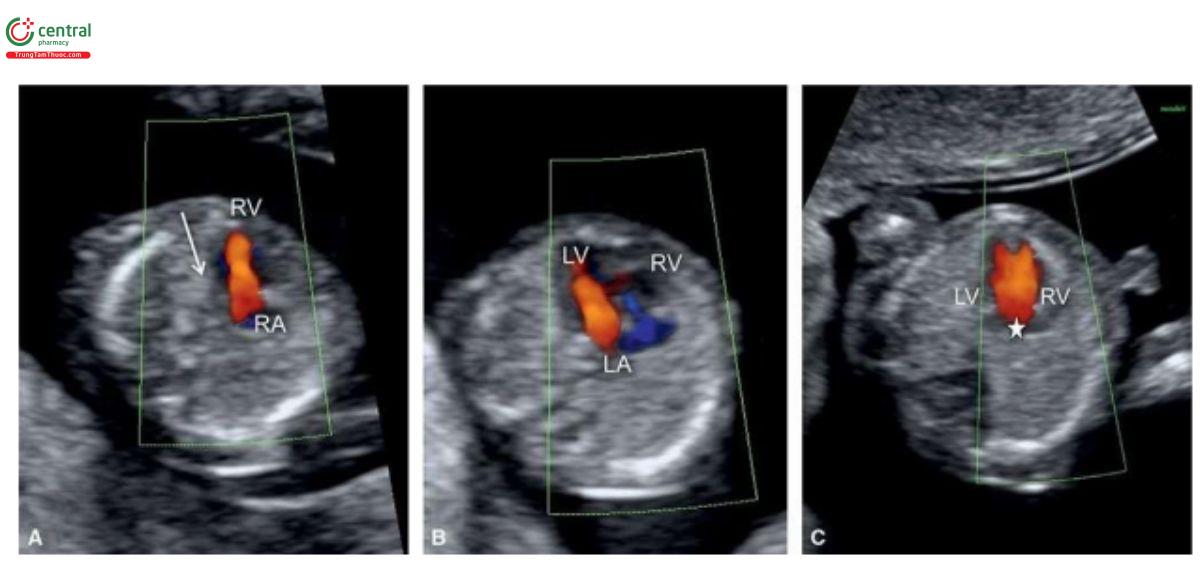
Trong HLHS, mặt cắt bốn buồng bất thường trên siêu âm 2D và với Doppler màu. Các trường hợp kèm theo teo van hai lá và teo động mạch chủ sẽ không thấy thất trái, và có thể phát hiện được lúc 12 đến 13 tuần tuổi (Hình 11.11A và 11.12A). Trên siêu âm 2D, thất trái nhỏ hoặc không có ở 4CV (Hình 11.11A và 11.12A), và Doppler màu cho thấy không có dòng chảy vào thất trái (Hình 11.11B và 11.12B). Vì vậy, trong quý 1, khi chỉ thấy một tâm thất trên siêu âm 2D và Doppler màu sẽ gợi ý đến HLHS. Trong quý 1, khi nghi ngờ ở 4CV, HLHS nên được xác nhận ở mặt cắt 3VT, cho thấy động mạch phổi lớn và cung động mạch chủ nhỏ với dòng chảy ngược trên Doppler màu (Hình 11.11C và 11.12C). Trong HLHS, đôi khi có thể thấy thất trái hình cầu, tăng âm trong quý 1 (Hình 11.13) và đó là những thay đổi trong thất trái (xơ chun (fibroelastosis)), tương tự như được thấy trong quý 2 và 3 của thai kỳ. Cũng cần lưu ý, khi thấy mặt cắt bốn buồng "bình thường" trong quý 1 cũng không thể loại trừ HLHS, vì nó đã được chứng minh là phát triển từ quý 1 đến quý 2 của thai kỳ.
Các bất thường liên quan
HLHS có liên quan với các bất thường nhiễm sắc thể, tỷ lệ từ 4% đến 5%, chẳng hạn như hội chứng Turner, trisomy 13 và 18… và khi nghi ngờ HLHS trong quý 1, nên tư vấn về các xét nghiệm di truyền cần thực hiện. Bất thường ngoài tim đã được báo cáo ở 10% đến 25% trẻ có HLHS với các hội chứng di truyền liên quan, chẳng hạn như hội chứng Turner, hội chứng Noonan, hội chứng Smith – Lemli – Opitz và hội chứng Holt – Oram. Thai nhi HLHS có thể bị chậm tăng trưởng ở cuối quý 2 và quý 3 của thai kỳ, có thể do cung lượng tim kết hợp giảm 20%. Khi chẩn đoán HLHS trong quý 1, khuyến cáo nên siêu âm theo dõi thêm.
Hẹp eo động mạch chủ (Coarctation of the Aorta)
Định nghĩa
Hẹp eo động mạch chủ (CoA) là tình trạng cung động mạch chủ bị thu hẹp, thường ở vùng eo, giữa động mạch dưới đòn trái và ống động mạch (Hình 11.14). CoA là một bất thường hay gặp với tỷ lệ mắc 5% đến 8% trẻ sơ sinh và trẻ nhỏ mắc CHD. CoA có thể được phân loại là CoA đơn giản khi không có các tổn thương tim quan trọng và CoA phức tạp khi kèm theo bệnh lý trong tim đáng kể.
Các dấu hiệu trên siêu âm
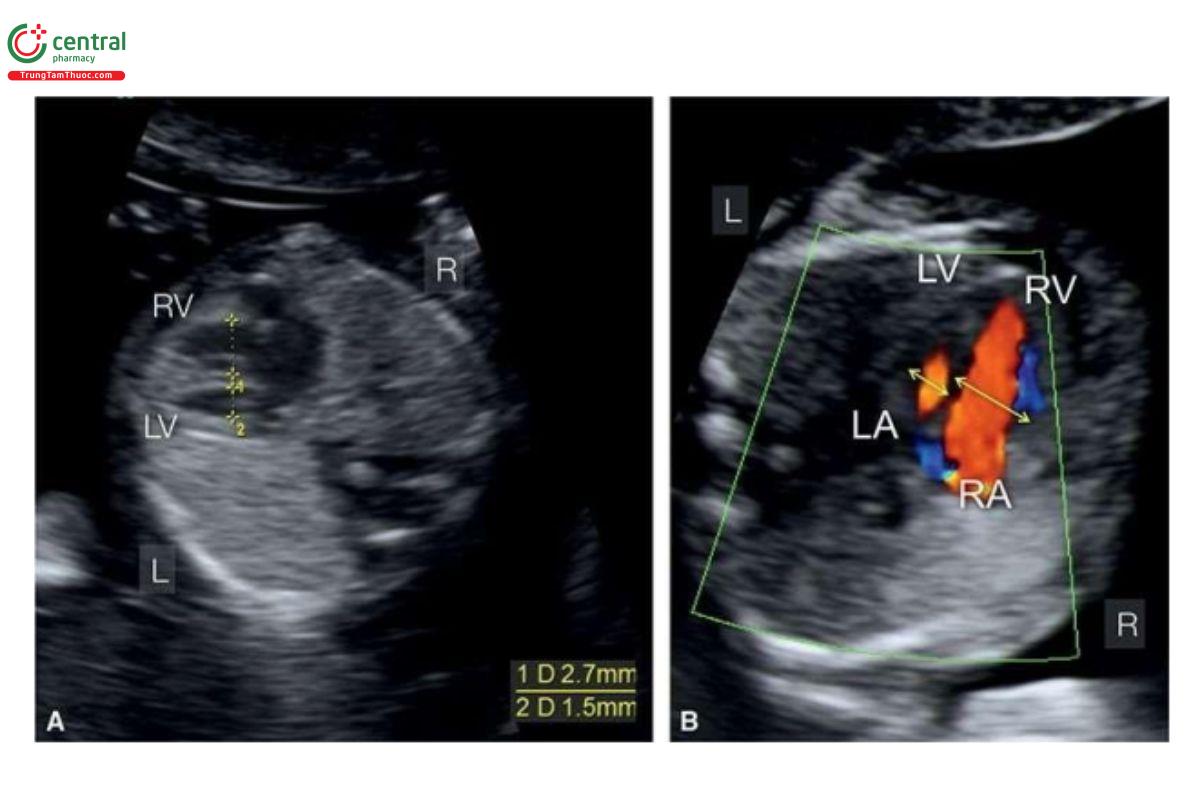
Trong quý 1, bất cân xứng tâm thất với thất trái nhỏ là một trong những dấu hiệu gợi ý CoA. Trên siêu âm 2D, có thể thấy rõ nhất sự bất cân xứng tâm thất ở mặt cắt bốn buồng từ bên (Hình 11.15). Doppler màu ở 4CV cho thấy sự khác biệt về sự đổ đầy tâm thất với dòng chảy qua thất phải lớn hơn thất trái (Hình 11.15B). Chẩn đoán CoA được xác nhận ở mặt cắt 3VT khi thấy cung động mạch chủ nhỏ so với động mạch phổi (Hình 11.16). Thông thường, trong CoA, thấy dòng chảy xuôi dòng trong cung động mạch chủ (Hình 11.16B), giúp phân biệt nó với HLHS khi thấy dòng chảy ngược trên Doppler màu (Hình 11.12C). Khi thấy cung động mạch chủ dường như không liên tục với động mạch chủ xuống cần nghi ngờ chẩn đoán gián đoạn cung động mạch chủ. Cần lưu ý, xác nhận lại CoA trong tam cá nguyệt thứ hai là cực kỳ quan trọng vì có thể thấy bất cân xứng tâm thất trong quý 1 thai kỳ, mà có thể thoái triển khi thai lớn dần. Rất khó chẩn đoán chính xác CoA trong quý 1 và thường dẫn đến các chẩn đoán dương tính giả.
.jpg)
Các bất thường liên quan
Trong CoA phức tạp, các bất thường tim liên quan hay gặp nhất bao gồm VSD lớn, van động mạch chủ hai mảnh, hẹp động mạch chủ ở mức van và dưới van, hẹp van hai lá, và tồn tại tĩnh mạch chủ trên bên trái, và rất khó thấy các bất thường tim liên quan này trên siêu âm quý 1, nếu không muốn nói là không thể. Các bất thường nhiễm sắc thể rất hay gặp trong CoA, trong đó hội chứng Turner là hay gặp nhất. Nếu đang nghi ngờ CoA mà kèm theo các dấu hiệu khác như nang bạch huyết (cystic hygroma) và / hoặc phù thai sớm thì nên xem xét chẩn đoán hội chứng Turner. CoA cũng có thể liên quan với các bất thường nhiễm sắc thể khác, chẳng hạn như trisomy 13 hoặc trisomy 18, đặc biệt khi có nhiều dị tật ngoài tim. CoA kèm theo nhịp tim nhanh, thai tăng trưởng chậm và / hoặc nhiều bất thường cấu trúc là các dấu hiệu gợi ý trisomy 13.
Các dấu hiệu trên siêu âm
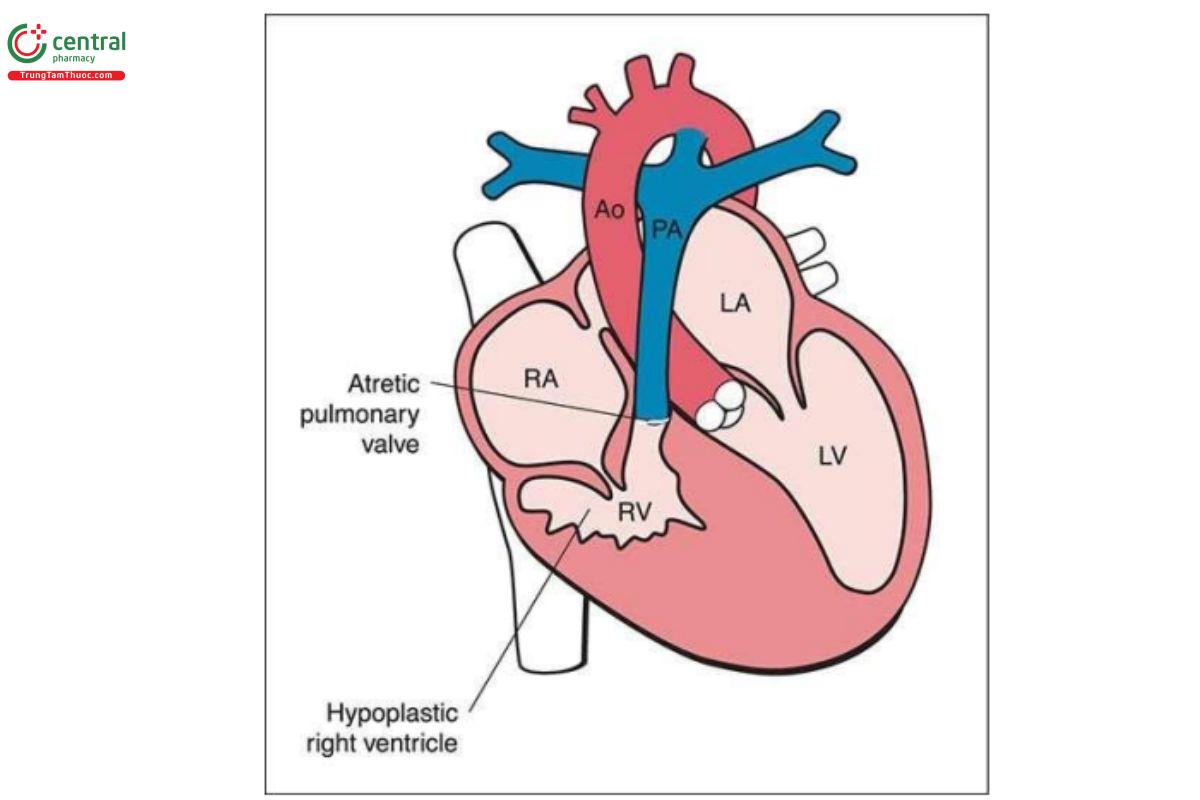
Có thể nghi ngờ PA-IVS trong quý 1 khi phát hiện thất phải thiểu sản, nhỏ, giảm vận động ở 4CV (Hình 11.18A). Mô tả giải phẫu của thất phải tương tự như thất trái trong HLHS. Trong hầu hết các trường hợp, dấu hiệu này được hỗ trợ bởi Doppler màu cho thấy không có sự đổ đầy thất phải ở 4CV (Hình 11.18B) và dòng chảy ngược trong ống động mạch và động mạch phổi ở mặt cắt 3VT (Hình 11.18C). Van ba lá loạn sản thường bị hở, và có thể thấy dòng trào ngược ở mức van trên Doppler màu và xung.
Các bất thường liên quan
Một trong những bất thường chính liên quan với PA-IVS và thất phải thiểu sản là bất thường động mạch vành, cụ thể là rò động mạch vành-thất phải (ventriculo-coronary arterial communication), gặp ở khoảng 1/3 trường hợp PA-IVS nhưng thường không thấy ở tuổi thai nhỏ. Các bất thường tim liên quan khác bao gồm dãn nhĩ phải, bất thường van ba lá, tắc nghẽn dưới van động mạch chủ (subvalvular obstruction of the aortic valve), thông liên nhĩ, dextrocardia và chuyển vị đại động mạch (transposition of great arteries). Trong quý 2, nên siêu âm đánh giá thai nhi tuần tự từng phần để loại trừ hội chứng đồng dạng, đặc biệt với các bất thường situs. Các bất thường ngoài tim cũng có thể gặp nhưng không có dạng đặc hiệu cho bất kỳ cơ quan nào. Các bất thường nhiễm sắc thể như trisomy 21, hoặc vi mất đoạn 22q11.2 rất hiếm gặp.
Các dấu hiệu trên siêu âm
Có thể nghi ngờ PA-IVS trong quý 1 khi phát hiện thất phải thiểu sản, nhỏ, giảm vận động ở 4CV (Hình 11.18A). Mô tả giải phẫu của thất phải tương tự như thất trái trong HLHS. Trong hầu hết các trường hợp, dấu hiệu này được hỗ trợ bởi Doppler màu cho thấy không có sự đổ đầy thất phải ở 4CV (Hình 11.18B) và dòng chảy ngược trong ống động mạch và động mạch phổi ở mặt cắt 3VT (Hình 11.18C). Van ba lá loạn sản thường bị hở, và có thể thấy dòng trào ngược ở mức van trên Doppler màu và xung.
Các bất thường liên quan
Một trong những bất thường chính liên quan với PA-IVS và thất phải thiểu sản là bất thường động mạch vành, cụ thể là rò động mạch vành-thất phải (ventriculo-coronary arterial communication), gặp ở khoảng 1/3 trường hợp PA-IVS nhưng thường không thấy ở tuổi thai nhỏ. Các bất thường tim liên quan khác bao gồm dãn nhĩ phải, bất thường van ba lá, tắc nghẽn dưới van động mạch chủ (subvalvular obstruction of the aortic valve), thông liên nhĩ, dextrocardia và chuyển vị đại động mạch (transposition of great arteries). Trong quý 2, nên siêu âm đánh giá thai nhi tuần tự từng phần để loại trừ hội chứng đồng dạng, đặc biệt với các bất thường situs. Các bất thường ngoài tim cũng có thể gặp nhưng không có dạng đặc hiệu cho bất kỳ cơ quan nào. Các bất thường nhiễm sắc thể như trisomy 21, hoặc vi mất đoạn 22q11.2 rất hiếm gặp.
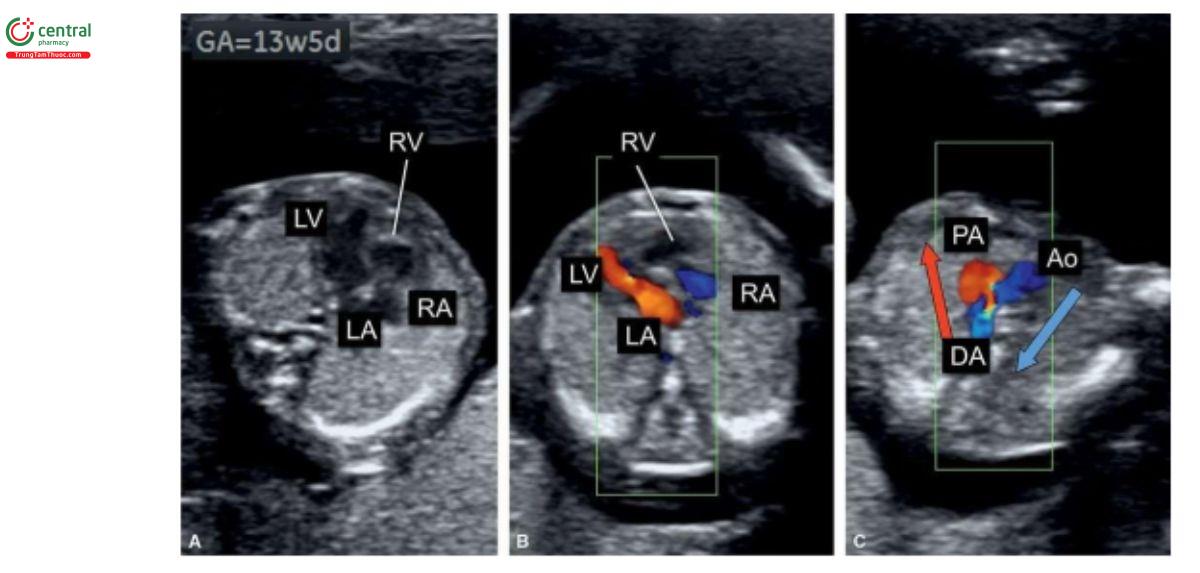
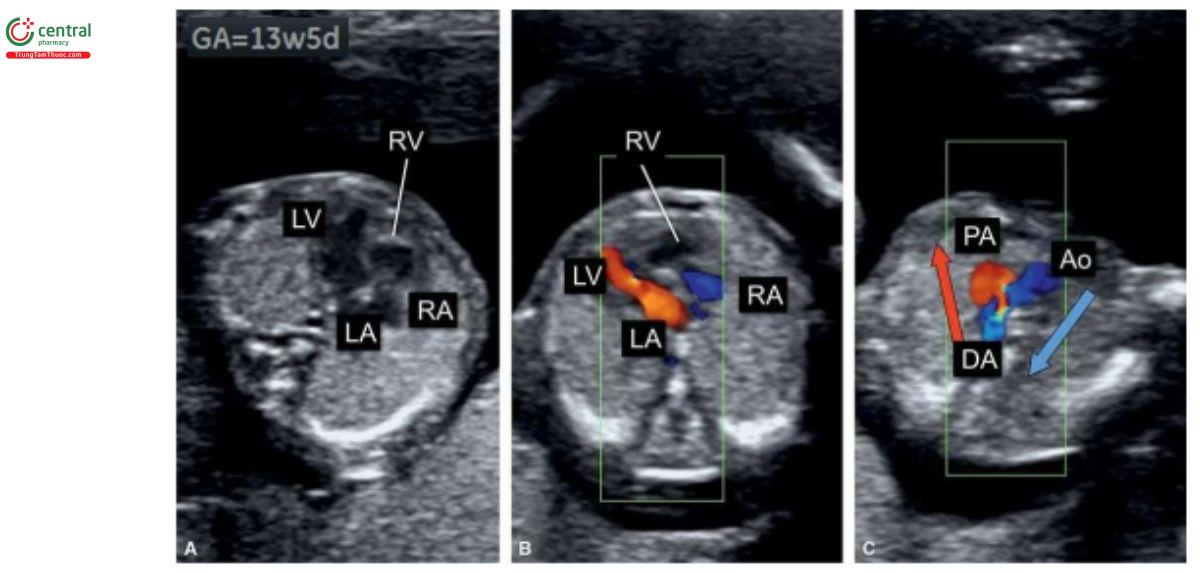
Teo van ba lá kèm thông liên thất (Tricuspid Atresia with Ventricular Septal Defect)
Định nghĩa
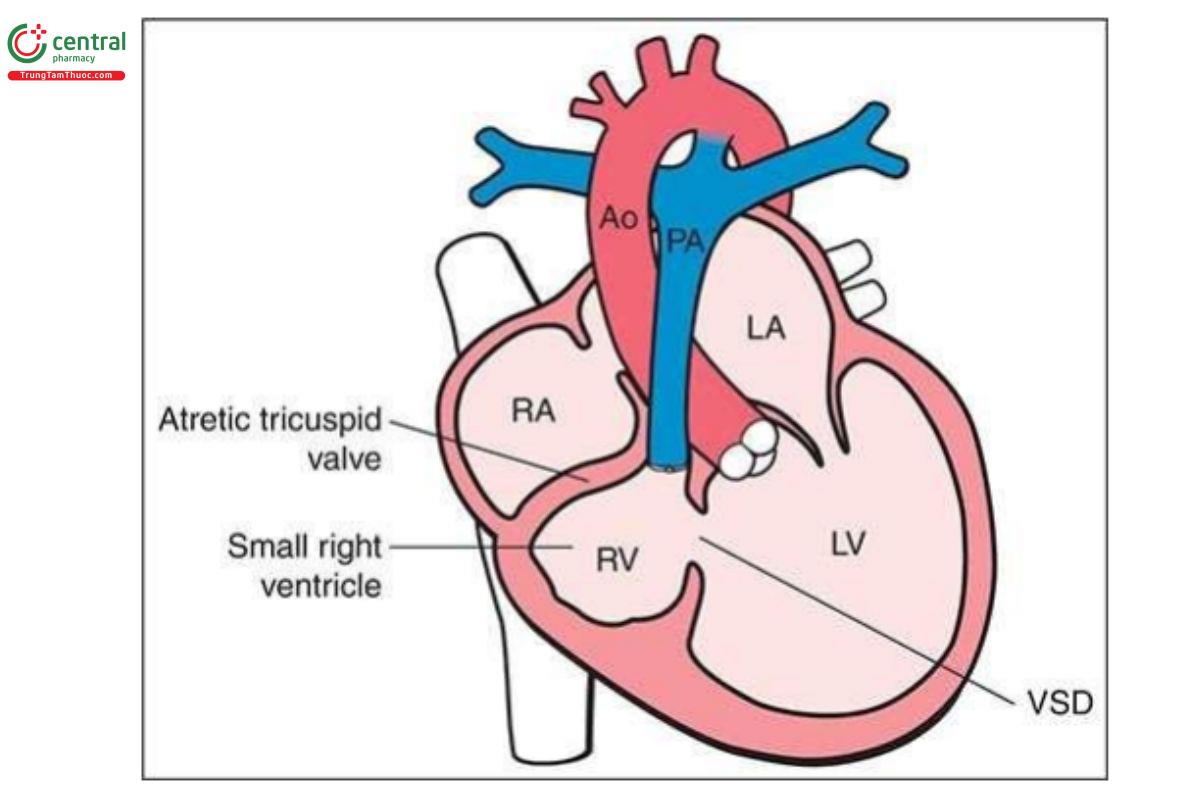
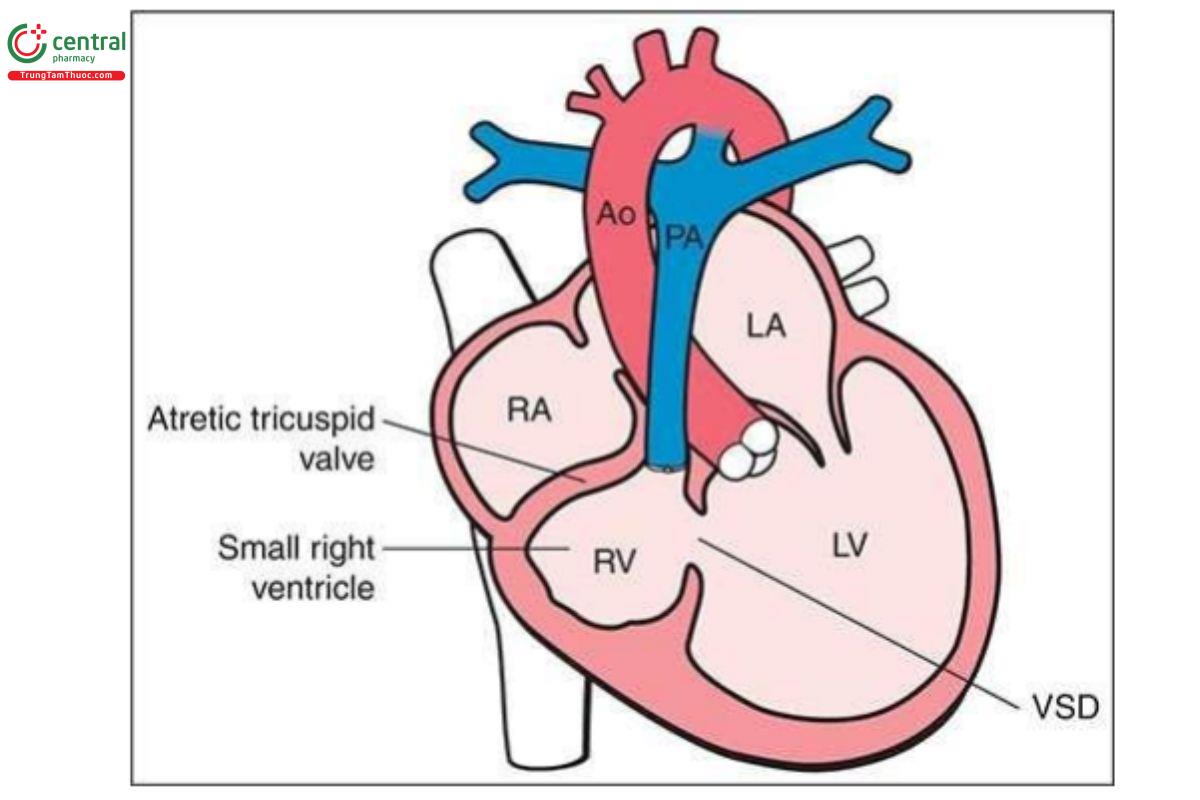
Teo van ba lá kèm thông liên thất (TA-VSD) đặc trưng bởi tình trạng không có kết nối nhĩ thất bên phải, dẫn đến không có sự thông thương giữa nhĩ phải và thất phải. Do đó, thất phải có kích thước rất nhỏ. VSD phần nhận, thường là quanh màng, luôn có, và kích thước thất phải có liên quan với kích thước VSD. Một sự thông thương lớn giữa hai tâm nhĩ, dưới dạng lỗ bầu dục hoặc thông liên nhĩ lớn là cần thiết khi van ba lá bị tắc nghẽn. TA được phân thành 3 type dựa trên định hướng không gian của các đại động mạch.
TA type 1 gặp trong 70% đến 80% trường hợp và kèm theo các đại động mạch có định hướng bình thường. TA type 2 gặp trong 12% đến 25% trường hợp và kèm theo chuyển vị đại động mạch hoàn toàn (D-transposition of the great vessels). Còn lại là TA type 3, một dị tật không thường gặp, và thường có các bất thường đại động mạch phức tạp, chẳng hạn như thân chung động mạch (truncus arteriosus) hoặc L-transposition. TA rất hiếm gặp, với tỷ lệ 0,8 trên 10.000 trẻ sinh sống (3). Hình 11.19 là hình vẽ minh họa TA-VSD type 1.
Các dấu hiệu trên siêu âm
Có thể chẩn đoán TA-VSD trong quý 1 trên siêu âm 2D và Doppler màu ở 4CV. Ở 4CV trên siêu âm 2D thường thấy thất trái lớn và thất phải thiểu sản và Doppler màu trên siêu âm qua ngả bụng dường như chỉ thấy tim một thất. Với đầu dò âm đạo và đầu dò qua ngả bụng độ phân giải cao, thấy thất phải thiểu sản và VSD với dòng máu từ thất trái sang thất phải (Hình 11.20A). Trong TA-VSD type 1, ở mặt cắt 3VT, động mạch phổi nhỏ hơn động mạch chủ với dòng chảy xuôi dòng (antegrade flow) ở cả hai động mạch lớn (Hình 11.20B). TA-VSD có liên quan với NT dày trong quý 1. Sóng A đảo ngược trong DV đã được báo cáo trong quý 2 và 3 của thai kỳ có liên quan với TA-VSD, và dấu hiệu này có thể gặp trong quý 1 và có thể là dấu hiệu sớm của tăng tiền tải nhĩ phải (right atrial increased preload).
Các bất thường liên quan
Các bất thường tim liên quan bao gồm sự thông thương giữa hai nhĩ lớn, chẳng hạn như lỗ bầu dục lớn hoặc thông liên nhĩ, VSD, chuyển vị đại động mạch và tắc nghẽn đường thoát thất phải ở các mức độ khác nhau. Các bất thường ngoài tim cũng có thể gặp và nên làm nhiễm sắc thể đồ thai nhi, mặc dù TA rất hiếm khi kèm theo bất thường nhiễm sắc thể, bao gồm cả vi mất đoạn 22q11.
Kênh nhĩ thất (Atrioventricular Septal Defect)
Định nghĩa
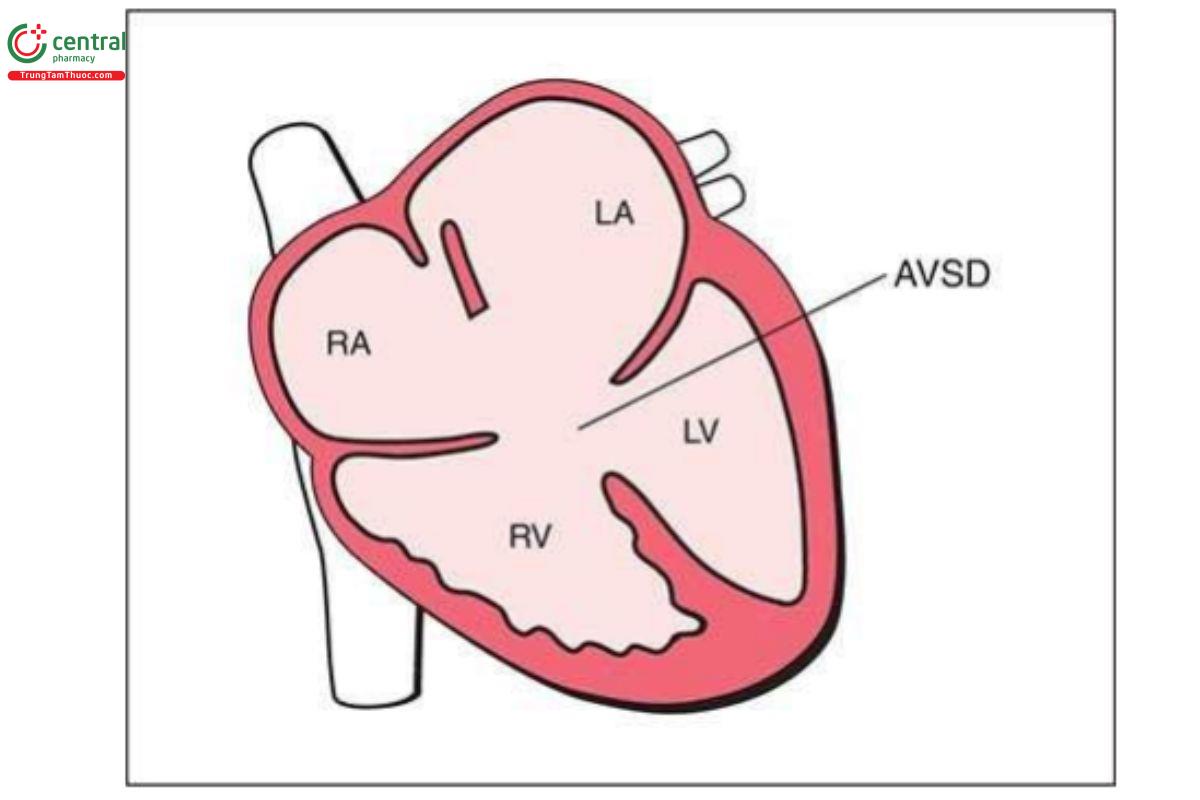
Kênh nhĩ thất (AVSD) là một bất thường tim, đặc trưng bởi khiếm khuyết vách nhĩ thất và bất thường van nhĩ thất, chủ yếu dẫn đến khúc nối nhĩ thất chung (common AV junction). Các từ đồng nghĩa với AVSD hay dùng bao gồm “AV canal defect” hoặc “endocardial cushion defect”. Trong AVSD toàn phần, có sự kết hợp giữa thông liên nhĩ vách nguyên phát và thông liên thất phần nhận với van nhĩ thất chung bất thường kết nối với thất phải và trái (Hình 11.21) và thường có 5 lá. AVSD bán phần bao gồm thông liên nhĩ vách nguyên phát và khe hở van hai lá (cleft in the mitral valve) với 2 vòng van hai lá và van ba lá riêng biệt nhưng bám ở cùng một mức trên vách liên thất. AVSD bán phần rất khó phát hiện trong quý 1. AVSD cũng có thể được phân loại là cân bằng hoặc không cân bằng. Trong AVSD thể không cân bằng, kết nối AV chủ yếu đổ vào một trong hai thất, dẫn đến bất cân xứng kích thước tâm thất. AVSD thể không cân bằng thường liên quan với hội chứng đồng dạng. AVSD là dị tật tim hay gặp với tỷ lệ 4% đến 7,4% tổng trẻ nhỏ mắc CHD.
Các dấu hiệu trên siêu âm
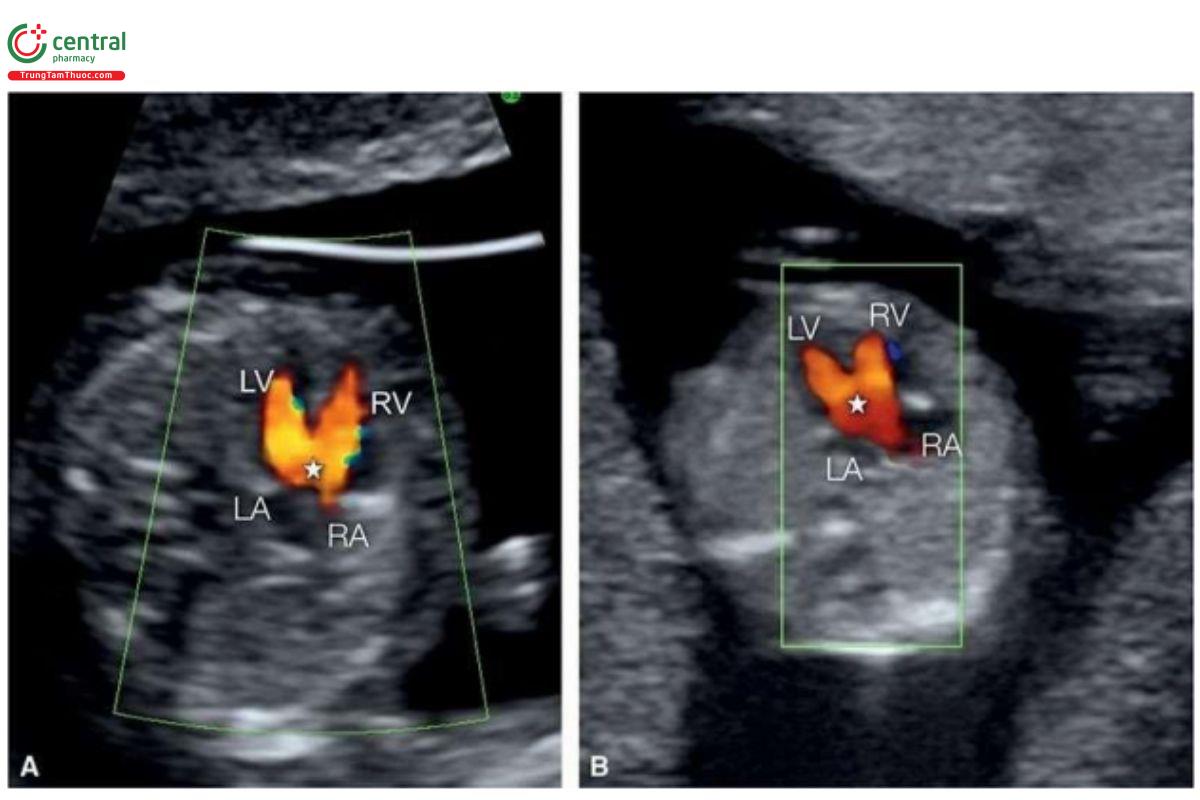
Có thể phát hiện AVSD trong quý 1 khi thấy khiếm khuyết ở giữa tim trong thì tâm trương trên siêu âm 2D ở 4CV (Hình 11.22A). Ở 4CV từ mỏm trong thì tâm thu, có thể thấy các van nhĩ thất bám thẳng hàng, mặc dù khá khó thấy trong quý 1. Doppler màu chỉ thấy 1 dòng máu đi vào AV chung (Hình 11.22B và 11.23) thay vì 2 dòng riêng biệt qua van ba lá và van hai lá như trong tim bình thường (Hình 11.3). Đôi khi, khiếm khuyết lớn đến mức mà hình ảnh giống như tim một thất (univentricular heart). Một dấu hiệu điển hình là hở van nhĩ thất chung trên Doppler màu (Hình 11.24). NT dày thường gặp trong AVSD và sự kết hợp này gợi ý trisomy 21 hoặc 18. AVSD kèm theo block tim hoặc dạ dày ở bên phải làm gia tăng nghi ngờ mắc hội chứng đồng dạng.
Các bất thường liên quan
Trong AVSD, các bất thường tim liên quan bao gồm TOF, thất hai đường ra (double outlet ventricle), cung động mạch chủ bên phải và các bất thường thân nón (conotruncal) khác. Các bất thường ngoài tim trong AVSD chủ yếu là các bất thường nhiễm sắc thể, phần lớn là trisomy 21 và ít gặp hơn là trisomy 18 và 13. Khoảng 40% đến 45% trẻ mắc hội chứng Down có CHD, và trong số này, 40% là AVSD và phần lớn là toàn phần. 58% trường hợp AVSD đơn độc được chẩn đoán trước sinh có kèm theo trisomy 21. Khi AVSD kèm theo hội chứng đồng dạng thì nguy cơ bất thường nhiễm sắc thể gần như bằng 0, nhưng kết cục xấu hơn vì mức độ nghiêm trọng của các dị tật tim và ngoài tim.
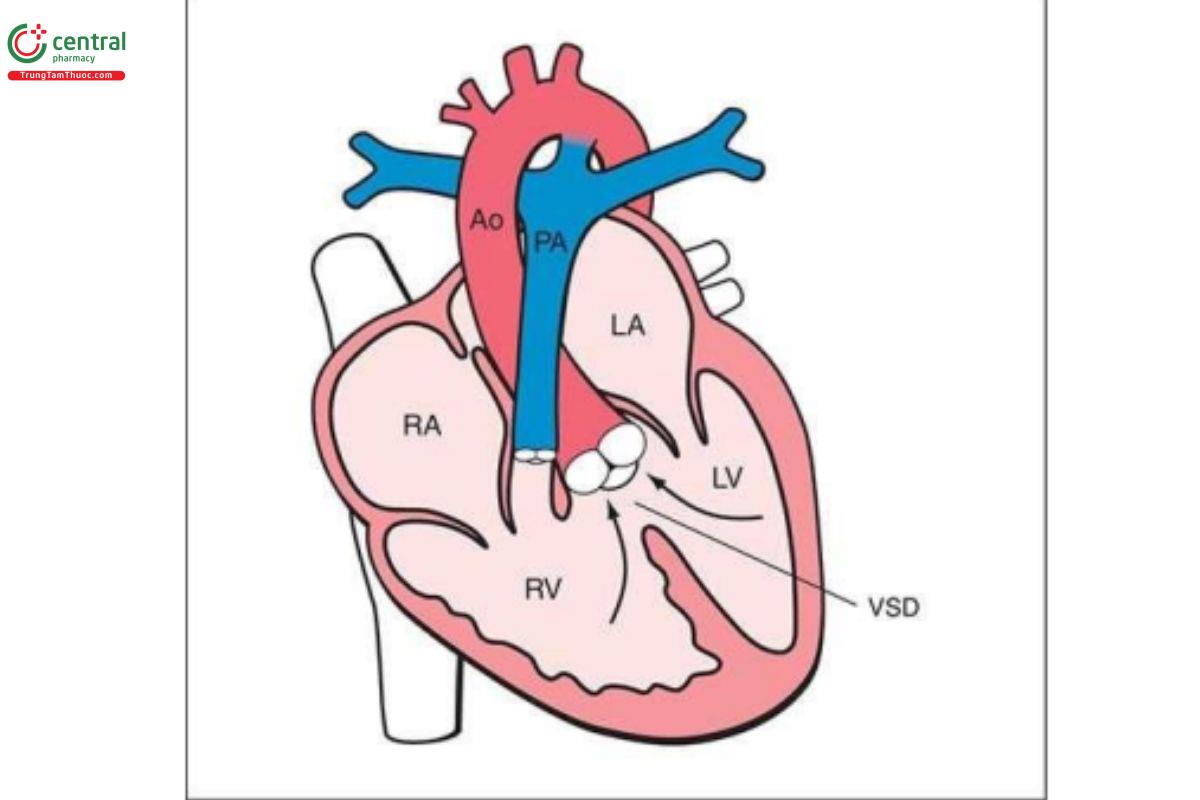
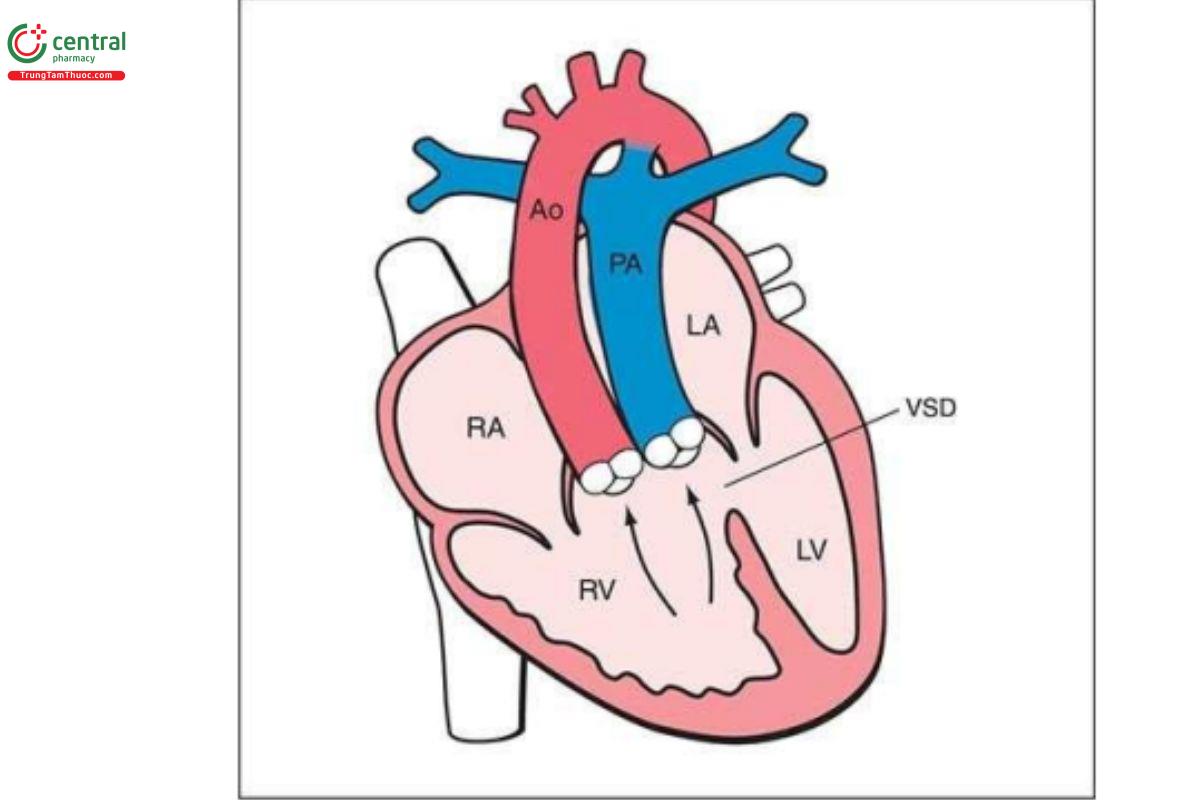
Thông liên thất (Ventricular Septal Defect-VSD)
Định nghĩa
VSD là khiếm khuyết ở vách liên thất, dẫn đến sự thông thương về mặt huyết động giữa thất trái và thất phải. VSD là CHD phổ biến, chỉ đứng sau van động mạch chủ hai mảnh (bicuspid aortic valve). Thông thường, VSD được báo cáo dựa trên vị trí giải phẫu của chúng trên vách liên thất. Trong các loạt báo cáo ca bệnh trước sinh (prenatal series), VSD phần cơ là phổ biến nhất và chiếm khoảng 80% đến 90%, trong đó VSD quanh màng là phổ biến thứ hai. VSD thường liên quan với các bất thường tim khác.
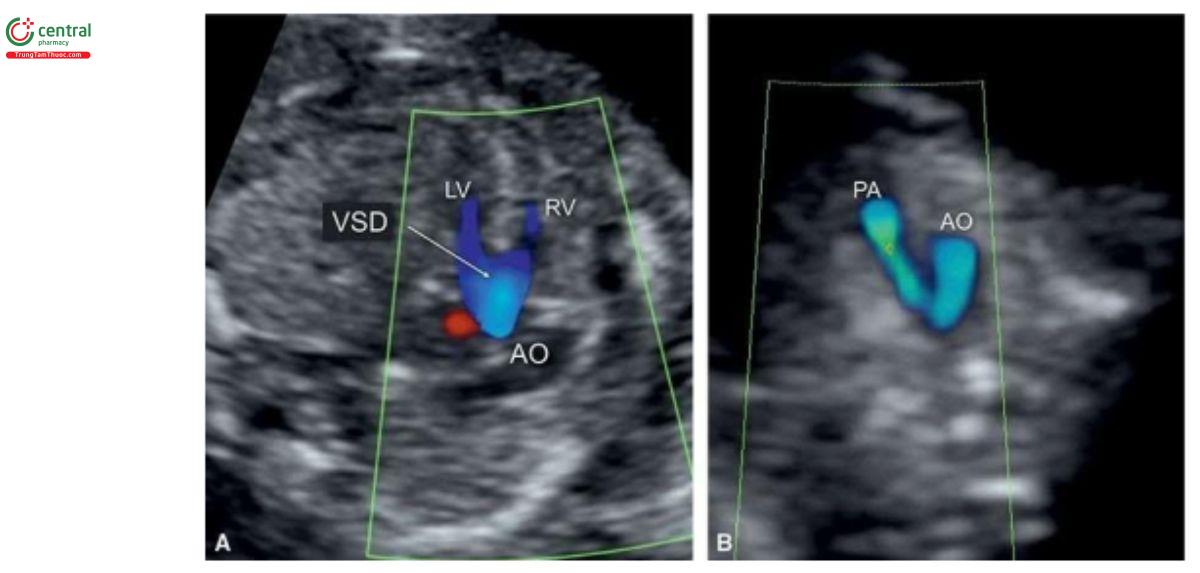
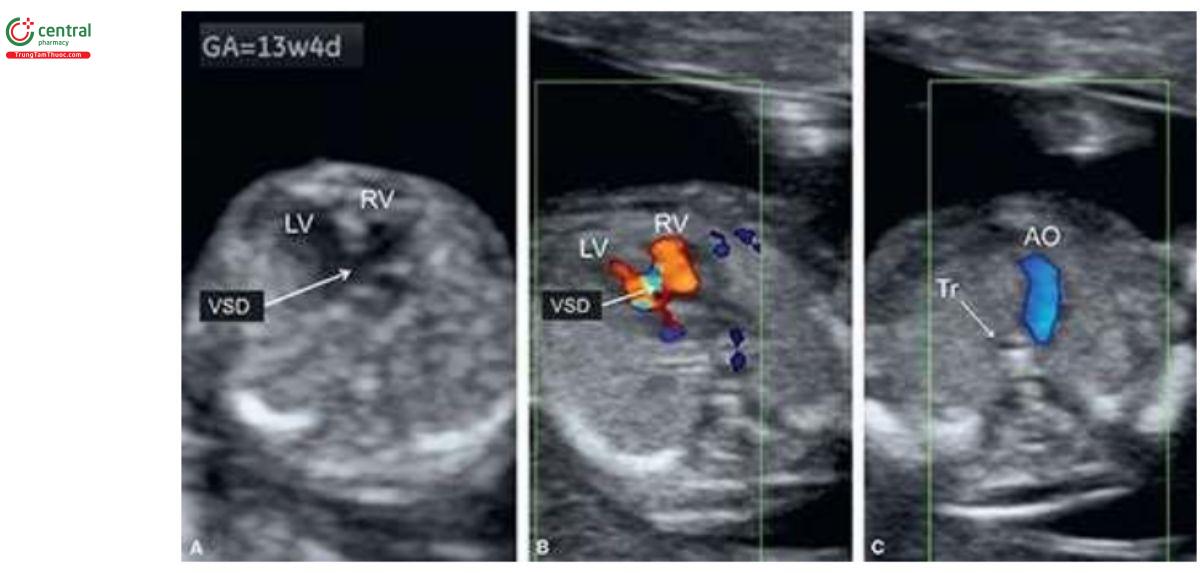
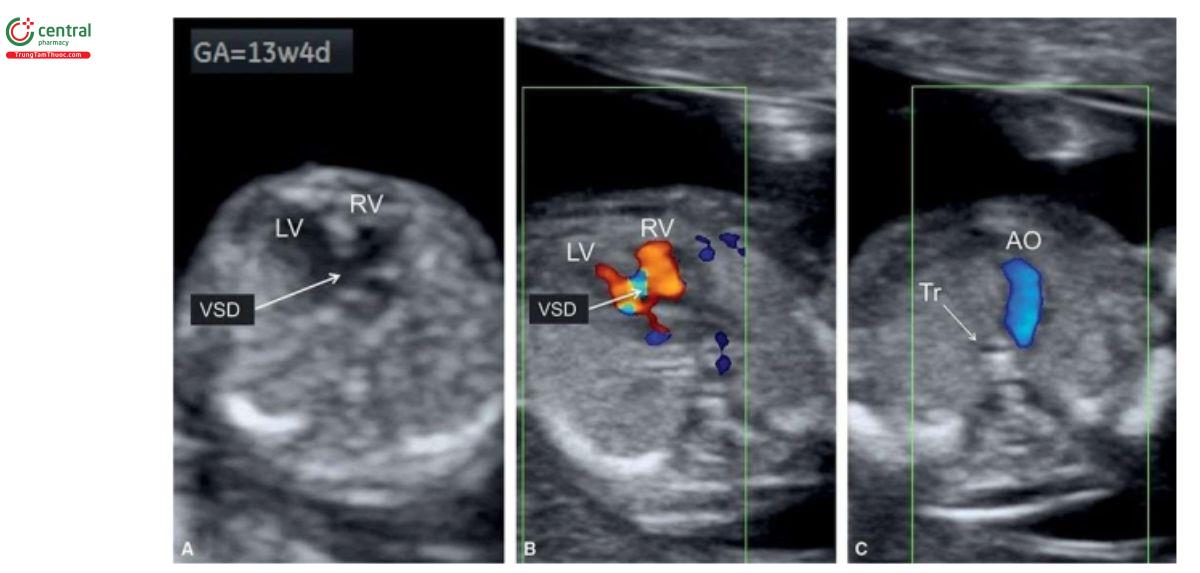
Các dấu hiệu trên siêu âm
VSD thường quá nhỏ để có thể chẩn đoán xác định như là bất thường đơn độc trong quý 1. Cần thận trọng khi chẩn đoán VSD ở tuổi thai nhỏ vì tỷ lệ chẩn đoán dương tính giả khá cao do xảo ảnh "echo dropout" trên siêu âm 2D và "overlapping" màu với Doppler màu. Trong hầu hết các trường hợp, thấy rõ VSD khi kèm theo bất thường tim khác (Hình 11.25A) hoặc khi giải phẫu mặt cắt bốn buồng bất thường. Trong quý 1, thấy dòng máu chảy qua VSD giúp xác nhận chẩn đoán (Hình 11.25B), nhưng khi nghi ngờ, cần siêu âm đánh giá lại VSD sau 16 tuần tuổi thai.
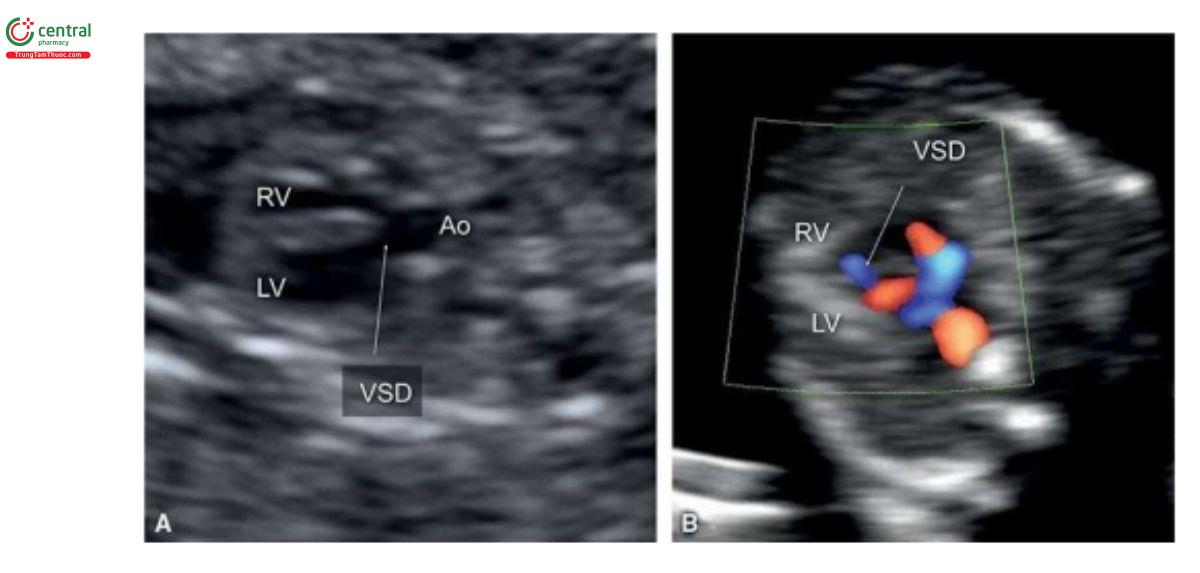
Các bất thường liên quan
Các bất thường tim liên quan rất hay gặp và thường được chẩn đoán trước khi phát hiện VSD trong quý 1. Bất thường ngoài tim kèm theo VSD làm tăng nguy cơ mắc hội chứng hoặc bất thường nhiễm sắc thể. VSD là những bất thường hay gặp nhất trong nhiều bất thường nhiễm sắc thể, chẳng hạn như trisomy 21, 18 và 13. VSD phần cơ đơn độc có nguy cơ bất thường nhiễm sắc thể tương tự như thai kỳ bình thường.
Bất thường Ebstein
Định nghĩa
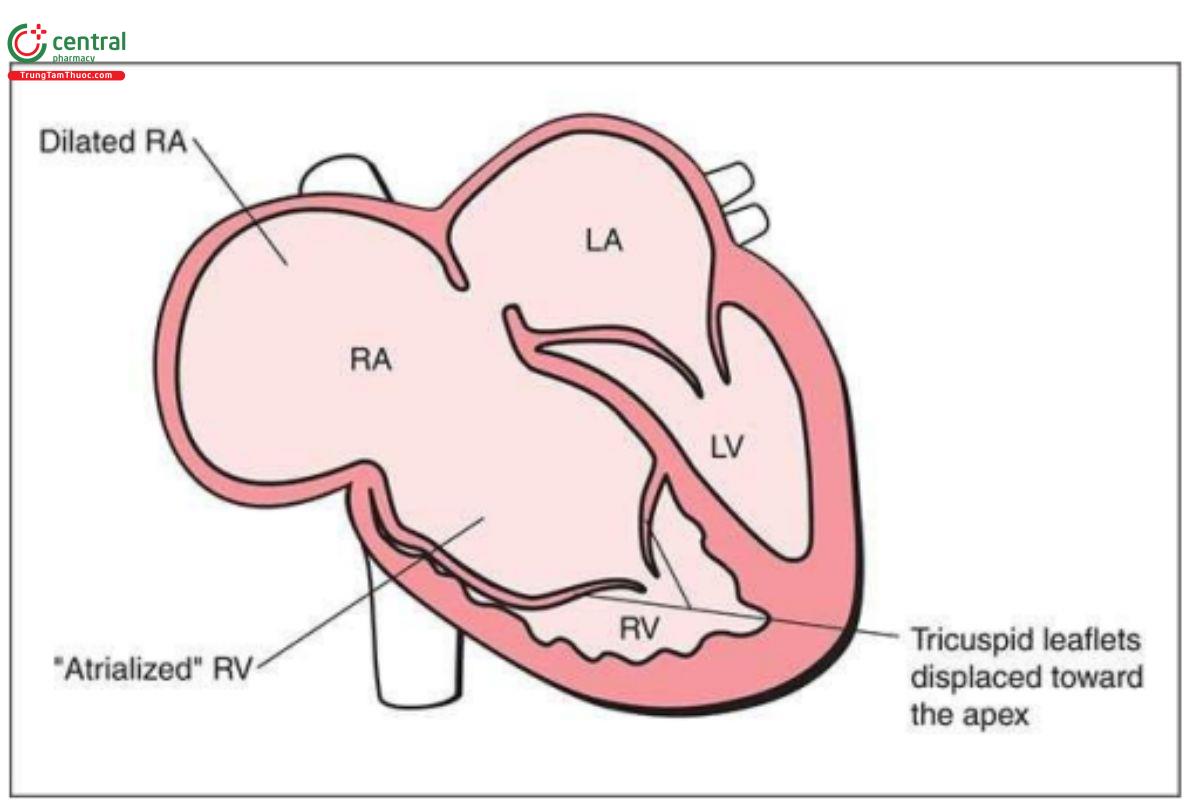
Trong bất thường Ebstein, các lá vách và lá sau của van ba lá bị dịch chuyển xuống dưới từ vòng van ba lá, về phía mỏm tim, và xuất phát từ cơ tim thất phải (Hình 11.26). Lá trước van ba lá vẫn ở vị trí bám bình thường của nó vào vòng van. Phần gần của thất phải sau đó liên tục với nhĩ phải thực sự và tạo thành phần "tâm nhĩ hóa" (atrialized) của thất phải (Hình 11.26). Phổ bất thường Ebstein rất rộng và thay đổi từ dạng nhẹ, với van ba lá bị dịch chuyển rất ít kèm theo hở van ba lá nhẹ, đến dạng nặng, với tình trạng "tâm nhĩ hóa" của toàn bộ thất phải. Bất thường Ebstein là một trong những bất thường tim ít gặp, tỷ lệ khoảng 0,5% đến 1% bệnh tim bẩm sinh ở trẻ sinh sống.
Các dấu hiệu trên siêu âm
Bất thường Ebstein được phát hiện trong quý 1 do TR đáng kể, và các dấu hiệu chính khác như tim to và nhĩ phải dãn thường thấy ở tuổi thai lớn hơn. Có thể thấy vị trí bám của van ba lá bị dịch chuyển về phía mỏm trong thất phải trên siêu âm 2D ở 4CV từ mỏm hoặc từ bên (Hình 11.27A). Có thể thấy rõ TR nặng xuất phát gần mỏm của RV trên Doppler màu và xung (Hình 11.27B và C). Trong quý 1, với trường hợp bất thường Ebstein nặng, khi phát hiện to tim kèm theo NT dày và phù thai, thì đây là các dấu hiệu báo trước thai nhi sắp tử vong. Mặc dù có thể nghi ngờ một số trường hợp bất thường Ebstein nặng trong quý 1, nhưng các trường hợp Ebstein nhẹ có thể bị bỏ sót và chỉ được phát hiện trong quý 2. TR đáng kể trong quý 1 có thể là dấu hiệu của bất thường Ebstein, và thường được xác nhận trong quý 2.
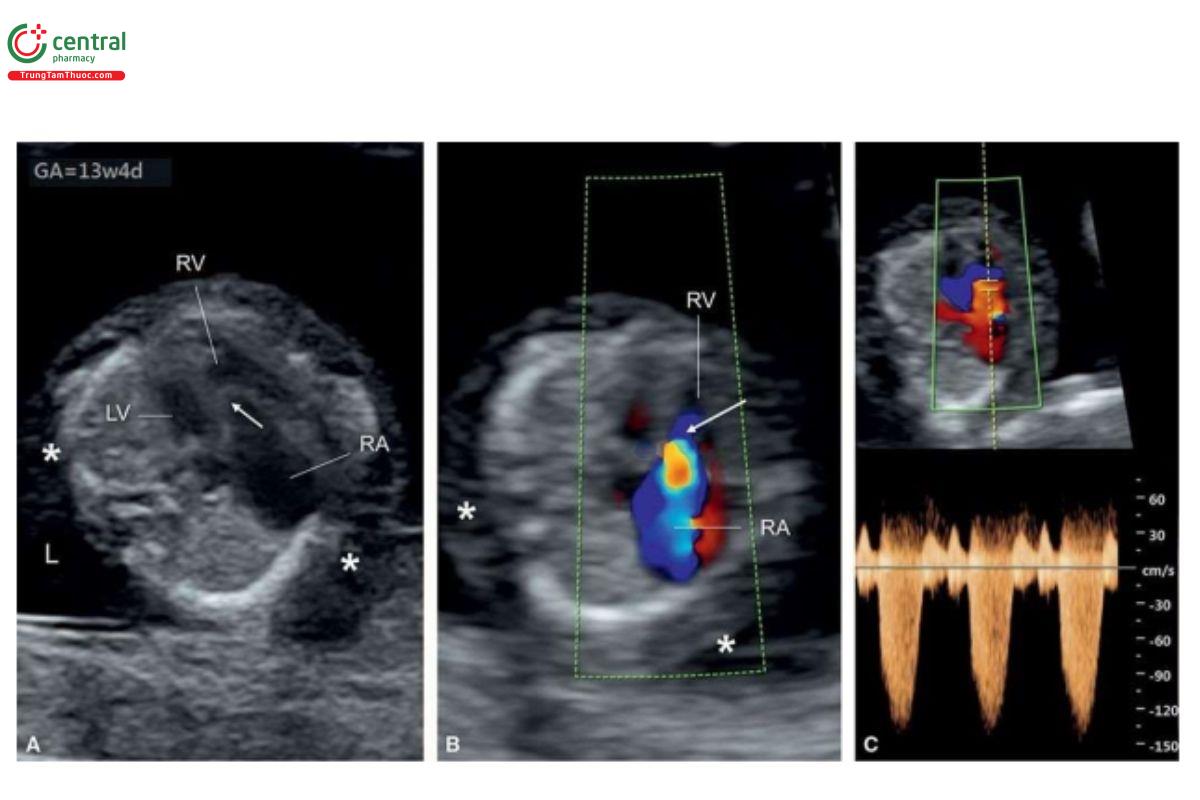
Các bất thường liên quan
Các bất thường tim liên quan bao gồm tắc nghẽn đường ra thất phải như hẹp hoặc teo động mạch phổi gặp ở > 60% thai nhi được chẩn đoán mắc bất thường Ebstein.38 Thông liên nhĩ, thường không rõ trong quý 1, là mối liên quan phổ biến khác và được báo cáo ở 60% trẻ em có bất thường Ebstein. Hầu hết các trường hợp bất thường Ebstein là đơn độc, nhưng cũng có liên quan với các bất thường nhiễm sắc thể, chẳng hạn như trisomy 21 hoặc trisomy 13, đã được báo cáo ngoài các trường hợp mang tính chất gia đình. Các biến chứng lâu dài của Ebstein bao gồm thiểu sản phổi ở trẻ sơ sinh và rối loạn nhịp tim ở trẻ em.
Tim một thất (Univentricular Heart)
Định nghĩa
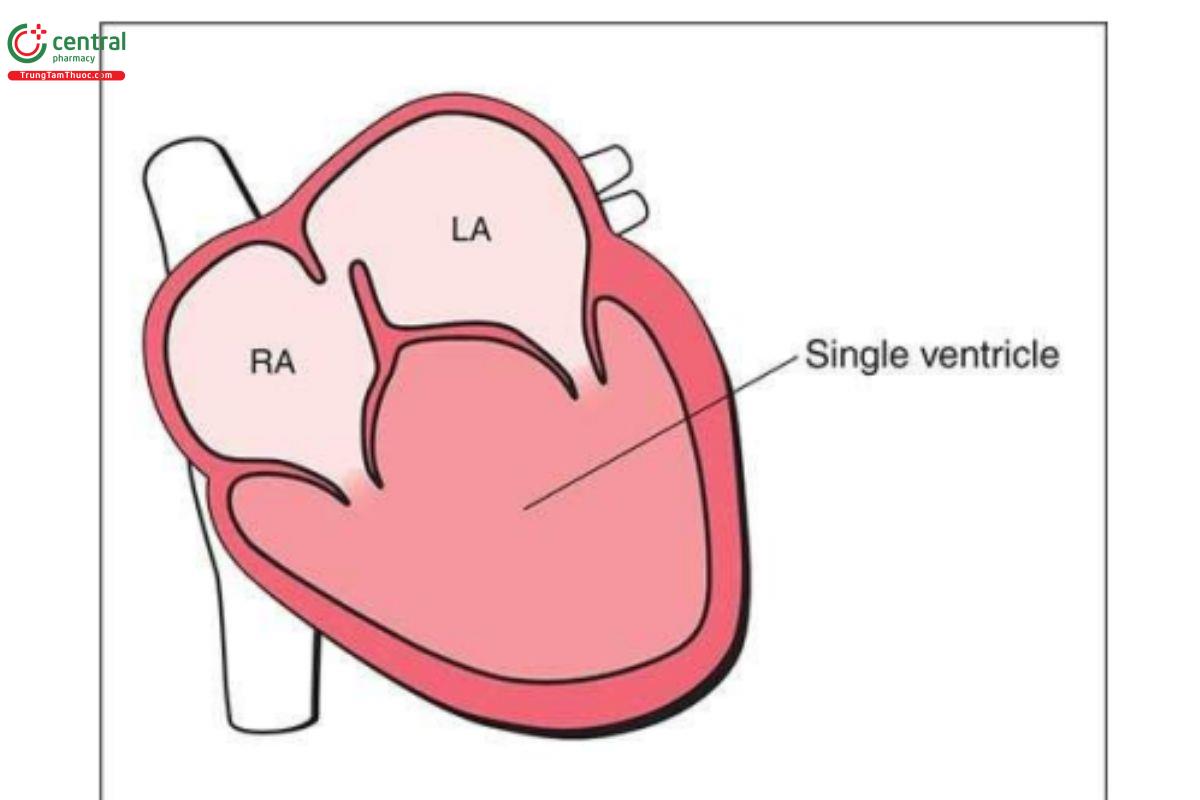
Tim một thất hoặc kết nối nhĩ thất một thất (univentricular AV connection) mô tả một nhóm các dị tật tim trong đó kết nối nhĩ thất hoàn toàn hoặc chủ yếu với một buồng thất đơn độc (single ventricular chamber). Về mặt phôi thai học, dị tật này được cho là kết quả của sự thất bại trong quá trình phát triển ở giai đoạn quai hành thất (bulboventricular loop stage). Từ quan điểm lâm sàng, CHD với tim một thất mô tả trái tim chỉ có một tâm thất hoạt động với dòng chảy vào từ một hoặc cả hai nhĩ. Trong tim một thất, có thể chia thành 3 phân nhóm (subgroups): 2 đường vào (double inlet), trong đó 2 tâm nhĩ kết nối với 1 tâm thất qua 2 van nhĩ thất; chỉ có 1 đường vào (single inlet), trong đó 1 tâm nhĩ kết nối với 1 tâm thất đơn độc qua 1 van nhĩ thất duy nhất; và đường vào chung (common inlet), trong đó cả 2 tâm nhĩ kết nối với 1 tâm thất đơn độc qua 1 van nhĩ thất duy nhất. Hình thái tâm thất thường là hình thái của thất trái với buồng thất phải sơ khai (rudimentary right chamber). Hình 11.28 là hình vẽ minh họa tim một thất với thất hai đường vào (double inlet ventricle).
Các dấu hiệu trên siêu âm
Trong quý 1, khá hay gặp tim một thất, không phải vì bản thân tình trạng này là phổ biến, mà là do một số dị tật tim nặng có biểu hiện tim một thất trên siêu âm 2D và Doppler màu. Điều thú vị là tim một thất cổ điển hiếm khi được phát hiện trong quý 1 và như trong Hình 11.29, bất thường này thường bị bỏ sót do thấy hai dòng chảy vào trên Doppler màu. Do kích thước tim trong quý 1 rất nhỏ, một số dị tật tim như HLHS, teo van ba lá, teo van hai lá, AVSD lớn và CoA nặng có thể biểu hiện như tim một thất, đặc biệt khi siêu âm qua ngả bụng với Doppler màu (Hình 11.11, 11.12 và 11.22). Trong quý 1, khi nghi ngờ tim một thất trên Doppler màu, nên đánh giá kỹ lưỡng tim thai với siêu âm qua ngả âm đạo để xác định bất thường tim cụ thể. Trong những trường hợp như vậy, ưu tiên siêu âm 2D tim thai qua ngả âm đạo đầu tiên và đánh giá chi tiết giải phẫu của các buồng tim và các đại động mạch trước khi bật Doppler màu. Hình 11.30 cho thấy các dị tật tim khác mà ban đầu được nghi ngờ là tim một thất trên Doppler màu.
Các bất thường liên quan
Trong tim một thất, các bất thường liên quan là teo, thiểu sản van nhĩ thất hoặc van nhĩ thất cưỡi ngựa, tắc nghẽn đường ra động mạch phổi (hoặc dưới động mạch phổi), tắc nghẽn đường ra động mạch chủ (hoặc dưới động mạch chủ) và các bất thường về dẫn truyền, chủ yếu là do gián đoạn hệ thống dẫn truyền về mặt giải phẫu. Đa số các bất thường tim liên quan này có thể không rõ ràng hoặc khó phát hiện trong ba tháng đầu thai kỳ.
Bất thường ngoài tim quan trọng nhất cần loại trừ là đồng dạng phải hoặc trái, đặc biệt khi thấy tâm thất đơn độc có đường vào chung. Các bất thường nhiễm sắc thể và ngoài tim khác khá hiếm gặp.
Hội chứng đồng dạng (Heterotaxy Syndrome), đồng dạng nhĩ (Atrial Isomerism) và Situs Inversus
Định nghĩa
Hội chứng đồng dạng (trong tiếng Hy Lạp, heteros có nghĩa là khác biệt và taxis có nghĩa là sắp xếp) là một thuật ngữ chung được dùng để mô tả toàn bộ phổ của sự sắp xếp các tạng bất thường. Thuật ngữ đồng dạng nhĩ phải và trái (right and left atrial isomerism) (trong tiếng Hy Lạp, iso có nghĩa là giống nhau và meros có nghĩa là phần) đã được đề xuất và sử dụng trong hội chứng đồng dạng vì hình thái tâm nhĩ mô tả tốt nhất sự sắp xếp các cơ quan. Đồng dạng các tạng trong lồng ngực đặc trưng bởi sự sắp xếp khá đối xứng của các cấu trúc không đối xứng, bao gồm cả tâm nhĩ và phổi, do đó cho phép phân loại thành 2 nhóm chính: đồng dạng bên trái hai bên, còn được gọi là đồng dạng nhĩ trái, và đồng dạng bên phải hai bên, còn được gọi là đồng dạng nhĩ phải. Hội chứng đồng dạng bao gồm đồng dạng nhĩ phải và trái phát hiện dao động từ 2,2% đến 4,2% trẻ nhỏ mắc CHD.
Situs inversus được định nghĩa là sự sắp xếp hình ảnh soi gương qua đường giữa (mirror-image arrangement) của các tạng trong ổ bụng và lồng ngực so với situs solitus (giải phẫu bình thường). Situs inversus bán phần có thể giới hạn ở các tạng trong ổ bụng và thường được gọi là situs inversus với levocardia hoặc giới hạn ở lồng ngực và được gọi là dextrocardia.
Các dấu hiệu trên siêu âm
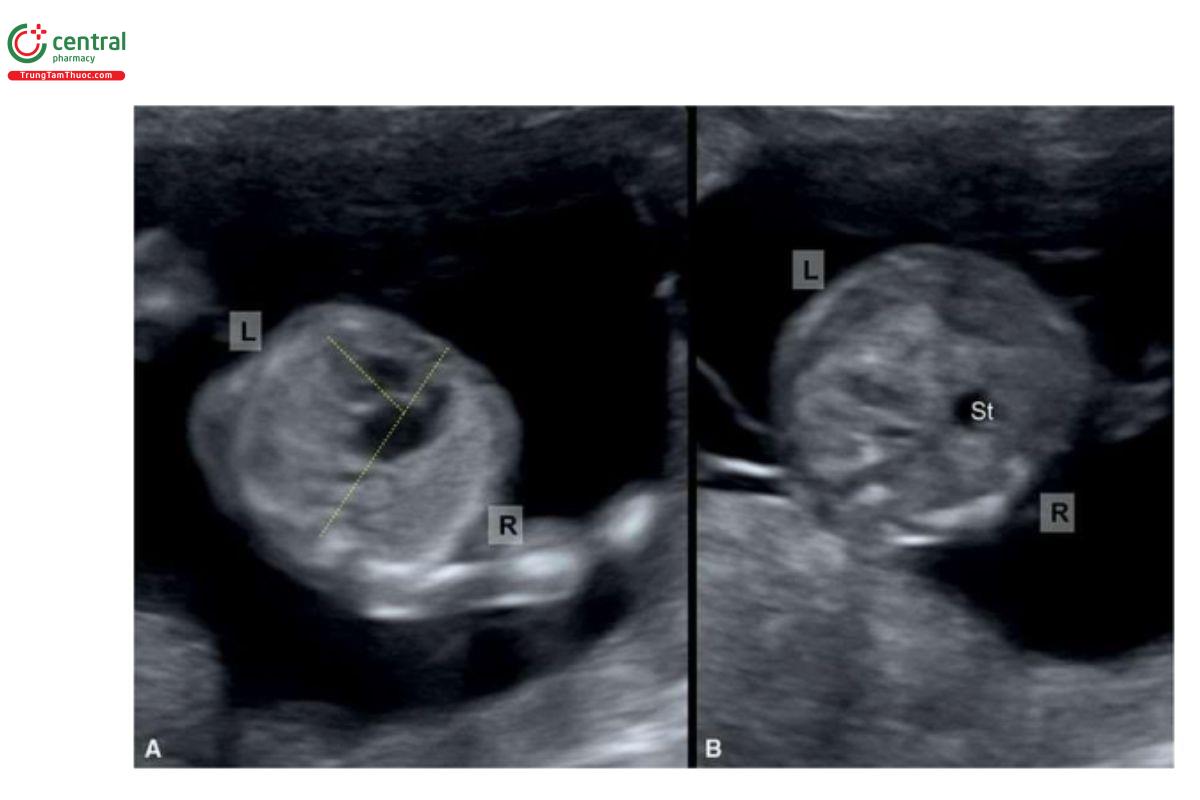
Có thể phát hiện đồng dạng bên phải và bên trái trong quý 1, do NT dày kết hợp với bất thường tim hoặc phù thai kết hợp với block tim hoàn toàn. Situs bất thường trên siêu âm quý 1, có thể là dấu hiệu gợi ý đầu tiên của đồng dạng bên phải hoặc bên trái (Hình 11.31 và 11.32). Cần phải nghi ngờ bất thường tim khi thấy trục tim lệch (Hình 11.31). Khi thấy block tim hoàn toàn trong quý 1 sẽ làm gia tăng nghi ngờ về đồng dạng nhĩ trái vì kháng thể Sjögren thường không liên quan với rối loạn nhịp chậm < 16 tuần tuổi. Trong quý 1, có thể phát hiện AVSD và tim một thất, và nghi ngờ các bất thường như vậy, đặc biệt khi kèm theo dạ dày bên phải, rất gợi ý hội chứng đồng dạng (Hình 11.31). Sự sắp xếp các mạch máu trong ổ bụng như động mạch chủ và IVC ở cùng bên của cơ thể (juxtaposition, đồng dạng bên phải) hoặc gián đoạn IVC với liên tục tĩnh mạch đơn (đồng dạng bên trái), sẽ rất khó chẩn đoán trong quý 1; tuy nhiên, dùng thêm Doppler màu có thể giúp ích cho chẩn đoán. Cũng có thể đánh giá hồi lưu tĩnh mạch phổi nhưng khá khó khăn trong quý 1. Có thể phát hiện situs inversus bán phần và toàn phần trong quý 1. Có thể khó xác định situs thai nhi khi siêu âm qua ngả âm đạo do khó khăn trong việc định hướng đầu dò. Nếu nghi ngờ bất thường situs, nên xác nhận ở tuổi thai lớn hơn.
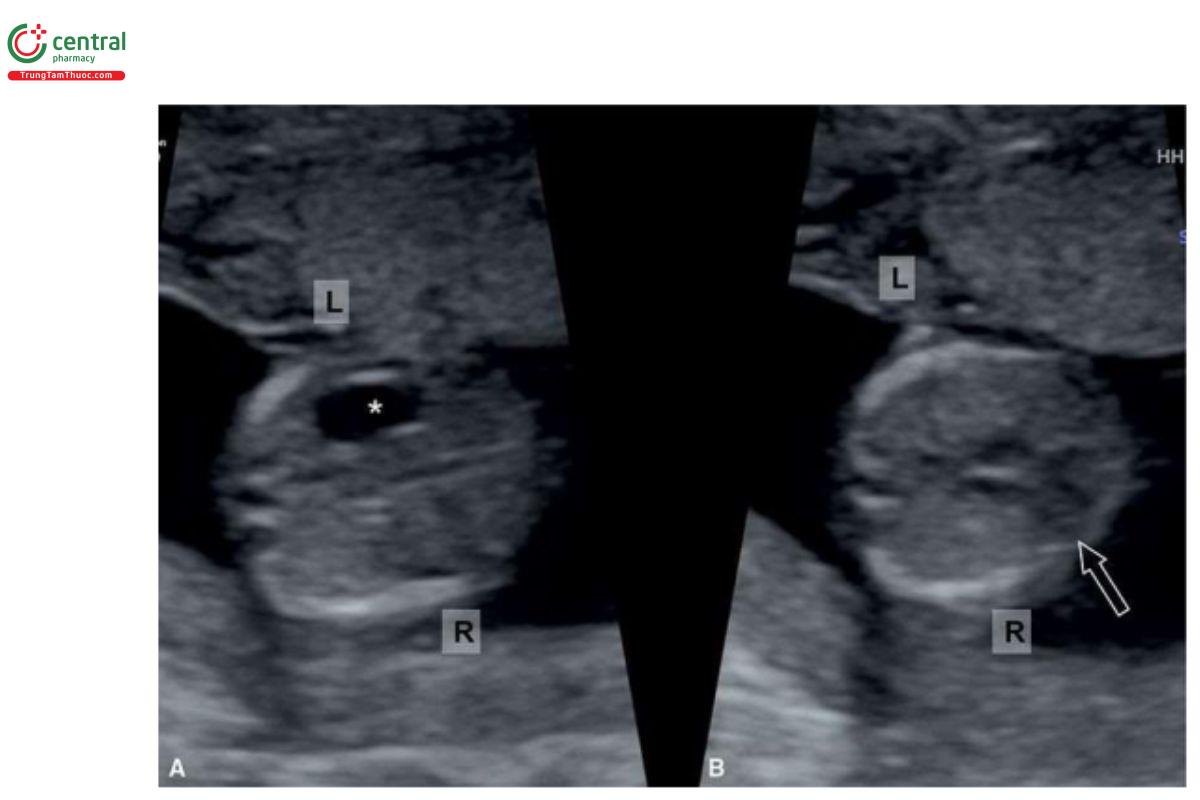
Các bất thường liên quan
Trong hội chứng đồng dạng, có vô số các bất thường tim liên quan và chủ yếu là AVSD và tim một thất. Các bất thường ngoài tim liên quan trong hội chứng đồng dạng thường không phát hiện được trong quý 1 và bao gồm các dị tật Đường tiêu hóa khác nhau và teo đường mật ngoài gan (extrahepatic biliary atresia).
Các bất thường tim liên quan với situs inversus khoảng 0,3% đến 5% bao gồm thông liên thất (VSD), tứ chứng Fallot (TOF), thất phải hai đường ra (DORV), và chuyển vị đại động mạch hoàn toàn hoặc có sửa chữa. Rối loạn vận động lông chuyển nguyên phát (primary ciliary dyskinesia) cũng gặp ở bệnh nhân có hội chứng đồng dạng và situs inversus toàn phần. Điều thú vị là, các bất thường nhiễm sắc thể như trisomy hầu như không gặp trong nhóm này.
Tứ chứng Fallot (Tetralogy of Fallot)
Định nghĩa
TOF đặc trưng bởi thông liên thất (VSD) dưới động mạch chủ (lệch hàng), gốc động mạch chủ cưỡi ngựa lên VSD (aortic root that overrides the VSD) và hẹp động mạch phổi ở mức phễu (infundibular) (Hình 11.33). Phì đại thất phải là đặc điểm giải phẫu thứ tư của "tứ chứng", thường không biểu hiện trước sinh. TOF với hẹp động mạch phổi là dạng cổ điển, nhưng phổ TOF bao gồm cả các dạng nặng, chẳng hạn như TOF với teo động mạch phổi (pulmonary atresia) và TOF với không van động mạch phổi (absent pulmonary valve). TOF là một trong những dạng CHD có tím phổ biến nhất và tỷ lệ khoảng 1/3.600 trẻ sinh sống. Dạng cổ điển TOF với hẹp động mạch phổi (pulmonary stenosis) chiếm khoảng 80% tổng số trẻ sơ sinh bị TOF.
Các dấu hiệu trên siêu âm
Trong quý 1, có thể khó chẩn đoán TOF dạng cổ điển. Trong TOF, mặt cắt bốn buồng có thể bình thường trong quý 1, trừ khi kèm theo lệch trục tim (Hình 11.34A và 11.34B). Các dấu hiệu gợi ý chẩn đoán bao gồm gốc động mạch chủ lớn ở mặt cắt năm buồng trên siêu âm 2D và Doppler màu (Hình 11.34C và 11.35A) với động mạch phổi nhỏ (Hình 11.34D và 11.35B). Mặc dù có thể khó thấy động mạch chủ cưỡi ngựa ở mặt cắt năm buồng, nhưng có thể dễ dàng phát hiện động mạch phổi nhỏ với Doppler màu ở mặt cắt 3VT (Hình 11.34D và 11.35B). Sự bất tương hợp kích thước giữa động mạch chủ và động mạch phổi ở mặt cắt 3VT với dòng chảy xuôi dòng ở cả hai đại động mạch trên Doppler màu là một dấu hiệu quan trọng giúp chẩn đoán TOF trong quý 1 (Hình 11.34D và 11.35B). Theo kinh nghiệm của chúng tôi, trong quý 1, TOF thường được phát hiện bởi mặt cắt 3VT bất thường hơn là mặt cắt năm buồng cho thấy động mạch chủ cưỡi ngựa.
Các bất thường liên quan
Các bất thường tim liên quan với TOF bao gồm cung động mạch chủ bên phải, gặp trong 25% trường hợp hoặc đôi khi là AVSD, làm tăng nguy cơ bất thường nhiễm sắc thể. TOF có tỷ lệ mắc dị tật ngoài tim, bất thường nhiễm sắc thể và hội chứng di truyền cao. Tỷ lệ bất thường nhiễm sắc thể khoảng 30%, với trisomy 21, 13 và 18 chiếm phần lớn các trường hợp. Tỷ lệ vi mất đoạn 22q11.2 được phát hiện từ 10% đến 15% thai nhi và trẻ sơ sinh bị TOF, và nguy cơ này tăng khi thiểu sản tuyến ức, cung động mạch chủ bên phải, các bất thường ngoài tim, hoặc đa ối trong ba tháng giữa thai kỳ.
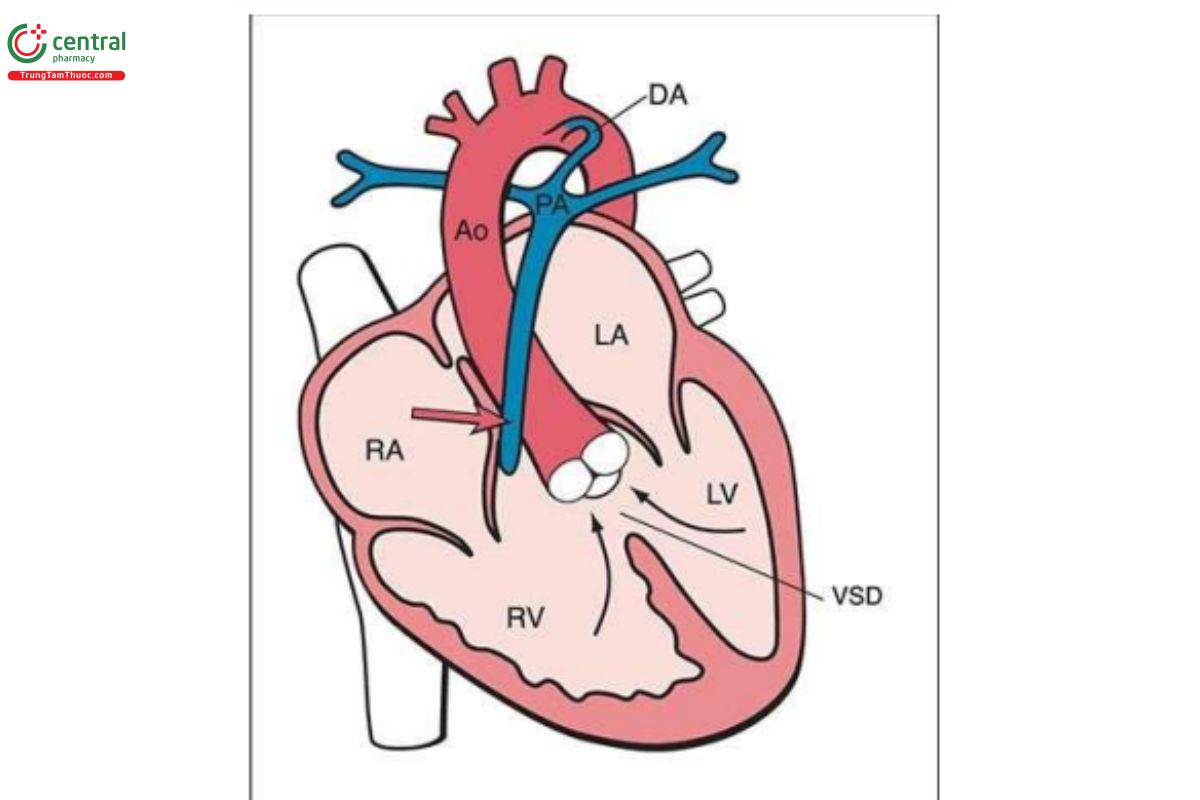
Teo động mạch phổi kèm thông liên thất (Pulmonary Atresia with Ventricular Septal Defect)
Định nghĩa
Teo động mạch phổi kèm thông liên thất (PA-VSD) đặc trưng bởi tình trạng teo động mạch phổi, thiểu sản đường hô hấp, VSD phần phễu hoặc phần màng và động mạch chủ cưỡi ngựa (Hình 11.36). Nguồn máu cung cấp cho phổi bao gồm ống động mạch và/hoặc tuần hoàn bàng hệ chủ-phổi. Tuần hoàn bàng hệ chủ-phổi thường bao gồm các động mạch bàng hệ từ động mạch chủ xuống đến phổi, được gọi là động mạch bàng hệ chủ-phổi chính (major aortopulmonary collateral arteries-MAPCA). Tỷ lệ PA-VSD là 0,07/1000 ca sinh sống. Nguy cơ PA-VSD tăng gấp 10 lần ở trẻ có mẹ bị đái tháo đường.
Các dấu hiệu trên siêu âm
Trục tim bất thường có thể là dấu hiệu gợi ý PA-VSD đầu tiên (Hình 11.37A). Trong PA-VSD, mặt cắt bốn buồng thường bình thường và mặt cắt năm buồng cho thấy gốc động mạch chủ dãn, cưỡi ngựa (Hình 11.37A) không có động mạch phổi có kích thước bình thường ở mặt cắt đường ra thất phải. Doppler màu ở mặt cắt ba buồng (3VT) cho thấy cung động mạch chủ ngang dãn với không có dòng chảy xuôi dòng (antegrade flow) qua động mạch phổi (Hình 11.37B). Doppler màu thường thấy dòng chảy ngược (reverse flow) trong ống động mạch và động mạch phổi ngoằn ngoèo ở mặt cắt chếch ngực, thấp hơn cung động mạch chủ. Không phát hiện được MAPCA trong ba tháng đầu thai kỳ.
Các bất thường liên quan
Cung động mạch chủ bên phải có thể gặp ở 20% đến 50% các trường hợp PA-VSD. Khoảng một nửa số trường hợp không có ống động mạch. MAPCA gặp ở khoảng 44% các trường hợp và thường được chẩn đoán trong ba tháng giữa thai kỳ. Các bất thường ngoài tim liên quan bao gồm tỷ lệ bất thường nhiễm sắc thể cao. Trong nghiên cứu Baltimore–Washington Infant Study, 8,3% trẻ bị PA-VSD có bất thường nhiễm sắc thể. Tỷ lệ vi mất đoạn 22q11 cao và được phát hiện ở 18% đến 25% thai nhi mắc PA-VSD, với tỷ lệ cao hơn khi có MAPCA và/hoặc cung động mạch chủ bên phải hoặc tuyến ức thiểu sản.
Thân chung động mạch (Common Arterial Trunk)
CAT đặc trưng bởi chỉ có một thân động mạch duy nhất xuất phát từ đáy tim và là nguyên ủy của các tuần hoàn hệ thống, mạch vành và phổi (Hình 11.38). Trong dị tật này, thông liên thất (VSD) lớn gần như luôn có, do gần như không có vách nón. Phổ bệnh của CAT rất rộng và chủ yếu liên quan đến nguyên ủy giải phẫu của động mạch phổi phải và trái. Nó có thể xuất phát từ thân động mạch phổi hoặc phân nhánh trực tiếp từ CAT hoặc động mạch chủ xuống. Trong hầu hết các trường hợp, gốc CAT lớn và có nguồn gốc từ cả hai thất (cưỡi ngựa lên VSD). Tuy nhiên, có đến 1/3 các trường hợp CAT, gốc dường như xuất phát hoàn toàn từ thất phải và trong một vài trường hợp, hoàn toàn từ thất trái. Van CAT có 3 lá trong khoảng 69% trường hợp, 4 lá trong 22% trường hợp, 2 lá trong 9% trường hợp, và trong những trường hợp rất hiếm, 1 lá hoặc ≥ 5 lá. CAT được báo cáo với tỷ lệ 1,07/10.000 ca sinh.
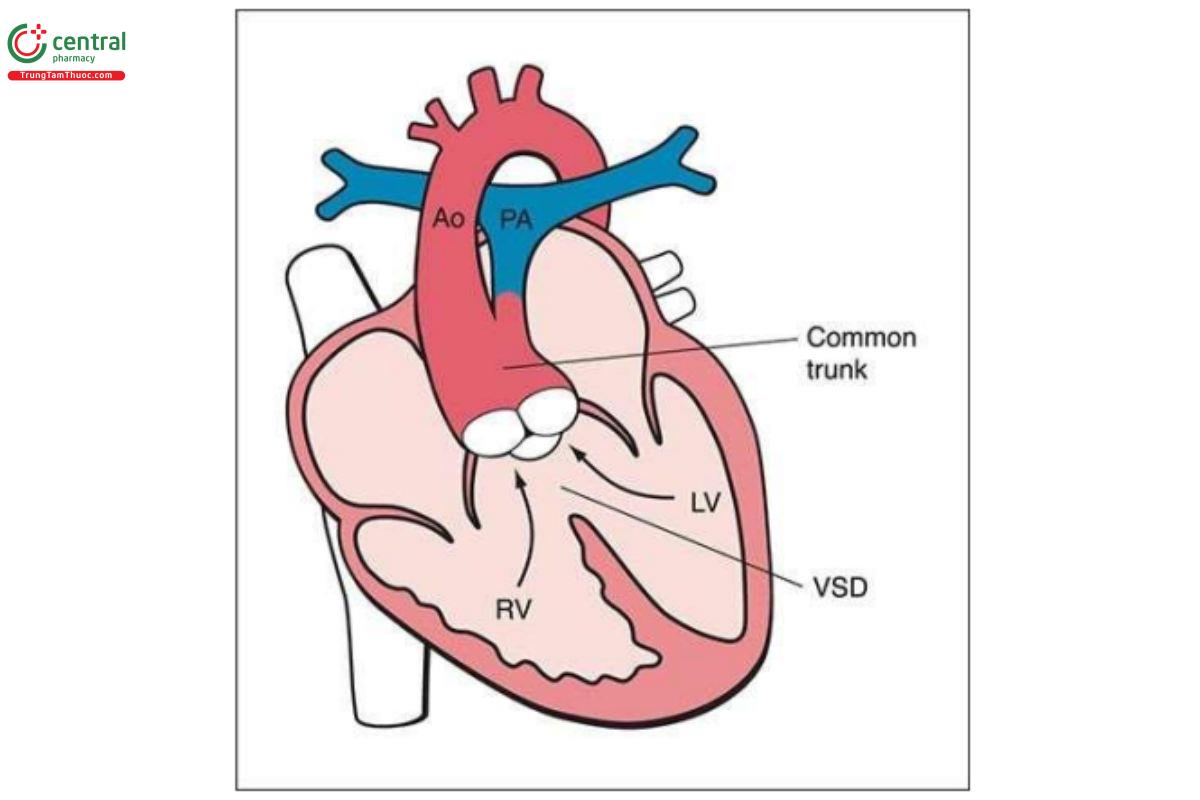
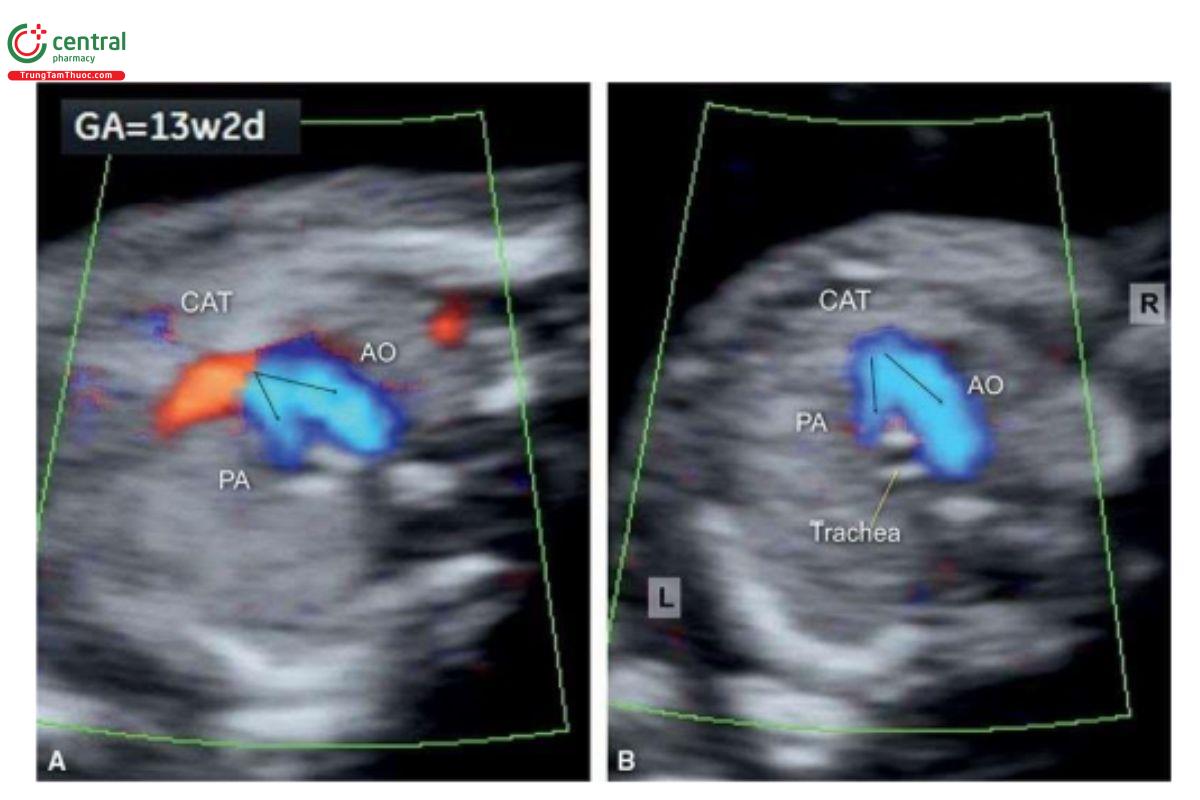
Các dấu hiệu trên siêu âm
Trong quý 1, khá khó thấy động mạch phổi xuất phát trực tiếp từ CAT, nhưng sẽ dễ dàng hơn khi áp dụng Doppler màu (Hình 11.39). Đặc điểm điển hình của CAT là hở van thân chung, đây là đặc điểm có thể giúp phân biệt CAT với các dị tật tim khác mà cũng có động mạch chủ cưỡi ngựa. Một đặc điểm khác biệt của CAT với PA-VSD là các động mạch phổi xuất phát trực tiếp từ CAT chứ không phải từ thất phải.
Các bất thường liên quan
Trong CAT, rất hay kèm theo các dị tật tim khác. Không có ống động mạch trong 50% trường hợp, và khi có, ống động mạch vẫn tồn tại sau sinh ở khoảng 2/3 bệnh nhân. Bất thường cung động mạch chủ cũng rất hay gặp trong CAT, với cung bên phải được ghi nhận ở 21% đến 36% trường hợp (Hình 11.39). Loạn sản kèm theo hở van thân chung cũng rất hay gặp. Dị tật cấu trúc ngoài tim gặp ở 40% các trường hợp CAT và thường không đặc hiệu. Các bất thường số lượng nhiễm sắc thể được phát hiện ở khoảng 4,5% các trường hợp và bao gồm các trisomy 21, 18, 13 và thể tam bội (triploidy); vi mất đoạn 22q11.2 cũng được báo cáo ở 30% đến 40% trường hợp.
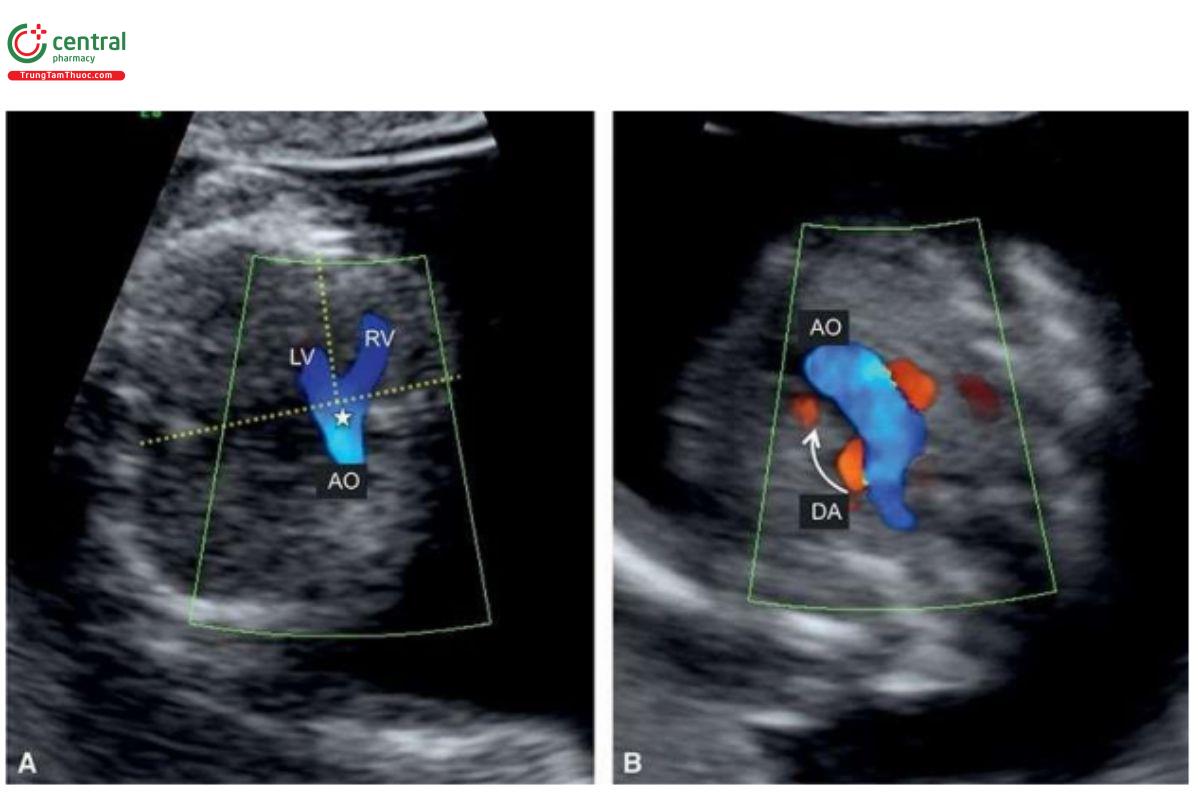
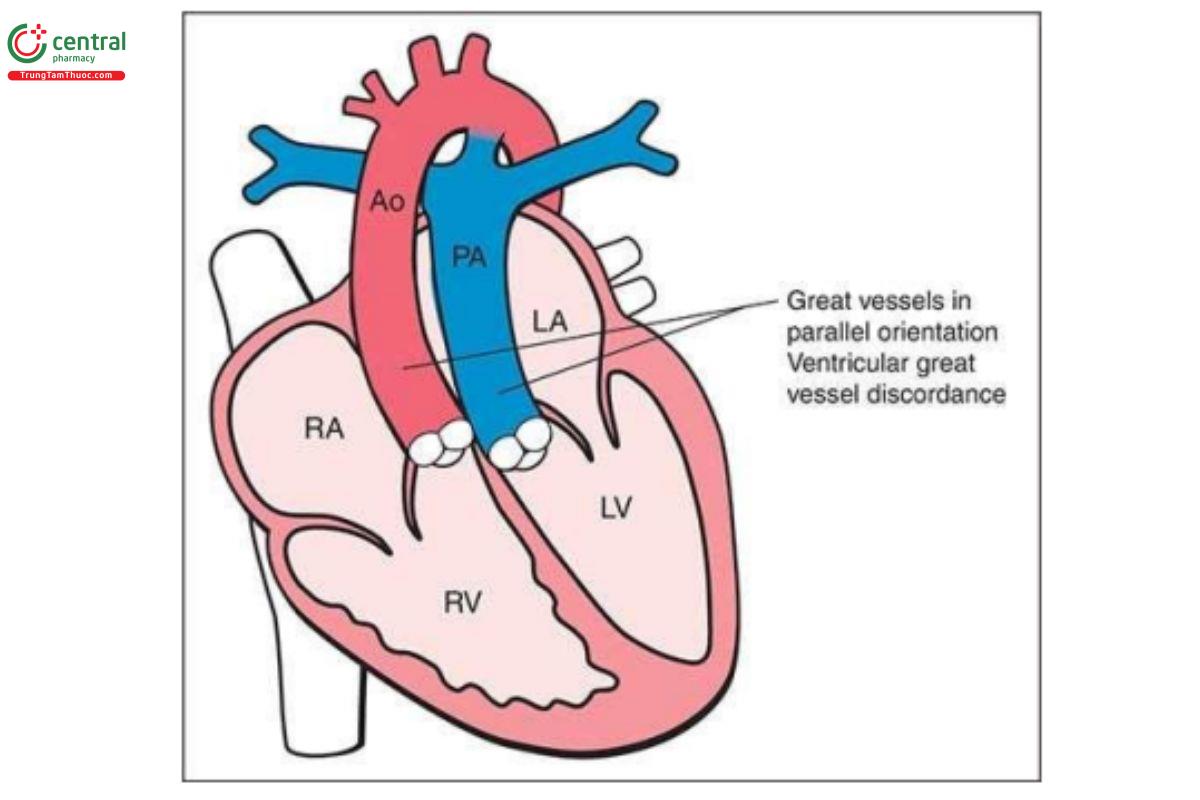
Chuyển vị đại động mạch (Transposition of the Great Arteries)
Định nghĩa
Chuyển vị đại động mạch hoàn toàn (TGA) là một dị tật tim phổ biến, đặc trưng bởi sự tương hợp nhĩ-thất (atrioventricular concordance) và bất tương hợp thất-đại động mạch (ventriculoarterial discordance). Điều này có nghĩa là kết nối giữa tâm nhĩ và tâm thất vẫn bình thường; nhĩ phải kết nối với thất phải qua van ba lá, và nhĩ trái kết nối với thất trái qua van hai lá. Tuy nhiên, có sự hoán vị của hai đại động mạch, với động mạch phổi xuất phát từ thất trái và động mạch chủ xuất phát từ thất phải. Hai đại động mạch có hướng đi song song với nhau, với động mạch chủ ở trước và bên phải động mạch phổi (Hình 11.40). D-TGA là một bất thường tim khá thường gặp với tỷ lệ 0,315 ca trên 1.000 ca sinh sống.
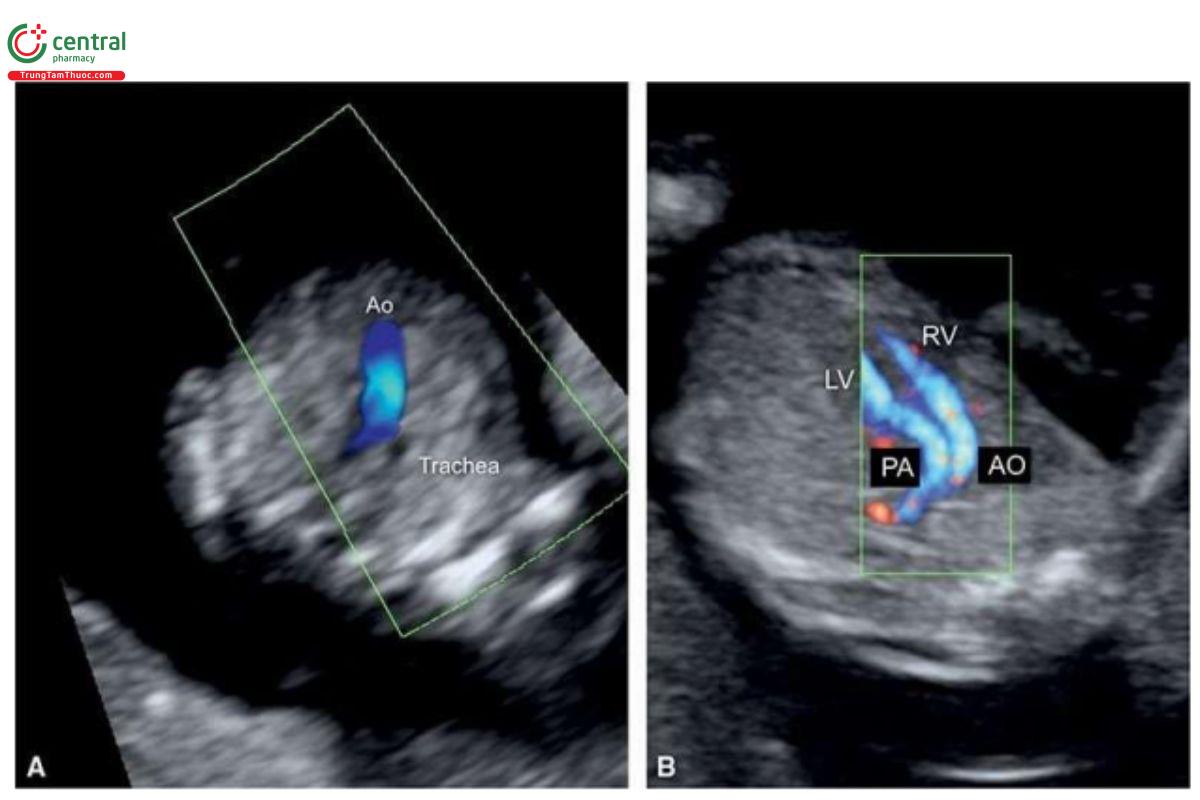
Các dấu hiệu trên siêu âm
Trong TGA, các đại động mạch chạy song song với nhau, có thể thấy ở mặt cắt ngang chếch của ngực thai nhi (Hình 11.41B), nhưng đây không phải là mặt cắt tiêu chuẩn khi siêu âm sản khoa, vì vậy không được thực hiện thường quy. Ở mặt cắt 3VT với Doppler màu, chỉ thấy một đại động mạch thường là dấu hiệu gợi ý TGA đầu tiên trong quý 1 (Hình 11.41A). Khi nghi ngờ TGA ở mặt cắt 3VT, chẩn đoán có thể được xác nhận trong quý 1 khi thấy các đại động mạch chạy song song với nhau ở mặt cắt chếch của ngực thai nhi (Hình 11.41B). Trong TGA, mặt cắt 4 buồng (4CV) thường bình thường, ngoại trừ trục tim bất thường trong một số trường hợp có mesocardia.
Các bất thường liên quan
Trong D-TGA, hai bất thường tim kèm theo hay gặp nhất là VSD và hẹp động mạch phổi (tắc nghẽn đường ra thất trái). VSD rất phổ biến, gặp ở khoảng 40% các trường hợp và thường là VSD quanh màng, tuy nhiên có thể xuất hiện ở bất kỳ vị trí nào dọc vách liên thất. Hẹp động mạch phổi kèm theo VSD xuất hiện ở khoảng 30% trường hợp, và hẹp động mạch phổi thường nặng và phức tạp hơn ở bệnh nhân D-TGA kèm vách liên thất nguyên vẹn. Mặc dù có thể có các bất thường ngoài tim trong D-TGA, nhưng chúng rất hiếm, và bất thường số lượng nhiễm sắc thể thực tế không thường gặp. Vi mất đoạn 22q11.2 có thể xuất hiện và nên được loại trừ, đặc biệt khi có dị tật ngoài tim hoặc D-TGA phức tạp.
Thất phải hai đường ra (Double Outlet Right Ventricle - DORV)
Định nghĩa
DORV bao gồm một nhóm các dị tật tim phức tạp, trong đó cả hai đại động mạch đều xuất phát chủ yếu từ thất phải về mặt hình thái (morphologic right ventricle) (Hình 11.42). Mặc dù cả hai đại động mạch đều xuất phát từ thất phải, chúng khác nhau về mối tương quan không gian của các đại động mạch, vị trí VSD (thường gặp trong DORV), và có hay không có tắc nghẽn đường ra động mạch phổi hoặc ít gặp hơn là động mạch chủ. Trong DORV, có 4 kiểu tương quan giải phẫu của động mạch chủ với động mạch phổi ở mức van bán nguyệt và 4 vị trí VSD về mặt giải phẫu đã được mô tả. Khó có thể xác định chính xác loại DORV trước sinh vì rất khó xác định được chính xác vị trí VSD khi siêu âm tim thai. Tỷ lệ mắc DORV khoảng 0,09 trên 1.000 trẻ sinh sống.
Các dấu hiệu trên siêu âm
Đôi khi, có thể chẩn đoán DORV trong quý 1 nhờ các dấu hiệu bất thường ở mặt cắt 4CV hoặc 3VT. Trong DORV, trục tim bất thường thường thấy và có thể phát hiện trong quý 1 (Hình 11.43A và B). Mặt cắt 3VT có thể cho thấy sự bất tương xứng về kích thước của các đại động mạch, chỉ thấy một đại động mạch (Hình 11.43C), hoặc các đại động mạch chạy song song với nhau (Hình 11.44). Khi mặt cắt 4CV bình thường, việc chẩn đoán DORV trong quý 1 có thể gặp khó khăn.
Các bất thường liên quan
Các bất thường tim kèm theo khá thường gặp trong DORV và bao gồm tất cả các tổn thương tim. Hẹp động mạch phổi (Pulmonary stenosis) là dị tật kèm theo phổ biến nhất, xuất hiện ở khoảng 70% trường hợp. Bất thường ngoài tim cũng rất hay gặp ở thai nhi mắc DORV nhưng không đặc hiệu cho bất kỳ hệ cơ quan nào.
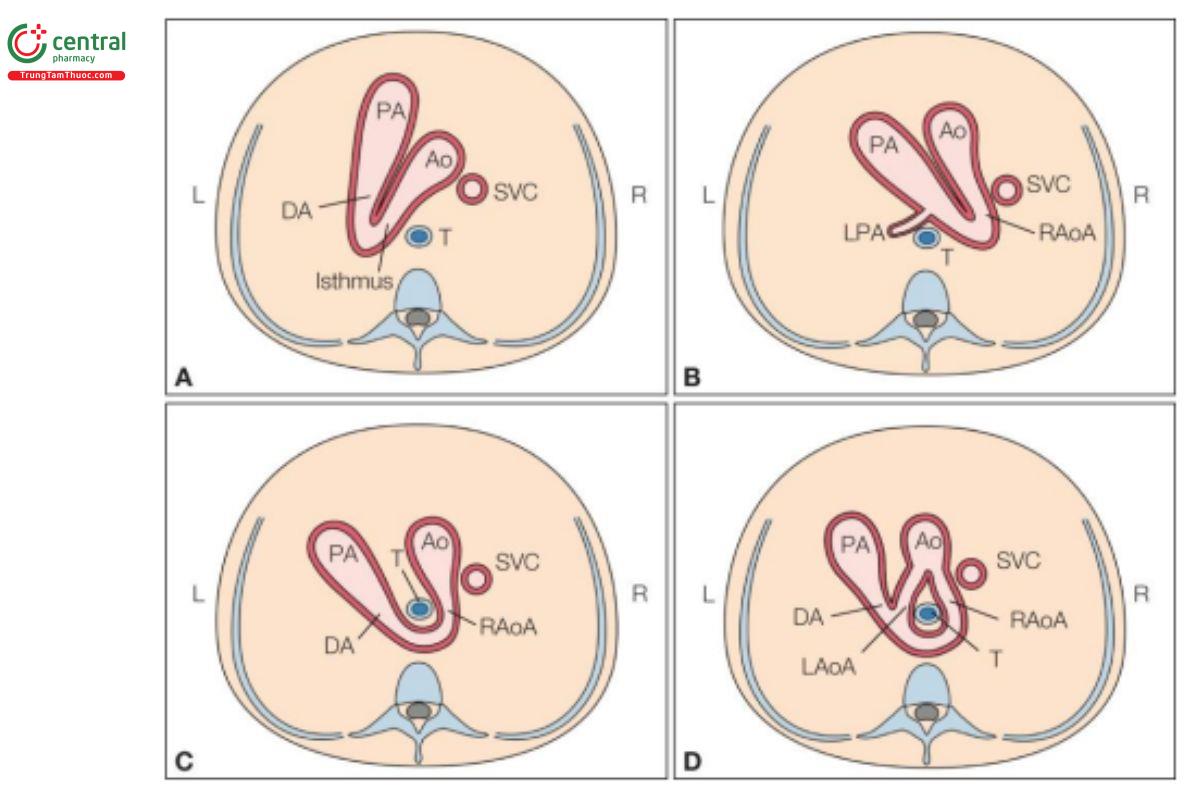
Cung động mạch chủ bên phải (RAA) được chẩn đoán khi cung động mạch chủ nằm bên phải khí quản trên mặt cắt ngang ngực. RAA liên quan đến ba nhóm bất thường chính của cung động mạch chủ: RAA với ống động mạch (DA) bên phải, RAA với DA bên trái, và DAA (cung động mạch chủ đôi) (Hình 11.45). RAA có thể là một phần của dị tật tim phức tạp hoặc xuất hiện đơn độc. Tỷ lệ RAA trong dân số chung là khoảng 1/1000 người, tuy nhiên, tỷ lệ này có thể cao hơn khi đi kèm với các dị tật tim khác.
Các bất thường nhiễm sắc thể cũng khá phổ biến, dao động từ 12% đến 40% thai nhi mắc DORV, trong đó chủ yếu là trisomy 18, trisomy 13 và vi mất đoạn 22q11.2.
Các dấu hiệu trên siêu âm
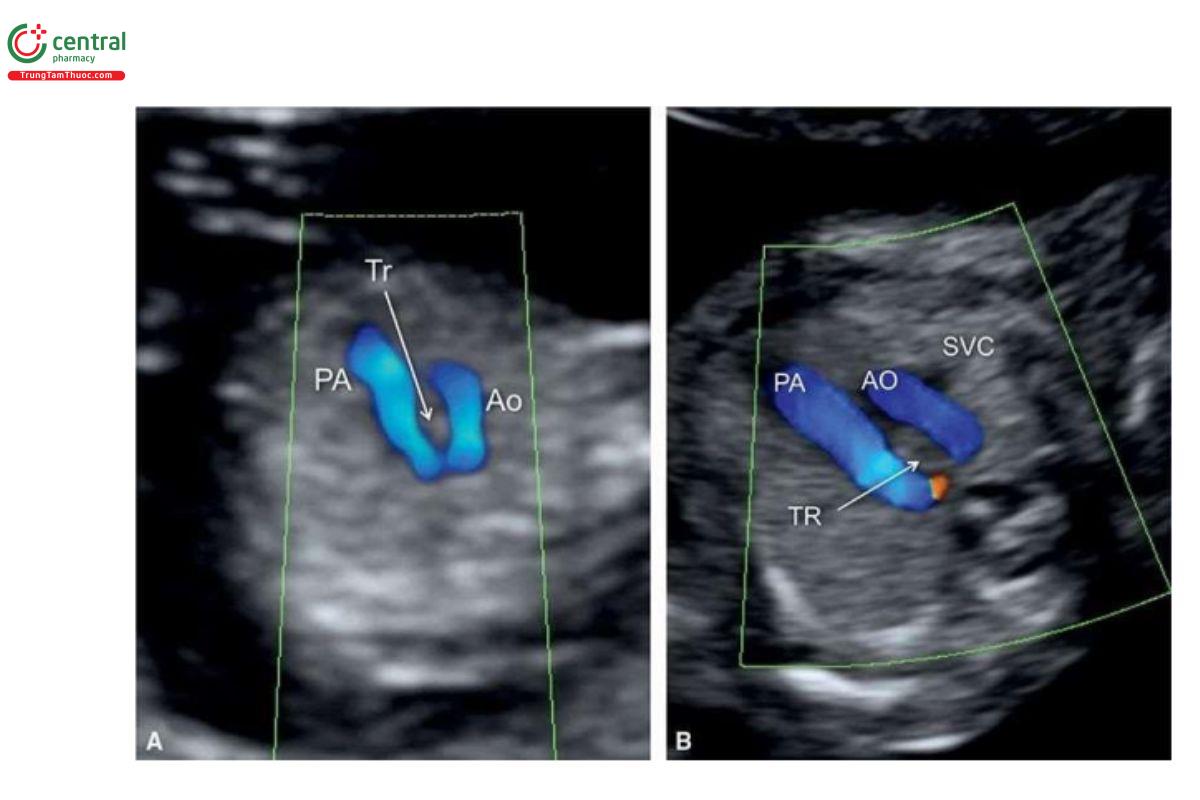
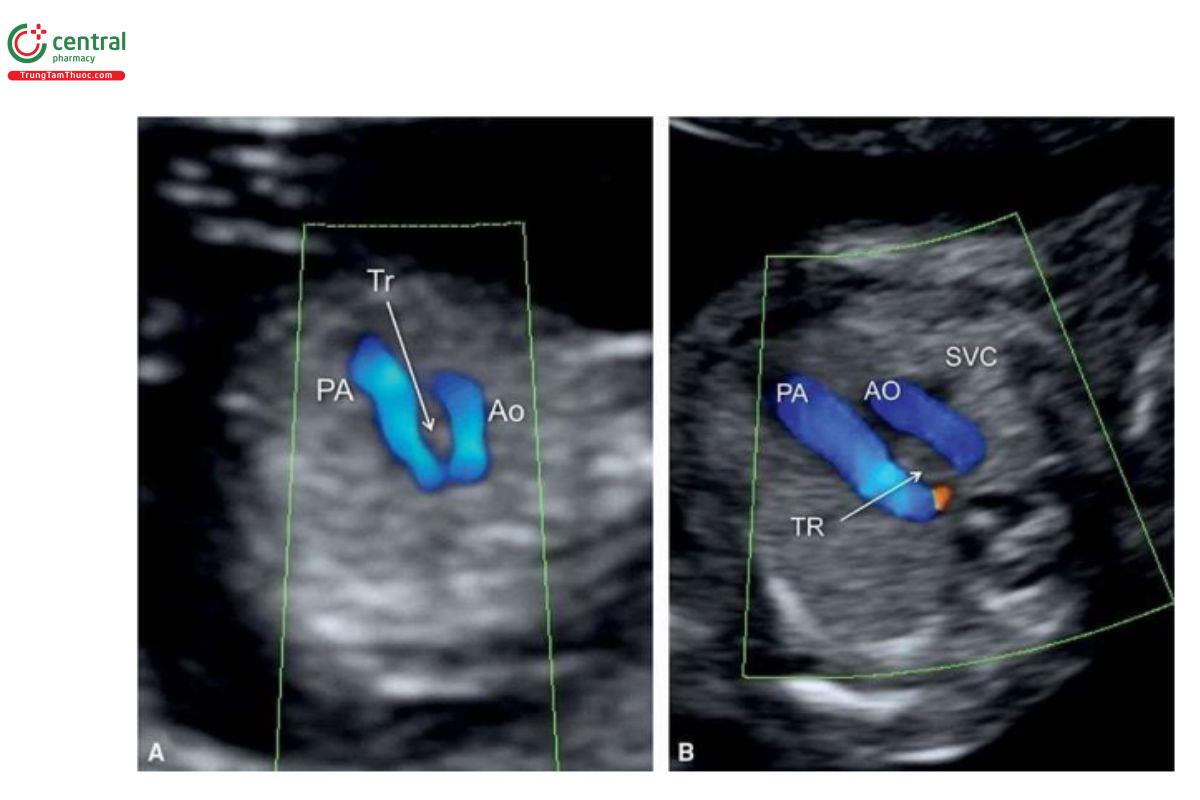
Cung động mạch chủ bên phải (RAA) có thể được chẩn đoán trong quý 1 qua mặt cắt 3VT với Doppler màu (Hình 11.46 và 11.47). RAA thường được nghi ngờ khi siêu âm qua thành bụng để đánh giá mối quan hệ giữa cung động mạch chủ ngang và ống động mạch. Siêu âm qua ngả âm đạo cũng có thể hỗ trợ trong việc xác định chẩn đoán.
Trong những năm gần đây, việc chẩn đoán RAA trong quý 1 đã có thể bao gồm cả ba phân nhóm của nó. Tuy nhiên, việc phân biệt giữa RAA (dấu hiệu chữ "U") và cung động mạch chủ đôi (DAA - dấu hiệu "λ") trong quý 1 có thể gặp khó khăn (Hình 11.46 và 11.47). Khi có nghi ngờ về RAA trong quý 1, cần siêu âm theo dõi trong quý 2 để xác định rõ phân nhóm RAA thực sự trong quý 2 của thai kỳ.
Các bất thường liên quan
Ngay cả khi RAA đơn độc, cũng nên làm nhiễm sắc thể đồ thai nhi để loại trừ các bất thường nhiễm sắc thể, chủ yếu là vi mất đoạn 22q11.2 và đôi khi là trisomy 21, v.v... Các bất thường tim kèm theo hay gặp hơn khi động mạch chủ và ống động mạch ở bên phải (dấu hiệu chữ V) so với DAA hoặc RAA-dấu hiệu chữ U. Các dị tật tim điển hình hay gặp trong RAA là TOF, teo động mạch phổi (pulmonary atresia) kèm VSD, CAT, không van động mạch phổi (absent pulmonary valve), teo van ba lá (tricuspid atresia) và DORV. RAA kèm theo bất thường thân nón (conotruncal anomaly) làm tăng nguy cơ vi mất đoạn 22q11.2.
Bất thường tĩnh mạch phổi và hệ thống (Anomalies of the Systemic and Pulmonary Veins)
Trong quý 1, các tĩnh mạch hệ thống và tĩnh mạch phổi thường quá nhỏ để có thể thấy rõ trên siêu âm 2D, vì vậy cực kỳ khó phát hiện các bất thường tĩnh mạch ở tuổi thai này. Bất thường hệ thống tĩnh mạch bụng được thảo luận trong Chương 12. Tồn tại tĩnh mạch chủ trên bên trái có thể hiếm khi được phát hiện trong quý 1. Bất thường hệ thống tĩnh mạch phổi vẫn được coi là không thể chẩn đoán được trong quý 1, trừ khi kết hợp với hội chứng đồng dạng, và có dấu hiệu gợi ý bất thường hồi lưu tĩnh mạch phổi (anomalous pulmonary venous return). Khi nghi ngờ bất thường tĩnh mạch phổi trong quý 1, cần siêu âm theo dõi đánh giá lại vào quý 2 của thai kỳ.
Động mạch dưới đòn phải lạc chỗ (Aberrant Right Subclavian Artery)
Có thể thấy ARSA trong quý 1 ở mặt cắt 3VT với Doppler màu khi giảm thang vận tốc màu để có thể thấy được động mạch dưới đòn nhỏ. ARSA có thể thấy rõ hơn khi siêu âm thai qua ngả âm đạo (Hình 11.48). ARSA có liên quan với trisomy 21 và các thể lệch bội khác. Nên xem xét nguy cơ lệch bội "prior" của bệnh nhân khi thực hiện tư vấn với chẩn đoán ARSA đơn độc.
8 TÀI LIỆU THAM KHẢO
- Abuhamad A, Chaoui R. A Practical Guide to Fetal Echocardiography: Normal and Abnormal Hearts. 3rd ed. Philadelphia, PA: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2015.
- Gittenberger-de Groot AC, Bartelings MM, DeRuiter MC, et al. Basics of cardiac development for the understanding of congenital heart malformations. Pediatr Res. 2005;57:169–176.
- Groot ACG-D, Bartelings MM, Poelmann RE, et al. Embryology of the heart and its impact on understanding fetal and neonatal heart disease. Semin Fetal Neonatal Med. 2013;18:237–244.
- Srivastava D. Making or breaking the heart: from lineage determination to morphogenesis. Cell. 2006;126:1037–1048.
- Hoffman JI, Christianson R. Congenital heart disease in a cohort of 19,502 births with long-term follow-up. Am J Cardiol. 1978;42:641–647.
- Ferencz C. Epidemiology of Congenital Heart Disease: The Baltimore-Washington Infant Study, 1981–1989. 1st ed. Philadelphia, PA: WB Saunders; 1993.
- Yoon PW, Olney RS, Khoury MJ, et al. Contribution of birth defects and genetic diseases to pediatric hospitalizations. A population-based study. Arch Pediatr Adolesc Med. 1997;151:1096–1103.
- Jones KL, Jones MC, del Campo M. Smith's Recognizable Patterns of Human Malformation. 7th ed. Philadelphia, PA: Saunders; 2013.
- Perez E, Sullivan KE. Chromosome 22q11.2 deletion syndrome (DiGeorge and velocardiofacial syndromes). Curr Opin Pediatr. 2002;14:678–683.
- Chaoui R, Heling KS, Sarut Lopez A, et al. The thymic-thoracic ratio in fetal heart defects: a simple way to identify fetuses at high risk for microdeletion 22q11. Ultrasound Obstet Gynecol. 2011;37:397–403.
- Besseau-Ayasse J, Violle-Poirsier C, Bazin A, et al. A French collaborative survey of 272 fetuses with 22q11.2 deletion: ultrasound findings, fetal autopsies, and pregnancy outcomes. Prenat Diagn. 2014;34:424–430.
- Perolo A, De Robertis V, Cataneo I, et al. Risk of 22q11.2 deletion in fetuses with right aortic arch and without intracardiac anomalies. Ultrasound Obstet Gynecol. 2016;48:200–203.
- Chaoui R, Heling K-S, Zhao Y, et al. Dilated cavum septi pellucidi in fetuses with microdeletion 22q11. Prenat Diagn. 2016;36:911–915.
- Lamouroux A, Mousty E, Prodhomme O, et al. La dysgénésie thymique: marqueur de microdélétion 22q11.2 dans le bilan d‘un hydramnios. J Gynécol Obstét Biol Reprod. 2016;45:388–396.
- Clur SA, Ottenkamp J, Bilardo CM. The nuchal translucency and the fetal heart: a literature review. Prenat Diagn. 2009;29:739–748.
- Khalil A, Nicolaides KH. Fetal heart defects: potential and pitfalls of first-trimester detection. Semin Fetal Neonatal Med. 2013;18:251–260.
- Maiz N, Nicolaides KH. Ductus venosus in the first trimester: contribution to screening of chromosomal, cardiac defects and monochorionic twin complications. Fetal Diagn Ther. 2010;28:65–71.
- Huggon IC, DeFigueiredo DB, Allan LD. Tricuspid regurgitation in the diagnosis of chromosomal anomalies in the fetus at 11-14 weeks of gestation. Heart. 2003;89:1071–1073.
- Sinkovskaya ES, Chaoui R, Karl K, et al. Fetal cardiac axis and congenital heart defects in early gestation. Obstet Gynecol. 2015;125:453–460.
- Raymond FL, Simpson JM, Sharland GK, et al. Fetal echocardiography as a predictor of chromosomal abnormality. Lancet. 1997;350:930.
- Natowicz M, Chatten J, Clancy R, et al. Genetic disorders and major extracardiac anomalies associated with the hypoplastic left heart syndrome. Pediatrics. 1988;82:698–706.
- Rosenthal GL. Patterns of prenatal growth among infants with cardiovascular malformations: possible fetal hemodynamic effects. Am J Epidemiol. 1996;143:505–513.
- Beekman RH. Aortic coarctation. In: Allen HD, Driscoll DJ, Shaddy RE, eds. Moss and Adams‘ Heart Disease in Infants, Children, and Adolescents. Baltimore, MD: Williams & Wilkins; 2012:1044–1054.
- Moene RJ, Gittenberger-de Groot AC, Oppenheimer-Dekker A, et al. Anatomic characteristics of ventricular septal defect associated with coarctation of the aorta. Am J Cardiol. 1987;59:952–955.
- Rosenquist GC. Congenital mitral valve disease associated with coarctation of the aorta: a spectrum that includes parachute deformity of the mitral valve. Circulation. 1974;49:985–993.
- Paladini D, Volpe P, Russo MG, et al. Aortic coarctation: prognostic indicators of survival in the fetus. Heart. 2004;90:1348–1349.
- Todros T, Paladini D, Chiappa E, et al. Pulmonary stenosis and atresia with intact ventricular septum during prenatal life. Ultrasound Obstet Gynecol. 2003;21:228–233.
- Shinebourne EA, Rigby ML, Carvalho JS. Pulmonary atresia with intact ventricular septum: from fetus to adult: congenital heart disease. Heart. 2008;94:1350–1357.
- Tandon R, Edwards JE. Tricuspid atresia. A re-evaluation and classification. J Thorac Cardiovasc Surg. 1974;67:530–542.
- Hoffman JI, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol. 2002;39:1890–1900.
- Galindo A, Comas C, Martínez JM, et al. Cardiac defects in chromosomally normal fetuses with increased nuchal translucency at 10–14 weeks of gestation. J Matern Fetal Neonatal Med. 2003;13:163–170.
- Berg C, Kremer C, Geipel A, et al. Ductus venosus blood flow alterations in fetuses with obstructive lesions of the right heart. Ultrasound Obstet Gynecol. 2006;28:137–142.
- Wald RM, Tham EB, McCrindle BW, et al. Outcome after prenatal diagnosis of tricuspid atresia: a multicenter experience. Am Heart J. 2007;153:772–778.
- Cetta F, Minich LL, Maleszewski JJ. Atrioventricular septal defects. In: Allen HD, Driscoll DJ, Shaddy RE, eds. Moss and Adams‘ Heart Disease in Infants, Children, and Adolescents. Baltimore, MD: Williams & Wilkins; 2012:691–712.
- Delisle MF, Sandor GG, Tessier F, et al. Outcome of fetuses diagnosed with atrioventricular septal defect. Obstet Gynecol. 1999;94:763–767.
- Rubio AE, Lewin MB. Ventricular septal defects. In: Allen HD, Driscoll DJ, Shaddy RE, eds. Moss and Adams‘ Heart Disease in Infants, Children, and Adolescents. Baltimore, MD: Williams & Wilkins; 2012:713–721.
- Gómez O, Martínez JM, Olivella A, et al. Isolated ventricular septal defects in the era of advanced fetal echocardiography: risk of chromosomal anomalies and spontaneous closure rate from diagnosis to age of 1 year. Ultrasound Obstet Gynecol. 2014;43:65–71.
- Sharland GK, Chita SK, Allan LD. Tricuspid valve dysplasia or displacement in intrauterine life. J Am Coll Cardiol. 1991;17:944–949.
- Earing MG, Hagler DJ, Edwards WD. Univentricular Atrioventricular Connection. In: Allen HD, Driscoll DJ, Shaddy RE, eds. Moss and Adams‘ Heart Disease in Infants, Children, and Adolescents. Baltimore, MD: Williams & Wilkins; 2012:1175–1194.
- Van Praagh R, Ongley PA, Swan HJ. Anatomic types of single or common ventricle in man: morphologic and geometric aspects of sixty necropsied cases. Am J Cardiol. 1964;13:367–386.
- O'Leary PM, Hagler DJ. Cardiac malpositions and abnormalities of atrial and visceral situs. In: Allen HD, Driscoll DJ, Shaddy RE, eds. Moss and Adams‘ Heart Disease in Infants, Children, and Adolescents. Baltimore, MD: Williams & Wilkins; 2012.
- Sapire DW, Ho SY, Anderson RH, et al. Diagnosis and significance of atrial isomerism. Am J Cardiol. 1986;58:342–346.
- Sharland GK, Cook AC. Heterotaxy syndromes/isomerism of the atrial appendages. In: Allan L, Hornberger L, Sharland G, eds. Textbook of Fetal Cardiology. London: Greenwich Medical Media; 2000:333–346.
- Berg C, Geipel A, Kamil D, et al. The syndrome of right isomerism—prenatal diagnosis and outcome. Ultraschall Med. 2006;27:225–233.
- Ticho BS, Goldstein AM, Van Praagh R. Correlation of prenatal findings and postnatal outcome in fetal congenital heart disease. Pediatr Cardiol. 2004;25:123–135.
- Wren C, Davenport R, Peart I, et al. Impact of prenatal diagnosis on early outcomes in congenital heart disease: a population-based study. Heart. 2008;94:450–456.
- Sanchez OA, Mahle WT. Outcome of patients with transposition of the great arteries diagnosed by fetal echocardiography. Pediatr Cardiol. 2009;30:546–550.
- Muthusamy S, Applegate KE, Blackwell A, et al. Outcome of fetuses with conotruncal anomalies diagnosed by 3D echocardiography: a single center experience. J Perinatol. 2009;29:452–458.
- Borrell A, Martínez JM, Fernández S, et al. Prenatal detection and outcome of left ventricular outflow tract obstruction in the fetus. Prenat Diagn. 2005;25:1102–1107.
- Silva IA, Rezende J, Carvalho JP, et al. Aortic arch anomalies and their association with chromosomal abnormalities. Ultrasound Obstet Gynecol. 2010;35:291–295.
- Bharati S, Paul MH, Idriss FS, et al. The surgical anatomy of pulmonary atresia with ventricular septal defect: pseudotruncus. J Thorac Cardiovasc Surg. 1975;69:713–721.
- Cabalka AK, Edwards WD, Dearani JA. Truncus arteriosus. In: Allen HD, Driscoll DJ, Shaddy RE eds. Moss and Adams‘ Heart Disease in Infants, Children, and Adolescents. Baltimore, MD: Williams & Wilkins; 2012:990–1002.
- Fuglestad SJ, Puga FJ, Danielson GK, et al. Surgical pathology of the truncal valve: a study of 12 cases. Am J Cardiovasc Pathol. 1988;2:39–47.
- Butto F, Lucas RVJ, Edwards JE. Persistent truncus arteriosus: pathologic anatomy in 54 cases. Pediatr Cardiol. 1986;7:95–101.
- Volpe P, Paladini D, Marasini M, et al. Common arterial trunk in the fetus: characteristics, associations, and outcome in a multicenter series of 23 cases. Heart. 2003;89:1437–1441.
- Wernovsky G. Transposition of the great arteries. In: Allen HD, Driscoll DA, Shaddy RE, eds. Moss and Adams’ Heart Disease in Infants, Children, and Adolescents. Baltimore, MD: Williams & Wilkins; 2012:1097–1146.
- Sridaromont S, Feldt RH, Ritter DG, et al. Double outlet right ventricle: hemodynamic and anatomic correlations. Am J Cardiol. 1976;38:85–94.
- Bradley TJ, Karamlou T, Kulik A, et al. Determinants of repair type, reintervention, and mortality in 393 children with double-outlet right ventricle. J Thorac Cardiovasc Surg. 2007;134:967–973.e6.
- Gedikbasi A, Oztarhan K, Gul A, et al. Diagnosis and prognosis in double-outlet right ventricle. Am J Perinatol. 2008;25:427–434.
- Obler D, Juraszek AL, Smoot LB, et al. Double outlet right ventricle: aetiologies and associations. J Med Genet. 2008;45:481–497.
- Berg C, Bender F, Soukup M, et al. Right aortic arch detected in fetal life. Ultrasound Obstet Gynecol. 2006;28:882–889.
- Achiron R, Rotstein Z, Heggesh J, et al. Anomalies of the fetal aortic arch: a novel sonographic approach to in-utero diagnosis. Ultrasound Obstet Gynecol. 2002;20:553–557.
- Zidere V, Tsapakis EG, Huggon IC, et al. Right aortic arch in the fetus. Ultrasound Obstet Gynecol. 2006;28:876–881.

