Hội chứng Cushing: tình trạng tăng quá mức glucocorticoid

Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 NGUYÊN LÝ CHUNG
Hội chứng Cushing là một bệnh lý lâm sàng do tiếp xúc kéo dài với tình trạng tăng quá mức hay dư thừa glucocorticoid từ nguồn gốc nội sinh hoặc ngoại sinh.
Nguyên nhân thường gặp nhất của hội chứng Cushing là do sử dụng glucocorticoid ngoại sinh gây nên.
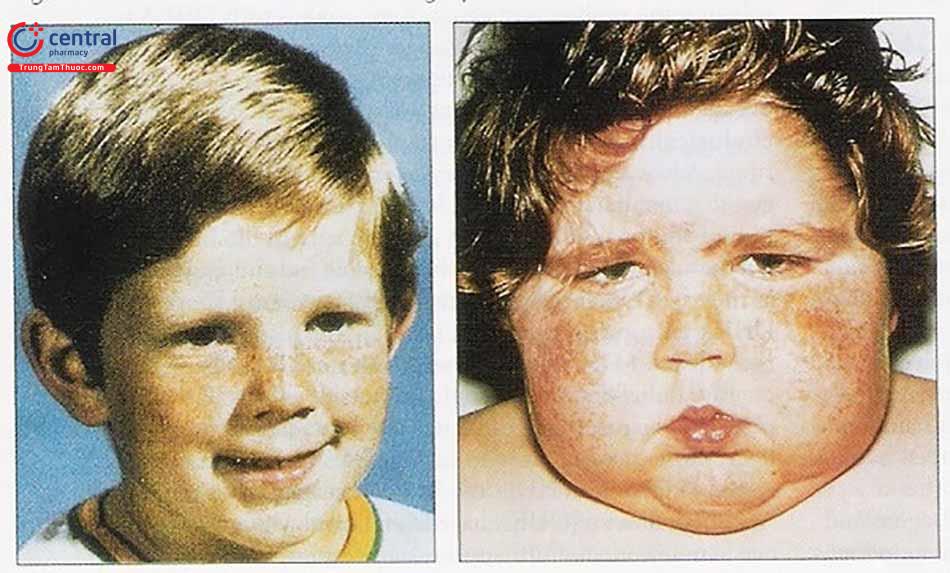
1.1 Phân loại
Hội chứng Cushing có thể được chia thành hai nhóm dựa trên cơ sở sinh lý bệnh: phụ thuộc hoặc không phụ thuộc vào hormon hướng vỏ thượng thận (ACTH) Bảng 15.1.
Tình trạng tăng cortisol máu phụ thuộc ACTH là nguyên nhân thường gặp nhất của hội chứng Cushing nội sinh và rất thường thấy do u tuyến yên tiết ACTH gây nên. Các nguyên nhân khác bao gồm hội chứng ACTH lạc chỗ và hội chứng tiết CRH (hormon gây giải phóng kích tố vỏ thượng thận) lạc chỗ.
- Khi hội chứng Cushing thứ phát do adenoma tuyến yên tiết ACTH nó được gọi là bệnh Cushing (CD), bệnh lý này được Harvey Cushing mô tả lần đầu tiên vào năm 1932 [2]. Tiết ACTH từ adenoma tuyến yên kích thích tăng sản xuất quá mức cortisol từ các tuyến thượng thận.
- Hội chứng tiết ACTH lạc chỗ dẫn tới tăng sản vỏ thượng thận cả hai bên và tăng cường hoạt động chức năng. Ung thư phổi tế bào nhỏ và các khối u thần kinh nội tiết của phổi, tuyến ức và tụy là các nguyên nhân thường gặp nhất gây tiết ACTH lạc chỗ.
- Trong hội chứng CRH lạc chỗ, khối u nguyên phát tiết CRH gây tăng sản các tế bào tuyến yên tiết kích tố hướng thượng thận vì vậy hậu quả là gây tăng tiết ACTH, tăng sản thượng thận hai bên và cuối cùng là tăng tiết cortisol. Đây là một tình trạng cực kỳ hiếm gặp [3].
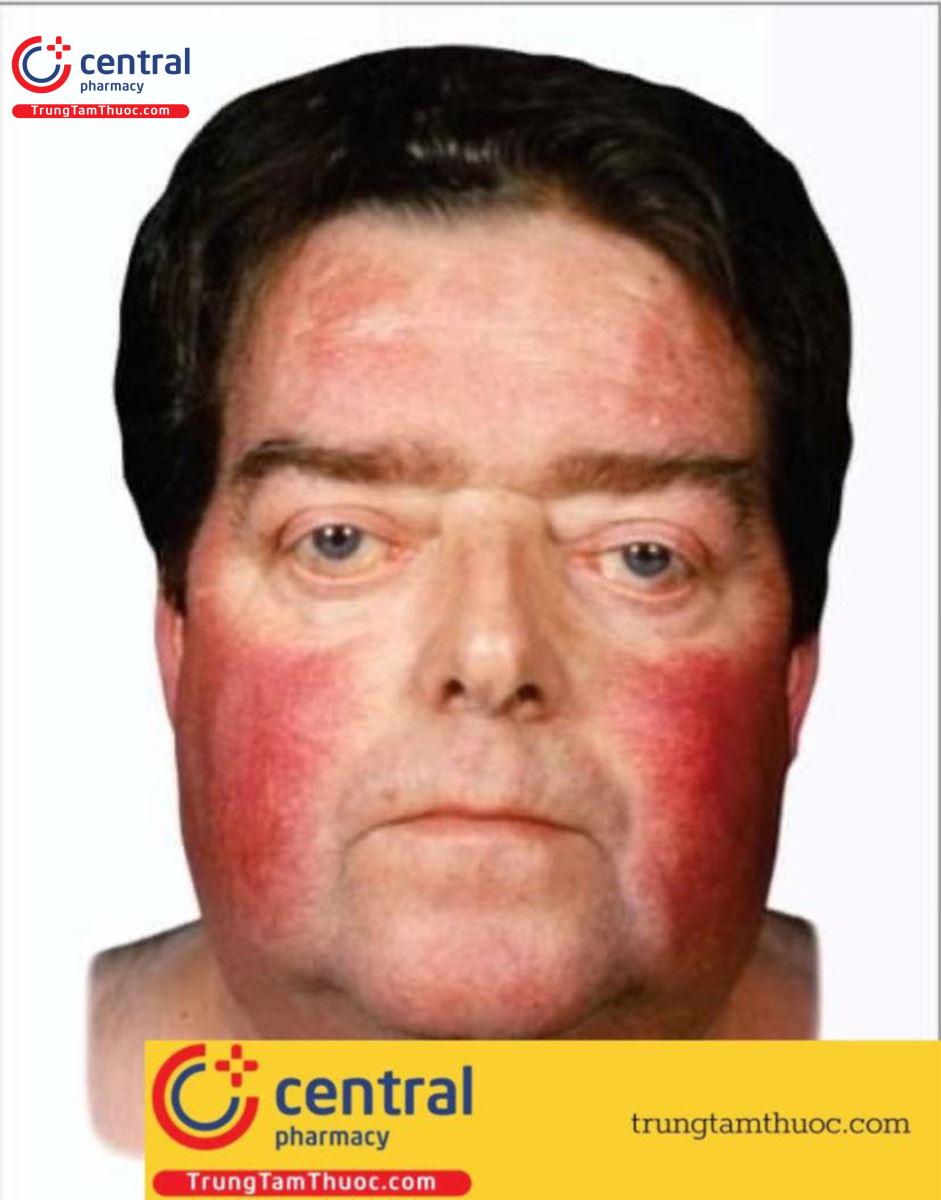
Các thể phụ thuộc ACTH của hội chứng Cushing do sử dụng glucocorticoid ngoại sinh hoặc rối loạn thượng thận nguyên phát gây nên.
- Hội chứng Cushing do thuốc có thể thứ phát do dùng glucocorticoid đường uống, tại chỗ, hít và tiêm gây nên. Megestrol là một chất có hoạt tính glucocorticoid nội tại, đã được cho thấy là gây ra các tác dụng giống glucocorticoid ở tới 30% các bệnh nhân được điều trị thuốc trong một thời gian kéo dài [4]. Kết hợp giữa ritonavir là một chất ức chế mạnh đối với enzym CYP3A4 và fluticason có thể gây hội chứng Cushing do làm chậm quá trình thanh thải fluticason.
- Nguyên nhân thường gặp nhất của hội chứng Cushing không phụ thuộc ACTH nội sinh là adenoma thượng thận. Các nguyên nhân khác bao gồm carcinoma thượng thận, tăng sản thượng thận dạng nốt nhiễm sắc tố nguyên phát (PPNAD) và tăng sản thượng thận dạng nốt kích thước lớn không phụ thuộc vào ACTH (adrenocorticotropin-independent macronodular adrenocortical hyperplasia [AIMAH]).
1.2 Dịch tễ học
Hội chứng Cushing cực kỳ hiếm gặp với tần suất mắc mới được ước tính là 0,2 đến 5,0 cho 1 triệu người dân mỗi năm và tỷ lệ bệnh lưu hành là 39 đến/1 triệu người dân. Tuổi khởi phát bệnh trung bình là 41,4 năm, với tỷ lệ nữ/nam là 3/1 [1].
1.3 Các bệnh lý kết hợp
Phức hợp Carney là một hội chứng di truyền tính trội qua nhiễm sắc thể thường được đặc trưng bằng tăng sản thượng thận thành các nốt nhỏ và adenoma tuyến yên, khối u tinh hoàn và tuyến giáp, u nhày nhĩ ở tim, nốt ruồi tăng sắc tố, vết chàm xanh và u tế bào Schwan. Các đột biến của gen PRKARIA gây ra hầu hết các trường hợp bị phức hợp Carney.
Hội chứng McCune-Albright được đặc trưng bằng tình trạng cường cortisol máu do tăng sản thượng thận dạng nốt kích thước lớn giống như các đốm màu cà phê sữa và loạn sản dạng sợi của xương.
Các rối loạn di truyền hoặc khiếm khuyết gen liên quan với hội chứng Cushing bao gồm [5]:
- Bệnh Cushing: hội chứng u tân sinh đa tuyến nội tiết (MEN1).
- Hội chứng tiết ACTH lạc chỗ: đột biến gen RET.
- Hội chứng Cushing thượng thận do adenoma thượng thận gây nên: có các khiếm khuyết của gen PRKACA, CTNNB1, GCPR, GNASI, PRKARIA.
- Carcinoma vỏ thượng thận: các khiếm khuyết của gen p53 (hội chứng Li–Fraumeni), GNAS, MEN1, IGF-II, H-19, CDKI (hội chứng Beckwith-Wiedemann) và gen APC.
| Bảng 15.1. Các nguyên nhân của hội chứng Cushing nội sinh | |
Chẩn đoán | bệnh nhân (%) |
| Phụ thuộc ACTH | 70-80 |
| Bệnh Cushing (tăng chế tiết ACTH của tuyến yên). | 60-70 |
| Hội chứng ACTH lạc chỗ ( các khối u không phải ở tuyến yên). | 5-10 |
| Hội chứng CRH lạc chỗ ( các khối u không phải ở vùng dưới đồi gây tăng chế tiết ACTH của tuyến yên). | <1 |
| Không phụ thuộc ACTH | 20-30 |
| Adenoma thượng thận. | 10-22 |
| Carcinoma thượng thận. | 5-7 |
| Tăng sản tạo các nốt nhỏ. | <2 |
| Tăng sản tạo các nốt lớn. | <2 |
Được điều chỉnh từ Lacroix A, Feelders RA, Stratakis CA, Nieman LK. Cushing's syndrome. Lancet 2015;386:913-927. | |
==> Bạn đọc có thể xem thêm : Những điều cần biết về tăng sản thượng thận bẩm sinh
2 CHẨN ĐOÁN
2.1 Biểu hiện lâm sàng

Bệnh nhân có nhiều biểu hiện từ các biểu hiện dưới lâm sàng tới có các triệu chứng rõ ràng, tùy thuộc vào căn nguyên, thời gian bị và cường độ sản xuất quá mức glucocorticoid.
Các dấu hiệu và triệu chứng của hội chứng này thường không đặc hiệu và có những hạn chế trong xét nghiệm chẩn đoán, khiến việc chẩn đoán hội chứng Cushing là một trong các thách thức nhất trong nội tiết học.
Một số dấu hiệu gợi ý cho hội chứng Cushing được trình bày ở phía dưới (cũng xem Bảng 15.2) [6]. Tuy nhiên, điều quan trọng được ghi nhận là không có bất kỳ dấu hiệu hay triệu chứng nào trong số này được coi là dấu hiệu đặc trưng của hội chứng Cushing, cần cảnh giác cao nếu trên lâm sàng nghi ngờ chẩn đoán này.
- Béo phì trung tâm tiến triển tác động đến bụng, mặt và cổ (bướu lưng trâu, mặt tròn như cái đĩa, các tấm mỡ vùng trên đòn và lồi mắt do lắng đọng mỡ sau hố mắt).
- Các biến chứng chuyển hóa bao gồm tình trạng không dung nạp Glucose (do kích thích tạo glucone bằng cortisol và kháng Insulin ngoại biên do béo phì) và tăng huyết áp (do các nguyên nhân đa yếu tố chưa được hiểu rõ), cả hai tình trạng này đều làm tăng nguy cơ tim mạch, một nguyên nhân chính gây tàn phế và tử vong ở bệnh nhân hội chứng Cushing [1,7]. Tăng huyết áp nặng và hạ Kali máu thường thấy ở bệnh nhân u tiết ACTH lạc chỗ vì nồng độ cortisol huyết thanh rất cao lấn át khả năng của enzym 11ẞ-hydroxysteroid dehydrogenase typ 2, enzym này oxy hóa cortisol thành cortisone trong ống thận, do đó dẫn đến hoạt hóa các thụ thể của mineralocorticoid [7].
- Tình trạng tăng đông máu do tăng nồng độ các yếu tố VIII, yếu tố IX, yếu tố von Willebrand và tăng sản xuất thrombin làm tăng nguy cơ bị huyết khối động mạch và tĩnh mạch [6].
- Các biểu hiện ở da bao gồm teo da (lớp sừng mỏng đi), da dễ bị tổn thương, dễ bị bầm tím, các vệt rạn da màu tím rộng (do tình trạng kéo căng da mỏng hay dễ bị tổn thương), các nhiễm trùng nấm ở da và tăng sắc tố da (trong hội chứng tiết ACTH lạc chỗ).
- Các thay đổi về sinh sản bao gồm kinh nguyệt không đều ở nữ, rậm lông, da mặt nhờn với các mụn trứng cá và các dấu hiệu nam hóa khác (hói vùng thái dương, giọng nói trầm) nhất là ở các phụ nữ bị carcinoma thượng thận. Ở nam, suy sinh dục thứ phát có thể xảy ra các dấu hiệu và triệu chứng của giảm thấp nồng độ testosteron.
- Các biểu hiện cơ xương bao gồm bệnh cơ gốc chi, teo cơ (hậu quả của các tác dụng dị hóa do tình trạng dư thừa glucocorticoid trên cơ vân), loãng xương (do giảm tạo xương, tăng tiêu xương và giảm tái hấp thu Canxi ở ruột và thận). Cũng có thể thấy có tình trạng gãy ép đốt sống, gãy xương bệnh lý của xương sườn hoặc các xương dài, hoại tử vô khuẩn của chỏm xương đùi.
- Các thay đổi tâm thần kinh có thể bao gồm khí sắc dao động, trầm cảm kích động, lo âu, các cơn hoảng sợ, chứng hoang tưởng bộ phận hay paranoid nhẹ, suy giảm trí nhớ và nhận thức ngắn hạn, loạn thần và mất ngủ.
| Bảng 15.2. Các triệu chứng và dấu hiệu ở bệnh nhân bị hội chứng Cushing | |
| Dấu hiệu/triệu chứng | % bệnh nhân |
| Béo phì thân mình | 95 |
| Mặt tròn như cái đĩa | 90 |
| Rối loạn chức năng tuyến sinh dục. | 90 |
| Teo da và bầm tím ngoài da. | 80 |
| Kinh nguyệt không đều. | 80 |
| Tăng huyết áp. | 75 |
| Rậm lông, trứng cá. | 75 |
| Rối loạn khí sắc. | 70 |
| Yếu cơ | 65 |
| Đái tháo đường hoặc không dung nạp với glucose. | 60 |
| Thiểu xương, loãng xương, gãy xương. | 50 |
| Được sửa đổi từ Newell-Price J, Bertagna X, Grossman AB, Nieman LK. Cushing's syndrome. Lancet 2006;367:1605-1617 | |
.jpg)
2.2 Chẩn đoán phân biệt
Tình trạng tăng cortisol sinh lý không do u (hội chứng giả Cushing) được đặc trưng bằng cường hay tăng cortisol máu nhẹ và có thể khó phân biệt với hội chứng Cushing thực sự [8,9].
- Kiểu hình giống như hội chứng Cushing: trầm cảm, bệnh thận mạn, nghiện rượu, béo phì, đái tháo đường không được kiểm soát, bệnh lý tâm thần và có thai.
- Không có các đặc điểm lâm sàng của hội chứng Cushing: stress thực thể (nhập viện, chấn thương, phẫu thuật, bị bệnh lý cấp tính), suy dinh dưỡng, chán ăn tâm thần, gắng sức thể lực kéo dài với cường độ cao, vô kinh do căn nguyên vùng dưới đồi và các tình trạng làm tăng nồng độ protein gắn với cortisol (có thai, điều trị estrogen).
- Đặc điểm phân biệt của rối loạn này là các dấu hiệu lâm sàng và cận lâm sàng của tình trạng tăng cortisol máu mất đi nếu điều trị căn nguyên chính thành công.
Hội chứng chuyển hóa được đặc trưng bằng béo phì trung tâm, tăng huyết áp và mất dung nạp với glucose có thể giống như hội chứng Cushing.
Hội chứng buồng trứng đa nang có thể được biểu hiện bằng kinh nguyệt không đều và cường androgen (rậm lông, trứng cá) đó có thể là các đặc điểm của hội chứng Cushing.
Hội chứng giả Cushing thứ phát do người bệnh lén uống corticosteroid hiếm gặp, có thể khó chẩn đoán. Bệnh nhân thường có biểu hiện các đặc điểm lâm sàng của hội chứng Cushing, nồng độ cortisol tự do trong nước tiểu 24 giờ UFC) dao động và nồng độ ACTH bị ức chế không liên tục. Định lượng nồng độ corticosteroid trong huyết tương và nước tiểu bằng kỹ thuật sắc ký lỏng hiệu năng cao song song với đo khối phổ (HPLC-MS/MS) có thể được sử dụng để khẳng định sự có mặt của các steroid ngoại sinh [10].
2.3 Chẩn đoán cận lâm sàng
Xem Hình 15 để biết lược đồ thăm dò chẩn đoán [1,6,11].
Chẩn đoán sinh hóa đối với hội chứng Cushing bao gồm ba bước quan trọng:
- Tìm bằng chứng xác định có tình trạng tăng cortisol máu (bệnh nhân có hội chứng Cushing hay không).
- Xác định xem tình trạng dư thừa cortisol phụ thuộc hay không phụ thuộc ACTH (bệnh nhân có bệnh lý tuyến thượng thận nguyên phát hay có khối u chế tiết ACTH).
- Xác định nguồn gốc của ACTH đối với thể phụ thuộc ACTH ( bệnh nhân có bệnh Cushing hay hội chứng tiết ACTH lạc chỗ).
Bệnh nhân có hội chứng Cushing không?
- Test định lượng nồng độ cortisol tự do trong nước tiểu 24 giờ là một trong những test thường được sử dụng nhất để chẩn đoán hội chứng Cushing. Bệnh nhân có thể được thừa nhận là có hội chứng Cushing nếu bài tiết cortisol cơ sở hay nền trong nước tiểu cao hơn 3 - 4 lần so với mức bình thường trong ít nhất hai lần xét nghiệm riêng biệt. Sau đó việc đánh giá có thể tiến hành qua các bước tiếp theo để xác định nguyên nhân gây ra tình trạng tăng cortisol máu. Nếu nồng độ này tăng lên một cách không rõ ràng, nghĩa là trên mức giới hạn bình thường cao (ULN) nhưng không đạt tới mức tăng gấp 3 - 4 lần, bệnh nhân cần được đánh giá lại sau vài tuần hoặc được thực hiện thêm các xét nghiệm khác (xem ở phần kế tiếp và Bảng 15.3) [9,12,13].
- Test ức chế bằng 1 mg dexamethason qua đêm là một test sàng lọc khác thường được sử dụng. Không may là test này có tỷ lệ dương tính giả cao (Bảng 15.4) và không nên sử dụng test như một tiêu chuẩn duy nhất để chẩn đoán hội chứng Cushing. Một số tác giả gợi ý xét nghiệm nồng độ dexamethason cùng lúc với nồng độ cortisol. Một nồng độ dexamethason thấp gợi ý sự không tuân thủ của bệnh nhân, thay đổi giữa các cá nhân trong chuyển hóa dexamethason hoặc các tác động của thuốc lên chuyển hóa dexamethason [9,14].
- Một số thầy thuốc nội tiết ưa chuộng sử dụng test ức chế dexamethason liều thấp 2 mg/ngày trong 48 giờ (LDDST) như một test sàng lọc cho bệnh nhân có các tình trạng liên quan đến hoạt động quá mức của trục dưới đồi - tuyến yên - thượng thận (ví dụ, ở bệnh nhân rối loạn tâm thần, béo phì, nghiện rượu hoặc đái tháo đường) do trong một số nghiên cứu, test này đã được chứng minh là có độ đặc hiệu cao hơn so với test ức chế bằng 1 mg dexamethason [5].
- Định lượng nồng độ cortisol nước bọt vào đêm khuya là một nghiệm pháp sàng lọc khác đã được kiểm chứng với những ưu điểm khác biệt: test không xâm lấn, bệnh phẩm nước bọt dễ được thu gom, nồng độ cortisol trong nước bọt ổn định ngay cả ở nhiệt độ phòng trong vài ngày, test có thể được bệnh nhân thực hiện tại nhà [9,15].
- Test CRH-dexamethason có thể hữu ích để phân biệt bệnh nhân bị hội chứng Cushing với bệnh nhân bị tình trạng tăng cortisol máu sinh lý không do căn nguyên ung thư. Khi so sánh với bệnh nhân bị hội chứng Cushing, bệnh nhân bị ức chế tiếp tục cho thấy nồng độ cortisol huyết tương bị ức chế (< 1,4 ug/dL) ngay cả sau khi truyền CRH, điều này phản ánh tình trạng nhạy cảm trong chế tiết ACTH vẫn được bảo toàn đối với ức chế bằng dexamethason [8,9].
Bệnh nhân có hội chứng Cushing phụ thuộc hay không phụ thuộc ACTH?
- Sau khi chẩn đoán sinh hóa đối với hội chứng Cushing đã được khẳng định, nên tiến hành định lượng nồng độ ACTH và cortisol huyết tương lúc 8 giờ sáng.
- Một nồng độ ACTH không phát hiện được hoặc thấp (< 5 pg/dL) ở bệnh nhân có nồng độ cortisol huyết thanh > 15 ug/dL đặc trưng cho nguồn gốc thượng thận nguyên phát (hội chứng Cushing không phụ thuộc ACTH). Nếu nghi ngờ hội chứng Cushing không phụ thuộc ACTH nên chỉ định chụp CT với lát cắt mỏng hoặc thăm dò hình ảnh học MRI tuyến thượng thận để tìm kiếm khối u thượng thận. Nồng độ ACTH > 15 pg/dL thường chỉ dẫn nguyên nhân phụ thuộc ACTH và bước tiếp theo là tìm kiếm nguồn gốc tiết ACTH cao (tuyến yên hay u tiết ACTH lạc chỗ).
- Một nồng độ ACTH trong khoảng 5 - 15 pg/dL được coi là kết quả không xác định và cần được xét nghiệm lại. Nếu nồng độ ACTH vẫn tiếp tục ở trong khoảng không xác định, có thể tiến hành làm test kích thích CRH. Nếu sau truyền 1 ug/kg CRH thấy đáp ứng ACTH đỉnh bị giảm đi (< 10 pg/dL), nhiều khả năng đây là nguyên nhân không phụ thuộc ACTH (tại thượng thận). Tuy nhiên, nếu có tình trạng tăng ACTH tăng >50% so với giá trị nền sau khi truyền CRH, nhiều khả năng đây là nguyên nhân phụ thuộc ACTH [16].
Bệnh nhân bị bệnh Cushing hay có hội chứng tiết ACTH lạc chỗ?
- Có thể có chồng lấp đáng kể về nồng độ ACTH giữa bệnh nhân bị bệnh Cushing và hội chứng tiết ACTH lạc chỗ, song phân biệt giữa hai rối loạn này rất quan trọng do nó ảnh hưởng đáng kể đến điều trị. Một số test có thể sử dụng để phân biệt giữa bệnh Cushing nguồn gốc tuyến yên và hội chứng tiết ACTH lạc chỗ (Bảng 15.5) [17-19].
- Test ức chế dexamethason liều cao (HDDST) tận dụng được lợi thế là liều cao của glucocorticoid sẽ gây ức chế tiết ACTH một phần từ hầu hết các adenoma tuyến yên tế bào tiết kích tố thượng thận trong khi hầu hết các khối u không phải tuyến yên đi kèm với tiết ACTH lạc chỗ kháng lại với cơ chế điều hòa ngược (các ngoại lệ bao gồm các khối u carcinoid của phế quản, tuyến ức và tuyến tụy). Test liều cao có thể được thực hiện như một test chuẩn trong 2 ngày (2 mg, mỗi 6 giờ/lần x 8 liều) hoặc với một liều 8 mg duy nhất qua đêm. Nếu cortisol tự do trong nước tiểu 24 giờ bị ức chế > 90% hoặc nồng độ cortisol huyết tương bị ức chế > 50% so với giá trị nền, rất có khả năng đây là bệnh Cushing [1,2,9].
- Các test kích thích CRH và DDAVP (1-deamino-8D-arginine vasopressin) là các test không xâm lấn bổ sung có thể được sử dụng để phân biệt giữa bệnh Cushing với hội chứng tiết ACTH lạc chỗ. Cả hai thuốc này đều kích thích gây tăng ACTH và cortisol ở hầu hết bệnh nhân bị bệnh Cushing. Do chế tiết ACTH của tuyến yên bị ức chế, hầu hết bệnh nhân bị hội chứng tiết ACTH lạc chỗ không có đáp ứng.
- Phải tiến hành chụp MRI tuyến yên cho tất cả các bệnh nhân bị hội chứng Cushing phụ thuộc ACTH. Một khối u tuyến yên > 6 mm gợi ý bệnh Cushing. Dựa trên kết quả mổ tử thi và các thăm dò MRI, tỷ lệ mắc hiện hành của u tuyến yên phát hiện tình cờ dao động từ 10% đến 28% ở các đối tượng được coi là “người khỏe mạnh” [20], vì vậy sự có mặt của một adenoma tuyến yên nhỏ không khẳng định bệnh Cushing. Ngoài ra, 20 – 58% các bệnh nhân bị bệnh Cushing có thể không quan sát được khối u trên hình ảnh MRI [17].
- Lấy mẫu máu từ xoang đá dưới (IPSS) là một thủ thuật xâm lấn nhằm để lấy mẫu đo đạc độ chênh lệch ACTH từ trung tâm đến ngoại biên, được coi là tiêu chuẩn vàng để xác định nguồn gốc tiết ACTH là từ tuyến yên hay nguồn gốc lạc chỗ. Thủ thuật này được khuyến cáo áp dụng cho bệnh nhân có adenoma kích thước<6mm và ở những bệnh nhân có kết quả test ngược nhau (ví dụ, khi có tình trạng ức chế cortisol khi làm test ức chế dexamethason liều cao [gợi ý bị bệnh Cushing] song MRI tuyến yên âm tính). Xem Bảng 15.5 để biết thêm chi tiết.
| Bảng 15.3. Các xét nghiệm sinh hoá để xác định hội chứng Cushing | |||||
| Test | Quy trình | Định lượng | Tiêu chuẩn | Độ nhạy (%) | Độ đặc hiệu(%) |
| UFC 24 giờ 1 mg qua đêm | Thu nước tiểu 24 giờ. Dexamethason 1 mg uống lúc 11 giờ đêm | Cortisol, creatinine Nồng độ cortisol lúc 8 giờ sáng | > 3 × ULN > 1,8 μg/dL > 5 μg/dL | 80-98 91-97 85-90 | 45-98 80-94 95-99 |
| LDDST 2 | Dexamethason 0,5 mg uống mỗi 6 giờ/lần trong 48 giờ (liều cuối cùng lúc 6 giờ sáng). | Nồng độ cortisol lúc 8 giờ sáng. | > 1,8 μg/dL | 91-98 | 70-95 |
| Dex-CRH | Giống quy trình LDDST 2 ngày CRH 1 μg/kg TM lúc 8 giờ sáng. | Nồng độ cortisol huyết tương 15 phút sau khi tiêm CTH | > 1,4 μg/dL | 98-100 | 60-100 |
| Cortisol nước bọt lúc đêm khuya | Lấy mẫu lúc 11 giờ đêm | Nồng độ cortisol nước bọt Salivary cortisol | > 145 ng/dL | 92-100 | 93-100 |
| Cortisol huyết tương lúc nửa đêm | Cần đặt catheter và cho bệnh nhân nhập viện | > 7,5 μg/dL (lúc thức) > 1,8 μg/dL (lúc ngủ) | 91-98 | 92-100 100 | 30-62 |
UFC, (urine free cortisol): Nồng độ cortisol tự do trong nước tiểu; ULN, (upper limit of normal): Trên mức giới hạn bình thường; LDDST, (low-dose dexamethasone suppression test): Test ức chế dexamethason liều thấp; Dex, (dexamethasone): Dexamethason; CRH, (corticotropin- releasing hormone): Hormon giải phóng kích tố hướng vỏ thượng thận. Dữ liệu từ Sharma ST. An individualized approach to the evaluation of Cushing syndrome. Endocr Pract 2017;23:726-737. | |||||

| Bảng 15.4. Các nguyên nhân gây xét nghiệm sinh hoá âm tính và dương tính giả của hội chứng Cushing | ||
| Test | Dương tính giả | Âm tính giả |
| Test ức chế dexamethason liều thấp (LDDST) | Sai sót về thời gian uống dexamethason. Thuốc làm tăng chuyển hóa dexamethason (phenytoin, rifampin, carbamazepin, pioglitazon). Thuốc làm tăng globulin gắn với cortisol (estrogen, mitotane). Giảm hấp thu dexamethason. Hội chứng giả Cushing. | Suy thận mạn ( mức lọc cầu thận <30 mL/phút) Thuốc làm giảm chuyển hóa dexamethason (amiodaron, Ciprofloxacin, itraconazol, Fluconazole, ritonavir, cimetidin, Fluoxetine, Diltiazem). Tăng độ nhạy của trục dưới đồi - tuyến yên - thượng thận với dexamethason. |
| Cortisol niệu tự do (UFC) 24 giờ | Khẩu phần dịch cao Tương tác với carbamazepin khi xét nghiệm bằng kỹ thuật sắc ký lỏng (HPLC). Hội chứng giả Cushing | Hội chứng Cushing có tính chu kỳ. Hội chứng Cushing giai đoạn sóm. Suy thận mạn. Tương tác với nhóm thuốc fibrat. |
| Cortisol nước bọt đêm khuya | Thu mẫu và bảo quản mẫu không đúng cách. Dùng Cam Thảo. Hút thuốc/ dùng thuốc lá nhai. Đánh răng trước khi lấy mẫu. Dùng tay chạm vào que lấy mẫu. | Hội chứng Cushing có tính chu kỳ. |
| Cortisol huyết tương lúc nửa đêm | Stress do phải nằm viện hoặc lấy máu Bệnh nhân bị bệnh nặng Bệnh nhân không được ngủ hoặc nghỉ ngơi Không lấy được mẫu máu từ catheter đặt đúng vị trí. | Hội chứng Cushing có tính chu kỳ. |
| Được sửa đổi từ Sharma ST. An individualized approach to the evaluation of Cushing syndrome. Endocr Pract 2017;23:726-737. | ||
3 ĐIỀU TRỊ

Điều trị được dựa trên nguyên nhân gây tăng cortisol máu, vì vậy không cần quá nhấn mạnh nhu cầu chẩn đoán chính xác nguồn gốc của tình trạng này. Đích điều trị nhằm làm hết các biểu hiện lâm sàng của tăng cortisol máu bằng cách làm tình trạng tiết cortisol trở về mức bình thường.
Trong hội chứng Cushing ngoại sinh, cắt dần glucocorticoid rất quan trọng, vì hầu hết bệnh nhân đang được điều trị dài ngày bằng corticoid sẽ có tình trạng ức chế trục dưới đồi - tuyến yên - thượng thận ở một mức nào đó với hậu quả gây suy thượng thận nếu điều trị thuốc bị cắt đột ngột.
Trong hội chứng Cushing không phụ thuộc ACTH, hình ảnh học tuyến thượng thận bằng chụp CT hoặc bằng chụp MRI sẽ cho biết tình trạng bệnh ở một bên hoặc cả hai bên. Bệnh nhân nên được tư vấn chỉ định cắt bỏ tuyến thượng thận. Sau khi cắt bỏ một bên tuyến thượng thận, bệnh nhân nên được điều trị thay thế bằng glucocorticoid tới khi hồi phục trục dưới đồi - tuyến yên - thượng thận khỏi tác dụng gây ức chế kéo dài do dư thừa glucocorticoid gây nên. Bệnh nhân bị cắt bỏ thượng thận cả hai bên cần được điều trị thay thế glucocorticoid và mineralocorticoid suốt đời.
Trong bệnh Cushing, cắt bỏ u tuyến yên kích thước nhỏ qua xương bướm là phương pháp điều trị được chọn cho bệnh nhân có khối u tuyến yên nhỏ, ranh giới rõ ràng. Trong các trường hợp khác, có thể tiến hành cắt bỏ gần hoàn toàn thủy trước tuyến yên. Các lựa chọn cho bệnh nhân có khối u được cắt bỏ không hoàn toàn hoặc tái phát bao gồm: mổ lại, điều trị tia xạ tuyến yên bằng tia xạ thường quy hoặc tia xạ định vị, cắt bỏ cả hai bên tuyến thượng thận hoặc điều trị nội khoa.
Tia xạ tuyến yên có thể không kiểm soát được tình trạng tăng cortisol máu trong nhiều tháng tới nhiều năm, bệnh nhân cần được điều trị nội khoa tới khi thấy có tác dụng đầy đủ của điều trị tia xạ. Có thể đánh giá hiệu quả của điều trị triệt để bằng phẫu thuật cắt u tuyến yên qua xương bướm bằng cách theo dõi nồng độ ACTH và cortisol sau mổ, sẽ không phát hiện được các nồng độ này nếu cắt bỏ thành công hoàn toàn u. Sau khi cắt bỏ u tuyến yên qua xương bướm, bệnh nhân cần được điều trị thay thế glucocorticoid tới khi trục dưới đồi - tuyến yên - thượng thận hồi phục lại bình thường.
Hội chứng Cushing phụ thuộc ACTH lạc chỗ (Ectopic ACTH- dependent CS) phải được khẳng định bằng thăm dò hình ảnh học, bao gồm chụp CT, MRI và/hoặc xạ hình (ví dụ, [68] Ga-DOTATATE). Các khối u có thể được xác định vị trí bằng hình ảnh học nên được cắt bỏ bằng phẫu thuật. Nếu nguồn gốc là khối u không được biết rõ hoặc nếu có tình trạng bệnh di căn, điều trị nội khoa hoặc cắt cả hai bên tuyến thượng thận được khuyến cáo [20].
3.1 Các thuốc điều trị
Các thuốc làm giảm sản xuất cortisol hoặc ức chế tác dụng của cortisol có thể sử dụng cho bệnh nhân bị chống chỉ định phẫu thuật, kiểm soát tình trạng tăng cortisol máu trước khi mổ để điều trị tình trạng bệnh tiếp diễn hoặc tái phát và như một điều trị bắc cầu tới khi tia xạ có tác dụng đầy đủ ở bệnh nhân bị bệnh Cushing. Điều trị nội khoa cũng được sử dụng ở bệnh nhân bị hội chứng Cushing phụ thuộc ACTH lạc chỗ với các khối u không phát hiện được hoặc không thể mổ được. Các thuốc bao gồm điều trị hướng đích tuyến yên (chỉ với bệnh Cushing), thuốc ức chế enzym thượng thận và thuốc đối kháng thụ thể glucocorticoid.
| Bảng 15.5. Các xét nghiệm chẩn đoán phân biệt bệnh Cushing và u tiết ACTH lạc chỗ | ||
| Test | Bệnh Cushing | U tiết ACTH lạc chỗ |
| Triệu chứng lâm sàng | Khởi phát các triệu chứng từ từ; tiến độ chậm trong nhiều năm | Khởi phát đột ngột các triệu chứng; tiến bộ nhanh chóng |
| Ha kali | Xảy ra < 10% trường hợp | Phổ biến |
| Cortisol nước tiểu 24 giờ | <10 × ULN | Thường > 10 × ULN |
| ACTH | Thường <200 pg / mL | Thường > 200 pg/mL |
| MRI tuyến yên | Tổn thương> 6 mm gợi ý CD | Có thể có u tuyến yên kích thước nhỏ ngẫu nhiên |
| 8 mg dexamethason qua đêm [18] Định lượng nồng độ cortisol huyết thanh 8 giờ sáng; cho bệnh nhân uống 8 mg dexamethason lúc 23 giờ, lấy lại một mẫu máu khác để định lượng nồng độ cortisol lúc 8 giờ sáng hôm sau. | > 50% ức chế cortisol huyết tương Độ nhạy 95% Độ đặc hiệu 100% > 80% ức chế cortisol huyết tương Độ nhạy 62% Độ đặc hiệu 100% | Ức chế < 50% cortisol huyết tương |
Test kích thích bằng CRH Đặt catheter tĩnh mạch 2 giờ trước khi làm test, cho bệnh nhân dùng CRH 1mg blolus tĩnh mạch lúc 8h sáng, lấy máu đo nồng độ ACTH ở các thời điểm trước tiêm CRH 5 phút và 1 phút và các thời điểm 15 phút và 30 phút sau tiêm CRH. | ≥ 35% tăng ACTH ≥ 20% tăng cortisol | <35% tăng ACTH <20% tăng cortisol |
| Test kích thích bằng Desmopressin [6,19] Đo nồng độ ACTH và cortisol huyết thanh ban đầu, 15, 30, 45 và 60 phút từ catheter sau tiêm tĩnh mạch 10 ng desmopressin. | > 35 - 50% tăng ACTH Độ nhạy 84 - 89% Độ đặc hiệu 40 - 60 | < 35% tăng ACTH |
IPSS Lấy máu tĩnh mạch xoang đá dưới hai bên đồng thời với máu ngoại vi định lượng nồng độ ACTH trước và sau tiêm 100 kg CRH đường tĩnh mạch | Trước tiêm CRH: ACTH; Trước tiêm CRH IPS:P ≥ 2 Sau tiêm CRH: ACTH IPS:P ≥ 3 SENS 97-100% SPEC 100% | ACTH; IPS:P < 2 Sau tiêm CRH: ACTH IPS:P <3 |
ACTH: Hormon hướng vỏ thượng thận; UFC: Cortisol tự do trong nước tiểu; ULN, (upper limit of normal): Mức giới hạn bình thường cao; HDDST: Test ức chế dexamethason liều cao; CRH: Hormon gây giải phóng kích tố hướng vỏ thượng thận; IPSS: Lấy mẫu máu từ xoang đá dưới. Được sửa đổi từ Sharma ST. An individualized approach to the evaluation of Cushing syndrome. Endocr Pract 2017;23:726-737; Aytug S, Laws ER Jr, Vance ML. Assessment of the utility of the high-dose dexamethasone suppression test in confirming the diagnosis of Cushing disease. Endocr Pract 2012;18:152-157; and Terzolo M, Reimondo G, Ali A, et al. The limited value of the desmopressin test in the diagnostic approach to Cushing's syndrome. Clin Endocrinol (Oxf) 2001;54:609-616. | ||
Các thuốc hướng đích tuyến yên:
- Khoảng 80% adenoma tuyến yên loại tế bào tiết kích tố thượng thận có thụ thể dopamin D2. Cabergolin với liều từ 1 - 7 mg/tuần (trung bình 2 - 3,5 mg/tuần), đã được chứng minh là có thể kiểm soát sinh hóa ở 25 - 40% bệnh nhân bị bệnh Cushing [21]. Tuy nhiên, có đến một phần ba số bệnh nhân xuất hiện tình trạng không đáp ứng và có thể cần được chuyển sang các biện pháp điều trị thay thế khác [22]. Ngoài ra, điều trị kết hợp bằng ketoconazol và cabergolin đã được chứng minh giúp kiểm soát được tăng cortisol máu ở tới 80% bệnh nhân khi điều trị bằng ketoconazol hoặc cabergoline đơn độc không kiểm soát được tình trạng này [23]. Về các tác dụng phụ khi dùng thuốc, xem Chương 2, (U tế bào tiết prolactin).
- Paireotid chất tương đồng với Somatostatin đã được sử dụng trong điều trị to đầu chi (xem Chương 3), gắn với bốn trong số năm thụ thể somatostatin với ái lực cao nhất đối với somatostatin typ 5 (SSTR5), đây là thụ thể được biểu lộ chủ yếu trong adenoma tế bào tiết ACTH thượng thận. Thuốc được phê duyệt trong phác đồ tiêm dưới da 2 lần/ngày để điều trị bệnh Cushing và có thể được xem xét dùng cho bệnh nhân bị tăng nhẹ nồng độ cortisol tự do trong nước tiểu 24 giờ với bệnh Cushing tiếp diễn dai dẳng hoặc tái phát hoặc chỉ định cho bệnh nhân mới chẩn đoán song không được lựa chọn để điều trị phẫu thuật. Điều trị sau 6 tháng giúp bình thường hóa được nồng độ cortisol tự do trong nước tiểu 24 giờ ở khoảng 50% bệnh nhân bị bệnh Cushing nhẹ, (được định nghĩa là khi nồng độ cortisol tự do trong nước tiểu 24 giờ lớn hơn 1,5 - 2 lần giá trị bình thường cao), 26% bệnh nhân bị bệnh Cushing mức độ vừa (khi nồng độ cortisol tự do trong nước tiểu 24 giờ lớn hơn 2 - 5 lần giá trị bình thường cao), 8% bệnh nhân bị bệnh Cushing nặng (khi nồng độ cortisol tự do trong nước tiểu 24 giờ > 5 giá trị bình thường cao) bình thường hóa được nồng độ cortisol tự do trong nước tiểu 24 giờ [24]. Cũng có thể xem xét dùng pasireotid nếu bệnh nhân có khối u lớn ít cơ may có thể phẫu thuật lấy bỏ được hoàn toàn u hoặc không có bác sĩ phẫu thuật thần kinh đủ kinh nghiệm để tiến hành mổ cho bệnh nhân vì thuốc được chứng minh là làm giảm > 25% khối u cho bệnh nhân [25]. Bệnh nhân nên được bắt đầu với liều 600 hoặc 900 kg tiêm dưới da 2 lần/ngày với mức tăng liều mỗi lần 300 kg dựa trên nồng độ cortisol tự do trong nước tiểu 24 giờ và đáp ứng lâm sàng của bệnh nhân. Giảm nồng độ cortisol xảy ra trong vòng 2 tháng đầu, vì vậy có thể nhận diện được sớm các bệnh nhân nhiều khả năng sẽ có đáp ứng với điều trị. Tần suất bị các tác dụng ngoại ý liên quan với tăng đường huyết trong các thử nghiệm lâm sàng cao hơn ở bệnh nhân bị bệnh Cushing (68,4 – 73%) so với bệnh nhân bị to đầu chi (57,3 - 67%), có thể là do các khác biệt về sinh lý của bệnh [26]. Để biết các tác dụng phụ khác xin xem Chương 3 (To đầu chi).
- Pasireotid có thể được sử dụng kết hợp với cabergolin và/hoặc ketoconazol ở những bệnh nhân không đáp ứng với đơn trị liệu. Trong một thử nghiệm tiến cứu trên 17 bệnh nhân bị bệnh Cushing, 29% bệnh nhân bình thường hóa được nồng độ cortisol tự do trong nước tiểu 24 giờ khi dùng pasireotid đơn độc, 24% khi dùng kết hợp pasireotid và cabergolin và 35% khi dùng kết hợp của pasireotid, cabergolin và ketoconazol [27].
Thuốc ức chế tổng hợp steroid
- Thuốc ức chế tổng hợp steroid thượng thận ức chế các enzym quan trọng tham gia vào quá trình sản xuất steroid và có thể được sử dụng để điều trị hội chứng Cushing nội sinh do bất kỳ nguyên nhân nào.
- Ketoconazol là một kháng sinh chống nấm gây ức chế sự phân cắt chuỗi bên của các enzym 17,20-lyase và 116-hydroxylase. Các nghiên cứu cho thấy dùng thuốc giúp làm bình thường hóa nồng độ cortisol niệu 24 giờ ở 50% các bệnh nhân [28]. Ketoconazol được đưa vào danh sách đen cảnh báo ở Hoa Kỳ do có nguy cơ gây độc cho gan, đây là tác dụng phụ nghiêm trọng nhất của thuốc và bị chống chỉ định ở những bệnh nhân có bệnh gan. Nên theo dõi xét nghiệm men gan hằng tuần trong tháng đầu sau mỗi lần thay đổi liều dùng, sau đó 1 tháng/lần trong 3 tháng và theo dõi định kỳ sau đó. Trong một nghiên cứu trên 190 bệnh nhân bị bệnh Cushing, 13% bệnh nhân có mức tăng men gan <5 lần so với giá trị bình thường cao, 2,5% có mức tăng >5 lần so với giá trị bình thường cao, xét nghiệm men gan trở về mức ban đầu sau khi giảm hoặc ngừng dùng thuốc, không có trường hợp nào bị tử vong do viêm gan [29]. Các tác dụng phụ khác bao gồm vú to nam giới, bất lực và các triệu chứng tiêu hóa. Khoảng liều dùng từ 200 - 1.200 mg đường uống chia thành 2 - 3 lần/ngày.
- Metyrapon ức chế 11ß-hydroxylase và không được phổ biến rộng rãi ở Hoa Kỳ. Dùng thuốc giúp làm bình thường hóa về mặt sinh hóa ở 52% bệnh nhân [30], thuốc có tác dụng nhanh và an toàn nhất để có thể sử dụng trong khi có thai. Các tác dụng phụ chính bao gồm tăng androgen, tăng huyết áp và hạ kali máu do làm tăng 11- deoxycorticosterone. Liều dùng dao động trong khoảng từ 250 đến 1000 mg đường uống và thuốc có thể được cho mỗi 6 giờ/lần.
- Etomidat gây ức chế nhiều enzym trong quá trình sinh tổng hợp steroid như các enzym phân cắt chuỗi bên, 17-hydroxylase, 118-hydroxylase, enzym 17, 20-lyase và aldosteron synthase, là thuốc duy nhất dùng đường tĩnh mạch hiện có trên thị trường. Thuốc có thể được sử dụng để kiểm soát nhanh tình trạng tăng tiết cortisol ở bệnh nhân có các biến chứng nặng của hội chứng Cushing như loạn thần, sepsis hoặc tăng huyết áp.
- Mitotan ức chế enzym phân cắt chuỗi bên cholesterol và 116-hydroxylase. Mitotan gây phá hủy vĩnh viễn các tế bào vỏ thượng thận và do đó nó có thể được sử dụng để đạt được việc cắt bỏ tuyến thượng thận bằng thuốc như một biện pháp thay thế cho phẫu thuật cắt bỏ tuyến thượng thận. Mitotan được sử dụng phổ biến nhất trong điều trị carcinoma (ung thư biểu mô) vỏ thượng thận. Trong một nghiên cứu hồi cứu được thực hiện ở Pháp, tình trạng thuyên giảm bệnh xảy ra ở 73% bệnh nhân bị bệnh Cushing được điều trị trong một giai đoạn thời gian trung bình là 6,7 tháng [22]. Điều trị thay thế glucocorticoid được bắt đầu ngay khi bắt đầu dùng mitotan và điều trị bằng mineralocorticoid cuối cùng có thể cần tới. Các tác dụng phụ của thuốc nói chung phụ thuộc vào liều dùng, bao gồm các triệu chứng tiêu hóa, suy nhược, lờ đờ, giảm bạch cầu, vú to nam giới và tăng cholesterol máu. Liều được bắt đầu từ 0,5 g uống trước khi đi ngủ và tăng liều chậm lên 2 đến 3 g/ngày chia thành 3-4 lần/ngày. Có thể theo dõi nồng độ mitotan để đánh giá hiệu quả điều trị.
- Kết hợp mitotan, metyrapon và ketoconazol để điều trị cho những bệnh nhân bị hội chứng Cushing nặng thể phụ thuộc ACTH không phải là ứng viên để mổ cắt tuyến thượng thận đã được chứng minh là giúp làm giảm nhanh nồng độ cortisol máu và cải thiện lâm sàng trong một nghiên cứu trên 11 bệnh nhân [25].
Các thuốc đối kháng thụ thể glucocorticoid
- Mifepriston (RU486) là một thuốc đối kháng thụ thể glucocorticoid và progesteron với ái lực gắn với thụ thể glucocorticoid cao gấp 3 lần so với dexamethason và ái lực gắn với thụ thể glucocorticoid cao gấp 10 lần cortisol. Tại Hoa Kỳ, thuốc được phê chuẩn để điều trị hội chứng Cushing (do bất kỳ nguyên nhân nào) ở bệnh nhân đái tháo đường hoặc bị rối loạn dung nạp glucose là đối tượng đã phẫu thuật thất bại hoặc không phải là ứng viên cho chỉ định phẫu thuật. Theo ý kiến của chúng tôi, có thể xem xét sử dụng mifepriston cho cả các bệnh nhân không mắc bệnh đái tháo đường. Thuốc cũng có thể được xem xét dùng cho bệnh nhân cần giảm nhanh cortisol như ở các bệnh nhân có hội chứng tiết ACTH lạc chỗ với các biểu hiện nặng của tăng cortisol máu hoặc để cải thiện các thông số chuyển hóa ở bệnh nhân trước khi phẫu thuật.
- Mifepriston được kết hợp với cải thiện các biểu hiện lâm sàng của hội chứng Cushing ở 75% bệnh nhân, cải thiện khả năng dung nạp glucose ở 60% và cải thiện huyết áp ở 40% các trường hợp [25]. Trong một theo dõi lâu dài ở 36 bệnh nhân bị bệnh Cushing và có các dữ liệu về hình ảnh chụp MRI trong thử nghiệm SEISMIC, 4 bệnh nhân (3 trường hợp là u tuyến yên kích thước nhỏ) có sự tiến triển của khối u và 2 bệnh nhân có sự thoái triển của khối u, vì vậy nên chụp MRI để theo dõi sự phát triển của khối u [31].
- Mifepriston khởi phát tác dụng nhanh (1 đến 4 giờ) và thời gian bán thải dài (24 đến 90 giờ) và vì vậy được dùng 1 lần/ ngày. Bệnh nhân nên được bắt đầu với liều 300 mg/ngày với tăng liều mỗi lần 300 mg/ngày sau 2 đến 4 tuần/lần dựa trên đáp ứng lâm sàng cho tới khi đạt liều tối đa là 1.200 mg/ngày.
- Do cơ chế tác dụng của thuốc, nồng độ ACTH và cortisol tăng lên và không thể theo dõi được ở bệnh nhân bị bệnh Cushing hoặc u tiết ACTH lạc chỗ. Ở bệnh nhân bị hội chứng Cushing thượng thận, có thể sử dụng tình trạng giảm nồng độ ACTH như một chỉ dấu đại diện cho đáp ứng lâm sàng. Dư thừa cortisol dẫn đến hoạt hóa thụ thể mineralocorticoid, gây tăng huyết áp, hạ kali máu, phù nề ở nhiều bệnh nhân do đó cần dùng liều cao thuốc đối kháng thụ thể aldosteron và bổ sung kali cho bệnh nhân. Các tác dụng phụ khác bao gồm buồn nôn, mệt mỏi, đau đầu, đau khớp, tăng sản nội mạc tử cung và chảy máu âm đạo ở phụ nữ.
Thuốc đang được nghiên cứu: Các loại thuốc hiện đang được nghiên cứu bao gồm osilodrostat (LC1699), chất ức chế 11B-hydroxylase và aldosteron synthase [28], levoketoconazole (một chất đối quang [enantiomer] 2S, 4R của ketoconazol [28]) và CORT125134 (chất đối kháng hormon glucocorticoid chọn lọc [32]).
4 CÁC TRƯỜNG HỢP ĐẶC BIỆT
Hội chứng Nelson có thể xảy ra do mất cơ chế phản hồi ngược âm tính ở các bệnh nhân bị bệnh Cushing (adenoma tuyến yên) không đáp ứng với điều trị thường quy được điều trị bằng cắt bỏ cả hai bên tuyến thượng thận. Hội chứng này gây tình trạng khối u còn lại to ra và tăng rất cao nồng độ ACTH huyết thanh. Bệnh nhân xuất hiện tăng sắc tố da đi kèm với nồng độ ACTH tăng cao. Hiện vẫn chưa rõ liệu tia xạ tuyến yên trước hoặc sau cắt tuyến thượng thận hai bên có thể dự phòng được hội chứng này [23].
Đã có những trường hợp (mặc dù hiếm gặp) bị hội chứng Cushing trong khi có thai. Bệnh nhân có thai có thể được điều trị hiệu quả bằng phẫu thuật qua xương bướm (đối với bệnh Cushing) hoặc cắt cả hai bên tuyến thượng thận. Ngoài ra metyrapon và cabergolin có thể được sử dụng để điều trị tình trạng tăng cortisol máu trong khi có thai [34].
5 TIÊN LƯỢNG
Tỷ lệ tử vong trong hội chứng Cushing bị tăng lên so với tỷ lệ tử vong chuẩn (SMR) được ước tính trong khoảng 2,0 - 4,0 [1] với hầu hết các trường hợp tử vong là hậu quả của các biến chứng tim mạch/thuyên tắc mạch hoặc nhiễm trùng do vi khuẩn/nấm. Điều trị phẫu thuật triệt để hoặc kiểm soát bằng thuốc đối với tình trạng tăng cortisol máu, dẫn tới cải thiện dần các dấu hiệu và triệu chứng của hội chứng Cushing qua một khoảng thời gian từ 2 - 12 tháng. Tăng huyết áp, không dung nạp với glucose, loãng xương và các triệu chứng tâm thần nói chung sẽ cải thiện nhưng có thể không thuyên giảm hoàn toàn.
Tỷ lệ thuyên giảm bệnh sau phẫu thuật qua xương bướm đối với bệnh Cushing là 78% với khoảng thời gian theo dõi trung bình 64 tháng và tỷ lệ tái phát lên tới 32% [35]. Nhiều khả năng sẽ điều trị triệt để bệnh nếu bệnh nhân xuất hiện tình trạng giảm cortisol máu vào những ngày đầu tới các tuần đầu sau phẫu thuật. Cortisol huyết tương buổi sáng < 2 ug/dL đến 5 ug/dL trong vòng vài ngày sau phẫu thuật có giá trị tiên lượng thuyên giảm từ 90 - 100% [36,37]. Do một số bệnh nhân mặc dù có nồng độ cortisol sau mổ thấp, song vẫn bị tái phát nên cần theo dõi suốt đời.
Hồi phục của trục dưới đồi - tuyến yên - thượng thận ở bệnh nhân được điều trị triệt để sau phẫu thuật qua xương bướm có thể bị muộn lại tới sau 2 năm, vì vậy bệnh nhân cần được làm xét nghiệm đánh giá trục dưới đồi - tuyến yên - thượng thận nhắc lại để xác định sự cần thiết cần phải điều trị thay thế steroid ngoại sinh trong suốt cuộc đời của bệnh nhân. Bệnh nhân bị suy toàn bộ tuyến yên xảy ra sau phẫu thuật đòi hỏi phải được theo dõi suốt đời và điều chỉnh liều điều trị hormon thay thế.
Tỷ lệ thuyên giảm bệnh khi điều trị bằng xạ phẫu được báo cáo ở bệnh nhân bị bệnh Cushing dao động từ 0 - 100% (trung bình là 51%) với khoảng thời gian trung bình tới khi thuyên giảm về chỉ số sinh hoá là 12 tháng. Do phải sử dụng liều cao hơn để điều trị các khối u có hoạt động chức năng, tỷ lệ bị suy tuyến yên cho thấy cao hơn (lên tới 69%) ở bệnh nhân bị bệnh Cushing khi so sánh với các khối u không có chức năng [38].
Bệnh nhân có tình trạng tiết ACTH lạc chỗ hoặc carcinoma vỏ thượng thận có thể có tiên lượng tồi liên quan với bệnh lý ác tính nền. Các bệnh nhân này hiếm khi được điều trị triệt để, song có thể kiểm soát tình trạng tăng cortisol máu bằng thuốc hoặc cắt bỏ tuyến thượng thận cả hai bên.
6 HỘI CHỨNG GIẢ CUSHING
Hội chứng Cushing thực sự, do tăng tiết Cortisol máu liên tục, gây biến đổi hình thể và gây nhiều biến chứng về chuyển hóa, nhiễm trùng, tâm thần... có thể dẫn đến tử vong, nên cần được điều trị triệt để. Tuy nhiên, còn có một nhóm bệnh nhân cũng có tăng tiết cortisol nhưng yếu hơn và không liên tục, do trục dưới đồi – tuyến yên – tuyến thượng thận được hoạt hóa, cũng gây ra các biến đổi về lâm sàng và sinh hóa, có thể khó phân biệt với hội chứng Cushing thực sự. Tình trạng này được gọi là hội chứng giả Cushing (Pseudo-Cushing syndrome)
6.1 Nguyên nhân
Cơ chế đằng sau hội chứng giảm Cushing không rõ ràng. Hầu hết các bằng chứng đều có liên quan đến sự kích thích hormone giải phóng corticotropin (CRH) ở vùng dưới đồi.
Các nguyên nhân phổ biến của hội chứng giả Cushing bao gồm mang thai, rối loạn sử dụng rượu, bệnh béo phì, hội chứng buồng trứng đa nang, bệnh thận giai đoạn cuối, rối loạn trầm cảm nghiêm trọng và bệnh tiểu đường không được kiểm soát. Điều trị các bệnh lý tiềm ẩn giúp giải quyết được hội chứng giả Cushing.
Một giả thuyết đã chỉ ra hội chứng giả Cushing là do rượu gây ra. Cụ thể, những con chuột được uống 15% cồn trong 3 tháng cho thấy số lượng tế bào sản xuất corticotropin nhiều hơn với hoạt động bài tiết tăng lên. Trong bệnh gan mãn tính do rượu, có sự gia tăng tỷ lệ tiết cortisol. Một nghiên cứu khác cho rằng, rượu có thể tác động trực tiếp đến việc tăng tiết cortisol.
6.2 Phân biệt với hội chứng Cushing
Khá khó để phân biệt Cushing và giảm Cushing nếu dựa trên các triệu chứng thực thể. Để phân biệt 2 tình trạng này, người ta thường sử dụng xét nghiệm bài tiết cortisol tự do trong nước tiểu (UFC) trong 24 giờ, thử nghiệm ức chế dexamethasone qua đêm (DST), đo nồng độ cortisol huyết thanh lúc nửa đêm, đo nồng độ cortisol trong nước bọt vào đêm khuya.
Bạn đọc có thể tham khảo thêm cách chẩn đoán và điều trị hội chứng cushing sau đây:
7 TÀI LIỆU THAM KHẢO
1. Lacroix A, Feelders RA, Stratakis CA, Nieman LK. Cushing's syndrome. Lan- cet 2015;386:913-927.
2. Pivonello R, De Martino MC, De Leo M, Lombardi G, Colao A. Cushing's syndrome. Endocrinol Metab Clin North Am 2008;37:135-149.
3. Shahani S, Nudelman RJ, Nalini R, Kim HS, Samson SL. Ectopic corticotro- pin-releasing hormone (CRH) syndrome from metastatic small cell carcinoma: a case report and review of the literature. Diagn Pathol 2010;5:56. http://www. diagnosticpathology.org. Accessed October 25, 2017.
4. Vassiliadi D, Tsagarakis S. Un- usual causes of Cushing's syn- drome. Arq Bras Endocrinol Metabol 2007;51:1245-1252.
5. Pappachan JM, Hariman C, Edavalath M, Waldron J, Han- na FW. Cushing's syndrome: a practical approach to diagnosis and differential diagnoses. J Clin Pathol 2017;70:350-359.
6. Newell-Price JDC. Cushing disease. In: Melmed S, ed. The Pituitary. 4th ed. Academic Press; 2017: 515-571.
7. Carroll TB, Aron DC, Findling JW, Tyrrell JB. Glucocorticoids and adrenal androgens. In: Gardner DG, Shoback D, eds. Greenspan's Basic & Clinical Endocrinology. 10th ed. McGraw-Hill Education; 2018.
8. Findling JW, Raff H. Diagnosis of endocrine disease: differentiation of pathologic/neoplastic hypercorti- solism (Cushing's syndrome) from physiologic/non-neoplastic hyper- cortisolism (formerly known as pseudo-Cushing's syndrome). Eur J Endocrinol 2017;176:R205-R216.
9. Nieman LK, Biller BMK, Find- ling JW, et al. The diagnosis of Cushing's syndrome: an Endocrine Society Clinical Practice Guide- line. J Clin Endocrinol Me- tab 2008;93:1526-1540.
10. Thynne T, White GH, Burt MG. Factitious Cushing's syn- drome masquerading as Cush- ing's disease. Clin Endocrinol (Oxf) 2014;80:328-332.
11. Nieman LK, Biller BMK, Findling JW, et al. Điều trị of Cushing’s Syndrome: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2015;100:2807- 2831.
12. Pecori Giraldi F, Ambrogio AG, De Martin M, Fatti LM, Scacchi M, Cavagnini F. Specificity of first-line tests for the diagnosis of Cushing's syndrome: assessment in a large series. J Clin Endocrinol Metab 2007;92:4123-4129.
13. Elamin MB, Murad MH, Mullan R, et al. Accuracy of diagnostic tests for Cushing's syndrome: a systematic review and metaanal- yses. J Clin Endocrinol Me- tab 2008;93:1553-1562.
14. Ueland GÅ, Methlie P, Kellmann R, et al. Simultaneous assay of cor- tisol and dexamethasone improved diagnostic accuracy of the dexa- methasone suppression test. Eur J Endocrinol 2017;176:705-713.
15. Yorke E, Atiase Y, Akpalu J, Sarfo-Kantanka O. Screening for Cushing syndrome at the primary care level: what every general prac- titioner must know. Int J Endocri- nol 2017;2017:1547358.
16. Invitti C, Pecori Giraldi F, de Martin M, Cavagnini F. Diagno- sis and management of Cushing's syndrome: results of an Italian multicentre study. Study Group of the Italian Society of Endocrinol- ogy on the Pathophysiology of the Hypothalamic-Pituitary-Adrenal Axis. J Clin Endocrinol Me- tab 1999;84:440-448.
17. Sharma ST; AACE Adrenal Sci- entific Committee. An individu- alized approach to the evaluation of Cushing syndrome. Endocr Pract 2017;23:726-737.
18. Aytug S, Laws ER Jr, Vance ML. Assessment of the utility of the high-dose dexamethasone suppres- sion test in confirming the diag- nosis of Cushing disease. Endocr Pract 2012;18:152-157.
19. Terzolo M, Reimondo G, Ali A, et al. The limited value of the desmo- pressin test in the diagnostic ap- proach to Cushing's syndrome. Clin Endocrinol (Oxf) 2001;54:609–616.
20. Iglesias P, Arcano K, Triviño V, et al. Prevalence, clinical features, and natural history of incidental clinically non-functioning pi- tuitary adenomas. Horm Metab Res 2017;49:654–659.
21. Ferriere A, Cortet C, Chanson P, et al. Cabergoline for Cushing's disease: a large retrospective multicenter study. Eur J Endocri- nol 2017;176:305–314.
22. Iglesias P, Arcano K, Triviño V, et al. Prevalence, clinical features, and natural history of incidental clinically non-functioning pituitary adenomas. Horm Metab Res 2017;49:654–659.
23. Ferriere A, Cortet C, Chanson P, et al. Cabergoline for Cushing's disease: a large retrospective multicenter study. Eur J Endocri- nol 2017;176:305-314.
24. Cuevas-Ramos D, Lim DST, Flese- riu M. Update on medical điều trị for Cushing's disease. Clin Diabe- tes Endocrinol 2016;2:16. https:// clindiabetesendo.biomedcentral. com. Accessed October 25, 2017.
25. Barbot M, Albiger N, Ceccato F, et al. Combination therapy for Cushing's disease: effectiveness of two schedules of điều trị: should we start with caber- goline or ketoconazole? Pituitary 2014; 17:109-117.
26. Colao A, Petersenn S, Newell-Price J, et al. A 12-month phase 3 study of pasireotide in Cushing's disease. N Engl J Med 2012;366:914–924.
27. Pivonello R, De Leo M, Coz- zolino A, Colao A. The điều trị of Cushing's disease. Endocr Rev 2015;36:385–486.
28. Silverstein JM. Hyperglycemia induced by pasireotide in patients with Cushing's disease or acromega- ly. Pituitary 2016;19:536–543.
29. Feelders RA, de Bruin C, Pereira AM, et al. Pasireotide alone or with cabergoline and ketoconazole in Cushing's disease. N Engl J Med 2010;362:1846-1848.
30. Fleseriu M, Castinetti F. Updates on the role of adrenal steroidogen- esis inhibitors in Cushing's syn- drome: a focus on novel therapies. Pituitary 2016;19:643-653.
31. Castinetti F, Guignat L, Giraud P, et al. Ketoconazole in Cushing's disease: is it worth a try? J Clin En- docrinol Metab 2014;99:1623-1630.
32. Daniel E, Aylwin S, Mustafa O, et al. Effectiveness of metyrapone in treating Cushing's syndrome: a retrospective multicenter study in 195 patients. J Clin Endocrinol Metab 2015;100:4146-4154.
33. Fleseriu M, Findling JW, Koch CA, Schlaffer SM, Buchfelder M, Gross C. Changes in plasma ACTH levels and corticotroph tumor size in patients with Cushing's disease during long-term điều trị with the glucocorticoid receptor antagonist Mifepristone. J Clin Endocrinol Metab 2014; 99: 3718-3727.
34. Hunt H, Donaldson K, Strem M, et al. Assessment of safety, tol- erability, pharmacokinetics, and pharmacological effect of orally administered CORT125134: an adaptive, double-blind, random- ized, placebo-controlled phase 1 clinical study. Clin Pharmacol Drug Dev 2018;7:408–421.
35. Ritzel K, Beuschlein F, Mickisch A, et al. Clinical review: Outcome of bilateral adrenalectomy in Cushing's syndrome: a systematic review. J Clin Endocrinol Me- tab 2013;98:3939-3948.
36. Caimari F, Valassi E, Garbayo P, et al. Cushing's syndrome and pregnancy outcomes: a systematic review of published cases. Endo- crine 2017;55:555–563.
37. Pivonello R, De Martino MC, De Leo M, Simeoli C, Colao A. Cush- ing's disease: the burden of illness. Endocrine 2017;56:10-18.
38. Hameed N, Yedinak CG, Brzana J, et al. Remission rate after trans- sphenoidal surgery in patients with pathologically confirmed Cushing's disease, the role of cortisol, ACTH assessment and immediate reoper- ation: a large single center experi- ence. Pituitary 2013;16:452-458.
39. Ayala A, Manzano AJ. Detection of recurrent Cushing's disease: proposal for standardized patient monitoring following trans- sphenoidal surgery. J Neuroon- col 2014;119:235–242. 40. Ding D, Starke RM, Sheehan JP. Điều trị paradigms for pituitary adenomas: defining the roles of ra- diosurgery and radiation therapy. J Neurooncol 2014;117:445-45

