Hóa trị liệu và bài toán điều trị ung thư phụ khoa ở nữ giới
Đại học Huế - Trường ĐH Y Dược
Đồng chủ biên
GS.TS. Nguyễn Vũ Quốc Huy
GS.TS. Cao Ngọc Thành
PGS.TS. Lê Minh Tâm
PGS.TS. Trương Thành Vinh
Cùng nhiều tác giả tham gia biên soạn
1 ĐẠI CƯƠNG
Kỷ nguyên của hóa trị liệu hiện đại bắt đầu vào những năm 1940 với công trình đoạt giải Nobel của Huggins và Hodges về tác dụng chống khối u của estrogen trong ung thư tuyến tiền liệt. Quan sát này được phát hiện vào giữa những năm 1940, sau cuộc điều tra về hợp chất mù tạt nitơ (một sản phẩm phụ của khí nitơ được sử dụng trong thế chiến thứ nhất) vì chất này có tác dụng chống lại các khối u bạch huyết và khối u rắn.
Trong khoảng thời gian từ những năm 1945-1965, nhiều loại thuốc dùng trong hóa trị liệu đã được tìm ra và nghiên cứu, bao gồm actinomycin D, cyclophosphamide, vinca alkaloids, 5-fluorouracil (5-FU) và progesterones. Vào những năm 1970, cisplatin được ghi nhận là có tác dụng kháng u đáng kể để chống lại ung thư buồng trứng và ung thư tinh hoàn, Tamoxifen được phát hiện có hoạt tính chống lại ung thư vú cho cả liệu pháp bổ trợ và điều trị bệnh tiến triển. Cũng trong thập kỷ này, bleomycin, etoposide và doxorubicin được sử dụng trong làm sàng và các hợp chất dẫn xuất như carboplatin, vinorelbine và idarubicin đã được phát triển để có khả năng đạt được tác dụng kháng u tương tự nhưng ít độc tính về huyết học hơn. Vào những năm 1980-1990, một loạt các loại thuốc mới được sử dụng rộng rãi như nhóm taxane (paclitaxel và docetaxel), ifosfamide, các chất ức chế topoisomerase (topotecan và irinotecan) và các chất tương tự nucleoside (gemcitabine và capecitabine).
Cùng với sự gia tăng ngày càng nhiều các hoạt chất có thể trong hóa liệu pháp, các phác đồ dùng thuốc đã có nhiều cải thiện; sử dụng ở các dạng công thức khác nhau như bao gói dựa trên liposome hoặc polyme đa dạng về liệu trình, trình tự và đường dùng thuốc. Các liệu pháp hỗ trợ giải quyết độc tính xảy ra trên đường tiêu hóa và huyết học cũng đã có những bước phát triển như việc sử dụng thường quy các chất đối kháng thụ thể 5-HT3 (ví dụ: ondansetron và Granisetron) để dự phòng nên và các yếu tố kích thích các dòng tế bào bạch cầu (ví dụ: sargramostim và filgrastim) để cho phép sử dụng liều điều trị hóa chất cao hơn.
Các tác nhân hóa trị liệu là một phần quan trọng trong “kho vũ khí” của các bác sĩ trong “cuộc chiến” ngày càng mở rộng chống lại bệnh ung thư. Với việc sử dụng những loại thuốc này, các bác sĩ có thể cải thiện và thậm chí chữa khỏi những căn bệnh thường gây tử vong trong quá khứ. Cho đến nay, trong hầu hết các trường hợp hóa trị liệu được dành cho các giai đoạn tương đối muộn của bệnh, nhưng với việc sử dụng ngày càng thành công, đặc biệt là trong điều trị các khối u ác tính ở hệ tạo máu, cho thấy rằng hóa trị nên được chỉ định sớm hơn. Tất cả các bác sĩ điều trị và phẫu thuật viên phải hiểu rõ bản chất và nguyên tắc sử dụng của hóa trị liệu trong ung thư để có thể đưa ra quyết định hợp lý về thời điểm chỉ định. Mặc dù kết quả của hóa trị liệu trong ung thư không thể dự đoán được đầy đủ, nhưng mức độ thuyên giảm có thể được cải thiện bằng cách lựa chọn bệnh nhân một cách thận trọng, đánh giá cẩn thận mô hình phát triển của khối u và điều trị tổn thương tân sản bằng thuốc hoặc các loại thuốc có nhiều khả năng hiệu quả nhất. Đáp ứng lâm sàng đối với hóa trị liệu có thể được đánh giá bằng cách sử dụng tiêu chuẩn RECIST "Tiêu chí đánh giá đáp ứng dành cho các khối u đặc (Response Evaluation Criteria in Solid Tumors) được định nghĩa bởi Viện Ung thư Quốc gia Hoa Kỳ .
Tiêu chí đánh giá đáp ứng dành cho các khối u đặc (RECIST) | |
Đánh giá | |
Các tổn thương đích | |
Đáp ứng hoàn toàn | Biến mất tất cả các tổn thương đích |
Đáp ứng một phần | Giảm ít nhất 30% tổng đường kính dài nhất (the longest diameter - LD) của các tổn thương đích, lấy làm tham chiếu cho tổng LD cơ bản |
Bệnh tiến triển | Tăng ít nhất 20% tổng của các tổn thương đích, lấy tổng LD nhỏ nhất ghi lại được kể từ khi bắt đầu điều trị hoặc xuất hiện một hoặc nhiều tổn thương mới |
Bệnh ổn định | Không làm giảm bớt đủ để ứng với điều kiện của PR cũng như chưa tăng đủ mức để đủ điều kiện cho PD, lấy tổng LD nhỏ nhất kể từ khi bắt đầu điều trị. |
Các tổn thương không phải đích | |
Đáp ứng hoàn toàn | Biến mất tất cả các tổn thương không phải đích và các chất chỉ điểm khối u trở về bình thường |
Đáp ứng không hoàn toàn hoặc bệnh ổn định | Tồn tại đại đẳng một hoặc nhiều tổn thương không phải được hoặc chất chỉ điểm duy trì ở mức giới hạn trên |
Bệnh tiến triển | Xuất hiện một hoặc nhiều tổn thương mới hoặc có sự tiến triển rõ ràng của các tổn thương không phải tích đã tồn tại |
* Mặc dù sự tiến triển rõ ràng của tổn thương “không phải đích” chỉ là ngoại lệ, nhưng trong những trường hợp như vậy, ý kiến của bác sĩ điều trị nên được ưu tiên áp dụng và tình trạng tiến triển nên được hội đồng đánh giá (hoặc chủ tọa nghiên cứu) xác nhận sau đó.
Tuy vậy, không phải tất cả bệnh nhân ung thư đều có thể điều trị bằng hóa trị liệu. Một bệnh nhân thoả mãn điều kiện điều trị phụ thuộc vào ít nhất ba tiêu chỉ quan trọng:
i) Bản chất của tổn thương tân sản, ii) Mức độ lan tràn hoặc giai đoạn của bệnh.
ii) Tình trạng lâm sàng của bệnh nhân.
Không phải tất cả các bệnh ung thư đều nhạy cảm với thuốc như nhau. Các yếu tố để xác định tính nhạy cảm của một khối u bao gồm các thuốc được phân phối đến khối u, sự vận chuyển thuốc vào tế bào, liệu con đường sinh hóa nhạy cảm với thuốc có tồn tại trong tế bào khối u hay không và tỷ lệ tương đối của quá trình kích hoạt và bất hoạt nội bào của thuốc. Hiểu biết kỹ lưỡng về chu kỳ tế bào và động học phát triển tế bào là điều cơ bản để hiểu và vận dụng hóa trị liệu thích hợp.
2 KIỂM SOÁT CHU KÌ TẾ BÀO VÀ ĐỘNG HỌC PHÁT TRIỂN TẾ BÀO
Các mô bình thường được chia thành ba loại chính: tĩnh, mở rộng và đổi mới. Các quần thể tĩnh của tế bào nói chung đều được biệt hóa tốt sau một thời gian tăng sinh trong thời kỳ bào thai và hiếm khi trải qua quá trình phân chia ở người trưởng thành, ví dụ như tế bào thần kinh và cơ vân. Do hiểm gặp phân chia tế bào, các tế bào này không có khả năng bị tổn thương bởi các liệu pháp hóa học nhắm vào các tế bào đang phân chia nhanh chóng. Các quần thể mô mở rộng cũng thường bất hoạt ở người trưởng thành, nhưng không giống như các quần thể tĩnh, chủng giữ được khả năng tăng sinh nhanh chóng để phản ứng với stress hoặc chấn thương. Ví dụ điển hình của các tế bào mở rộng là tế bào gan và nội mô mạch máu. Cuối cùng các quần thể tế bào đang đổi mới là những quần thể liên tục trải qua quá trình phân chia, chẳng hạn như tủy xương và biểu mô đường tiêu hóa. Các mô đổi mới dễ bị tổn thương nhất bởi các tác nhân hóa trị liệu (Bảng 2).
Đổi mới (tăng sinh nhanh) | Mở rộng (tăng sinh chậm) | Tĩnh (Hiếm khi tăng sinh) |
Tủy xương | Phổi | Cơ |
Niêm mạc đường tiêu hoá | Gan | Xương |
Buồng trứng | Thận | Sụn |
Tinh hoàn | Các tuyến nội tiết | Thần kinh |
Nang lông | Nội mô mạch máu |
|
Nhìn chung, trong quá trình phát triển ác tính, các tế bào không ngừng nhân lên khi chúng đạt đến một khối lượng tới hạn. Sự phát triển không được kiểm soát này là kết quả của sự kết hợp giữa mất kiểm soát các chu kỳ tế bào bình thường và suy giảm cơ chế chết tế bào được lập chương trình bình thường. Mặc dù tăng trưởng không kiểm soát, quá trình phân chia tế bào ác tính dường như không nhanh hơn quá trình phân chia tế bào bình thường.
Nói chung, khi khối u phát triển, chúng biểu thị sự tăng trưởng theo đường cong Gompertz (Hình 11): Khi khối u tăng kích thước, thời gian cần thiết để tăng gấp đôi kích thước của nó cũng trở nên lâu hơn. Do đó, trong giai đoạn đầu của quá trình phát triển, các tế bào khối u dường như phát triển theo cấp số nhân nhưng khi kích thước khối u tăng lên thì thời gian để nhân đôi cũng tăng theo, mặc dù thời gian nhân đôi ở mỗi cơ quan trọng cơ thể người có thể khác nhau rất lớn. Ví dụ, trong khi các khối u phôi và một số u lympho có thời gian nhân đôi tương đối ngắn (20-40 ngày), thì các ung thư biểu mô tuyến và ung thư biểu mô tế bào vảy có thời gian nhân đội tương đối dài (50-150 ngày). Ba luận điểm đã được đưa ra để lý giải cho thời gian nhân đối bị kéo dài này:
i. Gia tăng thời gian chu kỳ tế bào (thời gian từ lần nguyên phân này đến lần nguyên phân tiếp theo).
ii. Giảm thành phần phát triển (các tế bào tham gia phân chia tế bào trong khối u).
iii. Gia tăng mất tế bào do các tế bào khối u thiếu hụt nguồn cung cấp mạch máu nuôi dưỡng.
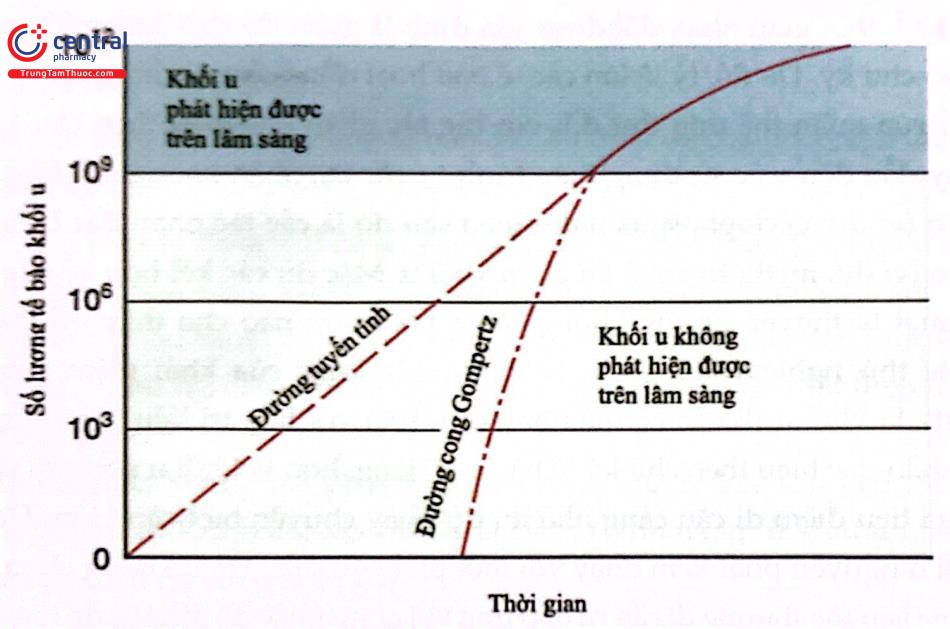
Mô hình Gompertz có một số ý nghĩa quan trọng đối với quá trình tiến triển của ung thư. Thứ nhất, các tổn thương di căn thường có thời gian nhân đôi ngắn hơn so với tổn thương nguyên phát. Nếu giả định rằng, sự phát triển theo cấp số nhân xảy ra sớm trong lịch sử của bệnh ác tính và bệnh ác tính đó bắt đầu từ một tế bào đơn lẻ, thì khối u 1mm chắc hẳn đã trải qua khoảng 20 lần nhân đôi. Một khối 5mm (kích thước có thể bắt đầu nhận ra được trên phim chụp X-quang) có thể đã trải qua 27 lần nhân đôi. Theo đó, một khối 1cm sẽ trải qua 30 lần nhân đối và bác sĩ lâm sàng sẽ rất vui khi phát hiện ra một tổn thương “sớm” như vậy. Tuy vậy, tổn thương “sớm” này đã trải qua 30 lần nhân đôi và có thể DNA đã thay đổi đáng kể. Với cơ sở lý luận này, các kỹ thuật lâm sàng hiện nay có xu hướng phát hiện các khối u ác tính ở giai đoạn muộn trong quá trình phát triển của chúng và tổn thương di căn có thể đã xảy ra rất lâu trước khi có biểu hiện lâm sàng rõ ràng của tổn thương nguyên phát. Một ý nghĩa khác là trong giai đoạn muộn của sự phát triển khối u, chỉ cần vài lần nhân đôi đã tác động đáng kể đến kích thước khối u và tình trạng của bệnh nhân. Khi khối u đã có thể sờ thấy được (đường kính 1cm tương ứng 30 lần nhân đôi) thì chỉ cần ba lần nhân đôi nữa sẽ tạo ra một khối u rất lớn (đường kính 8cm).
Mô hình Gompertz cũng có ý nghĩa lâm sàng giúp định hướng rất nhiều nghiên cứu hóa trị liệu lâm sàng. Khi khối u đáp ứng với điều trị (ví dụ như giảm kích thước), thời gian nhân đôi được giả định là giảm do một lượng lớn các tế bào đã đi vào chu kỳ. Do đó, tỷ lệ lớn các tế bào hoạt động chuyển hóa này sẽ làm tăng độ nhạy của quần thể ung thư đối với các tác nhân đặc hiệu theo chu kỳ tế bào. Điều này dẫn đến việc sử dụng theo trình tự các tác nhân không đặc hiệu cho chu kỳ tế bào (ví dụ: cyclophosphamide) theo sau đó là các tác nhân đặc hiệu cho chu kỷ tế bào (ví dụ, methotrexate) để giảm khối u. Mặc dù các kết hợp kế tiếp này hấp dẫn về mặt lý thuyết, nhưng không có sự phối hợp nào cho thấy ưu thế rõ ràng trong các thử nghiệm lâm sàng. Một ý nghĩa khác của khái niệm tăng trưởng Gompertz là khối u di căn có thể nhạy cảm hơn với hóa trị liệu nói chung và với các tác nhân đặc hiệu theo chu kỳ tế bào nói riêng, hơn là khối u nguyên phát. Kích thước của tiêu điểm di căn càng nhỏ thì độ nhạy chuyên biệt càng lớn. Do đó, nếu một khối u nguyên phát kém nhạy với một phác đồ điều trị, thì cũng chưa rõ để dự đoán được liệu tổn thương di căn có đáp ứng với cùng phác đồ điều trị đó hay không.
Cơ sở lý luận của việc sử dụng thuốc trong điều trị ung thư là nhằm đạt được mục đích tiêu diệt có chọn lọc các tế bào khối u. Cơ sở lý luận này là các nguyên tắc cơ bản của giả thuyết "tiêu diệt tế bào" được mô tả lần đầu tiên bởi Skipper và cộng sự. Bốn nguyên tắc sau đây đã được thực hiện trong mô hình bệnh bạch cầu L1210.
i. Thời gian sống của động vật bị ung thư có liên quan nghịch với số lượng tế bào ung thư.
ii. Một tế bào đơn lẻ có khả năng nhân lên và cuối cùng giết chết vật chủ.
iii. Đối với hầu hết các loại thuốc, có một mối quan hệ rõ ràng giữa liều lượng thuốc và khả năng tiêu diệt tế bào khối u của thuốc
iv. Một liều lượng nhất định của một loại thuốc sẽ tiêu diệt một phân khúc nhất định các tế bào, không phải là một hằng số, bất kể số lượng tế bào hiện có là bao nhiêu.
Nguyên tắc thứ tư và cũng là nguyên tắc quan trọng nhất này ngụ ý rằng các tác nhân hóa trị liệu hoạt động theo động học bậc một - nghĩa là, chúng tiêu diệt một phần nhất định của tế bào chứ không phải là một hằng số cụ thể nào. Khái niệm này có ý nghĩa quan trọng trong điều trị ung thư. Chỉ cần một lần tiếp xúc với các tế bào khối u thì thuốc chống ung thư có thể tiêu diệt từ 2 đến 4 log tế bào. Với khối u thông thường chứa 1012 tế bào (1kg) thì một liều hóa trị liệu duy nhất sẽ phá hủy một lượng lớn tế bào ung thư nhưng không thể diệt hết. Do đó, cần có các liệu trình hóa trị liệu ngắt quãng để đạt được mức độ tiêu diệt tế bào cần thiết để loại bỏ tổn thương. Về mặt lâm sàng, động học tế bào bậc một cho thấy để loại bỏ một quần thể khối u một cách hiệu quả, cần phải:
Tăng tổng liều của một loại thuốc hoặc các loại thuốc đến giới hạn tối đa mà cơ thể có thể dung nạp, hoặc
Bắt đầu điều trị khi số lượng tế bào còn đủ thấp để cho phép tiêu diệt khối u với tổng liều lượng thuốc mà cơ thể có thể dung nạp.
Kết luận hợp lý được rút ra từ giả thuyết này là cơ hội tối đa để chữa khỏi bệnh trong giai đoạn sớm. Trước đây, hóa trị liệu thường được dành để điều trị ung thư lan tỏa; phẫu thuật và xạ trị là những phương pháp điều trị được lựa chọn cho tổn thương khu trú. Tuy nhiên, khái niệm “giả thuyết tiêu diệt theo hàm log” này cung cấp cơ sở lý luận cho triết lý hóa trị bổ trợ, nghĩa là giả định sự hiện diện của các khối tế bào không thể phát hiện từ 10% đến 10% tế bào sau liệu pháp phẫu thuật ban đầu thì có khả năng khối u sẽ tái phát. Gánh nặng từ khối u nhỏ này dễ dàng đáp ứng điều trị với hóa trị liệu.
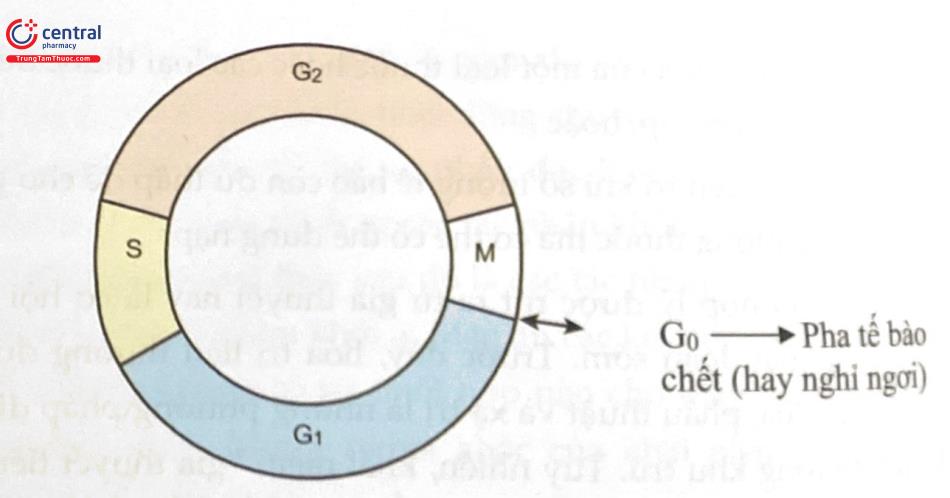
Để hiểu rõ hơn về động học của tế bào, bắt buộc phải hình dung được chu kỳ của tế bào. Tất cả các tế bào đang phân chia đều tuân theo một mô hình sao chép có thể dự đoán được. Thời gian tế bào cần để hoàn thành một chu kỳ tăng trưởng và phân chia được gọi là thời gian thế hệ. Có 5 pha cơ bản: (Hình 2). Pha G1 (G là viết tắt của từ "gap" - nghĩa là khoảng trống hay mục đích không cụ thể) kéo dài trong một khoảng thời gian biến đổi - thường từ 4 đến 24 giờ. Nếu pha này kéo dài, tế bào thường được coi là đang ở trong pha G0, hoặc pha nghỉ ngơi. Pha 5 là giai đoạn tổng hợp DNA và thường kéo dài từ 10 đến 20 giờ. Pha G2 là giai đoạn tiền phân bào kéo dài từ 2 đến 10 giờ và pha M, khi quá trình nguyên phân thực sự diễn ra, kéo dài từ 0,5 đến 1 giờ. Các khối u không có thời gian thế hệ nhanh hơn nhưng có nhiều tế bào trong các pha hoạt động nhân lên hơn các mô bình thường. Các mô bình thường có một lượng lớn tế bào ở pha G0, trong đó tế bào không hoạt động phân chia hoặc “nằm ngoài chu kỳ”.
Pha | Thời gian (giờ) |
Khoảng trống 1 (G1) Hậu phân bào | 4-24 (tùy biến) |
Tổng hợp DNA (S) | 10-20 |
Khoảng trống 2 (G2) | 2-10 |
Phân bào (M) | 0,5-1 |
Khoảng trống 0 (G0) | Nghỉ ngơi (tùy biến) |
Một số tác nhân hóa trị liệu chỉ hoạt động ở một số pha của chu kỳ tế bào. Các tác nhân alkyl hóa dường như hoạt động trong tất cả các pha từ Gọ đến nguyên phân. Chúng được gọi là các tác nhân không đặc hiệu theo chu kỳ phân chia tế bào. Các loại thuốc như hydroxyurea, doxorubicin (Adriamycin) và methotrexate đường như hoạt động chủ yếu ở pha S. Bleomycin dường như hoạt động ở pha Ga và Vincristin dường như hoạt động ở pha M. Những loại thuốc này được gọi là tác nhân đặc hiệu theo chu kỳ phân chia tế bào (Bảng 3) bởi vì chúng chỉ tác động về mặt hóa học trên các tế bào đang ở một pha cụ thể của chu kỳ tạo tế bào.
Steroid, 5-FU và cisplatin có hoạt tính khá đồng đều trong chu kỳ tạo tế bào. Về lý thuyết, nếu tác nhân điều trị ung thư chỉ tấn công các tế bào đang phân chia hoặc tế bào khối u đang phân chia nhiều hơn tế bào mô bình thường, thì bằng cách sắp xếp hợp lý tác nhân hóa trị liệu và kết hợp các tác nhân hoạt động trong các pha khác nhau của chu kỳ tế bào, người ta sẽ có thể tiêu diệt được một lượng lớn các tế bào khối u hơn so với các tế bào bình thường. Các nghiên cứu về động học ở người và động vật cho thấy rằng các khối u đã được chữa khỏi bằng hóa trị liệu là những khối u có phần lớn tế bào đang trong giai đoạn tăng sinh (ví dụ, ung thư nguyên bào nuôi liên quan thai kỳ và u lympho Burkitt).
Đánh giá dựa trên mức độ của bệnh chứ không phải là tổng kích thước của khối u chính là yếu tố quan trọng nhất khi xem xét xạ trị hoặc phẫu thuật, nhưng đối với hóa trị liệu, tổng kích thước khối u là quan trọng nhất. Khi thể tích khối u giảm, các tế bào khối u còn lại có thể bắt đầu hoạt động phân chia (chúng được chuyển từ trạng thái pha Go đi thẳng vào chu kỳ tạo tế bào dễ bị tổn thương hơn), do đó khiến chúng nhạy với hóa chất. Các tác nhân hóa trị liệu này, cũng như trong xạ trị, tiêu diệt theo nguyên tắc động học bậc một - tức là làm giảm quần thể khối u theo tỷ lệ phần trăm đặc trưng, bất kể số lượng tế bào khối u thực sự hiện diện lúc đầu (Hình 4). Nếu gánh nặng khối u nhỏ, thì có thể cần ít chu kỳ hóa trị hơn. Một miligam khối của khối u thường bao gồm 10 tế bào. Mộtcm khối của khối u thường bao gồm 10 tế bào. Bệnh nhân thường tử vong ở mức 10mux12 tế bào.

Phụ thuộc pha | Nhóm | Thuốc |
Tác động pha S | Antimetabolite | Cytarabine |
Doxorubicin | ||
5-Fluorouracil | ||
6-Mercaptopurine | ||
Methotrexate | ||
Hydroxyurea | ||
Prednisone | ||
Tác động pha M | Vinca alkaloids | Vincristine |
Vinblastine | ||
Nhóm taxanes | Paclitaxel | |
Docetaxel | ||
Podophyllotoxins | Etoposide | |
Teniposide | ||
Epothilones | Ixabepilone | |
Tác động pha G2 |
| Bleomycin |
Tác động pha G1 |
| Corticosteroids |
Nhóm các thuốc theo chu kỳ tế bào:
Pha G1: Actinomycin D.
Pha S sóm: Hydroxyurea, arabinoside cytosine, 5-fluorouracil, methotrexate.
Pha S muộn: Doxorubicin.
Pha G2: Bleomycin, etoposide, teniposide, carboplatin, cisplatin, topotecan. Pha M: Paclitaxel, vincristine, vinblastine.
3 ĐỘNG HỌC HÓA LIỆU PHÁP
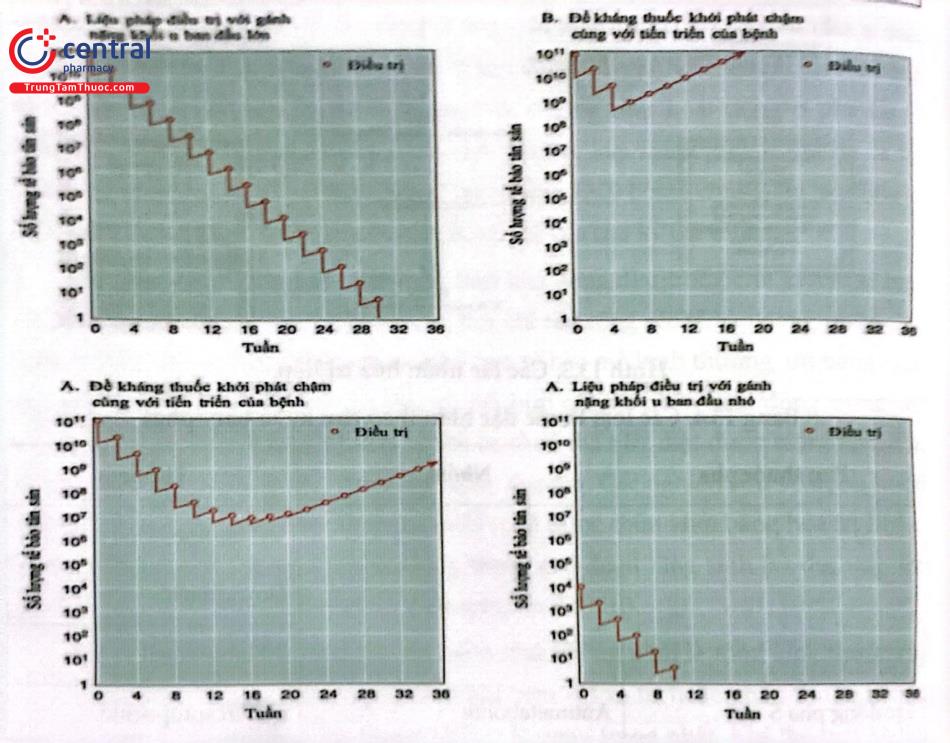
Thời gian nhân đôi của một khối u phụ thuộc vào cả thời gian thế hệ và tỷ lệ chết của tế bào (Hình 135). Chúng ta không thể giả định rằng, thời gian thế hệ dài chỉ đơn giản là do khối u từ từ lớn dần. Khối u phát triển chậm có thể do thời gian phát sinh nhanh kết hợp với tỷ lệ tế bào chết cao. Vì những lý do tương tự, một khối u nhỏ được phát hiện trên phim chụp X-quang hoặc khám sức khỏe không nhất thiết là một khối u sớm; chỉ những nghiên cứu liên tục xuyên suốt mới có thể đánh giá được tốc độ tăng trưởng của nó để giúp xác định thời gian hình thành. Các khối u lớn (đường kính > 2-3cm) to chậm hơn các khối nhỏ vì các tế bào của chúng, đặc biệt là những khối u nằm sâu trong lõi (xa nguồn cung cấp máu nhất), có thời gian thế hệ lâu hơn. Cạnh tranh về chất dinh dưỡng cũng như các áp lực cạnh tranh khác ít được đề cập tới, làm giảm hoạt động của toàn bộ khối u.
.jpg)
Hóa trị liệu thành công trong điều trị ung thư cần có một “biên sinh lý” để có thể khai thác và tiêu diệt được các tế bào ung thư một cách chuyên biệt nhưng vẫn bảo tồn được các tế bào bình thường càng nhiều càng tốt. Lợi dụng đặc tính phát triển nhanh của các khối u cũng như tính đồng bộ cao của các tế bào khối u so với các mô bình thường để có thể thiết kế các phác đồ điều trị. Tại bất kỳ thời điểm nào, một lượng tương đối lớn các tế bào ung thư sẽ ở trong giai đoạn tổng hợp DNA (pha S) của chu kỳ tế bào, thời điểm duy nhất mà các tác nhân phụ thuộc chu kỳ (những chất ức chế tổng hợp DNA) có thể hoạt động. Do đó, hóa trị liệu liều cao trong thời gian ngắn với các tác nhân gây ảnh hưởng đến quá trình tổng hợp DNA, chẳng hạn như methotrexate, có hiệu quả cao nhất bằng cách tiêu diệt các tế bào khối u đang phân chia nhanh và bảo tồn được tương đối các thành phần bình thường của tủy xương. Tuy vậy, tế bào tủy xương tế bào biểu mô lát đường tiêu hóa và nang lông đều có thời gian thế hệ tương đương với thời gian thế hệ của khối u và do đó chúng dễ bị tổn thương bởi các hợp chất ức chế tổng hợp DNA (xem Bảng 2). Tuy nhiên, quần thể tế bào khối u phát triển đồng bộ hơn, chỉ có một số tế bào tủy xương ở trong pha S tại bất kỳ thời điểm nào và điều này giải thích cho độc tính chọn lọc của các hợp chất phụ thuộc vào pha. Một đợt điều trị kéo dài trong khoảng vài ngày hoặc thậm chí vài tuần có thể được yêu cầu để tiêu diệt khối u phát triển chậm, khi mà chỉ một số tế bào đang trong giai đoạn tổng hợp DNA tại một thời điểm bất kỳ. Các tác nhân không phụ thuộc vào quá trình tổng hợp DNA về tác dụng của chúng (tức là các tác nhân không đặc hiệu theo chu kỳ), chẳng hạn như tác nhân alkyl hóa, có hiệu quả cao nhất đối với các khối u lớn, phát triển chậm. Các tế bào còn lại sau khi điều trị có xu hướng phân chia nhanh hơn và dễ tấn công bởi các tác nhân đặc hiệu theo chu kỳ. Do đó, chúng ta có thể thấy có tính linh hoạt trong tác động qua lại của các tác nhân hóa trị liệu.
Hiện tượng tăng tính nhạy cảm của các tế bào khối u trong quá trình phục hồi từ các tác nhân alkyl hóa là cơ sở cho việc kết hợp trình tự các tác nhân đặc hiệu và không đặc hiệu theo chu kỳ trong nhiều phác đồ mới. Ngoài ra, nếu các loại thuốc có cơ chế gây độc khác nhau được kết hợp với nhau, thì mỗi loại thuốc đó có thể được sử dụng với liều lượng an toàn khi chỉ dùng một mình. Mỗi loại thuốc được chọn để điều trị kết hợp phải có hoạt tính kháng u khi được sử dụng riêng lẻ. Nếu được thì các liệu trình hóa trị ngắt quãng nên được áp dụng để cho phép phục hồi các tế bào bình thường nếu chúng bị giảm số lượng do điều trị. Trong trường hợp đã biết thuốc giải độc cho tác nhân hóa trị liệu - ví dụ, leucovorin (yếu tố citrovorum, acid folinic) cho methotrexate - thuốc giải độc cũng có thể được sử dụng để đẩy nhanh quá trình phục hồi tế bào bình thường. Tất nhiên, nguy cơ các tế bào khối u thường có khả năng phục hồi cũng tồn tại và phải được đánh giá với mỗi phác đồ điều trị mới. Mặc dù cần có các nghiên cứu cẩn thận để so sánh từng phác đồ phối hợp thuốc mới với các tác nhân đơn lẻ có liên quan, nhưng có thể nói rằng xu hướng hiện nay là phối hợp thuốc, sử dụng đồng thời hoặc nối tiếp nhau.
4 DƯỢC LÝ HỌC
Một số yếu tố dược lý chung ảnh hưởng đáng kể đến việc sử dụng thích hợp các tác nhân hóa trị liệu, bao gồm sự hấp thụ, phân phối, vận chuyển, chuyển hóa và bài tiết của thuốc. Những nguyên tắc này không chỉ ảnh hưởng đến hiệu quả của thuốc mà còn quy định liều lượng, lịch trình sử dụng thuốc và cách các loại thuốc được lựa chọn để sử dụng kết hợp. Hiệu quả của một phác đồ nhất định phụ thuộc vào việc tối ưu hóa giá trị (nồng độ x thời gian) (còn được gọi là diện tích dưới đường cong [area under the curve - AUC]) tại vị trí khối u. Sự hấp thu thuốc ảnh hưởng đến đường dùng, do đó ảnh hưởng đến AUC. Việc một loại thuốc được sử dụng bằng đường uống tiêm tĩnh mạch, tiêm động mạch, tiêm bắp hoặc trong phúc mạc cũng được quyết định bởi khả năng chấp nhận của bệnh nhân, tính khả thi và độc tính.
Việc phân phối và đưa thuốc đến vị trí khối u cũng ảnh hưởng đến AUC. Các yếu tố như gắn kết thuốc (với Albumin hoặc với đường truyền catheter - chất liệu bằng Nhựa), khả năng hòa tan trong lipid và vận chuyển qua màng tế bào có vai trò quan trọng trong việc xác định hiệu quả của một tác nhân cụ thể nào đó. Một số vị trí nhất định trong cơ thể, chẳng hạn như não và tinh hoàn, đại diện cho các khu bảo tồn dược lý nơi việc phân phối thuốc bị hạn chế. Tương tự, quá trình hoại tử hoặc thiếu oxy làm giảm tưới máu khối u cũng có thể làm giảm khả năng phân phối và nồng độ thuốc. Hiểu biết về cơ chế vận chuyển qua màng tế bào cũng rất quan trọng: một số loại thuốc, chẳng hạn như 5-FU và mitomycin C, có thể xâm nhập vào tế bào thông qua cơ chế khuếch tán thụ động, nhưng những loại khác, chẳng hạn như cisplatin và melphalan đòi hỏi vận chuyển tích cực.
Chuyển hóa thuốc là quá trình cần thiết để chuyển một tiền chất bất hoạt thành dạng hoạt động. Một ví dụ là cyclophosphamide, yêu cầu kích hoạt cytochrome P450 trước khi có tác dụng kháng u. Các tác nhân đòi hỏi được chuyển hóa ở gan để trở thành dạng hoạt động thì không thể sử dụng trong phúc mạc hoặc trong động mạch. Ngược lại, chuyển hóa và bài tiết của hoạt chất cũng ảnh hưởng đến AUC. Gan và thận chịu trách nhiệm đào thải phần lớn thuốc, mặc dù sự bài tiết qua mật, phân và hô hấp cũng có thể góp phần trong một số trường hợp. Rối loạn chức năng cơ quan có thể làm tăng độc tính của thuốc và có thể phải điều chỉnh liều lượng.
4.1 Tương tác thuốc
Mặc dù bệnh nhân đang điều trị bằng hóa chất có thể sẽ nhận thêm nhiều loại thuốc khác để điều trị các tác dụng phụ cấp tính hoặc các tình trạng bệnh mãn tính, nhưng rất ít tương tác thuốc có ý nghĩa lâm sàng. Tuy nhiên, một vài tương tác thuốc cần chú ý. Cụ thể là, trong khi các tác nhân doxorubicin và nhóm taxane được biết là gây tăng độc tính khi làm suy giảm bài tiết mật, thì các hợp chất platin và methotrexat có thể gây tăng độc tính trong việc giảm chức năng thận. Aspirin và sulfonamid được biết là có thể đẩy methotrexate khỏi protein huyết tương, bên cạnh đó các tương tác hóa học trực tiếp cũng được ghi nhận giữa cisplatin với mannitol, mitoxantrone, Heparin.
4.2 Kháng thuốc
Hiệu quả của bất kỳ phương pháp điều trị ung thư nào cũng bị giới hạn bởi tình trạng kháng thuốc, có thể là nội tại hoặc mắc phải và có thể kháng một loại thuốc hoặc nhiều loại thuốc (kháng thuốc toàn diện). Có ý kiến cho rằng đột biến tự phát là cơ sở cho tình trạng kháng thuốc. Đột biến tự phát này xảy ra nhanh chóng trong các khối u ác tính. Khái niệm này - giả thuyết Goldie-Coleman - đã được áp dụng trong sự phát triển của các khối u ác tính và có ý nghĩa lâm sàng quan trọng. Lý thuyết cho rằng hầu hết các tế bào ác tính bắt đầu từ sự nhạy cảm nội tại với các tác nhân hóa trị liệu nhưng phát triển khả năng kháng thuốc tự phát với tỷ lệ khác nhau. Goldie và Coleman đã phát triển một mô hình toán học liên quan đến khả năng chữa khỏi với thời gian tái phát của các tế bào kháng đơn lẻ hoặc kép. Giả sử rằng, có một tỷ lệ đột biến tự nhiên, mô hình dự đoán sự thay đổi về kích thước của phần kháng thuốc ở những khối u có cùng kích thước và cùng loại, tỷ lệ này phụ thuộc vào tỷ lệ đột biến và thời điểm đột biến phát triển. Do đó, sẽ có một tỷ lệ nhỏ các tế bào kháng thuốc trong bất kỳ khối u nào chưa được điều trị, nhưng phản ứng ban đầu với điều trị sẽ không bị ảnh hưởng bởi số lượng tế bào kháng thuốc. Trong thực hành lâm sàng, điều này có nghĩa là có thể thuyên giảm hoàn toàn ngay cả khi có dòng tế bào kháng thuốc. Tuy nhiên, sự thất bại trong việc cứu chữa một bệnh nhân như vậy sẽ phụ thuộc trực tiếp vào sự hiện diện của các tế bào kháng thuốc này. Mô hình kháng thuốc tự phát này ngụ ý rằng việc giảm thiểu sự xuất hiện của các dòng kháng thuốc đòi hỏi phải áp dụng nhiều loại thuốc hoặc nhiều liệu pháp hiệu quả càng sớm càng tốt trong diễn tiến bệnh ác tính của bệnh nhân.
Trong các dòng tế bào và mô hình động vật, khả năng kháng với các loại thuốc cụ thể có thể xảy ra thông qua nhiều cơ chế khác nhau, mặc dù chỉ một số ít được xác nhận là có ý nghĩa lâm sàng đối với bệnh ung thư ở người. Chúng bao gồm tăng khả năng sửa chữa DNA thành thạo, giảm sự hấp thu thuốc hoặc tăng dòng chảy của tế bào, tăng mức độ hoặc thay đổi các enzym đích, thay đổi trong quá trình hoạt hóa hoặc phân hủy thuốc, khuếch đại gen và chuyển hóa thuốc bị khiếm khuyết. Các cơ chế này được xem xét trong Bảng.55.
Sự đề kháng nhiều loại thuốc cũng xảy ra qua nhiều cơ chế khác nhau. Một số bằng chứng thực nghiệm trong các khối u ở chuột cho thấy rằng một dạng kháng nhiều loại thuốc liên quan đến khả năng của các tế bào khối u kháng thuốc bằng cách hạn chế tích lũy thuốc không liên quan về cấu trúc. Sự đề kháng chéo này thường thấy nhất với các sản phẩm tự nhiên (ví dụ: Doxorubicin, etoposide, paclitaxel và vinca alkaloids); đề kháng với một loại thuốc duy nhất có thể gây ra đề kháng chéo với các loại thuốc khác nhau về cấu trúc với các phương thức tác dụng khác nhau. Đây là cơ chế được nghiên cứu để lý giải tốt nhất về khảng đa thuốc và được đặc trưng bởi glycoprotein p-170 và gen MDR1 của nó. Tác giả Ling là người đầu tiên biểu diễn sự xuất hiện của P-glycoprotein với trọng lượng phân từ 170kD trên màng tế bào. Sự xuất hiện của kháng thuốc toàn thân có liên quan đến tính thấm của tế bào để tích tụ và giữ lại thuốc chống ung thư.
Cơ chế | Các loại thuốc |
Tăng khả năng sửa chữa DNA | Các tác nhân alkyl hóa, cisplatin |
Giảm hấp thu tế bào hoặc tăng lưu lượng thuốc | Cisplatin, doxorubicin, etoposide, melphalan, 6-mercaptopurine, methotrexate, mù tạt nitơ, vinblastine, vincristine |
Tăng nồng độ enzyme "đích" | Methotrexate |
Thay đổi enzyme đích | 5-Fluorouracil, 6-mercaptopurine, methotrexate, 6-thioguanine |
Giảm hoạt hóa thuốc | Cytosine arabinoside, doxorubicin, 5-fluorouracil, 6-mercaptopurine, 6-thioguanine |
Tăng thoái giáng thuốc | Bleomycin, cytosine arabinoside, 6-mercaptopurine |
Thay đổi con đường sinh hoá | Cytosine arabinoside |
Bất hoạt các chất chuyển hóa có hoạt tính bằng cách gắn với | Các tác nhân alkyl hóa, cisplatin, doxorubicin sulfhydryl compounds |
Giảm hoạt động của men topoisomerase | Camptothecins, doxorubicin, etoposide |
Thay đổi các vị trí liên kết tubulin | Vincristine, paclitaxel, ixabepilone |
Tăng khả năng chịu thương tổn | Các tác nhân alkyl hóa, cisplatin |
Người ta đã chứng minh rằng, P-glycoprotein này liên quan trực tiếp đến sự biểu hiện của sự kháng thuốc và các tế bào trở về trạng thái nhạy cảm với thuốc sẽ mất glycoprotein này. DNA có thể được chuyển từ các tế bào kháng thuốc sang các tế bào nhạy cảm, tạo ra sự chuyển giao tính kháng toàn bộ cho các tế bào không bị phơi nhiễm. Mặc dù có đặc tính tốt nhất, nhưng MDR1 không hẳn là cơ chế phổ biến nhất để giải thích cho các trường hợp kháng hóa chất ở các bệnh ung thư buồng trứng, do hầu hết không biểu hiện gen MDR1. Một cơ chế khác cho kiểu hình đa kháng thuốc được thấy trong số các tác nhân alkyl, cisplatin và tia xạ. Sự đề kháng ở nhóm tác nhân này có liên quan đến việc tăng nồng độ Glutathione nội bào và không liên quan đến việc giảm tích lũy thuốc.
Các protein vận chuyển khác, bao gồm cả protein liên quan đến kháng đa thuốc, đã được xác định là không liên quan đến bơm glycoprotein p-170. Ha ria, những thay đổi trong các gen kiểm soát quá trình chết theo chương trình và ngưng tăng trưởng cũng đã được nêu ra. Mặc dù tầm quan trọng tương đối của các cơ riêng biệt này trong ung thư buồng trứng vẫn chờ được thiết lập, nhưng có vẻ việc kết hợp các cơ chế khác nhau tùy trường hợp lâm sàng cũng hiệu quả.
4.3 Tính toán liều lượng
Liều lượng của các tác nhân hóa trị liệu thường được đề cập theo thuật ngữ ng/kg trọng lượng cơ thể hoặc mg/m2 tổng diện tích bề mặt cơ thể (Bảng 6) Liều lượng dựa trên diện tích bề mặt được ưu tiên hơn so với liều lượng dựa trên trọng lượng, vì diện tích bề mặt thay đổi ít hơn nhiều trong quá trình điều trị, cho phép cung cấp lượng thuốc chính xác và nhất quán hơn trong suốt liệu trình. Liều lượng trên mỗi đơn vị cũng tương đương hơn ở người lớn và trẻ em (Hình 6 và 7) và sự khác biệt về tổng liều giữa những người rất béo và rất gầy được giảm thiểu. Liều lượng ở động vật thí nghiệm được biểu thị bằng mg/m2 cũng gần tương ứng đến liều lượng ở người. Ở người lớn, ng/kg có thể được chuyển đổi tương đương thành ng/m2 bằng cách nhân với 40.
| Công thức |
Mostellar (m2) | √(Cân nặng x Chiều cao)/3600 |
Dubois & Dubois (m2) | (Cân nặng)0.425 x (Chiều cao)0.725 x 71.84 |
Haycock (m2) | (Cân nặng)0.5378 x (Chiều cao)0.3964 x 0.024265 |
Nên điều chỉnh liều ở những bệnh nhân có khả năng bị suy giảm tự thì hay xương tức là những người trên 20 tuổi, những người đã được ta sự vùng nhi hoặc ở bụng trình đó và những người đã từng hóa trị liệu trà và ở những nhóm bệnh nhân này, bác sĩ nền còn nhắc bắt đầu với liều thấp từ 1.32% và th dần lên đến liều đầy đủ với các liệu trình tiếp theo nếu liều ban đầu thay đ nạp tốt. Theo cách tiếp cận tương tự, bất kỳ độc tính nào từ mức độ trung bình đa nghiêm trọng xảy ra trong quá trình điều trị của bệnh nhân số là họ thất tình giảm liều trong trường là. Dầu chính liều thường được yêu cầu ở những hình nhân đang dùng thuốc chống ung thư được thời trẻ qua thận. Những điều ch này làm giảm khả năng nồng độ thuốc trong huyết trung qua cái và ng nhiễm độc thân nghiêm trọng của bệnh nhân.


Một số kỹ thuật được sử dụng để đánh giá chức năng thận (mức lọc cầu thận) những người bị ung thư. Độ thanh thải creatinin được tính toán dựa vào creatinin huyết thanh được sử dụng phổ biến nhất. Sự đào thải creatinin chủ yếu qua quá trình lọc ở cầu thận, mặc dù một lượng nhỏ có thể được bài tiết ở ống thận. Một số nghiên cứu đã so sánh các phương pháp ước tính CrCl khác nhau bằng cách sử dụng giá trị creatinin huyết thanh. Các phương pháp này dựa trên mối tương quan của CrCl với tuổi, trọng lượng cơ thể, creatinin huyết thanh và chuyển hóa creatinin. Sau đây là các phương pháp được sử dụng nhiều nhất:
Phương pháp Jelliffe
Phương pháp Jelliffe ban đầu được sử dụng như một ước tính đơn giản của Cr Cl bằng cách sử dụng creatinine huyết thanh, có thêm phần hiệu chỉnh trong tính toán cho bệnh nhân nữ. Công thức Jelliffe hiện tại có sử dụng thông tin tuổi và chức năng thận, như sau:
CrCl (mL/phút) = (98 - (0.8 × (Tuổi - 20)) (Creatinin huyết thanh tính bằng mg/dL)) x (diện tích bề mặt cơ thể của bệnh nhân/1,73 m2).
(Đối với bệnh nhân nữ, sử dụng 90% lượng CrCl dự đoán).
Phương pháp Cockroft-Gault
Phương trình này bao gồm các yếu tố về trọng lượng cơ thể gầy, đặc biệt quan trọng đối với bệnh nhân béo phì và hiệu chỉnh đối với bệnh nhân nữ (giá trị thu được được nhân với 0,85 đối với phụ nữ). Phương pháp này tương tự như cách tính của Jelliffe và như sau:
CrCl = (140 - Tuổi) × (Trọng lượng cơ thể nạc [tính bằng kg]) (Creatinine huyết thanh) x 72.
Công thức Calvert
Việc sử dụng CrCl cũng được đưa vào công thức có tên là Calvert. Dựa trên dữ liệu tin cậy, có bằng chứng cho thấy có mối tương quan tuyến tính nghịch giữa GFR và AUC của các loại thuốc như carboplatin. Phát hiện này cho thấy rằng, để đạt được AUC mong muốn, không chỉ giảm liều ở bệnh nhân có chức năng thận thấp mà còn có thể dùng liều cao hơn liều tiêu chuẩn cho những bệnh nhân có giá trị thanh thải ở thận cao. Công thức Calvert như sau:
Liều carboplatin (mg) = AUC mục tiêu x (GFR + 25) * |
AUC được lựa chọn phù hợp với từng tình huống lâm sàng: |
|
|
|
*Mức lọc cầu thận (Glomerular filtration rate - GFR) tương đương với độ thanh thái creatinine, có thể đo được hoặc ước lượng theo tuổi bệnh nhân, cân nặng và creatinine huyết thanh. AUC (Area under the curve): Diện tích dưới đường cong
Liều (mg) = AUC mục tiêu × (GFR + 25)
Công thức Calvert ban đầu được rút ra từ GFR được đo bằng phương pháp chromium-51-EDTA (acid ethylenediaminetetraacetic). Mặc dù GFR được tính toán không giống với GFR đo được và CrCl có thể vượt quá GFR từ 10% đến 40%, nhưng phần lớn các bác sĩ chọn cách tính toán thay vì đo GFR bằng cách sử dụng các công thức như công thức Jelliffe hoặc Cockcroft-Gault và sau đó chèn các số vào công thức Calvert.
5 CÁC LOẠI NHÓM THUỐC
5.1 Các tác nhân alkyl hóa
Các tác nhân alkyl hóa ngăn chặn sự phân chia tế bào chủ yếu bằng cách liên kết chéo các sợi DNA. Do tiếp tục tổng hợp các thành phần cấu tạo tế bào khác. chẳng hạn như RNA và protein, sự tăng trưởng không cân bằng và tế bào sẽ chết. Hoạt động của các tác nhân alkyl hóa không phụ thuộc vào quá trình tổng hợp DNA trong tế bào đích. Tuy nhiên, Cyclophosphamide cũng ức chế sự tổng hợp DNA, điều này làm cho nó trở nên khác biệt giữa các tác nhân alkyl hóa về phương thức và phổ hoạt động của nó. Các chất alkyl hóa hiện được sử dụng trong ung thư phụ khoa như sau:
Carboplatin.
Cisplatin.
Oxaliplatin.
Cyclophosphamide.
Ifosfamide.
Altretamine (hexamethylmelamine).
Thuốc chống chuyển hóa
Các chất chống chuyển hóa hoạt động bằng cách ức chế các quá trình trao đổi chất cần thiết để tổng hợp purin, Pyrimidine và acid nucleic. Các tác nhân này thường đặc trưng cho pha S. Các loại thuốc hiện đang được sử dụng trong danh mục này như sau:
5-FU.
Methotrexate.
Capecitabine.
Gemcitabine.
Pemetrexed.
5.2 Kháng sinh kháng u
Thuốc kháng sinh chống khối u thường có nguồn gốc từ các sản phẩm lên men của nhiều loại nấm khác nhau và hầu hết hoạt động thông qua cơ chế thêm vào DNA. Một số loại thuốc kháng sinh gây độc tế bào đã được sử dụng trong hóa trị liệu để điều trị một số loại ung thư nhất định. Những chất được sử dụng trong ung thư phụ khoa như sau:
Dactinomycin (actinomycin D).
Bleomycin.
Doxorubicin và liposomal doxorubicin hydrochloride.
5.3 Dẫn chất từ thực vật
Một số tác nhân hóa trị liệu được phát triển từ thực vật. Vinca alkaloid, epipodophyllotoxin, epothilones và nhóm taxanes có tác dụng làm rối loạn quá trình lắp ráp, tháo rời và ổn định bình thường của các vi ống trong tế bào. Các chất tương tự camptothecin dùng để ức chế topoisomerase I, do đó gây ra đứt gãy DNA đơn sợi. Các chất ức chế topoisomerase II bao gồm etoposide (VP16) và mitoxantrone. Các loại thuốc này như sau:
Ancaloit Vinca:
Vinblastine.
Vincristine.
Vinorelbine.
Các đơn vị phân loại:
Paclitaxel.
Paclitaxel liên kết với protein.
Docetaxel.
Epipodophyllotoxin:
Etoposide.
Các chất tương tự camptothecin:
Topotecan.
Irinotecan.
Epothilone:
Ixabepilone.
5.4 Nội tiết tố
Những tác nhân này thường được sử dụng trong điều trị ung thư nội mạc tử cung ung thư vú và ung thư buồng trứng và được chia thành hai loại lớn: kháng estrogen và các chất có tác dụng giống progesteron. Megestrol acetate có thể vừa điều chỉnh các gen đáp ứng với estrogen vừa làm giảm số lượng các thụ thể estrogen có sẵn trên bề mặt tế bào. Ví dụ về các tác nhân này như sau:
Antiestrogen:
Tamoxifen.
Chất có tác dụng giống progesteron:
Megestrol axetat.
Medroxyprogesterone axetat.
Chất ức chế Aromatase:
Anastrozole.
Letrozole.
Exemestane.
Thuốc | Chỉ định liều và đường dùng | Tác dụng phụ cấp tính | Độc tính | Chú ý trước khi dùng | Chỉ định chính |
Tác nhân alkyl hóa | |||||
Cisplatin (CDDP hoặc Platinol) | 50-100 mg/m2 truyền TM mỗi 3 tuần: 40mg/m2 truyền TM mỗi tuần kết hợp với xạ trị; 75 - 100mg/m2 tiêm trong phúc mạc hòa với 2 L dung môi trên 30 phút mỗi 3 tuần | Buồn nôn và nôn, thường nặng nề | Tổn thương thận, suy tủy nhẹ, nhiễm độc thần kinh; có thể giảm thiểu tổn thương thận mức độ nặng bằng cách không dùng quá 500mg/m2 tổng liều trong một đợt điều trị | Truyền không quả 1mg/phút và chỉ sau khi 10-12 giờ truyền dịch. tránh các kháng thể gây độc cho thận; theo dõi chức năng thận và ngừng nếu BUN quá 30mg/dL hoặc creatinine quá 2mg/dL | Carcinoma buồng trứng, nội mạc tử cung, hoặc cổ tử cung |
Carboplatin (Paraplatin) | 250-400mg/m2 truyền TM liều bolus hoặc truyền liên tục 24 giờ mỗi 2-4 tuần (đa số tác giả khuyến cáo liều ứng với giá trị AUC 5,0-8,0); có thể tiêm trong phúc mạc ở mức AUC 6 mỗi 3 tuần | Buồn nôn và nôn mức độ nhẹ | Suy tủy xương, đặc biệt giảm tiểu cầu | Giảm liều ở bệnh nhân đã hóa trị liệu trước đó | Carcinoma cổ tử cung buồng trứng và nội mạc tử cung |
Cyclophosphamide (Cytoxan) | 50-1500mg/m2 truyền TM đơn liều hoặc 1- 5mg/kg/ngày (thường 50mg/ngày đường uống); giảm liều nếu giảm bạch cầu nặng 50mg uống hàng ngày | Buồn nôn và nôn | Suy tủy xương, rụng tóc, viêm bàng quang | Duy trì đủ dịch vào để tránh viêm bàng quang | Carcinoma cổ tử cung buồng trứng, nội mạc tử cung và vòi tử cung |
Chlorambucil (Leukeran) | 0,1-0,2 mg/kg/ngày đường uống; giảm liều nếu suy tủy xương nặng | Buồn nôn, nôn (khi dùng liều cao) | Suy tủy xương | (Không) | Carcinoma cổ tử cung buồng trứng, nội mới tử cung và với tử cung |
Ifosfamide (Ifex) | 7-10 g/m2 truyền TM trong 3-5 ngày mỗi 3-4 tuần | Buồn nôn, nôn, tiêu chảy, viêm niêm mạc | Suy tủy xương, rụng tóc, viêm bàng quang | Dùng thuốc bảo vệ đường tiểu để dự phòng viêm bàng quang xuất huyết | Carcinoma và sarcoma buồng trứng, cổ tử cung và nội mạc tử cung |
Oxaliplatin | 59-130 mg/m2 truyền TM trong 20 phút truyền trong 2 giờ mỗi 3 tuần | Buồn nôn và nôn | Suy tủy mức độ nhẹ đến vừa, tăng men gan, bệnh lý thần kinh ngoại biên | Không nên dùng ở bệnh nhân suy chức năng gan thận | Carcinoma buồng trứng |
Altretamine (Hexalen) | 4-12 mg/kg/ngày đường uống, dùng chia liều 14- 21 ngày, lặp lại mỗi 6 tuần | Buồn nôn và nôn | Suy tủy xương nhiễm độc thần kinh trung ương và ngoại biên | (Không) | Carcinoma buồng trứng |
Thuốc chống chuyển hoá | |||||
5-Fluorouracil (5-FU) | 12 mg/kg/ngày truyền TM trong 4 ngày 6 mg/kg trong 4 ngày cách nhật hoặc cho đến khi nhiễm độc, lặp lại hàng tháng hoặc truyền TM hàng tuần liều 12- 15 mg/kg; liều tối đa 1g thường được dùng trong phác đồ phối hợp ở dạng 500mg/m truyền TM | Thỉnh thoảng buồn nôn và nôn | Suy tủy xương, tiêu chảy, viêm dạ dày, rụng tóc
| Giảm liều ở bệnh nhân giảm chức năng gan, thận và tủy xương hoặc sau phẫu thuật cắt bỏ tuyến thượng thận | Carcinoma buồng trứng và nội mạc tử cung |
Methotrexate | Choriocarcinoma: 10- 30mg/ngày truyền TM trong 5 ngày. Carcinoma buồng trứng hoặc cổ tử cung: 200-2000 mg/m2 truyền TM đồng thời hoặc xen kẽ với thuốc giải độc ("thuốc giải leucovorin") | (Không) | Suy tủy xương, thiếu máu hồng cầu to, tiêu chảy, viêm dạ dày, nôn ít gặp rụng tóc, thỉnh thoảng xơ gan, viêm nội mô mạch máu, xơ phổi | Kiểm tra chức năng thận đầy đủ và duy trì lượng nước tiểu cho phép | Choriocarcinoma, carcinoma buồng trứng và cổ tử cung |
800-1000mg/m2 truyền TM vào ngày 1, 8, 15 trong mỗi 28 ngày; 800.-1000 mg/m2 truyền TM vào ngày 1, 8 trong mỗi 21 ngày; 900 mg/m2 truyền TM vào ngày 1, 8 trong mỗi 21 ngày cho những bệnh nhân bị sarcoma cơ tử cung | Buồn nôn, nôn mức độ nhẹ, khó chịu (thường nhẹ), sốt từng cơn thoáng qua, nổi ban dát sần | Suy tủy xương | (Không) | Carcinoma tuyến vú và buồng trứng; sarcoma cơ tử cung | |
1500-2000 mg/m2 đường uống hàng ngày với liều chia 2 trong 2 tuần với 1 tuần nghỉ, lặp lại mỗi 3 tuần | Hội chứng bàn tay-bàn chân (Hội chứng palmar- plantar); buồn nôn. nôn, tiêu chảy; đau bụng; táo bón | Suy tủy xương; tăng bilirubin máu | Nên dùng cách nhau 12 giờ, uống với nước sau bữa ăn 30 phút | Carcinoma buồng trứng | |
Kháng sinh kháng u | |||||
Dactinomycin (actinomycin D, Cosmegen) | 15 μg/kg/ngày truyền TM hoặc 0,5 mg/ngày trong 5 ngày | Đau khu trú ở chỗ thâm nhiễm hoại tử da; buồn nôn và nôn sau 2 giờ dùng thuốc thỉnh thoảng chuột rút và tiêu chảy | Suy tủy xương viêm dạ dày, tiêu hảy, hồng ban, bệnh lý gan; tăng sạm da và thỉnh thoảng bong da ở vị trí tia xạ trước đó | Truyền qua tĩnh mạch, chú ý ở những bệnh nhân có bệnh lý gan và biểu hiện suy tủy ; dự phòng chống nôn | Sarcoma cơ vân phổi, choriocarcinoma, u tế bào mầm buồng trứng |
Bleomycin | 10-20 mg/m2 truyền TM hoặc tiêm bắp 1 hoặc 2 lần tuần | Sốt, ớn lạnh, buồn nôn, nôn; ít gặp đau khu trú và viêm tĩnh mạch | Da: tăng sạm da, móng tay khô cứng, viêm loét, phát ban, bong da, rụng tóc; Phổi: viêm phổi biểu hiện khó thở, nghe rale, thâm nhiễm có thể tiến triển đến xơ phổi; Độc tính thường gặp ở những người trên 70 tuổi và tổng liều lớn hơn 400mg nhưng không dự đoán trước được | Theo dõi quá mẫn trong 1 hay 2 liều đầu ở u lympho; thận trọng khi có biểu hiện bệnh lý thận và phổi; bắt đầu điều trị tại bệnh viện; không dùng quá liều với tổng liều là 400mg | Carcinoma tế bào vảy ở da, âm hộ và có tử cung; choriocarcinoma, u tế bào mầm và u mô đệm - dây giới bào |
Doxorubicin (Adriamycin) | 60-100 mg/m2 truyền TM mỗi 3 tuần | Buồn nôn, nôn, sốt, viêm tĩnh mạch khu trú, hoại tử nếu thuốc bị thoát mạch, tiểu đỏ (không phải máu) | Suy tủy xương rụng tóc, độc cơ tim do tích tụ thuốc, viêm dạ dày; teo cơ tim có thể xảy ra, đặc biệt nếu vượt quá tổng liều 400-500 mg/m2 | Truyền qua TM; hạn chế dùng ở bệnh nhân có bệnh lý tim rõ; chú ý bất thường trên ECG và dấu hiệu suy tim | Carcinoma biểu mô tuyến nội mạc tử cung, vòi tử cung, buồng trứng và âm đạo; sarcoma cơ tử cung |
Liposomal doxorubicin hydrochloride (Doxie) | 40-50 mg/m2 truyền TM mỗi 4 tuần | Hội chứng bàn tay - bàn chân (Hội chứng ban đỏ palmar- plantar), buồn nôn, nôn mức độ nhẹ, viêm niêm mạc, viêm dạ dày | Suy tủy mức độ nhẹ, ít gặp bệnh cơ tim nếu dùng liều doxorubicin liều chuẩn | Quá mẫn được ghi nhận ở 7 bệnh nhân | Carcinoma buồng trứng |
Vinca Alkaloids | |||||
Vinblastine (Velban) | 0,10-0,15 mg/kg/tuần truyền TM | Viêm kéo dài nặng nề nếu thuốc thoát mạch; thỉnh thoảng buồn nôn và nôn, đau đầu và dị cảm | Suy tủy xương chủ yếu giảm bạch cầu trung tính; rụng tóc, yếu cơ, thỉnh thoảng có bệnh lý thần kinh ngoại biên mức độ nhẹ, sa sút trí tuệ sau điều trị 2-3 ngày, hiếm khi viêm dạ dày | Tiêm hoặc truyền qua TM với chủ ý dự phòng thoát mạch; giảm liều nếu có bệnh lý gan | Choriocarcinoma |
Vincristine (Oncovin) | 0,4-1,4 mg/m2/tuần truyền TM ở người lớn; 2 mg/m2/tuần ở trẻ em | Viêm khu trú nếu thuốc thoát mạch | Dị cảm da, người yếu, mất phản xạ táo bón; đau bụng. ngực và góc hàm; khàn giọng, bàn chân rủ; sa sút trí tuệ; gây độc tủy xương mức độ nhẹ, thiếu máu và chủ yếu giảm hồng cầu lưới; rụng tóc | Tiêm hoặc truyền qua TM với chủ ý dự phòng thoát mạch; giảm liều nếu có bệnh lý gan; những bệnh nhân có nền bệnh lý thần kinh dễ bị nhiễm độc thần kinh hơn; rụng tóc có thể dự phòng bằng cách sử dụng garo da đầu (scalp tourniquet) 5 phút trong và sau điều trị | Sarcoma tử cung, u tế bào mầm buồng trứng |
Vinorelbine (Navelbine) | 30 mg/m2/tuần truyền TM | Buồn nôn nhẹ, 10% có rụng tóc | Suy tủy xương, bệnh lý thần kinh ngoại biên từ nhẹ đến vừa | Chất kích thích cục bộ, điều chỉnh liều ở bệnh nhân suy chức năng gan | Carcinoma buồng trứng |
Epipodophyllotoxins | |||||
Etoposide (VP-16) | 100 mg/m2 truyền TM ngày 1, 3 và 5; lặp lại trong 4 tuần | Buồn nôn và nôn | Giảm bạch cầu giảm tiểu cầu, rụng tóc, đau đầu, sốt, thỉnh thoảng hạ huyết áp | Giảm liều 25%-50% ở bệnh nhân có nhiễm độc hệ tạo máu | Bệnh nguyên bào nuôi; u tế bào mầm |
Taxanes | |||||
Paclitaxel (Taxol) | 135-175 mg/m2 truyền TM trong 3 giờ mỗi 3 tuần; khi dùng đường tiêm trong phúc mạc kết hợp với platinum, có thể dùng liều 135mg/m2 truyền TM vào ngày 1 và 60mg/m2 tiêm trong phúc mạc vào ngày 8 mỗi 3 tuần; khi dùng trong liệu pháp liều dày đặc, có thể truyền TM 80mg/m/tuần kết hợp với carboplatin AUC 6 vào ngày 1 mỗi 3 tuần | Phản ứng dị ứng, buồn nôn, nôn | Suy tủy xương phản ứng dạng dị ứng mức độ nặng với biểu hiện hồng ban ở mặt, khó thở, nhịp nhanh, nhiễm độc cơ tim gây hạ huyết áp với biểu hiện nhịp chậm rụng tóc, viêm dạ dày, mệt mỏi | Có thể cần theo dài chức năng tim bằng monitoring | Carina buồng trứng, ung thư nội mạc tử cung, ung thư cổ tử cung |
Paclitaxel gắn protein (Abraxane) | 80-200mg/m2 truyền TM trong 30 phút hàng tuần; 175-260mg/m truyền TM trong 30 phút mỗi 3 tuần | Buồn nôn, nôn, tiêu chảy | Suy tủy xương, 1% bị quá mẫn; bất thường trên ECC bệnh lý thần kinh | Điều chỉnh liều ở bệnh nhân có tổn thương gan | Carcinoma buồng trứng |
Docetaxel (Taxotere) | 60-100 mg/m2 truyền TM trong 1 giờ mỗi 3 tuần | Quá mẫn | Suy tủy ; viêm niêm mạc rụng tóc, giữ nước | Yêu cầu dự phòng trước bằng steroids | Carcinoma buồng trứng |
Epothilones (Ixabepilone) | 20 mg/m2 truyền TM theo chu kỳ vào ngày 1, 8,15,28 | Buồn nôn, nôn, tiêu chảy | Suy tủy, bệnh lý thần kinh; mệt mỏi, viêm niêm mạc | Tránh dùng đồng thời với chất ức chế CYP3A4; tránh dùng nước ép trái cây | Carcinoma buồng trứng |
Chất tương tự camptothecin | |||||
Topotecan | 1,5 mg/m2 hàng ngày truyền TM trong 5 ngày; 4mg/m2 vào ngày 1 và ngày 8; lặp lại mỗi 21 ngày | Dát sẩn ngứa ngoài da | Suy tủy xương | Chú ý sốt giảm bạch cầu trung tính | Carcinoma buồng trứng, carcinoma cổ tử cung |
Irinotecan (CPT-11) | 300 mg/m2 truyền TM mỗi 3 tuần, 100 mg/m2 truyền TM hàng tuần trong 4 tuần mỗi 6 tuần | Buồn nôn và nôn, tiêu chảy | Suy tủy xương, rụng tóc, phát ban | (Không) | Carcinoma buồng trứng |
Chất ức chế PARP | |||||
Olaparib (Lynparza) | 400mg đường uống 2 lần/ngày | Đau bụng. chán ăn, buồn nôn, tiêu chảy, mệt mỏi, đau khớp, đau cơ | Thiếu máu, giảm bạch cầu trung tính, giảm tiểu cầu, tăng creatinin | Bào chế dưới dạng viên nén uống, không nhai, không rã thuốc hoặc mở vỏ thuốc; tránh dùng đồng thời với chất ức chế CYP3A | Ung thư buồng trứng (dòng tế bào mầm hoặc gen BRCA đột biến dương tính) |
Các tác nhân chống tăng sinh mạch | |||||
15 mg/kg truyền TM mỗi 3 tuần; 10mg/kg truyền TM mỗi 2 tuần | Đau bụng chảy máu mũi, đổi giọng nói, nôn, táo bón, chán ǎn | Xuất huyết, thủng ruột, chậm lành vết thương, bục vết thương, tăng huyết áp, huyết khối động & tĩnh mạch, protein niệu | Chú ý dùng thuốc ở những bệnh nhân có triệu chứng tắc ruột hoặc nguy cơ thủng ruột; ngừng thuốc ít nhất 28 ngày trước khi phẫu thuật vì nguy cơ chậm liền và bục vết thương | Ung thư buồng trứng ung thư cổ tử cung | |
Nội tiết tố | |||||
Chất có tác dụng giống progesteron Medroxyprogesterone acetate | 400-800 mg/tuần tiêm bắp hoặc đường uống |
|
|
|
|
Hydroxyprogesterone caproate | 1000mg tiêm bắp 2 lần/tuần | (Không) | Thỉnh thoảng bất thường chức năng gan, rụng tóc và phản ứng quá mẫn | Chú ý khi có biểu hiện rối loạn chức năng gan | Carcinoma nội mạc tử cung |
Megestrol acetate (Megace) | 20-80 mg uống 2 lần/ngày | ||||
Kháng estrogen Tamoxifen | 10-20mg uống 2 lần/ngày | Buồn nôn, thường nhẹ | Gây ra bởi hiệu ứng kháng estrogen (ví dụ: bốc hỏa, ngứa âm hộ, thỉnh thoảng ra máu âm đạo) | (Không) | Ung thư vú, có khả năng hữu ích trong carcinoma nội mạc tử cung |
Chất ức chế Aromatase | |||||
Anastrozole (Arimidex) | 1mg uống hàng ngày | Bốc hỏa, suy nhược, viêm khớp, đau khớp, buồn nôn, nôn phát ban | Tăng enzym gan, loãng xương, gãy xương, trầm cảm | Các liệu pháp chứa estrogen và tamoxifen không nên dùng kết hợp với anastrozole | Ung thư vú, carcinoma buồng trứng và nội mạc tử cung |
2,5mg uống hàng ngày | Đau khớp, viêm khớp, bốc hỏa, đổ mồ hôi trộm, mệt mỏi, trầm cảm, đau đầu | Tác động lên hệ xương, gãy xương; nhồi máu cơ tim, tăng cholesterol |
| Ung thư vú, carcinoma buồng trứng và nội mạc tử cung | |
Exemestane (Aromasin) | 25mg uống hàng ngày sau ăn | Bốc hỏa, mất ngủ, mệt mỏi, đau khớp, đau đầu, tăng ra mồ hôi, buồn nôn | Thiếu máu cơ tim cục bộ, tăng huyết áp | Phối hợp thuốc khởi phát CYP3A4 để giảm biểu hiện phơi nhiễm exemestane | Ung thư vú, carcinoma buồng trứng và nội mạc tử cung |
Các loại khác | |||||
Hydroxyurea (Hydrea) | 80 mg/kg uống mỗi 3 ngày hoặc 20-30 mg/kg mỗi ngày | Chán ăn và buồn nôn | Suy tủy xương, thiếu máu hồng cầu to, viêm dạ dày, tiêu chảy, ít gặp rụng tóc | Giảm liều ở những bệnh nhân rối loạn chức năng tủy xương và chức năng thận | Carcinoma cổ tử cung (kết hợp xạ trị) |
5.5 Liệu pháp trúng đích và liệu pháp miễn dịch
Cho đến nay, hóa trị liệu truyền thống chủ yếu tập trung vào việc tiêu diệt các tế bào đang phân chia nhanh chóng. Thật không may, các tế bào bình thường cùng có thể bị ảnh hưởng gây ra độc tính đáng kể. Các liệu pháp trúng đích đã cố gắng tập trung điều trị chống ung thư vào các con đường và cơ chế gây ung thư cụ thể để vừa tăng hiệu quả vừa giảm độc tính so với các hóa trị liệu truyền thống. Các liệu pháp này có thể nhằm mục đích gây ảnh hưởng đến các con đường hình thành mạch, chu kỳ tế bào và quá trình chết theo chương trình trong các tế bào khối u. Có một số phân loại lớn các liệu pháp nhắm trúng đích đang được sử dụng. Các kháng thể đơn dòng nhắm vào các thụ thể trên bề mặt của tế bào khối u. Có vai trò như một phần của liệu pháp chống ung thư, các kháng thể đơn dòng được sử dụng theo hai phương thức. Đầu tiên, việc truyền kháng thể đã cho phép liên kết với các tế bào đích, từ đó kích hoạt các cơ chế tác động bình thường của cơ thể. Thứ hai, các kháng thể đơn dòng đã được liên hợp với một nguyên tử phóng xạ mạnh, chẳng hạn như iốt-131, để hỗ trợ tiêu diệt mục tiêu. Các kháng thể đơn dòng, chẳng hạn như bevacizumab, chống lại yếu tố tăng trưởng nội mô mạch máu (vascular endothelial growth factor - VEGF) để ngăn chặn sự tăng sinh mạch là một trong phương thức phổ biến nhất được sử dụng trong điều trị ung thư phụ khoa.
Các liệu pháp trúng đích khác tập trung vào các thành phần bên trong và chức năng của tế bào ung thư, sử dụng các phân tử nhỏ để phá vỡ chức năng của tế bào, gây ra quá trình chết theo chương trình. Các chất ức chế poly (ADP-ribose) polymerase (PARP) là một nhóm tác nhân trúng đích mới và đã dùng để điều trị ung thư vú và ung thư buồng trứng.
PARP rất quan trọng trong việc sửa chữa các đứt gãy DNA đơn sợi (single- strand DNA breaks - SSB). Việc ức chế PARP cho phép các SSB vẫn tồn tại, dẫn đến các đứt gãy sợi kép (double-strand breaks - DSB) cuối cùng khi quá trình phân nhánh sao chép tiến triển. Bệnh nhân có đột biến ở gen BRCA không có khả năng sửa chữa các DSB này, dẫn đến chết tế bào. Liệu pháp miễn dịch bao gồm vắc xin (có thể là tế bào đuôi gai, protein/peptide, DNA hoặc RNA) và liệu pháp miễn dịch thích nghi. Mặc dù nhiều loại thuốc đang trong quá trình thử nghiệm lâm sàng nhưng hiện không có thuốc nào được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (the US Food and Drug Administration. FDA) chấp thuận ngoại trừ bevacizumab và olaparib - chất ức chế PARP. Một số ví dụ về các loại thuốc, cùng với các mục tiêu đích của chúng, như sau:
Kháng thể đơn dòng:
Oregovomab (CA-125).
Cetuximab (EGFR).
Bevacizumab (VEGF).
Trastuzumab (HER-2/neu).
Các phân tử nhỏ:
Cediranib (VEGFR).
Gefitinib (EGFR).
Erlotinib (EGFR).
Imatinib (Bcr-Abl protein tyrosine kinase, tyrosine kinase thu thể c-kit) Pazopanib (VEGFR, thụ thể yếu tố tăng trưởng có nguồn gốc từ tiểu cầu [platelet- derived growth factor receptor - PDGFR] -a, -ẞ, ckit).
Sorafenib (Raf/Mek/Erk, VEGFR).
Sunitinib (VEGFR, PDGFR-a, -ẞ).
Chất ức chế PARP:
Olaparib.
Rucaparib.
Veliparib.
6 ĐỘC TÍNH CỦA THUỐC
Các tác nhân hóa trị liệu truyền thống không có tác dụng phân biệt: cả mô ác tính và mô bình thường đều bị ảnh hưởng. Mặc dù mục đích của chúng là tiêu diệt nhiều tế bào ung thư hơn tế bào bình thường, nhưng không thể tránh khỏi nhiều tác dụng phụ, đặc biệt là đối với các hệ cơ quan có quần thể tế bào tăng sinh nhanh chóng. Thông thường, cơ chế gây độc tương tự như cơ chế tạo ra tác dụng gây độc tế bào mong muốn. Ngay cả các cơ quan có sự tăng sinh tế bào hạn chế cũng có thể bị tổn thương bởi các tác nhân hóa trị liệu, đặc biệt nếu các tác nhân này được sử dụng ở liều lượng cao. Các tác nhân hóa trị liệu phải được sử dụng ở liều lượng gây ra độc tính ở một mức độ nào đó đối với mô bình thường để có hiệu quả. Tỷ lệ các tác dụng phụ nghiêm trọng của các tác nhân hóa trị liệu bị tác động bởi rất nhiều yếu tố như người bị khuyết tật nặng, tuổi cao, dinh dưỡng kém, hoặc liên quan trực tiếp đến các cơ quan có các tổn thương nguyên phát hoặc di căn. Bác sĩ phải theo dõi những bệnh nhân này một cách cẩn thận và phải điều chỉnh liều lượng thích hợp (Bảng 9).

6.1 Đặc tính hệ tạo máu
Tác động lên hệ tạo máu chủ yếu là độc tính. Giảm bạch cầu hạt cấp tính xảy ra từ 6 đến 12 ngày sau khi sử dụng hầu hết các tác nhân hóa trị liệu ức chế tủy. Quá trình phục hồi diễn ra trong 10-14 ngày. Chuỗi megakaryocyte (tế bào khổng lồ - tiền thân của tế bào tiểu cầu) bị ảnh hưởng muộn hơn, do đó sự ức chế tiểu cầu thường xảy ra 4 hoặc 5 ngày sau khi giảm bạch cầu hạt và hồi phục vài ngày sau số lượng bạch cầu. Hầu hết các bác sĩ lâm sàng coi những bệnh nhân có số lượng bạch cầu hạt tuyệt đối dưới 500/mm trong 5 ngày hoặc lâu hơn có nguy cơ cao bị nhiễm trùng huyết. Sử dụng kháng sinh phổ rộng dự phòng ở bệnh nhân ung thư bạch cầu hạt do sốt đã làm giảm đáng kể tỷ lệ nhiễm trùng đe dọa tính mạng ở nhóm bệnh nhân này. Bệnh nhân giảm bạch cầu hạt nên được kiểm tra nhiệt độ 4 giờ một lần và họ nên được thăm khám thường xuyên để tìm bằng chứng nhiễm trùng Bệnh nhân giảm tiểu cầu với số lượng tiểu cầu dưới 20.000/mm3 có nguy cơ cao bị xuất huyết tự phát, đặc biệt là ở đường tiêu hóa. Truyền tiểu cầu thường quy khi tiểu cầu dưới 10.000-20.000/mm3 đã được một số bác sĩ lâm sàng áp dụng. Một số bác sĩ khác chờ đợi và theo dõi cho đến khi bệnh nhân biểu hiện một số bằng chứng chảy máu. Có thể cần truyền lặp lại tiểu cầu cách nhau 2-3 ngày ở những bệnh nhân bị giảm tiểu cầu nặng. Bệnh nhân loét dạ dày tá tràng tiến triển và bệnh nhân cần phẫu thuật cần được truyền máu với số lượng thấp hơn 50.000/mm3.
Kiểm tra tiểu cầu trước các đợt điều trị (/mm3) | Liều điều chỉnh |
Bạch cầu | |
> 4000 | 100% liều điều trị |
3000-3999 | 100% đối với tác nhân không gây độc tủy xương |
50% đối với tác nhân gây độc tủy xương | |
2000-2999 | 100% đối với tác nhân không gây độc tủy xương |
25% đối với tác nhân gây độc tủy xương | |
1000-1999 | 25% đối với tác nhân gây độc tủy xương |
≤ 999 | Không dùng thuốc |
Tiểu cầu | |
> 100,000 | 100% liều điều trị |
50,000-100,000 | 100% đối với tác nhân không gây độc tủy xương |
< 50,000 | Không dùng thuốc |
6.1.1 Liệu pháp yếu tố tăng trưởng
Liệu pháp kích thích bạch cầu hạt. Việc ứng dụng các yếu tố tạo máu vào điều trị hỗ trợ đem lại hiệu quả đáng kể. Những tiến bộ nhanh chóng trong việc hiểu rõ sinh học phân tử và hóa sinh của các hormon glycoprotein điều hòa quá trình tạo máu này đã dẫn đến việc chúng được sử dụng thường xuyên trên lâm sàng. Kể từ khi xuất hiện vào năm 1989, việc sử dụng chúng đã cho phép cải thiện chứng suy tủy liên quan đến liệu pháp, điều chỉnh suy tủy liên quan đến bệnh và tăng cường khả năng phòng vệ của vật chủ đối với nhiễm trùng. Nhóm tác nhân này bao gồm các phân tử như yếu tố kích thích dòng bạch cầu hạt (granulocyte- colony stimulating factor - G-CSF) và yếu tố kích thích dòng đại thực bào bạch cầu hạt (granulocyte macrophage colony-stimulating factor - GM-CSF). Các hoạt động sinh học của các protein này rất phức tạp và đa chức năng kích thích những thay đổi tiềm tàng trong sự tăng trưởng, biệt hóa, phân bố và trạng thái chức năng của các tế bào trưởng thành cũng như tiền thân của chúng.
Các nghiên cứu ban đầu với G-CSF và GM-CSF chỉ tập trung vào việc sử dụng chúng qua đường tĩnh mạch (intravenous - IV). Kể từ đó, nhiều nghiên cứu được tiến hành và chỉ ra rằng đường tiêm dưới da một hoặc hai lần một ngày thậm chí còn có tác dụng kích thích tủy hơn so với truyền tĩnh mạch từ 2 đến 4 giờ. Liều khuyến cáo của GM-CSF là 250 ug/m2 hoặc 3 đến 5 ug/kg. Trong một số trường hợp, một liều GM-CSF khá thấp có thể kích thích tủy nhiều hơn liều cao. Tăng cường chức năng của bạch cầu trung tính về khả năng kết dính, thực bào và điều hòa hóa chất cũng đã được ghi nhận trong các nghiên cứu lâm sàng và GM-CSF cũng có chức năng hoạt hóa tế bào lympho.
Cytokine | Nguồn | Chức năng | |
Yếu tố kích thích dòng bạch cầu hạt - đại thực bào (GM-CSF) | Tế bào lympho T, tế bào nội mô, tế bào đệm | Kích thích tạo máu dòng bạch cầu hạt và đại thực bào; hoạt hóa bạch cầu hạt và đại thực bào | |
Yếu tố kích thích dòng bạch cầu hạt (G-CSF) | Tế bào nội mô, bạch cầu đơn nhân, tế bào đệm | Kích thích tạo máu dòng bạch cầu hạt; hoạt hóa bạch cầu hạt | |
Erythropoietin | Thận | Kích thích tạo và tăng trưởng dòng hồng cầu | |
Interleukin-1 | Bạch cầu đơn nhân và đại thực bào, tế bào lympho B và T, tế bào nội mô | Phối hợp kích thích tạo máu giai đoạn sớm; hoạt hóa tế bào lympho T và B | |
Interleukin-3 | Tế bào lympho T | Kích thích tạo máu giai đoạn sớm | |
Interleukin-6 | Tế bào lympho T, bạch cầu đơn nhân và đại thực bào, nguyên bào sợi | Phối hợp kích thích tạo máu giai đoạn sớm; Hoạt hóa tế bào lympho T và B |
Có hai loại G-CSF: Filgrastim và Pegfilgrastim tác dụng kéo dài. Liều khuyến cáo của filgrastim là 5 ug/kg, tiêm dưới da. Điều trị nên bắt đầu ít nhất 24 giờ sau khi hoàn thành hóa trị và nên tiếp tục hàng ngày cho đến khi số lượng bạch cầu trung tính tuyệt đối vượt quá 10.000/mm3. Hóa trị liệu tiếp theo không nên bắt đầu cho đến khi đã qua ít nhất 48 giờ kể từ liều cuối cùng. Liều khuyến cáo của pegfilgrastim là 6mg. Nên tiêm dưới da ít nhất 24 giờ sau khi hoàn thành việc truyền hóa chất và không nên tiêm trong vòng 14 ngày kể từ ngày hóa trị liệu tiếp theo.
Đau xương là tác dụng phụ phổ biến nhất của G-CSF. Các tác phụ phụ khác hiếm hơn bao gồm:
Nổi rát và sẩn trên da.
Đợt cấp của bệnh tự miễn dịch tiềm ẩn.
Sốc phản vệ, hiếm gặp.
Tăng nhẹ nguy cơ huyết khối.
Về mặt lý thuyết, có khả năng làm trầm trọng thêm một bệnh ác tính tiềm ẩn. Có thể nói rằng, việc sử dụng G-CSF hoặc GM-CSF làm tăng tốc độ phục hồi bạch cầu trung tính ở một mức độ đáng kể sau khi hóa trị liều tiêu chuẩn. G-CSF được chỉ định để giảm tỷ lệ giảm bạch cầu có sốt với các phác đồ có liên quan đến tần suất giảm tỷ lệ bạch cầu trung tính đáng kể có sốt.
Liệu pháp kích thích tế bào hồng cầu. Sự tồn tại của một loại hormone điều hòa tạo hồng cầu (erythropoiesis - Epo) đã được đề xuất trong 100 năm qua. Năm 1985, hai nhóm nghiên cứu độc lập đã nhân bản gen chịu trách nhiệm về yếu tố tăng trưởng này. Gen này được đánh dấu là gen Epo. Thận được xem là nơi sản xuất chính erythropoietin. Erythropoietin kích thích sự phân chia và biệt hóa của các tiền nhân tạo hồng cầu trong tủy xương. Epoetin alpha là một glycoprotein được sản xuất bằng công nghệ DNA tái tổ hợp có chứa trình tự acid amin chính xác của Epo tự nhiên.
Epoetin có khả năng làm giảm nhu cầu truyền máu ở bệnh nhân thiếu máu và có thể nâng cao chất lượng cuộc sống. Có thể chỉ định khi nồng độ hemoglobin giảm xuống dưới 10mg/dL trong khi điều trị bằng hóa trị liệu hoặc khi có chỉ định truyền máu. Tuy nhiên, tình trạng thiếu Sắt phải được điều chỉnh trước khi bắt đầu dùng epoetin. Epoetin tiêm với liều 150 U/kg tiêm dưới da 3 lần/tuần trong 12 tuần đã được nhiều bác sĩ lâm sàng sử dụng. Có thể tăng liều lên đến 300 U/kg. Một số Bác sĩ sử dụng liều hàng ngày 60 U/kg tăng dần tới liều tối đa 90 U/kg mỗi ngày. Một cách tiếp cận thường được sử dụng khác nữa là tiêm 40.000 U/tuần, với mức tăng lên 60.000U cho người không đáp ứng. Darbepoetin alfa là một dạng tác dụng kéo dài có thể được dùng với liều 3,0 kg/kg mỗi 3 tuần. Các tác dụng ngoại ý ít gặp, gồm làm nặng thêm tình trạng tăng huyết áp ở bệnh nhân suy thận giai đoạn cuối. Các tác dụng phụ khác bao gồm phù nề và tiêu chảy.
Các tác nhân kích thích erythropoiesis phải được sử dụng một cách thận trọng. Năm 2007, FDA đã đưa ra cảnh báo nguy cơ quan trọng liên quan đến việc sử dụng cả epoetin alfa và darbepoetin alfa. Đã có hai thử nghiệm ngẫu nhiên lớn đã báo cáo tỷ lệ kiểm soát khối u và tỷ lệ sống sót kém hơn đáng kể ở những bệnh nhân dùng epoetin. Nghiên cứu cũng chỉ ra rằng, thụ thể erythropoietin được biểu hiện trong một số dòng tế bào ung thư, làm dấy lên lo ngại về khả năng kích thích tăng trưởng tế bào khối u bởi các loại thuốc này. Epoetin cũng có thể gây ra các biến chứng huyết khối tắc mạch, có thể liên quan đến tăng nồng độ hemoglobin. Hiện tại, các bác sĩ muốn sử dụng các tác nhân này cho bệnh thiếu máu liên quan đến hóa trị liệu phải đăng ký với chương trình Chiến lược Giảm thiểu và Đánh giá Rủi ro (the Risk Evaluation and Mitigation Strategy - REMS). Các nhà sản xuất đã triển khai Chương trình Ung thư mang tên Tác nhân Kích thích Erythropoiesis (Erythropoiesis Stimulating Agents - ESA) và Hỗ trợ bệnh nhân ung thư có thông tin về rủi ro để sử dụng an toàn các ESA (Assisting Providers and cancer Patients with Risk Information for the Safe use of ESAs - APPRISE) như một phần của Chương trình REMS được thiết kế cho các nhà cung cấp dịch vụ chăm sóc sức khỏe điều trị bệnh nhân ung thư.
6.1.2 Liệu pháp kích thích tiểu cầu
Oprelvekin được sản xuất từ vi khuẩn Escherichia coli bằng phương pháp tái tổ hợp DNA. Protein này rất giống với interleukin (IL) - 11, là một yếu tố tăng trưởng tạo huyết khối trực tiếp kích thích tăng sinh của tế bào gốc tạo máu và trưởng thành megakaryocyte, do đó làm tăng sản xuất tiểu cầu. IL-11 được sản xuất bởi các tế bào mô đệm của tủy xương và là một phần của họ cytokine. Liêu thông thường là 50 ug/kg, tiêm dưới da 1 lần mỗi ngày bằng một mũi tiêm duy nhất ở bụng, đùi hoặc hông. Điều trị nên bắt đầu từ 6 đến 24 giờ sau khi hoàn thành hóa trị và tiếp tục cho đến khi số lượng tiểu cầu đạt ngưỡng thấp nhất là 50.000 tế bào/pL. Các tác dụng phụ có thể xảy ra bao gồm giữ nước từ nhẹ đến trung bình và IL-11 nên được sử dụng thận trọng cho những bệnh nhân có tiền sử rối loạn nhịp nhĩ, giảm thị lực nhẹ thoáng qua và phát ban thoáng qua tại chỗ tiêm. Đã có trường hợp phản ứng phản vệ được báo cáo.
6.2 Độc tính dạ dày - ruột
Độc tính đường tiêu hóa là một biểu hiện thường xuyên khác của các tác nhân hóa trị liệu. Viêm niêm mạc có thể do tác động trực tiếp lên biểu mô niêm mạc đang phân chia nhanh. Giảm bạch cầu hạt đồng thời cho phép niêm mạc tổn thương bị nhiễm trùng và đóng vai trò như một cánh cổng xâm nhập của vi khuẩn và nấm.
Khởi phát viêm niêm mạc thường sớm hơn suy tủy từ 3 đến 5 ngày. Các tổn thương ở vòm họng rất khó phân biệt với các tổn thương do virus. Nhiễm nấm Candida thường được nhìn thấy và khó phân biệt với viêm miệng thứ phát sau hóa trị; các chất chống nấm đã rất hiệu quả trong việc điều trị tình trạng này. Viêm ruột hoại tử là một tình trạng khác cũng thường gặp ở những bệnh nhân đang hóa trị. Các triệu chứng của tình trạng này là tiêu chảy ra nước hoặc có máu, đau bụng, buồn nôn, nôn mửa và sốt. Bệnh nhân thường bị căng và chướng bụng. Họ cũng có tiền sử sử dụng kháng sinh phổ rộng. Hầu hết viêm ruột hoại tử là do vi khuẩn kỵ khí như Clostridium difficile. Lựa chọn điều trị nhiễm C. difficile là uống kháng sinh Vancomycin, 125mg, 4 lần/ngày trong 10-14 ngày.
Tác dụng phụ thường gặp nhất của hóa trị liệu mà bệnh nhân gặp phải là buồn nôn và nôn. Mặc dù các cơ chế chính xác không được xác định rõ ràng, hầu hết các tác nhân kích thích vùng kích hoạt thụ thể hóa học trong vùng nhận cảm hóa học của não để tiết ra chất dẫn truyền thần kinh như dopamine, serotonin và histamine. Những chất dẫn truyền thần kinh này có thể kích hoạt trung tâm nên lân cận để gây buồn nôn và nôn. Kích thích trực tiếp các thụ thể serotonin trong đường tiêu hóa, hoạt động trực tiếp của não và các tác động tâm lý cũng đóng một vai trò nào đó. Các dạng nên khác nhau bao gồm nôn cấp tính (trong vòng 24 giờ sau khi truyền hóa chất), nôn muộn (thường bắt đầu từ 16-24 giờ sau khi hóa trị nhưng kéo dài đến 72-96 giờ),và nôn sớm. Các phác đồ chống nôn thông thường được trình bày chi tiết trong Bảng 13.11). Việc lựa chọn các tác nhân phải được điều chỉnh bởi thông tin về khả năng gây nôn của các liệu pháp hóa học được sử dụng (Bảng 13.12). Các hóa chất gây nên cao bao gồm cisplatin (> 50mg/m) và cyclophosphamide liều cao (> 1500mg/m3). Cisplatin có thể gây nôn cả cấp tính và nôn muộn. Một phác đồ điều trị nên kết hợp với cả các thuốc chống nôn trước khi truyền hóa chất trị liệu 30 phút.
Các phác đồ phổ biến bao gồm sử dụng chất đối kháng thụ thể 5-HT3 với dexamethasone. Lorazepam và aprepitant uống cũng có thể được sử dụng. Các hỏa chất gây nôn trung bình bao gồm cisplatin liều thấp hơn (< 50mg/m) và cyclophosphamide (750-1500mg/m2) và carboplatin, doxorubicin, methotrexate (> 1000mg/m2), ifosfamide và 5-FU liều cao. Trước khi dùng các tác nhân này có thể chỉ định thuốc đối kháng thụ thể 5-HT3 kết hợp với dexamethasone. Các hóa chất gây dị ứng nhẹ bao gồm methotrexate, paditaxel, docetaxel, liposomal doxorubicin, gemcitabine, bleomycin và etoposide. Trước khi dùng các tác nhân này có thể chỉ định thuốc chống nón đơn chất.
Thuốc | Liều lượng | |
Thuốc chuẩn bị trước | ||
Chất đối kháng 5-HT3 receptor | Ondansetron | 8-24 mg truyền TM hoặc uống |
Granisetron | 10 μg/kg truyền TM; 2mg đường uống | |
Dolasetron | 1,8 mg/kg truyền TM; 100mg truyền TM | |
Palonosetron (tác dụng kéo dài) | 0,25mg truyền TM | |
Chất đối kháng chất P/NK1 receptor | Aprepitant | 125mg đường uống |
Tác nhân vận động | Metoclopramide | 2-3mg/kg truyền TM; 20–40mg đường uống |
Phenothiazine | Prochlorperazine | 10mg truyền TM/tiêm bắp/đường uống 25mg đường trực tràng; 15mg spansule (viên nang chứa nhiều hạt nhỏ) |
Benzodiazepine | Lorazepam | 0,5-2mg truyền TM, đường uống hoặc ngậm dưới lưỡi |
Corticosteroid | Dexamethasone | 8-20 μg truyền TM hoặc đường uống |
Chống nôn cấp | Dexamethasone | 20mg truyền TM |
Ondansetron | 8-24 mg truyền TM | |
Metoclopramide | 3 mg/kg truyền TM (lặp lại mỗi 2 giờ nếu cần) | |
Diphenhydramine | 25-50 mg truyền TM (lặp lại mỗi 2 giờ nếu cần) | |
Lorazepam | 1-2 mg truyền TM | |
Dự phòng nôn muộn | Dexamethasone | 8mg uống 2 lần/ngày trong 2 ngày; sau đó 4mg uống 2 lần/ngày trong 2 ngày |
phối hợp thêm metoclopramide | 40mg uống 4 lần/ngày trong 2-3 ngày | |
hoặc với chẩ đối kháng 5-HT3 | Ondansetron 8mg uống 2 lần/ngày hoặc 3 lần/ngày trong 2-3 ngày hoặc granisetron 1mg uống 2 lần/ngày hoặc 2mg uống 4 lần/ngày trong 2-3 ngày | |
Chất đối kháng 5- HT3 | Uống trong 2-3 ngày hoặc phối hợp uống thêm aprepitant 80mg và dexamethasone 8mg uống 4 lần/ngày trong 3 ngày | |
* Bệnh nhân nên uống 50mg Diphenhydramine khi có triệu chứng đầu tiên của phản ứng loạn trương lực cơ.
Khả năng gây nôn (Tần suất, %) | Tác nhân |
< 10 | Bleomycin |
Hydroxyurea | |
Melphalan (đường uống) | |
Methotrexate (< 50mg/m2) | |
10-30 | Docetaxel |
Doxorubicin (< 20mg/m2) | |
Etoposide | |
Fluorouracil (< 1.000 mg/m2) | |
Gemcitabine | |
Methotrexate (50-250 mg/m2) | |
Paclitaxel | |
Topotecan | |
30-60 | Cyclophosphamide (< 750mg/m2) |
Dactinomycin (<1,5 mg/m2) | |
Doxorubicin (20-60 mg/m2) | |
Ifosfamide | |
Methotrexate (250-1.000 mg/m2) | |
60-90 | Carboplatin |
Cisplatin (< 50 mg/m2) | |
Cyclophosphamide (750-1.500 mg/m2) | |
Dactinomycin (> 1,5 mg/m2) | |
Doxorubicin (> 60 mg/m2) | |
Irinotecan | |
Melphalan (truyền TM) | |
Methotrexate (>1.000 mg/m2) | |
≥ 90 | Cisplatin (> 50 mg/m2) |
Cyclophosphamide (> 1.500 mg/m2) |
Tình trạng nôn muộn cần được xem xét đặc biệt. Có thể dự phòng bằng sử dụng liệu pháp đối kháng thụ thể 5-HT3 đơn chất hoặc một liều ngắn của dexamethasone kết hợp với Metoclopramide, một chất đối kháng thụ thể 5-HT3, hoặc hoạt chất aprepitant, một chất đối kháng P/NK1. Thuốc tác dụng kéo dài như palonosetron, chất đối kháng thụ thể 5-HT3 và fosaprepitant, chất đối kháng P/NK1, hiện đã có sẵn trên thị trường và có thể được tiêm tĩnh mạch vào ngày hóa trị. Những loại thuốc này có tác dụng không thấp hơn so với liệu trình chuẩn 3 ngày đường uống và có thể thuận tiện hơn cho bệnh nhân.
6.3 Phản ứng da
Các phản ứng trên da, bao gồm rụng tóc và phản ứng quá mẫn dị ứng, cũng thường thấy với các tác nhân hóa trị liệu. Hoại tử và bong tróc da tại vị trí thoát mạch qua đường tĩnh mạch có liên quan đặc biệt với các tác nhân như doxorubicin, actinomycin D, mitomycin C, vinblastine, vincristin và mù tạt nitơ. Mức độ hoại tử được xác định bởi lượng thuốc thoát mạch. Xử trí bằng cách tháo đường truyền tĩnh mạch và xử lý vùng thâm nhiễm cục bộ bằng corticosteroid và liệu pháp chườm đá 4 hoặc 5 lần/ngày trong 3 ngày. Theo dõi lâu dài những bệnh nhân này là điều cần thiết. Bệnh rối loạn cảm giác hồng ban Palmar-plantar, còn gọi là hội chứng bàn tay - bàn chân có thể là một độc tính giới hạn liều của doxorubicin liposom và được đặc trưng bởi phù nề và ban đỏ kèm cảm giác đau. Rụng tóc là một tác dụng phụ phổ biến của nhiều tác nhân hóa trị liệu. Nhiều liệu pháp được thiết kế để giảm chứng rụng tóc nhưng không thành công. Tóc mọc trở lại từ 10 đến 20 ngày sau khi điều trị xong.
6.4 Phản ứng quá mẫn
Nhiều tác nhân hóa trị liệu có thể liên quan đến phản ứng quá mẫn, mặc dù chỉ có một số tác nhân gây ra những phản ứng này ở hơn 5% bệnh nhân. Trong số các tác nhân thường được sử dụng trong ung thư phụ khoa, các nhóm taxanes và các hợp chất bạch kim là thủ phạm có khả năng xảy ra nhất, mặc dù các phản ứng không thường xuyên nhưng cũng có thể gặp ở các hóa chất bleomyán, doxorubicin, etoposide, cyclophosphamide, ifosfamide và methotrexate.
Trong các thử nghiệm pha I, tỷ lệ quá mẫn mức độ nặng với paclitaxel là khoảng 30%; tuy nhiên, với điều trị dự phòng đầy đủ, tỷ lệ mắc bệnh hiện chỉ còn dưới 10%. Mặc dù quá mẫn liên quan đến paclitaxel thường được cho là vì công thức của nó có Cremophor EL, một loại đầu thầu dầu polyoxyetyl hóa, nhưng docetaxel cũng có liên quan đến tỷ lệ quá mẫn tương tự mặc dù công thức của nó là Tween 80. Với sự chuẩn bị trước thích hợp, quá mẫn với docetaxel đã giảm xuống 2-3%. Sự hiện diện của phản ứng quá mẫn không làm cản trở việc điều trị thuốc. Nếu việc điều trị thêm diphenhydramine hoặc corticosteroid không cho phép tiếp tục liệu trình sau một thời gian trì hoãn, thì bệnh nhân có thể được giải mẫn cảm hệ thống thành công.
Tỷ lệ quá mẫn với các chất đồng vận bạch kim thay đổi từ 5-20%. Không giống như phản ứng với các nhóm taxanes, thường xảy ra trong vòng vài phút sau khi bắt đầu dùng liều ban đầu, phản ứng với tác nhân platin thường không biểu hiện cho đến khi một số chu kỳ đã được thực hiện. Trung bình 8 liệu trình platin được sử dụng trước khi xảy ra quá mẫn. Điều trị dự phòng quá mẫn thường quy không được khuyến cáo và những bệnh nhân gặp các phản ứng nhẹ có thể đáp ứng tốt với việc bổ sung các thuốc dự phòng thích hợp. Bệnh nhân có phản ứng nặng có thể thử giải mẫn cảm hệ thống nếu có chỉ định, mặc dù không rõ khả năng thành công.
Tác nhân | Phác đồ dự phòng |
Docetaxel | Bắt đầu 1 ngày trước truyền: dexamethasone 8mg uống 2 lần/ngày trong 3 ngày |
Paclitaxel | Đêm trước truyền và sáng ngày lúc truyền: uống dexamethasone 20mg* |
30 phút trước truyền**: diphenhydramine 25-50mg truyền TM phối hợp với kháng H2 truyền TM (Cimetidine 300mg hoặc Ranitidine 50mg) |
* Có thể lặp lại liều uống hoặc đường TM 30 phút trước truyền.
** Nếu dung nạp tốt đợt điều trị đầu tiên thì đợt điều trị tiếp theo có thể dùng đường uống.
6.5 Độc tính gan
Độc tính gan thường không phổ biến. Tăng nhẹ transaminase, phosphatase kiếm và bilirubin được thấy với nhiều tác nhân, nhưng hiếm khi tình trạng nặng nề. Bệnh vảy nến và viêm gan do thuốc có thể ảnh hưởng đến lượng thuốc hóa trị được đưa vào cơ thể, cũng như có thể mắc bệnh gan từ trước hoặc tiếp xúc với các chất độc cho gan khác.
6.6 Độc tính phổi
Viêm phổi kẽ với xơ phổi được thấy với một số tác nhân hóa trị liệu. Các tác nhân có nhiều khả năng gây ra tình trạng này là doxorubicin, chất alkyl hóa và các nitrosourea. Điều trị bệnh nhân bị viêm phổi kẽ do thuốc bao gồm ngừng thuốc gây độc tế bào và chăm sóc hỗ trợ. Steroid có thể có một số lợi ích nhất định.
6.7 Độc tính tim mạch
Nguy cơ độc tính trên tim chủ yếu xảy ra với doxorubicin. Nguy cơ tăng đột ngột khi liều tích lũy vượt quá 500mg/m2 diện tích bề mặt cơ thể lý tưởng. Trong những năm gần đây, giới hạn này hiếm khi bị vượt quá; do đó, bệnh cơ tim đã giảm đi rất nhiều về tỷ lệ mắc bệnh. Rối loạn nhịp tim cấp tính có thể thường được nhìn thấy, nhưng những rối loạn này sẽ biến mất sau một vài ngày chăm sóc hỗ trợ. Trong những trường hợp hiếm, cyclophosphamide đã được báo cáo là gây độc cho tim, đặc biệt là khi nó được sử dụng với liều lượng lớn. Mitomycin C đã được báo cáo là gây ra xơ hóa màng trong tim và xơ hóa cơ tim, nhưng những biến cố này hiếm khi xảy ra.
6.8 Độc tính thận - niệu dục
Độc tính trên thận có thể theo liều, xảy ra đến 35% bệnh nhân dùng cisplatin. Tổn thương ống lượn gần và ống lượn xa dẫn đến thất thoát điện giải và tăng creatinin huyết thanh đồng thời làm giảm Cr Cl. Độc tính trên thận có thể được giảm bớt khi bù đủ nước qua đường tĩnh mạch và lợi tiểu bởi mannitol hoặc Furosemide. Liệu pháp kháng sinh với aminoglycosid làm tăng độc tính trên thận của các thuốc như cisplatin và nên tránh dùng nếu có thể. Các chất chuyển hóa của cyclophosphamide là chất kích thích niêm mạc bàng quang và có thể gây viêm bàng quang xuất huyết mãn tính. Chất chuyển hóa gây độc của cyclophosphamide gây nhiễm độc bàng quang được gọi là acrolein. Cần thiết phải bù nước thật nhiều và lợi tiểu trong khi dùng cyclophosphamide. Cisplatin tạo độc tính trên ống thận liên quan đến tăng ure máu và giảm Magie. Một lần nữa, biến chứng này có thể được giảm thiểu bởi lợi tiểu trong khi dùng cisplatin. Các tác nhân khác được biết là gây độc cho hệ niệu - sinh dục là methotrexate, nitrosoureas và mitomycin C. Mesna hoặc N-acetylcysteine đã được sử dụng trong thời gian gần đây cùng với cydophosphamide để ngăn ngừa nhiễm độc bàng quang. Tác nhân này hoạt động bằng cách làm bất hoạt chất chuyển hóa gây độc acrolein.
Nhiều tác nhân hóa trị liệu có ảnh hưởng lâu dài đến các chức năng của tỉnh hoàn và buồng trứng. Điều này đặc biệt đúng với các tác nhân alkyl hóa, có thể gây ra chứng vô tính và vô kinh. Sự khởi phát của vô kinh và suy buồng trứng đi kèm với sự gia tăng của hormone kích thích nang noãn trong huyết thanh và sự giảm Estradiol trong huyết thanh. Thực tế những bệnh nhân này thường bị mãn kinh sớm. Bệnh nhân bắt đầu điều trị lúc càng trẻ, thì càng ít có khả năng hóa trị liệu gây rối loạn chức năng tuyến sinh dục vĩnh viễn. Ở phụ nữ trên 30 tuổi, hầu hết các phác đồ hóa trị liệu có liên quan đến tỷ lệ suy buồng trứng sớm cao.
6.9 Độc tính thần kinh
Nói chung, hầu hết các loại thuốc chống ung thư đều có liên quan đến các tác dụng phụ thần kinh mức độ nhẹ, tuy nhiên có một số trường hợp ngoại lệ. Các vinca alkaloid thường liên quan đến các bệnh thần kinh tự động và cảm giác vận động ngoại biên. Các tác nhân như vincristine, vinblastine, paclitaxel và vinorelbine có thể gây mất phản xạ gần sâu với dị cảm xa. Paclitaxel cũng có thể gây ra bệnh thần kinh ngoại biên. Trong hầu hết các trường hợp, những độc tính thần kinh này có thể hồi phục sau khi ngừng thuốc. Cisplatin gây ra độc tính trên tai và bệnh thần kinh ngoại biên và đôi khi gây viêm dây thần kinh hậu nhãn cầu. Liều cao cisplatin, thường được sử dụng trong điều trị ung thư buồng trứng, đặc biệt có khả năng gây ra bệnh thần kinh ngoại biên tiến triển và đôi khi xuất hiện muộn. 5-FU có liên quan đến gây nhiễm độc tiểu não cấp tính.
Hexamethylmelamine được báo cáo là gây ra bệnh thần kinh ngoại biên và bệnh não. Ifosfamide cũng có liên quan đến bệnh não, đặc biệt ở những bệnh nhân có nồng độ albumin huyết thanh thấp.
7 ĐÁNH GIÁ ĐÁP ỨNG ĐIỀU TRỊ
Tiêu chí RECIST: Tiêu chí đánh giá đáp ứng trong khối u đặc (The Response Evaluation Criteria in Solid Tumors - RECIST) được sử dụng trong tất cả các thử nghiệm lâm sàng. Các tiêu chí đã được sửa đổi vào năm 2009 và RECIST1.1 được sử dụng trong các thử nghiệm lâm sàng.
Đáp ứng hoàn toàn (Complete response - CR) | Biến mất tất cả các tổn thương đích |
Đáp ứng một phần (Partial response -PR) | Giảm ít nhất 30% tổng đường kính đài nhất (the longest diameter - LD) của các tổn thương đích, lấy làm tham chiếu cho tổng LD cơ bản |
Bệnh tiến triển (Progressive disease - PD) | Tăng ít nhất 20% tổng của các tổn thương đích, lấy tổng LD nhỏ nhất ghi lại được kể từ khi bắt đầu điều trị hoặc xuất hiện một hoặc nhiều tổn thương mới |
Bệnh ổn định (Stable disease - SD) | Không làm giảm bớt đủ đề ứng với điều kiện của PR cũng như chưa tăng đủ mức để đủ điều kiện cho PD, lấy tổng LD nhỏ nhất kể từ khi bắt đầu điều trị |
8 NGHIÊN CỨU, ĐÁNH GIÁ CÁC CHẤT MỚI
Việc phát triển các tác nhân mới, có triển vọng là một quá trình lâu dài, phức tạp và tốn kém. Sau khi xác định các loại thuốc tiềm năng trong mô hình trong ống nghiệm (in vitro) và động vật, tất cả các chất điều trị chống ung thư phải trải qua thử nghiệm lâm sàng nghiêm ngặt. Cần thiết có một vài cấp độ thử nghiệm lâm sàng để chứng minh rằng liệu một tác nhân mới được phát triển có nên được phép sử dụng trong thực hành lâm sàng thưởng quy hay không. Những thử nghiệm như vậy đã được xác định như sau:
Pha I
Các thử nghiệm ban đầu này được thiết kể để thử nghiệm các loại thuốc mới với nhiều liều lượng khác nhau để đánh giá độc tính và xác định khả năng dung nạp với một tác nhân cụ thể. Mục đích chính của các thử nghiệm này là đánh giá độ an toàn. Thiết kế tăng liều thường được sử dụng để xác định liều dung nạp tối đa và đặc trưng cho liều giới hạn gây độc của thuốc. Một số tác dụng điều trị có thể được quan sát, mặc dù mục đích của các thử nghiệm này không phải là đo độ đáp ứng
Pha II
Nghiên cứu ở pha II cố gắng xác định tỷ lệ đáp ứng của tác nhân cụ thể ở liều lượng và liệu trình đã được xác định ở các thử nghiệm ở pha I. Các tiêu chí phụ bao gồm xác định khoảng thời gian không tiến triển, xác định độc tính và thời gian sống còn. Hầu hết các thử nghiệm ở pha II là các nghiên cứu không ngẫu nhiên đơn nhóm.
Pha III
Các thử nghiệm ở pha III được thiết kế để so sánh một loại thuốc được xác định là có triển vọng trong các thử nghiệm ở pha II với các phác đồ điều trị tiêu chuẩn hiện tại. Thông thường, một loại thuốc mới được kiểm chứng dựa trên tiểu chuẩn vàng của liệu pháp thuốc được chấp nhận cho một bệnh và mô học cụ thể. Những thử nghiệm này thường lớn để cung cấp đủ độ mạnh để phát hiện sự khác biệt giữa các nhóm điều trị. Trong khi tiêu chí chính trong các thử nghiệm ở pha III thường là thời gian sống thêm không tiến triển (progression-free survival), thì tiêu chí phụ thưởng bao gồm cả tỷ lệ đáp ứng và tỷ lệ sống thêm toàn bộ (overall survival).
9 TÀI LIỆU THAM KHẢO
1. Bender D, Sill MW, Lankes HA, et al. A phase II evaluation of cediranib in the treatment of recurrent or persistent endometrial cancer: An NRG Oncology/Gynecologic Oncology Group study. Gynecol Oncol. 2015;138:507-512.
2. Chu CS, MD, Rubin SC. Basic Principles of Chemotherapy. In: Clinical Gynecologic Oncology, Philip J. DiSaia, William T. Creasman, Robert S. Mannel, Scott McMeekin, David G, eds. Elsvier. 2018.
3. Fleming GF, Filiaci VL, Marzullo B, et al. Temsirolimus with or without megestrol acetate and tamoxifen for endometrial cancer: A Gynecologic Oncology Group study. Gynecol Oncol. 2014;132:585–592.
4. Friedlander ML, Markman M. Chemotherapy. In: Berek and Hacker's Gynecologic Oncology, Berek JS, Hacker NF, eds. Wolters Kluwer. 2015.
5. Kong A, Johnson N, Kitchener HC, et al. Adjuvant radiotherapy for stage I endometrial cancer: An updated Cochrane systematic review and meta-analysis. J Natl Cancer Inst. 2012;104:1625-1634.
6. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66:7-30.
7. Singh M, Zaino RJ, Filiaci VJ, et al. Relationship of estrogen and Progesterone receptors to clinical outcome in metastatic endometrial carcinoma: A Gynecologic Oncology Group Study. Gynecol Oncol. 2007;106:325-333.
8. Slomovitz BM, Jiang Y, Yates MS, et al. Phase II study of Everolimus and letrozole in patients with recurrent endometrial carcinoma. J Clin Oncol. 2015;33:930-936.

