Giao thức thông khí cơ học hướng đến khả năng huy động và đánh giá tường thuật cho bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính
Bản dịch của Bác sĩ Đặng Thanh Tuấn - Bệnh viện Nhi Đồng 1
Tải PDF bản dịch TẠI ĐÂY
1 Tóm tắt
Mặc dù đã có nhiều tiến bộ trong việc cải thiện kết quả lâm sàng, hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome - ARDS) vẫn là nguyên nhân đáng kể gây suy hô hấp cấp tính. Thông khí cơ học bảo vệ là xương sống của việc chăm sóc hỗ trợ cho những bệnh nhân này; tuy nhiên, vẫn còn nhiều vấn đề chưa được giải quyết trong bối cảnh này. Mục tiêu chính của thông khí cơ học là cải thiện oxygen hóa và thông khí. Việc sử dụng áp lực dương, đặc biệt là áp lực dương cuối thì thở ra (positive end-expiratory pressure - PEEP), là bắt buộc trong phương pháp tiếp cận này. Tuy nhiên, PEEP là con dao hai lưỡi. Cách cài đặt áp lực dương cuối thì thở ra một cách an toàn từ lâu đã là điều khó khăn đối với các bác sĩ lâm sàng. Chúng tôi xin đề xuất một phương pháp dựa trên phép đo đường cong áp lực-thể tích để đánh giá xem phổi bị tổn thương có thể huy động được hay không để thiết lập PEEP phù hợp. Đối với dạng ARDS nghiêm trọng nhất, oxygen hóa màng ngoài cơ thể (extracorporeal membrane oxygenation - ECMO) được coi là liệu pháp cứu cánh. Tuy nhiên, mức độ cao của nguồn lực y tế cần thiết và các biến chứng liên quan khiến việc sử dụng nó ở những bệnh nhân mắc ARDS nghiêm trọng còn gây tranh cãi. Giao thức đề xuất của chúng tôi cũng cố gắng đề xuất cách cải thiện kết quả cho bệnh nhân bằng cách cân bằng giữa việc sử dụng quá mức các nguồn lực có thể xảy ra với việc giảm thiểu tác hại cho bệnh nhân do cài đặt máy thở nguy hiểm. Một giao thức đánh giá theo hướng khả năng huy động có thể ổn định tình trạng thiếu oxy nhanh chóng và sàng lọc những bệnh nhân thực sự nghiêm trọng.
2 Giới thiệu
Hội chứng nguy kịch hô hấp cấp tính (ARDS) lần đầu tiên được Ashbaugh và cộng sự mô tả vào năm 1967 [1]. Hội chứng này được đặc trưng bởi tổn thương viêm ở các tế bào phế nang, tạo thành hàng rào của các túi khí cực nhỏ của phổi. Tăng tính thấm phế nang-mao mạch đối với chất lỏng, protein, bạch cầu trung tính và hồng cầu dẫn đến rối loạn chức năng chất hoạt động bề mặt, kích hoạt hệ thống miễn dịch và rối loạn quá trình đông máu của cơ thể, dẫn đến tình trạng thiếu oxy nghiêm trọng [2]. Trong những thập kỷ qua, trọng tâm của các chiến lược thở máy ở những bệnh nhân mắc ARDS đã tiến triển từ việc duy trì oxygen hóa đầy đủ và loại bỏ carbon dioxide sang ngăn ngừa tổn thương phổi liên quan đến máy thở (ventilator- associated lung injury - VALI) [2, 3]. Những tiến bộ đáng kể bao gồm thể tích khí lưu thông nhỏ [4] và tư thế nằm sấp [5] đã được thực hiện. Tuy nhiên, các vấn đề như chiến lược áp lực dương cuối thì thở ra (PEEP) cao/thấp [6-9], thủ thuật huy động (recruitment maneuver - RM) [8, 10-13], phong bế thần kinh cơ [14, 15], oxygen hóa màng ngoài cơ thể (ECMO) [16, 17], thông khí giải phóng áp lực đường thở (airway pressure release ventilation - APRV) [18, 19], oxit nitric hít vào (inhaled nitric oxide - iNO) [20-22] và thông khí dao động tần số cao [23-25] vẫn tồn tại. Mục tiêu của bài viết này là tích hợp các khái niệm được biết là hiệu quả và có khả năng hiệu quả này để cung cấp cho các bác sĩ lâm sàng các hướng dẫn nhanh và tiết kiệm thời gian cho các cài đặt máy thở ở bệnh nhân ARDS.
3 Nhận biết bệnh nhân mắc ARDS
Bước đầu tiên là nhận biết phổi của bệnh nhân có thể huy động được hay không. Theo nghiên cứu LUNGSAFE [26], có tới 50% bệnh nhân mắc ARDS nhẹ và 20% bệnh nhân mắc ARDS nặng không được phát hiện trong bối cảnh thực tế. Sự cảnh giác về mặt lâm sàng vẫn là điều kiện tiên quyết quan trọng nhất đối với các bác sĩ lâm sàng. Với sự hiểu biết rằng bản thân việc thở máy có thể gây ra và làm tăng tổn thương phổi, việc hạn chế thể tích khí lưu thông [27] và áp lực hít vào [28] ở tất cả các bệnh nhân thở máy là bắt buộc. Khi bệnh nhân không thể được thở máy an toàn [6] và/hoặc không đạt được mục tiêu oxygen hóa an toàn (được định nghĩa là PaO2 55-80 mmHg hoặc SpO2 88- 95%) [4], chúng tôi đặc biệt khuyến nghị đánh giá nhanh chóng khả năng huy động phổi của họ.
4 Chọn PEEP phù hợp
4.1 Xem xét chung
PEEP (5-20 cm H2O) là yếu tố chính của thở máy ở tất cả bệnh nhân mắc ARDS để cải thiện oxygen hóa và duy trì sự huy động phế nang [29]. Thật không may, vẫn chưa có phương pháp lý tưởng nào để xác định mức PEEP tối ưu ở từng bệnh nhân [2]. Một số nghiên cứu đã chỉ ra rằng các chiến lược PEEP cao hơn dẫn đến oxygen hóa cao hơn nhưng không mang lại kết quả lấy bệnh nhân làm trung tâm vượt trội [6-8, 30]. Tuy nhiên, một phân tích tổng hợp [9] về các thử nghiệm này cho thấy mức PEEP cao hơn có thể được ưu tiên ở những bệnh nhân mắc ARDS vừa hoặc nặng. Gattinoni và cộng sự [31] cũng báo cáo rằng tỷ lệ phổi có khả năng huy động được ở những bệnh nhân mắc ARDS rất thay đổi và có liên quan chặt chẽ với đáp ứng với PEEP. Khi PEEP quá thấp, bệnh nhân có nguy cơ bị tổn thương phổi do máy thở do phế nang đóng mở theo chu kỳ, trong khi nếu PEEP quá cao, bệnh nhân có thể bị nguy cơ căng phế nang quá mức. Cách tốt nhất để tránh những tình huống này là đánh giá khả năng huy động phổi của bệnh nhân. Có một số phương pháp hiện có cho mục đích này, mỗi phương pháp đều có ưu điểm và nhược điểm riêng (Bảng 1). Theo quan điểm của bác sĩ lâm sàng, phương pháp thực tế nhất là phương pháp không yêu cầu hoặc yêu cầu tối thiểu thiết bị đặc biệt, tương đối đơn giản và nhanh chóng để thực hiện và mang lại kết quả rõ ràng. PEEP INview [32, 33] hoặc chụp cắt lớp trở kháng điện [34, 35] thường được đề cập trong đánh giá khả năng huy động phổi, nhưng ứng dụng của nó phụ thuộc vào thiết bị cụ thể và tốn thời gian. PEEP hướng dẫn theo áp suất thực quản cũng yêu cầu thiết bị đặc biệt và đào tạo nhân sự và có thể cải thiện oxygen hóa cho bệnh nhân [7, 36] nhưng không cải thiện kết quả của bệnh nhân [36]. Bằng chứng về mục tiêu sinh lý của nó cũng còn đáng ngờ [37]. Bảng PEEP/FiO2, lần đầu tiên được Brower và cộng sự đề xuất. [4], đã được tạo ra để hướng dẫn các bác sĩ lâm sàng [38], nhưng các thử nghiệm ngẫu nhiên về hiệu chỉnh PEEP sử dụng bảng PEEP/FiO2 thấp so với cao đã không chứng minh được tính ưu việt của bất kỳ bảng nào [39]. Điểm yếu của phương pháp này là các thiết lập của nó dựa trên nghiên cứu đồng thuận hơn là bằng chứng sinh lý [6]. Phương pháp tỷ lệ huy động-bơm phồng (recruitment-to- inflation - R/I) [40] được thực hiện bằng cách giải phóng đột ngột PEEP (từ 15 xuống 5 cm H2O) làm tăng thể tích thở ra: sự khác biệt giữa thể tích này và thể tích dự đoán bởi độ giãn nở ở PEEP thấp ước tính thể tích được huy động bởi PEEP. Các giá trị R/I > 0,5 cho thấy khả năng huy động phổi nhiều hơn so với bơm phồng phổi. Tuy nhiên, phương pháp này chỉ có thể cung cấp thông tin hạn chế trong một phạm vi PEEP nhất định và cần một số phép đo nếu cần điều chỉnh chi tiết [41]. Phương pháp này tốn thời gian và liên quan đến các quy trình tương đối cồng kềnh mà không có mục tiêu trực tiếp. Siêu âm phổi (lung ultrasound - LUS) có thể hữu ích để đánh giá hiệu quả của thủ thuật huy động [42] thông qua đánh giá hình thái [43] hoặc hệ thống điểm [44], nhưng những nỗ lực này chỉ giới hạn ở các quan sát lâm sàng và không phải là tiêu chuẩn được chấp nhận rộng rãi.
Bảng 1. Các công cụ đánh giá khả năng huy động phổi.
Phương pháp | Ưu điểm | Nhược điểm |
Bảng PEEP/FiO2 [4,38] | 1. Không yêu cầu thiết bị cụ thể 2. Sự đồng thuận của chuyên gia với nhiều kinh nghiệm | 1. Thiếu bằng chứng sinh lý 2. Nguy cơ quá căng |
PEEP INview [32,33] | 1. Đạt được độ giãn nở tốt nhất 2. Nguy cơ quá căng thấp 3. Yêu cầu an thần tối thiểu | 1. Yêu cầu thiết bị chuyên dụng 2. Thời gian đo dài 3. Cần thiết lập thủ công phạm vi đo |
EIT [34,35] | 1. Đạt được độ giãn nở tối ưu 2. Nguy cơ quá căng tối thiểu 3. Yêu cầu an thần tối thiểu | 1. Yêu cầu thiết bị chuyên dụng 2. Phân tích ngoại tuyến 3. Thời gian đo dài |
Cài đặt PEEP theo áp suất thực quản [7,36] | 1. Sự hiện diện của mục tiêu cụ thể 2. Oxygen hóa tốt hơn | 1. Bằng chứng sinh lý hạn chế 2. Yêu cầu thiết bị cụ thể 3. Yêu cầu đào tạo cá nhân cụ thể |
Phương pháp tỷ lệ huy động/bơm phồng phổi [40,41] | 1. Yêu cầu an thần tối thiểu 2. Cho phép tinh chỉnh cài đặt PEEP thông qua nhiều bước đo | 1. Bằng chứng hạn chế 2. Thời gian đo dài 3. Yêu cầu thiết bị cụ thể 4. Cần thiết lập thủ công phạm vi đo |
Siêu âm phổi [42–44] | 1. Yêu cầu thiết bị tối thiểu 2. Khả năng theo dõi huyết động bổ sung | 1. Bằng chứng hạn chế 2. Nhiệm vụ đòi hỏi nhiều công sức 3. Yêu cầu đào tạo cá nhân cụ thể |
Đường cong P-V [45] | 1. Có thể nhanh chóng đạt được trạng thái ổn định ban đầu 2. Sự hiện diện của mục tiêu cụ thể 3. Cho phép tinh chỉnh nhiều lần trong một phép đo | 1. Yêu cầu thiết bị cụ thể 2. Biến động giữa các quan sát viên và trong cùng một người quan sát 3. Cần đo phụ trợ để tránh quá căng 4. Cần gây mê và liệt cơ |
Do đó, chúng tôi khuyên bạn nên sử dụng đường cong áp suất-thể tích (P-V) của hệ hô hấp bán tĩnh để đánh giá khả năng huy động phổi của bệnh nhân [45], điều này có thể cho phép cá nhân hóa các thiết lập PEEP ban đầu ở những bệnh nhân mắc ARDS.
4.2 Cách thực hiện đường cong PV và chuẩn độ PEEP
Quy trình đo đường cong PV được mô tả ngắn gọn dưới đây (sử dụng máy thở Hamilton ® trong hầu hết các trường hợp (Hamilton Medical AG, Bondaduz, Thụy Sĩ)):
• Bệnh nhân được an thần;
• Sử dụng succinylcholine 1 mg/kg tiêm tĩnh mạch và lặp lại cho đến khi kiểm soát được nhịp thở;
• Luôn bắt đầu từ 0 cm H2O, nhắm tới 35-40 cm H2O;
• Giữ ở vị trí trên cùng trong 5-15 giây rồi thở ra thụ động;
• Tăng áp suất: 3 cm H2O.
Điểm uốn dưới (lower inflection point - LIP) được định nghĩa là áp suất tại giao điểm của hai đường: vùng độ giãn nở thấp ở thể tích phổi thấp và vùng độ giãn nở cao hơn ở thể tích phổi cao hơn trên đường cong PV phổi. LIP chỉ ra áp suất để ngăn ngừa sự tái sụp phế nang vì đây là điểm thay đổi độ giãn nở đáng kể [46]. Sau khi xác định được, mức PEEP nên được bắt đầu ở giá trị LIP + 2 cm H2O kết hợp với thể tích khí lưu thông thấp để cung cấp thể tích phổi và tránh căng quá mức. Được phép hiệu chỉnh PEEP thêm dọc theo nhánh hít vào nếu bác sĩ cho rằng mức PEEP cao hơn có thể có lợi cho bệnh nhân. Trong trường hợp này, Millington và cộng sự [47] đề xuất tính toán áp lực đẩy (driving pressure - DP) ở các mức PEEP khác nhau. Giả sử thể tích khí lưu thông không thay đổi giữa các mức PEEP khác nhau (trong trường hợp này, chế độ thông khí nhắm mục tiêu theo thể tích được ưu tiên để giúp tính toán dễ dàng hơn), thì sự thay đổi trong DP chỉ có thể được giải thích bằng sự thay đổi độ giãn nở. Nếu DP giảm ở mức PEEP cao hơn, thì thử nghiệm PEEP cao hơn có thể được coi là thành công. Nếu DP không thay đổi, thì độ giãn nở tối ưu đã đạt được. Tuy nhiên, việc tăng thêm PEEP vẫn có thể an toàn nếu giới hạn áp lực cao nguyên không bị vi phạm. Nếu DP tăng, thì độ giãn nở đã trở nên tệ hơn, có thể chỉ ra tình trạng quá căng và cần cân nhắc giảm PEEP. So với phương pháp R/I, phép đo đường cong PV đơn lẻ từ áp lực dương cuối thì thở ra bằng không đòi hỏi phải gây mê và thuốc liệt cơ bệnh nhân, thoạt nhìn có vẻ cồng kềnh hơn, nhưng tốc độ đo của nó rất nhanh (thường dưới một phút). Ngoài ra, một phép đo duy nhất có thể cung cấp đủ thông tin để hiệu chỉnh PEEP và không bắt buộc phải gây mê và liệt cơ bệnh nhân. Cần phải đo hai đường cong PV đàn hồi dọc theo thể tích khí lưu thông và bắt đầu từ PEEP cao hơn và thấp hơn. Nó chỉ cung cấp một phạm vi sơ bộ cho thấy PEEP cao hơn có thể huy động nhiều thể tích hơn, nhưng không có cảnh báo về tình trạng quá căng và cần nhiều phép đo ở các mức PEEP khác nhau để thiết lập chi tiết. Hơn nữa, PEEP cao được chọn ban đầu (giả định theo kinh nghiệm) có thể gây ra tình trạng giãn phế nang quá mức ở những phổi ít có khả năng huy động; do đó, phương pháp R/I này không được khuyến khích để đánh giá khả năng huy động vì nó tốn thời gian, có mục tiêu không rõ ràng và có thể gây hại.
4.3 Các phương pháp tiếp cận thay thế
Nếu không thể tính toán đường cong PV, có thể áp dụng bảng PEEP/FiO2 [38], sửa đổi bằng phép đo chỉ số căng thẳng (stress index) [48, 49]. Một cách tiếp cận thay thế trong tình huống này là duy trì nhịp thở tự nhiên ở bệnh nhân để thúc đẩy quá trình huy động phổi và giảm stress/strain toàn cục. APRV biểu thị chế độ máy thở có chu kỳ thời gian giới hạn áp suất [19]. Các lợi ích khả năng của APRV liên quan đến nhịp thở tự nhiên và bao gồm những điều sau: (1) đồng bộ bệnh nhân-máy thở tốt hơn và cải thiện sự thoải mái cho bệnh nhân [18, 19]; (2) cải thiện sự phù hợp thông khí/tưới máu bằng cách thúc đẩy phân phối khí nhiều hơn đến các vùng phổi không phụ thuộc [50]; và (3) khả năng giảm thuốc an thần, giảm đau và chẹn thần kinh cơ [19]. Zhou và cộng sự [18] đã báo cáo rằng việc áp dụng sớm APRV ở những bệnh nhân mắc ARDS đã cải thiện oxygen hóa và độ giãn nở hệ hô hấp, giảm Pplat và giảm thời gian thở máy và nằm ICU. Trong giao thức của chúng tôi, khi tình trạng của bệnh nhân đáp ứng các tiêu chí về mức độ ARDS từ nhẹ đến trung bình, bác sĩ lâm sàng có thể chọn sử dụng APRV trước. Hai phương pháp này (đo đường cong PV và APRV) có thể hoán đổi cho nhau và tùy thuộc vào sở thích của bác sĩ lâm sàng.
4.4 Chiến lược liệt cơ
Haren và cộng sự đã báo cáo rằng thở tự nhiên là phổ biến ở những bệnh nhân mắc ARDS trong 48 giờ đầu tiên thở máy và không liên quan đến kết quả tồi tệ hơn [51]. Tuy nhiên, những bệnh nhân bị tổn thương phổi thường có nhu cầu hô hấp cao do trao đổi khí và suy giảm cơ học hô hấp [52]. Nhu cầu hô hấp cao dẫn đến những nỗ lực hít vào mạnh, có thể đi kèm với các tác động sinh lý (nguy cơ quá căng, pendelluft, atelectrauma và tăng áp lực xuyên thành mạch máu) [52] và suy giảm tương tác giữa bệnh nhân và máy thở [53], dẫn đến bệnh nhân tự gây tổn thương phổi (patient self-inflicted lung injury - P-SILI) [54]. Nếu muốn duy trì thở tự nhiên, những nỗ lực quá mức của bệnh nhân được theo dõi bằng phương pháp Bertoni [55], phương pháp này sử dụng sự dao động trong áp suất đường thở do nỗ lực của cơ hô hấp tạo ra trong quá trình thở máy hỗ trợ khi đường thở bị tắc nghẽn trong thời gian ngắn. Phương pháp này có thể được sử dụng để phát hiện nỗ lực hít vào có khả năng gây tổn thương và stress động của phổi. Mặc dù việc sử dụng thuốc giãn cơ sớm để cải thiện tiên lượng ARDS vẫn còn gây tranh cãi [14, 15], chúng tôi sẽ làm liệt cơ bệnh nhân khi họ được chẩn đoán mắc hội chứng nguy kịch hô hấp cấp tính nghiêm trọng hoặc nhịp thở của bệnh nhân được coi là quá mạnh, gây nguy cơ mắc P-SILI.
5 Nhiều phương thức tích hợp cho tình trạng thiếu oxy nghiêm trọng: Nằm sấp, iNO, RM và ECMO
5.1 Thủ thuật huy động
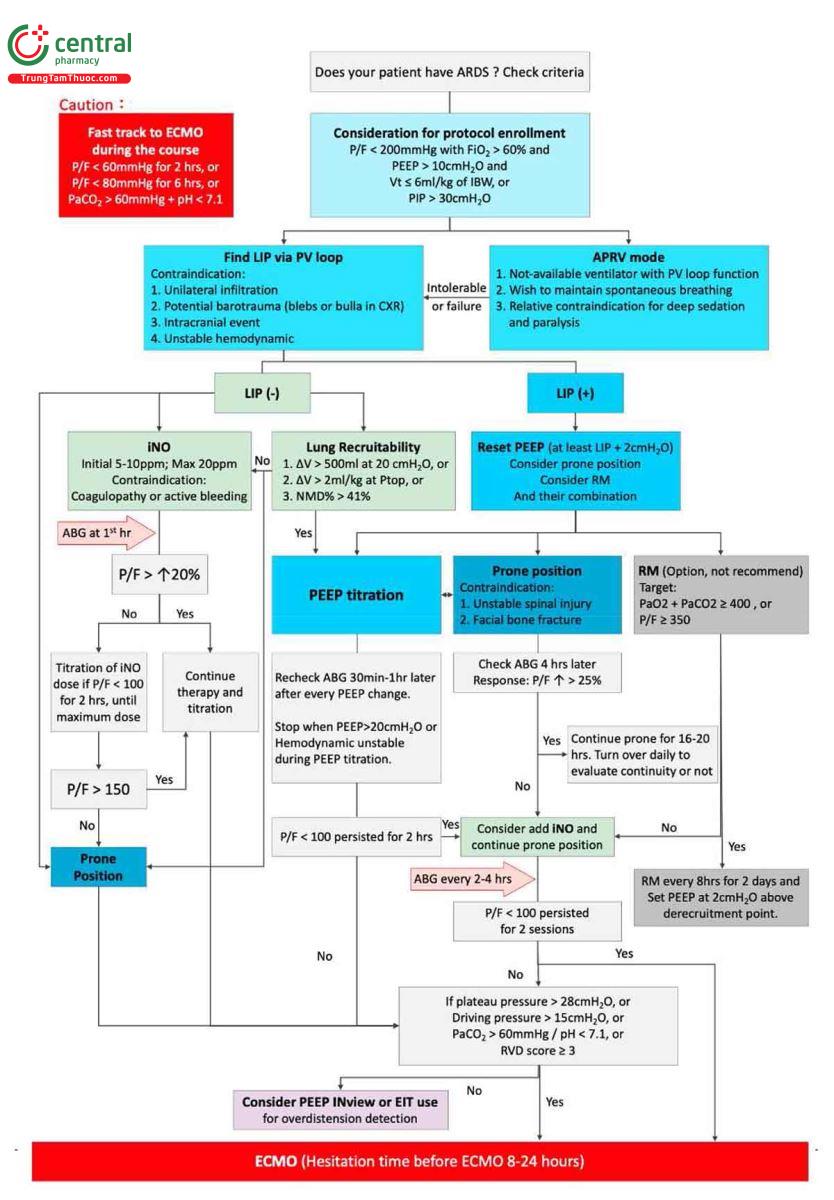
Ở những bệnh nhân được chỉ định đo đường cong PV, nếu có LIP, bệnh nhân được xử trí bằng cách hiệu chỉnh PEEP trước tiên có hoặc không có tư thế nằm sấp (như đã thảo luận trong đoạn sau), ngay cả khi mục tiêu oxygen hóa chưa đạt được. Chúng tôi không thường xuyên thực hiện RM vì thiếu hiệu quả [12], tỷ lệ biến chứng cao hơn [56] và khả năng gây hại [13]. Nếu bác sĩ lâm sàng lựa chọn RM, chúng tôi đề xuất mục tiêu sẽ là PaO2/FiO2 > 350 [57] hoặc chỉ số PaO2 + PaCO2 > 400 [58]. Sau đó, RM sẽ được lặp lại sau mỗi 8 giờ trong 2 ngày và PEEP sẽ được đặt ở mức 2 cm H2O trên điểm mất huy động trên nhánh xẹp xuống của đường cong PV [8] sau mỗi RM.
5.2 Chuẩn độ PEEP tỉ mỉ
Nếu không phát hiện được LIP, có thể thử tư thế nằm sấp và dùng thuốc giãn mạch hít vào (chủ yếu là iNO) trước khi cân nhắc ECMO. Tuy nhiên, việc không có LIP có thể không cho thấy khả năng huy động phổi không đủ vì huy động phổi là hiện tượng phụ thuộc vào thời gian không thể mô tả bằng một đường cong PV duy nhất [59]. Trong tình huống này, chúng tôi xem xét liệu (a) có sự gia tăng thể tích 2 mL/kg trọng lượng cơ thể lý tưởng (hoặc >200 mL) vào cuối giai đoạn giữ áp suất trong quá trình đo đường cong PV [45]; hoặc (b) hình dạng của nhánh hít vào của đường cong PV là lồi và/hoặc chênh lệch thể tích giữa đường cong bơm phồng và xả hơi ở 20 cm H2O là >500 mL [45]; hoặc (c) khoảng cách tối đa chuẩn hóa % là > 41%. Khoảng cách tối đa chuẩn hóa % biểu thị thể tích delta tối đa giữa nhánh bơm phồng và xả hơi của đường cong PV chia cho thể tích tối đa của phép đo đường cong PV [60]. Nếu đường cong PV của bệnh nhân không có LIP nhưng có bất kỳ yếu tố nào trong ba yếu tố này, thì vẫn có thể thực hiện hiệu chỉnh PEEP thận trọng như đã mô tả trước đây [47].
5.3 iNO
Ở những bệnh nhân được coi là có khả năng huy động kém hoặc hiệu chỉnh PEEP không mang lại kết quả khả quan hoặc đạt đến giới hạn áp suất an toàn trên [6], chúng tôi khuyên bạn nên sử dụng iNO, tư thế nằm sấp hoặc kết hợp cả hai. Mặc dù iNO chưa được chứng minh là làm giảm tỷ lệ tử vong ở những bệnh nhân mắc ARDS trong các nghiên cứu trước đây [20, 21], nhưng có thể cải thiện tạm thời tình trạng oxygen hóa [22], điều này có thể cho phép các vấn đề cơ bản có thời gian đáp ứng với các phương pháp điều trị hoặc can thiệp cứu hộ chắc chắn [61, 62]. Chúng tôi đặc biệt khuyên bạn nên sử dụng iNO nếu có sẵn và không có chống chỉ định [63] trong tình huống này.
5.4 Nằm sấp
Trong hầu hết các trường hợp, bệnh nhân cần nằm sấp. Tư thế nằm sấp (proning position - PP) đã được sử dụng từ những năm 1970 để điều trị tình trạng thiếu oxy nghiêm trọng ở những bệnh nhân mắc ARDS, nhưng hiệu quả của nó trong việc giảm tỷ lệ tử vong chỉ được xác nhận với việc công bố thử nghiệm PROSEVA mang tính bước ngoặt [5]. Mặc dù một số tác giả [64-66] cho rằng việc huy động phổi do PP gây ra là một cơ chế quan trọng trong việc cải thiện oxygen hóa, nhưng đây không phải là cơ chế duy nhất [67, 68].
Pelosi và cộng sự [69] thậm chí còn phát hiện ra rằng tình trạng oxygen hóa được cải thiện sau PP thường xảy ra mà không có sự cải thiện tương ứng về độ giãn nở của hệ hô hấp và sự có hoặc không có LIP có thể dự đoán đáp ứng PP. Xem xét tư thế nằm sấp không phải là không có nguy cơ [70, 71] và việc lật bệnh nhân đòi hỏi nỗ lực phối hợp của nhóm, chúng tôi khuyến nghị nên áp dụng tư thế nằm sấp cho những bệnh nhân mắc ARDS thiếu oxy kháng trị, nhưng tốt hơn là nên bắt đầu sau khi đánh giá khả năng huy động. Thời lượng tối ưu của mỗi buổi PP vẫn chưa chắc chắn, nhưng việc giữ PP trong > 16 giờ/ngày [5] được sử dụng ở hầu hết các viện. Chúng tôi tuân theo cùng một chính sách và thường giữ bệnh nhân trong PP cho đến sáng hôm sau. Chúng tôi lật họ lại để đánh giá xem họ có nên tiếp tục nằm sấp và thực hiện các xét nghiệm và điều trị cần thiết khác hay không. Trong đại dịch COVID-19, một số trung tâm đã báo cáo độc lập về việc kéo dài tư thế nằm sấp quá 24 giờ [72, 73]. Hầu hết báo cáo duy trì tư thế nằm sấp cho đến khi đạt được cải thiện lâm sàng đáng kể. Có hai cân nhắc chính khi kéo dài thời gian nằm sấp: một là thiếu nguồn nhân lực và hai là tác dụng lâm sàng. Douglas và cộng sự [74] duy trì các buổi PP ở những bệnh nhân mắc ARDS liên quan đến COVID-19 cho đến khi đạt được các tiêu chí sau: Tỷ lệ P/F > 150 với FiO2 > 60% và mức PEEP < 10 cm H2O. Giao thức này dẫn đến các buổi có thời gian trung bình là 2,95 ngày đối với những người sống sót và 3,3 ngày đối với những người tử vong. Xem xét rằng có một số biến chứng liên quan đến PP có thể tăng theo thời gian, như loét do tì đè, trào ngược và liệt đám rối thần kinh cánh tay [72], chúng tôi tin rằng bằng chứng hiện tại là không đủ để hỗ trợ việc sử dụng thường quy PP kéo dài cho những bệnh nhân mắc ARDS nặng.
5.5 ECMO
Vì những bệnh nhân mắc các dạng ARDS nghiêm trọng nhất có tỷ lệ tử vong vượt quá 50% mặc dù đã được chăm sóc hỗ trợ tối ưu [75], ECMO thường được coi là phương sách cuối cùng. Sau khi các thử nghiệm CESAR [16] và EOLIA [17] được công bố, việc áp dụng sớm ECMO cho những bệnh nhân mắc ARDS nghiêm trọng đã trở thành chủ đề nóng trong giới chuyên gia. Chúng tôi thừa nhận rằng một số bệnh nhân không phù hợp để điều chỉnh từng bước và cần can thiệp cứu hộ kịp thời. Ngoài ra, ngay cả khi bệnh nhân được thở máy đầy đủ, cài đặt máy thở vẫn có thể gây ra tổn thương; do đó, bệnh nhân vẫn không thể sống sót sau ARDS. Trong trường hợp này, sử dụng ECMO để phổi nghỉ ngơi có thể cải thiện khả năng sống sót của bệnh nhân. Vì sự chuyển đổi muộn có thể vô ích [17, 75], quyết định bắt đầu ECMO nên được đánh giá sớm. Đánh giá điểm RESP và PRESERVE [76, 77] có thể giúp các bác sĩ lâm sàng đánh giá xem có nên tiếp tục phương pháp điều trị hiện tại, chuyển sang chăm sóc giảm nhẹ hay cân nhắc đặt bệnh nhân vào ECMO. Việc có nên thử nghiệm nằm sấp trước khi bắt đầu ECMO hay không tùy thuộc vào đánh giá của bác sĩ lâm sàng [78]. Trong giao thức của chúng tôi, chúng tôi thực hiện phân tích khí động mạch và theo dõi cơ học hô hấp cứ sau 2 đến 4 giờ để xác định xem liệu việc thở máy của bệnh nhân có đáp ứng mục tiêu oxygen hóa và vẫn nằm trong giới hạn áp suất sinh lý an toàn hay không. Tất cả các quy trình quản lý có thể được hoàn thành trong vòng 8-24 giờ trước khi chúng được coi là không hiệu quả hoặc có hại. Đối với những bệnh nhân bị thiếu oxy nghiêm trọng (tỷ lệ P/F < 60 mg > 2 giờ hoặc P/F < 80 mmHg trong 6 giờ hoặc PaCO2 > 60 mmHg cộng với pH < 7,1) [17], được phép chuyển nhanh sang hỗ trợ ECMO theo yêu cầu của bác sĩ phụ trách. Ở những bệnh nhân có thể duy trì đủ oxy bằng các phương pháp truyền thống nhưng không đủ thông khí (PaCO2 > 60 mmHg cộng với pH < 7,1), ECMO (hoặc ECCO2R) cũng là một lựa chọn cho thở máy thể tích khí lưu thông thấp cực kỳ bảo vệ [79, 80, 81].
6 Kiểm tra an toàn cơ học phổi
Nếu bệnh nhân ổn định ở bất kỳ giai đoạn nào của phác đồ (trước khi áp dụng ECMO), việc bảo vệ tâm thất phải được xem xét để tránh tình trạng tâm phế mạn tính [82]. Áp suất đường thở thay đổi do thực tế là PEEP gây ra một loạt các thay đổi về kích thước tâm thất phải và tuần hoàn phổi có thể dẫn đến suy giảm huyết động tim phải. Chúng tôi cố gắng giảm thiểu stress phổi bằng cách giới hạn áp lực cao nguyên ở mức <25-28 cm H2O và áp lực đẩy ở mức <15 cm H2O [83]. Ngoài ra, nồng độ carbon dioxide trong động mạch được duy trì nghiêm ngặt ở mức <60 mmHg. Tư thế nằm sấp cũng được xem xét cho mục đích này (nếu chưa áp dụng). Khả năng căng quá mức cũng được đánh giá thông qua PEEP INview [32] hoặc chụp cắt lớp trở kháng điện [34] nếu bệnh nhân có thể được thở máy an toàn với FiO2 <60% ở giá trị PEEP> LIP + 2.
Khi vượt quá giới hạn áp suất (áp suất đỉnh/áp suất đẩy) [4, 84] và/hoặc điểm rối loạn chức năng thất phải (right ventricular dysfunction - RVD) [83] ≥3 mặc dù đạt được đủ oxy và thông khí thông qua các thiết lập máy thở cơ học thông thường, ECMO sẽ được xem xét để giảm thiểu VALI [2, 3, 79, 81]. Tóm tắt về giao thức đề xuất của chúng tôi được thể hiện trong Hình 1.
7 Kết luận
Tóm lại, giao thức đề xuất của chúng tôi cung cấp một phương pháp tiếp cận có cấu trúc, kịp thời và tiết kiệm tài nguyên cho những bệnh nhân bị suy hô hấp thiếu oxy nặng. Khái niệm về giao thức dựa trên việc phổi của bệnh nhân có khả năng được huy động hay không. Áp lực dương cuối thì thở ra (PEEP) tối ưu trong thở máy cho những bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (ARDS) vẫn còn gây tranh cãi. Khái niệm “Phổi trẻ em” [85] đã thuyết phục nhiều bác sĩ lâm sàng rằng nên hạn chế áp dụng áp lực dương để tránh tổn thương phổi liên quan đến máy thở (VALI). Nghiên cứu được tiến hành vào đầu những năm 2000 đã chứng minh rằng việc sử dụng thể tích khí lưu thông thấp [4] có thể cải thiện tiên lượng của những bệnh nhân mắc ARDS và tăng số ngày không thở máy, ủng hộ phương pháp tiếp cận này. Tuy nhiên, một số chuyên gia cho rằng việc sử dụng áp lực thích hợp hoặc cao hơn bình thường để thở máy, một chiến lược được gọi là thủ thuật huy động (RM), có thể phục hồi thể tích phổi ở những bệnh nhân mắc ARDS [8, 10, 11]. Những chiến lược khác biệt này vừa có lợi ích vừa có thách thức. Khi cố gắng áp dụng phương pháp tiếp cận tiêu chuẩn bằng cách hạn chế áp dụng áp lực dương, các bác sĩ lâm sàng thường gặp phải những tình huống mà họ không thể thông khí đầy đủ cho bệnh nhân, đòi hỏi các biện pháp thay thế như cho bệnh nhân hít oxit nitric, nằm sấp, thở máy dao động tần số cao hoặc oxygen hóa màng ngoài cơ thể (ECMO). Các kỹ thuật bổ sung này sử dụng nhiều thiết bị và nguồn nhân lực, và không phải tất cả các bệnh viện đều có đủ khả năng. Ngược lại, khi áp dụng RM, mặc dù dung tích phổi và oxygen hóa của một số bệnh nhân tạm thời cải thiện, nhưng những bệnh nhân khác có thể gặp các biến chứng liên quan đến RM, bao gồm cả tử vong [13]. Ngay cả khi oxygen hóa được cải thiện, những bệnh nhân được RM có thể không cải thiện được khả năng sống sót. Áp lực dương tối ưu có thể nằm giữa các cực trị. Lý do cho những kết quả khác nhau này là ARDS là chẩn đoán lâm sàng. Liệu oxygen hóa của những bệnh nhân có biểu hiện tương tự có thể được cải thiện thông qua áp lực dương hay không vẫn chưa dễ dàng đánh giá được. Vẫn chưa có sự đồng thuận về hiệu quả của các chiến lược PEEP cao so với thấp [6, 9]. Cách tiếp cận hiệu quả nhất để giải quyết tranh cãi này là xác định xem phổi của bệnh nhân có thể huy động được hay không. Chúng tôi chọn đường cong PV [45] nhưng không chọn PEEP INview [32], hướng dẫn bằng áp suất thực quản [7], phương pháp tỷ lệ R/I [40] hoặc chụp cắt lớp trở kháng điện [34] cho đánh giá ban đầu vì phương pháp trước dễ thực hiện hơn và cung cấp kết quả nhanh chóng. Tuy nhiên, có một số lo ngại khi giải thích đường cong PV. Đầu tiên, không có phương pháp chuẩn nào để thu thập đường cong PV [86, 87]. Thứ hai, sự thay đổi đáng kể giữa các quan sát viên và trong cùng một người quan sát trong việc xác định LIP trong các đường cong PV thu được từ những bệnh nhân mắc ARDS đã được ghi nhận, với sự khác biệt tối đa lên tới 11 cm H2O giữa những người quan sát đối với đường cong của cùng một bệnh nhân [88, 89]. Trong một phổi được huy động đồng đều, LIP phải được xác định rõ và sắc nét [90]; tuy nhiên, trong việc huy động phổi không đồng đều, các phế nang được huy động trên một phạm vi áp suất rộng hơn, dẫn đến LIP không có hoặc không rõ ràng [91]. Để khắc phục hạn chế này, chúng tôi sử dụng các phương pháp khác để nghiên cứu khả năng huy động [45, 47, 60]. Ngoài ra, còn thiếu dữ liệu cho thấy lợi ích về bệnh tật và tử vong khi sử dụng các đường cong PV [92]. Cài đặt máy thở định hướng khả năng huy động của chúng tôi không nhằm mục đích tối ưu hóa thông khí mà là giảm thiểu VALI. Cơ sở của giao thức này là cung cấp đủ oxy mà không gây căng thẳng hoặc mệt mỏi quá mức. Sau khi công bố kết quả của các thử nghiệm CESAR [16] và EOLIA [17], việc áp dụng sớm ECMO cho những bệnh nhân mắc ARDS nặng đã trở thành chủ đề tranh luận gay gắt. Chúng tôi thừa nhận rằng một số bệnh nhân không phù hợp để điều chỉnh gia tăng nhưng cần can thiệp cứu hộ ngay lập tức. Chúng tôi cũng nhận ra rằng ngay cả khi bệnh nhân có thể được thông khí đầy đủ, cài đặt máy thở vẫn có thể gây hại, dẫn đến tử vong. Trong những trường hợp như vậy, sử dụng ECMO để phổi nghỉ ngơi có thể tăng khả năng sống sót của bệnh nhân. Tóm lại, giao thức đề xuất của chúng tôi cung cấp một chiến lược cá nhân hóa cho những bệnh nhân mắc ARDS giúp giảm thiểu một số nhược điểm của các phương pháp tiếp cận khác.