Giải phẫu và sinh lý động mạch vành ứng dụng trong can thiệp
Nguồn: Sách Tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn: ThS.BSNT. Nguyễn Đức Nhương, TS.BSNT. Đinh Huỳnh Linh, ThS.BSNT. Nguyễn Văn Hiếu, ThS.BSNT. Trần Sơn Hải, ThS.BSNT. Nguyễn Việt Dũng
Bác sĩ tim mạch can thiệp cần hiểu biết tường tận về giải phẫu, cấu trúc và điều hòa tuần hoàn vành trong các điều kiện sinh lý bình thường và bất thường. Những kiến thức này sẽ giúp các bác sĩ thuận lợi trong quá trình chụp và đọc phim chụp mạch vành, cũng như có thể lựa chọn dụng cụ can thiệp phù hợp, đặc biệt là trong một số trường hợp giải phẫu động mạch vành hiếm gặp.
1 Giải phẫu động mạch vành
1.1 Giải phẫu mạch vành bình thường
Hệ thống động mạch vành (ĐMV) có thể được chia thành các mạch lớn (động mạch ở thượng tâm mạc), các tiểu động mạch (arterioles), và vi mạch. Các tiểu động mạch có kích thước nhỏ hơn 200 μm và khó nhìn thấy được bằng chụp ĐMV thường quy. Những tiểu động mạch này cung cấp một mạng lưới mao mạch phong phú mang máu giàu oxy cho cơ tim. Tiểu động mạch cũng điều chỉnh áp lực và lưu lượng mạch vành thông qua khả năng giãn và co mạch để đáp ứng với nhiều kích thích. Hệ vi mạch có vai trò quan trọng trong việc quyết định kết cục lâm sàng của bệnh nhân trong các trường hợp cấp tính, ví dụ như nhồi máu cơ tim, cũng như các trường hợp hội chứng mạch vành mạn tính.
1.1.1 Động mạch vành trái
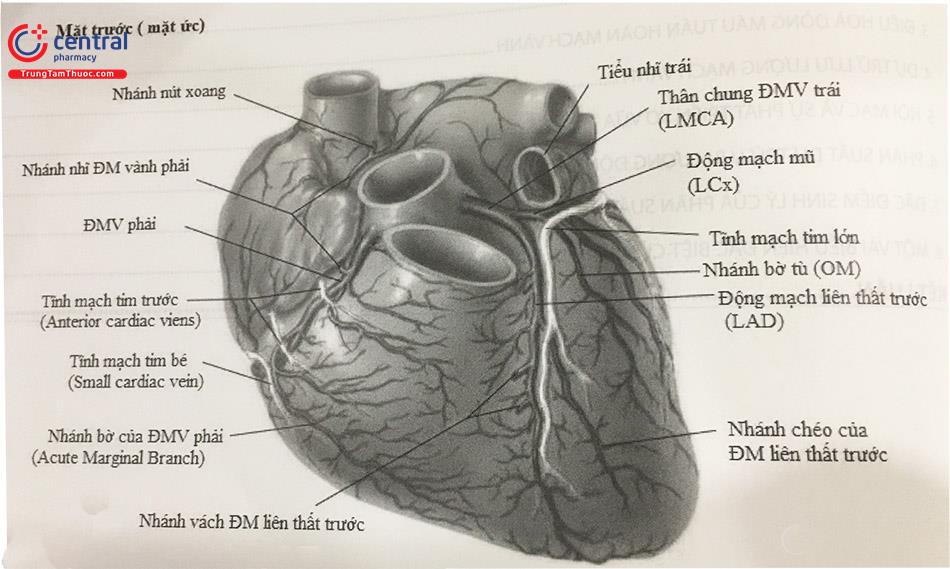
ĐMV trái xuất phát từ xoang vành trái. Lỗ vào ĐMV nằm cao hơn trung điểm giữa vị trí nối xoang-ống (sinotubular junction) và vòng van động mạch chủ. Sau khi gập góc sớm, ĐMV trái tiếp tục đi song song với thành xoang động mạch chủ, chạy giữa động mạch phổi và tâm nhĩ trái tại vùng tiểu nhĩ trái.
1.1.2 a. Thân chung ĐMV trái
Đoạn đầu của ĐMV trái gọi là thân chung ĐMV trái (Left Main Coronary Artery, viết tắt là LMCA), trước khi tách ra các nhánh chia. Trong đa số các trường hợp, LMCA kết thúc bằng cách chia đôi thành động mạch liên thất trước (Left Anterior Descending hay Anterior Interventricular, viết tắt là LAD) và động mạch mũ (Left Circumflex, viết tắt là LCx). Một số ít trường hợp, LMCA chia thành ba nhánh: LAD, LCx, và nhánh phân giác (nhánh Ramus, hay gọi là nhánh Intermediate). Chiều dài của LMCA dao động trong khoảng từ 0 mm (LAD, LCx xuất phát từ các lỗ riêng biệt) đến 20 mm. Chiều dài trung bình là 6 đến 15 mm, với đường kính trung bình từ 3 đến 6 mm. Đường đi của nhánh phân giác tương tự như đường đi của nhánh chéo đầu tiên tách ra từ LAD hoặc nhánh bờ đầu tiên tách ra từ LCx.
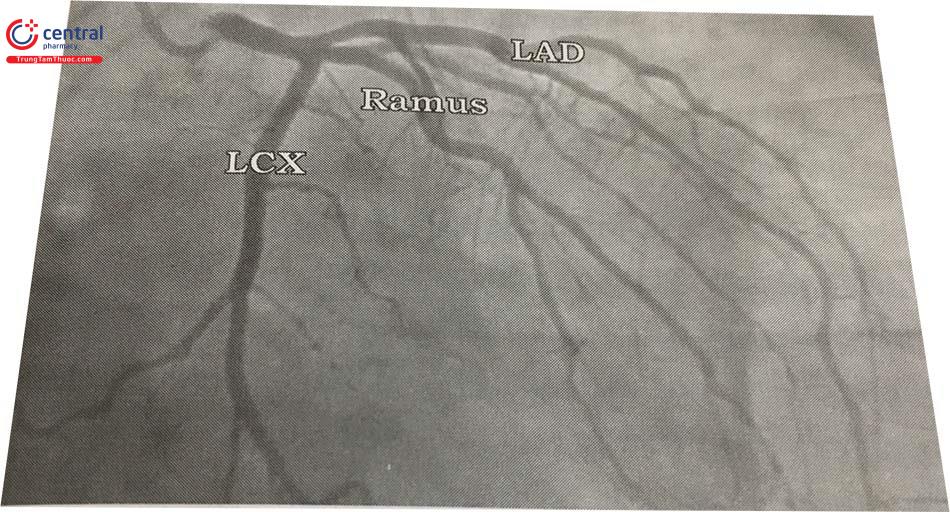
b. Động mạch liên thất trước
Động mạch liên thất trước (LAD) chạy dọc theo rãnh liên thất trước và vòng qua quanh mỏm tim. Sau khi vòng qua mỏm tim, LAD chạy dọc theo rãnh liên thất sau, có thể tiếp nối với nhánh liên thất sau của ĐMV phải. Một biến đổi giải phẫu thường gặp là LAD kết thúc trước khi tới mỏm tim. Trong trường hợp này, một nhánh động mạch chéo lớn hoặc ít gặp hơn là một động mạch liên thất sau lớn tách ra từ ĐMV phải (RCA) sẽ tưới máu bổ sung cho thất trái.
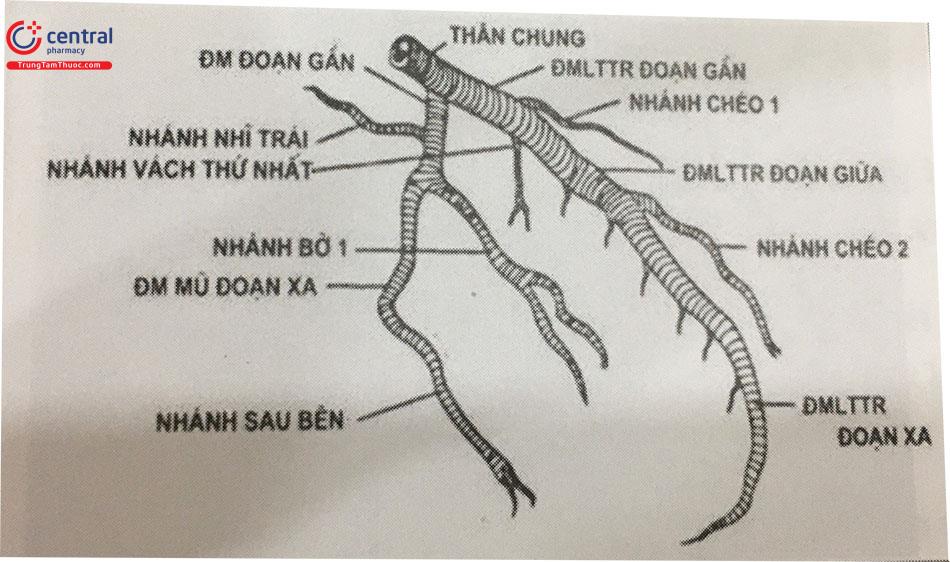
LAD có hai hệ thống nhánh bên:
- Các nhánh vách (nhánh septal) xuyên vào vách liên thất, cấp máu cho 2/3 trước và phần dưới mỏm của vách liên thất.
- Các nhánh chéo (nhánh diagonal) chạy dọc thành tự do trước bên của thất trái theo một hình chéo, vì thế có tên nhánh chéo. Thường có hai nhánh chéo lớn của LAD và nhiều nhánh chéo nhỏ hơn. Các nhánh chéo cấp máu cho thành bên của
Dọc đường đi, LAD có thể tách ra một số nhánh bên nhỏ cấp máu cho tâm thất, hình thành một mạng tiếp nối với các nhánh tương tự xuất phát từ đoạn gần của RCA.
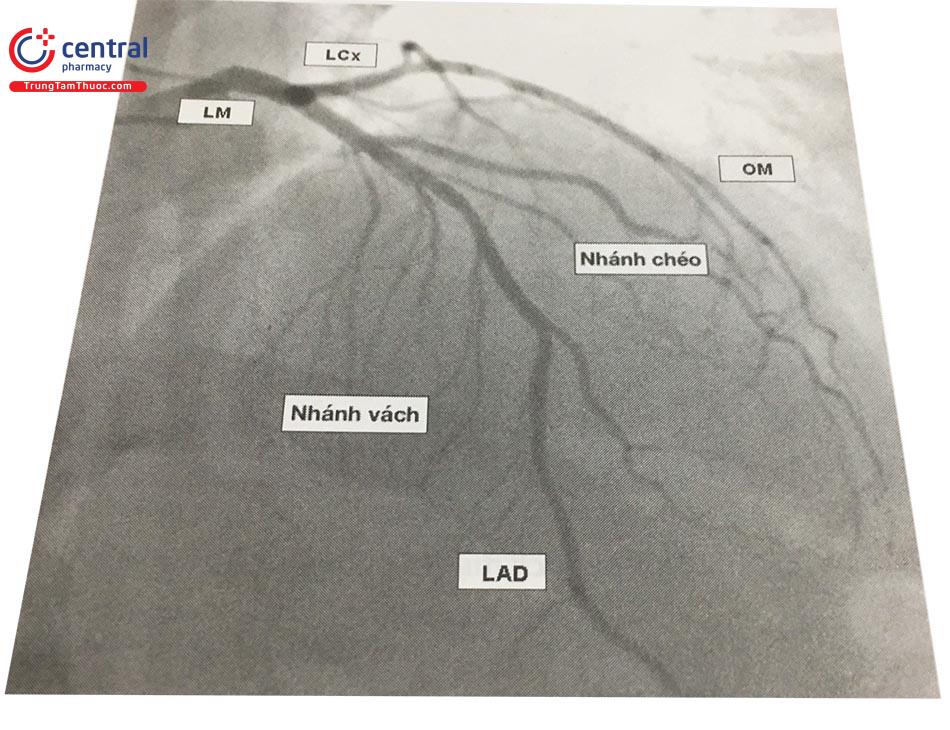
c. Động mạch mũ
Động mạch mũ (LCx) bắt đầu từ vị trí gập góc của LMCA rồi đi bên dưới tiểu nhĩ trái, tiếp tục chạy trong rãnh nhĩ thất trái.
Các nhánh bên lớn nhất của LCx là các nhánh bờ (Obtuse Marginal, viết tắt OM), cấp máu cho thành bên thất trái. Thường có hai đến ba nhánh OM. Đoạn xa LCx chuyển thành động mạch nhĩ thất, có kích thước nhỏ. Thông thường, nhánh tận này không vượt qua chỗ giao giữa mặt phẳng nhĩ thất và mặt phẳng vách liên thất. Tuy nhiên, khoảng 10-20% bệnh nhân, nhánh nhĩ thất lớn và có đường kính tương đương với động mạch LCx, tách ra cả các nhánh sau bên trái (Left PosteroLateral, viết tắt LPL) và động mạch liên thất sau. Đây là trường hợp ĐMV ưu năng trái.
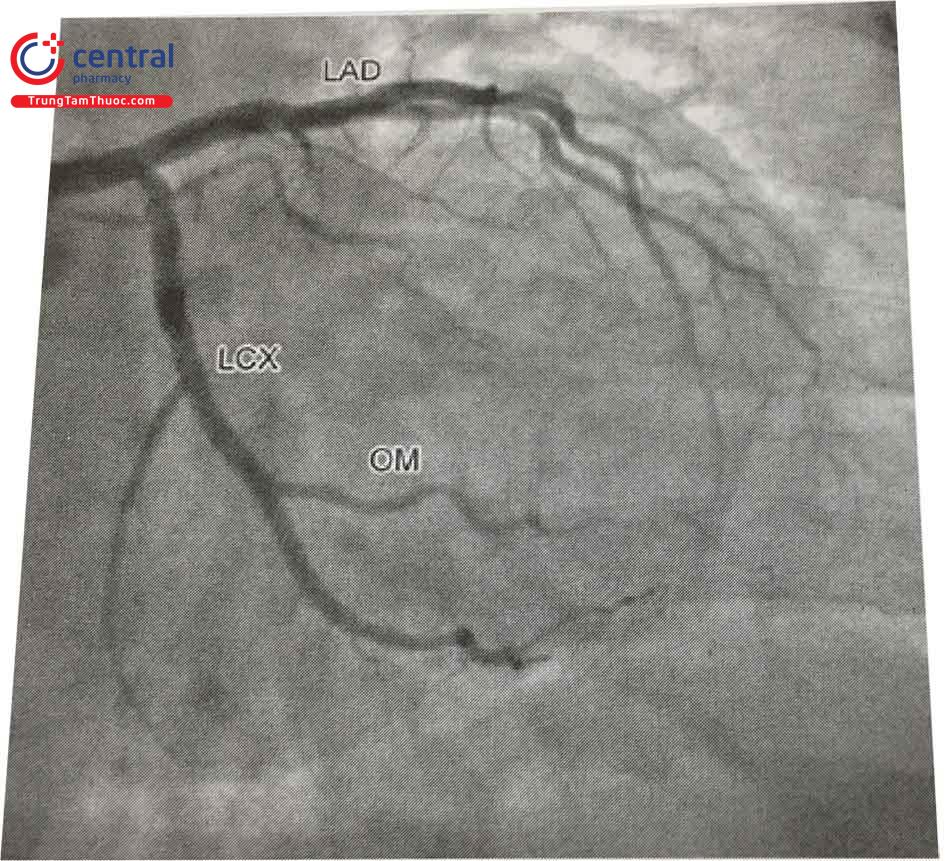
1.1.3 Động mạch vành phải
Động mạch vành phải (RCA) bắt nguồn từ xoang Valsalva vành phải, chạy dọc theo rãnh nhĩ thất phải, ôm lấy bờ phải của tim theo vòng cung hình chữ C.
Nhánh bên đầu tiên của RCA là nhánh nón (nhánh conus), tuy nhiên khoảng 50% trường hợp nhánh conus tách riêng biệt từ động mạch chủ. Nhánh nút xoang là nhánh lớn thứ hai, cấp máu nuôi nút xoang, nhánh này xuất phát từ RCA trong 60% trường hợp và từ LCx trong 40% trường hợp.
Ở đoạn giữa, RCA tách ra một nhánh bên quan trọng là nhánh thất phải, cấp máu cho thành tự do thất phải. Các nhánh bên tiếp theo của RCA là nhánh bờ (Acute Marginal), cấp máu cho thất phải và thường tiếp nối với các nhánh nhỏ của LAD, hoặc nhánh OM của LCx.
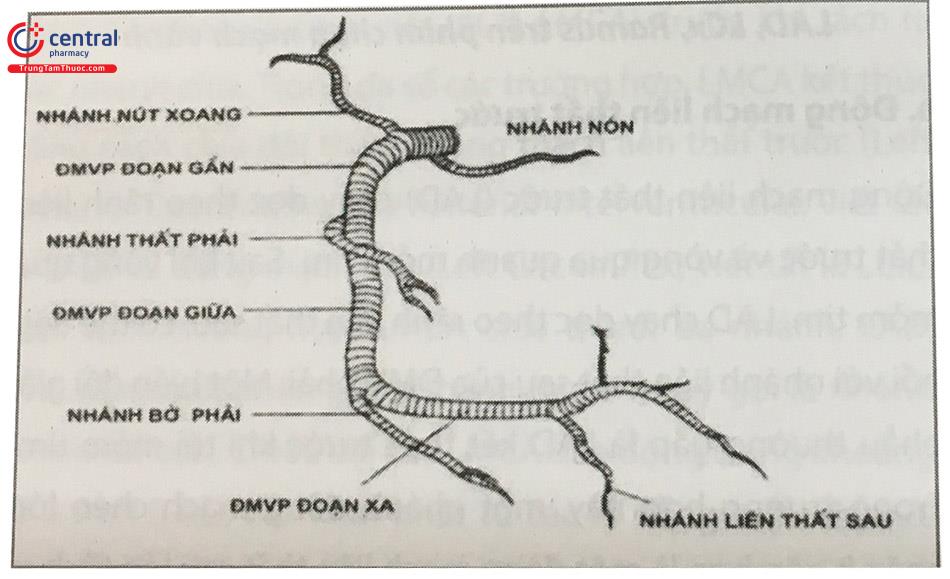
Đoạn xa của RCA tiếp tục đi trong rãnh nhĩ thất để đến chỗ giao của rãnh nhĩ thất và vách liên thất, tại đây RCA tách ra nhánh nuôi nút nhĩ thất. Sau đó, RCA chạy trong rãnh liên thất sau và tận cùng bằng cách chia thành nhánh liên thất sau (Posterior Descending Artery hay Inferior Posterior In- terventricular, viết tắt PDA) và nhánh cấp máu cho thành sau thất trái (Posterior Left Ventricular viết tắt là PLV).
Nhánh PDA tiếp tục đi trong rãnh liên thất sau và thường tận cùng tại vùng mỏm tim, cho các nhánh tiếp nối với các nhánh xa của LAD.Tuỳ thuộc vào nhánh PDA xuất phát từ bên phải (khoảng 85% trường hợp) hay bên trái
(15% trường hợp) mà quy ước hệ ĐMV ưu năng phải hay ưu năng trái. Trong trường hợp ĐMV ưu năng trái, nhánh PDA xuất phát từ LCx. Khi đó, RCA kết thúc bằng nhánh bờ (acute Marginal).
Khi LAD tắc hoàn toàn, đặc biệt là tắc đoạn gần, nhiều nhánh bên của RCA có thể tiếp nối bàng hệ với LAD. Nhìn thấy hình ảnh phần xa của LAD trên phim chụp mạch vành thông qua các nhánh bàng hệ là cực kỳ quan trọng khi tiến hành can thiệp trên bệnh nhân tắc hoàn toàn mạn tính LAD. Tương tự như vậy, có thể quan sát phần xa của RCA bị tắc dựa trên hình ảnh tưới máu bàng hệ khi chụp ĐMV trái.
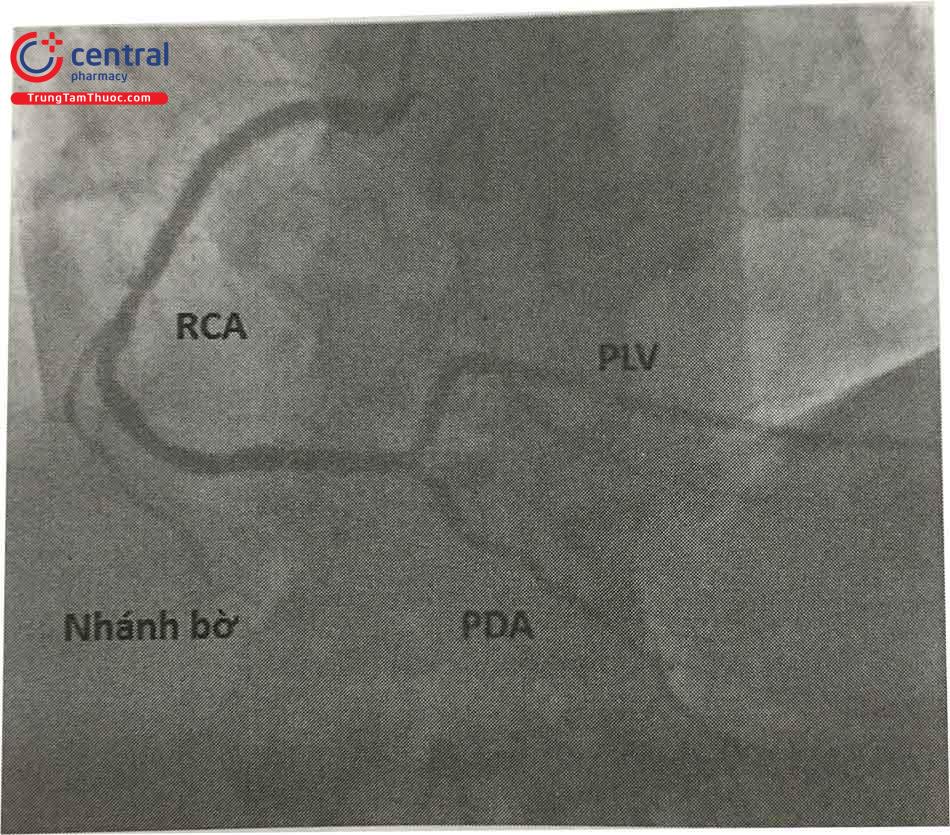
Chú thích: PDA: nhánh liên thất sau của ĐMV phải, PLV: Nhánh tới sau thất trái của ĐMV phải, RCA: Động mạch vành phải.
1.1.4 Cầu cơ động mạch vành
Cầu cơ là một biến đổi giải phẫu bẩm sinh, có thể xuất hiện ở tất cả các nhánh ĐMV, nhưng thường gặp nhất ở LAD. Đây là tình trạng một đoạn của ĐMV thượng tâm mạc đi xuyên giữa lớp cơ tim và sau đó lại đi ra ngoài. Tỉ lệ cầu cơ được báo cáo ở 40% các trường hợp giải phẫu tử thi, nhưng tỉ lệ phát hiện cầu cơ khi chụp ĐMV cản quang thấp hơn rất nhiều. Có thể chẩn đoán cầu cơ ở người bằng chụp cắt lớp vi tính ĐMV, hoặc phối hợp siêu âm trong lòng mạch trong lúc chụp ĐMV qua da.
Mối liên quan giữa cầu cơ ĐMV và triệu chứng lâm sàng còn đang tranh cãi. Trong đa số các trường hợp, cầu cơ lành tính và không gây triệu chứng. Tuy vậy, đôi khi cầu cơ ĐMV có thể gây ra đau ngực, rối loạn nhịp và hội chứng vành cấp. Những trường hợp này được cho là có liên quan đến rối loạn chức năng nội mạc, sự phát triển của xơ vữa gần cầu cơ, phì đại thất trái và rối loạn chức năng tâm trương làm tăng ảnh hưởng của cầu cơ ở các mức độ khác nhau, dẫn tới triệu chứng lâm sàng.
Cầu cơ có triệu chứng thường được điều trị nội khoa đơn thuần. Hiệu quả điều trị cầu cơ bằng can thiệp qua da còn dè dặt. Khi điều trị nội khoa thất bại, phẫu thuật cắt bỏ cầu cơ .
1.1.5 Hệ tĩnh mạch vành
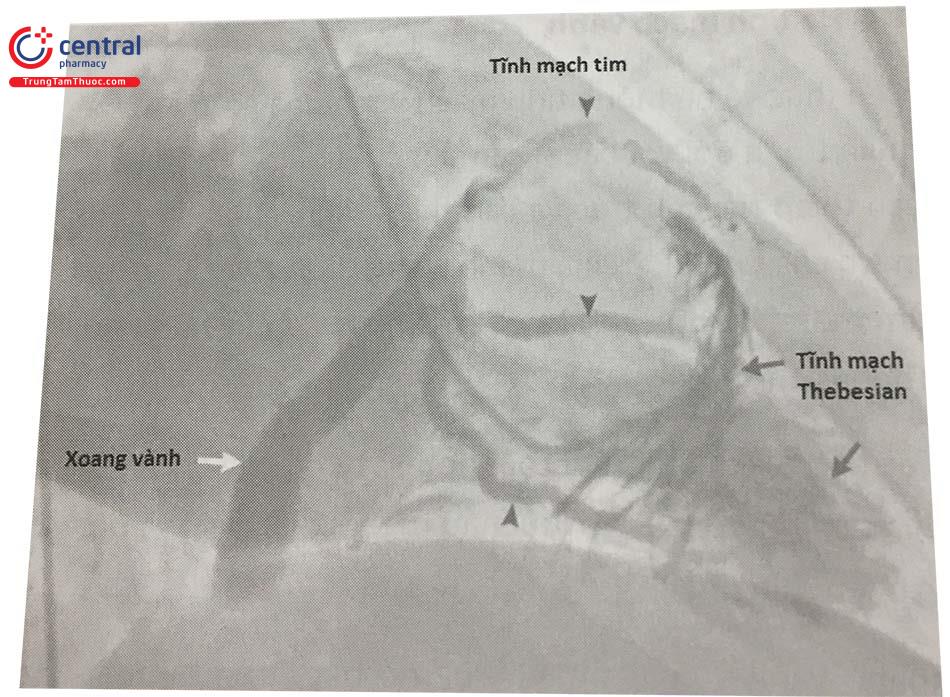
Kiến thức về hệ thống tĩnh mạch vành ngày càng trở nên quan trọng đối với bác sĩ can thiệp để giúp thực hiện các can thiệp tim cấu trúc và can thiệp điện sinh lý tim. Tĩnh mạch của tim được chia thành ba hệ thống: các tĩnh mạch tim trước, xoang vành và các nhánh của nó, và tĩnh mạch Thebesian.
Các tĩnh mạch tim trước, bắt nguồn từ bề mặt thành tự do của tâm thất phải, dẫn lưu máu từ tâm thất phải và đổ vào vào tâm nhĩ phải.
Xoang vành và các nhánh của nó nằm trên bề mặt của tâm thất trái, chạy song song với các nhánh ĐMV. Nhánh lớn nhất dẫn máu về xoang vành là tĩnh mạch liên thất trước, đi song song với động mạch liên thất trước, và đổi tên thành tĩnh mạch tim lớn khi đi vào trong rãnh nhĩ thất. Xoang vành đổ vào tâm nhĩ phải sát vị trí van ba lá.
Các tĩnh mạch Thebesian là tĩnh mạch nhỏ nhất của tim, không có van, dẫn máu từ cơ tim về buồng tim phải. Một lượng nhỏ máu từ tĩnh mạch Thebesian đổ về động mạch phế quản và ĐMV, và là căn nguyên gây luồng thông phải-trái sinh lý, ít ảnh hưởng lâm sàng.
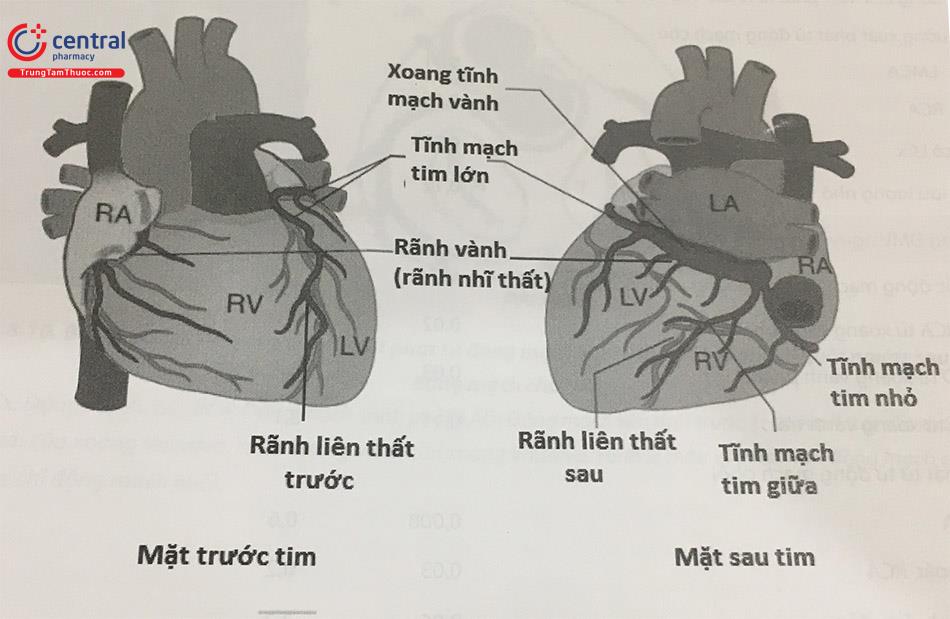
Chú thích: RA: Nhĩ phải (Right Atrium), LA: Nhĩ trái (Left Atrium), LV: Thất trái (Left Ventricular) , RV: thất phải (Right Ventricular)
1.2 Bất thường giải phẫu động mạch vành
1.2.1 Bất thường động mạch vành lành tính
a. Không có thân chung ĐMV trái
Hầu hết các bất thường ĐMV được tình cờ phát hiện trên lâm sàng và thường lành tính. LAD và LCx có hai lỗ vào riêng biệt và sát nhau là bất thường giải phẫu thường gặp nhất, chiếm khoảng 30% tất cả các bất thường giải phẫu lành tính của ĐMV. Những bệnh nhân đó thường kèm theo van động mạch chủ hai lá van. Từ góc độ thực hành, mỗi lần đưa ống thông vào chỉ có thể đánh giá được một trong hai ĐMV. Đôi khi, cần hai ống thông chẩn đoán khác nhau để có thể hoàn thành chụp ĐMV trái có bất thường giải phẫu này.
Bảng 4.1. Các bất thường giải phẫu động mạch vành lành tính
Dạng bất thường | Tỷ lệ (%) | Tỉ lệ trong các bất thường (%) |
| Bất thường ĐMV lành tính | ||
| LAD và LCx xuất phất riêng biệt | 0,41 | 30,4 |
| LCx xuất phát từ RCA hoặc xoang vành phải | 0,37 | 27,7 |
| Bất thường LCx xuất phát từ lá sau của xoang Valsalva | 0,004 | 0,3 |
| Bất thường xuất phát từ động mạch chủ | ||
| - LMCA | 0,01 | 1,0 |
| - RCA | 0,15 | 11,2 |
| Không có LCx | 0,003 | 0,2 |
| Rò ĐMV lưu lượng nhỏ | 0,12 | 9,7 |
| Bất thường ĐMV nguy hiểm | ||
| Nguồn gốc động mạch vành từ xoang vành đối diện | ||
| - LMCA từ xoang vành phải | 0,02 | 1,3 |
| - LAD từ xoanh vành phải | 0,03 | 2,3 |
| - RCA từ xoanh vành trái | 0,11 | 8,1 |
| ĐMV xuất phát từ động mạch phổi | ||
| - LMCA | 0,008 | 0,6 |
| - LAD hoặc RCA | 0,03 | 0,2 |
| Động mạch vành đơn độc | 0,05 | 3,3 |
| Rò động mạch vành lớn hoặc nhiều vị trios rò | 0,05 | 3,7 |
Chú thích: LAD: Động mạch vành trái, RCA: Động mạch vành phải. LCx: Động mạch mũ, LMCA: Thân chung động mạch vành
b. LCX xuất phát từ bên phải
Bất thường phổ biến thứ hai là LCx xuất phát từ RCA hoặc từ lá vành phải của xoang Valsalva. Bất thường này gặp ở 0,38% những trường hợp chụp ĐMV chẩn đoán và chiếm 28% các bất thường ĐMV lành tính, với đặc điểm LCx chạy phía sau gốc động mạch chủ.
Việc phát hiện ra bất thường giải phẫu này có ý nghĩa quan trọng trên lâm sàng. Thứ nhất, trường hợp này thường khó nhìn thấy mạch trên phim chụp nếu bác sĩ can thiệp không nghi ngờ để tìm từ trước. Thứ hai, đối với những bệnh nhân được thực hiện phẫu thuật sửa hoặc thay van động mạch
chủ hay van hai lá, động mạch mũ trong trường hợp này có thể bị tổn thương trong quá trình phẫu thuật nếu phẫu thuật viên không biết sự có mặt và đường đi phía sau gốc động mạch chủ của nó.
Trên phim chụp ĐMV, các trường hợp này thường có LMCA dài, thường hơn 15 mm. Đường đi phía sau động mạch chủ của LCx tạo ra hình ảnh “chồng hình”, biểu hiện là dấu hiệu “dấu chấm” khi chụp động mạch chủ hoặc chụp buồng thất trái ở góc chụp nghiêng phải. Nếu LCx xuất phát từ bên phải, nên chụp chọn lọc LCx bằng ống thông Amplatz hoặc ống thông đa dụng (Multi Purpose).

Chú thích: LCx: Động mạch mũ , RCA: Động mạch vành phải, LAD: Động mạch liên thất trước, L: Lá vành trái của xoang Valsalva, R: Lá vành phải của xoang Valsalva, N: Lá không vành của xoang Valsalva. Hình E: màu xám chỉ van động mạch chủ, van màu đen phía trước chỉ động mạch phổi.
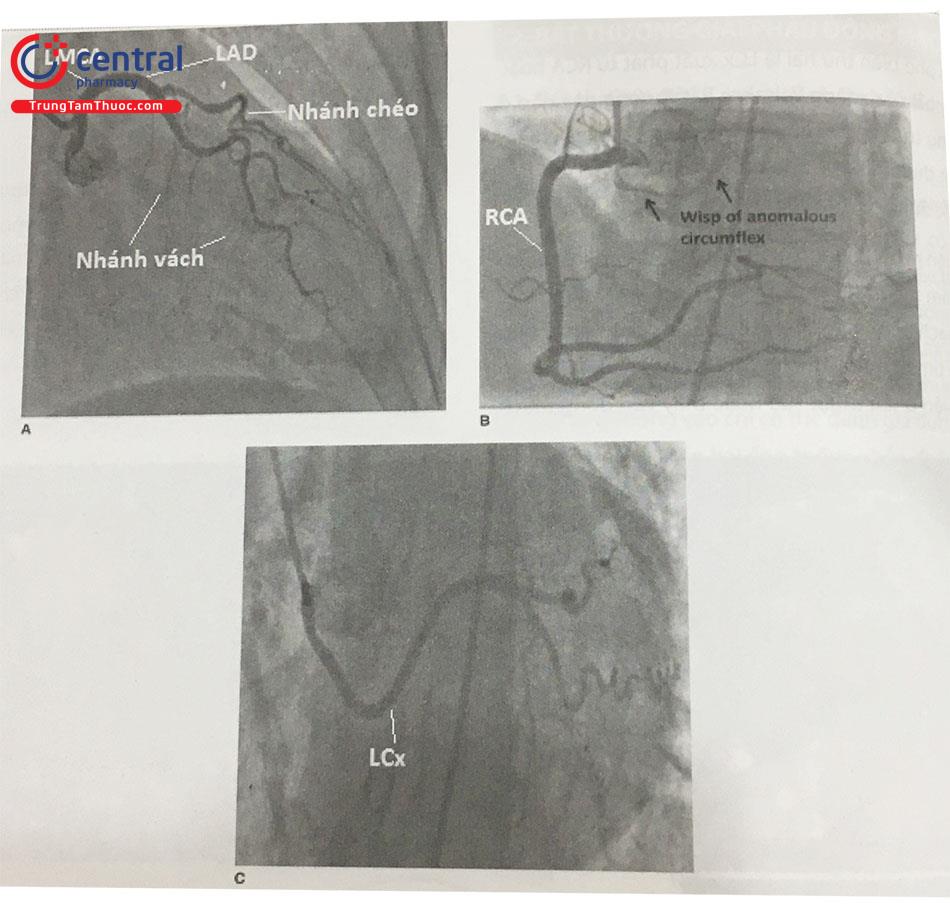
Thân chung động mạch vành trái dài chỉ tách ra LAD, không có LCx. B. Bơm thuốc cản quang vào RCA với dòng thuốc cản quang chạy ngược vào trong LCx (mũi tên: Wisp of anomalous circumflex: Nhánh động mạch mũ xuất phát bất thường). C. Bơm thuốc chụp chọn lọc LCx xuất phát bất thường từ xoang vành phải.
1.2.2 c. Các bất thường lành tính khác
Bất thường giải phẫu lành tính thường gặp thứ ba là RCA xuất phát từ lá vành trái của xoang Valsalva, xuất hiện ở 0,15% trường hợp và chiếm 12% bất thường giải phẫu mạch vành lành tính. Ngoài ra, có thể gặp LMCA tách ra từ ĐMC lên hoặc không có LCx, với tỉ lệ thấp (chiếm < 1% các trường hợp bất thường lành tính giải phẫu ĐMV).
Rò ĐMV là tình trạng một nhánh ĐMV có thông thương trực tiếp với buồng tim hoặc cấu trúc khác, như động mạch phổi. Hầu hết các rò được phát hiện tình cờ qua chụp mạch vành, có kích thước nhỏ, lưu lượng thấp, ít ảnh hưởng trên lâm sàng và hiếm khi tạo ra một luồng thông trái-phải đáng kể. Những đường rò nhỏ được ghi nhận với tỷ lệ khoảng 0,12-0,14% các trường hợp thông tim, chiếm khoảng 10% các bất thường lành tính mạch vành.
1.2.3 Bất thường động mạch vành nguy hiểm
a. Động mạch vành phải (RCA) xuất phát từ xoang vành trái
Khoảng 20% xuất phát bất thường ĐMV liên quan tới hậu quả lâm sàng nghiêm trọng. Phổ biến nhất là ĐMV phải xuất phát từ xoang Valsalva trái, gặp với xác suất khoảng 0,1%, chiếm xấp xỉ 8% bất thường ĐMV. Trong trường hợp này, RCA chạy giữa động mạch chủ và động mạch phổi. Đường đi của RCA tạo thành điểm uốn cong phía trước của động mạch chủ, hình thành một dấu chấm động mạch nhìn thấy trên phim chụp buồng tim hoặc chụp động mạch chủ. RCA có thể bị chèn ép dẫn tới giảm lưu lượng máu, và gây triệu chứng thiếu máu cơ tim trên lâm sàng. Nếu triệu chứng nặng có thể cần phẫu thuật.
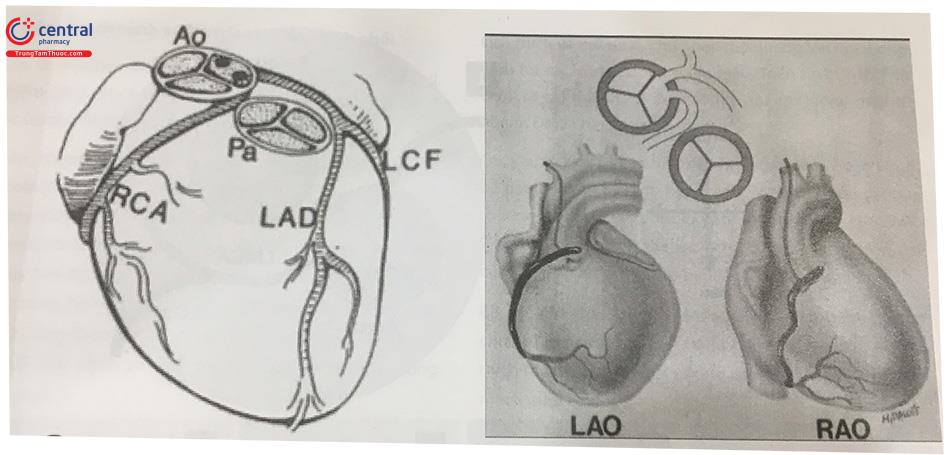
Chú thích: Ao: Động mạch chủ (Aorta), Pa: Động mạch phổi (Pulmonary Artery), RCA: Động mạch vành phải, LAD: Động mạch liên thất trước, LCF (LCx): Động mạch mũ, LAO: Góc chụp chếch nghiêng trái (left anterior oblique), RAO: Góc chụp chếch nghiêng phải (right anterior oblique)
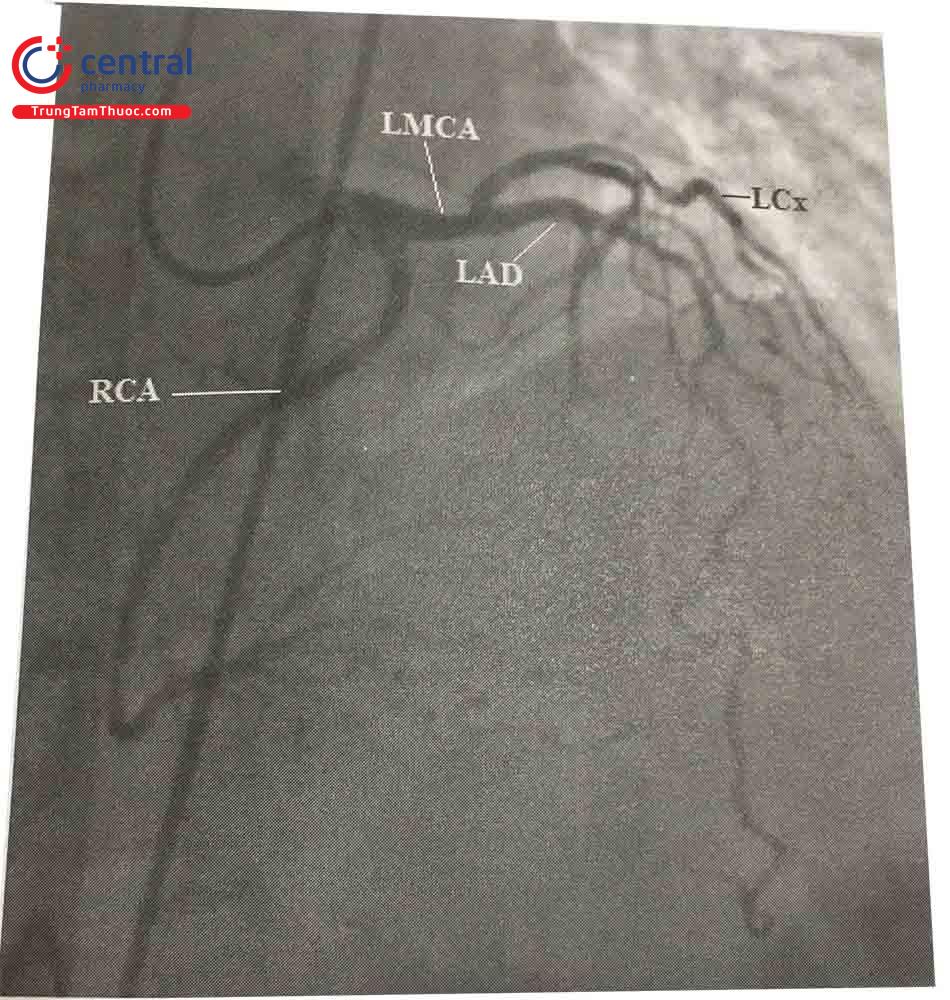
Chú thích: LMCA: Thân chung động mạch vành, RCA: Động mạch vành phải, LAD: Động mạch liên thất trước, LCx: Động mạch mũ
b. ĐMV trái xuất phát từ xoang vành phải
Một bất thường khác có khả năng đe doạ tính mạng là thân chung ĐMV trái xuất phát từ xoang vành phải. Bất thường này chiếm 1,5% tất cả các bất thường giải phẫu mạch vành và được ghi nhận ở 0,2% những trường hợp chụp ĐMV. Chụp cắt lớp vi tính đa dãy ĐMV là một phương pháp đơn giản giúp chẩn đoán bất thường đường đi của thân chung động mạch vành trái (LMCA), nhưng chụp ĐMV cản quang vẫn đóng một vai trò quan trọng.
LMCA xuất phát từ xoang vành phải có thể đi theo các hướng dưới đây:
- LMCA chạy trước động mạch phổi và thất phải.
- LMCA đi thấp và ra trước một đoạn dọc vách liên thất, các nhánh từ LMCA xuyên vào vách liên thất, với một đoạn đường đi trong cơ đi gần đường ra thất phải.
- LMCA đi phía sau động mạch chủ, vị trí của LMCA phía sau gốc động mạch chủ.
- LMCA giữa hai động mạch chủ và động mạch phổi. Đây là trường hợp nguy hiểm có khả năng gây đột tử.
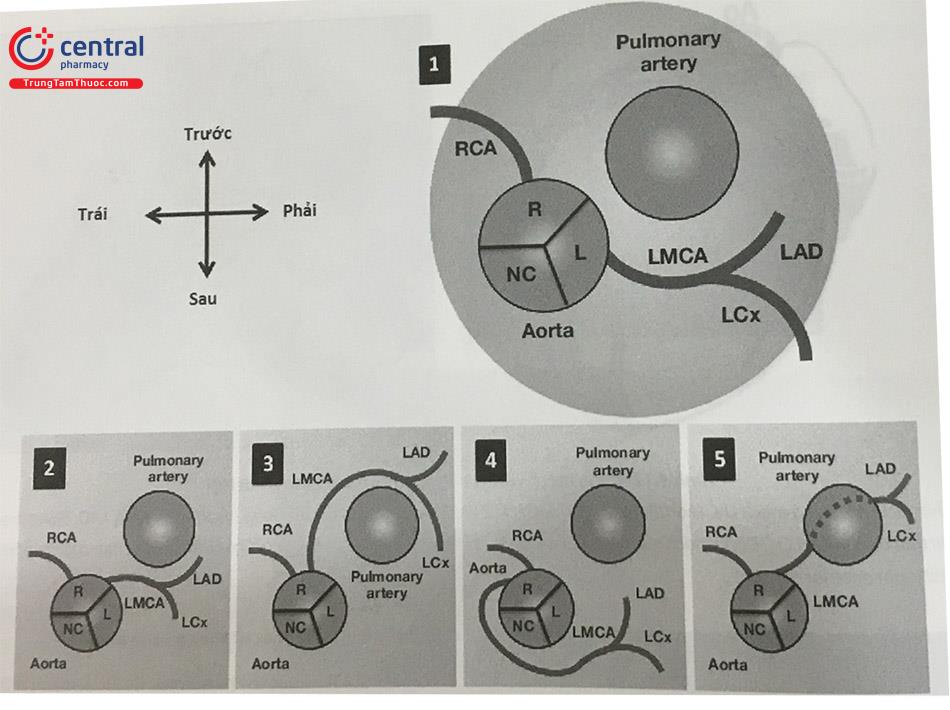
(1) Giải phẫu bình thường ĐMV; (2) LMCA đi giữa hai động mạch (Inter-arterial course); (3) LMCA đi trước động mạch phổi (Pre-pulmonary course); (4) LMCA đi sau động mạch chủ (Retro-aortic course). (5) LMCA đi dưới động mạch phổi (Subpulmonic course)
Chú thích: LMCA: Thân chung động mạch vành, RCA: Động mạch vành phải, LAD: Động mạch liên thất trước, LCx: Động mạch mũ, Aorta: Động mạch chủ, Pulmonary Valve: Động mạch phổi, R: Xoang vành phải, L: Xoang vành trái, NC: Xoang không vành.
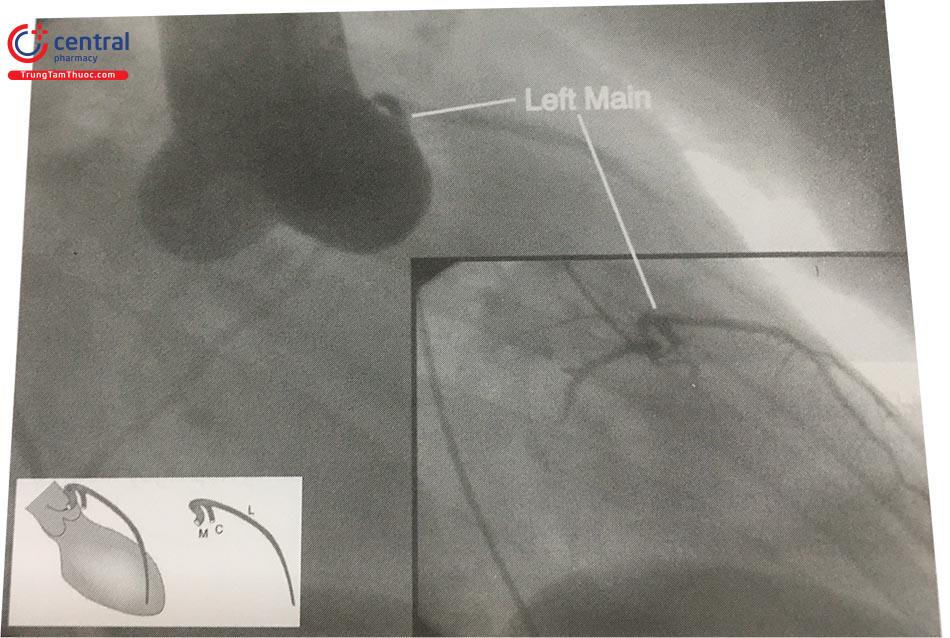
c. Động mạch vành xuất phát từ động mạch phổi
Đây là một bất thường có khả năng đe doạ tính mạng, chiếm 0,8% tất cả bất thường mạch vành và 0,04% tất cả các trường hợp được chụp ĐMV.
Thân chung ĐMV trái xuất phát từ động mạch phổi (Anomalous Left Coronary Artery from the Pulmonary Artery, viết tắt ALCAPA) là bất thường bẩm sinh nặng. Máu đi nuôi tim là máu nghèo oxy, dẫn đến thiếu máu cơ tim và suy tim ngay từ giai đoạn sơ sinh. Nếu hệ thống tuần hoàn bàng hệ mạch vành tốt, bệnh nhân có thể sống tới tuổi trưởng thành. Biện pháp điều trị là phẫu thuật làm cầu nối chủ vành và thắt nhánh ĐMV tách ra từ động mạch phổi.

Các trường hợp ĐMV phải hoặc động mạch mũ xuất phát từ động mạch phổi có tiên lượng tốt hơn, thường không biểu hiệu triệu chứng lâm sàng. Các bệnh nhân này sẽ có luồng thông trái phải từ giường mạch vành đến tuần hoàn phổi.
Một động mạch vành duy nhất
Có thể gặp một động mạch vành đơn độc cấp máu cho toàn bộ tâm thất, chiếm tỉ lệ 0,05% tổng số trường hợp chụp mạch và chiếm 3,3% tổng số trường hợp bất thường mạch vành.
1.3 Tuần hoàn bàng hệ động mạch vành
1.3.1 Đặc điểm tuần hoàn bàng hệ động mạch vành
Bình thường, có nhiều vòng nối nhỏ giữa các nhánh mạch vành thượng tâm mạc, tuy nhiên những vòng nối này tồn tại theo kiểu ngủ đông. Khi bị kích thích, các vòng nối được
kích thích và mở rộng, cho phép một lượng lớn lưu lượng máu tới các vùng cơ tim thiếu máu. Tuần hoàn bàng hệ ĐMV sẽ cải thiện tưới máu cơ tim khi lưu lượng máu từ nhánh ĐMV chính bị giảm.
Các yếu tố kích thích phát triển hệ thống tuần hoàn bàng hệ bao gồm: (i) mức độ hẹp mạch ĐMV, (ii) chiều dài tổn thương, (iii) hẹp ĐMV đoạn gần, (iv) thời gian tắc ĐMV. Ngoài ra, hoạt động thể lực tích cực trong thời gian dài cũng làm phát triển các tuần hoàn bàng hệ.
Cơ chế của phát triển hệ thống tuần hoàn bàng hệ còn chưa rõ ràng. Có thể tình trạng thiếu máu cơ tim sẽ kích thích tế bào nội mô giải phóng các cytokine và chất giãn mạch (nitơ oxide).
Sự xuất hiện của tuần hoàn bàng hệ ảnh hưởng tới kết cục lâm sàng của người bệnh trong cả bối cảnh cấp tính và mạn tính. Ở bệnh nhân nhồi máu cơ tim cấp, tuần hoàn bàng hệ giúp cải thiện chức năng thất trái, giảm tổn thương phình thành tim, giảm diện tích vùng nhồi máu. Với bệnh nhân hội chứng mạch vành mạn, tỉ lệ sống sót dài hạn tốt hơn ở nhóm có tuần hoàn bàng hệ phong phú, so với nhóm tuần hoàn bàng hệ nghèo nàn.
Đánh giá tuần hoàn bàng hệ theo tiêu chuẩn Rentrop bằng cách chụp chọn lọc ĐMV lành xem có ngấm thuốc sang ĐMV bị tắc hay không:
- Độ 0: Không quan sát được tuần hoàn bàng hệ từ ĐMV lành qua ĐMV bị tắc.
- Độ 1: Ngấm thuốc cản quang từ ĐMV lành qua các nhánh bên của ĐMV bị tắc, nhưng không ngấm thuốc lên ĐMV bị tắc.
- Độ 2: Ngấm thuốc một phần ĐMV bị tắc.
- Độ 3: Ngấm thuốc toàn bộ ĐMV bị tắc.
Phương pháp này chỉ có thể đánh giá một cách định tính các tuần hoàn bàng hệ, với độ nhạy không cao. Biện pháp chính xác hơn là đo áp lực và tốc độ dòng chảy trong mạch bàng hệ dựa vào dây dẫn nhận cảm áp lực (pressure wire).
1.3.2 Các hệ thống tuần hoàn bàng hệ
a. Tuần hoàn bàng hệ giữa ba nhánh ĐMV
Các hệ thống tuần hoàn bàng hệ quan trọng bao gồm:
- Bàng hệ vách – vách từ động mạch liên thất sau (PLV- nhánh tận của RCA) nối với động mạch liên thất trước (LAD).
- Nhánh bờ (OM) của LCx nối với nhánh chéo của
- Nhánh nón (Conus branch) của RCA nối với
Nắm vững kiến thức giải phẫu về các hệ thống bàng hệ này sẽ giúp bác sĩ tim mạch can thiệp không bỏ sót mạch bàng hệ khi chụp ĐMV chẩn đoán. Trong trường hợp cần đánh giá kỹ hệ thống tuần hoàn bàng hệ, có thể cần đưa ống thông vào các mạch nhỏ để chụp chọn lọc, thay vì chỉ chụp từ động mạch lớn ở thượng tâm mạc.
b. Tuần hoàn bàng hệ tự thân
Ngoài tuần hoàn bàng hệ nối giữa hai ĐMV ở thượng tâm mạc, còn có các tuần hoàn bàng hệ tự thân, là những vòng nối từ đoạn gần của động mạch bị tắc tới đoạn xa của nó. Tuần hoàn bàng hệ tự thân có thể là nhánh lớn, như nhánh Acute Marginal (nhánh bờ) của RCA cấp máu cho nhánh liên thất sau; hoặc động mạch Kugel, một nhánh tách ra từ đoạn gần của RCA nối với động mạch nút nhĩ thất phía dưới đoạn RCA bị tắc, đảm bảo tưới máu cho nút nhĩ thất.
Một trường hợp hợp khác của tuần hoàn bàng hệ tự thân là các bàng hệ cầu nối (bridging collaterals). Đây là những mạch nhỏ phát triển xung quanh vị trí tắc, cấp máu cho phần hạ lưu.
Sinh lý tuần hoàn động mạch vành
1.4 Tuần hoàn mạch vành
Ở người, ĐMV có đường kính từ 2,5 – 4 mm và chạy xung quanh tim. Như các ĐM khác, ĐMV cũng có cấu trúc thành lớp gồm: nội mạc, lớp áo giữa, lớp áo ngoài. Dưới điều kiện bình thường, sức cản của ĐMV với dòng máu là không đáng kể, kể cả khi sung huyết.
Từ ĐMV thượng tâm mạc, các nhánh nhỏ xuyên vào cơ tim, chia tiếp thành các mạch máu nhỏ hơn – gọi là tiểu động mạch, có đường kính từ 100 – 400 μm. Xung quanh tiểu động mạch, các sợi cơ trơn nằm thành từng bè và có thể thay đổi sức cản của tiểu động mạch.
Những tế bào cơ trơn xung quanh tiểu động mạch giống như một loại cơ thắt. Sức cản của tiểu ĐM có thể thay đổi ít nhất 500%, tương đương dòng máu tối đa tăng ít nhất 5 lần so với bình thường. Dự trữ lưu lượng động mạch vành (CFR- Coronary Flow Reserve) được định nghĩa là tỷ số giữa lưu lượng động mạch vành tối đa trong điều kiện giãn mạch và lưu lượng động mạch vành bình thường. Các tiểu ĐM chia thành hệ thống mao mạch, nằm cạnh mỗi tế bào cơ tim. Từ đó, tập hợp lại thành các tiểu tĩnh mạch, tĩnh mạch và đổ trực tiếp vào buồng tim hoặc đổ vào xoang vành (đường kính từ 5 – 10 mm) rồi đổ vào nhĩ phải.
Lưu lượng ĐMV chiếm 3 – 5% cung lượng tim, thay đổi từ 200 mL/phút khi nghỉ và tới khoảng 1 lít/phút khi gắng sức tối đa.
Ngược lại với hầu hết các cơ quan, hiệu suất tiêu thụ oxy trong tuần hoàn vành rất cao do đó bão hòa oxy trong xoang vành tương đối thấp (30 – 40%). Điều này có nghĩa là trong tuần hoàn mạch vành, sự gia tăng tiêu thụ oxy của cơ tim chỉ có thể đạt được bằng cách tăng lưu lượng máu chứ không phải bằng cách tăng giải phóng oxy.
Trong điều kiện cơ bản, tiêu thụ oxy của cơ tim từ 0,7 – 1,3 mL O2/phút/gam mô và khi tăng tưới máu tối đa có thể lên tới 3 – 6 mL O2/phút/gam.
Trong quá trình gắng sức, tần số và sức co bóp cơ tim tăng tức hậu gánh tăng sẽ làm tăng tiêu thụ và nhu cầu oxy cơ tim. Để cân bằng điều này, cần có các cơ chế tự điều hòa (Hình 4.18).

ĐMV chia thành các tiểu ĐM, sau đó chia tiếp thành giường mao mạch. Ở lỗ vào của tiểu ĐM, có các cơ thắt có thể thay đổi sức cản tiểu ĐM ít nhất 500%. Trong trạng thái nghỉ, các cơ này co lại và nếu cần nhiều lượng máu hơn để đáp ứng với tăng nhu cầu oxy (khi gắng sức), các cơ này giãn ra. Khi đó, với áp lực tưới máu tương đương, lưu lượng có thể tăng ít nhất 500%. Trong trường hợp hẹp vừa để bù trừ cho sức cản ở ĐM thượng tâm mạc được cộng thêm cơ thắt tiểu ĐM giãn một phần ngay cả khi nghỉ để duy trì tổng sức cản trong giường mao mạch bằng R. Do đó, trong trạng thái nghỉ, không nhận ra ảnh hưởng của hẹp ĐMV thượng tâm mạc. Nhưng khi nhu cầu tăng lên, khả năng giãn bù trừ của cơ thắt giảm đi, lưu lượng máu tối đa đạt được trong ĐMV giảm dẫn đến thiếu máu cơ tim và triệu chứng đau thắt ngực. Trong trường hợp hẹp nặng, cơ thắt tiểu ĐM cần giãn tối đa để bù sức cản lớn của ĐMV ở thượng tâm mạc. Điều này có nghĩa không còn dự trữ mạch vành thêm và đau thắt ngực xảy ra cả khi gắng
sức nhẹ.
Chú thích : F: Lưu lượng mạch vành, R: Sức cản mạch vành.
1.5 Tuần hoàn bàng hệ
Là những mạch máu nhỏ có thể nối những vùng tưới máu của các ĐMV khác nhau. Đường kính của tuần hoàn bàng hệ có thể thay đổi từ 10 μm tới hơn 1 mm và có thể quan sát thấy trên phim chụp mạch. Tuần hoàn bàng hệ (THBH) có thể tồn tại trước đó hoặc do đáp ứng với thiếu máu cục bộ. Thiếu máu cục bộ lặp lại là điều kiện quan trọng của hình thành THBH.
THBH có thể nằm ở dưới nội tâm mạc hoặc dưới thượng tâm mạc. Quá trình hình thành THBH dưới nội tâm mạc thường là tăng sinh mạch và các THBH này chỉ có cấu trúc thành mạch 1 lớp. THBH dưới nội tâm mạc thường đi xuyên qua vách, liên kết với các nhánh vách của ĐM liên thất trước và nhánh liên thất sau của ĐM vành phải. Với THBH dưới thượng tâm mạc, mạch máu có cấu trúc 3 lớp như mạch máu bình thường và thường rất xoắn vặn. Loại này thường đi qua mỏm nối với các nhánh xa của ĐM vành phải và ĐM liên thất trước hoặc chạy từ nhánh ĐM thất phải tới ĐM liên thất trước hoặc xuyên qua tâm nhĩ.
1.5.1 Cơ chế tự điều hòa
Là cơ chế giúp cân bằng cung – cầu oxy cơ tim tương ứng với cả điều kiện sinh lý thông thường và bệnh lý.
Các cơ thắt tiểu ĐM đóng vai trò quan trọng do có thể thay đổi sức cản trong phạm vi lớn. Khi cơ thắt này giãn hoàn toàn, sức cản tuần hoàn vành giảm 500%, tức là với cùng một áp lực tưới máu, dự trữ lưu lượng ĐM vành có thể tăng lên 500%.
Bình thường, áp lực tưới máu ĐMV bằng hiệu số của áp lực ĐMC và áp lực tĩnh mạch trung tâm (0 – 5 mmHg). Nếu không có hẹp ĐMV, áp lực đoạn xa ĐMV tại lỗ vào tiểu ĐM bằng áp lực ĐMC do không có sự giảm áp lực trong ĐMV bình thường.
Khi nhu cầu oxy cơ tim tăng, cơ thắt tiểu ĐM có thể giãn, dòng máu có thể tăng lên nhưng áp lực tưới máu là không thay đổi. Cơ chế chính giúp cơ thắt có thể co/giãn phụ thuộc vào yếu tố cơ học (stress) cũng như các yếu tố thể dịch (bradykinin, acetylcholine, NO). Khi gắng sức, nếu áp lực máu ĐM tăng thêm, lưu lượng ĐMV có thể tăng và luôn duy trì đủ đáp ứng nhu cầu chuyển hóa cơ tim.
Cơ chế tự điều hòa cũng giúp lưu lượng ĐMV ổn định mặc dù huyết áp thay đổi. Khi huyết áp thấp, cơ thắt giãn ra và khi HA tăng cao đột ngột, cơ thắt co lại. Vì vậy, lưu lượng ĐMV duy trì ổn định khi huyết áp ĐMC trung bình từ 50– 130 mmHg. Khi HA trung bình từ 130 mmHg trở lên, cơ thắt co tối đa, và HA tăng thêm nữa, tưới máu ĐMV sẽ tăng. HATB < 50 mmHg, cơ thắt giãn tối đa và giảm thêm HA sẽ giảm tưới máu ĐMV.
1.5.2 Sung huyết phản ứng
Trong điều kiện sinh lý bình thường, tưới máu ĐMV trái chủ yếu xảy ra trong thì tâm trương. Trong thì tâm thu, cơ tim ép lên mạch máu và gần như không có dòng máu trong ĐMV trái. Điều này có nghĩa là tưới máu ĐMV ngược pha với tưới máu các cơ quan khác, khi mà các cơ quan này được tưới máu chủ yếu trong thì tâm thu.
Trong quá trình sung huyết cơ tim (khi gắng sức tối đa hoặc dùng các thuốc giãn mạch) dòng máu tâm trương tăng lên và lưu lượng tâm thu chiếm 15 – 25% tổng lưu lượng mạch vành.
So với ĐMV trái, lưu lượng trong ĐMV phải thay đổi hơn và đều hơn giữa tâm thu và tâm trương. Khi ĐMV phải ưu năng, lưu lượng cũng tương tự như trong ĐMV trái.
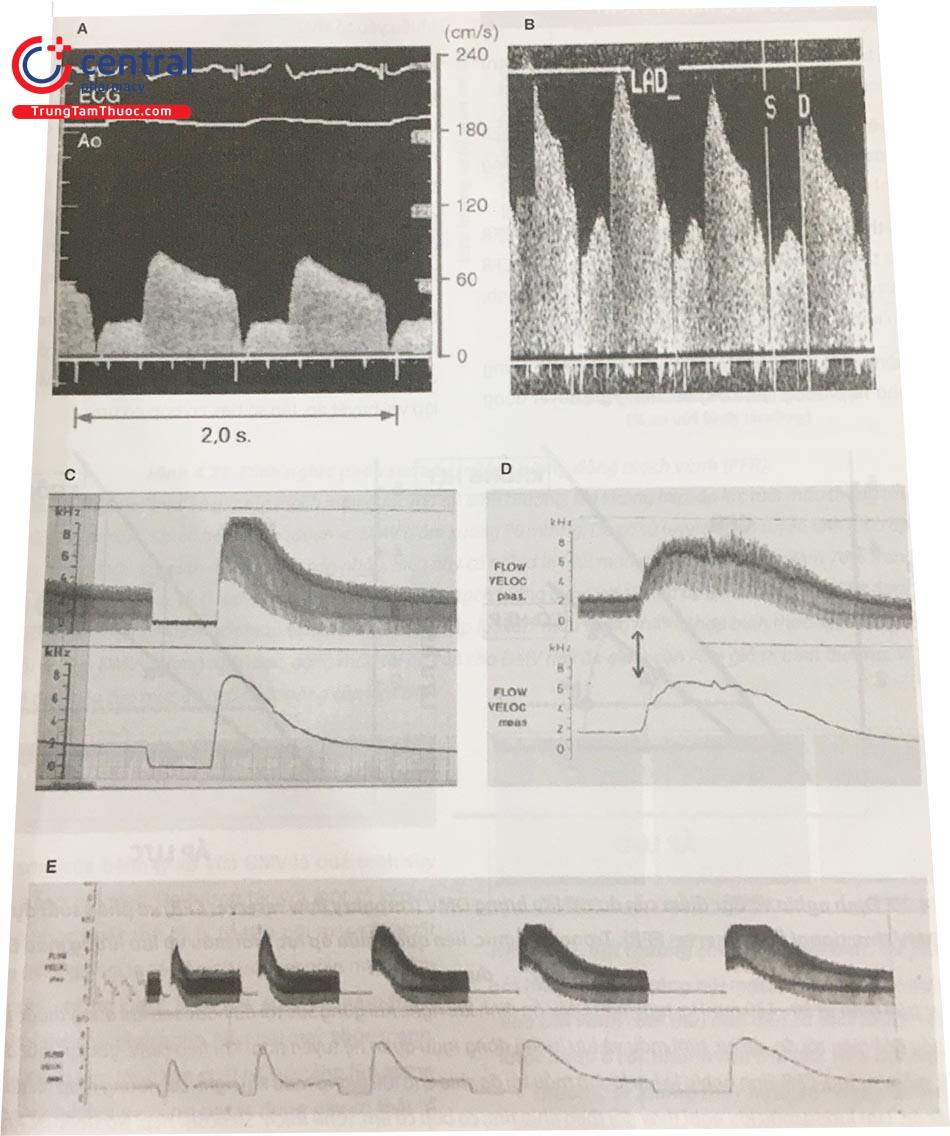
Khi nghỉ ngơi, lưu lượng máu tâm thu rất thấp, và lưu lượng chủ yếu xảy ra trong thời kỳ tâm trương. Khi gắng sức tối đa, lưu lượng tăng lên cả kì tâm thu và trong kì tâm trương thậm chí còn tăng nhiều hơn. C. Ví dụ về phản ứng giãn mạch vành sau 20 giây tắc ĐM liên thất trước ở chó. Sau khi giải phóng tắc nghẽn, dòng máu tăng nhanh 500% so với khi nghỉ, sau đó giảm xuống khi gánh nặng về oxy được giải quyết. D. Phản ứng giãn mạch sau khi tiêm 10 mg Papaverine. E. Lưu lượng ĐMV và các pha trong ĐM liên thất trước sau tắc nghẽn 3,5,10,20,30 giây. Khi thời gian tắc nghẽn tăng lên, phản ứng giãn mạch rõ rệt hơn tới thời gian tắc nghẽn khoảng 20 giây. Với thời gian tắc nghẽn dài hơn, đỉnh lưu lượng máu không còn tăng thêm nhưng kéo dài hơn trước khi trở về bình thường.
1.6 Dự trữ lưu lượng mạch vành
Khả năng lưu lượng ĐMV có thể tăng lên được gọi là dự trữ ĐMV (coronary flow reserve – CFR).
Giá trị tuyệt đối của CFR là tỷ số giữa lưu lượng động mạch vành tối đa trong điều kiện giãn mạch và lưu lượng động mạch vành bình thường.
CFR phụ thuộc vào huyết áp, CFR tăng khi HA tăng. CFR cũng phụ thuộc tuổi, giảm đi khi tuổi cao. Ở người trẻ, CFR bình thường từ 5 – 6, nhưng ở người từ 80 tuổi khỏe mạnh, CFR hiếm khi đạt đến 1,5.
CFR là thông số lý thuyết để hiểu về tuần hoàn ĐMV nhưng không phù hợp trong lâm sàng để lượng giá huyết động của ĐMV bị hẹp vì nó phụ thuộc vào huyết áp, tuổi và nhiều yếu tố khác.
Hạn chế lớn nhất trong thực hành lâm sàng là xác định CFR khi nghỉ. Trong phòng thông tim, bệnh nhân nằm trên bàn và được tiến hành can thiệp, nên khó đảm bảo đó là dòng máu khi nghỉ. Vì vậy, ngưỡng CFR mà dưới mức đó gây thiếu máu cục bộ cơ tim thay đổi khác nhau tùy nghiên cứu, từ 1,6 – 3,3. Điều này có nghĩa là cùng một giá trị thì ở người này là bình thường nhưng là bất thường ở người khác. Vì vậy, khó sử dụng CFR để quyết định can thiệp.
Để khắc phục điều này, FFR (fractional flow reserve) đã được sử dụng. FFR là lưu lượng máu tối đa khi có hẹp ĐMV chia cho lưu lượng máu tối đa khi không hẹp ĐMV. FFR độc lập với huyết áp, tần số tim, co bóp cơ tim.
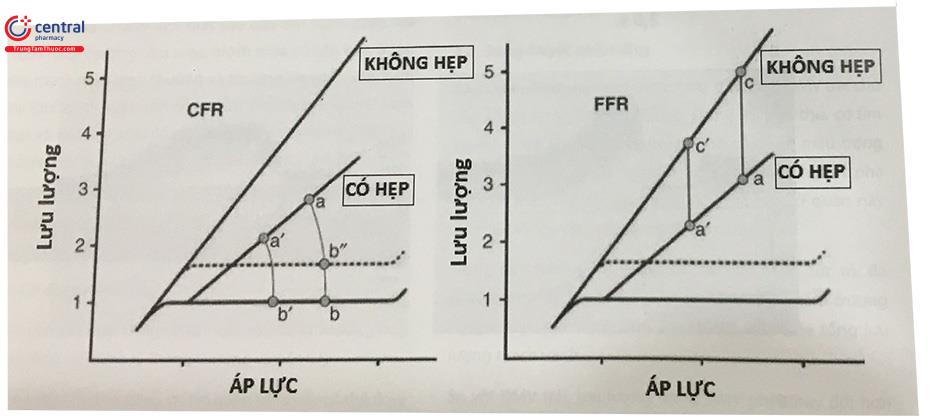
Khi áp lực tưới máu từ 50 – 130 mmHg, tưới máu ĐMV ổn định khi nghỉ. Khi gắng sức tối đa hoặc sau khi dùng thuốc giãn mạch, cơ thắt tiểu ĐM giãn tối đa, áp lực tưới máu và lưu lượng dòng máu quan hệ tuyến tính. Khi hẹp ĐMV, góc tạo bởi đường chéo và áp lực giảm xuống. CFR định nghĩa là lưu lượng máu tối đa chia cho lưu lượng máu khi nghỉ. Lưu lượng máu tối đa phụ thuộc vào huyết áp. Lưu lượng máu khi nghỉ thay đổi theo nhịp tim, co bóp cơ tim. (Chú thích: Stenosis: Hẹp; No stenosis: Không hẹp)
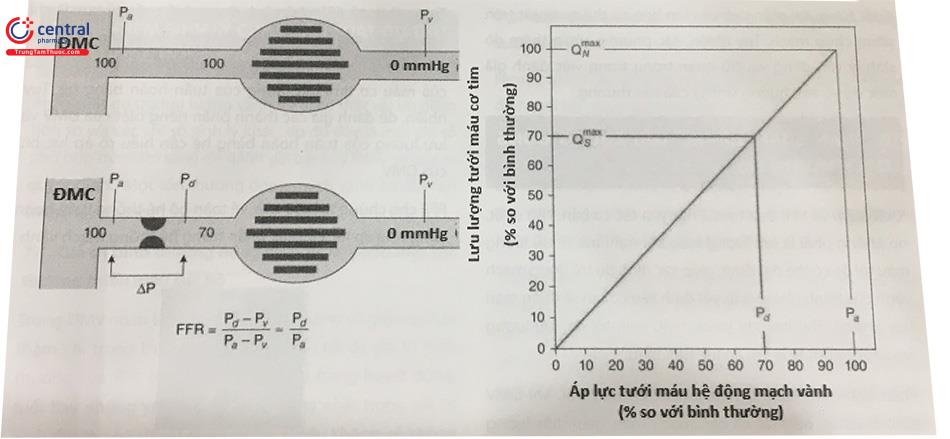
Bên trái: ĐM thượng tâm mạc và giường mạch máu được mô tả. Bình thường, khi không hẹp, áp lực tưới máu thông thường khi giãn mạch là 100 mmHg. Khi có hẹp, áp lực đoạn xa ĐMV giảm xuống 70 mmHg. Do có sự tương quan tuyến tính giữa áp lực tưới máu với lưu lượng máu khi giãn mạch (hình bên phải), điều này có nghĩa là tưới máu cơ tim tối đa nếu giảm 70% trong trường hợp có hẹp mạch vành. Thực tế, tỉ suất lưu lượng máu khi giãn mạch tương quan với tỷ suất áp lực tưới máu và FFR được biểu thị là áp lực tưới máu đoạn xa khi mạch máu bị hẹp (Pd) chia cho áp lực tưới máu trong trường hợp bình thường (Pa). FFR = 0,7 có nghĩa là khi có hẹp ĐMV thượng tâm mạc, dòng máu tối đa cấp cho ĐMV này đã giảm còn 70% giá trị bình thường. Vì vậy, FFR là thông số đặc hiệu của mức độ hẹp chức năng của hẹp ĐMV
1.7 Nội mạc mạch máu và sự phát triển của xơ vữa
Giai đoạn sớm của bệnh lý xơ vữa ĐMV là quá trình suy giảm chức năng nội mạc. Do tương tác với một số yếu tố kích thích cơ học hoặc thể dịch, tế bào nội mạc sản xuất nitric oxide (NO) gây giãn tế bào cơ trơn và giãn mạch làm tăng dòng máu trong ĐMV. Điều này có thể chứng minh bằng cách khi thêm acetylcholin. Nếu nội mạc khỏe mạnh, acetylcholin cũng làm tăng sản xuất NO và tăng lưu lượng mạch vành. Acetylcholine cũng có tác dụng gây co thắt tế bào cơ trơn nhưng ở những người khỏe mạnh, tác dụng này yếu hơn so với tác dụng giãn mạch qua trung gian NO. Nếu nội mạc bệnh lý, tác dụng co mạch trực tiếp chiếm ưu thế, vì thế còn gọi là co mạch nghịch thường. Phương pháp này có thể được sử dụng trong các phòng thí nghiệm can thiệp để chứng minh suy giảm chức năng nội mạc. Do test này thực hiện bằng cách tiêm không chọn lọc acetylcholine vào lòng ĐMV dưới sự kiểm soát nhưng không phải không có nguy cơ nên chỉ được tiến hành ở các phòng thí nghiệm can thiệp chuyên biệt.
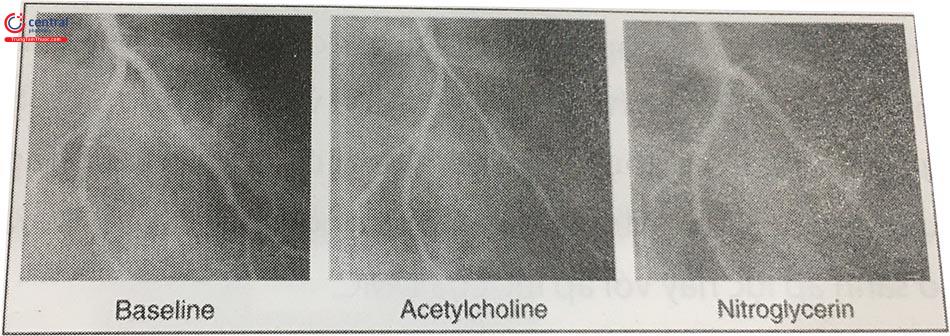
Nitroglycerin được thêm vào để giảm tác dụng của acetylcholin. Trong các giai đoạn tiến triển tiếp theo của bất thường chức năng nội mạc và phát triển của mảng xơ vữa, các tổn thương xơ vữa lan tỏa thường không quan sát thấy trên phim chụp mạch nhưng có thể chứng minh trên các phương pháp giải phẫu như siêu âm trong lòng mạch (intravascular ultrasound – IVUS), OCT (optical coherence tomography) hoặc phương pháp thăm dò sinh lý đánh giá phân suất dự trữ lưu lượng động mạch vành (FFR).
Cuối cùng, khi mảng xơ vữa lớn hơn có thể quan sát trên phim chụp mạch. Tuy nhiên, các phương pháp thăm dò sinh lý vẫn đóng vai trò quan trọng trong việc đánh giá mức độ và ảnh hưởng sinh lý của tổn thương.
1.8 Phân suất dự trữ lưu lượng động mạch vành (FFR)
Khái niệm về FFR dựa trên 2 nguyên tắc cơ bản. Thứ nhất, nó không phải là lưu lượng máu khi nghỉ mà là lưu lượng máu tối đa có thể đạt được giúp xác định dự trữ động mạch vành của bệnh nhân và quyết định liệu cơ tim sẽ thiếu máu hay không. Thứ hai, khi mạch máu giãn tối đa, lưu lượng máu tới cơ tim tỷ lệ với áp lực tưới máu.
Phân tích hình 4.21: Ở hình phía trên bên trái, khi ĐMV bình thường, nếu tất cả các mạch máu giãn, lưu lượng máu trong ĐMV sẽ tỷ lệ với áp lực ĐMC (Pa) trừ đi áp lực tĩnh mạch trung tâm (Pv) – thường đặt bằng 0 với trường hợp bình thường. Ở hình phía dưới, khi có hẹp ĐMV một phần áp lực bị giảm đi. Như ở trên, áp lực tưới máu giảm xuống 70 mmHg. Do tương quan tuyến tính giữa áp lực tưới máu và lưu lượng máu trong ĐMV, lưu lượng máu tối đa đạt được trong trường hợp bệnh lý giảm tới 70% giá trị bình thường. Nói cách khác, tỉ lệ về lưu lượng dòng máu tối đa biểu hiện tương quan với tỉ lệ về áp lực tưới máu. Ngược với lưu lượng máu, áp lực có thể đo dễ dàng bằng dây dẫn nhận cảm áp lực kích thước 0,03 cm. Vì vậy, FFR được đánh giá dễ dàng trong thực hành bằng một đầu dò áp lực đo áp lực đoạn xa ĐMV (Pd) sau khi kích thích giãn mạch tối đa và so sánh áp lực này với áp lực của ĐMC.
Trong thực tế, FFR phản ánh được nhiều yếu tố hơn là chỉ ảnh hưởng của mức độ hẹp ĐMV lên lưu lượng ĐMV. Nó có thể biểu hiện lưu lượng tối đa ĐMV, lưu lượng tối đa của máu cơ tim, lưu lượng của tuần hoàn bàng hệ. Tuy nhiên, để đánh giá các thành phần riêng biệt của ĐMV và lưu lượng của tuần hoàn bàng hệ cần hiểu rõ áp lực bít của ĐMV. FFR cho chúng ta hiểu biết về toàn bộ hệ thống tuần hoàn cũng như áp lực của các phần trong hệ thống mạch vành .
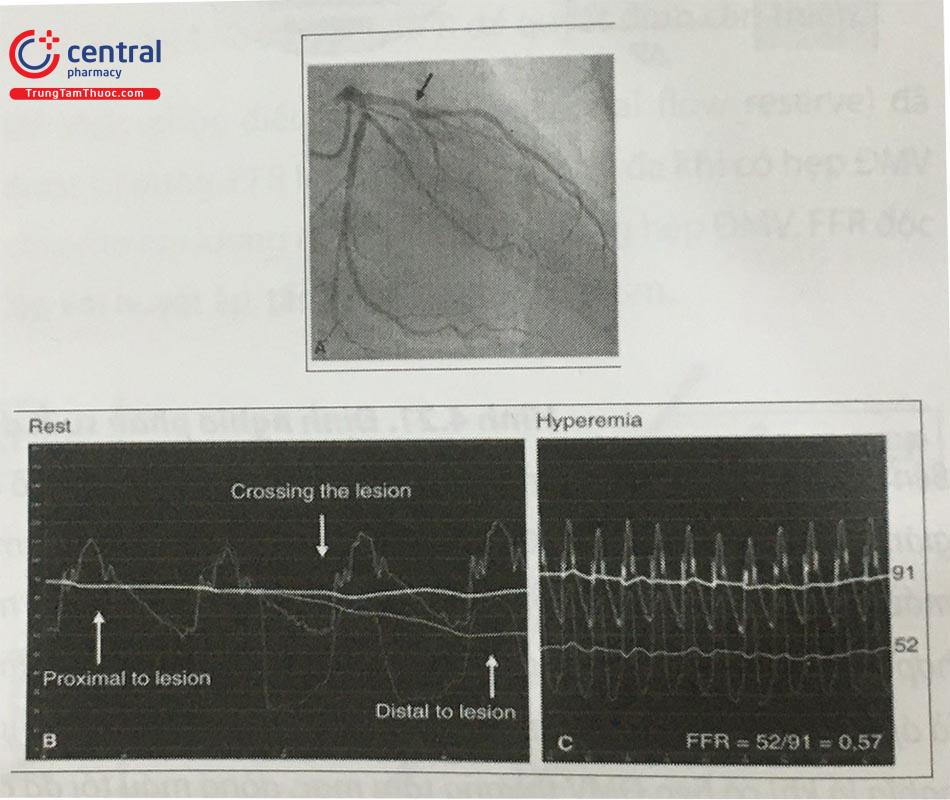
Chú thích: Proximal to lesion: đoạn gần của tổn thương, Distal to lesion: đoạn xa của tổn thương, Crossing to lesion: đi qua tổn thương, Rest: khi nghỉ, Hyperemia: khi sung huyết (Giãn mạch)
1.9 Đặc điểm sinh lý của phân suất sự trữ lưu lượng động mạch vành
Phân suất dự trữ lưu lượng vành (FFR) có một vài ưu điểm hơn so với các chỉ số sinh lý khác, do đó đây là một chỉ số phù hợp trên lâm sàng để đánh giá bệnh lý ĐMV và đưa ra quyết định: “Một tổn thương động mạch vành có cần can thiệp hay không?”
1.9.1 Giá trị bình thường đồng nhất và sự phân biệt tổn thương thiếu máu cục bộ
Trong ĐMV hoàn toàn bình thường, không có giảm áp lực, thậm chí trong trường hợp giãn mạch tối đa giá trị bình thường của FFR bằng 1,0 bất kể tình trạng huyết động, tuổi hay những yếu tố khác. Sự thống nhất trong giá trị bình thường này là rất quan trọng, vì nếu không, sẽ không thể định nghĩa được giá trị ngưỡng của thiếu máu.
Giá trị ngưỡng của thiếu máu cục bộ của FFR là 0,8. Trong thực hành lâm sàng, sẽ hợp lý nếu can thiệp một tổn thương hẹp nếu FFR ≤ 0,8 và điều trị nội khoa nếu FFR > 0,8.
1.9.2 Mối liên quan giữa kích cỡ mạch máu và cùng tưới máu
Ngược lại với các phương pháp thăm dò hình ảnh, FFR xác định mối liên quan giữa mức độ nặng của hẹp ĐMV và kích thước vùng tưới máu. Điều này rất quan trọng trong đánh giá mức độ nặng của hẹp sau biến cố nhồi máu cơ tim. Hai ĐMV có thể có mức độ hẹp giống nhau, với đặc điểm hình thái như nhau nhưng mức độ nặng về mặt chức năng sẽ thay đổi nếu diện tưới máu khác nhau.
Trong trường hợp hai tổn thương gây ra mức độ hẹp như nhau nhưng một trong hai có diện tưới máu đoạn xa lớn hơn, đáp ứng phản ứng giãn mạch khi tim sung huyết sẽ lớn hơn và FFR sẽ thấp hơn. Điều này giải thích tại sao, sau NMCT, tổn thương nhìn hẹp nặng lại có FFR cao trong khi với mức độ hẹp tương tự và không có NMCT trước đó lại có FFR thấp hơn. Điều này cũng giải thích tại sao tổn thương hẹp vừa ĐMV với diện tưới máu lớn, gồm cả vùng cơ tim được THBH, có thể biểu hiện giảm FFR đáng kể, trong khi nó sẽ giảm ít hơn nếu không có THBH.

Trong cả 2 trường hợp ở trên, mức độ hẹp là như nhau đánh giá bằng phương tiện chẩn đoán hình ảnh. Tuy nhiên, ở hình phía trên, diện tưới máu lớn hơn, đáp ứng với phản ứng giãn mạch lớn hơn khi giãn mạch nhiều hơn và FFR sẽ thấp hơn so với trường hợp có diện tưới máu giảm (sẹo nhồi máu cơ tim – hình phía dưới)
1.9.3 FFR không phụ thuộc huyết áp, tần số tim và sức co bóp cơ tim
FFR không phụ thuộc vào sự thay đổi huyết động như: tần số tim, huyết áp, sức co bóp cơ tim.
1.9.4 Tuần hoàn bàng hệ
FFR đánh giá ảnh hưởng của tuần hoàn bàng hệ (THBH).
Thực tế, sự đóng góp của THBH vào lưu lượng của ĐMV đối với cơ tim có thể tính toán qua thông số áp lực, với áp lực bít đã biết.
Nếu THBH phong phú, tại vị trí hẹp có thể có FFR cao, trong khi nếu không có THBH, FFR có thể thấp.
1.9.5 Vấn đề sung huyết (giãn mạch) tối đa
Khi giãn mạch (hay sung huyết) tối đa, FFR là một chỉ số tin cậy cho thiếu máu cục bộ.

Chú thích: ¯ Giãn mạch, Co mạch, IC (intracoronary injection) tiêm trong lòng mạch vành
Mặc dù có nhiều cách để gây tăng giãn mạch ở phòng can thiệp, nhưng cần được tiến hành với quy trình được xây dựng tốt để đảm bảo an toàn. Để đơn giản, gần đây người ta đã đề xuất bỏ đo các thông số khi giãn mạch và chỉ tiến hành đo khi nghỉ. Một vài chỉ số khi nghỉ được đưa ra như Pd/Pa khi nghỉ, gọi là iFR – tỉ số lặng sóng tức thời (instantaneous wave-free ratio). Theo luật Poiseuille và được chứng minh ở trên động vật và con người, chênh áp thấp qua chỗ hẹp kèm theo chênh áp cao khi giãn mạch (hay sung huyết) tối đa gặp ở những bệnh nhân trẻ, bệnh nhân có tổn hẹp nặng trên đoạn ngắn hoặc có tổn thương gần với diện tưới máu lớn, trong khi chênh áp trung bình khi giãn mạch (phản ứng ứ huyết) mức độ vừa có thể được quan sát thấy ở bệnh nhân lớn tuổi hoặc bệnh nhân có tổn thương đoạn xa hay đoạn động mạch vành nhỏ.
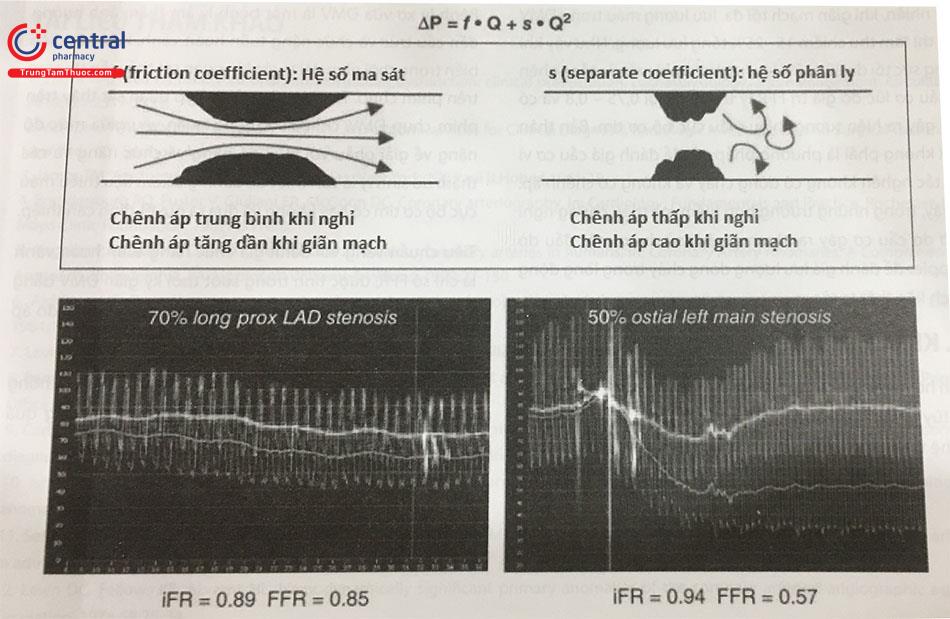
Theo định luật Poiseuille, chênh áp qua chỗ hẹp liên quan tuyến tính với lưu lượng theo hàm bậc 2, đại diện là hệ số ma sát (friction coefficient kí hiệu là f) và hệ số phân ly (separate coefficient kí hiệu là s). Ở một vài tổn thương, ma sát đóng vai trò chủ yếu chênh áp trung bình khi nghỉ sẽ tăng lên vừa phải khi sung huyết (hay giãn mạch). Ở phía cuối của phổ theo dõi, khi lực phân ly chiếm ưu thế, chênh áp thấp khi nghỉ có thể kèm theo chênh áp rất cao khi sung huyết. Trường hợp này đặc biệt gặp ở người trẻ với tổn thương ngắn ở đoạn gần ĐMV lớn với diện tưới máu rộng.
Chú thích: 70% long proximal LAD stenosis: Hẹp 70% đoạn đầu LAD; 50% ostial left main stenosis: Hẹp 50% lỗ vào thân chung động mạch vành
Một vài biểu hiện đặc biệt của bệnh lý động mạch vành
1.9.6 Tổn thương lan tỏa ĐMV và bệnh lý vi mạch
Dự trữ lưu lượng vành (coronary flow reserve- CFR) và phân suất dự trữ lưu lượng vành (FFR) thường được cho rằng dùng để đánh giá tổn thương ở một hoặc một vài vị trí hẹp khu trú. Tuy nhiên, xơ vữa là một quá trình bệnh lý lan tỏa và bất thường sẽ có ở toàn bộ chiều dài ĐMV, và có thể nhận thấy trên các thăm dò IVUS hoặc OCT.
Bệnh lý vi mạch cũng ảnh hưởng đến cả CFR và FFR. Một vài chỉ số được đưa ra để đánh giá bệnh lý vi mạch (như chỉ số sức cản hệ thống vi mạch). Tuy nhiên, sự quan trọng và phổ biến của bệnh lý vi mạch không nên được đánh giá quá mức. Phần lớn bệnh nhân đau thắt ngực bao gồm nhồi máu cơ tim và tổn thương khu trú, biện pháp đặt stent hoặc phẫu thuật bắc cầu chủ – vành mang đến cải thiện về triệu chứng thiếu máu cục bộ, điều đó nghĩa là tổn thương ĐMV thượng tâm mạc vẫn là yếu tố chủ đạo.
1.9.7 Cầu cơ ĐMV
Khi chụp ĐMV, đôi khi cầu cơ LAD được ghi nhận trong thì tâm thu do một đoạn ĐMV nằm ở một phần dưới cơ tim. Biểu hiện lâm sàng của nó thường ít và các triệu chứng lâm sàng thường không rõ ràng.
Triệu chứng do cầu cơ chỉ có thể biểu hiện trong quá trình kích thích giao cảm. Điều này có nghĩa rằng nếu triệu chứng xuất hiện khi nghỉ không nên quy cho cầu cơ vì lưu lượng ĐMV khi nghỉ chủ yếu trong thì tâm trương.
Tuy nhiên, khi giãn mạch tối đa, lưu lượng máu trong ĐMV trái thì tâm thu chiếm 15 – 25% tổng lưu lượng. Như vậy khi gắng sức tối đa 20 – 25% lưu lượng này bị mất do tắc nghẽn vì cầu cơ lúc đó giá trị FFR lý thuyết dưới 0,75 – 0,8 và có thể gây ra hiện tượng thiếu máu cục bộ cơ tim. Bản thân FFR không phải là phương pháp tốt để đánh giá cầu cơ vì khi tắc nghẽn không có dòng chảy và không có chênh áp. Vì vậy, trong những trường hợp hiếm mà triệu chứng nghi ngờ do cầu cơ gây ra, thường phải sử dụng một đầu dò Doppler để đánh giá lưu lượng dòng chảy trong lòng động mạch liên thất trước.
2 Kết luận
Tuần hoàn ĐMV được tạo ra để cân bằng cung – cầu oxy cơ tim tùy theo điều kiện sinh lý. Sự cân bằng này được duy trì bởi hệ thống tự điều hòa.
Bệnh lý xơ vữa ĐMV là một bệnh lý âm thầm ảnh hưởng đến cấu trúc và chức năng tuần hoàn vành. Hầu hết diễn biến trong thời gian dài trước khi quan sát thấy tổn thương trên phim chụp. Trong trường hợp hẹp quan sát thấy trên phim chụp ĐMV, chỉ có sự tương quan yếu giữa mức độ nặng về giải phẫu với mức độ nặng về chức năng và các thăm dò sinh lý là cần thiết để đánh giá xem liệu thiếu máu cục bộ cơ tim có hay không và đưa ra quyết định can thiệp.
Tiêu chuẩn vàng với đánh giá chức năng tuần hoàn vành là chỉ số FFR, được tính trong suốt thời kỳ giãn ĐMV bằng việc dùng dây dẫn nhận cảm áp lực (pressure wire) đo áp lực ĐMV đoạn xa và so với áp lực đoạn gần.
FFR cho phép đánh giá dễ dàng chức năng của hệ thống động mạch vành trong thực hành cũng như trong quá trình can thiệp.
3 Tài liệu tham khảo
1. Lanza GA, Crea Primary coronary microvascular dysfunction: clinical presentation, pathophysiology, and management. Circulation. 2010;121:2317-2325.
2. McAlpine Heart and Coronary Arteries: An Anatomical Atlas for Clinical Diagnosis, Radiologic Investigation, and Surgical Treatment. New York, NY: Springer-Verlag; 1975:10.
3. James Anatomy of the Coronary Arteries. New York, NY: Paul B.Hober; 1961:25.
4. Brandenburg RO, Fuster V, Giuliani ER, McGoon DC. Coronary arteriography. In: Cardiology: Fundamentals and Practice. Rochester, MN: Mayo Clinic Foundation; 1987:451-470.
5. Angelini P, Villason S, Chan Normal and anomalous coronary arteries in humans. In: Coronary Artery Anomalies: A Comprehensive Approach. Philadelphia, PA: Lippincott Williams & Wilkins; 1999:27-150.
6. Aldridge HE. Decade or more cranial and caudal angulated projections in arteriography: another look. Cathet Cardiovasc Diagn. 1984;10:539-542.
7. Levin DC. Pathways and functional significance of the coronary collateral circulation. Circulation. 1974;50:831-837.
8. Baroldi G, Scomazzon G. Coronary Circulation in the Normal Heart and the Pathologic Heart. Washington, DC: US Government Printing Office; 1967:22.
9. Corban MT, Hung OY, Eshtehardi P, et al. Myocardial bridging: contemporary understanding of pathophysiology with implications for diagnostic and therapeutic strategies. J Am Coll Cardiol. 2014;63:2346-2355.
10. Ishikawa T, Brandt Anomalous origin of the left main coronary artery from the right aortic sinus: angiographic definition of anomalous course. Am J Cardiol. 1985;55:770-776.
11. Serota H, Barth CW 3rd, Seuc CA, Vandormael M, Aguirre F, Kern MJ. Rapid identification of the course of anomalous coronary arteries in adults: the “dot and eye” Am J Cardiol. 1990;65:891-898.
12. Levin DC, Fellows KE, Abrams HL. Hemodynamically significant primary anomalies of the coronary arteries: angiographic aspects. Circulation. 1978;58:25-34.
13. Click RL. Anomalous coronary arteries: location, degree of atherosclerosis, and effects on survival. A report from the coronary artery surgery study. J Am Coll Cardiol. 1989;13:531-537.
14. Donaldson RM, Raphael MJ. Missing coronary artery. Review of technical problems in coronary arteriography resulting from anatomical variants. Br Heart J. 1982;47:62-70.
15. Wald S, Stonecipher K, Baldwin Anomalous origin of the right coronary artery from the pulmonary artery. Am J Cardiol. 1971;27: 677-681.
16. Lipton MJ, Barry WH, Obrez I, Silverman JF, Wexler L. Isolated single coronary artery: diagnosis, angiographic classification, and clinical significance. Radiology. 1979;130:39-47.
17. D’Amore PA, Thompson Mechanisms of angiogenesis. Annu Rev Physiol. 1987;49:453-464.
18. Rogers WJ, Hood WP Jr, Mantle JA, et al. Return of left ventricular function after reperfusion in patients with myocardial infarction: importance of subtotal stenoses or intact collaterals. Circulation. 1984;69:338-349.
19. Hirai T, Fujita M, Nakajima H, et al. Importance of collateral circulation for prevention of left ventricular aneurysm formation in acute myocardial infarction. Circulation. 1989;79:791-796.
20. Habib GB, Heibig J, Forman SA, et al. Influence of coronary collateral vessels on myocardial infarct size in humans. Results of phase I Thrombolysis in Myocardial Infarction (TIMI) The TIMI Investigators. Circulation. 1991;83:739-746.
21. Hanse Coronary collateral circulation: clinical significance and influence on survival in patients with coronary artery occlusion. Am Heart J. 1989;117:290-295.
22. Rentrop KP, Cohen M, Blanke H, Phillips RA. Changes in collateral channel filling immediately after controlled coronary artery occlusion by an angioplasty balloon in human subjects. J Am Coll Cardiol. 1985;5:587-592.
23. Pijls NH, Bech GJ, el Gamal MI, et al. Quantification of recruitable coronary collateral blood flow in conscious humans and its potential to predict future ischemic events. J Am Coll Cardiol. 1995;25:1522-1528.
24. Matsuo H, Watanabe S, Kadosaki T, et al. Validation of collateral fractional flow reserve by myocardial perfusion imaging. Circulation. 2002;105:1060-1065.
25. Van Liebergen RA, Piek JJ, Kock KT, de Winter RJ, Schotborgh CE, Lie Quantification of collateral flow in humans: a comparison of angiographic, electrocardiographic and hemodynamic variables. J Am Coll Cardiol. 1999;33:670-677.
26. Thompson AJ, Froelicher Kugel’s artery as a major collateral channel in severe coronary disease. Aerosp Med. 1974;45:1276-1280.

