Động học lactate - một marker của tưới máu: phân tích sinh lý và cạm bẫy

Tác giả: Bruno Levy1,4,5*, Glenn Hernandez3, Fabio Taccone2
Người dịch: BS Nguyễn Thanh Tuấn – khoa ICU Bệnh viện Hữu Nghị Đa Khoa Nghệ An.
Tải PDF bản dịch TẠI ĐÂY
Nồng độ Lactate trong máu là 1 trong những biomarkers được sử dụng rộng rãi nhất trong chăm sóc tích cực; sự gia tăng của nó theo truyền thống được coi là dấu hiệu đặc trưng của tình trạng giảm oxy hoá mô. Tình trạng tăng Lactate kéo dài có liên quan chặt chẽ đến các kết quả bệnh lý ở những bệnh nhân nặng [1]. Tuy nhiên, điều hòa chuyển hóa Lactate phức tạp hơn hệ quả của quá trình đường phân kị khí đơn thuần. Ví dụ, động học Lactate, tức là, mức độ tiến triển theo thời gian như thế nào, cung cấp cái nhìn sâu sắc hơn về tình trạng sinh lý của bệnh nhân so với các phép đo tại 1 thời điểm đơn lẻ.
Bài viết này xem xét cơ sở sinh lý, ứng dụng lâm sàng và phân tích những thách thức trong theo theo dõi Lactate ở bệnh nhân nặng.
1 Lactate: Không chỉ là giảm oxy mô
Lactate không chỉ là điểm cuối của chuyển hóa kị khí, nó cũng được sản xuất nhiều trong điều kiện hiếu khí. Bối cảnh liên quan với tăng nhu cầu chuyển hóa hoặc kích thích adrenegic có thể dẫn đến sự gia tăng đột biến dòng đường phân, vượt quá khả năng oxy hóa của ty thể, dẫn đến sự chuyển pyruvate thành Lactate mặc dù cung cấp oxy thích hợp. Quá trình này gọi là đường phân hiếu khí, được quan sát phổ biến trong sepsis, chấn thương và các tình trạng stress cao độ khác [2]. Do đó, tăng Lactate có thể do nhiều cơ chế (bảng bổ sung 1), bao gồm giảm oxy mô do giảm cung cấp oxy hoặc giảm khả năng chiết tách, gia tăng đường phân (thúc đẩy bởi hoạt động adrenergic, trong sepsis, sau khi dùng các tác nhân chủ vận B2, tăng hoạt động chuyển hóa (trong sốt), giảm thanh thải (chủ yếu trong suy gan, nhưng cũng thứ phát do giảm chức năng thận và/hoặc rối loạn chức năng cơ, hoặc giảm chuyển hóa mô (rối loạn chức năng ty thể tác động đến oxy hóa pyruvate trong sepsis hoặc ngộ độc thuốc) [3].
Tăng nồng độ Lactate có thể xảy ra trong bối cảnh vắng mặt giảm tưới máu mô, điều này nhấn mạnh cần phải giải thích bối cảnh lâm sàng cẩn thận (khám lâm sàng, đánh giá rối loạn chức năng cơ quan, các dấu hiệu sinh học khác của tình trạng thiếu oxy mô) để tránh các lỗi chẩn đoán hoặc liệu pháp sai lầm.
2 Theo dõi động học và phân tích xu hướng.
Mặc dù nồng độ Lactate đơn độc trong ICU có giá trị tiên lượng [4], đo chuỗi Lactate cung cấp đánh giá chính xác hơn về “quỹ đạo” của bệnh. Giảm Lactate (không phải "thanh thải" - ngụ ý không sản xuất thêm Lactate mà chỉ loại bỏ nó khỏi cơ thể con người), thường được đánh giá theo tỷ lệ % trong 6–24 giờ so với ban đầu, là một chỉ điểm mạnh hơn về sự cải thiện hoặc xấu đi về mặt lâm sàng. Giảm nhanh chóng thường cho thấy tình trạng sốc được giải quyết, phục hồi tưới máu mô hoặc cải thiện chức năng trao đổi chất [6]. Ngược lại, mức độ tăng hoặc tăng dai dẳng có thể chỉ ra tình trạng giảm tưới máu mô đang diễn ra, chuyển hóa tế bào bị suy yếu và/hoặc điều trị thất bại. [7]. Trong quản lý sốc, việc giảm Lactate sớm ≥ 10–20% mỗi giờ có liên quan đến kết quả được cải thiện, thường vượt trội hơn các ngưỡng giá trị tĩnh [8]. Tuy nhiên, những nỗ lực điều trị chỉ nhằm mục đích bình thường hóa Lactate có thể dẫn đến hồi sức quá mức, quá tải dịch hoặc sử dụng thuốc co mạch quá mức. [3].
Do đó, việc giảm Lactate cũng nên được diễn giải trong bối cảnh lâm sàng rộng hơn (Hình 1). Ví dụ, 1 bệnh nhân sepsis có nồng độ Lactate máu giảm từ 8,3 xuống 3,2 mmol/L sau khi hồi sức ban đầu, và không có dấu hiệu lâm sàng cho thấy tình trạng giảm tưới máu mô đang diễn ra., không nên can thiệp điều trị thêm dù nồng độ Lactate vẫn trên 2mmol/L trong những trường hợp như vậy, có thể xảy ra xu hướng giảm liên tục, và các can thiệp sâu hơn có thể không cần thiết và có nguy cơ gây hại. Quan trọng là, giảm Lactate có thể chậm hơn so với cải thiện các markers tưới máu khác (ví dụ ScvO₂ hoặc khoảng trống PCO₂), và các bác sĩ lâm sàng nên nhận thức được sự phân ly tạm thời này.
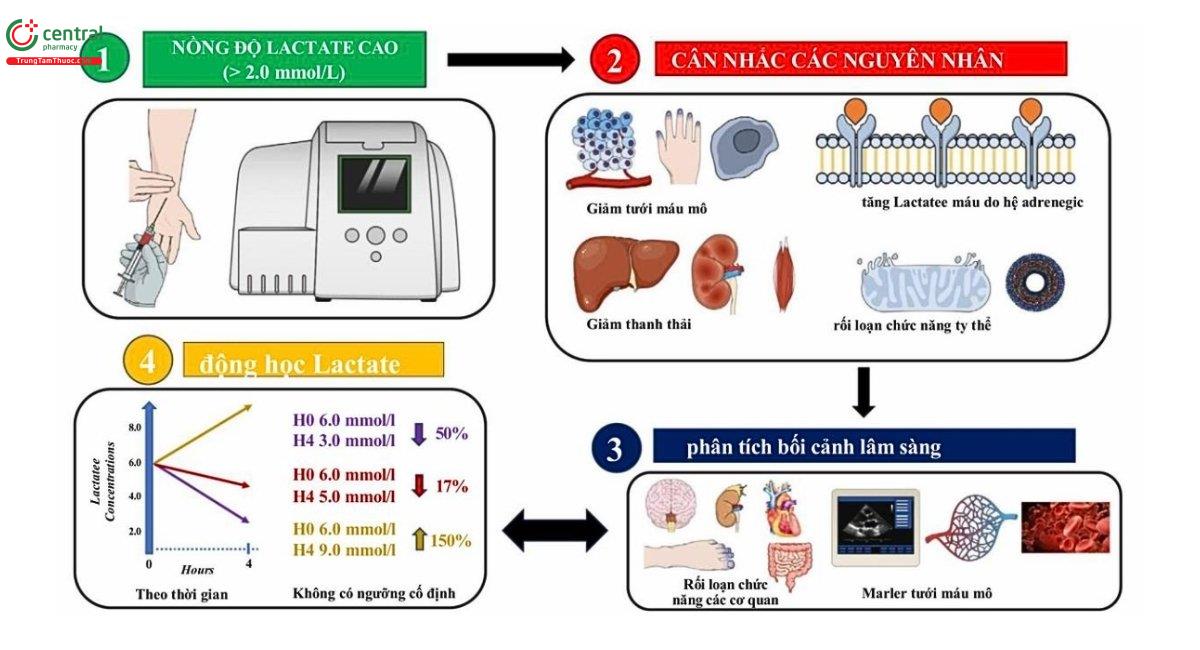
Hình 1. Minh họa các cơ chế đa yếu tố cơ bản gây tăng Lactate máu ở bệnh nhân bệnh nặng và tầm quan trọng của việc diễn giải giá trị Lactate một cách linh hoạt. Nồng độ Lactate trong máu tăng cao (> 2,0 mmol/L) có thể là kết quả của tình trạng giảm tưới máu mô, phân giải đường hiếu khí do adrenergic, giảm thanh thải (ví dụ: rối loạn chức năng gan) hoặc suy giảm chức năng ty thể. Do đó, Lactate luôn phải được diễn giải trong bối cảnh lâm sàng của nó, kết hợp với các dấu hiệu rối loạn chức năng cơ quan và các chỉ số tưới máu mô khác. Không có ngưỡng cố định nào phân biệt đáng tin cậy giữa trạng thái lành tính và trạng thái bệnh lý. Thay vào đó, động học học Lactate, thu được từ các phép đo nối tiếp, cung cấp nhiều thông tin tiên lượng hơn. Ví dụ, việc giảm từ 6,0 xuống 3,0 mmol/L trong vòng 4 giờ phản ánh một “quỹ đạo” thuận lợi (giảm 50%), trong khi các giá trị ổn định (6,0 xuống 5,0 mmol/L, giảm 17%) hoặc mức tăng (6,0 đến 9,0 mmol/L, tăng 150%) cho thấy quá trình bệnh đang diễn ra hoặc trở nên tồi tệ hơn. Theo dõi xu hướng thay vì các giá trị riêng lẻ cho phép tích hợp Lactate một cách tinh tế và an toàn hơn vào các chiến lược quản lý sốc.
3 Động học Lactate trong các loại sốc khác nhau.
Việc giảm nồng độ Lactate có thể phụ thuộc vào loại sốc gây ra. Trong sốc nhiễm khuẩn, tăng Lactate thường phản ánh sự kết hợp của giảm oxy mô, tăng chuyển hóa và kích thích β-adrenergic. Mức độ giảm thường chỉ ra sự cải thiện tưới máu và giải quyết các đáp ứng stress [9]. Trong sốc tim hoặc sốc tắc nghẽn, tăng Lactate ban đầu do giảm tưới máu hệ thống và đóng vai trò là một marker tiên lượng mạnh; quá trình giảm có thể chậm mặc dù huyết động ổn định, đặc biệt khi có mặt suy gan hoặc phụ thuộc vào việc giải quyết nguyên nhân (thuyên tắc phổi, chèn ép tim) [10].
Trong sốc giảm thể tích, Lactate tương quan tốt với trạng thái tuần hoàn và luôn bình thường hóa nhanh chóng khi bù dịch thích hợp [11]. Lưu ý, ở những bệnh nhân đang trải qua liệu pháp thay thế thận (RRT), Lactate có thể bị giảm một cách “nhân tạo” tùy thuộc vào đặc điểm của màng và lưu lượng, điều này làm việc giải thích phức tạp hơn.
4 Các cạm bẫy phổ biến trong phân tích.
Một cạm bẫy lớn đó là quy kết một cách có hệ thống nồng độ Lactate trong máu cao do tình trạng thiếu oxy mô, trong khi các cơ chế khác (ví dụ, quá trình đường phân do sự thúc đẩy của adrenergic) thường gặp ở bệnh nhân nặng [12]. Một sai lầm phổ biến khác là quá phụ thuộc vào nồng độ Lactate trong máu như một dấu hiệu duy nhất của quá trình tưới máu mô. Về suy gan, mặc dù sự giảm thanh thải thường bị nhấn mạnh quá mức, nhưng sự gia tăng Lactate thường là kết quả của sự kết hợp giữa tăng sản xuất và giảm thanh thải. Suy gan nhẹ đến trung bình hiếm khi gây tăng Lactate máu đáng kể (> 4 mmol/L) nếu không kèm theo tăng sản xuất [13]. Cuối cùng, việc nhấn mạnh đến mục tiêu giảm Lactate như một điểm cuối cứng nhắc có thể dẫn đến hồi sức quá mức, khiến bệnh nhân có nguy cơ quá tải dịch hoặc dùng thuốc vận mạch quá mức.
Một cách tiếp cận an toàn hơn là kết hợp xu hướng Lactate với các dấu hiệu lâm sàng và huyết động khác (thời gian đổ đầy mao mạch, ScvO₂, khoảng trống PCO₂, tưới máu da) [7]
5 Các dấu hiệu tưới máu bổ sung
Do những hạn chế của nó, Lactate nên được sử dụng cùng với các thông số khác trong lâm sàng. Các thử nghiệm như ANDROMEDA-SHOCK [14] đề xuất rằng việc nhắm mục tiêu vào thời gian đổ đầy mao mạch có thể phù hợp hoặc hiệu quả hơn các chiến lược hồi sức được hướng dẫn bởi Lactate trong sốc nhiễm khuẩn.
Những đánh giá tại giường này thường đáp ứng nhanh hơn với các can thiệp và ít bị ảnh hưởng bởi chức năng gan hoặc tác dụng adrenergic. Thêm vào đó, khoảng trống PCO₂ tĩnh mạch - động mạch, kết hợp với tỉ lệ C(a–v)O₂ có thể giúp phân biệt tình trạng tăng Lactate máu liên quan đến tình trạng thiếu oxy mô với tình trạng tăng Lactate máu do cơ chế không thiếu oxy [15]. Mặc dù điểm cuối chính của ANDROMEDA-SHOCK là âm tính, các phân tích hậu kiểm cho thấy rằng chiến lược hướng dẫn bằng Lactate vẫn có thể cung cấp thông tin tiên lượng và lợi ích tiềm năng khi được tích hợp vào đánh giá đa phương thức.
6 Tích hợp lâm sàng
Chiến lược quản lý dịch cũng có thể ảnh hưởng đến động học của Lactate; chiến lược dịch hạn chế so với tự do cho thấy tác dụng khác nhau đối với việc giảm Lactate tùy thuộc vào lượng dịch được truyền vào [16].
Do đó, việc sử dụng hiệu quả việc theo dõi Lactate liên quan đến một phương pháp tiếp cận theo xu hướng và bối cảnh: (a) ưu tiên các xu hướng kết quả theo chiều dọc hơn các giá trị riêng lẻ; (b) tương quan Lactate với các dấu hiệu tưới máu khác và chức năng cơ quan; (c) cân nhắc các nguyên nhân không do giảm oxy mô khác gây tăng Lactate, như đáp ứng stress hoặc rối loạn chức năng gan; (d) tránh mục tiêu bình thường hóa một cách cứng nhắc, điều chỉnh các biện pháp can thiệp theo toàn bộ bức tranh lâm sàng.
7 Kết luận
Lactate vẫn là một biomarker nền tảng trong chăm sóc tích cực, nhưng việc phân tích nó cần sự hiểu biết sinh lý sâu sắc. Nó phản ánh sự tương tác phức tạp giữa tưới máu, chuyển hóa, chức năng cơ quan và đáp ứng stress thần kinh – nội tiết. Theo dõi động học Lactate bổ sung giá trị chẩn đoán và tiên lượng đáng kể, nhưng các bác sĩ lâm sàng phải luôn cảnh giác với các nguyên nhân không phải do thiếu oxy gây tăng, và chống lại sự thôi thúc điều trị quá mức chỉ dựa vào Lactate. Một phương pháp tiếp cận đa phương thức, đa sắc thái đảm bảo việc sử dụng dấu ấn sinh học quan trọng này một cách hiệu quả nhất và lấy bệnh nhân làm trung tâm. [17]
Supplementary Information
The online version contains supplementary material available at https://doi.org/10.1007/s00134-025-08140-4
Author details
1Médecine Intensive et Réanimation, CHRU Nancy, Pôle Cardio-Médico-Chirurgical, Vandoeuvre-Lès-Nancy, France. 2Departamento de Medicina Intensiva, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile. 3Department of Intensive Care, Hôpital Universitaire de Bruxelles (HUB), Université Libre de Bruxelles (ULB), Brussels, Belgium. 4INSERM U1116, Faculté de Médecine, Vandoeuvre-Lès-Nancy, France. 5Université de Lorraine, Nancy, France.
Funding
No funding sources.
Declarations
Conflicts of interest
BL reports grants from AOP Pharma, and personal fees from BD, Orion, and AOP Pharma outside the submitted work. GH and FC.
Research involving human and animal participants
Not applicable for the present manuscript.
8 Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Received: 28 August 2025 Accepted: 23 September 2025
References
- Vincent JL, Bakker J (2021) Blood lactate levels in sepsis: in 8 questions. Curr Opin Crit Care 27:298–302.
- Levy B (2006) Lactate and shock state: the metabolic view. Curr Opin Crit Care 12:315–321.
- Bakker J, Nijsten MW, Jansen TC (2013) Clinical use of lactate monitoring in critically ill patients. Ann Intensive Care 3:12.
- Bakker J, Coffernils M, Leon M, Gris P, Vincent JL (1991) Blood lactate levels are superior to oxygen-derived variables in predicting outcome in human septic shock. Chest 99:956–962.
- Levy B, Girerd N, Baudry G, Duarte K, Cuau S, Bakker J, Kimmoun A, group H-Et, the International EN (2024) Serial daily lactate levels association with 30-day outcome in cardiogenic shock patients treated with VA-ECMO: a post-hoc analysis of the HYPO-ECMO study. Ann Intensive Care 14:43.
- Nguyen HB, Rivers EP, Knoblich BP, Jacobsen G, Muzzin A, Ressler JA, Tomlanovich MC (2004) Early lactate clearance is associated with improved outcome in severe sepsis and septic shock. Crit Care Med 32:1637–1642.
- Hernandez G, Bellomo R, Bakker J (2019) The ten pitfalls of lactate clearance in sepsis. Intensive Care Med 45:82–85.
- Fuernau G, Desch S, de Waha-Thiele S, Eitel I, Neumann FJ, Hennersdorf M, Felix SB, Fach A, Böhm M, Poss J, Jung C, Ouarrak T, Schneider S, Werdan K, Zeymer U, Thiele H (2020) Arterial lactate in cardiogenic shock: prognostic value of clearance versus single values. JACC Cardiovasc Interv 13:2208–2216.
- Levy B, Desebbe O, Montemont C, Gibot S (2008) Increased aerobic glycolysis through β₂ stimulation is a common mechanism involved in lactate formation during shock states. Shock 30:417–421.
- Marbach JA, Stone S, Schwartz B, Pahuja M, Thayer KL, Faugno AJ, Chweich H, Rabinowitz JB, Kapur NK (2021) Lactate clearance is…Associated With Improved Survival in Cardiogenic Shock: A System- atic
- Review and Meta-Analysis of Prognostic Factor Studies, J Card Fail 27:1082— 1089. Rixen D, Siegel JH (2005) Bench-to-bedside review: oxygen debt and its metabolic correlates as quantifiers of the severity of hemorrhagic and post- traumatic shock. Crit Care 9:441—453
- Levy B, Gibot S, Franck P, Cravoisy A, Bollaert PE (2005) Relation between muscle Na+K+ ATPase activity and raised Lactatee concentrations in septic shock: a prospective study. Lancet 365:871—875
- Hemandez G, Bruhn A, Castro R, Regueira T (2012) The holistic view on perfusion monitoring in septic shock. Curr Opin Crit Care 18280286
- Hernandez G, Ospina-Tascon GA, Damiani LP, Estenssoro E, Dubin A, Hurtado J, Friedman G, Castro R, Alegria L, Teboul JL, Cecconi M, Ferri G, Jibaja M, Pairumani R, Fernandez P, Barahona D, Granda-Luna V, Cavalcanti AB, Bakker J, The ASI, the Latin America Intensive Care N, Hernandez G, Ospina-Tascon G, Petri Damiani L, Estenssoro E, Dubin A, Hurtado J, Fried- man G, Castro R, Alegria L,Teboul JL, Cecconi M, Cecconi M, Ferri G, Jibaja M, Pairumani R, Fernandez P, Barahona D, Cavalcanti AB, Bakker J, Heman- dez G, Alegria L, Ferri G, Rodriguez N, Holger P, Soto N, Pozo M, Bakker J, Cook D, Vincent JL, Rhodes A, Kavanagh BP, Dellinger P, Rietdijk W, Carpio D, Pavez N, Henriquez E, Bravo S, Valenzuela ED, Vera M, Dreyse J, Oviedo V, Cid MA, Larroulet M, Petruska E, Sarabia C, Gallardo D, Sanchez JE, Gonzalez H, Arancibia JM, Munoz A, Ramirez G, Aravena F, Aquevedo A, Zambrano F, Bozinovic M, Valle F, Ramirez M, Rossel V, Munoz P, Ceballos C, Esveile C, Carmona C, Candia E, Mendoza D, Sanchez A, Ponce D, Ponce D, Lastra J, Nahuelpan B, Fasce F, Luengo C, Medel N, Cortes C, Campassi L, Rubatto P, Horna N, Furche M, Pendino JC, Bettini L, Lovesio C, Gonzalez MC, Rodruguez J, Canales H, Caminos F, Galetti C, Minoldo E, Aramburu. MJ, Olmos D, Nin N, Tenzi J, Quiroga C, Lacuesta P, Gaudin A, Pais R, Silvestre A, Olivera G, Rieppi G, Berrutti D, Ochoa M, Cobos P, Vintimilla F, Ramirez V, Tobar M, Garcia F, Picoita F, Remache N, Granda V, Paredes F, Barzallo E, Garces P, Guerrero F, Salazar S, Torres G, Tana C, Calahorrano J, Solis F, Torres P, Herrera L, Omes A, Perez V, Delgado G, Lopez A, Espinosa E, Moreira J, Salcedo B, Villacres I, Suing J, Lopez M, Gomez L, Toctaquiza G, Cadena Zapata M, Orazabal MA, Pardo Espejo R, Jimenez J, Calderon A, Paredes G, Barberan JL, Moya T, Atehortua H, Sabogal R, Ortiz G, Lara A, Sanchez F, Hernan Portilla A, Davila H, Mora JA, Calderon LE, Alvarez. I, Escobar E, Bejarano A, Bustamante LA, Aldana JL (2019) Effect of a Resuscitation Strategy Targeting Peripheral Perfusion Status vs Serum Lactatee Levels on 28-Day Mortality Among Patients With Septic Shock: The ANDROMEDA-SHOCK Randomized Clinical Trial. JAMA 321:654—664
- Ospina-Tascon GA, Umana M, Bermudez W, Bautista-Rincon DF, Hernan- dez G, Bruhn A, Granados M, Salazar B, Arango-Davila C, De Backer D (2015) Combination of arterial Lactate levels and venous-arterial CO2 to arterial- venous O 2 content difference ratio as markers of resuscitation in patients with septic shock. Intensive Care Med 41:796—805
- Ahlstedt C, Sivapalan P, Kriz M, Jacobson G, Sylvest Meyhoff T, Skov Kaas- Hansen B, Holm M, Hollenberg J, Nalos M, Rooijackers 0, Hylander Moller M, Cronhjort M, Perner A, Grip J (2024) Effects of restrictive fluid therapy on the time to resolution of hyperLactateemia in ICU patients with septic shock. A secondary post hoc analysis of the CLASSIC randomized trial. Intensive Care Med 50:678—686
- Legrand M, van der Horst ICC, De Jong A (2024) Serial Lactatee measure- ments to guide resuscitation: more evidence not to? Intensive Care Med 50:728—730

