Định lượng Calprotectin trong phân để chẩn đoán và quản lý các bệnh viêm ruột

Bài gốc: Fecal Calprotectin for the Diagnosis and Management of Inflammatory Bowel Diseases - PMC (nih.gov)
Biên dịch: BS. Mai Xuân Sơn
Tải bản dịch TẠI ĐÂY
1 Một số thuật ngữ
IBD - inflammatory bowel disease – bệnh viêm ruột
UC - ulcerative colitis – viêm loét đại tràng
CD – Crohn’s disease – bệnh Crohn
FC – Fecal Calprotectin – Calprotectin trong phân
IBS - irritable bowel syndrome – Hội chứng ruột kích thích
2 Tóm tắt
Calprotectin là một protein liên kết với Canxi và Kẽm, nguồn gốc chủ yếu từ nguyên sinh chất của bạch cầu đa nhân trung tính, có chức năng kháng khuẩn trực tiếp và có vai trò điều hòa đáp ứng miễn dịch bẩm sinh. Nó có thể được tìm thấy trong các khoang sinh học khác nhau, đặc biệt là trong phân, với nồng độ liên quan tuyến tính đến mức độ viêm niêm mạc. Do đó, việc định lượng calprotectin trong phân đã được công nhận là dấu ấn sinh học hữu ích để phân biệt bệnh viêm ruột với hội chứng ruột kích thích. Hơn nữa, nó cho phép theo dõi mức độ viêm ruột với giá trị tiên đoán âm cao, giúp loại trừ chẩn đoán bệnh viêm ruột cho những bệnh nhân có triệu chứng. Nó cũng cho thấy độ nhạy cao trong việc xác định liệu bệnh nhân có cần đánh giá thêm, chẳng hạn như nội soi đường tiêu hóa và nó cũng giúp đánh giá đáp ứng điều trị, cung cấp bằng chứng về các đợt tái phát hoặc bằng chứng về sự phục hồi của niêm mạc, từ đây hướng dẫn quyết định điều trị tích cực hơn hay không. Vì nồng độ calprotectin là thước đo mức độ viêm niêm mạc, nồng độ cao của nó trong phân cũng xuất hiện trong các bệnh gây viêm khác, ví dụ như viêm ruột nhiễm trùng hoặc ung thư đại trực tràng. Do đó, việc diễn giải nồng độ FC phải luôn đặt trên bối cảnh lâm sàng, bệnh sử của bệnh nhân và các triệu chứng cụ thể.
Từ khóa: calprotectin, bệnh viêm ruột, bệnh Crohn, viêm loét đại tràng, dấu ấn sinh học, phân, điều trị thuốc cá thể hóa.
3 Giới thiệu
Calprotectin, một protein có trọng lượng phân tử 36-kDa liên kết với canxi và kẽm, thuộc họ protein S100. Phức hợp dị thể này bao gồm chuỗi nhẹ (S100A8) và hai chuỗi nặng (S100A9) với 93 và 113 axit amin tương ứng. Mỗi monome có thể liên kết với 2 ion Ca2+ có ái lực khác nhau và các cation hóa trị hai khác như Zn2+, Mn2+, Fe2+ và Ni2+ (1–3). Nó tồn tại trong tế bào chất bạch cầu trung tính, chiếm khoảng 5% tổng lượng protein và 30%–60% protein tế bào. Ngoài ra nó còn được tiết ra bởi các bạch cầu đơn nhân, tế bào có gai, đại thực bào được hoạt hóa, tế bào sừng và một số tế bào biểu mô niêm mạc, calprotectin đóng vai trò điều hòa miễn dịch thông qua tương tác với metallicoproteinase phụ thuộc kẽm, kích hoạt tổng hợp cytokine tiền viêm và điều hòa đường truyền tín hiệu tế bào liên quan đến miễn dịch bẩm sinh. Ở bên trong tế bào, nó sắp xếp lại các vi ống, thúc đẩy việc chiêu mộ bạch cầu, vận chuyển axid arachidonic đến các vị trí viêm và tạo ra các loại oxy phản ứng (3).
Khi được giải phóng vào môi trường ngoại bào, calprotectin xuất hiện trong huyết tương, nước tiểu, nước bọt, dịch ruột và phân. Nó thể hiện đặc tính kháng khuẩn trực tiếp bằng cách tạo ra các phức hợp với các ion Zn2+ và Mn2+, và làm mất đi nguồn dinh dưỡng này của vi sinh vật, cản trở sự phát triển tế bào (4). Nó góp phần gây viêm thông qua hóa hướng động bạch cầu trung tính và nồng độ calprotectin trong lòng ruột tương quan với sự di chuyển của bạch cầu hạt đến niêm mạc. Định lượng calprotectin trong phân (FC) nổi lên như một dấu ấn sinh học về mức độ viêm niêm mạc vào cuối những năm 1990, nó có mối tương quan chặt chẽ với sự bài tiết bạch cầu và hỗ trợ phân biệt bệnh viêm ruột (IBD) với hội chứng ruột kích thích (IBS). Định lượng FC được sử dụng để đánh giá mức độ nặng của bệnh, đáp ứng điều trị và nguy cơ tái phát trong quá trình theo dõi hoặc sau phẫu thuật. Đáng chú ý, nồng độ FC vẫn không bị ảnh hưởng trong quá trình viêm ngoài đường ruột. Bài viết này sẽ khám phá các khía cạnh của hiệu quả của xét nghiệm FC ứng dụng lâm sàng của nó.
Định lượng Calprotectin trong phân
Khi gắn kết với phân tử Calci, calprotectin sẽ thay đổi hình thái, điều này cho phép nó đề kháng với môi trường phân và vi khuẩn trong ruột. Cho dù những nghiên cứu ban đầu cho thấy mẫu phân sẽ ổn định tới 7 ngày ở nhiệt độ phòng, nhưng hiện tại thấy rằng tốt hơn hết là nên lưu trữ từ 2-3 ngày. Ưu tiên bảo quản ở nhiệt độ 4°C, tuy nhiên, có nhiều mâu thuẫn trong các kết quả nghiên cứu khi bảo quản lâu hơn 7 ngày, tùy vào kit xét nghiệm (6,7). Cuối cùng, lưu trữ mẫu phân ở nhiệt độ 4°C có vẻ là tốt nhất nếu định lượng Calprotectin trong vòng 1 tuần (6). Mẫu phân có thể được bảo quản ở nhiệt độ - 20°C với thời gian dài hơn, lên tới 1 năm và được báo cáo là không có sự thay đổi gì về nồng độ calprotectin trước và sau khi rã đông (8).
Lấy mẫu thường được thực hiện ngay tại nhà. Trong trường hợp này, bệnh nhân phải được tư vấn không chỉ về thời gian bản quản tối đa mà còn về tầm quan trọng của chất lượng mẫu xét nghiệm, đó là hoàn toàn không được dính tạp chất từ nước tiểu hoặc nước bồn cầu. Bệnh nhân nên được tư vấn rằng, phân lỏng không là chống chỉ định làm định lượng FC, đặc biệt thường gặp trường hợp bệnh nhân trong cơn cấp, đợt tái phát (flare-ups) của bệnh viêm ruột (IBD). Một số nghiên cứu báo cáo rằng, sự thay đổi nồng độ calprotectin của mỗi bệnh nhân phụ thuốc vào thời gian lấy mẫu (sáng, trưa hay chiều tối), khả năng cao là liên quan đến thời gian phân di chuyển trong ruột. Vì vậy, ưu tiên lấy mẫu xét nghiệm phân từ lần đi cầu đầu tiên trong ngày (9). Các kết quả xét nghiệm khác nhau trên cùng một bệnh nhân hiếm khi làm thay đổi chỉ định điều trị. Hơn nữa, không cần thiết và không có khuyến cáo làm xét nghiệm liên tục trong nhiều ngày liên tiếp (9). Một mẫu chỉ chứa vài gram phân là đủ làm xét nghiệm. Bất kể phương pháp định lượng, bước đầu tiên là luôn phải chuẩn bị trước khi lấy phân. Phương pháp “tiêu chuẩn vàng” là gồm cân lượng phân và làm loãng nó trong một lượng dung môi thích hợp. Bởi vì cách này rất tốn công và tốn thời gian nên đa số các nhà sản xuất lựa chọn cách sản xuất dụng cụ lấy mẫu. Tuy nhiên, các dụng cụ này khi dùng cho các mẫu phân lỏng, phân chứa dịch nhầy hay phân rất khô, có nguy cơ lấy mẫu không đủ, từ đây làm sai lệch kết quả định lượng.
Có nhiều xét nghiệm thương mại có thể được sử dụng, tất cả đều dựa trên phương pháp miễn dịch – enzyme, nhưng các xét nghiêm này vẫn chưa được chuẩn hóa. Xét nghiệm miễn dịch liên kết enzyme đã và đang được sử dụng trong nhiều năm. Nhưng vì tốn nhiều thời gian và nó cần phải làm nhiều lần, vì vậy phương pháp này đã bị thay thế bởi các phương pháp khác (huỳnh quang, hóa phát quang, đo độ đục miễn dịch,..vân vân) có khả năng tương thích với nhiều máy xét nghiệm và cho ra kết quả tùy theo mục đích. Tất cả các xét nghiệm đều sử dụng kháng thể đa dòng hoặc đơn dòng nhắm vào các nhiều epitop khác nhau của dị vòng, do đó điều này giải thích cho sự khác trong kết quả. Tuy nhiên, phương pháp thực hiện chẩn đoán là như nhau (10) và không có lí do gì để ưu tiên phương pháp này hơn phương pháp khác. Bởi vì thiếu đi sự chuẩn hóa, các xét nghiệm không thể hoán đổi cho nhau được. Hơn nữa, bệnh nhân phải được theo dõi bằng cùng một phương pháp, để mà giảm đi sai số. Ví dụ, kết quả nồng độ FC bị giảm sau khi định lượng bằng phương pháp khác, đây không phải là chỉ điểm của việc đáp ứng điều trị và ngược lại. Do đó, cần cảnh giác khi thay đổi phương pháp xét nghiệm. Test nhanh bằng sắc khí miễn dịch (trước đây là bán định lượng, sau này là định lượng) đã phát triển rất tốt, nhưng mà không nên được xem là ưu tiên hàng đầu, đặc biệt khi mà nồng độ calprotectin trong phân cao (9).
Tất cả đều khuyến cáo nồng độ calprotectin bình thường là 50 μg/g phân, áp dụng cho người lớn và trẻ em > 4 tuổi, không kể giới tính (8). Nồng độ FC ở mức trung bình, trên 100 μg/g, được xem là bình thường với đối tượng người già trên 65 tuổi (11). Nồng độ FC cao hơn ở sơ sinh, trẻ nhũ nhi và trẻ nhỏ (cao sinh lý) (12). Trong một cá thể, nồng độ FC cao và dao động nhiều, thể hiện tình trạng tăng thẩm thấu hoặc đáp ứng viêm-miễn dịch bị kích thích bởi sự cư trú của vi khuẩn vào đường ruột hay đáp ứng dị ứng với thức ăn (13). Nồng độ FC nên được diễn giải một cách cẩn thận khi đối tượng là trẻ em và một phòng Lab nên chọn được ngưỡng bình thường của xét nghiệm. Vì Calprotectin cũng được tìm thấy trong huyết tương khi cơ thể có hiện tượng viêm, câu hỏi được đặt ra ở đây là liệu máu trong đường ruột có thể làm thay đổi nồng độ FC phân hay là không. Tibble và cộng sự (14) chứng minh rằng, cần phải chảy máu đến khoảng 300 ml/24 giờ để nồng độ FC đạt 150 μg/g. Vì vậy, hiện tượng này không có ý nghĩa. Cuối cùng, có một số dữ liệu nói về vai trò của một số thuốc như NSAID, PPI, đây là những thuốc có thể làm tăng nồng độ FC. Nếu được, tốt nhất là nên dừng những thuốc này ít nhất 2 tuần trước khi làm định lượng FC (9).
4 Chỉ định và diễn giải kết quả của xét nghiệm định lượng FC
Bởi vì Sinh khả dụng đa dạng của Calprotectin, không ngạc nhiên khi đây là một dấu ấn có độ nhạy cao trong xác định và theo dõi sự viêm của đường ruột. Tuy nhiên, FC sẽ không giúp tìm ra nguyên nhân gây bệnh bởi vì nồng độ của nó tăng trong nhiều trường hợp có liên quan tới viêm (ví dụ như nhiễm trùng dạ dày ruột, polyp đại tràng và túi thừa đại tràng, ung thư đạ tràng, chảy máu dạ dày ruột, viêm đại tràng vi thể, viêm trực tràng sau xạ trị, viêm túi thừa, vân vân) (9). Cần cẩn trọng đối với những bệnh nhân được phẫu thuật nối ruột hay có hậu môn nhân tạo, đặc biệt nếu bệnh nhân có thêm tiêu chảy thì nồng độ FC có thể dao động rất lớn. Vì vậy, khi diễn giải kết quả nồng độ Calprotectin, cần phải xem xét bệnh sử, đặc điểm triệu chứng và những yếu tố khác có thể làm thay đổi kết quả xét nghiệm.
Chẩn đoán phân biệt giữa bệnh viêm ruột (IBD - Inflammatory bowel disease) và hội chứng ruột kích thích (Irritable bowel syndrome)
Tiêu chảy mạn tính là một trong những nguyên nhân đến khám thường gặp nhất của bệnh nhân. Vì vậy, việc phân biệt giữa hội chứng ruột kích thích với các bệnh viêm ruột là rất quan trọng. Hai thể chính trong bệnh viêm ruột đó là viêm loét đại tràng (UC – ulcerative colitis) và bệnh Crohn (CD). Cả 2 thể bệnh này có đặc trưng bởi những đợt cấp tái diễn, đặc điểm viêm của hai bệnh này khác nhau như sau: bệnh Crohn, hiện tượng viêm có thể xảy ra ở bất kỳ vị trí nào của đường ruột, còn đối với viêm loét đại tràng, hiện tượng viêm chỉ khu trú ở đại tràng. Từ nghiên cứu sử dụng kit xét nghiệm thế hệ đầu tiên, Tibble và cộng sự (15) chỉ ra rằng, nồng độ cao FC có thể xác nhận sự viêm là từ đường ruột, bất kể nguồn gốc chính xác của bệnh (bệnh viêm ruột, tân sinh, viêm ruột nhiễm trùng, vân vân), với giá trị dự đoán dương 76%, giá trị dự báo âm là 89%, và tỉ số chênh là 27,8 (khoảng tin cậy 95% [CI]: 17,6–43,7). Những kết quả này có giá trị hơn rất nhiều so với các chỉ điểm sinh hóa viêm trong huyết tương. Một số phân tích gộp và tổng quan hệ thống hiện đã xác nhận những kết quả ban đầu này và thấy rằng độ nhạy chung là 80%–98% và độ đặc hiệu là 68%–96% với ngưỡng FC từ 30 đến 100 μg/g ở người lớn, đa số là 50 μg/g (16,17). Trong hầu hết các trường hợp, ngưỡng 50 μg/g được sử dụng, với độ nhạy chung là 0,81 (khoảng tin cậy 95%: 0,75–0,86) và độ đặc hiệu cao 0,87 (KTC 95%: 0,78–0,92). Ngưỡng cut-off này có vẻ như là tốt nhất trên thực hành lâm sàng bởi vì bệnh nhân với nồng độ FC cao sẽ tăng nguy cơ mắc bệnh viêm ruột lên gấp 6 lần (tỉ số khả dĩ 6.0; 95% CI: 3.0–9.5) (18). Vị trí tổn thương chưa cho thấy có sự liên quan tới nồng độ FC (19). Định lượng nồng độ FC có thể cân nhắc sử dụng cho mục đích tầm soát ban đầu trên những bệnh nhân có triệu chứng nghi ngờ và có khả năng cần phải nội soi đại tràng để chẩn đoán bệnh viêm ruột (20). Tiếp cận theo cách này có thể giảm đáng kể số ca bệnh không cần thiết có chỉ định nội soi đại tràng (16). Tuy nhiên, cách tiếp cận trên cũng có thể làm trì hoãn chẩn đoán bệnh viêm ruột, vì có khoảng 5% bệnh nhân có viêm ruột nhưng nồng độ FC dưới 50 μg/g . Cho dù đã có đồng thuận về ngưỡng FC bình thường, nhưng tới nay vẫn đang còn tranh cãi về ngưỡng nồng độ để chẩn đoán liệu có hiện tượng viêm ở niêm mạc ruột hay không. Nồng độ FC có thể tăng vừa trong một số bệnh nhân mắc hội chứng ruột kích thích, kết quả này là một trường hợp dương tính giả. Ngược lại, một số thực sự có bệnh (bệnh viêm ruột hoặc bệnh khác) có nồng độ FCđược xem là bình thường, từ 50 đến 150 μg/g (hoặc có thể hơn 250 μg/g, tùy vào loại xét nghiệm) . Đối với những bệnh nhân này thì nguy cơ bùng phát đợt cấp là thấp, do đó có thể cho bệnh nhân đánh giá lại FC trong vòng 1 tháng trước khi chỉ định nội soi đại trực tràng. Lưu đồ dưới đây sẽ giúp diễn giải kết quả FC và hướng dẫn quyết định lâm sàng, được đề ra bởi tác giả Jukic và cộng sự (3). Giới hạn trên của vùng xám phụ thuộc vào phương pháp xét nghiệm, định lượng FC.
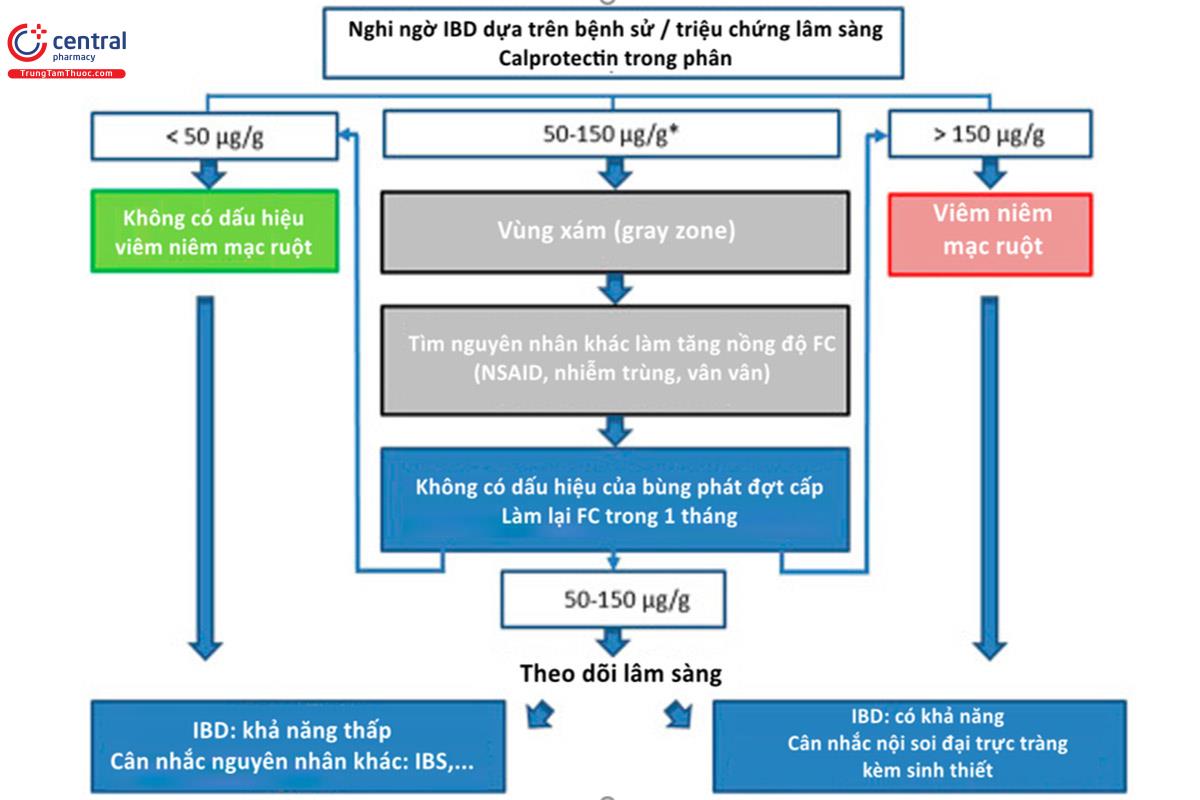
*Ngưỡng này phụ thuộc tùy vào phương pháp định lượng FC và có thể cao tới 250 μg/g. FC, fecal calprotectin; IBD, inflammatory bowel disease; IBS, irritable bowel syndrome; NSAID, nonsteroidal anti-inflammatory drug.
Một số báo cáo về sử dụng FC cho bệnh nhi nhưng kết quả có giá trị độ đặc hiệu thấp hơn (16). Một phân tích gộp của 8 nghiên cứu được thực hiện trên 715 bệnh nhi nghi ngờ mắc bệnh viêm ruột (IBD) cho thấy độ nhạy là 98% (95%–100%) và độ đặc hiệu là 68% (50%–86%), khả năng cao là liên quan tới tần suất bệnh ruột do nhiễm khuẩn(21). Trẻ sơ sinh là đối tượng thích hợp để phát triển các xét nghiệm dấu ấn sinh học không xâm lấn. Đặc biệt, điều này quan trọng trên những trẻ sơ sinh non tháng vì mục đích chẩn đoán bệnh viêm ruột hoại tử. Tuy nhiên, nghiên cứu gần đây lại chưa thể cho chúng ta biết được ngưỡng giá trị có thể giúp xác định bệnh đường ruột trên nhóm trẻ sơ sinh trên (22).
5 Đánh giá mức độ hoạt động của bệnh và đáp ứng điều trị trong IBD
Bệnh viêm ruột (IBD) là bệnh mạn tính đặc trưng bởi các đợt bùng phát tái diễn, gây ảnh hưởng rất nhiều tới chất lượng cuộc sống của bệnh nhân. Đánh giá mức độ viêm của niêm mạc ruột đóng vai trò quan trọng trong xử trí, không chỉ tại thời điểm chẩn đoán mà xuyên suốt thời gian mắc bệnh, đặc biệt với bệnh Crohn có triệu chứng lâm sàng không phản ánh đúng với mức độ viêm của niêm mạc. Nội soi kèm sinh thiết là phương pháp để đánh giá sự viêm niêm mạc trong bệnh viêm ruột, và hiện tại phương pháp này là cực kỳ quan trọng bởi vì nó có thể đánh giá được sự lành của lớp niêm mạc, đây là chỉ điểm của đáp ứng điều trị và sự cải thiện trong diễn tiến của bệnh (23,24). Tuy nhiên, nội soi đại trực tràng là một xét nghiệm có giá thành đắt và có tính xâm lấn, các bác sĩ thực hiện cần được đào tạo bài bản, do đó những điều này làm hạn chế đi việc thực hiện nội soi một cách thường xuyên nhằm theo dõi tình trạng bệnh.
Thời nay, định lượng nồng độ Calprotectin phân có thể sử dụng như là chỉ điểm đáng tin cậy không chỉ trong các đợt bùng phát bệnh mà còn là dấu hiệu cho thấy sự lành của niêm mạc (25). Đã có nhiều nghiên cứu xác nhận kết quả của tác giả Roseth và cộng sự rằng nồng độ FC không chỉ tương quan đến mức độ hoạt động bệnh mà còn tương quan với hình ảnh nội soi và giải phẫu bệnh, FC tốt hơn các dấu ấn sinh hóa khác như CRP, tiểu cầu hay bạch cầu (3,26,27). Schoepfer và cộng sự (26) chỉ ra mối tương quan mật thiết giữa nồng độ FC và số điểm trên thang điểm nội soi dựa trên nghiên cứu trên 122 bệnh nhân mắc bệnh Crohn. Do đó, xét nghiệm này có thể được dùng để phân biệt các mức độ hoạt động của bệnh như không hoạt động (niêm mạc đã lành) và viêm nhẹ (104 ± 138 so với 231 ± 244 μg/g, P < 0,001), giữa nhẹ và trung bình (231 ± 244 so với 395 ± 256 μg/g). , P = 0,008), và cuối cùng, giữa mức độ hoạt động của bệnh vừa và nặng (395 ± 256 so với 718 ± 320 μg/g, P < 0,001). Nhiều báo cáo có kết quả tương tự đối với bệnh viêm loét đại tràng (UC) khi sử dụng thang điểm Baron biến đổi để đánh giá mức độ nặng của bệnh qua nội soi. Ở những người có giai đoạn 0 và 1 trên nội soi, được coi là thuyên giảm, sự thuyên giảm này thường liên quan đến quá trình lành niêm mạc, FC vẫn nằm trong giá trị bình thường, tức là khoảng 16 (10–30) μg/g và 35 (25–48) μg/g. Ngược lại thì với người mà bệnh đang hoạt động, có sự tăng lên của nồng độ FC với giá trị khoảng 102 (44-159) μg/g và giai đoạn 2 trên nội soi, khoảng 235 (176-319) μg/g và giai đoạn 3, khoảng 611 (406-868) μg/g và giai đoạn 4 trên nội soi (27) . Ngưỡng xác định liệu bệnh thuyên giảm hay không là tùy vào từng nghiên cứu, nhưng nồng độ FC trên ngưỡng cutoff (150 μg/g hoặc 250 μg/g) có thể dùng với độ nhạy hơn 80% (28). Cập nhật gần đây của STRIDE (Selecting Therapeutic Targets in Inflammatory Bowel Disease) do Tổ Chức Nghiên Cứu Bệnh Viêm Ruột Quốc Tế công bố đã đồng thuận và đề xuất ngưỡng < 150 μg/g, đây là mốc được xem là bệnh “thuyên giảm” (24). Một lần nữa, sự đa dạng của các phương pháp đo lường và sự thiếu sót của một tiêu chuẩn “chuẩn hóa” đã dẫn đến đề xuất “vùng xám”, có thể lấy mốc lên tới 250 μg/g . Ngưỡng cutoff này đã được xác nhận trên một nghiên cứu 87 bệnh nhân mắc bệnh Crohn với kết luận rằng nồng độ FC lớn hơn 250 μg/g có liên quan tới sự hiện diện của các ổ viêm loét lớn và thấp hơn ngưỡng này thì liên quan đến sự thuyên giảm bệnh (29). Một phân tích gộp 19 nghiên cứu được báo cáo về việc sử dụng FC để dự báo phát hiện bệnh tái phát trên nội soi cho thấy độ nhạy 0.88 (95% CI: 0.84–0.90), độ đặc hiệu 0.73 (95% CI: 0.66–0.79) (30).
Một số bệnh nhân có thêm rối loạn tiêu hóa, việc này khiến cho theo dõi bệnh viêm ruột trở nên khó khăn vì có tới 30% bệnh nhân mắc viêm ruột xuất hiện hiện tượng này. Do đó, tổ chức bệnh Crohn và viêm đại tràng châu Âu (The European Crohn's and Colitis Organization) đã khuyến cáo đo nồng độ FC để theo dõi bệnh viêm ruột, và còn giúp phân biệt giữa rối loạn tiêu hóa và đợt cấp của bệnh (31). Hơn nữa, nghiên cứu đa trung tâm CALM (giai đoạn 3) so sánh hiệu quả giữa lưu đồ đánh giá mức độ hoạt động bệnh sử dụng định lượng FC (ngưỡng: 250 μg/g) và lưu đồ tương tự nhưng chỉ dựa trên lâm sàng cho thấy lưu đồ sử dụng định lượng FC tốt hơn hẳn khi áp dụng cho bệnh nhân giai đoạn sớm bệnh Crohn (32). Một lưu đồ khác giúp diễn giải giá trị nồng độ calprotectin và hướng dẫn lâm sàng được đề xuất bởi Jukic và các cộng sự (3), ở hình 2. Hiện tại, mục tiêu điều trị dựa trên nồng độ FC đó là thấy FC giảm một mức có ý nghĩa, xu hướng về giá trị “chấp nhận được”, bất kể phương pháp điều trị (24). Tuy nhiên, triệu chứng lâm sàng luôn cần được cân nhắc bởi vì bệnh đường tiêu hóa khác, một số thuốc hay kể cả lối sống cũng có thể ảnh hưởng tới nồng độ FC.
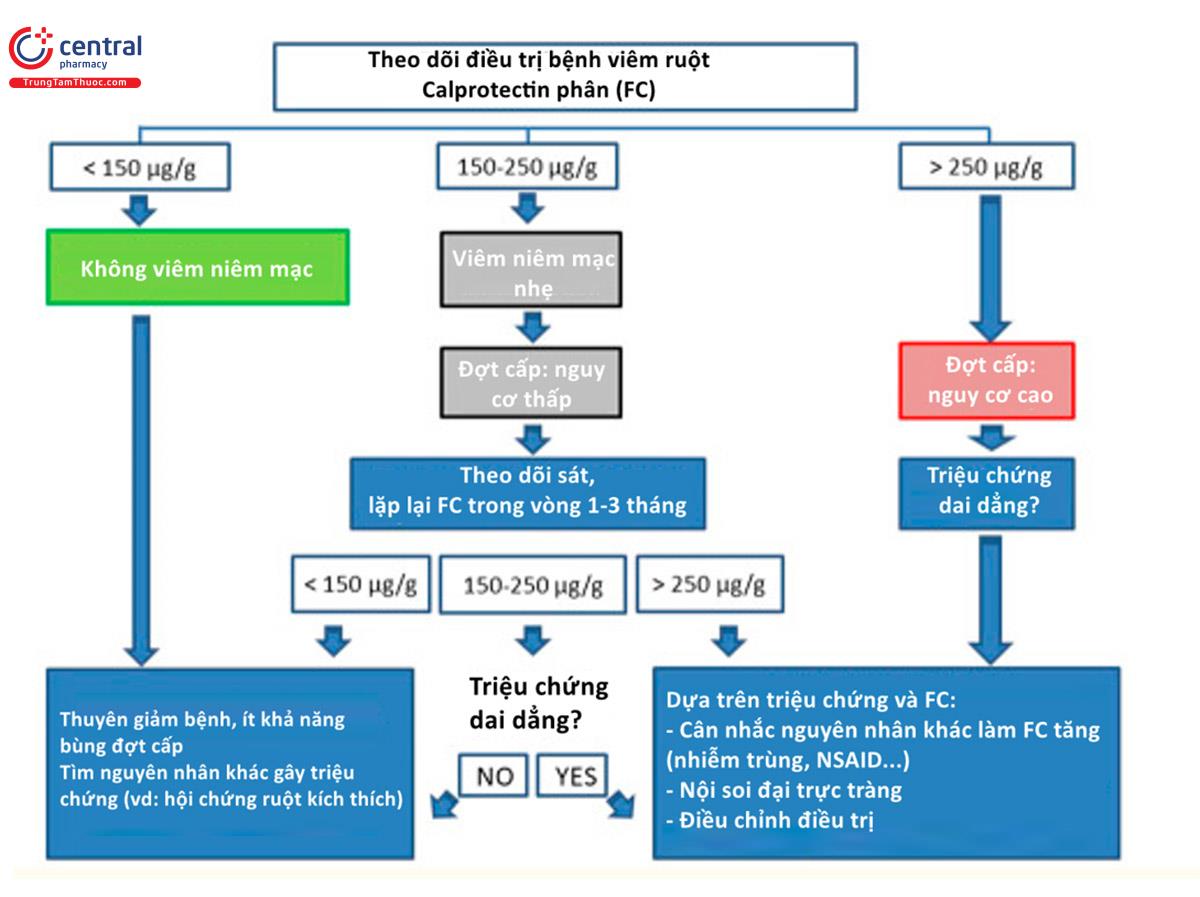
Dự đoán đợt tái phát
Diễn tiến tự nhiên của bệnh viêm ruột đặc trưng bởi các đợt thuyên giảm và các đợt tái phát. Có một dấu ấn sinh hóa hiệu quả có thể giúp dự đoán các đợt tái phát, từ đây có thể điều chỉnh điều trị kịp thời đồng thời tránh được điều trị quá tay với những bệnh nhân có nguy cơ đợt cấp thấp. Một nghiên cứu cho thấy nguy cơ tương đối của đợt tái phát trong vòng một năm của bệnh nhân có UC là gấp 14 lần (P < 0,0001) khi nồng độ FC trên 150 μg/g (33). Các nghiên cứu khác đề xuất ngưỡng cao hơn, Kallel và cộng sự (34) báo cáo ngưỡng 340 μg/g cho nguy cơ tái phát lên gấp 18 lần. Cuối cùng, một phân tích gộp của 6 nghiên cứu bao gồm 318 bệnh nhân mắc UC và 354 bệnh nhân mắc CD đã báo cáo độ nhạy tổng là 78% (KTC 95%: 72%–83%) và độ đặc hiệu là 73% (KTC 95%: 68%– 77%) khi sử dụng các ngưỡng trong khoảng từ 120 đến 340 μg/g (35). Bổ sung thêm cho kết quả này, việc theo dõi nồng độ FC sẽ góp phần giúp xác định nguy cơ tái phát. Một nghiên cứu tiền cứu được thực hiện trên những bệnh nhân mắc UC đang thuyên giảm khi điều trị bằng infliximab và những người này được theo dõi FC hàng tháng, kết quả là FC bình thường (<50 μg/g) trong suốt thời gian nghiên cứu và họ không có đợt bùng phát nào trên lâm sàng (36). Kết quả tương tự cũng đã được báo cáo cho các phương pháp điều trị khác nhau. Do đó, theo dõi ít hơn (nửa năm hoặc thậm chí hàng năm) có thể được sử dụng cho những bệnh nhân không có triệu chứng và nồng độ FC thường xuyên dưới 50 μg/g.. Ngược lại, trước khi xuất hiện đợt cấp trên lâm sàng, những bệnh nhân trong trường hợp này có nồng độ FC cao trước khi đợt cấp xảy ra từ 2 đến 3 tháng. Mô hình đường cong biểu diễn (đường cong ROC) đưa ra ngưỡng 300 μg/g, với độ nhạy 58,3% và độ đặc hiệu 93,3% đối với nguy cơ tái phát. Điều thú vị là, nếu 2 lần đo liên tiếp thực hiện cách nhau 1 tháng có chênh lệch hơn 300 μg/g thì độ nhạy để xác định nguy cơ tái phát tăng lên 61,5% và độ đặc hiệu lên 100% (36). Cuối cùng, Theede và cộng sự (37) đã chỉ ra rằng định lượng FC là đủ để xác định nguy cơ tái phát UC trước 6–12 tháng và cũng đủ để đánh giá quá trình lành vết thương niêm mạc.
Bất chấp sự phát triển của phương pháp điều trị, diễn tiến tự nhiên của IBD vẫn khiến bệnh nhân thường xuyên cần phải điều trị bằng phẫu thuật. Mặc dù mổ cắt đại tràng, phần lớn có tác dụng chữa khỏi bệnh UC, ngoại trừ trường hợp viêm túi thừa đại tràng, phẫu thuật không thể chữa khỏi bệnh Crohn và các đợt tái phát thường xuyên là không tránh khỏi. Nội soi đại tràng là phương pháp chẩn đoán tốt nhất để xác định tái phát bệnh sau mổ, tuy nhiên vẫn còn nhiều hạn chế đã được nêu và dữ liệu chưa đủ để đưa ra tần suất theo dõi tối ưu. Nhiều nghiên cứu hiện đã và đang đánh giá hiệu quả của FC như một công cụ chẩn đoán để phát hiện các đợt tái phát sau phẫu thuật Crohn, ở người lớn và trẻ em (38,39). Một phân tích gộp 9 nghiên cứu cho thấy ngưỡng >150 μg/g là có độ chính xác tổng tốt nhất để dự đoán tái phát trên nội soi, sau phẫu thuật, với độ nhạy khoảng 70% (40). Tuy nhiên, nồng độ FC có thể thay đổi đáng kể theo thời gian sau khi cắt bỏ hồi manh tràng, đặc biệt ở những bệnh nhân bị tiêu chảy. Do đó, ở những bệnh nhân này, chỉ một mẫu định lượng FC là không đủ để dự đoán tái phát trên nội soi (41). Định lượng FC bây giờ là một phần quan trọng trong quản lý đợt tái phát của bệnh nhân Crohn sau khi mổ, để xem liệu bệnh nhân có cần nội soi hay thay đổi điều trị.
6 Hỗ trợ quyết định ngừng điều trị
Các thuốc sinh học liên quan tới điều hòa miễn dịch được sử dụng rộng rãi bởi vì chúng hiệu quả trong việc làm thuyên giảm bệnh và hạn chế các đợt tái phát. Nghiên cứu STORI đánh giá nguy cơ tái phát của 115 bệnh nhân mắc Crohn hiện đang ổn khi đang điều trị với anti-TNFα và một thuốc điều hòa miễn dịch (thiopurines hoặc Methotrexate), những bệnh này đã ngưng infliximab. Sau trung bình 28 tháng theo dõi, 52 bệnh nhân bị tái phát. Phân tích đa biến các kết quả trên đã xác định một số yếu tố nguy cơ làm tái phát bệnh, trong số đó có nồng độ FC >300 μg/g (42). Do đó, xét nghiệm định lượng FC, kết hợp với theo dõi lâm sàng của bệnh nhân, sẽ góp phần tìm ra những bệnh nhân có nguy cơ tái phát thấp mà việc điều trị có thể bị gián đoạn..
7 Kết luận
Các dấu ấn sinh học trong phân hiện nay đang được sử dụng rộng rãi để giúp chẩn đoán và quản lý các bệnh lý đường tiêu hóa, đặc biệt là bệnh viêm ruột. FC là dấu hiệu sinh học có tính thuyết phục cao và được nghiên cứu nhiều nhất. Các nghiên cứu được thực hiện trong thập kỷ vừa qua đã giúp chúng ta hiểu hơn về chức năng phân tử của Calprotectin, phát hiện nó có nhiều đặc tính kháng khuẩn và khả năng điều hòa miễn dịch. Việc định lượng FC là dễ dàng thực hiện. Các nghiên cứu đầu tiên được thực hiện bằng xét nghiệm miễn dịch liên kết với enzyme và chiết xuất thủ công. Hiện nay có nhiều phương pháp và các thiết bị chiết đã được phát triển để giảm bớt thời gian phân tích. Tuy nhiên, những thiết bị này không phù hợp với tất cả các mẫu. Cuối cùng, mặc dù khả năng phân tích của các xét nghiệm nói chung là tốt nhưng kết quả đưa ra là có khác nhau đáng kể và do đó cần một tiêu chuẩn hóa quốc tế. Vì vậy, mỗi phòng thí nghiệm cần phải kiểm soát tất cả các vấn đề xung quanh của xét nghiệm (trước và sau), đồng thời xác định ngưỡng và diễn giải phù hợp với thực tế lâm sàng của chính họ. Dấu hiệu sinh hóa không xâm lấn này lần đầu tiên được dùng để chẩn đoán phân biệt giữa các bệnh lý chức năng kiểu hội chứng ruột kích thích với bệnh ruột viêm, cho những bệnh nhân có triệu chứng nghi ngờ, từ đây xác định được những bệnh nhân cần nội soi hay không. Tuy nhiên, FC không phải là chỉ điểm của riêng bệnh IBD mà là nó liên quan với tình trạng viêm của niêm mạc ruột, có thể tăng trong nhiều trường hợp, IBD chỉ là một ví dụ, mà còn trong nhiễm trùng đường tiêu hóa hoặc melanoma. Do đó, việc diễn giải kết quả xét nghiệm phải luôn đặt trong bối cảnh lâm sàng. Dấu ấn sinh học này hiện đã được chấp thuận để quản lý và theo dõi IBD nhằm đánh giá tình trạng đáp ứng điều trị. Điều này cho phép phát hiện hoặc thậm chí dự đoán các đợt tái phát cũng như biết được sự lành của niêm mạc và từ đây hỗ trợ bác sĩ lâm sàng quyết định tăng hoặc giảm liều thuốc điều trị. Tuy nhiên, vẫn còn thiếu sự đồng thuận về ngưỡng tối ưu. Điều này dẫn đến vùng xám cho nồng độ của FC, dao động từ 50 đến 250 μg/g, vùng này khiến diễn giải FC rất khó khăn và do đó cần phải theo dõi chặt chẽ để có thể diễn giải phù hợp. Ngược lại, nồng độ dưới <50 μg/g cho phép loại trừ bệnh viêm ruột (IBD) với giá trị tiên đoán âm tính >95%, trong khi nồng độ >250 μg/g cho thấy cần phải theo dõi thật sát và có thể cần chỉ định nội soi, đặc biệt để xác nhận đợt bùng phát trên bệnh nhân có triệu chứng dai dẳng. Mặc dù dấu ấn sinh học này không thể thay thế biểu hiện lâm sàng và nội soi, nhưng nó góp phần hiệu quả vào việc quản lý và theo dõi IBD ngắn hạn và dài hạn.
8 Tài liệu tham khảo
1. Striz I, Trebichavsky I. Calprotectin-a pleiotropic molecule in acute and chronic inflammation. Physiol Res 2004;53:245–53. [PubMed] [Google Scholar]
2. Ayling RM, Kok K. Fecal calprotectin. Adv Clin Chem 2018;87:161–90. [PubMed] [Google Scholar]
3. Jukic A, Bakiri L, Wagner EF, et al.. Calprotectin: From biomarker to biological function. Gut 2021;70:1978–88. [PMC free article] [PubMed] [Google Scholar]
4. Steinbakk M, Naess-Andresen CF, Lingaas E, et al.. Antimicrobial actions of calcium binding leucocyte L1 protein, calprotectin. Lancet 1990;336:763–5. [PubMed] [Google Scholar]
5. Røseth AG, Schmidt PN, Fagerhol MK. Correlation between faecal excretion of Indium-111-labelled granulocytes and calprotectin, a granulocyte marker protein, in patients with inflammatory bowel disease. Scand J Gastroenterol 1999;34:50–4. [PubMed] [Google Scholar]
6. Hamer HM, Mulder AHL, de Boer NK, et al.. Impact of preanalytical factors on calprotectin concentration in stool: A multiassay comparison. J Appl Lab Med 2022;7:1401–11. [PubMed] [Google Scholar]
7. Oyaert M, Van den Bremt S, Boel A, et al.. Do not forget about pre-analytics in faecal calprotectin measurement. Clin Chim Acta 2017;473:124–6. [PubMed] [Google Scholar]
8. Ton H, Brandsnes O, Dale S, et al.. Improved assay for fecal calprotectin. Clin Chim Acta 2000;292:41–54. [PubMed] [Google Scholar]
9. D'Amico F, Rubin DT, Kotze PG, et al.. International consensus on methodological issues in standardization of fecal calprotectin measurement in inflammatory bowel diseases. United European Gastroenterol J 2021;9:451–60. [PMC free article] [PubMed] [Google Scholar]
10. Labaere D, Smismans A, Van Olmen A, et al.. Comparison of six different calprotectin assays for the assessment of inflammatory bowel disease. United European Gastroenterol J 2014;2:30–7. [PMC free article] [PubMed] [Google Scholar]
11. Joshi S, Lewis SJ, Creanor S, et al.. Age-related faecal calprotectin, Lactoferrin and tumour M2-PK concentrations in healthy volunteers. Ann Clin Biochem 2010;47:259–63. [PubMed] [Google Scholar]
12. Rugtveit J, Fagerhol MK. Age-dependent variations in fecal calprotectin concentrations in children. J Pediatr Gastroenterol Nutr 2002;34:323–4. [PubMed] [Google Scholar]
13. Kapel N, Campeotto F, Kalach N, et al.. Faecal calprotectin in term and preterm neonates. J Pediatr Gastroenterol Nutr 2010;51:542–7. [PubMed] [Google Scholar]
14. Tibble JA, Sigthorsson G, Foster R, et al.. Faecal calprotectin and faecal occult blood tests in the diagnosis of colorectal carcinoma and adenoma. Gut 2001;49:402–8. [PMC free article] [PubMed] [Google Scholar]
15. Tibble JA, Sigthorsson G, Foster R, et al.. Use of surrogate markers of inflammation and Rome criteria to distinguish organic from nonorganic intestinal disease. Gastroenterology 2002;123:450–60. [PubMed] [Google Scholar]
16. van Rheenen PF, Van de Vijver E, Fidler V. Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: Diagnostic meta-analysis. Br Med J 2010;341:c3369. [PMC free article] [PubMed] [Google Scholar]
17. Menees SB, Powell C, Kurlander J, et al.. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. Am J Gastroenterol 2015;110:444–54. [PubMed] [Google Scholar]
18. Carrasco-Labra A, Lytvyn L, Falck-Ytter Y, et al.. AGA technical review on the evaluation of functional diarrhea and diarrhea-predominant irritable bowel syndrome in adults (IBS-D). Gastroenterology 2019;157:859–80. [PubMed] [Google Scholar]
19. Jensen MD, Kjeldsen J, Nathan T. Fecal calprotectin is equally sensitive in Crohn's disease affecting the small bowel and colon. Scand J Gastroenterol 2011;46:694–700. [PubMed] [Google Scholar]
20. Savarino E, Zingone F, Barberio B, et al.. Functional bowel disorders with diarrhoea: Clinical guidelines of the United European Gastroenterology and European Society for Neurogastroenterology and Motility. United Eur Gastroenterol J 2022;10:556–84. [PMC free article] [PubMed] [Google Scholar]
21. Henderson P, Anderson NH, Wilson DC. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease: A systematic review and meta-analysis. Am J Gastroenterol 2014;109:637–45. [PubMed] [Google Scholar]
22. Campeotto F, Elie C, Rousseau C, et al.. Faecal calprotectin and gut microbiota do not predict enteropathy in very preterm infants. Acta Paediatr 2021;110:109–16. [PMC free article] [PubMed] [Google Scholar]
23. Peyrin-Biroulet L, Sandborn W, Sands BE, et al.. Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE): Determining therapeutic goals for treat-to-target. Am J Gastroenterol 2015;110:1324–38. [PubMed] [Google Scholar]
24. Turner D, Ricciuto A, Lewis A, et al.; International Organization for the Study of IBD. STRIDE-II: An update on the selecting therapeutic targets in inflammatory bowel disease (STRIDE) initiative of the International organization for the study of IBD (IOIBD): Determining therapeutic goals for treat-to- target strategies in IBD. Gastroenterology 2021;160:1570–83. [PubMed] [Google Scholar]
25. Kawashima K, Oshima N, Kishimoto K, et al.. Low fecal calprotectin predicts histological healing in patients with ulcerative colitis with endoscopic remission and leads to prolonged clinical remission. Inflamm Bowel Dis 2022;29:359–66. [PubMed] [Google Scholar]
26. Schoepfer AM, Beglinger C, Straumann A, et al.. Fecal calprotectin correlates more closely with the simple endoscopic score for Crohn's disease (SES-CD) than CRP, blood leukocytes, and the CDAI. Am J Gastroenterol 2010;105:162–9. [PubMed] [Google Scholar]
27. Schoepfer AM, Beglinger C, Straumann A, et al.. Fecal calprotectin more accurately reflects endoscopic activity of ulcerative colitis than the Lichtiger Index, C-reactive protein, platelets, hemoglobin, and blood leukocytes. Inflamm Bowel Dis 2013;19:332–441. [PubMed] [Google Scholar]
28. Lin JR, Chen JM, Zuo JH, et al.. Meta-analysis: Fecal calprotectin for assessment of inflammatory bowel disease activity. Inflamm Bowel Dis 2014;20:1407–15. [PubMed] [Google Scholar]
29. D'Haens G, Ferrante M, Vermeire S, et al.. Fecal calprotectin is a surrogate marker for endoscopic lesions in inflammatory bowel disease. Inflamm Bowel Dis 2012;18:2218–24. [PubMed] [Google Scholar]
30. Mosli MH, Zou G, Garg SK, et al.. C-reactive protein, fecal calprotectin, and stool lactoferrin for detection of endoscopic activity in symptomatic inflammatory bowel disease patients: A systematic review and meta-analysis. Am J Gastroenterol 2015;110:802–19. [PubMed] [Google Scholar]
31. Dignass A, Eliakim R, Magro F, et al.. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis: Definitions and diagnosis. J Crohns Colitis 2012;6:965–90. [PubMed] [Google Scholar]
32. Colombel JF, Panaccione R, Bossuyt P, et al.. Effect of tight control management on Crohn's disease (CALM): A multicentre, randomised, controlled phase 3 trial. Lancet 2017;390(10114):2779–89. [PubMed] [Google Scholar]
33. Costa F, Mumolo MG, Ceccarelli L, et al.. Calprotectin is a stronger predictive marker of relapse in ulcerative colitis than in Crohn's disease. Gut 2005;54:364–8. [PMC free article] [PubMed] [Google Scholar]
34. Kallel L, Ayadi I, Matri S, et al.. Fecal calprotectin is a predictive marker of relapse in Crohn's disease involving the colon: A prospective study. Eur J Gastroenterol Hepatol 2010;22:340–5. [PubMed] [Google Scholar]
35. Mao R, Xiao YL, Gao X, et al.. Fecal calprotectin in predicting relapse of inflammatory bowel disease: A meta-analysis of prospective studies. Inflamm Bowel Dis 2012;18:1894–9. [PubMed] [Google Scholar]
36. De Vos M, Louis EJ, Jahnsen J, et al.. Consecutive fecal calprotectin measurements to predict relapse in patients with ulcerative colitis receiving infliximab maintenance therapy. Inflamm Bowel Dis 2013;19:2111–7. [PubMed] [Google Scholar]
37. Theede K, Holck S, Ibsen P, et al.. Fecal calprotectin predicts relapse and histological mucosal healing in ulcerative colitis. Inflamm Bowel Dis 2016;22:1042–8. [PubMed] [Google Scholar]
38. Herranz Bachiller MT, Barrio Andres J, Fernandez Salazar L, et al.. The utility of faecal calprotectin to predict post-operative recurrence in Crohńs disease. Scand J Gastroenterol 2016;51:720–6. [PubMed] [Google Scholar]
39. Hukkinen M, Pakarinen MP, Merras-Salmio L, et al.. Fecal calprotectin in the prediction of postoperative recurrence of Crohn's disease in children and adolescents. J Pediatr Surg 2016;51:1467–72. [PubMed] [Google Scholar]
40. Tham YS, Yung DE, Fay S, et al.. Fecal calprotectin for detection of postoperative endoscopic recurrence in Crohn's disease: Systematic review and meta-analysis. Therap Adv Gastroenterol 2018;11:1756284818785571. [PMC free article] [PubMed] [Google Scholar]
41. Lasson A, Strid H, Öhman L, et al.. Fecal calprotectin one year after ileocaecal resection for Crohn's disease—A comparison with findings at ileocolonoscopy. J Crohns Colitis 2014;8:789–95. [PubMed] [Google Scholar]
42. Louis E, Mary JY, Vernier-Massouille G, et al.. Maintenance of remission among patients with Crohn's disease on antimetabolite therapy after infliximab therapy is stopped. Gastroenterology 2012;142:63–70. [PubMed] [Google Scholar]

