Điều trị tế bào gốc trong suy tim sau nhồi máu cơ tim
Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS.Phạm Mạnh Hùng
Tác giả
TS.BSNT.Phan Tuấn Đạt
PGS.TS.BS.Phạm Mạnh Hùng
Nhồi máu cơ tim là một loại bệnh lý phổ biến hiện nay với tỉ lệ tử vong và biến chứng cao. Có những cách nào điều trị? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu những thông tin về Điều trị tế bào gốc trong suy tim sau nhồi máu cơ tim.
1 Nhồi máu cơ tim và vấn đề suy tim sau nhồi máu cơ tim cấp
1.1 Dịch tễ học của bệnh
Bệnh mạch vành đang là nguyên nhân gây tử vong và tàn phế hàng đầu, chiếm khoảng 16% tổng số các ca tử vong trên toàn thế giới.
Khái niệm suy tim sau nhồi máu cơ tim (NMCT) cấp đã được tác giả Killip mô tả đầu tiên vào những năm 1960. Trước thời kỳ ra đời của các biện pháp tái tưới máu mạch vành, chỉ với điều trị nội khoa đơn thuần, tỷ lệ suy tim sau NMCT có ST chênh lên trong thời gian nằm viện là khoảng 40%. Tỷ lệ này giảm xuống còn 17% sau khi thuốc tiêu sợi huyết được đưa vào sử dụng. Tại thời điểm này, suy tim vẫn là một yếu tố tiên lượng xấu, dự báo tử vong cao gấp 5 lần trong năm đầu so với những bệnh nhân không bị suy tim.
Nhờ sự tiến bộ của kỹ thuật, tỷ lệ suy tim sau nhồi máu cơ tim cấp tiếp tục giảm đáng kể sau khi biện pháp can thiệp động mạch vành thì đầu trở nên phổ biến rộng rãi. Trong khoảng thời gian từ năm 1995 đến 2005, một nghiên cứu trên 2089 bệnh nhân người Ý bị NMCT cấp được can thiệp ĐMV thì đầu ghi nhận có 17% kèm theo suy tim. Tuy nhiên, sau can thiệp ĐMV chỉ có 1% bệnh nhân có tiến triển suy tim cấp trong thời gian nằm viện. Kết quả tương tự cũng được thể hiện trong nghiên cứu HORIZON-AMI trên 3602 bệnh nhân được tuyển chọn từ năm 2005-2007 được can thiệp ĐMV thì đầu. Tại thời điểm nhập viện, có 8,0% bệnh nhân có biểu hiện suy tim trái với độ Killip II-IV. Trong 30 ngày theo dõi sau đó, chỉ có 4,6% bệnh nhân có suy tim tiến triển, tăng lên 5,1% sau 2 năm.
1.2 Sinh lý bệnh suy tim sau nhồi máu cơ tim cấp
Cơ chế suy tim ngay sau NMCT cấp là do hiện tượng cơ tim “choáng váng”, cơ tim bị hoại tử, hở hai lá cấp do tổn thương dây chằng cột cơ do tình trạng thiếu máu cơ tim. Suy tim xuất hiện trong quá trình nằm viện cũng có thể do các cơ chế nêu trên, kèm theo hiện tượng quá tải dịch hay cản quang đưa vào, suy thận, hoặc một số các biến chứng như thủng vách liên thất, tràn dịch màng tim… Các trường hợp suy tim muộn hơn là hậu quả của tổn thương cơ tim do tế bào cơ tim bị chết, hình thành sẹo song song với quá trình tái cấu trúc tâm thất.
Trong vài giây đầu sau khi bị NMCT, các phản ứng đường phân ái khí bị ảnh hưởng, dẫn tới giảm tổng hợp ATP trong khi cơ thể tích tụ nhiều hơn axit lactic. Ở giai đoạn sớm, sự co giãn của cơ tim bị suy giảm là do hậu quả thứ phát của các chuyển hóa tại mô làm giảm độ nhạy cảm với Ca2+ của các sợi cơ. Tình trạng thiếu hụt oxy cũng làm đình trệ hoạt động của bơm Na+/K+ khiến gia tăng chất tan nằm trong tế bào và hậu quả làm phù ở khoảng gian bào tăng lên. Sự tích tụ axit lactic làm giảm pH của tế bào sẽ hạn chế hoạt động của một số enzyme thiết yếu và làm tăng giải phóng các sản phẩm của lysosomal dẫn đến phá vỡ tế bào cơ tim. Ngoài ra, hoạt động của bơm Ca2+ bị suy giảm cũng làm ảnh hưởng đến một số thành phần nội bào bao gồm phân ly của ribosome và giảm chức năng của màng ty thể, cuối cùng kết thúc bằng quá trình tự chết theo chương trình (apoptosis).
Vào ngày thứ 3 đến thứ 5 sau NMCT, quá trình viêm được thay thế bằng các hoạt động sửa chữa. Các báo hiệu về tế bào cơ tim chết giúp kêu gọi đại thực bào và thâm nhiễm bạch cầu trung tính, ban đầu chúng tập trung ở ngoại vi và sau đó đến trung tâm của vùng nhồi máu. Các tế bào cơ tim hoại tử được các đại thực bào ăn, thúc đẩy quá trình hình thành sẹo cơ tim. Quá trình thực bào khiến các mô hoại tử được thay thế bằng mô hạt xơ hoá, và gây hậu quả làm thành cơ tim mỏng đi. Giai đoạn muộn hơn, sự hoạt hoá của hệ renin-angiotensin và hệ thần kinh giao cảm, quá trình tái cấu trúc diễn ra bao gồm thay đổi về hình dạng của tâm thất, thành tim trở nên mỏng hơn, hở hai lá nhiều hơn, và các tế bào cơ tim vẫn có thể tiếp tục bị chết thêm trong giai đoạn này. Các vùng tế bào cơ tim đã chết được thay thế bằng các sợi collagen, hình thành nên sẹo cơ tim.
1.3 Tế bào gốc trong điều trị suy tim sau nhồi máu cơ tim cấp
1.3.1 Khái niệm tế bào gốc
Tế bào gốc (TBG) là một loại tế bào duy nhất có cả hai khả năng đặc biệt: (1) Có thể tự tái tạo mới, sinh ra những tế bào giống hệt chúng và (2) có thể biệt hoá thành những loại tế bào chuyên biệt trong những điều kiện nhất định.
Về phía thứ bậc, mức độ phát triển và khả năng biệt hoá của tế bào gốc, có thể phân chia thành 4 bậc:
TBG toàn năng (Totipotent stem cells): Hợp tử (Zygote) là TBG đầu tiên, TBG nguyên thủy. Từ đây phát triển thành túi mầm, rồi tách thành tế bào bên ngoài tạo bánh rau và khối tế bào bên trong tạo thành thai
TBG vạn năng (Pluripotent stem cells): đó là TBG thuộc khối tế bào bên trong của túi mầm, phát triển thành 3 lá thai: ngoại bì, trung bì và nội bì.
TBG đa năng (multipotent stem cells): TBG này có thể phát triển thành 2, 3, 4 TBG kế cận, để thành TBG đơn dòng.
TBG đơn dòng (monopotent stem cells) hay đơn khả năng (unipotent stem cells): TBG này chỉ sinh sản và biệt hóa thành 1 dòng tế bào trưởng thành, có chức năng cá thể.
1.3.2 Các dòng tế bào gốc được sử dụng trong điều trị suy tim sau NMCT cấp

1.3.3 Tế bào gốc từ tủy xương (Bone Marrow Stem Cells)
Tế bào gốc tủy xương bắt đầu được thử nghiệm trên người từ năm 2001 và cho tới nay là nguồn tế bào gốc được sử dụng nhiều nhất trong các nghiên cứu và trên thực tế lâm sàng. Hầu như rất ít nghiên cứu sử dụng dòng tế bào gốc riêng biệt, mà đa số sử dụng nguồn tế bào gốc không chọn lọc từ tủy xương, trong đó chứa sẵn nhiều dòng tế bào rất đa dạng, chưa biệt hoá như tế bào tạo máu gốc (HSCs), tế bào trung mô gốc (MSCs) và tế bào tiền thân nội mô (EPCs).
Tế bào gốc tạo máu biểu hiện CD31, CD34, CD45, CD133 có khả năng biệt hoá thành tế bào cơ tim và tế bào nội mô. Tế bào trung mô gốc (mesenchymal stem cells) đa số biểu hiện một số kháng nguyên bề mặt như CD105 và CD90, trong khi CD17, CD29, CD44, CD73, CD106, CD124
và CD166 gặp ở một số tế bào. MSCs được cho là có đặc quyền miễn dịch không bộc lộ phân tử MCH lớp II nên đây là dòng tế bào thích hợp cho cấy tế bào gốc dị gen. Tế bào tiền thân nội mô có thể trực tiếp biệt hóa thành tế bào nội mô hoặc thúc đẩy quá trình tân sinh mạch bằng cách tiết ra các cytokine.
Ưu điểm
Đây là nguồn tế bào gốc (TBG) có nhiều ưu điểm với khả năng lấy tủy dễ dàng, không cần những thiết bị đắt tiền, phức tạp. Tế bào gốc không chọn lọc từ tủy xương rất phù hợp để cấy vào cơ tim nhờ khả năng phát triển theo nhiều kiểu khác nhau (theo đường trung mô) để hình thành tế bào cơ trơn, cơ tim, mạch máu non – vốn là ba loại tế bào chủ chốt của quả tim. TBG từ tuỷ xương cũng rất phù hợp để ứng dụng rộng rãi trong lâm sàng do khả năng tách trực tiếp từ dịch chọc tủy hoặc thu thập từ máu ngoại vi truyền hoàn hồi đều dễ dàng, mức độ tăng sinh cao trong môi trường nuôi, đặc tính sinh lý/hóa sinh có thể xác định chi tiết trước khi đem cấy.
Đã gần 20 năm kể từ khi được thử nghiệm trên người, có hơn 3000 bệnh nhân đã tham gia các nghiên cứu lâm sàng với liệu pháp sử dụng tế bào gốc tủy xương. Qua các kết quả này, các tác giả đã đưa ra các đồng thuận:
Liệu pháp bơm tế bào gốc tủy xương vào động mạch vành là an toàn:
- Liệu pháp bơm tế bào gốc tủy xương vào động mạch vành thủ phạm gây NMCT sau khi được can thiệp đặt stent là an toàn do không làm tăng nguy cơ rối loạn nhịp tim. Biến cố tái hẹp trong stent chỉ được ghi nhận trong 1 nghiên cứu nhỏ, không phải là nghiên cứu ngẫu nhiên.
- Các nghiên cứu gộp sau đó không ghi nhận biến cố tái hẹp và tái can thiệp nhánh ĐMV thủ phạm nhiều hơn so với nhóm chứng. Cuối cùng, các tác giả đều không thấy gia tăng tỷ lệ xuất hiện các loại ung thư ở nhóm được điều trị tế bào gốc tủy xương. Tóm lại, đây là nguồn tế bào gốc tỏ ra an toàn nhất trong các nguồn tế bào gốc được sử dụng trên lâm sàng.
Hiệu quả của tế bào gốc tủy xương đa số cho kết quả cải thiện lâm sàng hơn so với nhóm chứng:
- Mặc dù, tiêu chí chính của các nghiên cứu không cho kết quả tương đồng hoàn toàn, một số nghiên cứu cho kết quả âm tính, tuy nhiên, khi đánh giá trên các nghiên cứu gộp của nhiều nghiên cứu cho kết quả cải thiện về hiệu quả lâm sàng ở nhóm tế bào gốc hơn so với nhóm chứng.
- Qua một phân tích gộp trên 811 bệnh nhân tham gia trong 13 nghiên cứu thử nghiệm lâm sàng ngẫu nhiên về hiệu quả của tế bào gốc tủy xương cho thấy những hiệu quả ở mức độ vừa phải, nhưng có ý nghĩa khác biệt so với nhóm chứng, cụ thể: phân suất tống máu thất trái cải thiện khoảng 3%, thể tích thất trái cuối tâm thu giảm khoảng 5ml, và kích thước sẹo giảm 3,5%. Các phân tích dưới nhóm cho thấy hiệu quả rõ ràng hơn thấy ở nhóm bệnh nhân được bơm tế bào gốc trong vòng 7 ngày sau khi bị NMCT (tối ưu là từ 5-7 ngày sau NMCT) và với số lượng tế bào gốc tủy xương được truyền vào là trên 100 triệu.
Nhược điểm
Tỷ lệ đậu ghép thấp:
- Tỷ lệ tế bào gốc tủy xương được giữ lại thấp dưới 10% bất kể là đường đưa tế bào vào cơ tim là gì. Tế bào bị rửa trôi thông qua hệ tĩnh mạch vành hoặc bị đẩy bật ra khỏi cơ tim qua mỗi nhát bóp của quả Hơn nữa, có khoảng 90% tế bào được giữ lại tại cơ tim sẽ chết trong tuần đầu tiên. Nguyên nhân, liên quan đến cơ chế thiếu máu cơ tim, viêm hay chết theo chương trình do mất sự kết dính với mạng lưới ngoại bào. Sau cấy ghép 4 tuần, chỉ có dưới 1% tế bào được đậu ghép thành công.
- Tỷ lệ đậu ghép thấp không tương xứng với những hiệu quả về cải thiện lâm sàng được ghi nhận qua các nghiên cứu. Chính vì vậy giả thiết về hiệu quả cận tiết của các tế bào gốc được đậu ghép thành công thúc đẩy sự tái tạo cơ tim và cải thiện chức năng thất trái tỏ ra là cách giải thích hợp lý hơn là khả năng biệt hoá trực tiếp thành tế bào cơ
Hiệu quả cận tiết giảm đi theo tuổi và các yếu tố nguy cơ tim mạch đi kèm:
- Tuổi càng cao và càng mắc nhiều yếu tố nguy cơ tim mạch thì càng ảnh hưởng đến chức năng của các tế bào nội sinh và cả môi trường mà tế bào gốc sẽ được đưa vào và đậu ghép.
- Trong các yếu tố nguy cơ tim mạch, đái tháo đường là yếu tố ảnh hưởng nhiều nhất đến hiệu quả cận tiết của tế bào gốc tủy xương. Các nghiên cứu đã cho thấy tỷ lệ tế bào CD34+ KDR+ EPC ở những bệnh nhân này thấp hơn hẳn so với người khoẻ mạnh.
1.3.4 Tế bào gốc trung mô(Mesenchymal Stem Cell)
Nguồn tế bào gốc trung mô đa số nằm ở tủy xương, tuy nhiên cũng có thể được phân lập từ mô mỡ và máu cuống rốn. Tế bào gốc trung mô (MSC) gồm các dòng tế bào CD34- và CD133- có khả năng biệt hoá thành tế bào xương, sụn và mỡ, song cũng có thể biệt hoá thành các tế bào giống cơ tim sau khi cấy vào cơ tim, đồng thời tiết ra cytokine có tác dụng tăng sinh mạch máu, cải thiện dòng chảy trong tuần hoàn bàng hệ.
Ưu điểm
Đây là nguồn tế bào gốc có tính kháng nguyên thấp, có thể nhân rộng trong phòng thí nghiệm nên phù hợp để cấy tế bào gốc dị gen.
Khâu tách chiết từ tủy xương và truyền vào cơ tim đã được chứng minh là an toàn cũng như hiệu quả cải thiện tiên lượng đã được thể hiện qua nhiều nghiên cứu và thử nghiệm lâm sàng.
Nhược điểm
Mặc dù, tế bào gốc trung mô tập trung chủ yếu tại tủy xương nhưng với số lượng rất nhỏ (chiếm khoảng 0,001 – 0,01% tổng số tế bào tủy xương). Chính vì vậy, để đạt được số lượng tế bào đủ để mang lại hiệu quả điều trị thì cần phải nuôi cấy qua nhiều công đoạn. Điều này có thể làm giảm chức năng và chất lượng của tế bào gốc. Số lượng và chất lượng MSC thu lượm được tử tủy xương cũng giảm đi rõ rệt theo tuổi tác và các yếu tố nguy cơ tim mạch đồng mắc, nhất là đái tháo đường. Với nguồn MSC từ mô mỡ, mặc dù việc tách chiết chỉ cần qua một đường mổ tối thiểu nhưng cũng tiềm ẩn các nguy cơ của huyết khối tĩnh mạch hay tắc động mạch phổi, tổn thương nội tạng hay nhiễm khuẩn. Các biến chứng này hiếm gặp nhưng lại rất nghiêm trọng.
1.3.5 Nguyên bào cơ vân(skeletal myoblasts)
Đây là nguồn tế bào gốc (TBG) được thử nghiệm đầu tiên trên người vào tháng 6 năm 2000, sau khi được phân lập từ mảnh sinh thiết cơ đùi, các tế bào được nhân lên và truyền lại bằng cách tiêm vào cơ tim trong khi tiến hành phẫu thuật bắc cầu nối chủ vành ở một bệnh nhân suy tim nặng do thiếu máu cơ tim. Nguyên bào cơ vân hay tế bào “vệ tinh” là nhóm TBG, nằm dưới màng đáy của sợi cơ trưởng thành, bình thường ở trạng thái ngủ. Khác với tế bào cơ tim, sau đẻ, nguyên bào cơ vân vẫn duy trì khả năng vào lại chu trình biệt hoá tế bào và dễ dàng tăng sinh trong môi trường nuôi. Nguyên bào cơ vân có thể phân lập được từ các mẩu sinh thiết sợi cơ vân rồi được nhân lên trong phòng thí nghiệm. Sau khi cấy vào mô chủ, nguyên bào cơ biệt hoá thành tế bào cơ vân trưởng thành, giữ nguyên đặc tính co bóp và khả năng đề kháng với thiếu máu.
Ưu điểm
Đây là dòng tế bào có thể được dễ dàng phân lập, nuôi cấy và được ghép lại cho chính bệnh nhân nên tránh được hiện tượng thải ghép.
Nhược điểm
Qua các nghiên cứu ghi nhận sự tăng tỷ lệ xuất hiện các biến cố rối loạn nhịp tim nguy hiểm khi sử dụng nguyên bào cơ vân. Cơ chế là do nguyên bào cơ vân sau khi đã đi vào khu trú tại vùng cơ tim tổn thương lại không biệt hoá hoàn toàn thành tế bào cơ tim. Mặt khác, chính do loại tế bào gốc này làm giảm sự biểu hiện của protein connexin dẫn đến làm mất vai trò quan trọng liên kết khe, tạo ra sự xung đột về điện học với tế bào cơ tim nội tại và biệt lập về điện-cơ học với mô chủ.
Nghiên cứu MAGIC trên 97 bệnh nhân nhồi máu cơ tim có phân suất tống máu EF < 35% được tiêm nguyên bào cơ vân vào cơ tim trong khi thực hiện phẫu thuật bắc cầu nối chủ vành, sau 6 tháng theo dõi, nhóm tế bào gốc không có sự cải thiện chức năng thất trái hơn so với nhóm chứng. Ngược lại, nghiên cứu ghi nhận các biến cố nghiêm trọng liên quan đến rối loạn nhịp tim nguy hiểm, tăng cao hơn ở nhóm sử dụng nguyên bào cơ vân. Các quan ngại về các biến cố rối loạn nhịp tim đã khiến nguồn tế bào gốc này không còn được sử dụng phổ biến.
1.3.6 Tế bào gốc cơ tim
Tế bào gốc cơ tim (Cardiac stem cells) hiện diện ở quả tim trong thời kỳ phôi thai, sơ sinh sau đẻ và ngay cả ở tuổi trưởng thành, giữ khả năng biệt hoá thành cơ tim hoặc mạch máu và có thể phân lập rồi nhân lên trong phòng thí nghiệm từ các mẩu sinh thiết cơ tim.
Tế bào gốc cơ tim (CSCS) cư trú tại các“ổ”(niches) trong tim và giữ vai trò biệt hoá tái tạo thành cơ tim hay mạch máu. Tuy nhiên, với số lượng rất ít, ước tính chỉ khoảng 1 tế bào cơ tim gốc trên 10.000 tế bào cơ tim.
Sự thay thế các tế bào cơ tim giảm đi theo tuổi (1% ở tuổi 25 và chỉ còn 0,45% khi 75 tuổi) và chỉ có dưới 50% các tế bào cơ tim được thay mới trong suốt cuộc đời của một người trưởng thành.
Ưu điểm
Cũng giống như nguyên bào cơ vân, ưu điểm của tế bào gốc cơ tim có khả năng điều hoà miễn dịch và ức chế miễn dịch. Các nghiên cứu cho thấy nguồn tế bào gốc này biểu hiện MHC (Major Histocompatibility Complex – Phức hợp kháng nguyên phù hợp tổ chức của người) lớp I nhưng thiếu kháng nguyên MHC lớp II nên tránh được sự đào thải miễn dịch
Nhược điểm
Tế bào gốc cơ tim chiếm tỷ lệ rất nhỏ trong cơ tim và lại giảm đi theo tuổi, chính vì vậy khâu phân lập, nuôi cấy nhân số lượng sẽ khó khăn, tốn kém, cũng như mất thời gian hơn. Mặt khác, để lấy được nguồn tế bào này từ cơ tim đòi hỏi phải tiến hành thủ thuật xâm lấn là sinh thiết cơ tim.
1.3.7 Tế bào gốc phôi người
Tế bào gốc phôi (human embryonic stem cells- hESCs) có nguồn gốc từ khối tế bào thuộc lớp bên trong của túi phôi khi ở giai đoạn phôi nang, tiền làm tổ.
Ưu điểm
Chúng có khả năng tự làm mới để tạo thành một số lượng lớn tế bào mà không thay đổi đặc tính đa tiềm năng và có khả năng biệt hóa thành các loại tế bào khác nhau trong cơ thể, trong đó có cả tế bào cơ tim với những đặc điểm về cấu trúc và chức năng của tế bào cơ tim non.
Nhược điểm
Ngay cả khi chưa biệt hoá, các TBG phôi người biểu hiện mức thấp của kháng nguyên HLA lớp I sau đó tăng lên khi tế bào dần trưởng thành. Chính vì vậy, có thể xuất hiện hiện tượng thải ghép khi tế bào gốc được cấy vào vật chủ.
Các nghi ngại về khả năng hình thành các khối u quái (teratomas) do TBG phôi có khả năng biệt hoá in vivo thành khối u quái, các khối u này chứa các tế bào có đặc điểm giống như các tế bào trong ba lớp mầm phôi: nội bì, trung bì, ngoại bì.
Các thử nghiệm trên động vật đã ghi nhận các rối loạn nhịp tim nguy hiểm do mặc dù có tạo được các khoảng nối giữa các TBG với tế bào vật chủ nhưng chính do sự hình thành các mô sợi bảo vệ bao quanh các tế bào gốc được ghép đã khiến cho dẫn truyền điện học không được trọn vẹn và gây ra các rối loạn nhịp tim. Cuối cùng, trở ngại lớn nhất của việc ứng dụng nguồn tế bào gốc này là những tranh cãi về vấn đề đề đạo đức do sử dụng phôi thai người.
1.3.8 Tế bào gốc cảm ứng vạn năng
Phát minh tìm ra nguồn tế bào gốc cảm ứng vạn năng (Induced pluripotent stem cells – iPSCs) được coi là cột mốc quan trọng trong sự phát triển của nền y học tái tạo. Năm 2006, GS. Shinya Yamanaka tại Đại học Kyoto, Nhật Bản, đã công bố bốn gene với các yếu tố sao chép được mã hóa đặc biệt, giúp các tế bào trưởng thành được tái lập trình để thành các tế bào gốc đa tiềm năng tương tự như tế bào gốc phôi. Cùng với GS. John Gurdon, ông được trao giải Nobel Y sinh 2012 cho những “phát hiện về các tế bào trưởng thành có khả năng được tái lập trình để trở thành những tế bào gốc cảm ứng vạn năng”.
Ưu điểm
Các tế bào iPS có thể được tạo ra từ các tế bào trưởng thành trên các mô của cơ thể, đây là nguồn cung cấp tế bào tự thân không giới hạn, hỗ trợ đắc lực cho việc cấy ghép mà không lo nguy cơ bị hệ miễn dịch đào thải. Ngoài ra, nguồn TBG này khắc phục được vấn đề đạo đức khi không phải sử dụng phôi thai người.
Nhược điểm
Để tạo ra được các dòng tế bào iPS riêng biệt cần đầu tư về thời gian và chi phí lớn. Ví dụ như nếu tạo ra 100-1000 tế bào gốc cơ tim cần tối thiểu 6 tháng. Ngoài ra giai đoạn tái lập trình tế bào trưởng thành biến thành iPS có thể gây ra những nguy cơ tiềm ẩn. Chẳng hạn, nếu sử dụng virus để thay đổi kiểu gene trong tế bào, thì một số gene biểu hiện gây bệnh ung thư (oncogene) có khả năng sẽ bị kích hoạt.
2 Các phương thức cấy ghép tế bào gốc trong điều trị suy tim sau nhồi máu cơ tim
Mục đích của bất kỳ phương thức cấy nào đều nhằm đưa đến mô đích một lượng tế bào đủ lớn và duy trì tối đa hiện diện của chúng tại chỗ, vì thế rất cần tính tới vị trí cấy ghép (ảnh hưởng đến khả năng sống ngắn hạn và cả khả năng biệt hoá), khả năng kết dính, xuyên thành mạch và vào mô. Thực tế, các nghiên cứu hiện nay thường áp dụng các đường cấy ghép tế bào gốc như sau:

2.1 Truyền qua đường động mạch vành
Đường mạch máu đặc biệt phù hợp để cấy tế bào vào cơ tim sau nhồi máu cơ tim (NMCT) cấp và đã được tái lưu thông (nong/đặt stent ĐMV) khi dòng chảy động mạch vành (ĐMV) và mật độ các phân tử gắn kết tế bào và chất hoá ứng động còn ở mức cao. Tuy nhiên, số lượng tế bào được gắn kết (homing) vào cơ tim bị tổn thương bằng phương thức này không cao. Tác giả Hofman đã tiến hành đánh dấu các tế bào gốc tủy xương bằng 18 – fluorodeoxyglucose trước khi tiêm vào động mạch vành, kết quả cho thấy chỉ có khoảng 1,3% đến 2,6% số lượng tế bào này đến và cư trú lại được vào cơ tim.
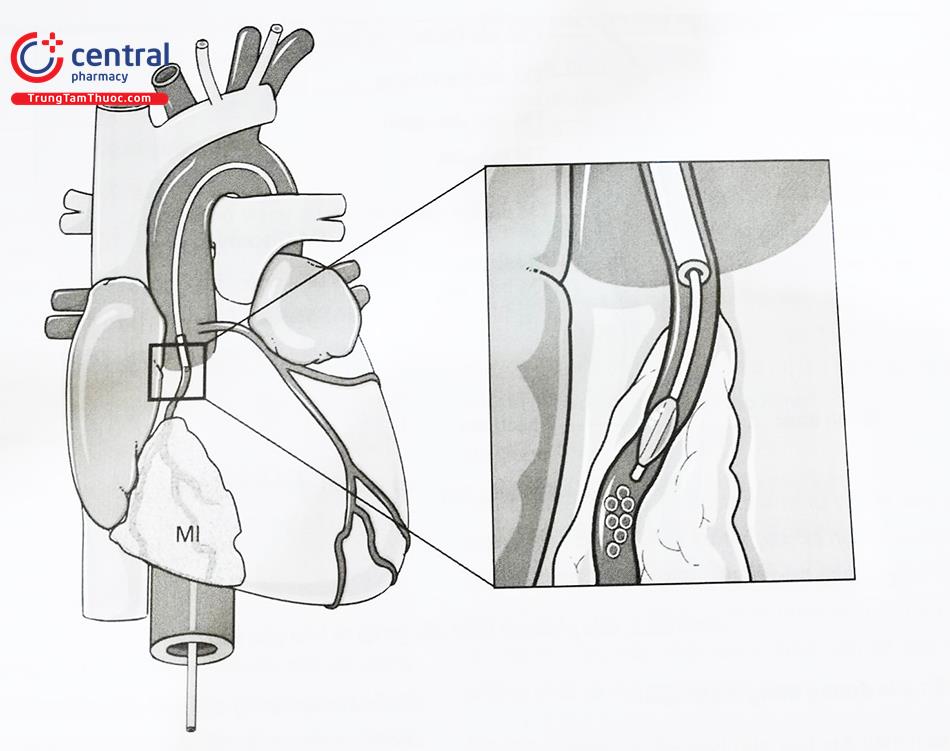
Truyền qua đường động mạch vành chọn lọc được thực hiện bằng cách bơm căng một bóng nong ĐMV (over-the-wire balloon) để gây tắc tạm thời ĐMV thủ phạm NMCT (vị trí đã được can thiệp), sau đó truyền tế bào gốc qua lòng của quả bóng nong nói trên nhằm kéo dài tối đa thời gian tiếp xúc giữa các tế bào gốc và mạng lưới vi mạch tận của ĐMV thủ phạm. Số lượng mỗi lần truyền khoảng 3-5 ml, chứa khoảng 10 triệu tế bào gốc đơn nhân. Trong một lần tiến hành thủ thuật có thể tiến hành truyền nhiều lần, với mỗi lần lên bóng khoảng 3 phút và nghỉ 3 phút.
Kỹ thuật này tương đối đơn giản, có thể thực hiện nhanh chóng trong chưa đầy một giờ. Các nghiên cứu hiện nay cho thấy đây là phương pháp hiệu quả, khá đơn giản và tiện dụng.
Tuy nhiên, nhược điểm là tỷ lệ tế bào gốc cư trú lại được cơ tim thấp, có thể có hiện tượng tắc vi mạch khi nguồn tế bào gốc là những tế bào có kích thước lớn như tế bào trung mô gốc hoặc nguyên bào cơ vân, và không thể truyền tế bào gốc với những mạch đã tắc mà không thể tái thông.

2.2 Truyền qua đường tĩnh mạch ngoại vi
Phương pháp này có vẻ đơn giản nhất, nhưng một số lớn các tế bào gốc sau khi truyền tĩnh mạch sẽ di chuyển và cư trú tại các mô ngoài mô đích, hạn chế khả năng ứng dụng lâm sàng của kỹ thuật này. Hiện nay người ta dùng các biện pháp hoá ứng động tế bào gốc và tế bào non tự thân bằng các chất cytokine… tuy đơn giản, ít sang chấn song mới chỉ được thử nghiệm in vivo rất hạn chế.
2.3 Tiêm trực tiếp vào thành tâm thất
Đây là cách thức cấy được ưa chuộng đối với bệnh nhân ở giai đoạn muộn, khi động mạch vành (ĐMV) tắc ngăn cản quá trình phân tán tế bào gốc (TBG) theo đường mạch máu (bệnh ĐMV mạn tính) hoặc khi chỉ còn rất ít tế bào còn sót lại (mô sẹo) đồng thời rất phù hợp với những dòng tế bào gốc có kích thước lớn như tế bào trung mô gốc hoặc nguyên bào cơ vân, vốn dễ hình thành các cục nghẽn nhỏ gây tắc mạch vành. Biện pháp này chỉ phù hợp với bệnh nhân có bệnh ĐMV mạn tính. Tuy nhiên, khi nguồn TBG được tiêm vào những vùng cơ tim mà nguồn tưới máu nghèo nàn cũng làm giảm tỷ lệ sống sót của các tế bào này.
Đối với bệnh nhân NMCT cấp thì khó khăn hơn về kỹ thuật nhất là khi cần cấy vào vùng ranh giới của ổ nhồi máu cũng như nguy cơ gây thủng tim khi tiêm vào vùng cơ đang tổn thương sau NMCT.
2.4 Tiêm qua tĩnh mạch vành
Sử dụng một hệ thống ống thông tích hợp siêu âm dẫn đường và kim tiêm để cấy tế bào gốc vào cơ tim qua đường tĩnh mạch vành, để cấy tế bào gốc song song với bề mặt thất và sâu xuống vùng cơ tim tổn thương không còn sống cho những bệnh nhân suy tim-cơ tim giãn do thiếu máu. Biện pháp này khá phức tạp, đòi hỏi có các phương tiện định vị như hệ thống NOGA thăm dò điện sinh lý tim và tiêm trực tiếp từ trong nội mạc ra.

3 Cơ chế hoạt động của tế bào gốc trong điều trị suy tim sau nhồi máu cơ tim cấp
3.1 Biệt hoá thành các tế bào cơ tim
Về mặt lý thuyết, sự biệt hoá của tế bào gốc thành tế bào cơ tim, mạch máu có vẻ là cách giải thích hợp lý nhất, tuy nhiên trên thực tế các bằng chứng qua các nghiên cứu cho tới thời điểm hiện tại lại không ủng hộ rằng đây là cơ chế chủ yếu.
Qua theo dõi, 90% tế bào sẽ bị rửa trôi trong vòng 24 giờ đầu, và có tới 90% các tế bào còn bám trụ lại được sẽ bị chết trong tuần đầu. Vì vậy, chỉ có dưới 1% các tế bào gốc được tiêm vào có thể được gắn kết vào vùng cơ tim tổn thương trong thời gian dài sau đó.
Cơ chế biệt hoá tế bào gốc trung mô thành tế bào cơ tim còn gây nhiều tranh cãi, có các thử nghiệm lâm sàng ủng hộ giả thiết này cũng như các kết quả từ các nghiên cứu khác bác bỏ.
Tương tự, tế bào cơ tim gốc – là TBG đa năng, có thể biệt hoá thành tế bào cơ tim, tế bào nội mô và tế bào cơ trơn mạch máu qua các thử nghiệm in vitro. Tuy nhiên, trên các thử nghiệm trên chuột và lợn là các đối tượng nghiên cứu bị suy tim mạn tính sau NMCT, kết quả cho thấy sự cải thiện chức năng thất trái và số lượng tế bào được biệt hoá là không tương xứng.
Trong hầu hết các nghiên cứu cho tới nay cho thấy tình trạng cải thiện chức năng tim mạch dường như không liên quan đến các số lượng tế bào gốc được biệt hoá thành cơ tim. Chính vì vậy, các cơ chế khác đóng vai trò chủ chốt hơn được trình bày ngay sau đây.
3.2 Hiệu ứng cận tiết
Hiệu ứng cận tiết được coi là cơ chế quan trọng nhất tạo ra hiệu quả của tế bào gốc trong điều trị các bệnh lý tim mạch bằng cách tiết ra các chất tín hiệu như cytokin, chemokine, các yếu tố tăng trưởng, exosome và các tiểu phân tử trong tuần hoàn ra các mô xung quanh. Điều này giúp hoạt hóa quá trình tân tạo bao gồm hoạt hoá các tế bào cơ tim gốc nội sinh, tân tạo mạch máu, ức chế quá trình tự chết của tế bào theo chương trình, tái cấu trúc chất nền ngoại bào. Kết quả, chức năng thất trái được cải thiện, cơ tim được sửa chữa.
3.2.1 Hoạt hoá các tế bào cơ tim gốc nội sinh
Tang và cộng sự trong thử nghiệm lâm sàng với đối tượng nghiên cứu là chuột bị suy tim sau nhồi máu cơ tim, đã tìm thấy tế bào cơ tim gốc được hoạt hoá không những ở vùng bị nhồi máu và cả vùng lân cận. Từ đó cho thấy giả thiết hiệu quả cận tiết giúp hoạt hoá các cơ tế bào cơ tim gốc. Chính các tế bào cơ tim gốc này lại tiết ra các yếu tố tăng trưởng làm thu hút các tế bào khác đến cư trú và biệt hoá thành cơ tim, mạch máu.
3.2.2 Khởi phát quá trình tân sinh mạch
Các tế bào gốc có thể khởi phát quá trình tân sinh mạch bằng cách tiết ra các chemokine – yếu tố bắt nguồn từ tế bào đệm và các yếu tố tăng sinh mạch máu. Các tế bào tiền thân nội mạc di cư đến vùng cơ tim bị thiếu máu sẽ tiết ra enzyme tổng hợp Nitric oxide cảm ứng tại nội mô và kéo dài thời gian sống của tế bào này.
Đây là cơ chế đóng vai trò quan trọng trong các trường hợp tắc mạn tính động mạch vành, khi mà vùng cơ tim bị thiếu máu nhưng vẫn còn khả năng sống sót. Sự tăng sinh mạch giúp cải thiện tình trạng hệ thống mạch máu nghèo nàn ở những bệnh nhân này. Trên lâm sàng, việc cải thiện tuần hoàn bàng hệ này giúp cải thiện chức năng co bóp của cơ tim.
Tuy nhiên, với những bệnh nhân mà vùng cơ tim bị tổn thương đã được tái thông, hay được tưới máu bởi các mạch máu lớn, hoặc những bệnh cơ tim không do thiếu máu thì cơ chế này lại không có vai trò rõ ràng nữa.
3.2.3 Ức chế quá trình tự chết của tế bào theo chương trình (apotosis)
Hàng loạt các nghiên cứu đã cho thấy các yếu tố cận tiết như yếu tố tăng trưởng insulin-1 được tiết ra bởi các tế bào gốc có thể giúp ức chế quá trình apoptosis. Nghiên cứu của Bonaros và cộng sự cho thấy khi kết hợp nguyên bào cơ vân và tế bào AC133+ giúp cải thiện chức năng cơ tim thông qua hạn chế apoptosis.
3.2.4 Ức chế sự phì đại cơ tim
Qua một số các nghiên cứu về suy tim cho thấy có sự giảm phì đại cơ tim ở những bệnh nhân được điều trị tế bào gốc. Cơ chế của hiện tượng này cũng chưa thật sự rõ ràng là do cơ chế tác động trực tiếp của các tế bào gốc hay là thứ phát do hoạt động của tim được cải thiện nhờ các cơ chế nêu trên.
3.2.5 Tái cấu trúc chất nền ngoại bào
Tế bào gốc có khả năng điều hoà một số thành phần cấu tạo nên chất nền ngoại bào giúp làm hạn chế vùng nhồi máu lan rộng, thúc đẩy quá trình tái cấu trúc thất trái và giảm sẹo xơ cơ tim.
Các nghiên cứu đã chỉ ra nguyên bào cơ vân có tác dụng bảo tồn cấu trúc của mạng lưới Collagen giúp giảm sự xơ hoá ở vùng ngoại vi và lân cận với vùng nhồi máu. Nguồn TBG này cũng có khả năng điều chỉnh MMP-2 và ức chế nồng độ MMP-4 tại mô, tạo ra các tác động thuận lợi trên chuyển hóa của chất nền ngoại bào. Các Matrix Metalloproteinase (MMPs) là một họ các enzyme giữ chức năng quan trọng trong việc phân hủy chất nền ngoại bào, phá vỡ lớp màng cơ bản và được biểu hiện trong các mảng xơ vữa động mạch.
4 Kết quả các thử nghiệm lâm sàng sử dụng liệu pháp tế bào gốc tuỷ xương tự thân trong điều trị suy tim sau nhồi máu cơ tim cấp
4.1 Trên thế giới
Trong khoảng thời gian 20 năm qua, đã có khoảng hơn 90 nghiên cứu, thử nghiệm lâm sàng ngẫu nhiên có đối chứng với hơn hàng chục nghìn bệnh nhân tham gia, được cấy tế bào gốc tủy xương tự thân trong điều trị nhồi máu cơ tim (NMCT) cấp, suy tim hay đau ngực dai dẳng.
Nghiên cứu thử nghiệm lâm sàng đầu tiên áp dụng trên đối tượng là con người được công bố năm 2001 tại Đức. Tác giả Strauer và cộng sự đã tiến hành tiêm tế bào gốc đơn nhân tủy xương tự thân vào động mạch vành cho một bệnh nhân nam 46 tuổi. Bệnh nhân này trước đó bị nhồi máu cơ tim cấp, tắc hoàn toàn động mạch liên thất trước và đã được can thiệp đặt stent. Sau tiêm tế bào gốc 10 tuần theo dõi, diện tích vùng nhồi máu cơ tim giảm từ 24,6% xuống 15,7%, chức năng tâm thu thất trái và chỉ số tim tăng từ 20% lên 30%. Thành công từ trường hợp ban đầu này đã khởi đầu cho hàng loạt nghiên cứu sau đó.
Năm 2002, tác giả Strauer và cộng sự tiếp tục tiến hành cấy ghép TBG tủy xương tự thân tiêm vào động mạch vành cho 10 bệnh nhân suy tim sau NMCT, so sánh với 10 bệnh nhân nhóm chứng chỉ được can thiệp động mạch vành (ĐMV) qua da thường quy. Kết quả sau 3 tháng theo dõi, ở nhóm được cấy ghép tế bào gốc diện nhồi máu được cải thiện trên kỹ thuật chụp thất đồ (ventriculography) (từ 30 ± 13 giảm còn 12 ± 7%, p=0,005), và sự cải thiện ở nhóm bệnh nhân này nhiều hơn nhóm chứng một cách có ý nghĩa thống kê (p = 0,04).
Cũng trong năm 2002, thử nghiệm TOPCARE-AMI cũng đã được đăng tải kết quả trên tạp chí Circulation. Thử nghiệm được tiến hành trên 29 bệnh nhân nhồi máu cơ tim được tiêm TBG tủy xương tự thân sau khoảng 4,9 ± 1,5 ngày sau can thiệp ĐMV. Nhóm chứng có 30 bệnh nhân được tiêm tế bào tiền thân lưu hành (circulating blood–derived progenitor cells-CPCs). Sau 4 tháng theo dõi, bệnh nhân được chụp buồng thất trái và cho kết quả phân số tống máu thất trái cải thiện rõ rệt và có ý nghĩa thống kê (50 ± 10% tới 58 ± 10%; p<0,001) và thể tích cuối tâm thu thất trái giảm (từ 54 ± 19 ml xuống còn 44 ± 20 ml; p<0,001). Qua chụp cộng hưởng từ tim, cũng cho thấy kết quả cải thiện EF (p<0,001) và vùng nhồi máu cơ tim được thu nhỏ hơn.
Năm 2004, thử nghiệm lâm sàng ngẫu nhiên có đối chứng BOOST thực hiện trên 30 bệnh nhân được cấy ghép tế bào gốc tự thân sau can thiệp NMCT và 30 bệnh nhân nhóm chứng. Cộng hưởng từ tim cũng là phương pháp chẩn đoán hình ảnh được lựa chọn để đánh giá sự thay đổi của chức năng tâm thu thất trái sau 6 tháng. Kết quả cho thấy: EF tăng thêm 6,7% so với nhóm chứng chỉ tăng 0,7% (p=0,0026). Mặc dù sự cải thiện chức năng thất trái là rõ ràng ở nhóm được cấy ghép tế bào gốc, nhưng không có sự khác nhau giữa 2 nhóm về tỷ lệ xuất hiện các biến cố tim mạch. Những lợi ích quan sát được đã mất sau 18 tháng trừ trường hợp có diện nhồi máu lớn (> 60%) và EF thấp < 50% tại thời điểm tiêm tế bào gốc.
Trong số những thử nghiệm sử dụng tế bào gốc từ máu hoặc tủy xương, thử nghiệm có đối chứng, mù đôi REPAIR – AMI đánh dấu cột mốc quan trọng nhất. Đây là một trong những thử nghiệm có số lượng bệnh nhân lớn nhất, với 204 bệnh nhân nhồi máu cơ tim đã được can thiệp ĐMV qua da thành công. Sau 3-7 ngày, người bệnh sẽ được lựa chọn ngẫu nhiên vào nhóm được bơm tế bào gốc tủy xương tự thân vào động mạch vành hoặc nhóm chỉ bơm giả dược. Phân số tống máu thất trái được đánh giá lại sau 4 tháng. Kết quả cho thấy ở nhóm được cấy ghép tế bào gốc tự thân sự cải thiện khoảng 2,5% hơn so với nhóm chứng (5,5 ± 7,3% so với 3,0 ± 6,5%, 95% CI, 0,5-4,5, p=0,01). Và ở nhóm bệnh nhân có chức năng tâm thu thất trái giảm nhiều, được cấy ghép tế bào gốc tự thân thì sự hồi phục lại nhanh hơn và nhiều hơn so với nhóm còn lại. Kết quả sự cải thiện phân số tống máu ở những bệnh nhân được cấy ghép tế bào gốc tiếp tục được duy trì sau 4 năm qua đánh giá bằng chụp cộng hưởng từ tim. Tương tự như nghiên cứu BOOST, những ca có LVEF < 50% có sự cải thiện là rõ ràng hơn.
Nghiên cứu FINCELL thử nghiệm trên 80 bệnh nhân, nhóm bệnh được tiêm tế bào gốc tự thân tủy xương (4,0 ± 2,0 x 108 tế bào) vào động mạch vành sau 2 đến 6 ngày sau NMCT cấp có ST chênh lên, so sánh với nhóm chứng chỉ được tiêm giả dược. Sau 6 tháng theo dõi, nhóm được tiêm tế bào gốc có sự cải thiện LVEF hơn một cách có ý nghĩa so với nhóm chứng (4,0% ± 11,2% so với -1,4% ± 10,2%, p=0,03). Tuy nhiên, sự cải thiện này lại không mang lại khác biệt về biến cố tim mạch chính và rối loạn nhịp tim.
Bên cạnh các nghiên cứu cho kết quả dương tính, thì cũng có một số nghiên cứu lại không thấy được lợi ích cải thiện lâm sàng và tiên lượng của tế bào gốc tủy xương. Một số nghiên cứu về thời gian tối ưu để tiêm tế bào ở bệnh nhân nhồi máu cơ tim cấp chưa mang lại kết quả như mong đợi. Đặc biệt, các nghiên cứu TIME, lateTIME và gần đây là REGENERATE-AMI đã không thể chứng minh lợi ích của việc tiêm sớm (3-7 ngày) và/hoặc muộn (2-3 tuần) tế bào gốc trong điều trị nhồi máu cơ tim cấp.
Nghiên cứu HEBE chia ngẫu nhiên 200 bệnh nhân NMCT thành 3 nhóm: nhóm được tiêm TBG đơn nhân tủy xương vào động mạch vành sau 3 đến 8 ngày sau NMCT, nhóm được tiêm tế bào đơn nhân tiền thân lưu hành và nhóm chỉ điều trị chuẩn mà không tiêm placebo (giả dược). Sau thời gian 4 tháng, không thấy có sự khác biệt về chức năng thất trái, diện nhồi máu cũng như các biến cố tim mạch chính ở 3 nhóm này. Kết quả tương tự cũng lặp lại trong nghiên cứu ASTAMI khi LVEF và các biến cố tim mạch chính là không có sự cải thiện rõ rệt ở nhóm được tiêm tế bào gốc so với nhóm chứng.
Qua kết quả của hơn 60 nghiên cứu, thử nghiệm lâm sàng ngẫu nhiên đã công bố hơn 18 năm qua, đã có một số nghiên cứu gộp đánh giá hiệu quả của nguồn TBG tủy xương trong điều trị suy tim sau NMCT cấp. Một nghiên cứu gộp gần đây, dựa trên tổng hợp từ 22 nghiên cứu với 2037 bệnh nhân, trong đó có 1218 bệnh nhân được điều trị bằng tế bào gốc tủy xương đơn nhân. Kết quả cho thấy đây là một biện pháp điều trị an toàn, phân suất tống máu thất trái (LVEF) tăng (+2,1%), giảm diện cơ tim bị nhồi máu (-2,7%) và thể tích thất trái cuối tâm thu giảm đáng kể (-4 mL) mà không làm tăng các biến cố ngắn hạn. Phân tích dưới nhóm sâu hơn cho thấy sự cải thiện LVEF rõ ràng nhất ở (1) nhóm bệnh nhân có mức LVEF ban đầu thấp, (2) nhóm được tiêm nhiều hơn 1×106 tế bào gốc, (3) thời gian được tiêm tế bào gốc trong từ 5 đến 30 ngày sau NMCT.
Một nghiên cứu gộp khác từ 50 nghiên cứu với 2625 bệnh nhân được tuyển chọn với chẩn đoán bệnh tim thiếu máu cục bộ (cả cấp và mạn tính) đã cho kết quả ở nhóm được điều trị bằng tế bào gốc tủy xương có sự cải thiện hơn về LVEF (+3,95%), diện nhồi máu cơ tim được thu nhỏ (-4,03%) và thể tích cuối tâm thu thất trái giảm (-5,23 mL). Tương tự như nghiên cứu gộp trên, khi phân tích dưới nhóm cho thấy (1) nhóm bệnh nhân có LVEF ban đầu thấp và (2) được nhận nhiều hơn 4×107 TBG tủy xương thì có sự cải thiện LVEF nhiều hơn so với nhóm còn lại. Cả 2 phân tích gộp trên đều nhấn mạnh đến tầm quan trọng của số lượng tế bào gốc sử dụng, lựa chọn thời điểm tiêm cũng như diện cơ tim nhồi máu đóng vai trò quan trọng đến kết quả và tiên lượng điều trị. Điểm cần nhấn mạnh là ở nhóm TBG cho thấy có sự cải thiện có ý nghĩa về tỷ lệ tử vong do mọi nguyên nhân (OR: 0,39), tử vong do nguyên nhân tim mạch (OR: 0,41), tái NMCT (OR: 0,25) và tái hẹp trong stent (OR: 0,34). Không có sự khác biệt về biến cố xuất hiện loạn nhịp thất ở 2 nhóm.
Ngược lại, cũng có nghiên cứu gộp cho kết quả âm tính về hiệu quả của tế bào gốc tủy xương trong điều trị suy tim sau NMCT cấp. Một tổng quan hệ thống dữ liệu Cochrance công bố năm 2015 với 41 nghiên cứu ngẫu nhiên, có đối chứng, sử dụng tế bào đơn nhân tủy xương trên 2732 bệnh nhân cho thấy liệu pháp này an toàn nhưng không cải thiện chất lượng cuộc sống hay LVEF ngắn hạn và dài hạn. Mức khác biệt trung bình của LVEF giữa nhóm điều trị và nhóm chứng là 2-5%. Mức khác biệt này tương đương với sai số thường gặp trong các kĩ thuật chẩn đoán hình ảnh và không có ý nghĩa lâm sàng.
Kết quả của các thử nghiệm lâm sàng về các tế bào đơn nhân tủy xương (BMC) ở những bệnh nhân có bệnh tim thiếu máu cục bộ là không đồng nhất do thời gian quan sát khác nhau sau khi cấy ghép BMC, sự khác biệt lớn trong tách chiết BMC và đặc tính của tế bào, kỹ thuật và thời gian cấy ghép BMC, số lượng và khối lượng tế bào tiêm. Tuy nhiên, xu hướng quan trọng có thể được thấy rõ từ ba phân tích gộp riêng biệt từ nhiều thử nghiệm BMC tự thân dùng cho bệnh nhân chủ yếu qua đường truyền vào động mạch vành trong điều trị nhồi máu và/ hoặc bệnh cơ tim thiếu máu cục bộ. Nói chung, liệu pháp tế bào gốc tủy xương cải thiện đáng kể EF khoảng 3-4% (1,26-7,4%), giảm thể tích cuối tâm thu thất trái khoảng 5,7 mL (-1,41 đến
-12,20 mL) và làm giảm kích thước vùng nhồi máu khoảng 4,9% (-1,11 đến -9,10%) so với nhóm chứng. Về tính an toàn, không phân tích gộp nào cho thấy có sự gia tăng rối loạn nhịp tim, khối u, ung thư. Do đó, liệu pháp cấy ghép tế bào gốc tự thân cho thấy tính an toàn và khả năng giúp cải thiện phân suất tống máu thất trái và giảm kích cỡ vùng nhồi máu.
Nghiên cứu được công bố trong năm 2020 là BAMI, vốn được đặt nhiều kỳ vọng nhưng cũng cho kết quả âm tính về hiệu quả của liệu pháp tế bào gốc tủy xương trong điều trị suy tim sau NMCT cấp. Lý giải cho kết quả này, do ban đầu nghiên cứu dự kiến sẽ tuyển chọn số lượng bệnh nhân lớn là 3000. Tuy nhiên, trong thực tế, do các yếu tố khách quan chỉ có 375 bệnh nhân tham gia nên các số liệu về các biến cố chưa đủ lớn để có thể thấy được sự khác biệt rõ rệt về thống kê y học giữa hai nhóm nghiên cứu.
Như vậy, các nghiên cứu cho các kết quả rất khác nhau, thậm chí là trái ngược nhau. Theo chúng tôi, có một số yếu tố có thể ảnh hưởng đến sự thống nhất giữa các kết quả này.
Thứ nhất là số lượng bệnh nhân, vì đây là một can thiệp mang tính chất xâm nhập nhiều với chi phí cao nên đa số các nghiên cứu có số lượng bệnh nhân dưới 30 ca, đặc biệt là ở nhóm chứng chỉ với 10-20 bệnh nhân. Ngoài ra một số nghiên cứu chọn lựa bệnh nhân với tỉ lệ nhóm tế bào gốc/nhóm chứng = 2/1 hoặc 3/1. Với số lượng ít như vậy rõ ràng sẽ ảnh hưởng đến kết quả của nghiên cứu khi so sánh giữa hai nhóm.
Thứ hai là vị trí tổn thương. Như đã biết, trong nhồi máu cơ tim thành sau và thành bên, quá trình tái cấu trúc thường ít diễn ra hoặc diễn ra với mức độ ít. Với giả thiết là các tế bào gốc sẽ làm cải thiện quá trình tái tưới máu thì rõ ràng vị trí tổn thương có thể làm thay đổi hiệu quả của phương pháp điều trị bằng tế bào gốc. Như vậy, các nghiên cứu trên những bệnh nhân có vị trí tổn thương khác nhau sẽ có thể cho kết quả khác nhau. Đồng thời, ngay trong những nghiên cứu bao gồm nhiều vị trí tổn thương khác nhau thì tỉ lệ khác nhau giữa các vị trí tổn thương giữa hai nhóm cũng có thể ảnh hưởng đến kết quả so sánh.
Thứ ba là thời gian từ khi cơ tim bị nhồi máu đến khi được tái tưới máu. Khoảng thời gian này sẽ ảnh hưởng đến mức độ suy tim sau nhồi máu cơ tim. Rõ ràng thời gian này càng kéo dài, nếu có kết hợp với nhồi máu diện rộng thì mức độ suy tim sẽ càng nặng nề. Trong những trường hợp này, cho dù bệnh nhân được ghép tế bào gốc từ sớm thì hiệu quả cũng sẽ bị ảnh hưởng nhất định.
Thứ tư là số lượng tế bào gốc được ghép cho bệnh nhân. Trong tất cả các nghiên cứu đều sử dụng một liều cố định cho tất cả các bệnh nhân. Điều đó có nghĩa là các bệnh nhân trong một nghiên cứu này có thể chỉ được ghép một lượng tế bào gốc ít hơn bệnh nhân trong nghiên cứu khác mặc dù họ có cùng một vị trí cũng như diện tích nhồi máu. Như đã phân tích ở trên, hiệu quả cải thiện suy tim của các tế bào gốc là kết quả khi tốc độ và mức độ tái sinh của các tế bào gốc vượt qua tốc độ và mức độ tái cấu trúc cơ tim sau nhồi máu. Trong khi đó, quá trình tái cấu trúc cơ tim phụ thuộc vào diện cơ tim bị nhồi máu. Như vậy, nếu như số lượng tế bào gốc không đủ thì sẽ không thể cải thiện được quá trình gây suy tim này. Trên thực tế, chúng tôi chưa thấy có nghiên cứu nào đưa ra được liều tế bào gốc thích hợp cho từng diện nhồi máu cũng như vị trí bị nhồi máu. Trong nghiên cứu này, chúng tôi cố gắng đưa ra một liều tế bào gốc ở mức độ đủ nhiều như trong các nghiên cứu trên thế giới và thích hợp với người Việt Nam.
Thứ năm là thời gian theo dõi. Như đã phân tích ở trên, chúng tôi cho rằng sau khi nhồi máu, quá trình tái cấu trúc diễn ra mạnh mẽ trong 6 tháng đầu và còn tiếp diễn đến sau 12 tháng. Đấy là lý do vì sao các ca tử vong do suy tim thường xảy ra trong khoảng 6-12 tháng. Như vậy, nếu như chỉ theo dõi và đánh giá trong vòng 6 tháng đầu thì có khả năng quá trình tái cấu trúc vẫn diễn ra rất mạnh mẽ khiến cho chúng ta chưa thể thấy được sự cải thiện chức năng thất trái do các tế bào gốc mang lại. Tuy nhiên, cũng có một vài nghiên cứu thấy được sự khác biệt giữa hai nhóm bệnh nhân trong 6 tháng đầu nhưng mức độ cải thiện chức năng thất trái của hai nhóm lại như nhau khi theo dõi đến 12 tháng. Điều này cho thấy các tế bào gốc có khả năng làm chậm tốc độ của quá trình tái cấu trúc trong 6 tháng đầu. Tuy nhiên, sau 6 tháng, có thể tốc độ hồi phục tự nhiên ở nhóm chứng đã bắt kịp tốc độ của các tế bào gốc. Mặc dù vậy, cũng cần phải lưu ý về vấn đề số lượng bệnh nhân thuộc nhóm chứng ở các nghiên cứu này đều chỉ bằng 1/3 hoặc 1/2 so với nhóm tế bào gốc.
Ngoài ra còn một yếu tố nữa rõ ràng sẽ ảnh hưởng đến chức năng thất trái sau nhồi máu cơ tim. Đó chính là các thuốc điều trị suy tim sau nhồi máu. Các khuyến cáo của Hội Tim mạch Hoa Kỳ và châu Âu trong việc sử dụng thuốc đã chứng minh các loại thuốc này có tác dụng cải thiện chức năng thất trái. Tuy nhiên, trong các nghiên cứu này rất ít đề cập đến các loại thuốc được chỉ định sau khi bệnh nhân được can thiệp cũng như sau khi được ghép tế bào gốc. Do đó cũng có thể dẫn đến sự khác biệt về kết quả của các nghiên cứu.
Như vậy, các nghiên cứu riêng lẻ do có sự khác nhau về thiết kế nghiên cứu mang lại những kết quả trái ngược nhau về khả năng cải thiện chức năng thất trái của phương pháp điều trị tế bào gốc. Tuy nhiên khi xem xét các nghiên cứu gộp, chúng tôi thấy có sự cải thiện rõ ràng về chức năng thất trái của nhóm tế bào gốc so với nhóm chứng. Các nghiên cứu đều cho thấy sự an toàn và khả thi của phương pháp điều trị tế bào gốc như điều trị bổ sung sau khi được can thiệp tái tưới máu thì đầu ở bệnh nhân NMCT.
4.2 Tại Việt Nam
Năm 2007, Trường Đại học Y Hà Nội đã chủ trì nghiên cứu một đề tài cấp Nhà nước KC01/06 với nội dung “Ứng dụng tế bào gốc trong điều trị một số bệnh tim mạch, giác mạc và cơ quan tạo máu” do GS.TS. Đỗ Doãn Lợi làm chủ nhiệm. Đề tài đã được nghiệm thu với kết quả đạt được đáng khích lệ. Một loạt các hướng nghiên cứu cận lâm sàng và lâm sàng đã được triển khai như nghiên cứu nuôi cấy tế bào gốc, biệt hóa tế bào cơ tim từ phôi thai, nghiên cứu nuôi cấy mảnh giác mạc, ứng dụng trong điều trị bệnh tạo máu, và đặc biệt đã triển khai bước đầu trên một số bệnh nhân suy tim sau nhồi máu cơ tim cấp.
Đề tài nhánh (thuộc đề tài cấp Nhà nước KC01/06): “Điều trị thử nghiệm tế bào gốc tự thân từ tủy xương cho bệnh nhân suy tim nặng do nhồi máu cơ tim” do GS.TS. Nguyễn Lân Việt làm chủ nhiệm đề tài đã bước đầu cho thấy tính khả thi và hiệu quả của phương pháp này. Nghiên cứu được công bố trên Tạp chí Tim Mạch Việt Nam số 52 và 54 năm 2010, do với số lượng bệnh nhân còn hạn chế (6 bệnh nhân) nên đề tài mới chỉ có thể có những kết luận sơ bộ ban đầu. Kết quả sơ bộ: có sự cải thiện rõ rệt về triệu chứng cơ năng, chỉ số BNP và EF của người bệnh ở thời điểm 1 năm sau tiêm tế bào gốc so với trước điều trị.
Đề tài độc lập cấp Nhà nước: “Nghiên cứu sử dụng tế bào gốc tự thân trong điều trị suy tim sau nhồi máu cơ tim” (Mã số: ĐTĐL.2011T/09) do GS.TS. Nguyễn Lân Việt làm chủ nhiệm đề tài cũng đã được nghiệm thu kết quả năm 2014. Đối tượng nghiên cứu bao gồm 100 bệnh nhân thỏa mãn tiêu chuẩn lựa chọn và loại trừ và được tuyển chọn vào nghiên cứu, chia làm 2 nhóm: Nhóm được cấy ghép tế bào gốc tự thân (n=50) và nhóm chứng (n=50). Qua thời gian theo dõi là 12 tháng, kết quả cho thấy phương pháp tách chiết, vận chuyển, bảo quản và cấy ghép tế bào gốc tự thân từ tủy xương trong điều trị suy tim sau nhồi máu cơ tim là khả thi, an toàn với tỷ lệ thành công về mặt kỹ thuật thu gom dịch tủy xương và kỹ thuật bơm tế bào gốc vào động mạch vành là 100%.
Liệu pháp tế bào gốc cho hiệu quả cao trong điều trị suy tim sau nhồi máu cơ tim cấp, thể hiện:
Trên lâm sàng: Phân độ NYHA cải thiện ở nhóm tế bào gốc hơn so với nhóm chứng tại thời điểm tháng thứ 12 (1,90 ± 0,29 so với 2,10 ± 0,34, p12=0,005).
Trên cận lâm sàng: Tại thời điểm kết thúc nghiên cứu, ở nhóm tế bào gốc, phân suất tống máu thất trái (EF) đều được cải thiện một cách có ý nghĩa thống kê hơn so với nhóm chứng trên cả 3 phương pháp đánh giá là siêu âm tim, chụp buồng thất trái và chụp cộng hưởng từ tim.
Trong 12 tháng theo dõi và ghi nhận các biến cố xảy ra, có 09 bệnh nhân tử vong: nhóm tế bào gốc 4 bệnh nhân và nhóm chứng 5 bệnh nhân. Trong đó, biến cố cộng gộp bao gồm: tử vong, tái nhồi máu cơ tim, tái can thiệp ĐMV, tái nhập viện do suy tim gặp ít hơn ở nhóm tế bào gốc so với nhóm chứng (12% so với 26%, p=0,041).
TÀI LIỆU THAM KHẢO
- J. Benjamin, P. Muntner, A. Alonso et al. (2019), Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association, Circulation, 139(10): e56-e528.
- C. Wollert, G. P. Meyer, J. Lotz et al. (2004), Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomized controlled clinical trial, Lancet, 364(9429): 141-8.
- Schachinger, S. Erbs, A. Elsasser et al. (2006), Improved clinical outcome after intracoronary administration of bone-marrow-derived progenitor cells in acute myocardial infarction: final 1-year results of the REPAIR-AMI trial, Eur Heart J, 27(23): 2775-83.
- Đỗ Doãn Lợi Nguyễn Lân Việt, Phạm Mạnh Hùng và cộng sự (2010), Kết quả bước đầu điều trị thử nghiệm tế bào gốc tự thân từ tủy xương cho bệnh nhân bị suy tim sau nhồi máu cơ tim, Tạp chí Tim mạch học Việt Nam 52: 53-63.
- Hirsch, R. Nijveldt, P. A. van der Vleuten et al. (2011), Intracoronary infusion of mononuclear cells from bone marrow or peripheral blood compared with standard therapy in patients after acute myocardial infarction treated by primary percutaneous coronary intervention: results of the randomized controlled HEBE trial, Eur Heart J, 32(14): 1736-47.
- O. Beitnes, E. Hopp, K. Lunde et al. (2009), Long-term results after intracoronary injection of autologous mononuclear bone marrow cells in acute myocardial infarction: the ASTAMI randomized, controlled study, Heart, 95(24): 1983-9.
- Mathur, F. Fernandez-Aviles, J. Bartunek et al. (2020), The effect of intracoronary infusion of bone marrow-derived mononuclear cells on all-cause mortality in acute myocardial infarction: the BAMI trial, Eur Heart J, 41(38): 3702-3710.
- P. Meyer, K. C. Wollert, J. Lotz et al. (2009), Intracoronary bone marrow cell transfer after myocardial infarction: 5-year follow-up from the randomized-controlled BOOST trial, Eur Heart J, 30(24): 2978-84.
- Nguyễn Lân Việt, Phạm Mạnh Hùng và cộng sự (2014), Đánh giá kết quả điều trị suy tim sau nhồi máu cơ tim bằng phương pháp cấy ghép tế bào gốc tủy xương tự thân, Tạp chí Tim mạch học Việt Nam.

