Rối loạn lipid máu và đại cương các thuốc điều trị
Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 CÁC NGUYÊN LÝ CHUNG
1.1 Định nghĩa
Nhiều định nghĩa có thể được tìm thấy trong các hướng dẫn điều trị. Định nghĩa sau đây có nguồn gốc từ Hiệp hội Lipid Quốc gia Hoa kỳ (NLA) trong đó nồng độ lipid máu được biểu diễn bằng đơn vị mg/dL đối với người lớn [1].
- Lipoprotein cholesterol tỷ trọng thấp (LDL-C):
- <100(<2,6 < 100 (< 2,6 mmol/L) ngưỡng mong muốn.
- Từ 100 - 129 ( 2,6- 3,3 mmol/L) bình thường, trên ngưỡng mong muốn.
- Từ 130 - 159 (3,4- 4,1 mmol/L) ranh giới cao.
- Từ 160 - 189 (4,1- 4,9 mmol/L) ngưỡng cao.
- >190 (25 mmol/L) rất cao.
Cholesterol lipoprotein tỷ trọng cao (HDL-C):
- <40 (1,05 mmol/L) đối với nam: thấp.
- < 50 (1,3 mmol/L) đối với nữ: thấp.
Cholesterol không phải là lipoprotein tỷ trọng cao (Non-HDL-C):
- < 130 (< 3,4 mmol/L) ngưỡng mong muốn.
- Từ 130 - 159 (3,4 - 4,1 mmol/L) trên ngưỡng mong muốn.
- Từ 160 - 189 (4,1- 4,9 mmol/L) ranh giới cao.
- Từ 190 – 219 (5-5,8 mmol/L) cao.
- >220 (25,8 mmol/L)rất cao.
Triglycerid:
- <150 (< 1,7 mmol/L) bình thường.
- Từ 150 - 199 (1,7- 2,25 mmol/L) ranh giới cao.
- Từ 200 - 499 (2,3- 5,6 mmol/L) cao.
- >500 (5,7 mmol/L) rất cao.
Rối loạn lipid máu thường rơi vào một trong bốn kiểu chung sau đây:
- Tăng triglycerid đơn độc.
- Tăng LDL - C đơn độc.
- Tăng triglycerid và LDL - C.
- HDL - C thấp đơn độc.
1.2 Dịch tễ học
Rối loạn lipid máu rất phổ biến ở Mỹ. Ước tính có khoảng 28,5 triệu người > 20 tuổi có nồng độ cholesterol toàn phần ≥ 6,3 mmol/L [2].
.jpg)
1.3 Bệnh căn
Cả yếu tố di truyền và môi trường sống đều đóng vai trò trong sự phát triển của rối loạn lipid máu.
Sinh lý bệnh nền của rối loạn lipid máu thường phức tạp. Mặc dù trong nhiều trường hợp các chỉ dấu di truyền đặc hiệu còn chưa được xác định, một số trường hợp có cơ sở di truyền rõ ràng với cơ chế nền được xác định rõ (xem Bảng 35.1) [3,4].
Chẩn đoán phân biệt các rối loạn lipid chủ yếu được tóm tắt trong Bảng 35.2.
1.4 Phòng ngừa
Chế độ ăn, luyện tập, giảm cân đóng vai trò to lớn trong việc phòng ngừa và điều trị rối loạn lipid máu [5].
1.5 Các điều kiện liên quan
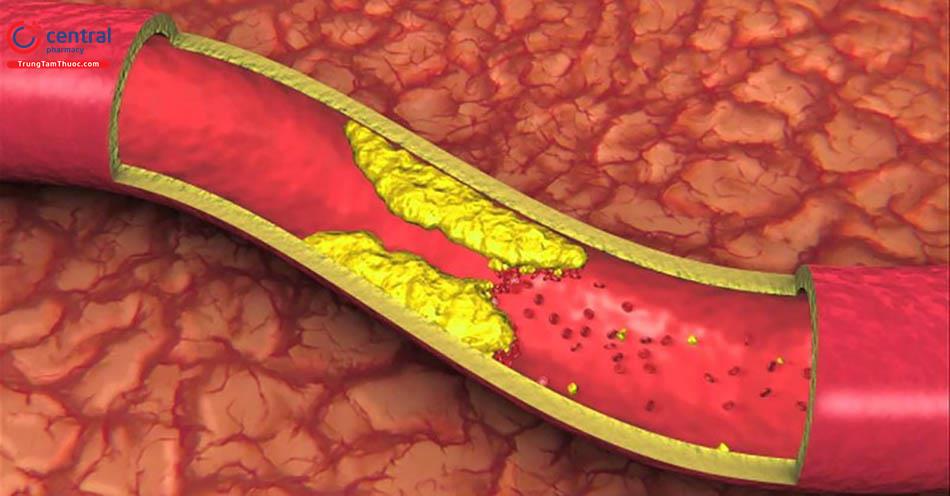
Rối loạn lipid máu là một yếu tố nguy cơ chính có thể thay đổi được đối với bệnh tim mạch, mạch máu não và mạch máu ngoại biên. Mức LDL- C thấp hơn làm giảm tỷ lệ đau ngực, tái thông mạch vành và nhồi máu não. Ước tính khi làm giảm được 1 mmol/L (khoảng 38 mg/dL) trong nồng độ LDL-Cholesterol sẽ giảm được khoảng 20% nguy cơ biến cố tim mạch [6]. Tăng nồng độ triglycerid và giảm HDL-C có thể tăng thêm nguy cơ, tuy nhiên lợi ích của giảm triglycerid và tăng HDL- C chưa được xác minh rõ ràng [4].
Rối loạn lipid máu thường kết hợp với các bất thường chuyển hóa khác bao gồm béo phì, tăng huyết áp, kháng Insulin và bệnh gan nhiễm mỡ.
1.6 Chẩn đoán
Sàng lọc tình trạng rối loạn lipid máu nên được thực hiện ít nhất 5 năm 1 lần bắt đầu từ độ tuổi 20. Nếu non -HDL- C và LDL- C nằm trong giới hạn mong muốn, cần kiểm tra lại test sàng lọc này trong vòng 5 năm hoặc sớm hơn dựa trên nhận định lâm sàng. Cân nhắc tiến hành tái sàng lọc sớm hơn nếu thấy có thay đổi các yếu tố nguy cơ của bệnh lý tim mạch do xơ vữa; có bằng chứng của bệnh lý tim mạch do xơ vữa; bệnh lý tim mạch do xơ vữa xảy ra sớm ở người thân trực hệ của bệnh nhân hoặc nguyên nhân tiềm ẩn mới của rối loạn lipid máu [1].
Một số dấu hiệu khi khám thực thể (xem phần Khám thực thể ) có thể cung cấp các bằng chứng cho tình trạng rối loạn lipid và nên tức khắc tiến hành làm bộ xét nghiệm sàng lọc lipid máu (xem Bảng 35.1) [3,4].
1.7 Biểu hiện lâm sàng
1.7.1 Khai thác tiền sử bệnh
Khai thác tiền sử của bệnh nhân phải tập trung tới phát hiện các nguyên nhân thứ phát của rối loạn lipid máu, tiền sử gia đình bị bệnh mạch vành xảy ra sớm và đánh giá các yếu tố nguy cơ tim mạch. Chế độ ăn uống, thuốc, uống rượu và các bệnh kèm theo có thể góp phần vào biểu hiện và mức độ nghiêm trọng của rối loạn lipid máu (xem Bảng 35.2). Chi tiết về tiền sử gia đình rất quan trọng vì tiền sử gia đình mắc bệnh mạch vành sớm có thể rất gợi ý rối loạn lipid máu di truyền (xem Bảng 35.1) [1,6]. Do yếu tố nguy cơ tim mạch xác định mức độ điều trị của từng bệnh nhân, vì vậy cần đánh giá các yếu tố nguy cơ (xem phần điều trị).
1.7.2 Khám lâm sàng
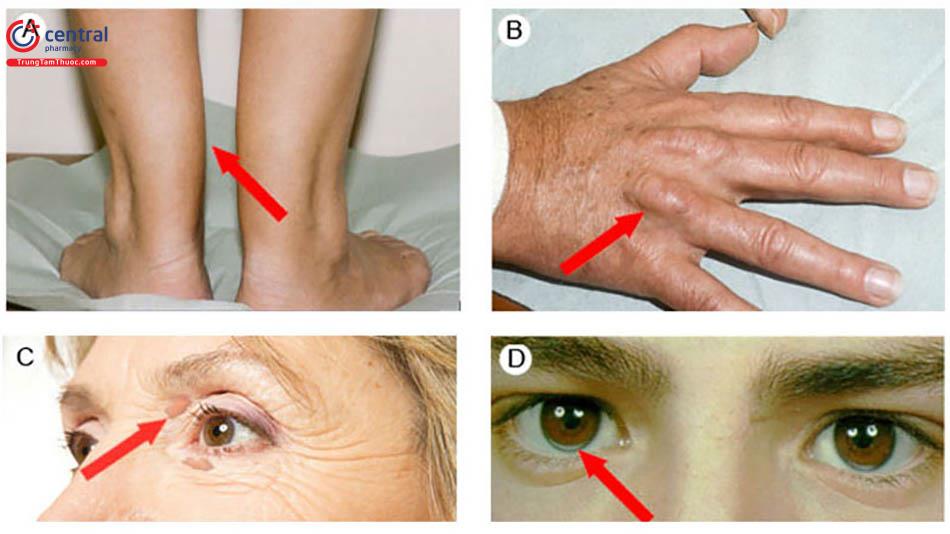
Khám lâm sàng nên tập trung vào xác định bệnh mạch máu (vết bầm tím) và các phát hiện thực thể gợi ý rối loạn lipid nghiêm trọng, chẳng hạn như u vàng gân, u vàng ở lòng bàn tay, u vàng thể phát ban, u vàng dạng củ, u vàng quanh mắt, nhiễm lipid máu võng mạc hoặc vòng mỡ giác mạc.
| Bảng 35.1. Đánh giá các rối loạn lipid máu di truyền chủ yếu | ||||
| Rối loạn lipid máu di truyền | Rối loạn lipid điển hình | Đặc điểm di truyền | Đặc điểm kiểu hình | Sinh lý bệnh |
| Tăng LDL đơn độc | ||||
| Tăng cholesterol máu gia đình (FH) | Dạng dị hợp tử: LDL > 220 mg/dL (5,8 mmol/L) Dạng đồng hợp tử: LDL > 500 mg/dL (13,2 mmol/L) | Di truyền trội | Bệnh lý mạch vành. Xanthomas & gân. Xanthelasma: u vàng quanh mắt Vòng mỡ giác mạc. | Gây ra bởi đột biến của các thụ thể LDL dẫn đến khiếm khuyết trong quá trình hấp thu và giáng hóa LDL. |
| Khiếm khuyết apo B-100 có tính chất gia đình. | Tương tự như tăng cholesterol máu gia đình | Di truyền trội | Tương tự như tăng cholesterol máu gia đình. | Gây ra bởi một đột biến của apo B-100 điều này làm suy yếu tương tác của LDL với thụ thể dẫn đến giảm giải phóng LDL. |
| Tăng chức năng của PCSK9 [3] | Tương tự như tăng cholesterol máu gia đình | Di truyền trội | Tương tự như tăng cholesterol máu gia đình. | Gây ra bởi một trong hai sự gia tăng của PCSK9 hoặc hình thành ràng buộc chặt chẽ giữa PCSK9 và thụ thể của LDL. PCSK9 gắn vào thụ thể LDL để giáng hóa. |
| Tăng triglycerid đơn độc | ||||
Thiếu hụt lipoprotein lipase (LPL) hoặc apo C-II | TGs 1.000 -25.000 mg/dL (11,4 - 284 mmol/L) | Di truyền lặn | Được chẩn đoán khi trẻ tuổi. U vàng thể phát ban. Nhiễm lipid võng mạc Viêm tụy Gan lách to Biểu hiện lâm sàng xảy ra khi triglycerid vượt quá 1,500 mg/dL. | Sự thiếu hụt LPL hoặc đồng yếu tố apo C-II làm giảm sự hấp thu của triglycerid ở các mô ngoại biên. |
| Tăng triglycerid gia đình | TGs 1,7 - 5,7 mmol/L hoặc cao hơn khi có yếu tố phụ (béo phì, uống rượu, đái tháo đường) | Di truyền trội | Chẩn đoán ở độ tuổi trưởng thành Tương tự như LPL nếu triglycerid ở ngưỡng tăng nghiêm trọng. | Gây ra bởi sản xuất thừa VLDL triglycerid Các khiếm khuyết di truyền không được thành lập. |
| Tăng kết hợp LDL và triglycerid | ||||
| Tăng lipid máu kết hợp gia đình (FCH) Tăng lipid máu loại III (rối loạn chuyển hóa protein. máu gia đình) | Tăng vừa phải của LDL, triglycerid hoặc cả hai. Tăng đồng thời cả cholesterol và triglycerid (300 - 500 mg/dL). Sự xuất hiện của tăng lipid máu thường đòi hỏi yếu tố thứ hai. | Di truyền trội Di truyền lặn | Bệnh lý mạch vành không có các xanthomas ở gân và da. Bệnh lý mạch vành. Các hạt xanthomas. Các xanthomas phẳng ở các nếp nhăn lòng bàn tay. | Gây ra bởi sự sản xuất quá mức của VLDL Các khiếm khuyết di truyền không thành lập. Gây ra bởi đột biến đồng hợp tử trong apo E (apo E2/E2) dẫn đến lỗi trong quá trình giải phóng của chylomicron tàn dư và VLDL. |
| Thấp HDL đơn độc [4] | ||||
| Giảm lipoprotein máu gia đình | HDL ở dưới phân vị thứ 10 (< 0,8 mmol/L) đối với nam và < 1,05 mmol/L đối với phụ nữ tiền mãn kinh. | Di truyền trội | Bệnh lý mạch vành. Không có dấu hiệu lâm sàng đặc trưng khi khám bệnh. | Các khiếm khuyết di truyền không được thành lập. |
| Bệnh Tangier | Mức HDL < 20 mg/dL (0,5 mmo/L) | Di truyền lặn | Bệnh lý thần kinh ngoại biên. Phì đại amidan. Gan lách to. Amidan và niêm mạc trực tràng chuyển màu vàng cam. | Đột biến gen ABCA1 vận chuyển cholesterol ra ngoài tế bào apoA-I để tạo thành HDL. |
Thiếu hụt LCAT gia đình | Mức HDL < 20 mg/dL (0,5 mmo/L) | Di truyền lặn | Mờ giác mạc. Thiếu máu. Bệnh thận tiến triển. | Thiếu hụt LCAT hoàn toàn. LCAT xúc tác chuyển đổi cholesterol tự do thành ester di chuyển vào lõi của HDL. |
| Bệnh mắt cá | Mức HDL < 20 mg/dL (0,5 mmo/L) | Di truyền lặn | Mờ giác mạc. | Thiếu hụt LCAT nhẹ hơn. |
| Coronary artery disease (CAD): Bệnh động mạch vành; High-density lipoprotein (HDL): Lipoprotein tỷ trọng cao; Low-density lipoprotein (LDL): Lipoprotein tỷ trọng thấp; Proprotein convertase subtilisin/kexin type 9 (PCSK9); Triglycerid (TGs); Very low-density lipoprotein (VLDL): Lipoprotein tỷ trọng rất thấp. | ||||
1.8 Chẩn đoán cận lâm sàng

Xét nghiệm lipid máu lúc đói là nền tảng của chẩn đoán.
Hầu hết các phòng xét nghiệm đo trực tiếp triglycerid, cholesterol toàn phần, HDL- C và tính toán LDL-C. Nếu triglycerid > 400 mg/dL, kết quả LDL- C được tính toán không đáng tin cậy mà nên đo LDL-C trực tiếp.
Tăng triglycerid máu mới khởi phát, cần sàng lọc ngay bệnh đái tháo đường, suy giáp và bệnh lý thận.
LDL-C mới tăng cao nên nhanh chóng sàng lọc suy giáp, bệnh lý gan tắc nghẽn và hội chứng thận hư.
2 ĐIỀU TRỊ
Các nhóm lợi ích của statin: Hướng dẫn của trường đại học Hoa Kỳ/ Hiệp Hội Tim Mạch Hoa Kỳ (ACC/AHA) về cholesterol năm 2013 đưa ra các khuyến nghị về việc điều trị tăng cholesterol máu đều làm giảm nguy cơ tim mạch do xơ vữa động mạch ở người lớn [5]. Hướng dẫn tập trung vào việc xác định bốn nhóm lợi ích của statin và xác định cường độ thích hợp của liệu pháp statin (xem Bảng 35.3) [5].
.jpg)
Phòng ngừa thứ phát
- Liệu pháp statin liều cao như là liệu pháp đầu tay ở những người < 75 tuổi có bệnh lý tim mạch do xơ vữa (ASCVD) trên lâm sàng.
- Nếu có chống chỉ định với statin liều cao, statin cường độ trung bình là một lựa chọn.
- Nếu > 75 tuổi, hãy đánh giá lợi ích giảm nguy cơ bệnh lý tim mạch do xơ vữa (ASCVD) tiềm ẩn, tác dụng không mong muốn, tương tác thuốc, thuốc và sở thích của bệnh nhân. Điều thích hợp là tiếp tục điều trị bằng statin ở những người đang dung nạp với thuốc.
| Bảng 35.2. Chẩn đoán phân biệt các rối loạn lipid chính | ||
| Bất thường lipid | Rối loạn nguyên phát | Rối loạn thứ phát |
| Tăng cholesterol máu | Đa gien, tăng cholesterol gia đình, khiếm khuyết apo B-100 gia đình. | Suy giáp, hội chứng thận hư, bệnh gan tắc nghẽn, lợi tiểu thiazid. |
| Tăng triglycerid máu | Thiếu lipoprotein Lipase, thiếu apo C-II, tăng triglycerid máu có tính gia đình. | Đái tháo đường kiểm soát kém, suy giáp, suy thận, béo phì, chế độ ăn giàu carbohydrat, uống rượu, uống thuốc estrogen, chẹn B, chất ức chế Protease, glucocorticoids, Vitamin A, Nhựa gắn acid mật, thuốc chống loạn thần, lợi tiểu thiazid. |
| Rối loạn lipid máu kết hợp | Tăng lipid máu kết hợp gia đình, tăng lipid máu typ III | Đái tháo đường kiểm soát kém, suy giáp, glucocorticoids, thuốc ức chế miễn dịch, chất ức chế protease, hội chứng thận hư. |
| Giảm HDL | Thiếu alphalipoprotein máu gia đình,bệnh Tangier,thiếu HDL gia đình, lecithin: thiếu hụt cholesterol acyltransferase | Steroids đồng hóa, retinoids, sử dụng thuốc lá. |
Phòng ngừa nguyên phát ở những người>21 tuổi có LDL25mmol/L.
- Đánh giá các nguyên nhân thứ phát tăng lipid máu ở những người có LDL- C > 5 mmol/L (190 mg/dL) hoặc triglycerid > 500 mg/dL (5,6 mmol/L).
- Người lớn ≥21 tuổi có LDL- C≥ 5 mmol/L nên được điều trị bằng liệu pháp statin (không cần ước tính nguy cơ ASCVD 10 năm):
- Sử dụng liệu pháp statin liều cao trừ khi có chống chỉ định.
- Sử dụng liệu pháp statin dung nạp tối đa nếu không thể dung nạp statin liều cao
- Đối với người > 21 tuổi không được điều trị LDL- C≥ 5 mmol/L:
- Việc tăng cường điều trị bằng statin là hợp lý để giảm ít nhất 50% LDL-C.
- Việc bổ sung một loại thuốc nonstatin có thể được xem xét để làm giảm LDL-C hơn nữa sau khi đã đạt được cường độ tối đa của liệu pháp statin.
Phòng ngừa nguyên phát ở người mắc đái tháo đường có mức LDL-C từ 70 đến 189 mg/dL
- Đối với người lớn từ 40 đến 75 tuổi mắc đái tháo đường:
- Liệu pháp statin liều trung bình nên được bắt đầu hoặc tiếp tục.
- Liệu pháp statin liều cao là hợp lý nếu ước tính nguy cơ tim mạch do xơ vữa (ASCVD) trong 10 năm là > 7,5%.
- Đối với người lớn < 40 tuổi hoặc > 75 tuổi hoặc LDL < 70: việc đánh giá nguy cơ tim mạch do xơ vữa (ASCVD) tiềm ẩn, tác dụng không mong muốn, tương tác thuốc và sở thích của bệnh nhân là hợp lý trước khi quyết định bắt đầu, tiếp tục hoặc tăng cường độ liệu pháp statin.
Phòng ngừa nguyên phát ở người không mắc đái tháo đường và có LDL 1,8-4,9 mmol/L (70 - 189 mg/dL)
- Sử dụng công cụ đánh giá nguy cơ rủi ro ASCVD trong 10 năm.
- Người lớn từ 40 đến 75 tuổi có LDL-C từ 1,8 - 4,9 mmol/L không có lâm sàng của ASCVD hoặc đái tháo đường:
- Nếu nguy cơ ASCVD 10 năm ≥ 7,5%, điều trị bằng liệu pháp statin trung bình đến cao.
- Nếu nguy cơ ASCVD 10 năm từ 5% đến < 7,5%, điều trị bằng liệu pháp statin cường độ trung bình là hợp lý.
- Nếu quyết định điều trị dựa trên rủi ro không chắc chắn, các yếu tố bổ sung có thể được xem xét để cung cấp thông tin cho việc ra quyết định.
- Cần thảo luận nguy cơ giữa bác sĩ lâm sàng và bệnh nhân trước khi bắt đầu điều trị bằng liệu pháp statin.
| Bảng 35.3. Khuyến nghị điều trị giảm cholesterol máu để giảm nguy cơ tim mạch ở người lớn | |
| Loại phòng ngừa | Nhóm điều trị |
| Thứ phát | Bệnh nhân s 75 tuổi có triệu chứng lâm sàng của bệnh lý tim mạch do xơ vữa (ASCVD). |
| Nguyên phát | Người lớn ≥ 21 tuổi có mức LDL- C ≥ 5 mmol/L (190 mg/dL). |
| Nguyên phát | Người lớn từ 40 - 75 tuổi mắc đái tháo đường và mức LDL- C từ 1,8 - 4,9 mmol/L không có triệu chứng lâm sàng của ASCVD. |
| Nguyên phát | Người lớn từ 40 - 75 tuổi có mức LDL- C từ 1,8 - 4,9 mmol/L không có triệu chứng lâm sàng của ASCVD hoặc đái tháo đường và với nguy cơ rủi ro ASCVD ước tính trong vòng 10 năm ≥ 7,5% |
Triệu chứng lâm sàng của bệnh tim mạch do xơ vữa (ASCVD) bao gồm: hội chứng động mạch vành cấp, tiền sử nhồi máu cơ tim (MI), đau thắt ngực ổn định hoặc không ổn định, tái thông mạch vành hoặc các động mạch khác, đột quỵ, cơn thiếu máu não thoáng qua (TIA) hoặc bệnh động mạch ngoại biên nguồn gốc xơ vữa tiến triển. Phỏng theo Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;63:2889-2934. | |
2.1 Các thuốc điều trị
2.1.1 Liệu pháp Statin
Phần trăm giảm LDL- C cho một sttain và liều lượng cụ thể đã được tính toán từ các thử nghiệm ngẫu nhiên có đối chứng (xem Bảng 35.4) [5].
- Cường độ cao: làm giảm LDL- C khoảng > 50%.
- Cường độ trung bình: làm giảm LDL- C khoảng 30% đến <50%.
- Cường độ thấp: làm giảm LDL- C < 30%.
2.1.2 Liệu pháp Nonstatin [7]
Xem Bảng 35.5 [5,8-10]
Người lớn >21 tuổi có dấu hiệu lâm sàng của bệnh lý tim mạch do xơ vữa (ASCVD), statin để phòng ngừa thứ phát
ASCVD lâm sàng ổn định và không có bệnh kèm theo: nếu bệnh nhân đáp ứng ít hơn dự đoán (giảm LDL- C < 50%).
- Tuân thủ điều trị bằng statin.
- Tăng liều lên statin cường độ cao nếu chưa đạt liều.
- Nếu không dung nạp với statin cường độ trung bình, hãy đánh giá statin không dung nạp.
- Tăng cường thay đổi lối sống.
- Xem xét kết hợp các chất xơ trong bữa ăn và phytosterol.
- Nếu bệnh nhân vẫn chưa giảm LDL- C < 50%, thảo luận thêm nonstatin:
- Lựa chọn đầu tay: ezetimibe 10 mg mỗi ngày: giảm LDL, làm giảm nguy cơ tim mạch [11].
- Lựa chọn thứ hai: chất gắn acid mật (BAS) nếu không dung nạp ezetimibe và triglycerid < 300 mg/dL.
- Nếu bệnh nhân vẫn giảm LDL-C<50%, xem xét alirocumab và evolocumab (tiếp tục statin liều tối đa).
| Bảng 35.4. Liệu pháp statin cường độ cao trung bình, thấp | |
| Liệu pháp statin | Tên thuốc và liều |
Cường độ cao Liều hằng ngày làm giảm trung bình LDL-C khoảng ≥50% | Atorvastatin 40 - 80 mg Rosuvastatin 20-40 mg |
Cường độ trung bình Liều hằng ngày làm giảm LDL-C khoảng 30% đến < 50% | Atorvastatin 10-20 mg Rosuvastatin 5 - 10 mg Simvastatin 20-40 mg Pravastatin 40-80 mg Lovastatin 40 mg Fluvastatin XL 80 mg Fluvastatin 40 mg 2 lần/ngày, Pitavastatin 2 - 4 mg |
Cường độ thấp Liều hằng ngày làm giảm LDL-C Pravastatin 10 - 20 mg khoảng < 30% | Simvastatin 10 mg Lovastatin 20 mg Fluvastatin 20-40 mg Pitavastatin 1 mg |
| Low- density lipoprotein cholesterol (LDL- C): Lipoprotein cholesterol tỷ trọng thấp. Phỏng theo Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;63:2889-2934. | |
Lâm sàng bệnh lý tim mạch do xơ vữa (ASCVD) có bệnh lý kèm theo
- Các bệnh lý đi kèm: đái tháo đường, ASVD gần đây (< 3 tháng), tiền sử ASCVD đang dùng statin, kiểm soát kém các yếu tố nguy cơ chính ASCVD khác, lipoprotein cao (a) hoặc bệnh thận mạn (CKD) chưa chạy thận.
- Cách tiếp cận tương tự như đã nêu ở trên đối với người không có bệnh lý kèm theo nhưng ngưỡng LDL- C < 70 mg/dL và ngưỡng non-HDL- C< 100 mg/dL.
Lâm sàng ASCVD và LDL-C ban đầu ≥ 5 mmol/L (190 mg/dL) không do nguyên nhân thứ phát
- Tăng cholesterol máu gia đình nhiều khả năng có dị hợp tử (HeFH) hoặc đồng hợp tử (HoFH), rối loạn di truyền. Nếu xác định được, hãy thực hiện sàng lọc theo tầng (đánh giá có hệ thống về những người họ hàng gần gũi để xác định những người mắc bệnh khác).
- Nếu bệnh nhân không giảm được LDL- C > 50% khi điều trị bằng statin, hợp lý khi xem xét chất ức chế proprotein convertase subtilisin/kexin type 9 (PCSK9) là bước đầu tiên thay vì ezetimibe hoặc BAS sử dụng chất ức chế PCSK9 có tác dụng làm giảm LDL-C lớn hơn. Evolocumab làm giảm nguy cơ biến cố tim mạch [12].
- Nếu điều trị kết hợp liệu pháp statin và nonstatin với ezetimibe hoặc thuốc gắn acid mật (BAS) và chất ức chế PCSK9 mà bệnh nhân vẫn giảm LDL-C < 50%, hãy chuyển bệnh nhân đến bác sĩ chuyên khoa.
- Mipomersen hoặc lomitapide chỉ được chấp thuận để điều trị rối loạn di truyền kiểu hình đồng hợp tử.
- Giảm LDL: kiểu hình rối loạn di truyền đồng hợp tử và LDL-C ≥ 190 mg/dL mặc dù liệu pháp y tế đã được dung nạp tối đa và kiểu hình rối loạn di truyền kiểu hình đồng hợp tử.
| Bảng 35.5. Đặc điểm của thuốc giảm lipid máu | ||||
| Nhóm thuốc | Thuốc và liều lượng hằng ngày | Tác dụng giảm Lipid/ lipoprotein | Tác dụng phụ | Chống chỉ định |
| HMG CoA ức chế reductase (statins) | Lovastatin (20-80 mg) Pravastatin (20-40 mg) Simvastatin (20-40 mg) Fluvastatin (20 - 80 mg) Atorvastatin (10-80 mg) Pitavastatin (1-4 mg) Rosuvastatin (5-40 mg) | LDL-C ↓18 - 55% HDL-C ↑ 5-15% TG ↓ 10-30% | Bệnh cơ Tăng men gan | Tuyệt đối: bệnh gan đang tiến triển Tương đối: sử dụng đồng thời một số loại thuốc |
| Thuốc gắn acid mật | Cholestyramine (8-16 g) Colestipol (2-16 g) Colesevelam (1,9 - 3,8 g) | LDL-C ↓ 10-27% HDL ↑ 3-5% TG không thay đổi hoặc tăng | Đau dạ dày Táo bón Giảm hấp thu các loại thuốc khác | Tuyệt đối: Dysbetalipoproteinemia, TG > 4,5 mmol/L (> 400 mg/dL). Tương đối: TG > 2,3 mmol/L (> 200 mg/dL). |
| Acid Nicotinic [8] | Immediate release (1,5 - 3 g) Extended release (1 - 2 g) | LDL-C ↓ 5-20% HDL-C ↑ 10-30% TG ↓ 10-30% | Đầy hơi Tăng đường máu Tăng uric máu Đau dạ dày Nhiễm độc gan | Tuyệt đối: bệnh gan năm tính, gout nghiêm trọng. Tương đối: đái tháo đường kiểm soát kém, tăng acid uric máu, bệnh viêm loét dạ dày. |
| Acid Fibric | Gemfibrozil (600 mg hai lần 1 ngày) Fenofibrate (đa dạng liều từ 135 đến 200 mg) | LDL-C ↓ 15-20% HDL-C ↑ 10-20% TG ↓ 30-50% | Rối loạn tiêu hóa Sỏi mật Bệnh cơ | Bệnh thận nghiêm trọng. Bệnh gan nghiêm trọng. |
| Ức chế hấp thu cholesterol | Ezetimibe (10 mg) | LDL-C ↓ 18% HDL- C không thay đổi TG không thay đổi | Tiêu chảy Đau cơ | Bệnh gan nghiêm trọng. |
| Acid béo Omega-3 | Lovaza (3-4 g) Dầu Cá OTC (số lượng thay đổi của EPA + DHA: cần tổng 3–4 g) | LDL- C không thay đổi đáng kể HDL-C ↑ 5% TG ↓ 20-50% | Ợ hơi Tiêu chảy Rối loạn tiêu hóa | Không có |
| Chất ức chế Antisense oligonucleotide cúa apo B [9]. | Mipomersen (200 mg tiêm dưới da mỗi tuần/lần) | LDL-C ↓ 25-37% HDL- C không thay đổi TG ↓ 9-27% | Phản ứng tại chỗ tiêm Các triệu chứng giống cúm Nhiễm độc gan | Suy gan trung bình hoặc nặng Bệnh gan hoạt động hoặc mạn tính. Tăng men gan. |
| Chất ức chế protein chuyển triglycerid ở microsome | Lomitapide 5-60 mg | LDL-C 38-51% HDL- C không thay đổi TG↓ ~30% | Đau dạ dày Nhiễm độc gan | Sử dụng đồng thời cường độ mạnh hoặc trung bình thuốc ức ché CYP3A4. Suy gan trung bình hoặc nặng hoặc bệnh gan hoạt động. |
| Ức chế PCSK9 [10] | Alirocumab 75 mg hoặc 150 mg mỗi hai tuần. Evolocumab 140 mg tiêm dưới da (SC) mỗi hai tuần hoặc 420 mg mỗi tháng. | LDL-C 45 - 71% HDL-C ↑ 5-12% TG ↓ 4-17% | Phản ứng tại chỗ tiêm Viêm mũi họng | không |
Cyclosporine, các kháng sinh phổ rộng, các chất chống nấm khác nhau và chất ức chế P- 450. Có thể tăng ở bệnh nhân có triglycerid cao. Phỏng theo Loyd-Jones DM, Morris PB, Ballantyne CM, et al. 2016 ACC Expert Consensus Decision Pathway on the Role of Non-Statin Therapies for LDL-Cholesterol Lowering in the Management of Atherosclerotic Cardiovascular Disease Risk: A Report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol 2016;68(1):92-125. | ||||
Người lớn ≥ 21 tuổi có LDL- C≥5 mmol/L (190 mg/dL) (không do nguyên nhân thứ phát) điều trị bằng statin phòng ngừa tiên phát
- Điều trị sớm có thể làm giảm đáng kể nguy cơ bệnh tim mạch do xơ vữa (ASCVD).
- Theo dõi việc thay đổi lối sống và liệu pháp statin dung nạp tối đa.
- Nên khuyến khích chế độ ăn ít chất béo bão hòa, ít cholesterol và tham khảo bác sĩ dinh dưỡng. Ngay cả khi tuân thủ nghiêm ngặt, chế độ ăn uống cũng có tác dụng hạn chế đến mức độ nghiêm trọng của tăng cholesterol máu.
- Dấu hiệu nguy cơ: tiền sử gia đình có biến cố ASCVD sớm, hút thuốc lá, đái tháo đường, tăng huyết áp, bệnh thận mạn, bằng chứng về xơ vữa động mạch cận lâm sàng, tăng lipoprotein(a) hoặc tăng protein phản ứng nhạy cảm cao. Cố gắng kiểm soát trong phạm vi có thể.
- Nếu giảm LDL- C < 50% (có thể xem xét < 100 mg/dL hoặc non- HDL-C< 130 mg/dL ở bệnh nhân đái tháo đường) khi dùng statin dung nạp tối đa, xem xét thêm ezetimibe hoặc ức chế PCSK9 (tùy thuộc vào việc giảm tỷ lệ phầm trăm mong muốn của LDL- C). Thuốc gắn acid mật (BAS) có thể được lựa chọn thứ hai.
Người lớn từ 40 đến 75 tuổi không có bệnh tim mạch do xơ vữa (ASCVD) nhưng bị đái tháo đường và LDL- C từ 1,8 – 4,9 mmol/L (70 - 189 mg/dL), đã được điều trị statin điều trị phòng ngừa nguyên phát
- Nếu nguy cơ ASCVD 10 năm < 7,5% và không có các yếu tố nguy cơ rủi ro cao:
- Statin cường độ trung bình hoặc tăng cùng độ statin cao nếu không đạt được mức giảm LDL-C từ 30 - 50% (hoặc xem xét nếu LDL- C > 2,6 mmol/L hoặc non-HDL- C > 3,4 mmol/L) mặc dù đã tăng cường thay đổi lối sống.
- Nếu chuyển sang statin cường độ cao mà mức giảm LDL-C<50%, thảo luận về việc bổ sung thuốc nonstatin:
- Ezetimibe được ưu tiên.
- Thuốc gắn acid mật (BAS) lựa chọn thứ hai.
- Ức chế PCSK9 không được lựa chọn.
- Nếu nguy cơ ASCVD 10 năm ≥ 7,5%
- Statin cường độ cao.
- Cân nhắc bổ sung chất xơ hòa tan trong thực phẩm và phytosterols.
- Nếu LDL-C giảm < 50%:
- Ezetimibe được ưu tiên.
- BAS lựa chọn thứ hai.
- Ức chế PCSK9 không được lựa chọn.
Người lớn từ 40 - 75 tuổi không có ASCVD và đái tháo đường, có LDL- C từ 1,8 – 4,9 mmol/L và rủi ro ASCVD trong 10 năm ước tính ≥7,5%, đã điều trị bằng statin phòng ngừa nguyên phát
- Một số bệnh nhân nên được xem xét điều trị bổ sung ngoài dùng statin cường độ dung nạp tối đa.
- Có thể cân nhắc liệu pháp nonstatin nếu LDL- C giảm<30% và có một hoặc nhiều yếu tối nguy cơ cao sau đây:
- Nguy cơ ASCVD 10 năm >20%. " LDL- C ban đầu > 160 mg/dL.
- Kiểm soát các yếu tố ASCVD kém.
- Tiền sử gia định bị ASCVD sớm.
- Bằng chứng về xơ hóa động mạch tiến triển trên cận lâm sàng (ví dụ, vôi hóa động mạch vành).
- hs-CRP tăng.
- Các điều kiện rủi ro khác: CKD, HIV, rối loạn viêm mạn tính.
Cố gắng thay đổi lối sống, các chất xơ hòa tan trong chế độ ăn uống cũng như kiểm soát các yếu tố nguy cơ. Nếu LDL- C vẫn giảm < 30%, sử dụng statin dung nạp tối đa. Nếu điều này không làm giảm LDL- C > 50% và các dấu hiệu của yếu tố nguy cơ cao xuất hiện, hãy thảo luận với bệnh nhân:
- Nếu điều trị, ezetimibe (hoặc thuốc gắn acid mật như một lựa chọn thứ hai) có thể được xem xét.
- Không kê đơn ức chế PCSK9.
2.2 Thay đổi lối sống/yếu tố nguy cơ
Đối với tất cả các bệnh nhân, thay đổi lối sống bao gồm chế độ ăn lành mạnh cho tim mạch, thói quen tập thể dục thường xuyên, tránh các sản phẩm thuốc lá, duy trì cân nặng hợp lý là rất quan trọng để giảm nguy cơ ASCVD [5]. Giới thiệu đến một chuyên gia dinh dưỡng thường hữu ích.
2.2.1 Chế độ ăn uống [13]

Những người trưởng thành mong muốn được hưởng lợi ích từ việc giảm LDL- C nên thực hiện những thay đổi sau:
- Thực hiện chế độ ăn kiêng gồm rau, trái cây và các ngũ cốc nguyên hạt.
- Tiêu thụ các sản phẩm từ sữa ít béo, thịt gia cầm, cá, các loại đậu, dầu thực vật không nhiệt đới và các loại hạt.
- Hạn chế đồ ngọt, đồ uống có đường và thịt đỏ.
- Giảm phần trăm calo từ chất béo bão hòa và chất béo chuyển hóa.
- Hướng đến chế độ ăn kiêng đạt được từ 5 - 6% calo từ chất béo bão hòa.
- Tuân theo các kế hoạch như chế độ ăn ngăn ngừa tăng huyết áp (DASH), mẫu thực phẩm của Bộ Nông nghiệp Hoa Kỳ (USDA) hoặc chế độ ăn nhiều hạt và giảm béo (AHA).
2.2.2 Hoạt động thể chất [13]
- Tập thể dục aerobic
- Làm giảm LDL- C từ 3 - 6 mg/dL (0,08-0,16 mmol/L).
- Làm giảm non- HDL- C 6 mg/dL (0,16 mmol/L).
- Có thể không có tác dụng nhất quán đối với triglycerid hoặc HDL-C.
- Các bài tập luyện đối kháng làm giảm LDL-C, triglycerid, non-HDL-C từ 6 đến 9 mg/dL (0,16- 0,24 mmol/L) và không ảnh hưởng lên HDL-C.
3 CÁC TRƯỜNG HỢP ĐẶC BIỆT
Bệnh nhân bị suy tim có triệu chứng [7].
- Cân nhắc sử dụng statin ở bệnh nhân có suy tim có triệu chứng do nguyên nhân thiếu máu cục bộ là hợp lý, ở những người được mong đợi là sống đủ lâu để đạt được lợi ích từ liệu pháp statin (ví dụ, 3 đến 5 năm hoặc nhiều hơn).
- Chất ức chế PCSK9 không được khuyến khích trong thời gian này.
Chạy thận nhân tạo [7].
- Phương pháp tiếp cận nên được cá thể hóa.
- Quyết định điều trị bằng statin hoặc các nonstatin khác là vấn đề đánh giá lâm sàng.
- Chất ức chế PCSK9 không được khuyến khích trong thời gian này.
Đang có thai (hoặc chuẩn bị mang thai) [7].
- Chỉ nên sử dụng statin cho phụ nữ tiền mãn kinh đang sử dụng các biện pháp tránh thai hiệu quả và không cho con bú.
- Ngừng điều trị bằng thuốc, ngoại trừ thuốc gắn acid mật (BAS), ít nhất 1 tháng (tốt nhất là 3 tháng) trước khi cố gắng có thai. Ngừng ngay thuốc nếu đang có thai.
- Nếu bệnh nhân có triệu chứng bệnh tim mạch do xơ vữa (ASCVD) hoặc mức LDL- C ban đầu > 190 mg/dL, hãy tư vấn về các biện pháp thay đổi lối sống chuyên sâu. Nên giới thiệu đến bác sĩ chuyên khoa và chuyên gia dinh dưỡng. Nếu bệnh nhân đang điều trị hạ lipid máu khi bị đái tháo đường hoặc có nguy cơ ASCVD 10 năm cao, hãy ngừng thuốc và theo dõi sự gia tăng đáng kể của LDL- C trong thời gian mang thai. Tăng dần cả LDL-C và triglycerid là do sinh lý. Có thể được quản lý bằng BAS.
- Statin và ezetimibe có thể được tiếp tục sau khi hoàn thành cho con bú.
- Lomitapide không được khuyến khích.
- Không có sẵn dữ liệu an toàn/ hiệu quả để sử dụng mipomersen hoặc ức chế PCSK9.
- Xem xét các liệu pháp giảm LDL ở bệnh nhân bị:
- Rối loạn lipid máu có tính di truyền kiểu hình đồng hợp tử (HOFH).
- Rối loạn lipid máu có tính di truyền kiểu hình dị hợp tử (HeFH) nghiêm trọng và LDL- C>7,9 mmol/L (300 mg/dL).
- Bệnh tim mạch do xơ vữa (ASCVD) nếu LDL- C >5 mmol/L.
4 RỐI LOẠN LIPID MÁU KHÁC
4.1 Tăng Triglycerid [8]
Chẩn đoán dựa trên nồng độ triglycerid lúc đói.
Đánh giá các nguyên nhân thứ phát bao gồm, béo phì, đái tháo đường, suy giáp, mang thai và các loại thuốc (lợi tiểu, chẹn beta, estrogens, BASs, Tamoxifen, steroids, điều trị thuốc kháng virus (ARV), ức chế miễn dịch, một số thuốc chống loạn thần thế hệ hai).
Quản lý:
- Tư vấn chế độ ăn uống và hoạt động thể chất để giảm cân.
- Giảm uống rượu.
- Giảm lượng carbohydrat đơn và đồ uống có đường.
- Kiểm soát đường máu ở bệnh nhân bị đái tháo đường.
- Thay đổi estrogen đường uống bằng đường qua da.
- Fibrate là lựa chọn đầu tay ở bệnh nhân có nguy cơ viêm tụy cấp do triglycerid. Mục tiêu điều trị < 11,2 mmol/L (1.000 mg/dL).
- Fibrates, niacin, acid béo omega-3 đơn độc hoặc kết hợp với stain để điều trị tăng triglycerid mức trung bình (từ 2,3 - 11 mmol/L [200 - 999 mg/dL]) đến nặng (11,2 - 22,7 mmol/L [1.000 - 1.999 mg/dL]).
- Fibrates: không làm giảm các biến cố tim mạch khi thêm simvastatin ở phần lớn bệnh nhân có nguy cơ cao bị đái tháo đường typ 2 [14].
- Niacin: uống sau bữa ăn với một viên Aspirin sẽ làm giảm thiểu tình trạng nôn. Không có lợi ích lâm sàng khi thêm statin ở bệnh nhân bị xơ vữa động mạch và LDL < 1,8 mmol/L (70 mg/dL), mặc dù đã cải thiện mức triglycerid và HDL [15].
- Không sử dụng Heparin truyền để điều trị tăng triglycerid rất nặng ( 22,72 mmol/L [2.000 mg/dL]) và có tình trạng viêm tụy cấp. Thay huyết tương thường không được khuyến cáo đối với tăng triglycerid cực kỳ nghiêm trọng.
4.1.1 ==> Bạn đọc có thể tham khảo mua tại: [itemblock_a_0]
4.1.2 HDL- C thấp [4]
Được định nghĩa là < 1,05 mmol/L (40 mg/dL) đối với nam hoặc < 1,3 mmol/L (50 mg/dL) đối với nữ.
Cực kì thấp khi HDL- C< 0,5 mmol/L (20 mg/dL).
Loại bỏ tăng triglycerid nghiêm trọng như là nguyên nhân và sau đó phân loại nguyên nhân, nguyên phát hay thứ phát.
- Rối loạn đơn gen nguyên phát (đột biến apolipoprotein A-I, bệnh Tangier, thiếu hụt lecithin-cholesterol acyltransferase).
- Nguyên nhân thứ phát bao gồm sử dụng andogen và bệnh ác tính.
Mối liên hệ giữa HDL- C thấp và bệnh xơ vữa động mạch vẫn chưa rõ ràng.
5 CÁC TRƯỜNG HỢP ĐẶC BIỆT
5.1 Không dung nạp statin [16]
Statin có thể gây viêm cơ: các triệu chứng cơ liên quan đến nồng độ CK trong huyết thanh tăng đáng kể. Cao > 10 × giới hạn trên của ngưỡng bình thường (ULN) xảy ra ở 1/1.000 đến 1/10.000 người mỗi năm.
Nếu bệnh nhân phàn nàn về các triệu chứng của viêm cơ:
- Loại trừ các nguyên nhân thứ phát như suy giáp, viêm đa cơ, thấp khớp hoặc tăng hoạt động thể chất cũng như dùng thuốc (ví dụ, glucocorticoid, thuốc chống loạn thần, thuốc kháng virus, thuốc ức chế miễn dịch, thuốc điều chỉnh lipid cũng như các chất lạm dụng).
- Việc ngừng điều trị bằng statin sau một vài lần điều trị lại có thể giúp xác định các nguyên nhân liên quan.
- Nếu các triệu chứng/bất thường CK hết sau khi ngưng điều trị, điều trị liều thấp hơn với cùng loại statin hoặc chuyển sang loại
- statin khác.
- Nếu vẫn không dung nạp, điều trị bằng cách dùng liều luân phiên hoặc hai lần mỗi tuần với liều thấp hơn của cường độ statin cao có thời gian bán hủy kéo dài (atorvastatin, rosuvastatin và pitavastatin).
- Có thể làm giảm LDL- C từ 12 - 38% và đạt được khoảng 70% bệnh nhân không dung nạp trước đó [16].
- Nếu CK > 4 × ULN, đánh giá lại nhu cầu sử dụng statin. Nếu cần, tiếp tục theo dõi CK nhưng dừng điều trị nếu nồng độ CK vượt quá 10 × ULN.
- Nếu LDL- C vẫn ở trên mục tiêu, mặc dù liều statin đã được dung nạp tối đa, hãy xem xét sử dụng ezatimibe như lựa chọn đầu tay, có khả năng sau đó là thuốc gắn acid mật (BAS) hoặc fibrat kết hợp với ezetimibe.
5.2 Tương tác thuốc và an toàn thuốc của statin (17)
Gemfibrozil làm giảm quá trình glucuronid hóa và thải trừ statin. Nếu sử dụng fibrat với statin hãy sử dụng fenofibrat.
Bưởi và nước cam ngọt cũng như quýt nên tránh sử dụng statin trong vòng 4 giờ.
Tránh dùng St. John’s Wort và rượu vang đỏ.
Không bắt đầu sử dụng simvastatin với liều 80 mg mỗi ngày hoặc tăng liều simvastatin lên 80 mg mỗi ngày.
Atorvastatin và fluvastatin được bài tiết tối thiểu qua thận.
5.3 Kiểm tra bất thường chức năng gan [18]
Tổn thương gan không hồi phục do statin là đặc biệt hiếm và có tính chất riêng.
Kiểm tra xét nghiệm men gan trước khi bắt đầu điều trị và theo chỉ định lâm sàng sau đó.
Xơ gan mất bù hoặc suy gan cấp tính là chống chỉ định dùng statin.
Statin an toàn để sử dụng cho bệnh nhân mắc bệnh gan nhiễm mỡ không do rượu, viêm gan tự miễn, bệnh gan mạn tính, xơ gan còn bù và bệnh nhân ghép gan.
Nếu bệnh nhân bị tăng men gan <3 × ULN:
- Kiểm tra tiền sử và khám sức khỏe tổng thể để xác định nguyên nhân có thể xảy ra.
- So sánh với các xét nghiệm gan trước đây.
- Lặp lại xét nghiệm để xác định độ tăng.
- Nếu bilirubion toàn phần không tăng và CK bình thường, hãy quyết định xem chẩn đoán có khả năng nhất là bệnh gan nhiễm mỡ không do rượu hay không.
- Nếu chưa dùng statin, có thể bắt đầu điều trị.
- Nếu đang dùng statin, không có lý do lâm sàng nào để dừng lại.
- Thực hiện thay đổi lối sống và sau đó lặp lại xét nghiệm.
- Nếu bilirubin toàn phần tăng cao và CK bình thường, hãy quyết định xem mức độ bilirubin trước đó có tăng hay không, gợi ý rối loạn bilirubin di truyền lành tính. Nếu không có nguyên nhân nào khác, bệnh nhân không có triệu chứng, các xét nghiệm trược đó tăng chủ yếu bilirubin gián tiếp
- Nếu chưa dùng statin, thì bắt đầu được.
- Nếu đang dùng statin, không có lý do lâm sàng nào để dừng.
- Nếu bilirubin trước đó không tăng, đặc biệt nếu bilirubin trực tiếp tăng, thì các biện pháp chẩn đoán tích cực hơn sẽ được chỉ định và sẽ giữ/ ngừng statin cho đến khi xác định được căn nguyên.
Nếu bệnh nhân có xét nghiệm men gan > 3 × ULN:
- Kiểm tra bệnh sử và khám sức khỏe tổng quát để xác định nguyên nhân có thể xảy ra.
- So sánh với các xét nghiệm gan trước đấy.
- Lặp lại xét nghiệm để xác định ngưỡng tăng.
- Nếu vẫn còn tăng > 3× ULN, giữ/ ngừng statin cho đến khi xác định được nguyên nhân rõ ràng.
6 CHUYỂN CHUYÊN GIA TƯ VẤN
Bệnh nhân tăng lipid máu thường được quản lý thành công bởi các nhà cung cấp dịch vụ chăm sóc sức khỏe ban đầu.
Chuyển đến chuyên gia nội tiết nên được xem xét trong các trường hợp rối loạn lipid máu nặng sau khi đã loại trừ và điều trị các nguyên nhân thứ phát.
7 KIỂM TRA VÀ THEO DÕI
Xét nghiệm lipid đói có thể được kiểm tra sau mỗi 6 đến 12 tuần trong quá trình điều chỉnh thuốc.
Sau khi đạt được các mục tiêu về lipid, xét nghiệm lipid đói nên được đánh giá sau mỗi 4 đến 6 tháng.
Các xét nghiệm khác được đánh giá các tác dụng phụ khi bệnh nhân có các triệu chứng.
8 TÀI LIỆU THAM KHẢO
1. Jacobson TA, Ito MK, Maki KC, et al. National lipid association recommendations for patient-cen- tered management of dyslipidemia: Part 1-full report. J Clin Lipi- dol 2015;9(2):129-169.
2. Benjamin EJ, Blaha MJ, Chi- uve SE, et al. Heart disease and stroke statistics-2017 update: A report from the American Heart Association. Circula- tion 2017;135(10):e146-e603.
3. McKenney JM. Understanding PCSK9 and anti-PCSK9 therapies. J Clin Lipidol 2015;9(2):170–186.
4. Rader DJ, deGoma EM. Approach to the patient with extremely low HDL-cholesterol. J Clin Endocri- nol Metab 2012;97(10):3399-3407.
5. Stone NJ, Robinson JG, Lichten- stein AH, et al. 2013 ACC/AHA guideline on the điều trị of blood cholesterol to reduce atherosclerot- ic cardiovascular risk in adults: A report of the American College of Cardiology/American Heart Associ- ation Task Force on Practice Guide- lines. J Am Coll Cardiol 2014;63(25 Pt B):2889-2934.
6. Baigent C, Blackwell L, Ember- son J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: A meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376(9753):1670-1681.
7. Lloyd-Jones DM, Morris PB, Bal- lantyne CM, et al. 2016 ACC Ex- pert Consensus Decision Pathway on the Role of Non-Statin Thera- pies for LDL-Cholesterol Lowering in the Management of Atheroscle- rotic Cardiovascular Disease Risk: A Report of the American College of Cardiology Task Force on Clini- cal Expert Consensus Documents. J Am Coll Cardiol 2016;68(1):92-125.
8. Berglund L, Brunzell JD, Goldberg AC, et al. Evaluation and điều trị of hypertriglyceridemia: An Endocrine Society clinical practice guideline. J Clin Endocrinol Me- tab 2012;97(9):2969-2989.
9. Gouni-Berthold I, Berthold HK. Mipomersen and lomitapide: Two new drugs for the điều trị of homozygous familial hypercho- lesterolemia. Atheroscler Sup- pl 2015;18:28-34.
10. Cupido AJ, Reeskamp LF, Kastelein JJP. Novel lipid mod- ifying drugs to lower LDL cholesterol. Curr Opin Lipi- dol 2017;28(4):367–373.
11. Cannon CP, Blazing MA, Giugli- ano RP, et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372 (25): 2387-2397.
12. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and clin- ical outcomes in patients with cardiovascular disease. N Engl J Med 2017; 376 (18): 1713–1722.
13. Eckel RH, Jakicic JM, Ard JD, et al. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: A report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines. Circulation 2014; 129(25 Suppl 2):S76-S99.
14. Ginsberg HN, Elam MB, Lo- vato LC, et al. Effects of com- bination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010;362(17):1563-1574.
15. Boden WE, Probstfield JL, Ander- son T, et al. Niacin in patients with low HDL cholesterol levels receiv- ing intensive statin therapy. N Engl J Med 2011;365(24):2255–2267.
16. Stroes ES, Thompson PD, Corsini A, et al. Statin-associated mus- cle symptoms: Impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J 2015; 36 (17):1012-1022.
17. Kellick KA, Bottorff M, Toth PP; The National Lipid Association's Safety Task Force. A clinician's guide to statin drug-drug inter- actions. J Clin Lipidol 2014; 8 (3 Suppl):S30-S46.
18. Bays H, Cohen DE, Chalasani N, Harrison SA; The National Lipid Association's Statin Safety Task Force. An assessment by the Statin Liver Safety Task Force: 2014 update. J Clin Lipidol 2014;8 (3 Suppl):S47-S57.

