Điều trị kháng sinh beta-lactam nhìn từ góc độ vi sinh trong kỷ nguyên phế cầu kháng thuốc
TS. BS. NGUYỄN VĂN THÀNH
PCT Hội Phổi Việt Nam, PCT Hội Hô hấp Việt Nam
(Trích từ: Tạp Chí Lao và bệnh phổi, số 37, 06/2025)
Tải bản PDF TẠI ĐÂY
1 Đặt vấn đề
Kể từ khi kháng sinh beta-lactam được đưa vào sử dụng trong lâm sàng cách đây hơn 60 năm, kháng sinh beta-lactam đã trở thành vũ khí chính của liệu pháp kháng khuẩn. Cơ chế hoạt động của kháng sinh beta-lactam thường là ức chế enzym chịu trách nhiệm tổng hợp cấu trúc thành tế bào vi khuẩn, dẫn đến sự phân hủy và chết của vi khuẩn. Thật không may, vi khuẩn đã phát triển khả năng kháng kháng sinh beta-lactam thông qua cơ chế thay đổi các protein liên kết với penicillin để có ái lực tương đối thấp đối với kháng sinh beta-lactam, giảm hoặc hoàn toàn không biểu hiện các protein màng ngoài (OMP) ở vi khuẩn Gram âm, tăng bơm đẩy (là một phần của kiểu hình kháng nội sinh tại hoặc thu được) và bằng cách sản xuất beta-lactamase, cơ chế đóng vai trò chính bằng cách thủy phân vòng beta-lactam, làm bất hoạt kháng sinh. Có thể chế ngự hoạt động của beta-lactamase bằng hai nguyên tắc, thứ nhất liên quan đến việc đưa vào thuốc các phân tử bất hoạt hoặc ức chế beta-lactamase (các phân tử như sulbactam, axit clavulanic và Tazobactam). Nguyên tắc thứ hai liên quan đến việc tìm ra một loại kháng sinh beta-lactam mới có ái lực lớn với beta-lactamase và không thể bị thủy phân hoặc bị thủy phân kém bởi beta-lactamase. Bài viết này cũng sẽ cập tới việc sử dụng hợp lý beta-lactam theo nguyên tắc dược động và dược lực học.
2 Phế cầu kháng thuốc và tình hình dịch tễ
Streptococcus pneumoniae (hay phế cầu) là tác nhân gây bệnh chính trong nhiễm trùng cộng đồng và gây ra khoảng 3 triệu ca tử vong mỗi năm trên toàn thế giới. Khả năng kháng beta-lactam của vi khuẩn này đã trở thành vấn đề sức khỏe cộng đồng toàn cầu. Phơi nhiễm kháng sinh đã được chứng minh là động lực chính thúc đẩy sự xuất hiện và lựa chọn S. pneumoniae kháng thuốc. Trong khi quá trình phát triển thuốc kháng sinh mới vẫn còn chậm chạp thì nhiều quốc gia đã khởi xướng các chương trình nhằm làm giảm sự lây lan của phế cầu khuẩn kháng kháng sinh hoặc hạn chế tỷ lệ nhiễm trùng do những vi khuẩn này gây ra. Các chiến lược như vậy hướng đến mục tiêu giảm đơn kê thuốc kháng sinh cho các bệnh nhiễm trùng đường hô hấp do vi-rút, thúc đẩy các xét nghiệm kháng nguyên liên cầu khuẩn và tăng cường hướng dẫn trong việc giảm việc tự dùng và lạm dụng thuốc. Tầm quốc gia, các chiến lược này chủ yếu tập trung vào việc làm giảm lượng kháng sinh tiêu thụ đồng thời với việc đưa vắc-xin liên hợp phế cầu vào sử dụng.
Theo WHO, ở quy mô toàn cầu, nhiễm trùng đường hô hấp dưới là nguyên nhân gây tử vong đứng thứ ba [1-3]. Hơn 100 tác nhân gây bệnh, bao gồm vi khuẩn, vi-rút và nấm nhưng S. pneumoniae là tác nhân vi khuẩn gây bệnh chính. Phế cầu cũng liên quan đến các bệnh lý khác, bao gồm nhiễm khuẩn huyết, viêm tai giữa và viêm màng não. Do lo ngại về nguy cơ kháng thuốc, WHO cũng đã xếp S. pneumoniae là một trong mười hai loại vi khuẩn cần phát triển ngay các phương pháp điều trị mới vào năm 2017 [4].
S. pneumoniae là vi khuẩn Gram dương, có khả năng quần cư (colonization) trên bề mặt niêm mạc đường hô hấp trên (URT) ở người [4]. Sự hiện diện của loại vi khuẩn này đã được chứng minh là có liên quan đến mức độ bệnh tật và tử vong cao, đặc biệt là ở những người trong nhóm dân số dễ bị tổn thương, chẳng hạn như trẻ em dưới hai tuổi, những người có hệ thống miễn dịch suy yếu và người lớn tuổi. Mặc dù là vi khuẩn cộng sinh, S. pneumoniae có khả năng gây bệnh đáng kể khi di chuyển từ ổ chứa chính trên bề mặt niêm mạc để lan truyền đến các vị trí khác vô trùng, chẳng hạn như phổi, dẫn đến phát triển bệnh viêm phổi. S. pneumoniae thường được xác định là bệnh đồng nhiễm vi khuẩn phổ biến ở những người mắc bệnh do vi-rút corona 2019 (COVID-19). Sự tương tác giữa các tác nhân gây bệnh đồng thời như S. pneumoniae, SARS-CoV-2 và cơ thể chủ đặt ra thách thức đáng kể đối với việc chẩn đoán, điều trị và tiên lượng trong bệnh cảnh này.
Các kháng sinh chính được sử dụng để điều trị S. pneumoniae là beta-lactam, macrolide và fluoroquinolone. Tuy nhiên, hiệu quả của các loại kháng sinh này đang giảm dần do S. pneumoniae kháng thuốc. Theo một cuộc điều tra năm 2014 do WHO tiến hành về tình trạng kháng kháng sinh, phế cầu khuẩn được xác định là một trong chín loại vi sinh gây ra mối lo ngại trên toàn thế giới [5]. Nhìn từ góc độ sử dụng kháng sinh, theo một nghiên cứu do Van Boeckel và cs. tiến hành năm 2014 [6], đã cho thấy có sự gia tăng đáng kể trong việc sử dụng kháng sinh trên toàn cầu từ năm 2000 đến năm 2010. Việc sử dụng kháng sinh đã tăng hơn 30%, đạt tổng số gần 70 tỷ đơn vị liều chuẩn, tăng khoảng 50 tỷ đơn vị. Các loại kháng sinh thường được sử dụng vào năm 2020 là penicillin, macrolide và cephalosporin.
Trong gần bốn thập kỷ, penicillin G đã đóng vai trò là phương pháp điều trị cơ bản để kiểm soát bệnh do phế cầu. Tỷ lệ phế cầu kháng penicillin, lần đầu tiên được quan sát thấy vào những năm 1960, đã tăng đáng kể trong thập kỷ qua. Theo một nghiên cứu được thực hiện vào năm 1999, khoảng 33% phế cầu đã biểu hiện khả năng kháng penicillin [7]. Đáng lưu ý rằng tetracycline, Clindamycin, Chloramphenicol và trimethoprim-sulfamethoxazole (TMP-SMX) cũng cho thấy ít hiệu quả khi được sử dụng điều trị vi khuẩn đã phát triển khả năng kháng penicillin. Tỷ lệ kháng beta-lactam và macrolide cao của phế cầu ở các quốc gia Nam Âu là vấn đề đáng lo ngại, với ước tính cho thấy con số này có thể vượt quá 20% [8,9]. Hầu hết các chủng S. pneumoniae nhạy cảm với penicillin hay kháng penicillin đều dễ điều trị bằng Rifampicin, fluoroquinolone và carbapenem. Độ nhạy cảm của phần lớn các chủng với carbapenem vượt quá 90% [7]. Tuy nhiên, người ta đã thấy có các trường hợp phế cầu đã mất nhạy cảm với fluoroquinolone, mặc dù thực tế là các fluoroquinolone hiện tại đã chứng minh in vitro có hiệu quả trên hơn 99% các phân lập [7]. Việc quản lý phế cầu đặt ra những thách thức do nhiều yếu tố, bao gồm việc sử dụng rộng rãi kháng sinh, sự xuất hiện của một số chủng kháng thuốc, hiện tượng thay thế type huyết thanh và hình thành cấu trúc nang (capsular) và sự chuyển giao ngang các gen liên quan đến tình trạng kháng thuốc kháng sinh.
Việc triển khai vắc-xin liên hợp phế cầu khuẩn (PCV) PCV7 và PCV13 đã thành công trong việc giảm các bệnh nhiễm trùng phế cầu xâm lấn và cung cấp khả năng bảo vệ cho những người chưa tiêm vắc-xin. Tuy nhiên, gánh nặng của các bệnh nhiễm trùng phế cầu vẫn còn cao do khả năng tiếp cận vắc-xin hạn chế ở các nước đang phát triển và phạm vi bao phủ hạn chế của các loại vắc-xin đã có đối với các type huyết thanh gây bệnh. Người ta đã lưu ý rằng tình trạng kháng kháng sinh đã tăng lên trong kỷ nguyên hậu PCV. S. pneumoniae là vi khuẩn được công nhận rộng rãi là tác nhân gây ra viêm phổi đáng kể trên toàn thế giới.
Sự xuất hiện của tình trạng kháng kháng sinh ở S. pneumoniae gây ra mối lo ngại đáng kể cho các hệ thống chăm sóc sức khỏe trên toàn cầu vì nó dẫn đến thất bại trong điều trị. Hậu quả của vấn đề kháng thuốc này bao gồm tỷ lệ tử vong cao, thời gian mắc bệnh kéo dài và chi phí chăm sóc y tế cao hơn. Các tài liệu ban đầu về tình trạng kháng penicillin của S. pneumoniae, sau đó là kháng thuốc tiếp theo đối với các loại kháng sinh khác, đã đặt ra những thách thức trong việc lựa chọn phương pháp điều trị bằng kháng sinh phù hợp. Tính nhạy cảm của S. pneumoniae với beta- lactam và macrolide đã giảm dần. Tỷ lệ kháng thuốc fluoroquinolones, Tetracycline và trimethoprim-sulfamethoxazole (TMP-SMX) cũng đã được báo cáo.
Cherazard và cs. năm 2017, thực hiện một nghiên cứu ở Hoa Kỳ [10], đã phát hiện các tỷ lệ kháng beta-lactam khác nhau ở S. pneumoniae, dao động từ dưới 1% đến 41,8%, tùy thuộc vào các loại thuốc beta-lactam cụ thể. Phạm vi tỷ lệ kháng của penicillin được thấy là từ 13,8% đến 41,8%. Phân bố tỷ lệ kháng của cephalosporin như sau: Cefuroxime chiếm 29,9%, Ceftriaxone chiếm 11,7%, ceftaroline chiếm 0-1% và Imipenem chiếm 23,8%. Ngoài ra, người ta đã chỉ ra rằng tỷ lệ kháng thuốc macrolide dao động từ 20% đến 40%. Tỷ lệ S. pneumoniae kháng thuốc fluoroquinolone dao động từ dưới 1% đến 2%, đây là tỷ lệ thấp nhất.
Các kháng sinh beta-lactam (bao gồm penicillin, cephalosporin và carbapenem) ức chế giai đoạn cuối quá trình tổng hợp peptidoglycan (thành tế bào vi khuẩn) bằng cách liên kết với các protein liên kết penicillin (PBP). Các loại kháng sinh này có phổ hoạt động rộng chống lại vi khuẩn Gram dương và Gram âm. Kháng sinh beta-lactam được coi là thuốc diệt khuẩn phụ thuộc vào thời gian, nghĩa là việc tăng nồng độ đáng kể trên nồng độ ức chế tối thiểu (MIC) không làm tăng hiệu quả kháng sinh. Các kháng sinh có hiệu quả khi nồng độ thuốc gấp khoảng bốn lần MIC của vi khuẩn. Để xác định hiệu quả của kháng sinh beta-lactam, thông số dược động học được ưu tiên là thời gian (T)>MIC. Đối với phần lớn các beta-lactam, hiệu quả đạt được ở T>MIC ở khoảng >40-50% khoảng cách liều thuốc [11].
Sự thay đổi axit amin của PBP thành tế bào dẫn đến giảm ái lực với penicillin, đây là cơ chế chính gây ra tình trạng kháng penicillin. Một số PBP đã được xác định, bao gồm 1a, 1b, 2x, 2a, 2b và 3. Những thay đổi về đặc tính của PBP được thực hiện bằng cách chuyển một phần gen mã hóa PBP từ các loài liên cầu khuẩn khác, dẫn đến hình thành gen dạng khảm. Viện Tiêu chuẩn Lâm sàng và xét nghiệm Hoa kỳ (CLSI) và Ủy ban Châu Âu về Thử nghiệm nhạy cảm với thuốc kháng khuẩn (EUCAST) định nghĩa khả năng kháng penicillin của phế cầu khuẩn thông qua xác định điểm gãy kinh nghiệm (empirical breakpoint) [12]. Các ngưỡng phân loại do CLSI thiết lập năm 2012 đối với phế cầu kháng penicillin là:
- Nhiễm trùng khác ngoài viêm màng não: Nhạy cảm <2μg/ml, trung gian <4μg/ml, và kháng ≥8μg/ml.
- Viêm màng não: Nhạy cảm ≤0,06 μg/ml, trung gian ≥0,12μg/ml, và kháng ≥2μg/ml
Các ngưỡng phân loại nhạy cảm với penicillin dựa trên ba tiêu chí: dữ liệu vi sinh, dược động học/dược lực học của kháng sinh beta-lactam và kết quả lâm sàng của nhiễm trùng phế cầu. Ở bệnh nhân được điều trị bằng liều penicillin tiêm tĩnh mạch, nồng độ đạt được trong phổi sẽ cao hơn 100 lần so với nồng độ đạt được trong não. Do đó, việc sử dụng nồng độ thấp beta-lactam cho các bệnh nhiễm trùng phế cầu, chẳng hạn như viêm tai giữa hoặc viêm màng não, có thể dẫn đến thất bại điều trị. Ngược lại, với các bệnh nhiễm trùng phổi, nồng độ beta-lactam đạt được thường đủ để loại bỏ nhiễm trùng. Do đó, việc điều trị cùng một tác nhân gây bệnh sẽ đòi hỏi các liều lượng khác nhau của một beta-lactam nhất định tùy thuộc vào vị trí nhiễm trùng.
S. pneumoniae đa kháng (MDR) được ước tính trên toàn thế giới cao, dao động từ 36% ở Châu Á đến 15% ở Châu Âu [13], mặc dù tỷ lệ lưu hành thay đổi theo vùng địa lý. Kháng đa thuốc ở phế cầu được định nghĩa là kháng với ba hoặc nhiều nhóm kháng sinh. MDR của phế cầu khuẩn thường liên quan đến tình trạng giảm nhạy cảm với beta-lactam, macrolide, tetracycline và sulfonamid. Tình trạng kháng quinolone ở phế cầu khuẩn MDR ít xảy ra hơn.
Phần lớn các chủng MDR của phế cầu khuẩn có nguồn gốc từ các dòng gen kháng thuốc, với một số dòng chiếm ưu thế trong các phân lập phế cầu trên toàn thế giới. Dữ liệu từ các nghiên cứu ở Châu Âu cho thấy kiểu hình MDR thường gặp nhất ở các huyết thanh nhóm 1, 14, 15A, 19A, 19F và 23F [13]. Tuy nhiên, tại Hoa Kỳ và Canada, các huyết thanh nhóm thường gặp nhất liên quan đến phế cầu MDR là 15A, 15B, 15C, 22F, 23A, 33F và 35B [13]. Các nghiên cứu từ các quốc gia Châu Á báo cáo rằng 11A, 15A, 19A và 19F là các huyết thanh nhóm thường gặp nhất liên quan đến phế cầu MDR [9]. Ở các quốc gia Châu Phi, 19A và 19F là các huyết thanh nhóm thường gặp nhất liên quan đến phế cầu MDR [13]. Nhìn chung, các dữ liệu này chỉ ra rằng sự lây lan của phế cầu khuẩn MDR trên toàn cầu có sự thay đổi cao giữa các quốc gia. Việc đưa vào sử dụng vắc-xin phế cầu khuẩn liên hợp đã góp phần làm giảm đáng kể gánh nặng của bệnh phế cầu và giảm tình trạng kháng thuốc ở S. pneumoniae. Tuy nhiên, sự xuất hiện của các nhóm huyết thanh không có trong vắc-xin cũng cho thấy khả năng kháng nhiều loại thuốc là mối quan tâm lớn.
Việc sử dụng kháng sinh beta-lactam trong 3-6 tháng trước là yếu tố nguy cơ chính liên quan đến nhiễm trùng phế cầu kháng penicillin. Một nghiên cứu của Ruhe và cs. [14] về thời gian điều trị bằng kháng sinh trước đó và mối liên quan với nhiễm trùng huyết do vi khuẩn kháng penicillin và cho thấy có nguy cơ khi tiếp xúc với kháng sinh trước đó và thời gian điều trị. Nghiên cứu trên đã phân tích 303 bệnh nhân bị nhiễm trùng huyết do phế cầu khuẩn. Trong 98 (32%) trường hợp nhiễm trùng huyết do S. pneumoniae không nhạy cảm với penicillin, phân tích thống kê cho thấy việc sử dụng beta-lactam, sulfonamid và macrolide trong 1-6 tháng trước có liên quan có ý nghĩa (p <0,05) đến nhiễm trùng huyết. Trong một nghiên cứu khác với cùng một quần thể nhiễm trùng huyết, Ruhe và cs. [15] đã xác định được 33 (11%) trường hợp nhiễm trùng huyết do S. pneumoniae kháng thuốc ở mức độ cao. Trên những trường hợp này, ba yếu tố nguy cơ nhiễm trùng phế cầu kháng thuốc ở mức độ cao đã được xác định, gồm: sử dụng kháng sinh beta-lactam trong 6 tháng trước, cư trú trước đó ở khu vực nguy cơ (được định nghĩa là ở trong các cơ sở chăm sóc ban ngày, nhà tù, nơi tạm trú cho người vô gia cư, viện dưỡng lão hoặc các cơ sở chăm sóc dài hạn khác) và nhiễm trùng đường hô hấp trong năm trước.
Hai đầu tháp tuổi (<5 tuổi hoặc >65 tuổi) là một yếu tố nguy cơ được công nhận đối với các bệnh nhiễm trùng phế cầu kháng thuốc ở mức độ cao. Như đã chỉ ra ở trên, tỷ lệ mang vi khuẩn phế cầu ở mũi họng ở trẻ em khỏe mạnh dao động từ 20% đến 50% và ở dân số người lớn khỏe mạnh, tỷ lệ mang vi khuẩn ở mũi họng dao động từ 5% đến 30%. Do đó, không khó để hiểu tại sao một số nghiên cứu đã chỉ ra rằng các trung tâm chăm sóc ban ngày là một yếu tố nguy cơ gây nhiễm trùng xâm lấn ở trẻ em do phế cầu khuẩn kháng penicillin. Tương tự như vậy, những người lớn được nhập viện, đặc biệt là những người trên 65 tuổi, có nguy cơ cao mắc các bệnh nhiễm trùng phế cầu kháng penicillin. Hơn nữa, sự hiện diện của các bệnh đi kèm, chẳng hạn như nhiễm vi-rút HIV và bệnh phổi mạn tính, đặc biệt là COPD, là một yếu tố nguy cơ được công nhận đối với nhiễm trùng phế cầu kháng penicillin. Một số nghiên cứu đã xác định mối liên quan giữa việc tiêu thụ kháng sinh và lựa chọn kháng thuốc cho thấy việc sử dụng thuốc kháng sinh trong chăm sóc ngoại trú và xu hướng kháng thuốc ở Châu Âu [16] đối với 21 quốc gia trong giai đoạn 2000-2005. Nghiên cứu này cho thấy rằng sự thay đổi trong mức tiêu thụ kháng sinh với tỷ lệ kháng thuốc ở cấp quốc gia [16]. Bốn nước (Pháp, Luxembourg, Bỉ và Bồ Đào Nha) trong số sáu quốc gia báo cáo mức sử dụng thuốc kháng sinh cao nhất (Hy Lạp, Pháp, Luxembourg, Bồ Đào Nha, Croatia và Bỉ) cũng báo cáo có tỷ lệ kháng thuốc cao nhất.
Trong một nghiên cứu [16a] nhằm đánh giá tác động của phơi nhiễm kháng sinh với chiến lược sử dụng thuốc được theo dõi trong 50 năm, các tác giả nhận định: Khi tần suất tiếp xúc với kháng sinh mỗi năm được giữ không đổi, mức liều có tác động mạnh đến mức độ kháng thuốc sau mô phỏng 50 năm. Liều thấp nhất dẫn đến tỷ lệ lưu hành cao các chủng không nhạy cảm (>70%) với MIC vẫn thấp (1mg/L), trong khi liều cao dẫn đến tỷ lệ lưu hành thấp hơn các chủng không nhạy cảm (<40%) và MIC cao hơn (2 mg/L). Hơn nữa, bằng cách giữ khối lượng kháng sinh không đổi trong quần thể, các mô hình sử dụng khác nhau (liều kháng sinh thấp và tần suất tiếp xúc kháng sinh cao so với liều cao và tần suất thấp) có thể dẫn đến tỷ lệ phân bố và tỷ lệ kháng thuốc khác nhau rõ rệt (từ 10 đến 100%). Kết quả của nghiên cứu này cho thấy các mô hình kháng thuốc của phế cầu trong cộng đồng có liên quan chặt chẽ đến liều beta-lactam cá nhân đã sử dụng và như vậy việc hạn chế sử dụng beta-lactam trong khi tăng liều có thể giúp giảm tỷ lệ kháng thuốc, mặc dù nó sẽ phải đối diện với mức độ kháng thuốc cao hơn. Do đó, các mạng lưới giám sát dược lâm sàng được khuyến khích thu thập số liệu TDM (therapeutic drug monitoring) để chọn thuốc và cách sử dụng phù hợp trên từng đối tượng bệnh nhân.
Có 98 type huyết thanh phế cầu khuẩn được báo cáo, 92 huyết thanh đã được xác định bằng phương pháp Quellung (là một phản ứng sinh hóa trong đó kháng thể liên kết với lớp vỏ vi khuẩn. Phản ứng kháng thể cho phép quan sát các loài này dưới kính hiển vi. Nếu phản ứng dương tính, lớp vỏ trở nên mờ đục và có vẻ to ra) và các huyết thanh bổ sung đã được xác định bằng các kỹ thuật sinh học phân tử. Các huyết thanh này được nhóm thành 48 nhóm dựa trên điểm tương đồng về kháng nguyên của chúng. Một số nghiên cứu dịch tễ học cho thấy rằng có mối quan hệ giữa các nhóm huyết thanh cụ thể và độ tuổi, vị trí nhiễm trùng, bệnh đi kèm, khu vực địa lý, mức độ xâm lấn của phế cầu và mức độ nặng của bệnh [13]. Như đã nói ở trên, sự khác biệt về type huyết thanh cũng liên quan đến khả năng kháng thuốc kháng sinh. Hành vi khác nhau giữa các nhóm huyết thanh có thể phản ánh sự khác biệt về vi khuẩn mang ở hầu họng, với tỷ lệ cao nhất ở trẻ em, đặc biệt là trong năm đầu đời. Các yếu tố nguy cơ gây bệnh viêm mũi họng ở trẻ em bao gồm mùa lạnh, độ tuổi dưới 6 tuổi, có em nhỏ và đi nhà trẻ. Ở người lớn, các yếu tố nguy cơ gây bệnh viêm mũi họng bao gồm hút thuốc lá, hen và nhiễm trùng đường hô hấp trên cấp tính. Thời gian nhiễm khuẩn ở trẻ em có thể kéo dài trung bình 4 tháng, nhưng ở người lớn thì ngắn hơn nhiều, thường là 2-4 tuần. Thời gian nhiễm khuẩn kéo dài này và việc trẻ em thường xuyên tiếp xúc với thuốc kháng sinh giải thích tại sao chúng được coi là nguồn chính các chủng phế cầu kháng thuốc.
Các yếu tố nguy cơ liên quan đến tình trạng kháng nhiều loại thuốc được báo cáo đối với tình trạng nhiễm phế cầu kháng nhiều loại thuốc là hai đầu độ tuổi (<2 tuổi và >65 tuổi), có các bệnh đi kèm, chẳng hạn như các bệnh mạn tính (tim, phổi, gan, thận), đã tiếp xúc trước đó, đặc biệt là tiếp xúc nhiều lần, với liệu pháp kháng sinh trong 3 tháng trước đó và trong tình trạng ức chế miễn dịch. Ngoài ra, nhiễm trùng với các huyết thanh nhóm như 6A/B, 19A, 19F, 15A, 35B, 23A, 22F và 33F là các yếu tố nguy cơ. Trong số này, yếu tố nguy cơ mạnh nhất là tiếp xúc nhiều lần với liệu pháp kháng sinh.
Sự liên quan của S. pneumoniae kháng penicillin với kết quả lâm sàng trong các trường hợp viêm phổi mắc phải cộng đồng (CAP) do phế cầu khuẩn vẫn còn là vấn đề gây tranh cãi. Một số nghiên cứu cho thấy thất bại điều trị trong các trường hợp CAP không xảy ra khi sử dụng liệu pháp kháng sinh và với liều lượng thích hợp, ngay cả ở những bệnh nhân bị nhiễm các chủng không nhạy cảm và được điều trị bằng beta-lactam. Ví dụ, vào năm 2010, một nghiên cứu của Tây Ban Nha đã phân tích 1041 bệnh nhân bị viêm phổi do phế cầu trong đó 114 (11%) bị sốc nhiễm trùng. Các yếu tố nguy cơ chính là hút thuốc lá, liệu pháp corticosteroid mạn tính và phế cầu sero type 3 đã không tìm thấy sự khác biệt nào về kiểu gen hoặc mô hình kháng kháng sinh giữa những bệnh nhân có hoặc không bị sốc nhiễm trùng [17]. Tương tự như vậy, một nghiên cứu của Morgandon và cs. [18], liên quan đến tình trạng viêm phổi nặng do phế cầu ở những bệnh nhân được đưa vào khoa chăm sóc đặc biệt (ICU), đã báo cáo rằng các yếu tố nguy cơ tử vong là tuổi, giới nam và lọc máu. Các bệnh đi kèm, sử dụng macrolide, nhiễm trùng huyết đồng thời hoặc nhạy cảm với penicillin không ảnh hưởng đến kết quả trong những trường hợp này. Các nghiên cứu trên cho thấy kết quả với viêm phổi cộng đồng do phế cầu có thể liên quan đến biểu hiện lâm sàng của viêm phổi hơn là tình trạng kháng kháng sinh của chủng phế cầu khuẩn. Một lời giải thích hợp lý là nồng độ kháng sinh đạt được trong phổi thường cao hơn MIC của phế cầu khuẩn trong hơn 40-50% khoảng cách liều dùng thuốc, ngay cả với các chủng kháng thuốc. Rất tiếc, từ y văn với từ khóa “phế cầu kháng beta-lactam rất cao (MIC ≥16μg/ml)” không có bài viết nào đề cập trên các trang tìm kiếm.
Ở Hòa kỳ, trong một nghiên cứu ở bệnh viện [19], tỷ lệ lưu hành phề cầu kháng rất cao (được định nghĩa là ≥8μg/ml) có xu hướng tăng, từ 0,56% (14 trong số 2.507) chủng vào năm 1995 lên 0,87% vào năm 2001 (P=0,03), với đỉnh điểm vào năm 1996 và 2000 liên quan đến dịch bệnh ở Georgia và Maryland. Đối với phần lớn các chủng này MIC của Amoxicillin (91%), cefuroxime (100%) và Cefotaxime (68%) là ≥8μg/ml và tất cả đều kháng ít nhất một nhóm thuốc khác. Viêm phổi (50%) và nhiễm khuẩn huyết (36%) là những biểu hiện lâm sàng phổ biến nhất.
Một tình huống khác được thấy ở viêm tai giữa hoặc viêm màng não do phế cầu khi được điều trị bằng beta-lactam - tình trạng thất bại điều trị có liên quan đến các chủng kháng thuốc. Có giả thuyết cho rằng thất bại trong điều trị là do khó đạt được nồng độ kháng sinh đủ cao tại các vị trí nhiễm trùng này. Vì lý do này, hầu hết các hướng dẫn đề xuất sử dụng vancomycin đồng thời cho bệnh nhân bị viêm màng não do phế cầu khuẩn cho đến khi biết được MIC của phế cầu khuẩn đối với beta-lactam [20].
Việc sử dụng liều cao và giảm thời gian điều trị, đặc biệt là đối với amoxicillin, cũng được đề xuất để tránh thất bại điều trị trong các trường hợp nhiễm trùng do vi khuẩn kháng thuốc mức độ cao gây ra và kiểm soát sự lây lan của các chủng kháng thuốc. Các nghiên cứu dược động học - dược lực học ủng hộ khả năng rằng các kiểu liều có thể ảnh hưởng đến việc lựa chọn kháng thuốc và diệt trừ vi khuẩn và tác động của các chiến lược như vậy đã được đánh giá ở cấp độ cá nhân trong các nghiên cứu lâm sàng.
3 Kháng sinh beta-lactam và kháng beta-lactam
Theo quan điểm sinh hóa, các thuốc nhóm beta-lactam có đặc điểm chung là vòng 3-carbon và 1- nitơ (vòng beta-lactam) có khả năng phản ứng cao. Nhóm này bao gồm [21]:
- Penicillin: Các loại kháng sinh này (hầu hết đều kết thúc bằng hậu tố -cillin) chứa nhân vòng axit 6-animopenicillanic (lactam cộng với thiazolidine) và các chuỗi bên vòng khác. Nhóm này bao gồm penicillin tự nhiên, aminopenicillin, carboxypenicillin và ureidopenicillin.
- Cephalosporin: Chứa nhân axit 7-aminocephalosporanic và chuỗi bên chứa vòng 3,6-dihydro- 2 H-1,3-thiazane. Cephalosporin theo truyền thống được chia thành năm lớp hoặc thế hệ, mặc dù thuật ngữ này không được chấp nhận rộng rãi.
- Carbapenem: Cấu trúc xác định của chúng là một carbapenem kết hợp với một vòng beta- lactam mang lại khả năng bảo vệ chống lại hầu hết các beta-lactamase, mặc dù khả năng kháng các kháng sinh nhóm này là một vấn đề đáng chú ý và chủ yếu xảy ra ở các vi khuẩn Gram âm (ví dụ: Klebsiella pneumoniae, Pseudomonas aeruginosa và Acinetobacter baumannii), tạo ra các loại beta-lactamase khác nhau được gọi là carbapenemase.
- Monobactam: Vòng beta-lactam đứng riêng lẻ và không gắn vào vòng khác.
- Chất ức chế beta-lactamase: Hoạt động chủ yếu bằng cách làm vô hiệu các beta-lactamase serine, đây là các enzyme thủy phân làm vỡ vòng beta-lactam (đặc biệt là ở vi khuẩn Gram âm). Các tác nhân này bao gồm chất ức chế beta-lactamase thế hệ đầu tiên (axit clavulanic, Sulbactam và tazobactam) và avibactam và vaborbactam.
Cấu trúc của penicillin bao gồm một vòng thiazolidine được kết nối với một vòng beta-lactam, được gắn vào một chuỗi bên. Tất cả các penicillin đều có nguồn gốc từ axit 6-amino-penecillinic. Các penicillin khác nhau khác nhau về cấu trúc chuỗi bên của chúng. Penicillin được chia thành penicillin tự nhiên và bán tổng hợp. Penicillin tự nhiên được chiết xuất từ Dung dịch nuôi cấy của penicillia, nhậy cảm với pH, và có tác dụng kháng khuẩn Gram (+) nhưng nhậy cảm với sự tác động của penicillinase. Penicillin bán tổng hợp được sản xuất bằng cách nuôi cấy penicillium trong môi trường nuôi cấy để chỉ tổng hợp nhân. Nhóm R (nhóm R là chuỗi bên biến đổi gắn vào vòng beta-lactam lõi và vòng thiazolidine. Nhóm R này xác định loại penicillin cụ thể và các đặc tính của nó), được gắn trong phòng thí nghiệm hoặc nuôi cấy penicillium, chiết xuất penicillin tự nhiên, loại bỏ nhóm R và gắn nhóm R mong muốn. Những penicillin nhóm này có phổ rộng hơn, chúng có hiệu quả chống lại các vi khuẩn Gram âm và kháng được với penicillinase.
Cephalosporin là một lớp kháng sinh beta-lactam ban đầu có nguồn gốc từ nấm Acremonium, trước đây được gọi là “Cephalosporium”. Cephalosporin là dẫn xuất của axit 7-amino-cephalosporanic và có cấu trúc gần giống với penicillin. Chúng có vòng beta-lactam. Cephalosporin tương đối ổn định trong axit loãng và có khả năng kháng penicillinase cao. Tất cả các cephalosporin đều có hoạt tính chống lại hầu hết các cầu khuẩn Gram dương, thế hệ đầu tiên bao gồm cephalothin, Cefazolin, Cephalexin có tác dụng mạnh hơn đối với vi khuẩn Gram dương so với vi khuẩn Gram âm. Thế hệ thứ hai có hoạt tính kháng khuẩn tăng lên đối với vi khuẩn Gram âm. Thế hệ thứ ba có tác dụng rộng nhất đối với vi khuẩn Gram âm và hoạt tính thấp nhất đối với vi khuẩn Gram dương. Thế hệ thứ tư là các kháng sinh phổ rộng có hoạt tính tương tự chống lại các vi khuẩn Gram dương như các cephalosporin thế hệ đầu tiên, Cephalosporin thế hệ thứ tư có thể xuyên qua màng ngoài của vi khuẩn Gram âm và kháng beta-lactamase cao hơn cephalosporin thế hệ thứ ba.
Có bốn cách chính mà vi khuẩn tránh được tác dụng diệt khuẩn của beta-lactam.
- Các protein liên kết với penicillin đã bị thay đổi biểu hiện ái lực tương đối thấp đối với kháng sinh beta-lactam và chúng có thể chuyển giao chức năng cho các PBP khác sau khi chúng bị bất hoạt. Giảm hoặc hoàn toàn không biểu hiện các protein màng ngoài (OMP) ở vi khuẩn Gram âm.
- Với vi khuẩn Gram âm, để có thể tiếp cận với PBP, beta-lactam phải di chuyển qua các kênh porin ở màng ngoài, giảm biểu hiện của OMP hạn chế một số beta-lactam xâm nhập vào không gian quanh bào tương, do đó hạn chế khả năng tiếp cận của chúng với PBP trên màng trong. Một số đột biến gen làm thay đổi cấu trúc kênh porin từ đó làm giảm khả năng tiếp cận PBP trên màng trong vi khuẩn Gram âm. Tuy nhiên người ta cho rằng cơ chế này riêng lẻ không đủ tạo nên kiểu hình kháng thuốc.
- Bơm tống thuốc là một phần của kiểu hình kháng thuốc nội tại hoặc kiểu hình kháng thuốc thu được. Bơm đẩy có khả năng đưa nhiều chất khác nhau từ phần quanh bào tương ra môi trường xung quanh. Các bơm này là yếu tố quyết định khả năng kháng thuốc đa kháng sinh ở nhiều loại vi khuẩn Gram âm, đặc biệt là P. aeruginosa.
- Sản xuất beta-lactamase (các men thủy phân vòng beta-lactam) làm cho kháng sinh beta- lactam bị bất hoạt trước khi đến được mục tiêu PBP. Do tương đồng cấu trúc mà beta- lactamase chia sẻ với PBP, nó liên kết, axyl hóa và cũng sử dụng các phân tử nước để thủy phân và bất hoạt beta-lactam gắn với PBP, cho phép các enzyme này liên kết, axyl hóa và sử dụng một phân tử nước nằm ở vị trí chiến lược để thủy phân và do đó bất hoạt beta-lactam. Ở vi khuẩn Gram âm, cơ chế kháng thuốc quan trọng nhất là bất hoạt beta-lactam bởi beta- lactamase. Người ta đã báo cáo rằng có hơn 530 enzyme beta-lactamase [22].
Về cơ bản, có hai cách để khắc phục tác động của hoạt động thủy phân của beta-lactamase.
- Nguyên tắc đầu tiên là làm bất hoạt hoặc ức chế beta-lactamase. Sulbactam, axit clavulanic và tazobactam-lactamase là ba chất ức chế được sử dụng trong ứng dụng lâm sàng. Cả ba hợp chất này đều có cấu trúc tương tự penicillin. Một số đặc điểm của các hợp chất này bao gồm ái lực cao đối với beta-lactamase, mỗi hợp chất này chiếm vị trí hoạt động tương đối lâu hơn beta-lactam và chúng cũng bị thủy phân kém bởi enzyme do đó, chất ức chế beta-lactamase cũng được gọi là “chất ức chế tự sát” vì chúng bị beta-lactamase giữ lại.
- Nguyên tắc thứ hai liên quan đến việc có được một loại kháng sinh beta-lactam mới có khả năng chống chịu mạnh với beta-lactamase. Đây là lý do ban đầu đằng sau việc mở rộng carbapenem phổ rộng hoặc cephalosporin. Ví dụ phổ biến về nguyên tắc này là sự phát triển của các hợp chất như doripenem và ceftobiprol. Ceftobiprole là một “cephalosporin chống MRSA” thể hiện ái lực rất cao đối với PBP2, nó hoạt động chống lại vi khuẩn Gram âm có beta- lactamase và kháng penicillinase của S. aureus. Doripenem là một carbapenem biến đổi với nhóm pyrrolidylthio thay thế sulfamoylaminomethyl ở vị trí C2 và nhóm 1-beta-methyl, thể hiện hoạt tính rất cao chống lại Acinetobacter spp, P. aeruginosa và Burkholderia cepacia.
Nền tảng cấu trúc của kháng sinh beta-lactam như đã nói bao gồm vòng beta-lactam (là vòng bốn cạnh chứa nitơ). Trình tự peptide D-Ala-D-Ala, đóng vai trò là chất nền cho transpeptidase thành tế bào, có cấu trúc tương tự như vòng beta-lactam. Cơ chế hoạt động của nhóm thuốc kháng sinh này liên quan đến việc nhắm mục tiêu cụ thể và ức chế sản xuất thành tế bào bằng cách bám vào các enzyme liên quan. Vòng beta-lactam đóng vai trò quan trọng trong cơ chế hoạt động của kháng sinh nhóm beta-lactam. PBP là một nhóm enzyme được gắn vào màng tế bào vi khuẩn. PBP được phân loại thành 4-6 loại riêng biệt theo loài vi khuẩn cụ thể. Transpeptidases (PBP), đóng vai trò quan trọng trong việc liên kết chéo trong thành tế bào, rất cần thiết cho sự sống còn của vi khuẩn. Đầu cuối peptide D-Ala-D-Ala đóng vai trò là chất nền đảm bảo cho hoạt động của transpeptidase liên quan đến sản xuất peptidoglycan trong thành tế bào. Đầu cuối peptide này có cấu hình ba chiều giống với cấu trúc vòng bốn cạnh được thấy trong kháng sinh beta-lactam. Thuốc beta-lactam ức chế quá trình tổng hợp thành tế bào bằng cách hình thành liên kết mạnh với vị trí hoạt động của transpeptidase. Hậu quả là tế bào chết vì mất ổn định thẩm thấu do tổng hợp thành tế bào không đầy đủ hoặc liên kết beta-lactam với PBP có thể khởi phát một loạt phản ứng cuối cùng dẫn đến tự phân hủy và chết tế bào. Kháng sinh beta-lactam có hiệu quả chống lại cả vi khuẩn Gram dương và Gram âm. Tuy nhiên, hiệu quả của các kháng sinh nhóm beta-lactam khác nhau do sự khác biệt trong cấu trúc tế bào của hai loại vi khuẩn (ví dụ, vi khuẩn Gram âm có màng ngoài, trong khi vi khuẩn Gram dương không có màng ngoài). Kháng sinh beta-lactam, trước đây được coi là kháng sinh rất hiệu quả để điều trị S. pneumoniae. Năm 1967, trường hợp đầu tiên về tình trạng kháng penicillin ở S. pneumoniae mới được ghi nhận tại Úc [23]. Nồng độ ức chế tối thiểu (MIC) của beta-lactam đã có xu hướng tăng theo thời gian. Tình hình kháng thuốc đã dẫn đến sự suy giảm trong việc sử dụng beta-lactam. Có một quan niệm cho rằng sự phát triển của tình trạng kháng thuốc ở phế cầu khuẩn và liên cầu khuẩn cộng sinh có thể là do tối thiểu hai giai đoạn riêng biệt. Quá trình này bao gồm việc lựa chọn các liên cầu cộng sinh có khả năng kháng đột biến ở gen pbp của chúng, sau đó là việc chuyển các gen kháng này sang các phế cầu gây bệnh bằng cách tái tổ hợp tương đồng. Các đột biến tích tụ dần dần bên trong ba transpeptidase (PBP) đóng vai trò quan trọng trong quá trình sản xuất thành tế bào. Việc sử dụng thuốc quá mức đã dẫn đến một biến đổi di truyền làm thay đổi trình tự axit amin của các protein PBP2x, PBP2b và PBP1a. Sự hiện diện của ngay cả những đoạn nhỏ và đa dạng phát sinh từ các đột biến cũng có thể ảnh hưởng đáng kể đến quá trình biến đổi gen pbp, dẫn đến sự phát triển khả năng kháng beta-lactam ở liên cầu khuẩn cộng sinh và S. pneumoniae. Các vi khuẩn biến đổi thể hiện lợi thế cạnh tranh khi có biến đổi di truyền này khi tiếp xúc với kháng sinh, làm giảm ái lực liên kết của transpeptidase đối với thuốc trong khi vẫn bảo tồn chức năng của enzyme. Các gen pbp trong các chủng phế cầu khuẩn kháng thuốc có kiểu khảm trái ngược với các phần tương tự của phế cầu khuẩn nhậy cảm kháng sinh. Cấu trúc khảm có thể là do sự chuyển gen giữa các loài có nguồn gốc từ Streptococcus mitis và Streptococcus oralis, được cho là những chủng tiềm năng cung cấp gen kháng thuốc. Hai loài này cùng tồn tại trong vòm họng, đóng vai trò là hốc sinh học chung của chúng. Sự tích hợp DNA ngoại sinh từ các chủng Streptococcus kháng beta-lactam sống trong cùng một hốc sinh thái (biological niche). Hơn nữa, người ta đưa ra giả thuyết rằng các gen không phải pbp, chẳng hạn như gen murM, có thể liên quan đến khả năng kháng thuốc kháng sinh beta-lactam của S. pneumoniae. Việc làm mất khả năng liên kết với PBP xảy ra khi các beta-lactamase phân cắt vòng beta-lactam. Tuy nhiên, cần lưu ý là không phải tất cả các beta-lactam đều có thể bị thủy phân bởi tất cả các beta-lactamase. Ví dụ, beta-lactamase của tụ cầu khuẩn thể hiện quá trình thủy phân nhanh penicillin và các dẫn xuất của nó. Tuy nhiên, nó không có khả năng thủy phân các cephalosporin khác, chẳng hạn như imipenem.
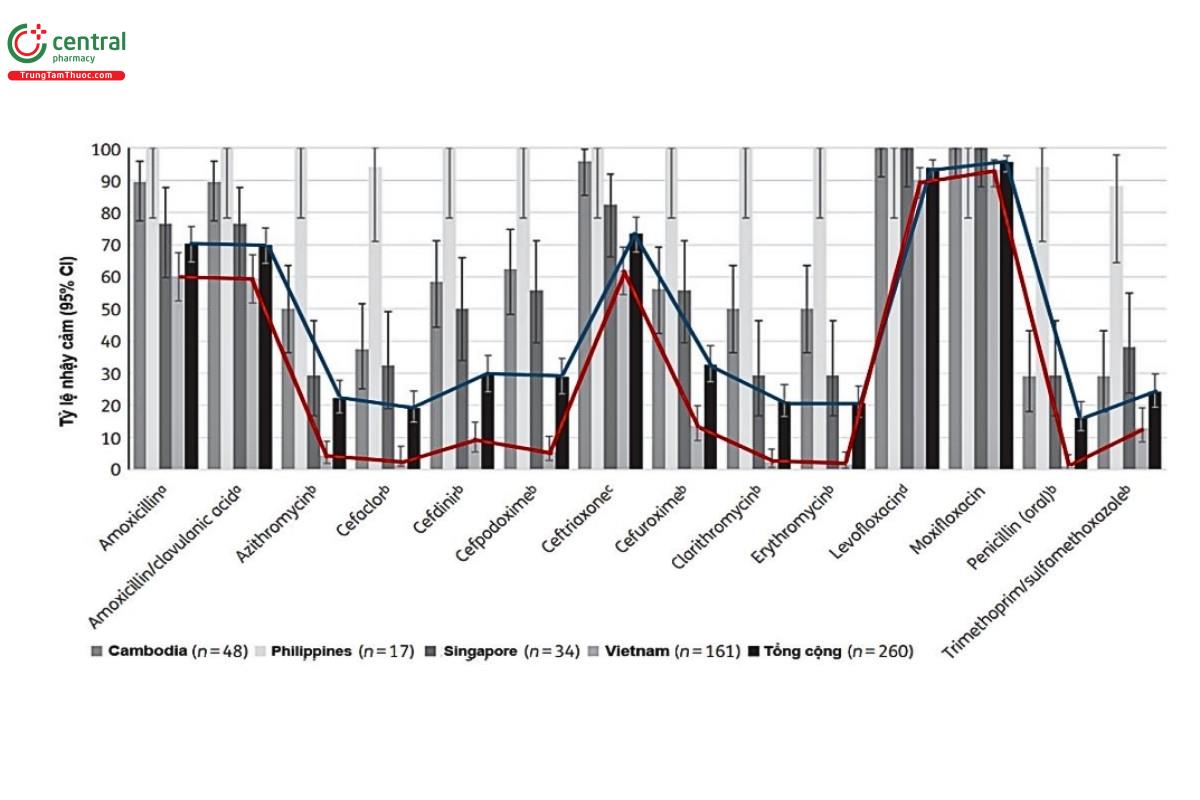
Kết quả nghiên cứu về tình hình nhậy cảm kháng sinh của S. pneumoniae từ nghiên cứu SOAR (2016-2018) ở Việt Nam và các nước Đông-Nam Á [24] (Hình 1) nhìn một cách tổng thể cho thấy tỷ lệ vi khuẩn còn nhậy cảm kháng sinh trên các phân lập ở Campuchia, Singapore và Philippine cao hơn so với Việt Nam ý nghĩa (p<0,05), trong đó sự khác biệt rất cần lưu ý là ở các kháng sinh beta-lamtam.
Ở Việt Nam, nghiên cứu EACRI, nghiên cứu ở cộng đồng năm 2019 cũng đã ghi nhận được sự thay đổi về tình hình đề kháng các kháng sinh đối với S. pneumoniae trong khoảng một thập niên vừa qua [24]. Nếu như trong nghiên cứu SOAR năm 2010-2011, tỷ lệ đề kháng fluoroquinolone (Ofloxacin) còn thấp là 4,8% thì trong nghiên cứu này đã có đến 29,2% kháng được fluoroquinolone hô hấp (Levofloxacin), ngay cả fluoroquinolone được ghi nhận là hiệu quả trên S. pneumoniae là Moxifloxacin, tỷ lệ đề kháng cũng được ghi nhận là 4,6%. Một ghi nhận nữa trong nghiên cứu AECRI là tỷ lệ S. pneumoniae kháng penicillin là 4,2% trong khi trong nghiên cứu SOAR chỉ có 1% S. pneumoniae kháng được penicillin (ở ngưỡng MIC ≥8μg/ml) và sự gia tăng đề kháng penicillin của S. pneumoniae trong nghiên cứu AECRI cũng được ghi nhận cả trong sự gia tăng MIC90 của penicillin và amoxicillin, đã lên đến 4μg/ml trong khi trong nghiên cứu SOAR [78], MIC90 của penicillin và amoxicillin chỉ là 3μg/ml [24].
4 Tiếp cận điều trị kháng sinh với beta-lactam hợp lý
S. pneumoniae đã được chứng minh là tác nhân gây bệnh thường gặp nhất của viêm phổi mắc phải cộng đồng (CAP) và tình trạng kháng kháng sinh của phế cầu khuẩn đối với các họ kháng sinh khác nhau vẫn là một vấn đề gây nhiều tranh cãi [25]. Tình trạng kháng thuốc của vi khuẩn gây ra rất nhiều nhầm lẫn trong việc lựa chọn phương pháp điều trị kinh nghiệm cho bệnh viêm phổi và điều này khiến chúng ta cần phải biết những yếu tố nào thực sự quyết định tác động của tình trạng kháng thuốc đối với kết quả của các bệnh nhiễm trùng do vi khuẩn này gây ra. Một số khía cạnh khác nhau phải được tính đến khi phân tích vấn đề này, chẳng hạn như thiết kế nghiên cứu, tình trạng của bệnh nhân tại thời điểm chẩn đoán, lựa chọn phác đồ kháng sinh ban đầu (phối hợp hoặc đơn trị liệu) và các biến số dược động học/dược lực học của loại kháng sinh đã chọn. Người ta thường chấp nhận rằng trong điều trị các bệnh nhiễm trùng do phế cầu kháng beta-lactam, các thuốc beta-lactam kháng phế cầu khuẩn tiêu chuẩn thường cho kết quả tốt trong điều trị CAP khi sử dụng thuốc thích hợp với liều lượng đủ. Theo nguyên tắc chung, đối với nhiễm trùng do các chủng nhạy cảm với penicillin, penicillin hoặc một aminopenicillin (thí dụ amoxicillin) với liều chuẩn sẽ có hiệu quả. Trong trường hợp các chủng có khả năng kháng trung gian, các tác nhân beta-lactam vẫn được coi là phương pháp điều trị phù hợp mặc dù khuyến cáo dùng liều cao hơn. Cuối cùng, các bệnh nhiễm trùng do các chủng phân lập có khả năng kháng penicillin ở mức độ cao nên được điều trị bằng các thuốc thay thế như cephalosporin thế hệ thứ ba hoặc các fluoroquinolone kháng phế cầu mới. Ở những khu vực có tỷ lệ kháng macrolide ở mức độ cao cao, liệu pháp đơn trị liệu kinh nghiệm bằng macrolide không phải là phương pháp tối ưu để điều trị cho những bệnh nhân CAP nhập viện ở mức độ trung bình hoặc trung bình - nặng. Fluoroquinolone được coi là loại kháng sinh tuyệt vời trong điều trị CAP do phế cầu ở người lớn nhưng có nhiều lo ngại về sự phát triển của tình trạng kháng thuốc. Hầu hết các hướng dẫn quốc tế đều khuyến cáo liệu pháp phối hợp beta-lactam cộng với một macrolide để điều trị cho những bệnh nhân CAP nhập viện.
Kháng sinh beta-lactam thể hiện hoạt động diệt khuẩn phụ thuộc vào thời gian và nói chung, cần fT>MIC (thời gian thuốc tự do cao hơn nồng độ ức chế tối thiểu) trong ~50% khoảng cách liều để đạt được hiệu quả tối đa. Tuy nhiên, nồng độ thuốc này có thể thay đổi tùy theo từng loại beta-lactam cụ thể. Ví dụ, trong khi beta-lactam dựa trên penicillin được báo cáo là cần 50% fT>MIC, các nghiên cứu trên người và động vật với cephalosporin cho thấy cần từ 50% đến 70% fT>MIC. Carbapenem (doripenem, Ertapenem, imipenem, meropenem) thường được cho là đạt được hoạt động diệt khuẩn tối đa ở ~40% fT>MIC. Do đó, tối đa hóa thời gian mà nồng độ cao hơn MIC là chiến lược dùng thuốc. Nhiều phương pháp khác nhau đã được sử dụng để tối đa hóa T>MIC, trong đó bao gồm tăng liều, sử dụng thuốc nhiều lần hơn và kéo dài thời gian truyền (trong mỗi 3-4 giờ hoặc liên tục trong 24 giờ). Nhìn chung, cách hiệu quả nhất để tối ưu hóa việc tiếp xúc, đặc biệt là đối với vi khuẩn Gram âm đa kháng (MDR), là tăng liều dùng và kéo dài thời gian truyền, do đó duy trì được nồng độ thuốc cao hơn MIC trong thời gian tiếp xúc diệt khuẩn cần thiết. Điều này đã được áp dụng cho beta-lactam như cefepime, doripenem, và Meropenem trong nhiều nghiên cứu. Ở những bệnh nhân có chức năng thận bình thường, doripenem/meropenem và cefepime liều dùng 2g mỗi 8 giờ (mỗi liều được truyền kéo dài trong 3 hoặc 4 giờ) đạt được khả năng cao trong việc điều trị các vi khuẩn được coi là kháng thuốc với MIC lần lượt là 8-16μg/ml và 16-32μg/ml, cao hơn đáng kể so với khi cùng một phác đồ liều dùng được truyền trong 30 phút tiêu chuẩn. Các phác đồ liều dùng piperacillin/tazobactam cũng có thể được tối ưu hóa bằng cách sử dụng phương pháp truyền liên tục hoặc kéo dài. Kim và cs. đã ghi nhận rằng liều 4,5g mỗi 6 giờ (mỗi liều truyền trong 3 giờ, tổng liều 18g/ngày) sẽ đạt được mức nồng độ dược động học tương tự như liều hàng ngày tương tự (18g) được dùng dưới dạng truyền liên tục và cả hai đều có khả năng đạt được mục tiêu cao hơn so với liều chuẩn 4,5g mỗi 6 giờ (tổng liều 18g) truyền trong 30 phút [26]. Lodise và cs. đã quan sát thấy kết quả lâm sàng vượt trội sau khi thực hiện chế độ dùng thuốc piperacillin/tazobactam so với 3,375g mỗi 6 giờ (truyền 30 phút) [27]. Tóm lại, hầu hết các nghiên cứu với truyền beta-lactam liên tục và kéo dài đã chứng minh giá trị lớn nhất trong việc điều trị cho những bệnh nhân bị bệnh nặng hơn và bị nhiễm các tác nhân gây bệnh có MIC cao hơn (tức là kém nhạy cảm hơn).
Trong viêm phổi, S. pneumoniae nên được coi là nhạy nếu nồng độ ức chế tối thiểu của penicillin (MIC) ≤1μg/mL, nhạy cảm trung gian nếu MIC là 2μg/mL và kháng thuốc nếu MIC ≥4μg/mL. Đối với điều trị ngoại trú viêm phổi cộng đồng, cho trẻ em từ 8 tuổi trở lên có thể chọn một beta-lactam đường uống có hoạt tính tốt chống lại phế cầu khuẩn (ví dụ: cefuroxime axetil, amoxicillin hoặc kết hợp amoxicillin và clavulanate Kali). Các phác đồ kháng sinh kinh nghiệm phù hợp cho viêm phổi ở bệnh nhân nội trú bao gồm một beta-lactam tiêm tĩnh mạch, chẳng hạn như cefuroxime, ceftriaxone natri, cefotaxime natri hoặc kết hợp Ampicillin natri và sulbactam natri cộng với một macrolide. Các fluoroquinolone mới có hoạt tính cải thiện chống lại S pneumoniae cũng có thể được sử dụng để điều trị cho người lớn bị viêm phổi mắc phải cộng đồng. Để hạn chế sự xuất hiện của các chủng kháng fluoroquinolone, các fluoroquinolone mới nên được giới hạn ở người lớn (1) khi mà một trong các phác đồ trên đã thất bại, (2) những người bị dị ứng với các thuốc thay thế hoặc (3) những người đã được ghi nhận nhiễm trùng phế cầu khuẩn kháng thuốc cao (ví dụ, penicillin MIC ≥4 μg/mL). Vancomycin hydrochloride không được chỉ định thường quy để điều trị viêm phổi mắc phải cộng đồng hoặc viêm phổi do phế cầu kháng thuốc (DRSP) [28].
5 Kết luận
Sự gia tăng tình trạng kháng thuốc kháng sinh trên toàn thế giới là mối quan tâm đối với sức khỏe cộng đồng. Thực tế là việc lựa chọn liều lượng và thời gian điều trị có thể ảnh hưởng đến việc tạo ra các đột biến kháng thuốc. Mối liên quan này đang trở nên rõ ràng hơn và ngày càng có nhiều nghiên cứu sử dụng các mô hình dược động học để mô tả mức độ phơi nhiễm thuốc và các điểm cắt dược động học cần thiết để giảm thiểu và dự đoán sự phát triển của tình trạng kháng thuốc. Tuy nhiên, vẫn còn thiếu dữ liệu đầy đủ và cần có các nghiên cứu trong tương lai để mô tả đầy đủ các nồng độ thuốc mục tiêu này. Cũng cần có thêm kiến thức về dược động học của thuốc so với vi khuẩn có các đột biến kháng thuốc và mức độ nhạy cảm khác nhau. Các phác đồ liều dùng phải thể hiện hiệu quả cao không chỉ đối với vi khuẩn hoang dã nhạy cảm mà còn tốt hơn là đối với vi khuẩn đột biến có thể tồn tại với số lượng ít trong các quần thể “nhạy cảm”. Do đó, để kéo dài tuổi thọ của các loại kháng sinh hiện có và mới, điều quan trọng là phải lựa chọn cẩn thận các phác đồ liều dùng dựa trên các đặc tính dược động học và dược lực học giúp ngăn ngừa sự xuất hiện của các đột biến đã tồn tại từ trước và mới hình thành. Như vậy, gọi là điều trị kháng sinh “kinh nghiệm” lại không phải là kinh nghiệm đơn thuần mà dựa trên sự phân tích đầy đủ về đặc tính kháng thuốc phổ biến của vi khuẩn gây bệnh tại chỗ và xây dựng các phác đồ điều trị phù hợp.
6 Tài liệu tham khảo
1. World Health Organization (WHO). Pneumonia. Available online: https://www.who.int/news-room/fact-sheets/detail/pneumonia (accessed on 26 September 2022).3
2. Lanks, C.W.; Musani, A.I.; Hsia, D.W. Community-Acquired Pneumonia and Hospital-Acquired Pneumonia. Med. Clin. N. Am. 2019, 103, 487-501.
3. Song, J.-H.; Thamlikitkul, V.; Hsueh, P.-R. Clinical and Economic Burden of Community-Acquired Pneumonia amongst Adults in the Asia-Pacific Region. Int. J. Antimicrob. Agents 2011, 38, 108-117.
4. Weiser, J.N.; Ferreira, D.M.; Paton, J.C. Streptococcus Pneumoniae: Transmission, Colonization and Invasion. Nat. Rev. Microbiol. 2018, 16, 355-367.
5. World Health Organization (WHO). Antimicrobial Resistance: Global Report on Surveillance 2014, Antimicrobial Resistance Global Surveillance Report;World Health Organization: Geneva, Switzerland, 2014.
6. Van Boeckel, T.P.; Gandra, S.; Ashok, A.; Caudron, Q.; Grenfell, B.T.; Levin, S.A.; Laxminarayan, R. Global Antibiotic Consumption 2000 to 2010: An Analysis of National Pharmaceutical Sales Data. Lancet Infect. Dis. 2014, 14, 742-750.
7. Jones, R.N.; Low, D.E.; Pfaller, M.A. Epidemiologic Trends in Nosocomial and Community-Acquired Infections Due to Antibiotic-Resistant Gram-Positive Bacteria: The Role of Streptogramins and Other Newer Compounds. Diagn. Microbiol. Infect. Dis. 1999, 33, 101-112.
8. Liñares, J.; Ardanuy, C.; Pallares, R.; Fenoll, A. Changes in Antimicrobial Resistance, Serotypes and Genotypes in Streptococcus Pneumoniae over a 30-Year Period. Clin. Microbiol. Infect. 2010, 16, 402-410.
9. Lynch, J.; Zhanel, G. Streptococcus Pneumoniae: Does Antimicrobial Resistance Matter? Semin. Respir. Crit. Care Med. 2009, 30, 210-238.
10. Cherazard, R.; Epstein, M.; Doan, T.-L.; Salim, T.; Bharti, S.; Smith, M.A. Antimicrobial Resistant Streptococcus Pneumoniae: Prevalence, Mechanisms, and Clinical Implications. Am. J. Ther. 2017, 24, e361-e369
11. Owens RC Jr, Shorr AF. Rational dosing of antimicrobial agents: pharmacokinetic and pharmacodynamics strategies. Am J Health Syst Pharm. 2009;66(12 Suppl 4):S23-30.
12. Cilloniz C, Ardanuy C, Vila J, Torres A. What is the clinical relevance of drug-resistant pneumococcus? Curr Opin Pulm Med. 2016;22(3):227-34.
13. Catia Cillóniz et al. Antimicrobial Resistance Among Streptococcus pneumoniae. In © Springer International Publishing AG, part of Springer Nature 2018 13 I. W. Fong et al. (eds.), Antimicrobial Resistance in the 21st Century, Emerging Infectious Diseases of the 21st Century.
14. Ruhe JJ, Hasbun R. Streptococcus pneumoniae bacteremia: duration of previous antibiotic use and association with penicillin resistance. Clin Infect Dis. 2003;36(9):1132-8.
15. Ruhe JJ, Myers L, Mushatt D, Hasbun R. High-level penicillin-nonsusceptible Streptococcus pneumoniae bacteremia: identification of a low-risk subgroup. Clin Infect Dis. 2004;38(4):508-14.
16. van de Sande-Bruinsma N, Grundmann H, Verloo D, et al. Antimicrobial drug use and resistance in Europe. Emerg Infect Dis. 2008;14(11):1722-30.
17. Lulla Opatowski et al. Antibiotic Dose Impact on Resistance Selection in the Community: a Mathematical Model of Beta-Lactams and Streptococcus pneumoniae Dynamics. Antimicrobial agents and chemotherapy, June 2010, p. 2330-2337 Vol. 54, No. 6
18. Garcia-Vidal C, Ardanuy C, Tubau F, et al. Pneumococcal pneumonia presenting with septic shock: host- and pathogen-related factors and outcomes. Thorax. 2010;65(1):77-81.
19. Mongardon N, Max A, Bougle A, et al. Epidemiology and outcome of severe pneumococcal pneumonia admitted to intensive care unit: a multicenter study. Crit Care. 2012;16(4):R155.
20. Stephanie J. Schrag et al. Antimicrobial agents and chemotherapy, Aug. 2004, p. 3016-3023. Emergence of Streptococcus pneumoniae with Very-High-Level Resistance to Penicillin
21. Kaplan SL, Mason EO Jr. Management of infections due to antibiotic-resistant Streptococcus pneumoniae. Clin Microbiol Rev. 1998;11(4):628-44
22. Beta-lactam antibiotics (In: Pandey N, Cascella M. Beta-Lactam Antibiotics. [Updated 2023 Jun 4]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK545311/)
23. Zango UU, Ibrahim M, Shawai SAA, et al. A review on beta-lactam antibiotic drug resistance. MOJ Drug Des Develop Ther. 2019;3(2):52‒58. DOI: 10.15406/mojddt.2019.03.00080
24. Hansman, D.; Bullen, M.M. A Resistant Pneumococcus. Lancet 1967, 2, 264-265
25. NV Thành. Vi khuẩn gây bệnh và kháng thuốc. Trong: Viêm phổi (NV Thành chủ biên) Y học 2023, tr. 115-151.
26. Pneumococcal antimicrobial resistance: therapeutic strategy and management in community-acquired pneumonia. Javier Aspa 1, Olga Rajas, Felipe Rodríguez de Castro. DOI: 10.1517/14656566.9.2.229
27. Kim A, Sutherland CA, Kuti JL, Nicolau DP. Optimal dosing of piperacillin-tazobactam for the treatment of Pseudomonas aeruginosa infections: prolonged or continuous infusion? Pharmacotherapy 2007;27:1490-7.
28. Lodise TP Jr, Lomaestro BM, Drusano GL. Piperacillintazobactam for Pseudomonas aeruginosa infection: clinical implications of an extended-infusion dosing strategy. Clin Infect Dis 2007;44:357-63.
29. J D Heffelfinger et al. Management of community-acquired pneumonia in the era of pneumococcal resistance: a report from the Drug-Resistant Streptococcus pneumoniae Therapeutic Working Arch Intern Med. 2000 May 22;160(10):1399-408. doi: 10.1001/archinte.160.10.1399.

