Điều trị chống huyết khối sau hội chứng mạch vành cấp tính hoặc can thiệp mạch vành qua da ở dân số Đông Á - Nghiên cứu đăng trên JACC: Asia
Trungtamthuoc.com - Tháng 2 năm 2022, một nghiên cứu tại Hàn Quốc đăng tải lên tạp chí JACC: Asia đã bàn luận về những vấn đề cốt lõi khi điều trị chống huyết khối trên người bệnh mắc hội chứng mạch vành cấp tính (ACS) hoặc có can thiệp mạch vành qua da (PCI) thông qua phân tích các thử nghiệm RCT thực hiện trên dân số Đông Á
Antithrombotic Therapy After Acute Coronary Syndromes or Percutaneous Coronary Interventions in East Asian Populations
Tạp chí Journal of the American College of Cardiology (JACC)
Tác giả Osung Kwon và Duk-Woo Park
Xem bản gốc: Tại đây
1 Tóm tắt
Điều trị chống huyết khối bằng thuốc chống kết tập tiểu cầu và thuốc chống đông đóng vai trò quan trọng đối với bệnh nhân mắc hội chứng vành cấp (ACS) hoặc sau can thiệp mạch vành qua da (PCI). Thực tế hiện nay, các hướng dẫn và khuyến nghị về sử dụng thuốc chống huyết khối từ các hiệp hội tim mạch trên thế giới liên tục có sự thay đổi hoặc cập nhật. Điều này làm cho việc áp dụng khuyến cáo vào thực hành lâm sàng hàng ngày trở nên phức tạp hơn.
Bên cạnh đó, đối với dân số châu Á nói chung và Đông Á nói riêng, tỷ lệ người tình nguyện đăng ký tham gia các thử nghiệm lâm sàng ngẫu nhiên (RCT) là thấp, điều này làm hạn chế việc áp dụng trực tiếp các kết quả của thử nghiệm vào thực hành lâm sàng ở các nước này.
Ngoài ra, so với bệnh nhân da trắng, bệnh nhân Đông Á được đánh giá là có nguy cơ thiếu máu cục bộ/xuất huyết khác nhau khi đáp ứng với liệu pháp chống huyết khối, được gọi là “nghịch lý Đông Á”. Có nghĩa là khi sử dụng các liệu pháp chống huyết khối, người bệnh Đông Á có tỷ lệ biến chứng xuất huyết cao hơn, trong khi đó tỷ lệ huyết khối tương tự hoặc thậm chí thấp hơn so với người bệnh da trắng.
Các yếu tố như tính đa hình về kiểu gen, ảnh hưởng của môi trường, các yếu tố nguy cơ tim mạch, bệnh kèm là những nguyên nhân khiến cho dân số Đông Á đặc trưng bởi khả năng hình thành huyết khối nội tại thấp và nguy cơ xuất huyết cao, do đó cần có cửa sổ ức chế kết tập tiểu cầu khác với các chủng tộc khác khi sử dụng thuốc chống kết tập tiểu cầu.
Mục đích của nghiên cứu này là cung cấp một bản tóm tắt toàn diện về các thử nghiệm lâm sàng RCT quan trọng liên quan đến chủ đề này và đề xuất các hướng và quan điểm trong tương lai về việc tối ưu hóa các liệu pháp chống huyết khối cho bệnh nhân Đông Á.
Thông qua phân tích các thử nghiệm RCT thực hiện trên dân số Đông Á, các tác giả bàn luận về những vấn đề cốt lõi khi điều trị chống huyết khối trên người bệnh mắc hội chứng mạch vành cấp (ACS) hoặc có can thiệp mạch vành qua da (PCI) bao gồm: rút ngắn thời gian sử dụng DAPT, lựa chọn thuốc ức chế P2Y12, giảm liều Ticagrelor và Prasugrel, tối ưu lựa chọn và thời gian phối hợp thuốc kháng kết tập tiểu cầu trên người bệnh có nguy cơ xuất huyết cao phải sử dụng thuốc chống đông suốt đời và giới thiệu một số thang điểm đánh giá nguy cơ xuất huyết/huyết khối được phát triển cho dân số châu Á. Đồng thời, các tác giả đề xuất một số chiến lược cá nhân hóa điều trị cũng như gợi ý về hướng nghiên cứu tiếp cận lựa chọn kháng kết tập tiểu cầu dựa trên kiểu gen. Cuối cùng, đưa ra khuyến nghị chiến lược điều trị chống huyết khối cho bệnh nhân Đông Á.
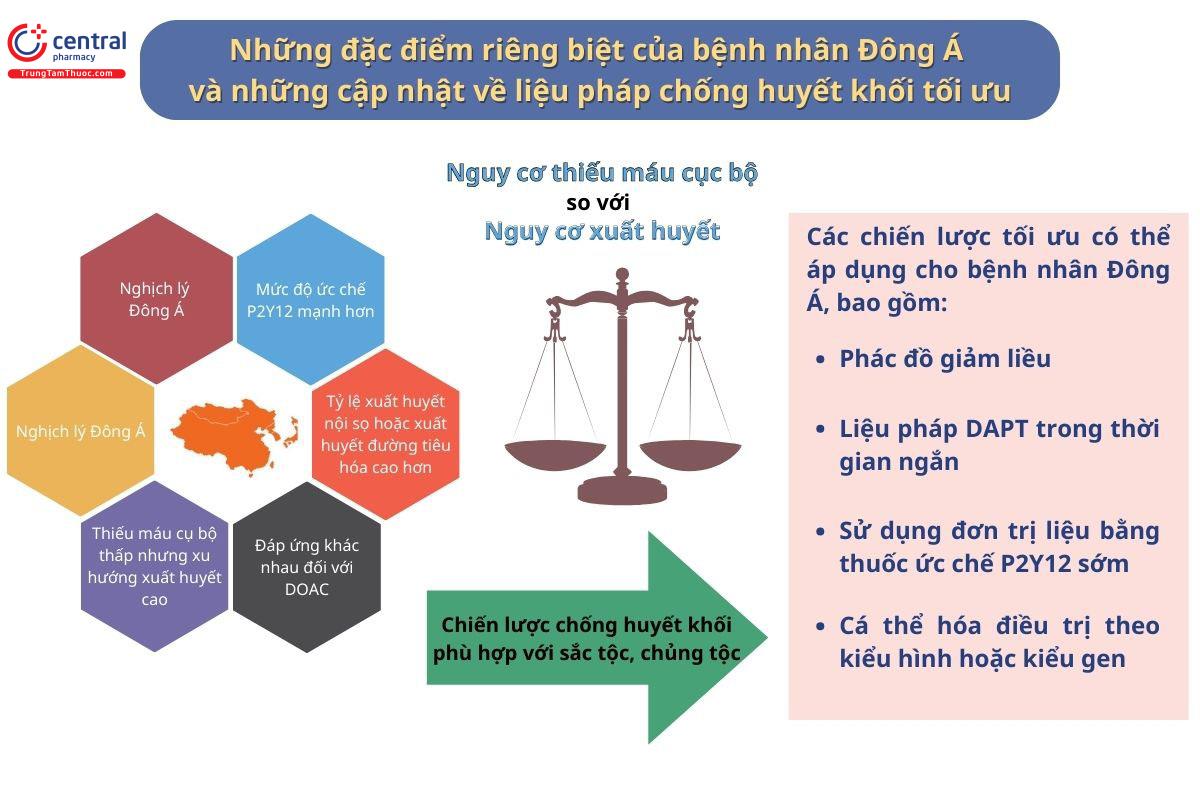
Do xu hướng thiếu máu cục bộ và xuất huyết đặc trưng của bệnh nhân Đông Á, cái gọi là nghịch lý Đông Á, các chiến lược chống huyết khối phù hợp với từng dân tộc được đặc biệt quan tâm. DAPT = liệu pháp kháng tiểu cầu kép; DOAC = thuốc chống đông đường uống trực tiếp.
2 Chữ viết tắt và từ viết tắt
ACS Hội chứng mạch vành cấp
BARC Hiệp hội nghiên cứu học thuật xuất huyết
CAD Bệnh động mạch vành
DAPT Liệu pháp chống kết tập tiểu cầu kép
DES Stent phủ thuốc
HBR Nguy cơ xuất huyết cao
MI Nhồi máu cơ tim
DOAC Thuốc chống đông máu đường uống trực tiếp
OAC Thuốc chống đông đường uống
PCI Can thiệp mạch vành qua da
PRU Đơn vị phản ứng P2Y12
RCT Thử nghiệm lâm sàng ngẫu nhiên có đối chứng
3 Điểm nổi bật của nghiên cứu
Các chiến lược chống huyết khối tối ưu là nền tảng trong điều trị hội chứng mạch vành cấp tính (ACS) hoặc can thiệp mạch vành qua da (PCI) và không ngừng phát triển để cân bằng giữa lợi ích và nguy cơ thiếu máu cục bộ và chảy máu.
Lợi ích của việc sử dụng thuốc điều trị chống huyết khối ở bệnh nhân Đông Á được đánh giá là thấp hơn so với người da trắng trong ngăn chặn thiếu máu cục bộ và đồng thời họ cũng là đối tượng có nguy cơ gặp biến cố xuất huyết cao hơn.
Không thể áp dùng cùng một phương pháp điều trị cho tất cả người bệnh tại Đông Á mắc hội chứng mạch vành cấp (ASC) hay có can thiệp mạch vành qua da (PCI). Thay vào đó, cần phải đánh giá cẩn thận nguy cơ huyết khối và nguy cơ xuất huyết thông qua chiến lược linh hoạt, phù hợp, cũng như kế hoạch điều trị dựa trên nguy cơ của từng cá nhân.
Các nghiên cứu lâm sàng hiện nay tích cực đã đánh giá các chiến lược điều trị hoặc yếu tố liên quan nhằm cải thiện sự cân bằng giữa lợi ích và rủi ro trong các liệu pháp chống huyết khối hiện tại.
Những nghiên cứu lâm sàng hiện nay được thực hiện để đánh giá các chiến lược đa dạng hoặc các liệu pháp mới có thể cải thiện sự cân bằng giữa lợi ích và nguy cơ trong các chiến lược chống kết tập tiểu cầu Điều này cho phép tìm ra các phương pháp mới hoặc các chất mới có thể mang lại lợi ích tốt hơn và giảm thiểu rủi ro trong việc điều trị các vấn đề liên quan đến kháng tiểu cầu.
4 Tổng quan
Thuốc chống huyết khối, bao gồm thuốc ức chế kết tập tiểu cầu và thuốc chống đông máu, đây là nhóm thuốc được kê đơn phổ biến nhất trên toàn thế giới để ngăn ngừa và điều trị nhiều chứng loại rối loạn tim mạch, bao gồm cả bệnh động mạch vành (CAD).
Trong các thập kỷ qua, nhiều thử nghiệm lâm sàng ngẫu nhiên có đối chứng (RCT) đã được thực hiện để đánh giá hiệu quả và độ an toàn của thuốc chống huyết khối và đánh giá các liệu pháp điều trị khác nhau ở bệnh nhân mắc Hội chứng mạch vành cấp tính (ACS) hoặc những người đã được Can thiệp mạch vành qua da (PCI) [1]. Do các hướng dẫn lâm sàng thay đổi nhanh chóng và nhiều khuyến nghị được đưa ra sau mỗi thử nghiệm RCT về các liệu pháp hoặc chiến lược điều trị mới nên việc quản lý các thuốc chống huyết khối cho bệnh nhân sau ACS hoặc PCI ngày càng trở nên phức tạp [2].
Đông Á nằm ở khu vực phía đông của châu Á, bao gồm các nước phát triển như Trung Quốc, Nhật Bản, Hàn Quốc và các nước đang phát triển như Mông Cổ, Triều Tiên, và Đài Loan [3]. Tính đến năm 2022, dân số Đông Á có khoảng 1,7 tỷ người, chiếm khoảng 20,5% dân số toàn cầu.
Một thực tế là ngày càng có nhiều bằng chứng cho thấy người Đông Á có đặc điểm về lợi ích - nguy cơ đối với liệu pháp chống huyết khối rất khác so với người dân phương Tây, hay được biết đến với tên gọi “nghịch lý Đông Á” [4].
Liên quan đến liệu pháp chống kết tập tiểu cầu kép (DAPT) của Aspirin và Clopidogrel, một phân tích tổng hợp trên bệnh nhân cho thấy sự cân bằng giữa thiếu máu cục bộ/xuất huyết có thể khác nhau giữa bệnh nhân Đông Á và bệnh nhân không phải người Đông Á. Ngoài ra, các thuốc ức chế P2Y12 mạnh bao gồm Prasugrel và Ticagrelor đã được chứng minh là có khoảng điều trị tối ưu và có đặc điểm an toàn hoặc hiệu quả khác nhau ở bệnh nhân Đông Á [6-8]. Ở đây các tác giả xem xét, đánh giá thêm những khác biệt liên quan đến chủng tộc trong quản lý chống huyết khối ở bệnh nhân Đông Á mắc ACS hoặc trải qua PCI, chủ yếu dựa trên các kết quả thử nghiệm RCT và thảo luận về những vấn đề vẫn chưa được giải đáp để thiết lập chiến lược chống huyết khối phù hợp cho bệnh nhân Đông Á.
5 Nguy cơ xuất huyết và thiếu máu cục bộ ở dân số Đông Á
5.1 Xu hướng xuất huyết và thiếu máu cục bộ của dân số Đông Á so với các khu vực khác
Dữ liệu tích lũy từ trước đến nay đã chỉ ra rằng có sự khác biệt đáng kể giữa các chủng tộc hoặc dân tộc về khả năng tạo huyết khối, sự ức chế kết tập tiểu cầu bởi thuốc ức chế P2Y12, xu hướng xuất huyết và các biến chứng thiếu máu cục bộ [9].
Thông thường, trong đáp ứng với các liệu pháp chống đông máu hoặc chống kết tập tiểu cầu, người Đông Á được xác định là có nhiều khả năng gặp biến chứng xuất huyết hơn nhưng ít khả năng gặp biến chứng huyết khối tắc mạch [10,11]. Do đó, một câu hỏi đặt ra là liệu có sự khác biệt về hiệu quả lâm sàng và độ an toàn của liệu pháp chống huyết khối sau ACS hoặc PCI giữa bệnh nhân Đông Á và các nhóm dân tộc khác hay không.
Nhiều thử nghiệm RCT đã được tiến hành để trả lời câu hỏi trên. Một phân tích thứ cấp của thử nghiệm CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance - Clopidogrel cho nguy cơ huyết khối cao và ổn định, quản lý và tránh thiếu máu cục bộ) với bệnh nhân dùng Aspirin và Clopidogrel ở nhiều khu vực địa lý đã cho thấy dân số châu Á có tỷ lệ tử vong do bệnh tim mạch thấp nhất nhưng tỷ lệ xuất huyết cao hơn so với các nhóm dân tộc khác [12].
Một nghiên cứu trước đây của Cơ sở dữ liệu đăng ký dữ liệu tim mạch quốc gia (National Cardiovascular Data Registry - NCDR) ở Hoa Kỳ bao gồm 423.965 trường hợp bệnh nhân cũng cho thấy bệnh nhân gốc Á có đáp ứng lâm sàng tốt hơn với liệu pháp chống huyết khối sau can thiệp PCI, bao gồm tỷ lệ tử vong và nhồi máu cơ tim (MI) thấp hơn so với bệnh nhân da đen hoặc bệnh nhân gốc Tây Ban Nha [13].
Trong kỷ nguyên can thiệp PCI bằng stent phủ thuốc thế hệ đầu tiên (DES), tỷ lệ huyết khối trong stent thấp hơn (∼0,4% mỗi năm) đã được ghi nhận trong nghiên cứu thuần tập ở Đông Á so với các phương Tây (∼1,0% mỗi năm) [14, 15, 16]. Một phân tích tổng hợp gần đây tập hợp 7 thử nghiệm RCT bao gồm tổng số 16.518 bệnh nhân đã cho thấy xu hướng xuất huyết hoặc thiếu máu cục bộ có sự khác biệt ở dân số Đông Á so với bệnh nhân không thuộc Đông Á [5]. Bệnh nhân Đông Á có tỷ lệ nguy cơ xuất huyết cao hơn thiếu máu cục bộ (0,66 so với 0,15) và tỷ lệ bệnh nhân có xác suất xuất huyết cao hơn thiếu máu cục bộ cũng cao hơn đáng kể ở bệnh nhân Đông Á (32,3% so với 0,4%, P < 0,001). Nói chung, bằng chứng này chỉ ra rằng nguy cơ gặp biến cố thiếu máu cục bộ với nguy cơ xuất huyết trong liệu pháp chống kết tập tiểu cầu có sự khác biệt đáng kể giữa bệnh nhân Đông Á và bệnh nhân không thuộc Đông Á sau can thiệp mạch vành qua da (PCI).
5.2 Nghịch lý Đông Á
Kể từ 2 thử nghiệm mang tính bước ngoặt, cụ thể thử nghiệm CURE - Clopidogrel trong cơn đau thắt ngực không ổn định để ngăn ngừa biến cố thiếu máu cục bộ tái phát và thử nghiệm PCI-CURE về Clopidogrel vào đầu năm 2000, Clopidogrel đã trở thành một chất ức chế thụ thể P2Y12 thiết yếu như một phần của Liệu pháp kháng kết tập tiểu cầu kép (DAPT) sau hội chứng mạch vàng (ACS) hoặc can thiệp mạch vành qua da (PCI) [17,18].
Clopidogrel là một tiền chất thienopyridine và việc chuyển đổi nó thành có hoạt tính (R-130964) cần trải qua 2 bước oxi hoá bởi hệ thống cytochrome P450 tại gan [19]. Do quá trình chuyển hóa tiền thuốc có thể khác nhau giữa các cá nhân, chủ yếu liên quan đến đa hình CYP2C19, nên đã có báo cáo về sự khác biệt đáng kể giữa từng cá thể và sự khác biệt giữa các chủng tộc trong phản ứng với Clopidogrel [19, 20]. Đặc biệt, người ta nhận thấy ở bệnh nhân Đông Á có đáp ứng với Clopidogrel kém hơn so với bệnh nhân da trắng, nguyên nhân chủ yếu là do tần suất xuất hiện các alen CYP2C19 mất chức năng cao hơn ở bệnh nhân Đông Á (∼65% so với ∼30%) [19, 21].
Với những lo ngại về mặt lý thuyết như vậy, một số nghiên cứu dược lực học đã chỉ ra rằng phản ứng ức chế kết tập tiểu cầu trong điều trị sau khi dùng Clopidogrel cao hơn đáng kể ở bệnh nhân Đông Á so với bệnh nhân phương Tây (40%-63,5% so với 20%-35%) [22, 23]. Tuy nhiên, trái ngược với giả thiết dự đoán (tức là người Đông Á có đáp ứng lâm sàng kém hơn với clopidogrel), đã có nhiều báo cáo cho thấy bệnh nhân Đông Á có tỷ lệ biến chứng xuất huyết cao hơn trong khi đó tỷ lệ biến cố thiếu máu cục bộ tương tự hoặc thậm chí thấp hơn so với người da trắng [26, 27]. Hiện tượng này hiện nay thường được gọi là “nghịch lý Đông Á”, liên quan đến sự tách rời các biến cố lâm sàng với mức độ phản ứng tiểu cầu để đáp ứng với liệu pháp chống huyết khối ở bệnh nhân Đông Á (Hình 1) [21, 26].

Các bệnh nhân Đông Á có nguy cơ chảy máu cao và thiếu máu cục bộ thấp (bên trái), và các cơ chế hợp lý của nghịch lý Đông Á được đề xuất (bên phải). CV = tim mạch; CYP = cytochrome P450; GI = đường tiêu hóa; MI = nhồi máu cơ tim.
Cơ chế phức tạp và đa yếu tố có thể là nguyên nhân gây ra hiện tượng “nghịch lý Đông Á” trong phản ứng với liệu pháp chống huyết khối. Mặc dù có sự khác biệt trong một số đặc điểm về chủng tộc như chỉ số khối cơ thể thấp hơn, các yếu tố nguy cơ tim mạch, bệnh đi kèm, mô hình bệnh xơ vữa động mạch và đặc điểm khu vực/môi trường sống có thể ảnh hưởng đến kết quả lâm sàng, nhưng những yếu tố này không thể hoàn toàn giải thích được sự khác biệt về chủng tộc trong phản ứng với liệu pháp chống huyết khối. Một giả thiết đã được đưa ra để giải thích một cách cơ bản cho hiện tượng này là sự khác biệt giữa các sắc tộc về "khả năng tạo huyết khối nội tại", tức khả năng tạo ra cục máu đông trong cơ thể [28].
Nhiều dữ liệu thực nghiệm và lâm sàng đã chỉ ra sự khác biệt giữa các chủng tộc về quá trình đông máu bao gồm 2 yếu tố: fibrinolysis (làm tiêu sợi fibrin - làm tan huyết khối) và phản ứng viêm, đây là những yếu tố chính quyết định khả năng tạo huyết khối [28]. Có thể hiếu là bệnh nhân Đông Á được xác định là có khả năng sinh huyết khối nội tại thấp hơn so với các nhóm dân số khác [29]. Sự khác biệt đáng chú ý về đa hình về kiểu gen (ví dụ, đột biến gen yếu tố V Leiden [G1691A] và prothrombin [G20210A]), các yếu tố đông máu (ví dụ, fibrinogen, D-dimer và yếu tố VIII), và các dấu hiệu kích hoạt nội mô (ví dụ, von Willebrand yếu tố, phân tử bám dính giữa các tế bào 1 và E-selectin) có thể góp phần một phần vào sự chênh lệch này [29, 30]. Từ góc độ lâm sàng, bệnh nhân Đông Á cũng được biết là dễ bị xuất huyết tiêu hóa và xuất huyết nội sọ hơn so với người da trắng [31].
Tóm lại, tính đa hình về kiểu gen, ảnh hưởng của môi trường, các yếu tố nguy cơ tim mạch truyền thống, bệnh kèm là những nguyên nhân tạo ra đặc trưng cho dân số Đông Á về khả năng hình thành huyết khối nội tại thấp và nguy cơ xuất huyết cao. Do đó, khi sử dụng thuốc chống kết tập tiểu cầu, cần có cách tiếp cận và điều trị khác đối với dân số Đông Á so với các chủng tộc khác.
6 Thời gian sử dụng Liệu pháp ức chế kết tập tiểu cầu kép (DAPT)
Sau khi Stent phủ thuốc (DES) được giới thiệu vào đầu năm 2000. Sau khi đưa vào sử dụng, Stent phủ thuốc thế hệ thứ nhất ( bao gồm: Taxus (phủ thuốc Paclitaxel) và Cypher (phủ thuốc Sirolimus)) dường như làm tăng nguy cơ tử vong do bệnh tim hoặc nhồi máu cơ tim cho bệnh nhân. Nguyên nhân chủ yếu là do tăng nguy cơ hình thành huyết khối muộn và rất muộn trong stent phủ thuốc (DES) so với stent kim loại trần [32, 33]. Và người ta thấy rằng phần lớn các biến cố huyết khối muộn này xảy ra sau khi ngừng điều trị bằng liệu pháp ức chế kết tập tiểu cầu kép DAPT [34].
Để giảm nguy cơ xảy ra các tác dụng phụ muộn này và phát triển các phác đồ DAPT tối ưu hơn, nhiều thử nghiệm RCT đã được tiến hành trên toàn thế giới [35]. Một số thử nghiệm như vậy cũng đã được tiến hành ở người dân Đông Á và được tóm tắt trong Bảng 1 và Hình 2 [36 - 45]. Trong đó, nghiên cứu REAL-LATE / ZEST-LATE (Mối tương quan giữa việc ngừng điều trị bằng Clopidogrel ở bệnh nhân thực tế được điều trị bằng đặt stent phủ thuốc và biến cố huyết khối động mạch vành muộn / Đánh giá tính an toàn lâu dài sau đặt stent phủ thuốc Zotarolimus, Sirolimus- Thử nghiệm Stent phủ thuốc hoặc Cấy stent phủ thuốc Paclitaxel cho các tổn thương mạch vành - Biến cố huyết khối động mạch vành muộn) là thử nghiệm RCT đầu tiên đánh giá thời gian sử dụng tối ưu của liệu pháp DAPT sau khi đặt stent phủ thuốc DES. Kết quả thử nghiệm cho thấy việc sử dụng liệu pháp DAPT kéo dài hơn 12 tháng là không cần thiết vì nó không cho thấy hiệu quả hơn đáng kể so với phương pháp đơn trị liệu bằng Aspirin trong việc giảm nguy cơ nhồi máu cơ tim hoặc tử vong do nguyên nhân tim mạch [36]. Các thử nghiệm RCT sau đó ở dân số Đông Á được điều trị bằng stent phủ thuốc thế hệ đầu tiên cho thấy kết quả tương tự [37, 38, 39].
Bảng 1 Các thử nghiệm RCT ở bệnh nhân Đông Á để đánh giá thời gian và chiến lược sử dụng liệu pháp DAPT
| Tên Thử nghiệm, năm và nơi tiến hành | Cỡ mẫu (số người tham gia thử nghiệm) | Thiết kế nghiên cứu | Tiêu chí theo dõi và đánh giá | Kết quả |
|---|---|---|---|---|
REAL-LATE/ZEST-LATE, 2010, Hàn Quốc | 2.701 bệnh nhân được điều trị bằng DES và không còn MACCE và xuất huyết nặng trong ít nhất 12 tháng | Nghiên cứu được thiết kế mở (người nghiên cứu và người tham gia nghiên cứu đều được biết họ đang cung cấp và nhận loại điều trị gì Thử nghiệm ngẫu nhiên 1 : 1 (người tham gia được phân ngẫu nhiên vào một trong hai nhóm điều trị. tỷ lệ phân chia là 1:1) So sánh nhóm sử dụng liệu pháp DATP (Clopidogrel + aspirin) so với nhóm đơn trị liệu bằng aspirin | Tiêu chí lâm sàng chính: tỷ lệ xuất hiện nhồi máu cơ tim hoặc tử vong do nguyên nhân tim mạch sau 2 năm Tiêu chí xuất huyết: xuất huyết nặng TIMI sau 2 năm | Liệu pháp kết hợp Clopidogrel + Aspirin so vs aspirin đơn thuần Tiêu chí lâm sàng về tính hiệu quả lần lượt là 1,8% vs 1,2% (HR: 1.65, KTC 95%, 0,80 đến 3,36) Tiêu chí xuất huyết: 0,2% so với 0,1% (HR: 2,96; KTC 95% CI, 0,31 đến 28,46) |
RESET, 2012, Hàn Quốc | 2,117 bệnh nhân điều trị bằng Stent phủ thuốc DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng liệu pháp DAPT 3 tháng so với nhóm sử dụng DAPT 12 tháng bằng aspirin + clopidogrel
| Tiêu chí chính: tử vong do bệnh tim mạch, nhồi máu cơ tim, huyết khối trong stent, tái can thiệp lại động mạch đích hoặc xuất huyết TIMI sau 1 năm Tiêu chí xuất huyết: xuất huyết theo tiêu chuẩn TIMI (nặng hoặc nhẹ) sau 1 năm | DAPT 3 tháng so với DAPT 12 tháng Tiêu chí chính: 4,7% so với 4,7% (chênh lệch, 0,0%; KTC 95%: –2,5 đến 2,5) Tiêu chí xuất huyết: 0,5% so với 1,0% (chênh lệch, –0,5%; 95% CI: –1,2 đến 0,2) |
EXCELLENT, 2012, Hàn Quốc | 1.443 bệnh nhân điều trị bằng Stent phủ thuốc DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng liệu pháp DAPT 6 tháng so với nhóm sử dụng DAPT 12 tháng bằng aspirin và clopidogrel | Tiêu chí chính: sự kết hợp gồm tử vong do biến cố tim mạch, nhồi máu cơ tim hoặc tái can thiệp lại động mạch đích sau 1 năm Tiêu chí xuất huyết: xuất huyết nghiêm trọng theo tiêu chuẩn TIMI sau 1 năm | DAPT 6 tháng so với DAPT 12 tháng Tiêu chí chính: 4,8% so với 4,3% (HR: 1,14; KTC 95%: 0,70 đến 1,86) Tiêu chí xuất huyết: 0,3% so với 0,6% (HR: 0,50; KTC 95%: 0,09 đến 2,73 ) |
DES-LATE, 2014, Hàn Quốc | 5,045 bệnh nhân được điều trị bằng DES và không còn MACCE và xuất huyết nặng trong ít nhất 12 tháng | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm dùng aspirin đơn thuần so với liệu pháp kết hợp clopidogrel + aspirin | Tiêu chí chính: sự kết hợp gồm tử vong do biến cố tim mạch, nhồi máu cơ tim, tai biến đột quỵ sau 2 năm Tiêu chí xuất huyết: xuất huyết nghiêm trọng theo tiêu chuẩn TIMI sau 2 năm | Aspirin đơn trị liệu so với clopidogrel + aspirin Tiêu chí chính: 2,4% so với 2,6% (HR: 0,94; KTC 95%: 0,66 đến 1,35) Tiêu chí xuất huyết: 1,1% so với 1,4% (HR: 0,71; KTC 95%: 0,42 đến 1,20) |
I-LOVE-IT 2, 2016, Trung Quốc | 1.829 bệnh nhân được điều trị bằng nhiều Stent phủ thuốc DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng liệu pháp DAPT 6 tháng so với DAPT 12 tháng với aspirin và clopidogrel | Tiêu chí chính: sự kết hợp gồm tử vong do biến cố tim mạch, nhồi máu cơ tim mục tiêu hoặc tái can thiệp mạch đích sau 1 năm Tiêu chí xuất huyết: xuất huyết theo tiêu chuẩn BARC loại 3-5 sau 1 năm | Liệu pháp DAPT 6 tháng so với DAPT 12 tháng Tiêu chí chính: 9,3% so với 7,5% (P = 0,33) Tiêu chí xuất huyết: 0,7% so với 0,4% (P = 0,57) |
IVUS-XPL, 2016, Hàn Quốc | 1.400 bệnh nhân được điều trị bằng Stent phủ thuốc DES | Nghiên cứu thiết kê mô hình 2x2: hai yếu tố độc lập được đánh giá đồng thời. Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng liệu pháp DAPT 6 tháng so với DAPT 12 tháng với aspirin và clopidogrel | Tiêu chí chính: sự kết hợp gồm tử vong do biến cố tim mạch, đột quỵ, xuất huyết nặng TIMI sau 1 năm Tiêu chí xuất huyết: xuất huyết nặng TIMI sau 1 năm | Liệu pháp DAPT 6 tháng so với DAPT 12 tháng Tiêu chí chính: 2,2% so với 2,1% (HR: 1,07; KTC 95%: 0,52 đến 2,22) Tiêu chí xuất huyết: 0,7% so với 1,0% (HR: 0,71; KTC 95%: 0,23 đến 2,25 ) |
NIPPON, 2017, Nhật Bản | 3.773 bệnh nhân ACS được điều trị bằng DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng liệu pháp DAPT 6 tháng so với nhóm sử dụng DAPT 18 tháng | Các biến cố bất lợi trên lâm sàng: sự kết hợp gồm tử vong do bất kỳ nghiên nhân nào, nhồi máu cơ tim, tai biến đột quỵ và xuất huyết nghiêm trọng trong khoảng thời gian từ 6 đến 18 tháng sau khi đặt Stent Tiêu chí xuất huyết: xuất huyết nghiêm trọng (a) trong khoảng thời gian từ 6 đến 18 tháng sau khi đặt Stent | Liệu pháp DAPT 18 tháng so với DAPT 6 tháng Các biến cố bất lợi trên lâm sàng: 1,5% so với 2,1% (chênh lệch –0,6; KTC 95%: –1,5 đến 0,3) Tiêu chí xuất huyết: 0,7% so với 0,7% (chênh lệch, 0,1; 95% CI: –0,6 đến 0,7) |
SMART-DATE, 2018, Hàn Quốc | 2.712 bệnh nhân ACS được điều trị bằng Stent phủ thuốc DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng liệu pháp DAPT 6 tháng so với nhóm sử dụng DAPT 12 tháng | Tiêu chí chính: sự kết hợp gồm tử vong do mọi nguyên nhân, nhồi máu cơ tim hoặc đột quỵ sau 18 tháng Tiêu chí xuất huyết: xuất huyết BARC loại 2-5 sau 18 tháng | Liệu pháp DAPT 6 tháng so với DAPT 12 tháng Tiêu chí chính: 4,7% so với 4,2% (HR: 1,13; KTC 95%: 0,79 đến 1,62) Tiêu chí xuất huyết: 2,7% so với 3,9% (HR: 0,69; KTC 95%: 0,45 đến 1,05 ) |
SMART-CHOICE, 2019, Hàn Quốc | 2.993 bệnh nhân được điều trị bằng Stent phủ thuốc DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 Nhóm điều trị bằng liệu pháp DAPT 3 tháng, sau đó là đơn trị liệu bằng thuốc ức chế P2Y12 so với nhóm điều trị bằng liệu pháp DAPT trong 12 tháng | Tiêu chí chính: sự kết hợp gồm tử vong do mọi nguyên nhân, nhồi máu cơ tim hoặc đột quỵ ở thời điểm 1 năm Tiêu chí xuất huyết: xuất huyết BARC loại 2-5 sau 1 năm | Kết quả nhóm điều trị bằng liệu pháp DAPT 3 tháng, sau đó là đơn trị liệu bằng thuốc ức chế P2Y12 so với nhóm điều trị bằng liệu pháp DAPT trong 12 tháng Tiêu chí chính: 2,9% so với 2,5% (HR: 1,19; KTC 95%, 0,76 đến 1,85) Tiêu chí xuất huyết: 2,0% so với 3,4% (HR: 0,58; KTV: 95 %; 0,36 đến 0,92 |
STOP-DAPT-2, 2019, Nhật Bản | 3.045 bệnh nhân được điều trị bằng Stent phủ thuốc DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm điều trị bằng liệu pháp DAPT sau 1 tháng, sau đó là đơn trị liệu bằng clopidogrel so với nhóm điều trị bằng liệu pháp DAPT trong 12 tháng với aspirin và clopidogrel | Tiêu chí chính: sự kết hợp của tử vong do biến cố tim mạch, nhồi máu cơ tim, đột quỵ, huyết khối trong stent xác định hoặc xuất huyết TIMI nặng hoặc nhẹ sau 1 năm Tiêu chí xuất huyết: xuất huyết nặng hoặc nhẹ theo TIMI sau 1 năm | Kết quả của nhóm điều trị bằng liệu pháp DAPT sau 1 tháng, sau đó là đơn trị liệu bằng clopidogrel so với nhóm điều trị bằng liệu pháp DAPT trong 12 tháng với aspirin và clopidogrel Tiêu chí chính: 2,4% so với 3,7% (HR: 0,64; KTC 95%: 0,42 đến 0,98) Tiêu chí xuất huyết: 0,4% so với 1,5% (HR: 0,20; KTC 95%: 0,11 đến 0,64) |
HOST-EXAM, 2021, Hàn Quốc | 5.438 bệnh nhân được điều trị bằng liệu pháp DAPT không có biến chứng lâm sàng trong 6-18 tháng sau khi đặt Stent phủ thuốc DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm dùng đơn trị liệu bằng Clopidogrel so với nhóm sử dụng đơn trị liệu bằng aspirin | Tiêu chí chính: sự kết hợp gồm tử vong do bất cứ nguyên nhân nào, nhồi máu cơ tim không tử vong, đột quỵ, tái nhập viện do ACS và xuất huyết BARC loại 3-5 sau 2 năm Tiêu chí xuất huyết: xuất huyết BARC loại 3-5 sau 2 năm | Kết quả nhóm dùng đơn trị liệu bằng Clopidogrel so với nhóm sử dụng đơn trị liệu bằng aspirin Tiêu chí chính: 5,7% so với 7,7% (HR: 0,73; KTC 95%: 0,59 đến 0,90) Xuất huyết BARC loại 3-5: 1,2% so với 2,0% (HR: 0,63; KTC 95%: 0,41 đến 0,97) |
STOP-DAPT-2 ACS, 2021, Nhật Bản | 4.169 bệnh nhân ACS được điều trị bằng Stent phủ thuốc DES | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng liệu pháp DAPT tỏng 1 tháng, sau đó là đơn trị liệu bằng clopidogrel so với nhóm điều trị bằng liệu pháp DAPT 12 tháng với aspirin và clopidogrel | Tiêu chí chính: sự kết hợp gồm tử vong do biến cố tim mạch, nhồi máu cơ tim, đột quỵ, huyết khối trong stent xác định hoặc xuất huyết TIMI nặng hoặc nhẹ sau 1 năm Tiêu chí xuất huyết: xuất huyết nặng hoặc nhẹ theo TIMI sau 1 năm | Kết quả của nhóm dùng liệu pháp DAPT trong 1 tháng sau đó là đơn trị liệu clopidogrel so với nhóm dùng liệu pháp DAPT 12 tháng với aspirin và clopidogrel Tiêu chí chính: 3,2% so với 2,8% (HR: 1,14, KTC 95%: 0,80 đến 1,62, P đối với không thua kém = 0,06) Tiêu chí xuất huyết: 0,5% so với 1,2% (HR: 0,46; KTC 95%: 0,23 đến 0,94) Tỷ lệ tử vong do mọi nguyên nhân: 1,4% so với 0,9% Tỷ lệ nhồi máu cơ tim: 1,6% so với 0,9% (HR: 1,91; KTC 95%: 1,06 đến 3,44) |
Chú thích: ACS: hội chứng mạch vành cấp tính; BARC: Hiệp hội nghiên cứu học thuật về xuất huyết; DAPT: liệu pháp chống kết tập tiểu cầu kép; DES: stent phủ thuốc; DES-LATE: Khoảng thời gian tối ưu của liệu pháp Clopidogrel với DES để giảm biến cố huyết khối động mạch vành muộn; EXCELLENT: Hiệu quả của Xience/Promus so với Cypher trong việc giảm biến cố muộn sau khi đặt stent; HOST-EXAM: Phối chiến lược tối ưu để điều trị hẹp động mạch vành - Đơn trị liệu kháng tiểu cầu kéo dài; HOST-REDUCE-POLYTECH-ACS: So sánh về việc giảm liều Prasugrel hoặc công nghệ Polyer ở bệnh nhân ACS; I-LOVE-IT 2: Đánh giá tính an toàn và hiệu quả của Tivoli DES và Firebird DES trong tái can thiệp mạch vành; IVUS-XPL: Tác động của hướng dẫn siêu âm nội mạch đến kết quả của Xience Prime Stent trong các tổn thương dài; MACCE: biến chứng nghiêm trọng về tim và não; MI = nhồi máu cơ tim; NIPPON: Liệu pháp kháng tiểu cầu kép Nobori trong khoảng thời gian thích hợp; RCT: thử nghiệm lâm sàng ngẫu nhiên có đối chứng; REAL-LATE: Mối tương quan giữa việc ngừng điều trị bằng Clopidogrel ở bệnh nhân thực tế được điều trị bằng đặt stent phủ thuốc và biến cố huyết khối động mạch vành muộn; RESET: Tính an toàn và hiệu quả thực sự của liệu pháp kháng tiểu cầu kép trong 3 tháng sau khi đặt stent phủ thuốc Endeavour Zotarolimus; SMART-CHOICE: Nhóm nghiên cứu nong mạch vành thông minh: So sánh giữa liệu pháp đơn trị liệu đối kháng P2Y12 và liệu pháp kháng tiểu cầu kép ở bệnh nhân được đặt stent phủ thuốc mạch vành; SMART-DATE: Nhóm nghiên cứu nong mạch vành thông minh - Độ an toàn của liệu pháp ức chế kết tập tiểu cầu kép trong thời gian 6 tháng sau can thiệp mạch vành qua da ở bệnh nhân mắc hội chứng mạch vành cấp tính; ST = huyết khối trong stent; STOP-DAPT-2: Thời gian ngắn và tối ưu của liệu pháp kháng tiểu cầu kép sau Stent 2 phủ thuốc Everolimus-Cobalt-Chromium; STOP-DAPT-2 ACS: Thời gian ngắn và tối ưu của liệu pháp kháng tiểu cầu kép sau Hội chứng mạch vành cấp tính phủ Everolimus-Eluting Cobalt-Chromium 2; TIMI: Tan huyết khối trong nhồi máu cơ tim; ZEST-LATE: Đánh giá tính an toàn lâu dài sau khi đặt stent phủ thuốc Zotarolimus, stent phủ thuốc Sirolimus hoặc cấy ghép stent phủ thuốc Paclitaxel cho các tổn thương mạch vành-các biến cố huyết khối động mạch vành muộn. a Xuất huyết nặng bao gồm xuất huyết nội sọ, xuất huyết nội nhãn, xuất huyết sau phúc mạc, xuất huyết có biểu hiện lâm sàng làm giảm hemoglobin >3 g/dl, tất cả các trường hợp xuất huyết làm giảm hemoglobin >4 g/dl và xuất huyết dẫn đến truyền hồng cầu lắng hoặc ≥2 U máu toàn phần. | ||||
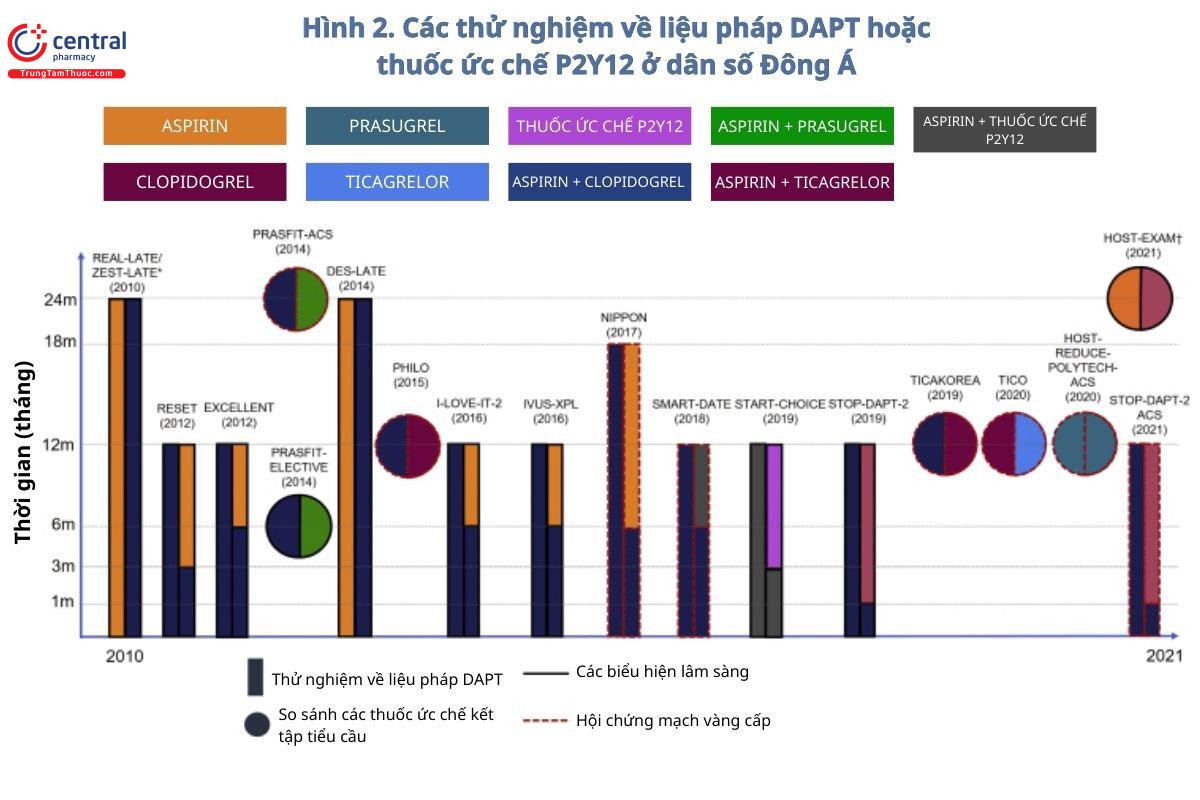
Từ năm 2010 trở đi, các thử nghiệm đa trung tâm mới về liệu pháp điều trị chống kết tập tiểu cầu kép (DAPT) hoặc các chất ức chế P2Y12 ở dân số Đông Á đã có sự phát triển. ∗Thử nghiệm REAL-LATE/ZEST-LATE lựa chọn ngẫu nhiên các bệnh nhân đã đặt Stent phủ thuốc (DES) và không gặp các biến cố bất lợi nghiêm trọng về tim hoặc mạch máu não cũng như xuất huyết nặng trong một thời gian ít nhất là 12 tháng.
** Thử nghiệm HOST-EXAM gồm những bệnh nhân được duy trì liệu pháp DAPT mà không có biến cố lâm sàng trong 6-18 tháng sau khi can thiệp mạch vành qua da bằng DES.
DES-LATE: Khoảng thời gian tối ưu của liệu pháp Clopidogrel với DES để giảm biến cố huyết khối động mạch vành muộn;
PHILO: Nghiên cứu đánh giá tính an toàn và hiệu quả của Ticagrelor so với Clopidogrel ở bệnh nhân châu Á/Nhật Bản mắc bệnh ACS không ST hoặc ST độ cao;
PRASFIT-ACS: Prasugrel So với Clopidogrel Dành cho bệnh nhân Nhật Bản mắc ACS trải qua PCI; PRASFIT-ELECTIVE: Prasugrel Dành cho bệnh nhân Nhật Bản mắc bệnh động mạch vành Đang trải qua PCI tự chọn;
TICAKOREA: Ticagrelor so với Clopidogrel ở bệnh nhân châu Á/Hàn Quốc mắc ACS dự định điều trị xâm lấn;
TICO: Đơn trị liệu bằng Ticagrelor sau 3 tháng ở bệnh nhân được điều trị bằng Stent phủ thuốc Sirolimus thế hệ mới cho ACS;
Sự tiến bộ liên tục của công nghệ stent, vật liệu stent mới và sử dụng các polyme tương thích sinh học hoặc phân hủy sinh học cùng với sự cải thiện trong động học giải phóng của thuốc đã mang lại kết quả lâm sàng tốt hơn sau khi cấy ghép stent phủ thuốc thế hệ thứ hai. Điều này đã dẫn đến giảm đáng kể tình trạng tái hẹp mạch và biến chứng huyết khối đồng thời cho phép rút ngắn thời gian điều trị bằng liệu pháp DAPT [46].
Theo đó, các thử nghiệm RCT bổ sung đã được thực hiện trong những năm gần đây để xác định thời gian sử dụng an toàn tối thiểu của liệu pháp DAPT sau khi đặt stent mới hơn trong các điều kiện lâm sàng khác nhau. Hầu hết các thử nghiệm này đều cho thấy rằng thời gian điều trị ngắn hạn (3 đến 6 tháng) nhìn chung có hiệu quả như thời gian điều trị DAPT kéo dài [40-43]. Phần lớn các thử nghiệm này xuất phát từ các nước Đông Á bao gồm Hàn Quốc và Nhật Bản. Ngoài ra, một số nghiên cứu cũng chỉ ra rằng ngay cả chiến lược điều trị ban đầu bằng DAPT trong 1 tháng (so với DAPT trong 12 tháng) sau đó chuyển sang đơn trị liệu bằng Clopidogrel sau can thiệp mạch vành qua da (PCI) chọn lọc đối với hầu hết các bệnh nhân CAD ổn định đã cho thấy hiệu quả tương đương với liệu pháp DAPT trong 12 tháng về các tiêu chí đánh giá [44]. Tuy nhiên, thử nghiệm STOP-DAPT-2 ACS gần đây tập trung vào bệnh nhân mắc hội chứng mạch vành cấp ACS với 56% bệnh nhân bị nhồi máu cơ tim ST chênh lên, cũng so sánh DAPT trong 1 tháng sau đó dùng Clopidogrel đơn trị liệu so với liệu pháp DAPT tiêu chuẩn sau PCI với DES, cho thấy rằng chiến lược DAPT trong 1 tháng không đáp ứng tiêu chí về tính an toàn đối với tổng số biến cố thiếu máu cục bộ/xuất huyết [45]. Mặc dù tình trạng xuất huyết nặng đã giảm đáng kể với phương pháp này, nhưng dường như có sự gia tăng đáng kể về các biến cố bất lợi về thiếu máu cục bộ và có một tín hiệu rõ ràng liên quan đến tỷ lệ tử vong chung.
Trong giai đoạn sau ở bệnh nhân có can thiệp mạch vành qua da (PCI) với stent phủ thuốc (DES), lựa chọn tối ưu đơn trị liệu ức chế kết tập tiểu cầu bằng Aspirin hoặc Clopidogrel vẫn chưa được chắc chắn. Tại Hàn Quốc, thử nghiệm HOST-EXAM đã chọn ngẫu nhiên 5.438 bệnh nhân duy trì liệu pháp DAPT mà không có biến cố lâm sàng trong 6 đến 18 tháng sau PCI với DES (chủ yếu là thế hệ thứ hai) và sau đó chuyển sang đơn trị liệu Clopidogrel hoặc Aspirin [48]. Tỷ lệ các biến cố trong 24 tháng của các nguyên nhân chính bao gồm tử vong do mọi nguyên nhân, nhồi máu cơ tim, đột quỵ, tái nhập viện do ACS và xuất huyết BARC (loại 3 hoặc cao hơn) ở nhóm dùng đơn trị liệu bằng Clopidogrel thấp hơn đáng kể so với dùng Aspirin đơn trị liệu (5,7% so với 7,7%; HR: 0,73; CI 95%: 0,59-0,90). Tỷ lệ xuất huyết và tỷ lệ tích lũy của bất kỳ biến cố xuất huyết nào cũng thấp hơn trong đơn trị liệu bằng clopidogrel.
Tóm lại, với bằng chứng hiện tại ủng hộ sử dụng liệu pháp DAPT trong thời gian ngắn cùng với xu hướng xuất huyết cao ở bệnh nhân Đông Á thì khoảng thời gian sử dụng tối ưu của liệu pháp DAPT và chiến lược ức chế kết tập tiểu cầu dài hạn sẽ là từ 3 - 6 tháng ngay cả ở bệnh nhân có hội chứng mạch vành cấp (ACS). Ngoài ra, việc sử dụng DAPT trong thời gian ngắn hơn (tức là 1 tháng) có thể tăng nguy cơ xuất huyết (HBR) đối với bệnh nhân có bệnh mạch vành ổn định ở Đông Á. Bên cạnh đó, xem xét tổng thể bằng chứng, việc sử dụng đơn trị liệu thuốc ức chế P2Y12 (như Clopidogrel) và loại bỏ aspirin sau một thời gian ngắn điều trị DAPT được coi là một chiến lược hiệu quả và an toàn để giảm nguy cơ xuất huyết trong khi vẫn duy trì đặc điểm thiếu máu cục bộ ở bệnh nhân Đông Á. Đối với việc duy trì đơn trị liệu ức chế kết tập tiểu cầu sau khi kết thúc DAPT, Clopidogrel được cho là vượt trội hơn aspirin trong việc ngăn ngừa các biến cố bất lợi trong tương lai, bao gồm cả các vấn đề về huyết khối và xuất huyết ở những bệnh nhân Đông Á trải qua PCI với DES hiện đại.
7 Thuốc ức chế mạnh P2Y12 (Ticagrelor, Prasugrel,...)
7.1 Các thử nghiệm RCT mang tính bước ngoặt của các thuốc ức chế mạnh P2Y12
Các thử nghiệm RCT mù đôi, giai đoạn III, quy mô lớn, bao gồm TRITON-TIMI 38 (Thử nghiệm đánh giá sự cải thiện kết quả điều trị bằng cách tối ưu hóa ức chế kết tập tiểu cầu bằng Prasugrel-Thrombolysis trong nhồi máu cơ tim 38) và PLATO (Ức chế kết tập tiểu cầu và kết quả bệnh nhân) đã chỉ ra việc sử dụng các thuốc ức chế mạnh P2Y12 như Prasugrel hoặc Ticagrelor so với Clopidogrel mang lại ít biến chứng thiếu máu cục bộ và huyết khối trong stent hơn nhưng lại lại tăng nguy cơ xảy ra xuất huyết bao gồm cả xuất huyết đe dọa tính mạng và gây tử vong ở bệnh nhân mắc ACS [49, 50]. Do đó, các hướng dẫn của Hoa Kỳ và Châu u khuyến cáo dùng Prasugrel hoặc Ticagrelor hơn Clopidogrel để sử dụng các thuốc chống huyết khối ưu tiên cho bệnh nhân sau ACS [52, 53].
Tuy nhiên, do phân nhóm châu Á trong thử nghiệm TRITON-TIMI và PLATO chỉ đại diện cho một tỷ lệ nhỏ số bệnh nhân được chọn (<10%) nên việc ngoại suy trực tiếp các phát hiện của thử nghiệm vào thực hành lâm sàng ở nhiều quốc gia châu Á có thể gặp vấn đề. Do đó, để xác định độ an toàn và hiệu quả tương đối của thuốc ức chế mạnh P2Y12 ở bệnh nhân Đông Á, nhiều nghiên cứu thực nghiệm và thử nghiệm lâm sàng cụ thể về chủng tộc đã được tiến hành.
7.2 Ticagrelor
7.2.1 Nghiên cứu dược động học/dược lực học
Một nghiên cứu thực nghiệm tại Nhật Bản trên những người tình nguyện khỏe mạnh cho thấy mức độ chuyển hóa và hoạt tính của Ticagrelor (ARC124910XX) ở bệnh nhân Nhật Bản cao hơn khoảng 33% đến 55% so với bệnh nhân da trắng [54]. Tương tự, một nghiên cứu dược động học trên bệnh nhân ACS cho kết quả người châu Á có Sinh khả dụng của Ticagrelor cao hơn 39% so với người da trắng [55]. Điều này cho thấy có sự khác biệt rõ rệt giữa các chủng tộc về đặc tính sinh huyết khối nội tại, đặc tính dược động học và dược lực học của thuốc Ticagrelor giữa người châu Á và người da trắng và việc giảm liều ticagrelor có thể được áp dụng nhiều hơn ở bệnh nhân Đông Á mắc ACS.

Một thử nghiệm mang tên OPTIMA (Liệu pháp chống kết tập tiểu cầu tối ưu trong quản lý bệnh nhân châu Á mắc hội chứng mạch vành cấp tính) thực hiện trên các bệnh nhân Hàn Quốc mắc ACS chưa từng sử dụng thuốc đối kháng P2Y12 trong vòng 6 tháng qua. Các bệnh nhân được phân ngẫu nhiên thành 3 nhóm với tỷ lệ 1:1:1, lần lượt dùng Ticagrelor liều thấp (liều nạp 120 mg, 60 mg hai lần mỗi ngày), ticagrelor liều chuẩn (liều nạp 180 mg, 90 mg hai lần mỗi ngày) hoặc sử dụng Clopidogrel liều chuẩn (liều nạp 600 mg, 75 mg một lần mỗi ngày)cùng kết hợp với Aspirin [56]. Kết quả không có sự khác biệt có ý nghĩa thống kê về số lượng P2Y12 đơn vị phản ứng (PRU) giữa Ticagrelor liều thấp (60 mg) và liều chuẩn (90mg) tại bất kỳ thời điểm nào. Nhưng cả hai liệu pháp sử dụng Ticagrelor đều giảm PRU trung bình đáng kể so với Clopidogrel. Điều này gợi ý rằng Ticagrelor 60 mg hoặc thậm chí liều thấp hơn có thể là một lựa chọn điều trị tiềm năng cho bệnh nhân Đông Á mắc ACS. Tuy nhiên, cần tiến hành thêm các nghiên cứu lớn hơn và đầy đủ hơn để xác định liều Ticagrelor tối ưu cho bệnh nhân Đông Á.
7.2.2 Bằng chứng lâm sàng từ thử nghiệm RCT
Các đặc điểm về thiết kế thử nghiệm và lựa chọn tiêu chí theo dõi, đánh giá của RCT nhằm đánh giá hiệu quả và độ an toàn của thuốc ức chế P2Y12 mạnh ở bệnh nhân Đông Á được tóm tắt trong Bảng 2.
Thử nghiệm PHILO (Nghiên cứu đánh giá tính an toàn và hiệu quả của Ticagrelor so với Clopidogrel ở bệnh nhân châu Á/Nhật Bản có ACS không ST hoặc ST chênh lên) có 801 bệnh nhân Nhật Bản, Đài Loan và Hàn Quốc mắc ACS trải qua PCI tham gia để so sánh kết quả lâm sàng sau 1 năm dùng Ticagrelor liều chuẩn (180/90 mg hai lần) so với Clopidogrel (300/75 mg/d) [7]. Các tiêu chí chính đánh giá hiệu quả bao gồm tỷ lệ tử vong do biến cố tim mạch, nhồi máu cơ tim hoặc đột quỵ (9,0% so với 6,0%) và các biến cố xuất huyết nặng (10,3% so với 6,8%) và nhẹ (15,2% so với 9,2%) do tiêu chuẩn PLATO xác định. Kết quả cho thấy các chỉ tiêu đánh giá đều có tỷ lệ cao hơn ở nhóm sử dụng Ticagrelor so với nhóm sử dụng Clopidogrel. Các kết quả tương tự cũng được quan sát thấy trong thử nghiệm TICAKOREA (So sánh Ticagrelor vs Clopidogrel ở bệnh nhân châu Á/Hàn Quốc mắc ACS dự định điều trị xâm lấn) đánh giá tính an toàn và hiệu quả của Ticagrelor liều chuẩn so với Clopidogrel trên 800 bệnh nhân ACS Hàn Quốc [8]. Kết quả cho thấy tỷ lệ xuất huyết đáng kể trên lâm sàng (chảy máu nặng hoặc nhẹ PLATO) tại thời điểm 12 tháng ở nhóm sử dụng Ticagrelor cao hơn đáng kể so với nhóm dùng Clopidogrel (lần lượt là 11,7% so với 5,3%). Ngoài ra, tỷ lệ chảy máu nặng và tử vong cũng cao hơn ở nhóm Ticagrelor. Hơn nữa, tỷ lệ tử vong do tim mạch, nhồi máu cơ tim hoặc đột quỵ trong 12 tháng ở nhóm Ticagrelor có xu hướng cao hơn nhóm Clopidogrel (9,2% so với 5,8%). Nhìn chung, những thử nghiệm này tuy chưa đủ mạnh nhưng đều cho thấy xu hướng xuất huyết chung nhiều hơn mà không có lợi đối với các biến cố thiếu máu cục bộ ở bệnh nhân Đông Á dùng liệu pháp DAPT bao gồm Ticagrelor trong đó.
Bảng 2. Các thử nghiệm RCT ở bệnh nhân Đông Á để đánh giá các chất ức chế P2Y12 tiềm năng
Tên thử nghiệm, năm tiến hành | Cỡ mẫu (số người tham gia thử nghiệm) | Thiết kế thử nghiệm | Tiêu chí theo dõi và đánh giá | Kết quả |
|---|---|---|---|---|
| Ticagrelor | ||||
PHILO 2015 | 801 bệnh nhân ACS được điều trị PCI theo kế hoạch | Thử nghiệm mù đôi (cả đối tượng được nghiên cứu và cả các nhà khoa học đều không biết liệu pháp điều trị cho từng đối tượng) Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm dùng ticagrelor + aspirin so với nhóm sử dụng clopidogrel + aspirin | Tiêu chí đánh giá tính an toàn: Xuất huyết nặng theo PLATO sau 12 tháng Tiêu chí đánh giá tính hiệu quả: tỷ lệ gặp biến cố nhồi máu cơ tim, đột quỵ hoặc tử vong do biến cố tim mạch sau 12 tháng | Nhóm dùng Ticagrelor so với nhóm sử dụng clopidogrel Thiêu chí đánh giá tính an toàn: 10,3% so với 6,8% (HR: 1,54; KTC 95%: 0,94-2,53) Tiêu chí đánh giá tính hiệu quả: 9,0% so với 6,3% (HR: 14,47; KTC 95%: 0,88-2,44) |
TICAKOREA 2019 | 800 bệnh nhân ACS được điều trị xâm lấn | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng ticagrelor + aspirin so với nhóm sử dụng clopidogrel + aspirin | Tiêu chí an toàn chính: tỷ lệ các xuất huyết nặng hoặc nhẹ PLATO sau 12 tháng Tiêu chí hiệu quả phụ: tỷ lệ tử vong do biến cố tim mạch, nhồi máu cơ tim không tử vong hoặc đột quỵ không tử vong sau 12 tháng | Ticagrelor so với clopidogrel Tiêu chí an toàn chính: 11,7% so với 5,3% (HR: 2,26; KTC 95%: 1,34-3,79) Tiêu chí hiệu quả phụ: 9,2% so với 5,8% (HR: 1,62; KTC 95%: 0,96-2,74) |
TICO 2020 | 3.056 bệnh nhân ACS được điều trị bằng DES | Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng đơn trị liệu bằng ticagrelor (90mg hai lần mỗi ngày) sau 3 tháng điều trị bằng DAPT so với nhóm duy trì điều trị DAPT (có ticagrelor) trong 12 tháng | Các biến cố lâm sàng bất lợi: bao gồm xuất huyết nặng TIMI và các biến cố bất lợi chính về tim và mạch máu não (tử vong, nhồi máu cơ tim, chênh lệch ST, đột quỵ hoặc tái thông mạch máu mục tiêu) sau 12 tháng | Ticagrelor đơn trị liệu so với DAPT Biến cố lâm sàng bất lợi: 3,9% so với 5,9% (HR: 0,66; KTC 95%: 0,48-0,92) Chảy máu nặng TIMI: 1,7% so với 3,0%; (HR: 0,56; KTC 95%: 0,34-0,91) Các biến cố bất lợi chính về tim và mạch máu não: 2,3% so với 3,4% (HR: 0,69; KTC 95%: 0,45-1,06) |
| Prasugrel | ||||
PRSFIT-ACS 2014 | 1.363 bệnh nhân ACS được thực hiện PCI | Thử nghiệm mù đôi Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng Prasugrel (20/3,75 mg, liều tấn công/duy trì) so với nhóm dùng clopidogrel (300/75mg) cùng kết hợp aspirin | Tiêu chí chính về tính hiệu quả: bao gồm tỷ lệ tử vong do biến cố tim mạch, nhồi máu cơ tim không tử vong và đột quỵ do thiếu máu cục bộ không tử vong sau 24 tháng Tiêu chí an toàn thứ cấp: chảy máu nặng TIMI không liên quan đến CABG sau 24 tháng | Prasugrel so với clopidogrel Tiêu chí chính về tính hiệu quả: 9,4% so với 11,8% (HR: 0,77; KTC 95%: 0,56-1,07) Tiêu chí an toàn thứ cấp: 1,9% so với 2,2% (HR: 0,82; KTC 95%: 0,39-1,73) |
PRASFIT-ELECTIVE 2014 | 742 bệnh nhân được chỉ định đặt stent mạch vành | Thử nghiệm mù đôi Thử nghiệm ngẫu nhiên 1 : 1 So sánh nhóm sử dụng Prasugrel (20/3,75 mg, liều tấn công/duy trì) so với nhóm dùng clopidogrel (300/75mg) cùng kết hợp aspirin | Tiêu chí về tính hiệu quả: bao gồm tỷ lệ tử vong do biến cố tim mạch, nhồi máu cơ tim không tử vong hoặc đột quỵ do thiếu máu cục bộ không tử vong ở 24 tuần Tiêu chí về tính an toàn: xuất huyết TIMI không liên quan đến CABG đến 14 ngày sau khi ngừng thuốc nghiên cứu | Prasugrel so với clopidogrel (sự khác biệt chưa được kiểm tra về ý nghĩa thống kê) Tiêu chí về tính hiệu quả: 4,1% so với 6,7% Tiêu chí về tính an toàn (xuất huyết nặng TIMI không liên quan đến CABG): 1,6% so với 3,0% |
HOST-REDUCE-POLYTECH-ACS 2020 | 2.338 bệnh nhân ACS được điều trị PCI | Nghiên cứu được thiết kế mở Thử nghiệm ngẫu nhiên 1 : 1 So sánh kết quả giữa nhóm sử dụng 5mg prasugrel (liều thấp) so với nhóm sử dụng 10 mg prasugrel (liều thông thường) sau 1 tháng điều trị với 10 mg prasugrel + 100 mg aspirin mỗi ngày (ở cả 2 nhóm) | Các biến cố lâm sàng bất lợi: bao gồm tử vong do mọi nguyên nhân, nhồi máu cơ tim không tử vong, ST, tái can thiệp thông mạch máu lặp lại, đột quỵ và biến cố xuất huyết BARC loại 2,3,5 sau 12 tháng | 5 mg prasugrel so với 10 mg prasugrel Biến cố lâm sàng bất lợi: 7,2% so với 10,1% (HR: 0,70; KTC 95%: 0,52-0,92) Biến cố thiếu máu cục bộ (tử vong do tim mạch, nhồi máu cơ tim, ST, đột quỵ do thiếu máu cục bộ): HR: 0,76; KTC 95%: 0,40-1,45 Biến cố xuất huyết: HR: 0,48; KTC 95%: 0,32-0,73 |
CABG: ghép bắc cầu động mạch vành; PCI: can thiệp mạch vành qua da; HOST- REDUCE-POLYTECH-ACS: So sánh việc giảm liều Prasugrel hoặc công nghệ polymer ở bệnh nhân ACS; PHILO: Nghiên cứu đánh giá tính an toàn và hiệu quả của Ticagrelor so với Clopidogrel ở bệnh nhân Châu Á/Nhật Bản mắc ACS không có ST hoặc ST cao; PLATO: Sự ức chế kết tập tiểu cầu và kết quả của bệnh nhân; PRASFIT-ACS: Prasugrel so với Clopidogrel dành cho bệnh nhân Nhật Bản mắc ACS trải qua PCI; PRASFIT-ELECTIVE: Prasugrel dành cho bệnh nhân Nhật Bản mắc bệnh động mạch vành dang trải qua PCI; TICAKOREA: Ticagrelor so với Clopidogrel ở bệnh nhân châu Á/Hàn Quốc mắc ACS dự định điều trị xâm lấn; TICO: Đơn trị liệu bằng Ticagrelor sau 3 tháng ở bệnh nhân được điều trị bằng Stent phủ thuốc Sirolimus thế hệ mới cho ACS; Các chữ viết tắt còn lại tương tự Bảng 1. | ||||
Gần đây, do việc sử dụng rộng rãi thuốc ức chế P2Y12 mạnh và tính khả thi của việc áp dụng thời gian sử dụng DAPT ngắn, các câu hỏi quan trọng về mặt lâm sàng đã được đặt ra về việc liệu việc sử dụng aspirin có nên bắt buộc hay không.
Theo đó, chiến lược loại bỏ aspirin và duy trì chất ức chế P2Y12 mạnh sau thời gian ngắn điều trị bằng liệu pháp DAPT đã được khám phá trong nhiều thử nghiệm RCT liên tiếp. Hiện đã có kết quả của 3 thử nghiệm lớn thuộc loại này với hoạt chất Ticagrelor, gồm 2 thử nghiệm ở Châu u và Bắc Mỹ và 1 thử nghiệm ở Hàn Quốc [59-61].
Thử nghiệm GLOBAL LEADERS (Nghiên cứu lâm sàng so sánh hai hình thức điều trị chống kết tập tiểu cầu sau đặt stent) đã chứng minh chiến lược dùng DAPT ngắn hạn 1 tháng với ticagrelor cộng với aspirin, sau đó chỉ sử dụng Ticagrelor trong 23 tháng cho hiệu quả tốt hơn so với sử dụng DAPT trong 12 tháng sau đó dùng đơn trị liệu bằng aspirin [59]. Cụ thể, sau 2 năm, tỷ lệ tử vong do mọi biến cố hoặc nhồi máu cơ tim không khác biệt đáng kể giữa nhóm thử nghiệm và nhóm tiêu chuẩn (3,8% so với 4,4%; tỷ lệ tỷ lệ: 0,87; KTC 95%: 0,75 đến 1,01).
Thử nghiệm tương tự có tên TWILIGHT với việc loại bỏ aspirin sau thời gian ngắn sử dụng DAPT ở những bệnh nhân có nguy cơ xuất huyết hoặc nguy cơ gặp biến cố thiếu máu cục bộ cao và đã trải qua PCI [60]. Kết quả thử nghiệm này cho thấy đơn trị liệu dựa trên ticagrelor (DAPT 3 tháng và sau đó chỉ dùng ticagrelor) có liên quan đến nguy cơ chảy máu trênlâm sàng thấp hơn (BARC loại 2, 3 hoặc 5) mà không làm tăng nguy cơ tử vong, nhồi máu cơ tim hoặc đột quỵ, so với việc tiếp tục sử dụng ticagrelor + aspirin. Tương tự, thử nghiệm TICO (Ticagrelor đơn trị liệu sau 3 tháng ở những bệnh nhân được điều trị bằng Stent phủ thuốc Sirolimus thế hệ mới cho ACS) được thực hiện ở nhiều trung tâm Hàn Quốc với 3.056 bệnh nhân ACS. Nghiên cứu này cho thấy việc sử dụng ticagrelor đơn trị liệu sau 3 tháng dùng DATP cho kết quả lâm sàng tốt hơn so với việc sử dụng liệu pháp DAPT kéo dài 12 tháng (Bảng 2) [61]. Tổng hợp các các biến cố lâm sàng bất lợi (tức là xuất huyết nặng và các biến cố bất lợi nghiêm trọng về tim và mạch máu não) tại thời điểm 1 năm thấp hơn đáng kể ở nhóm đơn trị liệu bằng ticagrelor. Sự khác biệt này chủ yếu là do các biến cố xuất huyết nặng vì không có sự khác biệt về các biến cố tim mạch nặng giữa 2 nhóm.
7.3 Prasugrel
7.3.1 Nghiên cứu dược động học/dược lực học
Một số nghiên cứu về dược động học và dược lực học đã phát hiện ra rằng sau khi dùng prasugrel, sự hiện diện của chất chuyển hóa có hoạt tính ở đối tượng người Đông Á cao hơn ở bệnh nhân da trắng [63, 64].

Trong một nghiên cứu trên những người tình nguyện khỏe mạnh, các đối tượng Đông Á dùng liều prasugrel 5mg mỗi ngày cho thấy mức độ ức chế kết tập tiểu cầu tương tự như đối tượng người da trắng dùng liều gấp đôi (10mg) [63].
Trong một nghiên cứu khác thử nghiệm giảm liều prasugrel ở bệnh nhân Nhật Bản bị bệnh động mạch vành được can thiệp PCI, mức độ ức chế kết tập tiểu cầu cao hơn khi sử dụng prasugrel với liều 10/2,5 mg, 15/3,75 mg và 20/5 mg so với clopidogrel (tương ứng là 12,3%, 20,9%, 29,8% so với 8,4%) [64]. Ngoài ra, thử nghiệm A-MATCH đã so sánh đặc điểm dược lực học ở 255 bệnh nhân ACS Hàn Quốc được chỉ định ngẫu nhiên dùng prasugrel liều cố định (10 mg với nhóm 5 mg) hoặc nhóm kiểm tra chức năng tiểu cầu (tỷ lệ 1:1:1) [65]. Sau 1 tháng, tỷ lệ phần trăm bệnh nhân nằm trong khoảng điều trị (95 ≤ PRU ≤ 208) thấp hơn đáng kể ở nhóm dùng prasugrel 10 mg so với nhóm được hướng dẫn xét nghiệm chức năng tiểu cầu và prasugrel 5 mg (35,3% tương ứng là 67,5% và 65,9%). Nhìn chung, những phát hiện này chỉ ra rằng giảm liều prasugrel có thể mang lại hiệu quả điều trị tối ưu hơn và giảm xu hướng xuất huyết ở bệnh nhân Đông Á mắc ACS.
7.3.2 Bằng chứng lâm sàng từ thử nghiệm RCT
Liều thấp prasugrel đã được thử nghiệm trong một số thử nghiệm RCT ở dân số phương Tây và châu Á. Ở bệnh nhân lớn tuổi hoặc nhẹ cân bị ACS ở Châu u, việc giảm liều prasugrel hàng ngày (5mg/ngày) so với sử dụng Ticagrelor liều chuẩn (90mg hai lần một ngày) có liên quan đến hiệu quả chống thiếu máu cục bộ được đồng thời bảo vệ những bệnh nhân này chống lại nguy cơ xuất huyết quá mức [66].
Ở châu Á, dựa trên nghiên cứu dược lực học, thử nghiệm PRASFIT-ACS (Prasugrel so với Clopidogrel dành cho bệnh nhân Nhật Bản mắc ACS đang trải qua PCI) đã đánh giá hiệu quả và độ an toàn của chiến lược prasugrel liều thấp (20/3,75 mg) so với chiến lược clopidogrel liều chuẩn (300/75 mg) ở 1.363 bệnh nhân ACS Nhật Bản trải qua PCI (Bảng 2) [6, 64]. Prasugrel (20/3,75 mg) có liên quan đến tỷ lệ biến cố thiếu máu cục bộ thấp (tương tự như kết quả của thử nghiệm TRITON-TIMI 38 RCT và nguy cơ xuất huyết nghiêm trọng trên lâm sàng thấp ở bệnh nhân ACS Nhật Bản.
Thử nghiệm PRASFIT-ELECTIVE (Prasugrel dành cho bệnh nhân Nhật Bản trải qua PCI chọn lọc) nghiên cứu việc giảm liều prasugrel (20/3,75 mg) ở 742 bệnh nhân Nhật Bản trải qua PCI chọn lọc cũng cho thấy kết quả an toàn và hiệu quả của chiến lược này [67]. Trên cơ sở các thử nghiệm này, hướng dẫn cập nhật năm 2020 của Nhật Bản khuyến nghị giảm liều prasugrel (15/3,75 mg) là phác đồ tiêu chuẩn cho bệnh nhân ACS hoặc PCI [68].
Gần đây, thử nghiệm HOST-REDUCE-POLYTECH-ACS được tiến hành ở Hàn Quốc đã thử nghiệm việc giảm liều DAPT sau PCI ở 2.338 bệnh nhân ACS dựa trên prasugrel [69]. Các biến cố lâm sàng bất lợi chính (bao gồm tử vong do mọi nguyên nhân, nhồi máu cơ tim, huyết khối trong stent, tái can thiệp thông mạch máu, đột quỵ và chảy máu BARC loại 2 hoặc cao hơn) sau 1 năm ở nhóm giảm liều (5mg) thấp hơn đáng kể so với nhóm dùng liều tiêu chuẩn (10mg), chủ yếu là do giảm các biến cố chảy máu mà không tăng các biến cố thiếu máu cục bộ. Tóm lại, dựa trên bằng chứng tích lũy từ các thử nghiệm RCT được thực hiện ở các nước châu Á, việc sử dụng liều prasugrel giảm (5 mg) có thể là một chiến lược tiêu chuẩn khả thi hoặc chiến lược thay thế trong quá trình điều trị ban đầu hoặc duy trì ở dân số Đông Á sau khi xem xét đặc điểm lợi ích-nguy cơ.
8 Bệnh nhân có nguy cơ cao
8.1 Bệnh nhân PCI được chỉ định dùng thuốc chống đông đường uống
Sử dụng thuốc chống đông đường uống suốt đời (OAC) được yêu cầu đối với hầu hết bệnh nhân có van tim cơ học và nguy cơ rung nhĩ cao, trong đó có tới 15% có bệnh mạch vành đồng thời được chỉ định PCI [70]. Thông thường liệu pháp ba thuốc kết hợp gồm warfarin và DAPT được sử dụng để ngăn ngừa biến cố huyết khối tắc mạch và thiếu máu cục bộ mạch vành trong những trường hợp như vậy. Tuy nhiên, liệu pháp cổ điển này làm tăng đáng kể nguy cơ xuất hiện biến chứng xuất huyết [71, 72]. Hơn nữa, các nhà khoa học vẫn còn lo ngại về các biến chứng xuất huyết khi điều trị bằng warfarin ví dụ như xuất huyết nội sọ, đặc biệt là ở người châu Á, vì dường như họ có nguy cơ xuất huyết liên quan đến warfarin cao hơn so với người không phải người châu Á [10].
Gần đây, một loạt thử nghiệm RCT được thực hiện để đánh giá hiệu quả của liệu pháp ba và hai thuốc chống đông máu trực tiếp đường uống (DOAC). Các thử nghiệm này đã chỉ ra rằng liệu pháp kép (clopidogrel cộng với DOAC) có lợi ích hơn và ít rủi ro hơn so với liệu pháp ba thuốc về mặt giảm biến chứng xuất huyết mà không tăng đáng kể các biến cố huyết khối [73]. Trong các thử nghiệm RCT này, các bệnh nhân được chọn ngẫu nhiên trong vòng 3 đến 14 ngày sau can thiệp PCI và không có liệu pháp chống huyết khối được chỉ định trước trong giai đoạn can thiệp, trong thời gian đó có thể áp dụng liệu pháp ba thuốc. Dựa trên bằng chứng này, các hướng dẫn hiện hành của Hoa Kỳ và Châu u đã khuyến cáo ngừng dùng aspirin sớm (dưới 1 tuần) và tiếp tục điều trị kép với DOAC và thuốc ức chế P2Y12 [74, 75]. Khuyến cáo này hiện được áp dụng rộng rãi trên lâm sàng ở nhiều nước châu Á. Do thiếu sự so sánh trực tiếp giữa các loại DOAC khác nhau nên không có khuyến nghị chính xác nào về việc lựa chọn cụ thể các loại thuốc này cho liệu pháp kép. Tuy nhiên, trong số các thuốc ức chế P2Y12, clopidogrel có thể là lựa chọn an toàn nhất khi sử dụng kết hợp với DOAC vì có nguy cơ chảy xuất huyết thấp nhất trong số các chất ức chế P2Y12, điều này đã được chứng minh qua nhiều thử nghiệm.
Cho đến nay, rất ít thử nghiệm RCT được tiến hành để xác định thời điểm tối ưu ngừng thuốc kháng kết tập tiểu cầu ở bệnh nhân PCI đang điều trị OAC mạn tính. Để giải quyết vấn đề này, 2 thử nghiệm RCT gần đây đã được thực hiện tại Nhật Bản. Tuy nhiên, một trong hai thử nghiệm không đủ mạnh và không có kết luận vì việc tuyển chọn bệnh nhân đã bị kết thúc sớm [76]. Thử nghiệm còn lại có tên AFIRE (Rung nhĩ và thiếu máu cục bộ với Rivaroxaban ở bệnh nhân có bệnh mạch vành ổn định). Thử nghiệm có tổng cộng 2.236 bệnh nhân đã trải qua can thiệp PCI hoặc phẫu thuật bắc cầu mạch vành hơn 1 năm trước hoặc những người được xác nhận mắc bệnh mạch vành thông qua chụp mạch vành, được chọn ngẫu nhiên để nhận DOAC (rivaroxaban 10 đến 15 mg) đơn trị liệu hoặc rivaroxaban kết hợp với một thuốc kháng kết tập tiểu cầu duy nhất (aspirin hoặc thuốc ức chế P2Y12 ) [77]. Tuy nhiên, thử nghiệm này đã bị dừng sớm do tỷ lệ tử vong tăng ở nhóm điều trị kết hợp 2 thuốc. Ở nhóm đơn trị liệu bằng Rivaroxaban được phát hiện có liên quan đến việc giảm 28% trường hợp đột quỵ, tắc mạch hệ thống, nhồi máu cơ tim, đau thắt ngực không ổn định cần tái tưới máu hoặc tử vong do bất kỳ nguyên nhân nào và giảm 41% số trường hợp xuất huyết nặng.
Tóm lại, trong trường hợp bệnh nhân trải qua can thiệp PCI và đã được chỉ định điều trị bằng OAC suốt đời, liệu pháp ba thuốc có thể được sử dụng trong giai đoạn chu phẫu sau PCI, tiếp theo là sử dụng liệu pháp kép OAC (DOAC thích hợp hơn warfarin) và thuốc ức chế P2Y12. Mặc dù vẫn còn sự không chắc chắn về thời điểm tối ưu để ngừng thuốc kháng kết tập tiểu cầu nhưng các hướng dẫn hiện hành của Hoa Kỳ và Châu u khuyến nghị chỉ nên sử dụng OAC suốt đời mà không dùng thuốc kháng kết tập tiểu cầu trên 1 năm, điều này cũng được hỗ trợ bởi các thử nghiệm RCT gần đây của Nhật Bản [74, 75, 77]. Với sự gia tăng bằng chứng về hiệu quả của DAPT ngắn hạn từ 3 đến 6 tháng, việc sử dụng đơn trị liệu OAC sau 3-6 tháng có thể là một lựa chọn khả thi cho bệnh nhân có nguy cơ xuất huyết cao.
8.2 Bệnh nhân có nguy cơ xuất huyết cao (HBR)
Việc xác định và quản lý nguy cơ xuất huyết ở những bệnh nhân mắc hội chứng mạch vành cấp ACS hoặc trải qua can thiệp mạch vành qua da PCI là rất quan trọng. Tuy nhiên, vì những bệnh nhân được coi là có nguy cơ xuất huyết cao (HBR) thường bị loại trừ hoặc không được trình bày đầy đủ trong các thử nghiệm RCT trước đây nên vẫn còn thiếu bằng chứng lâm sàng về trong quản lý và điều trị những bệnh nhân HBR này. Ngoài ra, việc xác định cách quản lý tối ưu bệnh nhân HBR mắc ACS hoặc trải qua PCI là một thách thức lớn do dữ liệu lâm sàng liên quan còn hạn chế và các định nghĩa khác nhau hoặc không đồng nhất về HBR giữa các nghiên cứu.
Một nhóm các nhà khoa học của Nhật Bản đã phát triển một phiên bản tiếng Nhật của các tiêu chí HBR này để tính đến những đặc điểm riêng biệt của dân số họ [68]. Phiên bản này bổ sung một số tiêu chí như trọng lượng cơ thể thấp, bệnh thận mãn tính có lọc máu, suy tim và bệnh mạch máu ngoại biên. Vì một tỷ lệ lớn bệnh nhân Đông Á có thể được phân loại là HBR, những tiêu chí mới này có thể giúp giảm thiểu nguy cơ xuất huyết trong thực hành lâm sàng hàng ngày [79].
Thông thường, bệnh nhân HBR thường được điều trị bằng cách sử dụng stent kim loại trần. Một số thử nghiệm RCT đã so sánh tính an toàn và hiệu quả của các loại stent khác nhau (DES với stent kim loại trần hoặc các DES khác nhau) với thời gian sử dụng DAPT ngắn ở những bệnh nhân trải qua PCI được coi là có nguy cơ chảy máu cao hơn [80, 81]. Gần đây, nghiên cứu MASTER-DAPT (Quản lý bệnh nhân có nguy cơ xuất huyết cao sau đặt stent phủ polymer có khả năng phân hủy sinh học với liệu pháp DAPT rút ngắn so với kéo dài) tập trung vào các bệnh nhân HBR được cấy stent phủ thuốc sirolimus bằng polyme phân hủy sinh học được điều trị bằng DES cho thấy hiệu quả sau 1 tháng sử dụng DAPT không thua kém so với tiếp tục sử dụng trong ít nhất 2 tháng nữa về khả năng xảy ra các biến cố tim mạch hoặc não bất lợi và nghiêm trọng, với tỷ lệ xuất huyết nặng hoặc không nghiêm trọng có liên quan đến lâm sàng thấp hơn [82]. Tuy nhiên, vì hầu hết các thử nghiệm này cho đến nay chủ yếu tập trung nghiên cứu trên dân số phương Tây, nên cần có thêm các nghiên cứu cụ thể theo chủng tộc để tối ưu hóa thời gian sử dụng DAPT, lựa chọn loại stent cụ thể và chiến lược chống huyết khối ở bệnh nhân Đông Á có HBR.
8.3 Bệnh nhân có nguy cơ thiếu máu cục bộ cao
Để giải quyết các yêu cầu lâm sàng trong việc giảm nguy cơ xuất huyết trong khi vẫn duy trì lợi ích chống thiếu máu cục bộ của các thuốc chống kết tập tiểu cầu, một số chiến lược điều trị đã được thử nghiệm nhằm tách rời nguy cơ huyết khối và xuất huyết [59, 60, 61, 69].
Dựa trên dữ liệu RCT mở rộng, có thể giảm nguy cơ gặp các biến chứng huyết khối bằng cách sử dụng tích cực thuốc chống kết tập tiểu cầu và thuốc chống đông máu trong giai đoạn đầu của ACS hoặc PCI nguy cơ cao. Tuy nhiên, lợi ích này giảm dần theo thời gian sau biến cố ACS hoặc khi sử dụng các thủ thuật có nguy cơ huyết khối cao. Do đó, việc quản lý tiếp theo đòi hỏi các phương pháp tiếp cận cá nhân hóa, trong đó lợi ích được cân nhắc nhiều hơn so với nguy cơ xuất huyết hơn là tình trạng huyết khối ban đầu [2]. Trong bối cảnh này, các phác đồ DAPT thay thế (tức là tăng cường sớm, giảm dần muộn) có thể được sử dụng ở nhóm bệnh nhân có nguy cơ cao, phức tạp này để đạt được sự cân bằng giữa tác dụng ức chế kết tập tiểu cầu của thuốc đủ và nguy cơ xuất huyết.
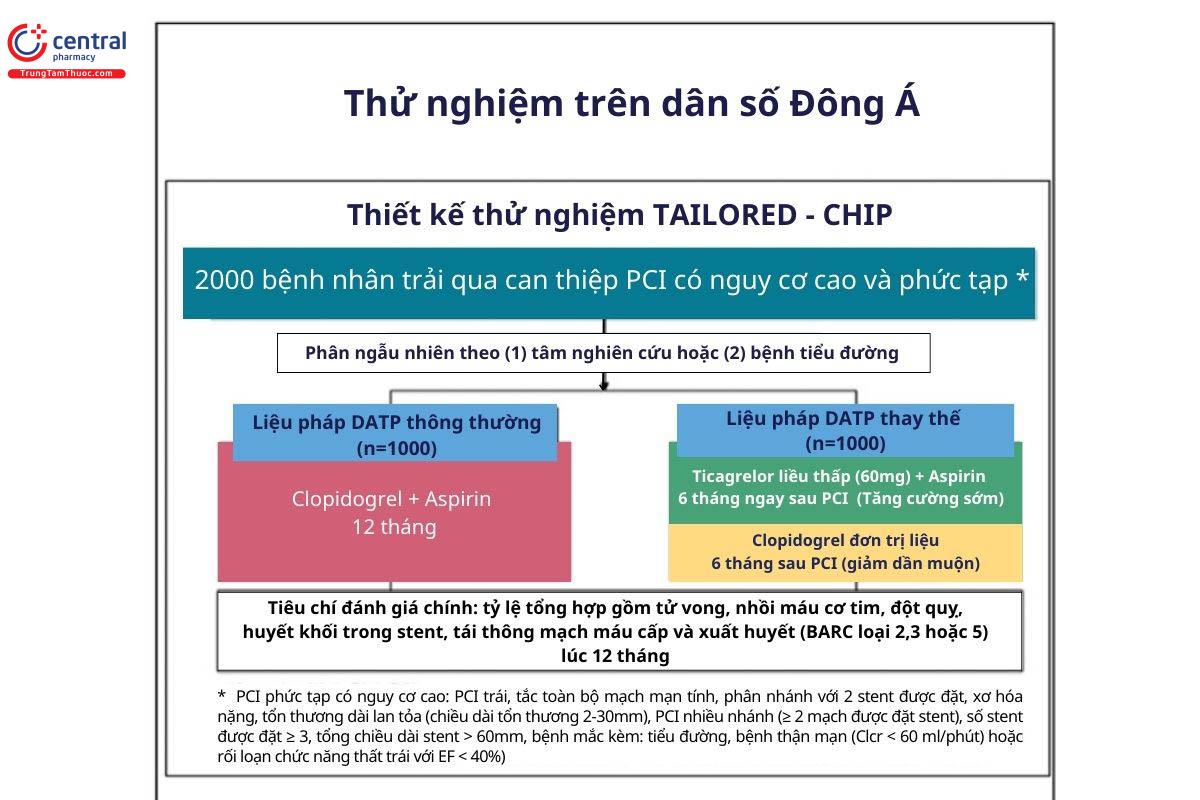
Thử nghiệm TAILORED CHIP (Chiến lược chống huyết khối thông thường dành cho PCI có nguy cơ cao phức tạp) được thực hiện ở Hàn Quốc sẽ mang lại những hiểu biết sâu sắc hơn về phác đồ DAPT thay thế (early escalation, late de-escalation - tăng cường sớm, giảm dần muộn) (Hình 3). Thử nghiệm này dự kiến bao gồm 2.000 bệnh nhân có các yếu tố lâm sàng/thủ thuật được chỉ định có nguy cơ cao và phức tạp ở Hàn Quốc. Nó được thiết kế để đánh giá tính hiệu quả và độ an toàn của liệu pháp chống huyết khối tăng cường sớm và giảm nguy cơ xuất huyết muộn.
Trong thử nghiệm TAILORED CHIP, thuật ngữ "early escalation" và "late de-escalation" đề cập đến hai chiến lược điều trị khác nhau được sử dụng để quản lý chống huyết khối sau can thiệp mạch vành qua da (PCI) ở bệnh nhân có nguy cơ cao. Trong đó, "Early escalation" (tăng cường sớm) là chiến lược trong đó bệnh nhân được điều trị bằng một phương pháp chống huyết khối mạnh mẽ và hiệu quả ngay sau khi thực hiện PCI. Trong nghiên cứu này, thuốc ticagrelor liều thấp (Liều nạp 120mg, liều duy trì: 60mg hai lần mỗi ngày) được sử dụng kết hợp với aspirin trong giai đoạn 6 tháng sau PCI. Tăng cường sớm nhằm đảm bảo ức chế kết tập tiểu cầu đủ mạnh để ngăn ngừa huyết khối tái phát hoặc mở rộng.
"Late de-escalation" (giảm dần muộn): Trong trường hợp này, bệnh nhân chỉ sử dụng thuốc clopidogrel đơn độc sau 6 tháng sau khi can thiệp PCI, điều này khác với liệu pháp thông thường (clopidogrel cộng với aspirin trong 12 tháng). Mục đích của phương pháp này nhằm giảm nguy cơ xuất huyết và tác dụng phụ liên quan đến ức chế kết tập tiểu cầu trong thời gian dài, trong khi vẫn duy trì mức độ đủ để ngăn ngừa huyết khối.
Với cả hai chiến lược này, mục tiêu là đạt được một sự cân bằng giữa lợi ích ức chế kết tập tiểu cầu và nguy cơ xuất huyết của việc dùng thuốc điều trị cho bệnh nhân có nguy cơ cao và phức tạp sau PCI.
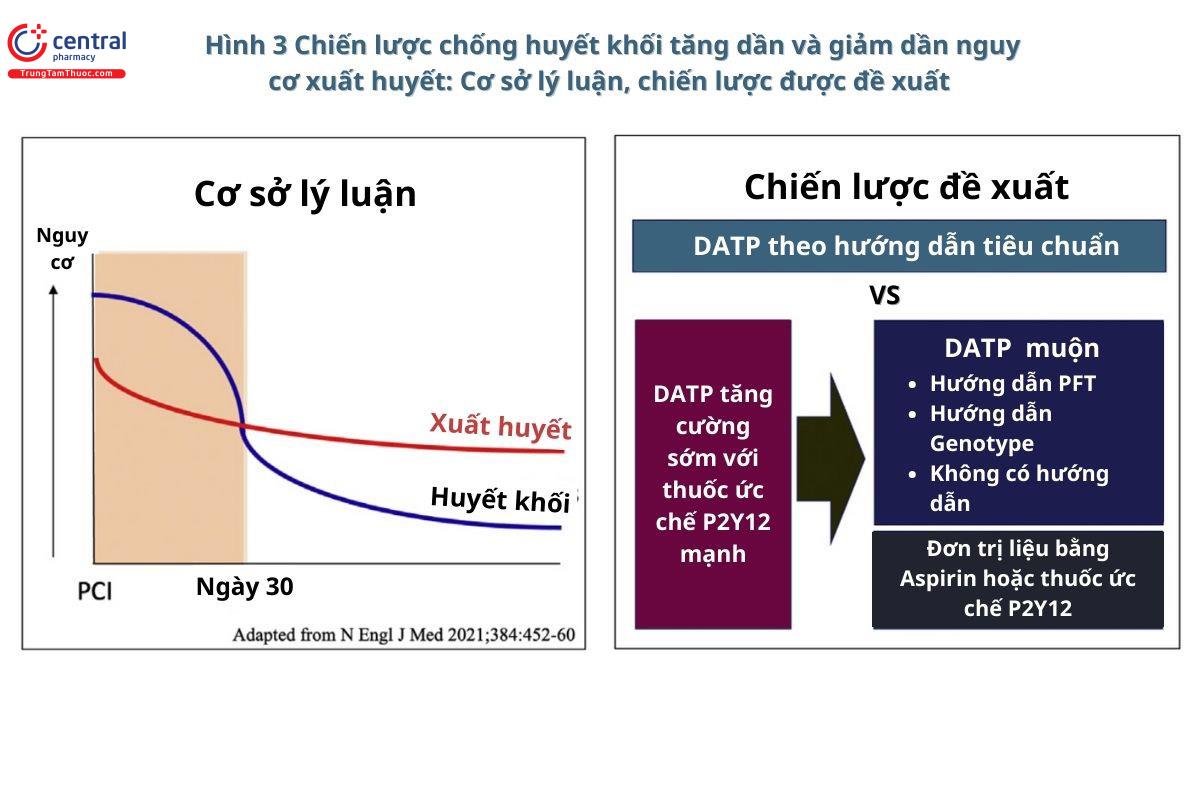
Trong giai đoạn đầu sau can thiệp mạch vành qua da (PCI), điều trị chống huyết khối tích cực thường có lợi; tuy nhiên, lợi ích này sẽ tiêu tan theo thời gian. Do đó, các chiến lược chống huyết khối tăng dần và giảm dần sau PCI đã được đề xuất. Hình bên trái được phỏng theo Rodriguez và Harrington [2]. BARC: Hiệp hội nghiên cứu học thuật xuất huyết; CHIP: PCI phức tạp có nguy cơ cao; CKD: bệnh thận mãn tính; EF: phân suất tống máu; LV: tâm thất trái; PFT: xét nghiệm chức năng tiểu cầu; các chữ viết tắt khác như trong Hình 1 và 2.
9 Cá nhân hóa khi đưa ra quyết định và lựa chọn chiến lược điều trị chống huyết khối cho bệnh nhân ASC hoặc IPC
9.1 Đánh giá điểm rủi ro ở bệnh nhân Đông Á
Trên lâm sàng, không phải tất cả bệnh nhân đều có nguy cơ xuất huyết, thiếu máu cục bộ hoặc huyết khối như nhau. Do đó, việc cá nhân hóa chiến lược chống huyết khối thường được khuyến nghị sau khi xem xét nguy cơ xuất huyết và thiếu máu cục bộ dựa trên các đặc điểm lâm sàng riêng biệt của từng bệnh nhân. Để hỗ trợ quá trình đưa ra quyết định trên lâm sàng cho từng cá nhân, các mô hình dự đoán rủi ro có thể được sử dụng. Trong thập kỷ qua, một số hệ thống tính điểm rủi ro đã được phát triển như điểm DAPT, điểm PARIS (Mô hình cho bệnh nhân đặt stent không tuân thủ phác đồ kháng kết tập tiểu cầu) và điểm PRECIS-DAPT (Dự đoán biến chứng xuất huyết ở bệnh nhân đặt stent và sử dụng liệu pháp DATP sau đó)[1]. Tuy nhiên, hầu hết các công cụ này đều bắt nguồn từ các nghiên cứu phương Tây và không đáp ứng đầy đủ đặc điểm lâm sàng và xu hướng thiếu máu cục bộ và xuất huyết khác nhau của bệnh nhân Đông Á. Vì vậy, cần có các mô hình dự đoán rủi ro áp dụng cho nhóm người này. Theo đó, điểm nguy cơ thiếu máu cục bộ và xuất huyết dành riêng cho người Đông Á gần đây đã được phát triển bao gồm điểm Asian DAPT, điểm rủi ro CREDO-Kyoto (Nghiên cứu kết quả tái can thiệp mạch vành ở Kyoto) và KAMIR-NIH DAPT (Cơ quan đăng ký nhồi máu cơ tim Hàn Quốc– điểm của Viện Y tế Quốc gia DAPT) [84, 85, 86]. Thông tin chi tiết về các thang đo này được tóm tắt trong Bảng 3.
Bảng 3. Điểm rủi ro được phát triển để ra quyết định cho DAPT ở bệnh nhân Đông Á
| Thang đo | Asian DAPT | CREDO-Kyoto | KAMIR-NIH DAPT |
|---|---|---|---|
| Năm xuất bản | 2019 | 2018 | 2021 |
| Áp dụng trên lâm sàng | Xác định thời gian sử dụng DAPT thích hợp | Dự đoán cả nguy cơ thiếu máu cục bộ và xuất huyết | Hướng dẫn lựa chọn thuốc ức chế P2Y12 mạnh ở bệnh nhân nhồi máu cơ tim cấp |
| Cơ quan xuất bản | Grand DES (cơ quan đăng ký tổng hợp đa trung tâm trên toàn quốc của Hàn Quốc về stent phủ thuốc) (n = 13.172) = | Nhóm đăng ký CREDO-Kyoto 2 | KAMIR-NIH (n = 10.687) |
| Nghiên cứu so sánh | HOST-ASSURE (n = 3,755) and NIPPON trials (n = 3,773) | RESET and NEXT trial (n = 4,669) | JAMIR dataset (n = 3,412) and SMART-DATE dataset (n = 2,712) |
| Đặc điểm người tham gia nghiên cứu | Bệnh mạch vành ổn định hoặc có ACS đang trải qua PCI | Bệnh mạch vành ổn định hoặc có ACS đang trải qua PCI | Nhồi máu cơ tim cấp |
| Kết quả thiếu máu cục bộ | Nhồi máu cơ tim hoặc nhồi máu cơ tim có ST chênh lên | Nhồi máu cơ tim hoặc nhồi máu cơ tim có ST chênh lên hoặc đột quỵ do thiếu máu cục bộ | Tử vong do biến cố tim mạch, nhồi máu cơ tim hoặc hồi máu cơ tim có ST chênh lên |
| Kết quả xuất | TIMI chảy máu nặng | GUSTO chảy máu vừa hoặc nặng | Chảy máu BARC 2, 3 và 5 |
| Hệ thống tính điểm | Nguy cơ thiếu máu cục bộ/xuất huyết | Nguy cơ thiếu máu cục bộ và xuất huyết | Nguy cơ thiếu máu cục bộ/xuất huyết |
| Số yếu tố nguy cơ | 7 yếu tố | Thiếu máu cục bộ: 8 yếu Xuất huyết: 7 yếu tố | 11 yếu tố |
Yếu tố nguy cơ cụ thể (mỗi yếu tố được gán một điểm tương ứng) | MI hoặc PCI trước đây | Biến cố huyết khối: bệnh thận mạn tính nặng, AF, PVD, thiếu máu và tuổi ≥75 tuổi, HF, DM và CTO. | Sốc tim LVEF <30%, Thiếu máu Phù phổi cấp hoặc HF mất bù STEMI AF Nhồi máu cơ tim trước đó Bệnh nhiều nhánh mạch máu Tái thông mạch máu hoàn toàn trên chụp mạch Cr >2,0 mg/dL Thuốc chống đông máu đường uống |
| Giá trị phạm vi và ngưỡng | Điểm từ -6 đến 6 Nguy cơ thiếu máu cục bộ cao hơn ≥ 1 Nguy cơ xuất huyết cao hơn ≤ -1 | Biến cố thiếu máu cục bộ: 0-12 Điểm nguy cơ huyết khối cao ≥4 Biến cố chảy máu 0-11 Điểm nguy cơ xuất huyết cao ≥3 | Điểm từ –6 đến 12 Nhóm nguy cơ thiếu máu cục bộ cao ≥3 |
AF: rung nhĩ; CKD: bệnh thận mãn tính; Cr: creatinin; CREDO-Kyoto: nghiên cứu kết quả chứng minh can thiệp tái thông mạch vành ở Kyoto; CTO: tắc toàn bộ nhiễm sắc thể; DM: đái tháo đường; GUSTO: việc sử dụng toàn cầu các chiến lược để mở các động mạch vành bị tắc; HF: suy tim; LVEF: phân suất tống máu thất trái; PVD: bệnh mạch máu ngoại biên; STEMI: nhồi máu cơ tim ST chênh lên; KAMIR-NIH: Cơ quan đăng ký nhồi máu cơ tim Hàn Quốc – Viện Y tế Quốc gia; Các chữ viết tắt khác như trong Bảng 1 và 2. | |||
Điểm Asian DAPT được phát triển để xác định thời gian sử dụng DAPT, dựa trên 13.172 bệnh nhân đã đăng ký trong cơ quan đăng ký triển vọng toàn quốc của Hàn Quốc và được xác nhận ở 7.529 bệnh nhân đăng ký vào 2 RCT từ Hàn Quốc và Nhật Bản [84ư. Điểm nguy cơ huyết khối và xuất huyết CREDO-Kyoto được phát triển để phân biệt nguy cơ thiếu máu cục bộ và xuất huyết ở dân số Nhật Bản. 85 Mặc dù điểm Asian DAPT và điểm CREDO-Kyoto cho thấy độ chính xác khiêm tốn trong việc phân tầng nguy cơ huyết khối và chảy máu, những mô hình dự đoán nguy cơ này cũng có thể hữu ích trong việc điều chỉnh thời gian DAPT sau PCI ở bệnh nhân Đông Á. Gần đây, điểm KAMIR-NIH DAPT đã được phát triển để hướng dẫn lựa chọn thuốc ức chế P2Y12 mạnh ở bệnh nhân MI cấp tính [86]. Việc xác nhận bên ngoài của công cụ này với các đoàn hệ Đông Á khác nhau mang lại chức năng phân biệt khiêm tốn và do đó sẽ cần phải có các nghiên cứu xác nhận sâu hơn với các đoàn hệ khác để xác minh hệ thống mới này.
Điểm Asian DAPT là một công cụ được phát triển để giúp xác định thời gian sử dụng DAPT (Dual Antiplatelet Therapy) dựa trên dữ liệu từ 13.172 bệnh nhân được đăng ký trong cơ quan đăng ký triển vọng toàn quốc của Hàn Quốc. Trong số này, 7.529 bệnh nhân đã được xác nhận thông qua hai nghiên cứu lâm sàng được thực hiện ở Hàn Quốc và Nhật Bản [84]. Điểm này được sử dụng để đánh giá rủi ro hình thành huyết khối và xuất huyết trong dân số Đông Á. Ngoài ra, điểm CREDO-Kyoto cũng được phát triển để phân biệt nguy cơ thiếu máu cục bộ và xuất huyết ở người dân Nhật Bản [85]. Mặc dù cả thang điểm Asian DAPT và điểm CREDO-Kyoto đều có độ chính xác hạn chế trong việc dự đoán rủi ro huyết khối và xuất huyết, nhưng các mô hình dự đoán này vẫn có thể hữu ích để điều chỉnh thời gian sử dụng DAPT sau can thiệp PCI ở bệnh nhân Đông Á.
Gần đây, điểm KAMIR-NIH DAPT đã được phát triển để hỗ trợ việc lựa chọn loại thuốc ức chế P2Y12 mạnh cho bệnh nhân trải qua cơn đau tim cấp tính [86]. Tuy nhiên, công cụ này cần được đánh giá bổ sung với các nghiên cứu khác nhau trên các quần thể Đông Á khác nhau để đảm bảo tính chính xác và đáng tin cậy của hệ thống mới này.
9.2 Đánh giá chức năng tiểu cầu và xác định trình tự gen (giải trình tự gen - genotyping)
Cho đến gần đây, hầu hết các thử nghiệm RCT về xác định chiến lược chống huyết khối dựa trên xét nghiệm chức năng tiểu cầu hoặc xác định trình tự gen (genotyping) đều không cho thấy ưu thế lâm sàng so với liệu pháp thông thường [87, 88, 89, 90].
Tuy nhiên, thử nghiệm TAILOR-PCI (Điều trị kháng kết tập tiểu cầu phù hợp sau PCI) gần đây trên 1.849 bệnh nhân mang alen CYP2C19 ∗2 hoặc ∗3 đã gợi ý rằng lựa chọn thuốc chống huyết khối dựa trên kiểu gen (chủ yếu liên quan đến điều trị bằng ticagrelor) làm giảm tỷ lệ mắc bệnh biến cố thiếu máu cục bộ so với điều trị bằng clopidogrel (HR hiệu chỉnh: 0,66; KTC 95%: 0,43-1,02; P= 0,06) [91]. Tuy nhiên lợi ích giảm biến cố thiếu máu cục bộ chỉ nổi bật trong 90 ngày đầu sau can thiệp PCI (giảm nguy cơ tuyệt đối 2,1%; KTC 95%: 1,0%-3,4%; P = 0,001). Tuy nhiên, lợi ích lâm sàng này ở bệnh nhân Đông Á tương đối thấp hơn so với bệnh nhân da trắng (giảm nguy cơ tuyệt đối: 1,5% so với 2,6%) [92]. Tuy nhiên, một phân tích tổng hợp gần đây đã chỉ ra việc lựa chọn các liệu pháp kháng tiểu cầu theo hướng dẫn này đã cải thiện cả kết cục hiệu quả tổng hợp và riêng lẻ với mức độ an toàn tốt, nhờ giảm xuất huyết nhẹ và hỗ trợ việc sử dụng xét nghiệm chức năng tiểu cầu hoặc xét nghiệm gen để đưa ra quyết định lựa chọn chiến lược chống huyết khối sau PCI [93].
10 Triển vọng và hướng phát triển trong tương lai
Các nghiên cứu, thử nghiệm đã chứng minh có sự khác biệt về nguy cơ gặp biến cố huyết khối - xuất huyết và khoảng thời gian tối ưu điều trị chống kết tập tiểu cầu ở bệnh nhân Đông Á. Cũng chính vì những khác biệt về mặt lâm sàng về khả năng sinh huyết khối và xu hướng xuất huyết nên kết quả của các thử nghiệm điều trị chống huyết khối lớn từ dân số phương Tây và hướng dẫn lâm sàng được đưa ra từ đó không được dùng để ngoại suy trực tiếp cho dân số Đông Á. Do đó, cần phải có các nghiên cứu tập trung và xây dựng sự đồng thuận/hướng dẫn mang tính đại diện cho người dân Đông Á. Ngoài ra, các công cụ dự đoán rủi ro áp dụng cho bệnh nhân Đông Á nên được phát triển để cải thiện trong thực hành lâm sàng ở những quốc gia đó. Hơn nữa, cần có các nghiên cứu quy mô lớn hơn nữa ở tất cả các nước Đông Á để xác định liệu pháp chống huyết khối tối ưu cho các biện pháp can thiệp mạch vành.
Triển vọng trong việc cá nhân hóa các liệu pháp chống huyết khối trong tương lai dựa trên các biến đổi của từng cá nhân trong gen và môi trường. Hiện tại, việc xem xét các yếu tố cá nhân như gene và môi trường đang trở nên quan trọng hơn. Trong tương lai, các liệu pháp chống huyết khối có thể được tùy chỉnh hơn thông qua việc tích hợp đánh giá rủi ro lâm sàng cá nhân hóa, có thể bao gồm cả xét nghiệm in vitro về tình trạng huyết khối và phân tích gen [94].
Trong bối cảnh này, các nghiên cứu trong tương lai sẽ đánh giá các chiến lược điều trị kháng tiểu cầu cá nhân hóa dựa trên kiểu hình hoặc kiểu gen, nhằm tối ưu hóa liệu pháp chống huyết khối ở cấp độ cá nhân. Việc nghiên cứu và áp dụng các phương pháp cá nhân hóa này sẽ đem lại cơ hội để điều chỉnh liệu pháp chống huyết khối theo từng cá nhân, đảm bảo tối ưu hóa lợi ích và giảm thiểu rủi ro, đặc biệt là trong quần thể Đông Á [95].
11 Khuyến nghị chiến lược điều trị chống huyết khối cho bệnh nhân Đông Á
Xem xét khả năng sinh huyết khối thấp, xu hướng xuất huyết cao hơn và khoảng thời gian điều trị khác nhau ở bệnh nhân Đông Á so với dân tộc phương Tây, các tác giả đã đưa ra đề xuất về các chiến lược sử dụng thuốc kháng kết tập tiểu cầu cho bệnh nhân Đông Á dựa trên các yếu tố đó (Bảng 4 và 5).
Khuyến nghị này sẽ hữu ích để tạo điều kiện thuận lợi cho việc đưa ra quyết định và đánh giá lâm sàng tối ưu trong thực hành lâm sàng hàng ngày. Một phác đồ chống huyết khối phù hợp với liều lượng thích hợp để cân bằng nguy cơ thiếu máu cục bộ và nguy cơ xuất huyết nên được xem xét tùy theo tình trạng lâm sàng của từng bệnh nhân.
Bảng 4 Chiến lược chống huyết khối cho bệnh nhân Đông Á theo nguy cơ xuất huyết và thiếu máu cục bộ
| Tình huống lâm sàng | Cách tiếp cận mặc định | Nguy cơ chảy máu cao | Lựa chọn thuốc sau thời gian sử dụng DAPT | ||
|---|---|---|---|---|---|
| Thời gian sử dụng DATP | Thuốc chống kết tập tiểu cầu | Thời gian sử dụng DATP | Thuốc chống kết tập tiểu cầu | ||
| Đau thắt ngực ổn định | 3-6 tháng | Aspirin + Clopidogrel | 1-3 tháng | Aspirin + Clopidogrel | Clopidogrel |
| Hội chứng mạch vành cấp (ASC) | 6-12 tháng | Aspirin + Prasugrel 3,75 hoặc 5 mg (hoặc Ticagrelor giảm liều) | 3-6 tháng | Aspirin + Clopidogrel | Clopidogrel |
Yêu cầu dùng thuốc chống đông đường uống | 1 tuần a | Aspirin + Clopidogrel + DOAC và sau đó, Clopidogrel + DOAC lên đến 12 tháng | Cho đến khi xuất viện (1 đến 2 ngày) | Aspirin + Clopidogrel + DOAC và sau đó, clopidogrel + DOAC lên tới 3-6 tháng | DOAC đơn thuần sau liệu pháp kép |
CHIP (hoặc nguy cơ thiếu máu cục bộ cao) | 6-12 tháng | Aspirin + Thuốc ức chế P2Y12 mạnh (giảm liều) |
|
| Tiếp tục liệu DAPT hoặc đơn trị liệu bằng thuốc ức chế P2Y12 mạnh |
| CHIP = thủ thuật/bệnh nhân có nguy cơ cao và được chỉ định phức tạp; DOAC = thuốc chống đông đường uống trực tiếp; các chữ viết tắt khác như trong Bảng 1. | |||||
Bảng 5 Những cân nhắc cụ thể cho bệnh nhân Đông Á theo nguy cơ chảy máu và thiếu máu cục bộ
| Vấn đề | Cân nhắc |
|---|---|
| Đánh giá điểm rủi ro ở bệnh nhân Đông Á | Để xác định thời gian sử dụng DAPT hoặc thuốc ức chế P2Y12, có thể xem xét điểm rủi ro để phân loại nguy cơ xuất huyết và huyết khối phát triển từ dân số Đông Á |
| Đánh giá chức năng tiểu cầu và xác định trình tự gen | Việc sử dụng xét nghiệm đánh giá và phân tích gen không được khuyến khích để điều chỉnh các chiến lược sử dụng thuốc kháng kết tập tiểu cầu; tuy nhiên, chúng có thể được xem xét ở những bệnh nhân Đông Á có nguy cơ cao bị biến chứng huyết khối hoặc xuất huyết. |
| Sử dụng thuốc ức chế bơm proton PPI | Các thuốc bảo vệ đường tiêu hóa (ví dụ PPI hoặc thuốc đối kháng thụ thể H2) có thể được xem xét sử dụng thường xuyên ở bệnh nhân Đông Á và thuốc PPI nên được kê đơn ở những bệnh nhân có tiền sử xuất huyết tiêu hóa hoặc ở những người có nguy cơ cao xuất huyết tiêu hóa |
12 Kết luận
Thông qua những nỗ lực nghiên cứu, xu hướng thiếu máu cục bộ và xuất huyết đặc trưng của bệnh nhân Đông Á, hay được gọi là “nghịch lý Đông Á”, đã trở nên rõ ràng, từ đó, các chiến lược chống huyết khối phù hợp với từng chủng tộc, khu vực đã xuất hiện.
Dựa trên bằng chứng tích lũy từ nhiều thử nghiệm RCT, có thể thấy thời gian sử dụng DAPT ngắn (chẳng hạn từ 3 đến 6 tháng sau ACS hoặc PCI)) được chứng minh có tính khả thi và thời gian sử dụng DAPT ngắn hơn nữa (tức là 1 tháng) có thể là một lựa chọn thích hợp cho một số người Đông Á có nguy cơ xuất huyết cao.
Một số thử nghiệm RCT đã liên tục chỉ ra rằng việc sử dụng các thuốc ức chế P2Y12 mạnh như prasugrel và ticagrelor ở liều tiêu chuẩn cần thận trọng hơn ở bệnh nhân Đông Á do nguy cơ biến chứng xuất huyết cao hơn. Các thử nghiệm RCT gần đây từ các nước Đông Á cho thấy chiến lược giảm liều với các thuốc này là phù hợp và tuy nhiên vẫn cần phải nghiên cứu thêm. Ngoài ra, các chiến lược được sửa đổi như phương pháp DATP thay thế (escalation or de-escalation protocols - tăng cường sớm hay giảm dần muộn) đã cung cấp những cách tiếp cận mới đáng kể. Trong thực hành lâm sàng hàng ngày, các bác sĩ nên đánh giá toàn diện nguy cơ thiếu máu cục bộ và xuất huyết của từng bệnh nhân và điều chỉnh chiến lược chống huyết khối cho phù hợp. Cuối cùng, những hiểu biết về sự khác biệt và đặc điểm riêng của dân số Đông Á cùng với điều chỉnh liệu pháp chống huyết khối phù hợp sẽ mang lại lợi ích lâm sàng tối đa cho bệnh nhân mắc hội chứng mạch vành cấp (ACS) hoặc những người tiếp nhận can thiệp mạch vành qua da (PCI).
13 Tài liệu tham khảo
1. Cao D, Chandiramani R, Chiarito M, Claessen BE, Mehran R. Evolution of antithrombotic therapy in patients undergoing percutaneous coronary intervention: a 40-year journey. Eur Heart J. 2021;42:339–351.
2. Rodriguez F, Harrington RA. Management of antithrombotic therapy after acute coronary syndromes. N Engl J Med. 2021;384:452–460.
3. East Asia. Wikipedia. Accessed October 19, 2021. https://en.wikipedia.org/wiki/East_Asia/
4. Kim HK, Tantry US, Smith SC Jr, et al. The East Asian paradox: an updated position
statement on the challenges to the current antithrombotic strategy in patients with cardiovascular disease. Thromb Haemost. 2021;121:422–432.
5. Kang J, Park KW, Palmerini T, et al. Racial differences in ischaemia/bleeding risk trade-off during anti-platelet therapy: individual patient level landmark meta-analysis from seven RCTs. Thromb Haemost. 2019;119:149–162.
6. Saito S, Isshiki T, Kimura T, et al. Efficacy and safety of adjusted-dose prasugrel compared with clopidogrel in Japanese patients with acute coronary syndrome: the PRASFIT-ACS study. Circ J. 2014;78:1684–1692.
7. Goto S, Huang CH, Park SJ, Emanuelsson H, Kimura T. Ticagrelor vs clopidogrel in Japanese, Korean and Taiwanese patients with acute coronary syndrome — randomized, double-blind, phase III PHILO study. Circ J. 2015;79:2452–2460.
8. Park DW, Kwon O, Jang JS, et al. Clinically significant bleeding with ticagrelor versus clopidogrel in Korean patients with acute coronary syndromes intended for invasive management: a randomized clinical trial. Circulation. 2019;140: 1865–1877.
9. Lev EI, Bliden KP, Jeong YH, et al. Influence of race and sex on thrombogenicity in a large cohort of coronary artery disease patients. J Am Heart Assoc. 2014;3:e001167.
10. Shen AY, Yao JF, Brar SS, Jorgensen MB, Chen W. Racial/ethnic differences in the risk of intracranial hemorrhage among patients with atrial fibrillation. J Am Coll Cardiol. 2007;50:309– 315.
11. Shinohara Y. Regional differences in incidence and management of stroke — is there any difference between Western and Japanese guidelines on antiplatelet therapy? Cerebrovasc Dis. 2006;21(suppl 1):17–24.
12. Mak KH, Bhatt DL, Shao M, et al. Ethnic variation in adverse cardiovascular outcomes and bleeding complications in the Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance (CHARISMA) study. Am Heart J. 2009; 157: 658 – 665.
13. Kumar RS, Douglas PS, Peterson ED, et al. Effect of race and ethnicity on outcomes with drugeluting and bare metal stents: results in 423,965 patients in the linked National Cardiovascular Data Registry and Centers for Medicare & Medicaid Services payer databases. Circulation. 2013;127: 1395–1403.
14. Park DW, Yun SC, Lee SW, et al. Stent thrombosis, clinical events, and influence of prolonged clopidogrel use after placement of drug-eluting stent data from an observational cohort study of drug-eluting versus bare-metal stents. J Am Coll Cardiol Intv. 2008;1:494–503.
15. Kimura T, Morimoto T, Nakagawa Y, et al. Antiplatelet therapy and stent thrombosis after sirolimus-eluting stent implantation. Circulation. 2009;119:987–995.
16. Daemen J, Wenaweser P, Tsuchida K, et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large twoinstitutional cohort study. Lancet. 2007;369: 667–678.
17. Yusuf S, Zhao F, Mehta SR, et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without STsegment elevation. N Engl J Med. 2001;345: 494–502.
18. Mehta SR, Yusuf S, Peters RJ, et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet. 2001;358:527–533.
19. Scott SA, Sangkuhl K, Stein CM, et al. Clinical Pharmacogenetics Implementation Consortium guidelines for CYP2C19 genotype and clopidogrel therapy: 2013 update. Clin Pharmacol Ther. 2013;94:317–323.
20. Gan XD, Wei BZ, Fang D, et al. Efficacy and safety analysis of new P2Y12 inhibitors versus clopidogrel in patients with percutaneous coronary intervention: a meta-analysis. Curr Med Res Opin. 2015;31:2313–2323.
21. Levine GN, Jeong YH, Goto S, et al. Expert consensus document: World Heart Federation expert consensus statement on antiplatelet therapy in East Asian patients with ACS or undergoing PCI. Nat Rev Cardiol. 2014;11:597–606.
22. Kim IS, Jeong YH, Tantry US, et al. Relation between the vasodilator-stimulated phosphoprotein phosphorylation assay and light transmittance aggregometry in East Asian patients after highdose clopidogrel loading. Am Heart J. 2013;166: 95–103.
23. Aradi D, Storey RF, Komocsi A, et al. Expert position paper on the role of platelet function testing in patients undergoing percutaneous coronary intervention. Eur Heart J. 2014;35:209–215.
24. Tantry US, Bonello L, Aradi D, et al. Consensus and update on the definition of on-treatment platelet reactivity to Adenosine diphosphate associated with ischemia and bleeding. J Am Coll Cardiol. 2013;62:2261–2273.
25. Ko YG, Suh JW, Kim BH, et al. Comparison of 2 point-of-care platelet function tests, VerifyNow Assay and Multiple Electrode Platelet Aggregometry, for predicting early clinical outcomes in patients undergoing percutaneous coronary intervention. Am Heart J. 2011;161:383–390.
26. Jeong YH. “East asian paradox”: challenge for the current antiplatelet strategy of “oneguideline-fits-all races” in acute coronary syndrome. Curr Cardiol Rep. 2014;16:485.
27. Kwon TJ, Tantry US, Park Y, et al. Influence of platelet reactivity on BARC classification in East Asian patients undergoing percutaneous coronary intervention. Results of the ACCEL-BLEED study. Thromb Haemost. 2016;115:979–992.
28. Kim HK, Tantry US, Park HW, et al. Ethnic difference of thrombogenicity in patients with cardiovascular disease: a pandora box to explain prognostic differences. Korean Circ J. 2021;51: 202–221.
29. Lutsey PL, Cushman M, Steffen LM, et al. Plasma hemostatic factors and endothelial markers in four racial/ethnic groups: the MESA study. J Thromb Haemost. 2006;4:2629–2635.
30. Ye Z, Liu EH, Higgins JP, et al. Seven haemostatic gene polymorphisms in coronary disease: meta-analysis of 66,155 cases and 91,307 controls. Lancet. 2006;367:651–658.
31. Huo Y, Jeong Y-H, Gong Y, et al. 2018 update of expert consensus statement on antiplatelet therapy in East Asian patients with ACS or undergoing PCI. Science Bulletin. 2019;64:166–179.
32. Nordmann AJ, Briel M, Bucher HC. Mortality in randomized controlled trials comparing drugeluting vs. bare metal stents in coronary artery disease: a meta-analysis. Eur Heart J. 2006;27: 2784–2814.
33. Camenzind E, Steg PG, Wijns W. Stent thrombosis late after implantation of first-generation drug-eluting stents: a cause for concern. Circulation. 2007;115:1440–1455. discussion 1455.
34. Ellis SG, Colombo A, Grube E, et al. Incidence, timing, and correlates of stent thrombosis with the polymeric paclitaxel drug-eluting stent: a TAXUS II, IV, V, and VI meta-analysis of 3,445 patients followed for up to 3 years. J Am Coll Cardiol. 2007;49:1043–1051.
35. Giustino G, Baber U, Sartori S, et al. Duration of dual antiplatelet therapy after drug-eluting stent implantation: a systematic review and meta-analysis of randomized controlled trials. J Am Coll Cardiol. 2015;65:1298–1310.
36. Park SJ, Park DW, Kim YH, et al. Duration of dual antiplatelet therapy after implantation of drug-eluting stents. N Engl J Med. 2010;362:1374–1382.
37. Lee CW, Ahn JM, Park DW, et al. Optimal duration of dual antiplatelet therapy after drugeluting stent implantation: a randomized, controlled trial. Circulation. 2014;129:304–312.
38. Gwon HC, Hahn JY, Park KW, et al. Six-month versus 12-month dual antiplatelet therapy after implantation of drug-eluting stents: the Efficacy of Xience/Promus Versus Cypher to Reduce Late Loss After Stenting (EXCELLENT) randomized, multicenter study. Circulation. 2012;125:505–513.
39. Kim BK, Hong MK, Shin DH, et al. A new strategy for discontinuation of dual antiplatelet therapy: the RESET Trial (REal Safety and Efficacy of 3-month dual antiplatelet Therapy following Endeavor zotarolimus-eluting stent implantation). J Am Coll Cardiol. 2012;60:1340–1348.
40. Hong S-J, Shin D-H, Kim J-S, et al. 6-month versus 12-month dual-antiplatelet therapy following long everolimus-eluting stent implantation. J Am Coll Cardiol Intv. 2016;9:1438–1446.
41. Nakamura M, Iijima R, Ako J, et al. Dual antiplatelet therapy for 6 versus 18 months after biodegradable polymer drug-eluting stent implantation. J Am Coll Cardiol Intv. 2017;10:1189–1198.
42. Hahn JY, Song YB, Oh JH, et al. 6-month versus 12-month or longer dual antiplatelet therapy after percutaneous coronary intervention in patients with acute coronary syndrome (SMARTDATE): a randomised, open-label, non-inferiority trial. Lancet. 2018;391:1274–1284.
43. Hahn JY, Song YB, Oh JH, et al. Effect of P2Y12 inhibitor monotherapy vs dual antiplatelet therapy on cardiovascular events in patients undergoing percutaneous coronary intervention: the SMART-CHOICE randomized clinical trial. JAMA. 2019;321:2428–2437.
44. Watanabe H, Domei T, Morimoto T, et al. Effect of 1-month dual antiplatelet therapy followed by clopidogrel vs 12-month dual antiplatelet therapy on cardiovascular and bleeding events in patients receiving PCI: the STOPDAPT-2 randomized clinical trial. JAMA. 2019;321:2414–2427.
45. Watanabe H. STOPDAPT-2 ACS: one-month dual antiplatelet therapy followed by clopidogrel monotherapy in acute coronary syndrome. Paper presented at: European Society of Cardiology Congress 2021 the digital experience; August 31, 2021; London, United Kingdom.
46. Palmerini T, Benedetto U, Biondi-Zoccai G, et al. Long-term safety of drug-eluting and baremetal stents: evidence from a comprehensive network meta-analysis. J Am Coll Cardiol. 2015;65: 2496–2507.
47. Koskinas KC, Nakamura M, Raber L, et al. Current use of intracoronary imaging in interventional practice — results of a European Association of Percutaneous Cardiovascular Interventions (EAPCI) and Japanese Association of Cardiovascular Interventions and Therapeutics (CVIT) Clinical Practice Survey. Circ J. 2018;82:1360–1368.
48. Koo BK, Kang J, Park KW, et al. Aspirin versus clopidogrel for chronic maintenance monotherapy after percutaneous coronary intervention (HOSTEXAM): an investigator-initiated, prospective, randomised, open-label, multicentre trial. Lancet. 2021;397(10293):2487–2496.
49. Wiviott SD, Braunwald E, McCabe CH, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2007;357: 2001–2015.
50. Wallentin L, Becker RC, Budaj A, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009;361: 1045–1057.
51. Camarero TG, de la Torre Hernandez JM. Antithrombotic treatment after coronary intervention: agreement and controversy. Eur Cardiol. 2020;15:1–8.
52. Levine GN, Bates ER, Bittl JA, et al. 2016 ACC/ AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. J Am Coll Cardiol. 2016;68:1082–1115.
53. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: the task force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39:213–260.
54. Teng R, Butler K. Pharmacokinetics, pharmacodynamics, and tolerability of single and multiple doses of ticagrelor in Japanese and Caucasian volunteers. Int J Clin Pharmacol Ther. 2014;52:478–491.
55. Li J, Tang W, Storey RF, Husted S, Teng R. Population pharmacokinetics of ticagrelor in patients with acute coronary syndromes. Int J Clin Pharmacol Ther. 2016;54:666–674.
56. Park DW, Lee PH, Jang S, et al. Effect of lowdose versus standard-dose ticagrelor and clopidogrel on platelet inhibition in acute coronary syndromes. J Am Coll Cardiol. 2018;71:1594–1595.
57. Bonaca MP, Bhatt DL, Cohen M, et al. Longterm use of ticagrelor in patients with prior myocardial infarction. N Engl J Med. 2015;372: 1791–1800.
58. Goto S. Global trial or local one? Circulation. 2019;140:1878–1880.
59. Vranckx P, Valgimigli M, Juni P, et al. Ticagrelor plus aspirin for 1 month, followed by ticagrelor monotherapy for 23 months vs aspirin plus clopidogrel or ticagrelor for 12 months, followed by aspirin monotherapy for 12 months after implantation of a drug-eluting stent: a multicentre, open-label, randomised superiority trial. Lancet. 2018;392:940–949.
60. Mehran R, Baber U, Sharma SK, et al. Ticagrelor with or without aspirin in high-risk patients after PCI. N Engl J Med. 2019;381:2032–2042.
61. Kim BK, Hong SJ, Cho YH, et al. Effect of ticagrelor monotherapy vs ticagrelor with aspirin on major bleeding and cardiovascular events in patients with acute coronary syndrome: the TICO randomized clinical trial. JAMA. 2020;323:2407– 2416.
62. Steg PG, Bhatt DL. Is there really a benefit to net clinical benefit in testing antithrombotics? Circulation. 2018;137:1429–1431.
63. Small DS, Kothare P, Yuen E, et al. The pharmacokinetics and pharmacodynamics of prasugrel in healthy Chinese, Japanese, and Korean subjects compared with healthy Caucasian subjects. Eur J Clin Pharmacol. 2010;66:127–135.
64. Yokoi H, Kimura T, Isshiki T, Ogawa H, Ikeda Y. Pharmacodynamic assessment of a novel P2Y12 receptor antagonist in Japanese patients with coronary artery disease undergoing elective percutaneous coronary intervention. Thromb Res. 2012;129:623–628.
65. Jeong YH, Oh JH, Yoon HJ, et al. Pharmacodynamic profile and prevalence of bleeding episode in East Asian patients with acute coronary syndromes treated with prasugrel standard-dose versus de-escalation strategy: a randomized AMATCH trial. Thromb Haemost. 2021;121(10):1376–1386.
66. Menichelli M, Neumann FJ, Ndrepepa G, et al. Age- and weight-adapted dose of prasugrel versus standard dose of ticagrelor in patients with acute coronary syndromes : results from a randomized trial. Ann Intern Med. 2020;173:436–444.
67. Isshiki T, Kimura T, Ogawa H, et al. Prasugrel, a third-generation P2Y12 receptor antagonist, in patients with coronary artery disease undergoing elective percutaneous coronary intervention. Circ J. 2014;78:2926–2934.
68. Nakamura M, Kimura K, Kimura T, et al. JCS 2020 guideline focused update on antithrombotic therapy in patients with coronary artery disease. Circ J. 2020;84:831–865.
69. Kim HS, Kang J, Hwang D, et al. Prasugrelbased de-escalation of dual antiplatelet therapy after percutaneous coronary intervention in patients with acute coronary syndrome (HOST-REDUCE-POLYTECH-ACS): an open-label, multicentre, non-inferiority randomised trial. Lancet. 2020;396:1079–1089.
70. Angiolillo DJ, Goodman SG, Bhatt DL, et al. Antithrombotic therapy in patients with atrial fibrillation treated with oral anticoagulation undergoing percutaneous coronary intervention: a North American perspective — 2018 update. Circulation. 2018;138:527–536.
71. Hansen ML, Sorensen R, Clausen MT, et al. Risk of bleeding with single, dual, or triple therapy with warfarin, aspirin, and clopidogrel in patients with atrial fibrillation. Arch Intern Med. 2010;170:1433–1441.
72. Choi HI, Ahn JM, Kang SH, et al. Prevalence, management, and long-term (6-year) outcomes of atrial fibrillation among patients receiving drugeluting coronary stents. J Am Coll Cardiol Intv. 2017;10:1075–1085.
73. Eyileten C, Postula M, Jakubik D, et al. Non–vitamin K oral anticoagulants (NOAC) versus vitamin K antagonists (VKA) for atrial fibrillation with elective or urgent percutaneous coronary intervention: a meta-analysis with a particular focus on combination type. J Clin Med. 2020;9(4):1120.
74. Angiolillo DJ, Bhatt DL, Cannon CP, et al. Antithrombotic therapy in patients with atrial fibrillation treated with oral anticoagulation undergoing percutaneous coronary intervention: a North American perspective: 2021 update. Circulation. 2021;143:583–596.
75. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021;42:373–498.
76. Matsumura-Nakano Y, Shizuta S, Komasa A, et al. Open-label randomized trial comparing oral anticoagulation with and without single antiplatelet therapy in patients with atrial fibrillation and stable coronary artery disease beyond 1 year after coronary stent implantation. Circulation. 2019;139:604–616.
77. Yasuda S, Kaikita K, Akao M, et al. Antithrombotic therapy for atrial fibrillation with stable coronary disease. N Engl J Med. 2019;381:1103–1113.
78. Urban P, Mehran R, Colleran R, et al. Defining high bleeding risk in patients undergoing percutaneous coronary intervention. Circulation. 2019;140:240–261.
79. Natsuaki M, Morimoto T, Shiomi H, et al. Application of the academic research consortium high bleeding risk criteria in an allcomers registry of percutaneous coronary intervention. Circ Cardiovasc Interv. 2019;12:e008307.
80. Ariotti S, Adamo M, Costa F, et al. Is baremetal stent implantation still justifiable in high bleeding risk patients undergoing percutaneous coronary intervention?: a pre-specified analysis from the ZEUS trial. J Am Coll Cardiol Intv. 2016;9:426–436.
81. Windecker S, Latib A, Kedhi E, et al. Polymerbased or polymer-free stents in patients at high bleeding risk. N Engl J Med. 2020;382:1208–1218.
82. Valgimigli M, Frigoli E, Heg D, et al. Dual antiplatelet therapy after PCI in patients at high bleeding risk. N Engl J Med. 2021;385(18):1643–1655.
83. Kirtane AJ, Doshi D, Leon MB, et al. Treatment of higher-risk patients with an indication for revascularization: evolution within the field of contemporary percutaneous coronary intervention. Circulation. 2016;134:422–431.
84. Kang J, Park KW, Ki YJ, et al. Development and validation of an ischemic and bleeding risk evaluation tool in East Asian patients receiving percutaneous coronary intervention. Thromb Haemost. 2019;119:1182–1193.
85. Natsuaki M, Morimoto T, Yamaji K, et al. Prediction of thrombotic and bleeding events after percutaneous coronary intervention: CREDO-Kyoto thrombotic and bleeding risk scores. J Am Heart Assoc. 2018;7(11):e008708.
86. Lee SH, Kim HK, Jeong MH, et al. Practical guidance for P2Y12 inhibitors in acute myocardial infarction undergoing percutaneous coronary intervention. Eur Heart J Cardiovasc Pharmacother. 2021;7:112–124.
87. Price MJ, Berger PB, Teirstein PS, et al. Standard- vs high-dose clopidogrel based on platelet function testing after percutaneous coronary intervention: the GRAVITAS randomized trial. JAMA. 2011;305:1097–1105.
88. Trenk D, Stone GW, Gawaz M, et al. A randomized trial of prasugrel versus clopidogrel in patients with high platelet reactivity on clopidogrel after elective percutaneous coronary intervention with implantation of drug-eluting stents: results of the TRIGGER-PCI (Testing Platelet Reactivity In Patients Undergoing Elective Stent Placement on Clopidogrel to Guide Alternative Therapy With Prasugrel) study. J Am Coll Cardiol. 2012;59:2159–2164.
89. Collet JP, Cuisset T, Range G, et al. Bedside monitoring to adjust antiplatelet therapy for coronary stenting. N Engl J Med. 2012;367:2100–2109.
90. Cayla G, Cuisset T, Silvain J, et al. Platelet function monitoring to adjust antiplatelet therapy in elderly patients stented for an acute coronary syndrome (ANTARCTIC): an open-label, blinded endpoint, randomised controlled superiority trial. Lancet. 2016;388:2015–2022.
91. Pereira NL, Farkouh ME, So D, et al. Effect of genotype-guided oral P2Y12 inhibitor selection vs conventional clopidogrel therapy on ischemic outcomes after percutaneous coronary intervention: the TAILOR-PCI randomized clinical trial. JAMA. 2020;324:761–771.
92. Goodman CW, Brett AS. Race and pharmacogenomics-personalized medicine or misguided practice? JAMA. 2021;325:625–626.
93. Galli M, Benenati S, Capodanno D, et al. Guided versus standard antiplatelet therapy in patients undergoing percutaneous coronary intervention: a systematic review and meta-analysis. Lancet. 2021;397:1470–1483.
94. Gorog DA, Geisler T. Platelet inhibition in acute coronary syndrome and percutaneous coronary intervention: insights from the past and present. Thromb Haemost. 2020;120:565– 578.
95. Claassens DM, Ten Berg JM. Genotypeguided treatment of oral P2Y12 inhibitors: where do we stand? Pharmacogenomics. 2020;21:83–86.

