Điều trị bằng kháng sinh theo kinh nghiệm trong viêm phổi mắc phải cộng đồng

Trungtamthuoc.com - Điều trị bằng kháng sinh theo kinh nghiệm đối với bệnh viêm phổi mắc phải tại cộng đồng và độ chính xác đối với Legionella pneumophila, Mycoplasma pneumoniae và Clamydophila pneumoniae: Một nghiên cứu cắt ngang mô tả trên bệnh nhân người lớn ở khoa cấp cứu.
Empirical antibiotic treatment for community-acquired pneumonia and accuracy for Legionella pneumophila, Mycoplasma pneumoniae, and Clamydophila pneumoniae: A descriptive cross-sectional study of adult patients in the emergency department.
BMC Infectious Diseases
Morten Hjarnø Lorentzen
Flemming Schønning Rosenvinge
Annmarie Touborg Lassen
Ole Graumann
Christian B. Laursen
Christian Backer Mogensen
Helene Skjøt Arkil
Người dịch: BS. Nguyễn Thiên Thạch. Tải bản dịch PDF tại đây.
1 Tổng quan
1.1 Cơ sở nghiên cứu
Có nhiều yếu tố quyết định việc điều trị bằng kháng sinh theo kinh nghiệm đối với bệnh viêm phổi mắc phải tại cộng đồng (CAP). Mục đích của nghiên cứu là mô tả phương pháp điều trị bằng kháng sinh theo kinh nghiệm cho bệnh nhân mắc CAP nhập viện cấp tính và xác định xem liệu rằng điều trị hiện tại có bao phủ cụ thể và đầy đủ nhóm tác nhân Legionella pneumophila, Mycoplasma pneumoniae và Clamydophil pneumoniae (LMC) hay không.
1.2 Phương pháp nghiên cứu
Một nghiên cứu mô tả cắt ngang, đa trung tâm trên tất cả người trưởng thành đến bệnh viện ở Khu vực Nam Đan Mạch trong khoảng thời gian từ tháng 1 năm 2016 đến tháng 3 năm 2018 đã được thực hiện. Sử dụng hồ sơ bệnh án, nghiên cứu đã xác định lại phương pháp điều trị bằng kháng sinh theo kinh nghiệm và tác nhân vi sinh đối với bệnh nhân CAP. Những bệnh nhân CAP được điều trị thuốc kháng sinh trong vòng 24 giờ sau khi nhập viện và nhóm vi khuẩn đã được phân lập. Từ đó, dựa vào điều trị bằng kháng sinh theo kinh nghiệm được chỉ định trước đó và khả năng bao phủ nhóm LMC đã được xác định bằng phân lập tác nhân vi sinh.
1.3 Kết quả nghiên cứu
Trong số 19.133 bệnh nhân được chẩn đoán CAP, có 1590 bệnh nhân (8,3%) được đưa vào nghiên cứu này. Piperacillin-tazobactam và Penicillin nhạy Beta-lactamase là nhóm thuốc kháng sinh theo kinh nghiệm được chỉ định phổ biến nhất, lần lượt là 515 (32%) và 388 (24%). Phân tích nghiên cứu cho thấy 42 (37%, 95% CI: 28-47%) trong số 113 bệnh nhân bị viêm phổi do LMC được chỉ định kháng sinh có độ bao phủ LMC và 42 (12%, 95% CI: 8-15%) trong số 364 bệnh nhân được chỉ định kháng sinh có độ bao phủ LMC có nhiễm LMC.
1.4 Kết luận
Piperacillin-tazobactam, một loại kháng sinh phổ rộng được khuyên dùng cho các trường hợp nhiễm trùng tác nhân không điển hình, là phương pháp điều trị CAP thường xuyên nhất. Ngoài ra, độ chính xác của điều trị bằng kháng sinh kinh nghiệm hiện nay đối với bệnh viêm phổi do LMC là thấp. Do đó, nghiên cứu trong tương lai nên tập trung vào các xét nghiệm chẩn đoán nhanh để xác định tác nhân gây bệnh và xét nghiệm vi sinh chính xác.
Từ khóa: Viêm phổi, CAP, điều trị kháng sinh theo kinh nghiệm, Legionella, Nhiễm trùng.
2 Cơ sở nghiên cứu
Viêm phổi mắc phải tại cộng đồng (CAP) là một trong những bệnh nhiễm trùng phổ biến nhất ở bệnh nhân tại khoa cấp cứu và có tỷ lệ tử vong cao trên toàn thế giới [1, 2]. Trên toàn cầu, tỷ lệ mắc CAP hằng năm ở người lớn được ước tính là từ 1,5 đến 14,0 trên 1000 người, với tỷ lệ tử vong ngắn hạn đối với bệnh nhân nhập viện là từ 4 đến 18% [3]. Các tác nhân CAP thường gặp nhất, Streptococcus pneumoniae và Haemophilusenzae, thường đáp ứng với kháng sinh beta-lactam phổ hẹp như Benzylpenicillin ở các quốc gia có tỷ lệ kháng penicillin thấp [4, 5]. Các mầm bệnh CAP khác như Legionella pneumophila, Mycoplasma pneumoniae và Clamydophila pneumoniae (LMC) không phổ biến, hiếm khi gây viêm phổi nặng và có thể được điều trị bằng macrolide hoặc quinolone [5, 6].
Việc sử dụng bừa bãi các loại kháng sinh như macrolide và quinolone là vấn đề đáng lo ngại. Thứ nhất, chúng là nguyên nhân gây ra vấn đề kháng kháng sinh (AMR) ngày càng gia tăng trên toàn thế giới [7, 8]. WHO đã phân loại AMR là mối đe dọa lớn toàn cầu và các kháng sinh như Cephalosporin thế hệ thứ ba, macrolide, fluoroquinolones, piperacillin/tazobactam và amoxicillin/axit clavulanic là những kháng sinh quan trọng đối với con người, vì vậy nên hạn chế sử dụng khi không cần thiết để tránh tình trạng kháng thuốc. Thứ hai, những loại kháng sinh này có liên quan đến các tác dụng phụ nghiêm trọng, ví dụ như nhiễm trùng Clostridium difficile, nhiễm độc tim và gây quái thai [9-12].
Tác nhân vi sinh hiếm khi được biết khi bệnh nhân được điều trị nghi ngờ CAP, và việc điều trị bằng kháng sinh theo kinh nghiệm nên được điều chỉnh theo dịch tễ học địa phương và mô hình AMR [2]. Các khuyến cáo trong nghiên cứu này dựa trên điểm mức độ nặng khác nhau như chỉ số mức độ nặng của Viêm phổi (PSI), CRB-65 và CURB-65 [13]. Vương quốc Anh, Đức và Đan Mạch sử dụng phương pháp tính điểm mức độ nặng theo CRB-65/CURB-65 để hướng dẫn điều trị bằng kháng sinh theo kinh nghiệm cho CAP [13-16]. Những hướng dẫn này khuyến cáo sử dụng penicillin, chẳng hạn như benzylpenicillin và amoxicillin, cho những bệnh nhân có điểm CURB-65 thấp. Đối với những bệnh nhân có điểm CURB-65 cao, các hướng dẫn khuyến cáo nên sử dụng biện pháp phòng ngừa đối với tác nhân LMC. Tuy nhiên, tác nhân LMC ít phổ biến ở những bệnh nhân có điểm CURB-65 cao [17, 18]. Ngoài ra, các yếu tố như bệnh đi kèm, điều trị bằng kháng sinh trước đó, tình trạng kháng thuốc tại địa phương, địa điểm điều trị, nguồn cung cấp kháng sinh cũng như kiến thức và sự tuân thủ hướng dẫn của bác sĩ điều trị đều ảnh hưởng đến việc lựa chọn điều trị bằng kháng sinh theo kinh nghiệm [19-21]. Mặc dù có nhiều yếu tố quyết định việc điều trị bằng kháng sinh theo kinh nghiệm đối với CAP và tình trạng đề kháng kháng sinh ngày càng tăng trên toàn thế giới, chúng tôi tìm thấy rất ít tài liệu về loại kháng sinh nào được chỉ định cho bệnh nhân mắc CAP và liệu các hướng dẫn hiện hành dựa trên hệ thống tính điểm cho bệnh viêm phổi có thành công trong việc khuyến cáo các phương pháp điều trị bằng kháng sinh nhắm trúng mục tiêu - tác nhân gây bệnh hay không.
Do đó, mục tiêu của chúng tôi là (1) mô tả loại kháng sinh theo kinh nghiệm được chỉ định cho bệnh nhân CAP khi đến cơ sở điều trị và 2) để xác định xem liệu rằng thuốc điều trị hiện tại có bao phủ được tác nhân không điển hình LMC hay không.
3 Phương pháp nghiên cứu
3.1 Thiết kế nghiên cứu
Nghiên cứu này được thực hiện ở Vùng Nam Đan Mạch, vùng lớn thứ ba ở Đan Mạch, với dân số 1,2 triệu người. Vùng này có bốn đơn vị bệnh viện: Bệnh viện Đại học Odense, Bệnh viện Lillebaelt, Bệnh viện Tây Nam Jutland và Bệnh viện Sønderjylland. Chúng tôi đã thực hiện một nghiên cứu cắt ngang mô tả dựa trên cơ sở dữ liệu Quản lý kháng sinh (SODAS) miền Nam Đan Mạch.
Cơ sở dữ liệu được thành lập để đánh giá tác động của việc thực hiện quản lý kháng sinh của Khu vực Nam Đan Mạch (RSDAS) vào năm 2017 đối với việc điều trị bằng kháng sinh cho từng cá nhân [22]. SODAS bao gồm việc thu thập dữ liệu hồi cứu từ tám khoa phân bổ trên 4 bệnh viện tiếp nhận bệnh nhân cấp tính trong hơn 18 năm. Tất cả dữ liệu được trích xuất từ hồ sơ y tế điện tử của bệnh nhân và được bổ sung dữ liệu từ Cơ quan đăng ký bệnh nhân quốc gia Đan Mạch [23].
RSDAS được thực hiện thông qua các chiến dịch và đào tạo giáo dục bắt buộc [24, 25]. Ngoài ra, nên lấy mẫu nguyên liệu toàn diện và nghiêm ngặt để phân tích vi sinh. Nghiên cứu của chúng tôi tuân thủ các nguyên tắc STROBE để báo cáo các nghiên cứu quan sát về dịch tễ học [26].
3.2 Đối tượng nghiên cứu
Tất cả bệnh nhân từ SODAS được chẩn đoán viêm phổi xuất viện từ tháng 1 năm 2016 đến tháng 3 năm 2018 (Phân loại quốc tế về bệnh phiên bản 10 (ICD-10): DJ100, DJ111, DJ158, DJ159, DJ180, DJ189) đều đủ điều kiện (phụ lục 1). Những bệnh nhân nhập viện trước đó trong vòng 14 ngày qua đã bị loại trừ vì họ được coi là tái nhiễm hoặc viêm phổi mắc phải tại bệnh viện.
Ngoài ra, những bệnh nhân không được điều trị bằng kháng sinh trong vòng 24 giờ đầu nhập viện đã được loại trừ để đảm bảo rằng chỉ bao gồm nhiễm trùng mắc phải tại cộng đồng. Chỉ những bệnh nhân bị nhiễm vi khuẩn được xác định mới được đưa vào nghiên cứu này.
3.3 Biến số
Chỉ số bệnh đi kèm Charlson (CCI) được tính toán từ các chẩn đoán xuất viện trong mười năm qua trước khi nhập viện và được chia thành ba nhóm; 0, 1, ≥ 2 điểm [27]. Không thể tính điểm CURB-65 vì dữ liệu không chứa dữ liệu urê, nhưng CRB-65 được tính khi có thể.
3.3.1 Điều trị bằng kháng sinh
Việc điều trị bằng kháng sinh được chỉ định trong vòng 24 giờ sau khi nhập viện được coi là điều trị theo kinh nghiệm. Hướng dẫn sử dụng kháng sinh cho CAP được liệt kê trong Bảng 1. Trước năm 2017, hướng dẫn điều trị bằng kháng sinh cho bệnh viêm phổi đã được mô tả trong các sách giáo khoa hàng đầu quốc gia [28]. Năm 2017, các hướng dẫn quốc gia và khu vực (RSDAS) đã được ban hành.
Thông tin về dị ứng penicillin không có sẵn
Với sự lựa chọn thứ hai của chúng tôi, macrolide hoặc fluoroquinolone được chỉ định cho rằng khuyến cáo điều trị bao phủ viêm phổi do tác nhân LMC. Tetracycline không được khuyến cáo trong hướng dẫn của Đan Mạch và hiếm khi được sử dụng cho CAP ở Đan Mạch.
3.3.2 Tác nhân vi sinh
Nguyên nhân xác định vi sinh của CAP được xác định dựa vào tiêu chuẩn lâm sàng và từ xét nghiệm vi sinh. Hướng dẫn xét nghiệm vi sinh được mô tả trong phụ lục 2.
Thống kê tác nhân gây CAP đáng tin cậy được xác định trong cấy đờm và máu được xác định bởi nhà vi sinh học (FSR) và chuyên gia tư vấn về bệnh truyền nhiễm (CBM) (phụ lục 3). Trong trường hợp có nhiều hơn một tác nhân gây bệnh, tác nhân LMC sẽ được xác định nếu ban đầu đã xác định được một tác nhân thì tác nhân còn lại sẽ là LMC.
Thử nghiệm vi sinh rộng rãi hơn, phản ứng chuỗi Polymerase (PCR) đối với mầm bệnh LMC và phương pháp điều trị nhắm vào mầm bệnh LMC, được khuyến nghị cho những bệnh nhân có điểm CURB-65 >2.
Lao màng phổi, bệnh cảnh lâm sàng thường gặp nhất của các thể lao ngoài phổi, là nguyên nhân chính gây tràn dịch màng phổi.
Phản ứng quá mẫn muộn với protein của trực khuẩn mycobacteria được coi là nguyên nhân chính trong cơ chế bệnh sinh tràn dịch màng phổi do lao (Tuberculous pleural effusion - TPE). Ngoài ra, sự lây lan trực tiếp của các phức hợp ổ mủ dưới màng phổi từ phổi vào khoang màng phổi cũng là nguyên nhân khác của TPE1,2. Dưới nội soi lồng ngực nội khoa, các bất thường chính trên bề mặt màng phổi thành và tạng trong lao màng phổi bao gồm các nốt màng phổi, dày dính màng phổi, tổn thương dạng mảng, sung huyết và loét. Trong ca lâm sàng này, quan sát thấy nhiều sợi fibrin, mạng dày dính, hoại tử và tràn máu màng phổi. Bên cạnh đó, các đặc trưng về mặt mô học qua sinh thiết màng phổi của lao màng phổi là u hạt hoại tử và u hạt tế bào biểu mô. Trong trường hợp này, hình ảnh viêm mạn của mô sợi kèm theo xuất huyết, hoại tử và xuất tiết được ghi nhận trong mẫu sinh thiết màng phổi. Các hình ảnh quan sát qua nội soi lồng ngực nội khoa và kết quả mô học của sinh thiết màng phổi trong ca lâm sàng của chúng tôi là tương đối hiếm.
3.4 Phân tích
Đặc điểm của bệnh nhân được báo cáo với giá trị trung bình hoặc tỷ lệ thích hợp. Điều trị bằng kháng sinh theo kinh nghiệm và tác nhân vi sinh được báo cáo dưới dạng số lượng và tỷ lệ phần trăm trên tổng số. Độ chính xác của điều trị kháng sinh theo kinh nghiệm đối với viêm phổi LMC được thể hiện bằng:
Số lượng và tỷ lệ viêm phổi do LMC được chỉ định kháng sinh bao phủ tác nhân LMC
Số lượng và tỷ lệ bệnh nhân được chỉ định kháng sinh điều trị LMC viêm phổi do LMC.
Số lượng thuốc kháng sinh được chỉ định điều trị bệnh viêm phổi LMC cần thiết để điều trị chính xác viêm phổi do LMC. Khoảng tin cậy 95% được tính toán cho các tỷ lệ khi thích hợp
Các trường hợp thiếu tác nhân vi sinh hoặc điều trị bằng kháng sinh theo kinh nghiệm đã bị loại khỏi phân tích chính.
Cỡ mẫu được xác định bởi số lượng trường hợp trong đoàn hệ SODAS. Phân tích dữ liệu được thực hiện bằng STATA 17 (StataCorp, USA).
3.5 Đạo đức
Nghiên cứu được thực hiện theo tuyên bố Helsinki. Theo Đạo luật Đan Mạch về điều trị đạo đức khoa học đối với các dự án nghiên cứu khoa học sức khỏe, các nghiên cứu dựa trên đăng ký không yêu cầu sự chấp thuận của ủy ban đạo đức [29]. Cơ quan An toàn Bệnh nhân Đan Mạch đã miễn yêu cầu phải có sự đồng ý của bệnh nhân (hồ sơ 3-3013-2272/1/) và việc xử lý dữ liệu cá nhân đã được Khu vực Nam Đan Mạch phê duyệt và được liệt kê trong hồ sơ nội bộ (2012-58-0018 số 17/24904) xem. Điều 30 của Quy định chung về bảo vệ dữ liệu của EU.
| Hướng dẫn sử dụng kháng sinh trước RSDAS | Hướng dẫn kháng sinh RSDAS |
|---|---|---|
Điểm CURB-65: 0-2 | Penicillin nhạy cảm với beta-lactamase hoặc Một macrolit* Dị ứng penicillin: macrolide | Penicillin nhạy cảm với beta-lactamase Dị ứng penicillin: macrolide hoặc Cefuroxim |
Điểm CURB-65: 3-5 | Một penicillin nhạy cảm với beta-lactamase + Fluoroquinolone Dị ứng penicillin: Fluoroquinolone | Penicillin + macrolide nhạy cảm với beta-lactamase HOẶC Piperacillin/tazobactam + macrolide ** Dị ứng penicillin: Cefuroxim + macrolide |
Đợt cấp của bệnh phổi tắc nghẽn mãn tính (COPD) | Amoxicillin/clavulanate | Amoxicillin/clavulanate HOẶC Piperacillin/tazobactam*** Dị ứng: Cefuroxim |
Nhiễm trùng không rõ tác nhân | Piperacillin/tazobactam | Piperacillin/tazobactam Dị ứng: Meropenem |
Chú thích
* Nghi ngờ viêm phổi do Mycoplasma pneumoniae, dựa trên độ tuổi của bệnh nhân hoặc đợt bùng phát Mycoplasma pneumoniae
** Điểm CURB-65 ≥3 và tình trạng thiếu oxy (SAT <92%) hoặc liên quan đến ≥2 thùy phổi trên X quang hoặc nhiễm trùng huyết
*** Không cần thở máy hoặc điều trị bằng đường uống
4 Kết quả nghiên cứu
4.1 Những người tham gia
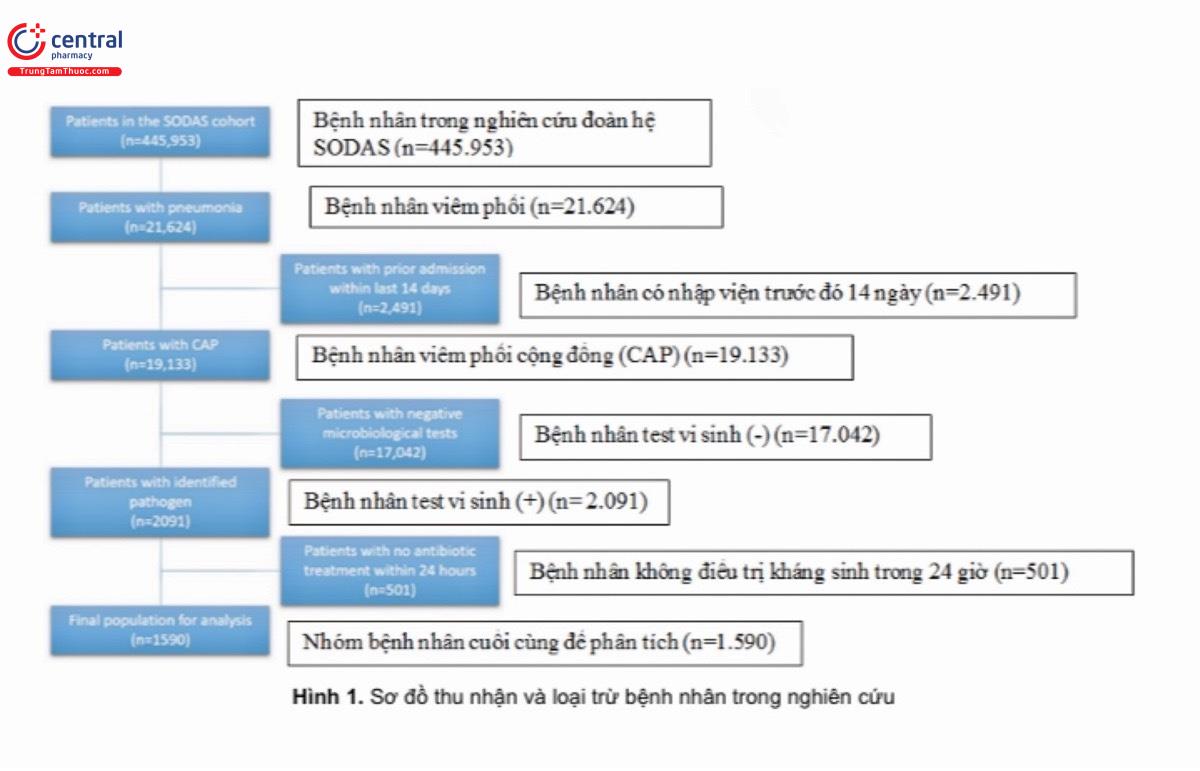
Trong thời gian nghiên cứu, tổng cộng 443.953 người đã được đưa vào cơ sở dữ liệu SODAS, trong đó 21.624 người được chẩn đoán lúc xuất viện là viêm phổi (hình 1) 2.491 đã bị loại trừ dưới dạng tái nhập viện trong vòng 14 ngày, còn 19.133 người được đưa vào nghiên cứu tiếp. Chúng tôi đã xác định được nguyên nhân gây bệnh ở 2.091 bệnh nhân, trong đó loại thêm 501 bệnh nhân do không được dùng kháng sinh trong vòng 24 giờ. Tổng cộng có 1590 (8,3%) bệnh nhân CAP được đưa vào phân tích của chúng tôi.
4.2 Đặc điểm bệnh nhân
Đặc điểm của dân số nghiên cứu được liệt kê trong Bảng 2.
Danh sách kháng sinh phổ rộng có thể được tìm thấy trong phụ lục 4.
Các trường hợp viêm phổi do virus được xác định, tần suất xét nghiệm vi sinh và tần suất xét nghiệm dương tính có thể được liệt kê trong phụ lục 5 và phụ lục 6.
4.3 Điều trị bằng kháng sinh
Đơn trị liệu bằng piperacillin-tazobactam và penicillin nhạy cảm với Beta-lactamase chiếm hơn một nửa số phương pháp điều trị bằng kháng sinh theo kinh nghiệm, với lần lượt là 515 (32%) và 388 (24%) (Bảng 2).
Thuốc kháng sinh được kê đơn chống lại viêm phổi LMC Thuốc kháng sinh có độ bao phủ LMC được kê đơn hoàn toàn cho 364 (23%), trong số này có 42 (37%, 95% CI: 28-47) trong số 113 bệnh nhân viêm phổi LMC và 42 (12%; 95% CI: 8-15) điều trị với kháng sinh chống LMC khi bị viêm phổi LMC (Bảng 3). Số bệnh nhân được chỉ định kháng sinh điều trị LMC khi nhiễm tác nhân LMC là 8,7 trên tất cả bệnh nhân.
Nam giới (%) | 831 (52%) |
Tuổi trung bình tính theo năm (SD) | 70,0 (15,7) |
Bệnh đi kèm | |
Bệnh phổi tắc nghẽn mãn tính (COPD) (%) | 631 (40%) |
Suy tim sung huyết (%) | 165 (11%) |
Điều trị kháng sinh theo kinh nghiệm < 24 giờ sau khi nhập viện | |
Piperacillin-tazobactam | 515 (32%) |
Đơn trị liệu bằng penicillin nhạy cảm với beta-lactamase) | 388 (24% |
Liệu pháp phối hợp bao gồm macrolide | 166 (10%) |
Cephalosporin Đơn trị liệu Fluoroquinolone Amoxicillin/clavulanate Liệu pháp phối hợp bao gồm fluoroquinolone Đơn trị liệu bằng macrolide Amoxicillin hoặc ampicillin Kháng sinh điều trị nhiễm trùng đường tiết niệu Khác | 148 (9%) 113 (7%) 96 (6%) 38 (2%) 36 (2%) 33 (2%) 13 (1%) 44 (3%) |
Đái tháo đường không có biến chứng (%) | 257 (16%) |
Đái tháo đường có biến chứng (%) | 81 (5%) |
Điểm số bệnh đi kèm trung bình Charlson (IQR) | 1 (0-2) |
Điều trị tại bệnh viện và thành phố (%) | |
Bệnh viện Sønderjylland Bệnh viện Tây Nam Jutland Bệnh viện Lillebaelt Bệnh viện Đại học Odense | 208 (13%) 157 (10%) 391 (25%) 834 (52%) |
Căn nguyên | |
Streptococcus pneumoniae | 396 (25%) |
Haemophilus influenzae | 381 (24%) |
Tụ cầu vàng Pseudomonas aeruginosa Moraxella catarrhalis Liên cầu tan máu LMC-viêm phổi Mycoplasma pneumoniae | 315 (20%) 176 (11%) 128 (8%) 81 (5%) 114 (7%) 79 (5%) |
Legionella pneumophila Chlamydophila pneumoniae | 26 (2%) 8 (1%) |
Điểm CRB-65 (n=872) | |
CRB-65 = 0 CRB-65 = 1 CRB-65 = 2 CRB-65 = 3 CRB-65 = 4 | 29 (3%) 212 (24%) 481 (55%) 149 (17%) 1 (<0%) |
| Viêm phổi LMC | Viêm phổi không phải LMC | Tổng cộng |
|---|---|---|---|
Thuốc kháng sinh được kê đơn điều trị viêm phổi LMC | 42 | 322 | 364 |
Thuốc kháng sinh được kê đơn không bao gồm viêm phổi LMC | 71 | 1155 | 1226 |
Tổng cộng | 113 | 1477 | 1590 |
5 Thảo luận
Nghiên cứu của chúng tôi cho thấy piperacillin-tazobactam và penicillin nhạy Beta-lactamase là những phương pháp điều trị theo kinh nghiệm được kê đơn nhiều nhất, với lần lượt là 515 (32%) và 388 (24%). Ngoài ra, phân tích của chúng tôi cho thấy chỉ có 42 (37%, 95% CI: 28-47%) bệnh nhân mắc bệnh viêm phổi LMC được điều trị bằng kháng sinh theo kinh nghiệm, trong khi chỉ có 71 (12%, 95% CI: 8-15%) số bệnh nhân được điều trị bằng kháng sinh với phạm vi bao phủ LMC thực sự bị viêm phổi LMC.
5.1 Kê đơn kháng sinh theo kinh nghiệm
Phần lớn, 515 (32%) trong số tất cả các loại kháng sinh được kê đơn là Piperacillin- Tazobactam đơn trị liệu. Tuy nhiên, điều này vẫn xảy ra tình trạng thiếu Piperacillin- tazobactam từ tháng 5 đến tháng 9 năm 2017 [30]. Đơn trị liệu Piperacillin- tazobactam là phương pháp điều trị theo kinh nghiệm được khuyến nghị cho những bệnh nhân không rõ ổ nhiễm trùng, nhiễm trùng huyết hoặc đợt cấp của bệnh phổi tắc nghẽn mạn tính (COPD) cần thở máy hoặc không thể điều trị bằng đường uống [22].
Mặc dù một số Piperacillin-tazobactam được kê đơn có thể dành cho bệnh nhân mắc COPD, nhưng chỉ có 96 (6%) bệnh nhân được kê đơn thuốc kháng sinh hàng đầu-Amoxicillin/clavulanate. Gợi ý rằng một số bệnh nhân COPD được kê đơn piperacillin-tazobactam thay vì Amoxicillin/clavulanate được khuyến nghị. Ngoài ra, việc sử dụng thường xuyên piperacillin-tazobactam đơn trị liệu và kháng sinh nhằm điều trị nhiễm trùng đường tiết niệu cho thấy trọng tâm của nhiễm trùng thường không chắc chắn ở bệnh nhân CAP khi nhập viện. Hơn nữa, nó nhấn mạnh sự cần thiết phải có các công cụ chẩn đoán tốt hơn để xác định tác nhân vi sinh của nhiễm trùng. Sự không chắc chắn trong chẩn đoán trước đây đã được đề cập là nguyên nhân dẫn đến việc tăng cường sử dụng kháng sinh phổ rộng [31].
Trong một nghiên cứu của Đan Mạch, 45% bệnh nhân CAP được điều trị bằng penicillin nhạy cảm với Beta-lactamase, so với chỉ 24% trong nghiên cứu của chúng tôi [32]. Tỷ lệ kê đơn kháng sinh phổ hẹp cao hơn có thể là do độ tin cậy chẩn đoán tăng lên vì nghiên cứu sử dụng các hình ảnh thâm nhiễm mới trên chụp X-quang ngực làm tiêu chí chẩn đoán viêm phổi mà chúng tôi không sử dụng. Mặc dù chụp X-quang ngực là công cụ chẩn đoán hình ảnh hàng đầu hiện nay đối với bệnh viêm phổi nhưng nó có độ nhạy thấp đối với bệnh viêm phổi [33, 34].
Chỉ bao gồm những bệnh nhân có thâm nhiễm mới trên X-quang ngực đã loại trừ một số lượng đáng kể bệnh nhân CAP. Trong tương lai, các công cụ như siêu âm lồng ngực và CT liều cực thấp có thể cải thiện chẩn đoán khu trú và tạo điều kiện thuận lợi cho việc điều trị bằng kháng sinh nhắm mục tiêu khu trú [35-37].
5.2 Kháng sinh phổ rộng chống lại bệnh viêm phổi LMC
Chúng tôi thấy rằng việc điều trị theo kinh nghiệm được hướng dẫn bởi điểm số mức độ nghiêm trọng đối với bệnh viêm phổi LMC là không đặc hiệu và không đầy đủ.
Kết quả này không có gì đáng ngạc nhiên, vì các nghiên cứu đánh giá khả năng dự đoán nguyên nhân của CAP của các mức độ nghiêm trọng đã báo cáo tần suất viêm phổi
LMC không cao ở những bệnh nhân có điểm mức độ nặng cao [18, 38]. Ngoài ra, các nghiên cứu khác đã chỉ ra rằng có tới một nửa số bệnh nhân có điểm CURB-65 thấp được khuyên dùng kháng sinh beta-lactam, được điều trị bằng cả kháng sinh beta-lactam và macrolide [19-21]. Vì mức độ bao phủ kháng sinh theo kinh nghiệm đối với LMC dựa trên mức độ nghiêm trọng của bệnh nhân, nên viêm phổi LMC không được điều trị bằng kháng sinh theo kinh nghiệm có thể sẽ ít nghiêm trọng hơn.
Tất cả những yếu tố này có thể giải thích kết quả của chúng tôi: việc kê đơn thuốc kháng sinh bao phủ viêm phổi LMC ở 23% bệnh nhân mặc dù LMC chỉ được xác định ở 7% bệnh nhân, chỉ 37% bệnh nhân viêm phổi LMC được kê đơn thuốc kháng sinh bao phủ LMC và chỉ 12 % (KTC 95%: 8-15) bệnh nhân được kê đơn kháng sinh bao phủ LMC bị viêm phổi LMC. Điều này cho thấy tiềm năng đáng kể trong việc cải thiện việc sử dụng kháng sinh với xét nghiệm vi sinh chính xác hơn và nhanh hơn trong tương lai.
Trong trung tâm nghiên cứu của chúng tôi, phân tích PCR tìm tác nhân LMC chỉ được khuyến nghị ở những bệnh nhân có điểm CURB-65 là 3-5. Do đó, chúng tôi ít có khả năng xác định bệnh viêm phổi LMC trong nhóm thuốc kháng sinh được chỉ định mà không bao phủ LMC và có thể đã đánh giá quá cao tỷ lệ thuốc kháng sinh được kê đơn cho bệnh viêm phổi LMC. Xét nghiệm PCR tất cả bệnh nhân CAP hoặc tất cả bệnh nhân được chỉ định kháng sinh với phạm vi bao phủ của LMC [39] có thể dẫn đến giảm việc sử dụng kháng sinh, chi phí và thời gian nằm viện [40].
5.3 Tính khái quát
Tần suất tương đối của từng tác nhân trong nghiên cứu của chúng tôi phù hợp với các nghiên cứu khác từ Đan Mạch và Na Uy [41,42]. Chúng tôi có tần suất nhiễm Streptococcus pneumoniae thấp so với các nước châu u khác nhưng tần suất tương tự so với Mỹ và Canada [4]. Liên quan đến tác nhân viêm phổi LMC, nghiên cứu này có tần suất thấp so với nhiều nghiên cứu khác báo cáo tần suất khoảng 21% [4]. Sự khác biệt về tần suất có thể là do sự khác biệt trong khu vực, việc sử dụng huyết thanh học và việc sử dụng PCR nhất quán hơn cho LMC trong các nghiên cứu khác.
Đan Mạch và các quốc gia Scandinavi khác có tần suất LMC và tình trạng kháng kháng sinh thấp, và các hướng dẫn thường khuyên dùng penicillin phổ hẹp, trái ngược với các quốc gia không phải Scandinavia, nơi kháng phổ rộng thường được sử dụng làm phương pháp điều trị theo kinh nghiệm đầu tay [14, 16, 42-44]. Do đó, những kết quả này có thể không áp dụng cho các quốc gia có nguyên nhân, mô hình kháng kháng sinh hoặc hướng dẫn về CAP khác nhau. Tuy nhiên, những quan sát nhấn mạnh từ nghiên cứu này có thể được áp dụng rộng rãi hơn. Việc sử dụng kháng sinh phổ rộng không phù hợp có thể do chẩn đoán không chắc chắn về trọng tâm và nguyên nhân nhiễm trùng.
5.4 Hạn chế
Một hạn chế của nghiên cứu này là dân số được chọn lọc và chỉ bao gồm 8% bệnh nhân mắc CAP, vì chỉ có thể xác định nguyên nhân vi sinh ở 13% bệnh nhân. Nuôi cấy đờm và PCR là các xét nghiệm vi sinh chính để phát hiện CAP. Tuy nhiên, các nghiên cứu đã cho thấy xu hướng hiệu suất nuôi cấy đờm thấp là 14-17% ở bệnh nhân CAP do không thể lấy mẫu đờm và tỷ lệ nuôi cấy đờm dương tính thấp [45, 46]. Ngoài ra, các yếu tố bệnh nhân như tuổi >75, sức khỏe yếu, khả năng ho sẽ ảnh hưởng đến khả năng lấy mẫu đờm. Hơn nữa, điều trị bằng kháng sinh trước khi lấy mẫu đờm làm giảm lượng nuôi cấy đờm, do đó một số mầm bệnh đặc biệt khó xác định thông qua nuôi cấy [46].
Một số hạn chế xuất phát từ thiết kế dựa trên dân số của chúng tôi, dựa trên chẩn đoán xuất viện đối với bệnh viêm phổi, có khả năng làm sai lệch kết quả do lựa chọn bệnh nhân kém hiệu quả hơn. Hơn nữa, sự hiện diện quá mức của bệnh nhân từ Bệnh viện Đại học Odense, với xét nghiệm nhân khẩu học và vi sinh rộng rãi cho từng bệnh nhân, có thể làm sai lệch kết quả của chúng tôi, đặc biệt là trong các mô hình kê đơn thuốc kháng sinh. Tác động của những yếu tố này rất khó để định lượng hoặc giải thích.
6 Tóm lại
Piperacillin-tazobactam là phương pháp điều trị bằng kháng sinh theo kinh nghiệm thường xuyên nhất đối với CAP với nguyên nhân rõ ràng sau đó được xác định. Độ chính xác của điều trị bằng kháng sinh theo kinh nghiệm đối với bệnh viêm phổi LMC là thấp. Chúng tôi thấy rằng có tiềm năng cải thiện việc điều trị bằng kháng sinh theo kinh nghiệm đối với bệnh viêm phổi cộng đồng và sự không chắc chắn trong chẩn đoán nguyên nhân nhiễm trùng có thể là yếu tố chính dẫn đến việc sử dụng kháng sinh phổ rộng không cần thiết.
7 Tài liệu tham khảo
1. Jain S, Self WH, Wunderink RG, Fakhran S, Balk R, Bramley AM, et al. Community Acquired Pneumonia Requiring Hospitalization among U.S. Adults. N Engl J Med. 2015;373(5):415-27. doi: 10.1056/NEJMoa1500245.
2. Waterer GW. Community-acquired Pneumonia: A Global Perspective. Semin Respir Crit Care Med. 2016;37(6):799-805. doi: 10.1055/s-0036-1592313.
3. Prina E, Ranzani OT, Torres A. Community-acquired pneumonia. The Lancet. 2015;386(9998):1097-1108. doi: 10.1016/S0140-6736(15)60733-4.
4. Shoar S, Musher DM. Etiology of community- acquired pneumonia in adults: a systematic review. Pneumonia (Nathan) 2020;12:11. doi: 10.1186/s41479-020-00074-3.
5. Cunha BA. The atypical pneumonias: clinical diagnosis and importance. Clin Microbiol Infect. 2006;12(Suppl 3):12-24. doi: 10.1111/j.1469-0691.2006.01393.x.
6. Arnold FW, Summersgill JT, Ramirez JA. Role of Atypical Pathogens in the Etiology of Community-Acquired Pneumonia. Semin Respir Crit Care Med. 2016;37(6):819-828. doi: 10.1055/s-0036-1592121.
7. Holmes AH, Moore LSP, Sundsfjord A, Steinbakk M, Regmi S, Karkey A, et al. Understanding the mechanisms and drivers of antimicrobial resistance. The Lancet. 2016;387(10014):176-187. doi: 10.1016/S0140-6736(15)00473-0.
8. Murray CJL, Ikuta KS, Sharara F, Swetschinski L, Robles Aguilar G, Gray A, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet. 2022;399(10325):629-655. doi: 10.1016/S0140- 6736(21)02724-0.
9. Brown KA, Khanafer N, Daneman N, Fisman DN. Meta-analysis of antibiotics and the risk of community-associated Clostridium difficile infection. Antimicrob Agents Chemother. 2013;57(5):2326-2332. doi: 10.1128/AAC.02176-12.
10. Wong AYS, Chan EW, Anand S, Worsley AJ, Wong ICK. Managing Cardiovascular Risk of Macrolides: Systematic Review and Meta-Analysis. Drug Saf. 2017;40(8):663-677. doi: 10.1007/s40264-017-0533-2.
11. Svanstrom H, Pasternak B, Hviid A. Use of Clarithromycin and Roxithromycin and risk of cardiac death: cohort study. BMJ. 2014;349:g4930. doi: 10.1136/bmj.g4930.
12. Kallen BA, Otterblad Olausson P, Danielsson BR. Is Erythromycin therapy teratogenic in humans? Reprod Toxicol. 2005;20(2):209-214. doi: 10.1016/j.reprotox.2005.01.010.
13. Lim WS, Baudouin SV, George RC, Hill AT, Jamieson C, Le Jeune I, et al. BTS guidelines for the management of community acquired pneumonia in adults: update 2009. Thorax. 2009;64(3):iii1-55.
14. Hoffken G, Lorenz J, Kern W, Welte T, Bauer T, Dalhoff K, et al. Guidelines of the Paul-Ehrlich-Society of Chemotherapy, the German Respiratory Diseases Society, the German Infectious Diseases Society and of the Competence Network CAPNETZ for the Management of Lower Respiratory Tract Infections and Community-acquired Pneumonia. Pneumologie. 2010;64(3):149-154. doi: 10.1055/s- 0029-1243910.
15. Rådet for Anvendelse af Dyr Sygehusmedicin R. Baggrundsnotat for hensigtsmæssig anvendelse af antibiotika ved nedre luftvejsinfektioner i almen praksis og på hospital 2016 [updated 28-09-201621- 06-2022]. [59].
16. Eccles S, Pincus C, Higgins B, Woodhead M, Guideline DG. Diagnosis and management of community and hospital acquired pneumonia in adults: summary of NICE guidance. BMJ. 2014;349:g6722. doi: 10.1136/bmj.g6722.
17. Stralin K, Olcen P, Tornqvist E, Holmberg H.
Definite, probable, and possible bacterial aetiologies of community-acquired pneumonia at different CRB-65 scores. Scand J Infect Dis. 2010;42(6-7):426-434. doi: 10.3109/00365540903552353.
18.Cilloniz C, Ewig S, Polverino E, Marcos MA, Esquinas C, Gabarrus A, et al. Microbial aetiology of community-acquired pneumonia and its relation to severity. Thorax. 2011;66(4):340-346. doi: 10.1136/thx.2010.143982.
19. Lim WS, Woodhead M, British TS. British Thoracic Society adult community acquired pneumonia audit 2009/10. Thorax. 2011;66(6):548-549. doi: 10.1136 thoraxjnl-2011-200081.
20. Eekholm S, Ahlstrom G, Kristensson J, Lindhardt T. Gaps between current clinical practice and evidence-based guidelines for treatment and care of older patients with Community Acquired Pneumonia: a descriptive cross-sectional study. BMC Infect Dis. 2020;20(1):73. doi: 10.1186 s12879-019-4742-4.
21. O'Kelly B, Rueda-Benito A, O'Regan M, Finan K. An audit of community-acquired pneumonia antimicrobial compliance using an intervention bundle in an Irish hospital. J Glob Antimicrob Resist. 2020;23:38-45. doi: 10.1016/j.jgar.2020.07.021.
22. Antibiotikagruppe DR. Diagnostik og behandling af akutte infektioner på sygehusene i Region Syddanmark: Region Syddanmark; 2016. Cited 30 Jan 2022.
23. Lynge E, Sandegaard JL, Rebolj M. The Danish National Patient Register. Scand J Public Health. 2011;39(7 Suppl):30-33. doi: 10.1177/1403494811401482.
24. Anne-Marie Blok Hellesøe CBM, Jakob Anhøj, Jette Nygaard Jensen, Helle Bak, Svend Ellermann-Eriksen, Tina Christensen. LKT Antibiotika Afslut nings- og evalueringsrappot [LKT antibiotic evaluation report]: Danske. regioner; 2019. Updated september 2019; Cited 30 Jan 2023. 343]
25. Anne-Marie Blok Hellesøe CBM, Jakob Anhøj, Jette Nygaard Jensen, Helle Bak, Svend Ellermann- Eriksen, Tina Christensen. Projektbeskrivelsen for LKT Antibiotika [project description for LKT antibiotca]: Danske regioner 2017
26. Vandenbroucke JP, von Elm E, Altman DG, Gotzsche PC, Mulrow CD, Pocock SJ, et al. Strengthening the Reporting of Observational Studie in Epidemiology (STROBE): explanation and elaboration. PLoS Med. 2007;4(10): e297.
27. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of clas sifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40(5):373-83
28. Schaffalitzky de Muckadel OB, Haunsø S, Vilstrup H. Infektionssygdomme. In: Schaffalitzky de Muckadel OB, Haunsø S, Vilstrup H, editors. Medicinsk kompendium. København: Nyt Nordisk Forlag Arnold Busck; 2013.
29. Health TDmo. Act number 593 of 14/06/2011 - Act on scientific ethical treatment of health science research projects 2011.
30. DANMAP 2017: Statens serum insitut; 2018. Cited 1 Sep 2022
31. Krockow EM, Colman AM, Chattoe-Brown E, Jenkins DR, Perera N, Mehtar S, et al. Balancing the risks to individual and society: a systematic review and synthesis of qualitative research on antibiotic prescribing behaviour in hospitals. J Hosp Infect. 2019;101(4):428-439. doi: 10.1016/j.jhin.2018.08.007
32. Egelund GB, Jensen AV, Andersen SB, Petersen PT, Lindhardt BO, von Plessen C, et al. Penicillin treatment for patients with Community-Acquired Pneumonia in Denmark: a retrospective cohort study. BMC Pulm Med. 2017;17(1):66. doi: 10.1186/s12890-017-0404-8
33. Self WH, Courtney DM, McNaughton CD, Wunderink RG, Kline JA. High discordance of chest x-ray and computed tomography for detection of pulmonary opacities in ED patients: implications for diagnosing pneumonia. Am J Emerg Med. 2013;31(2):401-5. doi: 10.1016 j.ajem.2012.08.041
34. Torres A, Cilloniz C, Niederman MS, Menendez R, Chalmers JD, Wunderink RG, et al. Pneumonia Nat Rev Dis Primers. 2021;7(1):25. doi: 10.1038/s41572-021-00259-0
35. Taekker M, Kristjansdottir B, Andersen MB, Fransen ML, Greisen PW, Laursen CB, et a Diagnostic accuracy of ultra-low-dose chest computed tomography in an emergency department.
36. Taekker M, Kristjansdottir B, Andersen MB, Fransen ML, Greisen PW, Laursen CB, et al. Diagnostic accuracy of ultra-low-dose chest computed tomography in an emergency department. Acta Radiol. 2021;63:284185121995804.
37. Staub LJ, Mazzali Biscaro RR, Kaszubowski E, Maurici R. Lung Ultrasound for the Emergency Diagnosis of Pneumonia, Acute Heart Failure, and Exacerbations of Chronic Obstructive Pulmonary Disease/Asthma in Adults: A Systematic Review and Meta-analysis. J Emerg Med. 2019;56(1):53-69. doi: 10.1016/j.jemermed.2018.09.009.
38. Singanayagam A, Aliberti S, Cilloniz C, Torres A, Blasi F, Chalmers JD. Evaluation of severity score-guided approaches to macrolide use in community-acquired pneumonia. Eur Respir J. 2017;50(3):1602306. doi: 10.1183/13993003.02306-2016.
39. Avni T, Bieber A, Green H, Steinmetz T, Leibovici L, Paul M. Diagnostic Accuracy of PCR Alone and Compared to Urinary Antigen Testing for Detection of Legionella spp.: a Systematic Review. J Clin Microbiol. 2016;54(2):401-11. doi: 10.1128/JCM.02675-15.
40. Shengchen D, Gu X, Fan G, Sun R, Wang Y, Yu D, et al. Evaluation of a molecular point-of-care testing for viral and atypical pathogens on intravenous antibiotic duration in hospitalized adults with lower respiratory tract infection: a randomized clinical trial. Clin Microbiol Infect. 2019;25(11):1415-1421. doi: 10.1016/j.cmi.2019.06.012.
41. Fally M, Israelsen S, Anhoj J, Benfeld T, Tarp B, Kolte L, et al. The increasing importance of Haemophilus infuenzae in community-acquired pneumonia: results from a Danish cohort study. Infect Dis (Lond). 2021;53(2):122-30
42. Waagsbo B, Buset EM, Longva JA, Bjerke M,Bakkene B, Ertesvag AS, et al. Diagnostic stewardship aiming at expectorated or induced sputum promotes microbial diagnosis in community-acquired pneumonia. Bmc Infect Dis. 2022;22(1):203.
43. Attauabi M, Høg BB, Müller-Pebody B. DANMAP 2020 - Use of antimicrobial agents and occurrence of antimicrobial resistance in bacteria from food animals, food and humans in Denmark: Statens serum institut; 2021.
44. Markus Fally CPF, Thyge Lynghøj Nielsen, Ulla Møller Weinreich, Pernille Ravn, Thomas Benfield, Jens-Ulrik Stæhr Jensen (DLS),. Retningslinjer for håndtering af voksne patienter indlagt med pneumoni [Guidelines for handling of adults admitted withpneumonia]: Danish society of respiratory medicine and Danish society of infectious diseases; Updated 2021; Cited 23 mar 2
45. Cartuliares MB, Sundal LM, Gustavsson S, Skjot-Arkil H, Mogensen CB. Limited value of sputum culture to guide antibiotic treatment in a Danish emergency department. Dan Med J.2020;67(11):A11190641.
46. Garcia-Vazquez E, Marcos MA, Mensa J, de Roux A, Puig J, Font C, et al. Assessment of the usefulness of sputum culture for diagnosis of community-acquired pneumonia using the PORT predictive scoring system. Arch Intern Med.2004;164(16):1807-1811. doi: 10.1001/archinte.164.16.1807
47.Morten Hjarnø Lorentzen, Flemming Schønning Rosenvinge, et al. Empirical antibiotic treatment for community-acquired pneumonia and accuracy for Legionella pneumophila, Mycoplasma pneumoniae, and Clamydophila pneumoniae: a descriptive cross-sectional study of adult patients in the emergency department”. BMC Infect Dis. 2023;23(1):580. Published 2023 Sep 5. doi:10.1186/s12879-023-08565-6. Tải bản PDF tại đây.

