Điều cần biết trong can thiệp động mạch vành cơ bản
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn:
PGS.TS.BS. Phạm Mạnh Hùng
TS.BSNT. Hoàng Việt Anh
TS.BSNT. Đinh Huỳnh Linh
ThS.BSNT. Lê Tuấn Minh
ThS.BSNT. Vũ Mạnh Cường
Trungtamthuoc.com - Can thiệp động mạch vành cơ bản là mộtthủ thuậtkhông chỉ dùng để điều trị những tổn thương khu trú ở một hoặc hai nhánh ĐMV mà còn có thể thực hiện trên những tổn thương phức tạp, vôi hoá, tổn thương lan toả, tổn thương nhiều thân ĐMV, bao gồm cả hẹp nặng thân chung động mạch vành trái. Hãy cùng Trung tâm thuốcCentral Pharmacy timg hiểu nhé!
1 Đại cương
Ngày 16 tháng 9 năm 1977, tại Zurich, Thụy Sỹ, Andreas Grüentzig lần đầu tiên thực hiện thủ thuật nong bóng động mạch vành qua da trên người. Tính đến thời điểm đó, phẫu thuật bắc cầu chủ vành (CABG) là lựa chọn duy nhất ngoài điều trị nội khoa tối ưu đối với bệnh lý động mạch vành (ĐMV). Trải qua hơn bốn thập niên, can thiệp động mạch vành qua da (PCI) đã trở thành thủ thuật thường quy tại rất nhiều trung tâm tim mạch trên toàn thế giới. Số ca can thiệp ĐMV tăng lên, tiếp cận điều trị các tổn thương ngày càng phức tạp. Rất nhiều tiến bộ mới về kỹ thuật, thiết bị, công nghệ đã cải thiện hiệu quả và tính an toàn của thủ thuật này.
Với các tiến bộ về kỹ thuật và thiết bị, ngày nay PCI không chỉ dùng để điều trị những tổn thương khu trú ở một hoặc hai nhánh ĐMV mà còn có thể thực hiện trên những tổn thương phức tạp, vôi hoá, tổn thương lan toả, tổn thương nhiều thân ĐMV, bao gồm cả hẹp nặng thân chung động mạch vành trái. Sự ra đời và ứng dụng rộng rãi của những kỹ thuật đặc biệt như siêu âm trong lòng mạch vành, khoan phá mảng xơ vữa, thiết bị hỗ trợ thất trái, đã mở rộng chỉ định can thiệp ĐMV ở nhiều đối tượng khác nhau. Hiện nay, PCI trở thành phương pháp tái tưới máu ĐMV phổ biến nhất, với tỷ lệ thành công cao. Ước tính, mỗi năm có trên 1,5 triệu ca PCI được thực hiện tại Mỹ, và hàng chục nghìn ca PCI ở Việt Nam.
Chương sách này sẽ tóm tắt, thảo luận về các kỹ thuật từ cơ bản đến phức tạp để giúp người thực hiện PCI ở mọi cấp độ hiểu được các khía cạnh thực tế của kỹ thuật can thiệp ĐMV. Can thiệp ĐMV trong các trường hợp tổn thương đặc biệt sẽ được trình bày ở những chương kế tiếp.

2 Chỉ định và chống chỉ định can thiệp động mạch vành qua da
2.1 Chỉ định can thiệp động mạch vành qua da (PCI)
Tuỳ thuộc vào từng bệnh cảnh lâm sàng cụ thể (hội chứng vành cấp có hoặc không có ST chênh lên, hội chứng động mạch vành mạn tính), thời gian từ khi có triệu chứng, tình trạng lâm sàng hiện tại của bệnh nhân (đau ngực, khó thở, suy tim, sốc tim, biến chứng cơ học…), giải phẫu ĐM vành, tuổi tác, các bệnh lý phối hợp, sự lựa chọn của người bệnh,… mà đưa ra quyết định có tái tưới máu cho bệnh nhân hay không, nếu có thì tái tưới máu bằng phương pháp nào: can thiệp ĐM vành qua da (PCI) hay bắc cầu chủ vành (CABG).
Nhìn chung, CABG được ưu tiên trong các trường hợp nguy cơ phẫu thuật thấp với tổn thương giải phẫu ĐM vành phức tạp (điểm SYNTAX ≥ 23, tổn thương nhiều nhánh ĐM vành, tổn thương thân chung, các tổn thương vôi hoá nặng, …), suy tim EF ≤ 35%, đái tháo đường, tái hẹp stent nhiều lần, bệnh nhân không thích hợp dùng kháng tiểu cầu kép hoặc có bệnh lý tại tim kèm theo cần phẫu thuật,… Trong khi đó, PCI được ưu tiên với các tổn thương đơn giản hơn với điểm SYNTAX ≤ 22, nguy cơ phẫu thuật cao, bệnh nền nội khoa phức tạp, giải phẫu không phù hợp cho CABG và có khả năng tái tưới máu hoàn toàn bằng PCI.
Theo khuyến cáo mới nhất của ACC/AHA/SCAI năm 2021, can thiệp ĐM vành qua da được chỉ định trong các trường hợp sau:
2.1.1 Nhồi máu cơ tim có ST chênh lên (STEMI)
Nhánh thủ phạm:
- PCI cần được tiến hành thường quy trong vòng 24 giờ (IIa-B), đặc biệt trong vòng 12 giờ (I-A) từ khi có triệu chứng.
- PCI cần được tiến hành bất kể thời điểm nào nếu triệu chứng thiếu máu còn dai dẳng, suy tim tiến triển, sốc tim, rối loạn nhịp tim đe doạ tính mạng (I-B).
- PCI cứu vãn nếu tiêu sợi huyết thất bại (I-C).
- Chụp động mạch vành và PCI thường quy trong vòng 3-24 giờ ở bệnh nhân được tiêu sợi huyết thành công (IIa-B).
Nhánh không thủ phạm:
- PCI nhánh không thủ phạm có kế hoạch sau khi PCI nhánh thủ phạm thành công (I-A).
- PCI nhánh không thủ phạm có thể được cân nhắc tiến hành trong cùng một thì với nhánh thủ phạm nếu tình trạng huyết động ổn định và tổn thương đơn giản (IIb-B).
- Trong trường hợp sốc tim, PCI nhánh không thủ phạm không được chỉ định một cách thường quy trong cùng một thì với nhánh thủ phạm vì tăng nguy cơ tử vong và suy thận tiến triển (III-B)
2.1.2 Hội chứng vành cấp không ST chênh lên (nhồi máu cơ tim không có ST chênh lên – NSTEMI và đau ngực không ổn định): được chỉ định tái tưới máu trong các trường hợp sau:
Bệnh nhân có nguy cơ cao thiếu máu cơ tim tái phát và phù hợp cho tái tưới máu, tái tưới máu được chỉ định để giảm các biến cố tim mạch (I-A).
Bệnh nhân bị sốc tim và phù hợp cho tái tưới máu, tái tưới máu cần được tiến hành khẩn cấp để giảm tỷ lệ tử vong (I-B).
Bệnh nhân đau ngực dai dẳng, huyết động không ổn định, rối loạn nhịp tim nguy hiểm tính mạng tái tưới máu ngay lập tức cần được tiến hành để cải thiện kết cục lâm sàng (I-C).
Bệnh nhân huyết động ổn định, nguy cơ cao của các biến cố lâm sàng (Grace > 140 điểm), cần tái tưới máu sớm trong vòng 24 giờ để cải thiện kết cục lâm sàng (IIa-B).
Bệnh nhân huyết động ổn định, nguy cơ các biến cố lâm sàng ở mức độ thấp hoặc trung bình, tái tưới máu cần được tiến hành trước khi xuất viện nhằm cải thiện kết cục lâm sàng (IIa-B).
Trong trường hợp sốc tim, PCI nhánh không thủ phạm không được chỉ định một cách thường quy trong cùng một thì với nhánh thủ phạm (III-B).
2.1.3 Hội chứng vành mạn tính
Cân nhắc tái tưới máu trong hội chứng vành mạn tính nhằm 3 mục đích: cải thiện triệu chứng, cải thiện sống còn chung và cải thiện các biến cố tim mạch.
2.1.3.1 Tái tưới máu để cải thiện triệu chứng
Bệnh nhân còn đau ngực dai dẳng dù đã được điều trị nội khoa tối ưu và có tổn thương hẹp ĐM vành có ý nghĩa trên giải phẫu (hẹp ≥ 70%) hoặc huyết động (FFR ≤ 0,80), tái tưới máu nên được thực hiện để cải thiện triệu chứng (I-A).
Ngược lại, bệnh nhân dù có đau thắt ngực nhưng không có tổn thương mạch vành hẹp có ý nghĩa, tái tưới máu không nên được thực hiện (III-C).
2.1.3.2 Tái tưới máu để cải thiện sống còn chung
Nếu bệnh nhân không có triệu chứng hoặc đau thắt ngực đáp ứng tốt với điều trị nội khoa, việc tái tưới máu vẫn nên được cân nhắc nhằm cải thiện sống còn về mặt lâu dài.
Tổn thương nhiều thân ĐM vành với chức năng tâm thu thất trái giảm:
Phẫu thuật bắc cầu chủ vành (CABG) (với nguy cơ phẫu thuật thấp, giải phẫu phù hợp) nên được thực hiện trong các trường hợp tổn thương nhiều thân ĐM vành với chức năng tâm thu thất trái giảm nhẹ đến trung bình EF 35-50% (IIa-B) hoặc nặng EF < 35% (I-B).
Nếu không phù hợp với CABG, điều trị nội khoa tối ưu ± cân nhắc PCI nếu giải phẫu cho phép (I-A).
Tổn thương ba thân ĐM vành (kèm theo hoặc không tổn thương đoạn gần LAD) với chức năng tâm thu thất trái bình thường (EF > 50%):
CABG hoặc PCI có thể được cân nhắc để cải thiện sống còn nhưng không chắc chắn về mặt lợi ích (IIb-B).
Tổn thương thân chung có ý nghĩa: CABG nếu phù hợp cần được tiến hành để cải thiện sống còn (I-B). PCI có thể cân nhắc ở một số bệnh nhân chọn lọc, phù hợp với PCI (IIa-B).
Tổn thương đoạn gần LAD có ý nghĩa: Trong trường hợp tổn thương đoạn gần LAD, chức năng tâm thu thất trái bình thường, lợi ích của tái tưới máu để cải thiện sống còn là không chắc chắn (IIb-B).
Tổn thương 1 hoặc 2 nhánh ĐM vành (không bao gồm đoạn gần LAD): Trong trường hợp tổn thương 1 hoặc 2 nhánh ĐM vành (không bao gồm đoạn gần LAD), chức năng tâm thu thất trái bình thường, tái tưới máu không được chỉ định để cải thiện sống còn (III-B).
2.1.3.3 Tái tưới máu để cải thiện các biến cố tim mạch
Các khuyến cáo thực hành lâm sàng trước đây chỉ tập trung việc đánh giá chỉ định tái tưới máu (PCI hoặc CABG) cho hội chứng mạch vành mạn tính nhằm mục đích cải thiện triệu chứng và sống còn nói chung so với điều trị nội khoa. Tuy nhiên, một số dữ liệu lâm sàng và các nghiên cứu gần đây đã chứng minh rằng tái tưới máu (PCI hoặc CABG) ở bệnh nhân tổn thương nhiều thân ĐM vành còn giúp cải thiện cả các biến cố tim mạch như tử vong tim mạch, nhồi máu cơ tim và tái tưới máu mạch vành cấp (IIa-B).
2.2 Chống chỉ định của can thiệp động mạch vành qua da
Tuân theo các chống chỉ định tương đối của chụp ĐM vành qua da (xem lại Chương 13: Chụp động mạch vành và chụp buồng tim), ngoài ra can thiệp ĐM vành nên được cân nhắc không nên thực hiện trong các trường hợp sau:
Giải phẫu động mạch vành không phù hợp cho PCI mà phù hợp cho CABG (đã nêu ở trên) hoặc chỉ điều trị nội khoa đơn thuần nếu cả 2 phương pháp đều không thể thực hiện được.
Bệnh nhân không thích hợp dùng kháng tiểu cầu kép: nguy cơ chảy máu cao, dị ứng với thuốc kháng kết tập tiểu cầu,…
Nhiều lần tái hẹp sau can thiệp động mạch vành.
3 Chuẩn bị can thiệp động mạch vành
3.1 Dụng cụ cơ bản trong can thiệp động mạch vành qua da
Xem thêm Chương 16: Các dụng cụ sử dụng trong can thiệp động mạch vành. Phần này tóm tắt ngắn gọn những dụng cụ thiết yếu trong bảng sau:
Bảng 17.1. Các thiết bị cần thiết để thực hiện PCI thành công
| Bộ dụng cụ mở đường vào mạch máu | Kim chọc mạch |
| Hệ thống bơm thuốc | Hệ thống Manifold |
| Đầu nối chữ Y với van cầm máu | Loại khóa chữ Y thông thường |
Guiding catheter (Ống thông can thiệp) | Có nhiều loại guiding từ các công ty khác nhau và dành cho hệ thống ĐMV phải và trái. Các guiding có độ hỗ trợ khác nhau, tùy theo hình dạng của guiding và đặc điểm giải phẫu gốc ĐMC và lỗ xuất phát ĐMV của bệnh nhân. Đối với ĐMV phải: Judkins Right 4, IMA, Amplatz Right, Multipurpose, KR4, IKARI left, Voda right, Amplatz left Đối với hệ ĐMV trái: Judkins left, IKARI left, Kimny, Voda left, EBU, XB, CLS, SAL, Amplatz left, v.v. |
| Ống thông can thiệp nối dài | Guideliner, Guidezilla, giúp đẩy dụng cụ (bóng, stent) đi qua tổn thương thuận lợi hơn |
| Dây dẫn sử dụng trong thủ thuật | Dây dẫn để đưa ống thông chẩn đoán hoặc guiding vào hệ ĐMV: 0,035 hoặc 0,038”, đầu cong chữ J, giúp dẫn ống thông qua các đoạn mạch xoắn vặn |
| Vi ống thông | FineCross, Caravel, Corsair, Tornus, Crussade |
| Dụng cụ hút huyết khối | Ống hút huyết khối thủ công (Thrombuster, Export catheter) Hệ thống hút huyết khối bằng máy (AngioJet) |
| Chẩn đoán hình ảnh nội mạch | IVUS, OCT |
| Khảo sát áp lực đoạn xa và dòng chảy ĐMV | PressureWire |
| Dụng cụ vượt qua thương tổn/chuẩn bị đặt stent | Bóng nhỏ Vi ống thông Tornus Hệ thống khoan cắt mảng xơ vữa |
| Thiết bị hỗ trợ can thiệp CTO dưới nội mạc | Hệ thống CrossBoss/Stingray LP |
| Bóng và stent | Bóng áp lực cao và bóng áp lực thường với tất cả các kích thước và độ dài khác nhau Stent kim loại trần, stent phủ thuốc và stent có màng bọc |
| Xử lý các biến chứng | Stent có màng bọc Coil bít mạch máu Bộ dụng cụ chọc dịch màng tim Đầu dò siêu âm tim và đầu dò siêu âm mạch máu Snares (thòng lọng): Esnare 18–30 mm hoặc 27–45 mm Bóng và stent mạch máu cho các biến chứng đường vào mạch máu |
| Thiết bị hỗ trợ huyết động | Thiết bị hỗ trợ huyết động |
Chú thích: PCI: Can thiệp động mạch vành qua da; ĐMV: Động mạch vành; IVUS: Siêu âm trong lòng mạch; OCT: Chụp cắt lớp quang học; CTO: Tắc hoàn toàn mạn tính (động mạch vành); IABP: Đặt bóng đối xung động mạch chủ; ECMO: Oxy hóa máu qua màng ngoài cơ thể.
3.2 Thuốc trong can thiệp động mạch vành qua da
Các thuốc sử dụng trong can thiệp ĐMV đã được trình bày đầy đủ trong Chương 9: Các thuốc sử dụng trong tim mạch can thiệp, bài này chỉ tập trung nói về các thuốc chống huyết khối (thuốc chống đông, thuốc kháng kết tập tiểu cầu) trước và trong can thiệp được cập nhật từ các khuyến cáo tái tưới máu động mạch vành của ESC năm 2018 và ACC/AHA/SCAI năm 2021.
3.2.1 Khuyến cáo sử dụng aspirin và thuốc ức chế P2Y12 đường uống ở bệnh nhân thực hiện PCI
| KHUYẾN CÁO | MỨC ĐỘ | BẰNG CHỨNG |
|---|---|---|
| Ở bệnh nhân thực hiện PCI, khuyến cáo dùng liều nạp aspirin, sau đó dùng liều duy trì để giảm các biến cố do thiếu máu | I | B |
| Ở bệnh nhân hội chứng vành cấp có thực hiện PCI, khuyến cáo dùng liều nạp thuốc kháng P2Y12, sau đó dùng liều duy trì để giảm các biến cố do thiếu máu | I | B |
| Ở bệnh nhân hội chứng vành mạn có thực hiện PCI, khuyến cáo dùng liều nạp clopidogrel, sau đó dùng liều duy trì để giảm biến cố do thiếu máu | I | C |
Ở bệnh nhân thực hiện PCI trong vòng 24h sau tiêu sợi huyết, khuyến cáo dùng liều nạp 300mg clopidogrel, sau đó dùng liều duy trì để giảm các biến cố do thiếu máu | I | C |
Ở bệnh nhân hội chứng vành cấp có thực hiện PCI, ưu tiên sử dụng ticagrelor hoặc prasugrel hơn clopidogrel để giảm các biến cố do thiếu máu, bao gồm huyết khối trong stent | IIa | B |
| Ở bệnh nhân < 75 tuổi thực hiện PCI trong vòng 24h sau tiêu sợi huyết, ưu tiên sử dụng ticagrelor hơn clopidogrel để giảm các biến cố do thiếu máu | IIb | B |
| Ở bệnh nhân thực hiện PCI có tiền sử đột quỵ hoặc tai biến mạch máu não thoáng qua, prasugrel không được chỉ định | III | B |
* Chống chỉ định với ticagrelor: tiền sử xuất huyết nội sọ hoặc đang có chảy máu. Chống chỉ định với prasugrel: tiền sử xuất huyết nội sọ, tiền sử nhồi máu não hoặc tai biến mạch máu não thoáng qua, hoặc đang có chảy máu. Prasugrel cần được thận trọng dùng liều thấp hơn ở bệnh nhân ≥ 75 tuổi hoặc cân nặng < 60 kg
3.2.2 Khuyến cáo sử dụng ức chế P2Y12 đường tĩnh mạch ở bệnh nhân thực hiện PCI
| KHUYẾN CÁO | MỨC ĐỘ | BẰNG CHỨNG |
|---|---|---|
| Ở bệnh nhân thực hiện PCI chưa từng dùng thuốc kháng thụ thể P2Y12, cân nhắc sử dụng cangrelor truyền tĩnh mạch để giảm các biến cố thiếu máu khi thực hiện thủ thuật | IIb | B |
3.2.3 Khuyến cáo sử dụng thuốc ức chế glycoprotein IIb/III đường tĩnh mạch ở nhân thực hiện PCI
| KHUYẾN CÁO | MỨC ĐỘ | BẰNG CHỨNG |
|---|---|---|
Ở bệnh nhân hội chứng vành cấp được thực hiện PCI có gánh nặng huyết khối lớn, mất dòng tái thông, hoặc dòng chảy chậm, cân nhắc sử dụng thuốc ức chế glycoprotein IIb/IIIa đường tĩnh mạch để cải thiện tỷ lệ thành công của thủ thuật. | IIb | C |
| Ở bệnh nhân hội chứng vành mạn có thực hiện PCI, không khuyến cáo sử dụng thuốc ức chế glycoprotein IIb/IIIa thường quy | III | B |
Bảng 17.2. Thuốc kháng ngưng tập tiểu cầu đường uống và đường tiêm ở bệnh nhân thực hiện PCI
| THUỐC | LIỀU NẠP | LIỀU DUY TRÌ |
|---|---|---|
| Thuốc kháng ngưng tập tiểu cầu đường uống | ||
| Aspirin | Liều nạp: 162-325 mg uống Có thể nhai để hấp thu nhanh hơn | Liều duy trì: 75-100mg uống mỗi ngày |
| Clopidogrel | Liều nạp: 600mg đường uống | Liều duy trì: 75mg uống mỗi ngày |
| Prasugrel | Liều nạp: 60mg đường uống | – Liều duy trì: 10mg uống mỗi ngày – Ở bệnh nhân ≥ 75 tuổi, có thể dùng liều 5 mg mỗi ngày nếu thật sự cần thiết |
| Ticagrelor | Liều nạp: 180mg đường uống Có thể nhai để hấp thu nhanh hơn | Liều duy trì: 90mg uống 2 lần mỗi ngày |
| Thuốc kháng ngưng tập tiểu cầu đường tiêm | ||
| Abciximab (GPI) | Bolus liều 0,25mg/kg | Liều duy trì: 0,125 µg/kg/phút truyền tĩnh mạch (tối đa 10g/phút) trong 12h |
| Eptifibatide (GPI) | Bolus hai lần liều 180µg/kg (cách nhau 10 phút) | Liều duy trì: 2,0 µg/kg/phút truyền tĩnh mạch trong tối đa 18h |
| Tirofiban (GPI | Bolus liều 25 µg/kg trong 3 phút | Liều duy trì: 0,15 µg/kg/phút truyền tĩnh mạch trong tối đa 18h |
| Cangrelor | Bolus liều 30 µg/kg | Liều duy trì: 4 µg/kg/phút truyền tĩnh mạch trong ít nhất 2h hoặc trong suốt quá trình can thiệp |
3.2.4 Khuyến cáo sử dụng heparin, heparin trọng lượng phân tử thấp và bivalirudin ở bệnh nhân thực hiện PCI
| KHUYẾN CÁO ACC 2021 | MỨC ĐỘ | BẰNG CHỨNG |
|---|---|---|
| Ở bệnh nhân thực hiện PCI, sử dụng Heparin không phân đoạn (UFH) truyền tĩnh mạch để giảm biến cố thiếu máu | I | C |
| Ở bệnh nhân có giảm tiểu cầu do heparin cần thực hiện PCI, cần thay thế UFH bởi bivalirudin hoặc argatroban để tránh biến chứng do huyết khối | I | C |
| Ở bệnh nhân thực hiện PCI, bivalirudin có thể thay thế UFH để giảm nguy cơ chảy máu | IIb | A |
Ở bệnh nhân sử dụng enoxaparin tiêm dưới da trong điều trị đau ngực không ổn định hoặc nhồi máu cơ tim cấp không ST chênh, cân nhắc dùng enoxaparin tiêm tĩnh mạch tại thời điểm PCI để giảm các biến cố thiếu máu | IIb | B |
| Ở bệnh nhân đang điều trị enoxaparin tiêm dưới da mà liều tiêm cuối cùng trong vòng 12h trước can thiệp PCI, không nên dùng UFH khi tiến hành PCI vì có thể làm tăng nguy cơ chảy máu | III | B |
Bảng 17.3. Liều thuốc chống đông đường tĩnh mạch trong can thiệp động mạch vành qua da (PCI)
| THUỐC | BỆNH NHÂN ĐÃ DÙNG THUỐC CHỐNG ĐÔNG | BỆNH NHÂN ĐÃ DÙNG THUỐC CHỐNG ĐÔNG |
|---|---|---|
| UFH | Dùng thêm UFH nếu cần (ví dụ 2000-5000UI) để đạt ACT 250 – 300s* | Ban đầu bolus 70-100 UI/kg để đạt ACT 250 – 300s * |
| Enoxaparin | Với bệnh nhân đã điều trị với enoxaparin, nếu liều tiêm dưới da cuối cùng trong vòng 8-12h trước PCI hoặc nếu chỉ mới dùng 1 liều tiêm dưới da enoxaparin, nên tiêm tĩnh mạch enoxaparin liều 0,3 mg/kg | Bolus 0,5-0,75 mg/kg tiêm tĩnh mạch |
| Bivalirudin | Với bệnh nhân đã dùng UFH, làm lại ACT | Bolus 0,75 mg/kg, sau đó truyền tĩnh mạch liều 1,75 mg/kg/h |
| Argatroban | Bolus 200 µg/kg sau đó truyền tĩnh mạch tốc độ 15 µg/kg/phút | Bolus 350 µg/kg, sau đó truyền tĩnh mạch tốc độ 15 µg/kg/phút |
* Đích ACT để chỉnh liều UFH xem ở các thiết bị HemoTec (GmbH, Switzerland) hoặc I-Stat (Abbott). Với máy Hemochron ACT (Werfen), đích ACT cao hơn 50s. Trong trường hợp CTO hoặc hội chứng vành cấp, cân nhắc để đích ACT cao hơn. Nếu có dự định sử dụng ức chế glycoprotein IIb/IIIa, đích ACT trong khoảng 200-250s.
3.3 Thuốc cản quang trong PCI
Thuốc cản quang sử dụng trong PCI chủ yếu là thuốc cản quang có chứa iod. Dựa vào số lượng phân tử (đơn phân hay trùng hợp) và đặc tính ion hóa (có hay không) mà thuốc cản quang iod được chia thành 4 loại: Đơn phân Iod hóa, đơn phân không ion hóa, trùng hợp ion hóa, trùng hợp không ion hóa.
Bảng 17.4. Thuốc cản quang dùng trong can thiệp động mạch vành
| TÊN THUỐC | NHÓM | ĐỘ THẨM THẤU (MOSMOL/KG H2O) |
|---|---|---|
| Telebrix | Đơn phân iod hóa | 2100 |
| Xenetix | Đơn phân không ion hóa | 695 |
| Omnipaque | Đơn phân không ion hóa | 690 |
| Ultravist | Đơn phân không ion hóa | 607 |
| Visipaque | Đơn phân không ion hóa | 290 |
Độc tính của thuốc cản quang (do nhóm carboxyl) gây tổn thương trực tiếp tế bào nội mô và tế bào ống thận. Do đó, thuốc cản quang không ion hóa (dạng monomer hoặc dimer) thường được sử dụng để hạn chế độc tính của nhóm carboxyl.
Áp lực thẩm thấu thuốc cản quang cao làm tăng áp lực thẩm thấu của dịch lọc cầu thận gây tắc nghẽn cơ học lòng ống thận dẫn đến hoại tử tế bào ống thận. Do đó, thường chọn loại thuốc cản quang có áp lực thẩm thấu thấp.
4 Các bước tiến hành can thiệp động mạch vành cơ bản
4.1 Đại cương
Để thực hiện PCI thành công đòi hỏi phải lập kế hoạch tốt. Đường vào mạch máu, thuốc chống đông, chống kết tập tiểu cầu, đánh giá tốt các tổn thương đích, chẩn đoán hình ảnh nội mạch, các biện pháp hỗ trợ (các thủ thuật khoan phá hoặc thay đổi mảng xơ vữa) và các dụng cụ cần thiết để thực hiện thủ thuật và xử lý các biến chứng nên có sẵn.
Các bước cơ bản chính của thủ thuật can thiệp ĐMV bao gồm: đưa hệ thống tới vị trí đích bằng guiding, lái dây dẫn qua tổn thương, nong bóng chuẩn bị tổn thương và cuối cùng là đặt stent. Bác sĩ can thiệp cần nắm vững quy trình kỹ thuật từng bước, các thách thức và biến chứng có thể gặp phải, cũng như chiến lược xử trí phù hợp.
Bảng 17.5. Các bước can thiệp động mạch vành cơ bản
|
4.2 Đường vào mạch máu
Các phương pháp tiếp cận đường vào mạch máu phổ biến này bao gồm đường vào động mạch quay phải và trái, động mạch trụ phải và trái, đoạn xa động mạch quay phải và trái (động mạch mu bàn tay), động mạch đùi và động mạch cánh tay. Phương pháp tiếp cận qua đường vào động mạch cảnh, động mạch nách có thể cần thiết trong một số trường hợp lâm sàng phù hợp. Đối với mỗi cách tiếp cận, bác sĩ can thiệp cần phải nắm rõ các hạn chế, ưu điểm, nhược điểm, kỹ thuật mở mạch và đóng mạch, các nguy cơ biến chứng và cách xử lý chúng (xem Chương 10: Mở và đóng đường vào mạch máu).
4.3 Ống thông can thiệp (guiding catheter)
4.3.1 Lựa chọn guiding phù hợp
Guiding catheter (ống thông can thiệp), gọi tắt là guiding, có các mục đích: gắn đồng trục vào mạch vành mục tiêu để tránh tổn thương vị trí tiếp cận và đưa được dụng cụ vào lòng mạch, cung cấp hỗ trợ và sự ổn định trong quá trình can thiệp khi thay đổi các dụng cụ như bóng, stent, và các dụng cụ hỗ trợ. Chọn guiding thích hợp là một bước rất quan trọng. Nó có thể làm cho việc can thiệp trở nên dễ dàng và nhẹ nhàng hơn đáng kể so với việc sử dụng guiding không phù hợp. Các đặc điểm cơ bản của guiding được trình bày trong Chương 16.
Lựa chọn ống thông dựa trên đặc điểm tổn thương: vị trí của tổn thương (ở lỗ vào hay không), độ khó của tổn thương và nhu cầu hỗ trợ (xoắn vặn, vôi hóa mạch vành), can thiệp tắc hoàn toàn cấp tính và mạn tính (CTO).
Về mặt kỹ thuật, hầu hết các ống thông đường đùi có thể được sử dụng trong phương pháp tiếp cận qua đường mạch quay và ngược lại. Nói chung, tiếp cận đường động mạch đùi thường cung cấp sự trợ lực tốt hơn. Nếu tiên lượng ca can thiệp khó khăn (tổn thương gập góc, vôi hoá, tổn thương CTO), thầy thuốc can thiệp cần chủ động lựa chọn đường vào động mạch đùi. Đường vào động mạch đùi cũng cho phép sử dụng các guiding kích cỡ lớn (7Fr, 8Fr). Chương 16 đã trình bày về sự tương thích của guiding các cỡ từ 5Fr tới 8Fr với các dụng cụ sử dụng trong can thiệp ĐMV. Ưu và nhược điểm của các loại kích cỡ này được mô tả theo bảng dưới đây:
Bảng 17.6. Một số yếu tố cân nhắc khi lựa chọn guiding catheter
| 5Fr | 6Fr | 7-8Fr | |
|---|---|---|---|
| Ưu điểm | Đường vào mạch máu nhỏ Ít co thắt (động mạch quay) Đưa sâu vào mạch vành ít gây chấn thương Ít tốn thuốc cản quang | Đường vào mạch máu nhỏ Ít tốn thuốc cản quang Cho phép các thiết bị hút huyết khối, siêu âm trong lòng mạch, đầu khoan nhỏ | Hỗ trợ can thiệp tốt và hình ảnh chụp rõ Truyền lực xoay tốt hơn Cho phép thực hiện kỹ thuật 2 stent đồng thời Cho phép các thiết bị kích thước lớn |
| Nhược điểm | Lòng bên trong nhỏ Hình chụp kém rõ Hỗ trợ ít và điều chỉnh khó | Chỉ cho phép hệ thống một stent Không cho các thiết bị kích thước lớn hơn đi qua | Phải mở đường vào động mạch đùi Cầm máu khó Tốn thuốc cản quang Hiện tượng hãm áp lực |
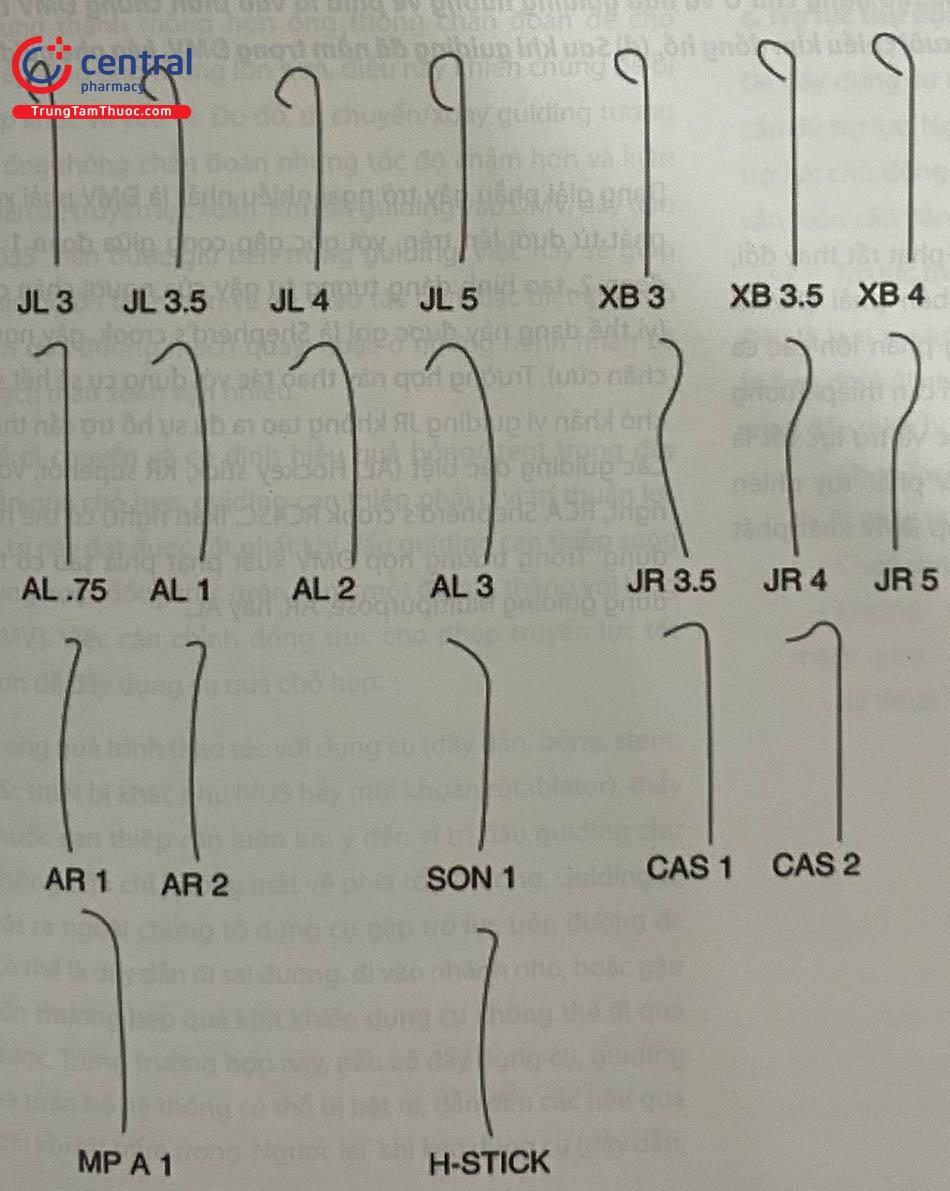
- Guiding cho hệ thống vành trái
Có rất nhiều guiding catheter dành cho hệ thống vành trái và chúng có thể được lựa chọn sử dụng linh hoạt để phù hợp với những biến thể giải phẫu khác nhau.
Guiding JL là guiding cơ bản nhất, nhưng sự trợ lực kém nhất. Vì thế không nên là lựa chọn đầu tay. Các loại guid- ing XB, EBU, AL cung cấp sự trợ lực tốt hơn, nhưng lại dễ gây sang chấn mạch vành hơn. Lựa chọn guiding JL cho các trường hợp tổn thương đơn giản, thân chung ĐMV trái ngắn hoặc dễ bị sang chấn.
(c) Xoay nhẹ guiding ngược chiều hoặc xuôi chiều kim đồng hồ, (d) Sau khi guiding đã nằm trong ĐMV, kéo nhẹ guiding để guiding đồng trục.
- Guiding cho hệ thống vành phải
ĐMV phải có vị trí lỗ vào và hướng xuất phát rất thay đổi, tuy nhiên, ống thông thông thường bên phải (JR/FR/ IMA/3RDC/AR) vẫn được sử dụng trong phần lớn các ca can thiệp do sự quen thuộc với các bác sĩ can thiệp. Tương tự can thiệp ĐMV bên trái, sự đồng trục và trợ lực tốt là 2 yếu tố quan trọng khi can thiệp ĐMV phải, tuy nhiên khó đạt được cùng lúc trong trường hợp ĐMV xuất phát bất thường.
Dạng giải phẫu gây trở ngại nhiều nhất là ĐMV phải xuất phát từ dưới lên trên, với góc gập cong giữa đoạn 1 với đoạn 2, tạo hình dáng tương tự gậy của người chăn cừu (vì thế dạng này được gọi là Shepherd’s crook, gậy người chăn cừu). Trường hợp này thao tác với dụng cụ sẽ hết sức khó khăn vì guiding JR không tạo ra đủ sự hỗ trợ cần thiết. Các guiding đặc biệt (AL, Hockey stick, KR superior, Voda right, RCA Shepherd’s crook RC4SC, Ikari right) có thể hữu dụng. Trong trường hợp ĐMV xuất phát phía sau có thể dùng guiding Multipurpose, AR, hay AL.
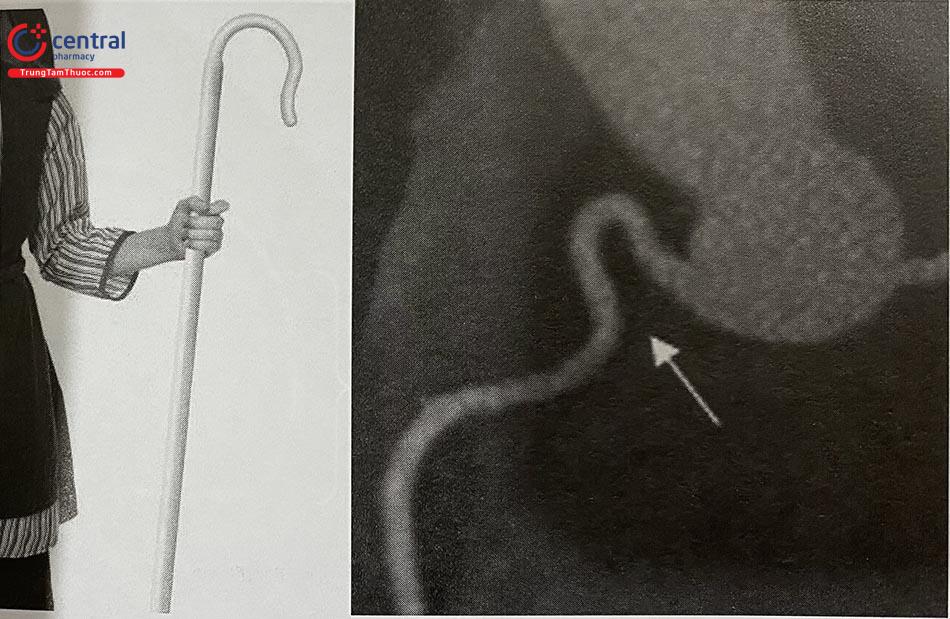
4.3.2 Thao tác với guiding
Guiding mặc dù có 3 lớp (ống thông chẩn đoán có 2 lớp) nhưng thành mỏng hơn ống thông chẩn đoán để cho phép lòng ống thông lớn hơn, điều này khiến chúng dễ bị gấp khúc và yếu đi. Do đó, di chuyển/xoay guiding tương tự ống thông chẩn đoán nhưng tốc độ chậm hơn và kiên nhẫn để truyền lực xoắn. Khi đặt guiding vào ĐMV, dây dẫn 0,035″ nên được giữ bên trong guiding. Việc này sẽ giúp guiding ổn định hơn và dễ thao tác hơn, đặc biệt khi tiếp cận qua đường mạch quay, hoặc ở những bệnh nhân có mạch máu xoắn vặn nhiều.
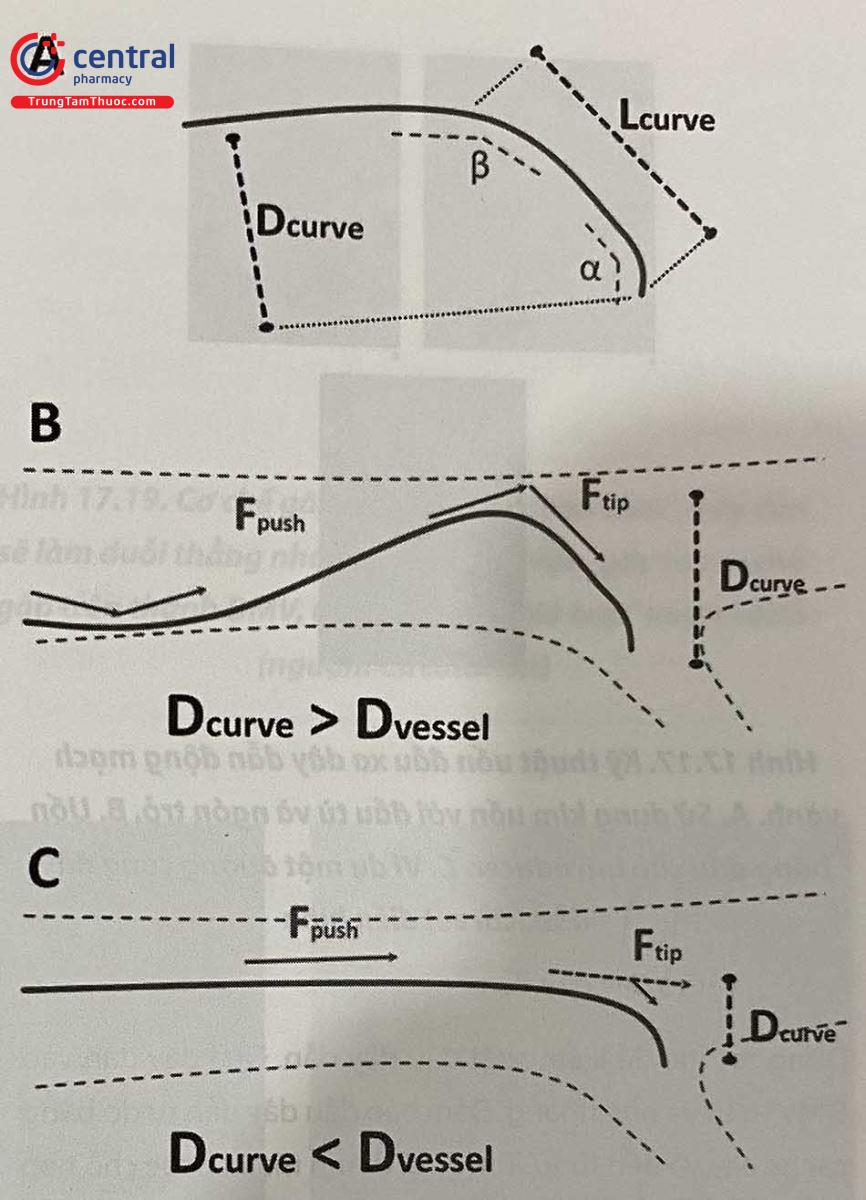
Để di chuyển và cố định hiệu quả bóng/stent trong dây dẫn qua chỗ hẹp, guiding can thiệp phải ở vị trí thuận lợi. Vị trí này đạt được tốt nhất khi đầu guiding can thiệp song song hoặc đồng trục (trên cùng một đường thẳng với lòng ĐMV). Việc căn chỉnh đồng trục cho phép truyền lực tốt hơn để đẩy dụng cụ qua chỗ hẹp.
Trong quá trình thao tác với dụng cụ (dây dẫn, bóng, stent, các thiết bị khác như IVUS hay mũi khoan rotablator), thầy thuốc can thiệp cần luôn lưu ý đến vị trí đầu guiding chứ không nên chỉ hướng mắt về phía tổn thương. Guiding bị bật ra ngoài chứng tỏ dụng cụ gặp trở lực trên đường đi. Có thể là dây dẫn đi sai đường, đi vào nhánh nhỏ, hoặc gặp tổn thương hẹp quá khít khiến dụng cụ không thể đi qua được. Trong trường hợp này, nếu cố đẩy dụng cụ, guiding và toàn bộ hệ thống có thể bị bật ra, dẫn đến các hậu quả đôi khi rất trầm trọng. Ngược lại, khi kéo dụng cụ (dây dẫn, bóng, stent) ra khỏi lòng mạch, guiding có thể bị hút vào sâu, gây sang chấn ĐMV.
4.3.3 Trợ lực thụ động và trợ lực chủ động
Để đẩy dụng cụ (bóng, stent) thuận lợi, guiding cần cung cấp đủ trợ lực. Người ta chia ra hai loại: trợ lực thụ động và trợ lực chủ động. Nhớ rằng trong bất cứ trường hợp nào, vẫn luôn cần đảm bảo tính đồng trục của guiding.
4.3.3.1 Trợ lực thụ động
Đây là loại trợ lực có được từ hỗ trợ vật lý của hệ thống, không đòi hỏi nhiều thao tác của thủ thuật viên trong quá trình đẩy thiết bị. Trợ lực thụ động bao gồm:
- Chọn loại guiding trợ lực tốt (VD chọn EBU thay vì JL, AL thay vì JR).
- Chọn guiding đường kính lớn (7Fr, 8Fr).
- Đường vào động mạch đùi thay vì động mạch
- Kỹ thuật “mỏ neo”.
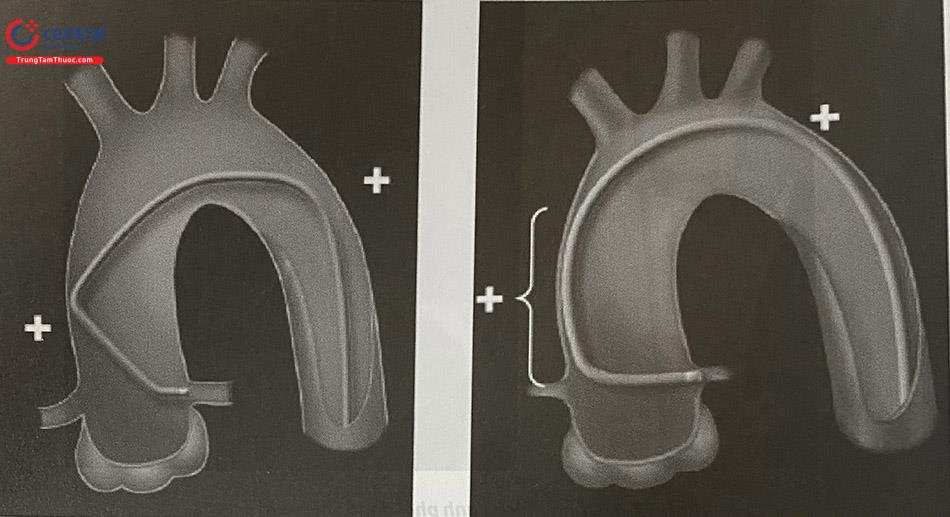
Kỹ thuật “mỏ neo” với bóng được thực hiện như sau: (1) lái 1 dây dẫn đi vào nhánh chính có tổn thương cần can thiệp và 1 dây dẫn đi vào nhánh bên, (2) đẩy bóng theo dây dẫn phụ vào nhánh bên, (3) bơm bóng ở nhánh bên với áp lực thấp, giúp tạo ra một “mỏ neo” để hệ thống không bật ra ngoài, đồng thời đẩy dụng cụ (vi ống thông, Tornus, bóng, stent) đi qua tổn thương ở nhánh chính, (4) sau khi dụng cụ đã đến vị trí cần thiết, làm xẹp bóng ở nhánh bên.
Đôi khi, có thể dùng trực tiếp bóng “mỏ neo” ở đoạn mạch cần can thiệp. Khi đó, 2 dây dẫn sẽ đồng thời chạy trong một nhánh mạch vành.

Có một số chi tiết kỹ thuật cần lưu ý khi thực hiện kỹ thuật “mỏ neo”:
- Tránh gây lóc tách hay thủng nhánh bên do bơm bóng quá căng.
- Guiding cần có đường kính đủ lớn để đẩy các thiết bị (2 dây dẫn, 1 bóng, 1 stent).
- Stent vẫn có thể bị rơi, xoắn, biến dạng, ngay cả khi có bóng neo ở nhánh bên. Vì thế không cố đẩy quá mức. Đổi sang chiến thuật khác nếu cảm thấy nhiều trở lực.
4.3.3.2 Trợ lực chủ động
Đây là loại trợ lực đòi hỏi thao tác từ thủ thuật viên, bao gồm:
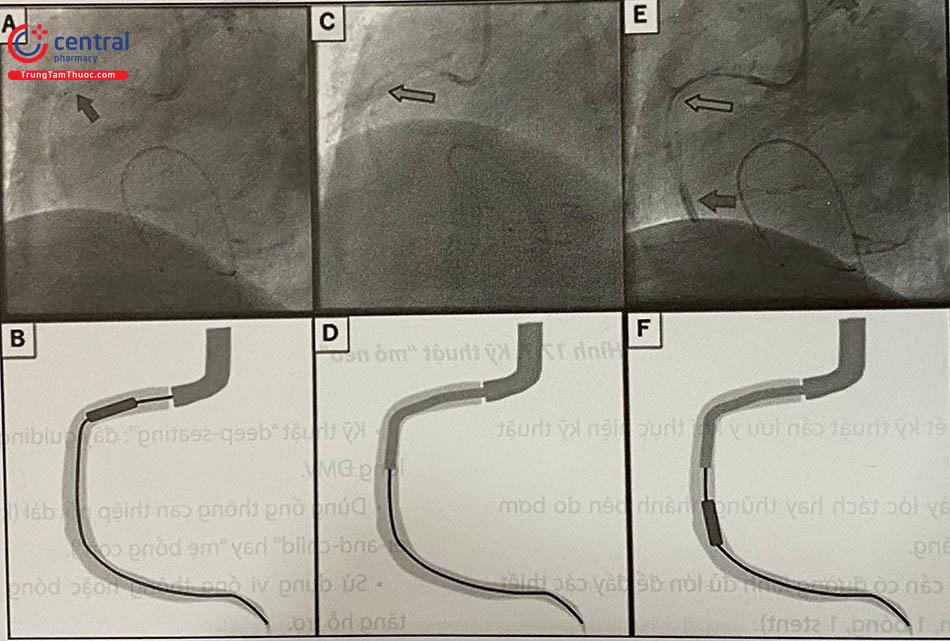
- Kỹ thuật “deep-seating”: đẩy guiding vào sâu trong lòng ĐMV.
- Dùng ống thông can thiệp nối dài (kỹ thuật “moth- er-and-child” hay “mẹ bồng con”).
- Sử dụng vi ống thông hoặc bóng đồng trục để tăng hỗ trợ.
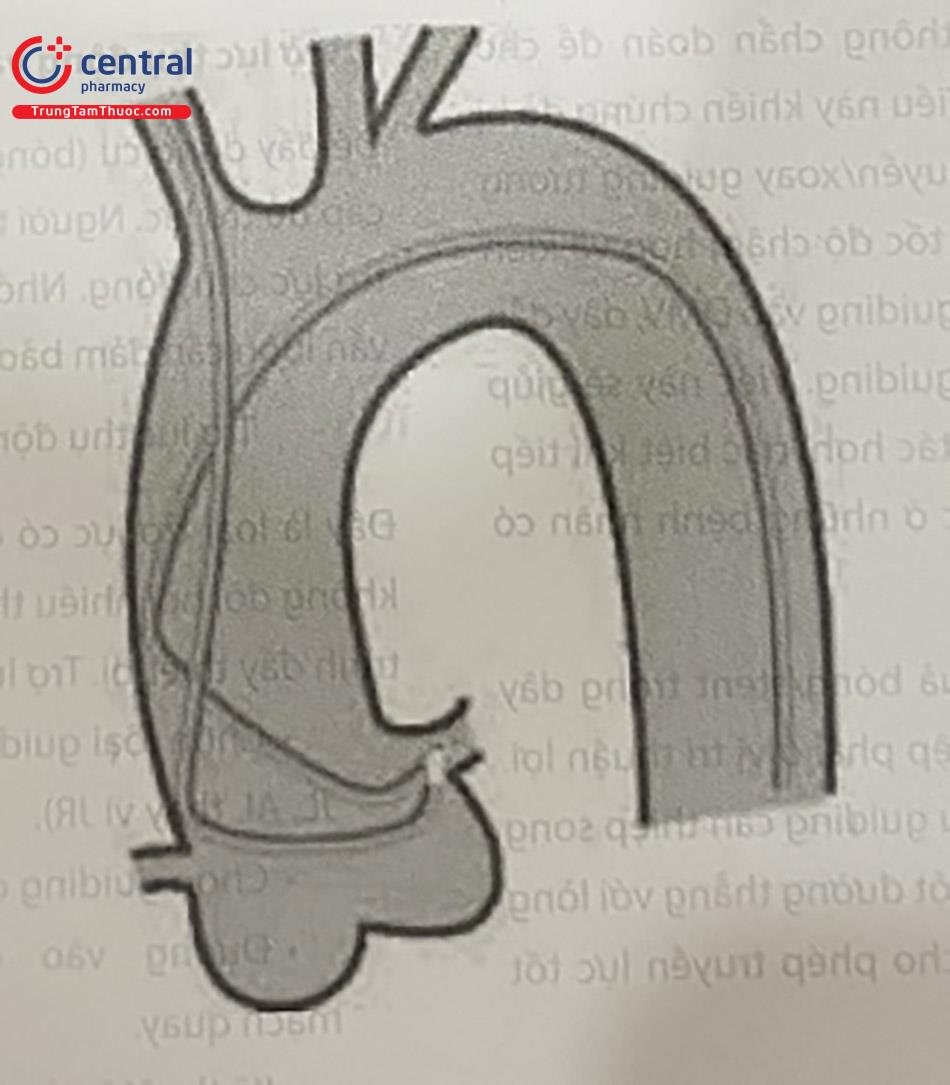
Đẩy guiding vào sâu trong ĐMV
Với can thiệp ĐMV phải, kỹ thuật deep-seating có thể được thực hiện tương đối an toàn (trong trường hợp không có tổn thương đoạn gần) như sau: (1) trượt guiding trên dây dẫn, (2) đồng thời dùng tay xoay nhẹ guiding theo chiều kim đồng hồ, guiding sẽ đi sâu vào lòng mạch vành.
Hạn chế đẩy guiding vào sâu trong thân chung ĐMV trái do rất nguy hiểm.
Ống thông can thiệp nối dài
Thiết kế của dụng cụ này được trình bày chi tiết trong Chương 16. Các hình dưới đây mô tả một số trường hợp
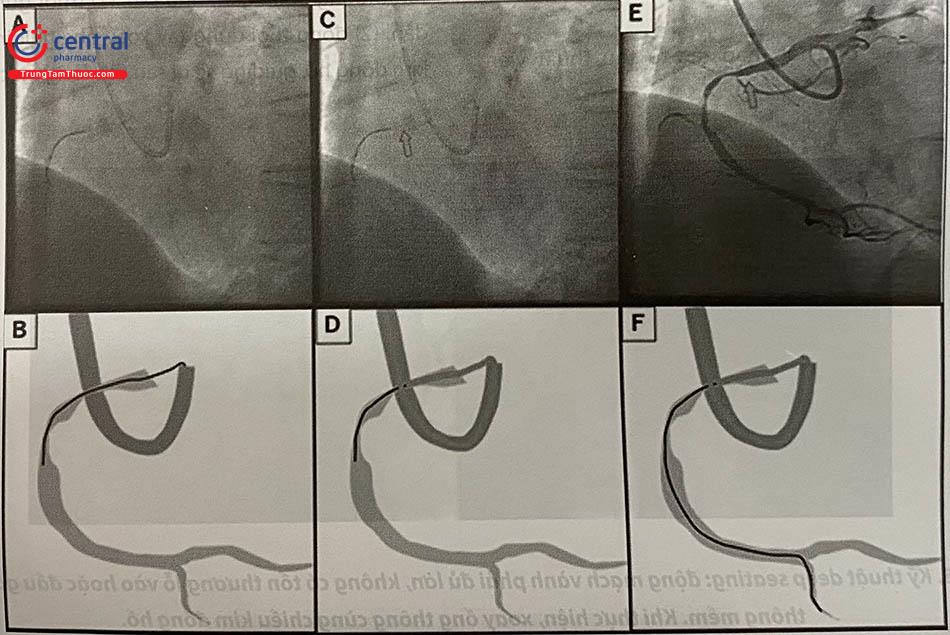

4.3.4 Hiện tượng thất hoá
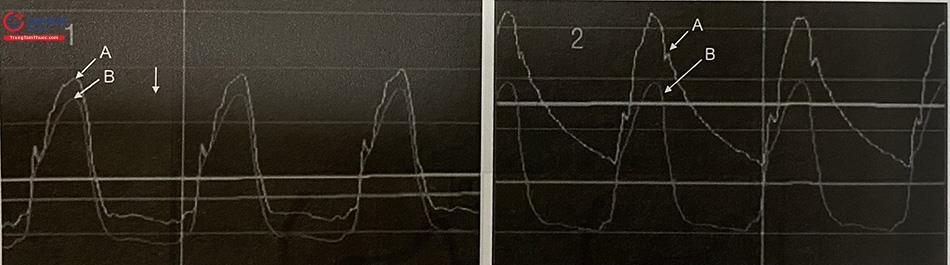
Với các trường hợp hẹp lỗ vào hoặc đoạn gần ĐMV, guid- ing nằm quá sâu trong lòng mạch vành có thể dẫn đến bít tắc dòng máu, biểu hiện là sự thay đổi hình dạng sóng áp lực động mạch, áp lực tâm trương tụt thấp (hiện tượng thất hoá). Đồng thời, khi bơm thuốc cản quang vào lòng mạch vành, sẽ có hiện tượng chậm thoát thuốc.

Guiding với các lỗ bên nhỏ ở gần đầu ống cho phép máu vẫn đi vào động mạch vành khi lỗ động mạch bị chặn bởi chính guiding, nhờ đó hạn chế nguy cơ thiếu máu mạch vành. Tuy nhiên, các lỗ bên này có thể dẫn đến sự quan sát không đầy đủ động mạch do thoát thuốc cản quang khỏi guiding trước khi đi vào động mạch. Dây dẫn can thiệp có thể đi ra khỏi các lỗ bên và bác sĩ can thiệp phải chú ý phát hiện được vấn đề tiềm ẩn đó để tránh biến chứng có thể xảy ra. Cuối cùng, các lỗ bên có thể làm tăng lượng thuốc cản quang được sử dụng và làm yếu phần đầu của guid- ing,khiến nó dễ bị gấp khúc.
4.4 Dây dẫn can thiệp động mạch vành (coronary an- gioplasty guidewire – CAG)
4.4.1 Lựa chọn dây dẫn
Các đặc điểm cơ bản của dây dẫn can thiệp đã được trình bày trong Chương 16. Mỗi bác sĩ can thiệp cần thành thạo một số loại dây dẫn cơ bản, hiểu rõ đặc tính của chúng, cũng như các nhược điểm. Các đặc tính của dây dẫn là: đường kính, độ đâm xuyên, lớp phủ, độ xoay, độ mềm dẻo, khả năng uốn, độ cản quang, cũng như độ luồn lách. Lựa chọn dây dẫn tùy theo đặc điểm tổn thương và sự quen thuộc của thủ thuật viên.
Luôn luôn bắt đầu với dây dẫn thường quy như BMW, Sion, Runthrough, v.v.). Tránh sử dụng dây dẫn quá cứng hay có độ đâm xuyên cao ngay từ đầu.
4.4.2 Thao tác với dây dẫn
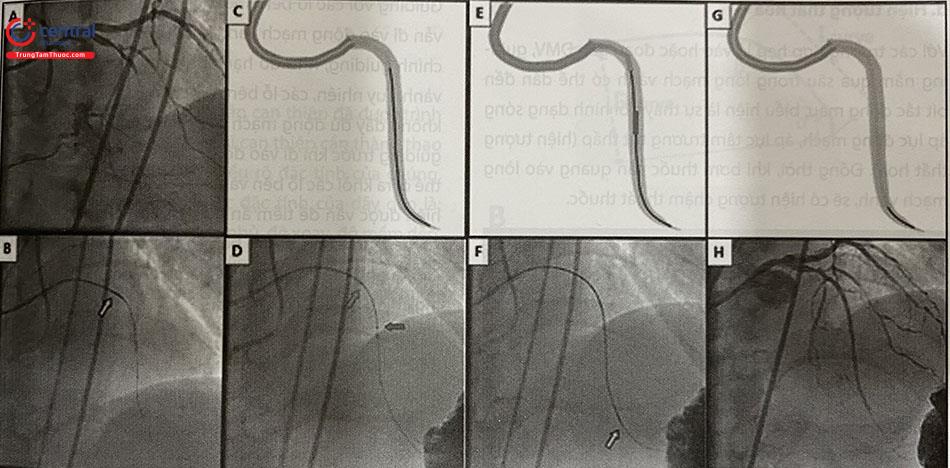
- Uốn đầu dây dẫn
Đây là một khâu quan trọng để vượt qua tổn thương đích nhất là khi mạch xoắn vặn. Đối với mỗi tổn thương cụ thể, bác sĩ can thiệp cần có các cách khác nhau để uốn đầu dây dẫn phù hợp. Uốn nhẹ đầu dây bằng kim hoặc introducer. Đối với các dây dẫn ngậm nước, cần nhúng ướt trước khi thực hiện thao tác này.
Đường cong đầu tiên (primary curve) là đường cong gần đầu tận dây dẫn hơn. Đường cong thứ hai (second- ary curve) là đường cong ở xa đầu dây dẫn. Quy tắc cơ bản là uốn đường cong đầu tiên phù hợp với góc gập của tổn thương và đường cong thứ hai phù hợp với góc gập và kích thước nhánh mạch đích. Khi cần điều khiển dây dẫn đi vào các đoạn mạch xoắn vặn, đường cong thứ hai lớn hơn kích thước mạch giúp dây dẫn dễ vào nhánh bên hơn.
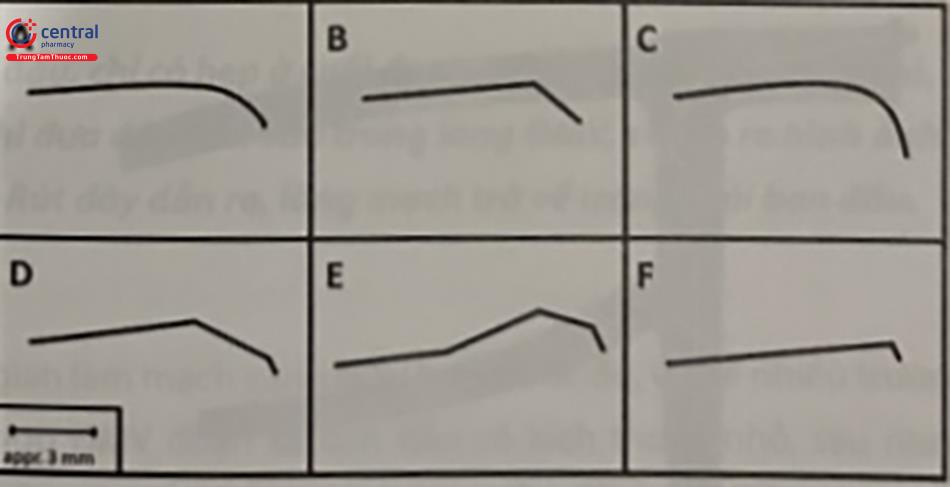
- Lái và đẩy dây dẫn
Dùng torque để kiểm soát đầu dây dẫn. Đưa dây dẫn vào ĐMV từ từ và nhẹ nhàng. Đảm bảo đầu dây dẫn tự do bằng cách xoay và tiến từ từ. Tìm vị trí thành mạch hoặc chỗ hẹp an toàn nhất để vượt qua tổn thương bằng cách sử dụng nhiều góc nhìn và hướng đầu dây dẫn vào đó trong khi xoay và tiến lên để vượt qua tổn thương.

Không bao giờ di chuyển qua tổn thương nếu phần đầu đã bị cong gập (knuckled wire). Khi đó, cần kéo dây dẫn về để làm thẳng phần đầu, rồi xoay nhẹ để dây dẫn lách qua tổn thương. Đẩy dây dẫn vào sâu khi phần đầu đã bị gập cong có thể khiến dây dẫn trượt qua lớp nội mô và gây lóc tách mạch vành (trừ khi bác sĩ can thiệp cố ý sử dụng như một kỹ thuật can thiệp CTO bằng cách sử dụng một số loại dây dẫn cụ thể và mục tiêu là băng qua lớp nội mô và kéo lại vào lòng thật). Trường hợp ngoại lệ cho phép là khi gánh nặng huyết khối lớn và đường đi mạch vành không rõ ràng. Dây dẫn có thể dễ dàng đi qua cục huyết khối và đảm bảo thành mạch an toàn và đi theo đường đi của mạch vành. Tuy nhiên, kỹ thuật này nên được thực hiện bởi bác sĩ can thiệp có kinh nghiệm.
Để tránh biến chứng thủng mạch vành, cần giữ dây dẫn trong mạch chính lớn (không phải nhánh nhỏ) và luôn chú ý đến đầu xa của dây dẫn. Điều này đặc biệt quan trọng nếu đoạn xa mạch vành không hiện hình rõ như khi can thiệp CTO hoặc can thiệp nhồi máu cơ tim cấp có huyết khối gây tắc hoàn toàn mạch vành. Thủng đoạn xa ĐMV có thể bị bỏ sót, gây chảy máu chậm và mất nhiều giờ để biểu hiện chèn ép tim. Do đó, việc phòng ngừa và phát hiện sớm là rất quan trọng. Tất cả các loại dây dẫn đều có thể gây thủng mạch vành đặc biệt là đoạn xa. Xin xem thêm Chương 25: Biến chứng của can thiệp.
Trong trường hợp dây dẫn gặp tổn thương hẹp khít hay tổn thương cứng khó xuyên qua, bác sĩ can thiệp có thể sử dụng vi ống thông (micro-catheter) hoặc bóng over-the- wire để tăng độ trợ lực. Sử dụng bóng hoặc vi ống thông đặt gần đầu dây dẫn có thể tăng độ đâm xuyên lên tới 10 lần, tuỳ thuộc vào loại dây dẫn.
Lưu ý rằng trong một số trường hợp mạch vành xoắn vặn, đẩy dây dẫn mềm vào trong lòng ĐMV có thể gây co thắt ĐMV, tạo hình ảnh “giả hẹp”, hoặc “giả bóc tách”. Đây gọi là hiện tượng accordion (đàn phong cầm). Thầy thuốc can thiệp cần đặc biệt lưu ý, tránh nong bóng và đặt stent những đoạn mạch vành này, vì khi kéo dây dẫn ra khỏi lòng mạch, ĐMV sẽ trở về trạng thái bình thường.
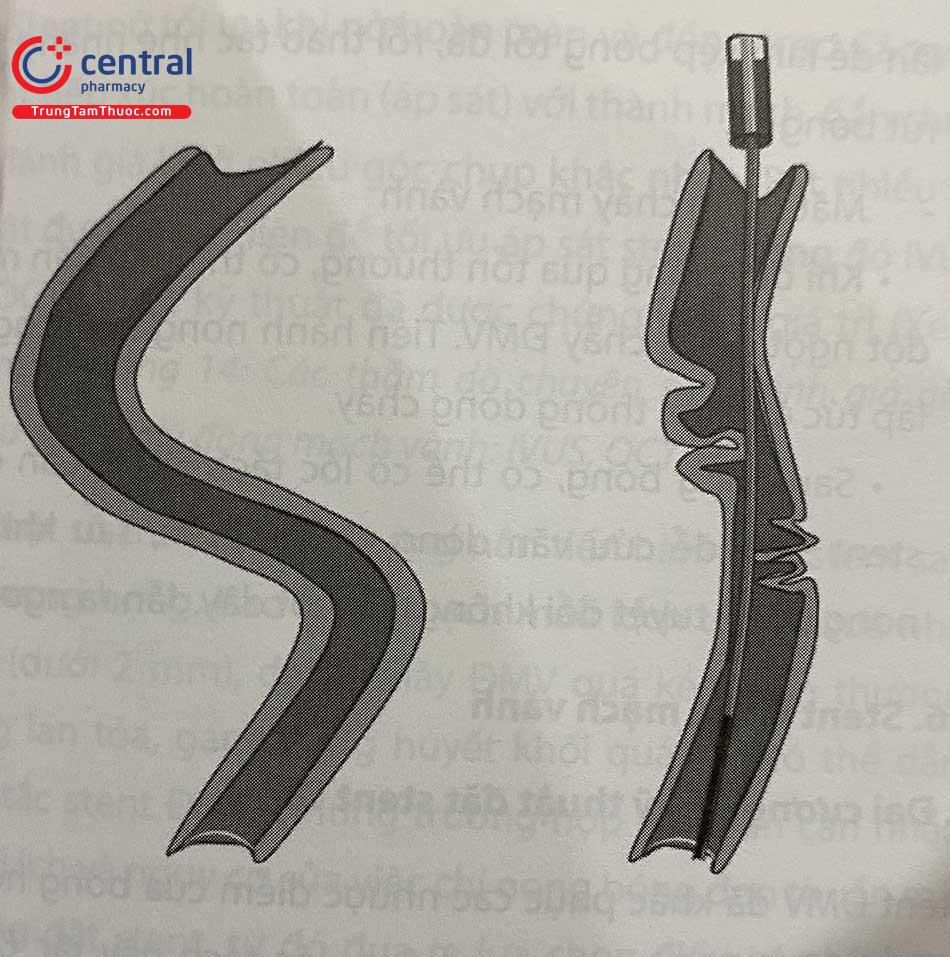

4.5 Bóng nong động mạch vành
4.5.1 Các vấn đề kỹ thuật
Dựa vào độ đàn hồi và độ cứng của vật liệu Nhựa, có hai loại bóng: bóng áp lực thường (giãn) và bóng áp lực cao (không giãn). Bóng áp lực thường khi được bơm với áp lực cao hơn áp lực chuẩn sẽ làm bóng giãn thêm 10-20%. Bóng áp lực cao, ngược lại, luôn giữ ổn định kích thước thậm chí kể cả bơm cao hơn nhiều áp lực.
Nói chung, nên nong bóng chuẩn bị trước khi đặt stent. Điều này giúp thầy thuốc nhận định tổn thương chính xác hơn, cũng như đánh giá độ phức tạp của tổn thương và lựa chọn kích thước stent phù hợp. Sau khi nong rộng chỗ hẹp, dòng máu được cải thiện sẽ giải phóng các chất trung
gian làm mạch vành giãn hơn trước đó, vì thế nhiều trường hợp ĐMV đoạn xa ban đầu có kích thước nhỏ, sau nong bóng lại có đường kính tăng lên đáng kể. Đặt stent trực tiếp có thể dẫn đến ước tính kích cỡ stent nhỏ hơn kích cỡ lòng mạch.
Khi chọn kích thước bóng/stent, sử dụng đường kính tham chiếu của mạch đoạn xa ước tính so với đường kính của ống thông. Lượng giá bằng mắt kích thước của mạch kém chính xác hơn chụp mạch vành định lượng (Quantitative coronary angiography – QCA) và hình ảnh nội mạch (IVUS, OCT), nhưng là biện pháp được sử dụng của hầu hết các bác sĩ trong quá trình can thiệp. Theo các nghiên cứu với IVUS, hầu hết stent được lựa chọn bằng mắt thường sẽ nhỏ hơn 0,5 mm so với đường kính thực tế của mạch. Thông thường, nên bắt đầu với bóng kích thước nhỏ, 2,0 mm hoặc 2,5 mm. Tốt nhất, lựa chọn kích thước bóng với tỉ lệ 1:1 so với kích thước mạch. Tỷ lệ bóng-mạch lớn hơn 1,2:1 có thể làm tăng biến chứng vỡ mạch. Không nên chọn bóng có chiều dài vượt quá chiều dài tổn thương, vì có thể gây ảnh hưởng đến đoạn mạch lành, dẫn tới đặt stent nhiều hơn cần thiết. Bóng quá dài cũng khó đi qua tổn thương hơn. Thông thường, bóng dài 15 hay 20 mm là vừa đủ.
Hầu hết tổn thương mạch vành được xử lý khi bơm bóng với áp lực dưới 10 atm. Tổn thương vôi hoá, tổn thương tái hẹp trong stent có thể cần áp lực cao hơn, (12-18 atm) hoặc dùng bóng áp lực cao để loại trừ phần “eo” của bóng. Thời gian bơm bóng thường ngắn, khoảng dưới 10-20 giây. Tuy nhiên cần đủ đến 10 giây để cho phép các mô đàn hồi giãn ra.
Với mạch nhỏ, ưu tiên bơm bóng nhỏ với áp lực thấp kéo dài để lòng mạch nở ra dần dần, hơn là lựa chọn bóng kích cỡ lớn dễ dẫn đến lóc tách mạch máu.
4.5.2 Biến chứng của nong bóng ĐMV
Vỡ bóng
Vỡ bóng là biến cố thường gặp nhất của nong bóng ĐMV. Vỡ bóng có thể dẫn đến vỡ mạch vành, tắc mạch do khí, hoặc bóng bị kẹt không rút ra được. Ngay cả bơm bóng với áp lực thông thường cũng có thể gây vỡ bóng, nếu như mạch vôi hoá quá nhiều. Nguyên nhân phổ biến hơn gây vỡ bóng là do bơm bóng quá căng, vượt quá áp lực vỡ (Rated Burst Pressure). Dấu hiệu đầu tiên của vỡ bóng là áp lực trong bơm áp lực tụt đi, đồng thời có thể thấy máu đi vào bơm áp lực.
Khi bóng vỡ, lượng khí trong bóng sẽ đi ra ngoài với áp lực cao, có thể gây tổn thương thành mạch, dẫn tới thủng ĐMV. Xử trí như các trường hợp vỡ ĐMV khác (xem thêm Chương 25: Các biến chứng trong can thiệp động mạch vành và xử trí).
Tắc mạch do khí thường nhẹ, do chỉ có 1-2 mL khí trong bơm áp lực.
Rút bóng bị vỡ ra khỏi mạch vành nhiều khi không đơn giản. Vì thế thầy thuốc cần thao tác nhẹ nhàng, tránh gây sang chấn cho ĐMV.
Kẹt bóng
Bóng có thể bị kẹt giữa mảng vôi hoá hoặc thành
Nguyên nhân hàng đầu là bóng chưa được làm xẹp hoàn toàn trước khi rút ra khỏi ĐMV. Cần hút âm nhiều
lần để làm xẹp bóng tối đa, rồi thao tác nhẹ nhàng để rút bóng ra.
Mất dòng chảy mạch vành
Khi đẩy bóng qua tổn thương, có thể dẫn đến mất đột ngột dòng chảy ĐMV. Tiến hành nong bóng ngay lập tức để khơi thông dòng chảy.
Sau nong bóng, có thể có lóc tách ĐMV. Cần đặt stent sớm để cứu vãn dòng chảy. Vì thế, sau khi đã nong ĐMV, tuyệt đối không để tuột dây dẫn ra ngoài.
4.6 Stent động mạch vành
4.6.1 Đại cương về kỹ thuật đặt stent ĐMV
Stent ĐMV đã khắc phục các nhược điểm của bóng nong (như co hồi ĐMV sau nong bóng, lóc tách gây tắc ĐMV cấp), vì thế đã trở thành lựa chọn tiêu chuẩn trong can thiệp ĐMV. Hiện nay, đại đa số các ca can thiệp ĐMV sử dụng stent phủ thuốc, do ưu điểm vượt trội ngăn ngừa tình trạng tái hẹp, đồng thời không gia tăng tỷ lệ biến cố. Hầu hết các stent mạch vành được làm nở bằng bóng. Cấu tạo và đặc điểm của stent được trình bày chi tiết trong Chương 16: Các dụng cụ sử dụng trong can thiệp động mạch vành.
Việc đặt stent thường được thực hiện sau khi nong bóng hoặc có thể thực hiện mà không cần nong bóng (đặt stent trực tiếp). Nong bóng giúp bác sĩ thủ thuật biết về khó khăn khi đi trong động mạch, đi qua tổn thương và lựa chọn kích thước stent. Sau khi nong chỗ hẹp, lưu lượng máu tăng lên gây giãn mạch và trên hình ảnh chụp mạch thứ hai, đường kính mạch máu thường lớn hơn do đó làm thay đổi kích thước stent. Mặc dù có thể giúp giảm thời gian can thiệp và tiết kiệm thuốc cản quang cũng như liều chiếu tia, nhưng nói chung lợi ích của đặt stent trực tiếp lại thấp hơn. Đôi khi nong bóng chuẩn bị là chưa đủ, có thể phải hút huyết khối, khoan cắt mảng xơ vữa…. Mục đích là tạo thuận lợi tối đa cho quá trình di chuyển và đặt stent, cũng như đánh giá tổn thương đầy đủ để lựa chọn kích cỡ stent phù hợp.
Sau khi đưa stent đến vị trí, cần xem đã phủ hết tổn thương chưa dựa trên vị trí của nó với các thành phần của mạch vành như nhánh bên, các điểm mốc quanh tổn thương. Nên nhớ là stent tồn tại vĩnh viễn và cần đặt đúng vị trí, tránh phải đặt thêm stent không cần thiết. Stent cần phủ hết chiều dài tổn thương mà không cản trở dòng chảy vào hay ra.
Dưới màn tăng sáng, đánh giá xem stent có nở hoàn toàn hay không, có phù hợp với kích mạch đoạn gần và đoạn
Stent nở tối ưu khi nở hoàn toàn và đồng trục. Các mắt stent tiếp xúc hoàn toàn (áp sát) với thành mạch. Cần chụp và đánh giá kỹ ở nhiều góc chụp khác nhau. Rất nhiều kỹ thuật được thực hiện để tối ưu áp sát stent, trong đó IVUS và OCT là các kỹ thuật đã được chứng minh giá trị (Xem thêm Chương 14: Các thăm dò chuyên sâu đánh giá giải phẫu và sinh lý động mạch vành: IVUS, OCT, FFR).
Có một số trường hợp không nên tiến hành đặt stent sau khi nong bóng, bao gồm: mạch máu kích thước quá nhỏ hơn (dưới 2 mm), dòng chảy ĐMV quá kém, tổn thương nặng lan tỏa, gánh nặng huyết khối quá lớn có thể dẫn đến tắc stent ĐMV. Những trường hợp này, cần cân nhắc kỹ lợi ích và nguy cơ của việc chỉ nong bóng đơn thuần mà không đặt stent, từ đó đưa ra lựa chọn điều trị phù hợp nhất cho người bệnh.
Đặt stent cho bệnh nhân có giải phẫu hoặc tình trạng lâm sàng phức tạp và có nguy cơ cao nên được xem xét cẩn thận. Can thiệp cho các bệnh nhân có nguy cơ biến chứng cao được thảo luận chi tiết ở Chương 9: Các thuốc sử dụng trong tim mạch can thiệp. Những lo ngại về giải phẫu bao gồm:
Các tổn thương dài phải cần đến nhiều
Đường kính động mạch vành nhỏ (< 2,5 mm).
Nhiều huyết khối ở vị trí tổn thương.
Tổn thương ở đoạn ghép tĩnh mạch hiển, thân chung động mạch vành trái, các vị trí lỗ vào hoặc tổn thương chia nhánh.
Tổn thương tái hẹp.
Tổn thương lan tỏa hoặc dòng chảy kém đến tổn thương.
Nhiều mạch máu rất ngoằn ngoèo ở khu vực tắc nghẽn hoặc ở gần với tổn thương.
Bệnh nhân có suy giảm chức năng thất trái.
4.6.2 Một số lưu ý và nguyên tắc khi đặt stent
Khi đặt stent cho nhiều tổn thương, cần đặt đoạn xa trước rồi mới đặt đoạn gần. Như thế sẽ tránh việc phải đẩy stent số hai đi qua stent đầu ở đoạn gần, giảm nguy cơ không đưa được stent đến đoạn xa hay rơi
Khi can thiệp đoạn xa của vị trí đã có stent trước đó, sử dụng dây dẫn với đầu được uốn cong hẳn lại để đảm bảo dây dẫn đi vào trong lòng stent chứ không chạy qua các mắt stent hoặc vào khoảng giữa stent và thành
mạch, có thể làm hỏng hoặc di lệch stent, và mắc kẹt hệ thống dụng cụ tại stent này.
Nếu còn hẹp hai đầu stent, cần nong bóng áp lực cao hoặc đặt thêm stent (đặc biệt nếu có lóc tách rìa stent).
Kết quả chụp mạch là chấp nhận được nếu hẹp tồn lưu ước tính < 10% nhưng kết quả đặt stent tối ưu hay không chỉ có thể đánh giá bằng IVUS hoặc
Trong quá trình làm thủ thuật có thể có hiện tượng co thắt mạch khi dùng bóng áp lực cao để tối ưu đặt Co thắt mạch thường sẽ tự hết hoặc khi cho ni- troglycerin, và không gây ra biến cố ngoại ý. Thường lên bóng áp lực rất cao (>16 atm) là không cần thiết vì làm stent giãn quá mức, co thắt mạch và tăng tỷ lệ tái hẹp trong stent.
4.6.3 Tối ưu hoá đặt stent
Tối ưu hoá stent là làm stent nở tốt nhất (nở đều, áp thành mạch, đạt kích thước tham chiếu) một cách an toàn mà không làm tổn thương mạch. Có hai phương pháp để cải thiện thiết diện lòng stent: (1) nong bóng áp lực cao; và dùng bóng có đường kính lớn hơn. Sử dụng bóng quá cỡ có thể làm tăng nguy cơ vỡ mạch. Bóng không giãn nở được ưu tiên hơn bóng giãn nở cho các lần nong lại Bóng không giãn nở sẽ mở rộng đồng đều ngay cả ở khu vực trung tâm của tổn thương, chịu lực tốt và gần như duy trì đường kính đồng đều ở các áp lực cao. Kết quả khảo sát IVUS cho thấy 25% stent sẽ cải thiện độ nở với mức tăng áp lực từ 15 đến 18 atm hoặc hơn. Cần chú ý không nong phần rìa stent bằng bóng quá lớn, vì có thể dẫn đến tổn thương đoạn mạch lành lân cận.
Có thể tối ưu hoá việc đặt stent thường sử dụng các kỹ thuật chẩn đoán hình ảnh trong lòng mạch như IVUS và OCT. Stent nở tối ưu hay không được đánh giá dựa trên tỷ số diện tích lòng stent cắt ngang (CSA) so với diện tích lòng mạch cắt ngang tại vị trí stent cũng như so với diện tích lòng mạch tham chiếu cắt ngang.
Xác định các kích thước của mạch tham chiếu và stent bằng IVUS/OCT.
Chọn bóng không giãn (áp lực cao) phù hợp dựa trên đường kính mạch đích qua IVUS,
Dùng bóng áp lực cao để nong thêm stent (thường
>12 atm) hoặc nong bằng bóng lớn hơn.
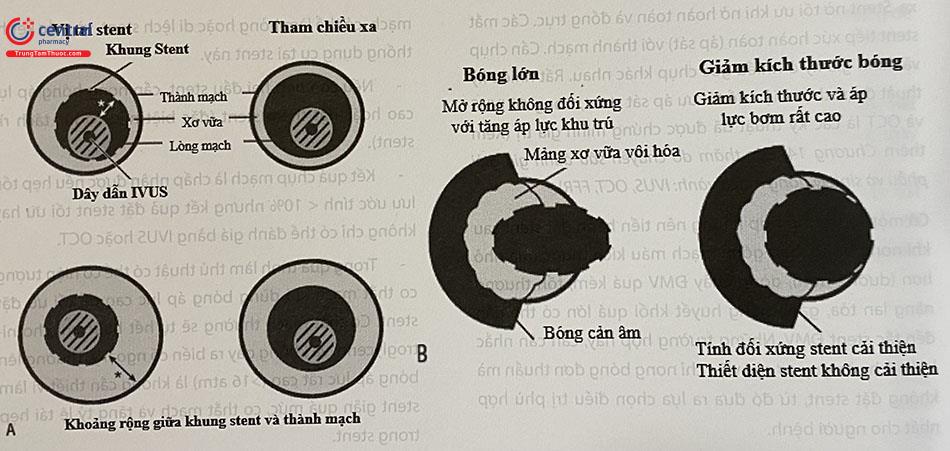
(A) Hình phía trên: Các đoạn gần của stent và kích thước stent được so sánh với đoạn mạch tham khảo phía xa. Hình phía dưới: So sánh diện tích của stent tương đối được đến khu vực tham chiếu phía xa của mạch và số lượng mảng bám trong mỗi phần mạch máu. (B) Chiến lược nong bóng dựa trên siêu âm trong lòng mạch (IVUS) sau khi đặt stent. Mở rộng stent không đối xứng có thể yêu cầu bóng lớn hơn. Stent đối xứng được cải thiện nhưng diện tích mặt cắt ngang không tăng; sử dụng bóng nhỏ hơn với áp lực nong rất cao.
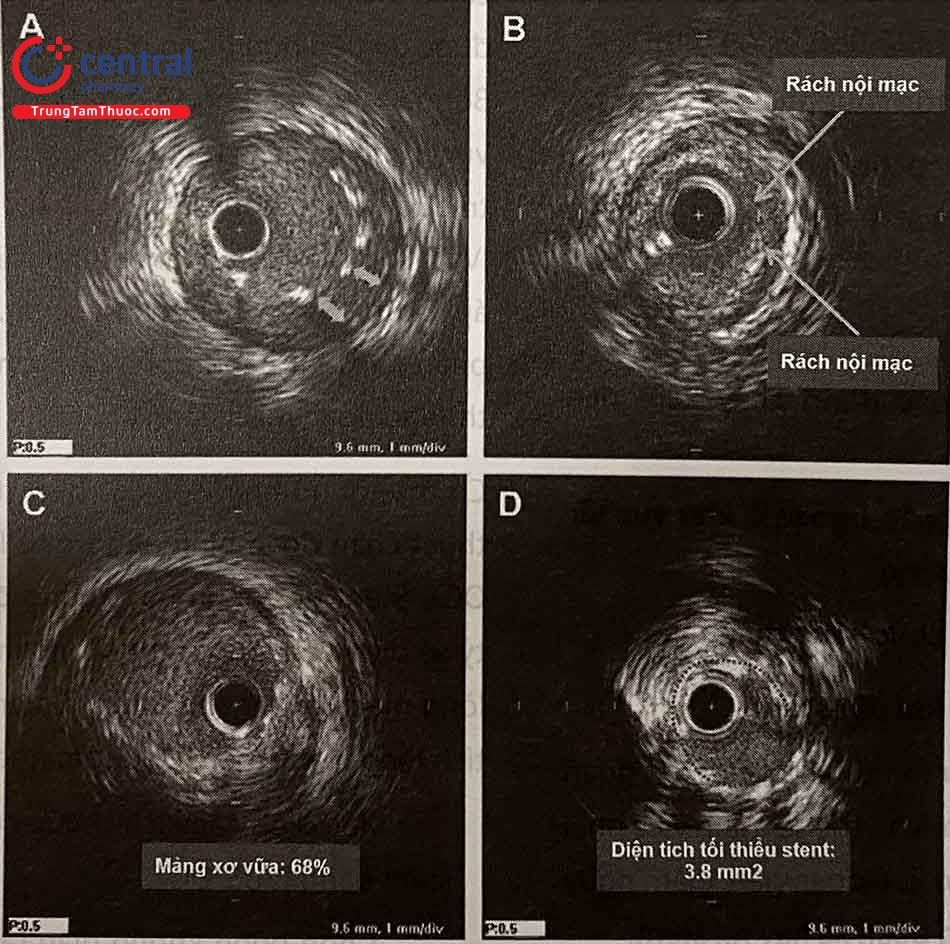
(C) Mảng xơ vữa thành bên lớn, (D) Stent không nở tốt
4.6.4 Khó khăn trong quá trình đặt stent
Tính chất phức tạp của thủ thuật đặt stent đặt ra những vấn đề về kỹ thuật. Các trở ngại này được xếp vào 5 nhóm dưới đây.
Không đẩy được stent tới tổn thương hoặc đi qua tổn thương
Có nhiều nguyên nhân: ống thông hỗ trợ không tối ưu, đoạn gần ĐMV xoắn vặn hoặc vôi hóa (mạch cứng và gấp khúc nhiều) khiến stent không thể tiếp cận tổn thương, tổn thương phức tạp khiến stent không thể đi qua (không nong rộng được do hẹp và vôi hoá nặng).
Giải pháp: điều đầu tiên là đảm bảo guiding đồng trục. Có những góc chụp ĐMV bộc lộ tổn thương tốt, nhưng lại không cho phép quan sát guiding đồng trục với đoạn gần ĐMV hay chưa, Vì thế, cần chỉnh bóng chụp về góc chụp thuận lợi nhất, thao tác với guiding nhẹ nhàng, và đẩy stent vào lòng ĐMV theo tư thế bóng này.
Cần nong chuẩn bị tổn thương nhiều lần, chứ không nên đặt stent trực tiếp. Đưa bóng nong và nong trước giúp đưa stent đến tổn thương một cách thuận lợi. Khó khăn khi đưa bóng, ống thông không ổn định và nong không tốt đoạn mạch xoắn vặn có thể gây ra biến chứng rơi stent.
Ở đoạn mạch xoắn vặn nhiều với nhiều đoạn gập, lựa chọn dây dẫn phù hợp là chìa khóa giúp đặt stent thuận lợi. Sử dụng 2 dây dẫn, tạo một “đường ray” để đẩy stent dễ dàng hơn (kỹ thuật “buddy wire”, dây dẫn đồng hành). Dây dẫn với thân cứng và độ trợ lực cao có thể hữu ích, tuy nhiên những dây dẫn này thường khó điều khiển do làm thẳng mạch và gây gấp nội mạc, làm co thắt mạch (dễ nhầm lẫn tổn thương). Trong các trường hợp này, lái dây dẫn thông thường đầu mềm đi qua tổn thương tới đoạn xa, sau đó tráo dây dẫn thân cứng bằng vi ống thông.
Có thể đưa ống thông tiếp cận tổn thương gần hơn bằng cách sử dụng ống can thiệp nối dài. Luôn thận trọng với đầu ống thông, vì có thể gây lóc tách hoặc sang chấn đoạn gần ĐMV.
Nếu bị rơi stent, có thể dùng một số kỹ thuật lấy lại stent rơi như sử dụng thòng lọng (snare), dụng cụ như cái rổ, kẹp gắp, kẹp sinh thiết, hay một số dụng cụ gắp khác.
Stent không nở hết
Do nguyên nhân: mạch vành vôi hoá hoặc mảng xơ vữa cứng. Hình ảnh có thể nhầm với stent chưa nở đủ là tách thành mạch xung quanh stent xuất phát từ rìa stent hay huyết khối hình thành trong vùng stent và mạch kế bên, các hình ảnh này cũng giống như stent chưa nở hết.
Giải pháp: trong khi lên bóng, nếu stent chưa nở hết có thể bơm áp lực cao hơn hay dùng bóng ngắn và lớn hơn. Stent chưa nở tối ưu thường do nong bóng chuẩn bị chưa đủ. Trong trường hợp stent nở chưa tốt, sử dụng IVUS hoặc OCT để kiểm tra cơ chế hẹp tồn lưu do xệ nội mạc, chưa áp sát, vôi hoá nặng hay trong một số trường hợp là do huyết khối. Stent không nở tốt sẽ làm tăng tái hẹp và nguy cơ huyết khối cấp. Cần chú ý khi kéo bóng ra trong khi stent chưa nở hết có thể làm đầu ống thông bị đưa sâu vào mạch vành có thể làm lóc tách đoạn gần mạch vành.
Không xử lý tiếp được sau khi bơm bóng làm nở stent
Tuột dây dẫn có thể làm cho không đưa được bóng vào nong thêm stent. Không thể đưa được dây vào lòng chính của stent sẽ làm stent bị méo. Đưa lại dây dẫn vào stent đã được đặt trước thường sử dụng một dây dẫn mềm với đầu uốn cong lớn có thể thò vào lòng chính của stent. Cố gắng tránh dây dẫn đi vào giữa mắt stent và thành mạch.
Bảng 17.7. Kỹ thuật xử lý khi không đẩy được stent đến tổn thương
Tổng quát
Với dây dẫn
Tổng quát
|
Vỡ động mạch vành: Cần sử dụng bóng nong tại chỗ, stent có màng bọc. Xử lý tràn máu màng tim cấp bằng chọc tháo, có thể mở màng tim cấp cứu nếu tái phát nhanh. Nặng hơn có thể phải phẫu thuật cấp cứu khâu chỗ rách (vỡ) mạch vành.
Stent gây tách thành, huyết khối hay tắc mạch: Do một số yếu tố: làm nở không hết stent (tại tổn thương vôi hoá không được khoan phá trước); tách thành mạch mà không xử lý tối ưu; đoạn mạch xa quá nhỏ, tổn thương có huyết khối trước đó.
Giải pháp: Xử trí bằng cách dùng bóng nong nhiều lần, kiểm tra lại bằng IVUS và OCT.
Xem thêm Chương 25: Dự phòng và xử trí biến chứng trong can thiệp động mạch vành.
5 Một số dụng cụ phụ trợ trong qúatrình can thiệp
5.1 Dụng cụ hút huyết khối
Hệ thống hút huyết khối thủ công được ưa thích hơn hút huyết khối bằng máy khi can thiệp ĐMV. Ngoài chi phí tương đối thấp, catheter hút thủ công dễ dàng sử dụng hơn, và an toàn hơn. Sự đơn giản và tiện dụng của hệ thống giúp triển khai nhanh và đảm bảo không có sự chậm trễ đáng kể trong tái thông động mạch vành, mặc dù có thể có thách thức về kỹ thuật trong trường hợp huyết khối lớn.
Hệ thống hút huyết khối thường gồm một ống thông có đường kính trong khoảng 1Fr, đường kính ngoài 4Fr. Đây là hệ thống monorail, đi vừa guiding 6Fr, được đẩy vào lòng ĐMV trên dây dẫn 0,014”. Một số ống hút huyết khối còn có thép bên trong, giúp ống hút đi trong lòng ĐMV dễ dàng hơn, và tránh bị gập. Sau khi đẩy vào tới vị trí huyết khối, lõi thép được rút ra, và ống hút huyết khối được kết nối với bơm hút áp lực âm để hút huyết khối.
(C) Hút huyết khối bằng dụng cụ Export. (D) Đặt stent ĐMV tái thông
dòng chảy.
5.2 Máy tạo nhịp tim trong lúc can thiệp
Máy tạo nhịp tim không được sử dụng thường quy cho can thiệp mạch vành mà chỉ sử dụng để dự phòng trong trường hợp có giảm huyết động do rối loạn nhịp chậm và cấp cứu bệnh nhân khi có tụt huyết áp gây bất thường dẫn truyền. Tạo nhịp tạm thời theo đường tĩnh mạch có thể thực hiện qua đường tĩnh mạch cảnh trong, tĩnh mạch dưới đòn, thay tĩnh mạch đùi. Đường vào dễ nhất là bên cạnh đường vào động mạch để can thiệp.
Chỉ định
- Được chẩn đoán block nhĩ thất độ cao trước đó.
- Nhịp chậm có triệu chứng (sau khi dùng thuốc cản quang hay chụp ĐMV phải).
- Nhồi máu cơ tim có block 3 phân nhánh.
- Dự phòng trong trường hợp dùng khoan phá mảng xơ vữa hay hút huyết khối đặc biệt đối với ĐMV phải.
- Làm mỏng vách liên thất bằng cồn trong trường hợp bệnh cơ tim phì đại.
Có thể sử dụng atropin để phòng nhịp chậm, nhưng cần có máy tạo nhịp luôn sẵn sàng cho các bệnh nhân đã có các nhịp chậm nguy hiểm trong quá trình chụp mạch.
5.3 Dụng cụ hỗ trợ huyết động
Các dụng cụ hỗ trợ huyết động được chỉ định trong trường hợp can thiệp ĐMV nguy cơ cao, như bệnh nhân suy tim nặng, bệnh nhân sốc tim hoặc rối loạn huyết động, hoặc trong các trường hợp tổn thương ĐMV phức tạp dễ dẫn đến biến chứng trong lúc làm thủ thuật. Chi tiết về các dụng cụ hỗ trợ huyết động được trình bày trong Chương 64: Các thiết bị hỗ trợ suy thất trái ứng dụng trong tim mạch can thiệp.
5.3.1 Bóng đối xung (IABP)
IABP có chi phí thấp so với các dụng cụ hỗ trợ huyết động khác, có thể dễ dàng sử dụng; giúp tăng cung lượng tim, tưới máu cơ tim và tưới máu não trong khi giảm gánh nặng thất trái. Tuy nhiên các nghiên cứu IABP-SHOCK II cho thấy IABP không giảm tử vong sau 30 ngày và không có bằng chứng lợi ích lâu dài trên bệnh nhân sốc tim nên không được khuyến cáo sử dụng cho bệnh nhân sốc tim do nhồi máu cơ tim.
5.3.2 Hỗ trợ tuần hoàn ngoài cơ thể (ECMO)
ECMO trong can thiệp giúp giảm gánh nặng thất trái và tăng hậu gánh thất trái. Nghiên cứu VA-ECMO cho thấy lợi ích hỗ trợ của ECMO hơn IABP tới 33% trên tỷ lệ sống sót sau 30 ngày ở những bệnh nhân có ngừng tuần hoàn tuy số lượng bệnh nhân nghiên cứu còn ít.
5.3.3 Dụng cụ hỗ trợ thất trái
Các thiết bị như như Impella và TandemHeart cho thấy tỷ lệ tử vong ngắn hạn không khác biệt dù lợi ích về huyết động như huyết áp hay tưới máu chi tốt. Các dụng cụ này có tỷ lệ chảy máu tại nơi chọc và thiếu máu chi dưới đáng kể. Nghiên cứu so sánh với IABP trên bệnh nhân suy tim nặng có tổn thương phức tạp cho thấy biến cố tim mạch sau 30 ngày tương đương do đó không đủ bằng chứng khuyến cáo cho bệnh nhân sốc tim.Thành công của can thiệp động mạch vành được đánh giá dựa trên tiêu chí chụp mạch, thủ thuật và lâm sàng.
6 Tiêu chí đánh giá thành công của thủ thuật can thiệp động mạch vành
6.1 Thành công về hình ảnh chụp mạch
Mức độ hẹp của lòng mạch sau thủ thuật phải < 10%.
6.2 Thành công về thủ thuật
Can thiệp ĐMV thành công mà không có biến cố lâm sàng lớn tại viện như tử vong, nhồi máu cơ tim, phẫu thuật bắc cầu nối cấp cứu, biến chứng nặng cần phải xử trí (xin xem thêm Chương 25: Các biến chứng trong can thiệp động mạch vành và xử trí).
Nhồi máu cơ tim (NMCT) thường được xác định bởi sóng Q mới xuất hiện và có tăng troponin gấp 3 lần giới hạn trên của bình thường. Troponin T và I có độ nhạy và độ đặc hiệu cao hơn CK-MB trong đánh giá hoại tử cơ tim. Tăng các men tim không có sóng Q mới xuất hiện thì được tính là NMCT sau thủ thuật. Không có đồng thuận nào về mức tăng troponin đơn độc bao nhiêu là cần xử trí sau thủ thuật can thiệp.
6.3 Thành công về lâm sàng
Thành công về chụp mạch và thành công về thủ thuật phải kèm theo giảm các dấu hiệu và/hoặc triệu chứng của thiếu máu cơ tim sau can thiệp. Thành công lâm sàng dài hạn là tiếp tục giảm các dấu hiệu và triệu chứng thiếu máu cơ tim trên 6 tháng. Tái hẹp là nguyên nhân chính của hạn chế thành công dài hạn khi đã có thành công ngắn hạn.
7 Theo dõi sau can thiệp động mạch vành
7.1 Tại phòng hồi sức
Điều dưỡng cần tư vấn cho bệnh nhân những thông tin cần thiết như các nguy cơ chảy máu, biến chứng muộn, và tái hẹp. Sau khi can thiệp ĐMV, cần thông tin cho phòng hồi tỉnh, phòng hồi sức tích cực và kíp ngoại lồng ngực trong trường hợp cần thiết. Làm xét nghiệm máu và điện tâm đồ.
7.2 Tại bệnh phòng
Sau khi can thiệp, khoảng 10% bệnh nhân có thể bị đau thắt ngực. Điện tâm đồ có bằng chứng của thiếu máu cơ tim là những trường hợp có nguy cơ bị tắc mạch cấp. Khi đau thắt ngực kèm biến đổi điện tâm đồ kiểu thiếu máu cơ tim xảy ra trong 24 giờ đầu tiên, cần đưa trở lại phòng can thiệp để chụp động mạch vành ngay và chẩn đoán và có thể tái can thiệp nếu cần thiết (hút huyết khối hoặc đặt stent). Quyết định điều trị cần dựa vào các yếu tố như ổn định về huyết động, số lượng vùng cơ tim có nguy cơ và khả năng thành công bằng điều trị nội khoa. Sau khi can thiệp, cần theo dõi bệnh nhân về phương diện thiếu máu cơ tim tái phát, nguy cơ vùng chọc mạch, và suy thận do thuốc cản quang.
Một số thuốc điều trị cần lưu ý:
- Aspirin liều nạp 162-325mg, sau đó duy trì 81-160mg/ngày.
- Thuốc kháng P2Y12 (clopidogrel 600mg liều nạp sau đó 75 mg/ngày, prasugrel 60mg liều nạp sau đó 10mg/ngày, hay ticagrelor 180mg uống liều nạp sau đó 90 mg x 2 lần/ngày, đánh giá tình trạng bệnh nhân và các đăc điểm liên quan can thiệp và quyết định thời gian dùng kháng kết tập tiểu cầu kép kéo dài bao lâu theo khuyến cáo hiện tại.
- Bắt đầu sử dụng statin (nếu chưa dùng).
- Bắt đầu lại thuốc hạ áp và các thuốc giảm đau thắt ngực tuỳ thuộc vào lâm sàng bệnh nhân.
- Tiếp tục dùng các thuốc đã dùng trước đó (VD: thuốc chống trào ngược).
Nên bắt đầu một chương trình dự phòng xơ vữa thứ phát gồm các phương pháp điều trị thuốc và thay đổi hành vi nhằm giảm mắc bệnh và tử vong do bệnh lý ĐMV.
Các bệnh nhân có suy thận hay đái tháo đường cần theo dõi nguy cơ suy thận do thuốc cản quang. Hơn nữa, những bệnh nhân dùng nhiều thuốc cản quang (> 5mL/kg) hay có chụp cản quang lần 2 trong vòng 72 giờ cần đánh giá chức năng thận liên tục trong nhiều ngày. Bất cứ khi nào cần thiết, cần dừng các thuốc có thể gây độc cho thận (một số kháng sinh, giảm đau non-steroid, cyclosporin) và Metformin (đặc biệt trên bệnh nhân có suy thận từ trước) từ 24-48 giờ sau thủ thuật.
7.3 Sau khi ra viện
Sau khi ra viện, bệnh nhân có thể trở lại các hoạt động bình thường trong vòng 1-2 ngày. Cần trì hoãn việc này trong trường hợp có các biến cố nơi chọc mạch hay còn triệu chứng. Đánh giá cơ năng (các nghiệm pháp gắng sức) các bệnh nhân có can thiệp nhiều mạch hay can thiệp chưa hết mạch để đánh giá các giới hạn về tim mạch đối với công việc.
Tất cả các bệnh nhân cần được giới thiệu về việc điều chỉnh yếu tố nguy cơ và các thuốc điều trị để dự phòng xơ vữa thứ phát trước khi ra viện. Các bác sĩ can thiệp cần nhấn mạnh các biện pháp này một cách trực tiếp tới bệnh nhân và gia đình họ. Bác sĩ can thiệp cần liên lạc với bác sĩ gia đình để trao đổi về việc bắt đầu các biện pháp dự phòng thứ phát và tiếp tục các thuốc điều trị như aspirin, kháng P2Y12, hạ áp, đái tháo đường, điều trị tích cực giảm LDL cholesterol với đích < 100 mg/dL theo khuyến cáo của hội Tim mạch Hoa Kỳ (AHA), cai thuốc lá và các chế phẩm có nicotin, giảm cân, tập thể dục thường xuyên và dùng thuốc ức chế men chuyển cũng là các biện pháp dự phòng thứ phát.
Đặt lịch khám lại và làm nghiệm pháp gắng sức:
- Khám lại lần đầu sau 2-4 tuần.
- Nghiệm pháp gắng sức không làm thường quy sau can thiệp. Nghiệm pháp gắng sức mỗi năm cũng không được khuyến cáo trừ khi có triệu chứng. Không có chỉ định làm nghiệm pháp gắng sức (NPGS) hàng năm cho bệnh nhân không triệu chứng. Khuyến cáo của AHA/ACC cần kiểm tra cho những bệnh nhân có nguy cơ đặc biệt cao (VD: bệnh nhân có giảm chức năng thất trái, bệnh lý nhiều mạch vành, tổn thương đoạn gần động mạch liên thất trước (LAD), có tiền sử ngừng tim, đái tháo đường, nghề nghiệp đặc biệt, và kết quả can thiệp chưa tối ưu). Vì nhiều lý do, chẩn đoán hình ảnh gắng sức được ưu tiên hơn khi đánh giá cho bệnh nhân có triệu chứng sau can thiệp. Nếu khả năng gắng sức bị hạn chế rõ thì cần chụp lại ĐMV để đánh giá chính xác nguyên nhân của triệu chứng đau thắt ngực điển hình. NPGS khi ra viện có ích để tư vấn cho bệnh nhân các hoạt động cá nhân hoặc có một chế độ phục hồi chức năng phù hợp. NPGS hoặc chẩn đoán hình ảnh gắng sức không được chỉ định thường quy để đánh giá bệnh nhân không triệu chứng sau can thiệp ĐMV mà không có chỉ định đặc biệt.
Nếu có dấu hiệu hay triệu chứng thiếu máucơ tim xuất hiện sớm sau khi can thiệp, cần phải chụp lại ĐMV.
8 Tài liệu tham khảo
1. Neumann, Franz-Josef, et al. “2018 ESC/EACTS guidelines on myocardial revascularization.” European heart journal 40.2 (2019): 87-165.
2. Levine Glenn, N., et al. “ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions.” J. Am. Coll. Cardiol 58.24 (2011): e44-122.
3. Bashore TM, Balter S, Barac A, et al. 2012 American College of Cardiology Foundation/Society for Cardiovascular Angiography and Interventions expert consensus document on cardiac catheterization laboratory standards update: American College of Cardiology Foundation Task Force on expert consensus documents Society of Thoracic Surgeons Society for Vascular Catheter Cardiovasc Interv. 2012;80:E37-E49.
4. Boden Optimal medical therapy with or without PCI for stable coronary artery disease. N Engl J Med. 2007;356:1503-1516
5. Uretsky B, Cardiac Catheterization: Concepts, Techniques and Applications. Malden, MA: Blackwell Science; 1997.
6. Anderson HV, Shaw RE, Brindis RG, et al. Relationship between procedure indications and outcomes of percutaneous coronary interventions by American College of Cardiology American Heart Association Task Force Guidelines. Circulation. 2005;112:2786-2791.
7. Bakalyar DM, Castellani MD, Safflan RD. Radiation exposure to patients undergoing diagnostic and interventional cardiac catheterization procedures. Cathet Cardiovasc Diagn. 1997;42:121-125.
8. Balter S, Moses Managing patient dose in interventional cardiology. Catheter Cardiovasc Interv. 2007;70:244-249.
9. Blankenship JC, Gigliotti OS, Feldman DN, et al. Ad hoc percutaneous coronary intervention: a consensus statement from the Society for Cardiovascular Angiography and Interventions. Catheter Cardiovasc Interv. 2013;81:748-758.
10. Brilakis ES, Banerjee S, Berger PB. Perioperative management of patients with coronary stents. J Am Coll Cardiol. 2007;49:2145-2150.
11. Chida K, et al. Patient skin dose in cardiac interventional procedures: conventional fluoroscopy versus pulsed fluoroscopy. Catheter Cardiovasc Interv. 2007;69:115-121.
12. Gibson CM, Cannon CP, Daley WL, et al. TIMI frame count: a quantitative method of assessing coronary artery “ow. 1996;93:879-888.
13. Holmes DR Jr, Kereiakes D, Garg S, et Stent thrombosis. J Am Coll Cardiol. 2010;56:1357-1365.
14. Kaul P, Medvedev S, Hohmann SF, et al. Ionizing radiation exposure to patients admitted with acute myocardial infarction in the United States. Circulation. 2010;122:2160-2169.
15. Kern MJ, ed. Hemodynamic Rounds: Interpretation of Cardiac Pathophysiology from Pressure Waveform Analysis. 3rd ed. New York: Wiley-Liss;
16. Kern MJ, The Cardiac Catheterization Handbook. 6th ed. Philadelphia: Elsevier; 2015.
17. Koenig TR, Wolff D, Meter FA, et al. Skin injuries from fluoroscopically guided procedures: part I, characteristics of radiation injury. AJR. 2001;177:3-11.
18. Moscucci M. Baim’s Cardiac Catheterization, Angiography, and Intervention. 8th ed. Philadelphia: Wolters/Kluwer/Lippincott Williams; 2014.
19. Naidu SS, Aronow HD, Box LC, et al. SCAI Expert Consensus Statement: 2016 best practices in the cardiac catheterization laboratory: Endorsed by the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencionista; Affirmation of Value by the Canadian Association of Interventional Cardiology–Association Canadienne de Cardiologie d’intervention. Catheter Cardiovasc Interv. 2016;doi:10.1002/ccd.26551.
20. Rao SV, Tremmel JA, Gilchrist IC, et al. Best practices for transradial angiography and intervention: a consensus statement from the Society for Cardiovascular Angiography and Interventions Transradial Working Group. Catheter Cardiovasc Interv.

