Nguyên nhân, triệu chứng, điều trị đái tháo đường typ 1

Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 NGUYÊN LÝ CHUNG
đái tháo đường typ 1 (T1DM) là tình trạng bệnh lý với sự phá hủy tự miễn các tế bào B tụy gây thiếu hụt insulin và tăng nồng độ đường máu.
Thiếu hụt insulin có thể dẫn đến mất bù chuyển hóa cấp được biết như là tình trạng nhiễm toan xêtôn do đái tháo đường (DKA); tuy nhiên, insulin ngoại sinh được đưa vào cơ thể quá mức so với nhu cầu tức thì của bệnh nhân có thể gây hạ đường máu đe dọa tính mạng.
Tăng đường máu mạn tính là nguyên nhân gốc rễ gây ra các biến chứng vi mạch gây tàn phế cho bệnh nhân và tham gia vào bệnh lý mạch máu lớn.
Mục tiêu điều trị của đái tháo đường typ 1 là bình thường hóa nồng độ đường máu bằng liệu pháp insulin thay thế dựa trên cơ sở sinh lý.
1.1 Dịch tễ học
Tỷ lệ mắc mới tổng thể của bệnh là 0,25 - 0,5% dân số hoặc 1/400 trẻ em và 1/200 người lớn ở Hoa Kỳ.
Tỷ lệ hiện mắc của ĐTĐ typ 1 đang gia tăng ở các nước phát triển, bệnh xuất hiện ở độ tuổi trẻ hơn [1,2].
Đỉnh khởi phát bệnh xảy ra ở độ tuổi từ 10 - 14 nhưng nó có thể được chẩn đoán từ vài tháng tuổi đến thập kỷ thứ chín trong cuộc đời.
Nam và nữ bị tác động như nhau.
ĐTĐ typ 1 chiếm khoảng 10% tất cả các trường hợp mắc đái tháo đường, cần được chẩn đoán chính xác để liệu pháp insulin không bị trì hoãn hoặc trì hoãn không thích hợp đối với bệnh nhân.
1.2 Bệnh căn

Quá trình tự miễn phá hủy một cách chọn lọc các tế bào B của tụy được trung gian qua tế bào T với một kích thích sinh kháng nguyên không được biết rõ ở những đối tượng nhạy cảm về mặt di truyền [3,4].
- Các yếu tố môi trường, bao gồm nhiễm virus coxsackie và rubella, các yếu tố chế độ ăn uống như tiếp xúc sớm với sữa bò có liên quan.
- Viêm tụy (xâm nhập tế bào lympho của đảo tụy) được phát hiện sớm, tiếp theo là phá hủy miễn dịch các tế bào B, dẫn đến mất tác dụng của tế bào B trong quá trình bệnh sau này.
- Các kháng thể kháng lại kháng nguyên tế bào B có thể được tìm thấy ở phần lớn bệnh nhân trước khi chẩn đoán bệnh và trong một thời gian sau khi khởi phát bệnh đái tháo đường lâm sàng.
- Chỉ dấu của bệnh lý này là các kháng thể kháng acid glutamic decarboxylase (GAD65), tyrosin phosphatases IA-2 và IA-2 beta, insulin (IAA) và chất vận chuyển Kẽm (ZnT8).
- Trong số các chỉ dấu này, GAD65 dương tính ở 80% trẻ em và người lớn ở gần thời điểm chẩn đoán bệnh, trong khi IA-2 và IAA dương tính ở xấp xỉ 50% trẻ em và ít có khả năng biểu hiện ở người lớn.
- Sự hiện diện của hai kháng thể này có độ nhạy và độ đặc hiệu cao trong dự đoán khả năng tiến triển nhanh tới tình trạng phụ thuộc insulin và giúp làm rõ chẩn đoán ở một số bệnh nhân. Trong trường hợp ĐTĐ typ 1 song không có bằng chứng của tình trạng tự miễn có thể phát hiện được, trường hợp này được phân loại là ĐTĐ typ 1 vô căn (idiopathic TIDM).
Một số bệnh tự miễn hệ thống hoặc với một cơ quan chuyên biệt xảy ra với tần suất gia tăng ở bệnh nhân bị đái tháo đường typ 1, bao gồm viêm tuyến giáp tự miễn (bệnh Hashimoto hoặc bệnh Graves- basedow), bệnh Addison, thiếu máu ác tính Biermer, bệnh không hấp thu gluten (celiac sprue), bạch biến, rụng tóc và viêm gan tự miễn (5,6].
- Trong một nghiên cứu trên 265 người lớn bị ĐTĐ typl, nguy cơ bị bệnh tuyến giáp là 32% ở chính đối tượng nghiên cứu, 25% đối với anh chị em ruột và 42% đối với cha mẹ họ, nữ giới thường bị tác động hơn nam giới.
- Nguy cơ phát triển bệnh tuyến giáp tự miễn và thiếu máu ác tính tăng theo tuổi, vì vậy cần tiếp tục sàng lọc định kỳ trong suốt tuổi trưởng thành ở bệnh nhân bị ĐTĐ typ 1 và các thành viên trong gia đình họ.
Tính nhạy cảm di truyền với ĐTĐ typ 1 được biểu hiện bằng sự liên kết với một số ổ gen (gene loci) và sự kết hợp với HLA-DR và DQ [7].
- Các nghiên cứu kết hợp toàn bộ các bộ gen đã phân lập được các ổ gen có nguy cơ cộng thêm là BACH2, C1QTNF6, CTSH và PRKCQ [7].
- Gen IDDM1 có vị trí ở vùng HLA của nhiễm sắc thể 6p21.3 đóng góp vai trò 42% và gen IDDM2 trong vùng 5’ nhánh lên của gen insulin trên nhiễm sắc thể 11p15.5 đóng góp vai trò 10%, vào các cụm gia đình bị bệnh được quan sát.
- Trong gia đình của một bệnh nhân bị ĐTĐ typ 1, nguy cơ phát triển thành ĐTĐ typ 1 ở cặp song sinh cùng trứng là 50%, ở con của họ là 6% và ở anh chị em ruột là 5%.
Sự không tương đồng rõ rệt trong nguy cơ bị bệnh giữa các thành viên trong gia đình là các bằng chứng ủng hộ cho tầm quan trọng của các yếu tố môi trường trong nguyên nhân gây bệnh.
1.3 Sinh lý bệnh
Cả bệnh nhân bị ĐTĐ typ 1 và ĐTĐ typ 2 dễ bị rối loạn chức năng của các cơ quan do tình trạng tăng nồng độ đường máu trong thời gian dài, vì vậy làm tăng nguy cơ tàn phế và tử vong ở bệnh nhân [8].
Các biến chứng vi mạch của bệnh đái tháo đường là bệnh võng mạc, bệnh cầu thận và bệnh lý dây thần kinh.
Mặc dù có chung một số đặc điểm sinh lý bệnh, các biến chứng này có thể không xuất hiện cùng một lúc hoặc với cùng mức độ nghiêm trọng ở tất cả các đối tượng bị đái tháo đường. Sinh lý bệnh của các biến chứng này bao gồm tăng stress oxy hóa, hoạt hóa bất thường các tín hiệu và kích thích các hệ thống điều hòa huyết động.
- Các sản phẩm cuối cùng của quá trình glycate hóa mức độ cao được hình thành bởi các quá trình gắn đường và/hoặc oxy hóa các protein, nucleotide, lipid và có độc tính nội sinh đối với tế bào.
- Nồng độ đường máu tăng cao và các chất oxy phản ứng đã được chứng minh là làm tăng diacyl-glycerol, kích thích hoạt tính của protein kinase C, gây ra các biến đổi trong dẫn truyền tín hiệu nội bào và sản xuất các cytokine và các yếu tố tăng trưởng [9].
Glucose đi vào các dây thần kinh ngoại biên bằng hàng loạt các hoạt động, đầu tiên nó được chuyển đổi thành Sorbitol bởi aldose reductase, sau đó được chuyển đổi thành Fructose bởi sorbitol dehydrogenase. Những saccharide này gây nên stress thẩm thấu, tăng quá trình gắn đường và gây ra các biến đổi trong tỷ lệ NADH/NAD. Tất cả các quá trình trên tham gia vào tình trạng gây tổn hại các sợi thần kinh và các triệu chứng của bệnh lý dây thần kinh ngoại biên.
Bệnh võng mạc do đái tháo đường được kết hợp với tình trạng tái cấu trúc bất thường của các tế bào nội mạc mạch máu do tăng nồng độ đường máu và tăng các cytokine như yếu tố tăng trưởng nội mạc mạch máu.
Trong bệnh cầu thận do đái tháo đường, tăng đường máu gây ra tình trạng biến đổi yếu tố tăng trưởng B, dẫn tới kích thích quá trình tổng hợp chất nền bào tương và ức chế giáng hóa chất nền bào tương của các tế bào nâng cuộn mao mạch cầu thận. Các thuốc nghiên cứu nhằm vào các quá trình này hiện đang được phát triển trên lâm sàng.
2 CHẨN ĐOÁN
2.1 Biểu hiện lâm sàng
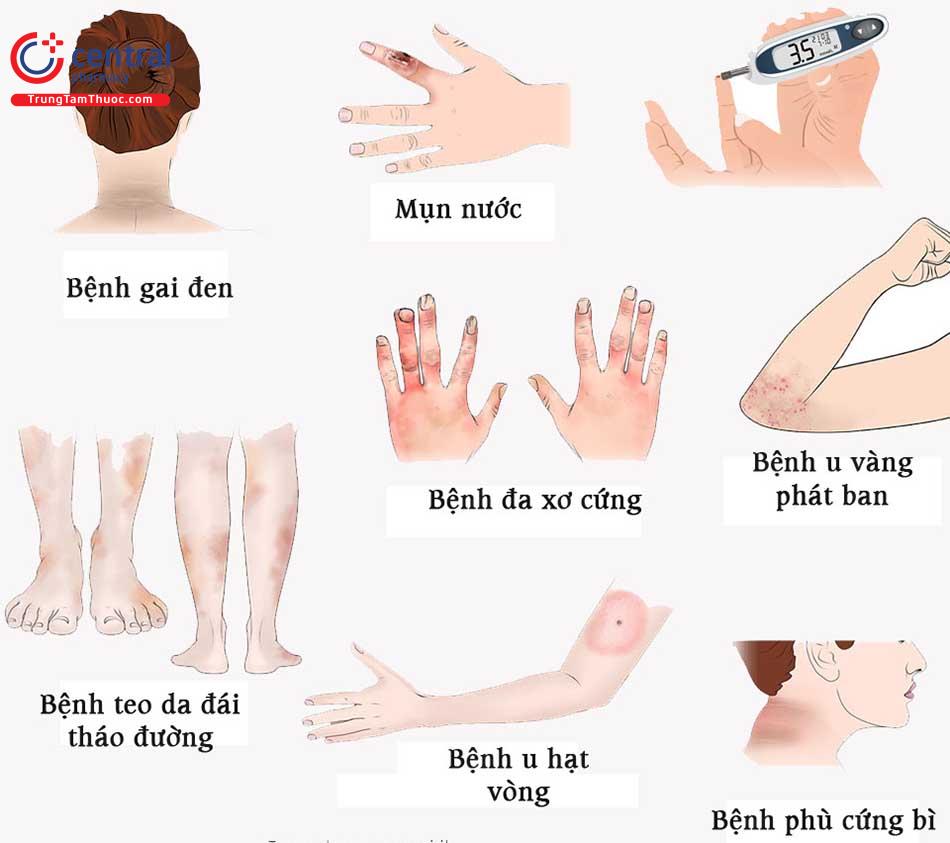
ĐTĐ typ 1 xuất hiện phổ biến nhất trong thời thơ ấu, tuy nhiên có thể được biểu hiện ở mọi lứa tuổi.
Do có tới 80% trường hợp xảy ra mà không có tiền sử gia đình bị bệnh đái tháo đường, các triệu chứng có thể bị bỏ qua đến khi tình trạng tăng đường máu đạt đến mức nghiêm trọng.
Các triệu chứng báo trước hay tiền triệu có liên quan đến tăng nồng độ đường máu bao gồm sút cân, tiểu nhiều, khát nhiều, ăn nhiều và nhìn mờ.
Nếu có biểu hiện nhiễm toan xêtôn do đái tháo đường (DKA), bệnh nhân có thể phàn nàn về đau bụng, buồn nôn, nôn, đau cơ, khó thở, biểu hiện các thay đổi về tình trạng tinh thần và huyết động.
2.1.1 Khai thác tiền sử bệnh
Ở những bệnh nhân được chẩn đoán bị bệnh đái tháo đường từ trước đó, tiền sử và bệnh sử của tình trạng bệnh hiện tại cần ghi nhận về khoảng thời gian mắc bệnh, tần suất tăng và hạ đường máu, kết quả của xét nghiệm tự theo dõi đường máu (SMBG), thói quen ăn uống và tình trạng của bất kỳ biến chứng mạch máu nhỏ hoặc mạch máu lớn nào.
Tiền sử bệnh hiện tại hoặc tiền sử dùng thuốc phải được ghi nhận chi tiết phác đồ điều trị bằng insulin và đưa ra đánh giá về tính thỏa đáng hoặc các vấn đề gặp phải với phác đồ điều trị áp dụng cho bệnh nhân.
Ở thanh thiếu niên là nữ giới và phụ nữ trưởng thành, tiền sử về kinh nguyệt, tình dục và thai nghén phải được khai thác, các phương pháp tránh thai cũng cần được ghi lại.
Hành vi hút thuốc, sử dụng rượu và ma túy, tình trạng kinh tế xã hội và hỗ trợ xã hội là các yếu tố quan trọng trong chăm sóc bệnh nhân bị ĐTĐ typ 1.
2.1.2 Khám thực thể
Nếu bệnh nhân có biểu hiện nhiễm toan xêtôn do đái tháo đường, có thể thấy rõ các dấu hiệu mất nước và nhiễm toan, chẳng hạn như nhịp tim nhanh, hạ huyết áp thế đứng và khô các màng niêm mạc.
Hơi thở mùi trái cây phản ánh có tình trạng nhiễm xêtôn.
Khám thực thể phải bao gồm cả khám da, soi đáy mắt, khám miệng, họng, tuyến giáp và tim mạch, cũng như test cảm giác và xét nghiệm sàng lọc biến chứng bàn chân của người đái tháo đường cần được thực hiện tối thiểu 1 lần mỗi năm.
Đo huyết áp và đếm nhịp tim là một thao tác quan trọng đối với tất cả bệnh nhân ĐTĐ typ 1.
Khám theo dõi định kỳ cần ghi chép lại chiều cao, cân nặng và giai đoạn Tanner ở trẻ em để xác định sự tăng trưởng và phát triển của trẻ đang tiến triển một cách bình thường.
Khám mắt có tiêm thuốc làm giãn đồng tử do bác sĩ chuyên khoa mắt thực hiện được khuyến cáo áp dụng cho bệnh nhân phát hiện bị ĐTĐ typ 1 trong thời gian 3 đến 5 năm, với lịch khám lại định kỳ dựa trên các dấu hiệu lâm sàng được phát hiện ở bệnh nhân.
2.2 Chẩn đoán cận lâm sàng
Chẩn đoán bệnh đái tháo đường, dựa trên hướng dẫn của Hiệp hội Đái tháo đường Hoa Kỳ (ADA) có thể được đưa ra khi bệnh nhân có một số bốn bất thường về chuyển hóa glucose sau đây [10]:
- Triệu chứng của tăng đường máu và một xét nghiệm nồng độ glucose huyết tương tĩnh mạch làm ngẫu nhiên ≥ 11 mmol/L. Nồng độ glucose huyết tương lúc đói > 7 mmol/L (126 mg/dL), được khẳng định bằng mẫu thứ hai nếu < 11 mmol/L (200 mg/dL).
- HbAlc > 6,5% (sử dụng kỹ thuật xét nghiệm được Chương trình Chuẩn hóa Glycohemoglobin Quốc gia Hoa Kỳ cấp chứng nhận).
- Nghiệm pháp dung nạp glucose đường uống (OGTT) bất thường. Nồng độ glucose huyết tương 2 giờ sau uống 75g glucose ≥ 200 mg/dL. Tuy nhiên, hiếm khi cần phải làm nghiệm pháp dung nạp glucose bằng đường uống để chẩn đoán ĐTĐ typ 1.
- Những người bị ĐTĐ typ 1 thường biểu hiện đặc trưng bằng các triệu chứng của tăng đường máu, có thể trong tình trạng nhiễm toan xêtôn do đái tháo đường (DKA), có nồng độ đường máu tăng rõ rệt, nồng độ glucose huyết tương ngẫu nhiên ≥ 11 mmol/L.
Sau khi đã chẩn đoán được đái tháo đường, phải phân biệt ĐTĐ typ 1 với các loại đái tháo đường khác.
- Việc chẩn đoán phân biệt này được dựa trên các biểu hiện lâm sàng (thể trạng cơ thể của bệnh nhân, tuổi, các dấu hiệu kháng insulin, tiền sử gia đình và các thăm dò cận lâm sàng nếu cần).
- Nếu bệnh nhân không trong tình trạng nhiễm toan xêtôn do đái tháo đường (DKA) và chẩn đoán ĐTĐ typ 1 không rõ ràng, xét nghiệm tìm tự kháng thể đặc hiệu với tiểu đảo tụy (islet-specific pancreatic autoantibodies), GAD65 hoặc đoạn 40K của tyrosin phosphatase IA-2B (cũng còn được biết như là ICA) hoặc IAA hoặc nồng độ C-peptid cũng có thể hữu ích [10].
- Nồng độ C-peptid thường thấp hoặc không thể phát hiện được ở bệnh nhân bị ĐTĐ typ 1.
- Cần lưu ý là, khi không thấy có tự kháng thể kháng tuyến tụy không loại trừ ĐTĐ typ 1. Ngoài ra, kháng thể có thể gặp ở khoảng 30% các đối tượng bị các thể khác của đái tháo đường.
Cần tiến hành định lượng nồng độ HbA1c từ 2 đến 4 lần/năm. Cần kiểm tra bộ xét nghiệm các thành phần lipid máu, nồng độ creatinin, các điện giải huyết thanh, cũng như cần kiểm tra tỷ lệ microalbumin/creatinin trong nước tiểu ít nhất 1 lần/năm ở bệnh nhân trong độ tuổi thanh thiếu niên và người lớn. Sàng lọc kháng thể kháng tuyến giáp được khuyến cáo, cũng cần kiểm tra nồng độ TSH hằng năm nếu bệnh nhân có kháng thể dương tính hoặc có bướu giáp [10].
3 ĐIỀU TRỊ
Mục tiêu của điều trị
- Mục tiêu của điều trị bệnh đái tháo đường là duy trì được nồng độ đường máu càng gần mức bình thường càng tốt và tránh bị hạ đường máu.
- Tất cả bệnh nhân bị ĐTĐ typ 1 cần điều trị insulin, sớm đạt được giá trị HbA1c gần bình thường đã được chứng minh là giúp bảo tồn được chức năng tế bào beta còn sót lại và làm giảm các biến chứng lâu dài [1].
- Thử nghiệm Kiểm soát Đái tháo đường và biến chứng (DCCT) và nghiên cứu theo dõi tiếp theo của thử nghiệm này đã chỉ ra rằng giảm mỗi 1% giá trị của HbA1c sẽ giúp làm giảm 33% bệnh võng mạc [11,12], 22% microalbumin niệu [13] và giảm 38% bệnh lý dây thần kinh [14].
- Kiểm soát chặt sớm hơn trong 5 - 10 năm đầu của bệnh đái tháo đường trước khi có biểu hiện biến chứng sẽ góp phần làm giảm nguy cơ lâu dài, điều này hỗ trợ giả thuyết cho rằng tăng đường máu gây tình trạng độc cho các cơ quan và tình trạng này có thể tự tồn tại kéo dài (trí nhớ về nồng độ đường máu [glycemic memory]).
- Ở trẻ em, các mục tiêu điều trị bao gồm đảm bảo tăng trưởng và phát triển của trẻ bình thường, cực kỳ chú ý để tránh xảy ra hạ đường máu nặng ở lứa tuổi trẻ.
- Ở bệnh nhân là trẻ vị thành niên sau tuổi dậy thì và người trưởng thành, duy trì huyết áp bình thường, đạt được các đích hay mục tiêu nồng độ lipid máu, ngừng hút thuốc, sử dụng Aspirin ở bệnh nhân trên 40 tuổi và tư vấn trước khi mang thai là các mục tiêu điều trị quan trọng. (tham khảo Chương 28 để biết các khuyến cáo chi tiết.)
Theo dõi nồng độ đường máu
- Cần khuyến khích bệnh nhân bị đái tháo đường typ 1 tiến hành tự theo dõi đường máu (SMBG) ít nhất 4 lần/ngày để có thể điều chỉnh được liều insulin thích hợp dựa trên nồng độ đường máu làm tại nhà.
- Những khuyến cáo này có thể được thay đổi với trẻ em đang tuổi đến trường.
- Cần tăng cường theo dõi trong khi mắc các bệnh cấp tính, tập thể dục gắng sức mạnh, trước và trong khi mang thai.
- Thay đổi luân phiên vị trí làm test đường máu; đọc kết quả nhanh; tải xuống các chỉ số nồng độ đường máu trung bình, đồ thị của những máy đo đường máu có chức năng này đã giúp bệnh nhân với những thách thức của việc tự theo dõi đường máu của bản thân.
- Theo dõi định kỳ trong thời gian ban đêm được khuyến cáo cho tất cả bệnh nhân để kiểm tra và phát hiện tình trạng hạ đường máu về đêm.
- Hệ thống theo dõi đường máu liên tục (CGM) có trên thị trường để hỗ trợ cho điều trị bệnh nhân đái tháo đường. Độ chính xác của thiết bị đã được cải thiện trong những năm qua, một số thiết bị được chấp thuận để tính liều insulin được gọi là sử dụng không phụ thuộc. Các dịch vụ chăm sóc y tế và hầu hết các công ty bảo hiểm chấp thuận các thiết bị này cho bệnh nhân ĐTĐ typ 1 khi họ đáp ứng được một số tiêu chí, chẳng hạn như đối tượng cần được theo dõi thường xuyên và tiêm 4 mũi insulin mỗi ngày. Một số hệ thống có thể cài đặt báo động cho các mức nồng độ đường máu cao và thấp. Dụng cụ hỗ trợ này đặc biệt hữu ích cho những người bị hạ đường máu không được nhận biết.
- Các thiết bị theo dõi đường máu liên tục (CGM) đo một cách liên tục nồng glucose trong dịch kế, cung cấp các thông tin về chiều hướng, mức độ và khoảng thời gian dao động đường máu của bệnh nhân.
- Các thiết bị CGM hiện được tích hợp với máy bơm insulin và cung cấp các tính năng tạm dừng khi hạ đường máu hoặc tự điều chỉnh vòng khép kín liều insulin nền.
- Các kết quả số đo CGM có thể được chia sẻ với các thành viên trong gia đình hoặc được hiển thị trong khi bệnh nhân đang lái xe đã tạo thêm một lớp bảo vệ an toàn khác cho bệnh nhân.
- Sử dụng CGM để hướng dẫn điều trị đã được chứng minh là giúp làm giảm tần suất hạ đường máu và cải thiện giá trị HbAlc [15,16].
3.1 Chế độ ăn uống
Bệnh nhân nên được áp dụng liệu pháp dinh dưỡng y khoa, liệu pháp điều trị dựa trên đánh giá và hướng dẫn cá thể hóa về chế độ ăn uống do một chuyên gia dinh dưỡng có chứng chỉ thực hiện.
Nhu cầu calo đối với những người có hoạt động thể chất vừa phải vào khoảng 35 kcal/kg/ngày nhưng có sự thay đổi đáng kể hằng ngày và giữa người này với người khác [10].
- Hướng dẫn được cá thể hóa nên xem xét nhu cầu calo của bệnh nhân, chủng tộc, thói quen, các ràng buộc liên quan với tôn giáo và phác đồ insulin được kê dùng cho bệnh nhân.
- Chế độ ăn uống cho bệnh nhân bị đái tháo đường phải nhằm tới mục tiêu đạt được giá trị lý tưởng đối với HbA1c, huyết áp, các thành phần lipid máu.
- Cần chú ý để đạt được tình trạng cân bằng giữa khẩu phần năng lượng nhập vào và năng lượng tiêu thụ để tránh tăng cân quá mức.
- Bệnh nhân đang sử dụng phác đồ insulin liều cố định cần phải có khẩu phần carbohydrat nhập vào hằng ngày nhất quán.
- Bệnh nhân cần nắm vững hệ thống trao đổi hoặc tính toán lượng carbohydrat cung cấp cho phép có được sự linh hoạt trong lập kế hoạch các bữa ăn, giúp tránh bị hạ đường máu hoặc tăng đường máu sau ăn.
- Xem xét lại các nguyên tắc dinh dưỡng là một cách hiệu quả về chi phí để giúp bệnh nhân đạt được các mục tiêu điều trị.
3.2 Các thuốc điều trị
3.2.1 Liệu pháp insulin
Phác đồ insulin phải được cá thể hóa để phù hợp với lối sống và các bệnh lý đồng mắc của từng bệnh nhân cụ thể.
Các loại insulin và dược động học của thuốc được trình bày trong Bảng 29.1.
Phác đồ insulin linh hoạt với tiêm nhiều mũi insulin hằng ngày (MDI) hoặc sử dụng một bơm insulin có thể là cách tốt nhất để đạt được đáp ứng insulin gần với sinh lý (Bảng 29.2).
Kê dùng insulin cho bệnh nhân bao gồm một mũi insulin nền tác dụng kéo dài và các mũi insulin tác dụng nhanh trước các bữa ăn (dựa trên khẩu phần carbohydrat ăn vào) là phù hợp nhất để đạt được mục tiêu HbAlc trong khi làm giảm thiểu tối đa nguy cơ hạ đường máu. Truyền insulin dưới da liên tục (CSII) qua một máy bơm insulin có thêm lợi ích là cho phép đo có nhiều tỷ lệ insulin nền khác nhau và linh hoạt tiêm liều insulin bolus.
DCCT và các nghiên cứu khác đã chứng minh rõ ràng rằng bệnh nhân nhiều khả năng hơn sẽ đạt được các mục tiêu đường máu bằng cách sử dụng liệu pháp insulin tăng cường bằng các mũi tiêm nền và mũi tiêm bolus so với điều trị thường quy bằng một hoặc hai mũi tiêm insulin mỗi ngày [11].
- Các quyết định về phác đồ insulin thích hợp nên được đưa ra dựa trên khả năng thực hiện và các ràng buộc về lịch trình tiêm của bệnh nhân.
- Nói chung, bệnh nhân cần một insulin tác dụng trung gian hoặc kéo dài để bao phủ nhu cầu insulin nền và insulin tác dụng nhanh hoặc ngắn để cung cấp cho các bữa ăn.
- Khi bắt đầu hoặc thay đổi phác đồ insulin, cần ước tính tổng liều insulin hằng ngày (TDD). Nhu cầu liều insulin đối với mỗi cá nhân có thể thay đổi nhưng thường dao động từ 0,5 - 0,8 đơn vị/kg/ngày. Bệnh nhân có thể cần liều insulin cao hơn nếu có tình trạng kháng insulin.
Trước đây, phác đồ liều insulin được kê dùng rộng rãi nhất là phác đồ “split-mixed” (“chia nhỏ - trộn”) mà trong phác đồ này NPH được sử dụng làm insulin nền và một chế phẩm tương đồng với insulin tác dụng ngắn hoặc analog nhanh được tiêm trước bữa sáng và bữa tối.
- Sử dụng phác đồ này đã thừa nhận là bệnh nhân sẽ ăn trưa vào thời điểm chuẩn, do mũi tiêm NPH buổi sáng nhiều khả năng đạt đỉnh tác dụng vào khoảng buổi trưa. Các vấn đề liên quan với lịch sinh hoạt của bệnh nhân và dược động học thất thường của NPH đã làm cho phác đồ này hiện tại ít phổ biến hơn.
- Nếu NPH được sử dụng, liều sẽ vào khoảng 0,2 đơn vị/kg x 2 lần/ngày.
Phác đồ được các thầy thuốc nội tiết kê dùng phổ biến nhất cho bệnh nhân bị ĐTĐ typ 1 hiện nay là tiêm nhiều mũi hằng ngày (MDI) hoặc truyền insulin dưới da liên tục (CSII). Các phác đồ này sử dụng quan niệm về liều nền và liều bolus (trước bữa ăn).
| Bảng 29.1. Các loại insulin và được động học/dược lực học của thuốc (a) | |||
| Insulin | Bắt đầu có tác dụng | Đỉnh | Thời gian có tác dụng |
| Tác dụng nhanh (b) | |||
| Insulin aspart (NovoLog, Fiasp) | 10 - 20 phút 3 - 15 phút | 1 - 2 giờ 60 - 90 phút | 3 - 4 giờ 3 - 4 giờ |
| Insulin lispro (Humalog) | 10 - 20 phút | 1 - 2 giờ | 3 - 4 giờ |
| Insulin glulisine (Apidra) | 10 - 20 phút | 1 - 2 giờ | 3 - 4 giờ |
| Technosphere insulin (Afrezza) | 10 phút | 30 phút | 2 giờ |
| Tác dụng ngắn | |||
| Regular ("R") | 0,5 - 1,0 giờ | 2 - 4 giờ | 4 - 8 giờ |
| Regular U-500 (c) | 1,0 giờ | 4 - 6 giờ | 8 - 14 giờ |
| Tác dụng trung gian | |||
| NPH ("N")(d) | 1,5 - 3 giờ | 4 - 10 giờ | 10 - 18 giờ |
| Bảng 29.1. Các loại insulin và dược động học/dược lực học của thuốc | |||
| Insulin | Bắt đầu có tác dụng | Đỉnh | Thời gian có tác dụng |
| Tác dụng kéo dài | |||
| Insulin detemir (Levemir) | 1 - 2 giờ | 6 - 8 giờ | 16 - 24 giờ |
| nsulin glargine (Lantus, Basaglar, Toujeo)(e) | 2 - 3 giờ | Không | gần 24 giờ |
Insulin degludec (Tresiba) (f) | 2 - 3 giờ | Không | 40 giờ |
(a) Dược động học và dược lực học của insulin thay đổi tùy theo đường đưa vào cơ thể. Thời gian bắt đầu tác dụng, đỉnh tác dụng và thời gian kéo dài tác dụng có thể bị ảnh hưởng bởi liều, vị trí tiêm, nhiệt độ da và các yếu tố khác ít được xác định rõ. (b) Insulin tác dụng nhanh nên được sử dụng trước các bữa ăn. Insulin tác dụng nhanh dạng tiêm thích hợp cho sử dụng bằng bơm insulin. (c) Insulin người tác dụng thường (Humulin U-500) có nồng độ cao gấp 5 lần so với U-100. (d) Các dạng bào chế loại dịch treo và đục cần được tái hồi lại dạng nhũ dịch (resuspension) bằng cách lăn và gõ nhẹ vào đầu ống thuốc (không lắc mạnh ống thuốc) trước khi sử dụng.Thao tác tái hồi lại dạng nhũ dịch của thuốc là nguồn gốc tiềm ẩn gây thay đổi tính chất dược động học của thuốc. (e) Insulin glargin có sẵn để sử dụng với nồng độ U-100 và U-300. Không trộn lẫn với bất kỳ loại insulin nào khác trong cùng 1 bơm tiêm do độ pH không tương thích với nhau. Dạng bào chế trong, không cần phải lắc lọ thuốc trước khi dùng. (f) Insulin degludec có sẵn để sử dụng với nồng độ U-100 và U-200. | |||
3.2.2 Tiêm nhiều mũi insulin hằng ngày
Liều nền nói chung chiếm 45% - 55% tổng liều insulin hằng ngày, xấp xỉ 0,4 đơn vị/kg/ngày và được cho thành một mũi tiêm (insulin glargin, insulin degludec) hoặc hai mũi tiêm/ngày (NPH người, insulin detemir, insulin glargin).
- Liều insulin nền được điều chỉnh sao cho nồng độ đường máu lúc đói thường xuyên nằm trong đích từ 4,4 - 6,7 mmol/L (80-120 mg/dL) và có sự thay đổi < 1,7 mmol/L (30 mg/dL) giữa các giá trị buổi tối và buổi sáng.
- Những thay đổi về trọng lượng cơ thể, hoạt động thể lực hay tập thể dục, có tình trạng tăng nồng độ đường máu tiếp diễn hoặc hạ đường máu xảy ra thường xuyên phải nhanh chóng xem xét lại liều insulin nền.
| Bảng 29.2. Phác đồ liều dùng insulin tiêm nhiều mũi hằng ngày (MDI) hoặc truyền insulin dưới da liên tục (CSII) | ||
| Thời điểm | Liều dùng | Phác đồ |
| Trước ăn sáng, ăn trưa và ăn tối | 0,15 - 0,2 × tổng liều insulin hằng ngày (TDD) hoặc số đơn vị insulin được xác định bằng tính lượng carbohydrat đưa vào cộng với yếu tố hiệu chỉnh. | Insulin tác dụng nhanh |
| Trước khi đi ngủ (có thể được cho vào buổi sáng hoặc chia nhỏ thành 2 liều) hoặc truyền liên tục qua bom insulin. | 0,4 - 0,55 × tổng liều insulin hằng ngày (TDD). | Insulin glargin, detemir hoặc degludec. Nếu dùng NPH, cho một nửa tổng liều vào buổi sáng và một nửa tổng liều vào buổi tối Insulin tác dụng nhanh được ưa chuộng để sử dụng qua bơm insulin. |
Liều bolus được sử dụng để giải quyết khẩu phần carbohydrate ăn vào và để điều chỉnh kết quả đo đường máu cao. Liều bolus trước bữa ăn được xác định bằng một hoặc nhiều phương pháp sau đây:
- Liều cố định trước mỗi bữa ăn, gần 0,13 đơn vị/kg hoặc bằng 1/6 tổng liều insulin tiêm hằng ngày.
- Liều cố định trước mỗi bữa ăn như trên cộng với “yếu tố hiệu chỉnh” theo thang điều chỉnh (xem nội dung bài ở phần tiếp theo) dựa vào kết quả tự theo dõi nồng độ đường máu trước bữa ăn.
- Tính toán lượng carbohydrat cộng với “yếu tố hiệu chỉnh” sử dụng các lượng thay đổi phụ thuộc vào khẩu phần carbohydrate ăn vào được dự kiến và kết quả tự theo dõi nồng độ đường máu trước bữa ăn.
- Cả bệnh nhân và thầy thuốc cần học và nắm rõ các ý tưởng quan trọng để việc sử dụng các phác đồ tiêm nhiều mũi insulin đạt được thành công. Nếu sử dụng phác đồ tiêm một lượng insulin cố định trước bữa ăn, bệnh nhân phải có ý tưởng rõ ràng về kế hoạch bữa ăn được chỉ định và có thể tuân thủ chỉ định này một cách chính xác.
- Ngoài ra, bệnh nhân có thể điều chỉnh liều insulin tiêm trước bữa ăn dựa trên lượng carbohydrat nhập vào được dự kiến, điều này cho phép có được tính linh hoạt hơn trong điều trị. Để làm điều này, thầy thuốc điều trị hoặc các giáo dục viên về bệnh đái tháo đường phải xác định được tỷ lệ “insulin/carbohydrat”, tỷ số này có thể được tính bằng cách chia 500 cho tổng liều insulin tiêm hằng ngày. - Một bệnh nhân đang sử dụng 50 đơn vị insulin mỗi ngày cần 1 đơn vị insulin cho mỗi 10 g carbohydrate ăn vào.
- Bệnh nhân cần tìm hiểu loại thực phẩm nào có chứa carbohydrat, cách ước tính số gam carbohydrat trong khẩu phần ăn được cung cấp và cách tính liều insulin trước bữa ăn.
- Đôi khi phải tiến hành điều chỉnh thêm đối với các bữa ăn chứa nhiều chất béo hoặc đối với các bữa ăn có lượng chất xơ cao.
- Thời điểm tiêm liều bolus insulin cũng rất quan trọng, vì ngay cả insulin “tác dụng nhanh” cũng không có tác dụng ngay lập tức. Nói chung, liều bolus insulin hoặc liều insulin trước bữa ăn phải được tiêm trước khi ăn, với thời gian để điều chỉnh nếu có đường máu cao hơn.
- Bệnh nhân có thể có được lợi ích khi sử dụng insulin có tác dụng nhanh hơn như technosphere insulin (Afrezza) (một dạng bào chế bột hít insulin) hoặc sản phẩm mới hơn đang được phát triển để giúp giữ nồng độ đường máu sau ăn tăng lên tối thiểu trong khi vẫn tránh bị hạ đường huyết xảy ra muộn sau bữa ăn.
- Ngoài việc phải đáp ứng được nhu cầu calo, bệnh nhân phải có thể điều chỉnh bù trừ được đối với các kết quả số đo nồng độ đường máu cao hoặc thấp. Một thang điều chỉnh liều lên xuống được cá thể hóa đối với từng bệnh nhân, được biết như là “yếu tố hiệu chỉnh” được xác định, nó cung cấp cho bệnh nhân số lượng đơn vị insulin thêm vào (hoặc bớt đi) cho mỗi liều tiêm trước bữa ăn. Hệ số điều chỉnh này được ước tính bằng cách chia 1.800 cho tổng liều insulin tiêm hằng ngày.
3.2.3 Tính toán mẫu
Ví dụ 1: Một bệnh nhân thừa cân, dùng 60 đơn vị insulin mỗi ngày. Nồng độ đường máu hiện tại của bệnh nhân là 9,9 mmol/L (178 mg/dL), bệnh nhân ăn mỗi bữa khoảng 90 gam carbohydrat. Bác sĩ nói với bệnh nhân là mục tiêu khi tự theo dõi nồng độ đường máu (SMBG) của bệnh nhân là 6,7 mmol/L (120 mg/dL). Liều insulin tác dụng nhanh mà bệnh nhân cần phải tiêm là bao nhiêu?
- Tỷ lệ insulin/carbohydrat = 500/60 = 1 đơn vị insulin/8,33 g
- Hệ số hiệu chỉnh = 1800/60 = 30 (dự kiến rằng 1 đơn vị insulin sẽ làm giảm 1,7 mmol/L tương đương 30 mg/dL đường máu). 90 g carbohydrat/8,33 g/đơn vị insulin = ~10 đơn vị insulin để bao tiêu được lượng carbohydrat trong khẩu phần ăn vào.
- Kết quả nồng độ đường máu khi bệnh nhân tự theo dõi đường máu (SMBG) - nồng độ đường máu mục tiêu = 178 mg/dL - 120 = 58 mg/dL (3,2 mmol/L). Bệnh nhân sẽ phải dùng 2 đơn vị insulin để hiệu chỉnh.
- Do đó, bệnh nhân cần phải tiêm 12 đơn vị insulin tác dụng nhanh.
Ví dụ 2: Một bệnh nhân nữ gầy, nhạy cảm với insulin, tiêm 30 đơn vị insulin mỗi ngày. Nếu bệnh nhân này có nồng độ đường máu hiện tại là 9,9 mmol/L và sắp ăn bữa ăn thường ngày có chứa 45 gam carbohydrat, vậy bệnh nhân nên sử dụng bao nhiêu đơn vị insulin?
- Tỷ lệ insulin/carbohydrat = 500/30 = 1 đơn vị insulin/16,66 g.
- Hệ số hiệu chỉnh = 1.800/30 = 60 (dự kiến rằng 1 đơn vị insulin sẽ làm giảm được 3,3 mmol/L tương đương 60 mg/dL đường máu).
- 45 gam carbohydrat/16,66 g/đơn vị insulin 3 đơn vị insulin để giảm được lượng carbohydrat nhập vào từ khẩu phần ăn.
- Kết quả nồng độ đường máu khi bệnh nhân tự theo dõi (SMBG) – nồng độ đường máu mục tiêu = 178 - 120 = 58 mg/dL (3,2 mmol/L).
- Bệnh nhân sẽ phải sử dụng 1 đơn vị insulin để hiệu chỉnh.
- Do đó, bệnh nhân này phải được dùng 4 đơn vị insulin tác dụng nhanh. Bằng cách sử dụng bút insulin có thể cung cấp liều tính đến nửa đơn vị, bệnh nhân này có thể điều chỉnh để tiêm cho mình 3,5 đơn vị.
3.2.4 Truyền insulin dưới da liên tục
Điều trị bằng bơm insulin đã trở thành một thay thế phổ biến cho tiêm nhiều mũi insulin hằng ngày và có cả những ưu điểm cũng như nhược điểm.
Các tiến bộ công nghệ đã góp phần tạo ra những máy bơm insulin nhỏ hơn với các tính năng như nhiều tốc độ insulin nền, có máy tính liều và phương thức liều thay thế.
Hệ thống truyền insulin dưới da liên tục hiện nay bao gồm thiết bị theo dõi nồng độ đường máu liên tục và hệ thống này giúp hỗ trợ điều chỉnh liều lượng và có các tính năng tạm dừng (“hệ thống vòng lặp kín”). Các hệ thống ghép sử dụng cả insulin và glucagon có thể làm giảm hơn nữa nguy cơ hạ đường máu và đang được phát triển. Truyền insulin dưới da liên tục (CSII) cung cấp cho bệnh nhân bị ĐTĐ typ 1 sự linh hoạt lớn nhất, dễ được xã hội chấp nhận hơn so với kim tiêm và bơm tiêm insulin để dùng liều thường xuyên. Máy bơm insulin có kích thước như một máy nhắn tin và chứa 180 - 300 đơn vị insulin trong một bơm tiêm chuyên dụng được kết nối đến một catheter đặt dưới da bởi một ống mỏng.
Cần thay catheter dưới da và đặt lại ở một vị trí khác mỗi 3 ngày/lần. Máy bơm được lập trình sẵn để truyền tốc độ nền của insulin nhưng bệnh nhân phải kích hoạt máy bơm để cung cấp các liều bolus tại thời điểm bữa ăn hoặc khi cần hiệu chỉnh liều.
Máy bơm chỉ sử dụng insulin tác dụng nhanh. Để sử dụng được máy bơm insulin cần giáo dục viên có kinh nghiệm trong lĩnh vực truyền insulin dưới da liên tục giáo dục về bệnh đái tháo đường và đào tạo cho bệnh nhân cách sử dụng máy bơm insulin, điều này đòi hỏi phải mất vài giờ để hướng dẫn cho bệnh nhân.
Liều insulin kê cho bệnh nhân dùng được chấp nhận cũng tương tự như liều khi tiêm nhiều mũi hằng ngày, tuy nhiên tổng liều insulin hằng ngày được giảm đi 10 - 20%.
- Tốc độ liều nền (bằng một nửa tổng liều hằng ngày) chia cho 24 và được lập trình dưới dạng tốc độ truyền mỗi giờ. Ví dụ, một bệnh nhân được chỉ định tiêm 48 đơn vị/ngày với phác đồ tiêm nhiều mũi hằng ngày (MDI) sẽ cần khoảng 20 đơn vị cho nhu cầu nền hoặc xấp xỉ 0,8 đơn vị/giờ để bắt đầu. Tốc đồ truyền liều nền này có thể được điều chỉnh để phù hợp với nồng độ đường máu thấp vào ban đêm, tăng lên vào buổi sáng và khi có tăng hoặc giảm hoạt động trong ngày. Tốc độ liều nền có thể tạm thời giảm đi khi bệnh nhân luyện tập thể dục hoặc máy bơm có thể cài đặt ở chế độ tạm ngừng khi bị hạ đường máu.
- Liều bolus được vận hành tương tự như đối với phác đồ tiêm nhiều mũi hằng ngày với một ngoại lệ quan trọng. Các máy bơm insulin hiện tại có thể cung cấp các liều insulin rất nhỏ, vì vậy yếu tố hiệu chỉnh có thể được kê dưới dạng một phân số (ví dụ 0,... thay vì số nguyên). Cơ hội cung cấp được các liều nhỏ inslin rất hữu ích với trẻ em và các bệnh nhân nhạy cảm với insulin.
Nhược điểm chính của truyền insulin dưới da liên tục là máy bơm insulin và vật tư tiêu hao đi kèm có giá thành cao. Do chỉ sử dụng insulin có tác dụng nhanh nên khi máy bơm hoặc catheter bị trục trặc có thể gây nên tình trạng tăng nhanh nồng độ đường máu và nhiễm toan xêtôn do đái tháo đường trong vòng 8 đến 12 giờ.
Một bất lợi tiềm ẩn khác là nguy cơ nhiễm trùng vị trí đặt catheter, có thể làm giảm thiểu nguy cơ này bằng cách hướng dẫn bệnh nhân thực hiện các kỹ thuật bán vô trùng.
3.2.5 Điều chỉnh liều Insulin
Điều chỉnh liều insulin hoặc thay đổi phác đồ dùng insulin được thực hiện sau khi đánh giá các kết quả tự theo dõi nồng độ đường máu (SMBG) của bệnh nhân hoặc kết quả đường biểu diễn theo dõi nồng độ đường máu liên tục (CGM) và tìm kiếm mô hình nồng độ đường máu của bệnh nhân.
Hiệu quả của liều insulin tác dụng nhanh cụ thể được theo dõi dựa trên các giá trị nồng độ đường máu thu được sau khi dùng liều insulin đang sử dụng (ví dụ: nồng độ đường máu sau ăn hoặc buổi trưa phản ánh liều insulin tác dụng nhanh tiêm lúc ăn điểm tâm).
Liều insulin tác dụng trung gian và tác dụng kéo dài được đánh giá bằng cách xem xét kỹ lưỡng kết quả tự theo dõi nồng độ đường máu hoặc đường biểu diễn kết quả theo dõi nồng độ đường máu liên tục sau khi tiêm insulin (ví dụ: nồng độ đường máu buổi sáng để xác định liều insulin buổi tối có thỏa đáng hay không) và xem xét lại tần suất tổng thể của các lần tăng và hạ đường máu.
Các giáo dục viên bệnh đái tháo đường có kỹ năng điều chỉnh liều insulin và cung cấp các nguồn thông tin quý giá cho những bệnh nhân đang gặp vấn đề về kiểm soát nồng độ đường máu của họ gần phạm vi mục tiêu.
Giáo dục cho bệnh nhân về bệnh đái tháo đường là một chi phí hiệu quả và cần thiết để đạt được việc kiểm soát chặt nồng độ đường máu mà vẫn tránh các đợt hạ đường máu.
3.2.6 Điều trị hỗ trợ
Pramlintid (symlin) là chất tổng hợp tương đồng với amylin, một sản phẩm được các tế bào beta chế tiết đã được chấp thuận để sử dụng như một điều trị bổ sung với insulin ở bệnh nhân bị ĐTĐ typ 1. Thuốc được cho như một mũi tiêm tách biệt với liều 15-45 ug trước bữa ăn và giúp làm giảm nồng độ đường máu sau ăn bằng cách ức chế glucagon và làm tăng cảm giác no.
Thuốc có tác dụng làm giảm HbA1c chỉ vào khoảng 0,5% và có thể góp phần làm giảm cân nhẹ. Các tác dụng phụ của thuốc là buồn nôn, nôn và tăng nguy cơ hạ đường máu. Cần điều chỉnh liều insulin khi kê đơn pramlintid sử dụng cho bệnh nhân [17,18].
Các điều trị bổ sung khác bao gồm Metformin và các chất ức chế SGLT-2 hiện đang được nghiên cứu để sử dụng ở bệnh nhân bị ĐTĐ typ 1.
3.3 Thay đổi lối sống/nguy cơ
Chế độ ăn uống

Bệnh nhân nên được áp dụng liệu pháp dinh dưỡng y khoa điều trị đây là liệu pháp điều trị dựa trên đánh giá và hướng dẫn cá thể hóa về chế độ ăn uống do một chuyên gia dinh dưỡng có chứng chỉ thực hiện.
Nhu cầu calo đối với những người có hoạt động thể chất vừa phải vào khoảng 35 kcal/kg/ngày nhưng có sự thay đổi đáng kể giữa các ngày và từ người này sang người khác [10].
Hướng dẫn được cá thể hóa phải xem xét tới nhu cầu calo của bệnh nhân, chủng tộc, thói quen, các ràng buộc liên quan với tôn giáo và phác đồ insulin được kê dùng cho bệnh nhân.
Chế độ ăn uống cho bệnh nhân bị đái tháo đường phải nhằm tới mục tiêu đạt được giá trị lý tưởng đối với HbA1c, huyết áp và các thành phần lipid máu.
Cần chú ý để đạt được tình trạng cân bằng giữa khẩu phần năng lượng nhập vào và năng lượng tiêu thụ để tránh tăng cân quá mức.
Bệnh nhân đang sử dụng phác đồ insulin liều cố định cần phải có khẩu phần carbohydrat nhập vào hằng ngày nhất quán.
Bệnh nhân cần nắm vững hệ thống trao đổi hoặc tính toán lượng carbohydrat cung cấp, cho phép có được sự linh hoạt trong lập kế hoạch các bữa ăn, giúp tránh bị hạ hoặc tăng đường máu sau ăn.
Xem xét lại các nguyên tắc dinh dưỡng là một cách làm hiệu quả về chi phí để giúp bệnh nhân đạt được các mục tiêu điều trị.
4 CÁC BIẾN CHỨNG
4.1 Nhiễm toan xê tôn do đái tháo đường
Nhiễm toan xêtôn do đái tháo đường (DKA) là kết quả trực tiếp của tình trạng thiếu hụt insulin tương đối. Mất nước và tăng quá mức các hormon điều hòa gây tăng đường máu (glucagon, epinephrin và cortisol) là các yếu tố thúc đẩy tình trạng này [19] .
Ở các trường hợp điển hình có thể xác định được yếu tố làm trầm trọng tình trạng bệnh: bệnh đái tháo đường mới được chẩn đoán, quên không dùng các liều insulin, nhiễm trùng, có thai, chấn thương, căng thẳng hay stress cảm xúc, uống quá nhiều rượu, nhồi máu cơ tim, đột quỵ não, bị một bệnh lý gian phát (hay đồng thời), cường giáp, bệnh Cushing hoặc hiếm gặp hơn, u tủy thượng thận.
Các đặc điểm lâm sàng chính của nhiễm toan xêtôn do đái tháo đường là tăng nồng độ đường máu, mất nước, nhiễm toan, đau bụng, buồn nôn, nôn, thay đổi tình trạng huyết động và biến đổi trạng thái tinh thần [19].
Sinh lý bệnh
- Sinh lý bệnh của nhiễm toan xêtôn do đái tháo đường bắt đầu bằng một nồng độ insulin không đủ để hỗ trợ hấp thu glucose ngoại biên và ức chế quá trình tân tạo đường ở gan.
- Tăng nồng độ đường máu được đầy thêm do gia tăng các hormon điều hòa gây tăng đường máu như glucagon, catecholamin, cortisol và hormon tăng trưởng. Hoạt hóa các con đường dị hóa trong cơ và mô mỡ dẫn tới sản xuất các acid amin và acid béo tự do, đó là nhiên liệu cho quá trình tân tạo glucose của gan và sản xuất ra thể xê tôn.
- Tăng bài niệu thẩm thấu do tình trạng tăng đường máu gây nên sẽ gây mất dịch và điện giải rõ rệt, kích thích phóng thích thêm nữa các catecholamin.
- Catecholamin có tác dụng đối kháng với tác dụng của insulin và góp phần làm tăng ly giải mỡ, điều này làm tăng thêm acid béo tự do vào tuần hoàn, chất này sau đó trải qua quá trình oxy hóa acid béo để tạo thành các thể xê tôn.
- Thiếu hụt thể tích làm giảm lưu lượng dòng máu thận, góp phần làm giảm bài tiết glucose và xêtôn, làm tăng nồng độ creatinin và Kali trong huyết thanh.
- Nhiễm toan xảy ra khi nồng độ aceton, acetoacetat và p-hydroxybutyrat vượt quá khả năng đệm của bicarbonat và đáp ứng hô hấp.
- PaCO, thấp phản ánh tình trạng hô hấp gắng sức và mức độ nặng của tình trạng nhiễm toan chuyển hóa.
- Khi xét nghiệm có tăng khoảng trống anion và nồng độ bicarbonat thấp trong bối cảnh nồng độ đường máu cao và bệnh nhân đang ốm yếu cần nhanh chóng tiến hành điều trị ngay tình trạng nhiễm toan xêtôn do đái tháo đường (DKA) trong khi chờ các đánh giá cận lâm sàng khẳng định bệnh [19,29].
- Sử dụng máy đo xêtôn tại giường ở phòng phân loại bệnh nhân cấp cứu hoặc tại các đơn vị cấp cứu giúp chẩn đoán nhiễm toan xêtôn do đái tháo đường và có thể hạn chế sự chậm trễ trong điều trị (20,21]. Chẩn đoán phân biệt đối với các trường hợp nhiễm toan có tăng khoảng trống anion khác được nêu trong Bảng 29.3.
Triệu chứng
- Các triệu chứng của nhiễm toan xêtôn trong đái tháo đường không đặc hiệu bao gồm chán ăn, buồn nôn, nôn (chiếm 25%), đau bụng và đau hoặc yếu cơ.
- Tiểu nhiều và khát nhiều là đặc trưng đối với nồng độ đường máu cao nhưng có thể trở nên mờ nhạt do nôn mửa, giảm Độ thanh thải creatinin thận, có các triệu chứng tâm thần kinh khi mức độ nặng của nhiễm toan xêtôn trong đái tháo đường tăng lên.
- Thở nhanh được ghi nhận với nhiễm toan nhẹ, bệnh nhân có thể phàn nàn về cảm giác khó thở (thở đoản hơi). Thở kiểu Kussmaul là một dấu hiệu của một bệnh nhân bị bệnh nặng.
- Khám thực thể cho thấy nhịp tim nhanh, tụt huyết áp hoặc hạ huyết áp thế đứng, niêm mạc khô, giảm độ chun giãn của da, bụng căng đau khi khám và các dấu hiệu khác của các biểu hiện lâm sàng là yếu tố thúc đẩy đợt nhiễm toan xêtôn do đái tháo đường. Trạng thái tinh thần có thể bình thường hoặc bị tổn hại nghiêm trọng. Các dấu hiệu của bệnh lý xảy ra đồng thời hoặc các yếu tố thúc đẩy nhiễm toan xêtôn trong đái tháo đường có thể được nhận thấy.
Các dấu hiệu cận lâm sàng
- Các dấu hiệu cận lâm sàng của DKA bao gồm: nồng độ đường máu >250 mg/dL, có đường niệu, khoảng trống anion tăng cao (khoảng trống anion bình thường là ≤ 12) và có hiện diện của xêtôn hoặc B-hydroxybutyrat trong huyết thanh hoặc nước tiểu [19,21].
- Khoảng trống anion được tính như sau: (khoảng anion = Na – [C1 + HCO3]). Nồng độ bicarbonat huyết thanh thường < 15 mEq/L, pCO,<40 mmHg và pH động mạch < 7,3, ẞ -hydroxybutyrat > 1,5 mmol/L [19,21].
- Creatinin và Kthường tăng trên mức bình thường.
- Nếu có hạ kali máu tại thời điểm chẩn đoán, bệnh nhân có tình trạng thiếu hụt Knặng và cần được theo dõi cẩn thận.
- Thường thì nồng độ K+ ban đầu cao, cần kiểm tra điện tâm đồ để phát hiện các dấu hiệu của tăng kali máu, như sóng T cao nhọn, khoảng QT bị rút ngắn, phức hợp QRS giãn rộng và sóng P dẹt hoặc mất sóng P.
- Sau đó, trong quá trình điều trị, nếu tình trạng hạ kali máu xảy ra, ghi lại điện tim có thể thấy khúc ST chênh xuống, sóng T dẹt hoặc âm, khoảng QT kéo dài và xuất hiện sóng U.
- Giả hạ natri máu có thể gặp, vì vậy cần điều chỉnh nồng độ natri huyết thanh đo được khi có tình trạng nồng độ đường máu tăng cao (cộng thêm 1,6 mmol/L cho giá trị nồng độ natri đo được cho mỗi mức tăng thêm 5,5 mmol/L (100 mg/dL) của nồng độ đường máu khi đường máu > 5,5 mmol/L), nồng độ này có thể bị giảm thêm khi triglycerid máu tăng cao.
- Amylase và lipase có thể tăng do các cơ chế không được biết rõ, tình trạng tăng này không nhất thiết chỉ dẫn bệnh nhân bị viêm tụy và nó sẽ hồi phục trở lại giá trị bình thường bằng cách điều trị nhiễm toan xêtôn do đái tháo đường.
| Bảng 29.3. Chẩn đoán phân biệt nhiễm toan có tăng khoảng trống anion (từ tắt MUDPILES giúp ghi nhớ) | |
| Tình trạng bệnh lý | Các kết hợp lâm sàng |
| M: Uống Methanol | Suy giảm/mất thị lực; Khoảng trống thẩm thấu nằm giữa áp lực thẩm thấu đo được và tính toán (có thể gặp khi uống bất kỳ loại rượu nào). |
| U: Tăng urê máu | Tiền sử suy thận; Tăng nồng độ urê và creatinin huyết thanh. |
| D: Nhiễm toan xê tôn do đái tháo đường (DKA) | Tiền sử bị ĐTĐ, tăng nồng độ đường máu. |
| P: Paraldehyde | Hơi thở có mùi giống formaldehyde; Tăng nồng độ paraldehyde. |
| I: Sǎt; isoniazid | Tăng nồng độ Sắt huyết thanh; Bệnh nhân có thể bị tăng các transaminase của gan trong ngộ độc Isoniazid. |
| L: Nhiễm toan lactic | Có thể do giảm thể tích tuần hoàn/sepsis, nhồi máu cơ tim, ngộ độc metformin, cyanide, hydrogen sulfid, khí CO, methemoglobin; Nồng độ lactat máu cao. |
| E: EtOH; ethylene glycol | khoảng trống thẩm thấu nằm giữa áp lực thẩm thấu đo được và tính toán (có thể gặp khi uống bất kỳ loại rượu nào); Tăng nồng độ EtOH gặp trong ngộ độc EtOH; Các tinh thể oxalat Canxi được thấy trong nước tiểu trong ngộ độc ethylene glycol. |
| S: Salicylates | Ù tai, tăng nồng độ salicylat, có thể có tình trạng kiềm hô hấp đồng thời. |
| EtOH: Ethanol. | |
Điều trị nhiễm toan xêtôn do đái tháo đường (DKA)
- Đánh giá lâm sàng và phân loại
- Cần cho nhập viện vào khoa hồi sức tích cực đối với các bệnh nhân có huyết động không ổn định hoặc thay đổi trạng thái tinh thần, bệnh nhân nhi hoặc nếu không thể theo dõi thường xuyên tại một bệnh phòng nội khoa.
- Có thể cần phải theo dõi huyết động cho bệnh nhân bị sốc, trong tình trạng sepsis, DKA có biến chứng nhồi máu cơ tim hoặc ở bệnh nhân bị bệnh thận giai đoạn cuối hoặc suy tim mạn. " Có thể cần đặt ống thông dạ dày cho bệnh nhân bị nôn ra máu hoặc bệnh nhân hôn mê.
- Dịch và chất điện giải: Hồi sức truyền dịch ở bệnh nhân người lớn nên bắt đầu bằng dịch muối sinh lý với tốc độ 1L/giờ trừ khi có chống chỉ định (suy tim mạn, bệnh thận giai đoạn cuối).
- Tổng lượng nước trong cơ thể bị thiếu hụt thông thường là 4 - 6L, thiếu hụt natri là 7 - 10 mEq/kg, thiếu hụt K là 3 - 5 mEq/kg và thiếu hụt PO là 5 – 7 mmol/kg. Nếu nồng độ natri hiệu chỉnh là bình thường hoặc cao khi kiểm tra lại xét nghiệm, thay đổi dịch truyền tĩnh mạch thành dịch nửa muối (NaCl 0,45%); tiếp tục truyền NaCl 0,9% nếu nồng độ natri máu vẫn thấp.
- Khi Kgiảm xuống < 5,0 mEq/L và bệnh nhân có được lưu lượng nước tiểu thỏa đáng, cho thêm 20 - 30 mEq K+ vào mỗi lít dịch truyền tĩnh mạch.
- Lên kế hoạch điều chỉnh các thiếu hụt dịch và muối trong vòng 24 giờ, tốc độ điều chỉnh chậm hơn ở trẻ em. Tốc độ truyền dịch lúc bắt đầu cho trẻ em là 10 - 20 mL/kg/giờ và không được vượt quá 50 mL/kg trong vòng 4 giờ điều trị đầu tiên.
- Bệnh nhân biểu hiện DKA có tình trạng thiếu hụt PO, do tăng bài niệu thẩm thấu, mặc dù điều này có thể không rõ ràng khi bệnh nhân tới viện cấp cứu do có thiếu hụt insulin và nhiễm toan khiến PO, dịch chuyển ra khỏi tế bào. Nồng độ PO, trong huyết thanh giảm xuống khi điều trị bằng insulin.
- Ngoại trừ trong trường hợp giảm PO, máu rất nặng (nồng độ PO, huyết thanh <1,0 mg/dL) hoặc bị tổn thương đồng thời cả tim mạch và hô hấp, dùng PO, thường quy chưa được chứng minh là mang lại lợi ích cho bệnh nhân và trên thực tế, nó có thể gây hại do bồi phụ dư thừa PO, có thể gây hạ canxi máu.
- Điều trị bằng bicarbonat trong nhiễm toan xêtôn do đái tháo đường gây tranh cãi, không nên dùng một cách thường quy, trừ khi pH huyết thanh < 7,0 hoặc bệnh nhân bị tăng kali máu đe dọa tính mạng.
Insulin và glucose
- Liều bolus tĩnh mạch lúc đầu là 0,1 đến 0,15 đơn vị/kg insulin nhanh (regular [R] insulin), được tiếp theo bằng truyền tĩnh mạch liên tục với liều 0,1 đơn vị/kg/giờ (100 đơn vị insulin nhanh [R ]/100 mL Dung dịch nước muối sinh lý), mặc dù không phải tất cả các hướng dẫn đều khuyến cáo tiêm insulin bolus liều tĩnh mạch [19,20]. Ở trẻ em, không nên cho liều insulin bolus tĩnh mạch mà nên bắt đầu truyền ngay insulin [14].
- Theo dõi nồng độ glucose huyết thanh hằng giờ và dự kiến nồng độ đường máu phải giảm từ 2,8 đến 4,2 mmol/L/giờ. Tốc độ giảm đường máu chậm hơn có thể chỉ dẫn có tình trạng kháng insulin, hồi sức truyền dịch không thỏa đáng hoặc cung cấp insulin không thích hợp.
- Khi hết nhiễm toan, nồng độ đường máu có khả năng giảm xuống nhanh hơn. Khi nồng độ đường máu < 13,8 mmol/L (<250 mg/dL), cho thêm dịch glucose 5% trong dịch truyền tĩnh mạch và giảm tốc độ truyền insulin xuống còn một nửa .
- Nếu tốc độ truyền glucose được giữ ổn định, nhu cầu truyền insulin sẽ dễ dự đoán hơn.
- Tiếp tục phác đồ điều trị insulin tích cực và theo dõi đến khi bệnh nhân có thể ăn uống lại, giải quyết được tình trạng nhiễm toan có tăng khoảng trống anion. Khi giải quyết song tình trạng nhiễm toan, khoảng trống anion sẽ mất đi, pH máu động mạch và tĩnh mạch tăng lên, nồng độ bicarbonat huyết thanh sẽ tăng lên.
- Hướng dẫn của ADA về điều trị nhiễm toan xêtôn do đái tháo đường (DKA) nêu rõ các tiêu chuẩn để đánh giá là tình trạng nhiễm toan xê tôn đã được giải quyết tốt bao gồm nồng độ đường máu < 11,1 mmol/L (200 mg/dL), nồng độ bicarbonat huyết thanh > 18 mEq/L và pH máu tĩnh mạch > 7,3 [19,22. Bệnh nhân hồi phục DKA có thể xuất hiện nhiễm toan chuyển hóa không có tăng khoảng trống anion thoáng qua hay tạm thời do tăng clo máu, tình trạng này xảy ra do mất qua nước tiểu “bicarbonat điện thế” dưới dạng anion xêtôn và các anion này được thay thế bằng các ion clo từ dịch truyền tĩnh mạch. Nhiễm toan không có tăng khoảng trống anion này có tính chất thoáng qua và vẫn còn chưa được chứng minh là có ý nghĩa lâm sàng, ngoại trừ trong trường hợp bệnh nhân bị suy thận.
- Các sai lầm thường gặp: Tăng nồng độ đường máu sẽ đáp ứng với điều trị nhanh hơn so với việc giải quyết tình trạng nhiễm toan. Không được giảm hoặc ngừng truyền insulin khi đường máu đạt tới khoảng giới hạn bình thường. Điều này có thể dẫn đến tình trạng nhiễm toan xê tôn diễn biến tồi đi. Thay vào đó, cần tiếp tục truyền insulin tĩnh mạch nhưng điều chỉnh liều và/hoặc truyền thêm dung dịch glucose 5% với tốc độ 50 - 75 mL/giờ, mà không phải với tốc độ sử dụng để truyền dịch hồi sức cho bệnh nhân. Nếu truyền dịch glucose 5% với tốc độ quá nhanh, nồng độ đường máu sẽ tăng lên sẽ làm chậm trễ trong việc chuyển dùng insulin sang đường tiêm dưới da.
Theo dõi
- Thử nồng độ đường máu đầu ngón tay hằng giờ trong khi truyền insulin.
- Theo dõi điện giải đồ, nồng độ urê và creatinin máu mỗi 2 - 4 giờ/ lần đến khi nồng độ K+ ổn định và tình trạng nhiễm toan tăng khoảng trống anion được giải quyết.
- Xét nghiệm nồng độ xêtôn hoặc B-hydroxybutyrat máu bằng thiết bị xét nghiệm máu đầu ngón tay làm tại giường khi bệnh nhân nhập viện và để theo dõi bệnh nhân nếu có sẵn để sử dụng [20,21.
- Tính toán khẩu phần đầu vào và đầu ra, trọng lượng cơ thể của bệnh nhân.
Chuyển sang tiêm insulin dưới da
- Tiếp tục truyền insulin tĩnh mạch và truyền dịch tĩnh mạch đến khi bệnh nhân hết tình trạng nhiễm toan, nồng độ đường máu < 250 mg/dL và bệnh nhân có thể ăn được. Cần lưu ý: có thể cho bệnh nhân thử ăn một bữa ăn nhẹ hoặc dạng dịch lỏng trong khi đang truyền nhỏ giọt insulin nhưng có thể cần phải tăng tốc độ truyền insulin trong thời gian cho ăn và sau đó trở lại tốc độ truyền insulin như thường lệ.
- Thực hiện quá trình chuyển đổi sang insulin tiêm dưới da trước khi ngừng truyền insulin tĩnh mạch, lý tưởng là gần thời điểm với thời điểm tiêm dùng insulin thông thường. Một số hướng dẫn khuyến cáo tiếp tục dùng insulin nền theo phác đồ trong khi điều trị ban đầu DKA để tránh tình trạng tăng đường máu dội lại khi ngừng truyền insulin tĩnh mạch [20].
- Nếu bệnh nhân đã được chẩn đoán bị đái tháo đường từ trước đó, cho liều insulin trước bữa ăn như thường lệ cộng với bất kỳ yếu tố điều chỉnh nào nếu có và phủ nhu cầu insulin nền bằng insulin tác dụng trung gian hoặc kéo dài. Nếu bệnh nhân mới được chẩn đoán ĐTĐ, cho insulin nền ở mức xấp xỉ 0,2 đơn vị/kg và liều bolus khoảng 0,1 đơn vị/kg/bữa ăn.
- Ví dụ, nếu có thể ngừng truyền nhỏ giọt insulin tĩnh mạch vào buổi trưa, cho dùng liều trước bữa ăn bằng insulin tác dụng ngắn theo lịch trình tiêm thông thường của bệnh nhân và cho thêm một phần liều NPH để có phủ tác dụng đến bữa tối hoặc trước khi đi ngủ.
- Nếu không tiếp tục dùng liều insulin nền trong giai đoạn điều trị cấp tính, bắt đầu insulin nền (bằng NPH, detemir [Levemir], glargin [Lantus, Basaglar, Toujeo] hoặc degludec [Tresiba]) và insulin tác dụng ngắn tối thiểu 2 giờ trước khi ngừng truyền nhỏ giọt insulin.
- Duy trì tốc độ truyền dextrose (dịch glucose) tĩnh mạch ≤100 mL/giờ hoặc ngừng truyền nếu bệnh nhân có thể ăn được.
- Cần lưu ý rằng có thể cần phải tiếp tục truyền dịch tĩnh mạch đến khi nồng độ creatinin máu trở lại mức nền của bệnh nhân.
Các vấn đề cần giải quyết
- Bệnh nhân bị DKA tái phát phải được lập tức tìm hiểu thêm vấn đề tiền sử và bệnh sử để tìm kiếm các nguyên nhân thúc đẩy tình trạng này. Bơm tiêm insulin bị trục trặc, bệnh nhân không tuân thủ liều insulin, có các vấn đề khúc mắc xã hội, do thuốc hoặc bị các bệnh đồng mắc. Những vấn đề này phải được một nhân viên chăm sóc y tế có kinh nghiệm về bệnh đái tháo đường thực hiện.
- Bệnh nhân mới được chẩn đoán ĐTĐ cần có thêm thời gian trong bệnh viện để được giáo dục về phác đồ insulin và các kiến thức về bệnh đái tháo đường.
- Nhiễm toan xêtôn do đái tháo đường (DKA) liên quan với chức năng nhận thức kém hơn, đặc biệt là ở trẻ em [23,24].
- DKA tái phát có liên quan với gia tăng tỷ lệ tử vong, nhất là ở bệnh nhân trẻ tuổi được kiểm soát đường máu kém và có những thách thức tâm lý xã hội [25].
4.2 Các biến chứng mạn tính
Chăm sóc bệnh nhân bị ĐTĐ typ 1 bao gồm sàng lọc các biến chứng vi mạch và mạch máu lớn, áp dụng các phác đồ điều trị đã được chứng minh để giảm tỷ lệ mắc bệnh và tử vong.
Kiểm soát chặt đường máu giúp ngăn ngừa các bệnh mạch máu lớn, như đã được xác nhận qua nghiên cứu DCCT và nghiên cứu dịch tễ học đối với các can thiệp và biến chứng của đái tháo đường [11,12,13).
Duy trì kiểm soát chặt đường máu ở bệnh nhân đái tháo đường typ 1 mang lại lợi ích phòng ngừa nguyên phát và thứ phát các biến chứng vi mạch, điều này đã được chứng minh qua nghiên cứu DCCT [11].
Can thiệp được nghiên cứu tốt nhất đối với ĐTĐ typ 1 là sử dụng thuốc ức chế men chuyển angiotensin (ACEIs) để ngăn chặn tiến triển của microalbumin niệu thành macroalbumin niệu và làm chậm tiến triển của bệnh thận do đái tháo đường [26].
- Cần bắt đầu cho dùng thuốc ức chế men chuyển angiotensin (ACEIs) nếu huyết áp tăng cao hơn giới hạn bình thường đối với độ tuổi của bệnh nhân hoặc thậm chí ở mức huyết áp mục tiêu hoặc thấp hơn mức huyết áp mục tiêu (130/80 mmHg) khi phát hiện thấy bệnh nhân có microalbumin niệu tiếp diễn dai dẳng [10].
- Cần tránh dùng ACEIs ở phụ nữ trước tuổi mãn kinh, những đối tượng không sử dụng các biện pháp tránh thai hiệu quả hoặc đang có kế hoạch mang thai hoặc phụ nữ đang mang thai do nguy cơ gây dị tật bẩm sinh.
Kiểm soát huyết áp, lipid và các biện pháp dự phòng khác được đề cập trong các Chương 28 và Chương 30, các biện pháp tiếp cận cũng tương tự như đối với bệnh nhân đái tháo đường typ 2.
Tư vấn trước khi mang thai là bắt buộc đối với các phụ nữ trẻ bị đái tháo đường typ 1, kiểm soát rất chặt đường máu cùng với việc làm gần bình thường hóa nồng độ đường máu được khuyến cáo trước khi thụ thai và trong khi mang thai để có được một kết quả điều trị tối ưu mę và thai nhi.
5 TÀI LIỆU THAM KHẢO
1. Patterson CC, Dahlquist GG, Gyurus E, Green A, Soltész G. Incidence trends for childhood type 1 diabetes in Europe during 1989-2003 and predicted new cases 2005-20: A multicentre prospective registration study. Lancet 2009; 373 (9680):2027–2033.
2. Dabelea D, Mayer-Davis EJ, Say- dah S, et al. Prevalence of type 1
2 diabetes among children and type 2 diabetes and adolescents from 2001 to 2009. JAMA 2014; 311 (17):1778-1786.
3. Roep BO, Peakman M. Antigen targets of type 1 diabetes autoim- munity. Cold Spring Harb Perspect Med 2012;2(4):a007781.
4. Concannon P, Rich SS, Nepom GT. Genetics of type 1A diabetes. N Engl J Med 2009;360(16):1646- 1654.
5. Triolo TM, Armstrong TK, McFann K, et al. Additional autoimmune disease found in 33% of patients at type 1 diabetes onset. Diabetes Care 2011;34(5):1211–1213.
6. Hughes JW, Riddlesworth TD, DiMeglio LA, Miller KM, Rick- els MR, McGill JB. Autoimmune diseases in children and adults with type 1 diabetes from the TID Exchange Clinic Registry. J Clin Endocrinol Metab 2016; 101(12):4931-4937.
7. Cooper JD, Smyth DJ, Smiles AM, et al. Meta-analysis of ge- nome-wide association study data identifies additional type 1 diabe- tes risk loci. Nat Genet 2008; 40 (12):1399-1401.
8. Brownlee M. Biochemistry and molecular cell biology of diabetic complications. Nature 2001; 414 (6865): 813-820.
9. Sheetz MJ, King GL. Molecular understanding of Tăng nồng độ đường máu’s adverse effects for di abetic complications. JAMA 2002; 288(20): 2579-2588.
10. American Diabetes Association. Classification and diagnosis of diabetes: Standards of medical care in diabetes-2018. Diabetes Care 2018;41(Suppl 1): S13-S27.
11. Nathan DM; DCCT/EDIC Re- search Group. The diabetes control and complications trial/ epidemiology of diabetes inter- ventions and complications study at 30 years: Overview. Diabetes Care 2014;37(1):9–16.
12. White NH, Sun W, Cleary PA, et al. Prolonged effect of intensive therapy on the risk of retinopathy complications in patients with type 1 diabetes mellitus: 10 years after the Diabetes Control and Complica- tions Trial. Arch Ophthalmol 2008; 126 (12): 1707-1715.
13. Writing Team for the Diabetes Control and Complications Trial/ Epidemiology of Diabetes Interven- tions and Complications Research Group. Sustained effect of intensive điều trị of type 1 diabetes mellitus on development and progression of diabetic nephropathy: The Epide- miology of Diabetes Interventions and Complications (EDIC) study. JAMA 2003; 290(16):2159–2167.
14. Albers JW, Herman WH, Pop-Bu- sui R, et al. Effect of prior intensive insulin điều trị. during the Diabetes Control and Complications Trial (DCCT) on peripheral neuropa- thy in type 1 diabetes during the Epidemiology of Diabetes Inter- ventions and Complications (EDIC) Study. Diabetes Care 2010; 33 (5):1090-1096.
15. Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group, Bode B, Beck RW, Xing D, et al. Sustained benefit of continuous glucose monitoring on HbA1c, glucose pro- files, and hypoglycemia in adults with type 1 diabetes. Diabetes Care 2009;32(11):2047–2049.
16. Weisman A, Bai JW, Cardinez M, Kramer CK, Perkins BA. Effect of artificial pancreas systems on gly- caemic control in patients with type 1 diabetes: A systematic review and meta-analysis of outpatient randomized controlled trials. Lan- cet Diabetes Endocrinol 2017; 5 (7):501–512.
17. Edelman S, Garg S, Frias J, et al. A double-blind, placebo-controlled trial assessing pramlintide điều trị in the setting of intensive insulin therapy in type 1 diabetes. Diabetes Care 2006;29(10):189–195.
18. Ryan G, Briscoe TA, Jobe L. Re- view of pramlintide as adjunctive therapy in điều trị of type 1 and type 2 diabetes. Drug Des Devel Ther 2009;2:203-214.
19. Fayfman M, Pasquel FJ, Umpierrez GE. Management of hyperglycemic crises. Med Clin North America 2016; 101 (3):587–606.
20. Joint British Diabetes Societies Inpatient Care Group. The man- agement of diabetic ketoacidosis in adults. Second edition, update 2013. Retrieved February 6, 2018, from http://www.diabetologists-ab- cd.org.uk/JBDS/JBDS_IP_DKA_ Adults.pdf.
21. Naunheim R, Jang TJ, Banet G, Richmond A, McGill J. Point-of- care test identifies diabetic ke- toacidosis at triage. Acad Emerg Med 2006;13(6):683–685.
22. Kitabchi AE, Umpierrez GE, Murphy MB, et al; American Diabetes Association. Hypergly- cemic crises in diabetes. Diabetes Care 2004;27(Suppl 1):S94-S102.
23. Semenkovich K, Bischoff A, Doty T, et al. Clinical presentation and memory function in youth with type 1 diabetes. Pediatr Diab 2016;17(7):492–499.
24. Cato MA, Mauras N, Mazaika P, et al. Longitudinal evaluation of cognitive functioning in young children with type 1 diabetes over 18 months. J Int Neuropsychol Soc 2016;22(3):293–302.
25. Gibb FW, Teoh WL, Graham J, Lockman KA. Risk of death fol- lowing admission to UK hospital with diabetic ketoacidosis. Diabeto- logia 2016; 59 (10): 2082–2087.
26. Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. For the Collaborative Study Group. The effect of angio- tensin-converting enzyme inhibi- tion on diabetic nephropathy. The Collaborative Study Group. N Engl J Med 1993;329(20):1456–1462.
Phần nghiên cứu sau đây do Ban Biên tập nội dung Dược sĩ Hoàng Bích của Central Pharmacy biên soạn thêm, không nằm trong phần bài của tác giả Thomas J.Braranski và các cộng sự.
6 So sánh tiểu đường type 1 và type 2
6.1 Điểm giống nhau
Tình trạng đường huyết: Đều gây tăng đường huyết mạn tính.
Triệu chứng ban đầu: Uống nhiều, tiểu nhiều, ăn nhiều, gầy nhiều.
Biến chứng lâu dài: Cùng có nguy cơ biến chứng mạch máu lớn (tim mạch) và nhỏ (võng mạc, thận, thần kinh).
6.2 Điểm khác nhau
| Tiêu chí | Tiểu đường type 1 | Tiểu đường type 2 |
| Nguyên nhân chính | Bệnh tự miễn phá hủy tế bào beta tụy dẫn đến không sản xuất insulin. | Kháng insulin và/hoặc giảm tiết insulin do lối sống, di truyền. |
| Di truyền | Có yếu tố di truyền nhưng yếu tố tự miễn là chính. | Yếu tố di truyền đóng vai trò quan trọng, thường xảy ra ở người lớn tuổi. |
| Đối tượng thường gặp | Trẻ em, thanh thiếu niên (nhưng cũng có thể xảy ra ở người lớn). | Người lớn tuổi, béo phì, ít vận động. |
| Khởi phát bệnh | Đột ngột, rầm rộ. | Từ từ, âm thầm, có thể không triệu chứng rõ. |
| Cần insulin ngay từ đầu? | Có. Bắt buộc dùng insulin suốt đời. | Không bắt buộc. Ban đầu có thể kiểm soát bằng thuốc uống và lối sống. |
| Nồng độ C-peptid | Thường thấp hoặc không đo được. | Thường bình thường hoặc tăng. |
| Kháng thể tự miễn (GAD65, IA-2...) | Có. Dùng để chẩn đoán phân biệt. | Không có. |
| Liên quan bệnh tự miễn khác | Phổ biến (viêm tuyến giáp Hashimoto, bệnh Addison…) | Hiếm. |
| Thể trạng người bệnh | Thường gầy hoặc cân nặng bình thường. | Thường thừa cân, béo phì. |
| Vai trò của tập thể dục | Tập thể dục giúp cải thiện điều kiện cơ xương và kiểm soát đường huyết, nhưng cần chú ý đến tình trạng hạ đường huyết. | Tập thể dục là công cụ hiệu quả để giảm kháng insulin và cải thiện hồ sơ chuyển hóa27. |
6.3 Cập nhật nghiên cứu so sánh gần đây năm 2024
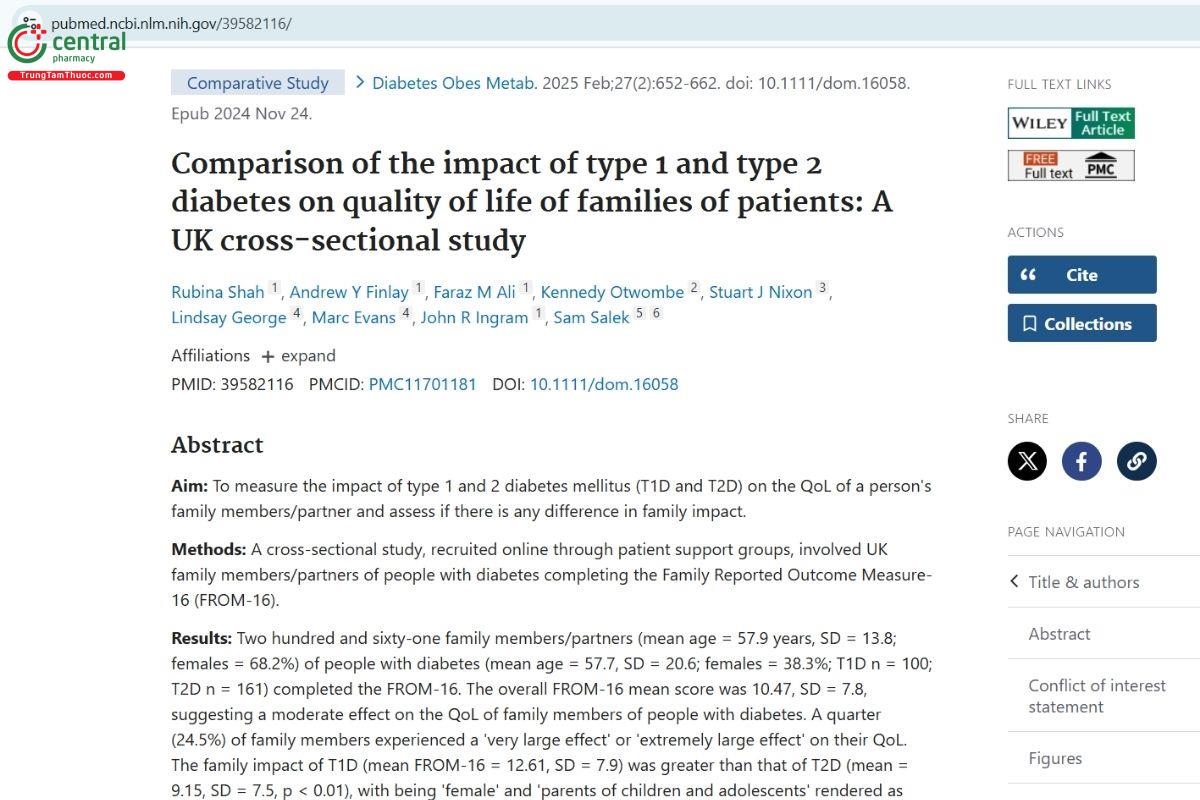
Tên: So sánh tác động của bệnh tiểu đường loại 1 và loại 2 đối với chất lượng cuộc sống của gia đình bệnh nhân: Một nghiên cứu cắt ngang tại Vương quốc Anh.
Phương pháp:
- Nghiên cứu là một nghiên cứu cắt ngang, được thực hiện qua tuyển dụng trực tuyến các thành viên gia đình hoặc bạn đời của những người mắc bệnh tiểu đường, thông qua các nhóm hỗ trợ bệnh nhân ở Anh. Các thành viên tham gia đã điền vào Đo lường kết quả do gia đình báo cáo-16 (FROM-16) để đo lường tác động đối với chất lượng cuộc sống của họ.
Kết quả:
- Số lượng người tham gia: 261 thành viên gia đình/bạn đời của người mắc tiểu đường (100 người với T1D và 161 người với T2D) tham gia nghiên cứu.
- Điểm trung bình FROM-16: Điểm trung bình từ bảng hỏi FROM-16 là 10,47, cho thấy tác động vừa phải đến chất lượng cuộc sống của các thành viên gia đình.
- Tác động lớn hơn của T1D: Các thành viên gia đình của người mắc T1D có mức độ tác động lớn hơn đến chất lượng cuộc sống (trung bình FROM-16 = 12,61) so với T2D (trung bình = 9,15), và sự khác biệt này có ý nghĩa thống kê (p < 0,01).
- Yếu tố dự báo tác động lớn hơn: Các yếu tố như là nữ giới và cha mẹ của trẻ em và thanh thiếu niên được xác định là những yếu tố quan trọng dẫn đến tác động lớn hơn đối với chất lượng cuộc sống của họ.
Kết luận:
- Bài báo cáo cho thấy rằng các thành viên gia đình của người mắc bệnh tiểu đường loại 1 (T1D) chịu ảnh hưởng lớn hơn đến chất lượng cuộc sống của họ so với những người có người thân mắc bệnh tiểu đường loại 2 (T2D).
- Việc đánh giá tác động đối với gia đình và bạn đời của bệnh nhân tiểu đường là rất quan trọng trong công tác chăm sóc bệnh nhân.28
7 Tài liệu tham khảo
27. Krause M, De Vito G, (Ngày đăng: Ngày 7 tháng 10 năm 2023). Type 1 and Type 2 Diabetes Mellitus: Commonalities, Differences and the Importance of Exercise and Nutrition. NIH. Truy cập ngày 12 tháng 4 năm 2025.
28. Shah R, Finlay AY, Ali FM, Otwombe K, Nixon SJ, George L, Evans M, Ingram JR, Salek S, (Ngày đăng: Tháng 2 năm 2025). Comparison of the impact of type 1 and type 2 diabetes on quality of life of families of patients: A UK cross-sectional study. NIH. Truy cập ngày 12 tháng 4 năm 2025.

