Những điều cần biết về bệnh lý u tủy thượng thận và u cận hạch
Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn.
1 NGUYÊN LÝ CHUNG
Mặc dù u tủy thượng thận và u ngoài thượng thận (u cận hạch) có biểu hiện tương tự nhau song về bản chất chúng vẫn có sự khác biệt như mức độ ác tính và các hội chứng bệnh lý di truyền khác nhau đi kèm.
Thuật ngữ pheochromocytoma (u tủy thượng thận) có nguồn gốc từ tiếng Hy lạp với Phaios có nghĩa là ”tối mờ” và chrono có nghĩa là “màu”. Thuật ngữ này lần đầu tiên được Frankel mô tả, tác giả đã phát hiện ra u thượng thận hai bên khi giải phẫu tử thi một phụ nữ 18 tuổi năm 1886.
Các bằng chứng mới gợi ý là khoảng 40% bệnh nhân bị u tủy thượng thận/u cận hạch có đột biến dòng tế bào mầm và 10 - 15% có di căn [1]. Tất cả các bệnh nhân này cần được xem xét làm xét nghiệm sàng lọc di truyền [2].
==> Bạn đọc có thể xem thêm: Nguyên nhân, triệu chứng và điều trị cường aldosteron tiên phát
1.1 Định nghĩa
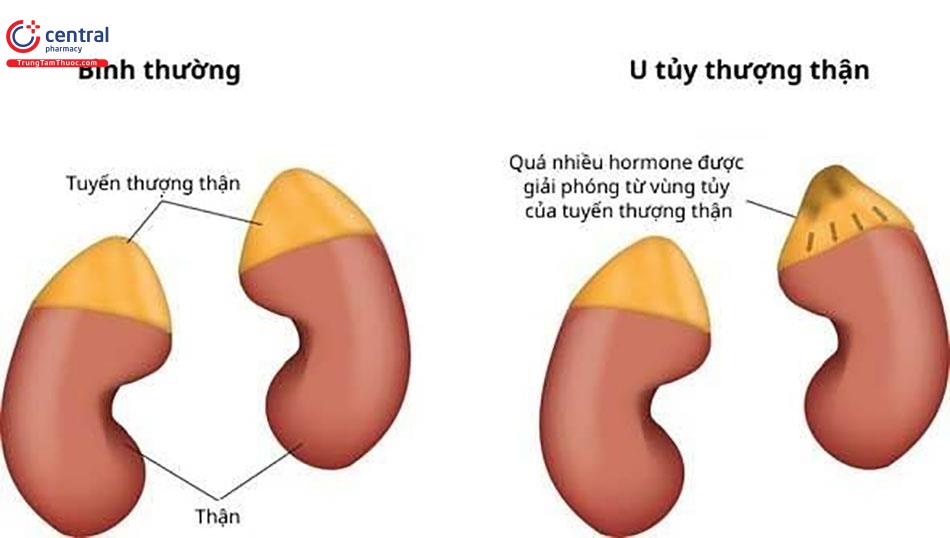
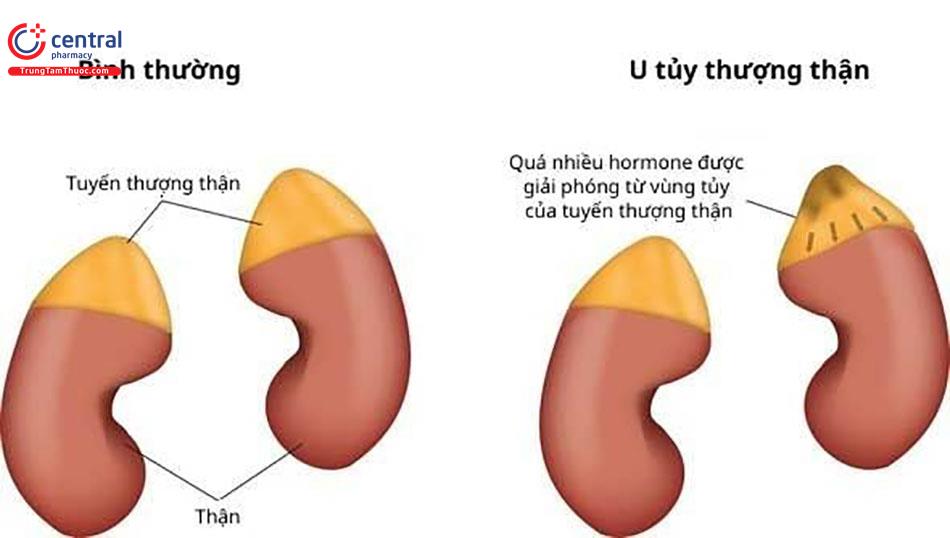
U tủy thượng thận là các khối u thần kinh-nội tiết phát sinh từ các tế bào ưa chrom sản xuất catecholamin của tủy thượng thận.
1.2 Các khối u phát sinh từ tổ chức ưa chrom ngoài thượng thận (các hạch giao cảm hoặc phó giao cảm) được gọi là các u cận hạch thượng thận [3].
1.3 Phân loại
U tủy thượng thận thường gặp hơn u cận hạch với các u ngoài thượng thận chỉ chiếm 15 - 20% các trường hợp [1].
Các u thượng thận thường lành tính, chế tiết cả adrenalin và noradrenalin trong ít nhất một nửa các trường hợp. Các u cận hạch ngoài thượng thận có thể có nguồn gốc từ hạch giao cảm hoặc phó giao cảm. Các u cận hạch giao cảm rất thường chế tiết các catecholamin. Các u này có khu trú trong lồng ngực, bụng và khung chậu, thường ở vùng nối giữa tĩnh mạch chủ dưới và tĩnh mạch thận trái hoặc tại thể Zuckerkandl cạnh động mạch chủ. Các u cận hạch phó giao cảm thường được tìm thấy ở nền sọ và cổ gần động mạch cảnh, hầu hết không có hoạt động chế tiết 4,5].
Các khối u cũng có thể được phân loại như là u có tính tản phát (đơn độc, một bên và trong thượng thận) hoặc có tính gia đình (cũng thường ở trong tuyến thượng thận song thường nhiều khối và ở cả hai bên).
Dịch tễ học
Tỷ lệ lưu hành của u tủy thượng thận ở bệnh nhân bị tăng huyết áp là 0,1 -0,6% [6].
Khoảng 5% các u thượng thận phát hiện tình cờ không có triệu chứng có kích thước > 1 cm là u tủy thượng thận [7].
Hầu hết u tủy thượng thận mang tính tản phát, song có tới 40% trường hợp có các đột biến gây tăng nhạy cảm với dòng tế bào mầm [1].
Tỷ lệ lưu hành của u tủy thượng thận vào khoảng 40% trong u tân sinh đa tuyến nội tiết MEN 2A, 10% trong Von Hippel-Lindau (VHL) và 5% trong bệnh u xơ thần kinh typ 1 ( NF1) [8].
Tỷ lệ bị di căn dao động trong khoảng 2 - 13% trong u tủy thượng thận và 2 - 50% đối với u cận hạch [9].
1.4 Bệnh căn
U tủy thượng thận có thể xảy ra trong hội chứng di truyền đột biến gen trội nhiễm sắc thể thường với 40% các ca bệnh có nền tảng đột biến di truyền [10].
Các đột biến dòng tế bào mầm ở nhiều gen khác nhau chịu trách nhiệm gây u tủy thượng thận có tính gia đình: RET proto-oncogene trong MEN2 và gen ức chế khối u VHL (tumor suppressor genes VHL) trong hội chứng von Hippel—Lindau và NF1 trong u xơ thần kinh. Các gen mã hóa các tiểu đơn vị A, B, C, D của succinate dehydrogenase trong ty lạp thể (SDHA, SDHB, SDHC, SDHD) và gen tham gia vào quá trình flavin hóa của SDHA (SDHAF2) được cho là có vai trò trong u tủy thượng thận và u tế bào cận hạch thần kinh có tính gia đình không thuộc các hội chứng nội tiết (familial nonsyndromic paragangliomas) [11,12].
Gần đây hơn, đột biến tế bào dòng mầm FP/TMEM12, đột biến gen ức chế u MAX và đột biến gen mã hóa enzym isocitrate dehydrogenase được cho là có liên quan với u tủy thượng thận và u cận hạch [13].
1.5 Sinh lý bệnh
Monoamin oxidase (MAO) sẽ chuyển hóa trong các sợi thần kinh hầu hết norepinephrin sản xuất và giải phóng bởi các sợi thần kinh giao cảm thành dihydroxyphenylglycol (DHPG).
Acid vanillylmandelic (VMA), một sản phẩm tận quan trọng của chuyển hóa noradrenalin và adrenalin. VMA gần như được gan sản xuất chỉ từ quá trình chuyển hóa các catecholamin và các chất chuyển hóa lưu hành trong tuần hoàn của chúng. Hầu hết VMA có nguồn gốc từ DHPG và 3-methoxy- 4-hydroxyphenylglycol (MHPG) trong tuần hoàn mà phần lớn MHPG có nguồn gốc từ chuyển hóa norepinephrine tại các nơron thần kinh, điều này giải thích tại sao VMA là một chỉ dấu tương đối kém nhạy đối với u tủy thượng thận.
Khoảng 90% metanephrin và tới 40% normetanephrin được hình thành từ quá trình chuyển hóa epinephrin và norepinephrin trong thượng thận trước khi được giải phóng vào tuần hoàn, khiến nó trở thành nguồn lớn duy nhất trong cơ thể [14].
Trên 94% các trường hợp tăng normetanephrin và metanephrin huyết tương có nguồn gốc từ chuyển hóa của catecholamin bởi enzym catechol-0-methyltransferase (COMT) trong các tế bào khối u độc lập với sự phóng thích catecholamin, điều này ủng hộ cho việc chỉ định xét nghiệm định lượng metanephrin và normetanephrin trong chẩn đoán u tủy thượng thận [15].
2 CHẨN ĐOÁN
2.1 Biểu hiện lâm sàng
2.1.1 Khai thác tiền sử bệnh
Bệnh nhân bị u tủy thượng thận thường có các cơn kịch phát đặc trưng do tình trạng giải phóng catecholamin gây nên.
Tam chứng điển hình bao gồm cơn đau đầu (60 - 90%), vã mồ hôi (55 - 75%) và trống ngực (50 - 70%) [6].
Tăng huyết áp là biểu hiện thường gặp nhất, xảy ra ở tới 90% các bệnh nhân và cơn tăng huyết áp kịch phát ở 30% [6].
Các triệu chứng ít gặp hơn khác bao gồm tình trạng xanh nhợt trong cơn (40 - 45%), buồn nôn (20 - 40%), mệt (25 - 40%), các cơn hoảng sợ (20 - 40%), sút cân (20 – 40%), tăng đường máu (40%) và tụt huyết áp tư thế (10 - 50%) [6].
Bệnh nhân bị u tủy thượng thận cũng có thể hoàn toàn không có triệu chứng. Các nghiên cứu loạt bệnh hồi cứu từ các trung tâm lớn cho biết, bệnh được phát hiện tình cờ trên hình ảnh học ở 10 - 58% trường hợp [16-18]. Vì vậy, chẩn đoán u tủy thượng thận đòi hỏi cần đặt nghi ngờ cao, nhất là đối với các bệnh nhân có một hoặc nhiều dấu hiệu sau:
- Tăng huyết áp không đáp ứng với điều trị thường quy và/hoặc khởi phát tăng huyết áp trước 20 tuổi.
- Các cơn trống ngực không do gắng sức, các cơn vã mồ hôi, đau đầu hoặc run chân tay.
- Hội chứng có tính gia đình (ví dụ, MEN 2, NF1, VHL) hoặc tiền sử gia đình bị u tủy thượng thận.
- Khối u thượng thận phát hiện tình cờ với các đặc trưng hình ảnh học phù hợp với u tủy thượng thận (tăng bắt thuốc rõ rệt trên phim CT có tiêm thuốc cản quang hoặc có tăng tín hiệu trên hình ảnh T2W của MRI).
- Cơn tăng huyết áp phản ứng trong khi gây mê hoặc mổ.
- Bệnh cơ tim giãn vô căn.
- Tiền sử có khối u mô đệm đường tiêu hóa hoặc u sụn lành tính của phổi (tam chứng Cerney).
Các cơn kịch phát đi kèm với u tủy thượng thận có thể bị khởi phát khi có tình trạng xê dịch các thành phần trong ổ bụng (ví dụ, nâng các tạng trong khi mổ hoặc sờ nắn khi khám). Trường hợp điển hình, các cơn kịch phát này kéo dài 30 - 40 phút và xảy ra 1 - 2 ngày/lần. Các cơn kịch phát có xu hướng gia tăng về tần suất và mức độ nặng theo thời gian. Huyết áp có thể tăng rất cao trong cơn.
Một số nhóm thuốc có thể thúc đẩy cơn tăng huyết áp kịch phát trong bệnh cảnh bệnh nhân có u tủy thượng thận: thuốc đối kháng dopamin (D,), thuốc gây ức chế thụ thể B-adrenergic, thuốc giống giao cảm, thuốc giảm đau nhóm opioid, thuốc chống trầm cảm ba vòng, thuốc ức chế tái hấp thu serotonin chọn lọc, thuốc ức chế MAO, corticosteroid, ACTH, glucagon và thuốc gây ức chế thần kinh-cơ. Nên tránh dùng các thuốc này cho tới khi đã loại trừ hoặc cắt bỏ được u tủy thượng thận hoặc bệnh nhân đã được kiểm soát thuốc trước đối kháng a-adrenergic [2].
2.1.2 Khám thực thể.
Tăng huyết áp là dấu hiệu khám thực thể thường gặp nhất trong u tủy thượng thận. Tình trạng tăng huyết áp thường nặng, không đáp ứng với điều trị thường quy và đi kèm với các dấu hiệu thực thể của tổn thương cơ quan đích như protein niệu hoặc bệnh lý võng mạc, tuy nhiên nó cũng có thể giống như trường hợp tăng huyết áp vô căn khi bệnh nhân không có biểu hiện các cơn kịch phát.
Các biểu hiện hiếm gặp bao gồm tụt huyết áp thành từng đợt (khi khối u chỉ tiết epinephrin) hoặc các dao động huyết áp nhanh theo chu kỳ.
2.2 Tiêu chuẩn chẩn đoán
Chẩn đoán xác định u tủy thượng thận được dựa trên các xét nghiệm sinh hóa, tiếp theo bằng thăm dò hình ảnh học giải phẫu và chức năng để xác định vị trí khối u.
2.3 Chẩn đoán phân biệt [6]
Nội tiết: cường giáp, hội chứng carcinoid, hạ đường máu, carcinoma tuyến giáp thể tủy, tăng tế bào mastocyt hay hội chứng tăng hoạt tế bào mastocyt, các triệu chứng mãn kinh.
Tim mạch: suy tim, loạn nhịp tim, bệnh tim thiếu máu cục bộ, suy giảm phản xạ nhận cảm áp lực (baroreflex).
Thần kinh: chứng đau nửa đầu, đột quỵ, u màng não, hội chứng nhịp tim nhanh hạ huyết áp tư thế (POTS).
Các căn nguyên khác: bệnh porphyria, rối loạn hoảng sợ hoặc rối loạn lo âu, sử dụng các thuốc giống giao cảm, thuốc ức chế MAO, ngừng thuốc clonidin, dùng thuốc bất hợp pháp (ví dụ, cocain).
2.4 Chẩn đoán cận lâm sàng
Có hai bước chính để chẩn đoán u tủy thượng thận: (a) Khẳng định sinh hóa, tiếp sau đó (b) Định vị giải phẫu khối u.
2.4.1 Cận lâm sàng
.jpg)
Chẩn đoán u tủy thượng thận đòi hỏi phải có bằng chứng sinh hoá về tình trạng tăng sản xuất catecholamin quá mức từ khối u, điều này được xác nhận bằng cách định lượng nồng độ catecholamin và một số chất chuyển hoá của catecholamin trong máu và nước tiểu (Bảng 16.1) [19-21].
Do các hậu quả tiềm ẩn nguy cơ gây tử vong khi bỏ sót chẩn đoán nên cần làm các test cận lâm sàng có độ nhạy cao. Nồng độ metanephrin tự do trong huyết tương và metanephrin phân đoạn trong nước tiểu đã được chứng minh là các xét nghiệm có độ nhạy cao nhất trong chẩn đoán u tủy thượng thận và được khuyến cáo như là các xét nghiệm khởi đầu [2,3].
Các yếu tố nhiễu từ thức ăn, thuốc, hay điều kiện lấy mẫu không chuẩn có thể làm nhiễu kết quả xét nghiệm sinh hoá (Bảng 16.2) [6]. Có thể tránh bị các yếu tố gây nhiễu này bằng cách yêu cầu bệnh nhân nhịn ăn, không được sử dụng các đồ uống chứa caffein qua đêm để sáng hôm sau lấy máu xét nghiệm. Nên đặt bệnh nhân ở tư thế nằm ít nhất 30 phút trước khi lấy mẫu để tránh gây ra các kết quả dương tính giả [22].
Các thuốc chống trầm cảm ba vòng và phenoxybenzamin là các nguyên nhân chính gây kết quả dương tính giả khi xét nghiệm normetanephrin và norepinephrin trong huyết tương và nước tiểu (xem Bảng 16.2) [23].
Định lượng nồng độ metanephrin phân đoạn bằng kỹ thuật sắc ký lỏng với đo khối phổ hoặc bằng phương pháp điện hóa (electrochemical detection methods) được ưu tiên áp dụng hơn so với kỹ thuật miễn dịch enzym [2].
Độ nhạy cao của các xét nghiệm sinh hoá này đồng nghĩa là, khi kết quả các xét nghiệm âm tính về cơ bản sẽ loại trừ tình trạng u tủy thượng thận, tuy nhiên một test dương tính không luôn chỉ dẫn tin cậy là có bệnh. Hầu hết các kết quả dương tính thật có thể được phân biệt với kết quả dương tính giả bằng biên độ tăng và mức độ tăng trong kết quả của test trên giới hạn tham chiếu. Các thông số sinh hoá thường tăng hơn gấp 2 - 3 lần so với giới hạn bình thường cao khi có u tủy thượng thận.
Các kết quả test dương tính song không cao hơn 2 - 3 lần giới hạn bình thường cao được đánh giá kết hợp với nhận định lâm sàng, dựa trên xác suất của các pre-test về khả năng có bệnh [23].
Trước khi tiến hành thăm dò thêm, cần xem xét cẩn thận về một loạt các nguyên nhân khác gây kết quả dương tính giả do dùng thuốc hay các yếu tố khác gây nên.
Nghiệm pháp ức chế bằng Clonidin có thể hữu ích khi có tăng nồng
độ catecholamin huyết tương song chưa đạt đủ ngưỡng chẩn đoán. Trong một nghiên cứu ca bệnh, khi sử dụng tiêu chuẩn có tình trạng tăng bền bỉ nồng độ normetanephrin và mất ức chế normetanephrin trên >40% sau khi dùng clonidin cho độ nhạy cao nhất (96%) và đặc hiệu 100% [23].
Cũng có thể thể sử dụng việc định lượng kết hợp chromogranin A với metanephrin phân đoạn trong nước tiểu như một xét nghiệm theo dõi tình trạng tăng nồng độ metanephrin trong huyết tương [24].
| Bảng 16.1. Đặc điểm các xét nghiệm sinh hoá trong chẩn đoán phân biệt pheochromocytoma | ||
| Xét nghiệm | Độ nhạy (%) | Độ đặc hiệu (%) |
| Các nghiên cứu loạt bệnh của NIH | ||
| Máu | ||
| Metanephrin tự do | 99 | 89 |
| Catecholamin | 84 | 81 |
| Nước tiểu 24 giờ | ||
| Catecholamin | 97 | 69 |
| Metanephrin toàn phần | 77 | 93 |
| Catecholamin | 86 | 88 |
| Vanillylmandelic acid | 64 | 95 |
| Nghiên cứu loạt bệnh của Mayo [20] | ||
| Metanephrin tự do máu | ||
| Metanephrin và catecholamin niệu 24 giờ | ||
| Perry và Cộng sự [21]. | ||
| Metanephrin và catecholamin niệu 24 giờ | ||
| Bảng 16.2. Các yếu tố ảnh hưởng đến xét nghiệm sinh hoá [2] | |||
| Kích thích tiết catecholamin nội sinh | Catecholamin ngoại sinh | Thuốc ảnh hưởng chuyển hoá catecholamin | Thuốc ảnh hưởng kết quả xét nghiệm |
Stress tâm lý và thực thể (phẫu thuật, chấn thương) Cai thuốc (alcohol, clonidine) Do thuốc (giãn mach, caffein, nicotin, theophyllin, ephedrin, amphetamin) Hạ đường máu Thiếu máu cơ tim Đột quỵ | Thuốc giãn PQ Thuốc ức chế cảm giác thèm ăn Thuốc chống nghẹt mũi | Thuốc chẹn B (làm tăng giả tạo catecholamin và metanephrin niệu) Phenoxybenzamin (tăng giả tạo norepinephrin và normetanephrin máu và nước tiểu) Thuốc chống trầm cảm 3 vòng (làm tăng giả tạo norepinephrin và normeta- nephrin máu và niệu) Levodopa Theophyllin Ức chế MAO | Labetalol, sotalol(a) Acetaminophen(b) Clofibrate Quinidine |
(a) Chỉ ảnh hưởng khi làm xét nghiệm spectrophotometric với metanephrin; catecholamin được đo bằng HPLC và metanephrin bằng mass speckhông bị ảnh hưởng. (b) Metanephrin tự do trong máu đo bằng HPLC không bị ảnh hưởng. Các thuốc lợi tiểu, ức chế ACE và SSRIs thường không ảnh hưởng tới kết quả xét nghiệm. Lenders JW, Duh QY, Eisenhofer G, et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014;99(6):1915-1942. | |||
2.4.2 Điện tâm đồ
Các dấu hiệu dày thất trái có thể gặp trên điện tim do có tăng huyết áp tiếp diễn.
2.4.3 Hình ảnh học
Chi nên bắt đầu tiến hành các đánh giá hình ảnh học sau khi đã khẳng định về phương diện hóa sinh có tăng quá mức catecholamin. Tuy nhiên, trong các tình huống khi xác suất làm pre-test cho khả năng bị bệnh cao, thậm chỉ cả khi các bằng chứng sinh hoá kém thuyết phục hoặc khi các u cận hạch bị nghi ngờ là thuộc loại không chế tiết (ví dụ, các paraganglioma ở nền sọ hay ở cổ, paragangliomas ở các bệnh nhân có đột biến SDHx), các thăm dò hình ảnh được khuyến cáo [2].
Do 95% trường hợp u tủy thượng thận nằm trong ổ bụng nên chụp CT hoặc MRI ổ bụng thường được thực hiện đầu tiên.
Hướng dẫn mới nhất của Hội Nội tiết Hoa Kỳ khuyến cáo nên thực hiện chụp CT có tiêm thuốc cản quang khi tiến hành các đánh giá hình ảnh học bước một do kỹ thuật có độ phân giải không gian (spartial resolution) tốt đối với lồng ngực, bụng và khung chậu [2].
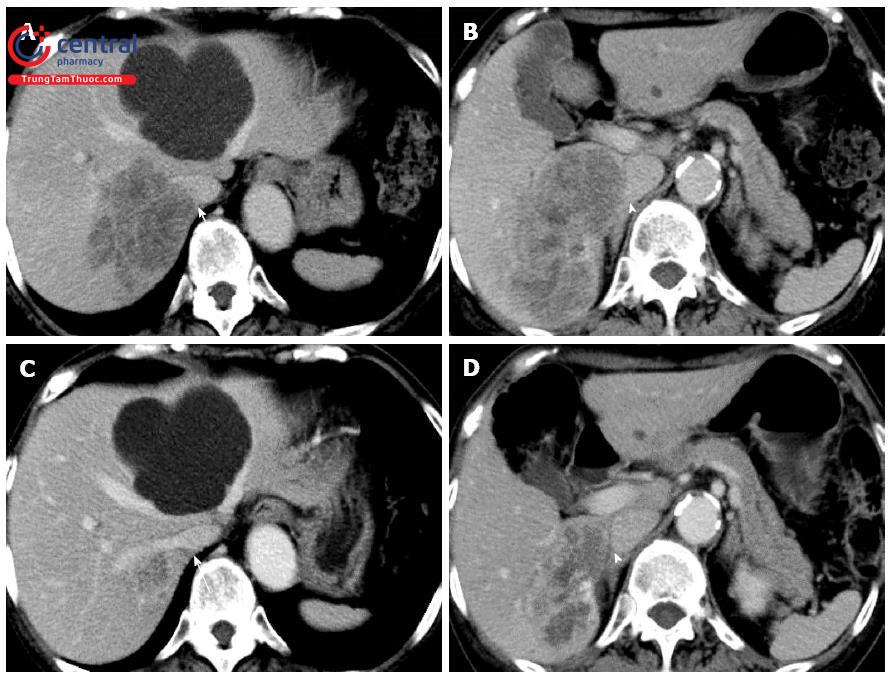
Chụp CT có độ nhạy cao lên tới 85 - 94% trong phát hiện u tủy thượng thận (90% đối với các u ngoài thượng thận, di căn hay u tủy thượng thận tái phát) nhưng độ đặc hiệu chỉ 29 - 50%. So với chụp CT không tiêm thuốc, chụp CT có tiêm cản quang và với các tổn thương thượng thận có ngấm thuốc chậm sẽ tăng độ nhạy lên 98% và độ đặc hiệu lên 92% [25].
Các u tuỷ thượng thận thường có biểu hiện trên thăm dò hình ảnh học dưới dạng các khối tròn hay bầu dục, ranh giới rõ, thường có đường kính trên 3 cm với kết cấu không đồng nhất và có các vùng nang. Tỷ trọng u khi chụp CT chưa tiêm thuốc thường trên 10 đơn vị Hounsfield (HU) và thải thuốc cản quang dưới 50% ở phút thứ 10 do có thành phần lipid thấp (tuy nhiên 30% u tủy thượng thận có thải thuốc trên 50%) [26].
Nếu kết quả chụp cắt lớp vi tính âm tính ở bệnh nhân có xét nghiệm sinh hoá dương tính với u tủy thượng thận nên sử dụng kỹ thuật chụp dịch chuyển hoá học MRI để phân biệt các khối trong thượng thận dựa trên có hay không lipid tương tự như khi chụp CT. Tăng sinh mạch của u tủy thượng thận làm cho khối u có vẻ sáng ra một cách đặc trưng hơn, với tăng tín hiệu trên xung T2 và không mất tín hiệu trên hành ảnh của pha tương phản. Sử dụng các kỹ thuật khác nhau để đánh giá tỷ trọng tín hiệu, kỹ thuật MRI có thể đạt độ nhạy lên tới 81 - 83% và độ đặc hiệu 88 - 93%. [27,28]. Chụp MRI được ưu tiên hơn CT ở các nhóm bệnh nhân bị bệnh di căn, u cận hạch ngoài thượng thận (paragangliomas) ở nền sọ hay cổ, bệnh nhân bị nhiễu do đặt clip phẫu thuật, những bệnh nhân cần hạn chế phơi nhiễm với phóng xạ như trẻ em hay phụ nữ có thai, các bệnh nhân có đột biến tế bào mầm [2].
Thăm dò hình ảnh học chức năng được chỉ định cho bệnh nhân đã bị hoặc có nguy cơ bị bệnh lý di căn (khối u nguyên phát lớn, u ngoài thượng thận, nhiều khối, tái phát).
- Chụp cắt lớp vi tính phát xạ với 123I (23I-MIBG SPECT) có thể hữu ích nếu 123I-MIBG được xem xét để điều trị cho bệnh nhân và có độ nhạy tốt hơn nhiều đối với u tủy thượng thận tại thượng thận so với u cận hạch ngoài thượng thận [29].
- Chụp PET/CT với đồng phân của Somatostatin gắn đồng vị phóng xạ (68Ga-DOTATATE) có độ nhạy rất tốt với các u cận hạch ở đầu và cổ, bệnh lý di căn và các khối u liên quan với SDHB/SDHD. 8F-FDOPA PET có độ nhạy tốt với các u cận hạch vùng nền sọ và cổ và bệnh không di căn, còn '8F-FDG PET có độ nhạy tốt với các paraganglioma liên quan với SDHB có di căn [33,34].
2.4.4 Các thủ thuật chẩn đoán
Khoảng 40% bệnh nhân u tủy thượng thận và u cận hạch ngoài thượng thận có đột biến dòng tế bào mầm [1]. Nên xem xét làm test di truyền cho tất cả các bệnh nhân bị u tủy thượng thận u cận hạch.
Đột biến đối với các gen sau đã được báo cáo là có vai trò gây bệnh: gen NF1, RET trong đa u nhiều tuyến nội tiết typ 2 (MEN2a, MEN2b), VHL, protein xuyên màng 127 (transmembrane domain protein 127) (FP/TMEM127), yếu tố X liên quan MYC ( MYC-associated factor X) (MAX), fumarat hydratase (FH), malat dehydrogenase 2 (MDH2), yếu tố cảm ứng giảm oxy mô 2a (hypoxia-inducible factor 2a) (EPAS1), SDHA, SDHB, SDHC, SDHD, SDHAF2 [2,8].
Đột biến của gen SDHB kết hợp với gia tăng nguy cơ xuất hiện tình trạng bệnh di căn (40 - 60%). Nên tiến hành kiểm tra tình trạng đột biến của gen này, nhất là ở bệnh nhân có u cận hạch, các khối u lớn và các khối u chế tiết methoxytyramine [1].
Đột biến của SDHD và SDHAF2 được di truyền theo kiểu tính trội qua nhiễm sắc thể thường mà chỉ các đột biến di truyền từ cha mới gây ra bệnh [8].
Nên ưu tiên lựa chọn các gen để phân tích theo các đặc điểm hội chứng lâm sàng, biểu hiện di căn, tuổi trẻ lúc khởi phát bệnh, vị trí u và kiểu hình chế tiết catecholamin. Nên sử dụng các tư vấn di truyền pre-test và post-test. Xem Bảng 16.3 [2,8].
3 ĐIỀU TRỊ
Cắt bỏ khối u bằng phẫu thuật là điều trị triệt để đối với u tủy thượng thận. Cắt bỏ khối u tủy thượng thận là một thủ thuật ngoại khoa có nguy cơ cao, đòi hỏi phải có đội ngũ các thầy thuốc gây mê và phẫu thuật viên có kinh nghiệm thực hiện cuộc mổ này. Ngoài ra, bệnh nhân phải được chuẩn bị nội khoa thích hợp để kiểm soát tốt tác động do kích thích adrenergic quá mức và dự phòng cơn tăng huyết áp nguy kịch trong khi mổ. Nên có một thầy thuốc chuyên khoa nội tiết hoặc các thầy thuốc có kinh nghiệm về xử trí u tủy thượng thận giám sát điều trị trong cuộc phẫu thuật.
U tủy thượng thận theo truyền thống thường được tiến hành mổ cắt
bỏ theo phương pháp mổ mở qua đường mở bụng. Tuy nhiên, một số nghiên cứu đã chỉ ra rằng, phẫu thuật cắt bỏ thượng thận bằng nội soi ít gây đau hơn, mất máu ít hơn, rút ngắn thời gian nằm viện cũng như ít gây tai biến ngoại khoa hơn so với mổ cắt tuyến thượng thận theo kiểu mổ mở, do vậy được ưu tiên lựa chọn hơn so với mổ mở truyền thống đối với hầu hết các u tủy thượng thận [35,36].
Phẫu thuật cắt thượng thận bằng nội soi có thể được tiến hành an toàn ngay cả với các khối u lớn (6 cm) [37]. Các u cận hạch cần phải mổ mở do chúng thường bị ác tính và được tìm thấy ở những vị trí khó tiếp cận bằng phương pháp mổ nội soi [2].
Đối với u tủy thượng thận thể tản phát bên trong thượng thận nên phẫu thuật cắt bỏ toàn bộ tuyến thượng thận.
Các bệnh nhân bị u tủy thượng thận có tính gia đình (MEN2 hay bệnh Von Hippel–Lindau) sẽ gặp một tỷ lệ mắc mới cao bệnh lý ở cả hai bên và thường cần phải phẫu thuật cắt tuyến thượng thận ở cả hai bên. Đối với một số bệnh nhân bị u tủy thượng thận do di truyền trước đó đã được cắt một bên tuyến thượng thận, có thể cân nhắc phẫu thuật cắt một phần tuyến thượng thận còn lại (nếu u nhỏ) để tránh gây suy thượng thận vĩnh viễn và phụ thuộc corticoid suốt đời. Các báo cáo nghiên cứu ca bệnh gần đây cho thấy tỷ lệ tái phát dưới 5% trong 10 năm khi bệnh nhân được phẫu thuật với bảo tồn chức năng glucocorticoid ít nhất 50% [38].
Tuy nhiên, nguy cơ tái phát u nên được “cân nhắc” với các nguy cơ liên quan
đến sử dụng corticoid kéo dài. Khi mổ cắt thượng thận 2 bên được lên lịch, bệnh nhân nên được dùng glucocorticoid với “liều stress” trong cuộc mổ và điều trị glucocorticoid thích hợp sau mổ.
Xử trí trước mổ:
- Mục tiêu chính của xử trí trước phẫu thuật đối với u tủy thượng thận là bình thường hoá được huyết áp, tần số tim và chức năng các cơ quan bằng cách phục hồi lại được thể tích tuần hoàn và dự phòng cơn bão catecholamin do phẫu thuật gây nên.
- Nếu không được chuẩn bị trước mổ thỏa đáng, tỷ lệ tử vong chu phẫu có thể lên tới 30 - 45%. Nếu được chuẩn bị tốt, tỷ lệ tử vong này giảm xuống dưới 1% [39].
- Thuốc đối kháng a-adrenergic hoặc thuốc chẹn kênh Canxi là các thuốc được khuyến cáo sử dụng cho bệnh nhân [39].
- Hiện chưa có ý kiến đồng thuận về thời điểm chính xác sử dụng thuốc chẹn adrenergic trước phẫu thuật. Ở hầu hết các trung tâm y khoa, thuốc chẹn adrenergic thường điều trị khởi đầu trước mổ 7-14 ngày để có được thời gian thỏa đáng giúp bình thường hoá huyết áp, tần số tim và làm tăng thể tích trong lòng mạch đang bị hạn chế.
Thuốc chẹn a-adrenergic:
- Thuốc chẹn a chọn lọc và không chọn lọc vẫn là nền tảng của điều trị trước mổ, lý tưởng nhất là nên dùng trước mổ 7-14 ngày.
- Thuốc chẹn a không chọn lọc: phenoxybenzamin
- Liều khởi đầu 10 mg x 2-3 lần/ngày (lên tới tổng liều hằng ngày 100 mg).
- Tác dụng kéo dài hơn, ức chế không hồi phục, giá thành đắt.
- 3. Tăng nguy cơ hạ huyết áp tư thế, phản xạ tăng nhịp tim, nghẹt mũi, ngất.
- Thuốc ức chế chọn lọc a: Doxazosin, prazosin, terazosin
- Doxazosin: 2-4 mg x 2-3 lần/ngày; prazosin: 1-2 mg x 2 lần/ ngày; terazosin: 1-4 mg /ngày.
- Tác dụng ngắn hơn, giá thành rẻ hơn.
- Tăng nguy cơ bị tăng huyết áp trong mổ [39].
Hiện không có các nghiên cứu đối chứng ngẫu nhiên tiến cứu nhưng các nghiên cứu hồi cứu tại Mayo Clinic và Cleveland Clinic đã cho thấy, các thuốc chẹn a chọn lọc gây tăng huyết áp trong khi mổ nhiều hơn mà không có các khác biệt về kết cục. Một nghiên cứu tiến cứu so sánh phenoxybenzamin với prazosin ở Ấn Độ cho thấy dùng prazosin gây tăng huyết áp trong mổ nhiều hơn 40,41].
Thuốc chẹn a-adrenergic cải thiện kết cục phẫu thuật với biến chứng chu phẫu ít hơn [42].
Làm tăng thể tích tuần hoàn (ví dụ, bằng cách bổ sung thêm muối qua đường uống hoặc dịch truyền tĩnh mạch) giúp giảm nguy cơ hạ huyết áp tư thế liên quan với dùng các thuốc chẹn a-adrenergic. Nhịp tim nhanh có thể xuất hiện khi điều trị thuốc ức chế a, đòi hỏi được điều trị bằng thuốc chẹn B. Tuy nhiên, không nên cho dùng thuốc chẹn B khi chưa đạt được tác dụng chẹn a-adrenergic thỏa đáng (thường sau 2-3 ngày) để dự phòng tăng huyết áp nghịch thường do kích thích thụ thể a-adrenergic bị mất đối kháng. Hiện không có đủ bằng chứng ủng hộ việc ưu tiên sử dụng thuốc chẹn thụ thể B1-adrenergic chọn lọc so với các thuốc chẹn thụ thể B-adrenergic không chọn lọc. Labetalol với đặc tính gây block B mạnh hơn a cũng không nên sử dụng như điều trị khởi đầu do thuốc có thể gây tăng huyết áp nghịch thường.
- Thuốc chẹn ß không chọn lọc: Propranolol (10 - 40 mg x 2 - 3 lần/ngày).
- Thuốc chẹn B chọc lọc: Metoprolol (25 - 100 mg x 2 lần/ngày).
Khởi đầu điều trị với liều thấp để kiểm soát tình trạng nhịp tim nhanh và theo dõi các dấu hiệu phù phổi cấp liên quan với bệnh cơ tim nền.
Đích huyết áp trước mổ là dưới 130/80 mmHg ở tư thế ngồi và huyết
áp tâm thu trên 90 mmHg khi đứng trong khi nhịp tim đích được duy trì từ 60 - 70 nhịp/phút khi ngồi và 70 - 80 nhịp/phút khi đứng, nhưng có thể được điều chỉnh theo lứa tuổi và nguy cơ tim mạch [2].
Tăng huyết áp và rối loạn nhịp tim trong mổ thường xảy ra trong quá trình tiền mê hay khi tiến hành thao tác trên u.
Nên điều trị cơn tăng huyết áp kịch phát bằng natri nitroprussid, phentolamin, hay nicardipin truyền tĩnh mạch. Lidocain hoặc esmolol có thể được sử dụng để điều trị rối loạn nhịp tim.
Sau khi cắt bỏ u, bệnh nhân có thể bị tụt huyết áp nhẹ, có thể tránh để xảy ra tụt huyết áp nặng bằng cách bồi phụ dịch tích cực. Khoảng 10 - 15% bệnh nhân có thể bị hạ đường máu sau mổ, tình trạng này có thể được xử trí bằng truyền tĩnh mạch Glucose trong thời gian ngắn [43].
Các thuốc khác :
- Thuốc chẹn kênh canxi nhóm dihydropyridin: nicardipin, amlodipin.
- Nicardipin: 30 mg x 2 lần/ngày; Amlodipin 5-10 mg/ngày.
- Có thể dùng bổ sung thêm hoặc thay thế cho thuốc chẹn a và B [2].
- Thuốc ức chế tyrosine hydroxylase: metyrosin :
- 250 - 500 mg x 4 lần/ngày.
- Ức chế sinh tổng hợp catecholamin.
- Có thể dùng bổ sung thêm hoặc thay thế cho thuốc chẹn a và B truyền thống.
Các yếu tố nguy cơ gặp các biến chứng chu phẫu như tăng huyết áp bao gồm sản xuất norepinephrin tăng cao, kích thước u lớn (>4 cm), tăng huyết áp khi biểu hiện bệnh trên lâm sàng và sau điều trị bằng thuốc chẹn a-adrenergic và hạ huyết áp tư thế nặng xuất hiện sau điều trị trước mổ [44].
| Bảng 16.3. Các đột biến di truyền và những biểu hiện lâm sàng kết hợp | ||||
| Gen | Hội chứng hoặc các đặc điểm kết hợp khác | Nguy cơ di căn | Khu trú | Đặc điểm sinh hóa |
| RET | MEN2A, MEN2B | Thấp | Thượng thận; có thể cả hai bên | Adrenergic |
| VHL | von Hippel-Lindau | Cao | Thượng thân; có thể cả hai bên Ngoài thượng thận | Noradrenergic |
| NF1 | U xơ thần kinh typ 1 Neurofibromatosis type 1 | Vừa | Thượng thận | |
| SDHB | Carcinoma tế bào thận Các khối u mô đệm đường tiêu hóa Adenoma tuyến yên hiếm gặp | Cao nhất | SBHN Thượng thận, ngoài thượng thận | Dopaminergic, noradrenergic, adrenergic |
| SDHD | Carcinoma tế bào thận Các khối u mô đệm đường tiêu hóa Adenoma tuyến yên hiếm gặp | Thấp - vừa | SBHN-multifocal Thượng thận, ngoài thượng thận | Dopaminergic, noradrenergic, adrenergic |
| SDHC | Carcinoma tế bào thận hiếm gặp Các khối u mô đệm đường tiêu hóa Adenoma tuyến yên hiếm gặp | Thấp -vừa | SBHN Thượng thận, ngoài thượng thận (trong lồng ngực) | Dopaminergic, noradrenergic, adrenergic |
| SDHA | Các khối u mô đệm đường tiêu hóa | Thấp | ||
| SDHAF2 | Thấp | SBHN-multifocal | ||
| MAX | Không được xác định | Vừa | Thượng thận, ngoài thượng thận | Adrenergic, noradrenergic |
| TMEM127 | Carcinoma tế bào thận hiếm gặp | Thấp | Thượng thận, ngoài thượng thận, SBHN | Adrenergic |
| FH | U cơ trơn (Leiomyomatosis), Carcinoma tế bào thận | Có thể cao | ||
| EPAS1 | Đa hồng cầu Polycythemia, u tiết somatostatin | Không được xác định | ||
| MDH2 | Không được xác định | Không được xác định | ||
MEN, multiple endocrine neoplasia: U tân sinh đa tuyến nội tiết; SBHN, skull base head and neck: Nền sọ và cổ. von Hippel-Lindau: hemangioblastomas of the central nervous system, endolymphatic sac tumors, epididymal cystadenomas, renal cell carcinomas, renal cysts, pancreatic neuroendocrine tumors, pancreatic cyst, pheochromocytoma, or paraganglioma. Neurofibromatosis type 1: cutaneous neurofibromas, plexiform neurofibromas, café au lait spots, Lisch nodules (iris hamartoma), inguinal or axillary freckling, long bone dysplasia, optic gliomas, pheochromocytoma. Lenders JW, Duh QY, Eisenhofer G, et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014;99(6):1915-1942; Fishbein L. Pheochromocytoma and paraganglioma: genetics, diagnosis, and diều trị. Hematol Oncol Clin North Am 2016;30(1):135-150. | ||||
4 CÁC TRƯỜNG HỢP ĐẶC BIỆT
U tủy thượng thận (pheochromocytoma) ác tính
- Ngoài xâm lấn tại chỗ hoặc di căn xa, không có đặc điểm mô bệnh học hay sinh hoá nào có thể phân biệt được các u thượng thận/ cận hạch lành tính với u ác tính [6]. Tuy nhiên, các nghiên cứu gần đây đã cho thấy là các đột biến của SDHB dẫn tới tình trạng bệnh di căn ở ≥ 40% các bệnh nhân [2]. Các yếu tố nguy cơ khác gây tình trạng bệnh ác tính bao gồm kích thước khối u lớn hơn 5 cm hay các khối u ngoài tuyến thượng thận [45].
- Các vị trí di căn hay gặp nhất là xương, phổi, gan và hạch bạch huyết.
- Hiện vẫn chưa có biện pháp điều trị hiệu quả đối với u tủy thượng thận ác tính. Phẫu thuật làm giảm khối lượng u có thể trợ giúp cho xạ trị sau đó, điều trị này có thể hữu ích đối với các trường hợp di căn xương có triệu chứng mặc dù chưa chứng minh được mang lại lợi ích về tỷ lệ sống sót của bệnh nhân. Liệu pháp '3'I-MIBG có thể được sử dụng như một lựa chọn điều trị nếu khối u cho thấy có tình trạng bắt giữ 123I-MIBG. Nếu khối u không bắt xạ, khi đó điều trị hóa chất kết hợp bằng cyclophosphamid, Vincristin, dacarbazin có thể làm thoái triển khối u và cải thiện triệu chứng ở tới 50% các trường hợp, tuy nhiên đáp ứng chỉ tồn tại trong thời gian ngắn [11,47]. Một nghiên cứu gần đây cho thấy khả năng sử dụng các thuốc ức chế tyrosine kinase sunitinib trong điều trị u cận hạch di căn đã và đang tăng lên [48].
Phụ nữ có thai
- U tủy thượng thận là một nguyên nhân gây tăng huyết áp hiếm gặp nhưng tiềm ẩn nguy cơ gây tử vong trong khi có thai, với các đặc điểm tương tự như ở quần thể dân chúng chung. Tuy nhiên, nếu tăng huyết áp và protein niệu xảy ra, u tủy thượng thận có thể khó phân biệt được với tiền sản giật.
- Chẩn đoán vẫn được dựa trên tình trạng tăng nồng độ metanephrin phân đoạn trong máu và nước tiểu, khu trú vị trí giải phẫu u bằng chụp MRI. Chụp xạ hình bằng chất đồng vị phóng xạ và tiến hành làm các nghiệm pháp kích thích đều không an toàn trong khi mang thai.
- Phụ nữ có thai nên được chuẩn bị trước mổ bằng phenoxybenzamin và được tiếp theo bằng thuốc chẹn B nếu cần để điều trị nhịp tim nhanh. Mặc dù phenoxybenzamin an toàn đối với thai nhi, song thuốc cũng qua nhau thai và có thể gây trầm cảm, tụt huyết áp thoáng qua trong giai đoạn chu sinh đối với sản phụ.
- Nếu u tủy thượng thận được chẩn đoán trước tuần 24 của thai kỳ, phẫu thuật cắt bỏ u thường được thực hiện. Ba tháng giữa của hai kỳ thường là thời điểm thích hợp để phẫu thuật [49]. Sau tuần thai 24, điều trị nội khoa sẽ được áp dụng đến khi thai trưởng thành (càng gần đủ tháng càng tốt), khi đó sẽ chỉ định tiến hành mổ lấy thai và phẫu thuật cắt bỏ khối u [50].
KIỂM TRA VÀ THEO DÕI
Theo dõi lâu dài được chỉ định cho tất cả các bệnh nhân. Nồng độ metanephrin huyết tương và nước tiểu phải được kiểm tra sau phẫu thuật từ 2 - 6 tuần để đánh giá việc cắt bỏ u có thỏa đáng không. Nên xem xét các thăm dò hình ảnh học bổ sung thêm nếu nồng độ chất này tăng cao.
Ngay cả sau khi đã cắt bỏ hoàn toàn u, vẫn có khoảng 5% nguy cơ khối u còn một phần, di căn hoặc hình thành u mới. Nguy cơ tái phát cao hơn ở các bệnh nhân càng trẻ tuổi, dưới 20 tuổi, bệnh nhân có biểu hiện các hội chứng (nội tiết), kích thước khối u lớn và ở các đối tượng có u cận hạch bạch huyết.
Theo dõi hằng năm được khuyến cáo cho tất cả các bệnh nhân đã được phẫu thuật trong ít nhất 10 năm. Đối với các đối tượng có nguy cơ bị bệnh tái phát cao, nên tiến hành theo dõi liên tục suốt cuộc đời bệnh nhân [51]. Tiền sử, đo huyết áp và định lượng nồng độ metanephrin trong huyết tương và nước tiểu nên được đưa vào quy trình thăm khám hằng năm cho bệnh nhân.
5 KẾT CỤC VÀ TIÊN LƯỢNG
Thời gian sống sót không bị tăng huyết áp ở bệnh nhân không bị tái phát bệnh là 74% sau 5 năm và 45% sau 10 năm. Tỷ lệ sống sót dường như không bị tác động bởi vị trí của khối u [52].
Bệnh nhân có khối u ác tính có tỷ lệ sống sót 5 năm dưới 85% (79% đối với u tủy thượng thận và 89% đối với u cận hạch thượng thận), tỷ lệ sống sót tổng thể 10 năm là 73% và tỷ lệ sống sót tổng thể 15 năm là 65% [9].
6 TÀI LIỆU THAM KHẢO
1. Lenders JWM, Eisenhofer G. Update on modern management of pheochromocytoma and paragan- glioma. Endocrinol Metab (Seoul) 2017; 32 (2):152–161.
2. Lenders JW, Duh QY, Eisenhofer G, et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guide- line. J Clin Endocrinol Me- tab 2014;99(6):1915-1942.
3. Pacak K, Eisenhofer G, Ahlman H, et al. Pheochromocytoma: recom- mendations for clinical practice from the First International Sympo- sium. October 2005. Nat Clin Pract Endocrinol Metab 2007;3(2): 92-102.
4. Welander J, Soderkvist P, Gimm O. Genetics and clinical characteristics of hereditary pheochromocytomas and paragangliomas. Endocr Relat Cancer 2011;18(6):R253-R276.
5. Lee JA, Duh QY. Sporadic paraganglioma. World J Surg 2008;32(5):683-687.
6. Lenders JW, Eisenhofer G, Man- nelli M, et al. Phaeochromocytoma. Lancet 2005;366(9486):665–675.
7. Young WF Jr. Management ap- proaches to adrenal incidentalomas. A view from Rochester, Minneso- ta. Endocrinol Metab Clin North Am 2000;29(1):159–185.
8. Fishbein L. Pheochromocyto- ma and paraganglioma:genetics, diagnosis, and treatment. Hema- tol Oncol Clin North Am 2016; 30(1):135-150.
9. Hamidi O, Young WF, Jr., Ini- guez-Ariza NM, et al. Malignant pheochromocytoma and para- ganglioma: 272 patients over 55 years. J Clin Endocrinol Me- tab 2017;102(9):3296-3305.
10. Buffet A, Venisse A, Nau V, et al. A decade (2001-2010) of genetic testing for pheochromocytoma and paraganglioma. Horm Metab Res 2012; 44(5):359–366.
11. Karagiannis A, Mikhailidis DP, Athyros VG, Harsoulis F. Pheochro- mocytoma: an update on genetics and management. Endocr Relat Cancer 2007;14(4):935–956.
12. Yao L, Schiavi F, Cascon A, et al. Spectrum and prevalence of FP/ TMEM127 gene mutations in pheo- chromocytomas and paraganglio- mas. JAMA 2010;304(23):2611- 2619.
13. Brito JP, Asi N, Bancos I, et al. Testing for germline mutations in sporadic pheochromocyto- ma/ paraganglioma: a system- atic review. Clin Endocrinol (Oxf) 2015;82(3):338-345
14. Eisenhofer G, Friberg P, Pacak K, et al. Plasma metadrenalines: do they provide useful information about sympatho-adrenal function and catecholamine metabolism? Clin Sci 1995; 88 (5): 533–542.
15. Eisenhofer G, Keiser H, Friberg P, et al. Plasma metanephrines are markers of pheochromocytoma produced by catechol-O-meth- yltransferase within tu- mors. J Clin Endocrinol Me- tab 1998;83(6):2175-2185.
16. Motta-Ramirez GA, Remer EM, Herts BR, Gill IS, Hamrahian AH. Comparison of CT findings in symptomatic and incidentally discovered pheochromocyto- mas. AJR Am J Roentgenol 2005; 185(3):684-688.
17. Kudva Y, Young W, Thompson G. Adrenal incidentaloma: An im- portant component of the presen- tation spectrum of benign sporadic adrenal pheochromocytoma. The Endocrinologist 1999; 9 (77).
18. Baguet JP, Hammer L, Mazzuco TL, et al. Circumstances of discov- ery of phaeochromocytoma: a ret- rospective study of 41 consecutive patients. Eur J Endocrinol 2004; 150(5):681-686.
19. Lenders JW, Pacak K, Walther MM, et al. Biochemical diagnosis of pheochromocytoma: which test is best? JAMA 2002;287(11): 1427-1434.
20. Sawka AM, Jaeschke R, Singh RJ, Young WF Jr. A comparison of biochemical tests for pheo- chromocytoma: measurement of fractionated plasma metanephrines compared with the combination of 24-hour urinary metanephrines and catecholamines. J Clin Endocrinol Metab 2003; 88(2):553–558.
21. Perry CG, Sawka AM, Singh R, Thabane L, Bajnarek J, Young WF Jr. The diagnostic efficacy of urinary fractionated metanephrines measured by tandem mass spec- trometry in detection of pheo- chromocytoma. Clin Endocrinol (Oxf) 2007; 66(5):703–708.
22. Darr R, Pamporaki C, Peitzsch M, et al. Biochemical diagnosis of phaeochromocytoma using plas- ma-free normetanephrine, meta- nephrine and methoxytyramine: im- portance of supine sampling under fasting conditions. Clin Endocrinol (Oxf) 2014;80(4):478–486.
23. Eisenhofer G, Goldstein DS, Wal- ther MM, et al. Biochemical diag- nosis of pheochromocytoma: how to distinguish true- from false-pos- itive test results. J Clin Endocrinol Metab 2003;88(6):2656–2666.
24. Algeciras-Schimnich A, Preiss- ner CM, Young WF Jr, Singh RJ, Grebe SK. Plasma chromogranin A or urine fractionated metaneph- rines follow-up testing improves the diagnostic accuracy of plasma fractionated metanephrines for pheo-chromocytoma. J Clin Endo- crinol Metab 2008; 93(1):91–95.
25. Ilias I, Pacak K. Current approach- es and recommended algorithm for the diagnostic localization of pheo- chromocytoma. J Clin Endocrinol Metab 2004;89(2):479–491.
26. Young WF Jr. Clinical practice. The incidentally discovered ad- renal mass. N Engl J Med 2007; 356(6):601-610.
27. Schieda N, Alrashed A, Flood TA, Samji K, Shabana W, McInnes MD. Comparison of quantitative MRI and CT wash- out analysis for differentiation of adrenal pheochromocytoma from adrenal adenoma. Am J Roentge- nol 2016;206(6):1141–1148.
28. Borhani AA, Hosseinzadeh K. Quantitative versus qualitative methods in evaluation of T2 signal intensity to improve accuracy in diagnosis of pheochromocy- toma. Am J Roentgenol 2015; 205(2):302-310.
29. Wiseman GA, Pacak K, O'Do- risio MS, et al. Usefulness of 1231-MIBG scintigraphy in the evaluation of patients with known or suspected primary or metastatic pheochromocytoma or paragan- glioma: results from a prospec- tive multicenter trial. J Nucl Med 2009;50(9):1448–1454.
30. Archier A, Varoquaux A, Garrigue P, et al. Prospective comparison of (68) Ga-DOTATATE and (18)F-FDOPA PET/CT in patients with various pheochromocytomas and paragan- gliomas with emphasis on sporadic cases. Eur J Nucl Med Mol Imag- ing 2016;43(7):1248-1257.
31. Janssen I, Blanchet EM, Adams K, et al. Superiority of [68Ga]-DO- TATATE PET/CT to other func- tional imaging modalities in the localization of SDHB-associated metastatic pheochromocytoma and paraganglioma. Clin Cancer Res 2015;21(17):3888-3895.
32. Janssen I, Chen CC, Taieb D, et al. 68Ga-DOTATATE PET/CT in the localization of head and neck paragangliomas compared with other functional imaging modalities and CT/MRI. J Nucl Med 2016; 57(2):186–191.
33. Timmers HJ, Kozupa A, Chen CC, et al. Superiority of fluoro- deoxyglucose positron emission tomography to other functional imaging techniques in the eval- uation of metastatic SDHB-as- sociated pheochromocytoma and paraganglioma. J Clin On- col 2007;25(16):2262-2269.
34. Timmers HJ, Taieb D, Pacak K. Current and future anatomical and functional imaging approach- es to pheochromocytoma and paraganglioma. Horm Metab Res 2012;44(5):367–372.
35. Agarwal G, Sadacharan D, Aggar- wal V, et al. Surgical management of organ-contained unilateral pheochromocytoma: compara- tive outcomes of laparoscopic and conventional open surgical procedures in a large single-insti- tution series. Langenbecks Arch Surg 2012;397(7):1109-1116.
36. Shen WT, Grogan R, Vriens M, Clark OH, Duh QY. One hundred two patients with pheochromo- cytoma treated at a single insti- tution since the introduction of laparoscopic adrenalectomy. Arch Surg 2010; 145(9):893-897.
37. Wang W, Li P, Wang Y, et al. Effec- tiveness and safety of laparoscopic adrenalectomy of large pheochro- mocytoma: a prospective, nonran- domized, controlled study. Am J Surg 2015; 210(2):230–235.
38. Castinetti F, Taieb D, Henry JF, et al. Management of endocrine disease: Outcome of adrenal sparing surgery in heritable pheo- chromocytoma. Eur J Endocri- nol 2016;174(1):R9-R18.
39. Naranjo J, Dodd S, Martin YN. Perioperative management of pheo- chromocytoma. J Cardiothorac Vasc Anesth 2017;31(4):1427-1439.
40. Weingarten TN, Cata JP, O'Ha- ra JF, et al. Comparison of two preoperative medical management strategies for laparoscopic resection of pheochromocytoma. Urolo- gy 2010;76(2):508 e6-e11.
41. Agrawal R, Mishra SK, Bhatia E, et al. Prospective study to compare peri-operative hemodynamic al- terations following preparation for pheochromocytoma surgery by phe- noxybenzamine or prazosin. World J Surg 2014;38(3):716–723.
42. Goldstein RE, O'Neill JA Jr, Holcomb GW 3rd, et al. Clin- ical experience over 48 years with pheochromocytoma. Ann Surg 1999;229(6):755-764; discussion 64-66.
43. Akiba M, Kodama T, Ito Y, Obara T, Fujimoto Y. Hạ đường huyết induced by excessive rebound secretion of Insulin after removal of pheo- chromocytoma. World J Surg 1990;14(3):317–324.
44. Bruynzeel H, Feelders RA, Groen- land TH, et al. Risk factors for hemodynamic instability during surgery for pheochromocyto- ma. J Clin Endocrinol Metab 2010;95(2):678–685.
45. Bravo EL, Tagle R. Pheochro- mocytoma: state-of-the-art and future prospects. Endocr Rev 2003; 24(4):539-553.
46. van Hulsteijn LT, Niemeijer ND, Dekkers OM, Corssmit EP. (131) I-MIBG therapy for malignant paraganglioma and phaeochro- mocytoma: systematic review and meta-analysis. Clin Endocrinol (Oxf) 2014;80(4):487-501.
47. Niemeijer ND, Alblas G, van Hul- steijn LT, Dekkers OM, Corssmit EP. Chemotherapy with cyclophos- phamide, vincristine and dacarba- zine for malignant paraganglioma and pheochromocytoma: systematic review and meta-analysis. Clin Endocrinol (Oxf) 2014;81(5):642- 651.
48. Joshua AM, Ezzat S, Asa SL, et al. Rationale and evidence for suni- tinib in the điều trị of malignant paraganglioma/pheochromocy- toma. J Clin Endocrinol Me- tab 2009;94(1):5–9.
49. Pearl J, Price R, Richardson W, et al. Guidelines for diagnosis, treatment, and use of laparosco- py for surgical problems during pregnancy. Surg Endosc 2011; 25(11):3479-3492.
50. Lenders JW. Pheochromocytoma and pregnancy: a deceptive con- nection. Eur J Endocrinol 2012; 166(2):143-150.
51. Plouin PF, Amar L, Dekkers OM, et al. European Society of Endocri- nology Clinical Practice Guideline for long-term follow-up of patients operated on for a phaeochromo- cytoma or a paraganglioma. Eur J Endocrinol 2016;174(5):G1-G10.
52. Plouin PF, Chatellier G, Fofol I, Corvol P. Tumor recurrence and hypertension persistence after successful pheochromocy- toma operation. Hypertension 1997;29(5):1133-1139

