Nguyên nhân, triệu chứng và điều trị cường aldosteron tiên phát
Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 NGUYÊN LÝ CHUNG
1.1 Định nghĩa
Cường aldosteron nguyên phát, cũng còn được gọi là hội chứng Conn, được định nghĩa là tình trạng tăng sản xuất aldosteron một cách không thích hợp (không phụ thuộc renin). Cường aldosteron nguyên phát phải được phân biệt với cường aldosteron thứ phát là tình trạng tăng sản xuất aldosteron thích hợp (phụ thuộc renin) khi đáp ứng với giảm thể tích tuần hoàn tương đối như được thấy trong tăng huyết áp do bệnh lý mạch thận và khi điều trị bằng lợi tiểu.
.jpg)
1.2 Phân loại
Phân biệt giữa bệnh một bên và hai bên tuyến thượng thận là vô cùng quan trọng vì nó quyết định biện pháp điều trị. Bệnh một bên được giới hạn chỉ ở một tuyến thượng thận và thường được điều trị bằng phẫu thuật. Bệnh hai bên được biểu hiện ở cả hai tuyến thượng thận và thường được điều trị bằng nội khoa.
1.3 Dịch tễ học
Tỷ lệ lưu hành của cường aldosteron nguyên phát hiện chưa được biết rõ. Theo các số liệu trong y văn trước đây tỷ lệ lưu hành < 1% ở bệnh nhân tăng huyết áp. Các tài liệu gần đây cho thấy tỷ lệ lưu hành bệnh lên tới 12% ở các bệnh nhân tăng huyết áp [1,2].
1.4 Bệnh căn
Cường aldosteron nguyên phát có thể do một số bệnh lý rối loạn thượng thận gây nên:
- Adenoma sản xuất aldosteron.
- Tăng sản tuyến thượng thận (một bên hoặc hai bên).
- Carcinoma vỏ thượng thận chế tiết aldosteron.
- Khối u buồng trứng tiết aldosteron.
- Cường aldosteron có tính chất gia đình.
1.5 Sinh lý bệnh
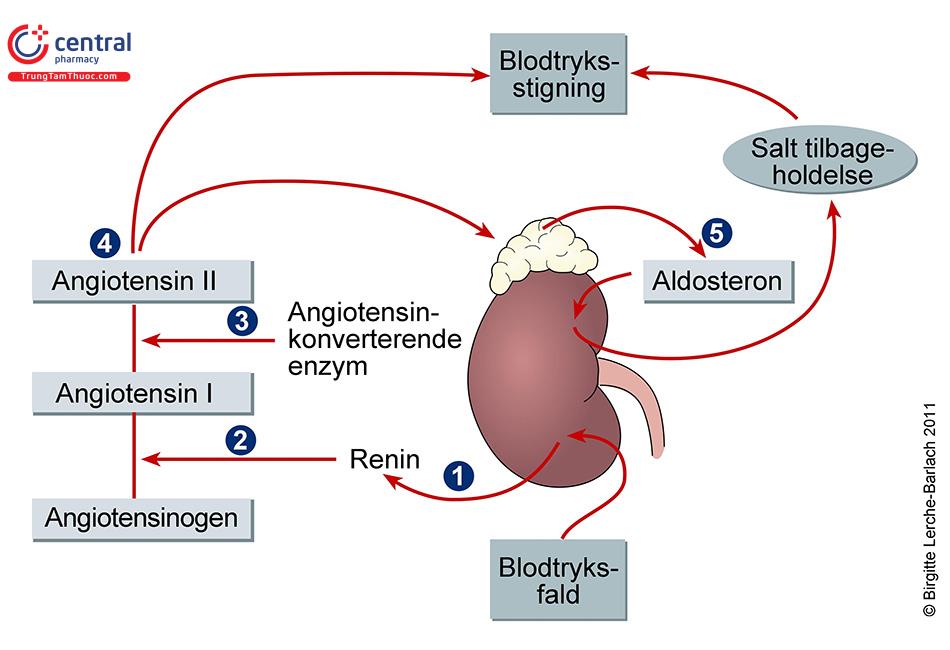
Aldosteron được sản xuất ở lớp cầu vỏ thượng thận, nó được tổng hợp và giải phóng khi đáp ứng với quá trình sản xuất angiotensin II phụ thuộc renin. Nồng độ Kali huyết thanh, ACTH, dopamin và peptid tăng thải natri qua nước tiểu nguồn gốc nhĩ (ANP) cũng có tác động tới quá trình sản xuất và chế tiết aldosteron. Tình trạng giữ natri và mất nhiều kali do aldosteron gây nên không dẫn tới phù toàn thân hoặc giảm nồng độ kali máu do hiện tượng “thoát aldosteron” (“aldosterone escape”) mà trong đó là tăng nồng độ natri nước tiểu và giảm tiết kali niệu đối kháng tức thì với tình trạng tăng aldosteron quá mức. Hiện tượng này được cho là trung gian qua tăng tiết ANP do giảm thể tích máu gây nên, giảm nồng độ chất đồng vận chuyển NaCl nhạy cảm với thiazid và tăng áp lực thải natri niệu.
2 CHẨN ĐOÁN
2.1 Biểu hiện lâm sàng
Các dấu hiệu điển hình của cường aldosteron nguyên phát là tăng huyết áp và hạ kai máu. Tuy vậy, biểu hiện phổ biến nhất của cường aldosteron nguyên phát là tăng huyết áp với nồng độ kali máu bình thường. Tình trạng tăng huyết áp thường gặp song không phải lúc nào cũng có [3], nhưng hạ kali máu được thấy ở ít hơn một nửa số trường hợp được chẩn đoán xác định bệnh [1,4].
2.1.1 Khai thác tiền sử bệnh
Các triệu chứng liên quan với hạ kali máu như yếu cơ và chuột rút có thể xảy ra. Các triệu chứng khác không đặc hiệu bao gồm đau đầu, mệt mỏi, đánh trống ngực và tiểu nhiều. Khai thác kỹ lưỡng về tiền sử dùng thuốc rất quan trọng, do nhiều thuốc điều trị tăng huyết áp cũng như khả năng uống Cam Thảo hoặc sử dụng thuốc lá dạng nhai có thể có tác động giao thoa với các test chẩn đoán. Tiền sử gia đình bị cường aldosteron nguyên phát khởi phát sớm, tăng huyết áp hoặc các biến cố mạch máu não phải đặt ra nghi ngờ về khả năng bị cường aldosteron có tính gia đình (FH).
2.1.2 Khám thực thể
Không có dấu hiệu thực thể đặc hiệu trong cường aldosteron nguyên phát, mặc dù tăng huyết áp được thấy ở hầu hết các trường hợp.
2.1.3 Tiêu chuẩn chẩn đoán
Chẩn đoán cường aldosteron nguyên phát được dựa trên bằng chứng là có tình trạng tăng sản xuất aldosteron quá mức không phụ thuộc renin.
2.2 Chẩn đoán phân biệt
Tăng sản tuyến thượng thận và các adenoma sản xuất aldosteron (APA) giải thích cho hầu hết các trường hợp cường aldosteron nguyên phát. Các nguyên nhân khác hiếm gặp và chiếm khoảng <3% các trường hợp.
Các adenoma sản xuất aldosteron (APA) chiếm khoảng 1/3 các trường hợp cường aldosteron nguyên phát. Đôi khi tình trạng này gặp trong hội chứng u tân sinh đa tuyến nội tiết typ 1.
Tăng sản tuyến thượng thận, cũng còn được biết như một tình trạng cường aldosteron vô căn (idiopathic hyperaldosteronism [IHA]), chiếm khoảng 2/3 các trường hợp cường aldosteron nguyên phát và có thể tác động tới một hoặc cả hai tuyến thượng thận.
Carcinoma vỏ thượng thận chế tiết aldosteron (ACC) hiếm gặp và chỉ là một phân nhóm các khối u tiết aldosteron. Các khối u này thường được chú ý vì gây đau do tình trạng xâm lấn tại chỗ hoặc đồng chế tiết cortisol và/hoặc androgen thượng thận, tình trạng này sẽ gây ra các triệu chứng của hội chứng Cushing và/hoặc nam hóa.
Khối u buồng trứng tiết aldosteron như một nguyên nhân của cường aldosteron nguyên phát là cực kỳ hiếm gặp.
Cường aldosteron có tính gia đình.
- Cường aldosteron có tính gia đình typ 1 hay cường aldosteron điều trị có đáp ứng với glucocorticoid là một rối loạn tính trội di truyền qua nhiễm sắc thể thường, bệnh thường kết hợp với tăng sản thượng thận hai bên. Rối loạn này được gây nên bởi sự tái tổ hợp giữa các vùng kích hoạt (promoter regions) của 118-hydroxylase (CYP11B1) và vùng mã hóa của 18 - hydroxylase (CYP11B2), theo kiểu như trong gen chimeric (chimera: [thần thoại Hy-lạp] quái vật đuôi rắn mình dê đầu sư tử), ACTH (mà không phải là renin hoặc nồng độ kali huyết thanh) sẽ thúc đẩy tình trạng bộc lộ gen (expression) của aldosteron synthetase và sản xuất aldosteron. Trái ngược với hầu hết bệnh nhân bị cường aldosteron nguyên phát sẽ xuất hiện tình trạng tăng huyết áp trong độ tuổi từ 30 đến 50, bệnh nhân cường aldosteron có đáp ứng với điều trị glucocorticoid (GRA) xuất hiện tăng huyết áp khi mới sinh hoặc ngay từ lúc còn rất nhỏ tuổi. Bệnh nhân bị cường aldosteron có đáp ứng điều trị với glucocorticoid thường có nồng độ kali máu bình thường do giải phóng aldosteron của họ có cùng dạng chế tiết theo nhịp ngày đêm như dạng chế tiết của ACTH và vì vậy, tiết aldosteron trên mức bình thường chỉ xảy ra ở một khoảng thời gian trong ngày. Tuy nhiên, các bệnh nhân này có thể xuất hiện hạ kali máu rõ rệt khi được điều trị bằng lợi tiểu thiazid. Các bệnh nhân bị cường aldosteron có thể có đáp ứng điều trị với glucocorticoid cũng có xu hướng bị tăng tỷ lệ mắc các biến chứng mạch máu não sớm, nhất là đột quỵ chảy máu do vỡ phình động mạch trong não.
- Cường aldosteron có đáp ứng điều trị với glucocorticoid typ độc lập với ACTH và dẫn đến adenoma sản xuất aldosteron (APA), cường aldosteron vô căn (IHA) hoặc cả hai trong dạng di truyền tính trội qua nhiễm sắc thể thường. Mặc dù khiếm khuyết di truyền chính xác còn chưa được biết rõ, ổ gen trên nhiễm sắc thể 7p22 đã được cho là có liên quan.
- Cường aldosteron có đáp ứng điều trị với glucocorticoid typ 3 (FH typ 3) là do các đột biến gây tăng chức năng đối với gen KCNJ5 tăng dòng Canxi nhập vào đối với các tế bào lớp cầu của vỏ thượng thận, dẫn tới tình trạng tiết aldosteron và có thể cả tăng sinh tế bào.
- Một loạt các đột biến tế bào soma khác đã được phân lập trong adenoma sản xuất aldosteron (APA) bao gồm ATPIA1, ATP2B3 và CACNAID. Các đột biến này hiện không có biểu hiện trên lâm sàng để điều trị.
2.3 Chẩn đoán cận lâm sàng
Chẩn đoán cận lâm sàng đối với cường aldosteron nguyên phát nhằm để xác nhận có tình trạng tăng quá mức aldosteron độc lập với renin (renin- independent aldosterone excess) và để xác định nguồn gốc của tình trạng tăng quá mức alosteron này là ở một bên hay cả hai bên thượng thận thông qua lược đồ tiếp cận chẩn đoán 3 bước được trình bày trong Hình 14.1 (5)
- Sàng lọc phát hiện tình trạng sản xuất aldosteron không phụ thuộc renin.
- Khẳng định sản xuất aldosteron không phụ thuộc renin.
- Khu trú nguồn sản xuất aldosteron.
2.3.1 Cận lâm sàng
Tiến hành sàng lọc tình trạng cường aldosteron không phụ thuộc vào renin được khuyến cáo ở nhóm các bệnh nhân có tỷ lệ bệnh lưu hành tương đối cao, bao gồm các bệnh nhân với:
- Huyết áp liên tục >150/100 qua ba lần đo.
- Huyết áp > 140/90 khi đã được điều trị bằng 3 thuốc chống tăng huyết áp (bao gồm một thuốc lợi tiểu).
- Phải kiểm soát huyết áp bằng bốn hoặc hơn các thuốc chống tăng huyết áp.
- Tăng huyết áp ở bất kỳ giai đoạn nào kết hợp với hạ kali máu tự phát hoặc do thuốc lợi tiểu gây ra.
- Tăng huyết áp được kết hợp với u thượng thận phát hiện tình cờ.
- Tăng huyết áp với tiền sử gia đình, bị tăng huyết áp khởi phát sớm hoặc tai biến mạch não xảy ra ở tuổi trẻ (40 tuổi).
- Tăng huyết áp và ngừng thở khi ngủ.
- Tăng huyết áp và người thân ở thế hệ F1 của bệnh nhân bị cường aldosteron nguyên phát [5].
Sàng lọc tình trạng cường aldosteron có đáp ứng điều trị với glucocorticoid (GRA) qua xét nghiệm di truyền nên được xem xét cho bệnh nhân bị cường aldosteron nguyên phát đã được khẳng định và có bất kỳ dấu hiệu nào dưới đây:
- Khởi phát trước tuổi 20.
- Có tiền sử gia đình bị cường aldosteron nguyên phát.
- Có tiền sử cá nhân hoặc gia đình bị đột quỵ trước tuổi 40 [5].
Bác sĩ điều trị cho bệnh nhân nên chắc chắn bệnh nhân đã được bồi phụ đủ kali, khẩu phần natri không hạn chế và ngừng sử dụng một số chất gây tác dụng giao thoa trong ít nhất 4 tuần trước khi tiến hành test sàng lọc. Các thuốc gây tác dụng giao thoa bao gồm lợi tiểu (nhất là các thuốc đối kháng thụ thể mineralocorticoid như spironolacton) và các sản phẩm dẫn xuất từ rễ cam thảo như thuốc lá dạng nhai.
Hai test được chỉ định để sáng lọc về phương diện hóa sinh đối với tình trạng cường aldosteron nguyên phát là nồng độ aldosteron huyết tương (PAC) và hoạt tính renin huyết tương (PRA). Tỷ số aldosteron/ renin được tính từ hai giá trị nói trên và bằng PAC/PRA. Giá trị PAC > 20 ng/dL và ARR > 30 ( đơn vị tính ng/dL mỗi ng/mL/giờ) được sử dụng cùng với nhau có độ nhạy và độ đặc hiệu 90% đối với cường aldosteron nguyên phát [6]. Mặc dù chưa có sự đồng thuận rộng rãi nhưng sử dụng các giá trị này làm điểm cắt để sàng lọc là hợp lý. Các kết quả ở mức ranh giới nên được nhận định một cách thận trọng, có thể tiến hành làm lại test nếu có tác động giao thoa từ các thuốc bị nghi vấn hoặc bệnh nhân có thể tiến hành trực tiếp để kiểm tra xác nhận. Sử dụng đơn độc thông số ARR mà không xem xét tới PAC có thể bị sai. Ví dụ, một phân nhóm bệnh nhân bị tăng huyết áp vô căn có thể có tăng tỷ số này do có một PRA rất thấp mà không có tăng PAC đi kèm.
Nhiều thuốc (nhất là thuốc điều trị tăng huyết áp) có thể ảnh hưởng đến kết quả của PAC hoặc ARR. Phải luôn giải thích kết quả của test sau khi đã xem xét tới các tác động giao thoa tiềm ẩn (Bảng 14.1) [5]. Ví dụ, thuốc ức chế men chuyển (ACE) và thuốc chẹn thụ thể angiotensin (ARBs) có thể làm tăng PRA, dẫn tới kết quả âm tính giả đối với ARR ở bệnh nhân bị cường aldosteron nguyên phát. Tuy nhiên, gia tăng ARR trong bệnh cảnh bệnh nhân đang điều trị bằng thuốc ức chế ACE hoặc ARB là một bằng chứng rất gợi ý đối với cường aldosteron nguyên phát. Nếu nghi ngờ kết quả test sàng lọc không đúng nên ngừng sử dụng các thuốc gây tác động giao thoa và sử dụng hydralazin, Verapamil hoặc thuốc chẹn a-adrenergic như Doxazosin để kiểm soát huyết áp. Diễn giải khả năng kết hợp PCA và PRA có thể tìm thấy trong Bảng 14.2.
Khẳng định có tình trạng cường aldosteron độc lập với renin được đưa ra khi có bằng chứng cho thấy mất ức chế aldosteron trong khi làm test nạp natri (hay tăng tải natri). Test tăng tải natri theo đường uống và truyền tĩnh mạch là các test khẳng định thường được sử dụng nhất. Nguyên lý cơ bản của test này là gây gia tăng thể tích trong lòng mạch sẽ làm giảm giải phóng renin và sau đó giảm sản xuất aldosteron ở bệnh nhân không bị cường aldosteron nguyên phát. Gây tăng tải natri có thể dẫn tới tăng gánh thể tích, nhất là ở bệnh nhân có tổn thương chức năng thất trái hoặc suy thận, cần phải được theo dõi sát. Cần tiến hành bồi phụ thỏa đáng kali trước khi tiến hành làm test.
- Test tăng tải natri đường uống: Bệnh nhân được hướng dẫn uống 6 g natri mỗi ngày. Phải tiến hành đo nồng độ kali hằng ngày và bồi phụ kali nếu cần, do test tăng tải (hay test nạp natri) ở bệnh nhân bị cường aldosteron nguyên phát dẫn tới tình trạng mất kali. Tiến hành thu mẫu nước tiểu 24 giờ được bắt đầu thực hiện chỉ vào ngày thứ ba sau khi làm test để định lượng nồng độ aldosteron, natri và creatinin trong nước tiểu. Bài xuất aldosteron niệu > 12 - 14 ug/24 giờ khẳng định có tình trạng mất ức chế aldosteron. Nồng độ natri nạp thỏa đáng được xác nhận bằng lượng natri niệu > 200 mEq/ngày [5].
- Test tăng tải natri tĩnh mạch: 2 lít dịch muối natri sinh lý được truyền tĩnh mạch trong vòng 4 giờ cho bệnh nhân ở tư thế nằm. Phải khẳng định là bệnh nhân đã được bồi phụ đủ trước đó song không cần phải theo dõi nồng độ kali trong khi truyền dịch muối 0,9%. Giá trị PAC > 10 ng/dL vào giờ thứ 4 khẳng định và giá trị PAC < 5 ng/dL loại bỏ chẩn đoán cường aldosteron nguyên phát. Giá trị PAC trong khoảng 5 -10 ng/dL được coi là nằm trong “vùng xám” [5].
- Các test thay thế khác: Quy trình của các test thay thế bao gồm test ức chế fludrocortison và test ức chế bằng captopril “challenge captopril” sẽ được trình bày chi tiết ở một phần khác [5]. Sử dụng test ức chế fludrocortison bị hạn chế bởi bệnh nhân cần phải nhập viện với mục đích theo dõi trong khi làm test. Test ức chế bằng captopril có thể được chấp nhận song là một test thay thế kém được chuẩn hóa hơn trừ khi test nạp natri bị chống chỉ định như trong suy tim.
| Bảng 14.1. Các thuốc có thể gây tác động trên các test sàng lọc đối với cường aldosteron nguyên phát | |||
| Thuốc | Tác động trên PAC | Tác động trên PRA | Tác động trên ARR |
| Thuốc lợi tiểu | ↑ | ⇈ | ↓ |
Thuốc chẹn B, thuốc chủ vận, chống viêm không phải steroid và thuốc ức chế renin | ↓ | ⇊ | ↑ |
| Thuốc ức chế ACE, ARBs, thuốc chẹn kênh canxi, thuốc ức chế renin. | ↓ | ⇈ | ↓ |
| Bảng 14.2. Chẩn đoán phân biệt đối với tăng huyết áp và hạ kali máu | ||
| ↑ PAC và ↓ JPRA | ↑ TPRA và ↓ PAC | ↑ JPRA và ↓ JPAC |
Cường aldosteron nguyên phát Adenoma thượng thận sản xuất aldosteron. Cường aldosteron tự phát hay vô căn. Tình trạng cường aldosteron đáp ứng với điều trị glucocorticoid. Tăng sản thượng thân nguyên phát. | Cường aldosteron thứ phát Hẹp động mạch thận. Khối u tiết renin. Tăng huyết áp ác tính. Bệnh thận mạn. Hẹp eo động mạch chủ. Hẹp động mạch chủ. | Trạng thái thừa hay tăng quá mức mineralocorticoid Thiếu hụt 17a-hydroxylase Thiếu hụt 11ẞ-hydroxylase Các khối u chế tiết deoxycorticosteron |
PAC = Plasma aldosterone concentration: Nồng độ aldosteron huyết tương; PRA = Plasma renin activity: Hoạt tính renin huyết tương; ARR = Aldosterone-renin ratio: Tỷ số aldosterone/ renin; NSAID = Nonsteroidal anti-inflammatory drug: Thuốc chống viêm không steroid; ACE = Angiotensin-converting enzyme: Thuốc ức chế men chuyển; ARBs = Angiotensin receptor bloker: Thuốc chẹn thụ thể angiotensin Phỏng theo Funder JW, Carey RM, Mantero F, et al. Case detection, diagnosis, and treatment of patients with primary aldosteronism: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2016;101(5):1889-1916. | ||
2.3.2 Hình ảnh học và các thủ thuật chẩn đoán
Khu trú hay xác định vị trí sản xuất aldosteron là điều cần thiết để hướng dẫn điều trị ở bệnh nhân bị cường aldosteron nguyên phát mong muốn được điều trị bằng phẫu thuật, bởi vì chỉ những bệnh nhân bị bệnh ở một bên tuyến thượng thận mới có cơ may nhận được lợi ích khi phẫu thuật. Theo nguyên tắc, thăm dò hình ảnh học không phải là cách đáng tin cậy để phân biệt bệnh lý thượng thận ở một bên hoặc cả hai bên, tuy vậy vẫn nên được tiến hành để phát hiện các khối u nhiều khả năng là u ác tính. Lấy mẫu từ tĩnh mạch thượng thận (adrenal vein sampling [AVS]) vẫn là thủ thuật được lựa chọn để xác định vị trí khối u cho các bệnh nhân mong muốn được điều trị triệt để bằng ngoại khoa.
- Hình ảnh học tuyến thượng thận: Nên thực hiện chụp CT tuyến thượng thận để phát hiện carcinoma vỏ thượng thận. Đây là các khối u có xu hướng khối u lớn (> 4 cm) và có hình dạng đặc trưng trên hình ảnh CT. Thăm dò hình ảnh MRI có thể là biện pháp thay thế nếu có chống chỉ định chụp cắt lớp vi tính. Không nên sử dụng đơn độc thăm dò hình ảnh học để xác định vị trí sản xuất aldosteron, do nó không thể phân biệt được đáng tin cậy nguồn gốc sản xuất ở một bên hay cả hai bên thượng thận. Ví dụ, cường aldosteron vô căn và u thượng thận phát hiện tình cờ không hoạt động chức năng có thể cùng tồn tại. Trong các trường hợp này, khối u ở một bên thượng thận chắc chắn sẽ được phát hiện trên thăm dò hình ảnh học, song nguồn gốc sản xuất quá mức aldosteron sẽ là hai bên. Ngược lại, các adenoma sản xuất aldosteron (APAs) có thể quá nhỏ để chụp CT phát hiện được. Trong tình huống này, sự hiện diện của các tuyến thượng thận “bình thường” có thể chỉ dẫn không chính xác về nguồn gốc của tình trạng tăng quá mức aldosteron hai bên. Tính tương hợp giữa hình ảnh CT và lấy mẫu từ tĩnh mạch thượng thận chỉ vào khoảng 50% [7,8].
- Lấy mẫu từ tĩnh mạch thượng thận: Kỹ thuật lấy mẫu từ máu tĩnh mạch thượng thận (AVS) đắt tiền, gây xâm lấn và khó về mặt kỹ thuật song có độ nhạy 95% và độ đặc hiệu 100% trong phát hiện tình trạng bệnh ở một bên [7]. Hầu như tất cả bệnh nhân sẽ được yêu cầu tiến hành AVS để xác định nguồn gốc gây tăng sản xuất aldosteron quá mức. Bệnh nhân bị cường aldosteron có đáp ứng với điều trị với glucocorticoid (GRA) là một ngoại lệ đối với quy tắc này do bệnh của họ luôn là hai bên. Một số nhóm cũng có ngoại lệ đối với những bệnh nhân trẻ hơn 35 tuổi bị adenoma một bên thể một nhân đơn độc do adenoma không hoạt động chức năng ít thường gặp hơn ở nhóm tuổi này [7,9]. Tiến hành kỹ thuật AVS cần đặt catheter các tĩnh mạch thượng thận ở cả hai bên. Có thể bắt đầu truyền liên tục cosyntropin (50 kg/giờ) trước khi đặt catheter và duy trì liên tục trong suốt thời gian thực hiện thủ thuật. Truyền kích tố thượng thận kích thích sản xuất aldosteron và cortisol, vì vậy làm giảm tác động của tình trạng dao động do tress gây nên đối với cả sản xuất aldosteron và cortisol, tránh vấn đề lấy mẫu khi adenoma sản xuất aldosteron có thể ở thời điểm không tiết hormon và tối đa hóa gradient cortisol giữa tĩnh mạch thượng thận và và tĩnh mạch chủ được sử dụng để khẳng định là đã đặt catheter thành công. Sau đó tiến hành định lượng nồng độ aldosteron và cortisol huyết tương từ mẫu máu của các tĩnh mạch thượng thận hai bên và một tĩnh mạch ngoại biên đơn lẻ. Nồng độ aldosteron thượng thận phải và trái nên được chia cho nồng độ cortisol ở bên tương ứng để điều chỉnh tác động pha loãng. Sau đó, có thể so sánh nồng độ aldosteron được điều chỉnh theo cortisol ở bên phải và bên trái. Nếu tỷ lệ chênh lệch giữa hai bên lớn hơn 4/1 chỉ dẫn có tình trạng tăng quá mức aldosteron một bên. Một tỷ lệ < 3/1 gợi ý nguồn gốc là cả hai bên. Nếu tỷ lệ trong khoảng 3/1 và 4/1 không thể kết luận được. Tỷ lệ cortisol tĩnh mạch thượng thận/tĩnh mạch ngoại biên là 10/1, khẳng định đặt thành công catheter tĩnh mạch thượng thận.
- Các thăm dò khác: Các thăm dò phụ trợ khác có thể được sử dụng trong trường hợp lấy máu tĩnh mạch thượng thận (AVS) không thành công, mặc dù không một nghiệm pháp nào trong số này đã được công nhận có giá trị. Vì vậy, nhiều thầy thuốc lâm sàng tránh sử dụng nghiệm pháp cùng nhau, thay vào đó làm lại nghiệm pháp AVS hoặc quyết định lựa chọn giữa điều trị ngoại hay nội khoa dựa trên cơ sở các bằng chứng lâm sàng hoặc thăm dò hình ảnh học. Nghiệm pháp kích thích theo tư thế (trong nghiệm pháp này xảy ra tình trạng giảm nghịch thường của PAC từ mẫu bệnh phẩm lấy ở tư thế nằm lúc 8 giờ sáng sang mẫu được lấy 4 giờ sau khi cho bệnh nhân duy trì tư thể đứng khi có sự hiện diện adenoma sản xuất aldosteron) hiếm khi được sử dụng. Chụp xạ hình thượng thận bằng chất tương tự cholesterol được đánh dấu bằng I'' và định lượng nồng độ 18-hydroxycorticosterone huyết tương hiện không còn được sử dụng ở hầu hết các trung tâm.
3 ĐIỀU TRỊ
Phẫu thuật cắt bỏ u là điều trị được lựa chọn đối với bệnh lý ở một bên. Điều trị nội khoa hay dùng thuốc là điều trị được lựa chọn đối với bệnh lý hai bên hoặc đối với bệnh nhân bị bệnh một bên nhưng không phù hợp để phẫu thuật.
3.1 Các thuốc điều trị
Spironolacton (12,5 - 400 mg/ngày dùng đường uống) là thuốc đối kháng thụ thể mineralocorticoid chính được dùng trong điều trị cường aldosteron nguyên phát. Mặc dù, các liều lên tới 400 mg/ngày đã được dùng một cách truyền thống, song các hướng dẫn điều trị gần đây gợi ý liều dùng tối đa là 100 mg [5]. Spironolacton có hiệu quả nhanh để điều chỉnh lại tình trạng hạ kali máu nhưng tác dụng chống tăng huyết áp của thuốc có thể chỉ được thấy rõ sau vài tuần điều trị. Các tác dụng phụ kháng androgen, bao gồm vú to nam giới, rối loạn cương dương, liệt dương, giảm ham muốn tình dục ở nam và rối loạn kinh nguyệt ở nữ là hạn chế tính dung nạp của thuốc.
Eplerenon (25 - 50 mg uống 2 lần/ngày) là một thuốc đối kháng thụ thể mineralocorticoid chọn lọc cao mới hơn, gần đây được phê chuẩn để điều trị tăng huyết áp cô căn. Thuốc có hiệu lực kém hơn so với spironolacton song có ít tác dụng phụ hơn do ái lực gắn cực kỳ thấp đối với cả thụ thể androgen và progesteron [10]. Cải thiện tính dung nạp khi điều trị với eplerenon cần được cân nhắc, với chi phí lớn hơn khi dùng thuốc và còn thiếu các thử nghiệm lâm sàng do đó hiện thuốc vẫn chưa được ủng hộ để sử dụng trong điều trị cường aldosteron nguyên phát.
Amlorid (5 đến 20 mg/ngày uống) và triamteren (100 - 150 mg uống 2 lần/ngày) là những lợi tiểu giữ lại kali, thuốc có tác dụng chặn kênh natri nhạy cảm với aldosteron tại ống góp. Thuốc kém hiệu quả hơn so với các thuốc đối kháng thụ thể mineralocorticoid song có thể được coi như một điều trị bổ sung thêm hoặc như một thuốc điều trị đơn độc nếu bệnh nhân kém dung nạp với các thuốc khác. Do các thuốc này không gây ngăn chặn bản thân thụ thể aldosteron, chúng không dự phòng được các tác dụng có hại của aldosteron trên hệ tim mạch. Các tác dụng phụ của thuốc bao gồm chóng mặt, mệt và buồn nôn.
Dexamethason (0,125 mg uống trước khi đi ngủ, điều chỉnh liều nếu cần) và prednisolon (2,5 mg uống trước khi đi ngủ, điều chỉnh liều nếu cần) là các glucocorticoid được chọn để điều trị cường aldosteron có đáp ứng với glucocorticoid (GRA) và thuốc tác động bằng cách ức chế một phần chế tiết ACTH bởi tuyến yên. Không nên sử dụng thuốc để điều trị cường aldosteron nguyên phát do các nguyên nhân khác. Dexamethason và prednison được ưu tiên chọn dùng hơn hydrocortison do thuốc có thời gian bán thải dài hơn, nên được cho dùng vào thời gian đi ngủ để ức chế tình trạng tăng tiết ACTH vào sáng sớm. Nên dùng thuốc với liều thấp nhất có hiệu quả để hạn chế nguy cơ bị hội chứng Cushing do thuốc. Điều trị bằng glucocorticoid đơn độc có thể không đủ để làm bình thường hóa huyết áp và có thể cần phối hợp thêm thuốc đối kháng thụ thể mineralocorticoid.
Có thể cần dùng các thuốc điều trị tăng huyết áp khác kết hợp với thuốc đối kháng thụ thể mineralocorticoid nếu vẫn không kiểm soát được huyết áp của bệnh nhân.
3.2 Điều trị ngoại khoa
Cắt bỏ hoàn toàn tuyến thượng thận qua nội soi do một phẫu thuật viên có kinh nghiệm là điều trị được chọn đối với bệnh lý ở một bên, do can thiệp này có thể giúp loại bỏ nhu cầu cần dùng thuốc điều trị tăng huyết áp, giảm số lượng thuốc điều trị tăng huyết áp cần dùng và điều chỉnh lại tình trạng tăng sản xuất quá mức aldosteron nội sinh. Cắt bỏ tuyến thượng thận bằng nội soi giúp bệnh nhân có thời gian cần nằm viện ngắn hơn và tỷ lệ biến chứng thấp hơn so với can thiệp kiểu phẫu thuật mở kinh điển. Không nên tiến hành phẫu thuật cắt bỏ một phần tuyến thượng thận do AVS không thể xác định được là liệu adenoma sản xuất aldosteron (APA) đơn độc hoặc tăng sản thượng thận một bên có phải là nguyên nhân của tăng aldosteron quá mức hay không.
Đích xử trí trước mổ là kiểm soát huyết áp tốt và điều chỉnh tình trạng hạ kali máu. Thông thường, một thuốc đối kháng thụ thể aldosteron được khuyến cáo sử dụng trước khi phẫu thuật.
Xử trí sau mổ có thể được hướng dẫn bằng nồng độ aldosteron huyết tương (PAC) nên định lượng nồng độ này để khẳng định kết quả điều trị ngay sau mổ. Nên theo dõi nồng độ kali huyết thanh, do tình trạng hạ kali máu được điều chỉnh nhanh chóng sau phẫu thuật cắt tuyến thượng thận và nên ngừng điều trị bổ sung kali. Cũng nên ngừng dùng thuốc đối kháng mineralocorticoid và giảm liều thuốc điều trị tăng huyết áp nếu bệnh nhân dung nạp dựa trên chỉ số huyết áp. Huyết áp thường sẽ cải thiện tối đa trong vòng 6 tháng đầu sau mổ nhưng huyết áp có thể tiếp tục giảm đến 1 năm sau mổ [5]. Do sản xuất aldosteron ở tuyến thượng thận còn lại có thể bị ức chế lúc ban đầu, chế độ ăn giàu natri và theo dõi nồng độ kali huyết thanh hằng tuần được khuyến cáo trong tháng đầu tiên sau phẫu thuật.
4 CÁC BIẾN CHỨNG
Các nghiên cứu đã chỉ ra rằng phơi nhiễm trong thời gian dài với tình trạng tăng quá mức aldosteron có thể dẫn tới tổn thương cấu trúc của cả hệ thống tim mạch [11-13] và thận [14,15] mà tình trạng tổn thương này độc lập với huyết áp của bệnh nhân. Bệnh nhân bị cường aldosteron nguyên phát không những bị tăng nguy cơ đối với các cơ quan đích như phì đại thất trái [16] và rối loạn chức năng tâm trương [17], song họ cũng có thể bị tăng nguy cơ có các sự cố tim mạch [18] khi so sánh với bệnh nhân bị tăng huyết áp vô căn. Aldosteron cũng đã bị cho rằng gây ra rối loạn chức năng nội mô [19] và cứng thành động mạch [20]. Độ lọc cầu thận và bài xuất Albumin niệu đều cao hơn ở bệnh nhân bị cường aldosteron nguyên phát so với các bệnh nhân bị tăng huyết áp vô căn, theo dõi lâu dài các bệnh nhân này gợi ý rằng các thông số nói trên có thể trở lại giá trị bình thường nhờ điều trị thích hợp đối với tình trạng dư thừa aldosteron [21,22].
5 KẾT CỤC VÀ TIÊN LƯỢNG
Mặc dù huyết áp sẽ cải thiện và nồng độ kali huyết thanh trở lại bình thường ở hầu hết bệnh nhân bị cường aldosteron nguyên phát được điều trị bằng ngoại khoa, song có tình trạng tăng huyết áp vô căn tồn tại từ trước, tổn thương cơ quan đích, các thay đổi trong trương lực mạch máu hoặc xơ cứng cầu thận có thể góp phần vào tăng huyết áp sau mổ, tình trạng này tiếp tục tiếp diễn ở khoảng 40 - 70% các bệnh nhân mặc dù tình trạng cường aldosteron đã được giải quyết hoàn toàn [23-25].
Các yếu tố dự kiến tăng cơ may điều trị triệt để bằng bằng phẫu thuật bao gồm: có adenoma sản xuất aldosteron (APA); đáp ứng trước mổ với spironolacton; giới nữ; tuổi trẻ hơn (< 44 tuổi); thời gian bị tăng huyết áp ngắn hơn (< 5 năm); sử dụng trước mổ ít thuốc điều trị tăng huyết áp hơn (≤ 2 thuốc); ARR trước mổ cao hơn; tiền sử gia đình bị tăng huyết áp chỉ gặp ở các người thân thuộc thế hệ F1 của bệnh nhân [24-26].
Hiện chưa có thông tin về tỷ lệ tàn phế và/hoặc tử vong của các thử nghiệm lâm sàng liên quan với điều trị tình trạng tăng qua mức aldosteron trong cường aldosteron nguyên phát.
6 TÀI LIỆU THAM KHẢO
1. Mulatero P, Stowasser M, Loh KC, et al. Increased diagnosis of primary aldosteronism, including surgically correctable forms, in centers from five continents. J Clin Endocrinol Metab 2004;89(3):1045-1050.
2. Monticone S, Burrello J, Tizzani D, et al. Prevalence and clinical manifestation of primary aldoste- ronism encountered in primary care practice. J Am Coll Cardi- ol 2017;69(14):1811-1820.
3. Kono T, Ikeda F, Oseko F, Imura H, Tanimura H. Normotensive primary aldosteronism: report of a case. J Clin Endocrinol Me- tab 1981;52(5):1009-1013.
4. Rossi GP, Bernini G, Caliumi C, et al. A prospective study of the prevalence of primary aldosteronism in 1,125 hypertensive patients. J Am Coll Cardiol 2006;48(11):2293-2300.
5. Funder JW, Carey RM, Mantero F, et al. Case detection, diagno- sis, and điều trị of patients with primary aldosteronism: an en- docrine society clinical practice guideline. J Clin Endocrinol Me- tab 2016;101(5):1889-1916.
6. Weinberger MH, Fineberg NS. The diagnosis of primary al- dosteronism and separation of two major subtypes. Arch Intern Med 1993;153(18):2125-2129.
7. Young WF, Stanson AW, Thompson GB, Grant CS, Far- ley DR, van Heerden JA. Role for adrenal venous sampling in primary aldosteronism. Sur- gery 2004;136(6):1227–1235.
8. Nwariaku FE, Miller BS, Auchus R, et al. Primary hyperaldoste- ronism: effect of adrenal vein sampling on surgical outcome. Arch Surg 2006;141(5):497–502; discussion 502-503.
9. Tan YY, Ogilvie JB, Triponez F, et al. Selective use of adrenal venous sampling in the lateralization of aldosterone-producing adeno- mas. World J Surg 2006;30(5):879- 885; discussion 886-887.
10. Parthasarathy HK, Ménard J, White WB, et al. A double-blind, randomized study comparing the antihypertensive effect of eplere- none and Spironolactone in patients with hypertension and evidence of primary aldosteronism. J Hyper- tens 2011;29:980-990.
11. Rocha R, Funder JW. The patho- physiology of aldosterone in the cardiovascular system. Ann N Y Acad Sci 2002;970:89-100.
12. Savard S, Amar L, Plouin PF, Steichen O. Cardiovascular com- plications associated with pri- mary aldosteronism: a controlled crosssectional study. Hyperten- sion 2013;62:331–336.
13. Mulatero P, Monticone S, Bertello C, et al. Long-term cardio- and cere- brovascular events in patients with primary aldosteronism. J Clin Endo- crinol Metab 2013;98:4826-4833.
14. Greene EL, Kren S, Hostetter TH. Role of aldosterone in the remnant kidney model in the rat. J Clin Invest 1996;98(4):1063–1068.
15. Hollenberg NK. Aldosterone in the development and pro- gression of renal injury. Kidney Int 2004;66(1):1–9.
16. Rossi GP, Sacchetto A, Vis- entin P, et al. Changes in left ventricular anatomy and func- tion in hypertension and pri- mary aldosteronism. Hyperten- sion 1996;27(5):1039–1045.
17. Rossi GP, Sacchetto A, Pavan E, et al. Remodeling of the left ventricle in primary aldosteronism due to Conn's adenoma. Circula- tion 1997;95(6):1471-1478.
18. Milliez P, Girerd X, Plouin PF, Blacher J, Safar ME, Mourad JJ. Ev- idence for an increased rate of car- diovascular events in patients with primary aldosteronism. J Am Coll Cardiol 2005;45(8):1243-1248.
19. Taddei S, Virdis A, Mattei P, Salvetti A. Vasodilation to acetylcholine in primary and secondary forms of human hypertension. Hyperten- sion 1993;21(6 Pt 2):929–933.
20. Blacher J, Amah G, Girerd X, et al. Association between increased plasma levels of aldosterone and decreased systemic arterial com- pliance in subjects with essen- tial hypertension. Am J Hyper- tens 1997;10(12 Pt 1):1326-1334.
21. Sechi LA, Novello M, Lapenna R, et al. Long-term renal outcomes in patients with primary aldostero- nism. JAMA 2006;295(22):2638- 2645.
22. Catena C, Colussi G, Nadalini E, et al. Cardiovascular outcomes in patients with primary aldostero- nism after điều trị . Arch Intern Med 2008;168:80-85.
23. Meyer A, Brabant G, Beh- rend M. Long-term follow-up after adrenalectomy for pri- mary aldosteronism. World J Surg 2005;29(2):155–159.
24. Celen O, O'Brien MJ, Melby JC, Beazley RM. Factors influ- encing outcome of surgery for primary aldosteronism. Arch Surg 1996;131(6):646–650.
25. Sawka AM, Young WF, Thomp- son GB, et al. Primary aldoste- ronism: factors associated with normalization of blood pres- sure after surgery. Ann Intern Med 2001;135(4):258–261.
26. Williams TA, Lenders JW, Mulatero P, et al. Outcomes after adrenalec- tomy for unilateral primary aldoste- ronism: an international consensus on outcome measures and analysis of remission rates in an international cohort. Lancet Diabetes Endocri- nol 2017;5(9):689–699.

