Chiến lược an thần ở trẻ em mắc hội chứng nguy kịch hô hấp cấp tính (PARDS)

Bản dịch của Bác sĩ Đặng Thanh Tuấn - Bệnh viện Nhi Đồng 1
Tải PDF bản dịch TẠI ĐÂY
1 Tóm tắt
Trong bài đánh giá này, chúng tôi thảo luận về bối cảnh thay đổi của việc an thần ở trẻ em thở máy mắc hội chứng suy hô hấp cấp ở trẻ em (PARDS). Trong khi các phương pháp tiếp cận trước đây ủng hộ việc an thần sớm và sâu bằng benzodiazepine, các tài liệu mới nổi đã nêu bật những lợi ích của việc an thần nhẹ và sử dụng các tác nhân an thần không phải benzodiazepine, chẳng hạn như dexmedetomidine. Các nghiên cứu gần đây đã nhấn mạnh tầm quan trọng của việc theo dõi nhiều yếu tố bao gồm nhưng không giới hạn ở mức độ an thần, hiệu quả giảm đau, cai thuốc phiện và sự phát triển của trạng thái mê sảng. Thông qua phương pháp tiếp cận này, chúng tôi hy vọng sẽ cải thiện kết quả PARDS. Nhìn chung, cần có nhiều nghiên cứu hơn để hiểu sâu hơn về các chiến lược an thần tốt nhất ở trẻ em mắc PARDS.
2 Giới thiệu
Hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome - ARDS) lần đầu tiên được mô tả ở người lớn vào năm 1967 (1). Định nghĩa ARDS kể từ đó đã được sửa đổi thành hội chứng hiện tại được đặc trưng bởi Tiêu chuẩn Berlin (2). Theo truyền thống, các bác sĩ chuyên khoa nhi chỉ giới hạn sử dụng các tiêu chuẩn và hướng dẫn dành cho người lớn này trong việc chăm sóc bệnh nhân của họ. Vào năm 2015, hội chứng nguy kịch hô hấp cấp tính ở trẻ em (pediatric ARDS - PARDS) đã được các thành viên của Hội nghị đồng thuận về tổn thương phổi cấp tính ở trẻ em (Pediatric Acute Lung Injury Consensus Conference - PALICC) chính thức định nghĩa là tình trạng thiếu oxy máu và những thay đổi trên phim chụp X-quang trong bối cảnh thâm nhiễm phổi mới xảy ra trong vòng bảy ngày sau một tổn thương đã biết (3). Tổn thương này xảy ra với những thay đổi về mô học bao gồm thâm nhiễm các dấu hiệu viêm, phù phế nang và phá vỡ các hàng rào mao mạch phế nang (4). Khi sự công nhận PARDS là một thực thể lâm sàng ngày càng tăng, thì nghiên cứu cũng vậy (5). Trong khi phần lớn tài liệu về an thần và chăm sóc bệnh nhân thở máy vẫn tập trung vào người lớn, thì có một lượng lớn tài liệu mới nổi trong thế giới nhi khoa.
Trước đây, chiến lược an thần chính ở người lớn thở máy mắc ARDS là an thần sâu trong vòng 48 giờ đầu sau khi đặt nội khí quản. Phương pháp an thần-gây ngủ này được cho là tối ưu để kiểm soát cả cơn đau và di chứng tâm lý của thở máy (6, 7). Tuy nhiên, vào năm 2012, nhiều bài đánh giá đã xuất hiện, tổng hợp dữ liệu cho thấy lợi ích của phương pháp an thần-giảm đau (8, 9). Trong Hướng dẫn thực hành lâm sàng cho khoa chăm sóc tích cực (ICU) dành cho người lớn năm 2013, Barr và cộng sự khuyến nghị mức độ an thần mục tiêu nhẹ với phương pháp an thần trước tiên là giảm đau, vì ngày càng có nhiều tài liệu từ các khoa ICU dành cho người lớn chứng minh các kết quả tiêu cực liên quan đến an thần sâu (10 - 12). Bài đánh giá này sẽ tập trung vào các chiến lược an thần tối ưu cho trẻ em thở máy. Do mối quan hệ chặt chẽ giữa an thần và giảm đau, liệt cơ, vận động và mê sảng, chúng tôi sẽ thảo luận ngắn gọn về những cân nhắc quan trọng khác này.
3 An thần
3.1 Độ sâu của thuốc an thần
Trước đây, các bác sĩ lâm sàng ủng hộ việc an thần sâu sớm ở những bệnh nhân thở máy vì người ta cho rằng nó cải thiện tình trạng oxygen hóa, giảm đau và giảm thiểu nhận thức tiêu cực về trải nghiệm (6, 13). Tuy nhiên, khi ngày càng có nhiều tài liệu xuất hiện, một sự chuyển dịch sang phương pháp tiếp cận "ít hơn nhiều " đã bắt đầu. Vào năm 2013, các hướng dẫn dành cho người lớn cho rằng an thần nhẹ có thể liên quan đến việc cải thiện kết quả mà không làm tăng di chứng tiêu cực của tình trạng căng thẳng sinh lý gia tăng (12). Nhóm Hội nghị đồng thuận về tổn thương phổi cấp tính ở trẻ em kể từ đó đã nhất trí, khuyến nghị "an thần tối thiểu nhưng có mục tiêu hiệu quả" với "theo dõi, điều chỉnh và cai thuốc" liên tục (14, 15). Những mục tiêu này đã được nhắc lại trong các hướng dẫn dành cho người lớn được đưa ra vào năm 2018 (16). Cả hai nhóm đều mô tả phương pháp tiếp cận "giảm đau-an thần", trước tiên sử dụng thuốc giảm đau và chỉ thêm thuốc an thần khi cần thiết (14, 16).
Các nghiên cứu đã chỉ ra lợi ích sống còn liên quan đến an thần nhẹ trong ARDS. Một nghiên cứu đoàn hệ tiến cứu đa trung tâm năm 2014 trên 45 khoa ICU dành cho người lớn đã ghi danh 322 bệnh nhân được thở máy và an thần. Kết quả cho thấy tỷ lệ tử vong trong bệnh viện tăng lên khi an thần sâu (OR 2,36; 95% CI: 1,31 đến 4,25), với nhiều ngày thở máy hơn (7 so với 5 ngày, P = 0,041) và nhiều ca mở khí quản được thực hiện hơn (38,9% so với 22%, P = 0,001) trong nhóm được an thần sâu (10). Điều này phù hợp với các phát hiện từ một nghiên cứu đoàn hệ theo chiều dọc đa trung tâm gần đây trên 42 khoa ICU trên toàn thế giới để đánh giá tỷ lệ sống sót sau 180 ngày ở 703 người lớn được thở máy. Kết quả cho thấy mối quan hệ phụ thuộc liều lượng rõ rệt giữa cường độ an thần và nguy cơ tử vong tăng (HR 1,29, 95% CI: 1,15 đến 1,46; P <0,001), tỷ lệ mê sảng tăng (HR 1,25, 95% CI: 1,10 đến 1,43; P = 0,001) và khả năng rút nội khí quản sớm giảm (HR 0,80, 95% CI: 0,73 đến 0,87; P <0,001) (17). Một đánh giá có hệ thống và phân tích tổng hợp năm 2018 đã xem xét các tài liệu về kết quả của an thần sâu sớm ở người lớn bệnh nặng. An thần nhẹ có liên quan đến việc cải thiện kết quả, bao gồm giảm số ngày thở máy (chênh lệch trung bình -2,1, 95% CI: -3,6 đến -0,5; P = 0,008) và giảm số ngày nằm ICU (chênh lệch trung bình -3,0, 95% CI: -5,4 đến -0,6; P = 0,02). Nhìn chung, họ thấy tỷ lệ tử vong thấp hơn khi dùng an thần nhẹ so với an thần sâu (OR 0,34, 95% CI: 0,21 đến 0,54; P < 0,001). Các kết quả gộp luôn chỉ ra kết quả được cải thiện với an thần nhẹ hơn (18).
3.2 Thời điểm an thần
Trong một nghiên cứu theo dõi dọc đa trung tâm năm 2012 ở 25 khoa ICU dành cho người lớn, Shehabi và cộng sự đã khám phá tác động của thuốc an thần sớm đối với kết quả điều trị của bệnh nhân. Họ định nghĩa “sớm” là thuốc an thần trong vòng bốn giờ sau khi bắt đầu thở máy. Vì hầu hết các thử nghiệm có đối chứng ngẫu nhiên đều ngẫu nhiên hóa sau khoảng thời gian bốn giờ, nên khung thời gian này thường không được ghi lại. Kết quả của họ cho thấy thuốc an thần sâu sớm vừa làm chậm quá trình rút nội khí quản vừa làm tăng tỷ lệ tử vong nói chung. Trong nghiên cứu của họ, mỗi đánh giá Thang an thần kích động Richmond (RASS) chỉ ra an thần sâu đóng vai trò là yếu tố dự báo việc rút nội khí quản chậm trễ (HR 0,90, 95% CI: 0,87 đến 0,94, P < 0,001), tử vong trong bệnh viện (HR 1,11, 95% CI: 1,02 đến 1,20; P = 0,01) và tử vong sau 6 tháng (HR 1,08, 95% CI: 1,01 đến 1,16; P = 0,026) (11).
3.3 Đường dùng
Việc sử dụng cả thuốc an thần và thuốc giảm đau có thể thông qua truyền liên tục hoặc liều ngắt quãng. Những lợi thế lý thuyết của truyền liên tục bao gồm khả năng chuẩn độ, giảm nguy cơ nhiễm trùng và duy trì nồng độ ở trạng thái ổn định. Thật không may, truyền liên tục cũng làm tăng nguy cơ quá liều an thần và dung nạp (19, 20). Mặc dù vậy, một cuộc khảo sát năm 2014 về các khoa chăm sóc đặc biệt nhi khoa cho thấy tỷ lệ sử dụng truyền liên tục để dùng thuốc an thần cao hơn đáng kể ở nhóm trẻ em thở máy so với liều ngắt quãng (20). Cần nghiên cứu thêm để xác định lợi ích của truyền thuốc an thần ngắt quãng so với liên tục trong PARDS.
3.4 Ngưng an thần hàng ngày (DSI)
DSI (daily sedation interruption) là phương pháp ngừng thuốc an thần một lần mỗi ngày để bệnh nhân có thể "thức tỉnh"; sau đó thuốc an thần được tiếp tục. Về mặt lý thuyết, điều này có thể giảm thiểu tình trạng an thần quá mức và cải thiện kết quả điều trị cho bệnh nhân (21). Mặc dù DSI được sử dụng rộng rãi trong nhóm bệnh nhân ICU người lớn, nhưng nó không phải là không có nhược điểm. Mặc dù ban đầu nó được đề xuất để giảm thiểu các tác dụng an thần tiêu cực, một thử nghiệm có đối chứng ngẫu nhiên vào năm 2012 cho thấy rằng, khi so sánh với thuốc an thần theo phác đồ, không có sự khác biệt về thời gian thở máy hoặc thời gian nằm ICU giữa DSI và không DSI ở người lớn (22). Hơn nữa, nghiên cứu cho thấy có thể có nhiều thay đổi về huyết động hơn ở trẻ em khi được đánh thức sau khi dùng thuốc an thần, do đó DSI phải được sử dụng thận trọng (tuy nhiên, xin lưu ý rằng không có sự gia tăng tình trạng rút nội khí quản vô tình liên quan đến DSI) (23). Một thử nghiệm nhi khoa ngẫu nhiên có đối chứng mang tính bước ngoặt đã phát hiện ra rằng DSI không ảnh hưởng đến số ngày không thở máy, thời gian an thần hoặc tổng liều thuốc an thần, nhưng đã làm tăng tỷ lệ tử vong chung và các đợt kích động ở trẻ em mắc bệnh nặng (24). Năm 2014, Kudchadkar và cộng sự cho rằng việc dùng thuốc an thần ngắt quãng thực sự có thể phủ nhận nhu cầu gián đoạn an thần đồng thời cũng làm giảm mức độ tiếp xúc với thuốc an thần (20, 21). Nhìn chung, bằng chứng nhi khoa hiện tại cho thấy mạnh mẽ rằng phương pháp thực hành tốt nhất có thể ưu tiên cách tiếp cận an thần nhẹ nhàng trong suốt quá trình thở máy của trẻ (thay vì an thần sâu hơn với sự gián đoạn hàng ngày) (24 - 26).
3.5 An thần theo phác đồ
Các giao thức an thần đã được thảo luận rộng rãi trong các tài liệu gần đây. Ở nhóm người lớn, Devlin và cộng sự ủng hộ các chiến lược theo giao thức điều dưỡng để cố gắng đạt được mức độ an thần nhẹ, nhưng điều này vẫn đang được tranh luận ở trẻ em (16). Năm 2011, Deeter và cộng sự đã triển khai thành công một giao thức an thần trong khoa chăm sóc tích cực nhi khoa (PICU) cho phép giảm sử dụng benzodiazepine và opioid (26). Tuy nhiên, trong một cuộc khảo sát năm 2014, chỉ có 27% bác sĩ chuyên khoa nhi sử dụng thuật toán điều trị khi làm việc với bệnh nhân được an thần và 52% trong số các giao thức đó do bác sĩ chỉ đạo thay vì do điều dưỡng chỉ đạo (20). Hiệu quả của chính phương pháp an thần theo giao thức ở trẻ em vẫn chưa chắc chắn. Năm 2015, Curley và cộng sự đã tiến hành một thử nghiệm lâm sàng ngẫu nhiên để đánh giá hiệu quả của thuốc an thần theo phác đồ (sử dụng thuật toán an thần dựa trên benzodiazepine) ở bệnh nhân nhi và không thấy sự khác biệt về số ngày thở máy, và thấy rằng bệnh nhân theo phác đồ an thần có nhiều ngày hơn với điểm số đau và kích động cao hơn. Lưu ý, có những kết quả thứ cấp có khả năng có lợi; bệnh nhân theo phác đồ an thần trong nghiên cứu này có ít ngày sử dụng opioid đồng thời hơn, nhìn chung ít tiếp xúc với nhóm thuốc an thần hơn, tăng thời gian tỉnh táo trong khi đặt nội khí quản và ít loét do tì đè hơn (6). Ngược lại, hai nghiên cứu PICU đơn trung tâm cho thấy lợi ích lâm sàng đối với thuốc an thần theo phác đồ do điều dưỡng chỉ đạo—điều đáng chú ý là cả hai nghiên cứu này đều sử dụng phương pháp an thần tiết kiệm benzodiazepine và nhắm mục tiêu vào mức độ an thần nhẹ (25, 26). Cần nghiên cứu thêm để đánh giá hiệu quả của thuốc giảm đau-an thần theo phác đồ ở nhóm bệnh nhân nhi.
3.6 Lựa chọn thuốc an thần
Trước đây, benzodiazepine là nhóm thuốc an thần phổ biến nhất được sử dụng cho trẻ em thở máy. Năm 2014, Kudchadkar và cộng sự phát hiện ra sự không đồng nhất đáng kể trong việc lựa chọn thuốc an thần ở các khoa ICU nhi khoa, với phần lớn sử dụng Midazolam để an thần, phổ biến nhất là thông qua truyền liên tục. Vào thời điểm đó, nhiều bệnh viện hạn chế sử dụng dexmedetomidine và ít hơn 1% số người được hỏi báo cáo chỉ sử dụng dexmedetomidine để an thần (20). Tuy nhiên, tài liệu nhi khoa mới nổi cho thấy lợi ích của việc sử dụng chất chủ vận α2, bao gồm mối liên quan với việc giảm sử dụng opioid và benzodiazepine, và cải thiện kết quả ở khoa ICU nhi khoa (27 - 31). Ở đây, chúng tôi sẽ thảo luận về những lợi ích và hạn chế có thể có của dexmedetomidine so với benzodiazepine.
3.6.1 Dexmedetomidine
Tài liệu gần đây cho thấy nhiều lợi ích có thể có của dexmedetomidine và các chất chủ vận α2 khác. Trong một thử nghiệm lâm sàng ngẫu nhiên vào năm 2009, Riker và cộng sự đã tìm thấy sự giảm đáng kể các kết quả tiêu cực như thời gian thở máy và tỷ lệ mê sảng (32). Trong một thử nghiệm có đối chứng ngẫu nhiên mang tính bước ngoặt, Pandharipande và cộng sự đã so sánh dexmedetomidine với lorazepam ở những người lớn bị bệnh nặng và nhiều kết quả đều ủng hộ việc sử dụng chất chủ vận α2. Nghiên cứu này cho thấy dexmedetomidine dễ kiểm soát hơn đáng kể trong việc đạt được mục tiêu an thần và có liên quan đến tỷ lệ mê sảng thấp hơn. Cũng có xu hướng giảm tỷ lệ tử vong khi so sánh dexmedetomidine với lorazepam (33). Tính dễ kiểm soát an thần đã được xác nhận thêm vào năm 2014 khi Tanaka và cộng sự cho thấy việc sử dụng dexmedetomidine riêng lẻ không có khả năng dẫn đến tình trạng an thần quá mức, khi so sánh với việc sử dụng midazolam và Fentanyl (10). Ngoài ra, hồ sơ giấc ngủ của dexmedetomidine đã được chứng minh là vượt trội hơn các thuốc giảm đau an thần khác, với việc duy trì giấc ngủ giai đoạn II trong nhóm nhi khoa (34). Cuối cùng, nhiều nghiên cứu cũng đã báo cáo về tác dụng tiết kiệm thuốc phiện của dexmedetomidine, với việc giảm tiêu thụ opioid khi được dùng đồng thời với thuốc chủ vận α2 (27 - 31).
Các tác dụng phụ có thể xảy ra liên quan đến dexmedetomidine đã được ghi nhận trong các báo cáo ca bệnh, bao gồm suy tuyến thượng thận và hội chứng ngừng thuốc cấp tính. Nhịp tim nhanh, tăng huyết áp và cai thuốc là những tác dụng phụ thường được báo cáo, mặc dù nhìn chung không có ý nghĩa lâm sàng (31, 35 - 37). Một rào cản đáng kể khác đối với việc sử dụng dexmedetomidine là chi phí; tuy nhiên, điều quan trọng cần lưu ý là cải thiện kết quả PICU như giảm thời gian nằm viện và giảm tỷ lệ mê sảng có thể dẫn đến tiết kiệm chi phí đáng kể khi sử dụng dexmedetomidine làm thuốc an thần hàng đầu (33, 38).
Thiếu bằng chứng nhi khoa
Do dexmedetomidine chỉ mới được chấp nhận sử dụng cho trẻ em thở máy gần đây nên nghiên cứu lâm sàng được công bố cho đến nay còn hạn chế. Năm 2007, Tobias và cộng sự đã tiến hành đánh giá tài liệu và phát hiện ra rằng dexmedetomidine đã được sử dụng trên một số lượng lớn bệnh nhi với tác dụng an thần và giảm đau tích cực và tác dụng tiêu cực hạn chế (39). Một nghiên cứu hồi cứu tại một trung tâm từ năm 2014 bao gồm 98 trẻ em và cho thấy không có tác dụng huyết động đáng kể nào có thể hạn chế việc sử dụng lâu dài trong PICU (31). Phân tích thứ cấp dữ liệu từ một thử nghiệm hiệu chỉnh liều an thần cho thấy thời gian đạt mức an thần mục tiêu tăng lên khi sử dụng dexmedetomidine (28% đến 50%) và phơi nhiễm thuốc phiện tích lũy giảm xuống (40). Hayden và cộng sự đã tiến hành đánh giá vào năm 2016 để tổng hợp tất cả các tài liệu về hiệu quả của chất chủ vận α2 trong an thần nhi khoa. Những phát hiện này không rõ ràng vì sự thiếu hụt nghiên cứu trong lĩnh vực này dẫn đến thiếu sức mạnh cần thiết để đưa ra kết luận thống kê (41).
Nghiên cứu SLEEPS (Hồ sơ an toàn, Hiệu quả và Tương đương trong nghiên cứu An thần chăm sóc tích cực nhi khoa) đã tuyển dụng 129 trẻ em tại mười PICU trên khắp nước Anh và so sánh clonidine tiêm tĩnh mạch với midazolam để an thần ở trẻ em thở máy xâm lấn. Mặc dù không đủ mạnh, nghiên cứu này đã có thể chứng minh clonidine không kém hơn (42). Do đó, trong khi kết quả sử dụng chất chủ vận alpha ở người lớn và trẻ em có vẻ khả quan, vẫn cần nhiều nghiên cứu hơn để xác định tác động đến kết quả ở trẻ em.
3.6.2 Benzodiazepine
Mặc dù được sử dụng rộng rãi ở người lớn và trẻ em trong quá khứ, benzodiazepine vẫn có liên quan đến một số tác dụng phụ tiêu cực. Vào tháng 12 năm 2016, Cục Quản lý Thực phẩm và Dược phẩm Liên bang (FDA) đã ban hành cảnh báo về việc sử dụng các thuốc an thần cụ thể ở trẻ em dưới ba tuổi, bao gồm lorazepam và midazolam, với một cảnh báo hộp đen mới (43). Cảnh báo này dựa trên nhiều nghiên cứu trên động vật và trên người đã chứng minh tình trạng mất tế bào thần kinh và ảnh hưởng đến kết quả nhận thức lâu dài (44 - 49). Tuy nhiên, nhiều chuyên gia tin rằng thông báo này của FDA là quá sớm; một quan điểm trên Tạp chí Y học New England đã nêu chi tiết bằng chứng từ cảnh báo của FDA là không đầy đủ và nhiều nghiên cứu lâm sàng có liên quan đang được tiến hành tại thời điểm ban hành (50).
Để ủng hộ cảnh báo của FDA, ngày càng có nhiều bằng chứng lâm sàng ủng hộ việc tránh dùng benzodiazepine trong bối cảnh PICU. Benzodiazepine đã được chứng minh là thường đạt được tác dụng an thần sâu hơn mục tiêu ban đầu (khi so sánh với dexmedetomidine) và tác dụng an thần sâu có liên quan đến kết quả kém (33). Một nghiên cứu theo dõi tiến cứu năm 2012 lưu ý rằng việc tiếp xúc với midazolam có liên quan đến việc rút nội khí quản chậm (11). Việc tiếp xúc với benzodiazepine cũng có liên quan đến khả năng xuất viện ICU thấp hơn ở trẻ em (51). Một vấn đề khác với benzodiazepine là tác dụng của chúng đối với giấc ngủ, làm giảm REM và giấc ngủ sóng chậm (20, 52 - 54).
Riêng trong thế giới nhi khoa, các nghiên cứu gần đây đã làm sáng tỏ mối quan hệ giữa việc sử dụng benzodiazepine và sự phát triển của chứng mê sảng. Trong một nghiên cứu theo dõi dọc có tiến cứu, việc sử dụng benzodiazepine là một yếu tố dự báo độc lập về sự phát triển của chứng mê sảng ở 1.547 trẻ em bị bệnh nặng (OR điều chỉnh 5,2, 95% CI: 3,7 đến 7,5; P <0,001) (55). Một nghiên cứu theo dõi đánh giá tỷ lệ mắc chứng mê sảng và các yếu tố nguy cơ ở 319 bệnh nhân ung thư nhi nhập viện đã phát hiện ra rằng việc sử dụng benzodiazepine có liên quan đến việc tăng gần gấp bốn lần nguy cơ mê sảng (OR 3,71; P <0,001) (56). Một nghiên cứu về tỷ lệ lưu hành điểm quốc tế đánh giá các yếu tố nguy cơ gây mê sảng ở 994 bệnh nhi cũng cho thấy việc sử dụng benzodiazepine là một yếu tố nguy cơ độc lập đối với sự phát triển của mê sảng (OR điều chỉnh 2,2, 95% CI: 1,5 đến 3,3; P <0,001) (57). Mody và cộng sự đã đưa mối liên quan này lên một bước nữa khi họ xác định mối quan hệ thời gian và phản ứng liều giữa việc sử dụng benzodiazepine và sự phát triển của mê sảng, trích dẫn mức tăng 43% nguy cơ mắc mê sảng tiếp theo cho mỗi một logarit tăng trong việc sử dụng benzodiazepine (58). Alvarez và cộng sự đã thiết lập thêm mối quan hệ này là có ý nghĩa trong một nghiên cứu quan sát tại khoa chăm sóc tích cực tim nhi (CICU) (59).
3.7 Theo dõi an thần
Khi làm việc với bệnh nhân được dùng thuốc an thần, điều cực kỳ quan trọng là phải xác định mức độ an thần mục tiêu và có thể theo dõi mức độ an thần thường xuyên (Hình 1). Trong các hướng dẫn lâm sàng dành cho người lớn, Thang điểm kích động-an thần Richmond (Richmond Agitation-Sedation Scale - RASS) và Thang điểm kích động-an thần (Sedation-Agitation Scale - SAS) được coi là những công cụ hợp lệ và đáng tin cậy nhất để theo dõi mức độ an thần ở bệnh nhân bệnh nặng (12). Thật không may, khi được khảo sát vào năm 2014, chỉ có 42% bác sĩ chuyên khoa nhi báo cáo thường xuyên sử dụng cơ chế chấm điểm an thần trong PICU của họ (20). Kể từ thời điểm đó, RASS đã được xác nhận để sử dụng trong nhóm bệnh nhi, cung cấp một cách nhanh chóng và dễ dàng để theo dõi mức độ an thần ở tất cả bệnh nhân PICU (60). Không có dữ liệu nào kể từ thời điểm đó về tần suất của các giao thức chấm điểm an thần, nhưng với sự thay đổi trong mô hình theo hướng an thần nhẹ, bài đánh giá này sẽ thúc đẩy việc sử dụng theo dõi để đảm bảo đạt được mức mong muốn. Điều này phù hợp với khuyến nghị của ESPNIC về việc sử dụng các công cụ đánh giá an thần đã được xác nhận ở trẻ em bệnh nặng để tránh kết quả tiêu cực (61).
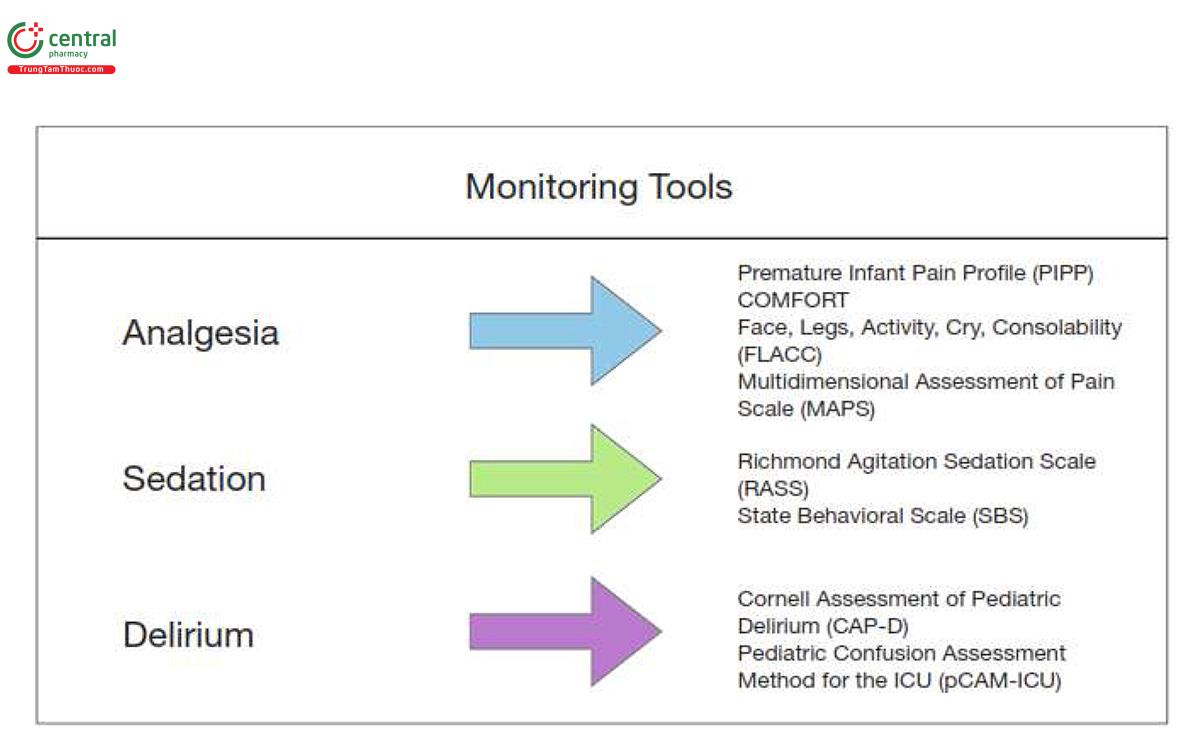
4 Giảm đau
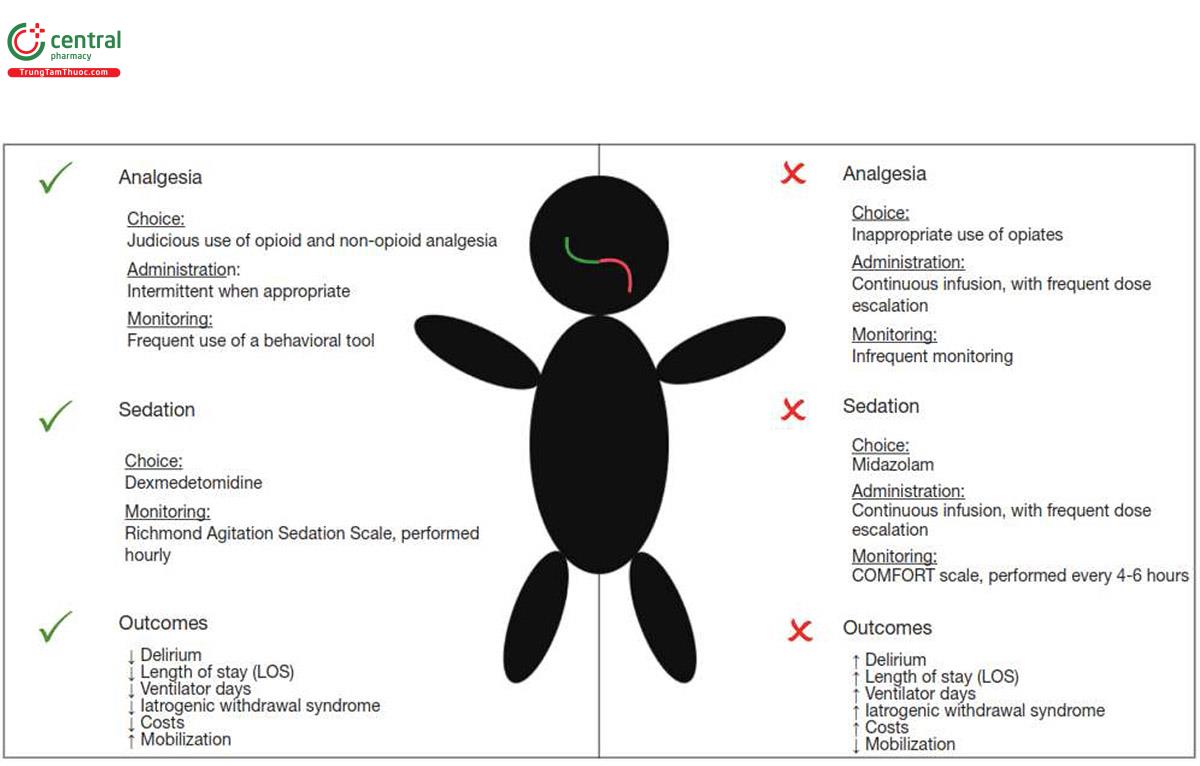
Giảm đau là một thành phần cực kỳ quan trọng của việc an thần thành công và kết quả tích cực tại ICU (23). Các nghiên cứu gần đây cho thấy rằng cơn đau không được nhận biết và điều trị đầy đủ trong các cơ sở ICU (62). Việc kiểm soát cơn đau cấp tính rất quan trọng, vì sự chậm trễ trong việc giảm đau sau này có thể chuyển thành đau mãn tính và gây ra di chứng tâm lý đáng kể như lo lắng và rối loạn căng thẳng sau chấn thương (post-traumatic stress disorder - PTSD) (63, 64). Người ta đã lưu ý rằng việc an thần quá mức có thể dẫn đến việc nhận biết không đầy đủ cơn đau, với sự chậm trễ trong việc điều trị dẫn đến việc kiểm soát cơn đau không tối ưu (62). Với phương pháp an thần-giảm đau, bệnh nhân sẽ tỉnh táo hơn. Với ít thuốc an thần hơn, những người chăm sóc tại giường sẽ hiệu quả hơn trong việc nhận biết và điều trị cơn đau (Hình 2). Ở đây, chúng ta sẽ thảo luận về lựa chọn thuốc giảm đau, đường dùng và các chiến lược theo dõi.
4.1 Lựa chọn thuốc giảm đau
4.1.1 Thuốc không phải opioid
Các hướng dẫn lâm sàng ở người lớn gợi ý nhiều phương thức để điều trị cơn đau ở người lớn bệnh nặng phải thở máy, bao gồm nhưng không giới hạn ở các kỹ thuật thư giãn, liệu pháp lạnh, liệu pháp âm nhạc, mát-xa, NSAID, thuốc giảm đau thần kinh, ketamine, Nefopam và Acetaminophen (12, 13, 16). Mặc dù có khả năng có lợi, ketamine đã có những tác động thần kinh có hại trong các nghiên cứu trên động vật, khuyến cáo thận trọng khi sử dụng để an thần hoặc giảm đau lâu dài ở trẻ em (65).
Thuốc phiện
Năm 2014, Kudchadkar và cộng sự phát hiện ra sự không đồng nhất đáng kể trong việc lựa chọn thuốc giảm đau ở các khoa ICU nhi khoa, với hầu hết sử dụng fentanyl để giảm đau bằng opioid và phổ biến nhất là truyền liên tục (20). Tanaka và cộng sự phát hiện ra một mô hình sử dụng tương tự ở người lớn, với 39,4% người tham gia sử dụng midazolam và fentanyl kết hợp, và 12,4% chỉ sử dụng fentanyl (10). Mặc dù opioid có một số tác dụng phụ không mong muốn bao gồm rối loạn tiêu hóa và các vấn đề về nhu động ruột, nhưng chúng có khả năng kiểm soát cơn đau tuyệt vời và có thể được sử dụng hiệu quả trong bối cảnh PICU (13). Nếu sử dụng opioid, có vẻ như Morphin có thể có hồ sơ thuận lợi hơn fentanyl, vì nó ít cần tăng liều hơn khi dùng thuốc (66). Cần nghiên cứu thêm, chú ý đến dược động học và dược lý di truyền để xác định lựa chọn thuốc giảm đau tối ưu ở trẻ em mắc PARDS.
Đường dùng
Giống như thuốc an thần, việc sử dụng thuốc giảm đau cũng có thể thông qua truyền liên tục hoặc dùng liều ngắt quãng. Ưu điểm của truyền liên tục bao gồm khả năng chuẩn độ và duy trì nồng độ ở trạng thái ổn định; tuy nhiên, có nguy cơ tăng khả năng dung nạp (19, 66). Lưu ý, nghiên cứu cho thấy việc truyền liên tục thuốc opioid không mang lại lợi ích đáng kể so với việc sử dụng ngắt quãng ở người lớn hoặc trẻ em (67 - 69). Bất chấp bằng chứng này, đánh giá của Kudchadkar và cộng sự năm 2014 cho thấy tỷ lệ truyền liên tục thuốc giảm đau tăng lên ở trẻ em thở máy (20). Nghiên cứu sâu hơn có thể chứng minh lợi ích của phương pháp tiếp cận ngắt quãng đối với việc sử dụng thuốc phiện.
Theo dõi cơn đau
Devlin và cộng sự cho rằng các dấu hiệu sinh tồn có thể không phải là công cụ hữu ích để theo dõi cơn đau ở những bệnh nhân thở máy. Thay vào đó, thang đo hành vi và tự báo cáo là những biện pháp đáng tin cậy nhất (12, 16). Có một số công cụ đánh giá đã được xác thực dành cho trẻ em được Hiệp hội Chăm sóc tích cực Nhi khoa và Sơ sinh Châu Âu (EPNIC) khuyến nghị, bao gồm Hồ sơ đau ở trẻ sinh non (Premature Infant Pain Profile - PIPP), thang đo COMFORT, Thang đánh giá đau đa chiều (Multidimensional Assessment of Pain Scale - MAPS) và thang đo Khuôn mặt, Chân, Hoạt động, Khóc, Khả năng dỗ dành (Face, Legs, Activity, Cry, Consolability - FLACC) (Hình 1) (61, 70 - 73).
Một cân nhắc quan trọng khi sử dụng thuốc giảm đau ở bất kỳ trẻ em nào là khả năng dung nạp, cai thuốc và phụ thuộc. Tài liệu cho thấy khả năng phát triển tình trạng dung nạp là không có khả năng xảy ra khi thời gian điều trị dưới 72 giờ và hội chứng cai thuốc do thầy thuốc (iatrogenic withdrawal syndrome - IWS) thường không phát triển trừ khi thuốc phiện được sử dụng trong sáu ngày trở lên (61, 74). Sau năm ngày tiếp xúc, có thể cần theo dõi IWS khi cai thuốc. Công cụ đánh giá cai thuốc (Withdrawal Assessment Tool - WAT) có thể được sử dụng ở trẻ em thở máy (75). Để giảm tỷ lệ dung nạp và cai thuốc, Anand và cộng sự khuyến cáo nên tìm liều tối thiểu có hiệu quả và tránh dùng thuốc phiện tác dụng kéo dài nếu có thể. Việc sử dụng nhiều nhóm thuốc trong một đợt điều trị đã được chứng minh là có hiệu quả ở người lớn và có thể được cân nhắc cho trẻ em sẽ được điều trị bằng thuốc phiện dài hạn (19, 23). Cần lưu ý rằng trẻ sơ sinh và trẻ nhỏ có thể phát triển tình trạng dung nạp thuốc phiện nhanh hơn, mặc dù cơ chế bệnh sinh đằng sau hiện tượng này vẫn chưa được hiểu đầy đủ (23, 74). Có khả năng những đứa trẻ này bị mê sảng được chẩn đoán nhầm là “dung nạp sớm” (vì nếu không được sàng lọc thường xuyên, mê sảng thường không được phát hiện và xử lý không đúng cách) (76).
5 Liệt/phong tỏa thần kinh cơ (NMB)
NMB (neuromuscular blockade) có thể là một phương pháp bổ sung hữu ích cho bệnh nhân mắc PARDS nặng. Nó có thể giảm thiểu tổn thương phổi do máy thở (ventilator-induced lung injury - VILI), ngăn ngừa mất đồng bộ, giảm áp lực xuyên phổi và giảm tiêu thụ oxy (77 - 83). Tuy nhiên, NMB phải được sử dụng một cách tiết kiệm và thận trọng.
Năm 2009, một đánh giá có hệ thống cho thấy NMB ở người lớn thở máy có thể là yếu tố nguy cơ phát triển sau này của tình trạng yếu cơ thần kinh. Tuy nhiên, các tác giả lưu ý rằng có khả năng có nhiều yếu tố gây nhiễu trong các nghiên cứu được xem xét, bao gồm cả việc dùng đồng thời steroid (84). Papazian và cộng sự đã tiến hành một thử nghiệm mù đôi đa trung tâm có tính bước ngoặt vào năm 2010 ở người lớn thở máy mắc ARDS so sánh việc sử dụng cisatracurium besylate với giả dược. Nghiên cứu này cho thấy việc sử dụng NMB trong 48 giờ dẫn đến giảm thời gian thở máy, tăng tỷ lệ sống sót sau 90 ngày và không làm tăng tình trạng yếu cơ thần kinh (80). Điều này phù hợp với nhiều nghiên cứu trong thập kỷ qua cho thấy không có mối liên hệ độc lập nào giữa NMB đơn thuần và tình trạng yếu cơ hoặc suy giảm khả năng kích thích màng cơ; thay vào đó, các nghiên cứu chỉ cho thấy mối liên hệ khi dùng đồng thời với steroid (80, 85 - 89). Tuy nhiên, một nghiên cứu tiếp theo do mạng lưới Phòng ngừa và Điều trị sớm Tổn thương Phổi Cấp tính (Prevention and Early Treatment of Acute Lung Injury - PETAL) của NIH thực hiện, “ROSE: Đánh giá lại Thuốc chẹn thần kinh cơ sớm toàn thân”, gần đây đã hoàn thành để đánh giá hiệu quả của NMB trong ARDS ở người lớn. Thử nghiệm có đối chứng ngẫu nhiên quy mô lớn này (n = 1.006) cho thấy không có lợi ích nào khi sử dụng thuốc liệt cơ sớm đối với ARDS từ trung bình đến nặng liên quan đến chấn thương do áp lực hoặc tử vong (trong khi có nhiều biến cố tim mạch bất lợi hơn ở những bệnh nhân bị liệt) (90). Các chuyên gia cho rằng điều này có thể là do thuốc an thần sâu được sử dụng trong nghiên cứu đầu tiên (80), có thể làm tăng tỷ lệ kích hoạt ngược ở nhóm không bị liệt và làm trầm trọng thêm VILI (91).
Năm 2016, Wilsterman và cộng sự đã nghiên cứu tác dụng ngắn hạn của NMB ở trẻ em và thấy chỉ số oxygen hóa được cải thiện 15 phút sau khi dùng thuốc. Tuy nhiên, nghiên cứu này không đánh giá các kết quả dài hạn như VILI, chấn thương do áp lực hoặc khả năng sống sót (92). Chưa có đủ nghiên cứu để kết luận rằng NMB có hiệu quả trong suy hô hấp ở trẻ em. Cần có thêm các nghiên cứu để khám phá lợi ích hoặc tác hại tiềm ẩn của thuốc an thần sâu hơn và/hoặc thuốc gây liệt cơ ở trẻ em mắc PARDS nặng. Hiện tại, PALICC khuyến cáo rằng chỉ “nếu chỉ dùng thuốc an thần không đủ để đạt được thở máy hiệu quả thì mới nên cân nhắc dùng thuốc chẹn thần kinh cơ (NMB)” ở liều “tối thiểu nhưng hiệu quả” (14, 15).
6 Mê sảng
Trong ấn bản thứ năm của Sổ tay chẩn đoán và thống kê (DSM-V), Hiệp hội tâm thần Hoa Kỳ định nghĩa mê sảng (delirium) là sự rối loạn ý thức hoặc thay đổi nhận thức dao động phát triển trong một thời gian ngắn (93). Như đã mô tả ở trên, các chiến lược an thần kém có thể dẫn đến mê sảng, có liên quan độc lập với bệnh tật và tử vong ở trẻ em. Mối quan hệ này khiến mê sảng trở thành một chủ đề quan trọng cần giải quyết khi thảo luận về các phương pháp an thần.
6.1 Tác động của mê sảng lên kết quả
Tình trạng mê sảng có thể là vấn đề nghiêm trọng ở trẻ em, dẫn đến thở máy kéo dài, tăng thời gian nằm viện và PICU, số lượng di chứng sau xuất viện cao hơn và tỷ lệ mắc bệnh và tử vong tăng (12, 51, 55, 57, 59, 94 - 97). Mặc dù vậy, một đánh giá năm 2014 cho thấy việc phòng ngừa, phát hiện và điều trị tình trạng mê sảng vẫn chưa đầy đủ ở hầu hết các đơn vị chăm sóc đặc biệt nhi khoa (20).
6.2 Các yếu tố nguy cơ gây mê sảng
Có nhiều yếu tố nguy cơ liên quan đến mê sảng. Các yếu tố tiền thân bao gồm tuổi trẻ và khuyết tật về phát triển (51, 55, 59, 95). Mặc dù các yếu tố nguy cơ này không thể thay đổi được, nhưng các yếu tố môi trường trong bệnh viện - chẳng hạn như chất lượng giấc ngủ kém do ô nhiễm ánh sáng và âm thanh - thường có thể thay đổi được. Đáng buồn thay, tính đến năm 2014, chỉ có một số rất ít khoa ICU nhi khoa tối ưu hóa các yếu tố này, với một nghiên cứu cho thấy chỉ có 16% và 9% giải quyết vấn đề tiếp xúc với tiếng ồn và ánh sáng (20). Tuy nhiên, rất có thể yếu tố nguy cơ có thể thay đổi quan trọng nhất đối với mê sảng ở trẻ em thở máy là lựa chọn thuốc an thần. Như đã thảo luận trong phần an thần ở trên, mức độ an thần và tiếp xúc với benzodiazepine có liên quan cao đến việc tăng nguy cơ mê sảng (12, 51, 55, 57, 58).
6.3 Phòng ngừa mê sảng
Phòng ngừa bắt đầu bằng việc nhận biết các yếu tố nguy cơ và thực hiện các chiến thuật theo dõi. Để ngăn ngừa chứng mê sảng ở người lớn, các hướng dẫn đề xuất “can thiệp không dùng thuốc tập trung vào (nhưng không giới hạn ở) việc giảm các yếu tố nguy cơ có thể thay đổi đối với chứng mê sảng, cải thiện nhận thức và tối ưu hóa giấc ngủ, khả năng vận động, thính giác và thị lực ở người lớn bị bệnh nặng”. (12, 16).
Đánh giá thường xuyên tình trạng mê sảng bằng một công cụ sàng lọc đã được xác nhận là rất quan trọng trong việc phòng ngừa, nhận biết và điều trị tình trạng mê sảng (16). Trong một cuộc khảo sát năm 2014, 71% PICU báo cáo không sàng lọc tình trạng mê sảng thường quy (20). Cùng năm đó, Đánh giá tình trạng mê sảng ở trẻ em của Cornell (Cornell Assessment of Pediatric Delirium - CAPD) đã được phát triển và xác nhận để đánh giá tình trạng mê sảng ở trẻ em ở mọi lứa tuổi. Điều quan trọng là CAPD được thiết kế riêng để dễ sử dụng ở trẻ em thở máy (98). Một công cụ sàng lọc tình trạng mê sảng ở trẻ em hợp lệ và đáng tin cậy khác là Phương pháp đánh giá lú lẫn ở trẻ em trong ICU (Pediatric Confusion Assessment Method for the ICU - pCAM-ICU) dành cho trẻ em trên 5 tuổi, với phiên bản dành cho trẻ mẫu giáo dành cho trẻ em từ 6 tháng đến 5 tuổi (99, 100). EPNIC đã khuyến nghị sử dụng CAPD để sàng lọc tình trạng mê sảng ở tất cả trẻ em bị bệnh nặng và CAPD hiện được sử dụng làm tiêu chuẩn chăm sóc tại nhiều PICU ở Bắc Mỹ (61, 101). Trên thực tế, các nghiên cứu đã chỉ ra rằng chỉ cần thực hiện sàng lọc mê sảng toàn diện có thể dẫn đến giảm tỷ lệ mê sảng (Hình 1) (25). Có liên quan nhất đến PARDS, dữ liệu cho thấy rằng việc giảm thuốc an thần sẽ dẫn đến giảm mê sảng ở trẻ em thở máy và có thể dẫn đến kết quả tốt hơn trong ngắn hạn và dài hạn (55).
7 Vận động
Vận động sớm (early mobilization - EM) được định nghĩa là “một liệu pháp liên ngành, hướng đến mục tiêu được sử dụng để tạo điều kiện cho việc di chuyển” ở những bệnh nhân mắc ARDS (102). Do một vấn đề thường được trích dẫn trong tài liệu là sự phát triển của tình trạng suy yếu thần kinh cơ sau khi thở máy, các bác sĩ chuyên khoa tích cực đã bắt đầu sử dụng thường quy phương pháp vận động để cố gắng ngăn ngừa sự phát triển của nó (103).
Cho đến nay, tài liệu về tác động của việc vận động đã hoàn toàn tích cực. Bằng chứng gần đây cho thấy rằng EM trong bối cảnh ICU không chỉ an toàn mà còn có thể cải thiện kết quả chức năng (103). Các hướng dẫn thực hành lâm sàng ở người lớn cho thấy EM làm giảm cả tỷ lệ mắc và số ngày mê sảng (12, 16).
Trong thế giới nhi khoa, một dự án cải tiến chất lượng quan sát mang tên “PICU Up!” đã nghiên cứu 200 trẻ em bệnh nặng để đánh giá tính khả thi của EM tại ICU nhi khoa. Kết quả sau khi triển khai cho thấy số lần vận động trung bình tăng lên (3 so với 6; P <0,001), mà không có bất kỳ biến cố bất lợi nào liên quan đến vận động. Nghiên cứu này ủng hộ tính khả thi và an toàn của EM ở trẻ em (104). Về hiệu quả của EM, một nghiên cứu nhi khoa năm 2017 đã triển khai một giao thức EM tại PICU và cho thấy tỷ lệ mê sảng giảm đáng kể (25). Vì bệnh nhân cần phải tỉnh táo và hợp tác để tham gia EM, điều này tạo thêm động lực để áp dụng phương pháp tiếp cận nhẹ nhàng đối với thuốc an thần trong PARDS.
8 Kết luận
Nhìn chung, tỷ lệ tử vong do PARDS đã giảm trong thập kỷ qua. Với tỷ lệ sống sót tăng lên (cụ thể là ở các quốc gia có thu nhập cao hơn), nghiên cứu đã chứng minh tỷ lệ mắc bệnh đáng kể sau PARDS. Có thể một sự thay đổi mô hình trong cách tiếp cận của chúng tôi đối với thuốc an thần có thể tối ưu hóa hơn nữa dịch vụ chăm sóc mà chúng tôi cung cấp. Với cách tiếp cận an thần-giảm đau—nhắm mục tiêu vào mức độ an thần nhẹ nhất có thể (và sử dụng các phương pháp thay thế cho benzodiazepine khi cần an thần)—chúng ta có thể giảm an thần quá mức, tối ưu hóa khả năng kiểm soát cơn đau, rút ngắn thời gian thở máy, giảm tỷ lệ mê sảng và tăng EM. Một sự thay đổi trong cách tiếp cận của chúng tôi đối với thuốc an thần có thể cải thiện trực tiếp kết quả ngắn hạn và dài hạn trong PARDS.

