Chấn thương não cấp tính liên quan đến ARDS: từ phổi đến não
Trungtamthuoc.com - Mối tương quan phức tạp giữa phổi và não ở bệnh nhân chấn thương phổi cấp tính (acute lung injury - ALI) đã được thiết lập bằng các nghiên cứu thực nghiệm và lâm sàng trong những thập kỷ qua. Bài viết dưới đây nêu lên ảnh hưởng có thể có của thở máy đối với chấn thương não cấp tính liên quan đến ALI.
Bản dịch của Bác sĩ Đặng Thanh Tuấn – Bệnh viện Nhi Đồng 1
Tải PDF bản dịch TẠI ĐÂY
1 Tóm tắt
Mối tương quan phức tạp giữa phổi và não ở bệnh nhân chấn thương phổi cấp tính (acute lung injury - ALI) đã được thiết lập bằng các nghiên cứu thực nghiệm và lâm sàng trong những thập kỷ qua. Mặc dù chấn thương não cấp tính là một trong những thiếu sót phổ biến nhất ở bệnh nhân mắc ALI và hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome - ARDS), sinh lý bệnh cơ bản của tương tác quan sát được này vẫn chưa được hiểu rõ do tính phức tạp của nó. Cụ thể, nó liên quan đến nhiều thông số sinh lý bệnh như thiếu oxy máu, các tác dụng phụ về thần kinh của thông khí bảo vệ phổi, hạ huyết áp, rối loạn hàng rào máu não (blood-brain barrier - BBB) và viêm thần kinh theo cách mà não của bệnh nhân ARDS, đặc biệt là vùng đồi thị, trở nên rất dễ bị chấn thương não cấp tính thứ phát qua trung gian tổn thương phổi. Chiến lược máy thở bảo vệ có thể làm giảm hoặc thậm chí giảm thiểu sự giải phóng thêm các chất trung gian gây viêm trong hệ thống và do đó duy trì cân bằng nội môi trong não. Mặt khác, thở máy với thể tích khí lưu thông thấp có thể dẫn đến tổn thương phổi tự gây ra, tăng CO2 máu và sau đó là giãn mạch não, tăng lưu lượng máu não và tăng áp lực nội sọ. Do đó, bằng cách mô tả sinh lý bệnh của chấn thương não cấp tính liên quan đến ARDS, chúng tôi mong muốn làm nổi bật và thảo luận về ảnh hưởng có thể có của thở máy đối với chấn thương não cấp tính liên quan đến ALI.
2 Giới thiệu
Bất chấp những tiến bộ đáng chú ý trong việc kiểm soát tổn thương phổi cấp tính (ALI) và hội chứng hô hấp cấp tính (ARDS), ALI vẫn là một tình trạng tương đối phổ biến và có mức độ bệnh tật cao hoặc gây tử vong [1]. Rối loạn chức năng não liên quan đến ARDS là một trong những biến chứng phổ biến nhất ở bệnh nhân ARDS bị bệnh nặng và là một trong những tình trạng suy cơ quan thường gặp nhất, thường kéo dài nhiều tháng sau khi xuất viện [2]. Mặc dù cơ chế bệnh sinh của tổn thương não liên quan đến ARDS vẫn chưa được hiểu đầy đủ, nhưng người ta đã xác định rõ ràng rằng phổi và não đại diện cho một quần thể tích hợp [3], tương tác mạnh mẽ thông qua các con đường sinh lý bệnh phức tạp [4]. Nhiều yếu tố khác nhau đã được đề xuất góp phần vào cơ chế bệnh sinh của chấn thương não liên quan đến ARDS, bao gồm thiếu oxy máu, các tác dụng phụ về thần kinh của thông khí bảo vệ phổi, hạ huyết áp, phá vỡ hàng rào máu não (BBB) và thay đổi dẫn truyền thần kinh. Ba cơ chế chính dường như có liên quan đến biểu hiện của nó, đó là viêm, thiếu oxy máu và các tác dụng phụ của thở máy [4, 5, 6, 7]. Việc nhận biết và hiểu biết về các cơ chế sinh lý bệnh liên quan đến bệnh não ARDS có thể giúp cải thiện kết quả lâm sàng và ý nghĩa điều trị. Tổng quan hiện tại nhằm mục đích phân tích các biểu hiện lâm sàng khác nhau về hệ thần kinh trung ương ở bệnh nhân mắc ARDS. Hơn nữa, chúng tôi đã tìm cách mô tả sinh lý bệnh của các biểu hiện thần kinh, xảy ra thứ phát sau ALI theo quan điểm cơ học. Cụ thể hơn, chúng tôi thảo luận về các vấn đề sinh lý bệnh liên quan đến tương tác phổi-não và cung cấp một cái nhìn tổng quan cập nhật về vai trò của tình trạng viêm, thiếu oxy và huyết động đối với sự phát triển của chấn thương não thứ phát liên quan đến ARDS. Cuối cùng, tác động của thở máy (mechanical ventilation - MV) đến cơ chế bệnh sinh của chấn thương não cấp tính ở bệnh nhân ARDS không có tổn thương não từ trước cũng được phân tích.
3 Biểu hiện lâm sàng của hệ thần kinh trung ương ở bệnh nhân ARDS
Theo truyền thống, suy hô hấp kháng trị được coi là nguyên nhân tử vong tương đối hiếm gặp ở bệnh nhân ARDS, xảy ra ở khoảng 20% bệnh nhân [8, 9, 10], trong khi các nghiên cứu báo cáo suy hô hấp không hồi phục chỉ ở 16% bệnh nhân ARDS [8]. Tuy nhiên, nghiên cứu cổ điển của Ferring và cộng sự [10] với 129 bệnh nhân ARDS có biểu hiện nhiễm trùng huyết, tức là suy đa cơ quan (multi- organ failure - MOF), là nguyên nhân tử vong chính ở 49% bệnh nhân ARDS, tiếp theo là suy hô hấp (16%), rối loạn chức năng tim (15%), nặng chấn thương thần kinh (10%) và các nguyên nhân khác (8%) (Hình 1) [10]. ARDS là một tình trạng viêm cấp tính được đặc trưng bởi sự giải phóng các chất trung gian gây viêm vào hệ tuần hoàn. Chất trung gian gây viêm quan trọng nhất là Interleukin (IL)- 6, IL-ip, IL-8 và yếu tố hoại tử khối u (TNF)-a, dẫn đến rối loạn chức năng của các cơ quan và hệ thống ở xa [11, 12, 13]. Hệ thống thần kinh trung ương dường như là một trong những cơ quan và hệ thống được nhắm mục tiêu nhiều nhất [2]. Thật vậy, một nghiên cứu của Hoppkins và các đồng tác giả kiểm tra giả định rằng ARDS có thể gây tổn thương não do thiếu oxy cho thấy tất cả những người sống sót sau ARDS (tức là 100% trường hợp) đều biểu hiện suy giảm nhận thức và cảm xúc khi xuất viện. Điều thú vị là, ngay cả 1 năm sau khi ARDS được quan sát, gần 80% bệnh nhân vẫn bị ít nhất một thay đổi về nhận thức thần kinh (tức là suy giảm trí nhớ, sự chú ý, sự tập trung và/hoặc tốc độ xử lý tâm thần) [14]. Bằng chứng đầu tiên này được hỗ trợ thêm bởi các nghiên cứu lâm sàng và thực nghiệm cho thấy bệnh nhân mắc ARDS dường như có nguy cơ cao phát triển tình trạng mê sảng (delirium) tại Đơn vị Chăm sóc Đặc biệt [15], độc lập với MV. Hơn nữa, phần lớn nhóm bệnh nhân này dường như phát triển những suy giảm mới về nhận thức, chức năng và thể chất với những hậu quả lâu dài về chất lượng cuộc sống của họ [16, 17, 18, 19, 20]. Gần đây, các nghiên cứu theo dõi tác động của đợt bùng phát virus Corona-2 (SARS-CoV-2) đối với những bệnh nhân nguy kịch đã mô tả sự xuất hiện của nhiều đặc điểm tâm thần kinh, chẳng hạn như bệnh não (encephalopathy), kích động, lú lẫn, mất tập trung (inattention), mất phương hướng và cử động tổ chức kém (poorly organized movements) trong tình trạng nguy kịch ở bệnh nhân SARS-CoV-2 bị bệnh suy hô hấp cấp tính nặng [21, 22, 23].
Các yếu tố nguy cơ làm gia tăng đáng kể tình trạng mê sảng bao gồm tuổi cao, rối loạn nhận thức thần kinh từ trước, tiền sử lạm dụng rượu, bệnh toàn thân nặng (ví dụ nhiễm trùng huyết và các bệnh về đường hô hấp), bất thường về chuyển hóa, kiểm soát cơn đau không đầy đủ, thở máy, phẫu thuật và ma túy [24]. Các tác nhân dược phẩm cổ điển có liên quan đến sự phát triển của rối loạn chức năng nhận thức thần kinh bao gồm các thuốc benzodiazepin, steroid, opioid tác dụng kéo dài và thuốc kháng cholinergic, nhấn mạnh việc sử dụng chúng một cách hết sức thận trọng ở bệnh nhân cao tuổi [25, 26]. Hơn nữa, thuốc an thần và giảm đau thường được sử dụng để kiểm soát sự lo lắng và tình trạng bất ổn về vận động, đau đớn và kích động, tránh khuyết tật thần kinh tự chủ (autonomic disability), giảm chuyển hóa não và tối ưu hóa MV [27, 28]. Hơn nữa, nên dùng thuốc an thần nhẹ thay vì dùng thuốc an thần sâu và ngừng dùng thuốc an thần trong thời gian ngắn đối với các thử nghiệm đánh thức hàng ngày (daily wake-up tests) để giảm nguy cơ rối loạn chức năng nhận thức thần kinh, thời gian của MV và thời gian nằm viện dựa trên thực tế cho thấy rằng thuốc an thần ở mức độ sâu có thể gây ra sự phát triển mê sảng [20, 26, 29, 30, 31, 32, 33].
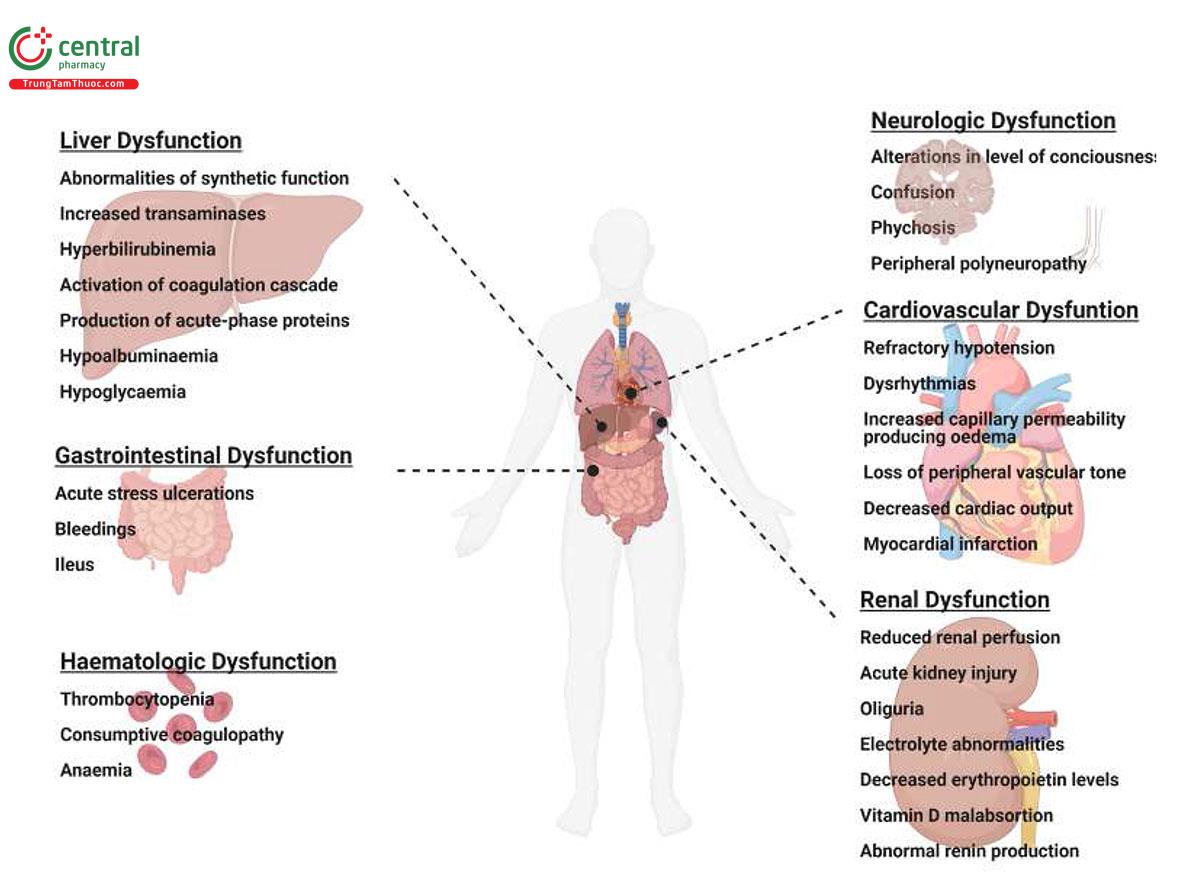
Mê sảng ICU là đa yếu tố với sinh lý bệnh của nó bao gồm ảnh hưởng của bệnh lý tiềm ẩn (ví dụ: nhiễm trùng huyết, chấn thương, v.v.), viêm thần kinh, giảm tưới máu não do thiếu oxy, phá vỡ BBB, gián đoạn lưu lượng máu não (cerebral blood flow - CBF) và rối loạn chức năng nội mô [34]. Tuy nhiên, mặt khác, bệnh nhân nguy kịch lại được MV đóng góp thêm; MV mặc dù có tác dụng cứu sống nhưng có thể có tác dụng phụ làm trầm trọng thêm tình trạng viêm phổi và viêm hệ thống, do đó dẫn đến tổn thương phổi và các cơ quan ở xa [4, 34]. Trên thực tế, người ta đã chứng minh rằng những bệnh nhân nguy kịch thường được đưa vào ICU để điều trị MV [35]. Tương tác giữa bệnh nhân và máy thở và khả năng phát triển tổn thương phổi cấp tính phần lớn được xác định bởi sự kiểm soát thần kinh của thông khí và phản ứng miễn dịch, điều này có thể khiến bệnh nhân dễ bị suy giảm tâm lý thần kinh ngắn hạn và dài hạn, bao gồm mê sảng, rối loạn giấc ngủ, suy giảm nhận thức dai dẳng và rối loạn căng thẳng sau chấn thương (post-traumatic stress disorder) [36]. Mặc dù sự tương tác giữa phổi được thông khí cơ học và hệ thần kinh trung ương rất phức tạp và được thảo luận chi tiết trong phần Sinh lý bệnh, các nghiên cứu thực nghiệm và lâm sàng cho thấy sự tồn tại của tín hiệu tương tác. Tín hiệu tương tác này có thể là do cơ chế sinh lý, ví dụ như phản xạ Hering-Breuer. Một nguyên nhân có thể khác có thể là một quá trình bệnh lý, chẳng hạn như phế nang bị kéo căng quá mức (excessive alveolar stretch) và quá căng (over-distension), có thể dẫn đến phản ứng kém thích nghi và góp phần gây ra các suy giảm nhận thức thần kinh và thay đổi tâm lý được quan sát thấy [36, 37].
Cho rằng mê sảng ICU kéo dài thời gian nằm viện của bệnh nhân thở máy và cuối cùng làm tăng tỷ lệ tử vong [20, 30, 31, 32] cần nhấn mạnh vào các chiến lược phòng ngừa và các biện pháp can thiệp có thể, liên quan đến việc xác định sớm các yếu tố nguy cơ, nhận biết kịp thời các nguy cơ bị các triệu chứng nhận thức thần kinh tiềm ẩn, tránh các yếu tố kích hoạt và cách tiếp cận bệnh nhân đa yếu tố.
4 Sinh lý bệnh của rối loạn chức năng não liên quan đến ARDS
4.1 Vai trò của viêm
Hơn hai thập kỷ trước, Slutsky và Tremplay đã cố gắng khám phá giả thuyết về sự góp phần của tổn thương phổi và thở máy trong việc khởi đầu các phản ứng viêm toàn thân, có thể dẫn đến suy đa cơ quan toàn thân [38]. Sau khi được công bố vào năm 1997, ngày càng có nhiều bằng chứng cho thấy tổn thương phổi cấp tính và thở máy có thể giải phóng các chất trung gian gây viêm vào hệ tuần hoàn, tạo ra môi trường gây viêm với những tác động bất lợi tiềm tàng lên các cơ quan ở xa bao gồm cả não [39, 40]. Lý thuyết về phản ứng viêm toàn thân với những tác động có hại sau đó lên các cơ quan ở xa được hỗ trợ thêm bởi các thành phần giải phẫu và chức năng. Mạch máu phổi chứa tới một phần ba tổng số bạch cầu trung tính bên ngoài tủy xương; vì nó nhận được toàn bộ cung lượng tim nên có khả năng tương tác đáng kể với bạch cầu trung tính tuần hoàn [38]. Ngoài ra, sự phá vỡ hàng rào vi mạch phổi do tăng tính thấm nội mô và biểu mô cũng như tổn thương phế nang do nồng độ cao các cytokine gây viêm cho phép các chất trung gian gây viêm tràn vào hệ tuần hoàn [41].
Hơn nữa, các nguyên nhân phổ biến gây tổn thương phổi cấp tính như chấn thương, nhiễm trùng hoặc phẫu thuật không chỉ ảnh hưởng đến phổi mà còn gây ra tình trạng viêm toàn thân và rối loạn chức năng cơ quan thông qua việc sản xuất các chất trung gian gây viêm bị rối loạn, rối loạn chức năng nội mô quá mức, thay đổi hàng rào máu não (BBB), viêm dây thần kinh và chết tế bào thần kinh đệm [42, 43]. Các cytokine như IL-ip và TNF-a là các chất trung gian trung gian của quá trình tạo thần kinh (neurogeneration) [44, 45] cho thấy mối liên hệ tiềm tàng giữa tổn thương phổi cấp tính và sự phát triển của rối loạn chức năng não. Thật vậy, các cytokine (ví dụ TNF-a, IL-1a, IL-1b và IL-6) có thể trực tiếp gây ra chết theo chương trình (apoptosis) các tế bào thần kinh và tạo ra một cụm các dấu hiệu không đặc hiệu như suy giảm khả năng tập trung, chán ăn, mệt mỏi, giảm động lực, và trầm cảm [46].
Điều thú vị là, ở cấp độ phân tử, hồi hải mã, tham gia vào quá trình ghi nhớ và học tập, có mật độ thụ thể IL-1 cao, điều này có thể giải thích sự xuất hiện phổ biến của tổn thương vùng đồi thị ở bệnh nhân bị tổn thương phổi cấp tính bất kể mức độ thiếu oxy [47, 48, 49]. Các mô hình thử nghiệm của ARDS đã tìm thấy sự gia tăng đáng kể về mức protein S-100b — một dấu hiệu huyết tương của tổn thương não — so với động vật thiếu oxy không có ARDS [50]. Hơn nữa, tổn thương vùng đồi thị chỉ xảy ra ở những người mắc ARDS. Fries và cộng sự kết luận rằng đối với cùng một mức độ thiếu oxy, tổn thương phổi cấp tính dẫn đến tổn thương não mạnh hơn khi so sánh với tình trạng thiếu oxy do giảm tỷ lệ oxy hít vào [50]. Đề xuất này phù hợp với nghiên cứu của Nguyễn và cộng sự [51], người đã báo cáo rằng nồng độ S-100b và enolase đặc hiệu cho tế bào thần kinh (neuron-specific enolase - NSE) tăng cao thường liên quan đến chấn thương não ở bệnh nhân nhiễm trùng huyết nặng và sốc nhiễm trùng [51]. Cơ chế sinh bệnh học này được hỗ trợ thêm bởi một nghiên cứu thực nghiệm trên lợn mắc ARDS và tăng áp lực nội sọ, trong đó người ta phát hiện ra rằng sự kết hợp của chúng gây ra tổn thương ở vùng hải mã và giảm mật độ trên CT não do phù não liên quan đến tình trạng thiếu oxy, cho thấy sự phối hợp làm trầm trọng thêm tình trạng tổn thương não có sẳn [52].
4.2 Ảnh hưởng của tình trạng viêm hàng rào máu não
BBB mạch máu là một cấu trúc sinh học thần kinh quan trọng với bề mặt được điều hòa cao độ giữa máu và não [53]. Nó phản ứng với các tín hiệu của hệ thống miễn dịch và điều chỉnh sự giao tiếp thần kinh miễn dịch giữa các khoang máu và não [54]. Tuy nhiên, trong quá trình viêm hệ thần kinh trung ương kéo dài [7] và phản ứng viêm toàn thân, nhiều chất trung gian gây viêm hòa tan có thể ảnh hưởng đến tính toàn vẹn của BBB và kết quả thần kinh tiếp theo của bệnh nhân [53, 55]. Sự tăng lên của cytokine ngoại vi kích hoạt các phản ứng siêu sinh lý, làm thay đổi BBB, bao gồm tăng tính thấm chất tan và vận chuyển tế bào lympho, kích hoạt các tế bào nội mô, suy giảm lưu lượng máu hệ thống và não, và thay đổi chuyển hóa Glucose trong não [53, 56].
Các nghiên cứu thực nghiệm cho thấy rằng kích hoạt tế bào vi mô đóng vai trò cơ bản trong việc phát triển các thay đổi BBB [57, 58]. Người ta cũng đã báo cáo rằng các cytokine ngoại vi được tăng cường tạo ra một dòng thác sinh hóa khổng lồ kích hoạt các microglia nằm trong nội sọ, các đại thực bào não thường trú, để tạo ra các cytokine gây viêm để tuyển bạch cầu đơn nhân vào não, cuối cùng dẫn đến apoptosis thần kinh và phù não [4, 59, 60, 61].
Ngoài ra, việc kích hoạt các tế bào nội mô vi mạch do sự liên kết của các cytokine ngoại vi với nội mô của BBB mạch máu làm thay đổi độ bám dính và tính thấm và dẫn đến sự vận chuyển cytokine tích cực giữa máu và khoang não [61, 62, 63]. Thật vậy, các cytokine tăng cao đã được mô tả trong dịch não tủy của những bệnh nhân nguy kịch, cho thấy sự gián đoạn của BBB và tình trạng viêm thần kinh [54, 64], những phát hiện này được hỗ trợ thêm bởi các nghiên cứu gần đây ở bệnh nhân SARS-CoV-2 có biểu hiện thần kinh [65, 66, 67]. Theo đó, các nghiên cứu lâm sàng và thực nghiệm trước đây mô tả nồng độ S-100b và NSE trong huyết tương tăng cao, cho thấy rối loạn chức năng BBB, tổn thương tế bào hình sao và tế bào thần kinh [37, 50, 51].
4.3 Viêm và thông khí cơ học
Thông khí cơ học thường là một công cụ hỗ trợ sự sống quan trọng trong hồi sức bệnh nhân bị tổn thương phổi cấp tính và ARDS [68, 69]. Tuy nhiên, thông khí cơ học thực chất có thể gây tổn thương não bằng cách gây ra sự giải phóng quá mức các cytokine gây viêm (ví dụ Il-1b, IL-6 và TNF-a) hoặc bằng cách thay đổi tín hiệu phế vị dẫn đến viêm thần kinh và chết tế bào thần kinh [37, 50, 68, 70, 71, 72, 73, 74]. Điều thú vị là, ngày càng có nhiều bằng chứng cho thấy rằng ngay cả khi thở máy trong thời gian ngắn cũng có thể làm tăng đáng kể nồng độ IL-1b, IL-6 và TNF-a trong huyết tương và vùng đồi thị [71]. Đề xuất này được hỗ trợ thêm bởi một nghiên cứu thực nghiệm gần đây của Sparrow và các đồng nghiệp, họ đã báo cáo rằng tổn thương phổi cấp tính do thở máy gây ra tổn thương thần kinh có thể đảo ngược và viêm ở vỏ não trước và vùng đồi thị của chuột được thở máy. Điều quan trọng là việc ức chế tín hiệu IL-6 làm giảm quá trình apoptosis vùng trán và vùng đồi thị [75].
Bằng chứng lâm sàng và thực nghiệm đã chỉ ra rằng chiến lược thở máy có thể kích hoạt hoặc thậm chí lan truyền phản ứng viêm toàn thân, dẫn đến rối loạn chức năng của nhiều cơ quan và hệ thống, bao gồm cả não [38, 73]. Trong 20 năm qua, nhiều nghiên cứu đã chứng minh phản ứng sinh học với việc giải phóng nhiều chất trung gian gây viêm và bắt đầu quá trình viêm cục bộ do chiến lược thở máy gây tổn thương [69], có khả năng gây tổn thương phổi cục bộ. Ngoài ra, các cơ quan ngoại vi cũng bị ảnh hưởng do sự phân chia các ngăn của viêm cục bộ để di chuyển vào hệ tuần hoàn [69]. Thực tế là chiến lược thông khí cơ học sử dụng thể tích khí lưu thông cao có thể tăng cường giải phóng các chất trung gian như IL-1b, IL-6 và TNF-a, đã được công nhận rõ ràng [76, 77]. Cụ thể, đối với tương tác phổi-não, người ta đã đề xuất rằng thông khí cơ học có thể truyền bá kích hoạt não khu vực. Ví dụ, nghiên cứu thực nghiệm của Quilez và cộng sự cho thấy MV với thể tích khí lưu thông cao có thể gây ra nhiều biểu hiện não c-fos hơn, một dấu hiệu kích hoạt não, ở chuột khỏe mạnh so với thở máy bảo vệ, hỗ trợ tăng cường tình trạng viêm thần kinh do điều trị [74].
Mặc dù các cơ chế mà tổn thương phổi có thể đến hệ thần kinh trung ương vẫn chưa được hiểu rõ [74], vai trò then chốt của dẫn truyền cơ học (tức là chuyển đổi các kích thích cơ học thành tín hiệu sinh học bởi các cơ quan thụ cảm cơ học) trong tương tác này đã được đề xuất [76, 78]. Ngày nay, người ta cũng thừa nhận rằng các chất trung gian gây viêm có thể tiếp cận các cấu trúc quan trọng trong não thông qua các cơ quan quanh não thất và kích hoạt hệ thống thần kinh tự trị ở ngoại vi [79].
Do đó, sự xuất hiện của sự tương tác giữa phổi và não thông qua các cơ chế và con đường sinh hóa khác nhau nhấn mạnh sự cần thiết phải kiểm soát nhiều hơn các biến số được sửa đổi, ví dụ như thở máy trong việc duy trì cân bằng nội môi của phổi và não.
5 Vai trò của tình trạng thiếu oxy máu
Não là một cơ quan có khả năng trao đổi chất và oxy hóa cao, chiếm khoảng 20% lượng oxy cơ bản, mặc dù kích thước nhỏ, chiếm khoảng 2% trọng lượng cơ thể [80]. Do đó, não dễ bị tổn thương trong tình trạng thiếu oxy [81]. Thật vậy, tình trạng thiếu oxy máu được cho là nguyên nhân gây ra tình trạng thiếu oxy mô và làm tăng nguy cơ suy đa cơ quan bao gồm cả não [82]. Tuy nhiên, mặc dù một số nghiên cứu đã chỉ ra những tác động sinh bệnh khác nhau của tình trạng thiếu oxy máu đối với chức năng não của bệnh nhân suy hô hấp nặng, nhưng vẫn chưa rõ liệu thiếu oxy có phải là nguyên nhân góp phần dẫn đến sự xuất hiện của rối loạn chức năng nhận thức hay không [81, 82]. Cho đến nay, người ta đã chứng minh rõ ràng rằng các kích thích thiếu oxy có thể bù đắp làm tăng lưu lượng não thông qua giãn mạch não để duy trì việc cung cấp oxy cho não [81]. Ngoài ra, quá trình oxy hóa mô được điều chỉnh từ nhiều thông số khác nhau, chẳng hạn như oxy hòa tan, nồng độ huyết sắc tố, chức năng tim, pH và nhiệt độ cơ thể [81, 82]. Trong một nghiên cứu lâm sàng về những người sống sót sau ALI được thở máy, Mikkelsen và cộng sự phát hiện ra rằng PaO2 trung bình là 72 mmHg có liên quan đáng kể đến rối loạn chức năng nhận thức lâu dài so với PaO2 trung bình là 87 mmHg [83]. Tuy nhiên, cần lưu ý rằng các kích thích thiếu oxy sẽ kích hoạt các thụ thể hóa học ngoại biên, từ đó có thể dẫn đến tăng thông khí, sau đó là giảm CO2 máu và co mạch não cũng như giảm tưới máu não [84].
Chảy máu vi mô não là những tổn thương nhỏ, giảm đậm độ với kích thước tối đa lên tới 10 mm trên các chuỗi MRI nhạy cảm với xuất huyết. Mặc dù mối liên hệ nhân quả của chúng với tăng huyết áp mạn tính, bệnh lý mạch máu não amyloid và tổn thương sợi trục lan tỏa đã được ghi nhận rõ ràng, nhưng gần đây người ta đã lưu ý rằng chúng có thể liên quan đến nguyên nhân gây ra ít xác định hơn, chẳng hạn như nhiễm trùng huyết và ARDS [85]. Riech và các đồng nghiệp đã mô tả vào năm 2015 nhiều trường hợp xuất huyết vi mô, chủ yếu ở thể chai, trên MRI của ba bệnh nhân sống sót sau ARDS, những phát hiện thường thấy ở những bệnh nhân bị tổn thương ở độ cao, đặt ra câu hỏi về cơ chế sinh bệnh phổ biến giữa hai thực thể bệnh [86]. Gần đây hơn, những phát hiện tương tự đã được trình bày bởi Fanou và cộng sự ở 12 bệnh nhân suy hô hấp, trong đó 11 bệnh nhân được hỗ trợ thở máy và 3 bệnh nhân phải tuần hoàn ngoài cơ thể. Cụ thể hơn, các tác giả đã mô tả các tổn thương vi mô xuất huyết, liên quan lan tỏa đến chất trắng gần vỏ não và thể chai nhưng không ảnh hưởng đến vỏ não, chất trắng sâu và quanh não thất, hạch nền và đồi thị [87]. Những phát hiện này dường như được xác nhận bởi nhiều nghiên cứu gần đây hơn ở những bệnh nhân bị nhiễm SARS-CoV-2 nặng. Thật vậy, một phân tích tổng hợp gần đây cho thấy những bệnh nhân này biểu hiện xuất huyết vi thể hoặc xuất huyết tiểu thùy ít sâu hơn nhiều, những phát hiện thường thấy ở những bệnh nhân mắc bệnh mạch máu tăng huyết áp và bệnh lý mạch máu não amyloid. Ở những bệnh nhân này, mô hình biểu hiện xuất huyết não không đồng nhất được mô tả, chẳng hạn như xuất huyết não lan tỏa, ảnh hưởng đến các cấu trúc chất trắng ở vỏ não sâu, bao gồm thể chai cũng như thân não và tiểu não [88]. Mặc dù các biểu hiện xuất huyết được báo cáo là biến chứng tương đối thường xuyên ở bệnh nhân mắc ARDS (25%) [5], cơ chế bệnh sinh chính xác cho sự xuất hiện của chúng vẫn chưa rõ ràng. Một giả thuyết cho rằng tình trạng thiếu oxy và viêm có thể dẫn đến rối loạn chức năng nội mô và BBB, ngoài ra còn dẫn đến sự thoát mạch của hồng cầu, dẫn đến xuất huyết não lan tỏa [87]—một kiểu hình của bệnh mạch máu nhỏ—có thể tiến triển thành đột quỵ xuất huyết [5].
Tổn thương não do thiếu máu cục bộ là một loại chấn thương khác thường thấy ở những bệnh nhân bị chấn thương phổi cấp tính. Cơ chế sinh lý bệnh của nó bao gồm hoạt hóa các tế bào nội mô và viêm hệ thống, dẫn đến hoạt hóa hệ thống đông máu sau đó và hình thành huyết khối. Tăng nguy cơ đột quỵ do thiếu máu cục bộ còn liên quan đến các gốc oxy phản ứng do tổn thương phổi cấp tính và thiếu oxy [89], trong khi tình trạng thiếu oxy kéo dài ở bệnh nhân suy hô hấp nặng dẫn đến giảm lượng oxy và glucose đến não. Kết quả là rối loạn chức năng ty thể và điều hòa lại các chuỗi ion phụ thuộc vào năng lượng được biểu hiện, gây ra apoptosis tế bào thần kinh, hoại tử và phù nề do độc tế bào [5, 6]. Quan sát này có tầm quan trọng cao, đặc biệt khi đề cập đến các cấu trúc nhạy cảm hơn với tổn thương thiếu máu cục bộ lan tỏa do nhu cầu trao đổi chất cao của chúng (ví dụ, vùng hải mã và cấu trúc chất xám) [90] và phù hợp với nghiên cứu của Janz và cộng sự, người đã báo cáo rằng tổn thương não do thiếu oxy ở bệnh nhân mắc ARDS được quan sát phổ biến nhất ở các tế bào thần kinh hình chóp ở vùng CA1 của vùng hải mã [49]. Các cơ chế sinh lý bệnh mà qua đó tình trạng thiếu oxy cấp tính dẫn đến tổn thương vùng đồi thị bao gồm quá trình đường phân, tăng nồng độ Adenosine, phản ứng bù trừ của tim phổi, stress oxy hóa và rối loạn ty thể. Các cơ chế này cuối cùng dẫn đến giảm độ dẻo của khớp thần kinh, hoại tử tế bào thần kinh và ức chế điện thế lâu dài [91].
Hơn nữa, tình trạng thiếu oxy máu được cho là nguyên nhân dẫn đến sự phát triển của phù não và teo não lan tỏa, mặc dù vẫn chưa rõ liệu cơ chế gây bệnh tiềm ẩn là do thiếu oxy máu hay viêm [5,6].
Cuối cùng, người ta chứng minh rằng Erythropoietin [92], là chất nội sinh được biểu hiện trong hệ thần kinh trung ương, có khả năng tạo ra các đặc tính bảo vệ thần kinh in vivo và in vitro. Các thụ thể EPO và EPO được biểu hiện ở nhiều vùng não khác nhau và tình trạng thiếu oxy/thiếu máu cục bộ chủ yếu kích thích biểu hiện của chúng [93, 94, 95, 96, 97, 98, 99]. Tín hiệu EPO đóng một vai trò then chốt trong quá trình hình thành tế bào thần kinh ở người trưởng thành và sự di chuyển của nguyên bào thần kinh đến các vùng thiếu máu cục bộ trong cơ thể, bên cạnh việc bảo vệ trực tiếp các tế bào thần kinh và điều chế phản ứng tạo mạch. Người ta cũng chứng minh rằng biểu hiện EPO chủ yếu bị hạn chế ở một số loại tế bào, chủ yếu là tế bào hình sao và cả tế bào thần kinh [93, 100, 101]. Ngoài ra, yếu tố gây thiếu oxy [102]—một dị vòng của tiểu đơn vị HIF-a và HIF-β—đã được phát hiện là có tác dụng điều chỉnh sự kích thích biểu hiện EPO do thiếu oxy gây ra. Chi tiết hơn, nồng độ oxy là tác nhân gây cảm ứng hiệu quả biểu hiện tiểu đơn vị HIF-a, trong khi biểu hiện của tiểu đơn vị HIF-0 có tính cấu thành và giảm dần theo các yếu tố phiên mã. Điều thú vị là, một nghiên cứu quan trọng đã xem xét vai trò của HIF-1a và HIF-2a (tức là hai trong số ba tiểu đơn vị HIF-a) trong việc tạo ra các tín hiệu bảo vệ cận tiết bởi tế bào hình sao, điều chỉnh sự sống sót của các tế bào thần kinh tiếp xúc với sự thiếu hụt oxy-glucose. . Nghiên cứu cho thấy HIF-2a là chất điều hòa chính biểu hiện EPO trong tế bào hình sao trong tình trạng thiếu oxy, cho thấy rằng tế bào hình sao đóng vai trò bảo vệ thần kinh quan trọng trong tình trạng thiếu oxy/thiếu máu cục bộ [103].
6 Thông khí cơ học
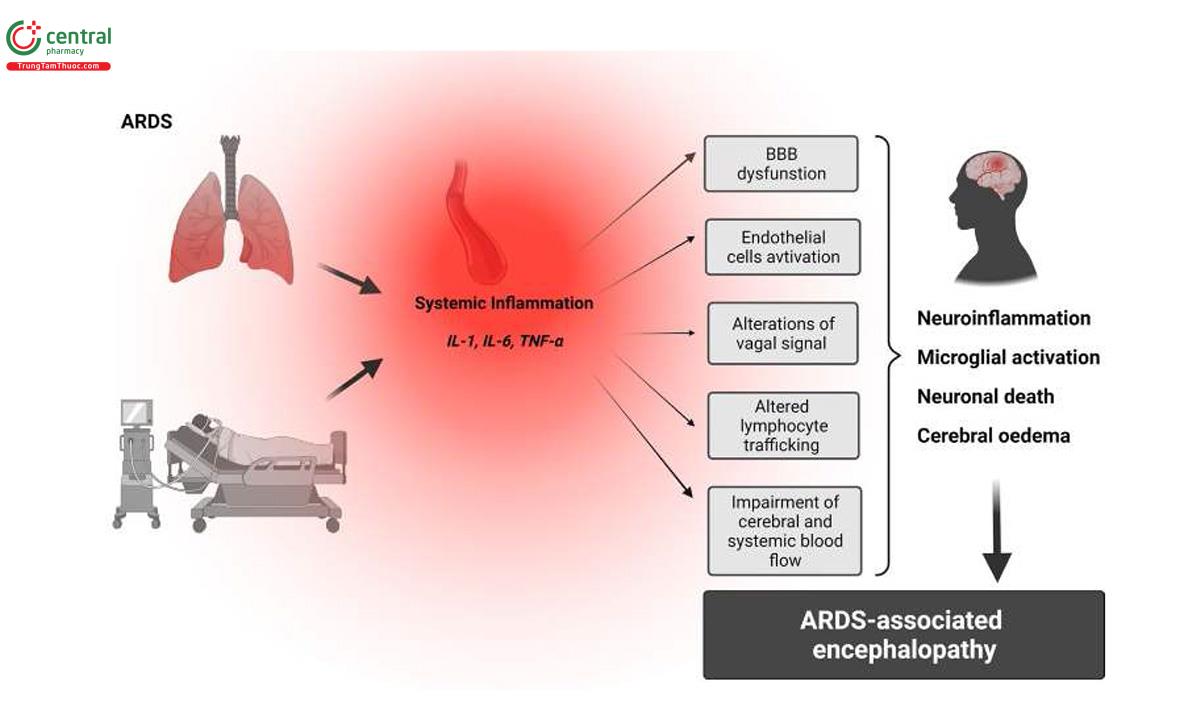
Như đã đề cập ở trên, mặc dù thở máy là một can thiệp trị liệu cứu sống trong việc quản lý bệnh nhân nguy kịch, nhưng có tài liệu rõ ràng rằng nó có thể kích hoạt hoặc làm trầm trọng thêm tình trạng viêm phổi và hệ thống [104, 105]. Các cơ chế sinh bệnh cơ bản bao gồm căng quá mức, xẹp phế nang tái phát và tái bơm phồng trong mỗi chu kỳ hô hấp [106]. Ngoài ra, có vẻ như việc chuyển đổi các kích thích cơ học sang kích thích sinh học có liên quan đến sinh lý bệnh của tổn thương phổi liên quan đến máy thở [107] với những tác động có hại cả cục bộ ở cấp độ phổi và các cơ quan và hệ thống ở xa bao gồm cả hệ thần kinh trung ương [4, 108]. Nhiều cơ chế, bao gồm các con đường thần kinh nội tiết, viêm, nội tiết tố và thần kinh, dường như có liên quan đến tổn thương não liên quan đến thở máy [4, 105, 109]. Ngoài ra, người ta đã chứng minh rằng sự mất cân bằng trong các chất dẫn truyền thần kinh (tức là dopamine và acetylcholine) góp phần vào sự phát triển của rối loạn chức năng nhận thức ở bệnh nhân ICU bị bệnh nặng [2, 49, 110, 111]. Nghiên cứu trước đây chứng minh rằng thông khí cơ học làm thay đổi tín hiệu phế vị, dẫn đến viêm dây thần kinh và chết tế bào thần kinh (Hình 2) [50, 70, 71, 72, 73, 74, 112, 113, 114]. Thật vậy, nhiều nghiên cứu đã ghi nhận sự gia tăng nồng độ của các tế bào viêm ở vùng hải mã qua trung gian dây thần kinh phế vị, ảnh hưởng đến trí nhớ sau phẫu thuật trên mô hình chuột thí nghiệm [71, 115]. Giả thuyết về sự điều hòa dây thần kinh phế vị trong việc gây ra phản ứng viêm não dường như được hỗ trợ thêm bởi phát hiện rằng việc thực hiện phẫu thuật cắt dây thần kinh phế vị hai bên trước khi thở máy ở chuột sẽ bảo vệ chống lại sự phát triển của tổn thương não [70]. Ngoài ra, một số nghiên cứu tiền lâm sàng đã kết luận rằng những bệnh nhân được thở máy trong thời gian dài có biểu hiện suy giảm chức năng nhận thức so với những bệnh nhân không được thở máy hoặc những bệnh nhân được thở máy trong thời gian ngắn [71, 112, 113]. Hơn nữa, sự gia tăng nồng độ của các tế bào viêm và protein proapoptotic đã được báo cáo trong não của những bệnh nhân được hỗ trợ thở máy [50, 70, 71, 72, 73, 74, 112, 113, 114]. Hơn nữa, có vẻ như những bệnh nhân nhận được thể tích khí lưu thông cao hơn có hoạt động hồi hải mã mạnh hơn, như đã thấy khi sử dụng MRI chức năng, dẫn đến tổn thương mô lớn hơn so với những bệnh nhân được thở máy với thể tích khí lưu thông thấp hơn [70]. Cuối cùng, người ta đã chứng minh rằng thể tích khí lưu thông cao hơn có thể dẫn đến hoạt động thần kinh bất thường ở vỏ não đai và đồi thị, bằng chứng là nồng độ c-Fos cao hơn ở các vùng não này, so với thể tích khí lưu thông thấp hơn [74].
Có tài liệu rõ ràng rằng thông khí cơ học bảo vệ với thể tích khí lưu thông thấp và áp lực dương cuối thì thở ra (PEEP) ở bệnh nhân mắc ARDS cải thiện kết quả bằng cách giảm strain phổi và ngăn ngừa viêm [4, 78]. Tuy nhiên, cần lưu ý thêm rằng chiến lược thở máy bảo vệ có thể dẫn đến tổn thương phổi tự phát, tăng CO2 máu và giãn mạch não sau đó, tăng lưu lượng máu não và tăng áp lực nội sọ [116]. Tuy nhiên, tác hại của chứng tăng CO2 cho phép đã được nghiên cứu trong một nghiên cứu nhỏ trên 12 bệnh nhân xuất huyết dưới nhện đang được thở máy bảo vệ. Các tác giả đã báo cáo rằng thở máy với thể tích khí lưu thông 5-8 ml/kg và mức PEEP vừa phải dẫn đến mức PaCO2 là 50-60 mmHg mà không ảnh hưởng tiêu cực đến áp lực nội sọ [117]. Hơn nữa, các nghiên cứu lâm sàng và thực nghiệm đã chỉ ra rằng thông khí với thể tích khí lưu thông cao gây ra sự kích hoạt vùng đồi thị cao hơn liên quan đến tổn thương mô nhiều hơn và hoạt động thần kinh bệnh lý, cho thấy tác dụng gây bệnh của thông khí thể tích khí lưu thông cao lên não [68].
PEEP cao là một phần khác của chiến lược thông khí bảo vệ được sử dụng trong ARDS để ngăn ngừa xẹp phế nang, huy động phế nang và giảm xẹp phổi [4, 118]. Tuy nhiên, PEEP cũng có thể làm tăng áp lực nội sọ (ICP), giảm hồi lưu tĩnh mạch não và lưu lượng dịch não tủy [4, 119]. Cơ chế sinh lý bệnh cơ bản rất phức tạp và liên quan đến nhiều yếu tố trong đó có giãn mạch não do áp lực trong lồng ngực tăng cao và áp lực động mạch trung bình giảm [4, 119]. Mặt khác, có ý kiến cho rằng PEEP làm tăng ICP, chỉ khi PEEP gây ra siêu bơm phồng phế nang, mặc dù khi PEEP gây huy động phế nang, không có ảnh hưởng đến tưới máu não và ICP [120].
Do các tác dụng phụ của thở máy (ví dụ: giải phóng phản ứng viêm cục bộ và toàn thân, thường cần dùng thuốc an thần sâu, phong tỏa thần kinh cơ và bất động), giải pháp thay thế để tránh nó có vẻ ngày càng thú vị [121]. Bất chấp những quan điểm gây tranh cãi và mâu thuẫn, thông khí không xâm lấn (NIV) có thể được xem xét để hỗ trợ ban đầu cho bệnh nhân mắc ARDS [122, 123]. Thật vậy, nghiên cứu LUNG SAFE cho thấy 15,5% bệnh nhân mắc ARDS ban đầu được thông khí không xâm lấn. Tuy nhiên, những bệnh nhân này được phát hiện có mức PEEP thấp hơn, thể tích hô hấp và nhịp thở cao hơn so với những bệnh nhân được thông khí xâm lấn. Ngoài ra, việc sử dụng NIV có liên quan đến rò rỉ mặt nạ nhiều hơn, bệnh nhân không dung nạp và chướng dạ dày [124]. Ngoài ra, có vẻ như xác suất thất bại của NIV tăng đáng kể theo mức độ nghiêm trọng của ARDS [124], đồng thời sự thất bại này làm kết quả xấu đi [125], cho thấy rằng sự chậm trễ trong đặt nội khí quản có thể có tác động tàn phá. Mặt khác, có vẻ như việc sử dụng NIV như một phương pháp tiếp cận ban đầu ở bệnh nhân mắc ARDS có liên quan đến việc tránh đặt nội khí quản ở một nửa số bệnh nhân và do đó, tỷ lệ mắc bệnh viêm phổi liên quan đến máy thở và tỷ lệ tử vong liên quan thấp hơn [122, 126]. Do bằng chứng mâu thuẫn từ các nghiên cứu lâm sàng hiện có và thiếu các khuyến nghị được ghi chép rõ ràng về việc sử dụng NIV ở những bệnh nhân bị ARDS bị ảnh hưởng nặng [127], việc sử dụng nó nên được giới hạn ở những bệnh nhân được lựa chọn nghiêm ngặt. Cần có nghiên cứu chất lượng cao hơn nữa để xác định rõ ràng vai trò của NIV trong điều trị bệnh nhân mắc ARDS nguy kịch.
7 Sự mất ổn định về huyết động
Sự mất ổn định huyết động là nguyên nhân hàng đầu làm tăng tỷ lệ tử vong ở bệnh nhân mắc ARDS và thường liên quan đến bệnh tim phổi, tác động có hại của MV lên chức năng tâm thất phải và cơ học mạch máu phổi, ngoài ra còn liên quan đến nhiễm trùng huyết [128, 129]. Cụ thể, thông khí cơ học gây ra những thay đổi về thể tích phổi và do đó làm thay đổi trương lực mạch máu và sức cản mạch máu phổi. Đặc biệt khi sử dụng thể tích khí lưu thông cao, thông khí cơ học có thể dẫn đến hiện tượng tương tự như chèn ép tim (tamponade) do chèn ép tim vào hố tim (cardiac fossa) [130]. Hơn nữa, những thay đổi về áp lực xuyên phổi ảnh hưởng đến hậu tải thất phải, trong khi những thay đổi về áp lực màng phổi ảnh hưởng đến sự hồi lưu của tĩnh mạch, dẫn đến rối loạn huyết động [128].
Bởi vì não là một cơ quan trao đổi chất chuyên sâu, chiếm khoảng 20% tổng lượng oxy tiêu thụ của cơ thể [131, 132] trong điều kiện bình thường, CBF xấp xỉ 50 ml/phút/100 g mô não và không đổi, nếu huyết áp động mạch hệ thống trung bình dao động trong khoảng từ 60 đến 150 mmHg, đảm bảo cơ chế tự điều hòa của não [133, 134, 135]. Theo lý do này, có thể kết luận rằng sự mất ổn định huyết động ở bệnh nhân thở máy mắc ARDS làm suy yếu cơ chế cân bằng nội môi của CNS, khiến não dễ bị tổn thương thứ phát [128, 129, 136, 137].
Ngày càng có nhiều bằng chứng ủng hộ giả thuyết rằng những thay đổi về huyết động, dẫn đến giảm tưới máu não, đóng một vai trò cơ bản trong sự phát triển rối loạn chức năng nhận thức thần kinh ở những bệnh nhân nguy kịch [138, 139]. Các nghiên cứu thực nghiệm và lâm sàng đã chỉ ra rằng giảm tưới máu não có liên quan rõ ràng đến rối loạn điều hòa chuyển hóa và năng lượng, thoái hóa mao mạch não, mất thụ thể cholinergic, gián đoạn tổng hợp protein và tổn thương tế bào thần kinh, ảnh hưởng đến các vùng não cụ thể nhạy cảm với các quá trình nêu trên và chủ yếu là, hồi hải mã [91, 140, 141]. Tuy nhiên, đặc biệt ở những bệnh nhân bị sốc nhiễm trùng, những thay đổi về vi tuần hoàn cùng với những thay đổi về tuần hoàn vĩ mô, có thể làm suy yếu khả năng tách cặp thần kinh, phá vỡ BBB và kích hoạt dòng đông máu, dẫn đến tổn thương do thiếu máu cục bộ thêm [142].
Mặc dù nằm ngoài phạm vi của tổng quan hiện tại, nhưng cần nhấn mạnh rằng không nên bỏ qua tính không đồng nhất của mạch máu não. Sự khác biệt đáng kể về vùng, tế bào và chức năng tồn tại và cần được tính đến với các vùng mạch máu não cụ thể có liên quan khác nhau đến sinh lý bệnh của các quá trình thần kinh khác nhau [9, 11, 143, 144, 145].
8 Kết luận
Để kết luận, các nghiên cứu thực nghiệm và lâm sàng cho thấy rõ ràng có tương tác phức tạp và có thể cảm nhận được giữa phổi và não ở những bệnh nhân bị tổn thương phổi cấp tính. Mục đích của tổng quan hiện tại là tập trung vào sinh lý bệnh của chấn thương não cấp tính ở bệnh nhân mắc ALI/ARDS. Như chúng tôi đã chỉ ra, ARDS liên quan đến việc kích hoạt các dòng viêm toàn thân và viêm thần kinh, do đó não của bệnh nhân ARDS và đặc biệt là vùng hải mã trở nên rất dễ bị tổn thương trước sự phát triển của chấn thương não cấp tính qua trung gian phổi thứ phát. Chiến lược máy thở bảo vệ có thể làm giảm hoặc thậm chí giảm thiểu sự giải phóng thêm các chất trung gian gây viêm trong hệ thống và do đó duy trì cân bằng nội môi của não. Cần có những sàng lọc sâu hơn để nâng cao hiểu biết của chúng ta về chấn thương não cấp tính liên quan đến ARDS và đánh giá cách xử trí tối ưu đối với chấn thương não cấp tính liên quan đến phổi.

