Chẩn đoán và điều trị tổn thương thận trong xơ gan - KDIGO 2012, EASL 2018 và AASLD 2021
Trungtamthuoc.com - Tổn thương thận ở bệnh nhân xơ gan được đã biết đến từ lâu, tuy nhiên việc chẩn đoán bệnh này vẫn đang là một thách thức lớn. Bài viết dưới đây giúp cung cấp kiến chức về nguyên nhân, cách chẩn đoán và hướng xử trí cũng như dự phòng tình trạng này.
1 TỔN THƯƠNG THẬN TRONG XƠ GAN
1.1 ĐỊNH NGHĨA VÀ CHẨN ĐOÁN
Tổn thương thận ở bệnh nhân xơ gan được đã định nghĩa hơn 30 năm trước bằng giá trị Creatinin huyết thanh (SCr) ≥ 1.5mg/dl bởi vì giá trị này tương quan với GFR s 40ml/phút. Sử dụng SCr để đánh giá chức năng thận ở bệnh nhân xơ gan có nhiều điểm hạn chế và nếu chỉ dựa trên sự sụt giảm GFR, chẩn đoán bệnh thận mạn (CKD) trong xơ gan vẫn đang là một thách thức bởi vì tất cả các công thức sử dụng chỉ số SCr được đề xuất đều cho giá trị ước đoán GFR cao hơn thực tế ở bệnh nhân xơ gan.
Suy thận cấp (ARF) là một biến chứng phổ biến của xơ gan mất bù. Trong quá khứ, chẩn đoán ARF dựa trên sự tăng SCr trên 50% so với giá trị nền đến giá trị >1.5mg/dl (133µmol/L). Ngày nay, thuật ngữ suy thận cấp (ARF) đã được thay thế bằng tổn thương thận cấp (AKI). Theo KDIGO, AKI được xác định khi giá trị SCr tăng 20,3 mg/dl (226,4 micromol/L) trong vòng 48 giờ, hoặc tăng SCr từ 50% trở lên (gấp 1,5 lần so với giá trị nền) trong 7 ngày.
Một hệ thống phân giai đoạn mới đã được giới thiệu (bảng 1), chủ yếu dựa trên tỉ lệ SCr gia tăng tại thời điểm đầu tiên thỏa mãn tiêu chuẩn của KDIGO (giai đoạn khởi đầu) hoặc tại giá trị đỉnh của SCr trong suốt thời gian nằm viện (giai đoạn đỉnh) so với mức nền của bệnh nhân. Từ đó, một phác đồ mới điều trị AKI cho bệnh nhân xơ gan đã được đề xuất dựa trên hệ thống phân giai đoạn và theo kết quả từ một số nghiên cứu hồi cứu (lưu đồ 1). Những nghiên cứu gần đây gợi ý rằng bệnh nhân xơ gan bị AKI ở giai đoạn 1 có SCr<1.5 mg/dl có kết cục xấu hơn những bệnh nhân có SCr ≥1.5mg/dl. Do đó, khác với hệ thống phân loại của KDIGO, AKI giai đoạn 1 được CLB Cổ trướng thế giới (ICA) để xuất phân thành 2 nhóm 1A (SCr <1.5mg/dL) và 1B (SCr ≥ 1.5mg/dL). KDIGO cũng đề xuất tiêu chuẩn về lượng nước tiểu để chẩn đoán AKI (bảng 3), tuy nhiên tiêu chuẩn này không nhận được sự đồng thuận của CLB cổ trướng thế giới (ICA) bởi vì: (a) những bệnh nhân này thường có tình trạng thiểu niệu, tăng giữ natri mặc dù GFR bình thường, (b) lượng nước tiểu có thể tăng do đang sử dụng lợi tiểu và (c) trên thực tế, việc thu thập nước tiểu thường không chính xác và không kịp thời. Tuy nhiên, tiêu chuẩn này vẫn có thể áp dụng cho những bệnh nhân xơ gan có đặt catheter bàng quang.
Định nghĩa về mức SCr nền được dùng trong tiêu chuẩn của KDIGO là rất quan trọng vì có khoảng 25-30% AKI xảy ra trước khi nhập viện hay còn gọi là "AKI mắc phải tại cộng đồng". "AKI mắc phải tại cộng đồng" nên được chẩn đoán ngay khi vào viện và theo tiêu chuẩn của AKI chúng ta cần có chỉ số SCr của 7 ngày trước đó. Một số tác giả cho rằng khi không có sẵn giá trị Scr trong vòng 7 ngày trước khi nhập viện thì giá trị này có thể được tính toán bằng cách tính ngược lại từ công thức ước đoán GFR, xem xét lấy giá trị GFR bình thường là 75ml/phút. Tuy vậy, giá trị SCr ước đoán lại không được chấp nhận cho nhóm bệnh nhân xơ gan trong khi vẫn được chấp nhận cho hầu hết các nhóm bệnh nhân khác. Vì ở bệnh nhân xơ gan, tất cả các công thức ước đoán GFR dựa trên SCr đều cho kết quả cao hơn thực tế nên nếu suy ngược như vậy sẽ làm ước đoán mức Scr nền cao hơn thực tế dẫn tới tỉ lệ AKI khi nhập viện thấp hơn. Do đó, giá trị SCr nền của bệnh nhân xơ gan là giá trị thu được trong cả 3 tháng trước nhập viện chứ không chỉ trong 7 ngày
Bảng 1: Định nghĩa mới của CLB Cổ trướng thế giới về chẩn đoán tổn thương thận cấp ở bệnh nhân xơ gan (ICA-AKI)
| Thông số | Định nghĩa | ||
| SCr nền | Là giá trị SC trong 3 tháng trước đó. Ở những bệnh nhân có nhiều hơn 1 giá trị SCr, giá trị gần với lần nhập viện nhất được sử dụng làm SCr nén. Bệnh nhân không có giá trị SC trong 3 tháng trước đó, có thể dùng giá trị SCr tại thời điểm nhập viện làm giá trị nền | ||
| AKI | Tăng SCr ≥ 0,3 mg/dl (≥ 26,5 µmol/l) trong 48 giờ hoặc tăng SCr ≥50% so với giá trị nền trong 7 ngày trước đó. | ||
| Giai đoạn AKI | -GĐ 1: Tăng SCr ≥ 0,3 mg/dl (≥ 26,5 µmol/l) hoặc tăng SCr ≥ 1,5-2 lần giá trị nền. Được chia làm GĐ 1A (SCr<1,5 mg/dl) và 1B (SCr ≥1,5 mg/dl). - GĐ 2: Tăng SCr > 2-3 lần giá trị nền. -GĐ 3: Tăng SCr > 3 lần giá trị nền hoặc SCr ≥ 4 mg/dl (≥ 352 µmol/l) có tăng cấp tính ≥ 26,4 µmol/l hoặc bắt đầu liệu pháp thay thế thận. | ||
| Diễn tiến của AKI | Tiến triển | Thuyên giảm | |
| AKI tiến triển đến giai đoạn cao hơn và/hoặc cần điều trị thay thế thận. | AKI thoái lui đến giai đoạn thấp hơn | ||
| Đáp ứng điều trị | Không đáp ứng | Đáp ứng một phần | Đáp ứng hoàn toàn |
| AKI không thoái lui | Giảm SCr đến giá trị ≥ 0,3 mg/dl so với giá trị nén (SCr - SCrnén ≥ 0,3 | Giảm SCr đến giá trị trong giới hạn 0,3 mg/dl so với giá trị nén (SCr-SCrnen < 0,3). | |
AKI: tổn thương thận cấp; SCr: nồng độ creatinine huyết thanh
Ngoài ra, nồng độ SCr trong vòng 3 tháng trước đó còn có giá trị để xác định bệnh thận cấp (AKD), một trong ba loại tổn thương thận (cùng với AKI và CKD) được KDIGO phân loại trong khuyến cáo mới đây. AKD là một nhóm riêng biệt với kết cục khác với những loại khác và có thể có hoặc không liên quan đến AKI. AKD được xác định khi GFR< 60ml/phút/1.73m2 da hoặc giảm GFR ≥35% hoặc tăng SCr ≥50% kéo dài dưới 3 tháng. Tuy nhiên, chưa có dữ liệu nào đánh giá tiên lượng về tác động của AKD (có hoặc không có AKI) ở bệnh nhân xơ gan. Vì vậy, trong khi chờ đợi các nghiên cứu trong tương lai, chẩn đoán AKI ở bệnh nhân xơ gan sẽ hợp lý hơn khi có SC tăng ≥50% trong ba tháng qua. Điều này cũng tạo điều kiện thuận lợi cho chẩn đoán những bệnh nhân AKI chồng lấp trên CKD.
Bảng 2: Định nghĩa tổn thương thận theo KDIGO 2012
| Khái niệm | Tiêu chuẩn về chức năng | Tiêu chuẩn về cấu trúc |
| Tổn thương thận cấp (AKI) | - Tăng SCr ≥50% trong vòng 7 ngày hoặc - Tăng SCr ≥ 0,3 mg/dl trong vòng 2 ngày | Không có |
| Bệnh thận cấp (AKD) | GFR<60 ml/phút/1,73 m2 kéo dài dưới 3 tháng hoặc giảm GFR ≥35% hoặc tăng SCr ≥ 50% kéo dài dưới 3 tháng | Tổn thương thận kéo dài dưới 3 tháng |
| Bệnh thận mạn (CKD) | GFR <60 ml/phút/1,73m2 kéo dài trên 3 tháng. | Tổn thương thận kéo dài trên 3 tháng |
Bảng 3: Chẩn đoán giai đoạn AKI dựa vào lượng nước tiểu (KDIGO 2012)
| Giai đoạn | Lượng nước tiểu |
| 1 | <0,5 ml/kg/h trong 6-12 giờ |
| 2 | <0,5 ml/kg/h kéo dài ≥12 giờ |
| 3 | <0,5 ml/kg/h kéo dài ≥24 giờ hoặc vô niệu kéo dài ≥12h |
KHUYẾN CÁO CỦA EASL 2018 • Ở bệnh nhân xơ gan, chỉ cần SC tăng nhẹ cũng cần được chú ý xem xét vì đó có thể là dấu hiệu của sự sụt giảm đáng kể GFR. (II-2;1) • Bước đầu tiên cần thực hiện trong quy trình chẩn đoán là xác định bệnh nhân có mắc CKD, AKD hay AKI hay không và sự chống lấp giữa các nhóm trên. (II-2;1) • Chẩn đoán CKD nên dựa trên kết quả GFR <60ml/phút/1.73m2 ước đoán bằng công thức dựa trên SCr, có hoặc không dấu hiệu tổn thương nhu mô thận (protein niệu/tiểu máu/bất thường trên siêu âm) trong ít nhất 3 tháng. (II-2;1) • Nên hoàn thành quy trình chẩn đoán bằng cách phân độ CKD dựa trên mức GFR và tìm kiếm nguyên nhân. Cần chú ý rằng, bất cứ công thức ước đoán GFR dựa trên SCr nào cũng thường cho kết quả cao hơn thực tế ở bệnh nhân xơ gan. (II-2;1) • Ở bệnh nhân xơ gan, chẩn đoán AKI nên áp dụng theo tiêu chuẩn của KDIGO sửa đổi với SCr tăng >0.3mg/dl so với giá trị nền trong vòng 48 giờ hoặc tăng ≥ 50% so với mức nền trong 3 tháng. (II-2;1) • Phân chia giai đoạn của AKI dựa theo hệ thông phân giai đoạn của KDIGO sửa đổi với sự khác biệt ở AKI giai đoạn 1 khi được phân thành 1A và 18 lần lượt tương ứng với SCr <1.5 hay ≥1.5 mg/dl. (II-2;1) |
1.2 YẾU TỐ THÚC ĐẨY
Nhiễm trùng, sử dụng thuốc lợi tiểu quá mức, xuất huyết tiêu hóa, không bù đủ thể tích khi chọc tháo bảng lượng lớn, thuốc độc thận và NSAID là những yếu tố thúc đẩy hay gặp của AKI ở bệnh nhân xơ gan. Khả năng gây độc thận của các chất cản quang ở bệnh nhân xơ gan vẫn đang còn là vấn đề gây tranh cãi, tuy vậy, cần thận trọng khi thực hiện các kĩ thuật có thuốc cản quang đặc biệt ở những bệnh nhân xơ gan mất bù hoặc ở những bệnh nhân đã có CKD. Cuối cùng, tăng áp lực ổ bụng do báng có thể dẫn đến AKI do tăng áp lực tĩnh mạch thận.
1.3 ĐIỀU TRỊ
KHUYẾN CÁO CỦA EASL 2018
• Khi đã chẩn đoán AKI, cần tìm nguyên nhân càng sớm càng tốt để ngăn chặn sự tiến triển của AKI. Nên bắt đầu điều trị ngay lập tức kể cả khi chưa biết nguyên nhân rõ ràng. Cần chú ý và thực hiện một cách tối ưu việc tầm soát và điều trị các nhiễm trùng. (II-2;1)
• Cần ngưng ngay các loại thuốc lợi tiểu và/hoặc chẹn beta cũng như các thuốc khác có liên quan đến AKI như thuốc dẫn mạch, NSAID hay thuốc độc thận. (II-2;1)
• Cần bù hoàn lại thể tích phù hợp với nguyên nhân và lượng dịch mất. (II-2;1) Bệnh nhân tiêu chảy và lợi tiểu quá mức cần được dùng dịch tinh thể trong khi nên truyền hồng cầu khối cho bệnh nhân xuất huyết tiêu hóa để giữ Hb từ 7-9g/dl. Ở bệnh nhân AKI có báng căng, chọc tháo báng cần kết hợp với bù albumin thích hợp vì nó giúp cải thiện chức năng thận.
• Trong trường hợp không biết nguyên nhân rõ ràng và AKI đang ở giai đoạn >1A, nên truyền dung dịch albumin 20% với liều 1g albumin/kg trọng lượng cơ thể (tối đa 100 g albumin) trong hai ngày liên tiếp. (III;1)
• Ở bệnh nhân AKI và báng căng, chọc tháo báng cần kết hợp với bù albumin ngay cả khi chọc tháo với lượng ít. (III, 1)
HƯỚNG DẪN THỰC HÀNH AASLD 2021
• Một khi AKI được chẩn đoán, cần phát hiện và giải quyết nhanh các yếu tố nguy cơ bao gồm: mất dịch, nhiễm khuẩn, huyết động không ổn định và các dùng các chất có khả năng gây độc cho thận (đặc biệt là thuốc chống viêm không steroid).
• AKI do giảm thể tích máu nên được điều trị bằng liệu pháp bù dịch, điều chỉnh nguyên nhân dẫn đến giảm thể tích và ngừng thuốc lợi tiểu.
• Chẩn đoán phân biệt AKI, HRS và ATN là một thách thức và cần theo các bước đã được trình bày trong lưu đồ 1
1.4 CÁC TYPE CỦA TỔN THƯƠNG THẬN CẤP (AKI)
Tất cả các type của AKI bao gồm: AKI trước thận, hội chứng gan thận (HRS), AKI tại thận và AKI sau thận đều có thể xảy ra ở bệnh nhân xơ gan. Nguyên nhân hay gặp nhất của AKI ở bệnh nhân xơ gan mất bù đang nằm viện là nguyên nhân trước thận, chiếm xấp xỉ 68% trường hợp. AKI tại thận chủ yếu là hoại tử ống thận cấp (ATN), trong khi đó nguyên nhân sau thận thường không phổ biến ở bệnh nhân xơ gan mất bù. Hầu hết các trường hợp AKI trước thận đều cải thiện với bù đủ dịch và AKI sau thận thường ít phổ biến, vậy điểm mấu chốt là cần phân biệt hoại tử ống thận cấp (ATN) và hội chứng gan thận (HRS). Như sắp đề cập trong mục "Hội chứng gan thận", khái niệm rằng HRS chỉ là một tổn thương chức năng đã bị phản đối trong suốt thập kỉ vừa qua và vì vậy, định nghĩa của HRS phải được sửa đổi. Cùng với đó, trong thực hành lâm sàng hiếm khi thực hiện sinh thiết thận ở bệnh nhân được chẩn đoán AKI nên phân biệt HRS-AKI với ATN là khá khó khăn. Gần đây, nhiều dấu ấn sinh học mới đã xuất hiện trong đó hứa hẹn nhất là NGAL (urinary neutrophil gelatinaseassociated lipocalin). Thật vậy, một số nghiên cứu cũng đã chỉ ra rằng NGAL nước tiểu là một marker của tổn thương ống thận, có thể giúp xác định type của AKI. Tuy nhiên, điềm cắt có sự khác nhau lớn giữa các nghiên cứu, có sự chống lấp giữa các type AKI khác nhau và cũng cần nhấn mạnh rằng không có nghiên cứu nào khẳng định lại chẩn đoán bằng sinh thiết thận. Như vậy, chẩn đoán dựa trên sự phối hợp nhiều marker sinh học là một vấn đề đáng hứa hẹn nhưng cần thêm nhiều dữ kiện trong tương lai.
KHUYẾN CÁO CỦA EASL 2018 • Tất cả các type của AKI bao gồm: AKI trước thận, hội chứng gan thận, AKI tại thận (đặc biệt là ATN) và AKI sau thận đều có thể xảy ra ở bệnh nhân xơ gan. Vì vậy, phân biệt chúng là điều quan trọng. (II-2;1) • Chuẩn đoán HRS-AKI cần dựa trên tiêu chuẩn của ICA sửa đổi. Vì sinh thiết thận hiếm khi được thực hiện cho bệnh nhân AKI, do đó nên thực hiện bổ sung các marker sinh học. Trên thực hành lâm sàng, trong số các marker sinh học hiện nay, có thể sử dụng NGAL để phân biệt giữa ATN và HRS. (II-2; 2) |
1.5 DỰ PHÒNG AKI THEO AASLD 2021
• Nguyên tắc đầu tiên trong dự phòng AKI là điều trị hoặc phòng ngừa các yếu tố nguy cơ, đặc biệt là xuất huyết tiêu hóa, nhiễm khuẩn, và tránh việc chọc báng lượng lớn mà không dùng albumin.
• Ngoài ra, những trường hợp cụ thể, có thể khuyến khích điều trị để dự phòng AKI. Ví dụ, albumin truyền tĩnh mạch cùng với kháng sinh, làm giảm tỷ lệ mới mắc HRS-AKI và cải thiện sự sống ở bệnh nhân SBP. Ngược lại, việc sử dụng albumin ở bệnh nhân xơ gan có nhiễm khuẩn mà không phải là SBP thì không ngăn ngừa HRS-AKI cũng như cải thiện tỷ lệ sống.
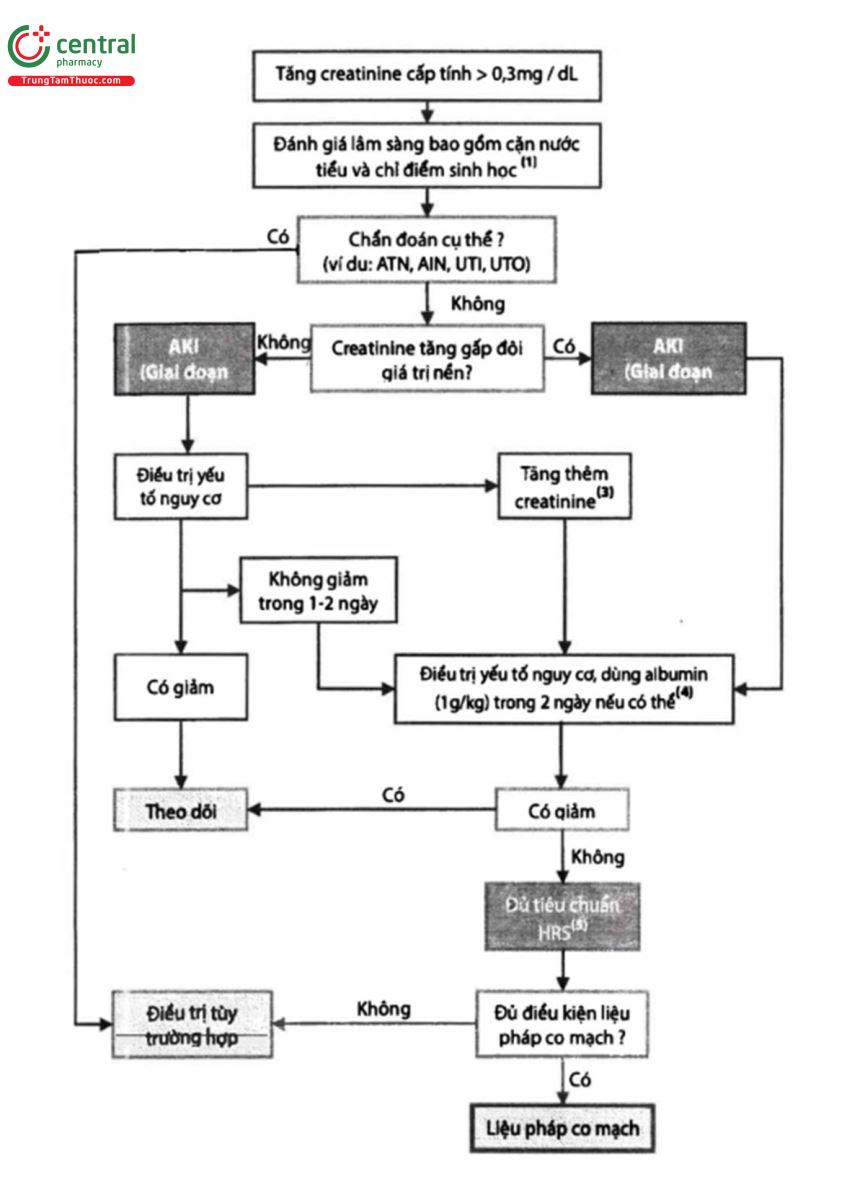
Các bước chẩn đoán quan trọng bao gồm:
[1] đánh giá lâm sàng và xét nghiệm cặn lắng nước tiểu và các chỉ điểm sinh học
[2] sự đáp ứng điều trị các yếu tố nguy cơ
[3] đánh giá đáp ứng với truyền albumin.
Chú thích:
(1) Đánh giá lâm sàng bao gồm đánh giá các nguyên nhân trước thận (vd: mất nước, lợi tiểu quá mức) hoặc nguyên nhân tổn thương cấu trúc (như sốc, chất độc thận, bệnh lý tắc nghẽn đường bài niệu). Xét nghiệm cặn lắng nước tiểu và chỉ điểm sinh học (đặc biệt là NGAL) có thể chỉ ra hoại tử ống thận cấp, trong khi phân xuất bài tiết Natri <1% gợi ý HRS.
(2) Điều trị các yếu tố nguy cơ bao gồm: dừng các thuốc gây độc cho thận, giảm hoặc ngưng lợi tiểu, phát hiện và điều trị nhiễm khuẩn nếu có và bổ sung thể tích tuần hoàn (nếu giảm thể tích nặng) bằng albumin 5% hoặc dung dịch tinh thể.
(3) Trên những bệnh nhân vẫn tiếp tục tăng creatinine máu mặc dù đã điều trị yếu tố nguy cơ, cần ngay lập tức thực hiện bước tiếp theo là truyền albumin. Một số thành viên của nhóm viết ủng hộ việc chú ý đến giá trị creatinin tuyệt đối ngoài sự thay đổi của creatinin để tiến hành bước này nhằm cho phép sử dụng thuốc co mạch sớm hơn ở những bệnh nhân có creatinine máu cao (ví dụ:> 1,5 mg/dL).
(4) Những bệnh nhân này thường có báng kháng trị và hầu như luôn có hạ natri máu.
(5) HRS được định nghĩa ở bảng 4. ATN: hoại tử ống thận cấp; AIN: viêm thận kẻ;
UTI: nhiễm trùng đường tiểu; UTO: tắc nghẽn đường niệu.
2 HỘI CHỨNG GAN THẬN (HEPATORENAL SYNDROME - HRS)
Hội chứng gan thận (HRS) là một biến chứng phổ biến của xơ gan, tỷ lệ báo cáo khoảng 10% trong số bệnh nhân nhập viện với xơ gan có báng.
Theo cổ điển, hội chứng gan thận (HRS) là một tình trạng suy thận chức năng, không có tổn thương thận thực tế, xảy ra trên bệnh nhân có bệnh gan mạn tính tiến triển, thỉnh thoảng ở những bệnh nhân viêm gan tối cấp, những người có tăng áp lực tĩnh mạch cửa và có báng. Tuy nhiên, quan điểm này đã có nhiều thay đổi trong những năm gần đây.
2.1 CHẨN ĐOÁN VÀ PHÂN LOẠI
Gần đây, Câu lạc bộ cổ trướng Quốc tế (ICA 2015) đã đưa ra tiêu chuẩn chẩn đoán HRS mới dựa trên việc áp dụng tiêu chuẩn AKI-ICA. Như vậy, chẩn đoán hội chứng gan thận là một chẩn đoán loại trừ và khi đầy đủ các tiêu chuẩn sau:
Bảng 4: Tiêu chuẩn chẩn đoán hội chứng gan thận
| 1. Xơ gan có có trướng |
| 2. Chẩn đoán AKI theo tiêu chuẩn AKI-ICA. |
| 3. Không cải thiện Creatinin huyết thanh sau ít nhất 2 ngày dừng thuốc lợi tiểu và bối phụ thể tích bằng Albumin (1 g/kg cân nặng mỗi ngày). |
| 4. Không có tình trạng shock. |
| 5. Không điều trị gần đây với thuốc gây độc cho thận (NSAIDs, aminoglycoside,...) |
| 6. Không có dấu hiệu tổn thương cấu trúc thận (với biểu hiện Protein niệu >500 mg/ngày, hồng cầu niệu vì thế >50 tế bào trên một vi trường độ phóng đại cao, và/hoặc có bất thường trên siêu âm thận). |
Theo cổ điển, HRS có 2 type với tiên lượng khác nhau, đặc biệt type 1 có tiên lượng cực kỳ xấu với tỷ lệ tử vong cao.
| Type 1 | Type 2 |
- Creatinine tăng gấp đôi, > 221 micromol/L trong ≤2 tuần. - Nặng, tiến triển nhanh. - Thường xảy ra ở những bệnh nhân có viêm gan rượu nặng, giai đoạn cuối của xơ gan, bệnh nhiễm trùng. | - Creatinine từ 133 - 221 micromol/L. - Suy thận mức độ trung bình. - Thường tiến triển tự phát, nhưng cũng thể xuất hiện sau các yếu tố thúc đẩy. - Thường kèm có trưởng dai dẳng |
Theo EASL 2018
Trong một thời gian dài, HRS được định nghĩa là tình trạng "suy thận chức năng" do co các mạch máu tại thận và xảy ra ở những bệnh nhân bệnh gan giai đoạn cuối, suy gan cấp hay viêm gan rượu". Gần đây, đã có nhiều bằng chứng phản đối định nghĩa này cũng như sự phân chia type 1 và 2 của HRS. Đầu tiên, như sẽ để cập bên dưới, sinh bệnh học của HRS bao gồm cả các thay đổi về huyết động cũng như quá trình viêm. Thứ hai, tình trạng không có các tổn thương nhu mô thận (suy thận chức năng) chưa bao giờ được chứng minh bằng sinh thiết thận. Việc không có protein niệu và/hoặc tiểu máu không thể loại trừ các tổn thương thận, đặc biệt là tổn thương ống thận và mô kê. Ngoài ra, các nghiên cứu đánh giá các marker sinh học của thận đã chỉ ra rằng tổn thương ống thận có thể xảy ra ở bệnh nhân mác HRS-AKI khi HRS được chẩn đoán theo các tiêu chuẩn truyền thống. Cuối cùng, cần lưu ý rằng HRS-AKI có thể xảy ra ở những bệnh nhân có bệnh nến là CKD.
Type 1 và type 2 là những khái niệm mang tính lịch sử được xác định dựa trên mức tăng của SC theo thời gian. Trong phân loại sửa đổi gần đây, HRS type 1 hiện nay tương ứng với HRS-AKI, còn HRS type 2 bao gồm các tổn thương thận đáp ứng đủ tiêu chuẩn của HRS nhưng không phải AKI, được gọi là non-AKI-HRS (NAKI) và chỉ là HRS-CKD như đề xuất trước đây.
2.2 YẾU TỐ LÀM DỄ KHỞI PHÁT HỘI CHỨNG GAN THẬN
Xơ gan có báng
• Dùng thuốc lợi tiểu, thuốc độc gan
• Nhiễm trùng báng
• Nhiễm trùng
• Dẫn lưu dịch báng lượng nhiều không bù Albumin
• Xuất huyết tiêu hóa
Viêm gan rượu
Suy gan cấp
2.3 SINH BỆNH HỌC
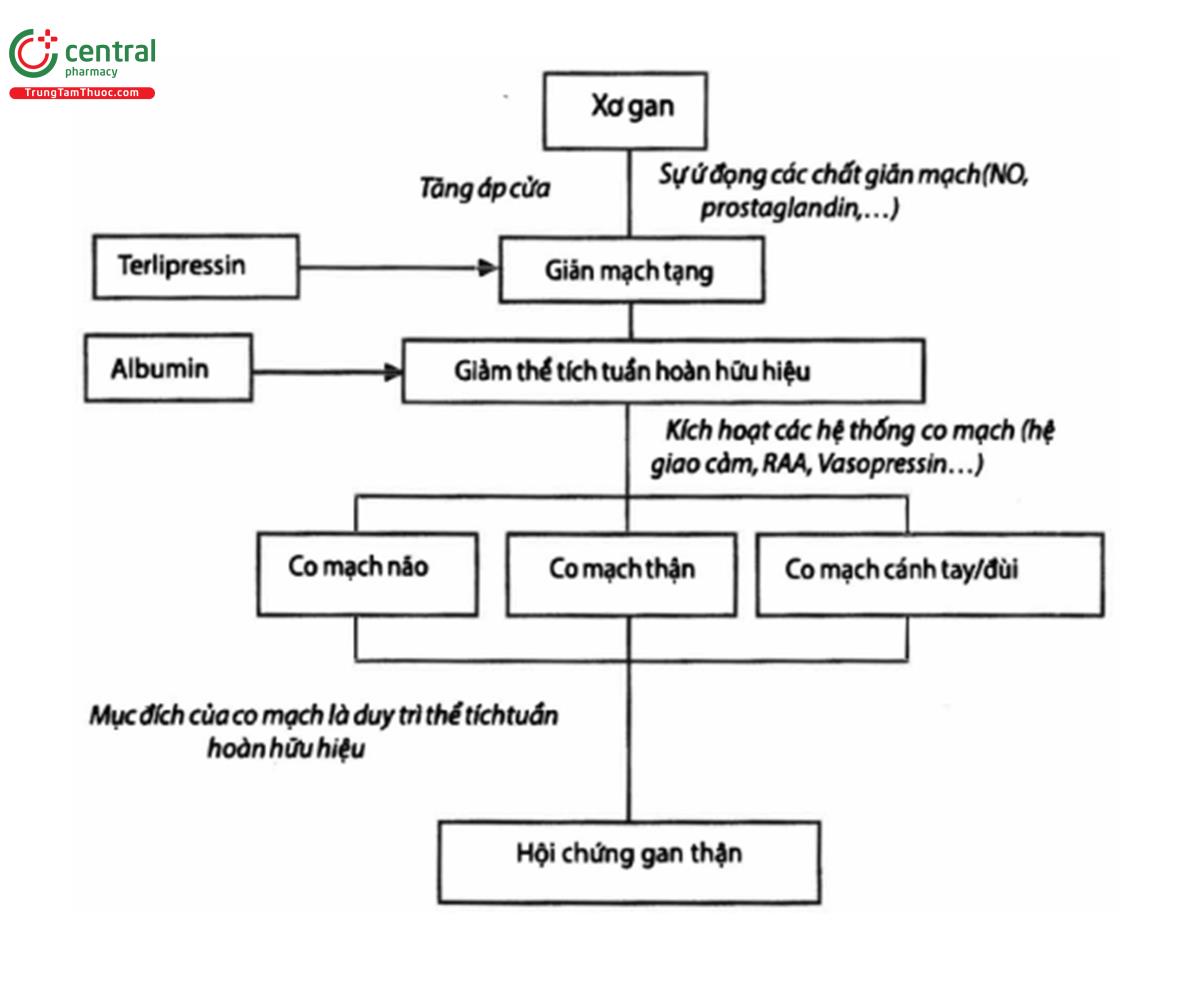
Dựa trên các giả thuyết mới về sinh bệnh học của xơ gan mất bù, quan điểm về HRS đã thay đổi trong những năm gần đây so với quan điểm cũ là HRS chỉ liên quan đến giảm tưới máu thận do rối loạn chức năng tuần hoàn (dãn tĩnh mạch lách hay giảm cung lượng tim). Các giả thuyết mới cho rằng sự tăng các cytokine tiền viêm và các chemokine lưu hành trong máu có thể liên quan trực tiếp đến việc xuất hiện HRS. Sự tương tác hiệp đồng giữa quá trình viêm và rối loạn chức năng vi mạch là nguyên nhân dẫn đến sự khuếch đại tín hiệu của PAMPs và DAMPs tác động lên các tế bào biểu mô đoạn gần ống thận. Việc nhận diện các tín hiệu này và sau đó lan tỏa đến tất cả các tế bào biểu mô ống lượn gần gây ra sự biến đổi các quá trình chuyển hóa qua trung gian ty lạp thể và tái sắp xếp các chức năng của tế bào để ưu tiên trên hết cho các quá trình mang tính sống còn. Các chức năng bị hy sinh là hấp thu của natri và clorua ở phía lòng ống. Việc tăng Natri clorua đến các tế bào dát đặc sẽ kích hoạt hệ thống RAAS tại thận và do đó làm giảm GFR. Cuối cùng, tình trạng ứ mật nghiêm trọng ở bệnh nhân xơ gan có thể làm suy giảm chức năng thận bằng cách làm nặng thêm tình trạng viêm và/hoặc rối loạn tuần hoàn, hay trực tiếp gây tổn thương ống thận. Tất cả những quan sát trên cho thấy rằng sinh bệnh học của AKI, đặc biệt là HRS-AKI, ở những bệnh nhân xơ gan mất bù, dường như phức tạp hơn rất nhiều so với những giả thuyết trước đây, ủng hộ cho quan điểm rằng AKI-HRS không đơn thuần là tổn thương thận chức năng.
2.4 ĐIỀU TRỊ
Bảng 5: Nguyên tắc và phương pháp điều trị chung
| Điều trị chung: Ngưng thuốc lợi tiểu, ngưng thuốc độc cho thận, điều trị nhiễm trùng, cân bằng điện giải. |
Các phương pháp điều trị:
|
2.4.1 Điều trị bằng thuốc
Một khi HRS-AKI (HRS type 1) được chẩn đoán, nên nhanh chóng chỉ định thuốc co mạch kết hợp truyền albumin cho bệnh nhân. Thuốc co mạch được dùng để chống lại sự giãn động mạch lách và cải thiện tưới máu thận. Terlipressin, một chất tương tự vasopressine, là thuốc được sử dụng thông dụng nhất. Lợi ích của việc sử dụng terlipressin kết hợp với albumin đã được chứng minh qua nhiều nghiên cứu. Trong những nghiên cứu mới đây nhất, tỉ lệ đáp ứng (hoàn toàn hay một phần) với riêng liệu trình điều trị này nằm trong khoảng 64-76%, và tỉ lệ đáp ứng chung từ 46-56%. Theo hai nghiên cứu phân tích gộp, terlipressin kết hợp với albumin đã chứng minh hiệu quả cải thiện chức năng thận cũng như tiên lượng sống ngắn hạn ở bệnh nhân HRS.
Terlipressin được khuyến cáo bắt đầu bằng tiêm bolus tĩnh mạch với liều khởi đầu 0.5-1 mg mỗi 4-6 giờ, tiếp tục tăng liều đến tối đa 2mg mỗi 4-6 giờ ở những trường hợp giảm SCr nền dưới 25%.
Kết hợp albumin với terlipressin có hiệu quả cao hơn so với dùng terlipressin đơn độc. Có thể giải thích vấn đề này rằng albumin sẽ làm tăng thể tích tuần hoàn, qua đó cùng với Terlipressin chống lại sự giảm cung lượng tim liên quan HRS. Thêm vào đó, tính chống oxy hóa cũng như chống viêm của albumin cũng có hiệu quả có lợi. Liều albumin trong điều trị HRS vẫn chưa được xác định rõ ràng. Các nghiên cứu đã đề nghị theo dõi áp lực tĩnh mạch trung tâm (CVP) để điều chỉnh liều albumin, tuy nhiên, có bằng chứng cho thấy CVP không đánh giá chính xác đáp ứng bù dịch và lưu lượng tim ở bệnh nhân xơ gan; tuy nhiên, CVP có thể hữu ích trong việc phòng ngừa quá tải tuần hoàn. Albumin được dùng đường tĩnh mạch với liều trung bình 20-40g/ngày và duy trì cho đến khi đáp ứng hoàn toàn (SCr dưới 1.5mg/dl) hoặc tối đa 14 ngày với những trường hợp đáp ứng một phần (SCr giảm trên 50% nhưng vẫn cao hơn 1.5mg/dl) hoặc những trường hợp không đáp ứng. Gần đây, truyền terlipressin tĩnh mạch liên tục với liều ban đầu 2 mg/ngày đã được đề xuất và cho thấy tỷ lệ đáp ứng tương đương nhưng tác dụng phụ thấp hơn so với bolus tĩnh mạch. Thêm vào đó, truyền tĩnh mạch liên tục terlipressin cho thấy tác dụng ổn định hơn trong việc làm giảm áp lực hệ cửa mặc dù được dùng với liều thấp hơn so với khi bolus tĩnh mạch. Các tác dụng phụ phổ biến nhất của terlipressin là tiêu chảy, đau bụng, quá tải tuần hoàn và các biến chứng thiếu máu cục bộ đã được báo cáo ở 45%-46% bệnh nhân khi dùng thuốc bằng đường bolus tĩnh mạch. Tỷ lệ ngừng thuốc vì tác dụng phụ chiếm khoảng 20%, chủ yếu là trên hệ tim mạch. Do đó, nên kiểm tra lâm sàng cần thận bao gồm đo điện tâm đồ ở tất cả bệnh nhân trước khi bắt đầu điều trị.
Bệnh nhân có thể được điều trị tại tuyến cơ sở nhưng cần quyết định chuyển tuyến cao hơn dựa trên từng trường hợp cụ thể. HRS tái phát lên đến 20% trường hợp sau khi kết thúc điều trị ở những bệnh nhân đáp ứng. Điều trị lại thường có hiệu quả, tuy nhiên, trong một số trường hợp tái phát liên tục cần điều trị lâu dài bång terlipressin kết hợp với albumin và nhập viện dài hạn.
Các thuốc co mạch khác bao gồm Noradrenaline tĩnh mạch và midodrine đường uống kết hợp với octretide tiêm dưới da hoặc tiêm tĩnh mạch, cả hai đều được phối hợp với albumin.
• Noradrenaline truyền tĩnh mạch liên tục liều 0,5-3 mg/giờ, đã được chứng minh là có hiệu quả như terlipressin trong làm tăng huyết áp động mạch trung bình, đảo ngược tổn thương thận và tăng tỷ lệ sống còn trong một tháng. Ngoài ra, ngược với terlipressin, noradrenaline luôn đòi hỏi một đường truyền tĩnh mạch trung tâm và bệnh nhân cần điều trị ở một đơn vị chăm sóc đặc biệt (ICU).
• Midodrine kết hợp với Octreotide đã được sử dụng ở các quốc gia chưa có terlipressin và được chứng minh là kém hiệu quả hơn nhiều so với terlipressin trong điều trị HRS type 1 trong các nghiên cứu RCT gần đây. Cụ thể:
o Midodrine: 7,5 mg tăng liều sau mỗi 8h cho đến khi đạt tối đa 15 mg đường uống, 3 lần/ngày.
o Octreotide: truyền tĩnh mạch liên tục với liều 50 microgam/giờ hoặc tiêm dưới da 100-200 microgam/giờ x 3 lần/ngày.
Thuốc co mạch, đặc biệt là terlipressin phối hợp với albumin, cũng đã được để xuất sử dụng trong điều trị HRS type 2. Việc điều trị đã được chứng minh là có hiệu quả trong hầu hết các trường hợp, nhưng thật không may, tái phát sau khi ngừng điều trị khá thường gặp. Ngoài ra, có những dữ liệu gây tranh cãi về tác động của điều trị này đối với kết cục của bệnh nhân, đặc biệt là ở các ứng viên chờ ghép gan. Điều này ít nhất một phần là do định nghĩa chưa hoàn toàn tối ưu của HRS type 2 như đã thảo luận trước đây.
Các yếu tố liên quan nhất có thể làm giảm đáp ứng với thuốc co mạch là: (a) giá trị nền của SCr, (b) mức độ viêm và (c) mức độ ứ mật. Việc nhận thấy rằng với mức SCr nền càng cao tỷ lệ đáp ứng với terlipressin cộng với albumin càng thấp đã phần nào phản ánh sự hiện diện của tổn thương nhu mô thận và đó là một trong những lý do chính đằng sau việc ứng dụng tiêu chuẩn KDIGO cho định nghĩa AKI ở bệnh nhân xơ gan và giới thiệu phác đồ mới trong điều trị.
KHUYẾN CÁO CỦA EASL 2018
• Thuốc co mạch và albumin được khuyến cáo cho tất cả bệnh nhân thỏa mãn định nghĩa mới của AKI-HRS giai đoạn >1A, và nên được chỉ định sớm. (III;1) • Terlipressin phối hợp với Albumin được coi là lựa chọn điều trị đầu tay trong điều trị HRS-AKI. Telipressin có thể bolus tĩnh mạch với liều khởi đầu 1 mg mỗi 4-6 giờ. Tuy nhiên, Terlipressin truyền tĩnh mạch liên tục với liều khởi đầu 2 mg/ngày làm giảm tổng liều cần dùng hàng ngày của thuốc và do đó giảm tỷ lệ tác dụng phụ. Trong trường hợp không đáp ứng (giảm SCr <25% so với giá trị đỉnh) sau hai ngày điều trị, nên tăng dần liều terlipressin đến liều tối đa 12 mg/ngày. (1;1) • Nên sử dụng dung dịch Albumin (20%) ở liều 20-40g/ngày. Trong điều kiện lý tưởng nhất, ngoài việc theo dõi thường xuyên bệnh nhân mắc HRS-AKI, đo CVP nhiều lần hoặc các phương pháp khác để đánh giá thể tích tuần hoàn có thể giúp ngăn ngừa tình trạng quá tải tuần hoàn bằng cách tối ưu hóa cân bằng dịch và giúp chỉnh liều Albumin. (II-2;1) • Noradrenaline có thể là một lựa chọn thay thế cho Terlipressin. Tuy nhiên, thông tin về vấn đề này vẫn còn hạn chế. (1;2) • Trái với Terlipressin, Noradrenaline luôn đòi hỏi một đường truyền tĩnh mạch trung tâm và bệnh nhân cần điều trị ở một đơn vị chăm sóc đặc biệt (ICU). Midodrine kết hợp với Octreotide có thể được sử dụng nếu không có sẵn Terlipressin và Noradrenaline, nhưng hiệu quả của chúng kém hơn nhiều so với Terlipressin. (1;1) • Theo định nghĩa mới của HRS-AKI, đáp ứng hoàn toàn với điều trị được xác định khi giá trị SC cuối cùng lớn hơn không quá 0,3 mg/dl (26,5 micromol/L) so với mức SCơ nến, trong khi đó đáp ứng một phần được xác định bởi sự giảm giai đoạn của AKI nhưng mức SCr cuối cùng vẫn ≥0,3 mg/dl (26,5lmol/L) so với giá trị SCr nền. (III;1) • Các tác dụng phụ liên quan đến Terlipressin hoặc Noradrenaline bao gồm thiếu máu cục bộ và các biến cố tim mạch. Vì vậy nên đánhn giá lâm sàng cần thận bao gồm đo ECG trước khi bắt đầu điều trị. Bệnh nhân có thể được điều trị tại tuyến cơ sở, nhưng cần quyết định chuyến tuyến điều trị cao hơn tùy từng trường hợp. Trong thời gian điều trị, điều quan trọng là phải theo dõi chặt chẽ bệnh nhân. Tùy thuộc loại tác dụng phụ và mức độ nghiêm trọng để quyết định ngừng hay thay đổi điều trị. (1;1) • Trong trường hợp tái phát HRS-AKI sau khi ngừng điều trị, nên điều trị lặp lại một đợt. (1;1) • Terlipressin kết hợp với Albumin cũng có hiệu quả trong điều trị HRS không phải AKI (HRS-NAKI), trước đây được gọi là HRS type II. Thật không may, tái phát sau khi ngừng điều trị khá thường gặp, và có những dữ liệu gây tranh cãi về tác động của việc điều trị đến kết cục lâm sàng dài hạn, đặc biệt ở nhóm bệnh nhân chờ ghép gan, vậy thuốc co mạch và albumin không được khuyến cáo trong bối cảnh lâm sàng này. (1;1) |
THEO HƯỚNG DẪN THỰC HÀNH CỦA AASLD 2021
- Lựa chọn điều trị HRS-AKI là thuốc co mạch kết hợp với albumin. Thuốc được ưu tiên là terlipressin, được dùng dưới dạng bolus tĩnh mạch hoặc truyền tĩnh mạch liên tục. - Ở những nơi không có sẵn terlipressin, có thể dùng norepinephrine. Nếu cả 2 không thể sử dụng, có thể xem xét kết hợp uống midodrine (5-15 mg mỗi 8 giờ) với octreotide (tiêm dưới da 100 đến 200 µg mỗi 8 giờ hoặc 50 µg/giờ truyền tĩnh mạch) nhưng hiệu quả thấp. - Bệnh nhân cần được theo dõi chặt chẽ về khả năng xảy ra các tác dụng phụ của thuốc co mạch và albumin, bao gồm biến chứng thiếu máu cục bộ và phù phổi. - Định nghĩa đáp ứng với terlipressin hoặc norepinephrine khi, creatinine giảm <1,5 mg/dL hoặc trở về trong khoảng 0,3 mg/dL so với giá trị nền trong tối đa 14 ngày. Nếu sau 4 ngày điều trị với thuốc co mạch liều tối đa mà bệnh nhân có thể dung nạp, creatinine ở bệnh nhân vẫn giữ nguyên hoặc cao hơn mức trước điều trị thì có thể ngừng thuốc. - Tái phát có thể xảy ra sau khi ngừng điều trị và cần được điều trị lại - Nên xem xét ghép gan khẩn cấp ở tất cả bệnh nhân xơ gan và AKI do tỷ lệ tử vong trong thời gian ngắn cao, ngay cả ở những người đáp ứng với thuốc co mạch. - Nên sử dụng liệu pháp thay thế thận cho những bệnh nhân ghép gan với chức năng thận xấu đi hoặc rối loạn điện giải hoặc quá tải thể tích mà không đáp ứng với liệu pháp co mạch. Nên cân nhắc khi bắt đầu liệu pháp thay thế thận ở những bệnh nhân không có chỉ định ghép gan. - Ghép gan-thận đồng thời có thể cần thiết cho những bệnh nhân không được mong đợi phục hồi chức năng thận sau ghép. - Không khuyến cáo TIPS ở bệnh nhân AKI-HRS vì không đủ dữ liệu. - Thuốc co mạch được duy trì cho đến khi creatinin trở lại giá trị cơ bản, thường là trong vòng 14 ngày, trong một số trường hợp giá trị creatinin trước điều trị rất cao cần dùng dài hơn 14 ngày để đạt được giá trị cơ bản. Một số bệnh nhân có thể cần truyền kéo dài để ngăn ngừa AKI-HRS tái phát sớm sau khi ngừng điều trị. - Cùng với terlipressin, albumin được truyền tĩnh mạch với liều 1 g/kg vào ngày đầu của điều trị, sau đó là 40-50 g/ngày và tiếp tục trong suốt thời gian điều trị. Các tác dụng phụ chủ yếu liên quan đến tác dụng co mạch của thuốc (đau bụng hoặc thiếu máu cục bộ ở chi, da, ruột, tim, v.v.) hoặc tiến triển sang phù phổi do truyền albumin. Những tác dụng phụ này xảy ra không thường xuyên và cần được tầm soát, vì chúng thường không nghiêm trọng và cải thiện sau khi giảm liều hoặc ngừng điều trị. Có thể giảm nguy cơ tác dụng phụ do thiếu máu cục bộ liên quan đến terlipressin bằng cách truyền tĩnh mạch liên tục (liều khởi đầu 2 mg/ngày, tăng sau mỗi 24-48 giờ lên đến 12 mg/ngày cho đến khi creatinin giảm). - Norepinephrine dường như có hiệu quả tương đương với terlipressin, mặc dù có ít dữ liệu hơn. Truyền tĩnh mạch liên tục Norepinephrine, thường trong đơn vị chăm sóc đặc biệt, bắt đầu từ 0,5 mg/giờ để tăng áp lực động mạch trung bình ít nhất 10 mmHg hoặc tăng lượng nước tiểu > 200 mL/4 giờ. Nếu ít nhất một trong những mục tiêu này không đạt được, thì liều norepinephrine được tăng lên sau mỗi 4 giờ với mức tăng khoảng 0,5 mg/giờ cho đến tối đa là 3 mg/giờ. Albumin cũng được dùng để duy trì áp lực tĩnh mạch trung tâm (CVP) từ 4 đến 10 mmHg. |
2.4.2 Tạo cầu nối cửa - chủ trong gan qua tĩnh mạch cảnh (TIPS)
Việc thực hiện TIPS có thể cải thiện chức năng thận ở bệnh nhân HRS type 1. Tuy nhiên, khả năng áp dụng TIPS trong bối cảnh lâm sàng này thường rất hạn chế bởi vì ở hầu hết các bệnh nhân, TIPS bị chống chỉ định vì mức độ suy gan nặng.
TIPS đã được nghiên cứu ở những bệnh nhân mắc HRS type 2 và trong điều trị báng kháng trị, thường liên quan với HRS type 2. Ở những bệnh nhân này, TIPS đã được chứng minh là giúp cải thiện chức năng thận.
2.4.3 Điều trị thay thế thận (RRT)
Điều trị thay thế thận nên được xem xét trong bất kể type AKI nào. Nên xem xét sử dụng RRT ở những bệnh nhân HRS-AKI không đáp ứng với thuốc co mạch. RRT cũng nên được xem xét ở những bệnh nhân mắc bệnh thận giai đoạn cuối. Các chỉ định cho RRT bao gồm: rối loạn điện giải hoặc toan kiểm nghiêm trọng và/hoặc kháng trị, quá tải thể tích nặng hoặc kháng trị, và/hoặc tăng azot máu có triệu chứng. Tuy nhiên, những dữ liệu được công bố về RRT ở bệnh nhân xơ gan còn rất ít, với những tranh cãi về tác động đến tỉ lệ sống còn của bệnh nhân
2.4.4 Hệ thống hỗ trợ gan
Đã có hai nghiên cứu RCT cho thấy lợi ích hứa hẹn của MARS hoặc Prometheus trong điều trị HRS type 1, tuy nhiên cần nhiều nghiên cứu hơn nữa.
2.4.5 Ghép gan và ghép gan-thận đồng thời
Lựa chọn điều trị tốt nhất ở bệnh nhân mắc HRS là ghép gan. Tuy nhiên, một số nghiên cứu đã chỉ ra rằng SCr sau ghép gan cao hơn ở những bệnh nhân có HRS so với những người không có HRS tại thời điểm ghép. Ngoài ra, sự hiện diện của HRS tại thời điểm ghép gan có tác động tiêu cực đến sự sống còn sau ghép. Việc điều trị HRS type 2 trước ghép đã cho kết quả khác nhau về kết quả lâm sàng sau ghép và do đó cần phải nghiên cứu thêm. Ghép đồng thời gan thận có thể được chỉ định ở bệnh nhân xơ gan và CKD trong các điều kiện sau: (a) GFR ước tính (sử dụng phương trình MDRD6) s40 ml/phút hoặc đo GFR bằng cách sử dụng độ thanh thải iothalamate s30 ml/phút, (b) protein niệu ≥2 g/ngày, (c) sinh thiết thận cho thấy >30% cầu thận bị xơ hóa hoặc >30% xơ hóa mô kẽ, hoặc (d) bệnh chuyển hóa di truyền. Ghép đồng thời gan-thận cũng được chỉ định ở những bệnh nhân bị xơ gan có AKI kéo dài bất kể type của AKI thỏa một trong các điều kiện sau: (a) AKI trên RRT trong 24 tuần hoặc (b) ước tính GFR s 35 ml/phút hoặc đo GFR ≤25 ml/phút trong 24 tuần, bao gồm HRS-AKI kháng trị với điều trị bằng thuốc.
KHUYẾN CÁO CỦA EASL 2018 • Không đủ dữ liệu để ủng hộ TIPS ở bệnh nhân HRS-AKI nhưng nó có thể được xem xét ở nhóm những bệnh nhân được HRS-NAKI chọn lọc. (II-2; 2) • Ghép gan là lựa chọn điều trị tốt nhất cho bệnh nhân mắc HRS bất kể đáp ứng với điều trị bằng thuốc. (1;1) • Quyết định bắt đầu điều trị thay thế thận phải dựa trên sự cá nhân hóa mức độ nghiêm trọng của bệnh. (1;2) • Chỉ định ghép gan-thận vẫn còn gây tranh cãi. Kĩ thuật này nên được xem xét ở bệnh nhân bị CKD mức độ nặng hoặc bị AKI kéo dài bao gồm HRS-AKI không đáp ứng với điều trị bằng thuốc. (II-2;1) |
2.5 DỰ PHÒNG HRS
KHUYẾN CÁO CỦA EASL 2018 • Nên chỉ định Albumin (liều 1,5 g/kg khi chẩn đoán và 1 g/kg vào ngày thứ ba) cho những bệnh nhân mắc SBP để ngăn ngừa AKI. (1;1) • Norfloxacin (400mg/ngày) dùng để dự phòng của SBP giúp ngăn chặn HRS- ΑΚΙ. (Ι;1) |
3 TÀI LIỆU THAM KHẢO CHÍNH
1/ Diagnosis, Evaluation, and Management of Ascites, Spontaneous Bacterial Peritonitis and Hepatorenal Syndrome: AASLD 2021
2/ Clinical Practice Guidelines for the management of patients with decompensated cirrhosis: EASL 2018
3/ICA 2015
4/ Medscape.com

