Chẩn đoán các bệnh di truyền và sàng lọc lệch bội nhiễm sắc thể trong quý 1
CHƯƠNG 6 : SÀNG LỌC LỆCH BỘI NHIỄM SẮC THỂ TRONG QUÝ 1, trang 139-180, Sách SIÊU ÂM THAI QUÝ 1
Dịch từ sách: First Trimester Ultrasound Diagnosis of Fetal Abnormalities -Tác giả Alfred Abuhamad và Rabih Chaoui
Người dịch: Bác sĩ Vũ Văn Tài
Tải bản PDF TẠI ĐÂY
1 GIỚI THIỆU
Tỷ lệ lệch bội số lượng nhiễm sắc thể thai nhi như trisomy 21 (T21; hội chứng Down), trisomy 18 (T18; hội chứng Edwards), và trisomy 13 (T13; hội chứng Patau) tăng theo tuổi mẹ. Lệch bội nhiễm sắc thể thai nhi có liên quan với các biến chứng thai kỳ đáng kể như đa dị tật, chậm tăng trưởng và tử vong chu sinh. Sàng lọc lệch bội nhiễm sắc thể trước sinh đã nhận được sự quan tâm đáng kể trong hơn 30 năm qua và hiện được coi là một phần không thể thiếu của chăm sóc tiền sản. Một số sự phát triển lớn ảnh hưởng đến việc sàng lọc các bất thường nhiễm sắc thể trước sinh, như xác định các “marker” siêu âm đối với thể lệch bội, sự ra đời của sàng lọc sinh hóa trong quý 2, sàng lọc độ mờ da gáy (NT) trong quý 1 và gần đây là DNA tự do của thai nhi trong huyết tương mẹ. Sự tiến bộ trong sàng lọc lệch bội hiện nay đã dẫn đến việc trước sinh đã xác định được hầu hết các thai nhi có bất thường nhiễm sắc thể. Cho đến nay, nghiên cứu lớn nhất về vai trò của NT dày và dị tật lớn ở ba tháng đầu thai kỳ trong việc phát hiện lệch bội nhiễm sắc thể được công bố1 gần đây, bao gồm tổng số 108.982 thai nhi với 654 trường hợp bị trisomy 21, 18 hoặc 13. Có ít nhất một trong số những dấu hiệu sau: NT dày (> 3,5 mm), não thất duy nhất (holoproscephaly), thoát vị rốn, hoặc bàng quang to có khả năng phát hiện 57% tổng số lệch bội. Điều thú vị là, ≥ 1 trong số 4 dấu hiệu này được phát hiện ở 53% tổng số thai nhi T21, 72% tổng số thai nhi T18 và 86% tổng số thai nhi T13.1 Trong chương này, chúng tôi trình bày chi tiết đặc điểm của các thể lệch bội trên siêu âm quý 1 ngoài khía cạnh các bệnh và hội chứng di truyền khác.
2 SIÊU ÂM QUÝ 1 VÀ CÁC DẤU ẤN HÓA SINH CỦA MẸ TRONG CÁC THỂ LỆCH BỘI
2.1 Trisomy 21
Mối liên quan giữa thai nhi có tăng khoảng dịch sau gáy và lệch bội trong quý 1 được mô tả lần đầu tiên cách đây hơn 2 thập kỷ,2-4 và phát hiện này đã dẫn đến việc thiết lập sàng lọc lệch bội trong quý 1 bằng NT và các dấu ấn sinh hóa. NT dày tương quan với trisomy 21 (T21) và thai nhi T21 có độ dày NT trung bình là 3,4 mm.5 Trong một nghiên cứu trên 654 thai nhi T21, hơn một nửa có NT ≥ 3,5 mm.1 NT ở thai nhi bình thường tăng theo số đo chiều dài đầu-mông (CRL) và sàng lọc NT đã được ứng dụng thành công để điều chỉnh nguy cơ “priori” lệch bội của thai nhi được thiết lập theo tuổi mẹ. Đây là một trong những thành phần quan trọng nhất của sàng lọc lệch bội vì nó làm giảm đáng kể các xét nghiệm xâm lấn không cần thiết ở thai phụ lớn tuổi.
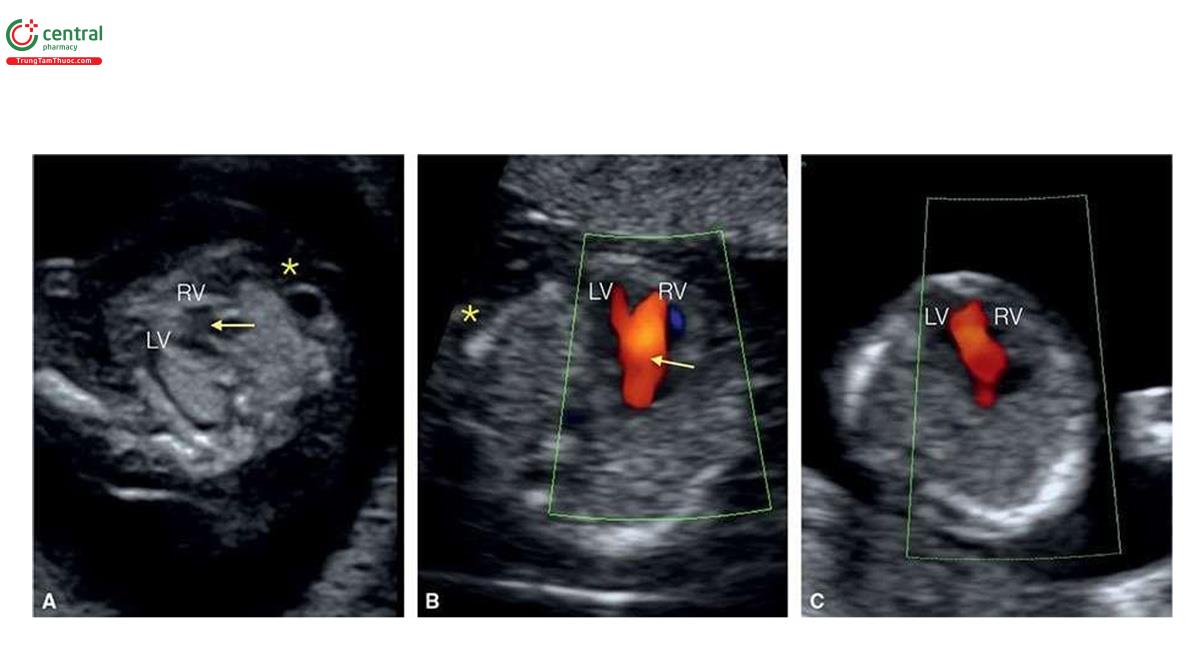
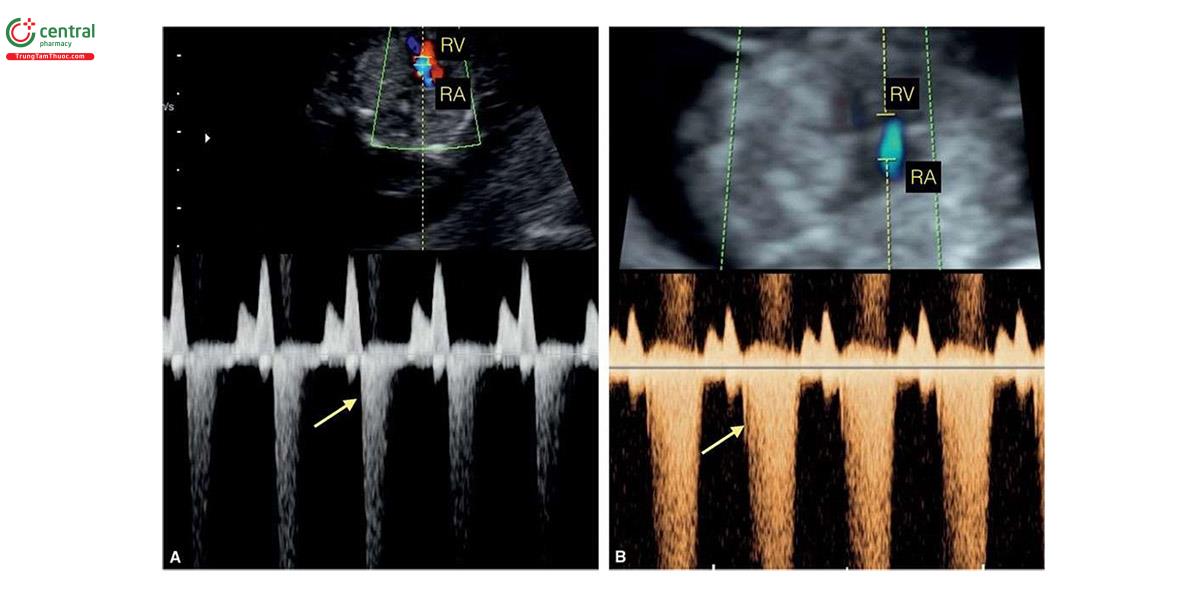
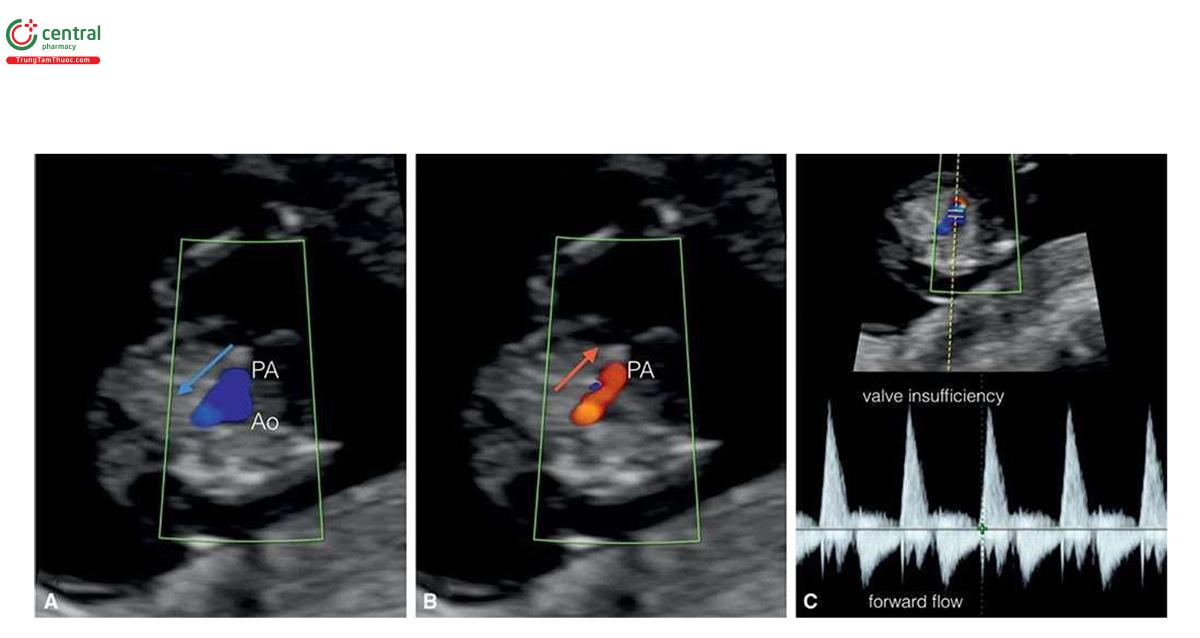
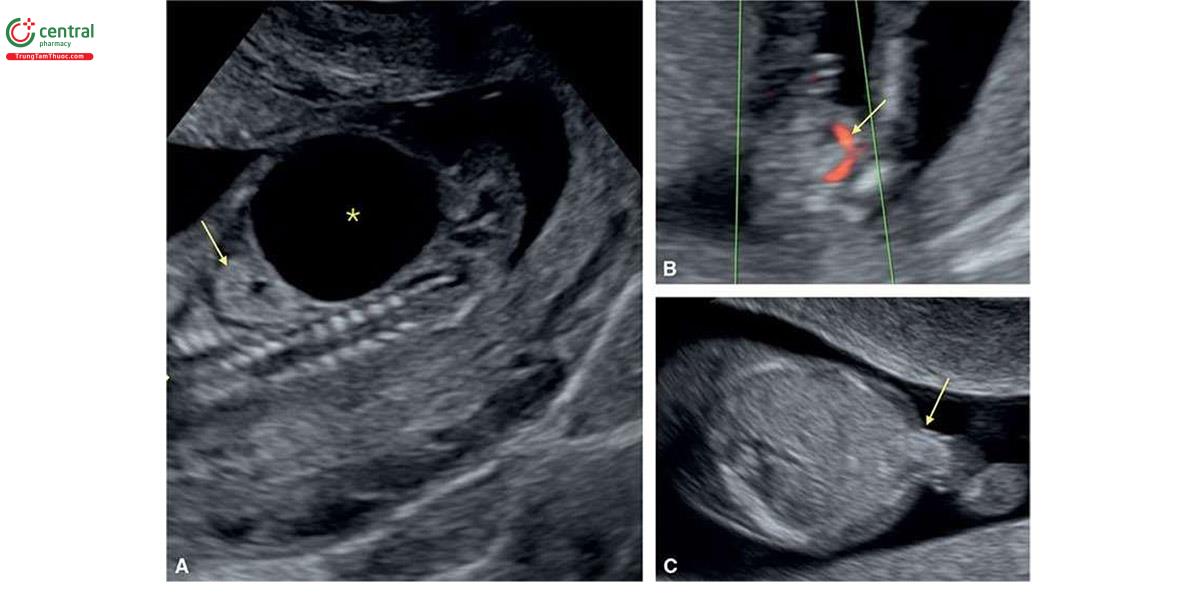
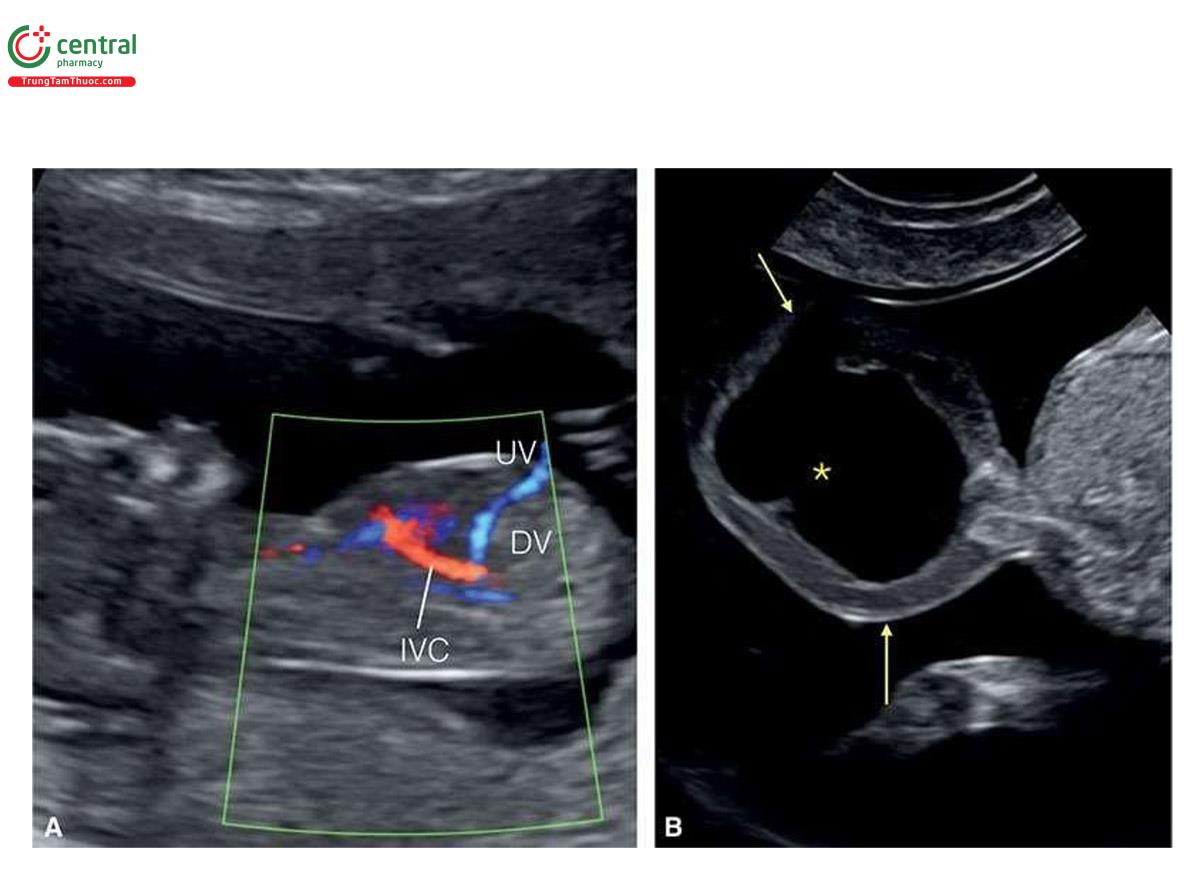
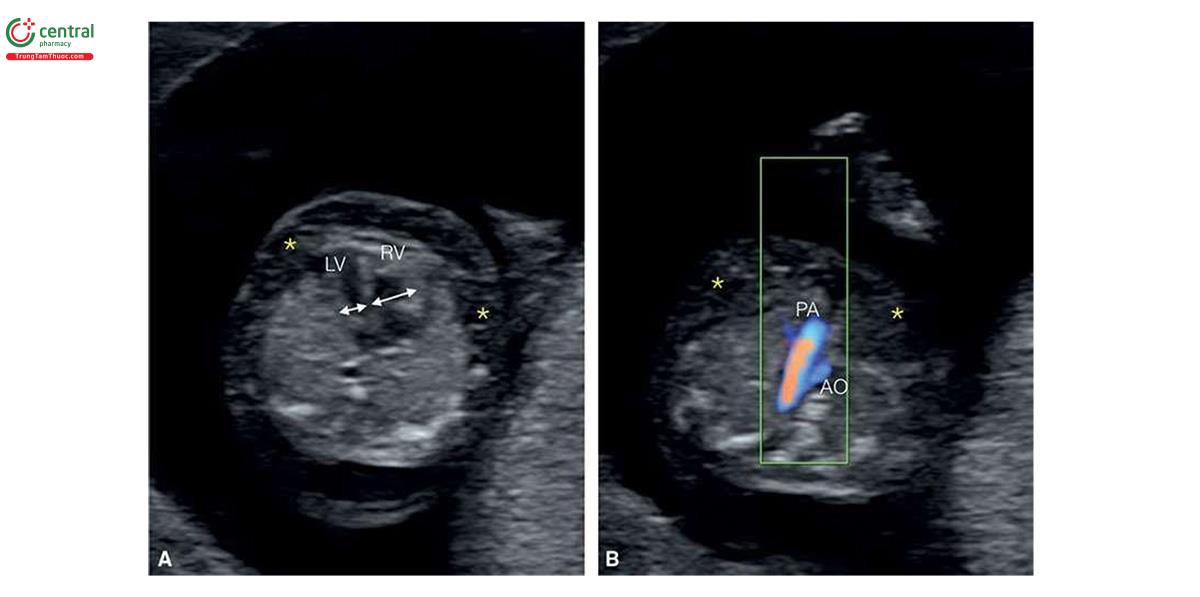
Ở những thai kỳ có thai nhi T21, nồng độ β-human Chorionic gonadotropin tự do (P- HCG) trong huyết thanh mẹ cao gấp đôi và protein A huyết tương liên quan đến thai kỳ (PAPP-A) giảm một nửa so với những thai kỳ đẳng bội (euploid pregnancies) (Bảng 6.1). Mặc dù đo NT đơn thuần xác định được khoảng 75% đến 80% thai nhi T21, kết hợp NT với các dấu ấn sinh học của mẹ trong quý 1 làm tăng tỷ lệ phát hiện T21 lên 85% đến 95%, trong khi vẫn giữ tỷ lệ dương tính giả ở mức 5% .5,6 Thật vậy, trong một nghiên cứu tiến cứu xác nhận gần đây về sàng lọc trisomy 21, 18 và 13 bằng cách kết hợp tuổi mẹ, NT thai nhi, nhịp tim thai và β-hCG tự do và PAPP-A trong huyết thanh từ 11+0 đến 13+6 tuần tuổi trên 108.982 thai đơn, tỷ lệ T21, 18 và 13 được phát hiện lần lượt là 90%, 97% và 92% với tỷ lệ dương tính giả là 4% .6 Monosomy X cũng được phát hiện ở hơn 90% trường hợp cùng với hơn 85% các thể tam bội (triploidies) và hơn 30% các bất thường nhiễm sắc thể khác.6 Ngoài NT, các “marker” nhạy khác của T21 trên siêu âm quý 1 bao gồm không có hoặc thiểu sản xương mũi (Hình 6.1), dị tật tim (kênh nhĩ thất (atrioventricular septal defect)) có hoặc không có phù toàn thân (generalized edema) (Hình 6.2 và 6.3), hở van ba lá (tricuspid regurgitation) (Hình. 6.4A), động mạch dưới đòn phải lạc chỗ (aberrant right subclavian artery) (Hình 6.4B), nốt tăng âm trong tim (echogenic intracardiac focus) (Hình 6.4C), và tăng trở kháng dòng chảy trong ống tĩnh mạch (Hình 6.5). Các đặc điểm của thai nhi T21 trong quý 1 được liệt kê trong Bảng 6.2, với các dấu hiệu khác được minh họa bằng hình ảnh ở các chương khác nhau của cuốn sách này.
Bảng 6.1 • Đặc điểm sinh hóa và siêu âm của trisomy 21, 18 và 13 | ||||
Mô hình kèm theo NT | Đẳng bội | Trisomy 21 | Trisomy 18 | Trisomy 13 |
Phân bố độc lập với CRL, % | 5 | 95 | 70 | 85 |
Trung vị của NT độc lập với CRL, mm | 2.0 | 3.4 | 5.5 | 4.4 |
Trung vị của β-hCG tự do huyết thanh, MoM | 1.0 | 2.0 | 0.2 | 0.5 |
Trung vị của PAPP-A huyết thanh, MoM | 1.0 | 0.5 | 0.2 | 0.3 |
Không có xương mũi, % | 2.5 | 60 | 53 | 45 |
Hở van ba lá, % | 1.0 | 55 | 33 | 30 |
Đảo ngược sóng A ống tĩnh mạch, % | 3.0 | 66 | 58 | 55 |
NT, độ mờ da gáy; CRL, chiều dài đầu-mông; β-hCG, P-human chorionic gonadotropin; MoM, bội số của số trung vị; PAPP-A, protein A huyết tương liên quan đến thai kỳ. | ||||
From Nicolaides KH. Screening for fetal aneuploidies at 11 to 13 weeks. Prenat Diagn. 2011;31:7-15; copyright John Wiley & Sons, with permission. | ||||
| Bảng 6.2 • Đặc điểm của Trisomy 21 trong quý 1 |
• Độ mờ da gáy dày (NT) • Gonadotropin màng đệm người cao (HCG, β-hCG) • Protein A huyết tương liên quan đến thai kỳ thấp (PAPP-A) • Xương mũi không có hoặc thiểu sản. • Dòng chảy đảo ngược ở thì tâm trương hoặc dòng chảy trở kháng cao trong ống tĩnh mạch • Hở van ba lá • Tăng góc trán-hàm trên-mặt (FMF) (fronto-maxillary-facial (FMF) angle), hàm trên ngắn (short maxilla) phản ánh thiểu sản vùng giữa mặt (midface hypoplasia) • Động mạch dưới đòn phải lạc chỗ (Aberrant right subclavian artery) • Nốt tăng âm trong tim (Echogenic focus) • Ruột tăng âm (Echogenic bowel) • Dãn đường tiết niệu (Renal tract dilation) • Tăng vận tốc đỉnh trong động mạch gan • Ống tĩnh mạch đổ trực tiếp vào tĩnh mạch chủ dưới • Các bất thường cấu trúc như kênh nhĩ thất (atrioventricular septal defect), tứ chứng Fallot và vv... |
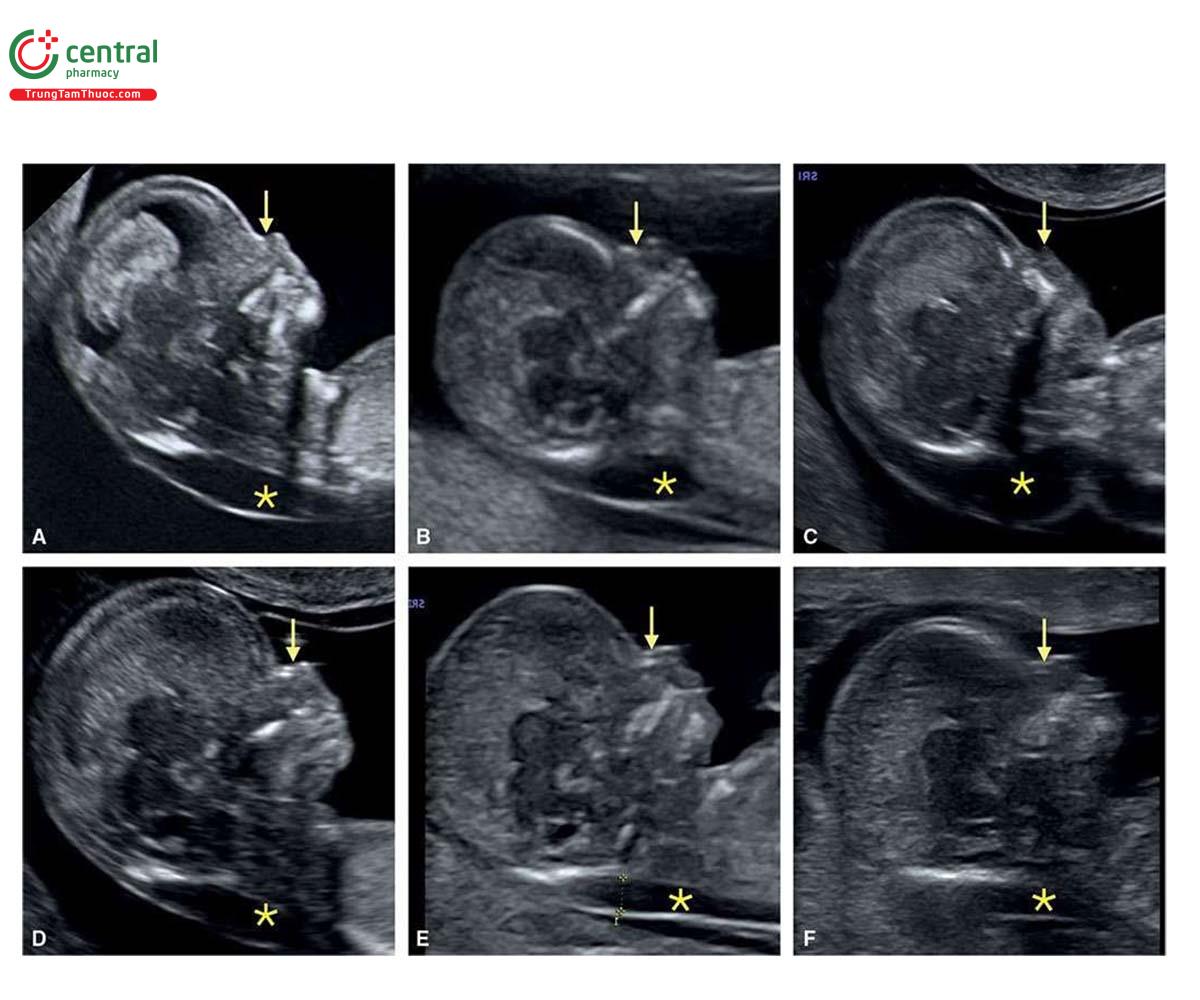
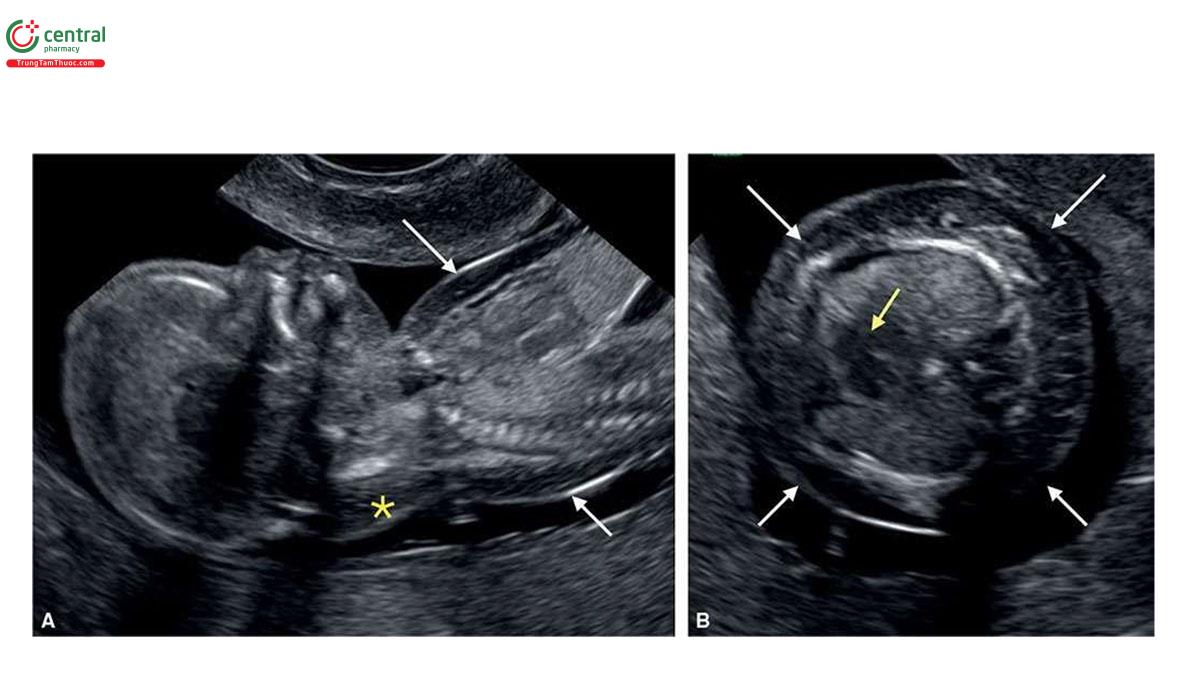
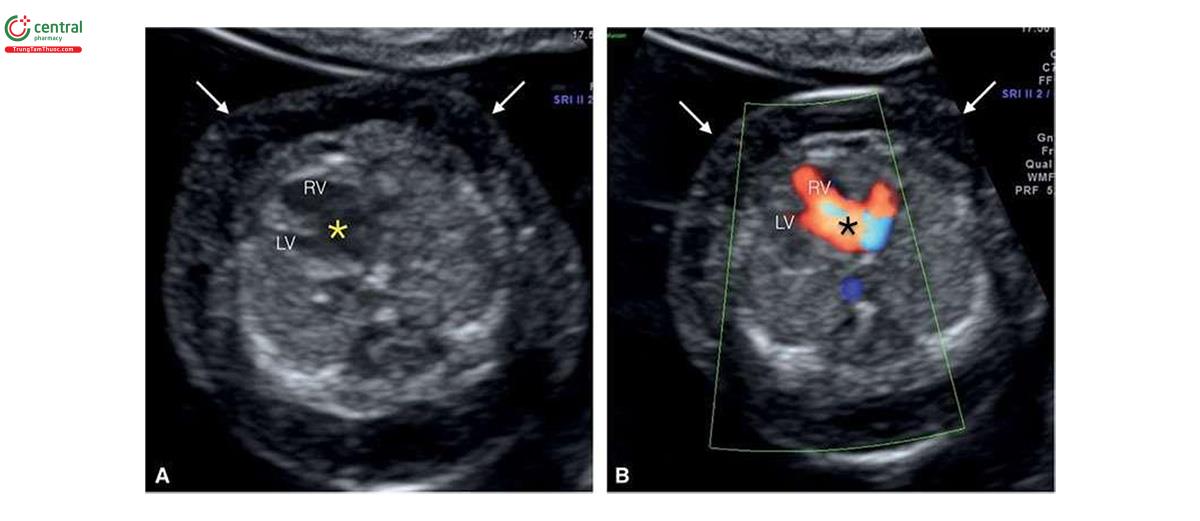
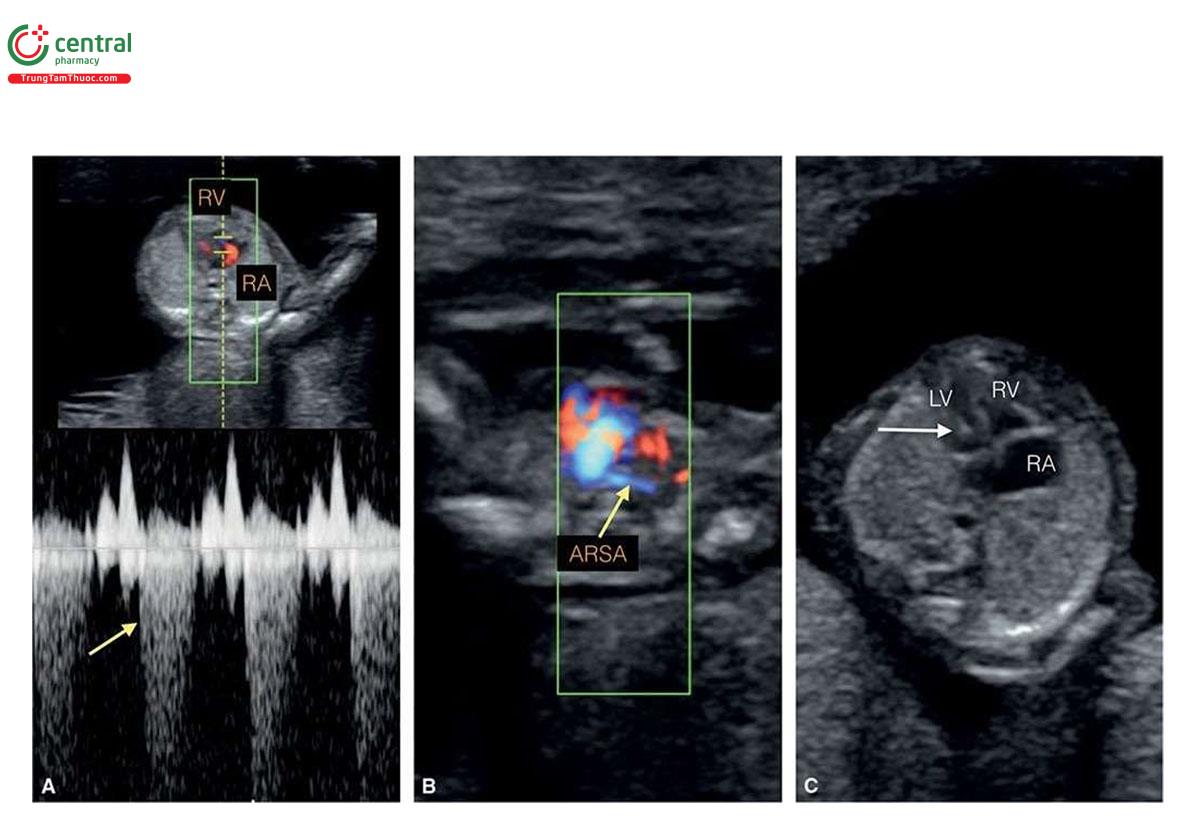
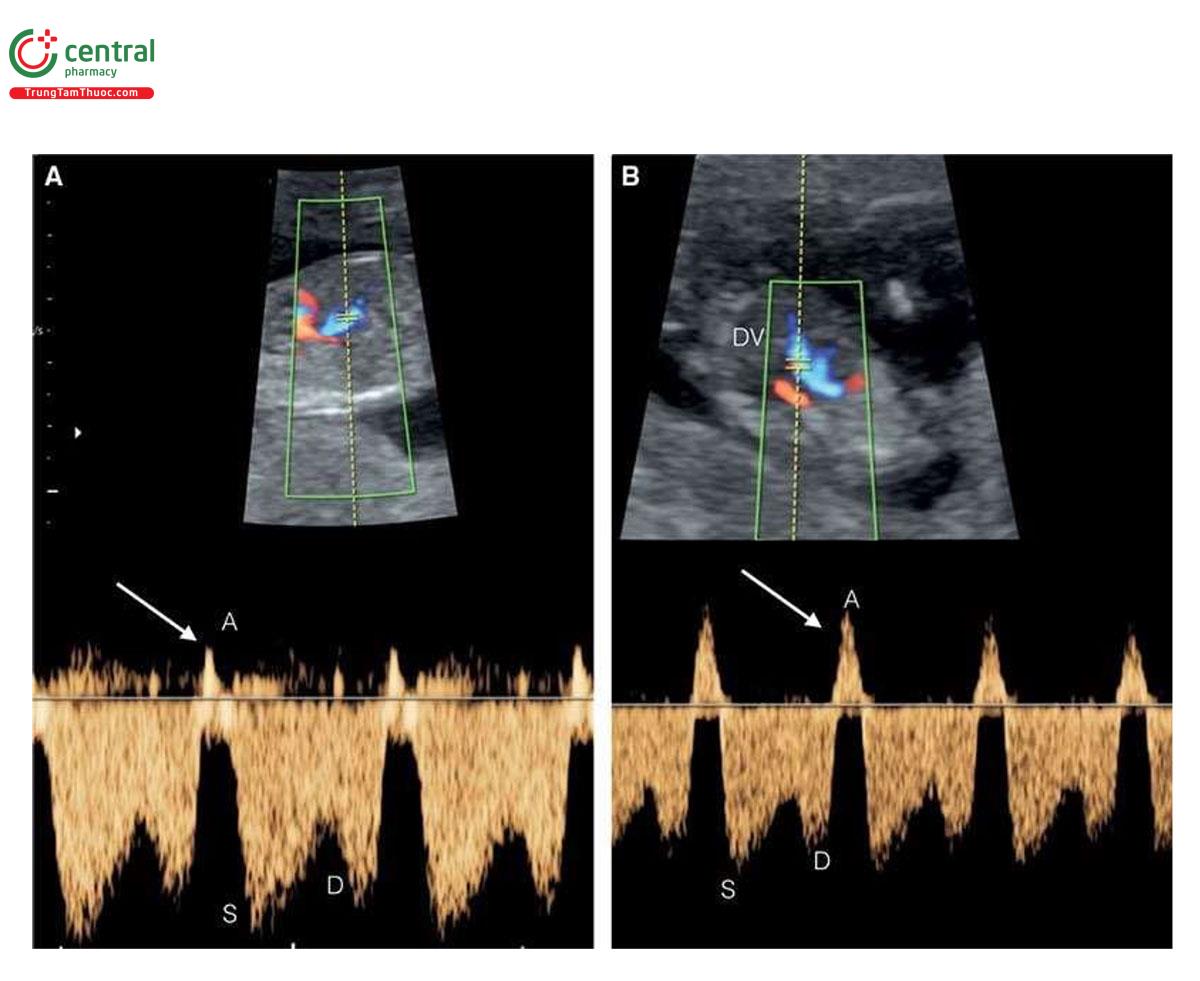
2.2 Trisomy 18 và Trisomy 13
NT dày không đặc hiệu cho T21 vì nó cũng có thể được phát hiện ở các thể lệch bội khác. Ở T18 và T13, giá trị trung vị (median values) của NT lần lượt là 5,5 và 4,0 mm.5,6 Giá trị PAPP-A cũng giảm ở cả 2 trisomy với giá trị trung vị là 0,2 MoM cho T18 và 0,3 MoM cho T13. Không giống như ở T21, giá trị β-hCG tự do giảm ở T18 và T13 với giá trị trung vị tương ứng là 0,2 MoM và 0,5 MoM (Bảng 6.1). Đối với các bác sĩ và kĩ thuật viên siêu âm có chuyên môn trong việc siêu âm hình thái thai nhi quý 1, T18 hoặc T13 thường được nghi ngờ đầu tiên bởi có các đặc điểm siêu âm điển hình, thay vì bằng sàng lọc sinh hóa. Trong một nghiên cứu bao gồm 5.613 thai nhi bình thường và 37 thai nhi T18, siêu âm thai quý 1 được phát hiện là một test sàng lọc tốt đối với T18.7. Độ dày NT trung bình là 5,4 mm ở thai nhi T18 so với 1,7 mm ở thai nhi đẳng bội.7 Dị tật tim bẩm sinh được quan sát thấy ở 70,3% thai nhi T18 và 0,5% thai nhi đẳng bội và dị tật ngoài tim được xác định ở 35,1% thai nhi T18 và 0,8% thai nhi đẳng bội.7 Chỉ có một trường hợp T18 không có dấu hiệu lệch bội trên siêu âm. 7
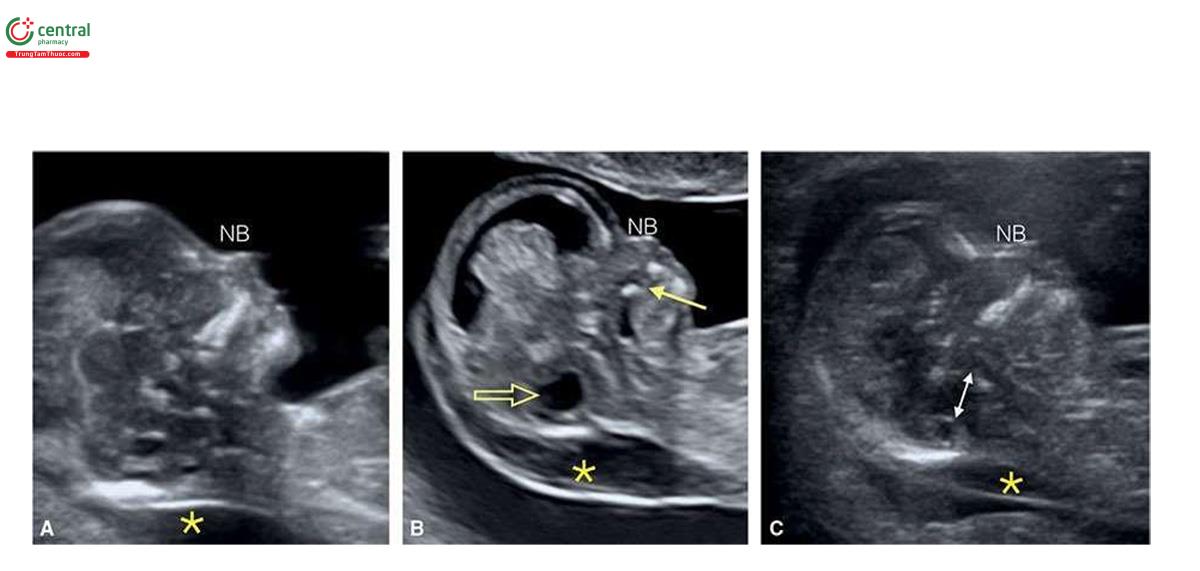
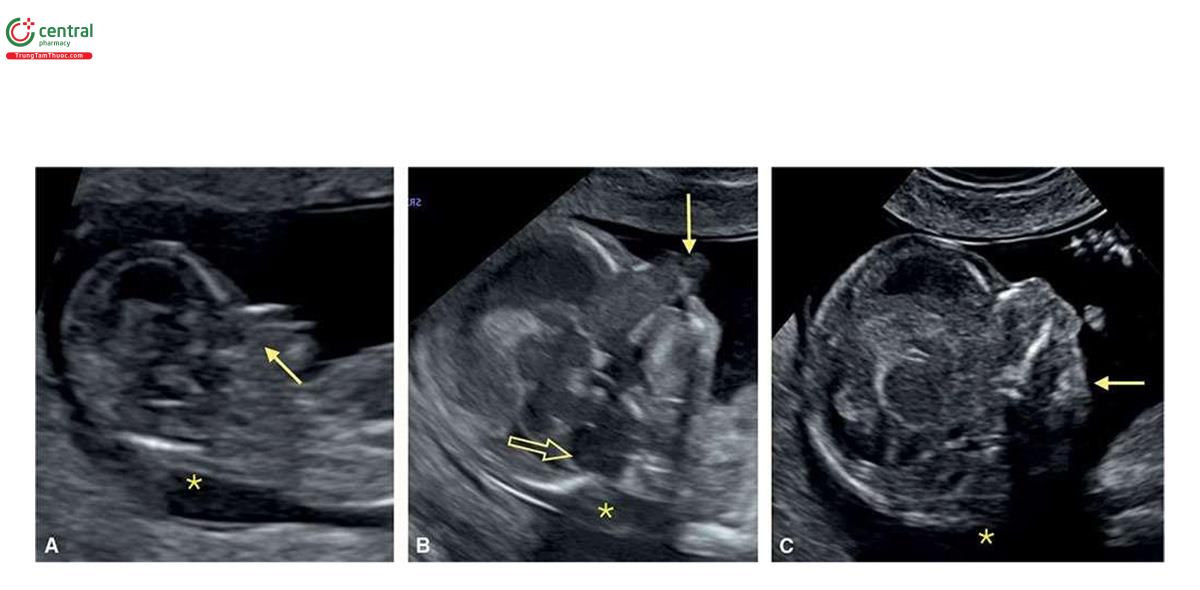
Hình 6.6 đến 6.17 cho thấy các đặc điểm siêu âm phổ biến của T18 trong quý 1, bao gồm NT dày (Hình 6.6, 6.8 và 6.9), không có / thiểu sản xương mũi (Hình 6.6 và 6.8), dãn não thất bốn / hố sau bất thường ( Hình 6.6 đến 6.8), bàng quang to (megacystis) (Hình 6.7), tật chẻ đôi đốt sống (spina bifida) (Hình 6.7 và 6.8), dị tật tim (Hình 6.10 đến 6.12), thoát vị rốn (omphalocele) nhỏ (Hình 6.6, 6.7 và 6.13), các chi bất thường ( Hình 6.14 và 6.15), khe hở môi và vòm miệng (cleft lip and palate) (Hình 6.6 và 6.15), CRL ngắn (Hình 6.6, 6.7 và 6.15), và bất thường dây rốn / động mạch rốn duy nhất (single umbilical artery) (Hình 6.16 và 6.17) .1,8
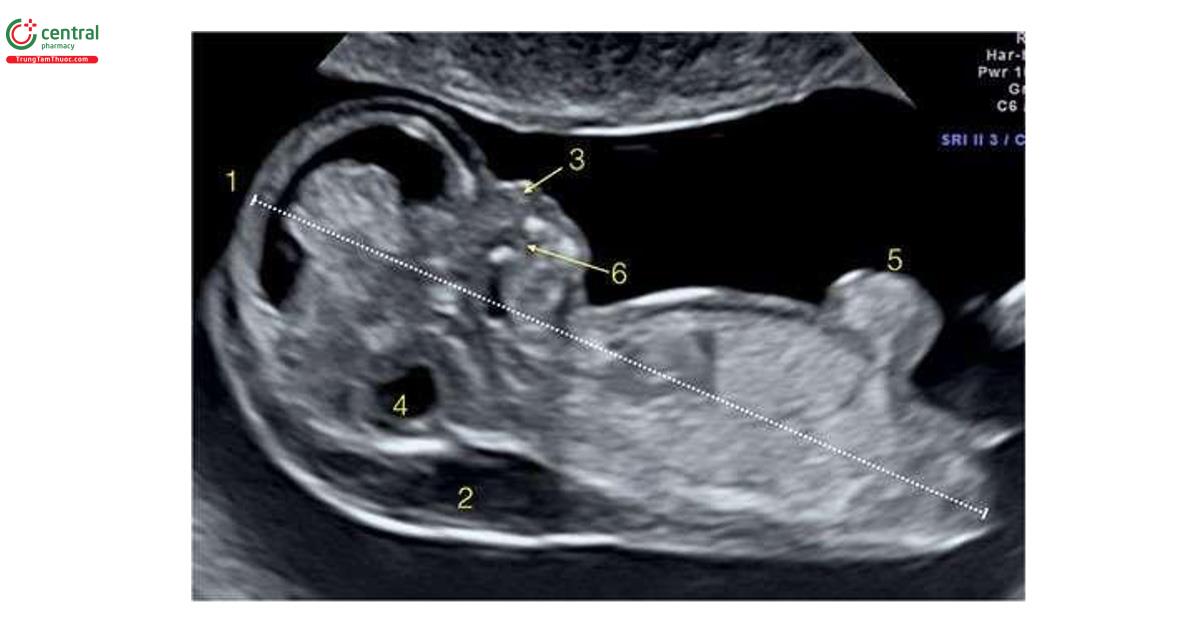
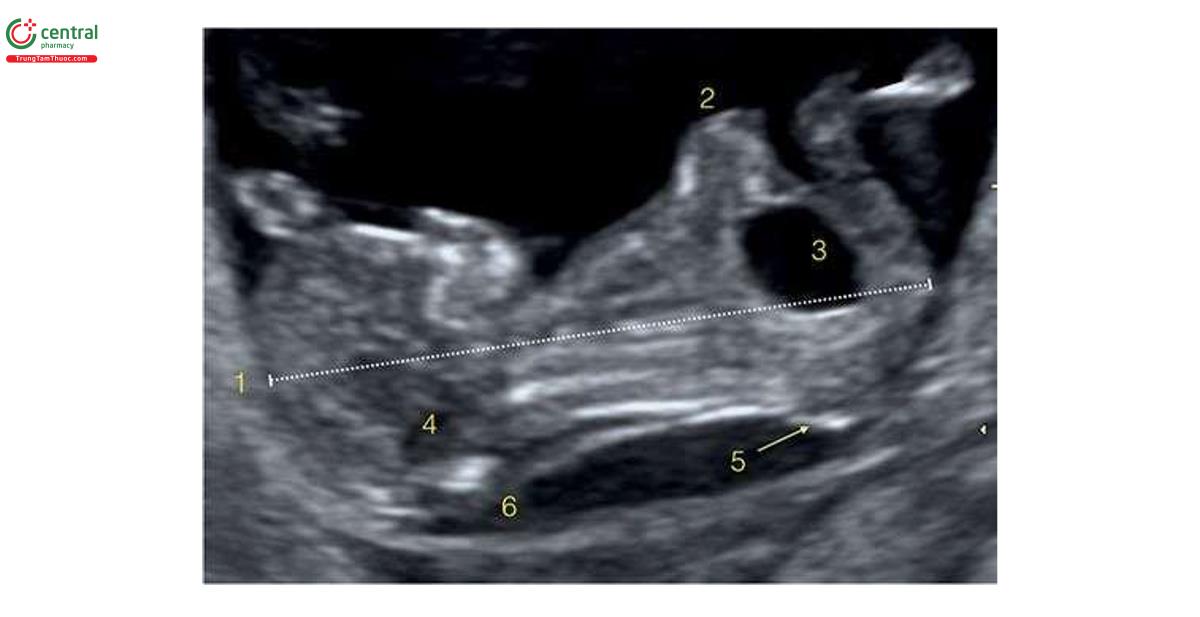
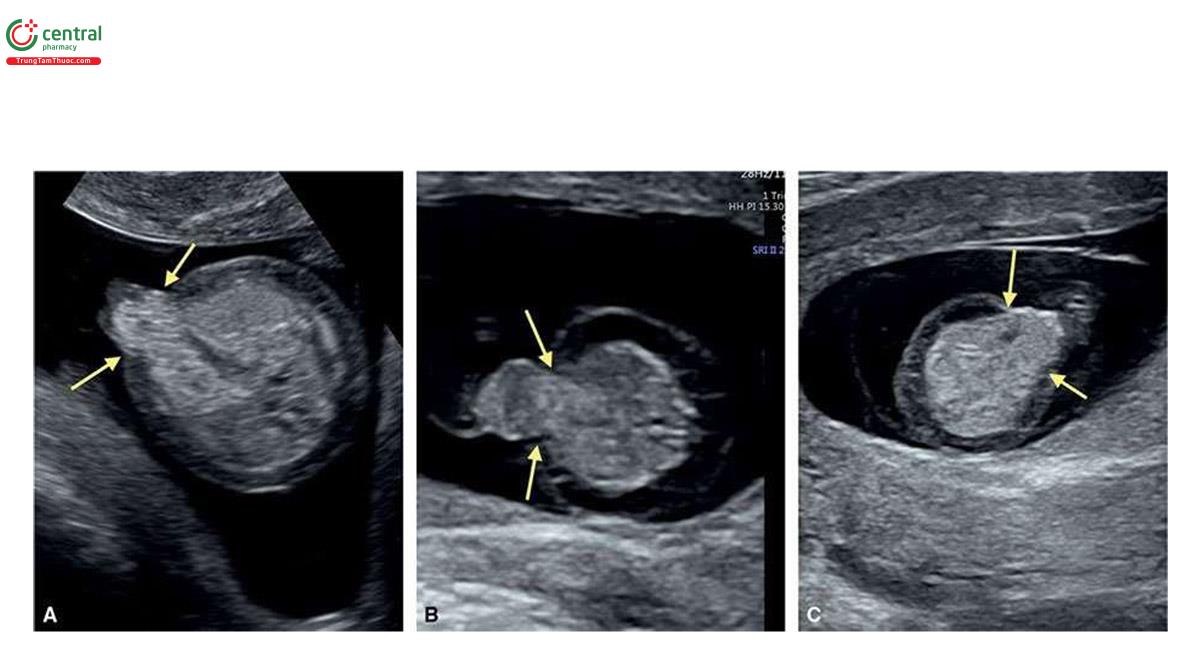
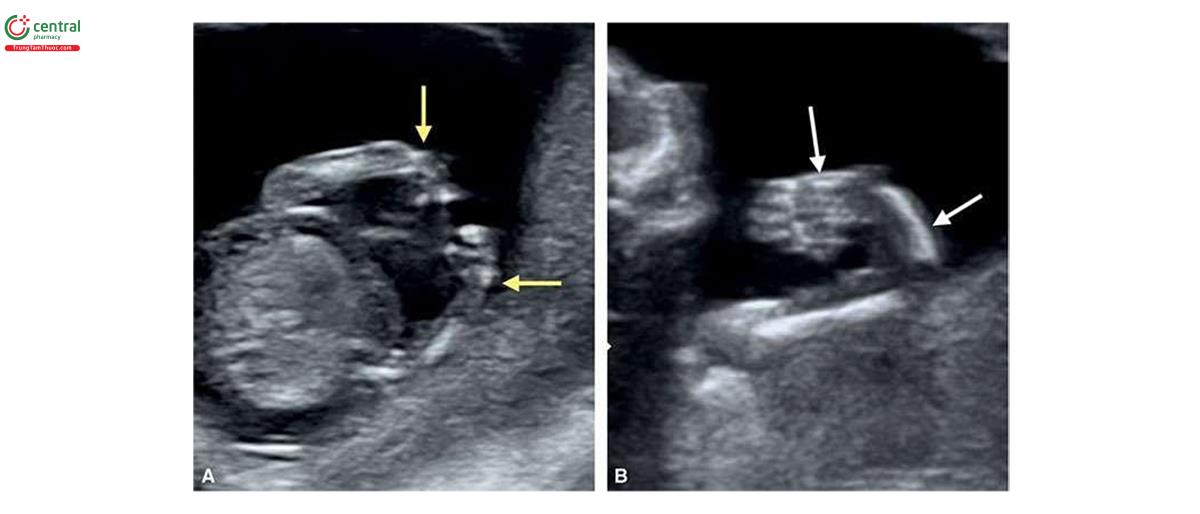
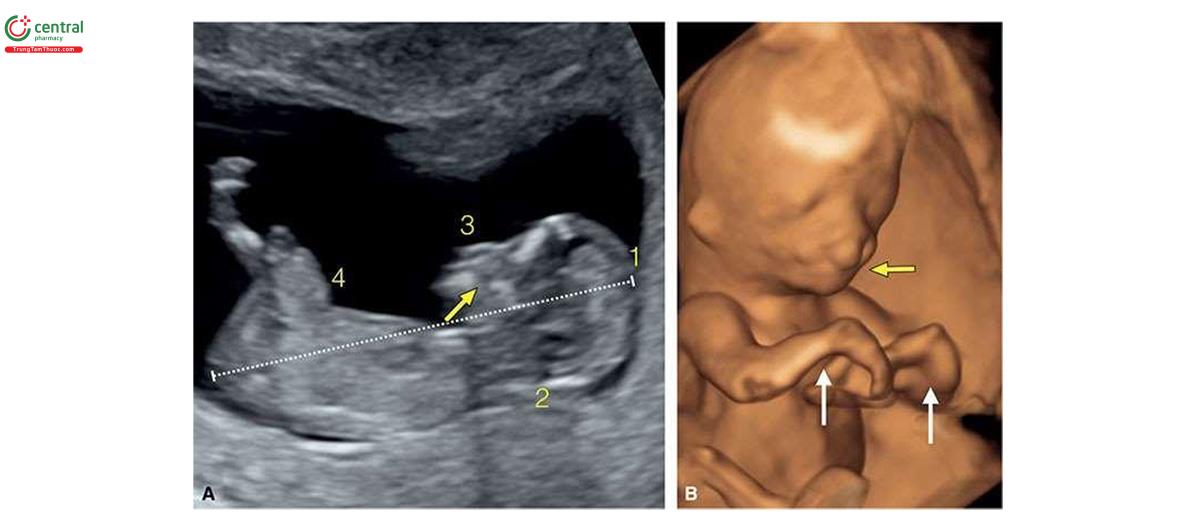
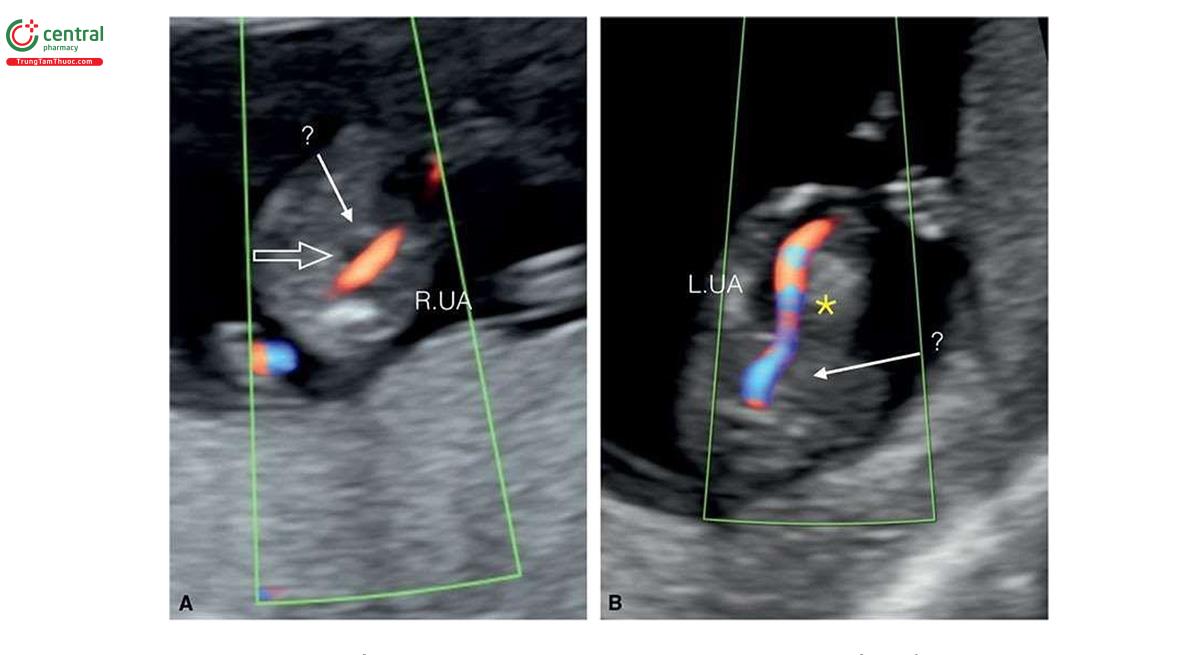
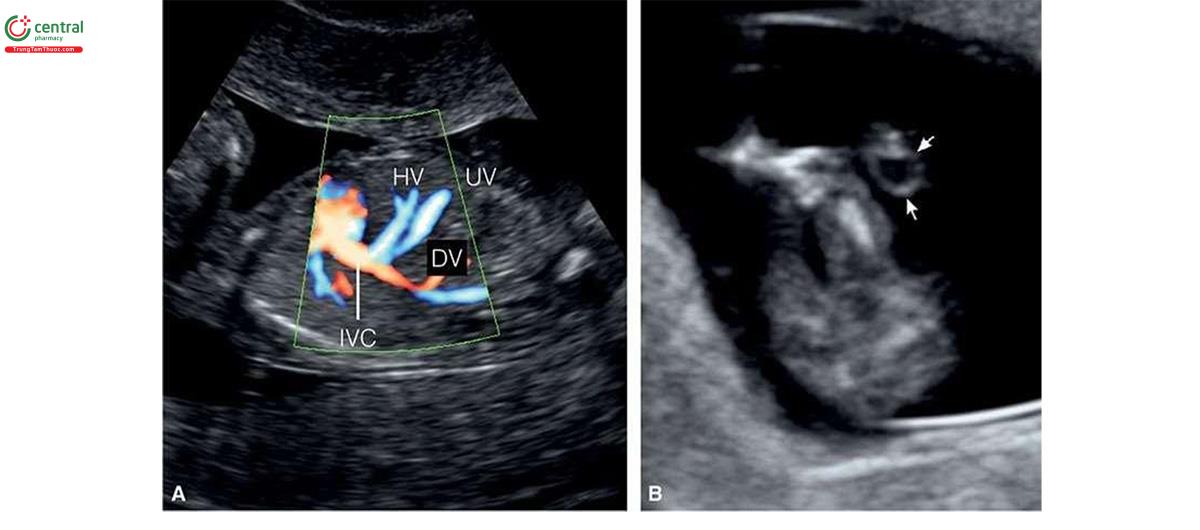
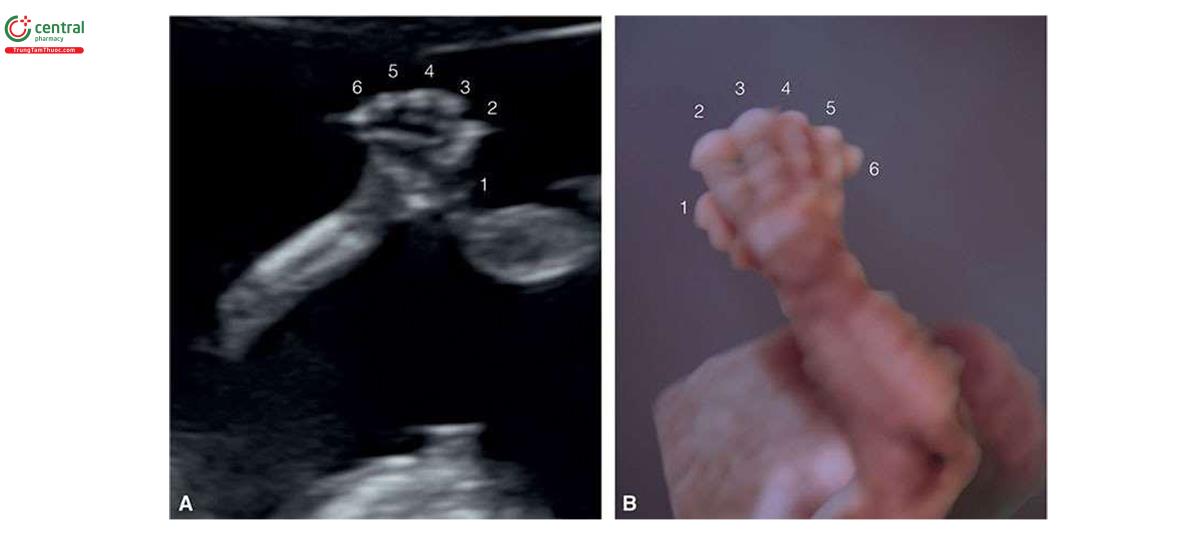
Đặc điểm của T13 trên siêu âm quý 1 bao gồm các bất thường sọ mặt (Hình 6.18 đến 6.20), Khe hở môi / vòm miệng (cleft lip/palate) (Hình 6.18 và 6.20), NT dày (Hình 6.20), các chi bất thường với tật thừa ngón (polydactyly) (Hình 6.21), bất thường tim (Hình 6.22), bất thường thận (Hình 6.23), và bất thường dây rốn / tĩnh mạch bụng (Hình 6.23 và 6.24).1,8
Các đặc điểm của thai nhi T18 và T13 trong quý 1 được liệt kê trong Bảng 6.3, với các dấu hiệu khác được thể hiện bằng hình ảnh trong các chương khác nhau của cuốn sách này.
Bảng 6.3 • Các đặc điểm của Trisomy 18 và 13 trong quý 1 | ||
| Trisomy 18 | Trisomy 13 |
Độ mờ da gáy (trung vị) | 5.5mm | 4.0mm |
β-hCG tự do (trung vị) | 0.2 MoM | 0.5 MoM |
PAPP-A (trung vị) | 0.2 MoM | 0.3 MoM |
Thai giới hạn tăng trưởng | Có | Có |
Não | Hiếm gặp não thất duy nhất (holoprosencephaly) Đôi khi có nang đám rối mạch mạc (choroid plexus cysts) | Hay gặp não thất duy nhất Đôi khi có nang đám rối mạch mạc |
Hố sau | Dãn dạng nang. Dấu hiệu thân não dày và chèn ép IT là các “marker” của tật chẻ đôi đốt sống thể hở (open spina bifida) | Dãn dạng nang |
Mặt | Không có xương mũi, mặt phẳng (flat profile), cằm tụt sau (retrognathia), đôi khi có khe hở đường giữa (median clefts) | Các bất thường mặt nghiêm trọng ở đường giữa: hai hốc mắt gần nhau (hypotelorism), giả một hốc mắt (pseudocyclopia), vòi voi (proboscis), không có mũi (arrhinia), khe hở đường giữa, cằm tụt sau, không có xương mũi |
Cổ và da | NT dày và phù thai nặng | NT dày và phù thai nặng |
Tim | Hở van ba lá, động mạch dưới đòn phải lạc chỗ (aberrant right subclavian artery), nốt tăng âm trong tim, bất thường cấu trúc tim đặc biệt là khiếm khuyết vách ngăn (AVSD; VSD), bất thường thân- nón (conotruncal anomalies) như tứ chứng Fallot và thất phải hai đường ra (double outlet right ventricle), van bán nguyệt loạn sản đa van (polyvalvular dysplastic semilunar valves) | Nhịp tim nhanh, hở van ba lá, nốt tăng âm trong tim, động mạch dưới đòn phải lạc chỗ, bất thường cấu trúc tim, đặc biệt là tắc nghẽn đường ra thất trái (HLHS, CoA,...) và van bán nguyệt loạn sản đa van |
Bụng | Thoát vị rốn (thường chỉ có ruột), thoát vị hoành. Ống tĩnh mạch có đường đi bất thường và đổ vào tĩnh mạch chủ dưới | Hiếm gặp thoát vị rốn hoặc các bất thường ruột khác. Ống tĩnh mạch có đường đi bất thường và đổ vào tĩnh mạch chủ dưới |
Bất thường niệu- dục | Thận móng ngựa (Horseshoe kidneys) | Bàng quang to (Megacystis), thận tăng âm (hyperechogenic kidneys) |
Bất thường xương | Bất sản xương quay (Radius aplasia), bàn tay khoèo (club hands), các ngón tay nắm chặt (clenched fingers), tật chẻ đôi đốt sống (spina bifida) | Tật thừa ngón (Polydactyly) |
Dây rốn | Động mạch rốn duy nhất (Single umbilical artery), nang dây rốn (cord cyst) | Động mạch rốn duy nhất, nang dây rốn |
β-hCG tự do, P Gonadotropin màng đệm người tự do; PAPP-A, protein A huyết tương liên quan đến thai kỳ; NT, độ mờ da gáy; AVSD, kênh nhĩ thất; VSD, thông liên thất; HLHS, hội chứng thiểu sản tim trái; CoA, hẹp eo động mạch chủ. | ||
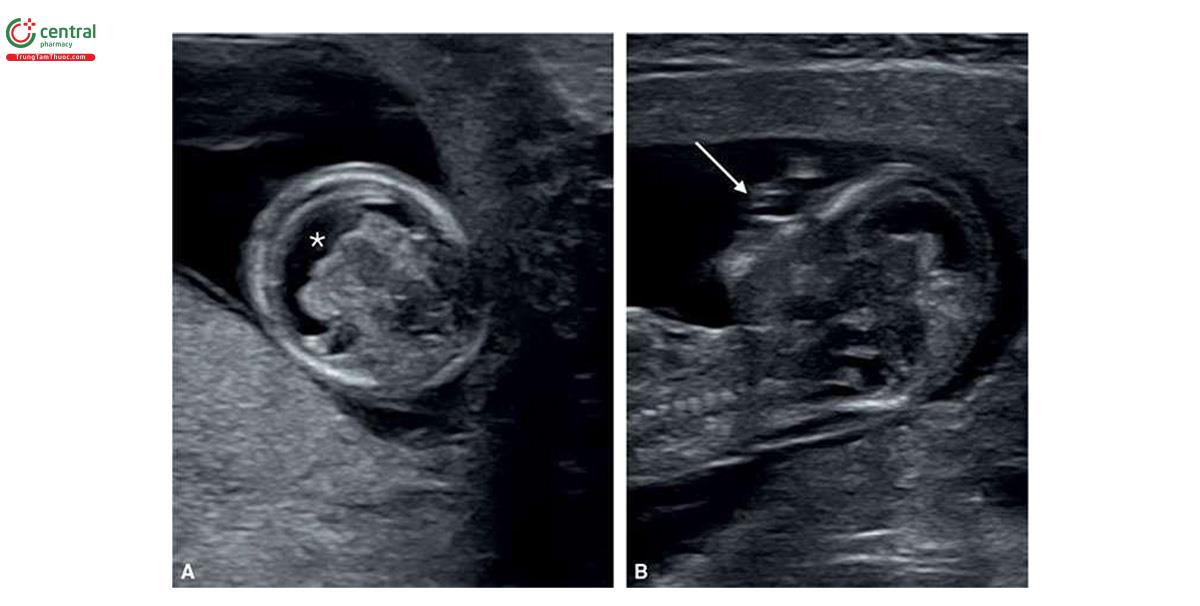
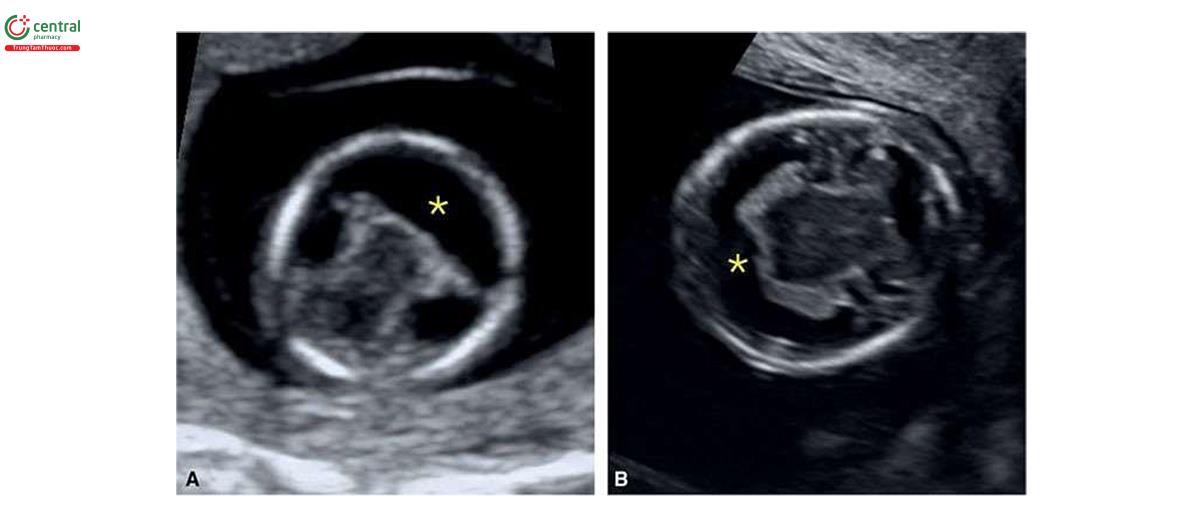
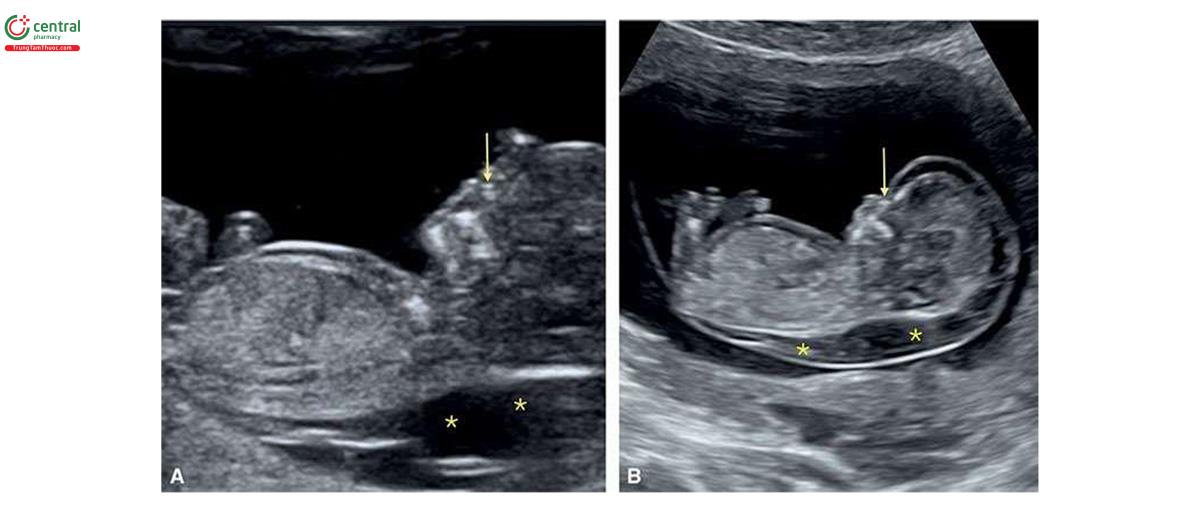
2.3 Monosomy X
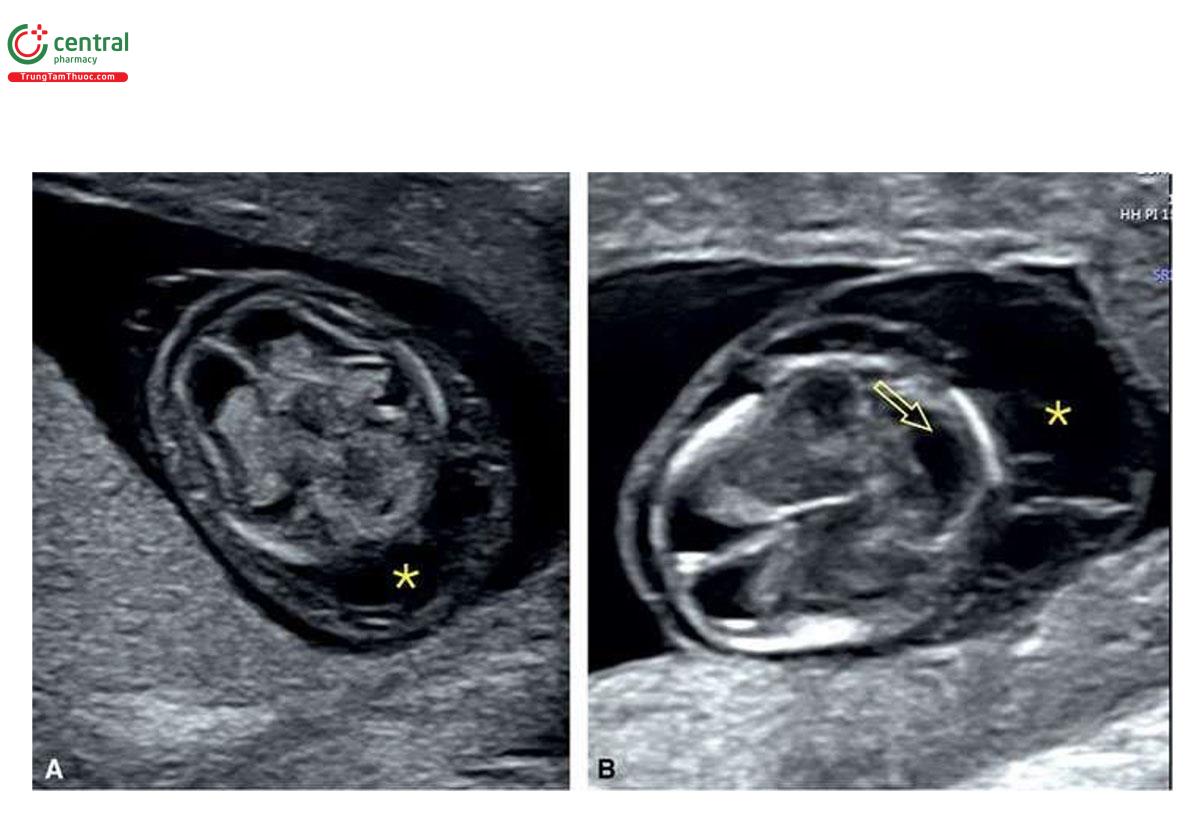
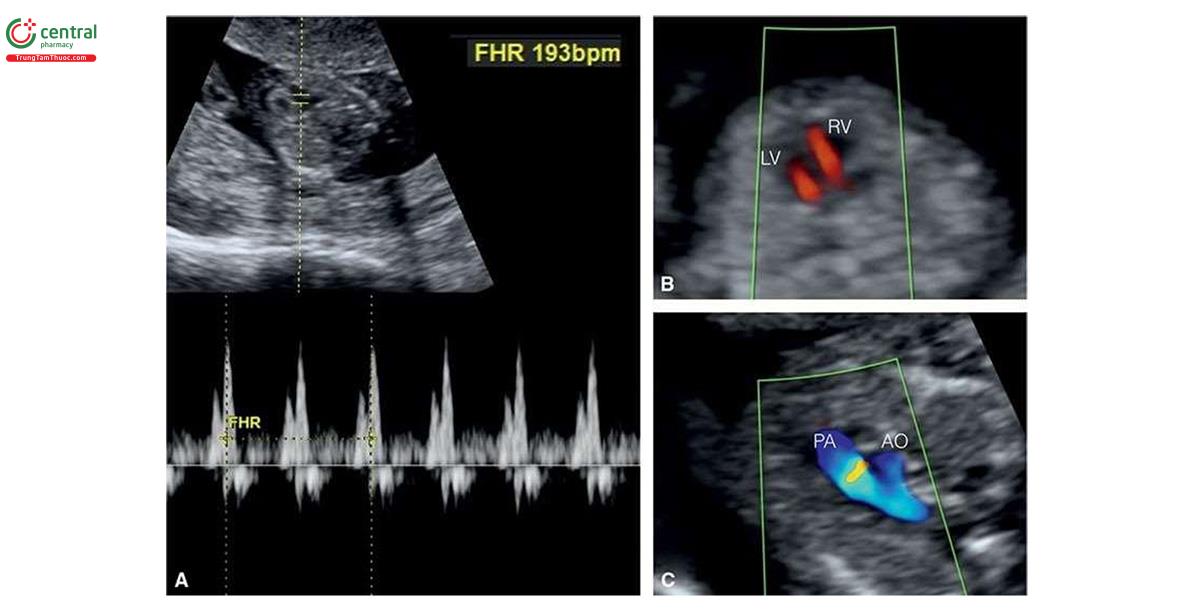
Thai nhi bị monosomy X (hội chứng Turner) thường có NT lớn, với giá trị trung vị là 7,8 mm5 và thường được mô tả là nang bạch huyết (cystic hygroma) (Hình 6.25 và 6.26). Monosomy X không liên quan với tuổi mẹ. Thông thường, trong monosomy X, rối loạn bạch huyết không giới hạn ở vùng cổ mà có thể ảnh hưởng đến toàn bộ cơ thể bao gồm tràn dịch màng phổi, cổ chướng và phù dưới da (Hình 6.27). Thai nhi bị monosomy X thường vẫn có xương mũi8, β-hCG tự do trong huyết thanh mẹ bình thường (1.1 MoM) và PAPP-A thấp (0.49 MoM).9 Các đặc điểm điển hình của monosomy X trong quý 1 được liệt kê trong Bảng 6.4, bao gồm nhịp tim thai nhanh và tắc nghẽn đường ra thất trái (Hình 6.28), các bất thường thận như thận móng ngựa (horseshoe kidneys) cũng như phù bàn chân (feet edema). Một số dị tật này thường khó chẩn đoán trong quý 1. Trong một nghiên cứu ở quý 1 bao gồm 31 trường hợp bị monosomy X và 5.613 trường hợp ở nhóm chứng đẳng bội, số đo NT (8,8 mm) và tần số tim thai (171 nhịp/phút) ở monosomy X cao hơn đáng kể so với nhóm chứng đẳng bội (NT = 1,7 mm và tần số tim thai 160 nhịp/phút) .10 Thai nhi bị monosomy X, các dị tật tim bẩm sinh và phù thai được ghi nhận lần lượt ở 54,8% và 43,8%.10 Tất cả các trường hợp monosomy X đều có ít nhất một dấu hiệu của thể lệch bội trên siêu âm.10 Các dấu hiệu khác ở thai nhi mắc monosomy X trong quý 1 được thể hiện bằng hình ảnh trong các chương khác nhau của cuốn sách này.
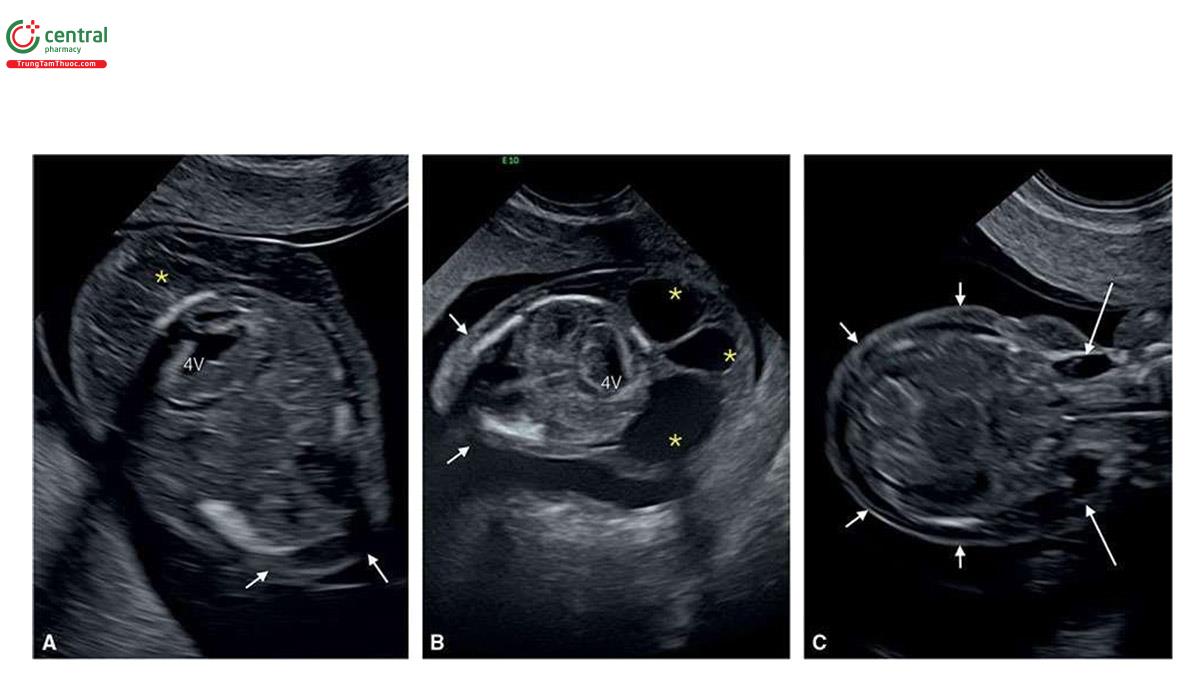
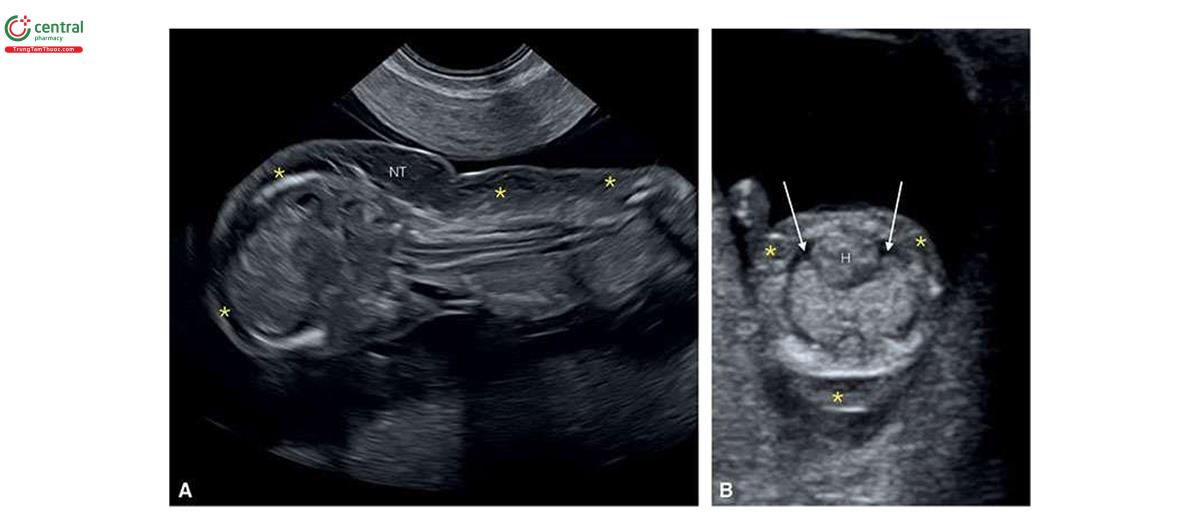
2.4 Thể tam bội (Triploidy)
Trong thể tam bội, có thêm một bộ nhiễm sắc thể đơn bội hoàn chỉnh (complete additional haploid set of chromosomes) dẫn đến có 69 nhiễm sắc thể trong mỗi tế bào thay vì 46 nhiễm sắc thể. Bộ nhiễm sắc thể đơn bội thêm vào có thể có nguồn gốc từ mẹ hoặc bố. Loại "bố" được gọi là thể tam bội có nguồn gốc từ bố (diandric triploidy ) và loại "mẹ" được gọi là thể tam bội có nguồn gốc từ mẹ (digynic triploidy). Hai loại thể tam bội này có những đặc điểm khác nhau, thường có thể phân biệt được trên siêu âm.
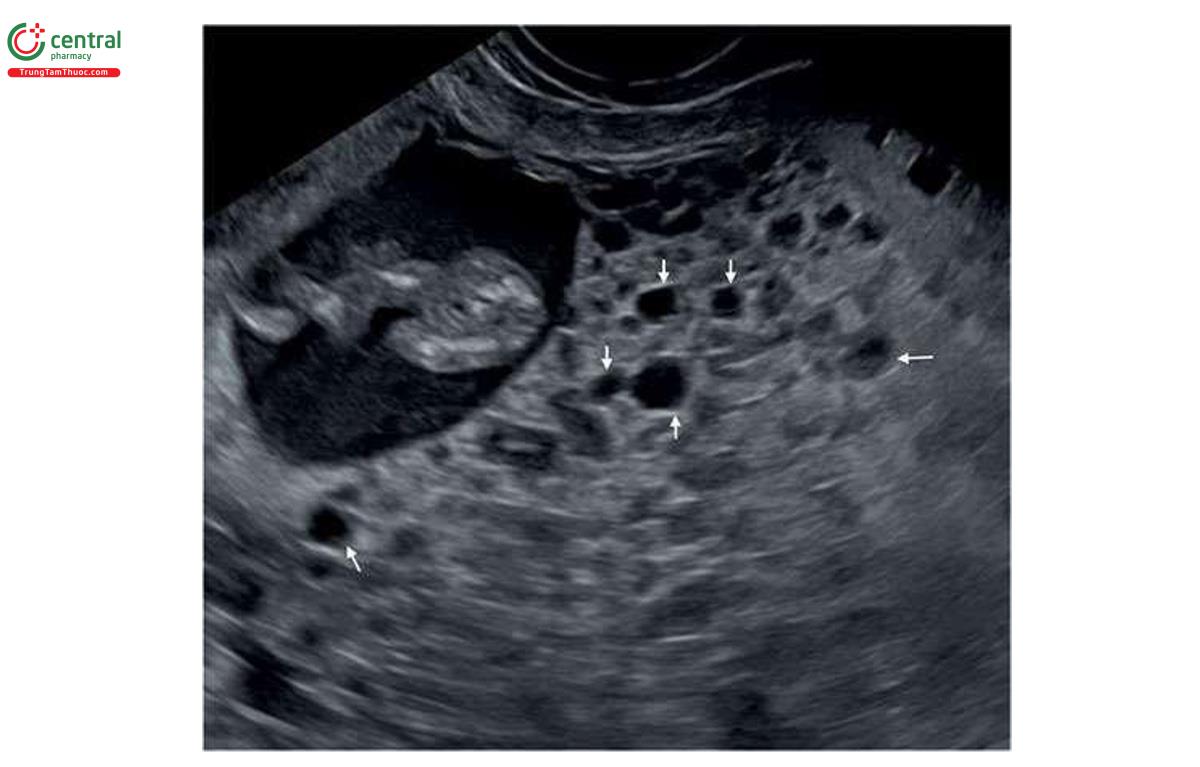
NT có thể dày ở cả thể tam bội có nguồn gốc từ bố và mẹ, nhưng thường nằm trong giới hạn bình thường. Dạng thể tam bội có nguồn gốc từ bố điển hình bao gồm nhau thai trứng (molar placenta) (Hình 6.29), với thai tăng trưởng bình thường, trong khi ở thể tam bội có nguồn gốc từ mẹ, ghi nhận thai giới hạn tăng trưởng nặng (severe growth restriction) với bánh nhau nhỏ nhưng không phải là nhau thai trứng. Sự khác biệt về nhau thai này được phản ánh trong xét nghiệm sinh hóa với thể tam bội có nguồn gốc từ bố có tăng β-hCG tự do và giảm nhẹ PAPP-A trong huyết thanh mẹ và thể tam bội có nguồn gốc từ mẹ có giảm rõ rệt β-hCG tự do và PAPP-A trong huyết thanh mẹ.11,12 Một đặc điểm quan trọng khác của thể tam bội có nguồn gốc từ mẹ trong quý 1 là CRL ngắn đáng kể và sự khác biệt rõ rệt về kích thước giữa chu vi bụng và chu vi đầu, thường > "2 tuần” tuổi thai13 (Hình 6.30 đến 6.32) và đây là một dấu hiệu bệnh lý gần như đặc trưng của thể tam bội có nguồn gốc từ mẹ.
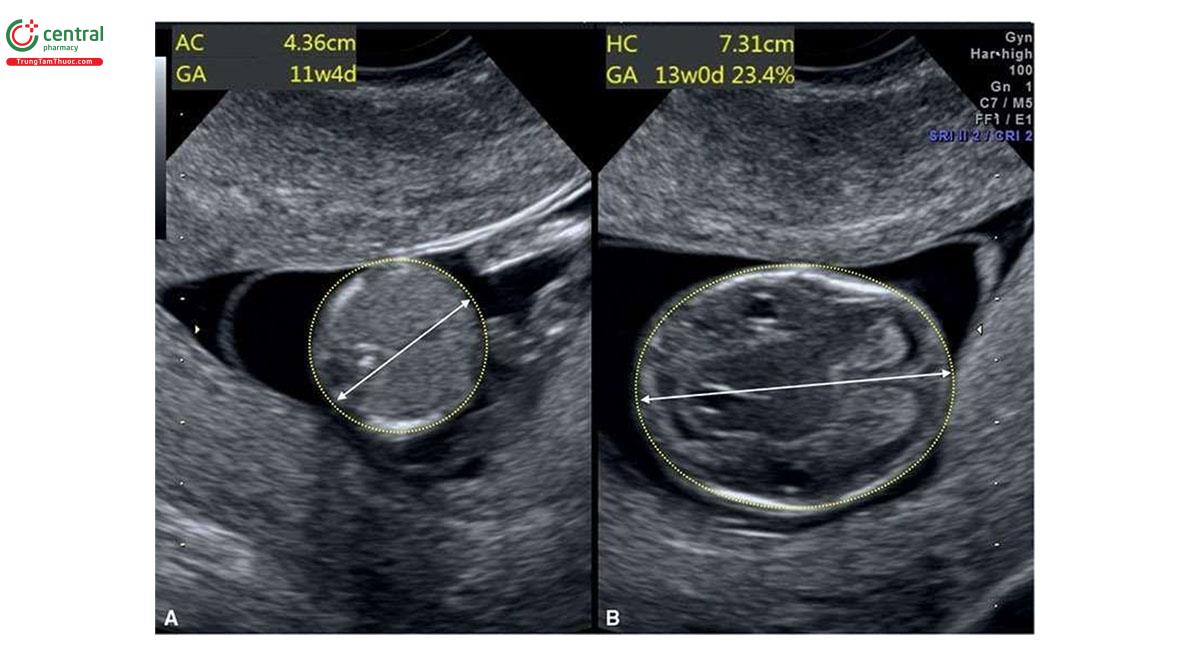
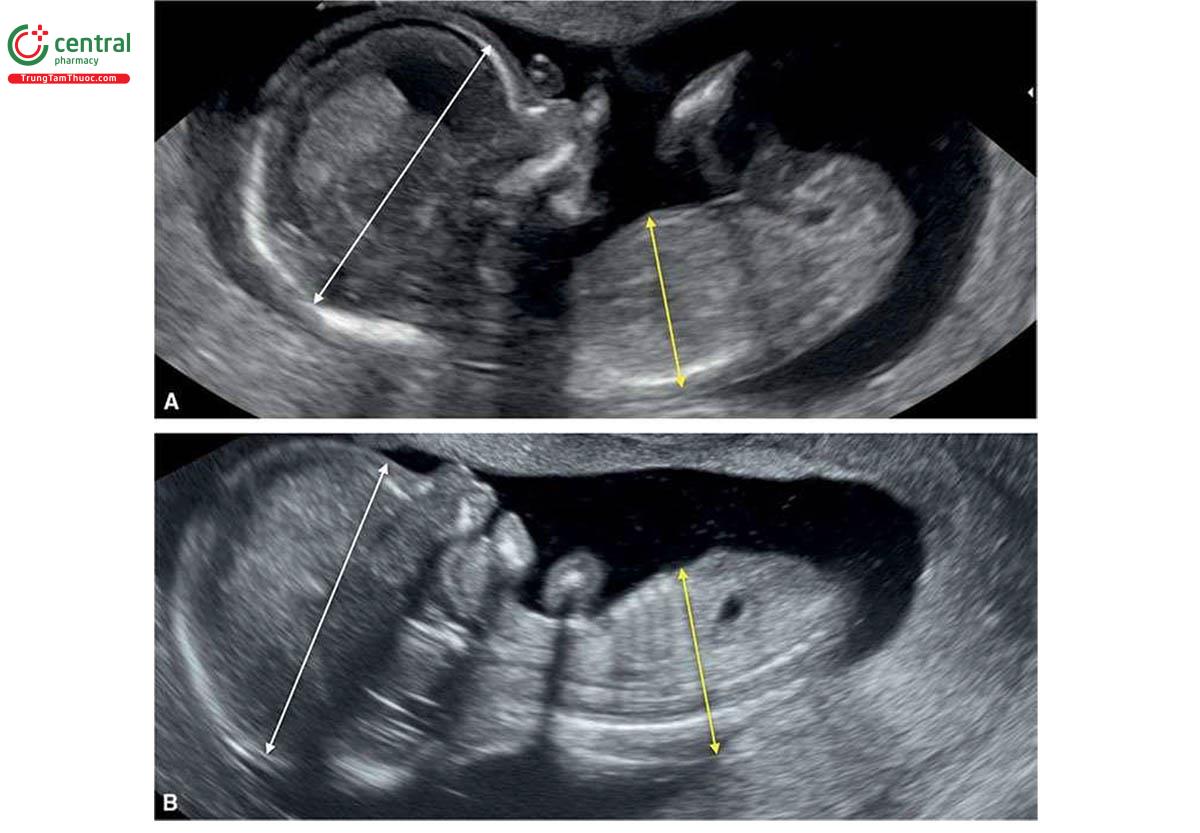
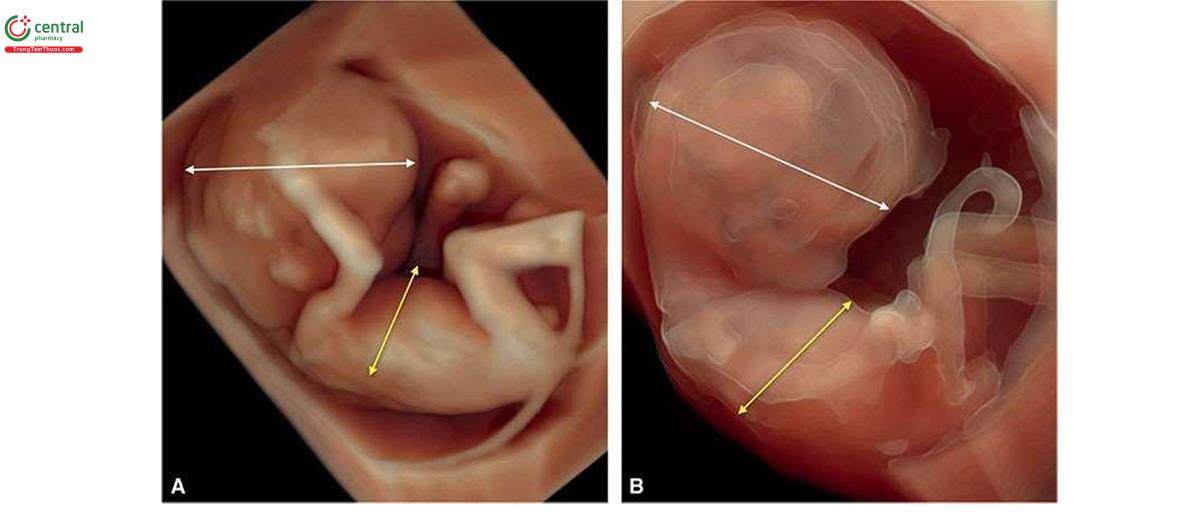
Sàng lọc T21 trong quý 1 cũng giúp phát hiện thể tam bội với tỷ lệ cao. Trong một nghiên cứu bao gồm 198.427 phụ nữ mang thai đơn đã thực hiện sàng lọc trong quý 1 từ 11+2 đến 14+0 tuần tuổi, tỷ lệ phát hiện thể tam bội gộp chung là 25/30 (83,3%), chủ yếu là do sàng lọc quý 1 bất thường ở 23/30 và bất thường cấu trúc ở 2/30,12 CRL nhỏ hơn so với kỳ vọng được phát hiện ở 95% thai nhi với dữ liệu hiện có và 8/30 thai nhi có đường kính lưỡng đỉnh lớn hơn kỳ vọng so với tuổi thai.12 Các đặc điểm điển hình của thể tam bội được trình bày trong Bảng 6.5 với các dấu hiện khác được thể hiện bằng hình ảnh trong các chương khác nhau của cuốn sách này.
Bảng 6.5 • Các đặc điểm của thể tam bội trong quý 1 | ||
| Thể tam bội có nguồn gốc từ mẹ (Digynic (Maternal) Triploidy) | Thể tam bội có nguồn gốc từ bố (Diandric (Paternal) Triploidy) |
Độ mờ da gáy | Bình thường | Tăng |
β-hCG tự do (trung vị) | 0.18 MoM | 8 MoM |
PAPP-A (trung vị) | 0.06 MoM | 0.75 MoM |
Tăng trưởng của thai | Chiều dài đầu-mông ngắn, thai giới hạn tăng trưởng nặng với chu vi đầu/bụng chênh lệch > 2 tuần | Thai tăng trưởng bình thường hoặc chiều dài đầu- mông ngắn |
Đầu | Đầu rất lớn, dãn não thất bốn, hố sau bị chèn ép là các dấu hiệu gợi ý tật chẻ đôi đốt sống (spina bifida), não thất duy nhất (holoprosencephaly) | |
Tim | Bất thường tim, động mạch dưới đòn phải lạc chỗ, nốt tăng âm trong tim, hở van ba lá | |
Bụng | Ruột tăng âm, động mạch rốn duy nhất, bất sản túi mật, thận tăng âm | |
Các chi, xương | Bàn tay nắm chặt (Clenched hands), tật dính ngón (syndactyly), bàn chân khoèo (club feet), tật chẻ đôi đốt sống (spina bifida) | |
β-hCG tự do, p gonadotropin màng đệm người tự do; PAPP-A, protein A huyết tương liên quan đến thai kỳ. | ||
3 XÉT NGHIỆM TIỀN SẢN KHÔNG XÂM LẤN
Xét nghiệm tiền sản không xâm lấn (NIPT) là một xét nghiệm di truyền tương đối mới được ứng dụng như một xét nghiệm sàng lọc trong quý 1 (và quý 2) để sàng lọc trisomy 21, 13, 18, monosomy X và các bất thường nhiễm sắc thể giới tính. Xét nghiệm dựa trên DNA tự do thai nhi (cfDNA) trong tuần hoàn mẹ chủ yếu từ quá trình chết theo chương trình của tế bào nhau thai (placental cells apoptosis). Quá trình chết theo chương trình của tế bào nhau thai giải phóng vào tuần hoàn mẹ các mảnh DNA nhỏ, có thể phát hiện được từ khoảng 4 đến 7 tuần tuổi thai.14 Ước tính có khoảng 2- 20% cfDNA lưu hành trong tuần hoàn mẹ có nguồn gốc từ thai nhi.14 Thời gian bán thải của cfDNA ngắn và thường không thể phát hiện được trong vòng vài giờ sau sinh.15 Chi tiết về khía cạnh kỹ thuật của NIPT nằm ngoài phạm vi của cuốn sách này ngoại trừ các xét nghiệm khác nhau có sẵn trên lâm sàng dựa trên việc phân lập và đếm số lượng cfDNA bằng phương pháp giải trình tự (sequencing methods).
NIPT có hiệu suất sàng lọc T21 rất cao. Ở các nghiên cứu đã được công bố, tỷ lệ phát hiện T21 là 99% với tỷ lệ dương tính giả là 0,16%.16,17 Tỷ lệ phát hiện T18 là 97% với tỷ lệ dương tính giả là 0,15%.16 NIPT đang ngày càng được ứng dụng rộng rãi và hiện đang được dùng như một xét nghiệm sàng lọc sơ cấp (primary screening test) trong thai kỳ. Ngay cả khi xét nghiệm NIPT có tỷ lệ phát hiện rất tốt đối với T21, T18 và T13, nhưng các thể lệch bội khác vẫn bị bỏ sót.18-20
Cần nhấn mạnh rằng, NIPT là một xét nghiệm sàng lọc chứ không phải là một xét nghiệm chẩn đoán, do đó cần thận trọng khi sử dụng NIPT trong việc đánh giá dị tật thai nhi về mặt di truyền. Bởi mối liên quan khá cao giữa các dị tật với sự mất cân bằng nhiễm sắc thể, nên giải thích cho bệnh nhân về ý nghĩa của kết quả NIPT bình thường trong trường hợp có dị tật thai nhi và khuyến cáo thực hiện thêm xét nghiệm chẩn đoán xâm lấn. Không còn nghi ngờ gì nữa, công nghệ NIPT sẽ có những bước tiến vượt bậc trong vài năm tới, cho phép sàng lọc các trường hợp mất đoạn và lặp đoạn (deletions and duplications) nhiễm sắc thể và hiện có sẵn cho một vài tình trạng đơn gen.
4 CHẨN ĐOÁN CÁC BỆNH DI TRUYỀN VÀ HỘI CHỨNG TRONG QUÝ 1
Sàng lọc lệch bội nhiễm sắc thể trong quý 1 với NT và các dấu ấn khác đã mở rộng việc ứng dụng siêu âm ở tuổi thai nhỏ, từ đó giúp phát hiện một hoặc nhiều dị tật thai nhi và trong một số trường hợp gợi ý có thể có hội chứng di truyền. Chúng tôi đã trình bày trong Chương 5 về 4 con đường có thể dẫn đến việc phát hiện dị tật thai nhi trong quý 1. Bốn con đường này bao gồm: (1) có bất thường cấu trúc rõ ràng trên siêu âm, (2) phát hiện NT dày với xét nghiệm thích hợp dẫn đến phát hiện dị tật thai nhi, (3) có tiền sử gia đình dương tính dẫn đến phát hiện một trường hợp tái phát và (4) phát hiện dị tật với siêu âm thai chi tiết. Trong trường hợp không có tiền sử gia đình về một hội chứng di truyền mà thai nhi có dị tật, chẩn đoán mới một hội chứng di truyền trong quý 1 là tương đối khó khăn. Khi có một loạt các bất thường trên siêu âm quý 2 hoặc quý 3, một chuyên gia siêu âm thường có thể gợi ý một hội chứng đặc hiệu. Đây là một nhiệm vụ khó khăn hơn trong quý 1, tuy nhiên, ở tuổi thai nhỏ, rất hiếm khi có đủ tất cả các đặc điểm của một hội chứng di truyền trên siêu âm. Tuy nhiên, có 4 cách để chẩn đoán các hội chứng trong quý 1:
1. Có nhiễm sắc thể đồ (karyotype) bất thường sau một thủ thuật chẩn đoán xâm lấn như trisomy, thể tam bội (triploidy), monosomy X và chuyển đoạn lớn không cân bằng (unbalanced translocations), mất đoạn và lặp đoạn (deletions, and duplications).
2. Có vi mất đoạn (microdeletions) và vi lặp đoạn (microduplications), được phát hiện bằng kỹ thuật lai huỳnh quang tại chỗ (FISH) hoặc phương pháp lai so sánh hệ gen (CGH hoặc microarray).
3. Các bệnh đơn gen được phát hiện bằng các xét nghiệm di truyền phân tử có chọn lọc về một tình trạng đặc biệt hoặc sử dụng phương pháp giải trình tự thế hệ mới (next generation sequencing).
4. Hội chứng di truyền với "liên quan” hoặc "nối tiếp” không có hoặc chưa xác định được nền tảng di truyền phân tử.
4.1 Nhiễm sắc thể đồ bất thường, mất đoạn, lặp đoạn
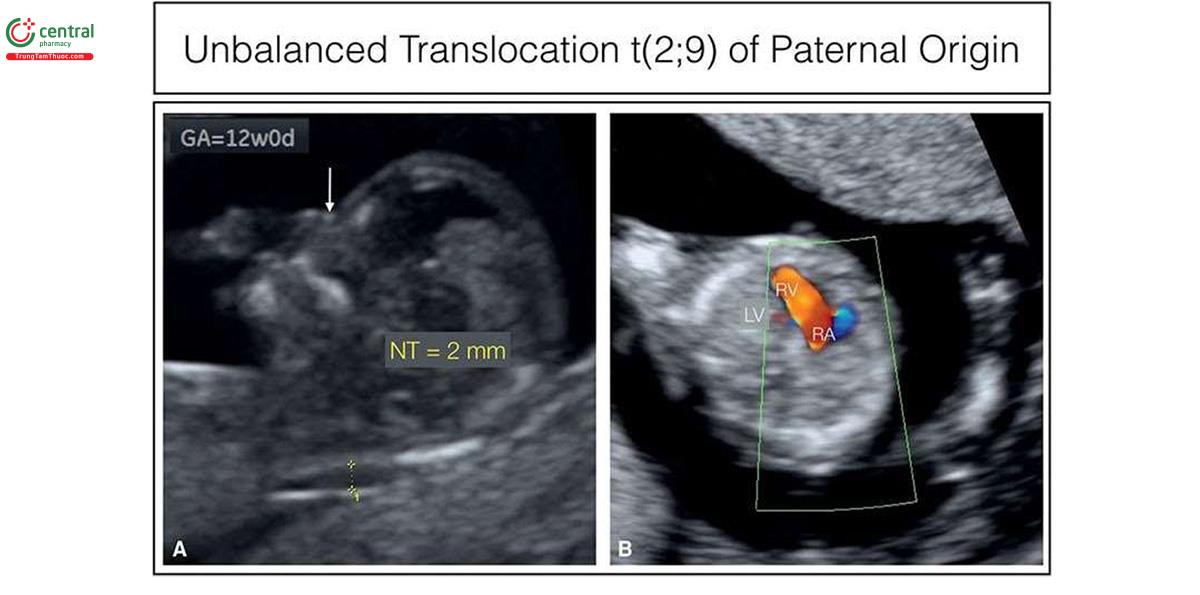
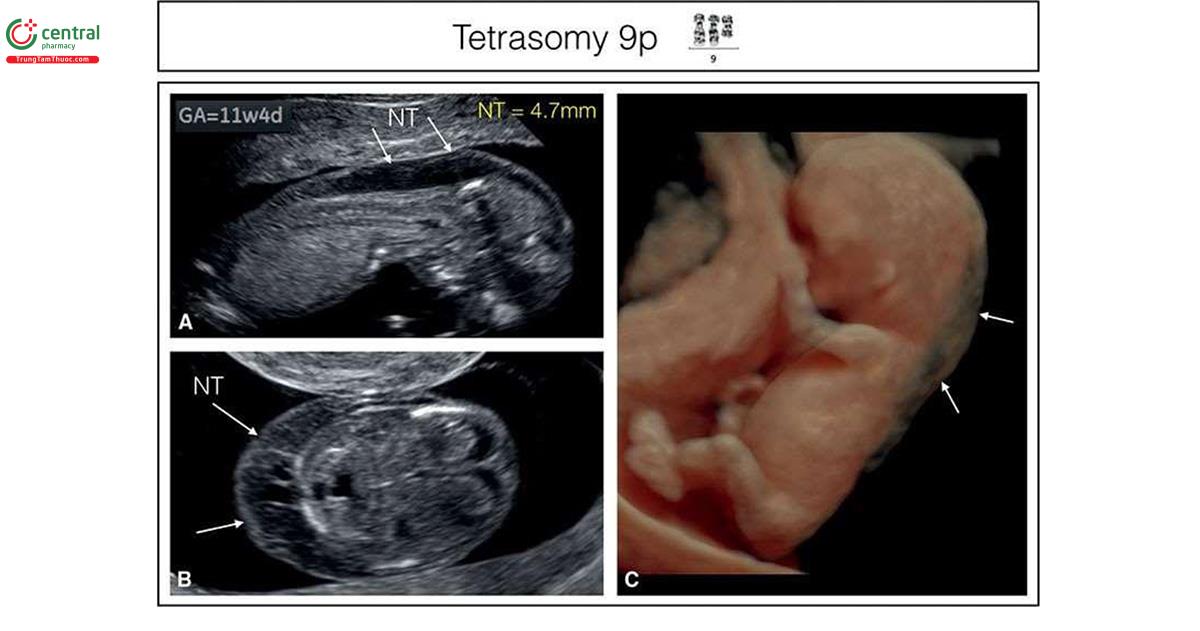
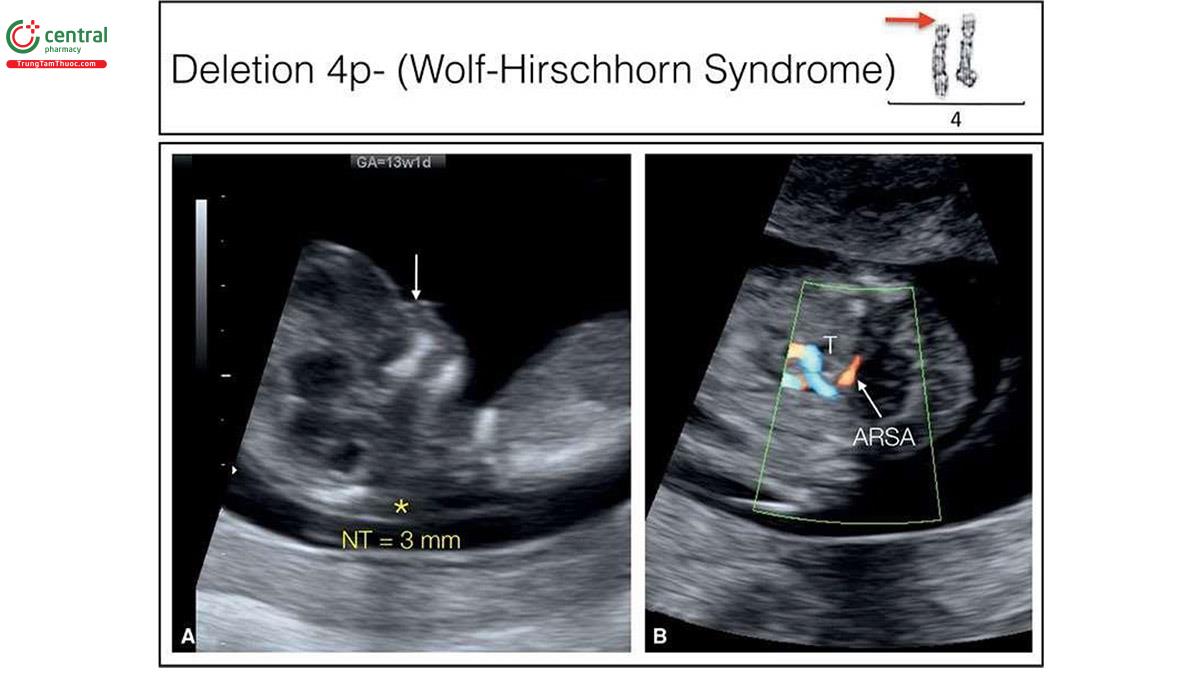
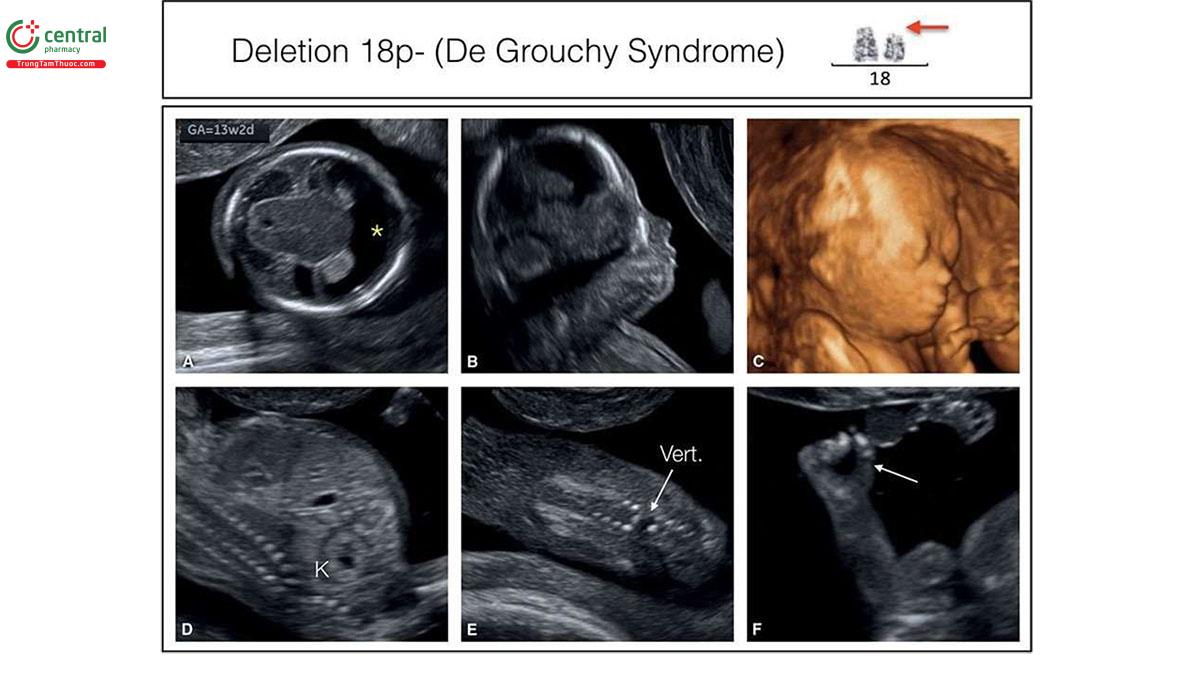
Nếu phát hiện bất thường trên siêu âm, các tác giả tin rằng không nên chỉ định xét nghiệm NIPT, vì đây là xét nghiệm sàng lọc và sẽ bỏ sót một số lượng đáng kể bất thường nhiễm sắc thể18, khi đó nên thực hiện xét nghiệm chẩn đoán xâm lấn, như sinh thiết gai nhau (CVS). Phân tích nhiễm sắc thể đồ truyền thống (traditional karyotypic analysis) sẽ phát hiện được chuyển đoạn lớn cân bằng hoặc không cân bằng (large balanced or unbalanced translocations) (Hình 6.33), trisomy thể khảm hiếm gặp, nhiễm sắc thể đánh dấu (marker chromosomes) và isochromosomes (Hình 6.34 và 10.19) ngoài các bất thường về số lượng nhiễm sắc thể. Các mất đoạn nhiễm sắc thể lớn cũng có thể xác định được trên phân tích nhiễm sắc thể đồ truyền thống như trong phần lớn các trường hợp mất đoạn 4p- (hội chứng Wolf Hirschhorn) (Hình 6.35) hoặc mất đoạn 18p- (Hội chứng De Grouchy) (Hình 6.36). Các mất đoạn nhỏ, được gọi là vi mất đoạn, như 22q11 (hội chứng DiGeorge), thường quá nhỏ để có thể xác định được bằng phương pháp này (Hình 11.6). Các vi mất đoạn có thể được phát hiện bằng FISH, khi nghi ngờ tình trạng như vậy (ví dụ: FISH phát hiện vi mất đoạn 22q11 trong các bất thường thân-nón động mạch) hoặc kiểm tra nhiễm sắc thể toàn diện bằng CGH hoặc microarray. Gần đây, kỹ thuật CGH đã trở nên phổ biến, mặc cho chi phí và hạn chế của nó. Một số trung tâm cung cấp CGH như một xét nghiệm di truyền đầu tay sau khi CVS hoặc chọc ối, trong khi các trung tâm khác hạn chế sử dụng CGH nếu nghi ngờ mất cân bằng DNA hoặc như một xét nghiệm hàng thứ hai sau khi phân tích nhiễm sắc thể đồ bình thường. Các nghiên cứu gần đây gợi ý rằng, CGH phát hiện thêm 6% các bất thường nhiễm sắc thể ngoài các thể lệch bội ở thai kỳ có dị tật thai nhi.21,22
4.2 Các bệnh đơn gen và hội chứng khác
Nhiều dị tật thai nhi được xác định trong quý 1 cũng có thể do bệnh di truyền đơn gen gây ra (ví dụ: dị tật hệ xương, dị tật hệ thần kinh trung ương liên quan với bệnh tế bào nhung mao (ciliopathies), bệnh thận đa nang (polycystic renal diseases) và vv...) và có thể không phát hiện được bởi CGH. Trong những trường hợp này, cần có kiến thức về các đặc điểm siêu âm điển hình để kiểm tra (các) gen đặc hiệu có liên quan. Gần đây, các panel gen chọn lọc ngày càng được ứng dụng rộng rãi đối với các bệnh di truyền và trong tương lai giải trình tự exon hay genome thế hệ mới sẽ ngày càng được chỉ định nhiều hơn. Cho đến lúc đó, các chuyên gia siêu âm và bác sĩ siêu âm nên làm quen với các dị tật thai nhi trong quý 1 thường liên quan với các kiểu di truyền đơn gen.
Khả năng đề xuất một mối liên quan có thể có của một dị tật thai nhi với một loại di truyền đơn gen khác nhau dựa vào chuyên môn của người làm siêu âm và loại dị tật. Ví dụ, tương đối dễ dàng để đưa ra chẩn đoán hội chứng Meckel-Gruber (Hình 8.21, 13.30, và 13.31), khi phát hiện thoát vị não vùng chẩm và thừa ngón trong quý 1. Hội chứng Noonan được gợi ý khi NT rất dày kết hợp với nhiễm sắc thể đồ bình thường và kéo dài sang quý 2 (Hình 9.45). Chẩn đoán các hội chứng đơn gen khá khó khăn khi các dị tật rất kín đáo và các dấu hiệu trên siêu âm không biểu hiện đầy đủ trong quý 1. Trong trường hợp này, cần phải siêu âm theo dõi vào đầu quý 2. Trong cả hai trường hợp, các tác giả quan sát thấy xương đùi ngắn và thừa ngón ở 12 đến 13 tuần tuổi và CVS cho thấy nhiễm sắc thể đồ bình thường. Siêu âm theo dõi ở tuần thứ 15 cho thấy xương sườn ngắn, khiến chúng tôi nghĩ đến hội chứng thừa ngón - xương sườn ngắn (short-rib-polydactyly) hoặc Ellis-Van Creveld, và xét nghiệm di truyền phân tử xác nhận chẩn đoán trong cả 2 trường hợp (Hình 14.18 và 14.22). Thông thường, các bệnh di truyền được chẩn đoán ở tuổi thai nhỏ nhờ sàng lọc thường quy hoặc xét nghiệm chẩn đoán khi mẹ hoặc bố mang gen bệnh và trước khi có bất kỳ dấu hiệu nào trên siêu âm. Ví dụ về các tình trạng như vậy bao gồm bệnh xơ nang (cystic fibrosis), xơ cứng củ (tuberous sclerosis), fragile X, thalassemia, hồng cầu hình liềm (sickle cell), bệnh rối loạn dự trữ (storage diseases) và vv. Ngoài ra, còn có các hội chứng như hội chứng VATER, hoặc các tình trạng di truyền theo gen lặn trên NST thường như hội chứng Fryns (Hình 10.20) cho đến nay vẫn chưa xác định được gen đặc hiệu. Bảng 6.6 liệt kê một số hội chứng và tình trạng di truyền mà tác giả chẩn đoán được trong quý 1 cùng với các hình ảnh siêu âm tương ứng của chúng, được trình bày trong các chương khác nhau của cuốn sách này.
Bảng 6.6 • Tình trạng di truyền và hội chứng được trình này cùng với các hình ảnh tương ứng bày trong cuốn sách | |
Hội chứng Beckwith-Wiedemann | Hình 12.18 |
Loạn sản Campomelic | Hình 14.23 |
Hội chứng CHARGE | Hình 9.32 |
Loạn sản Diastrophic | Hình 14.20 |
Hội chứng Ellis-Van Creveld | Hình 14.22 |
Phức hợp xương đùi-xương mác-xương trụ (FFU) (Femur- fibula-ulna (FFU) complex) | Hình 14.25 và 14.32 |
Hội chứng Fryns | Hình 10.20 |
Loạn sản Grebe | Hình 14.33 |
Não thất duy nhất (Holoprosencephaly), di truyền trội trên NST thường, không liên quan với hội chứng | Hình 8.30 |
Hội chứng Joubert type 14 | Hình 8.22 |
Hội chứng Meckel-Gruber | Hình 8.21, 13.30, và 13.31 |
Hội chứng Noonan | Hình 9.45 |
Tạo xương bất toàn type II (Osteogenesis imperfecta Type II) | Hình 14.18 và 14.19 |
Hội chứng xương sườn ngắn-thừa ngón (Short-rib- polydactyly syndrome) | Hình 14.18 |
Loạn sản xương gây chết (Thanatophoric dysplasia) | Hình 14.21 |
Phức hợp VACTERL-VATER | Hình 12.36 |
Hội chứng Walker-Warburg | Hình 8.35 |
Thảo luận chi tiết về các đặc điểm trên siêu âm và xét nghiệm di truyền của tất cả các hội chứng di truyền nằm ngoài phạm vi của cuốn sách này. Độc giả quan tâm có thể tìm đọc các sách chuyên khảo23 và các trang trên Internet như Online Mendelian Inheritance (www.OMIM.org) và Orphanet (www.orphanet.net).
5 TÀI LIỆU THAM KHẢO
1. Syngelaki A, Guerra L, Ceccacci I, et al. Impact of holoprosencephaly, exomphalos, megacystis and high NT in first trimester screening for chromosomal abnormalities. Ultrasound Obstet Gynecol. 2016. doi:10.1002/uog.17286.
2. Szabó J, Gellén J. Nuchal fluid accumulation in trisomy-21 detected by vaginosonography in first trimester. Lancet. 1990;336:1133.
3. Schulte-Vallentin M, Schindler H. Non-echogenic nuchal oedema as a marker in trisomy 21 screening. Lancet. 1992;339:1053.
4. Nicolaides KH, Azar G, Byrne D, et al. Fetal nuchal translucency: ultrasound screening for chromosomal defects in first trimester of pregnancy. BMJ (Clin Res ed). 1992;304:867-869.
5. Nicolaides KH. Screening for fetal aneuploidies at 11 to 13 weeks. Prenat Diagn. 2011;31:7-15.
6. Santorum M, Wright D, Syngelaki A, et al. Accuracy of first trimester combined test in screening for trisomy 21, 18 and 13. Ultrasound Obstet Gynecol. 2016. doi:10.1002/uog.17283.
7. Wiechec M, Knafel A, Nocun A, et al. How effective is ultrasound-based screening for trisomy 18 without the addition of biochemistry at the time of late first trimester? J Perinat Med. 2016;44:149- 159.
8. Wagner P, Sonek J, Hoopmann M, et al. First-trimester screening for trisomy 18 and 13, triploidy and Turner syndrome by detailed early anomaly scan. Ultrasound Obstet Gynecol. 2016;48:446-451.
9. Spencer K, Tul N, Nicolaides KH. Maternal serum free beta-hCG and PAPP-A in fetal sex chromosome defects in the first trimester. Prenat Diagn. 2000;20:390-394.
10. Wiechec M, Knafel A, Nocun A, et al. What are the most common first- trimester ultrasound findings in cases of Turner syndrome? J Matern Fetal Neonatal Med. 2016. doi:10.1080/14767058.2016.1220525.
11. Spencer K, Liao AW, Skentou H, et al. Screening for triploidy by fetal nuchal translucency and maternal serum free beta-hCG and PAPP-A at 10-14 weeks of gestation. Prenat Diagn. 2000;20:495- 499.
12. Engelbrechtsen L, Br0ndum-Nielsen K, Ekelund C, et al. Detection of triploidy at 11-14 weeks‘ gestation: a cohort study of 198 000 pregnant women. Ultrasound Obstet Gynecol. 2013;42:530- 535.
13. Zalel Y, Shapiro I, Weissmann-Brenner A, et al. Prenatal sonographic features of triploidy at 12-16 weeks. Prenat Diagn. 2016;36:650-655.
14. lllanes S, Denbow M, Kailasam C, et al. Early detection of cell-free fetal DNA in maternal plasma. Early Hum Dev. 2007;83:563-566.
15. Lo YM, Zhang J, Leung TN, et al. Rapid clearance of fetal DNA from maternal plasma. Am J Hum Genet. 1999;64:218-224.
16. Lo JO, Cori DF, Norton ME, et al. Noninvasive prenatal testing. Obstet Gynecol Surv. 2014;69:89-99.
17. Norton ME, Jacobsson B, Swamy GK, et al. Cell-free DNA analysis for noninvasive examination of trisomy. N Engl J Med. 2015;372:1589-1597.
18. Syngelaki A, Pergament E, Homfray T, et al. Replacing the combined test by cell- free DNA testing in screening for trisomy 21, 18 and 13: impact on the diagnosis of other chromosomal abnormalities. Fetal Diagn Ther. 2014;35:174-184.
19. Norton ME, Baer RJ, Wapner RJ, et al. Cell-free DNA vs sequential screening for the detection of fetal chromosomal abnormalities. Am J Obstet Gynecol. 2016;214:727.e1-.e6.
20. Wellesley D, Dolk H, Boyd PA, et al. Rare chromosome abnormalities, prevalence and prenatal diagnosis rates from population-based congenital anomaly registers in Europe. Eur J Hum Genet. 2012;20:521-526.
21. Wapner RJ, Martin CL, Levy B, et al. Chromosomal microarray versus karyotyping for prenatal diagnosis. N Engl J Med. 2012;367:2175-2184.
22. Srebniak MI, Diderich KE, Joosten M, et al. Prenatal SNP array testing in 1000 fetuses with ultrasound anomalies: causative, unexpected and susceptibility CNVs. Eur J Hum Genet. 2016;24:645-651.
23. Jones KL, Jones MC, del Campo M. Smith‘s Recognizable Patterns of Human Malformation. 7 ed. Philadelphia, PA: Saunders; 2013.

