Cập nhật chẩn đoán và điều trị xơ phổi tiến triển trong bệnh phổi kẽ ngoài xơ phổi vô căn
CẬP NHẬT CHẨN ĐOÁN VÀ ĐIỀU TRỊ XƠ PHỔI TIẾN TRIỂN TRONG BỆNH PHỔI KẼ NGOÀI XƠ PHỔI VÔ CĂN
PGS. TS. TẠ BÁ THẮNG
Bệnh viện Quân y 103, Học viện Quân y
Tải PDF TẠI ĐÂY
1 Tóm tắt
Bệnh phổi kẽ đang là mối quan tâm trong thực hành lâm sàng bởi đây không phải là bệnh hiếm gặp và đã có nhiều tiến bộ trong chẩn đoán, điều trị trong những năm gần đây. Bệnh phổi kẽ được phân thành 2 nhóm: bệnh phổi kẽ vô căn (Idiopathic pulmonary fibrosis - IPF) và bệnh phổi kẽ có nguyên nhân (do nhiễm trùng, các bệnh mô liên kết, dị ứng…). Xơ phổi tiến triển (Progression of pulmonary fibrosis-PPF) là một trong những biến chứng và biểu hiện sự tiến triển của bệnh phổi kẽ. Chẩn đoán xơ phổi tiến triển dựa trên các bằng chứng về lâm sàng, chức năng hô hấp và chụp cắt lớp vi tính lồng ngực độ phân giải cao. Sự phối hợp của đa chuyên khoa có vai trò rất quan trọng trong chẩn đoán xơ phổi tiến triển. Hiệu quả của các thuốc kháng xơ trong điều trị xơ phổi tiến triển ở bệnh phổi kẽ, đặc biệt là bệnh phổi kẽ ngoài xơ phổi vô căn đã được chứng minh trong nhiều nghiên cứu trên thế giới và đã được sử dụng rộng rãi. Nhiều triển vọng trong chẩn đoán và điều trị xơ phổi tiến triển ở bệnh phổi kẽ đang được nghiên cứu và áp dụng trong tương lai.
Từ khóa: Xơ phổi tiến triển; Bệnh phổi kẽ.
UPDATED DIAGNOSIS AND TREATMENT OF PROGRESSIVE PULMONARY FIBROSIS IN INTERSTITIAL LUNG DISEASE OTHER THAN IDIOPATHIC PULMONARY FIBROSIS
Summary: Interstitial lung disease is a concern in clinical practice because it is not a rare disease and there have been many advances in diagnosis and treatment in recent years. Interstitial lung disease is divided into two groups: idiopathic pulmonary fibrosis (IPF) and interstitial lung disease with causes (Infection, connective tissue diseases, allergies...). Progressive pulmonary fibrosis (PPF) is one of the complications and represents the progression of interstitial lung disease. Diagnosis of progressive pulmonary fibrosis is based on clinical evidence, lung function and high-resolution chest computed tomography. Multidisciplinary coordination plays a very important role in diagnosing progressive pulmonary fibrosis. The effectiveness of antifibrotic drugs in treating progressive pulmonary fibrosis in interstitial lung disease, especially interstitial lung disease other than idiopathic pulmonary fibrosis, has been proven in many studies in the world and has been widely used. Many prospects in the diagnosis and treatment of progressive pulmonary fibrosis in interstitial lung disease are being researched and applied in the future.
Keywords: Progressive pulmonary fibrosis; Interstitial lung disease.
2 Khái niệm xơ phổi tiến triển
Xơ phổi tiến triển (Progression of pulmonary fibrosis-PPF) ở bệnh nhân mắc bệnh phổi kẽ (Interstitial lung diseases - ILD) ngoài xơ phổi kẽ vô căn (Idiopathic pulmonary fibrosis - IPF), có bằng chứng của xơ phổi trên X quang được xác định khi có ít nhất hai trong ba tiêu chuẩn sau xảy ra trong 1 năm qua mà không do các nguyên nhân khác: Các triệu chứng hô hấp ngày càng trầm trọng; Bằng chứng của bệnh tiến triển trên chức năng hô hấp; Bằng chứng của bệnh tiến triển trên X quang [1, 2, 6].
PPF được định nghĩa riêng biệt với IPF và thuật ngữ “xơ phổi tiến triển” đã thay thế thuật ngữ “bệnh phổi kẽ có xơ phổi tiến triển-Progressive fibrosing ILD” bởi các lý do sau [6]:
- Tiến triển của bệnh là kết quả của xơ phổi tiến triển ở khoảng kẽ trong nhu mô phổi.
- Sự tiến triển của bệnh gây ra diễn biến lâm sàng tương tự như IPF.
- Xơ phổi tiến triển là thuật ngữ đơn giản và được sử dụng rộng rãi bởi cả bác sĩ và bệnh nhân.
3 Dịch tễ
Hiện chưa có dữ liệu chính xác về dịch tễ của PPF. Ước tính rằng trong 2 năm tiếp theo, với các biện pháp điều trị phù hợp, vẫn có 13-40% bệnh nhân xơ phổi do ILD không IPF sẽ tiến triển[2]. Nghiên cứu PROGRESS, trên một nhóm bệnh nhân mắc ILD trong thế giới thực cho thấy kiểu hình tiến triển gặp ở khoảng 25% ILD bị xơ hóa ngoài IPF [7]. Trong một nghiên cứu thực tế khác thấy tỷ lệ ILD không IPF có kiểu hình xơ hóa tiến triển gặp từ 18% đến 32% [8].
Thời gian từ khi xuất hiện triệu chứng đến khi tử vong của bệnh nhân PPF trung bình là 61-80 tháng. Thời gian sống trung bình sau chẩn đoán xơ phổi tiến triển ở bệnh nhân ILD khoảng 3 năm [6, 8].
4 Bệnh sinh
Các yếu tố nguy cơ PPF trong bệnh phổi kẽ bao gồm[3, 9, 11]:
- Các yếu tố chung: viêm phổi kẽ thông thường (Usual interstitial pneumonia-UIP), BMI thấp, giảm độ bão hòa oxy khi làm test đi bộ 6 phút.
- Đặc điểm các bệnh phổi kẽ:
- Viêm phổi tăng cảm có xơ: giảm FVC ≥10%; FVC nền thấp; xác định kháng nguyên; biến thể gen MUC5B/TLD.
- Bệnh phổi kẽ trong viêm khớp dạng thấp: UIP; mức kháng thể CCP/CCP2 cao; hút thuốc 30 bao-năm; điểm xơ và lan rộng xơ trên HRCT.
- Bệnh xơ cứng bì hệ thống: FVC <65%, DLCO<55%; giảm DLCO>15%, giảm Kco>10%; điểm xơ và lan rộng xơ trên HRCT (10-30%, FVC<70%).
Các yếu tố thúc đẩy phát triển xơ trong PPF bao gồm[5, 6]:
- Tăng sinh nguyên bào sợi
- Rối loạn do quá trình viêm
- Tổn thương biểu mô hoặc mạch máu mạn tính lặp đi lặp lại dẫn đến phá hủy các tế bào và quá trình sửa chữa không được kiểm soát.
- Các nguyên bào sợi tăng sinh, di chuyển từ các nguồn khác nhau đến vị trí tổn thương và được kích hoạt để trở thành nguyên bào sợi cơ, tiết ra lượng chất nền ngoại bào tăng lên.
5 Các bệnh phổi kẽ có xơ phổi tiến triển
Ngoài IPF, các bệnh phổi kẽ khác có xơ phổi tiến triển bao gồm bệnh phổi kẽ do các bệnh mô liên kết (Connective tissue disease-ILD), xơ do viêm phổi tăng cảm (Hypersensitivity pneumonitis - HP), bệnh phổi kẽ không phân loại (Unclassifiable ILD), viêm phổi kẽ vô căn không đặc hiệu (Idiopathic nonspecific interstitial pneumonia - NSIP), sarcoidosis, viêm phổi tổ chức hóa (Organizing pneumonia), và ILD kết hợp với phơi nhiễm nghề nghiệp[2, 3, 10].
Tần suất các bệnh phổi kẽ kết hợp với xơ phổi tiến triển: Tỷ lệ PPF dao động từ 0,2-50% tùy theo nguyên nhân bệnh phổi kẽ, trong đó gặp tỷ lệ cao ở nhóm bệnh phổi kẽ do bệnh mô liên kết[10]. Sơ đồ 1: Tần suất các bệnh phổi kẽ kết hợp với xơ phổi tiến triển [10]
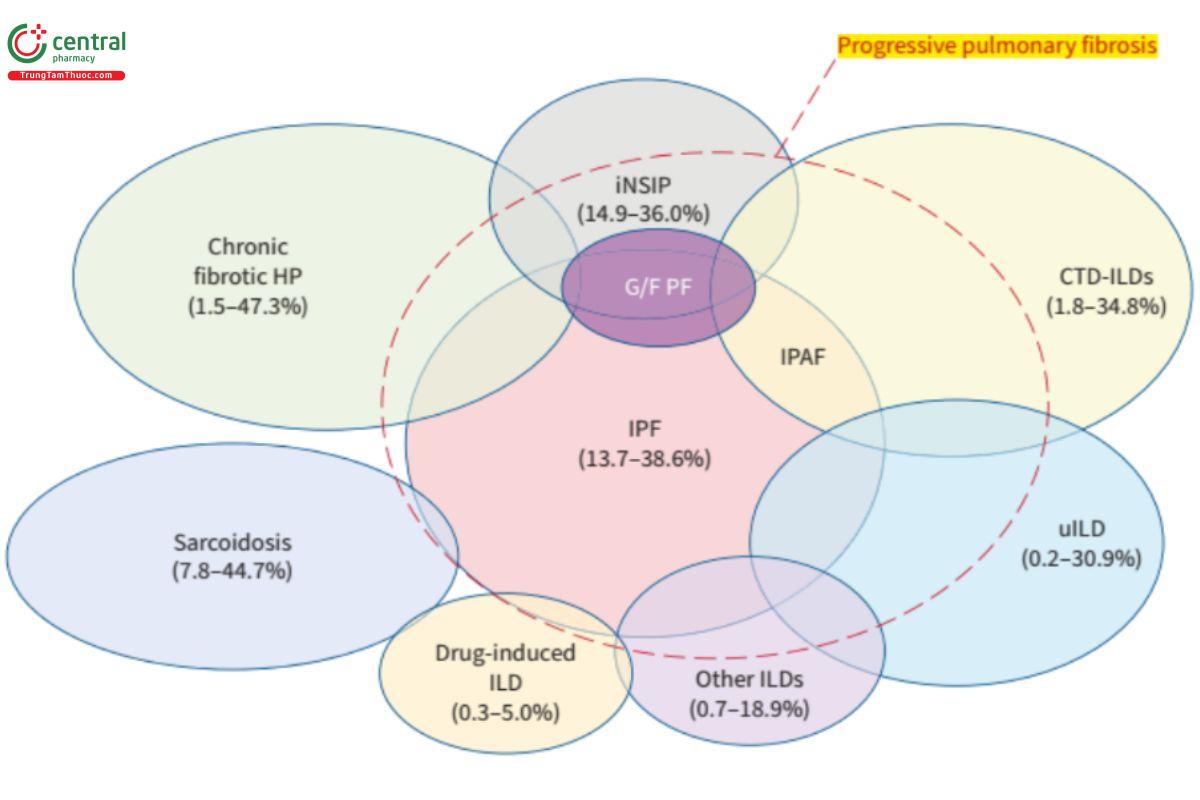 Sơ đồ 1: Tần xuất các bệnh phổi kẽ kết hợp với xơ phô tiến triển [1]
Sơ đồ 1: Tần xuất các bệnh phổi kẽ kết hợp với xơ phô tiến triển [1]
(Chú thích: Bệnh mô liên kết (CTD: connective tissue disease); Xơ phổi di truyền và/hoặc yếu tố gia đình (G/F PF: genetic and/or familial pulmonary fibrosis); Viêm phổi tăng cảm (HP: hypersensitivity pneumonitis); Viêm phổi kẽ vô căn không đặc hiệu (iNSIP: idiopathic non-specific interstitial pneumonia); Viêm phổi kẽ với các dấu hiệu tự miễn (IPAF: interstitial pneumonia with autoimmune features); IPF: Viêm phổi kẽ vô căn (idiopathic pulmonary fibrosis); Bệnh phổi kẽ không phân loại được (uILD: unclassifiable ILD).
6 Chẩn đoán xơ phổi tiến triển
6.1 Tiêu chuẩn về chức năng hô hấp
Bằng chứng về rối loạn chức năng hô hấp của xơ phổi tiến triển khi có sự hiện diện của một trong hai dấu hiệu sau đây, nếu những rối loạn đó đó là do tình trạng xơ hóa ngày càng trầm trọng [3, 6]:
- Giảm tuyệt đối FVC >5% trong vòng 1 năm theo dõi.
- Giảm tuyệt đối của DLCO (đã hiệu chỉnh đối với Hb) >10% trong vòng 1 năm kể từ theo dõi.
FVC là thông số chính trong đánh giá xơ phổi tiến triển và đã được sử dụng trong các thử nghiệm lớn như INBUILD (Efficacy and Safety of Nintedanib in Patients with Progressive Fibrosing Interstitial Lung Disease), RELIEF (Exploring Efficacy and Safety of Oral Pirfenidone for Progressive, Non-IPF Lung Fibrosis) và thử nghiệm trên bệnh nhân ILD không thể phân loại (Unclassifiable ILD - uILD)
Sự thay đổi trong DLCO (đã hiệu chỉnh cho Hb) là phù hợp và yếu tố dự báo mạnh về tỷ lệ tử vong ở nhiều bệnh nhân xơ phổi.
Một số các tiêu chuẩn khác như khoảng cách đi bộ trong 6 phút, đợt cấp tính nặng, tần xuất nhập viện, tăng áp động mạch phổi tiến triển, thay đổi về chất lượng cuộc sống … không được sử dụng bởi các tiêu chuẩn này dao động lớn và phụ thuộc vào bối cảnh lâm sàng của bệnh nhân.
Tiêu chuẩn về tình trạng xấu đi các triệu chứng hô hấp và/hoặc suy giảm DLCO có độ đặc hiệu thấp hơn so với FVC và cắt lớp vi tính (Computed tomography - CT) ngực[1, 6].
6.2 Tiêu chuẩn trên chụp cắt lớp vi tính độ phân giải cao
Xác định trực quan sự tiến triển của xơ phổi (Visual determination of progression of pulmonary fibrosis) trên cắt lớp vi tính độ phân giải cao (High-resolution computed tomography: HRCT): Sự tiến triển của xơ phổi thường được đánh giá bằng trực quan, dựa vào phần trăm thể tích phổi ở vùng trên, giữa và dưới của phổi có phổi. Các phần ngang, bên và dọc trên các lớp HRCT ở thời điểm ban đầu và các lần khám tiếp, sau khi điều chỉnh thay đổi thể tích phổi. Mức độ gia tăng của xơ biểu thị sự tiến triển của bệnh [6, 12, 13].
Các hình ảnh biểu hiện sự tiến triển của bệnh trên HRCT [6]:
- Lan rộng hoặc tăng mức độ giãn phế quản co kéo (Traction bronchiectasis) và giãn tiểu phế quản (Bronchiolectasis)
- Dấu hiệu kính mờ mới với giãn phế quản co kéo
- Lưới mờ mới (New fine reticulation)
- Tăng đậm độ và lan rộng của lưới mờ
- Tăng lên hoặc có thêm hình ảnh tổ ong mới
- Giảm thể tích thùy phổi tăng lên (Increased lobar volume loss)
Trong các ILD ngoài IPF, hình ảnh thể hiện tiến triển có thể thay đổi và bao gồm sự tiến triển của hình ảnh kính mờ thành lưới bất thường, hình ảnh lưới tiến triển đến hình ảnh tổ ong, và/hoặc tăng hình ảnh giãn phế quản co kéo/giãn tiểu phế quản[1, 6].
HRCT được chỉ định theo dõi khi có nghi ngờ lâm sàng về tình trạng xơ hóa nặng lên. Khoảng thời gian tối ưu theo dõi HRCT để xác định tiến triển bệnh đối với bệnh nhân bị xơ cứng bì hệ thống và chức năng phổi ổn định, HRCT ngực cần chụp lặp lại trong vòng 12-24 tháng kể từ thời điểm ban đầu. HRCT hàng năm cũng có thể thực hiện để sàng lọc các biến chứng, đặc biệt là ung thư phổi. Sự hiện diện của hình ảnh phổi tổ ong và giãn phế quản co kéo liên quan đến tiên lượng xấu hơn, mức độ nặng hơn ở ILD liên quan đến viêm khớp dạng thấp, xơ cứng bì hệ thống, viêm phổi tăng cảm, sacoidosis phổi và ILD không thể phân loại[13].
Đặc điểm trên CT của xơ phổi sớm bao gồm các lưới, đường trong tiểu thùy, và biến dạng cấu trúc (mạch phổi và đường thở không đều, quanh co hoặc giải phẫu thùy bị biến dạng), thấy tách rời hoặc chồng lên hình ảnh kính mờ.
Đánh giá định lượng sự tiến triển của xơ phổi: Dựa trên CT định lượng (Computer-based quantitative CT - QCT) có thể cung cấp nhiều thông tin hơn đánh giá trực quan. QCT bao gồm sử dụng các phương pháp như: simple histogram-based techniques, machine learning methods based on texture, local histogram và deep learning-based classification [6].
HRCT hoặc các triệu chứng đơn thuần không nên sử dụng làm tiêu chuẩn “duy nhất” cho đánh giá sự tiến triển của xơ, và nên được sử dụng kết hợp với chức năng phổi[1, 6, 15].
7 Điều trị
Nguyên tắc điều trị xơ phổi tiến triển[3, 6, 13]:
- Điều trị đặc hiệu các bệnh nền là nguyên nhân gây viêm phổi kẽ
- Thuốc kháng xơ
- Phục hồi chức năng hô hấp
7.1 Điều trị thuốc kháng xơ:
Theo nhiều hướng dẫn của các Hội trên thế giới (American Thoracic Society-ATS, European Respiratory Society-ERS, Japanese Respiratory Society-JRS, Asociacion Latinoamericana de Torax-ALAT) điều trị thuốc kháng xơ cần được xem xét và chỉ định sớm trong điều trị PPF [6].
Thuốc kháng xơ có vai trò làm chậm sự tiến triển của bệnh, cải thiện chức năng hô hấp và chất lượng cuộc sống cho bệnh nhân PPF [16, 18].
Cơ chế chung của thuốc kháng xơ là ức chế quá trình tạo xơ thông qua ức chế các yếu tố tăng trưởng mạch máu, xơ, ngăn chặn sự lắng đọng chất gian bào ngoại bào (Hình 1) [16]. 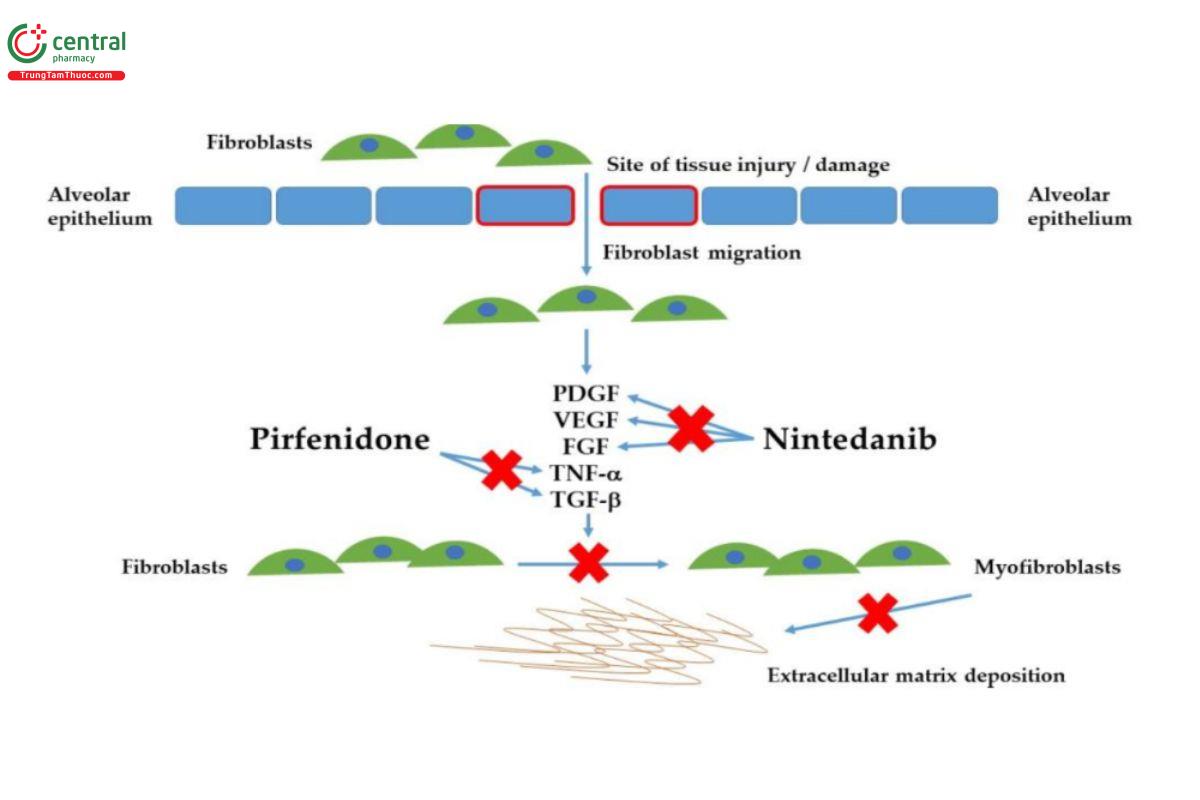
Hình 1: Cơ chế tác dụng của các thuốc kháng xơ
(Chú thích: PDGF: Patelet-derived growth factor; VEGF: Vascular endothelia endothelial growth factor; FGF: Fibroblast growth factor; TNF-α Tumor necrosis factor alpha; TGF-β: Transforming growth factor beta)
Hiện nay có 2 thuốc kháng xơ được chấp nhận điều trị trên lâm sàng: Nintedanib và Pirfenidone [6, 16].
Nintedanib ức chế nhiều đích kinase tyrosine bao gồm: yếu tố tăng trưởng nguồn gốc tiểu cầu (platelet-derived growth growth factor: PDGF), thụ thể yếu tố tăng trưởng nội mạch (Vascular endothelial growth factor receptor - VEGF), thụ thể yếu tố tăng trưởng nguyên bào sợi (Fibroblast growth factor receptor (FGFR), dẫn đến rối loạn con đường tín hiệu cho hoạt hóa và tăng sinh nguyên bào sợi. Hiệu quả của thuốc đã được chứng minh trong các thử nghiệm lâm sàng ngẫu nhiên, đa trung tâm. Trong thử nghiệm (INBUILD) trên 663 bệnh nhân PPF điều trị nintedanib so với nhóm giả dược trong 52 tuần, kết quả cho thấy:
- Giảm tiến triển của bệnh: mức giảm trung bình hàng năm FVC ở nhóm điều trị nintedanib ít hơn đáng kể so với giả dược. Nintedanib làm giảm nguy cơ tiến triển của bệnh phổi kẽ 2,4 lần. Giảm tốc độ suy giảm FVC hàng năm của nhóm dùng nintedanib và giả dược là 128 ml/năm đối với những bệnh nhân có dấu hiệu viêm phổi kẽ thông thường (Usual interstitial pneumonia-UIP), và 75,3 ml/năm ở những bệnh nhân không có dấu hiệu viêm phổi kẽ thông thường trên CT ngực.
Nintedanib cũng làm giảm nguy cơ tiến triển bệnh 2,3 lần ở những bệnh nhân có dấu hiệu viêm phổi kẽ thông thường. Ở những bệnh nhân PPF do bệnh mô liên kết có tốc độ giảm FVC <106,2ml/năm, bệnh nhân có viêm phổi kẽ không đặc hiệu có tốc độ giảm FVC <141,7 ml/năm, bệnh nhân bệnh phổi nghề nghiệp có tốc độ giảm FVC <252,8 ml/năm). Tuy nhiên không có sự
khác biệt đáng kể về tỷ lệ tử vong do mọi nguyên nhân ở tất cả các bệnh nhân PPF được sử dụng nintedanib. Về tác dụng phụ: nintedanib gây tăng tác dụng phụ trên Đường tiêu hóa như đau bụng (4,2 lần), buồn nôn (3,1 lần), nôn (3,6 lần), tiêu chảy (2,8 lần), chán ăn (2,8 lần), sụt cân (3,7 lần), tăng aspartate aminotransferase (3,2 lần), tăng alanine aminotransferase (3,6 lần) so với nhóm giả dược. Không có sự khác biệt về biến cố hô hấp như ho, khó thở, viêm phế quản và viêm mũi họng, đau đầu, biến cố nghiêm trọng hoặc nặng so ở nhóm sử dụng nintedanib so với nhóm giả dược[17, 18].
Trong thử nghiệm SENSCIS, bệnh nhân PPF điều trị bằng nintedanib trong 52 tuần đã làm giảm sự suy giảm FVC trung bình so với nhóm giả dược. Tốc độ giảm FVC hàng năm ở nhóm dùng nintedanib phối hợp mycophenolate thấp hơn so với nhóm chỉ dùng nintedanib (26,3 ml/năm so với 55,4 ml/năm). Ở những bệnh nhân có tổn thương viêm phổi kẽ thông thường trên CT, hiệu quả điều trị thuốc kháng xơ cao hơn. Từ những bằng chứng trong các thủ nghiệm lâm sàng, hiện tại nintedanib được khuyến cáo sử dụng ở bệnh nhân PPF dựa trên hai yếu tố chính: Có sự giảm đáng kể tiến triển của bệnh (được đánh giá dựa trên sự suy giảm FVC hàng năm) và các tác dụng phụ của thuốc có thể hồi phục khi ngừng sử dụng [6, 13].
7.2 Các biện pháp điều trị khác
Phục hồi chức năng hô hấp: nhằm mục đích cải thiện chất lượng cuộc sống và hỗ trợ các hoạt động sinh hoạt hàng ngày. Liệu pháp này nên bắt đầu càng sớm càng tốt, đặc biệt là biện pháp tập thể lực bắt buộc[6].
Ô xy liệu pháp: Điều trị ô xy dài hạn (Long-term oxygen therapy): được chỉ định cho bệnh nhân có tình trạng thiếu oxy máu khi nghỉ ngơi. Bệnh nhân có giảm độ bão hòa ô xy khi tập thể dục nên được cung cấp ô xy lưu động nhằm mục đích tăng khả năng vận động, tập thể dục và cải thiện chất lượng cuộc sống. Thông khí không xâm nhập tại nhà mục đích để kiểm soát triệu chứng khó thở của bệnh nhân (bao gồm cả đợt cấp) và nên duy trì cho đến khi chất lượng cuộc sống được cải thiện.
Ghép phổi cần được xem xét sớm nếu bệnh nhân có chỉ định [1, 13].
8 Kết luận
PPF là một giai đoạn tiến triển của nhiều bệnh phổi kẽ ngoài xơ phổi vô văn. Cần được quan tâm đến chẩn đoán và điều trị PPF sớm. Trong chẩn đoán PPF cần phối hợp các triệu chứng lâm sàng, đặc điểm tổn thương trên HRCT và chức năng phổi. Điều trị kháng xơ là biện pháp can thiệp chính vào bệnh sinh PPF và hiệu quả của thuốc đã được chứng minh trên nhiều nghiên cứu thử nghiệm lâm sàng và được chấp thuận sử dụng trên lâm sàng.
9 Tài liệu tham khảo
1. Rajan SK, Cottin V, Dhar R, et al. Progressive pulmonary fibrosis: an expert group consensus statement. Eur Respir J 2023; 61: 2103187 [DOI: 10.1183/13993003.03187-2021].
2. Strykowski R., Adegunsoye A. Idiopathic Pulmonary Fibrosis and Progressive Pulmonary Fibrosis. Immunol Allergy Clin N Am 43 (2023) 209–228.
3. Molina-Molina M., Castellví I., Valenzuela C., et al. Management of progressive pulmonary fibrosis associated with connective tissue disease, Expert Review of Respiratory Medicine 2022, 16:7, 765-774, DOI: 10.1080/17476348.2022.2107508.
4. Flaherty K.R., Wells A.U., Cottin V., et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. NEJM, September 29, 2019.
5. Hyldgaard C.. Bendstrup E.. Pedersen A.B.. Pedersen L.. Ellingsen T. Interstitial Lung Disease in Connective Tissue Diseases: Survival Patterns in a Population-Based Cohort. J. Clin. Med. 2021, 10, 4830. https:// doi.org/10.3390/jcm10214830.
6. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults. Am J Respir Crit Care Med Vol 205, Iss 9, pp e18–e47, May 1, 2022
7. Barratt SL., Creamer A., Hayton C., et al. Idiopathic Pulmonary Fibrosis (IPF): An Overview. J. Clin. Med. 2018, 7, 201; doi:10.3390/jcm7080201.
8. Hata A., Schiebler ML, Lynch DA., Hatabu H. Interstitial Lung Abnormalities: State of the Art. Radiology 2021; 301:19–34.
9. Pereira CAC, Cordero S., Resende A C. Progressive fibrotic interstitial lung disease. J Bras Pneumol. 2023;49(5): e20230098.
10. Molina-Molina M., Castellví I., Valenzuela C. et al. Management of progressive pulmonary fibrosis associated with connective tissue disease. EXPERT REVIEW OF RESPIRATORY MEDICINE 2022, VOL. 16, NO. 7, 765–774.
11. Strykowski R., Adegunsoye A.. Idiopathic Pulmonary Fibrosis and Progressive Pulmonary Fibrosis. Immunol Allergy Clin N Am 43 (2023) 209–228.
12. Duman D. Progressive pulmonary fibrosis (PPF). Tuberk Toraks 2022;70(4):375-381.
13. Gruden JF., Green DB., Girvin FG., Naidich DP. Current Imaging of Idiopathic Pulmonary Fibrosis. Radiol Clin N Am 60 (2022) 873–888.
14. Liu GY., Budinger S., Dematte JE. Advances in the management of idiopathic pulmonary fibrosis and progressive pulmonary fibrosis. BMJ2022;377:e066354.
15. Lee KS, Han J, Wada N, et al. Imaging of Pulmonary Fibrosis: An Update, From the AJR Special Series on Imaging of Fibrosis. AJR 2023 Apr 12.
16. Boleto G., Avouac J., Allanore Y. The role of antifibrotic therapies in the treatment of systemic sclerosis associated interstitial lung disease. Ther Adv Musculoskel Dis.2022, Vol. 14: 1-14.
17. Yang M., Wu Y., Liu X. et al. Efficacy and safety of antifibrotic agents in the treatment of CTD-ILD and RA-ILD: A systematic review and meta-analysis. Respiratory Medicine 216 (2023): 107329.
18. Shumar JN., Chandel A., King CS. Antifibrotic Therapies and Progressive Fibrosing Interstitial Lung Disease (PF ILD): Building on INBUILD. J. Clin. Med. 2021, 10: 2285.

