Can thiệp van ba lá qua đường ống thông - Lựa chọn thay cho phẫu thuật
Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS. Phạm Mạnh Hùng
Tác giả
TS.BSNT.Nguyễn Minh Hùng
ThS.BSNT.Phạm Tuấn Việt
BSNT.Lê Xuân Hùng
ThS.BSNT.Nguyễn Phương Anh
BSNT.Nguyễn Đinh Hồng Phúc
Bùi Thị Thanh Huyền
PGS.TS.BS.Phạm Mạnh Hùng
Các thủ thuật can thiệp van ba lá qua đường ống thông (TTVIs) vẫn đang được phát triển. Các kỹ thuật đó như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu trong bài viết sau đây.
1 Đại cương
Hở van ba lá cơ năng (FTR) tác động xấu đến tiên lượng của bệnh nhân bệnh van ba lá và gây suy giảm chức năng thất phải tiến triển. Thông thường những bệnh nhân này thường được điều trị bảo tồn cho đến khi bệnh tiến triển nặng dần lên gây khó khăn và tăng nguy cơ khi phẫu thuật. Từ đó, việc can thiệp van ba lá qua đường ống thông với nguy cơ thấp, ít xâm nhập hơn đang dần phát triển như một lựa chọn thay thế cho phẫu thuật.
Tuy nhiên, các yếu tố về giải phẫu, huyết động như kích thước và các góc giải phẫu giữa vòng van ba lá (TA) với các tĩnh mạch chủ, dòng chảy chậm qua van, cấu trúc cơ bè của tim phải và việc không có vôi hóa vòng van làm cho việc xác định đặt van qua đường ống thông trở nên khó khăn, do đó, đến nay chỉ tiến hành được các dạng thủ thuật van trong van (valve-in-valve) hoặc van trong vòng van (valve-in-ring). Các lựa chọn thủ thuật can thiệp van ba lá qua đường ống thông (TTVIs) vẫn đang được phát triển, bao gồm các thủ thuật như sau:
Đặt van sinh học qua đường ống thông tại vị trí 2 tĩnh mạch chủ đổ vào nhĩ phải.
Sửa van ba lá (TV) qua đường ống thông theo quy trình phẫu thuật
Sửa van ba lá qua đường ống thông bằng kĩ thuật bờ-bờ, kẹp lá van với clip (Tricuspid Edge-to-Edge Repair – TEER).
Tạo hình vòng van ba lá qua đường ống thông (VD: Edwards Cardioband™, Edwards Lifesciences, Irvine, CA).
Thay van ba lá qua đường ống thông (Transcatheter tricuspid valve replacement – TTVR).
Giống với các phương pháp can thiệp qua đường ống thông khác, việc lập kế hoạch trước can thiệp và theo dõi trong quá trình can thiệp là rất cần thiết. Tất cả các bệnh nhân đều được đánh giá bằng siêu âm tim qua thành ngực (TTE) và nếu đủ điều kiện là siêu âm tim qua thực quản (TEE); trong một số trường hợp, cắt lớp vi tính là bắt buộc để đánh giá tất cả các cấu trúc giải phẫu cần thiết. Việc kiểm tra này nhằm mục đích điều chỉnh quy trình và lựa chọn phương pháp điều trị tốt nhất cho từng bệnh nhân.
Đánh giá hình ảnh trong can thiệp, đặc biệt là siêu âm tim là cần thiết để theo dõi các bước của quá trình thủ thuật, đánh giá kết quả và phát hiện các biến chứng.
Trong bài viết này, chúng tôi nhấn mạnh đến hai kĩ thuật can thiệp van ba lá: sửa van ba lá qua đường ống thông bằng kĩ thuật bờ-bờ, kẹp lá van với clip (Tricuspid Edge-to-Edge Repair – TEER) và kỹ thuật thay van ba lá qua đường ống thông với kỹ thuật van trong van (valve -in-valve ViV).
2 Giải phẫu và hình thái van ba lá trong can thiệp
2.1 Giải phẫu bộ máy van ba lá bình thường
Van ba lá là van lớn nhất và nằm ở vị trí thấp nhất trong các van; giải phẫu chức năng của van có thể chia ra thành 4 phần: vòng van, lá van, cơ nhú và các dây chằng. Mặt phẳng giải phẫu của vòng van ba lá gần như là theo chiều dọc và xấp xỉ 450 từ mặt phẳng đứng dọc. Vòng van có hình tam giác hoặc hình trứng, trong đó có phần trên có hình yên ngựa (nhìn từ mặt nhĩ), dịch chuyển trong phần trước vách gần đường ra thất phải và van động mạch chủ còn phần dưới (nhìn từ mỏm tim) dịch chuyển trong phần sau vách gần lỗ vào xoang vành và phần trước bên. Không giống van 2 lá, van ba lá không có sự liên tục giữa vòng xơ của van với van bán nguyệt tương ứng. Tuy nhiên giống với van 2 lá, sự di chuyển của vòng van ba lá góp phần vào việc đóng các lá van. Đường kính và diện tích vòng van ba lá bình thường ở người khỏe mạnh tương ứng là 12 ± 1 cm và 11 ± 2 cm2.
Trong suốt quá trình tâm nhĩ thu và cuối tâm thất thu/ đầu tâm trương, có sự gia tăng diện tích vòng van (29, ± 5,5%) cũng như đường kính vòng van. Một điều quan trọng là đường đi của động mạch vành phải nằm trong rãnh vành phải và thường ngập trong môi trường mỡ, nằm cao hơn khoảng 5 đến 8mm so với vòng xơ bên phải của van 3 lá. Tuy nhiên, mối liên quan này có thể thay đổi và nên được hiểu rõ trước khi phẫu thuật hoặc thực hiện các thủ thuật qua đường ống thông.
Có sự thay đổi đáng kể về số lượng lá van 3 lá, với các báo cáo từ 2 đến 6 lá van. Việc gia tăng số lượng liên quan đến việc gia tăng số lượng các mép van: phần lớn trường hợp có 4 lá van với sự xuất hiện lá van thứ 4 nằm giữa lá van trước và sau. Tuy nhiên mô tả thường gặp nhất của van ba lá là có 3 lá van với các lá van có sự thay đổi cả về chu vi vòng van và bán kính. Do vòng van ba lá nằm theo trục dọc, tên theo giải phẫu của các lá van là lá van trước trên, lá van vách và lá van dưới.
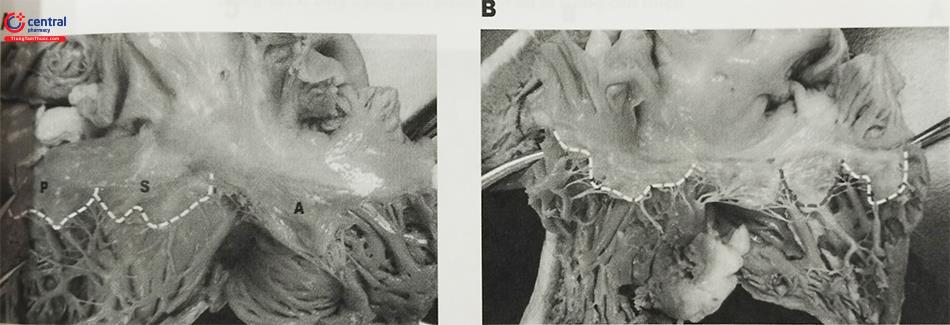
Tuy nhiên, danh pháp thường dùng là lá van trước, lá van sau và lá van vách. Lá van trước là lá van dài nhất với diện tích van lớn nhất và biên độ chuyển động lớn nhất. Lá van vách có bán kính nhỏ nhất và biên độ vận động bé nhất. Lá van vách này gắn với vòng van ba lá ngay trên vách liên thất với các dây chằng gắn trực tiếp với vách liên thất; lá van vách được gắn với phần vách liên thất thấp hơn 10mm về phía mỏm so với vị trí gắn của lá trước van 2 lá vào vách liên thất. Lá van sau (lá van dưới) có nhiều rãnh và có kích thước nhỏ nhất; tuy nhiên lá van này có thể không được tách rõ ràng từ lá van trước gặp ở khoảng 10% bệnh nhân. Các mốc giải phẫu cho mỗi lá van có thể rất thay đổi tùy thuộc vào kích thước và hình dạng của vòng van tuy nhiên mép giữa lá vách và lá sau (trong trường hợp được tách rõ ràng) thường nằm ở gần chỗ đổ của xoang vành vào nhĩ phải. Diện tích van ba lá thường từ 7 đến 9 cm2 và do đó là van lớn nhất trong 4 van của tim. Bởi vì kích thước lớn và áp lực dòng máu thấp giữa thất và nhĩ phải, tốc độ dòng chảy tâm trương tối đa qua van ba lá thường nhỏ hơn 1m/s với áp lực trung bình nhỏ hơn 2mmHg.
Cơ nhú van ba lá cũng có sự biến đổi đáng kể. Cơ nhú của lá van trước thường lớn và là ổn định nhất, xuất phát từ thành trước gần bè cơ tạo thành dải điều hòa. Cơ nhú thường có một nhú và ít gặp hơn là 2 nhú và thường hỗ trợ cho lá van trước nhưng cũng có thể cho mép van giữa lá trước và lá sau. Cơ nhú giữa nhỏ xuất phát từ dải dưới vách và hỗ trợ cho lá van vách và lá van trước. Cơ nhú sau ngược lại thường có 2 nhú, nhưng có thể có tới 4 nhú. Cơ này hỗ trợ cho mép giữa lá van sau và lá van vách. Những dây chằng được gắn trực tiếp với thành thất mà không có cơ nhú vách có thể gặp trong 21% đến 93% trường hợp. Về phương diện khác cơ nhú vách có 1 nhú hay gặp hơn có 2 nhú. Dây chằng gắn cũng khác biệt giữa mỗi lá van: lá van vách có nhiều dây chằng nhất; dây chằng thô góp phần hỗ trợ ban đầu cho lá van trước và dây chằng nền thường gắn với lá van sau.
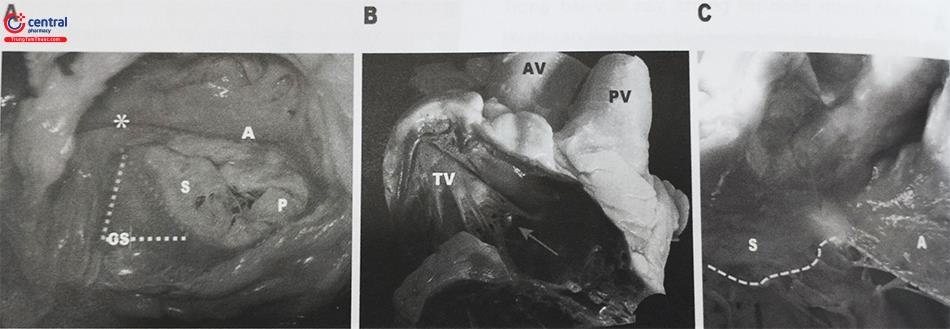
Các giải phẫu quan trọng khác cho việc đánh giá can thiệp bao gồm các lỗ đổ vào của tĩnh mạch chủ và xoang vành. Tĩnh mạch chủ trên (SVC) có vị trí ở phía trên hơn, phía sau tiểu nhĩ phải và tiếp giáp trực tiếp với vách liên nhĩ. Lỗ đổ tĩnh mạch chủ dưới rất lớn, và sừng trước trên của van eustachian (gân của Todaro) tạo thành đường viền sau của tam giác Koch và được sử dụng để giúp xác định vị trí của nút nhĩ thất. Lối vào mạch máu thứ ba đổ vào tâm nhĩ phải là lỗ xoang vành. Lỗ đổ này của xoang mạch vành nằm dọc theo thành trung gian của nhĩ phải, khoảng 2 cm đằng sau thân của đỉnh vách ngăn, phổ biến nhất là tại mép giữa lá van vách và lá van sau. Cùng với gân của Todaro, van The- besius của xoang vành tạo thành đường viền phía dưới.
2.2 Giải phẫu bộ máy van ba lá khi hở ba lá cơ năng
Khi hở ba lá cơ năng (TR) xảy ra, phần vách ngăn của vòng van được hỗ trợ bởi sự gắn của vách ngăn phần cơ, và do đó vòng van chủ yếu giãn ra dọc theo phần bên, phần gắn vào của lá trước và lá sau, làm cho vòng van trở nên tròn và phẳng hơn, và vị trí hở van chủ yếu ở vùng giữa lá trước – lá sau và lá sau – lá vách. Độ rộng của hở van ba lá liên quan đến diện tích vòng van lớn hơn, thể tích nhĩ phải và trái lớn hơn, vòng van tròn hơn và thất phải giãn. Mô hình trên động vật của hở van ba lá đã gợi ý rằng mức độ hở van ba lá lớn hơn có liên quan đến “sự kéo dài” hơn của lá van sau (so với lá van trước hoặc lá van vách) cùng với sự giãn ra hơn của vòng van hoặc giãn thất phải và/hoặc sự dịch chuyển của các cơ nhú, với một chút tác động của việc mất hình dạng yên của vòng van. Tuy nhiên, các nghiên cứu gần đây cũng đã chỉ ra rằng sự khác biệt về giải phẫu có ý nghĩa của thất phải, van và vòng van có thể xảy ra dựa trên nguyên nhân của hở van ba lá cơ năng.
Với TR vô căn luôn thấy hình ảnh giãn có ý nghĩa của thất phải cùng với giãn vòng van trong khi không có hạn chế vận động các lá van, với chiều dài thất phải tương đối bình thường (biến dạng thất phải). Với hở van ba lá cơ năng liên quan với tăng áp động phổi thường xuất hiện sự kéo dài có ý nghĩa của thất phải trong khi giãn nở vùng đáy ít hơn (và tỷ lệ đường kính đáy/đường kính giữa tâm thất phải thấp) nhưng tăng giãn nở vùng giữa thất phải, dẫn đến biến dạng thất phải hình elip/hình cầu.
Bảng 1. Ứng dụng giải phẫu van ba lá trong can thiệp
| Lá van và mép van | Cân nhắc khi can thiệp |
Lỗ van rộng (9 cm2 , với chênh áp trung bình < 2 mmHg) Thường có 3 lá van (lên tới 6 lá van) hoặc nhiều khe sâu và nếp gấp Lá van rất mỏng. Lá van trước lớn, di động mạnh Lá vách ngắn và ít di động | Không phù hợp cho các thiết bị thu nhỏ lỗ van vùng trung tâm (như kẹp lá van hay tăng diện áp) tuy nhiên chênh áp trung bình >2-3 mmHg là nhiều. Khó quan sát rõ lá van khi thăm dò Khó đánh giá giải phẫu lá van Lá van không hỗ trợ cho các thiết bị cần bám, neo vào lá van Lực kéo căng lá van sẽ nhiều khi lá van di động mạnh Rất khó kiểm soát được lá van trong thủ thuật. |
| Dây chằng và cột cơ | Cân nhắc khi can thiệp |
Các cột cơ trước thường lớn, cho các dây chằng hỗ trợ cho lá van trước và sau Dây chằng lá vách đi ra trực tiếp ở vùng vách hoặc từ nhiều cơ nhú. Trung bình có 25 dây chằng với nhiều dạng hình dạng khác nhau bao gồm các bó Collagen thẳng (bởi vậy ít trùng hơn dây chằng van hai lá) | Nhú cơ lá trước được sử dụng như mốc giải phẫu cho việc xác định các lá van này. Hình ảnh “Lều”, phồng lên của lá van hoặc do lực kéo của lá vách nguyên nhân chủ yếu gây hở ba lá nhẹ thứ phát, đặc biệt khi vùng vách di chuyển về phía thất trái. Khi đưa ống thông và thiết bị vào có thể ảnh hưởng đến dây chằng. Lực căng các lá van tăng nhiều do giãn thất phải hoặc di chuyển vị trí các nhú cơ |
| Vòng van ba lá | Cân nhắc khi can thiệp |
Có dạng hình chữ D với phần dẹt nằm phía vách Chuyển động mạnh nhất vào cuối tâm thu, đầu tâm trương và nhĩ thu Chu vi trung bình = 12 ± 1 cm Diện tích trung bình = 11 ± 2 cm2 Không đồng nhất cấu trúc mô cơ và mô mỡ, với vòng xơ không liên tục. | Giãn buồng thất phải xảy ra ở phía thành bên và sau của vòng van, nơi không có tổ chức xơ hỗ trợ làm vòng van tròn và phẳng hơn. Những thay đổi hình dạng động học phải được tính đến để lựa chọn thiết bị phù hợp. Khi có giãn buồng tim phải, các thiết bị lớn có thể phù hợp. Tính ổn định của thiết bị neo, bám vào vòng van có thể thay đổi dọc theo các vị trí này. |
| Các cấu trúc lân cận van ba lá | Cân nhắc khi can thiệp |
Nhĩ phải có thành mỏng, giãn nhiều khi bệnh tiến triển. TMCT (SVC) = chiều dài trung bình ~7 cm, đường kính tối đa ~ 2 cm, có hình dạng không cân xứng TMCD (IVC) = là tĩnh mạch lớn nhất của cơ thể (bình thường < 21 mm). Chỗ đổ vào xoang vành gần mép giữa lá van vách và lá van sau. Không có sự liên tục giữa phần buồng nhận và tống máu. ĐMV phải chạy trong rãnh nhĩ thất (khoảng cách ngang thay đổi tính từ vòng van). | Có khoảng trống rộng để lái thiết bị nhưng khó quan sát về mặt hình ảnh không xâm. Sử dụng đường vào TM cho các thiết bị mới có thể phải cân nhắc đến kích thước TMCT và hình dạng của nó. Góc tạo bởi TMCD và vòng van có thể gây khó khăn cho việc đặt thiết bị. Dòng chảy từ xoang vành có thể là mốc giải phẫu quan trọng để xác định mép các lá van. Ít nguy cơ gây cản trở đường tống máu của thất phải khi đặt thiết bị. |
Chú thích: TM: Tĩnh mạch; ĐMC: Động mạch chủ; TMCT: Tĩnh mạch chủ trên; TMCD: Tĩnh mạch chủ dưới.
Nhiều tác giả cũng đã phát hiện ra mối quan hệ giữa việc tạo lều (tenting) của lá van và mức độ nặng của hở van ba lá với vùng bị căng giãn và mức tải của tim có tương quan với mức độ nghiêm trọng của hở van ba lá và với sự tái phát và tiên lượng sau khi sửa chữa phẫu thuật. Những khác biệt này của giải phẫu vòng van ba lá và thất phải cũng có thể có tác động có ý nghĩa đối với sự thành công của các phương pháp can thiệp qua đường ống thông khác nhau.
3 Các thăm dò hình ảnh trong can thiệp van ba lá
3.1 Siêu âm tim qua thành ngực
Do tính chất phức tạp của hở van ba lá và khó khăn trong việc hình dung cả 3 lá van trong một mặt phẳng 2 chiều (2D), một đánh giá toàn diện về hở van ba lá nên được thực hiện từ nhiều mặt cắt khác nhau trên siêu âm qua thành ngực. Các hướng dẫn gần đây của ASE phác thảo các quan điểm được đề xuất để thực hiện đánh giá toàn diện về thất phải và van 3 lá; tuy nhiên, việc xác định các lá van ba lá từ các mặt cắt tiêu chuẩn vẫn còn gây tranh cãi, một phần vì sự thay đổi của hình ảnh các mặt cắt này thu được do sự thay đổi các góc độ đầu dò khác nhau cũng như các sự thay đổi giải phẫu có ý nghĩa như đã được mô tả ở trên. Hiểu được giải phẫu của van ba lá và các cấu trúc lân cận sẽ giúp làm rõ các hình ảnh trên các mặt phẳng và cho phép xác định chính xác hơn các lá van 3 lá.
Việc có cái nhìn trước về giải phẫu của van ba lá rất quan trọng. Đầu tiên mép giữa lá van trước và lá van vách liền kề với lá không vành của van động mạch chủ; lá vành phải chỉ liền kề với mỗi lá van trước. Thứ hai, mặc dù một phần nhỏ (trước) của lá vách có thể được nhìn thấy nếu động mạch chủ được quan sát trên các mặt cắt, hầu hết lá vách tiếp nối với vách liên nhĩ. Thứ ba, xoang vành đổ vào tâm nhĩ phải tại mép giữa lá van vách và lá van sau. Cuối cùng, tiểu nhĩ phải nằm phía trên hơn so với lá van trước. Bất kỳ hình ảnh mặt cắt 2 buồng nào của thất phải (mặt cắt cạnh ức hoặc mặt cắt 2 buồng từ mỏm) sẽ có xu hướng làm rõ hình ảnh lá van trước và sau cũng như thành trước (cong, tiểu nhĩ phải) và thành sau (phẳng, trên màng ngăn) của thất phải. Mặt khác, mặt cắt 4 buồng sẽ thường xuyên nhìn thấy được hình ảnh lá vách và lá sau, mặc dù hơi nghiêng đầu dò ra trước (có hoặc không có hình ảnh động mạch chủ) sẽ quan sát được lá trước và lá vách còn nghiêng đầu dò ra sau (có hoặc không có xoang mạch vành) sẽ quan sát được lá van vách và lá van sau. Từ các mặt cắt trục ngắn cạnh ức, một góc nghiêng đầu dò ra hẳn phía trước có thể dẫn đến tăng hình ảnh nhìn rõ của lá van trước lớn hoặc lá van trước và lá van sau.
Bảng 2. Các góc quét siêu âm qua thành ngực và các thông số cần cho kĩ thuật sửa van ba lá với hệ thống MitraClip/TriClip
| I. Trục dài cạnh ức | ĐRTT có/không Doppler màu (bao gồm phóng to hình) Van ĐMC có/không ( bao gồm phóng to hình) |
| II. Góc cắt buồng nhận cạnh ức của van ba lá | Van ba lá có/không Doppler liên tục, màu Doppler theo dòng hở ba lá với Doppler xung ở mức vòng van ba lá Doppler xung ngang mức đầu lá van ba lá PISA của dòng hở ba lá |
| III. Góc cắt cạnh ức đường ra của van ĐMP | Van ĐMP có/không có Doppler màu Doppler xung của ĐMP Doppler màu của van ĐMP |
| IV. Trục ngắn cạnh ức | SA 2D thất phải (vùng đáy, giữa và mỏm thất phải) SA 2D van ba lá ( lá van: trước, sau và vách), đỉnh của lá van ba lá. Doppler màu của van ba lá qua lỗ van ba lá. |
| V. Góc cắt trục ngắn cạnh ức vùng đáy (ngang mức ĐMC) | Vùng van ĐMP có/không Doppler màu SA Doppler van ba lá có/không Doppler màu SA Doppler xung của dòng chảy ĐMP ngang mức van ĐMP (cần đồng trục) Doppler xung đồng trục với dòng hở ba lá ngang mức vòng van ba lá Doppler xung ngang mức đỉnh lá van ba lá PISA của dòng hở ba lá |
| VI. Góc cắt 4 buồng từ mỏm | Siêu âm 2D van ba lá có/không Doppler màu Doppler xung của dòng hở ba lá Doppler xung ngang mức vòng van ba lá Doppler ngang mức đỉnh lá van ba lá PISA của dòng hở ba lá Doppler mô của vòng van ba lá Siêu âm 2D nhĩ phải với van ba lá (bao gồm phóng to hình) Thất phải (vùng đáy, vòng van) (bao gồm phóng to hình) |
| VII. Góc cắt dưới sườn ( mũi ức) | Tĩnh mạch chủ dưới Doppler màu của tĩnh mạch chủ dưới và tĩnh mạch gan Doppler xung của tĩnh mạch gan (hướng theo dòng trào ngược) nếu hình ảnh chất lượng tốt Doppler xung đồng trục với dòng hở ba lá Doppler xung ở mức vòng van ba lá Doppler xung ở mức đỉnh lá van ba lá PISA của dòng hở ba lá |
| VIII. SA kiểu M-mode | Thất trái/thất phải ngay dưới đỉnh của lá van hai lá/van ba lá. |
Chú thích: ĐMC: động mạch chủ; ĐMP: động mạch phổi; ĐRTT: đường ra thất trái; PISA: proximal isovelocity surface area; SA: siêu âm.
Bảng 3. Phân loại mức độ hở ba lá mới áp dụng cho can thiệp van ba lá qua đường ống thông với 5 mức độ từ nhẹ, vừa, nặng tới hở ba lá toàn bộ.
| Nhẹ | Trung bình | Nặng | Rất nặng | Hở toàn bộ | |
| Độ rộng dòng hở (mặt cắt 2 buồng) | < 3 mm | 3 – 6,9 mm | 7 -13 mm | 14 – 20 mm | ≥ 21 mm |
| Diện tích lỗ hở hiệu dụng (Phương pháp PISA) | < 20 mm2 | 20 – 39 mm2 | 40 – 59 mm2 | 60 – 79 mm2 | ≥ 80 mm2 |
| Diện tích dòng hở trên siêu âm 3D | 75 – 94 mm2 | 95 – 114 mm2 | ≥ 115 mm2 |
Hình ảnh của tim bên phải có nhiều hình ảnh khác nhau vì hình dạng bất thường của thất phải, sự gián đoạn của van nhĩ thất và đường ra thất phải, và vị trí trong lồng ngực. Hướng dẫn đánh giá các buồng tim của Hội Siêu âm tim Hoa Kỳ (ASE) gần đây khuyến nghị sử dụng 3 mặt cắt 4 buồng từ mỏm để đánh giá thất phải: mặt cắt 4 buồng từ mỏm, mặt cắt 4 buồng tập trung vào thất phải và mặt cắt 4 buồng có điều chỉnh. Mặc dù thất phải thường được đo từ mặt cắt 4 buồng từ mỏm tiêu chuẩn, các khuyến cáo mới cho thấy đo kích thước thất phải từ mặt cắt tập trung vào thất phải vì toàn bộ thành tự do thất phải được quan sát. Các phép đo khác về kích thước và chức năng thất phải được xem xét rộng rãi trong khuyến cáo của ASE. Độ dày thành thất phải được đánh giá từ mặt cắt dưới sườn, cho phép sử dụng Doppler đánh giá dòng trào ngược của hở van 3 lá. Ngoài ra, một đánh giá của áp lực đổ đầy nhĩ phải nên được thực hiện từ việc đánh giá kích thước và sự thay đổi theo nhịp thở của tĩnh mạch chủ dưới (IVC).
3.2 Siêu âm tim qua thực quản (TEE)
Các hướng dẫn hiện tại của Hội Siêu âm tim Hoa Kỳ (ASE) để thực hiện TEE toàn diện bao gồm bổ sung hình ảnh nhiều trong số đó nhằm cải thiện hình ảnh của van 3 lá. Ngoài ra, việc kiểm tra TEE của van ba lá nên bao gồm hình ảnh từ nhiều độ sâu và các mặt cắt khác nhau. Cung cấp thông tin về vị trí của tim liên quan đến thực quản và dạ dày, đoạn giữa thực quản, đoạn xa thực quản, đoạn thực quản đổ vào dạ dày, và hình ảnh đoạn thực quản đổ vào dạ dày có thể đưa đầu dò lại gần van ba lá để có cả hình ảnh siêu âm 2D và 3D. Nhiều hình ảnh mặt cắt có thể tương tự như hình ảnh TTE, và các hình ảnh tương tự là đáng chú ý.
Hình ảnh TEE thường bắt đầu ở đoạn giữa thực quản. Mặt cắt 4 buồng từ đây, cho phép quan sát vách ngăn và thông thường cả lá van trước; hình ảnh hai buồng đồng thời có thể giúp nhìn rõ thêm các lá van từ đó cho thấy sự thay đổi về số lượng và kích thước tương đối của mỗi lá van. Xoay từ mặt cắt 4 buồng (góc xem ở 0o) đến góc 90o để quan sát lá van trước (liền kề với van động mạch chủ) và lá van sau phía đối diện. Bởi vì viền phía dưới của tim phải ở gần với cơ hoành, từ từ đưa đầu dò TEE đến thực quản đoạn xa gần với ngã ba dạ dày thực quản; từ vị trí này có thể không quan sát được tâm nhĩ trái, chỉ có tâm nhĩ phải và xoang vành. Tại vị trí này, mặt cắt quan sát van ba lá không bị cản trở bởi các cấu trúc tim trái, đó là lý tưởng để thực hiện một đánh giá toàn diện về chức năng van ba lá và có được hình ảnh 3D rõ nét đi qua van 3 lá.
Bảng 4. Các góc quét siêu âm qua thực quản và các thông số cần cho kĩ thuật sửa van ba lá với hệ thống MitraClip/ TriClip
| I. Thực hiện nhiều góc quét đồng thời | Góc cắt qua 2 tĩnh mạch chủ có cải tiến quan sát van ba lá có/không Doppler màu. Góc quét buồng nhận và buồng tống máu có/không Doppler màu . Góc siêu âm 4 buồng từ mỏm có/không Doppler màu. |
| II. Góc quét giữa thực quản cải tiến qua 2 tĩnh mạch chủ (góc cắt qua mép van ba lá ) | SA Doppler xung, liên tục của dòng hở ba lá Đánh giá dòng qua van ba lá (mức vòng van) Đỉnh van ba lá |
| III. Góc cắt giữa thực quản dòng vào-dòng ra | Doppler xung, liên tục của dòng hở ba lá Dòng vào qua van ba lá (mức vòng van) đỉnh van ba lá Hình ảnh siêu âm 3D của thất phải |
| IV. Góc cắt 4 buồng (sâu trong thực quản) | Doppler xung, liên tục của dòng hở ba lá Dòng vào qua van ba lá (mức vòng van), đỉnh van ba lá Hình ảnh siêu âm 3D của thất phải |
| V. SA dựng hình 3D van ba lá (khuyến cáo) | SA van ba lá từ vị trí giữa thực quản ở góc cắt 0o, 30o, và 60o, và sâu trong dạ dày 0o và 90o và có/không Doppler màu. |
| VI. Góc cắt 5 buồng giữa thực quản | Qua van ba lá có/không Doppler màu |
| VII. Góc cắt 4 buồng giữa thực quản | Qua van ba lá có/không Doppler màu |
| VIII. Góc cắt giữa thực quản buồng nhận- tống máu | ĐRTP SA 2D van ĐMP có/không Doppler màu |
| IX. Góc cắt trục dọc giữa thực quản qua van ĐMC | ĐRTP SA 2D van ĐMP có/không Doppler màu |
| X. Góc cắt trục ngắn giữa thực quản | ĐRTP SA 2D van ĐMP có/không Doppler màu |
| XI. Góc cắt trục ngắn vùng đáy qua dạ dày | Qua van ba lá có/không Doppler màu Qua van ba lá có/không Doppler màu Qua van ba lá có/không Doppler màu Doppler xung ở ĐRTP Các góc cắt của thất phải |
| XII. Góc cắt vùng đáy thất phải qua dạ dày | |
| XIII. Góc cắt qua dạ dày buồng nhận và tống máu thất phải | |
| XIV. Góc cắt sâu trong dạ dày | |
| XV. Các góc cắt buồng thất |
Chú thích: 3D: siêu âm 3 chiều; ME: giữa thực quản; ĐRTP: đường ra thất phải.
Tại vị trí 0o từ mặt cắt này, lá van sau, nằm trên cơ hoành, thường được nhìn thấy đặc biệt nếu xoang vành quan sát được. Lá van trước ở đối diện có thể được xác định liền kề với tiểu nhĩ phải. Đẩy đầu dò TEE vào dạ dày cho hình ảnh mặt cắt qua dạ dày. Vị trí 0o tư thế gấp trước và xoay phải để một lần nữa đánh giá lá van trước (gần động mạch chủ) và lá van sau (gần cơ hoành). Xoay đầu dò từ 60o đến 90o dẫn đến chế độ xem 2D duy nhất quan sát được đồng thời của tất cả 3 lá van với lá van sau ở gần, lá van trước ở xa, và lá van vách ở liền kề với vách ngăn. Đẩy đầu dò TEE xa hơn vào dạ dày cùng với uốn cong ra trước sang phải tạo ra mặt cắt nằm sâu trong dạ dày của van ba lá, cũng cho phép quan sát dòng màu tối ưu và đánh giá Doppler dòng chảy qua van 3 lá.
Điều quan trọng ở mỗi vị trí là xoay qua nhiều mặt cắt để hiểu rõ ràng hơn về van ba lá và sử dụng nhiều mặt cắt đồng thời để xác định các lá van và các cấu trúc lân cận. Tuy nhiên, do sự thay đổi của các hình ảnh trên các mặt cắt cũng như giải phẫu khác biệt, có thể sử dụng siêu âm 3D để xác định các lá van.
3.3 Siêu âm tim 3 chiều (3D)
Siêu âm tim ba chiều được tái tạo dựa trên nhiều mặt cắt qua siêu âm tim 2D. Lang và các đồng nghiệp đã mô tả một hình ảnh siêu âm 3D tiêu chuẩn cho việc đánh giá van ba lá với vách liên nhĩ đặt ở phía dưới hơn (vị trí 6 giờ) bất kể hướng nhĩ hoặc thất. Quan sát van 3 lá từ phía mặt thất, lá van trước khi đó ở bên phải còn lá van sau nằm ở bên trái. Nhìn từ phía mặt nhĩ, lá van trước khi đó sẽ ở bên trái và lá van sau ở bên phải. Do vị trí nằm ở phía trước của bên tim phải, hình ảnh TTE 3D có thể bằng hoặc đôi khi chất lượng tốt hơn so với hình ảnh TEE 3D. Các hệ thống 3D hiện tại có độ phân giải khác nhau cho mỗi hệ thống 3 chiều, với độ phân giải trục (0,5 mm) tốt hơn so với bên (2,5 mm) và độ phân giải độ cao (3,0 mm). Tương tự như hình ảnh 2D, tuy nhiên, hình ảnh ở trường phía xa có thể bị mở rộng và bị suy giảm chùm tia. Khi tạo hình ảnh 3D, hãy ghi nhớ những hạn chế về thiết bị hiện tại để nhận ra rằng hình ảnh tối ưu của hở van ba lá có thể yêu cầu một mặt cắt nằm giữa các mặt cắt tiêu chuẩn. Thu được nhiều giá trị tải khác nhau từ các mặt cắt khác nhau có thể cần thiết để xác định đầy đủ tính chất của van và vòng van. Cuối cùng, do tính chất phức tạp của van, thông tin thu được có thể cần phải có các cấu trúc liền kề để giúp xác định giải phẫu lá van, van động mạch chủ/động mạch chủ để xác định lá van trước và vách liên nhĩ/ van hai lá để xác định lá van vách.
3.4 Giải phẫu trên phim chụp mạch van 3 lá
Chụp động mạch và soi trên màn huỳnh quang tăng sáng có vai trò bổ sung trong việc hướng dẫn các bước can thiệp.
Hình ảnh giải phẫu trên phim chụp mạch và soi trên màn tăng sáng của bệnh lý van tim bên trái dễ đánh giá hơn, nhưng ngược lại, khó khăn hơn đối với các van tim bên phải. Nội soi huỳnh quang rất hữu ích trong việc hướng dẫn đưa thiết bị vào các buồng tim bên phải, chỉnh hướng và điều hướng dụng cụ về phía vị trí mục tiêu. Có 2 góc chiếu vuông góc nhau trên phim huỳnh quang: vị trí nhìn thẳng van ba lá, thường là góc chiếu chếch trái trước – chếch chân là góc cắt hữu ích để điều hướng ống thông đến vị trí mục tiêu (tương tự như siêu âm 3D nhìn từ mặt thất), và góc chiếu vuông góc với mặt phẳng vòng van, thường là góc chếch trước phải – nghiêng đầu giúp lái ống thông và các thiết bị, để điều chỉnh quỹ đạo và tìm mối liên quan giữa thất phải và vòng van ba lá (tương tự mặt cắt 2 buồng thất phải).
Ngoài ra, chụp động mạch vành là nền tảng cho các thủ thuật can thiệp vòng van, để tránh các tổn thương mạch vành tiềm ẩn do mối quan hệ chặt chẽ giữa vòng van và động mạch vành phải (RCA), đặc biệt là ở các phần vách và phần sau. Một mẹo tốt là đặt một dây dẫn trong RCA để có một điểm đánh dấu trong quá trình can thiệp.
3.5 Chụp cắt lớp vi tính (CT)
Chụp cắt lớp vi tính có một vai trò quan trọng trong việc chuẩn bị kế hoạch cho can thiệp van ba lá (TTVI). Các hình ảnh thu được qua chụp CT phải bao gồm tim và các tĩnh mạch chủ trên, tĩnh mạch chủ dưới. Hình ảnh CT làm nổi bật các cấu trúc mục tiêu và cũng cung cấp một bản đồ mạch máu, với thông tin bổ sung cho siêu âm tim và nội soi huỳnh quang, đặc biệt là đối với sửa chữa vòng van qua đường ống thông.
Chụp CT cung cấp thông tin về cấu trúc vòng van và mức độ giãn, chất lượng và số lượng mô của vòng van, và mối quan hệ của nó với động mạch vành phải (RCA) ở các khu vực khác nhau. Một khía cạnh quan trọng khác là kích thước chính xác của tĩnh mạch chủ dưới và góc đổ của nó vào tâm nhĩ phải.
4 Chỉ định và chống chỉ định
Theo các nghiên cứu lớn đã tiến hành trên thế giới, một số các thiết bị can thiệp van ba lá qua đường ống thông đã được cấp chứng nhận CE của châu Âu. Hội Tim mạch châu Âu 2021 đã cho chỉ định điều trị can thiệp van ba lá qua đường ống thông ở những bệnh nhân có hở ba lá nặng, không phẫu thuật được cần can thiệp sớm bệnh lý van ba lá với khuyến cáo IIB mức bằng chứng C.
4.1 Chỉ định và chống chỉ định sửa van ba lá kiểu kẹp hai bơ van hay kiểu bờ – bờ
4.1.1 Chỉ định
Chỉ định chung: (1) Bệnh nhân hở ba lá có triệu chứng suy tim sung huyết; (2) Bệnh nhân có nguy cơ cao khi phẫu thuật và (3) Hở ba lá mức độ nặng. Thêm vào đó, các chỉ định về mặt giải phẫu:
- Hở ba lá thứ phát (do bệnh tim bên trái, rung nhĩ, phẫu thuật can thiệp van hai lá trước đây, có cấy máy tạo nhịp tim hoặc cấy máy phá rung tim tự động…) với cấu trúc lá van bình thường hoặc hở ba lá tiên phát có sa lá van không nặng (với độ rộng dòng hở < 10-12 mm và sa lá van qua vòng van < 10 mm).
- Khoảng cách phần diện áp giữa 2 lá van không quá lớn và cử động lá van bình thường hoặc giảm nhẹ.
- Dòng hở ba lá trung tâm.
- Nếu có máy tạo nhịp tim hoặc máy phá rung tự động không gây ảnh hưởng đáng kể tới van ba lá và dụng cụ để kẹp lá van.
4.1.2 Chống chỉ định
- Van ba lá có tổn thương nặng do thấp tim, lá van dày nhiều, co rút nhiều, mất cấu trúc hoặc sa van nặng.
- Khoảng trống giữa hai diện áp lá van lớn ( > 8,5 mm).
- Dòng hở không phải trung tâm, rất lệch tâm hoặc đi ra từ giữa lá trước-sau.
- Không thể quan sát các lá van trên siêu âm
- Hở ba lá do cơ chế liên quan đến máy tạo nhịp tim hoặc máy phá rung tự động.
- Chức năng thất phải giảm nặng hoặc giãn thất phải nặng.
- Áp lực tâm thu động mạch phổi > 60-65 mmHg (ước tính trên siêu âm) và/hoặc sức cản mạch phổi 4 đơn vị
Không dung nạp liệu pháp chống đông trong thủ thuật và các thuốc kháng tiểu cầu sau thủ thuật, viêm nội tâm mạc, bệnh van ba lá do thấp và huyết khối.
4.2 Chỉ định và chống chỉ định thay van ba lá qua đường ống thông kiểu van trong van (ViV)
4.2.1 Chỉ định
Hở van ba lá sinh học nhiều, hoặc phối hợp cả hở và hẹp van ba lá sinh học (chênh áp trung bình qua van ba lá > 10 mmHg).
4.2.2 Chống chỉ định
Không dung nạp liệu pháp chống đông trong thủ thuật và các thuốc kháng tiểu cầu sau thủ thuật, viêm nội tâm mạc nhiễm khuẩn, huyết khối tại van.
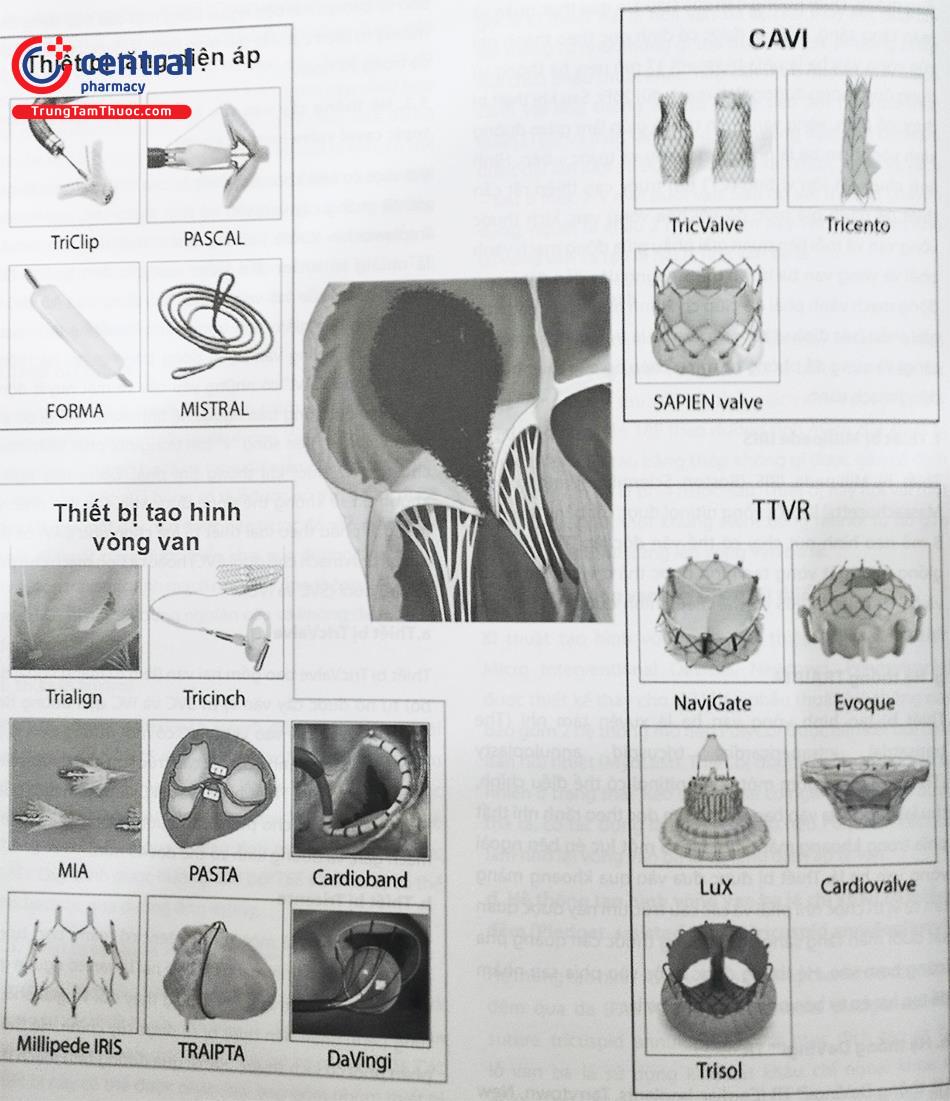
5 Giới thiệu về một số loại dụng cụ can thiệp van ba lá
5.1 Các thiết bị tăng diện áp van
Tác dụng chính của các thiết bị tăng diện áp van là để giảm mức độ hở ba lá bằng cách tăng số lượng lá van (kĩ thuật bờ-bờ), giảm mức độ hở khi các lá van áp sát nhau. Có một vài thiết bị đã sử dụng như thiết bị MitraClip/TriClip (Abbott, Santa Clara, CA, USA), hệ thống PASCAL (Edwards Lifesciences, Irvine, CA, USA), thiết bị FORMA (Edwards Lifesciences, Irvine, CA, USA), và hệ thống Mistral (Mitralix Lt, Israel).
Thiết bị TriClip và PASCAL là các thiết bị được sử dụng trước đó cho van hai lá và các thiết bị sử dụng kĩ thuật bờ-bờ là được sử dụng rộng rãi trong can thiệp van ba lá.
5.1.1 Thiết bị MitraClip/TriClip
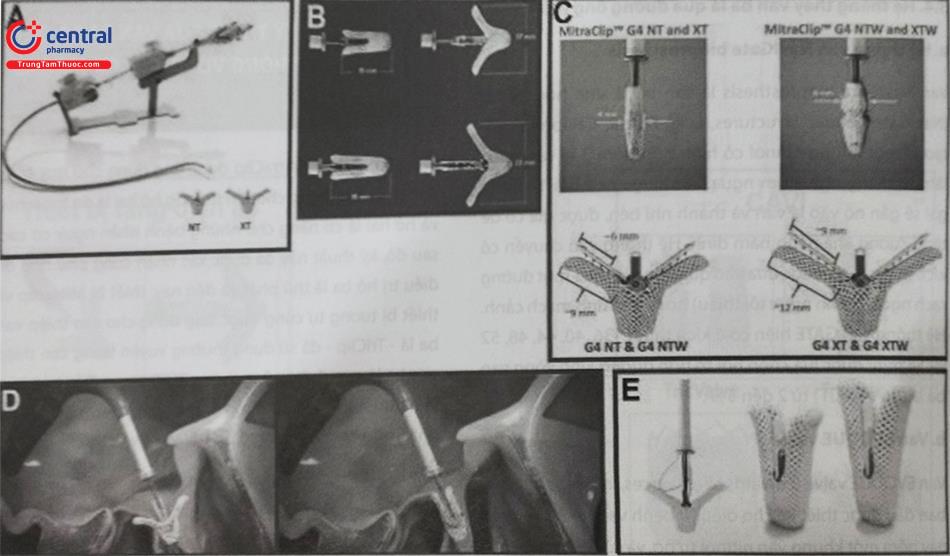
Hệ thống MitraClip bao gồm 2 phần, hệ thống ống thông dẫn hướng có thể lái được (SGC) và hệ thống vận chuyển thiết bị kẹp lá van “clip” (CDS). Clip làm từ hợp kim cobalt-chrome gồm hai “cánh tay” có khớp nối giúp để kẹp các lá van lại với nhau, kích thước bề rộng của “clip” là 4 mm (NT) và 7 mm (XTR). Thế hệ mới nhất gần đây của MitraClip/TriClip G4 (NT, XT, NTW và XTW) sẽ thay thế cho các thiết bị trước đây. Hệ thống TriClip The TriClip được thiết kế đặc biệt để can thiệp van ba lá với các tính năng tương tự.
5.1.2 Hệ thống PASCAL
Hệ thống sửa van hai lá qua đường ống thông Edwards PASCAL (Edwards Lifesciences, Irvine, CA) cũng được áp dụng cho sửa van ba lá kiểu bờ-bờ. Hệ thống này cũng bao gồm miếng đệm nitinol 10 mm vùng trung tâm có tác dụng như một chất độn vào chỗ hở van và sẽ được gắn vào lá van nhờ hai thanh kẹp có móc cài. Dụng cụ có ưu điểm với kích thước dụng cụ lớn hơn, cánh kẹp rộng hơn với miếng đệm trung tâm ở phía trong để giảm mức độ hở van ba lá bằng cách tăng tối đa diện áp của lá van, có thể kẹp lần lượt từng lá van và có thể điều chỉnh ở phía dưới lá van dễ dàng hơn. Tiến trình kĩ thuật cũng sử dụng đường vào tĩnh mạch đùi và kích thước hệ thống vận chuyển là 22Fr. Cũng như trong quy trinh sử dụng thiết bị TriClip, TEE đóng vai trò trung tâm trong việc lập kế hoạch và triển khai hướng dẫn quy trình.
5.1.3 Thiết bị FORMA
Thiết bị FORMA được thiết kế làm giảm mức độ hở ba lá bằng cách sử dụng thiết bị đặt trong lỗ van ba lá nhờ đó làm giảm dòng hở ba lá và tăng diện áp của lá van. Thiết bị bao gồm một quả bóng có thể được nở thụ động, được đưa tới qua một dây dẫn được neo trước đó vào mỏm thất phải. Kĩ thuật cũng được triển khai qua đường tĩnh mạch dưới đòn trái hoặc tĩnh mạch nách với ống thông 24Fr. Đến nay, thiết bị này đã dừng nghiên cứu và không đưa vào áp dụng trên thực tế.
5.1.4 Thiết bị Mistral
Thiết bị Mistral (Mitralix Lt, Israel) gồm một dây nitinol với đường kính 0,475 mm, có dạng xoắn ốc, giúp cho làm khoảng trống diện áp giữa các lá van bằng cách kéo các dây chằng giống như bó một bó hoa. Thiết bị sử dụng hệ thống vận chuyển qua đường tĩnh mạch đùi kích thước 8,5Fr. Quy trình được hướng dẫn bởi TEE và thiết bị có thể thu lại được qua đường ống thông.
5.2 Thiết bị tạo hình vòng van ba lá
Tác dụng của hầu hết các thiết bị này là mô phỏng và tương tự các thiết bị sửa van bằng kĩ thuật phẫu thuật qua điều trị cơ chế bệnh sinh chính của hở ba lá thứ phát. Các thiết bị này có thể được phân loại bao gồm nhóm thiết bị khâu vòng van trực tiếp (Trialign, TriCinch, tạo hình vòng van tối thiểu, tạo hình vòng van ba lá có hỗ trợ và tạo hình vòng van dạng vòng (Cardioband, Millipede IRIS, tạo hình vòng van ba lá xuyên tâm nhĩ).
5.2.1 Trialign
Thiết bị Trialign, khâu trực tiếp vòng van (Mitralign, Tewksbury, Massachusetts) tương tự kĩ thuật phẫu thuật Kay cải tiến với can thiệp vòng van dọc theo phần cơ liền kề lá sau van ba lá. Kĩ thuật Kay trong phẫu thuật, còn được gọi là kĩ thuật hai lá hóa van ba lá, cho thấy kết quả lâu dài tương tự như những gì thu được với các phương pháp sửa chữa phẫu thuật khác. Tiếp cận theo đường tĩnh mạch cảnh với ống thông 8Fr. Sử dụng siêu âm tim qua thực quản (TEE) và màn tăng sáng, hai miếng đệm của chỉ khâu được đặt lần lượt và buộc vào mép van trước – sau và vách – sau ở mức 2-5 mm dưới van. Sau đó với thiết bị chuyên dụng, người ta khâu 2 miếng đệm này với nhau, làm nhỏ lại vòng van và tạo ra hai lá hóa van ba lá.
5.2.2 Thiết bị TriCinch
Hệ thống TriCinch (4Tech Cardio, Galway, Ireland) nhằm làm giảm đường kính vòng van ba lá bằng cách kéo các mép van trước – sau về phía tĩnh mạch chủ dưới (IVC). Với hệ thống ống dẫn 18F theo đường tĩnh mạch đùi, thiết bị “corkscrew” cấu tạo bằng thép không gỉ được gắn cố định vào vòng van ba lá phía trước-sau. Thiết bị này nối với một vòng Dacron tới một khung stent bằng nitinol tự nở gắn tại IVC, duy trì sức căng lên vòng van ba lá.
5.2.3 Tạo hình vòng van can thiệp tối thiểu
Kĩ thuật tạo hình vòng van can thiệp tối thiểu (MIA™, Micro Interventional Devices, Newtown, Pennsylvania) được thiết kế thay cho chỉ khâu phẫu thuật. Hệ thống này bao gồm 2 hệ thống mỏ neo PolyCor được liên kết bởi chất đàn hồi nhiệt (MyoLast). Thiết bị được cấy lên vòng van tự nhiên ở trạng thái “kéo dãn” và sẽ co ngắn lại sau khi được thả ra, có tác dụng làm kéo hai mỏ neo PolyCor , kết quả làm nhỏ lại vòng van ba lá và tăng diện áp lá van.
5.2.4 Hệ thống tạo hình vòng van ba lá chỉ khâu có miếng đệm (Pledget-assisted suture tricuspid annuloplasty)
Hệ thống tạo hình vòng van ba lá bằng cách khâu có miếng đệm qua da (PASTA: the percutaneous pledget-assisted suture tricuspid annuloplasty) với mục đích tạo ra hai lỗ van ba lá sử dụng kĩ thuật khâu chỉ ngoại khoa có miếng đệm. Hai mũi chỉ khâu được đặt ở vòng van phía trước- giữa và vách-sau, sau đó chúng được buộc lại với nhau, tạo thành mặt nối hai đầu van lại với nhau. Kĩ thuật được tiến hành qua đường tĩnh mạch đùi phải hoặc tĩnh mạch cảnh trong.
5.2.5 Cardioband
Hệ thống sửa van ba lá Cardioband (Edwards Lifesciences, Irvine, CA, USA) với vòng van Dacron tương tự như phẫu thuật có các mỏ neo bằng thép không gỉ neo quanh vòng van đã được ứng dụng trong điều trị hở hai lá qua đường ống thông. Dưới hướng dẫn của siêu âm qua thực quản và màn tăng sáng, thiết bị được cố định dọc theo thành nhĩ của vòng van ba lá phía trước với 17 mỏ neo, hệ thống sử dụng ống thông đường tĩnh mạch đùi 26Fr. Sau khi thiết bị được cố định, vòng van nhân tạo sẽ giúp làm giảm đường kính vòng van ba lá phía trước – sau và trước – bên. Hình ảnh chụp cắt lớp vi tính (CT) tim trước can thiệp rất cần thiết để đánh giá mức độ vôi hóa vòng van, kích thước vòng van và mối liên quan giải phẫu giữa động mạch vành phải và vòng van ba lá. Có thể sử dụng dây dẫn đặt trong động mạch vành phải để giúp cho định hướng các cấu trúc giải phẫu (xác định vị trí vòng van ba lá trên màn hình tăng sáng) và cũng để phòng nguy cơ chèn ép của thiết bị vào động mạch vành.
5.2.6 Thiết bị Millipede IRIS
Thiết bị Millipede IRIS (Boston Scientific, Marlborough, Massachusetts) là một vòng nitinol được cắt bằng laser với 8 mỏ neo hình nút chai có thể vặn độc lập. Thiết bị này giống như một vòng tạo hình được thả ở vị trí van hai lá và ba lá. Thiết bị IRIS có thể điều chỉnh được vị trí và thu lại nếu cần.
5.2.7 Hệ thống TRAIPTA
Thiết bị tạo hình vòng van ba lá xuyên tâm nhĩ (The transatrial intrapericardial tricuspid annuloplasty (TRAIPTA) ) bao gồm một vòng nitinol có thể điều chỉnh, thu lại được đưa vào bao quanh tim dọc theo rãnh nhĩ thất phía trong khoang màng tim tạo ra một lực ép bên ngoài vòng van ba lá. Thiết bị được đưa vào qua khoang màng tim từ vị trí chọc nhĩ phải và các cấu trúc tim này được quan sát dưới màn tăng sáng với sử dụng thuốc cản quang pha loãng bơm vào. Hệ thống được buộc vào phía sau nhằm để tạo lực ép từ bên ngoài vào van ba lá.
5.2.8 Hệ thống DaVingi™ TR
Hệ thống DaVingi™ TR (Cardiac Implants, Tarrytown, New York) giúp làm giảm kích thước vòng van, giảm mức độ hở van ba lá, bằng cách cấy một vòng van có thể điều chỉnh vào thành bên tâm nhĩ. Một khung với nhiều cánh tay được đưa qua tĩnh mạch cảnh trong và được mở rộng
hoàn toàn sau khi bơm bóng. Tiếp theo, tất cả các mỏ neo bao quanh vòng van này và đồng thời được mở ra và nhờ vậy vòng van được gắn cố định vào thành nhĩ của vòng van ba lá. Tiếp theo, hệ thống được rút ra ngoại trừ để lại một dây mảnh gắn vào vòng van. Các dây buộc này được bảo vệ bao quanh bên ngoài bằng một cấu trúc dạng ống (tương tự điện cực dây tạo nhịp tim) và được cố định dưới da trong 90 ngày.
5.3 Hệ thống cấy van vào hệ tĩnh mạch chủ (Hetero- topic caval valve implantation)
Với một cơ chế khác các thiết bị can thiệp van ba lá qua da, hệ thống cấy van vào hệ tĩnh mạch chủ (caval valve implantation (CAVI) ) không nhằm trực tiếp vào van ba lá nhưng lại nhằm đến kiểm soát các ảnh hưởng đến huyết động của hở van ba lá. Tác dụng của hệ thống này nhằm làm giảm tình trạng sung huyết hệ tĩnh mạch chủ bởi hệ thống van ngăn dòng trào ngược. Hệ thống “heterotopic CAVI” có những yêu cầu về mặt huyết động và giải phẫu. Dòng trào ngược hệ tĩnh mạch chủ được xác định khi xuất hiện sóng ”v” lớn trong nhĩ phải, tĩnh mạch chủ trên và dưới khi thông tim phải. Dòng trào ngược không đủ sẽ không thể đóng được van. Các cân nhắc về mặt giải phẫu theo loại thiết bị lựa chọn như CAVI có thể đặt tại tĩnh mạch chủ dưới (IVC) hoặc cả tĩnh mạch chủ trên và chủ dưới (SVC và IVC).
5.3.1 Thiết bị TricValve
Thiết bị TricValve bao gồm hai van (làm từ màng ngoài tim bò) tự nở được cấy vào vị trí SVC và IVC qua đường tĩnh mạch đùi. Van cấy vào vị trí SVC có một đường kính là 30 mm được bao quanh bởi một cấu trúc làm cho đường kính có thể đạt 45 mm Thiết bị đặt vào IVC được gắn một phần nhô vào nhĩ phải cho phép dẫn hướng dòng chảy từ tĩnh mạch gan, và đường kính có thể đạt 43 mm.
5.3.2 Thiết bị Tricento
Thiết bị Tricento là một khung stent có màng bọc, tự nở, có móc gắn vào tĩnh mạch chủ, có hai lá van có nguồn gốc từ màng ngoài tim của lợn. Do sự thay đổi về giải phẫu ở từng bệnh nhân nên thiết bị sẽ được tùy chỉnh. Hệ thống phân phối có kích thước 24F đi qua đường tĩnh mạch đùi.
5.3.3 Valve Sapien
Valve SAPIEN 3 kích thước 29 mm được sử dụng hạn chế cho vị trí tĩnh mạch chủ dưới (IVC). Tuy nhiên, vị trí tĩnh mạch chủ trên (SVC) phù hợp hơn do SVC thường dài. Kĩ thuật CAVI với sử dụng van SAPIEN 3 yêu cầu kích thước tĩnh mạch chủ trên ≤ 30 mm, được đo tại vị trí đổ vào của SVC vào nhĩ phải.
Chú thích: TTVR: thay van ba lá qua đường ống thông; CAVI: cấy van nhân tạo vào vị trí tĩnh mạch chủ.
5.4 Hệ thống thay van ba lá qua đường ống thông
5.4.1 Hệ thống van NaviGate bioprosthesis
Van NaviGate bioprosthesis là van ba lá sinh học, tự nở (NaviGate Cardiac Structures, Lake Forest, California) cấu tạo là một khung nitinol có hình nón gồm 3 lá van được làm từ màng ngoài tim ngựa. Van được neo bởi 12 chiếc gai sẽ gắn nó vào lá van và thành nhĩ bên, được gia cố để tăng cường khả năng bám dính. Hệ thống vận chuyển có kích thước 42 Fr được đưa vào qua tâm nhĩ (qua một đường rạch ngoài thành ngực tối thiểu) hoặc qua tĩnh mạch cảnh. Hệ thống van GATE hiện có 6 kích thước (36, 40, 44, 48, 52 và 54 mm) được lựa chọn hơi to hơn đường kính vòng van ba lá (đo trên CT) từ 2 đến 5% .
5.4.2 Van EVOQUE valve
Van EVOQUE valve (Edwards Lifesciences, Irvine, California) ban đầu được thiết kế cho điều trị bệnh van hai lá. Thiết bị này gồm một khung van nitinol tự nở, và có phủ thêm một lớp bên ngoài để giảm thiểu nguy cơ rò quanh van. Có hai dạng kích thước (44 và 48 mm) được sản xuất gần đây. Van này cần hệ thống vận chuyển qua đường tĩnh mạch đùi với kích thước 28 Fr.
5.4.3 Van LuX-Valve
Van LuX-Valve (Ningbo Jenscare Biotechnology Co., Ningbo, China) có cấu trúc van ba lá tự nở được gắn trên một cấu trúc đĩa. Hệ thống này được vận chuyển xuyên qua tâm nhĩ với hệ thống kích thước 32F.
5.4.4 Van Cardiovalve
Van Cardiovalve (Edwards Lifesciences, Irvine, CA, USA) được thiết kế cho thay van hai lá qua đường ống thông. Cấu trúc van gồm khung nitinol lõi kép và có 24 chân kẹp được thiết kế không gây chấn thương vòng van khi neo vào. Hệ thống này cũng tiếp cận qua đường tĩnh mạch đùi.
5.4.5 Van TRISOL
Van TRISOL valve (TriSol Medical, Yokneam, Israel) được cấu tạo từ màng ngoài tim động vật được xếp nếp tạo ra 2 lá van, giống như một van cơ học có hai lá van được gắn trên khung nitinol. Bên ngoài khung được phủ một lớp chống rò quanh van.
6 Quy trình kỹ thuật sửa van ba lá qua đường ống thông với dụng cụ Mitral-Clip/Triclip
Ban đầu, thiết bị MitraClip được ứng dụng cho quy trình dựa trên ống thông cho tổn thương hở hai lá do thoái hóa và hở hai lá cơ năng cho những bệnh nhân nguy cơ cao; sau đó, kỹ thuật này đã được xác nhận cũng phù hợp để điều trị hở ba lá thứ phát và đến nay, thiết bị Mitraclip và thiết bị tương tự cũng được ứng dụng cho can thiệp van ba lá – TriClip – đã sử dụng thường xuyên trong can thiệp van ba lá qua đường ống thông TEER trong điều trị hở ba lá (là thiết bị được sử dụng nhiều nhất, chiếm 80% bệnh nhân trong nghiên cứu sổ bộ TriValve Registry).
Thiết bị được triển khai qua hệ thống vận chuyển kích thước 22 Fr qua đường tĩnh mạch đùi bao gồm hệ thống ống thông dẫn hướng có thể lái được (SGC) và hệ thống vận chuyển thiết bị kẹp lá van (CDS). Đặc biệt các vị trí kẹp để tăng diện áp lá van giữa các lá van ở vùng vách-trước và vách-sau có thể được tiếp cận và điều trị thành công với thiết bị TriClip (chứng nhận CE vào năm 2020). Với kĩ thuật này, người ta có thể sử dụng một hoặc nhiều thiết bị “clip” có thể được cấy vào – tạo ra dạng “hai lá hóa van ba lá” nếu các “clip” được kẹp định vị dọc theo mép vách trước hoặc mép vách sau với kĩ thuật kéo khóa “zipping technique” hoặc tạo 3 lỗ van (triple orifice) nếu “clip” nằm ở cả vị trí trước-vách và sau – vách . Hệ thống TriClip có sẵn ở 4 kích thước khác nhau – NT, NTW, XT và XTW – thiết bị XT và XTW lớn hơn cho phép điều trị các trường hợp mà mức độ hở nhiều hơn và phức tạp hơn (ví dụ như có sa van ba lá hay dạng lều “tenting”). Hình 42.4 cho ta thấy một cái nhìn tổng quan về các đặc điểm và tính năng chính của thiết bị MitralClip/TriClip.
Các thủ thuật qua đường ống thông có thể thực hiện ở bệnh nhân được gây mê toàn thân dưới hướng dẫn của siêu âm tim qua thành ngực, qua thực quản và chụp mạch trong phòng can thiệp tim. Thủ thuật bao gồm các bước chính sau:
Bước 1: Thiết lập đường vào mạch máu
- Thiết lập đường vào tĩnh mạch đùi phải.
- Thiết lập 1 hoặc 2 chỉ khâu ProGlide (Abbott Vascular, Santa Clara, CA) để chờ khi đóng mạch cầm máu khi kết thúc thủ thuật.
- Heparin đường tĩnh mạch đảm bảo ACT (activated clotting time) > 300 giây.
- Đưa ống thông 7 Fr, dây dẫn cứng được đẩy tới tĩnh mạch chủ trên qua ống thông và đổi ống thông với hệ thống SGC sau khi đã nong mạch với các ống nong 14 Fr, 18
Bước 2: Chuẩn bị hệ thống ống thông đưa van có thể lái hướng (SGC) và hệ thống đưa kẹp (CDS)
- Hệ thống SGC được đưa vào tương tự quy trình MitraClip, duỗi thẳng phía đầu của thiết bị.
- Kết nối hệ thống CDS vào đầu xa của SGC.
Bước 3: Đưa “clip” tiếp cận van ba lá
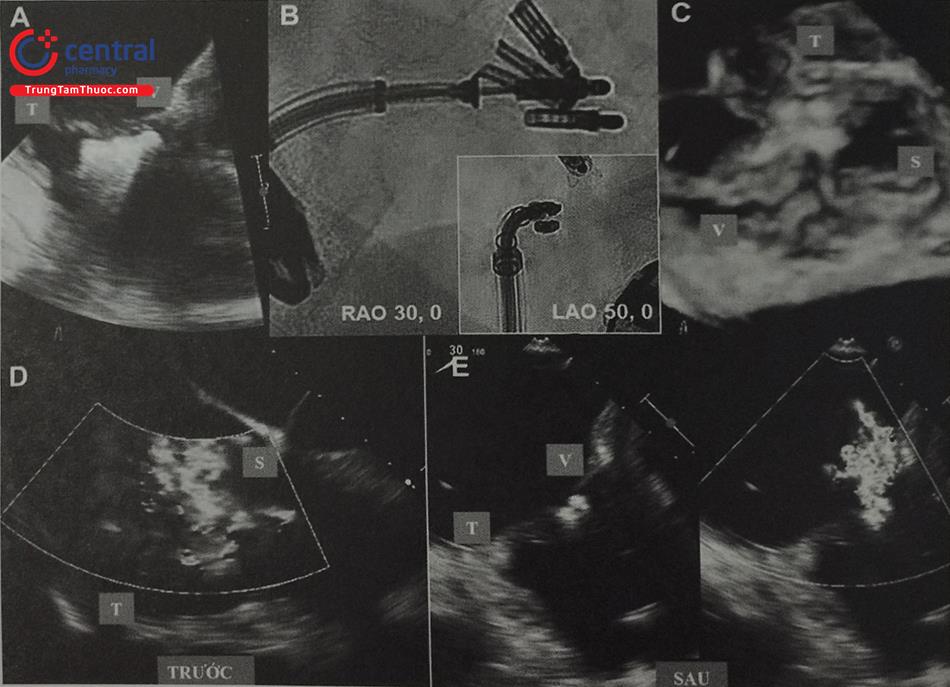
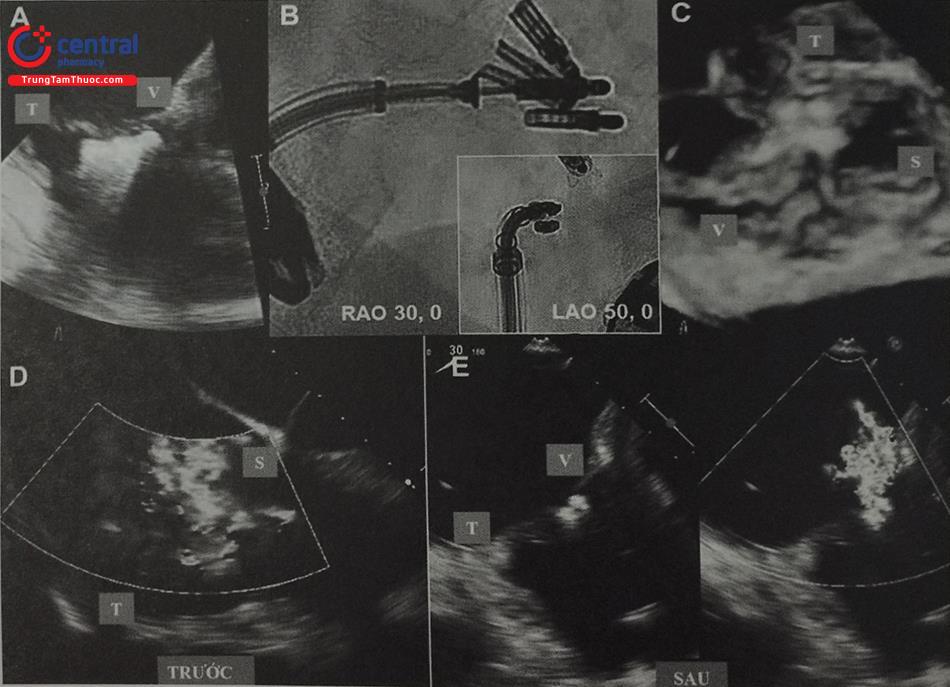
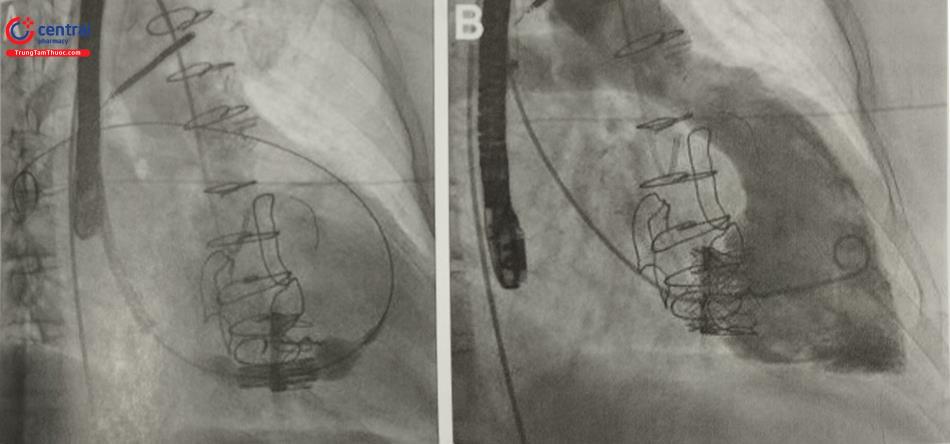
- Dưới hướng dẫn của siêu âm tim qua thực quản (TEE) và dưới màn huỳnh quang tăng sáng, ở góc soi nghiêng trái (LAO), chúng ta xoay hệ thống SGC theo chiều kim đồng hồ trong khi sử dụng các nút điều chỉnh để từ từ hướng “clip” về phía van ba lá (Hình 5A–D).
- Ở góc soi LAO, “clip” nên được hướng sang trái về phía van ba lá dọc theo thành nhĩ phải. Xoay “clip” sang phái hướng sang vách liên nhĩ và có thể làm khó khăn khi đưa hệ thống qua van ba lá. (Hình 5.A,B).
- Khi chúng ta quan sát thấy “clip” ở ngay phía trên van ba lá trên siêu âm TEE, dưới góc soi nghiêng phải (RAO) giúp cho chúng ta quan sát được theo chiều dọc van ba lá (nhìn nghiêng van ba lá) (Hình 5.E,F). Đây là góc cho kẹp van ba lá dưới màn huỳnh quang tăng sáng.
Bước 4: Đưa “clip” vượt qua van ba lá
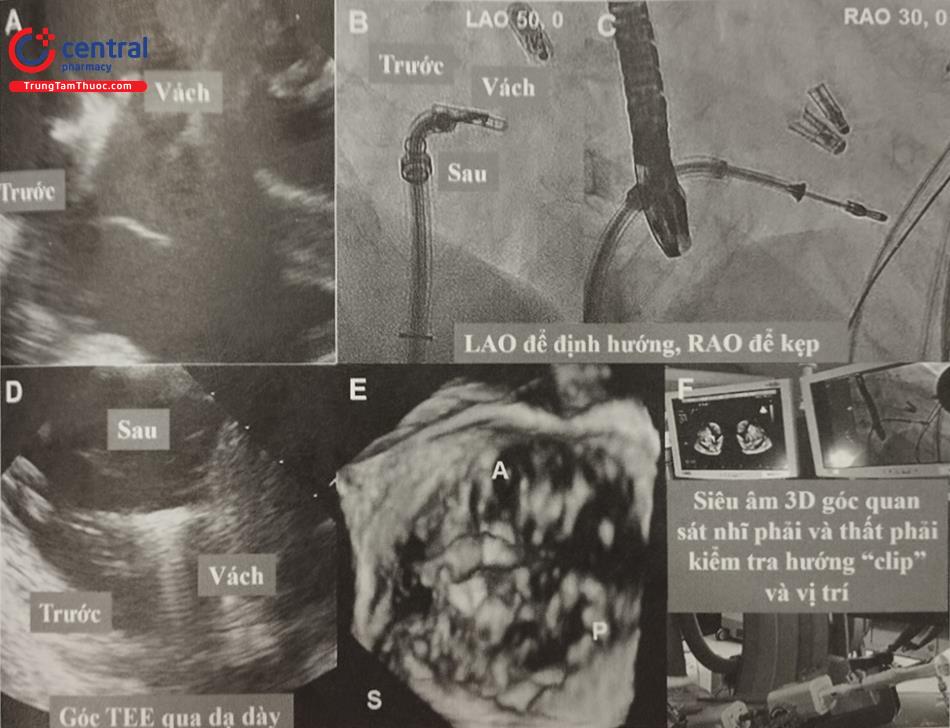
- Vị trí đích để kẹp lá van (như lá trước/vách) với hệ thống CDS nên được xác định ngay trước thủ thuật (Hình 6.A). Khi “clip” ngay phía trên vòng van ba lá, dưới màn huỳnh quang tăng sáng ở góc soi LAO và phối hợp siêu âm qua thực quản 3D (3D TEE) để giúp cho hướng “clip” thuận lợi tiếp cận vị trí đích (Hình 6.B).
- Khép góc “clip” tới góc 60o nhằm tránh vướng vào lá van hoặc dây điện cực thất phải (nếu có), ở góc soi RAO, đẩy “clip” từ từ vào thất phải. Nên hết sức cẩn thận tránh gây tổn thương thất phải khi hệ thống CDS vào quá sâu trong thất phải. (Hình 6.C).
Bước 5: Vị trí kẹp “clip” và kẹp lá van
- Mở lại “clip” và chỉnh hướng ở góc soi LAO, cùng với TEE ở góc cắt trục ngắn qua dạ dày. Lái “clip” hướng tới vị trị đích, sau đó chuyển sang góc soi để kẹp lá van trên Xác định lại vị trí “clip” trên 3D TEE. (Hình 6.D–F).
- Dưới góc soi LAO phối hợp góc xem 4 buồng tim trên siêu âm kẹp lá van ở vị trí đã xác định (Hình 7.A,B).
Bước 6: Kiểm tra lại vị trí kẹp lá van và tháo “clip” khỏi hệ thống
- Sau khi đã kẹp lá van tại vị trí giải phẫu đã chọn, soi dưới màn huỳnh quang tăng sáng và siêu âm TEE ở nhiều góc độ. Đánh giá mức độ hở ba lá cải thiện sau khi kẹp.
- Nếu có ống thông tĩnh mạch trung tâm, chúng ta sẽ đo áp lực tĩnh mạch trung tâm trong thủ thuật. Ngoài ra, cổng bên của hệ thống SGC có thể giúp theo dõi áp lực liên tục và vì vậy chúng ta sẽ theo dõi được sự thay đổi huyết động về áp lực nhĩ phải và sóng V trong thủ thuật. Khi mức độ hở ba lá giảm nhiều chúng ta sẽ thấy giảm áp lực tĩnh mạch trung tâm và áp lực nhĩ phải.
- Sau khi kiểm tra kĩ càng, xác định lá van được kẹp tốt, tiến hành thả “clip” theo cùng quy trình như MitraCLip. Cần đặc biệt chú ý khi tháo dây kẹp và tiến hành chậm và thận trọng vì đầu kim nhọn của hệ thống có thể rất dễ dàng di chuyển mất kiểm soát gây tai biến (không giống như trong kĩ thuật sửa van hai lá). Đánh giá kết quả và mức độ hở ba lá với nhiều góc cắt trên TEE (Hình 7.C–E).

Bước 7: Tháo dụng cụ và đóng mạch cầm máu
Tương tự như kĩ thuật MitraClip cho sửa van hai lá, chúng ta rút hệ thống CDS. Làm duỗi thẳng hệ thống SGC và xoay trở lại hướng ban đầu và rút hệ thống này ra ngoài. Đóng tĩnh mạch đùi bằng chỉ ProGlide đã được khâu chờ trước đó và băng ép cầm máu.
* Lưu ý khi có dây điện cực máy tạo nhịp ở thất phải
Dây điện cực có thể ảnh hưởng đến chất lượng hình ảnh siêu âm tim do hiệu ứng “echo”. Vị trí dây điện cực cũng không phải ở vị trí ảnh hưởng đến hệ thống CDS khi đưa vào thất phải và tốt nhất không làm ảnh hưởng đến lá vách van ba lá. Nếu có thể rút điện cực trước khi tiến hành kĩ thuật sẽ giúp cho thủ thuật thuận lợi hơn.
7 Quy trình kỹ thuật thay van ba lá qua đường ống thông với kĩ thuật van trong van (TVIV)
Với bệnh nhân đã được sửa van ba lá bằng vòng van trước đây hoặc đã được thay van sinh học cho van ba lá nhưng bệnh tiến triển, kỹ thuật thay van ba lá qua đường ống thông cơ thể được lựa chọn trong đó lợi dụng vòng van nhân tạo cũ như một giá đỡ cho van được thay qua đường ống thông.
7.1 Lựa chọn van tim cho can thiệp
Van có thể nở trên bóng là loại van được sử dụng cho thay van ba lá qua đường ống thông. Hai loại van hiện đang được sử dụng là van Melody (Medtronic, Minneapolis, MN) và Edwards Sapien (Edwards Lifesciences, Irvine, CA).
7.1.1 Van Melody cho thay van qua đường ống thông
Van Melody được cấu tạo bởi một đoạn tĩnh mạch cảnh bò gắn trên một khung stent platinum-iridium. Hệ thống van này có 2 kích thước 16 mm và 18 mm và hệ thống vận chuyển Ensemble và Ensemble II. Hướng dẫn sử dụng hệ thống Medtronic (IFU) với kích thước van và hệ thống phân phối tương ứng được liệt kê trong Bảng 5 và 6.
Các tĩnh mạch cảnh của bò được sử dụng đặc biệt cho các hệ thống áp lực thấp, phù hợp cho áp lực tim bên phải, và nhà sản xuất khuyến cáo không nên sử dụng van này cho vị trí van hai lá hoặc vị trí động mạch chủ. Như đã lưu ý trong Bảng 5, hệ thống vận chuyển van có một quả bóng nhỏ bên trong một quả bóng nong lớn hơn hay còn gọi là bóng trong bóng “balloon-in-balloon” (bóng BiB) và như vậy sẽ có 2 bước nong bóng. Hệ thống ống thông vận chuyển có kích thước 22 French (Fr).
7.1.2 Các loại van Edwards Sapien
Các loại van Edwards Sapien được làm từ màng ngoài tim của bò gắn kết trên một khung Coban-crom. Có 3 thế hệ van, lần lượt là Sapien 3000 TFX, Sapien XT và Sapien 3. Phiên bản mới nhất là van Sapien 3 bao gồm một lớp màng ngoài PTFE bổ sung thêm cấu trúc bao quanh bên ngoài quanh van giúp giảm thiểu nguy cơ rò quanh van sau can thiệp. Các Sapien 3 với 4 kích thước: 20 mm, 23 mm, 26 mm và 29 mm. Do kích thước lớn của van sinh học và vòng van tạo hình vòng cung ở bệnh nhân mang van sinh học người lớn, sử dụng Van Sapien 3 kích thước 29 mm là phù hợp cho hầu hết các bệnh nhân không có bệnh lý bẩm sinh kèm theo. Sapien 3 được vận chuyển qua ống thông kích thước 14-16 Fr có thể tự mở rộng hoặc ống thông 22-24 Fr mà không tự mở rộng thêm được bên trong.
Đo kích thước vòng van sinh học bằng bóng (Hình 8.A). Sau khi tĩnh mạch đùi hoặc tĩnh mạch cảnh được nong giãn ra và khi van thích hợp đã được chuẩn bị và đặt trên quả bóng, một ống thông ngắn 18 Fr được trao đổi cho hệ thống đưa van qua ống thông (Hình 8.B). Sử dụng bóng BiB (bóng trong bóng) của thủ thuật van trong van. Sau đó, bóng (BIB) được bơm căng đến áp suất do nhà sản xuất khuyến nghị, áp van vào thành của van sinh học. Sau khi triển khai van, hệ thống vận chuyển van được rút ra (Hình 8.C). Lặp lại các phép đo áp lực không xâm lấn và chụp buồng thất phải được thực hiện sau khi cấy (Hình 8.D). Sử dụng nong van bằng bóng nong van áp lực cao hơn là không cần thiết.
Đóng mạch bằng thiết bị Perclose AT (Abbott Vascular, Santa Clara, CA, USA), hoặc ép tay trực tiếp, hoặc bằng đường khâu “hình số 8” sử dụng kích thước “0” Prolene® (Ethicon, Somerville, NJ, USA).
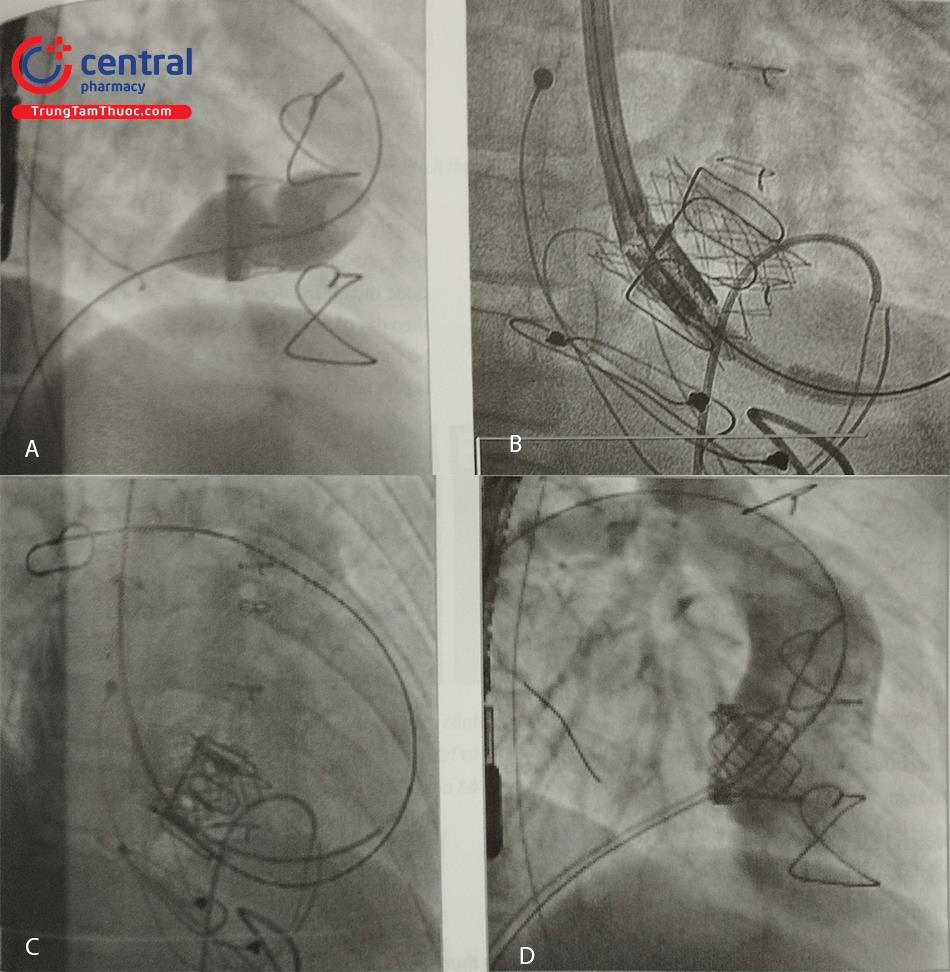
Hình A. Bóng đo van ba lá sinh học cho thấy hẹp nặng với eo nổi rõ trên nong bóng
Hình B. Van ba lá sinh học đã được đặt trước bằng stent Palmaz 4014 (Cordis, Johnson & Johnson, Warren, NJ, USA) và hệ thống đưa van qua ống thông Edwards được đưa vào vị trí
Hình C. Van Edwards sau khi mở được áp thành tốt vào khung stent Palmaz được đặt trước đó
Hình D. Chụp mạch thất phải sau khi cấy ghép Melody cho thấy không có hở van ba lá tồn dư
7.2 Quy trình kỹ thuật thay van ba lá qua đường ống thông
7.2.1 Thuốc chống huyết khối trước can thiệp
Tất cả các bệnh nhân được bắt đầu sử dụng Aspirin với liều 100-325 mg, vào buổi tối của thủ thuật. Điều trị chống kết tập tiểu cầu dài hạn được tiếp tục trong 6 tháng.
Sử dụng kháng sinh đường tĩnh mạch trước thủ thuật.
7.2.2 Thiết lập đường vào mạch máu
Đường vào mạch máu cho can thiệp thay van ba lá qua đường ống thông trong thủ thuật ViV hoặc ViR là qua đường tĩnh mạch đùi bên phải hoặc tĩnh mạch cảnh trong. Về mặt lý thuyết, các tĩnh mạch nách/dưới đòn cũng có thể nhưng hiếm khi được sử dụng cho thủ thuật này. Các đường vào từ tĩnh mạch cảnh trong cho hướng đồng trục tuy nhiên lại làm tăng phơi nhiễm bức xạ cho thủ thuật viên. Đường vào từ tĩnh mạch đùi có lợi điểm dễ điều khiển hơn nhưng sự đồng trục có thể khó hơn. Các đặc điểm ảnh hưởng đến sự đồng trục theo đường vào tĩnh mạch đùi như: độ sâu buồng thất phải (RV), góc tạo bởi tĩnh mạch chủ dưới (IVC) và thất phải, mức độ xoắn vặn của IVC và sự hiện diện của van Eustachian hoặc mạng lưới Chiari quá phát là những yếu tố có thể ảnh hưởng đến thủ thuật.
Theo dõi huyết áp xâm lấn được thực hiện thông qua 1 cannula 18 gauge hoặc 1 sheath 4 Fr ở động mạch đùi.
Chống đông heparin 70 – 100 IU/kg để duy trì thời gian đông máu hoạt hóa (ACT) trên 250 giây.
Các bước can thiệp thay van ba lá qua đường ống thông:
Mặc dù các thông số chi tiết kỹ thuật liên quan đến việc cấy ghép qua ống thông vị trí van ba lá là khác nhau, nhưng phương pháp chung cho cả cấy ghép van Edwards
SAPIEN và Melody là giống nhau và điều này được tóm tắt dưới đây.
Thông tim phải được thực hiện để đánh giá áp lực cuối tâm trương thất phải (RV) và chênh áp qua van ba lá. Sau khi đánh giá huyết động, một dây dẫn siêu cứng Amplatz (Cook Medical, Bloomington, IN, USA) được đưa qua một ống thông có đầu bóng và được định vị trong động mạch phổi phân thùy dưới, tốt nhất là bên phải. Chụp mạch được thực hiện bằng cách sử dụng một ống thông đưa theo dây dẫn, để đánh giá kích thước thất phải và mức độ hở van ba lá. Kích thước của lỗ thông hiệu quả của van ba lá sinh học được xác định bởi siêu âm tim qua thực quản và bằng cách sử dụng bóng định cỡ (Hình 8.A). Việc tính kích thước bóng phải được thực hiện vì một số van sinh học bị hẹp tiến triển và do đó hiệu quả độ mở của chúng khác với đường kính bên trong ban đầu.
Nong van ba lá bằng bóng áp lực cao ở bệnh nhân hẹp van ba lá là không cần thiết. Có thể chọn đặt van sinh học đặt trước stent với diện tích tiếp xúc ngắn, đặc biệt là trong quá trình cấy van Edwards SAPIEN.
Đặt van ba lá: Sau khi tĩnh mạch đùi hoặc tĩnh mạch cảnh được nong tốt, van thích hợp đã được chuẩn bị và đặt trên quả bóng, một ống thông ngắn 18 Fr được trao đổi cho hệ thống đưa van qua ống thông (Hình 8.B). Sử dụng bóng BiB (bóng trong bóng) của thủ thuật van trong van. Sau đó, bóng (BIB) được bơm căng đến áp suất cho phép, áp van vào thành của van sinh học. Sau khi van nở tốt, hệ thống ống thông vận chuyển được rút ra (Hình 8.C).
Kiểm tra sau đặt van: Tiến hành thông tim đo áp lực và chụp buồng thất phải được thực hiện sau khi cấy van (Hình 8.D). Sử dụng nong van bằng bóng nong van áp lực cao hơn là không cần thiết.
Bảng 5. Các thông số kích thước van khi nong trên bóng BiB
| Kích thước hệ thống bóng BiB (bóng trong/bóng ngoài) | Áp lực giới hạn cho bóng trong (Atm) | Áp lực giới hạn cho bóng ngoài (Atm) | Đường kính ngoài của van khi mở ra (mm) |
18 (9 mm x 3,5 cm/18 mm x 4 cm) | 5 | 4 | 20,1 |
20 (10 mm x 3,5 cm/20 mm x 4 cm) | 5 | 4 | 22,4 |
22 (11 mm x 3,5 cm/22 mm x 4 cm) | 4,5 | 3 | 24,1 |
Chú thích: Atm: áp suất khí quyển; BiB: Bóng trong bóng (Balloon in Balloon).
Đóng mạch bằng thiết bị Perclose AT (Abbott Vascular, Santa Clara, CA, USA), hoặc ép tay trực tiếp, hoặc bằng đường khâu “hình số 8” sử dụng kích thước “0” Prolene® (Ethicon, Somerville, NJ, USA).
Bảng 6. Kích thước van Melody
| Van Melody (đường kính ghi trên van) | Đường kính lớn nhất có thể (sau nong) |
| 16 mm | 20 mm |
| 18 mm | 22 mm |
8 Biến chứng can thiệp và xử lý
Căn chỉnh dưới van là rất quan trọng và việc đưa clip vào buồng thất phải trong khi duy trì sự căn chỉnh này (có thể được thực hiện bằng 2D TEE và soi huỳnh quang) là điều tối quan trọng. Nếu xảy ra hiện tượng kẹp bị lệch, khi clip đã được đặt, mặt phẳng lá van có thể bị biến dạng đáng kể và hở ba lá tổng thể có thể xấu đi. Cấu trúc dây chằng và cơ nhú phức tạp của van ba lá làm cho việc điều khiển CDS trong van trở nên rủi ro. Nên căn chỉnh dưới van một cách cẩn thận bằng siêu âm 3D TEE, thay đổi tối thiểu căn chỉnh đó trong quá trình vào buồng thất phải (RV), vào RV với các nhánh clip đóng một phần và mở clip và rút lại tại thời điểm lá van được thả bởi clip. Trường hợp vướng mắc xảy ra, điều quan trọng là phải đảo ngược số bước tối thiểu đã được thực hiện. Trong trường hợp xấu nhất, nếu clip không thể được giải phóng, có thể được triển khai trong các cấu trúc dây chằng. Quá nhiều lực để loại bỏ có thể dẫn đến rách dây chằng. Trong nhiều trường hợp, do giãn vòng van nghiêm trọng, có rất ít lá van áp lại (nếu có). Ấn nhẹ trước ngực trước bằng tay nhẹ nhàng cung cấp áp lực bên ngoài lên vòng van ba lá; có thể đưa các lá van lại gần hơn và giảm mức độ hở ba lá (Hình 42.10). Các lá van thực sự đi kèm với nhau, nhưng toàn bộ hệ thống CDS/SGC cũng bị dịch chuyển, dẫn đến vị trí kẹp lá van thay đổi và dẫn đến không kiểm soát được mức độ hở ba lá.
8.1 Kiểm soát tạo nhịp và máy tạo nhịp trong thủ thuật thay van ba lá qua đường ống thông
Thông thường, không cần thiết phải thực hiện tạo nhịp nhanh khi cấy van vào vị trí van ba lá. Tuy nhiên, nếu các bệnh nhân có áp lực tâm thu buồng thất phải (RV) cao và cần tiến hành can thiệp nhanh chóng, một số tác giả có thể chọn giữa sử dụng dây dẫn máy tạo nhịp tim đã có sẵn, tạo nhịp từ mạch vành, hoặc sử dụng dây dẫn của hệ thống thay van THV để tạo nhịp độ. Lưu ý, tạo nhịp tim nhanh được sử dụng 22% thời gian trong nghiên cứu sổ bộ VIVID Registry. Với 329 bệnh nhân được phân tích trong thử nghiệm VIVID Registry, 31 người bệnh cấy ghép van có điện cực tạo nhịp qua đường tĩnh mạch. Trong nhóm này, có 3,2% bệnh nhân bị tuột điện cực thất phải và có 6,4% bệnh nhân có hỏng điện cực thất phải. Vì vậy, van THV cấy ghép khi đang có dây điện cực là khả thi với một tỷ lệ nhỏ biến cố cho hệ thống tạo nhịp tim.
8.2 Tái can thiệp van ba lá
Tổng số 10% bệnh nhân yêu cầu tái can thiệp van ba lá trong thời gian theo dõi. Phẫu thuật hở van ba lá được thực hiện ở 18 bệnh nhân, kỹ thuật TTVR lần 2 được thực hiện ở 8 bệnh nhân.
Bảng 7. Các chỉ định tái can thiệp lại sau thay van qua đường ống thông
| Rối loạn chức năng van |
| Rò quanh van |
| Viêm nội tâm mạc nhiễm khuẩn |
| Huyết khối tại van |
| Các can thiệp đồng thời |
| Di lệch/Rơi van |
| Suy chức năng tạng liên quan đến van |
8.3 Độ bền của van tim
Mới có các công bố của các dữ liệu theo dõi trung hạn tại thời điểm này. Nghiên cứu sổ bộ The VIVID Registry đã cho thấy 14/306 bệnh nhân được phát hiện có rối loạn chức năng van đáng kể ở tháng thứ 15,8. Sử dụng thuốc chống huyết khối và rối loạn chức năng van sau THV không có mối tương quan trực tiếp, 32% bệnh nhân hở hay hẹp van sau THV đã được dùng thuốc chống máu khi so với 52% của người bệnh không có rối loạn chức năng van. Các yếu tố quyết định của độ bền sau THV bao gồm hình thành huyết khối và viêm nội tâm mạc nhưng không đề cập đến pannus hình thành trong báo cáo.
8.4 Huyết khối van
Tổng số 8 bệnh nhân bị huyết khối van, một số ít xuất hiện vài ngày sau TTVR đến 6 tháng sau can thiệp cấy ghép. Một số các trường hợp được điều trị tốt với thuốc chống đông máu; tuy nhiên, có 2 bệnh nhân cần yêu cầu phẫu thuật. Tỷ lệ huyết khối là 0,033 tại 3 năm và tăng chênh áp qua van sau can thiệp là một yếu tố nguy cơ độc lập cho hình thành huyết khối tại van (HR 1,38 cho mỗi tăng 1 mmHg, P = 0,002). Tính an toàn của việc sử dụng thuốc chống đông máu sau THV còn ít, nếu ngoại suy từ dữ liệu của van ba lá nhân tạo cơ học thì tỷ lệ chảy máu đường tiêu hóa và nội sọ là 16% và 5% tương ứng.
Hiện nay khuyến cáo là người bệnh sau TTVR sẽ điều trị với thuốc chống đông kéo dài và người bệnh không dung nạp với thuốc chống đông máu thì được xem xét không điều trị bằng kĩ thuật này.
8.5 Viêm nội tâm mạc nhiễm khuẩn
8 bệnh nhân được chẩn đoán viêm nội tâm mạc sau THV. Tỷ lệ mắc bệnh viêm nội tâm mạc là 0,017 sau 1 năm và 0,042 sau 3 năm. Tỷ lệ mắc hàng năm được tính toán là 1,5% bệnh nhân năm. Trong số bệnh nhân viêm nội tâm mạc, 3 bệnh nhân được điều trị bằng phẫu thuật và 4 bệnh nhân dùng thuốc. Không có bệnh nhân nào tử vong do viêm nội tâm mạc.
8.6 Tỷ lệ sống còn
Thời gian theo dõi trung bình là 15,9 tháng. Tử vong sớm rất hiếm, 2,6% tử vong trong 30 ngày. Phân tích đa biến cho thấy bệnh cấp tính/tái nhập viện gần đây (HR 4,4, P <0,001) người có tuổi (HR 1,03 mỗi năm, P <0,001) là các yếu tố dự báo độc lập cho tỷ lệ tử vong. Tỷ lệ tích lũy tử vong là 0,18.
9 Kết quả can thiệp qua một số nghiên cứu
9.1 Kết quả can thiệp van ba lá qua đường ống thông (TTVI)
Hở van ba lá (TR) là một bệnh hay gặp và có thể tiến triển nặng trên lâm sàng. Các nghiên cứu trước đây đã chỉ rõ ràng ở cả 2 nhóm hở ba lá tiên phát và thứ phát đều có ảnh hưởng đến tiên lượng sống còn. Gần đây, can thiệp van ba lá qua đường ống thông (transcatheter tricuspid valve intervention – TTVI) đang dần trở thành một phương thức điều trị tiềm năng cho các bệnh nhân bị hở ba lá nặng có triệu chứng hay nguy cơ phẫu thuật cao. Lĩnh vực của TTVI đang ở giai đoạn đầu và vẫn còn cần thêm các thử nghiệm lâm sàng cũng như cần các thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng RCT.
Tính khả thi, an toàn và hiệu quả đã được chứng minh trong các thử nghiệm lâm sàng ban đầu với tỷ lệ thành công của thủ thuật hơn 95% và với tỷ lệ giảm mức độ TR (ít nhất 1 phân độ) có ý nghĩa cũng như cải thiện kết cục lâm sàng (theo phân độ NYHA, 6- MWT, KCCQ).Trong nghiên cứu sổ bộ đa trung tâm TriValve Registry, từ năm 2015 tới năm 2018, tác giả Mehr và cộng sự đã báo cáo kết quả can thiệp cho 249 bệnh nhân TR có triệu chứng, được điều trị sửa van ba lá qua đường ống thông với MitraClip. Các bệnh nhân có độ tuổi trung bình 77, giới nữ chiếm 51% và có nguy cơ phẫu thuật cao với EuroSCORE II là 6%, 4%. Phân độ NYHA III gặp từ 94% bệnh nhân trở lên, 74% rung nhĩ, 68% đồng thời có bệnh lý van tim bên trái, 30% có máy tạo nhịp tim vĩnh viễn hoặc ICD, 26% có phân suất tống máu thất trái giảm, 25% có bệnh lý phổi tắc nghẽn mạn tính (COPD), 7% có bệnh lý thận mạn và 30% đái tháo đường. Phân độ TR lớn hơn độ 3 gặp ở 45% và lớn hơn 4 gặp trong 52%, tương ứng, và đa phần là hở ba lá thứ phát (89%). Tỷ lệ thành công về mặt kỹ thuật đạt 96% với trung bình là 2 thiết bị cấy ghép cho mỗi quy trình – trong đó 86% ở vị trí trước vách và 21% ở cả hai vị trí trước-vách và sau-vách, tương ứng. Thành công về thủ thuật đạt được 77% (với TR giảm xuống ≤ 2 +) và 89% (TR giảm 1 bậc so với mức ban đầu), tương ứng. Tỷ lệ bệnh nhân có độ TR ≥ 3 giảm từ 97% lúc ban đầu xuống 23% và 28% khi xuất viện và sau 1 năm theo dõi, tương ứng. Đáng chú ý, 52% bệnh nhân đã được điều trị đồng thời cả hở hai lá nhiều trong cùng 1 lần can thiệp sửa van theo kiểu kĩ thuật bờ-bờ. Không có tử vong trong thủ thuật. mặc dù có 3 bệnh nhân tử vong trong khi nằm viện, có 1 bệnh nhân cần phẫu thuật tim hở sau đó và 2 bệnh nhân bị đột quỵ ở bệnh nhân tiến hành sửa van hai lá qua đường ống thông (TMVR) đồng thời. Ở thời điểm 1 năm tỷ lệ tử vong do mọi nguyên nhân là 19%. Thành công về thủ thuật cho thấy đã làm giảm tử vong đáng kể sau 1 năm và nhu cầu tái nhập viện lại. Về kết quả chức năng, phân độ NYHA được cải thiện ít nhất 1 độ ở 72% bệnh nhân, 69% bệnh nhân có phân độ NYHA + II (so với chỉ có 5% ở giai đoạn đầu trước can thiệp).
Nghiên cứu sổ bộ “The TriValve international registry” cho đến gần đây vẫn là nghiên cứu đầu tiên và đa trung tâm lớn nhất với việc sử dụng nhiều loại thiết bị TTVI cho điều trị bệnh nhân TR nặng. Phân tích ghép cặp dựa trên điểm xu hướng “A propensity-matched analysis” của nghiên cứu này cho thấy việc sử dụng thiết bị TTVI có làm giảm tỉ lệ tử vong do mọi nguyên nhân, giảm nguy cơ tử vong và tái nhập viện do suy tim ở các nhóm sử dụng các thiết bị TTVI khác nhau trong điều trị bệnh nhân TR nặng có triệu chứng so sánh với nhóm điều trị nội khoa đơn thuần. Nghiên cứu này đặc biệt quan trọng vì đã cung cấp những bằng chứng đầu tiên chứng minh lợi ích của can thiệp van ba lá qua đường ống thông cho cải thiện các kết cục lâm sàng so sánh với nhóm điều trị nội khoa theo khuyến cáo hướng dẫn. Cũng còn một số hạn chế trong nghiên cứu này, đó là hạn chế của nghiên cứu hồi cứu trong cả 2 nhánh nghiên cứu trên.
Kỹ thuật sửa van hai lá với dụng cụ MitraClip cũng được áp dụng cho bệnh nhân TR và có nguy cơ phẫu thuật cao trong nghiên cứu TRILUMINATE, là nghiên cứu một nhánh tiến cứu, đa trung tâm mới gần đây. Kết quả sau 1 năm nghiên cứu đã được báo cáo tại Hội nghị PCR e-Course 2020 cho thấy với 85 bệnh nhân với tuổi trung bình cao hơn (trung bình 77,8 tuổi), nữ giới là chủ yếu (66%), nhiều bệnh phối hợp (với 92% rung nhĩ, 86% tăng huyết áp, 46% suy thận, 33% có can thiệp hai lá trước đó, 22% tiểu đường, 18% nhồi máu cơ tim trước đây) và có nguy cơ phẫu thuật cao với EuroScore II trung bình là 8%, 6%. Kết quả cho thấy tỷ lệ cấy ghép thành công 100%, TR là giảm ít nhất 1 độ ở thời điểm ra viện 91% (76 bệnh nhân) và ở 86% các bệnh nhân sau 30 ngày theo dõi. Trong thử nghiệm này, các tác giả đã sử dụng sơ đồ phân loại năm mức độ hở ba lá của Hahn và đồng nghiệp. Ở thời điểm tháng thứ 6 theo sát các tỷ lệ của người bệnh với TR nặng giảm xuống còn 24% (so với 29% ở mức ban đầu), trong khi 7% (so với 29% ở mức ban đầu) và 1% (so với 37% tại thời điểm ban đầu) cho TR rất nặng (độ 4) hoặc toàn bộ (độ 5) ở thời điểm theo dõi 6 tháng, tương ứng. Có sự cải thiện chức năng đáng kể (phân loại NYHA, 6-MWT, KCCQ) tại thời điểm ngày thứ 30 và 6 tháng theo dõi. Trong nghiên cứu, trung bình có 2,2 thiết bị được sử dụng cho mỗi lần can thiệp, chủ yếu ở vị trí mép lá vách-trước (77%, 20% ở vị trí mép van vách – sau). Về tính an toàn, nghiên cứu chỉ ra không gặp biến chứng rơi dụng cụ kẹp, đột quỵ, hoặc nhồi máu cơ tim; biến chứng thiết bị “clip” rơi khỏi một cánh van (SLDA) gặp ở 5 bệnh nhân (7%), và ở 6 bệnh nhân, chênh áp trung bình qua van ba lá van > 5 mmHg ở thời điểm đánh giá sau 6 tháng cho thấy có hẹp van ba lá . Tỷ lệ sống còn sau 30 ngày là 100% và tỷ lệ tử vong do mọi nguyên nhân sau 6 tháng là 5% (N = 4) với 2% (N = 2) tử vong do nguyên nhân tim mạch. Kết quả siêu âm tim sau 6 tháng cho thấy có sự cải thiện của chức năng thất phải (chỉ số TAPSE, FAC thất phải) và kéo dài thời gian giãn nở nhĩ phải và thất phải, do đó, cho thấy thiết bị TriClip là an toàn và hiệu quả trong điều trị STR ở bệnh nhân có nguy cơ phẫu thuật cao. Vào tháng 4/2020, thiết bị TriClip™ (Abbott) đã được cấp chứng CE, và đây là thiết bị sửa van ba lá qua đường ống thông đầu tiên với cơ chế kẹp mép van được đưa vào sử dụng trên thế giới. Gần đây việc công bố kết quả theo dõi sau 1 năm cho thấy TR giảm liên tục (mức độ TR ≤ trung bình gặp ở 71% các bệnh nhân tại thời điểm sau 1 năm, so với 8% tại thời điểm ban đầu). Hơn nữa, phân độ NYHA từ độ II trở xuống gặp ở 83% (so với 31% ban đầu). Tỷ lệ tử vong và biến cố phụ chính là 7%. Về các thông số trên siêu âm tim, kích thước và chức năng thất phải và nhĩ phải đã cải thiện đáng kể chỉ ra đảo ngược tái cấu trúc thất phải sau sửa van ba lá qua đường ống thông. Chúng ta sẽ đợi kết quả của các thử nghiệm đang tiến hành để đánh giá hiệu quả của thiết bị TriClip so sánh với điều trị nội khoa tối ưu (OMT) trong thử nghiệm “TRILUMINATE Pivotal Trial” và “TRICuspid Intervention in Heart Failure Trial”.
Nghiên cứu “The TRI-REPAIR study” đánh giá hiệu quả và độ an toàn của kĩ thuật sửa van ba lá với thiết bị Cardioband (hệ thống cấu trúc lại van ba lá qua đường ống thông của hãng Edwards Lifesciences) là một nghiên cứu một nhánh, đa trung tâm với 30 bệnh nhân không thể phẫu thuật có mức độ hở ba lá cơ năng từ trung bình đến nặng. Kết quả sau 6 tháng cho thấy hệ thống hoạt động tốt và an toàn ở nhóm các bệnh nhân trước can thiệp có triệu chứng với mức độ hở ba lá từ vừa đến nặng. Kết quả theo dõi sau 1 năm của các bệnh nhân TR cơ năng được can thiệp cho thấy có hiệu quả trong việc thay đổi, giảm kích thước vòng van và mức độ hở van. Tỉ lệ sống còn cao sau 1 năm (83,3%). Và như vậy hãng Edwards đã được nhận chứng nhận CE cho thiết bị Cardioband này, với chỉ định điều trị hở ba lá vào năm 2018. Nghiên cứu sổ bộ TriBAND (Transcatheter Repair of Tricuspid Regurgitation With Edwards Cardioband TR System Post Market Study) đang tiến hành khi thiết bị Cardioband được sử dụng trên thế giới sẽ cung cấp thêm nhiều bằng chứng mới có giá trị.
Thiết bị mới FORMA là thiết bị sửa van ba lá của hãng Edwards Lifesciences được thiết kế để nhằm tăng độ áp các lá van bởi thu hẹp diện tích vùng hở van. Các kết quả ngắn hạn và trung hạn được báo cáo trước đây. Vào năm 2019, kết quả nghiên cứu dài hạn của thiết bị này trên người đã được công bố. Ở thời điểm 32 tháng sau can thiệp, mức độ hở van ba lá đã giảm ở 67% các bệnh nhân. So sánh với trước can thiệp, đã cải thiện đáng kể khả năng gắng sức như phân độ NYHA (p <0,001), nghiệm pháp đi bộ 6 phút tăng thêm 54m (+54 m, p=0,016) và điểm đánh giá theo thang điểm KCCQ tăng thêm 16 điểm (+16 points, p=0,016) với cỡ mẫu 15 bệnh nhân được theo dõi ít nhất 24 tháng. Hệ thống FORMA cho thấy kết quả an toàn ở nhóm bệnh nhân có nguy cơ cao, với sự cải thiện chức năng bền vững giảm mức độ hở ba lá lên tới 3 năm. Tuy nhiên, chương trình FORMA đã bị tạm dừng không còn tiếp tục triển khai từ phía công ty Edwards.
Hệ thống sửa van PASCAL đã cung cấp những bằng chứng đầu tiên trên người cho can thiệp hở van ba lá (TR) nặng cho thấy tỉ lệ thành công của tiến trình đạt 86%; không có biến chứng trong quá trình làm can thiệp. Tại thời điểm 30 ngày, tỉ lệ tử vong là 7,1% và 88% các bệnh nhân chỉ còn mức NYHA I/II, với mức độ TR ≤ 2 + gặp ở 85% các bệnh nhân. Nghiệm pháp đi bộ 6 phút tăng từ 240 m đến 335 m (p<0,001). Những kinh nghiệm và kết quả đầu tiên trên người của hệ thống PASCAL khẳng định tỉ lệ thành công cao, an toàn và cải thiện triệu chứng lâm sàng đáng kể. Vào tháng 5/2020, hệ thống PASCAL được được nhận chứng nhận CE cho can thiệp TR.
9.2 Thay van trong van cho bệnh nhân có van sinh học bị thoái hóa
Trong nghiên cứu sổ bộ VIVID Registry, khoảng một nửa số bệnh nhân có hở van ba lá đơn thuần, một phần tư số bệnh nhân bị hẹp đơn thuần, và số còn lại phối hợp vừa hở vừa hẹp van ba lá. Thay van (THV) trong van qua đường ống thông cho van sinh học thoái hóa sẽ được hỗ trợ bởi bộ khung của van sinh học giúp cho đồng trục THV. Các phần khung của van sinh học có thể từ 12 mm đến 26 mm tùy trên các kích thước và loại van. Các khung của van sinh học thoái hóa giúp định hướng THV linh hoạt hơn khi căn chỉnh sự đồng trục và cho phép cấy ghép an toàn. Một số loại van sinh học có các vòng khâu bằng chất cản quang tối thiểu, như là như van Biocor Epic valve (Abbott Vascular, Santa Clara, CA), và có thể gây ảnh hưởng cho việc quan sát khi cấy ghép.
Với van THV không nở tối ưu hoặc còn chênh áp qua van cao sau can thiệp có thể do gãy khung van sinh học. Nói chung là, khi bơm bóng với áp suất cao với bóng không đàn hồi (non-compliant NC) (True balloon hoặc Vida, Bard Medical, Covington, GA). Chưa có hướng dẫn rõ ràng về kích thước bóng nong cho van sinh học nhân tạo với hướng dẫn gần đây cho nong van ĐMC sinh học và khu- yến cáo là bóng nong có kích thước lớn hơn 1 mm đường kính như hiện tại hướng dẫn được xuất bản dành cho gãy động mạch chủ sinh học và khuyến cáo là lớn hơn 1mm so với đường kính van nhân tạo được khuyến cáo bởi nhà sản xuất. Một đặc điểm giải phẫu quan trọng cần lưu ý là ĐMV phải rất gần vòng van ba lá, nên khuyến cáo cần hết sức cẩn thận khi nong bóng lên đặc biệt khi gãy van sinh học. Áp lực cao tới 20 atm đã được sử dụng để đạt được kích thước mong muốn. Còn ít thông tin về ảnh hưởng lâu dài của việc bơm áp lực cao lên chức năng van ba lá sinh học; do đó, vai trò của việc làm đứt gãy nên được dành cho THV chưa được mở rộng hết hoặc chênh áp tồn dư cao. Chênh áp tồn dư cao hơn sau TTVR là có liên quan với nguy cơ tái can thiệp lại (HR 1,14 cho mỗi chênh áp thêm 1mmHg, P = 0,0005) và nên được giải quyết trong thủ thuật nếu có thể .
Trong nghiên cứu sổ bộ VIVID Registry, khoảng một nửa số bệnh nhân có hở van ba lá đơn thuần, một phần tư số bệnh nhân bị hẹp đơn thuần, và số còn lại phối hợp vừa hở vừa hẹp van ba lá. THV cấy ghép cho van sinh học thoái hóa sẽ được hỗ trợ bởi bộ khung của van sinh học giúp cho đồng trục THV. Các phần khung của van sinh học có thể từ 12 mm đến 26 mm tùy trên các kích thước và loại van. Các khung của van sinh học thoái hóa giúp định hướng THV linh hoạt hơn khi căn chỉnh sự đồng trục và cho phép cấy ghép an toàn. Một số loại van sinh học có các vòng khâu bằng chất cản quang tối thiểu, như là như van Biocor Epic valve (Abbott Vascular, Santa Clara, CA), và có thể gây ảnh hưởng cho việc quan sát khi cấy ghép.
Với van THV không nở tối ưu hoặc còn chênh áp qua van cao sau can thiệp có thể do gãy khung van sinh học. Nói chung là, khi bơm bóng với áp suất cao với bóng không đàn hồi (non-compliant NC) (True balloon hoặc Vida, Bard Medical, Covington, GA). Chưa có hướng dẫn rõ ràng về kích thước bóng nong cho van sinh học nhân tạo với hướng dẫn gần đây cho nong van ĐMC sinh học và khuyến cáo là bóng nong có kích thước lớn hơn 1 mm đường kính như hiện tại hướng dẫn được xuất bản dành cho gãy động mạch chủ sinh học và khuyến cáo là lớn hơn 1mm so với đường kính van nhân tạo được khuyến cáo bởi nhà sản xuất. Một đặc điểm giải phẫu quan trọng cần lưu ý là ĐMV phải rất gần vòng van ba lá, nên khuyến cáo cần hết sức cẩn thận khi nong bóng lên đặc biệt khi gãy van sinh học. Áp lực cao tới 20 atm đã được sử dụng để đạt được kích thước mong muốn. Còn ít thông tin về ảnh hưởng lâu dài của việc bơm áp lực cao lên chức năng van ba lá sinh học; do đó, vai trò của việc làm đứt gãy nên được dành cho THV chưa được mở rộng hết hoặc chênh áp tồn dư cao. Chênh áp tồn dư cao hơn sau TTVR là có liên quan với nguy cơ tái can thiệp lại (HR 1,14 cho mỗi chênh áp thêm 1mmHg, P = 0,0005) và nên được giải quyết trong thủ thuật nếu có thể.
9.3 Hướng phát triển tương lai cho can thiệp van ba lá qua đường ống thông
Việc phát triển của kỹ thuật can thiệp van ba lá qua đường ống thông vẫn còn đối mặt với nhiều thách thức. Thứ nhất, các nghiên cứu phải so sánh hiệu quả của thiết bị với điều trị nội khoa tối ưu trong các thử nghiệm lâm sàng ngẫu nhiên để chứng minh tính khả thi và kết quả đầy hứa hẹn của các nghiên cứu trước đây (Bảng 42.8.) Trong khi đó, các đánh giá dữ liệu trong thế giới thực, sau khi thử nghiệm trên người rất quan trọng, đặc biệt khi hầu hết việc tuyển chọn bệnh nhân với các tiêu chuẩn lâm sàng chặt chẽ, nghiêm ngặt cho mỗi loại thiết bị. Thứ hai, thời điểm tối ưu để can thiệp hở van ba lá cần được làm rõ thêm, và việc điều trị ban đầu bằng thuốc lợi tiểu không nên gây trì hoãn vấn đề phẫu thuật hay can thiệp qua đường ống thông.
Để tối ưu, quyết định can thiệp hở van ba lá (TR) cần được thảo luận và đưa ra quyết định từ nhóm tim mạch chuyên gia dựa trên trên các số liệu khách quan. Thứ ba, độ ổn định và kết cục lâu dài của các thiết bị này vẫn chưa được biết rõ.
Bảng 8. Các nghiên cứu đang triển khai cho các thiết bị trong can thiệp van ba lá qua đường ống thông
| Thiết bị | Tên nghiên cứu | Thiết kế | Số BN | Mức độ TR | Mục tiêu nghiên cứu |
TriClip | TRILUMINATE (03904147) | Ngẫu nhiên, nhãn mở | 700 | Từ nặng trở lên | Tử vong do tim mạch hoặc hở ba lá, tái nhập viện do suy tim và cải thiện chất lượng sống sau 12 tháng |
| PASCAL | CLASP II TR (04097145) | Ngẫu nhiên, nhãn mở | 825 | Từ nặng trở lên | Biến cố bao gồm tử vong, suy tim tái nhập viện, phẫu thuật van ba lá và cải thiện trên xét nghiệm sau 24 tháng |
| MISTRAL | MASTER II (04073979) | NC sổ bộ tiến cứu | 10 | Từ TB trở lên | An toàn với tỷ lệ tai biến liên quan đến thủ thuật vào ngày 5 và ngày 30. |
| Trialign | SCOUT II (03225612) | Sổ bộ tiến cứu | 60 | TB hoặc hơn | Tử vong do mọi nguyên nhân ngày 30 |
| MIA | STAR (03692598) | Sổ bộ tiến cứu, 2 nhánh (PT và CT) | 60 | TB trở lên | An toàn: Biến chứng chính trong 30 ngày sau thủ thuật: tử vong, tràn dịch màng ngoài tim, NMCT, phẫu thuật cứu nguy, cấy ghép, đột quỵ Hiệu quả: giảm mức độ nặng TR sau 30 ngày. |
| Cardioband | TriBAND (03779490) | Sổ bộ tiến cứu | 150 | TB trở lên | Giảm mức độ nặng TR sau khi ra viện |
| DaVingi | 03700918 | Sổ bộ tiến cứu đầu tiên trên người | 15 | Nặng trở lên | An toàn: biến cố liên quan đến thiết bị sau 30 ngày. Hiệu quả: tỉ lệ thành công |
| TricValve | TRICUS STUDY (03723239) TRISCEND (04221490) | Sổ bộ tiến cứu Sổ bộ tiến cứu | 10 200 | N/A TB trở lên | An toàn: biến cố sau 30 ngày. Hiệu quả: NYHA sau 6 tháng. Không có biến cố liên quan đến thiết bị hoặc thủ thuật |
| Evoque | TRISCEND II (04482062) | Ngẫu nhiên, nhãn mở | 775 | Nặng trở lên | Giảm mức độ hở và chức năng trên thang điểm đo lường: KCCQ, NYHA, 6MWT sau 6 tháng.
|
| LuX-Valve | Sổ bộ tiến cứu | 150 | Nặng trở lên | Tử vong do mọi nguyên nhân sau 1 năm | |
| Cardiovalve | Sổ bộ tiến cứu | 15 | TB trở lên | Giảm mức độ TR sau 1 năm. An toàn: tỷ lệ BN không có biến cố chính sau 30 ngày Hiệu quả: thành công về kĩ thuật, giảm mức độ TR sau 30 ngày. |
Chú thích: TR: hở van ba lá; PT: Phẫu thuật; BN: Bệnh nhân; TB: Trung bình; NMCT: nhồi máu cơ tim.
Do nguy cơ TR tái phát thường thấy sau phẫu thuật, do đó cần đánh giá hiệu quả lâu dài của các thiết bị này trước khi mở rộng chỉ định can thiệp qua đường ống thông. Cuối cùng, sử dụng thuốc chống huyết khối khi tuần hoàn bên tim phải phải với áp lực thấp cần được xác định cụ thể trên mỗi loại thiết bị nhằm để phòng ngừa huyết khối gây ảnh hưởng đến hoạt động của thiết bị.
Can thiệp TR qua đường ống thông là một lĩnh vực phát triển nhanh chóng và nhiều thiết bị đã được phát triển trong những năm qua. Độ an toàn của thủ thuật và những kết quả sớm rất đáng khích lệ đã đạt được với hầu hết các thiết bị và điều này đã mang lại cơ hội điều trị cho nhóm bệnh nhân TR có nguy cơ phẫu thuật cao. Các thử nghiệm quan trọng so sánh can thiệp TR qua đường ống thông với điều trị nội khoa tối ưu đang được háo hức chờ đợi để xác nhận các kết quả này. Tuy nhiên, bằng chứng sắp tới sẽ cần cho các minh chứng chi tiết trong việc lựa chọn bệnh nhân và thiết bị phù hợp, cũng như các bằng chứng về hiệu quả và tính an toàn lâu dài. Tóm lại, tương lai dường như rất tươi sáng cho điều trị TR qua đường ống thông, kỹ thuật đang lấp dần khoảng trống trong điều trị trước đây với nhu cầu ngày càng tăng và xóa bỏ dần câu chuyện về van ba lá – “van bị quên lãng”.
10 Theo dõi sau can thiệp
10.1 Theo dõi bệnh nhân sau can thiệp
Bệnh nhân được theo dõi các dấu hiệu lâm sàng sau khi kết thúc thủ thuật (nhịp tim, huyết áp …), nhằm phát hiện các tai biến như chảy máu, tụ máu vị trí chọc mạch, tràn máu màng tim, hở van ba lá tiến triển.
Bệnh nhân được dự phòng viêm nội tâm mạc nhiễm khuẩn.
Nếu bệnh nhân có nhịp xoang và không có chỉ định dùng thuốc chống đông khác kèm theo: sử dụng aspirin 100 – 325 mg/ngày trong 6-12 tháng và Clopidogrel 75 mg hàng ngày trong 30 ngày đầu.
10.2 Theo dõi bệnh nhân lâu dài
Bệnh nhân được khám lâm sàng, cận lâm sàng và siêu âm Doppler tim sau can thiệp van ba lá và tái khám theo định kỳ (1 tháng, 3 tháng, 6 tháng, 1 năm sau khi can thiệp và hàng năm sau đó).
Khi tái khám định kỳ bệnh nhân được khám lâm sàng, trả lời bộ câu hỏi đánh giá chất lượng sống, xét nghiệm cận lâm sàng (NT-proBNP, chức năng gan, thận), nghiệm pháp đi bộ 6 phút (6MWT), điện tâm đồ và siêu âm tim.
11 Tài liệu tham khảo
- Latib A, Mangieri A, Agricola E, et al. Percutaneous bicuspidalization of the tricuspid valve using the MitraClip system. Int J Cardiovasc Imaging. 2017;33(2):227–228.
- Dreyfus G.D, Martin P, Chan K.M, et al. Functional tricuspid regurgitation: a need to revise our understanding. J Am Coll Cardiol. 2015;65(21):2331–2336
- Sanz J, Sánchez-Quintana D, Bossone E, et al. Anatomy, function, and dysfunction of the right ventricle: JACC state-of-the-art review. J Am Coll Cardiol. 2019;73(12):1463–1482.
- Lurz P, Besler C, Noack T, et al. Transcatheter treatment of tricuspid regurgitation using edge-to-edge repair: procedural results, clinical implications and predictors of success. EuroIntervention. 2018;14(3):e290–e297. .
- Braun D, Orban M, Hagl C, et al. Transcatheter edge-to-edge repair for severe tricuspid regurgitation using the triple-orifice technique versus the bicuspidalization technique. JACC Cardiovasc Interv. 2018;11(17):1790–1792.
- Webb J.G, Wood D.A, Ye J, et al. Transcatheter valve-in-valve implantation for failed bioprosthetic heart valves. Circulation. 2010;121: 1848–1857.
- Mehr M, Taramasso M, Besler C, et al. 1-year outcomes after edge-to-edge valve repair for symptomatic tricuspid regurgitation: results from the TriValve Registry. JACC Cardiovasc Interv. 2019;12(15):1451–1461.
- Wang , Gao C., Kawashima H. et al. (2020) Valvular heart interventions: advances from 2019 to 2020. EuroIntervention; 16:808-823
- Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur J Cardiothorac Surg. 2021;60(4):727–
- McElhinney D.B., Cabalka A.K., Aboulhosn J.A., Eicken A. et al .Transcatheter Tricuspid Valve-in-Valve Implantation for the Treatment of Dysfunctional Surgical Bioprosthetic Valves. An International, Multicenter Registry Study. Circulation. 2016;133:1582–1593.
- Fam P, Ong G, Deva D.P, et al. Transfemoral transcatheter tricuspid valve replacement. JACC Cardiovasc Interv. 2020;13:e93–e94.
- Goldberg H, Ho E, Chau M, et al. Update on transcatheter tricuspid valve replacement therapies. Front Cardiovasc Med. 2021;8:619558.
- Ruparelia N, Mangieri A, Ancona M, et al. Percutaneous transcatheter treatment for tricuspid bioprosthesis failure. Catheter Cardiovasc Interv. 2016;88:994–1001.
- Cullen W, Cabalka A.K, Alli O.O, et al. Transvenous, antegrade melody valve-in-valve implantation for bioprosthetic mitral and tricuspid valve dysfunction: a case series in children and adults. JACC Cardiovasc.Interv. 2013;6:598–605.
- Kilic A, Saha-Chaudhuri P, Rankin S, et al. Trends and outcomes of tricuspid valve surgery in north america: an analysis of more than 50,000 patients from the society of thoracic surgeons database. The Ann Thorac Surg. 2013;96:1546– 1552.

