Can thiệp tổn thương chỗ chia nhánh động mạch vành
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn:
TS.BSNT. Lê Thanh Bình
ThS.BSNT. Đàm Trung Hiếu
PGS.TS.BS. Phạm Mạnh Hùng
Trungtamthuoc.com - Tổn thương chỗ chia nhỏ động mạch vành (ĐMV) là tình trạng tổn thương ĐMV xảy ra sát ngay và/hoặc bao gồm chỗ xuất phát của một nhánh bên quan trọng. Vậy cần phải can thiệp như thế nào để khắc phục được tổn thương đó? Hãy cùng Trung Tâm Thuốc Central Pharmacy tìm hiểu trong bài viết dưới đây.
1 Đại cương
Định nghĩa: Theo định nghĩa được Câu lạc bộ can thiệp chỗ chia nhánh động mạch vành châu Âu (European Bifurcation Club – EBC) đồng thuận, tổn thương chỗ chia nhánh động mạch vành (ĐMV) là “tình trạng tổn thương ĐMV xảy ra sát ngay và/hoặc bao gồm chỗ xuất phát của một nhánh bên quan trọng”.
Nhánh bên quan trọng là một nhánh mà bác sỹ không mong muốn bị mất đi trong bối cảnh chung của một bệnh nhân cụ thể (bao gồm triệu chứng, vị trí vùng thiếu máu, nhánh bên gây ra triệu chứng hoặc vùng thiếu máu, khả năng sống sót, tuần hoàn bàng hệ, chức năng thất trái).
Tổn thương chỗ chia nhánh ĐMV rất thường gặp, thấy ở khoảng 20% các trường hợp can thiệp ĐMV. Can thiệp tổn thương này luôn là một thách thức vì có nhiều nguy cơ như: mất nhánh bên, huyết khối sớm, đặc biệt là nguy cơ tái hẹp cao. Vì thế, khi gặp tổn thương này, điều đầu tiên bác sỹ lâm sàng luôn phải cân nhắc đó là lựa chọn chiến lược điều trị nào phù hợp hơn: Can thiệp động mạch vành qua da (PCI) hay bắc cầu nối chủ vành (CABG).
Trong quá khứ, trước khi có mặt stent phủ thuốc (DES), can thiệp tổn thương chỗ chia nhánh với stent kim loại thường (BMS) hoặc nong bóng đơn thuần thường có tỷ lệ thành công thấp, tỷ lệ biến chứng cao, tỷ lệ tái hẹp cao hơn. Mặc dù sự ra đời của DES đã làm giảm đáng kể tỷ lệ tái hẹp, tái can thiệp, tuy nhiên can thiệp tổn thương chỗ chia nhánh vẫn là một thách thức.
Trong hơn 10 năm qua, chiến lược nào tối ưu nhất trong can thiệp này vẫn là một đề tài còn nhiều tranh cãi. Nhìn chung, chiến lược chỉ đặt stent nhánh chính vẫn là lựa chọn ưu tiên, vì việc đặt stent vào cả hai nhánh một cách thường quy vẫn chưa chứng minh được lợi ích vượt trội.
2 Giải phẫu và hình thái tổn thương
2.1 Giải phẫu, sinh lý và mô bệnh học tổn thương chỗ chia nhánh động mạch vành
Giải phẫu chỗ chia nhánh động mạch vành: Mạch máu chỗ chia nhánh ĐMV bao gồm: nhánh chính đoạn gần (Proximal main vessel – PMV) là đoạn nhánh chính (Main vessel – MV) tính từ vùng cựa carina trở về trước, nhánh chính đoạn xa (Distal main vessel – DMV) là đoạn MV tính từ vùng cựa carina ra phía xa, SB là đoạn nhánh bên tính từ vùng cựa carina (hình 19.1).
.jpg)
Đường kính mạch máu: Đường kính mạch máu (cũng như lưu lượng dòng chảy qua nó) được chi phối bởi quy tắc 3 đường kính, tức là có mối liên quan giữa kích thước thật lòng mạch của PMV, DMV và SB. Mối liên quan này có thể được chi phối bởi các định luật như:
Định luật Murray: ({PMV}^3={DMV}^3 + {SB}^3)
Hoặc đơn giản là Định luật Finet trong đó kích thước của PMV bằng 2/3 của tổng DMV và SB (PMV=0,678{DMV+SB}).
Trong đó:
- PMV: Đường kính nhánh chính đoạn gần.
- DMV:Đường kính nhánh chính đoạn xa.
- SB: Đường kính nhánh bên.
Dòng chảy: Bên cạnh sự xuất hiện dòng chảy rối ở những vị trí MV chia ra SB, thì lưu lượng máu chảy qua chỗ chia nhánh ĐMV được chi phối bởi quy luật chia nhánh của cây mạch vành, có nghĩa là lưu lượng máu chảy vào SB có mối tương quan giữa đường kính SB, chiều dài SB và vùng cơ tim do SB này nuôi dưỡng. Như vậy, các mạch máu càng dài và đường kính càng lớn thì lưu lượng máu chảy qua chúng càng nhiều.
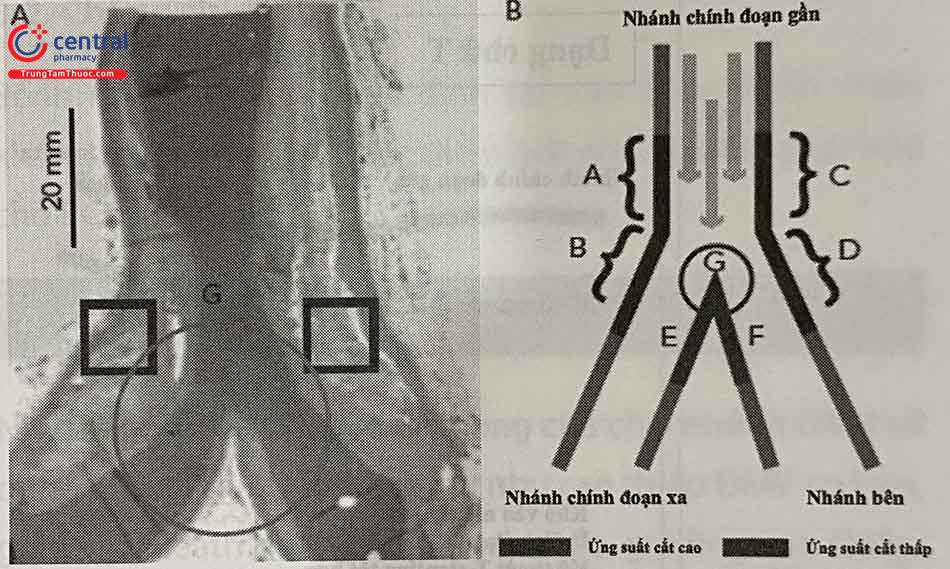
Sự phân bố mảng xơ vữa và sự hình thành huyết khối trên tổn thương chỗ chia nhánh ĐMV: Do sự thay đổi huyết động đột ngột xảy ra ở các điểm chia nhánh của cây mạch vành làm thúc đẩy quá trình hình thành mảng xơ vữa. Các tổn thương xơ vữa chỗ chia nhánh có xu hướng hình thành ở những vùng mà dòng chảy bị rối loạn, đặc biệt là ở những vùng ứng suất cắt thấp (low shear stress). Những vùng ứng suất cắt thấp được cho là làm thúc đẩy quá trình xơ vữa mạch máu, bao gồm thúc đẩy rối loạn chức năng tế bào nội mạch, gây tăng hấp thu các phân tử lipoprotein, rối loạn sự điều tiết các phân tử kết dính bạch cầu… tất cả những điều này góp phần vào sự phát triển và tiến triển của xơ vữa mạch vành.
.jpg)
(* Nguồn: theo Nakazawa G. và cộng sự. (2010)) Vùng A, B, C, D: Những vùng có ứng suất cắt thấp (low shear stress), thường gặp mảng xơ vữa. Vùng E, F: Các vùng ứng suất cắt cao (high shear stress), ít gặp mảng xơ vữa.
Sự phân bố các mảng xơ vữa cũng bị ảnh hưởng bởi góc xuất phát của nhánh bên, mảng xơ vữa hay lắng đọng về phía góc nhọn và cách xa góc tù. Vùng cựa carina chỗ chia nhánh (vùng G, hình 19.2) chịu ứng suất cắt cao và lưu lượng dòng chảy cao do đó thường ít gặp mảng xơ vữa nặng, tuy nhiên khi góc chia nhánh tăng lên (góc tù) hoặc tăng tỷ lệ kích thước giữa MV và SB hoặc có sự gập góc nhiều thì mảng xơ vữa sẽ xuất hiện ở vùng cựa carina nhiều hơn. Ngược lại, huyết khối stent muộn thường gặp ở những vùng chịu ứng suất cắt cao như vùng cựa carina, nơi hiện tượng tái tạo nội mạc xảy ra kém hơn.
Góc chia nhánh: Là góc được tạo ra giữa DMV và SB. Tổn thương chỗ chia nhánh có dạng chữ Y khi góc chia nhánh < 70° và có dạng chữ T khi góc chia nhánh > 70°. Khi tổn thương có dạng chữ Y, nguy cơ di lệch mảng xơ vữa hoặc di lệch vùng cựa carina chỗ chia nhánh gây ảnh hưởng dòng chảy SB trong quá trình đặt stent nhánh chính cao hơn so với tổn thương dạng chữ T (Hình 19.3), và sẽ khó về mặt kỹ thuật để bao phủ stent ở chỗ xuất phát của nhánh bên khi sử dụng kỹ thuật đặt stent chữ T ở những tổn thương này. Với tổn thương dạng chữ T, mặc dù nguy cơ tắc nhánh bên thấp nhưng việc đưa dây dẫn vào nhánh bên có thể gặp khó khăn khi gánh nặng xơ vữa lớn ở chỗ xuất phát của nhánh bên.
.jpg)
2.2 Phân loại tổn thương chỗ chia nhánh ĐMV
Để thuận tiện cho việc đánh giá tổn thương chỗ chia nhánh ĐMV cũng như việc lựa chọn chiến lược can thiệp tối ưu, cho đến nay trên thế giới đã có 6 phân loại cho tổn thương chỗ chia nhánh ĐMV, trong đó có 4 phân loại được đưa ra từ thời kỳ stent kim loại thường.
Căn cứ vào sự phân bố của mảng xơ vữa ở PMV (nhánh chính đoạn gần), DMV (nhánh chính đoạn xa) và SB (nhánh bên), các tác giả đã đưa ra các cách phân loại tổn thương chỗ chia nhánh ĐMV: phân loại của tác giả Sanborn, phân loại của tác giả Duke, phân loại của tác giả Lefevre, phân loại của Safian, phân loại của Medina, phân loại của Movahed. Trong đó cách phân loại của Medina hay được ứng dụng nhiều nhất trong thực hành lâm sàng do tính chất đơn giản, dễ nhớ và dễ ứng dụng. Do đó Câu lạc bộ EBC đã đưa ra đề xuất sử dụng phân loại của Medina trong đánh giá tổn thương chỗ chia nhánh ĐMV.
Medina A. và cộng sự đã sử dụng chữ số 0 và 1 để mô tả tổn thương chỗ chia nhánh ĐMV, số 0 tức là không có tổn thương hoặc tổn thương không đáng kể, số 1 là có tổn thương (hẹp > 50% đường kính). Và như vậy, với một tổn thương chỗ chia nhánh ĐMV, 3 số được ký hiệu cho 3 nhánh ĐMV, trong đó số thứ nhất mô tả tổn thương ở PMV, số thứ hai mô tả tổn thương ở DMV và chữ số thứ ba mô tả tổn thương ở SB.
.jpg)
Theo phân loại của Medina, tổn thương chỗ chia nhánh động mạch vành gồm:
- Type 1.1.1: tổn thương ở PMV, DMV và SB.
- Type 1.1.0: tổn thương ở PMV và DMV.
- Type 0.1: tổn thương ở PMV và SB.
- Type 0.1.1: tổn thương ở DMV và SB.
- Type 1.0.0: tổn thương chỉ ở PMV.
- Type 0.1.0: tổn thương chỉ ở DMV.
- Type 0.0.1: tổn thương chỉ ở SB.
Chú thích: PMV (nhánh chính đoạn gần), DMV (nhánh chính đoạn xa), SB (nhánh bên).
Bên cạnh ứng dụng phân loại tổn thương theo Medina, còn có phân loại: “tổn thương thực thụ chỗ chia nhánh ĐMV” (true bifurcation) và “tổn thương liên quan chỗ chia nhánh ĐMV” (non-true bifurcation). Tổn thương được coi là tổn thương thực thụ chỗ chia nhánh ĐMV khi cả MV và SB đều tổn thương đáng kể (hẹp ≥ 50% đường kính lòng mạch), còn tổn thương liên quan chỗ chia nhánh ĐMV thì tổn thương chỉ ở một nhánh (MV hoặc SB). Như vậy, tổn thương thực thụ chỗ chia nhánh ĐMV sẽ bao gồm các tổn thương: type 1.1.1; type 1.0.1 và type 0.1.1 theo phân loại của Medina.
Cùng với đặc điểm phân bố của mảng xơ vữa, một số yếu tố cũng góp phần quan trọng trong việc quyết định lựa chọn chiến lược can thiệp chỗ chia nhánh ĐMV đó là tương quan đường kính của PMV, DMV và SB, mức độ vôi hoá của ĐMV và đặc biệt là góc chia nhánh được tạo bởi DMV và SB.
3 Chỉ định và chống chỉ định
3.1 Chỉ định và lựa chọn bệnh nhân
Chỉ định can thiệp tổn thương chỗ chia nhánh ĐMV phải tuân theo các chỉ định tái tưới máu theo các khuyến cáo hiện hành của hội chứng vành cấp, hội chứng mạch vành mạn tính.
Quyết định lựa chọn giữa can thiệp động mạch vành qua da (PCI) hay phẫu thuật bắc cầu nối chủ vành (CABG) phải dựa vào nhiều yếu tố như: đặc điểm tổn thương giải phẫu, điểm SYNTAX; bệnh cảnh lâm sàng cụ thể, nguy cơ chảy máu; nguồn lực, kinh nghiệm của trung tâm và bác sĩ can thiệp; mong muốn của người bệnh…
3.2 Chống chỉ định
Bệnh nhân không có chỉ định tái tưới máu; bệnh nhân không đồng ý làm PCI; đặc điểm giải phẫu không phù hợp cho PCI.
4 Dụng cụ can thiệp
Nhìn chung, can thiệp tổn thương chỗ chia nhánh ĐMV sử dụng những dụng cụ tương tự như can thiệp ĐMV cơ bản, gồm có: sheath đường vào mạch máu, guiding can thiệp, wire can thiệp, bóng nong, stent, và có thể sử dụng một số dụng cụ hỗ trợ khác như: siêu âm trong lòng mạch (IVUS), dụng cụ khoan phá mảng xơ vữa… Cụ thể có một số điểm cần lưu ý như sau:
Lựa chọn guiding can thiệp: Phần lớn trường hợp có thể sử dụng guiding catheter 6Fr vì ưu tiên dùng chiến lược provisional stenting. Tuy nhiên, nếu chiến lược đặt stent cả 2 nhánh được đưa ra ngay từ đầu thì nên chọn guiding 7 hoặc 8Fr. Nếu còn nghi ngờ hay chỉ có thể quyết định chiến lược sau khi nong bóng, các tác giả khuyên nên sử dụng guiding 7 hoặc 8Fr ngay từ đầu. Bởi vì, với guiding 6Fr có thể đưa 2 bóng nhỏ vào cùng lúc, nhưng rất khó để đưa 2 stent vào cùng lúc để thực hiện kỹ thuật V stent hay kỹ thuật Crush.
Lựa chọn guidewire can thiệp: đối với nhánh chính, có thể dùng một wire mềm bất kỳ. Nếu dự định đặt stent nhánh chính phủ qua lỗ vào nhánh bên, khi đó wire tại nhánh bên sẽ trở thành wire kẹp (jailed wire), vì thế nên dùng wire ngậm nước ở nhánh bên để khi cần sẽ rút được jailed wire ra dễ dàng hơn. Khi cần lái lại wire vào nhánh bên qua mắt stent nhánh chính, lựa chọn wire ngậm nước cũng lái qua được thuận lợi hơn.
Lựa chọn stent: nên lựa chọn các loại stent phủ thuốc có thiết kế mắt stent mở, khi đó việc lái wire qua mắt stent dễ dàng hơn, đường kính lỗ vào nhánh bên được mở ra tối đa khi nong bóng qua mắt stent, tạo thuận cho việc đặt stent nhánh bên nếu cần.
5 Chiến lược chung tiếp cận can thiệp tổn thương chỗ chia nhánh động mach vành
5.1 Chiến lược chung
Hình 19.5 tổng kết chiến lược điều trị được khuyến nghị khi can thiệp chỗ chia nhánh. Nhìn chung, chiến lược chủ động đặt stent cả hai nhánh chỉ khi nhánh bên hẹp đáng kể, hẹp dài và diện tưới máu lớn.
Cách tiếp cận thường quy nhất vẫn là chỉ đặt stent nhánh chính, provisional stenting (chiến lược đặt 1 stent nhánh chính, dự phòng stent nhánh bên khi cần) đối với nhánh bên, theo các bước như sau:
- Lái 2 guidewire vào nhánh chính và nhánh bên.
- Nong bóng nhánh chính hoặc cả 2 nhánh nếu cần.
- Đặt stent nhánh chính.
- Tối ưu hóa đầu gần stent nhánh chính bằng kỹ thuật POT (proximal optimization technique). Tức là nong đầu gần nhánh chính cho đến chỗ cựa carina bằng bóng cỡ to hơn stent và bằng đường kính tham chiếu gần.
- Lái lại wire vào nhánh bên.
- Đưa bóng vào nhánh bên.
- Thực hiện kissing balloon với mức áp lực lên bóng trung bình (8 atm) tại nhánh bên.
- Sau kissing balloon, nếu kết quả đã thỏa mãn, làm lại POT.
- Nếu kết quả chưa thỏa mãn (hẹp tồn dư > 75%, lóc tách, dòng chảy TIMI < 3 ở nhánh bên có đường kính ≥ 2,5 mm hoặc FFR < 0,8) thì đặt stent nhánh bên.
Để bảo vệ nhánh bên cần chú ý: giữ guidewire ở nhánh bên cho đến khi đặt xong stent nhánh chính, lên bóng stent ở áp lực cao, hoặc nong bóng áp lực cao sau đặt stent. Khi rút jailed wire, cần chú ý tránh gây tổn thương lỗ vào mạch vành vì guiding có xu hướng bị kéo vào sâu khi rút jailed wire.
Khi lái lại wire vào nhánh bên, nên lái qua mắt xa của stent nhánh chính giúp tạo hình nhánh bên tối ưu hơn khi kiss- ing balloon. Để tạo thuận cho đường vào nhánh bên, nên thực hiện kỹ thuật POT, tối ưu hóa đoạn đầu stent nhánh chính đến carina bằng bóng ngắn, đường kính lớn sẽ giúp tạo thuận cho lái wire qua mắt xa của stent nhánh chính.
Sau khi đặt stent nhánh chính, nếu kết quả không thỏa đáng, có thể đặt stent nhánh bên theo các kỹ thuật T stent hay TAP stent, reverse crush hoặc culotte. Sau đó tiến hành kissing balloon 2 nhánh. Lựa chọn kỹ thuật phụ thuộc vào đặc điểm giải phẫu cụ thể và kinh nghiệm của bác sĩ can thiệp.
.jpg)
Chú thích: Provisional stenting (chiến lược đặt 1 stent nhánh chính, dự phòng stent nhánh bên khi cần ), PTCA (Percutaneous Transluminal Coronary Angioplasty): Nong bóng, mạch vành qua da dưới màn tăng sáng.
5.2 Tiếp cận can thiệp chỗ chia nhánh theo European Bifurcation Club (EBC)
Câu lạc bộ Bifurcation châu Âu (EBC) được thành lập năm 2004, với mục tiêu đưa ra những thuật ngữ chung để mô tả và điều trị tổn thương chỗ chia nhánh, và để trao đổi, chia sẻ kinh nghiệm, ý tưởng trong lĩnh vực này. Tóm tắt một số nội dung đã được thống nhất như sau:
Nên sử dụng phân loại MEDINA đối với tổn thương chỗ chia nhánh và phân loại MADS đối với các kỹ thuật đặt stent chỗ chia nhánh.
Provisional T stenting vẫn được coi là kỹ thuật tiêu chuẩn cho hầu hết trường hợp.
Đối với nhánh bên lớn, tổn thương lan tỏa từ cựa carina kéo dài > 5mm, có thể nên đặt stent cả hai nhánh.
Trong chiến lược provisional stenting, sau khi lái wire vào cả 2 nhánh, nên nong bóng nhánh chính trước khi đặt stent, đối với nhánh bên nếu tổn thương không dài (> 5mm) hoặc vôi hóa nặng thì không cần nong bóng thường
Đối với “true bifurcation”, wire nhánh bên nên được giữ lại trong khi lên bóng stent nhánh chính (jailed wire).
Lựa chọn đường kính stent nhánh chính theo đường kính đầu xa nhánh chính, sau đó nong bóng áp lực cao, hoặc kissing balloon để stent áp thành tốt ở đầu gần nhánh chính.
Sau khi đặt stent nhánh chính, nên dùng kỹ thuật POT (proximal optimization technique) để tối ưu hóa đầu gần: dùng một bóng ngắn nong áp lực cao từ đầu gần stent đến cựa Nên thực hiện POT trước khi lái lại wire vào nhánh bên để tạo thuận cho việc lái lại wire nhánh bên.
Chỉ định can thiệp nhánh bên nếu lỗ vào nhánh bên hẹp nặng hoặc dòng chảy nhánh bên hạn chế sau
Nên lái lại wire nhánh bên vào mắt xa của stent nhánh chính.
Đối với chiến lược provisional stenting, nên thực hiện “kissing balloon”. Đối với chiến lược đặt stent cả hai nhánh, kissing balloon là bắt buộc.
Sau khi “kissing balloon”, nên thực hiện POT để tối ưu hóa đầu gần stent nhánh chính, tránh biến dạng
Các biện pháp chẩn đoán hình ảnh nội mạch (IVUS, OCT) có giá trị hỗ trợ, đặc biệt trong trường hợp tổn thương phức tạp do hạn chế của chụp mạch đơn thuần.
6 Các kỹ thuật đặt Stent nhánh bên trong chiến lượcprovisional stenting
Sau khi đặt stent nhánh chính và nong bóng nhánh bên theo chiến lược provisional stenting, nếu kết quả không như mong đợi, chúng ta có thể đặt stent nhánh bên theo một trong các kỹ thuật sau:
6.1 Kỹ thuật T stent (hình 19.6)
Đây là kỹ thuật phổ biến nhất khi đặt stent nhánh bên từ chiến lược provisional stenting. Sau khi nong bóng stent nhánh chính và lỗ vào nhánh bên, stent thứ hai được đặt ở ngay lỗ vào nhánh bên sao cho stent nhánh bên không nhô vào nhánh chính nhưng phải tối thiểu hóa khoảng trống giữa stent nhánh bên và nhánh chính. Sau đó cần thực hiện kissing balloon lần thứ 2. Nhược điểm của kỹ thuật này là vẫn để lại một khoảng trống nhỏ giữa stent nhánh bên và stent nhánh chính, đây có thể là yếu tố dẫn đến dễ tái hẹp lỗ vào nhánh bên.
.jpg)
6.2 Kỹ thuật TAP (T stent and small protrusion)
Đây là một biến thể của kỹ thuật T stent, stent nhánh bên sẽ nhô vào nhánh chính tối thiểu. Kỹ thuật này được mô tả như sau:
Stent thứ hai được đưa vào nhánh bên sao cho đầu gần stent nhô vào trong nhánh chính ít nhất có thể (khoảng 1 hoặc 2mm).
Một quả bóng được đưa vào nhánh chính.
Lên bóng đồng thời ở cả stent nhánh bên và bóng nhánh chính (áp lực ≥ 12atm).
Xuống bóng đồng thời rồi rút bóng.
Mặc dù có những lo lắng về phần stent thò vào nhánh bên, nhưng chúng ta có thể làm IVUS ở nhánh chính và nhánh bên để kiểm tra. Một nghiên cứu theo dõi 95 bệnh nhân được thực hiện kỹ thuật TAP trong 3 năm cho thấy tỷ lệ các biến cố tim mạch chính (MACE) là 12,9%, và không có ca nào xuất hiện huyết khối trong stent.
6.3 Reverse/internal crush (kỹ thuật crush sau đặt stent nhánh chính) (hình 19.7)
Kỹ thuật này có mục đích để giảm tối thiểu khoảng trống giữa stent nhánh bên và stent nhánh chính. Có thể thực hiện kỹ thuật này qua guiding 6-Fr theo các bước sau:
Sau khi đặt stent nhánh chính, đưa stent thứ hai vào nhánh bên.
Đưa một quả bóng đường kính tương đương nhánh chính vào nhánh chính, đặt tại vị trí bifurcation, chú ý bóng phải nằm hoàn toàn trong stent nhánh chính.
Stent nhánh bên được rút nhô vào trong nhánh chính khoảng ≤ 3mm sau đó lên bóng stent. Rút bóng stent ra, sau đó chụp lại để loại trừ lóc tách đoạn xa (nếu cần đặt thêm stent đoạn xa). Nếu không có vấn đề gì ở đoạn xa, rút wire nhánh bên, sau đó lên bóng tại nhánh chính với áp lực cao (≥12atm).
Lái lại wire vào nhánh bên, sau đó nong bóng áp lực cao ở stent nhánh bên.
Thực hiện FKBI (final kissing balloon inflation).
Trong thực hành, kỹ thuật này đã gần như thay thế hoàn toàn kỹ thuật TAP.
.jpg)
6.4 Kỹ thuật provisional cullote: kỹ thuật cullote có thể được thực hiện trong chiến lược provisional stenting khi chỗ chia nhánh có dạng chữ Y, theo các bước sau
Sau khi đặt stent nhánh chính, stent thứ hai được đưa vào nhánh bên sao cho đầu gần stent nhánh bên nhô hẳn vào nhánh chính và chồng lấp với đầu gần stent nhánh
chính. Rút guidewire ở nhánh chính, sau đó lên stent nhánh bên.
Lái wire lại vào nhánh chính qua mắt stent, sau đó nong bóng.
Cuối cùng, thực hiện FKBI (nong bóng kissing).
Hình 19.8 minh họa một ca can thiệp thực tế sử dụng kỹ thuật Provisional cullote
.jpg)
(1, 2): tổn thương hẹp nặng LM-LAD-LCX tại chỗ chia nhánh, phân loại Medina 1,1,1.
(3) : đặt 1 stent vào LM-LAD sau khi nong bóng LM-LAD và LM-LCX.
(4): hẹp khít lỗ vào LCX sau đặt stent LM-LAD.
(5): lái lại wire vào LCX và nong bóng mở mắt bên LCX.
(6): đặt 1 stent vào LM-LCX.
(7): lái wire vào LAD sau đó thực hiện kissing balloon tại chỗ chia nhánh.
(8): thực hiện POT tại LM.
(9, 10): kết quả sau can thiệp.
Chú thích viết tắt: LM: Thân chung động mạch vành trái; LAD: Động mạch liên thất trước; LCX: Động mạch mũ. POT (proximal optimization technique): Kỹ thuật tối ưu hóa đầu gần.
6.5 Vai trò của Final kissing balloon inflation (FKBI)
FKBI nên được thực hiện sau khi nong bóng lỗ vào nhánh bên qua mắt stent nhánh chính, với mục đích hạn chế biến dạng stent nhánh chính và tạo hình tối ưu lỗ vào nhánh bên. Tuy nhiên, lợi ích lâu dài của FKBI (trong trường hợp chỉ đặt stent nhánh chính) vẫn chưa được chứng minh. Các nghiên cứu NORDIC III, CORPAL-KISS và COBIS registry đã khẳng định điều này. Mặc dù vậy trong nghiên cứu NOR- DIC III ta vẫn thấy tỷ lệ tái hẹp nhánh bên theo dõi sau 8 tháng thấp hơn ở nhóm làm FKBI đối với tổn thương “true bifurcation”.
Một nghiên cứu phân nhóm ngẫu nhiên so sánh ảnh hưởng của việc can thiệp dưới hướng dẫn FFR so với chụp mạch đơn thuần trong quyết định điều trị nhánh bên ở 320 bệnh nhân can thiệp chỗ chia nhánh theo chiến lược provisional stenting, kết quả là tỷ lệ nong bóng hoặc đặt stent nhánh bên có xu hướng ít hơn ở nhóm có hướng dẫn của FFR, trong khi không có sự khác biệt về tỷ lệ các biến cố tim mạch chính (MACE) hay phải tái thông mạch đích (TVR) sau 1 năm.
Một vài tiêu chuẩn để quyết định làm FKBI nhánh bên được đưa ra là: hẹp > 75% đường kính nhánh bên, dòng chảy TIMI < 3, hoặc FFR < 0,8. Qua đó, có 2 chiến lược phù hợp được đưa ra đó là: hoặc thăm dò FFR nhánh bên để quyết định, hoặc làm FKBI ở tất cả các trường hợp có hẹp nghiêm trọng lỗ vào nhánh bên trên chụp mạch. Đáng chú ý là, theo nghiên cứu NORDIC III, không có hậu quả nghiêm trọng nào thì thực hiện FKBI thường quy. Một cách đơn giản hơn để thay thế FKBI đó là nong bóng lần lượt nhánh chính – nhánh bên – nhánh chính cũng cho hiệu quả tương đương. Do đó, chúng tôi khuyến khích làm FKBI cho chiến lược provisional stenting.
7 Chiến lược đặt Stent cả hai nhánh
Chiến lược đặt stent cả 2 nhánh chỉ dành cho một số trường hợp “true bifurcation” cụ thể, dựa trên một số yếu tố sau:
Kích thước và diện tưới máu của nhánh bên. Về giải phẫu, có nhiều trường hợp nhánh bên quan trọng tương đương nhánh chính về cả đường kính và diện tưới máu. Một số ví dụ như: thân chung động mạch vành trái (LM) chia ra nhánh động mạch liên thất trước (LAD) và động mạch mũ (LCX), động mạch vành phải (RCA) ưu năng chia ra nhánh PDA và nhánh PLV, động mạch mũ (LCX)
ưu năng chia ra đoạn xa LCX và nhánh bờ bên (OM) lớn. Kích thước và diện tưới máu nhánh bên sẽ quyết định việc có cần phải stent nhánh bên hay không khi nhánh bên hẹp đáng kể.
Chiều dài đoạn hẹp nhánh bên tính từ lỗ vào nhánh bên. Nếu độ dài này đáng kể, có thể cần cân nhắc đặt stent nhánh bên.
Góc giữa nhánh bên – nhánh chính và mức độ hẹp của lỗ vào nhánh bên.
Góc xuất phát của nhánh bên có thể là góc nhọn, gần như vuông góc, hoặc góc tù. Góc này càng hẹp thì nguy cơ mảng xơ vữa chèn ép vào lỗ vào nhánh bên càng lớn. Liên quan đến góc giữa 2 nhánh còn có mức độ khó khi lái lại wire vào nhánh bên sau khi đặt stent nhánh chính. Một số yếu tố khác ảnh hưởng đến quyết định đặt stent cả 2 nhánh đó là: mức độ hẹp nặng của lỗ vào nhánh bên, tình trạng nhánh bên sau khi nong bóng cả nhánh bên và nhánh chính.
Một điều quan trọng cần nhớ đó là, nếu chúng ta chọn chiến lược chỉ đặt stent nhánh chính, nhưng sau đó kết quả tại nhánh bên không như mong muốn, chúng ta vẫn luôn có thể đặt thêm một stent tại nhánh bên.
7.1 Các kỹ thuật đặt stent cả hai nhánh
7.1.1 Kỹ thuật Culotte
Kỹ thuật Culotte (Hình 19.9) giúp che phủ toàn bộ chỗ chia nhánh bằng khung stent, tuy nhiên đổi lại thì có tới 2 lớp stent ở đầu gần nhánh chính. Đây có thể là kỹ thuật giúp che phủ carina tốt nhất. Nghiên cứu NORDIC so sánh giữa hai kỹ thuật Culotte và Crush sử dụng stent phủ thuốc Sirolimus cho kết quả: không có sự khác biệt giữa hai nhóm khi theo dõi sau 6 tháng về tử vong, nhồi máu cơ tim hoặc phải tái thông mạch vành. Kết cục lâm sàng cũng tương tự khi theo dõi sau 3 năm.
Mô tả kỹ thuật:
Bước 1: Lái guidewire và nong bóng cả hai nhánh.
Bước 2: Đặt stent tại nhánh gập góc hơn trước, thường là nhánh bên, sau đó thực hiện kỹ thuật POT (proximal optimization technique) để tối ưu hóa đầu gần.
Bước 3: Lái wire lại qua mắt stent vào nhánh chưa được đặt stent rồi nong bóng mở mắt.
Bước 4: Đưa stent thứ hai vào nhánh chưa được đặt stent, thường là nhánh chính, sao cho đầu gần của 2 stent chồng lên nhau, sau đó lên bóng stent.
Bước 5: Cuối cùng thực hiện kissing balloon và POT.
Kỹ thuật này phù hợp với mọi kiểu góc xuất phát của nhánh bên và cho phép che phủ gần như hoàn hảo lỗ vào nhánh bên. Nhược điểm gồm có: lớp kim loại dày với 2 lớp stent tại carina và đầu gần nhánh chính; việc lái lại wire qua mắt stent vào các nhánh có thể gặp khó khăn và mất nhiều thời gian, thực hiện POT sau mỗi lần đặt stent có thể tạo thuận cho việc lái lại wire.
.jpg)
Chú thích: FKBI (Final kissing balloon inflation): Nong bóng kissing.
7.1.2 Kỹ thuật Mini-Crush (stent nhánh bên được đập dập bởi stent nhánh chính)
Kỹ thuật Crush (hình 19.10) ra đời từ khi có sẵn các loại stent phủ thuốc. Từ “mini” được thêm vào để nhấn mạnh việc phải giảm tối thiểu phần chồng lấp giữa stent nhánh bên và stent nhánh chính. Từ khi FKBI được thực hiện thường quy, tỷ lệ tái hẹp ở lỗ vào nhánh bên đã giảm đáng kể.
Ưu điểm chính của kỹ thuật này là sự thông suốt của cả 2 nhánh được đảm bảo trong quá trình can thiệp. Điều này đặc biệt có ý nghĩa khi nhánh bên quan trọng và khó lái wire. Bất lợi chính của kỹ thuật này là khá khó khăn để thực hiện FKBI khi phải lái lại wire và đưa bóng qua nhiều lớp mắt stent tại lỗ vào nhánh bên.
Để thực hiện kỹ thuật Crush tiêu chuẩn cần dùng guiding catheter 7-8 Fr.
Mô tả kỹ thuật:
Bước 1: Lái wire vào cả 2 nhánh rồi nong bóng. Lưu ý nhớ luôn phải nong bóng nhánh bên để mở rộng lỗ vào nhánh bên, nếu cần thiết có thể dùng cutting balloon ngắn khoảng 6mm.
Bước 2: Đưa một stent vào nhánh bên trước, sau đó đưa một stent vào nhánh chính.
Bước 3: Kéo stent nhánh bên vào trong nhánh chính khoảng 2-3 mm. Cần xác định rõ bởi ít nhất 2 góc chụp.
Bước 4: Lên stent ở nhánh bên trước với áp lực tối thiểu 12 atm. Xuống bóng và rút bóng khỏi guiding. Chụp lại để xác định tình trạng nhánh bên sau đặt stent. Nếu kết quả
thỏa đáng (dòng chảy tốt, không có lóc tách đoạn xa…) và không cần đặt thêm stent nhánh bên thì rút wire nhánh bên. Sau đó lên stent nhánh chính với áp lực cao (≥ 12 atm) và tối ưu hóa bằng POT (proximal optimization technique). Chụp lại xác định kết quả.
Bước 5: Lái lại wire vào nhánh bên. Đây có thể là thao tác khó khăn vì phải lái wire qua nhiều lớp stent. Nên sử dụng các wire mềm, ngậm nước. Sau đó nên dùng bóng nhỏ (1,25 – 1,5 mm) để đẩy qua mắt stent trước. Nếu ngay cả bóng nhỏ cũng không đẩy qua được thì nên lái lại wire qua mắt stent khác. Sau đó, nên nong bóng áp lực cao tại nhánh bên.
Bước 6: Một quả bóng thứ hai được đưa vào nhánh chính, sau đó thực hiện kissing balloon với áp lực ≥ 8 atm.
.jpg)
7.1.3 Kỹ thuật Step Crush và Double-Kissing Crush
Khi chiến lược đặt stent cả hai nhánh được đặt ra mà chỉ có thể thực hiện với guiding catheter 6Fr (tiếp cận đường động mạch quay), có thể thực hiện kỹ thuật “step crush” hoặc “modified balloon crush”. Kết quả cuối cùng tương tự với kỹ thuật crush tiêu chuẩn, chỉ khác là từng stent sẽ được đẩy vào đặt riêng rẽ. Các kỹ thuật DK-crush và “sleeve technique” là các biến thể khác của kỹ thuật crush.
Trong một nghiên cứu có đối chứng ngẫu nhiên theo dõi trong vòng 12 tháng, tỷ lệ phải tái can thiệp mạch đích của nhóm sử dụng kỹ thuật DK-crush thấp hơn so với nhóm thực hiện provisional stenting. Một nghiên cứu khác ở bệnh nhân can thiệp “true bifurcation” đoạn xa LM cho thấy nhóm sử dụng kỹ thuật DK-crush cũng làm giảm các biến cố liên quan đến mạch đích so với nhóm provisional stenting.
Mô tả kỹ thuật:
Bước 1: Lái wire vào cả 2 nhánh rồi nong bóng. Lưu ý nhớ
luôn phải nong bóng nhánh bên để mở rộng lỗ vào nhánh bên, nếu cần thiết có thể dùng cutting balloon ngắn khoảng 6mm.
Bước 2: Đưa một stent vào nhánh bên trước sao cho đầu gần của stent nhô vào trong lòng nhánh chính khoảng vài mm. Đưa một bóng áp lực cao vào nhánh chính ở vị trí ngang qua chỗ chia nhánh.
Bước 3: Lên stent nhánh bên, rút bóng stent, chụp lại, nếu kết quả tốt thì rút wire nhánh bên. Sau đó lên bóng nhánh chính để đập dập đầu stent nhánh bên rồi rút bóng. Có thể thực hiện kissing balloon tại bước này (kỹ thuật DK-crush).
Bước 4: Stent thứ hai được đưa vào nhánh chính và lên stent ở áp lực ≥ 12atm.
Các bước tiếp theo tương tự với kỹ thuật crush tiêu chuẩn, gồm lái lại wire vào nhánh bên, nong nhánh bên và FKBI.
7.1.4 Kỹ thuật V stent và simultaneous kissing stent (SKS)
.jpg)
Kỹ thuật V stent và SKS (Hình 19.11) được thực hiện bằng việc đưa 2 stent vào và lên stent đồng thời. Một stent được đưa vào nhánh chính, một stent vào nhánh bên. Trong kỹ thuật V stent, cả 2 stent được kéo lại để tạo thành cựa carina mới càng gần với carina tự nhiên càng tốt. Ưu điểm chính của kỹ thuật này là luôn giữ được đường vào cho cả 2 nhánh, và không cần phải lái lại wire qua các mắt stent để thực hiện FKBI. Trong kỹ thuật SKS, hai stent được kéo vào đầu gần nhánh chính nhiều hơn tạo carina mới cách xa carina tự nhiên hơn. Chúng tôi ưu tiên lựa chọn kỹ thuật V stent với tổn thương thuộc phân loại Medina 0,1,1. Nếu có tổn thương hẹp cả ở đầu gần nhánh chính, nên lựa chọn chiến lược khác hơn là kỹ thuật SKS.
Mô tả kỹ thuật:
Bước 1: Lái guidewire vào cả 2 nhánh và nong bóng tối ưu, mục đích để khi đặt stent áp thành tốt nhất.
Bước 2: Hai stent được đưa vào từng nhánh sao cho cả 2 stent đều nhô ít nhất vào đầu gần nhánh chính. Đường kính stent được chọn dựa vào đường kính của mạch được đặt stent. Mức độ nhô vào nhánh chính có thể tùy theo kinh nghiệm phẫu thuật viên, đôi khi có thể nhô vào ≥ 5 mm (kỹ thuật SKS). Đôi khi có thể phải đẩy stent thứ nhất xa hơn một chút để tạo thuận cho việc đẩy stent thứ hai. Điều này đặc biệt cần thiết khi đặt 3 stent kissing ở chỗ chia ba (cần dùng guiding catheter 9-Fr). Cần chụp tối thiểu hai góc khác nhau để xác định vị trí stent đã chính xác chưa trước khi lên stent.
Bước 3: Lên bóng đồng thời cả 2 stent. Trong trường hợp đường kính tham chiếu của đầu gần nhánh chính tương đối nhỏ và phẫu thuật viên lo ngại nguy cơ quá cỡ khi thực hiện kissing stent, có thể lên stent ở áp lực thấp (4 atm).
Kỹ thuật V stent phù hợp với tổn thương chia nhánh mà đầu gần nhánh chính không có xơ vữa và không cần phải đặt thêm stent ở đầu gần, ví dụ chỗ chia nhánh của LM ngắn và không có xơ vữa, lý tưởng nhất là góc giữa 2 nhánh < 90O.
7.1.5 Kỹ thuật Y stent và “Skirt technique”
Kỹ thuật Y stent có giá trị lịch sử đặc biệt vì nó là kỹ thuật đặt stent chỗ chia nhánh đầu tiên được trình diễn trong một khóa live case. Kỹ thuật này gồm các bước: lái wire vào cả 2 nhánh và nong bóng, sau đó đặt stent từng nhánh tại lỗ vào. Nếu kết quả chưa thỏa đáng, stent thứ 3 sẽ được đặt tại nhánh chính. Để stent nhánh chính này gắn gần được với 2 stent nhánh bên, cần sử dụng “skirt technique”, stent cuộn trên 2 quả bóng song song, đẩy hệ thống trượt trên 2 wire của 2 nhánh, đến khi hệ thống chạm đến carina thì lên stent bằng cách lên cả 2 bóng đồng thời. Kỹ thuật này là phương pháp cuối cùng để can thiệp những tổn thương chia nhánh khó mà bắt buộc luôn phải giữ đường vào cả 2 nhánh.
Bảng 19.1. Tổng kết những kỹ thuật đặt stent chỗ chia nhánh phổ biến nhất
| T/TAP | Mini-Crush | Culotte | SKS | |
|---|---|---|---|---|
| Guiding catheter (Fr) | 6 | 7 | 6 | 7 |
| Provisional stenting nhánh bên | Có | Không | Có thể | Không |
| Duy trì được wire ở nhánh chính | Có | Có | Không | Có |
| Duy trì được wire ở nhánh bên | Không | Không | Không | Có |
| Góc chia nhánh: | ||||
| <700 | Không lý tưởng | Lý tưởng | Phù hợp | Phù hợp |
| >700 | Lý tưởng | Không lý tưởng | Không lý tưởng | Không lý tưởng |
| Đường kính nhánh bên và nhánh chính: | ||||
| Tương đương nhau | Phù hợp | Phù hợp | Lý tưởng | Lý tưởng |
| Chênh lệch nhau | Phù hợp | Lý tưởng | Không lý tưởng | Lý tưởng |
Lưu ý: Guiding 6Fr có thể dùng trong kỹ thuật step-crush hoặc double kissing-crush. Chú thích: TAP: (T stent and small protrusion); SKS: simultaneous kissing stent.
8 Một số lưu ý trong can thiệp chỗ chia nhánh
8.1 Tổn thương đơn độc lỗ vào LAD hoặc LCX
8.1.1 Tiếp cận tổn thương lỗ vào LAD
Tổn thương LM phân loại 0,1,0 (lỗ vào LAD) trước đây được coi là không phù hợp để làm PCI vì kỹ thuật khó khăn và tiềm ẩn nhiều nguy cơ biến chứng. Hai chiến lược thường được sử dụng đối với tổn thương này là: đặt stent chính xác tại lỗ vào LAD hoặc đặt stent phủ qua cả LM-LAD.
Nên dùng IVUS hướng dẫn để đánh giá chính xác phân bố mảng xơ vữa trước khi quyết định dùng chiến lược can thiệp nào. Đặt stent chính xác lỗ vào LAD phù hợp khi góc chia nhánh rộng và trên IVUS không thấy xơ vữa tại đoạn xa LM. Khi đặt stent lỗ vào LAD, đầu gần stent cần nhô vào carina một chút để phủ hết lỗ vào LAD, nếu cần có thể dùng IVUS hướng dẫn để xác định chính xác vị trí đầu stent.
Một số nhược điểm của kỹ thuật đặt stent lỗ vào LAD:
nếu stent nhô ra đầu gần quá nhiều thì sẽ vào LM, chèn vào lỗ vào LCX và gây khó khăn nếu cần tái can thiệp;
nếu stent không phủ hết lỗ vào LAD, có thể gây chùn stent cấp và tái hẹp muộn. Vì thế yếu tố quan trọng hàng đầu là vị trí stent phải chính xác. Hơn nữa, tổn thương tại lỗ vào LAD hoặc LCX thường kèm theo tổn thương đoạn xa LM, vì thế luôn có nguy cơ stent không phủ hết tổn thương. Do đó, nhiều người ủng hộ quan điểm khi can thiệp lỗ vào LAD hay LCX thì nên đặt stent phủ từ LM đến nhánh bị tổn thương theo chiến lược provisional
b. Tiếp cận tổn thương bifurcation đơn độc tại lỗ vào nhánh bên, phân loại Medina 0,0,1 (tổn thương lỗ vào nhánh Diagonal/ OM/ PLV)
Hẹp lỗ vào các nhánh bên trên đặc biệt quan trọng bởi nó còn có nguy cơ trở thành nguồn gốc của tổn thương mới ở nhánh chính. Tổn thương đơn độc lỗ vào nhánh bên (Medina 0,0,1) dù không phổ biến nhưng lại là một thách thức điều trị. Chúng ta nên nhớ rằng, việc can thiệp quá tích cực tổn thương này không phải lúc nào cũng là cách tiếp cận tốt nhất, vì có thể gây tổn thương hẹp tại nhánh chính. Thật không may, chưa có biện pháp nào được coi là tốt nhất cho tổn thương này. Đôi khi, có thể can thiệp tối thiểu bằng nong bóng cutting balloon tại lỗ vào nhánh bên.
Brunel và cộng sự đã phát triển một kỹ thuật để điều trị tổn thương Medina 0,0,1 dựa trên kỹ thuật provisional T stenting. Stent được đặt từ đầu gần nhánh chính vào nhánh bên, sau đó mở mắt stent ở đầu xa nhánh chính và thực hiện kissing balloon.
Một số cách tiếp cận khác như: đặt 1 stent chính xác tại lỗ vào nhánh bên (thường áp dụng khi góc chia nhánh 90o), hoặc shunt technique, hoặc dùng dedicated stents.
Chúng ta có thể sử dụng đo phân suất dự trữ lưu lượng vành (FFR) để đánh giá mức độ ảnh hưởng về chức năng của tổn thương lỗ vào nhánh bên, và không bao giờ quên điều trị nội khoa tối ưu luôn là một cách tiếp cận hợp lý.
8.2 Một số loại stent chuyên dụng trong can thiệp chỗ chia nhánh động mạch vành
Các kỹ thuật can thiệp tổn thương chỗ chia nhánh truyền thống vẫn có một số hạn chế, ví dụ không duy trì được đường vào nhánh bên trong suốt thủ thuật, khó lái lại guidewire và đẩy bóng/stent qua mắt stent vào nhánh bên, biến dạng stent nhánh chính khi nong bóng nhánh bên, stent không phủ hết lỗ vào nhánh bên, cuối cùng là phụ thuộc nhiều vào kinh nghiệm và kỹ năng của phẫu thuật viên. Ưu điểm chính của các loại stent chuyên dụng là trong suốt thủ thuật, phẫu thuật viên sẽ không phải lái lại wire. Nói chung, stent chuyên dụng có thể chia thành các nhóm sau:
Stent đặt vào nhánh chính, tạo thuận hoặc duy trì đường vào nhánh bên sau khi đặt stent nhánh chính mà không cần lái lại wire qua mắt stent nhánh chính. Những stent này cho phép đặt thêm stent vào nhánh bên nếu cần. Ví dụ: Petal, AST stent (Boston Scientific); Invatec Twin-Rail (Medtronic); Nile Croco/Pax (Minvasys); Antares (Trireme Medical); Y-Med Sidekick (Y-Med); Stentys (Stentys SAS).
Nhóm stent mà sau khi đặt thường vẫn cần phải đặt thêm stent khác ở chỗ chia nhánh Ví dụ: Axxess Plus (Devax); Sideguard (Cappella); Tryton (Tryton Medical). Stent Tryton và Sideguard được thiết kế để can thiệp nhánh bên trước rồi mới đặt stent nhánh chính, sau đó vẫn phải lái lại wire vào nhánh bên qua mắt stent nhánh chính để thực hiện FKBI. Stent Axxess Plus được thiết kế để đặt tại đầu gần nhánh chính ngay tại vị trí cựa carina, không cần phải lái lại wire vào nhánh bên, nhưng có thể cần phải đặt thêm 2 stent ở đầu xa của nhánh chính và nhánh bên để phủ toàn bộ tổn thương chỗ chia nhánh.
Hầu hết các loại stent này chưa được kiểm chứng bởi các nghiên cứu có đối chứng ngẫu nhiên, trừ stent Tryton được so sánh với chiến lược provisional stenting trong thử nghiệm TRYTON IDE. Đây là một thử nghiệm lâm sàng có đối chứng ngẫu nhiên. Tuy nhiên kết quả của nghiên cứu không chứng minh được chiến lược đặt stent Tryton ở nhánh bên sau đó đặt thêm một stent nhánh chính không kém hơn so với chiến lược chỉ đặt stent nhánh chính và provisional stenting nhánh bên (cộng gộp các biến cố liên quan đến mạch đích của nhóm provisional stenting là 12,8%, của nhóm dùng stent Tryton là 17,4%). Tuy vậy, phân tích dưới nhóm gợi ý stent này an toàn và hiệu quả khi can thiệp nhánh bên lớn.
Các loại stent chuyên dụng can thiệp chỗ chia nhánh có thể tiềm năng để giải quyết các giới hạn của stent truyền thống trong can thiệp chỗ chia nhánh. Tuy nhiên, vào thời điểm hiện tại, vẫn chưa có stent chuyên dụng nào có đủ bằng chứng thách thức được chiến lược provisional T stenting truyền thống.
8.3 Vai trò của các thủ thuật hỗ trợ
8.3.1 Chẩn đoán hình ảnh trong lòng mạch vành
Câu lạc bộ EBC khuyến cáo sử dụng siêu âm trong lòng mạch (IVUS) cho hầu hết các ca can thiệp LM vì có một số phân tích gộp chỉ ra lợi ích vượt trội khi can thiệp LM dưới hướng dẫn IVUS so với hướng dẫn chụp mạch đơn thuần, đặc biệt là khi can thiệp chỗ chia nhánh đoạn xa LM với chiến lược đặt stent cả hai nhánh. Năm 2018, Đồng thuận của EBC về sử dụng hướng dẫn của IVUS cho đánh giá và điều trị tổn thương ở LM đã được phát hành. Những thông điệp chính của Đồng thuận này gồm có:
- Mảng xơ vữa thường lan tỏa ở LM và thường khó đánh giá được đầy đủ khi chỉ dựa vào hình ảnh chụp mạch.
- Mảng xơ vữa đơn độc tại lỗ vào LAD trên chụp mạch chỉ chiếm khoảng 9% các trường hợp, trong khi nếu phối hợp thêm các biện pháp chẩn đoán hình ảnh nâng cao, chúng ta thấy trên 90% trường hợp có mảng xơ vữa liên tục từ đoạn gần LAD vào
- Nếu có sự khác nhau trong kết quả đo diện tích lòng mạch tối thiểu (MLA) của LM trên IVUS khi pull-back từ LAD và LCX, kết quả MLA nhỏ nhất được coi là chính xác hơn.
- Những thông tin từ IVUS có thể phục vụ cho những bước lập kế hoạch can thiệp sau:
- Đánh giá nguy cơ ảnh hưởng đến nhánh bên, tổn thương đoạn gần, đoạn xa cũng như lỗ vào nhánh bên, những dấu hiệu dự báo sự dịch chuyển carina trầm trọng đè vào nhánh bên như dấu hiệu “lông mày”, mạch vôi hóa nặng.
- Quyết định đường kính và chiều dài
- Đánh giá đường kính tham chiếu tối ưu ở đoạn đầu LM, chiều dài đoạn từ carina đến rìa đầu gần của
- Sau khi đặt stent nhánh chính, IVUS có thể giúp hướng dẫn tối ưu hóa kết quả cuối cùng:
- Phát hiện hẹp ở rìa stent hoặc lóc tách mạch vành (trên chụp mạch có thể không phát hiện ra).
- Đánh giá stent nhánh chính đã nở tốt và áp thành tốt chưa.
- Kiểm soát việc lái lại wire vào nhánh bên (kiểm tra vị trí wire có đi dưới nội mạc hay không).
- Trong trường hợp có đặt stent nhánh bên, đánh giá stent nhánh bên đã nở tốt và áp thành tốt chưa, đặc biệt là tại lỗ vào nhánh bên.
- Loại trừ tình trạng biến dạng stent.
8.3.2 Khoan phá mảng xơ vữa
Khoan phá mảng xơ vữa có vai trò quan trọng giúp stent nở tối ưu với những tổn thương mạch vành vôi hóa nặng tại nội mạc. Ngay cả khi chưa có dữ liệu liên quan đến vai trò của kỹ thuật này với stent phủ thuốc, về cảm quan chúng tôi vẫn cho rằng khoan phá mảng xơ vữa giúp stent nở tối ưu và cân đối. Điều này chỉ đạt được nếu tổn thương vôi hóa nặng được chuẩn bị tốt.
Điểm còn tranh cãi là khi nào một tổn thương vôi hóa cần chuẩn bị bằng khoan phá mảng xơ vữa, và ngược lại, khi nào chỉ cần nong bóng áp lực cao là đủ. Hiện tại chưa có đủ các bằng chứng khoa học để đưa ra khuyến cáo. Quyết định vẫn phụ thuộc vào kinh nghiệm của phẫu thuật viên. Kích thước đầu khoan thường nhỏ, với mục đích làm giảm mảng xơ vữa, giảm tối thiểu nguy cơ kẹt đầu khoan.
Theo kinh nghiệm của chúng tôi, stent nhánh bên nở không tốt do tổn thương chưa được chuẩn bị đầy đủ là nguyên nhân chính dẫn đến tái hẹp tại lỗ vào nhánh bên.
8.3.3 Cutting balloon và scoring balloon
Tổn thương lý tưởng cho loại dụng cụ này là tổn thương hẹp tại lỗ vào nhánh bên với mảng xơ vữa do thành phần xơ là chính. Thử nghiệm lâm sàng có đối chứng ngẫu nhiên REDUCE III so sánh vai trò của nong bóng cutting balloon trước đặt stent so với nong bóng tiêu chuẩn. Kết quả của nghiên cứu cho thấy tỷ lệ tái hẹp thấp hơn và đường kính lòng mạch sau can thiệp lớn hơn ở nhóm dùng cutting balloon, qua đó gợi ý ưu điểm chính của cutting balloon là giúp stent nở tốt hơn.
Chúng tôi khuyến cáo nên dùng cutting balloon trong một số trường hợp chọn lọc với tổn thương vôi hóa trung bình và tổn thương xơ hóa, đặc biệt là tại vị trí lỗ vào nhánh bên. Một sự lựa chọn khác đó là dùng scoring balloon AngioSculpt để chuẩn bị tổn thương. Khi nong bóng này, các sợi nitinol xoắn quanh bóng sẽ khía vào tổn thương xơ – vôi, giúp ổn định vị trí bóng, tránh trượt bóng, giảm nguy cơ lóc tách mạch vành. Trong can thiệp “true bifurcation” phức tạp, kết quả của thử nghiệm AGILITY ủng hộ cho chiến lược provisional stenting, đặt stent nhánh chính sau khi nong nhánh bên với scoring balloon.
9 Tiêu chí đánh giá thành công của thủ thuật
Tiêu chí thành công về hình ảnh chụp mạch:
Nhánh chính hẹp tồn dư < 10%, dòng chảy TIMI 3, không có lóc tách trước và sau
Nếu không đặt stent nhánh bên: lỗ vào nhánh bên hẹp tồn dư < 75%, dòng chảy TIMI 3, không có lóc tách, không có huyết khối.
Tiêu chí thành công về thủ thuật: Thành công về hình ảnh chụp mạch kèm theo không có biến cố lâm sàng lớn tại viện (tử vong, nhồi máu cơ tim, phẫu thuật bắc cầu chủ vành cấp cứu).
10 Biến chứng và xử trí
Nhìn chung, can thiệp tổn thương chỗ chia nhánh ĐMV có thể gặp các biến chứng như trong can thiệp ĐMV cơ bản (Tham khảo Chương 17: Can thiệp động mạch vành cơ bản, và Chương 25: Các biến chứng của can thiệp động mạch vành và xử trí).
Ngoài ra, một biến chứng đặc trưng trong can thiệp tổn thương chỗ chia nhánh đó là mất nhánh bên. Nguyên nhân hàng đầu của biến chứng này là do sự khó khăn trong việc lái guidewire vào nhánh bên trước hoặc sau khi đặt stent nhánh chính. Khi lái wire vào nhánh bên thất bại mặc dù đã uốn lại wire và thử các kỹ thuật lái wire khác nhau, một vài giải pháp có thể giải quyết như sau:
Dừng thủ thuật nếu nguy cơ mất nhánh bên quá cao, mà nhánh bên lớn và diện tưới máu rộng (ví dụ động mạch mũ).
Dùng microcatheter hỗ trợ lái wire trong trường hợp đặc điểm giải phẫu nhánh chính gây khó khăn, hoặc dùng catheter có đầu tip uốn cong có thể xoay các hướng như Supercross
Dùng dụng cụ khoan phá mảng xơ vữa ở nhánh chính có thể giúp loại bỏ bớt mảng xơ vữa ngăn đường vào nhánh bên.
Nong bóng nhánh chính trước.
Dùng kỹ thuật “reverse wire”.
Dùng Venture wire control catheter (một loại catheter đặc biệt có đầu tip có thể xoay các hướng khác nhau lên đến 900 để tạo thuận cho lái wire).
Đôi khi có thể dùng wire tương đối cứng để tăng khả năng lái và đâm xuyên. Có thể dùng wire ngậm nước. Tuy nhiên cần chú ý nguy cơ wire đi vào lớp dưới nội mạc khi dùng 2 loại wire này.
Mỗi phương pháp trên đều có ưu nhược điểm riêng, lựa chọn phương pháp nào phụ thuộc vào đặc điểm giải phẫu cụ thể, kinh nghiệm của bác sĩ và bệnh cảnh lâm sàng.
11 Kết quả can thiệp qua một số nghiên cứu lớn
Một vài nghiên cứu có đối chứng ngẫu nhiên lớn so sánh giữa hai chiến lược đặt một hay hai stent đã cho thấy chiến lược chỉ đặt stent nhánh chính vẫn được coi là chiến lược ưu tiên. Sau đây, chúng tôi điểm lại một vài nghiên cứu lớn:
Nghiên cứu NORDIC: trong nghiên cứu này, 413 bệnh nhân được chia ngẫu nhiên vào hai nhóm: đặt hai stent hoặc provisional stenting và sử dụng stent phủ thuốc Sirolimus. Sau 6 tháng, không có sự khác biệt giữa hai nhóm về tử vong do tim mạch, nhồi máu cơ tim, tái can thiệp mạch đích và huyết khối trong stent. Sau 5 năm, tỷ lệ cộng gộp các biến cố của hai nhóm cũng tương đương nhau (15,8% ở nhóm provisional stenting, 21,8% ở nhóm đặt hai stent, với p=0,15).
Nghiên cứu BBK (Bifurcations Bad Krozingen): 202 bệnh nhân được chia ngẫu nhiên vào hai nhóm: hoặc thực hiện kỹ thuật T stent một cách thường quy, hoặc provisional T stenting, và cũng sử dụng stent phủ thuốc Sirolimus. Tiêu chí chính của nghiên cứu là mức độ hẹp của nhánh bên theo dõi trên chụp mạch trong vòng 9 tháng, kết quả tương đương giữa hai nhóm. Tỷ lệ cộng gộp các biến cố liên quan đến mạch đích cũng như các biến cố tim mạch chính cũng tương tự nhau.
Nghiên cứu CACTUS: 350 bệnh nhân được chia ngẫu nhiên vào hai nhóm: hoặc sử dụng kỹ thuật provisional T stenting, hoặc kỹ thuật crush. Cả 2 nhóm đều sử dụng stent phủ thuốc Sirolimus và đều thực hiện FKBI bắt buộc. Can thiệp đặt stent nhánh bên trong chiến lược provisional T stenting chỉ khi có ít nhất một trong các tình huống: hẹp tồn dư ≥50%, lóc tách mạch vành từ type B trở lên, dòng chảy TIMI ≤2. Kết quả hai tiêu chí chính của nghiên cứu: tỷ lệ tái hẹp trong stent sau 6 tháng của 2 nhóm tương tự nhau, tỷ lệ các biến cố tim mạch chính giữa 2 nhóm cũng tương tự nhau.
Nghiên cứu BBC ONE: 500 bệnh nhân được chia ngẫu nhiên vào 2 nhóm: hoặc sử dụng chiến lược đơn giản provisional T stenting, hoặc sử dụng các kỹ thuật phức tạp hơn (crush hoặc culotte). Nghiên cứu này sử dụng stent phủ thuốc Paclitaxel. Tiêu chí để đặt stent nhánh bên trong chiến lược provisional T stenting: dòng chảy TIMI <3, hẹp nặng lỗ vào nhánh bên >90%, lóc tách mạch vành từ type A trở lên. Chỉ 30% số ca phải can thiệp nhánh bên (27% nong bóng, 3% đặt stent). Kết quả sau 9 tháng theo dõi: có sự khác biệt có ý nghĩa thống kê giữa 2 nhóm về tỷ lệ tử vong, NMCT, hoặc phải tái thông mạch đích (8% biến cố ở nhóm chiến lược đơn giản, 15,5% biến cố ở nhóm can thiệp phức tạp). Kết quả cho thấy tỷ lệ biến cố khá cao ở nhóm can thiệp chiến lược phức tạp.
Nghiên cứu DKCRUSH-II: nghiên cứu gồm 370 bệnh nhân, so sánh tỷ lệ các biến cố tim mạch chính sau 12 tháng (tử vong do tim mạch, NMCT, hoặc phải tái thông mạch đích) giữa 2 nhóm: sử dụng kỹ thuật double kissing crush so sánh với chiến lược provisional stenting. Kết quả: tỷ lệ các biến cố tim mạch chính và huyết khối trong stent ở 2 nhóm tương đương nhau. Tuy nhiên, tỷ lệ tái hẹp tại nhánh chính và nhánh bên, cũng như tỷ lệ phải tái can thiệp mạch đích thấp hơn ở nhóm double kissing crush. Theo dõi dài hơn sau 5 năm, tỷ lệ các biến cố tim mạch chính có xu hướng cao hơn ở nhóm provisional stenting (23,8% so với 15,7%, p=0,051). Tỷ lệ phải tái can thiệp mạch đích cũng cao hơn có ý nghĩa thống kê ở nhóm provisional stenting (16,2% so với 8,6%, p=0,027).
Nghiên cứu DKCRUSH-V: so sánh giữa chiến lược double kissing crush và chiến lược provisional stenting trong can thiệp tổn thương chỗ chia nhánh đoạn xa LM (left main). Kết quả cho thấy: khi theo dõi trong vòng 12 tháng, tỷ lệ các biến cố liên quan đến mạch đích (target lesion failure – TLF) của nhóm DK-crush thấp hơn so với nhóm provisional stenting (5,0% so với 10,7%, p=0,02). Nhóm sử dụng kỹ thuật DK-crush còn có xu hướng giảm tỷ lệ phải tái can thiệp mạch đích, và đáng ngạc nhiên, còn giảm cả tỷ lệ NMCT và huyết khối trong stent hơn nhóm provisional stenting.
Từ các nghiên cứu trên, chúng ta thấy chiến lược phù hợp cho hầu hết các trường hợp tổn thương chỗ chia nhánh là provisional stenting. Chiến lược này tiết kiệm chi phí hơn, đơn giản hơn, cần lượng thuốc cản quang ít hơn, thời gian thủ thuật ngắn hơn. Đồng thời, kết quả của các nghiên cứu cũng không phủ nhận việc có thể sử dụng kỹ thuật crush hay culotte trong một số trường hợp chọn lọc với giải phẫu phức tạp hay tổn thương lan tỏa tại nhánh bên. Tóm lại, chiến lược đặt 2 stent một cách thường quy ở tổn thương chỗ chia nhánh không làm cải thiện kết cục lâm sàng hay kết quả hình ảnh đối với hầu hết trường hợp, tuy nhiên cũng không tệ hơn về kết cục so với chiến lược can thiệp đơn giản.
So sánh đối đầu giữa các chiến lược đặt 2 stent với nhau, có một số nghiên cứu sau:
Nghiên cứu Nordic: 424 bệnh nhân được chia ngẫu nhiên vào 2 nhóm thực hiện kỹ thuật culotte hoặc crush, sử dụng stent phủ thuốc Sirolimus (77% trường hợp là “true bifurcation”). Kết quả theo dõi sau 6 tháng: không có sự khác biệt giữa 2 nhóm về tỷ lệ tử vong, NMCT sau thủ thuật, phải tái can thiệp mạch đích. Tuy nhiên, tỷ lệ tái hẹp trong stent ở nhóm sử dụng kỹ thuật crush cao hơn có ý nghĩa thống kê so với nhóm sử dụng kỹ thuật culotte (10,5% ở nhóm crush so với 4,5% ở nhóm culotte, p=0,046). Kết cục lâm sàng sau 3 năm của hai nhóm cũng tương tự nhau.
Nghiên cứu DKCRUSH-III: so sánh giữa kỹ thuật DK-crush và kỹ thuật culotte trong can thiệp tổn thương chỗ chia nhánh đoạn xa LM với 419 bệnh nhân tham gia nghiên cứu, theo dõi trong 12 tháng. Bệnh nhân thuộc nhóm culotte có tỷ lệ các biến cố tim mạch chính cao hơn có ý nghĩa thống kê so với nhóm DK-crush (16,3% so với 6,2%, p=0,001), trong đó tăng chủ yếu tỷ lệ phải tái can thiệp mạch đích (11% so với 4,3%, p=0,016). Sau 3 năm, tỷ lệ các biến cố tim mạch chính vẫn cao hơn ở nhóm culotte (23,7% so với 8,2%, p<0,001), đặc biệt là tỷ lệ phải tái can thiệp mạch đích và NMCT. Đặc biệt, tỷ lệ huyết khối trong stent ở nhóm culotte là 3,4%, trong khi ở nhóm DK-crush không ghi nhận ca nào.
Nghiên cứu BBK II: so sánh giữa kỹ thuật TAP (T stenting and small protrusion) và kỹ thuật culotte ở 300 bệnh nhân bifurcation cần đặt stent cả nhánh bên. Kết quả trên chụp mạch vành sau 9 tháng, tỷ lệ tái hẹp tại chỗ chia nhánh ở nhóm sử dụng kỹ thuật TAP cao hơn nhóm sử dụng kỹ thuật culotte (17% so với 6,5%, p=0,006). Sau 1 năm, tỷ lệ phải tái can thiệp mạch đích ở nhóm TAP cũng cao hơn ở nhóm culotte (12% so với 6%, p=0,069).
Để đánh giá ảnh hưởng của các loại stent khác nhau đến kết cục lâm sàng ở bệnh nhân can thiệp tổn thương chỗ chia nhánh, Pan và cộng sự đã tiến hành một nghiên cứu có đối chứng ngẫu nhiên, so sánh giữa nhóm đặt stent phủ thuốc Sirolimus (103 bệnh nhân) và nhóm đặt stent phủ thuốc Paclitaxel (102 bệnh nhân). Tất cả bệnh nhân đều được can thiệp theo chiến lược provisional T stenting. Kết quả theo dõi trong vòng 24 tháng, tỷ lệ tái hẹp thấp hơn đáng kể ở nhóm dùng stent phủ thuốc Sirolimus (9% so với 29%, p=0,011), tương tự là tỷ lệ phải tái can thiệp mạch đích (4% so với 13%, p=0,021). Kết quả tương tự ở nghiên cứu COBIS, trong đó tỷ lệ các biến cố tim mạch chính ở nhóm dùng stent phủ thuốc Sirolimus thấp hơn nhóm dùng stent phủ thuốc Paclitaxel.
Kết cục lâm sàng của các stent phủ thuốc thế hệ mới hơn trong điều trị tổn thương chỗ chia nhánh cũng được đánh giá qua một số nghiên cứu đối chứng ngẫu nhiên. Nghiên cứu SEA-SIDE so sánh stent phủ thuốc Sirolimus (SES) với stent phủ thuốc Everolimus (EES), cả 2 nhóm đều can thiệp theo chiến lược provisional stenting. Kết quả về khả năng kiểm soát nhánh bên trong thủ thuật cũng như kết quả hình ảnh chụp mạch sau can thiệp tương đương giữa 2 nhóm. Về kết cục lâm sàng khi theo dõi trong 18 tháng, không có sự khác biệt về tỷ lệ biến cố liên quan đến mạch đích giữa 2 nhóm (9,0% ở nhóm SES, 10,7% ở nhóm EES, p=0,57). SES và EES cũng được so sánh trong nghiên cứu CORPAL với 293 bệnh nhân, kết quả tỷ lệ các biến cố tim mạch chính sau 12 tháng cũng tương tự giữa 2 nhóm (6,2% so với 6,1%).
Để so sánh giữa stent phủ thuốc thế hệ thứ hai và stent phủ thuốc thế hệ thứ nhất, nghiên cứu LEADERS all-comers so sánh stent phủ thuốc Biolimus A9 (BES) với stent phủ thuốc Sirolimus, thời gian theo dõi 5 năm, cho thấy BES có kết cục dài hạn tốt hơn SES, với tỷ lệ huyết khối rất muộn trong stent thấp hơn so với SES. Ưu thế của stent phủ thuốc thế hệ thứ hai so với thế hệ thứ nhất cũng quan sát thấy trong một phân tích gộp gồm 3162 bệnh nhân can thiệp chỗ chia nhánh tại Hàn Quốc. Đồng thời nghiên cứu này cũng quan sát thấy, khi sử dụng stent phủ thuốc thế hệ thứ hai, kết cục tương đương nhau giữa nhóm chiến lược can thiệp tối thiểu đặt 1 stent và nhóm chiến được đặt 2 stent chỗ chia nhánh. Điều này trái với các báo cáo trước đó với ưu thế nghiêng về chiến lược đặt 1 stent khi sử dụng stent phủ thuốc thế hệ thứ nhất.
12 Theo dõi sau can thiệp
Tương tự với theo dõi sau can thiệp ở những trường hợp can thiệp ĐMV cơ bản (xem thêm tại Chương 17: Can thiệp động mạch vành cơ bản).
Sau can thiệp tổn thương chỗ chia nhánh ĐMV, đặc biệt ở những trường hợp đặt stent cả hai nhánh, chúng tôi khuyến cáo nên dùng thuốc kháng kết tập tiểu cầu kép trong tối thiểu 6 – 12 tháng.
13 Kết luận
Sự ra đời của stent phủ thuốc đã đánh dấu một bước phát triển lớn trong can thiệp tổn thương chỗ chia nhánh. Tuy nhiên, dữ kiện từ một số nghiên cứu lâm sàng cho thấy việc can thiệp đặt hai stent chỗ chia nhánh một cách thường quy không làm cải thiện kết cục lâm sàng. Vì thế, chiến lược provisional stenting nhánh bên vẫn được coi là kỹ thuật tiêu chuẩn cho hầu hết các trường hợp. Tuy nhiên có một số trường hợp cần đặt ra chiến lược đặt hai stent ngay từ đầu, đòi hỏi sự thành thạo của bác sĩ can thiệp trong những trường hợp này.
14 Tài liệu tham khảo
1. Textbook of Interventional Cardiology (2019). 8th edition, Elsevier
2. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines | Circulation
3. 2018 ESC/EACTS Guidelines on Myocardial
4. Mukherjee và Bavry A., btv. (2011), Interventional Cardiology: Essential Clinician’s Guide, Oxford University Press.
5. Redwood , Curzen N., và Banning A., btv. (2018), Oxford Textbook of Interventional Cardiology, Oxford University Press, New York.
6. Steigen K., Maeng M., Wiseth R. và cộng sự. (2006). Randomized study on simple versus complex stenting of coronary artery bifurcation lesions: the Nordic bifurcation study. Circulation, 114(18), 1955–1961.
7. Ferenc M., Gick M., Kienzle -P. và cộng sự. (2008). Randomized trial on routine vs. provisional T-stenting in the treatment of de novo coronary bifurcation lesions. Eur Heart J, 29(23), 2859–2867.
8. Colombo , Bramucci E., Saccà S. và cộng sự. (2009). Randomized study of the crush technique versus provisional side-branch stenting in true coronary bifurcations: the CACTUS (Coronary Bifurcations: Application of the Crushing Technique Using Sirolimus-Eluting Stents) Study. Circulation, 119(1), 71–78.
9. Hildick-Smith D., de Belder A.J., Cooter N. và cộng sự. (2010). Randomized trial of simple versus complex drug-eluting stenting for bifurcation lesions: the British Bifurcation Coronary Study: old, new, and evolving strategies. Circulation, 121(10), 1235–1243.
10. Chen S.-L., Santoso , Zhang J.-J. và cộng sự. (2011). A randomized clinical study comparing double kissing crush with provisional stenting for treatment of coronary bifurcation lesions: results from the DKCRUSH-II (Double Kissing Crush versus Provisional Stenting Technique for Treatment of 11. Coronary Bifurcation Lesions) trial. J Am Coll Cardiol, 57(8), 914–920.
12. Chen S.-L., Zhang J.-J., Han và cộng sự. (2017). Double Kissing Crush Versus Provisional Stenting for Left Main Distal Bifurcation Lesions: DKCRUSH-V Randomized Trial. J Am Coll Cardiol, 70(21), 2605–2617.
13. Erglis , Kumsars I., Niemelä M. và cộng sự. (2009). Randomized comparison of coronary bifurcation stenting with the crush versus the culotte technique using sirolimus eluting stents: the Nordic stent technique study. Circ Cardiovasc Interv, 2(1), 27–34.
14. Chen S.-L., Xu B., Han -L. và cộng sự. (2013). Comparison of double kissing crush versus Culotte stenting for unprotected distal left main bifurcation lesions: results from a multicenter, randomized, prospective DKCRUSH-III study. J Am Coll Cardiol, 61(14), 1482–1488.
15. Ferenc M., Gick M., Comberg và cộng sự. (2016). Culotte stenting vs. TAP stenting for treatment of de-novo coronary bifurcation lesions with the need for side-branch stenting: the Bifurcations Bad Krozingen (BBK) II angiographic trial. Eur Heart J, 37(45), 3399–3405.
16. Pan M., Suárez de Lezo J., Medina A. và cộng sự. (2007). Drug-eluting stents for the treatment of bifurcation lesions: a randomized comparison between paclitaxel and sirolimus stents. Am Heart J, 153(1), e1–7

