Kỹ thuật điều trị can thiệp thuyên tắc động mạch phổi cấp tính

Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS.Phạm Mạnh Hùng
Tác giả
ThS.BSNT.Trần Bá Hiếu
ThS.BSNT.Trần Huyền Trang
ThS.BSNT.Trần Ngọc Cầm
PGS.TS.BS.Phạm Mạnh Hùng
Can thiệp thuyên tắc động mạch phổi cấp là một phương pháp điều trị tắc mạch phổi cấp. Kỹ thuật đó như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu trong bài viết sau đây.
1 Đại cương
Thuyên tắc huyết khối tĩnh mạch (VTE) là một trong những bệnh tim mạch hay gặp với tỷ lệ tử vong khoảng 0,8 – 1 mỗi 1000 người/năm. Hàng năm, có khoảng trên 250.000 bệnh nhân mắc VTE tại Hoa Kỳ. Một phần ba số ca này bị thuyên tắc động mạch phổi (TTĐMP) với tỷ lệ khoảng 0,45 trên 1000 người/năm. Tỷ lệ mắc thuyên tắc động mạch cấp tính là đáng kể, với tỷ lệ tử vong khoảng 15% trong 28 ngày.
Điều trị TTĐMP dựa trên tình trạng lâm sàng của người bệnh bằng việc phân tầng nguy cơ dựa trên yếu tố huyết động và thông số cận lâm sàng (Bảng 1). Đối với tất cả các nhóm phân tầng nguy cơ, điều trị cơ bản cho bất kỳ nhóm nguy cơ TTĐMP là thuốc chống đông. Điều trị TTĐMP nguy cơ thấp vẫn là điều trị chống đông đơn thuần. Bệnh nhân bị TTĐMP nguy cơ cao được ưu tiên điều trị bằng tiêu huyết khối nếu không có chống chỉ định. Tuy nhiên, phương thức tối ưu của tiêu huyết khối bằng tiêu sợi huyết toàn thân hoặc can thiệp qua đường ống thông hiện tại vẫn còn nhiều tranh cãi. Cuối cùng, cách tiếp cận ưu tiên để điều trị TTĐMP nguy cơ trung bình bằng tiêu huyết khối và/hoặc kết hợp với phương pháp can thiệp qua đường ống thông vẫn còn nhiều tranh luận.

2 Sinh lý bệnh học
Đáp ứng huyết động với TTĐMP cấp tính là khác nhau ở mỗi bệnh nhân dựa trên một số yếu tố. Ngoài mức độ của huyết khối, các yếu tố thần kinh thể dịch bao gồm serotonin, thrombin và histamine, góp phần vào nguy cơ gây rối loạn huyết động. Dự trữ tim phổi của bệnh nhân cũng đóng một vai trò lớn trong khả năng chịu đựng một biến cố tắc mạch cấp tính. Do đó, TTĐMP nhỏ hơn có thể dẫn đến tình trạng nặng ở bệnh nhân có tiền sử bệnh tim mạch hoặc bệnh phổi. Ngược lại, gánh nặng huyết khối lớn có thể được dung nạp ở những người khỏe mạnh. Vì thế, cần có một phương pháp tiếp cận cụ thể cho từng bệnh nhân dựa trên phân tầng TTĐMP cấp tính để hướng dẫn điều trị phù hợp (Bảng 1).
Bảng 1. Phân tầng nguy cơ thuyên tắc phổi cấp tính
| Phân tầng nguy cơ | Chỉ số đánh giá | ||||
| Rối loạn huyết động a | Thông số lâm sàng độ nặng PE và/hoặc bệnh đồng mắc: PESI loại III, V hoặc sPESI ≥ 1 | Rối loạn chức năng RV trên TTE hoặc CTPA b | Nồng độ Troponin tim tăng c | ||
| Cao | + | (+)d | + | (+) | |
| Trung bình | Trung bình – cao | – | + e | + | + |
| Trung bình – thấp | – | + e | Một (hoặc không) dương tính | ||
| Thấp | - | - | - | Không bắt buộc đánh giá. Nếu có đánh giá, thì kết quả âm tính | |
a: Một trong những biểu hiện lâm sàng sau đây: ngừng tim, sốc tắc nghẽn (Huyết áp tâm thu <90 mmHg hoặc cần thuốc vận mạch để đạt được HA ≥ 90 mmHg mặc dù đã đổ đầy lòng mạch, kết hợp với giảm tưới cơ quan đích) hoặc hạ huyết áp kéo dài (HA tâm thu <90 mmHg hoặc giảm HA tâm thu ≥ 40 mmHg trong >15 phút, không do rối loạn nhịp tim mới khởi phát, hạ Kali máu hoặc nhiễm trùng huyết). b: Kết quả chẩn đoán hình ảnh có liên quan đến tiên lượng (TTE hoặc CTPA) ở bệnh nhân PE cấp tính và ngưỡng cắt tương ứng. c: Các xét nghiệm dấu ấn sinh học khác tăng, như NT-proBNP ≥ 600 ng/L, H-FABP ≥6 ng/mL, hoặc copeptin ≥24 pmol/L, có thể cung cấp thêm thông tin tiên lượng. d: Rối loạn huyết động, kết hợp với chẩn đoán xác định PE trên CTPA và/hoặc có bằng chứng về rối loạn chức năng RV trên TTE, đủ để phân loại một bệnh nhân vào nhóm PE nguy cơ cao. e: Có thể có dấu hiệu rối loạn chức năng RV trên TTE (hoặc CTPA) hoặc tăng dấu ấn sinh học tim, mặc dù PESI tính toán là I-II hoặc sPESI là 0.
Chú thích viết tắt: RV: Thất phải; PE: Thuyên tắc động mạch phổi; TTE: Siêu âm tim qua thành ngực; CTPA: Chụp cắt lớp vi tính động mạch phổi; Thang điểm PESI, sPESI xem thêm Phụ lục: Các thang điểm thường dùng trong tim mạch can thiệp.
Nguyên nhân tăng sức cản mạch phổi của TTĐMP cấp tính bao gồm tình trạng tắc nghẽn vật lý do huyết khối và sự đáp ứng co mạch của giường mạch xung quanh để đáp ứng với tình trạng giảm oxy. Áp lực ĐMP tăng khi có khoảng 25% – 30% các động mạch phổi bị tắc nghẽn. Áp lực động mạch phổi trung bình từ 30 – 40 mmHg được xếp vào loại tăng áp phổi nặng. Tuy nhiên, nếu bệnh nhân có phì đại thất phải từ trước có thể có áp lực động mạch phổi ở ngưỡng cao hơn khi có tình trạng TTĐMP.
Sự cản trở dòng máu qua các động mạch bị tắc dẫn đến tăng thông khí khoảng chết. Tình trạng tăng thông khí thường kết hợp để thải CO2 cũng có thể làm tăng PaO2. Tuy nhiên, sự không phù hợp giữa thông khí – tưới máu và giảm thông khí phế nang dẫn đến giảm oxy máu ở những bệnh nhân bị TTĐMP.
Tăng hậu gánh thất phải tùy thuộc mức độ của huyết khối và sức co mạch phổi do giảm oxy máu có thể gây ra hiện tượng quá tải thất phải cấp. Điều này dẫn đến giãn thất phải, giảm vận động thất phải, hở van ba lá, thiếu máu cục bộ cơ tim và cuối cùng là suy tim phải. Thất phải giãn cũng dẫn đến phẳng vách liên thất và suy giảm chức năng thất trái. Những yếu tố này sau đó có thể dẫn đến hạ huyết áp hệ thống do giảm tiền gánh thất trái, gây thiếu máu cục bộ cơ tim và suy giảm chức năng thất trái toàn bộ. Quá trình sinh lý bệnh này xảy ra theo thời gian, do đó suy sụp huyết động có thể thực sự xảy ra sau 12 – 48 giờ “huyết áp bình thường” và huyết động ổn định.
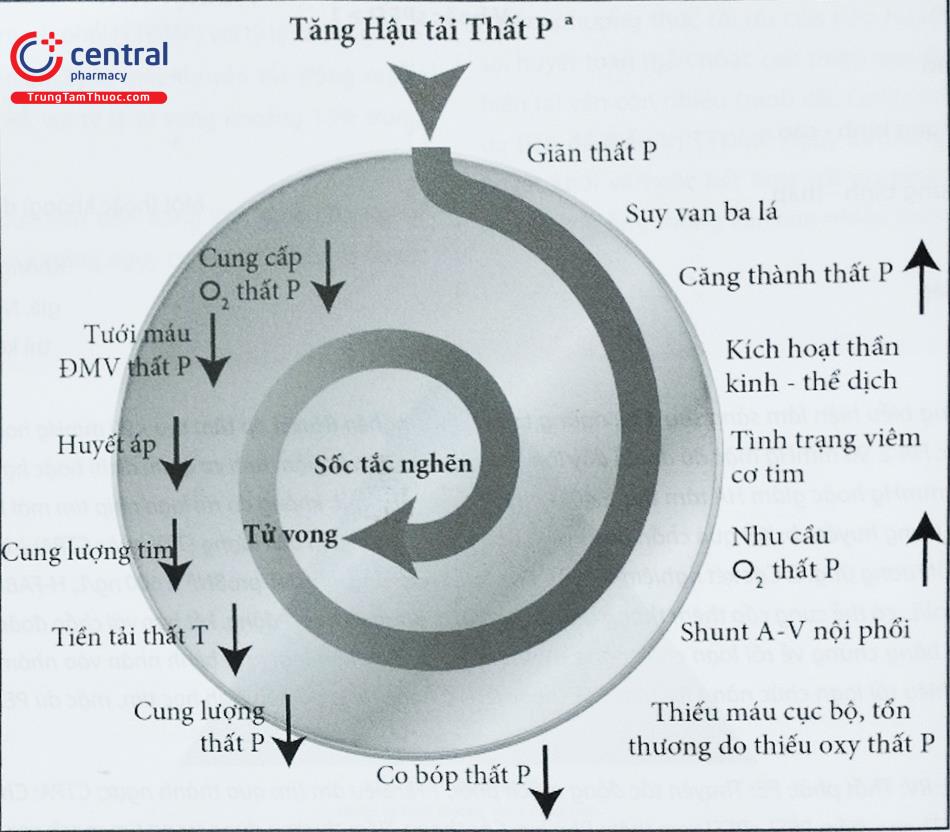
Chú thích: Thất P: Thất phải; ĐMV: Động mạch vành; Shunt A-V: Luồng thông động -tĩnh mạch.
3 Giải phẫu và hình thái tổn thương
Tuần hoàn phổi là vòng tuần hoàn đưa máu nhiều khí cacbonic, ít oxy tới phổi để trao đổi với không khí trong phế nang và đưa máu đã gắn nhiều oxy về tâm nhĩ trái rồi sang vào hệ đại tuần hoàn đi nuôi cơ thể.
Từ tâm thất phải, thân động mạch phổi chạy lên trên, ở bên trái động mạch chủ lên và tới khi tới dưới quai động mạch chủ thì chia thành các động mạch phổi chính phải và động mạch phổi chính trái đi vào hai rốn phổi. Ở trong mỗi phổi, mỗi động mạch phổi chia thành các nhánh nhỏ dần chạy theo các phế quản, cuối cùng thành mạng lưới mao mạch bao quanh các phế nang. Động mạch phổi phải dài hơn động mạch phổi trái; nó phải đi sau động mạch chủ lên và tĩnh mạch chủ trên trước khi tới rốn phổi phải. Trong mỗi phổi, mạng lưới mao mạch quanh phế nang kết hợp thành các tiểu tĩnh mạch, rồi các mạch này hợp thành những tĩnh mạch phổi lớn dần, cuối cùng thành hai tĩnh mạch phổi trên và dưới. Trên đường chạy về tâm nhĩ trái, các tĩnh mạch phổi phải đi sau tĩnh mạch chủ trên, các tĩnh mạch phổi trái đi trước động mạch chủ xuống.
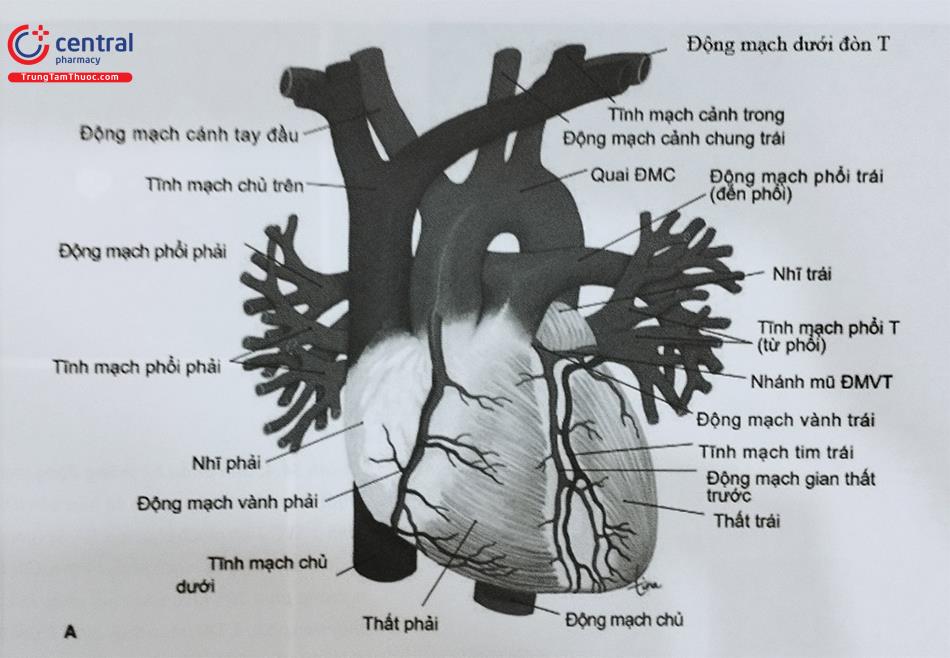
Chú thích: ĐMV: Động mạch vành; T: Trái; ĐMC: Động mạch chủ.
Trên phim chụp mạch số hóa nền (DSA), thân động mạch phổi xuất phát từ thất phải, kéo dài 4-5 cm. Chỗ chia đôi của thân chung thành hai động mạch phổi phải và trái thường ở dưới, phía trước và bên trái của carina gần đốt sống ngực thứ năm. Động mạch phổi bên phải dài hơn bên trái và đi theo chiều ngang hướng sang phải và chia thành 3 nhánh động mạch thùy trên (nhánh đỉnh, trước, sau). Sau đó chia thành 5 nhánh tận chi phối thùy giữa và thùy dưới bên phải. Động mạch phổi trái đi hướng lên trên và ra sau trước khi tách thành nhánh lên chi phổi cho thùy trên bên trái và nhánh đi xuống chi phối cho vùng lưỡi phổi và thùy dưới bên trái.
Hệ mạch động mạch phổi có tính đàn hồi cao với dung lượng lớn giúp tăng lưu lượng máu. Áp lực động mạch phổi tâm thu (PAP) là 15 đến 30 mmHg và trung bình là 9 đến 18 mmHg. Bệnh nhân có huyết khối động mạch phổi mạn tính và tăng áp phổi kéo dài sẽ dẫn tới suy tim phải cũng như các biểu hiện lâm sàng kèm theo.
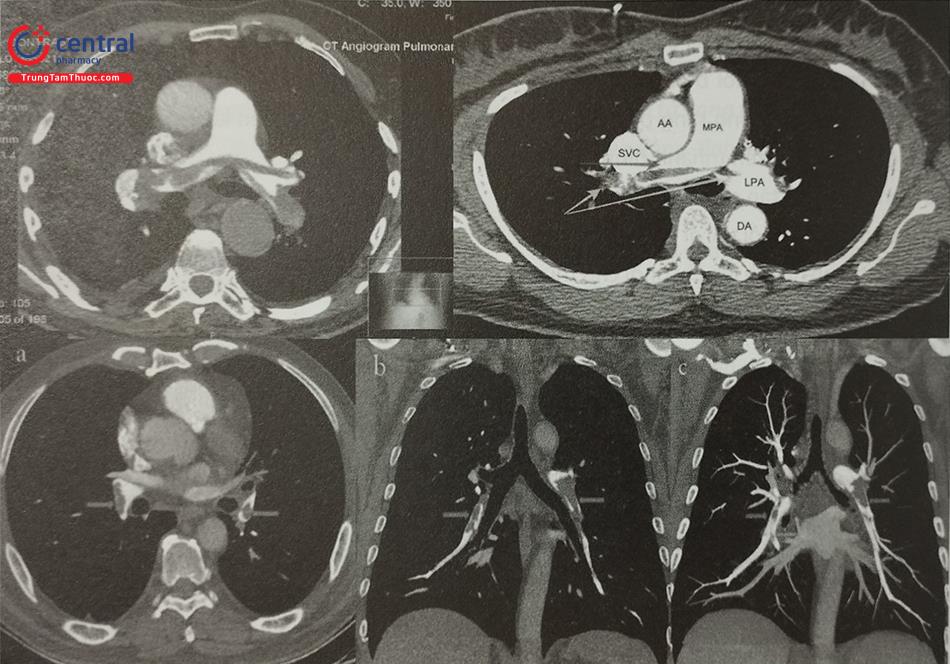
AA: Động mạch chủ, MPA: thân chung động mạch phổi, SVC: tĩnh mạch chủ trên, LPA: Động mạch phổi trái, DA: Động mạch chủ xuống. Mũi tên: Huyết khối động mạch phổi.
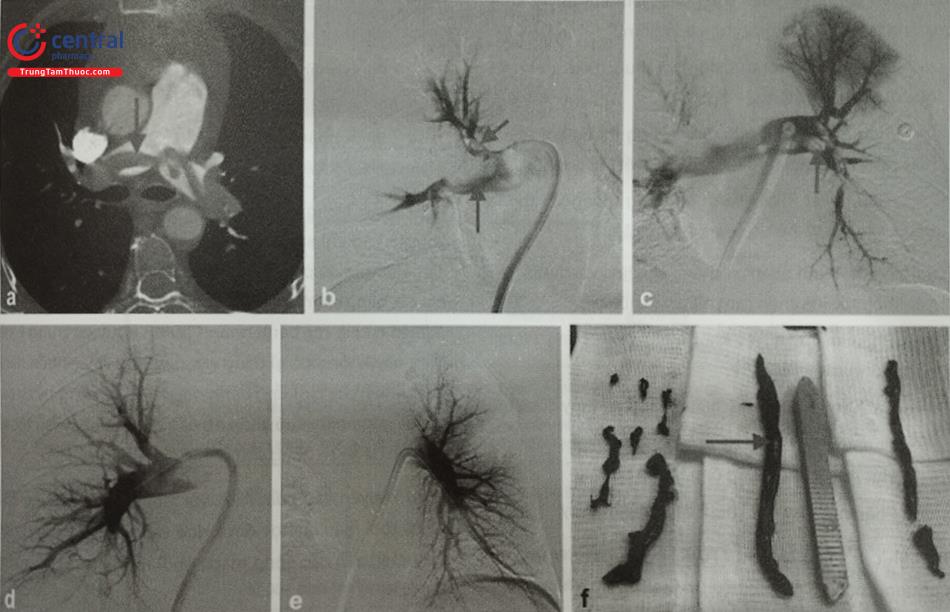
Hình (a) Hình ảnh chụp cắt lớp vi tính của thuyên tắc động mạch phổi (TTĐMP) cấp. (b), (c) Hình ảnh động mạch phổi phải và trái cho thấy các khuyết cản quan tương ứng với huyết khối động mạch phổi. (d), (e) Hình ảnh DSA sau hút huyết khối cho thấy sự cải thiện đáng kể trong lưu lượng động mạch phổi. (f) Ảnh mặt sau của cục huyết khối được hút bằng thiết bị Inari có lỗ khoan lớn.
Với TTĐMP cấp tính, điều trị cần giải quyết 3 khía cạnh: (1) ngăn ngừa sự hình thành huyết khối mới; (2) loại bỏ bớt huyết khối khỏi ĐMP (nhanh chóng hoặc theo thời gian); và (3) điều trị rối loạn chức năng thất phải nếu có.
Các hướng dẫn hiện tại khuyến cáo phương pháp tiêu huyết khối cho những bệnh nhân có TTĐMP nguy cơ cao và nguy cơ chảy máu thấp. Ngoài ra, những bệnh nhân có TTĐMP nguy cơ trung bình được có nguy cơ tiên lượng xấu (huyết động trở nên không ổn định, suy hô hấp nặng hơn, rối loạn chức năng thất phải nặng, hoặc hoại tử cơ tim lớn) có thể được xem xét để tiêu huyết khối.
Tuy nhiên cần lưu ý quan trọng, một số bệnh nhân có chống chỉ định tiêu huyết khối toàn thân (xuất huyết nội sọ hoặc phẫu thuật nội sọ, phẫu thuật cột sống, chấn thương sọ não gần đây, ung thư nội sọ, tăng huyết áp không kiểm soát, hoặc chảy máu đang hoạt động hoặc gần đây). Ngoài ra, tiêu huyết khối toàn thân có 20% nguy cơ chảy máu và 3% – 5% nguy cơ đột quỵ xuất huyết não. Hơn nữa, có thể không đủ thời gian cho phép truyền các thuốc tan huyết khối toàn thân và để có tác dụng trong bệnh cảnh cấp tính.
Cuối cùng, một số bệnh nhân sẽ không cải thiện mặc dù được điều trị tiêu huyết khối. Trong những trường hợp này, các phương pháp điều trị thay thế để loại bỏ nhanh huyết khối và/hoặc giảm liều lượng thuốc tiêu huyết khối, chẳng hạn như can thiệp lấy huyết khối hoặc phẫu thuật lấy huyết khối vẫn là những điều trị nên được lựa chọn.
4 Chỉ định và chống chỉ định can thiệp
Mục tiêu của điều trị can thiệp thuyên tắc động mạch phổi (TTĐMP) qua đường ống thông là loại bỏ huyết khối tắc nghẽn từ các động mạch phổi chính để tạo điều kiện thuận lợi cho phục hồi chức năng thất phải và cải thiện các triệu chứng và khả năng sống sót. Đối với bệnh nhân không có chống chỉ định tuyệt đối với tiêu huyết khối, những cách tiếp cận được ưu tiên là tiến hành làm tan huyết khối bằng thuốc tiêu sợi huyết toàn thân hoặc làm tan huyết khối qua ống thông với các lựa chọn bao gồm:
- Tiêu huyết khối trực tiếp với thuốc tiêu sợi huyết qua đường ống thông.
- Tiêu huyết khối qua đường ống thông với thuốc tiêu sợi huyết phối hợp thêm hút huyết khối cơ học.
- Tiêu huyết khối qua đường ống thông với thuốc tiêu sợi huyết và hỗ trợ của sóng siêu âm.
- Tuy nhiên với bệnh nhân có chống chỉ định với thuốc tiêu huyết khối, các lựa chọn can thiệp bao gồm:
- Phân mảnh huyết khối bằng ống thông Pigtail hoặc bóng
- Cắt huyết khối bằng thiết bị catheter thủy động lực học.
- Hút huyết khối bằng ống thông hút.
- Phân mảnh huyết khối bằng thiết bị
Chỉ định can thiệp điều trị TTĐMP bằng catheter qua da là phương pháp thay thế tiêu sợi huyết ở ba phân nhóm bệnh nhân có TTĐMP nguy cơ cao:
- Bệnh nhân có nguy cơ chảy máu cao.
- Bệnh nhân có huyết động không ổn định dai dẳng sau khi điều trị tiêu sợi huyết (điều trị thất bại).
- Bệnh nhân có nguy cơ tử vong cao trước khi tiêu sợi huyết có hiệu quả.
Điều quan trọng cần lưu ý là, mặc dù các hướng dẫn khuyến cáo chỉ sử dụng can thiệp điều trị TTĐMP bằng catheter qua da cho bệnh nhân TTĐMP nguy cơ cao, hầu hết các bằng chứng hiện có đều bắt nguồn từ các quần thể nghiên cứu là các bệnh nhân TTĐMP nguy cơ trung bình. Điều này không có gì đáng ngạc nhiên, vì việc tiến hành các nghiên cứu ở những bệnh nhân TTĐMP có nguy cơ cao có thể gặp nhiều khó khăn do cần điều trị ngay lập tức và các vấn đề về sự đồng ý từ phía bệnh nhân.
Theo khuyến cáo của Hiệp hội Tim mạch châu Âu ESC về tái tưới máu cơ học được dựa vào việc đặt ống thông (catheter) vào các động mạch phổi thông qua tĩnh mạch đùi năm 2019:
Bảng 2. Khuyến cáo tái tưới máu ở bệnh nhân thuyên tắc động mạch phổi cấp (Theo ESC 2019)
| Điều trị tái tưới máu ở bệnh nhân TTĐMP | Loại | Mức bằng chứng |
| Điều trị tiêu sợi huyết cấp cứu được khuyến cáo cho bệnh nhân huyết động xấu đi khi đang điều trị chống đông. | I | B |
| Phẫu thuật lấy huyết khối hoặc điều trị catheter trực tiếp qua da nên được xem xét cho những bệnh nhân có huyết động xấu đi khi đang điều trị chống đông, như một thay thế cho điều trị tiêu sợi huyết cứu mạng. | IIa | C |
| Sử dụng thường quy tiêu sợi huyết toàn thân ban đầu không được khuyến cáo ở những bệnh nhân TTĐMP nguy cơ trung bình hoặc nguy cơ thấp. | III | B |
Chú thích: TTĐMP: Thuyên tắc động mạch phổi.
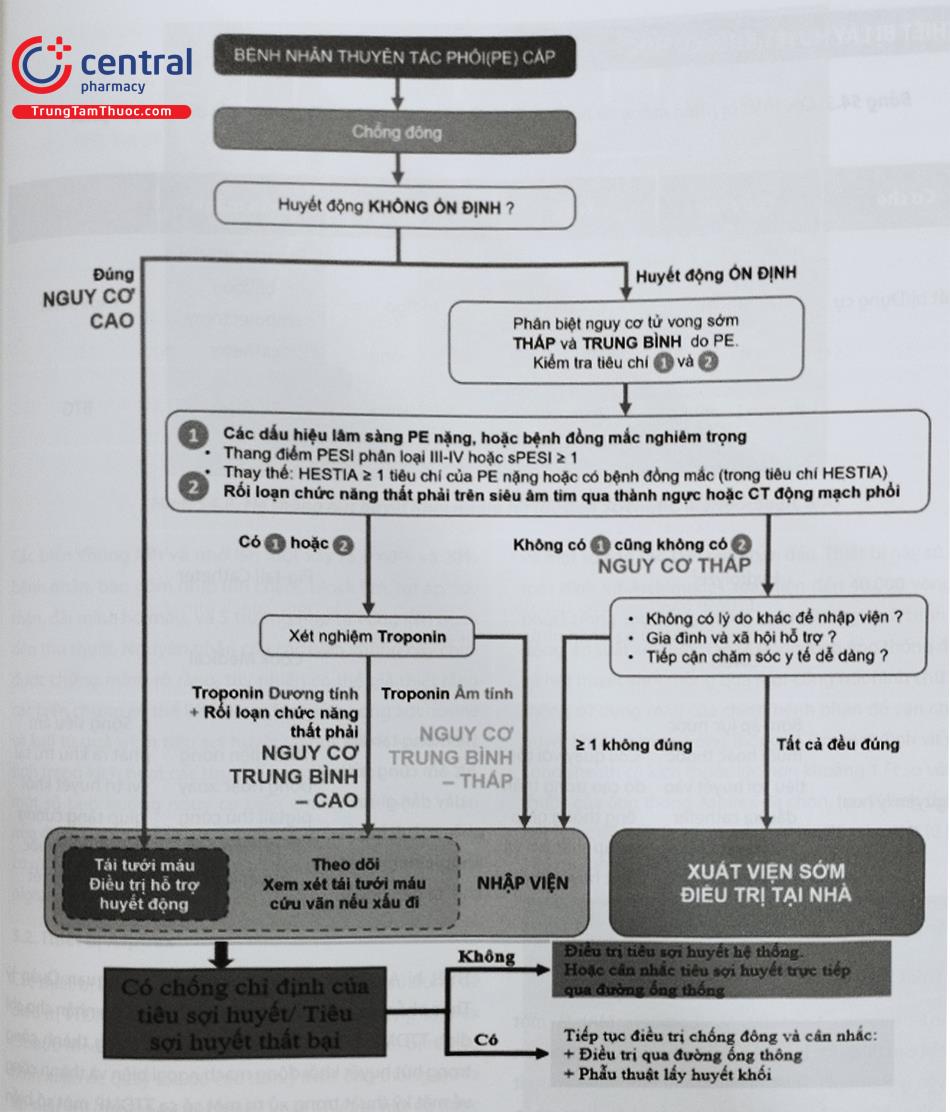
Chú thích: PE: Thuyên tắc động mạch phổi; Thang điểm PESI và sPESI: Tiên lượng mức độ nặng của thuyên tắc động mạch phổi (Xem Phụ lục Các thang điểm thường dùng trong tim mạch can thiệp).
5 Thiết bị lấy huyết khối cơ học
Bảng 3. Các thiết bị phân mảng và hút huyết khối can thiệp nội mạch thuyên tắc động mạch phổi
| Cơ chế | Thủy lực | Xoay | Hút | Phân mảnh | Siêu âm |
| Thiết bị/Dụng cụ | Angio Jet | Rotarex | Indigo | Fogarty arterial balloon embolectomy catheter | Ekos Sonic |
| Boston Scientific | Aspirex | Penumbra | Edwards | BTG | |
| Straub Medical | |||||
| Hydrolyzer | Pig-tail Catheter | ||||
| Cordis | Cook Medical | ||||
| Nguyên lý hoạt động | Bơm áp lực nước muối hoặc thuốc tiêu sợi huyết vào đầu xa catheter và huyết khối phân mảnh được hút vào cathete | Coil quay với tốc độ cao trong thân ống thông giúp tạo áp suất âm và hút huyết khối | Hệ thống tạo áp lực âm cùng với dây dẫn giúp phân mảnh huyết khối và hút huyết khối ra bên ngoài | Thực hiện nong bóng hoặc xoay pigtail thủ công để phân mảnh huyết khối | Sóng siêu âm phát ra khu trú tại vị trí huyết khối giúp tăng cường tác dụng thuốc tiêu sợi huyết tại chỗ |
5.1 Thiết bị AngioJet
AngioJet (Boston Scientific, Marlborough, MA) là một thiết bị can thiệp cắt huyết khối thủy lực lưu biến dựa trên nguyên lý Bernoulli. Thiết bị này tạo ra một vùng áp suất thấp (lên đến -600 mmHg). Cục huyết khối được phân mảnh và hút vào ống thông để đưa ra ngoài. Phương pháp này có thể được kết hợp với truyền chất hoạt hóa plasminogen (tPA) để loại bỏ huyết khối theo cơ chế hoá cơ học, nhờ đó tPA được đưa vào bên trong cục huyết khối (sử dụng 10 hoặc 20 mg tPA và ống thông hỗ trợ phun xung AngioJet). Thiết bị này có một số ống thông với kích thước khác nhau để sử dụng hút huyết khối động mạch ngoại biên và động mạch vành. Hầu hết các ống thông tương thích từ 6Fr trở xuống và yêu cầu tháp bơm Angio- Jet để hoạt động.
Thiết bị AngioJet này hiện chưa được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) công nhận cho chỉ định TTĐMP. Mặc dù Angiojet được sử dụng thành công trong hút huyết khối động mạch ngoại biên và thành công về mặt kỹ thuật trong xử trí một số ca TTĐMP, một số biến chứng đáng kể đã gặp phải khi nó được sử dụng trong tuần hoàn phổi. Một đánh giá có hệ thống về tất cả các liệu pháp điều trị bằng ống thông cho TTĐMP đã chứng minh rằng việc sử dụng AngioJet cho TTĐMP đã dẫn đến 76% tổng số ca bệnh bị biến chứng, mặc dù nó chỉ được sử dụng trong 11% trường hợp.
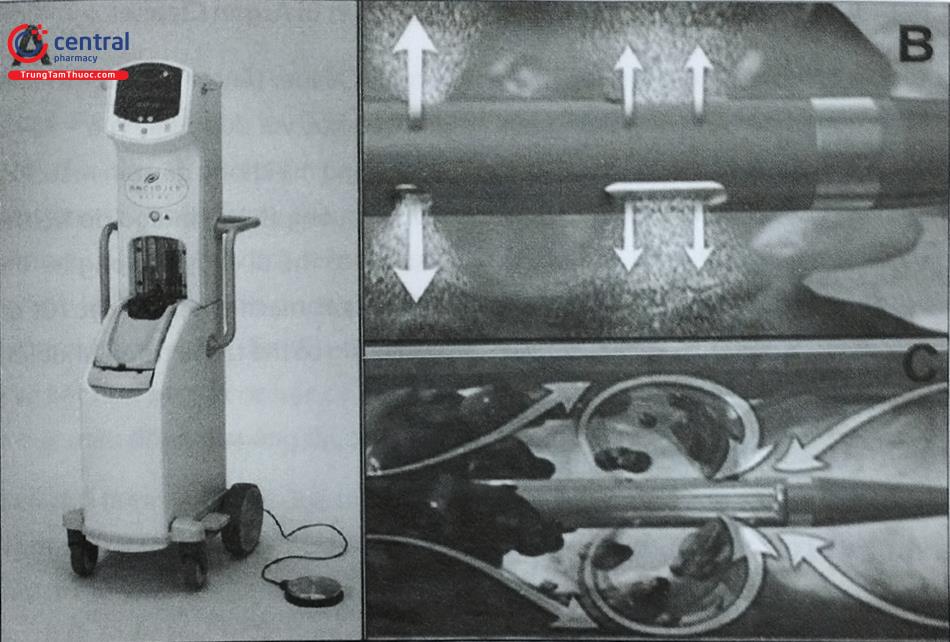
Các biến chứng lớn và nhỏ lần lượt xảy ra ở 40% và 28% bệnh nhân, bao gồm nhịp tim chậm, block tim, tụt áp, suy thận, đái máu, ho máu, và 5 trường hợp tử vong liên quan đến thủ thuật. Nguyên nhân của các biến chứng này chưa được chứng minh rõ ràng, tuy nhiên có thể giả thiết rằng các biến chứng có thể liên quan đến giải phóng Adenosine và kali từ quá trình tiêu sợi huyết và hút huyết khối, hoặc tình trạng kích hoạt các thụ thể kéo dài do lực hút. Do đó, một số tình huống nguy cơ biến chứng cao, bệnh nhân nên được sử dụng các phương pháp điều trị khác với nguy cơ rủi ro thấp (ví dụ: như điều trị qua đường ống thông với pigtail phân mảnh).
5.2 Thiết bị Aspirex
Các thiết bị lấy huyết khối khác cũng đã được sử dụng để điều trị TTĐMP như Helix Clot Buster và ống thông Aspirex (Straub Medical, Wangs, Thụy Sĩ). Aspirex là thiết bị này có hình xoắn ốc quay tốc độ cao trong thân ống thông tạo ra áp suất âm, cho phép hút huyết khối. Thiết bị này đã được chứng minh là có hiệu quả qua các thử nghiệm in vitro và in vivo và một số báo cáo lâm sàng ban đầu. Ngoài ra, hệ thống Indigo (Penumbra, Alameda, CA) đã phát triển một ống thông định hướng lớn để hút huyết khối, tuy nhiên các dữ liệu còn hạn chế.
Hệ thống Aspirex (Straub Medical, Wangs, Thụy Sĩ) với kích thước từ 6 đến 10 Fr. Aspirex là thiết bị này có hình xoắn ốc quay tốc độ cao trong thân ống thông tạo ra áp suất âm, cho phép hút huyết khối. Thiết bị này đã được chứng minh là có hiệu quả qua các thử nghiệm in vitro và in vivo và một số báo cáo lâm sàng ban đầu. Thiết bị này sử dụng một đinh vít Archimedes xoay (lên đến 40.000 vòng mỗi phút) trong một ống thông mềm. Trong quá trình hoạt động, áp suất âm được tạo ra trong lòng ống thông để hút và hút huyết khối thông qua một cổng hút hình chữ L. Hệ thống sử dụng máu của chính bệnh nhân để vận chuyển huyết khối trở lại qua ống thông và làm mát đinh vít quay. Long sheath có kích thước lớn hơn khoảng 1 Fr so với kích thước của ống thông Aspirex đã chọn, lưu ý rằng thể tích hút được đề xuất là 45 mL/phút (6 Fr), 75 mL/phút (8 Fr) và 180 mL/phút (10 Fr).

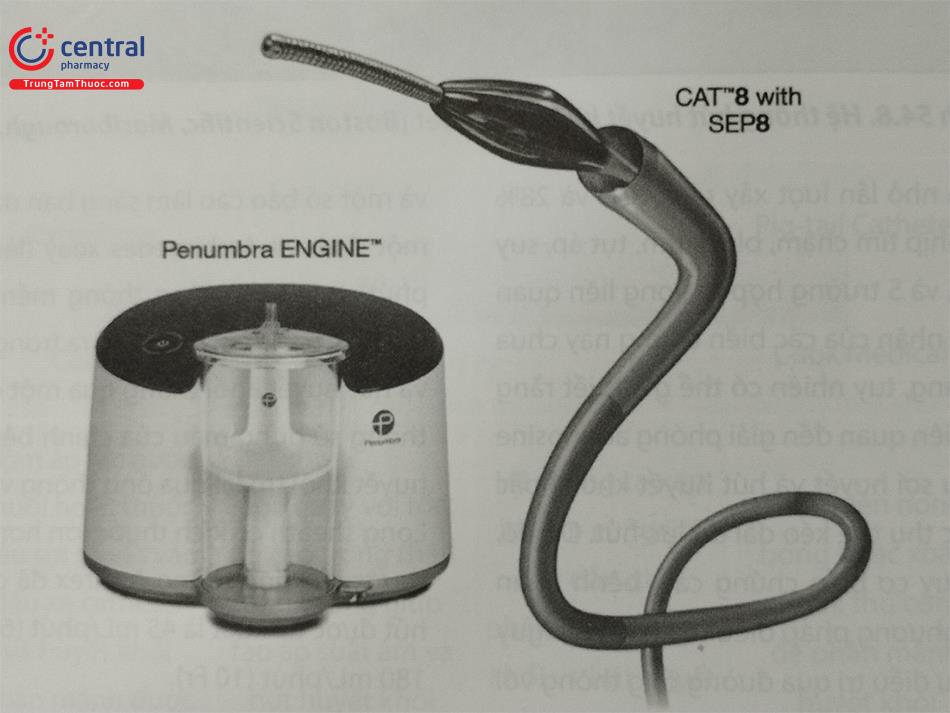
5.3 Thiết bị Penumbra Indigo
Thiết bị Penumbra Indigo (Penumbra, Alameda, CA) là một ống thông hút huyết khối bằng hệ thống ống thông nối với bơm hút áp lực cao. Kích thước ống thông là 6 hoặc 8 Fr được gọi là CAT6 hoặc CAT8. Trong quá trình hút, phải theo dõi lượng máu ở buồng thu vì có thể hút quá nhiều máu hoặc bị tắc ống thông. Khi bị tắc trong quá trình hoạt động, nó thường được giải quyết bằng sử dụng bộ tách dây (SEP) để cố gắng thông ống thông bị tắc.
Thiết bị Penumbra cũng có thể được sử dụng cùng với thiết bị Cleaner (Argon, Plano, TX).
5.4 Thiết bị argon cleaner
Argon Cleaner (Argon, Plano, TX) là một thiết bị lấy huyết khối cơ học với đường kính 6 – 7 Fr có thể phân tách cục máu đông mà không gây tan máu. Nó có thể được sử dụng cùng với ống thông Indigo do hệ thống Cleaner 6F đồng trục và có thể di chuyển trong hệ thống Penumbra CAT8. Đối với các mạch lớn hơn, việc rút một phần dây hình sin bên trong có thể tạo ra trường hút lớn hơn của cho thiết bị.
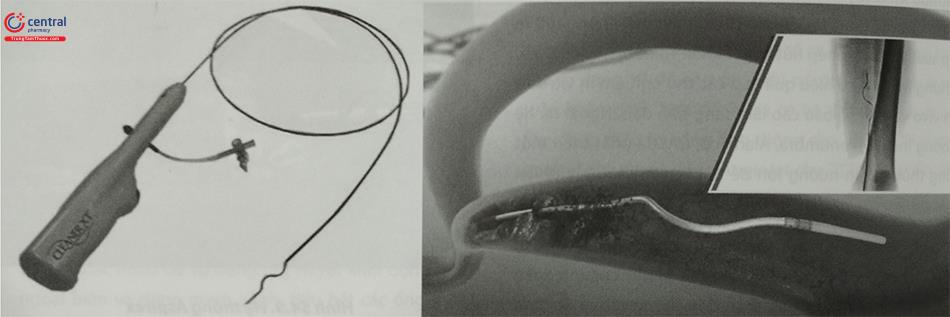
5.5 Thiết bị FlowTriever
Hệ thống hút/lấy FlowTriever (Inari, Irvine, CA) để điều trị TTĐMP cấp tính. Thiết bị FlowTriever có ba thành phần (dây dẫn bên trong với đĩa nitinol, ống thông hút bên ngoài và tay cầm hút). Dạng dây bên trong bao gồm ba đĩa nitinol mềm, các đĩa này nhằm mục đích tham gia và phá vỡ cục máu đông mà không làm tổn thương thành mạch. Khi huyết khối được đưa vào đĩa, tay cầm của máy hút được kéo một lần và kết hợp lực hút cơ học để loại bỏ các đĩa nitinol có chứa cục máu đông qua ống thông.
Thiết bị có Ba Kích cỡ có thể được lựa chọn dựa trên kích thước huyết khối và vị trí mạch máu có huyết khối. Thiết bị thế hệ hiện tại nhằm xử lý TTĐMP được đưa vào qua sheath 22-Fr. Tất cả các thiết bị cơ học hoặc dụng cụ hút, có thể được sử dụng cùng hoặc không dùng thuốc tiêu sợi huyết tại chỗ.
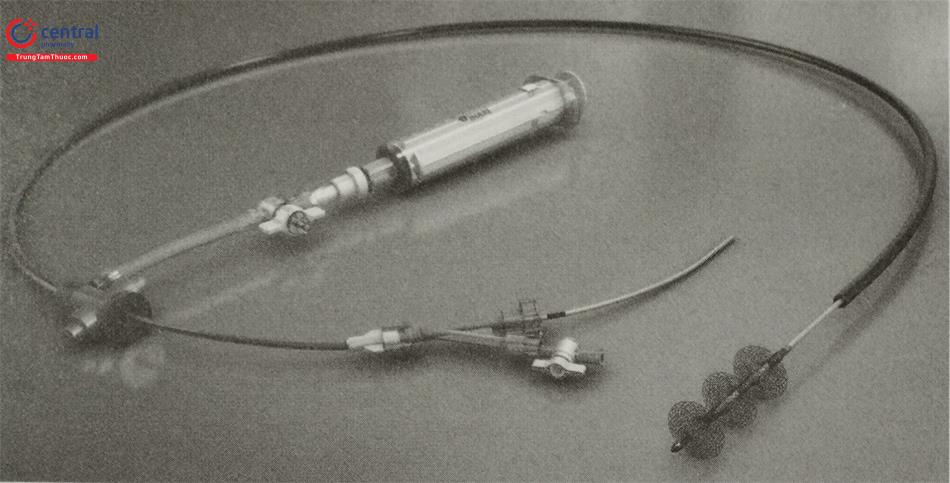
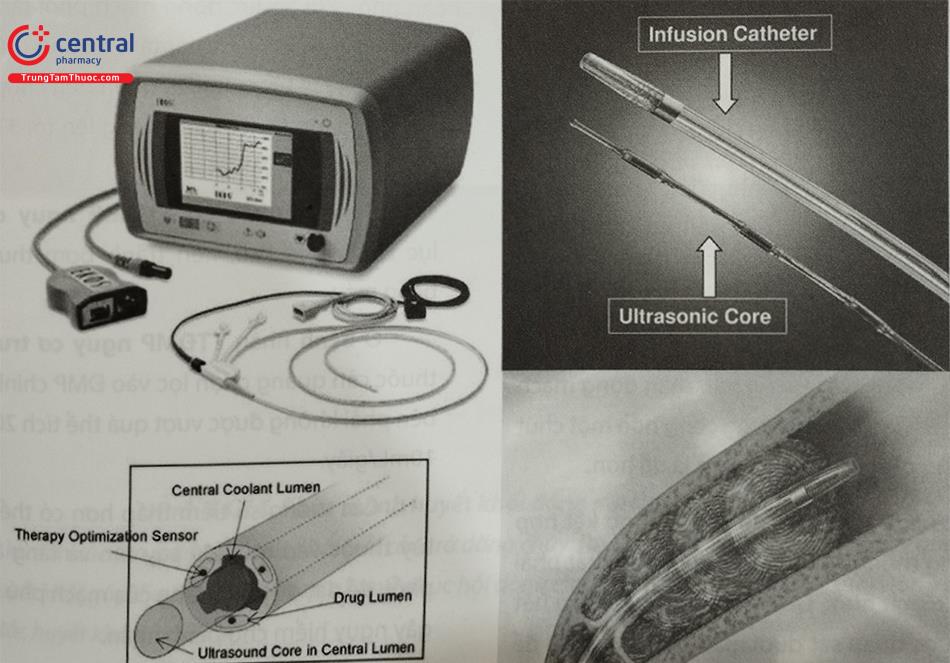
5.6 Thiết bị Ekosonic
Hệ thống can thiệp nội mạch EkoSonic (EKOS Corpora- tion, Bothwell, WA) được sử dụng trong điều trị bệnh nhân thuyên tắc phổi cấp tính. Thiết bị này bao gồm hai thiết bị nội mạch: một ống thông phân phối thuốc thông minh (IDDC), một ống thông truyền đa nòng 5,2 Fr và một thiết bị siêu âm (MSD) có chứa một số đầu dò siêu âm cách đều nhau được đặt dọc theo vùng điều trị.
Thiết bị Ekosonic có khả năng truyền đồng thời một loại thuốc tiêu sợi huyết trong động mạch phổi và phát ra sóng siêu âm tần số cao (2,2 MHz) công suất thấp giúp “làm lỏng” cục huyết khối, tăng sự thâm nhập của thuốc tiêu sợi huyết vào cục huyết khối và (về mặt lý thuyết) đẩy nhanh quá trình tiêu huyết khối.
6 Các bước thủ thuật
6.1 Chuẩn bị bệnh nhân trước can thiệp
Đối với những bệnh nhân nhồi máu phổi nguy cơ cao có sốc tim hoặc suy hô hấp nặng, nên cân nhắc nguy cơ và lợi ích của gây mê toàn thân. Cần lưu ý rằng thuốc an thần để đặt nội khí quản và thông khí áp lực dương có thể làm giảm tiền gánh, làm nặng thêm tình trạng suy chức năng thất phải và gây tụt huyết áp. Cũng như đánh giá toàn diện bệnh nhân dựa trên các bệnh lý đồng mắc để quyết định chiến lược gây tê tại chỗ hay đặt ống nội khí quản với gây mê toàn thân.
Siêu âm tĩnh mạch đùi chung hoặc tĩnh mạch cảnh trong nên được thực hiện trước thủ thuật để chắc chắn rằng không có sự hiện diện của huyết khối ở vị trí đường vào mạch máu. Trước khi đưa ống thông lên thân động mạch phổi, kiểm tra điện tâm đồ xem có hình ảnh block nhánh trái hay không. Đối với những bệnh nhân bị block nhánh trái, cần đặt máy tạo nhịp tạm thời trước khi làm thủ thuật, vì thao tác đưa dây dẫn, ống thông ở tim phải có thể gây ra block nhánh phải và hậu quả gây ra block nhĩ thất hoàn toàn.
6.2 Đưa ống thông lên thân động mạch phổi
Đường vào mạch máu tại vị trí tĩnh mạch đùi hoặc tĩnh mạch cảnh. Chọc đường vào mạch máu dưới hướng dẫn của siêu âm được khuyến khích giúp giảm nguy cơ chảy máu trước, trong và sau quá trình làm can thiệp cũng như tránh chọc vào động mạch. Có nhiều phương pháp thăm dò động mạch phổi khác nhau tùy thuộc vào kinh nghiệm của bác sĩ can thiệp và thiết bị sẵn có.
Hệ thống ống thông (catheter) như ống thông cong, Grollman, hoặc pigtail cùng với dây dẫn (guidewire) ưa nước (Terumo, Somerset, NJ) và thiết bị kiểm soát quá trình xoay của dây dẫn (Torque). Một số bác sĩ can thiệp sẽ uốn cong đầu của dây dẫn Bentson và luồn vào trong lòng ống thông để giúp di chuyển ống thông vào thân động mạch phổi dễ dàng hơn, do pigtail đỡ đường cong hơn một chút và tạo điều kiện cho pigtail đi qua van ba lá dễ hơn.
Sau khi qua van ba lá thì tiếp tục đẩy ống thông kết hợp xoay 180 độ thì ống thông sẽ đến vị trí đường ra thất phải rồi lên thân động mạch phổi. Quá trình thủ thuật cần hết sức cẩn thận và được quan sát dưới màn huỳnh quang để giảm nguy cơ tổn thương mạch máu do dây dẫn hoặc ống thông. Ngoài ra, cần có sự theo dõi liên tục tình trạng lâm sàng cũng như monitor để phát hiện và xử trí sớm tình trạng suy hô hấp, các rối loạn nhịp thất.
Sau khi ống thông đã đến vị trí đường ra thất phải, có thể được thay thế bằng dây dẫn với lớp vỏ kị nước như dây Rosen để có cố định vị trí chắc hơn ở thân động mạch phổi. Nếu có chiến lược tiêu sợi huyết trước khi hút huyết khối, một long sheath có đường kính lớn hơn 2Fr so với ống thông dùng để bơm thuốc tiêu sợi huyết, mục đích là để theo dõi áp lực động mạch phổi chính xác nhất. Ví dụ, một long sheath với đường kính 7 hoặc 8 Fr (ví dụ, vỏ bọc Flexor, Cook, Bloomington, IN) kéo dài từ đường vào mạch máu đến thân động mạch phổi sẽ chứa một ống thông truyền thuốc tiêu sợ huyết 5 Fr (Angiodynamics, Latham, NY) để cho phép đo PAP đồng thời.
Ngoài ra, nếu cần thiết lập 2 vị trí ống thông truyền thuốc tiêu sợi huyết, nên sử dụng 2 long sheath, không nên đặt chung trong 1 long sheath do nguy cơ thuốc sẽ bị rò rỉ ra xung quanh ống thông, 2 long sheath này có thể ở cùng 1 tĩnh mạch hoặc 2 tĩnh là tĩnh mạch cảnh trong (IJV) và/ hoặc tĩnh mạch đùi chung (CFV).
6.3 Đo áp lực và chụp mạch phổi
Trước khi thực hiện chụp động mạch phổi, mức độ tăng áp động mạch phổi và dự trữ tim phổi là những cân nhắc quan trọng. Các yếu tố này phải để xác định tốc độ và thể tích bơm thuốc cản quang một cách an toàn vào hệ tuần hoàn phổi. Khi áp lực động mạch phổi tâm thu vượt quá 55 mmHg hoặc áp lực cuối tâm trương thất phải lớn hơn 20 mmHg, tỷ lệ tử vong liên quan đến chụp mạch phổi sử dụng lượng lớn thuốc cản quang lên tới 3%. Một số lưu ý trong bơm thuốc cản quang:
- Ở bệnh nhân có TTĐMP nguy cơ cao với áp lực ĐMP tăng cao, nên tránh bơm thuốc cản quang bằng máy.
- Ở bệnh nhân TTĐMP nguy cơ trung bình, tiêm thuốc cản quang chọn lọc vào ĐMP chính bên trái hoặc bên phải không được vượt quá thể tích 20 mL với tốc độ 10mL/giây.
- Các thông số tiêm thấp hơn có thể được xem xét tùy thuộc vào mức độ suy tim và tăng áp động mạch phổi, để đạt được độ sáng của mạch phù hợp mà không gây nguy hiểm cho bệnh nhân.
Tốc độ chụp hình là 6 khung hình/giây và điều này lý tưởng nên được thực hiện trong thời gian nín thở vài giây mà bệnh nhân có thể chấp nhận được. Khi chụp mạch số hóa nền (DSA), cần xác định nhánh động mạch phổi có huyết khối lớn nhất và tương quan với hình ảnh cắt ngang trong MSCT ngực trước đó nếu có.
6.4 Phân mảnh và hút huyết khối
Kỹ thuật đơn giản được sử dụng rộng rãi nhất là sử dụng pigtail phân mảnh. (Hình 54.14). Đường vào là tĩnh mạch đùi hoặc tĩnh mạch cảnh. Guidewire được đưa vào động mạch phổi (ĐMP) xuyên qua huyết khối. So với pigtail truyền thống, pigtail phân mảnh dùng trong TTĐMP cấp có một lỗ bên hình bầu dục ở mặt ngoài chỗ uốn cong. Điều này cho phép ống thông “over the wire” và wire được sử dụng như một trục quay xung quanh. Ống thông 8 mm có thể phù hợp cho các ĐM phổi có nhánh và ống thông 12 mm dùng cho ĐMP phải và ĐMP trái.
Thủ thuật này có thể được thực hiện trong khoảng 30 phút, làm phân nhỏ huyết khối, giúp biến huyết khối ĐM lớn thành huyết khối các động mạch nhỏ hơn và cải thiện huyết động tuần hoàn phổi (Hình 54.14c). Ngoài ra, thủ thuật này làm tăng diện tích bề mặt tiếp xúc huyết khối với thuốc tiêu sợi huyết. Trong một nghiên cứu tổng quan về các kỹ thuật can thiệp, kỹ thuật phân nhỏ huyết khối có hiệu quả về mặt lâm sàng là 80%, với ít biến chứng. Ngoài ra, có thể thực hiện thủ thuật bổ sung sau kỹ thuật phân mảnh bằng cách đưa một bóng nong (9 – 14 mm) qua huyết khối. Bóng phải có kích thước nhỏ hơn so với đường kính động mạch phổi để tránh các biến chứng.
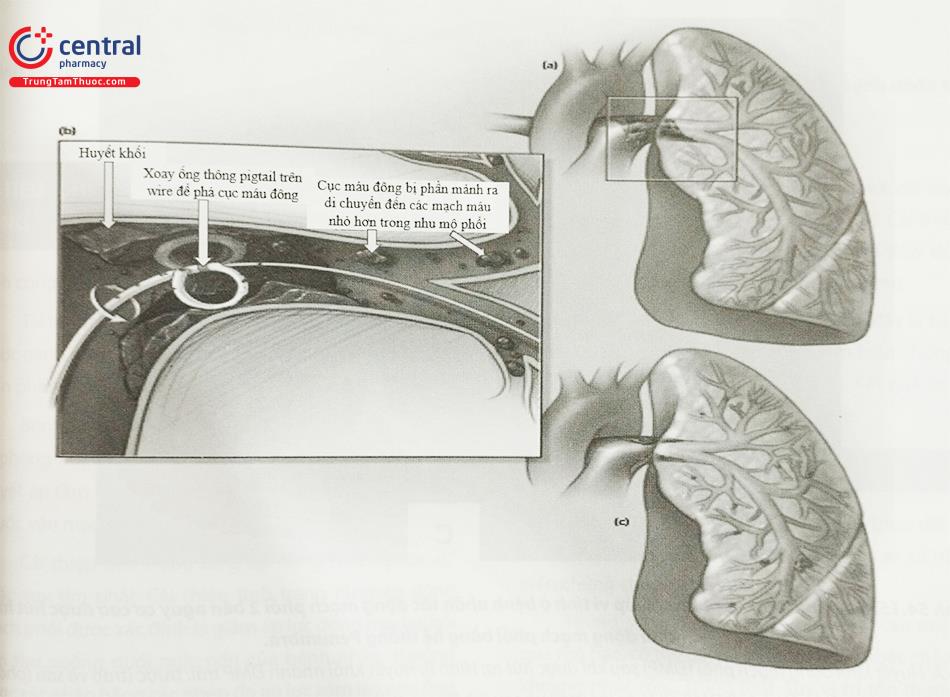
Huyết khối kích thước lớn ở động mạch phổi trái cản trở dòng chảy. (b) Ống thông Pigtail được quay quanh trục dây wire để phân mảnh huyết khối gây thuyên tắc đoạn xa nhưng phục hồi dòng chảy động mạch phổi chính. (c) Dòng chảy được khôi phục với sự thuyên tắc huyết khối nhỏ ở
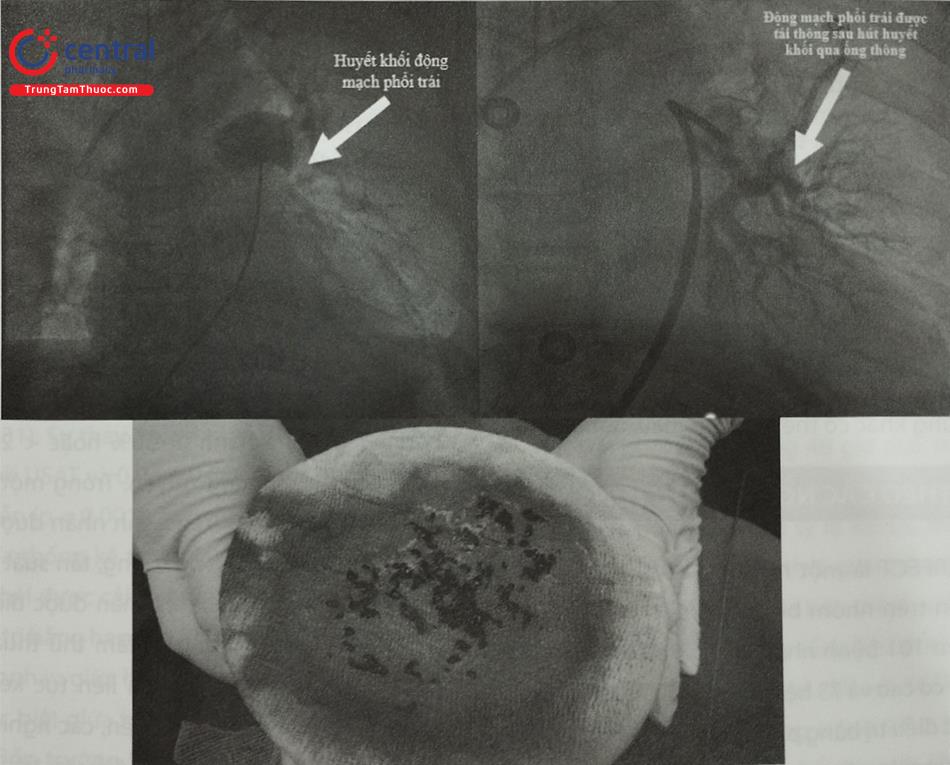
Ngoài kỹ thuật phân mảnh huyết khối, có thể loại bỏ huyết khối bằng cách hút từ các động mạch phổi nhỏ hơn. Thủ thuật này có thể được thực hiện cần ống thông có lỗ tận (8 hoặc 9 Fr) được đặt vào cục huyết khối và hút bằng áp lực âm. Trong một đánh giá tổng quan về các phương pháp điều trị tiêu sợi huyết qua đường ống thông, phẫu thuật cắt bỏ huyết khối bằng hút áp lực âm, có kèm theo kỹ thuật phân mảnh hoặc không, thành công về mặt kỹ thuật đạt được trong 40% –100% trường hợp.
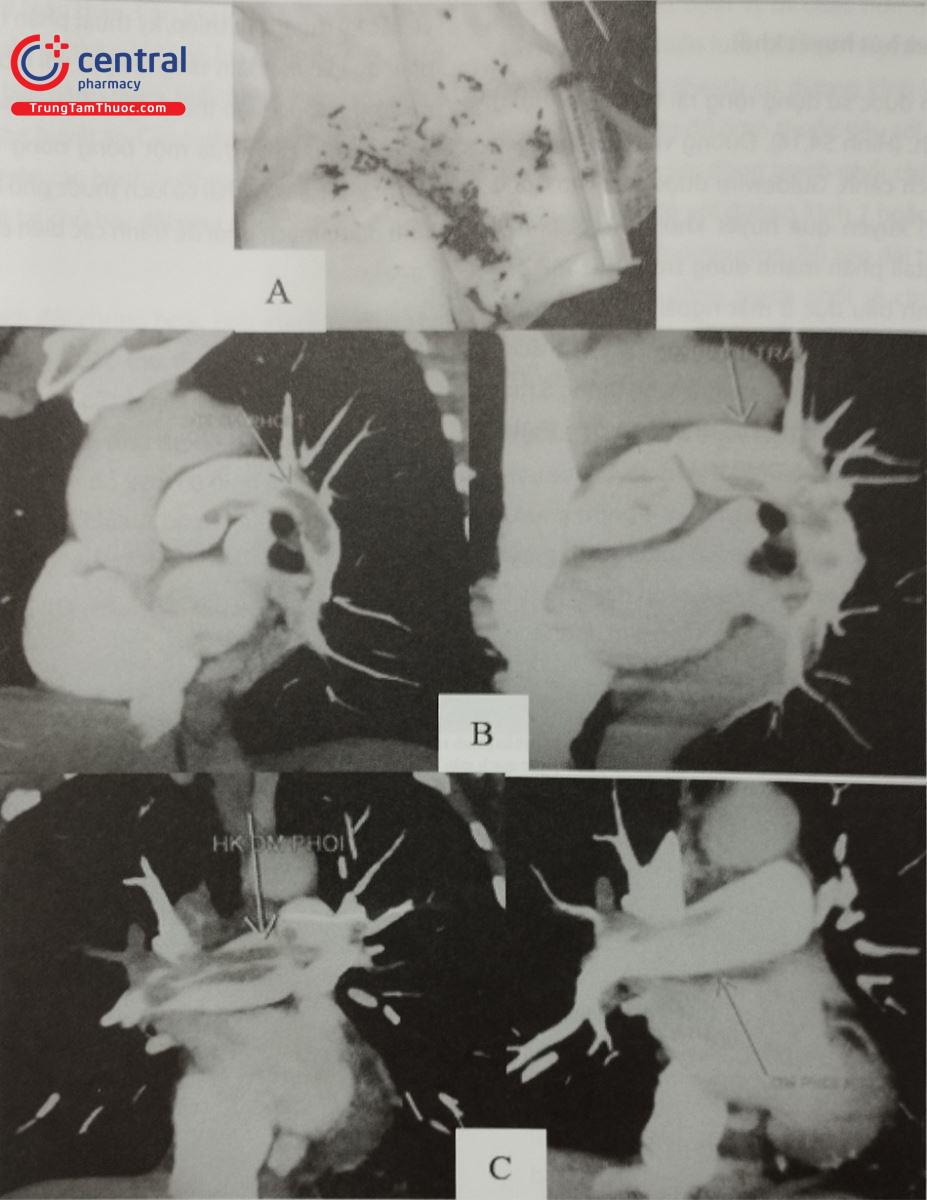
Hình A: Huyết khối động mạch phổi (ĐMP) sau khi được hút ra; Hình B: Huyết khối nhánh ĐMP trái: trước (trái) và sau (phải) can thiệp; Hình C: Huyết khối nhánh ĐMP phải: trước (trái) và sau (phải) can thiệp.
7 Tiêu chí đánh giá thủ thuật thành công
Thành công lâm sàng khi đạt được tất cả các tiêu chí:
Tái thông được các nhánh động mạch phổi và giảm được gánh nặng huyết khối sau quá trình hút huyết khối trên phim chụp mạch.
Bệnh nhân ổn định huyết động: được định nghĩa là phòng hoặc cải thiện tình trạng sốc tim (sốc tim khi huyết áp tâm thu < 90 mmHg) mà không cần dùng các thuốc vận mạch hoặc các thiết bị cơ học.
Cải thiện tình trạng tăng áp động mạch phổi và/ hoặc suy tim phải: Cải thiện tình trạng tăng áp động mạch phổi được xác định là giảm áp lực động mạch phổi tâm thu xuống dưới mức nền của bệnh nhân, thường được xác nhận bằng các phép đo áp lực xâm lấn qua ống thông, cũng có thể đo qua siêu âm tim sau can thiệp. Rối loạn chức năng thất phải được đánh giá trên siêu âm tim bằng cách so sánh các thông số trước và sau can thiệp loại bỏ huyết khối mạch phổi dựa trên hướng dẫn thực hành hiện tại và được phân loại thành 4 mức độ suy thất phải (bình thường, nhẹ, trung bình, nặng). Cải thiện rối loạn chức năng thất phải được xác định là thay đổi ≥ 1 mức đối với chức năng thất phải bình thường.
Bệnh nhân sống sót đến khi ra viện: đây là tiêu chí về kết quả an toàn chính liên quan đến biến chứng của thủ thuật và các biến cố chảy máu lớn. Kết quả an toàn thứ cấp là các biến chứng chảy máu nhẹ.
8 Biến chứng và xử trí
- Biến chứng đường vào mạch máu: theo dõi vị trí tĩnh mạch sau khi rút sheath để phát hiện và xử trí sớm biến chứng chảy máu.
- Thủng, vỡ tĩnh mạch trong quá trình can thiệp: do quá thô bạo, có thể gây tụ máu trong cơ hoặc chảy máu khoang phúc mạc, trung thất. Tùy vị trí tổn thương và mức chảy máu mà hướng xử trí có thể dùng bằng ép ngoài hoặc phẫu thuật cấp khi cần thiết.
- Biến chứng chảy máu sau thủ thuật liên quan đến thuốc tiêu sợi huyết và chống đông.
- Tụt áp trong quá trình can thiệp: có thể do nguyên nhân chảy máu hoặc do hút ra lượng máu quá lớn. đặc biệt để ý với dụng cụ hút huyết khối Penumbra Indigo.
Block dẫn truyền trong tim: trong trường hợp bệnh nhân can thiệp thuyên tắc động mạch phổi có thể xuất hiện block nhánh phải mới. Vì vậy, nếu bệnh nhân có block nhánh trái từ trước thì nên được đặt máy tạo nhịp tim tạm thời trong quá trình làm thủ thuật để tránh nguy cơ tiến triển thành block nhĩ thất hoàn toàn, làm nặng thêm tình trạng huyết động của bệnh nhân.
- Biến chứng khác có thể gặp: tan máu, đột quỵ não.
9 Kết quả theo các nghiên cứu lớn
Thử nghiệm PERFECT là một nghiên cứu sổ bộ đa trung tâm, ngẫu nhiên trên nhóm bệnh nhân TTĐMP cấp tính. Nghiên cứu gồm 101 bệnh nhân, trong đó 28 bệnh nhân có TTĐMP nguy cơ cao và 73 bệnh nhân có TTĐMP nguy cơ trung bình được điều trị bằng phương pháp hút huyết khối cơ học hoặc tiêu sợi huyết trực tiếp qua đường ống thông với thuốc tiêu sợi huyết là rtPA hoặc urokinase. Thành công được xác định khi đáp ứng đầy đủ các tiêu chí: Bệnh nhân ổn định huyết động, cải thiện tình trạng tăng áp phổi, sức căng tim phải và bệnh nhân sống sót ra viện. Kết cục an toàn chính là các biến chứng liên quan đến thủ thuật và các biến cố chảy máu lớn. Kết quả cho thấy tỷ lệ thành công về mặt lâm sàng đạt 85,7% (95%CI: 67,3% – 96,0%) ở nhóm bệnh nhân có TTĐMP nguy cơ cao và 97,3% (95%CI: 90,5% – 99,7%) ở nhóm bệnh nhân có TTĐMP nguy cơ trung bình. Áp lực động mạch phổi trung bình cải thiện từ 51,17 ± 14,06 mmHg xuống 37,23 ± 15,81 mmHg (n = 92) (p < 0,0001). Trong số các bệnh nhân được theo dõi bằng siêu âm Doppler tim cho thấy có 89,1% (95%CI: 78,8% – 95,5%; p < 0,0001) cải thiện sức căng thất phải. Không có biến chứng nào liên quan đến thủ thuật và không có biến có chảy máu lớn nào được ghi nhận.
Để giảm liều thuốc tiêu sợi huyết đường toàn thân (thường 50 – 100 mg trong 1 – 2 giờ) trong điều trị TTĐMP, các thuốc tiêu huyết khối tại chỗ đã được dùng để làm giảm nguy cơ chảy máu. Tiêu sợi huyết tại chỗ được sử dụng như một phương pháp điều trị độc lập hoặc hỗ trợ trong gần 2/3 tổng số caCDT (catheter-directed thrombolysis) được chỉ định trong TTĐMP nặng và trung bình. Đường vào của guidewire là tĩnh mạch đùi hoặc tĩnh mạch cảnh. Sau đó, một ống thông tiêu sợi huyết nhiều lỗ (UniFuse – Angiodynamics, Lytham, NY) được đặt vào bên trong cục huyết khối, và thuốc tiêu sợi huyết (urokinase hoặc tPA) được truyền một bên hoặc hai bên. Liều đối với tPA là 1 – 2 mg/giờ, thường truyền liên tục trong trong khoảng 15 giờ. Sau đó tiến hành chụp động mạch phổi để theo dõi. Liều của tPA thường < 30 mg, do đó về mặt lý thuyết, phương pháp này có nguy cơ biến chứng chảy máu thấp hơn. Nếu bệnh nhân cần được truyền thuốc tiêu sợi huyết kéo dài (> 24 giờ), cần theo dõi nồng độ fibrinogen máu chặt chẽ. Nếu mức fibrinogen giảm mạnh (> 50% hoặc < 200 mg/dL), nên giảm liều hoặc ngừng truyền. Trong một phân tích tổng hợp các thử nghiệm trên bệnh nhân được tiến hành tiêu sợi huyết qua đường ống thông, tần suất thành công cao hơn nếu ít nhất 80% bệnh nhân được điều trị tiêu huyết khối tại chỗ trong thời gian làm thủ thuật (91,2% so với 82,8%, p = 0,01) hoặc truyền liên tục kéo dài (89,2% so với 84,2%, p = 0,045). Tuy nhiên, các nghiên cứu là không đồng nhất, do đó lợi ích của điều trị tiêu huyết khối qua đường ống thông khó được chứng minh hiệu quả hơn so với các phương pháp khác.
Để cải thiện lượng tPA đến mạch máu phổi và giảm thời gian truyền tPA (mục đích là giảm tổng liều tPA), hệ thống siêu âm hỗ trợ (USAT) được sử dụng cho TTĐMP lớn và trung bình. Hiện tại, hệ thống nội mạch EkoSonic (EKOS Corp, Bothwell, WA) là thiết bị duy nhất được phép sử dụng tại Hoa Kỳ. Năng lượng sóng siêu âm làm phân chia có đảo ngược các sợi fibrin và mở ra các vị trí gắn kết tPA để tạo điều kiện cho thuốc tác dụng. Ngoài ra, sóng siêu âm có thể làm tăng sự thâm nhập của thuốc tiêu sợi huyết vào huyết khối bằng cách truyền âm. Điều này có thể được thực hiện một cách đơn phương hoặc song phương, loại sau phổ biến hơn. Ống thông của hệ thống siêu âm tương thích với catheter 6Fr. Tuy nhiên, nếu có kế hoạch điều trị động mạch phổi hai bên, thì cần phải dùng sheath tĩnh mạch đùi 10-Fr. Hệ thống mạch máu phổi được lựa chọn bằng các kỹ thuật tiêu chuẩn. Khi dây dẫn đến các động mạch thùy, ống thông truyền thuốc tiêu sợi huyết được “over the wire” và đầu sóng phát sóng siêu âm được đưa vào để phát với tần số cao (2,2 GHz) với mức năng lượng thấp (0,5 W trên mỗi ống dẫn).
Thử nghiệm ULTIMA là thử nghiệm ngẫu nhiên về điều trị bằng hệ thống siêu âm hỗ trợ cho đến nay. Thử nghiệm này chọn ngẫu nhiên 59 bệnh nhân có TTĐMP nguy cơ trung bình (tỷ lệ đường kính RV/LV ≥ 1,0) để điều trị bằng Heparin hoặc heparin kết hợp với USAT (hệ thống EkoSonic – tiêu sợi huyết một bên hoặc hai bên ĐMP) với liều tPA 1 mg/giờ trong 15 giờ. Tiêu chí chính là sự thay đổi tỷ lệ RV/LV lúc ban đầu so với 24 giờ sau khi điều trị. Ở nhóm USAT, 100% bệnh nhân được đặt catheter thành công (trong đó 87% được đặt catheter hai bên). Có sự khác biệt đáng kể về tỷ lệ RV/LV (thất phải/thất trái) đối với nhóm USAT (1,28 ± 0,19 đến 0,99 ± 0,17, p < 0,001) so với nhóm điều trị heparin đơn thuần (1,2 ± 0,14 đến 1,17 ± 0,2, p = 0,31). Sự thay đổi về tỷ số RV/LV trung bình là 0,3 ± 0,2 đối với USAT và 0,03 ± 0,16 đối với nhóm dùng heparin đơn thuần (p < 0,001). Tuy nhiên, sự khác biệt này không có ý nghĩa thống kê trong 90 ngày. Hầu hết huyết động của thất phải được cải thiện đáng kể sau 24 giờ với USAT so với điều trị bằng heparin. Thời gian nằm viện trung bình không khác nhau giữa hai nhóm. Sau 90 ngày, tỷ lệ tử vong không khác biệt giữa hai nhóm và không có biến cố xuất huyết lớn. Bốn trường hợp chảy máu nhẹ xảy ra với USAT và một trường hợp ở nhóm dùng heparin đơn thuần.
Trong một loạt các nghiên cứu hồi cứu lớn hơn, USAT có tác động tương tự đối với việc cải thiện tỷ số đường kính RV/LV (thất phải/thất trái). Engelberger và cộng sự báo cáo trên 52 bệnh nhân TTĐMP nguy cơ trung bình và cao. Tỷ lệ RV/LV giảm từ 1,42 ± 0,21 xuống 1,06 ± 0,23 sau 24 giờ (p < 0,001). Những bệnh nhân TTĐMP nguy cơ cao có lợi hơn so với nhóm có nguy cơ trung bình cao. Các biến chứng bao gồm tử vong 3,8%, chảy máu lớn ở 3,8% bệnh nhân và chảy máu nhỏ ở 21% bệnh nhân. Ngoài ra, Kennedy và cộng sự báo cáo trên 60 bệnh nhân được điều trị bằng USAT. Tất cả các bệnh nhân đều được đặt catheter thành công. Huyết khối tiêu hoàn toàn ở 57% trường hợp và áp lực thất phải giảm đáng kể, tỷ lệ tử vong là 5%. McCabe và cộng sự nghiên cứu trên 53 bệnh nhân thấy cải thiện tương tự về tỷ lệ RV/LV và áp lực thất phải, tỷ lệ chảy máu 9,4% . Một loạt bài khác cũng đã cho thấy USAT có tỷ lệ chảy máu 2% –20% và tỷ lệ tử vong thấp. Cuối cùng, trong báo cáo duy nhất để so sánh USAT với điều trị tiêu huyết khối hướng dẫn qua ống thông tiêu chuẩn, Lin và cộng sự báo cáo USAT làm tan huyết khối hoàn toàn hơn, thời gian truyền thuốc ngắn hơn (17,4 ± 5,2 so với 25,3 ± 7,3 (h), p = 0,03), liều tPA thấp hơn (17,2 ± 2,4 so với 25,4 ± 5,3 (mg), p = 0,03) và biến chứng chảy máu thấp hơn (0% so với 21%, p = 0,02) so với tiêu huyết khối hướng dẫn qua ống thông tiêu chuẩn.
Thử nghiệm ngẫu nhiên SUNSET sPE Trial so sánh USAT so với tiêu huyết khối qua catheter tiêu chuẩn SCDT ở nhóm đối tượng thuyên tắc huyết khối động mạch phổi nguy cơ trung bình. Những người tham gia được chọn ngẫu nhiên 1:1 vào USAT hoặc SCD, 81 bệnh nhân được tham gia nghiên cứu. Tiêu chí đánh giá chính là sự tiêu huyết khối động mạch phổi trong vòng 48 giờ dựa trên thang điểm Miller trong chụp cắt lớp vi tính trước và sau can thiệp. Kết cục phụ bao gồm cải thiện tỷ lệ RV/LV, thời gian điều trị tại đơn vị hồi sức cấp cứu, thời gian nằm viện và biến cố chảy máu. Thời gian đánh giá tiêu chí phụ lên đến 90 ngày. Kết quả nghiên cứu cho thầy tổng liều alteplase trung bình đối với USAT là 19 ± 7 mg và đối với SCDT là 18 ± 7 mg (p = 0,53), truyền tương ứng trong 14 ± 6 và 14 ± 5 giờ (p = 0,99). Ở nhóm USAT, điểm huyết khối động mạch phổi trung bình giảm từ 31 ± 4 lúc ban đầu xuống 22 ± 7 (p < 0,001). Ở nhóm SCDT, điểm số giảm từ 33 ± 4 xuống 23 ± 7 (p < 0,001). Không có sự khác biệt đáng kể về mức giảm điểm huyết khối trung bình giữa 2 nhóm (p = 0,76). Tỷ lệ RV/LV giảm trung bình tại thời điểm ban đầu là 1,54 ± 0,30 đối với USAT, 1,69 ± 0,44 đối với SCDT và đến 48 giờ là 0,37 ± 0,34 ở nhóm USAT và 0,59 ± 0,42 ở nhóm SCDT (p = 0,01). Chảy máu lớn xảy ra trên 2 bệnh nhân (một trường hợp đột quỵ và một trường hợp chảy máu âm đạo cần truyền máu), cả hai đều thuộc nhóm USAT. Một RCT so sánh giữa điều trị heparin thông thường với điều trị bằng catheter bao gồm can thiệp điều trị bằng hệ thống siêu âm hỗ trợ và tiêu sợi huyết tại chỗ liều thấp với 59 bệnh nhân có TTĐMP nguy cơ trung bình. Trong nghiên cứu đó, tiêu sợi huyết có trợ giúp của siêu âm có liên quan đến giảm nhiều hơn tỷ lệ đường kính RV/LV (thất phải/thất trái) ở giờ thứ 24 sau thủ thuật, mà không tăng nguy cơ chảy máu. Dữ liệu từ hai nghiên cứu tiến cứu và một nghiên cứu sổ bộ với tổng số 352 bệnh nhân, cho kết quả cải thiện chức năng RV, tưới máu phổi và áp lực mạch phổi ở bệnh nhân TTĐMP nguy cơ trung bình hoặc cao.
10 Kết luận
Như vậy, phân tầng nguy cơ là bước quan trọng đầu tiên trong quản lý TTĐMP cấp. Đối với TTĐMP nguy cơ cao, liệu pháp tiêu huyết khối toàn thân là phương pháp điều trị đầu tay. Nếu chống chỉ do nguy cơ chảy máu cao, hoặc nếu tình trạng bệnh nhân quá nguy kịch thì phẫu thuật hoặc lấy huyết khối qua đường ống thông có thể được xem xét để nhanh chóng ổn định huyết động. Hơn nữa, phẫu thuật hoặc lấy huyết khối qua đường ống thông nên được xem xét nếu quá trình tiêu huyết khối tĩnh mạch thất bại. Các kỹ thuật lấy huyết khối qua đường ống thông mới được phát triển có tiềm năng đầy hứa hẹn vì chúng giúp cải thiện huyết động nhanh chóng và giảm đáng kể với tỷ lệ chảy máu.
11 Tài liệu tham khảo
- V. Konstantinides, G. Meyer, C. Becattini, H. Bueno, G.J. Geersing, V.P. Harjola, et al.ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): the Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC)Eur. Respir. J., 54 (3) (2019).
- V. Konstantinides, A. Torbicki, G. Agnelli, N. Danchin, D. Fitzmaurice, N. Galie, et al. Corrigendum to: 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism Eur. Heart J., 36 (39) (2015), p. 2642.
- Lenga, F. Trapp, M.H. Albrecht, J.L. Wichmann, A.A. Johnson, I. Yel, et al. Single- and dual-energy CT pulmonary angiography using second- and third-generation dual-source CT systems: comparison of radiation dose and image quality Eur. Radiol., 29 (9) (2019), pp. 4603-4612.
- M. Dudzinski, J. Giri, K. Rosenfield. Interventional treatment of pulmonary embolism Circ. Cardiovasc. Interv., 10 (2) (2017).
- R. Jaff, M.S. McMurtry, S.L. Archer, M. Cushman, N. Goldenberg, S.Z. Goldhaber, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association Circulation, 123 (16) (2011), pp. 1788-1830.
- Jimenez, J. de Miguel-Diez, R. Guijarro, J. Trujillo-Santos, R. Otero, R. Barba, et al. Trends in the management and outcomes of acute pulmonary embolism: analysis from the RIETE registry J. Am. Coll. Cardiol., 67 (2) (2016), pp. 162-170.
- Meyer, E. Vicaut, T. Danays, G. Agnelli, C. Becattini, J. Beyer-Westendorf, et al.Fibrinolysis for patients with intermediate-risk pulmonary embolism N. Engl. J. Med., 370 (15) (2014), pp. 1402-1411.
- Grifoni, I. Olivotto, P. Cecchini, F. Pieralli, A. Camaiti, G. Santoro, et al.Short-term clinical outcome of patients with acute pulmonary embolism, normal blood pressure, and echocardiographic right ventricular dysfunction Circulation, 101 (24) (2000), pp. 2817-2822.
- Tanabe, T. Yamamoto, T. Murata, K. Mabuchi, N. Hara, A. Mizuno, et al.Gender differences among patients with acute pulmonary embolism Am. J. Cardiol., 122 (6) (2018), pp. 1079-1084.
- Keller, L. Rappold, A. Gerhold-Ay, L. Hobohm, G. Hasenfuss, S.V. Konstantinides, et al. Sex-specific differences in pulmonary embolism Thromb. Res., 178 (2019), pp. 173-181.
- Chatterjee, A. Chakraborty, I. Weinberg, M. Kadakia, R.L. Wilensky, P. Sardar, et al.Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis J. Am. Med. Assoc., 311 (23) (2014), pp. 2414-2421.
- Kearon, E.A. Akl, J. Ornelas, A. Blaivas, D. Jimenez, H. Bounameaux, et al. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report Chest, 149 (2) (2016), pp. 315-352.
- Arora, S.S. Panaich, N. Ainani, V. Kumar, N.J. Patel, B. Tripathi, et al. Comparison of in-hospital outcomes and readmission rates in acute pulmonary embolism between systemic and catheter-directed thrombolysis (from the national readmission Database) Am. J. Cardiol., 120 (9) (2017), pp. 1653-1661.
- A. de Winter, E.A. Hart, D.A.F. van den Heuvel, A. Moelker, R.J. Lely, K.A.H. Kaasjager, et al. Local ultrasound-facilitated thrombolysis in high-risk pulmonary embolism: first Dutch experience Cardiovasc. Intervent. Radiol., 42 (7) (2019), pp. 962-969.
- P. Engelberger, N. Kucher Ultrasound-assisted thrombolysis for acute pulmonary embolism: a systematic review Eur. Heart J., 35 (12) (2014), pp. 758-764.
- Kucher, P. Boekstegers, O.J. Muller, C. Kupatt, J. Beyer-Westendorf, T. Heitzer, et al.Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism Circulation, 129 (4) (2014), pp. 479-486.

