Tim mạch can thiệp: Can thiệp thân chung động mạch vành trái
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn:
TS.BSNT Lê Thanh Bình
ThS. BSNT Đàm Trung Hiếu
PGS.TS.BS Phạm Mạnh Hùng
Các nội dung về giải phẫu, hình thái tổn thương, chỉ định và chống chỉ định trong can thiệp thân chung động mạch vành trái,,... sẽ được Trung tâm thuốc Central Pharmacy (trungtamthuoc.com) gửi đến bạn đọc trong bài viết sai đây.
1 Đại cương
Tổn thương thân chung động mạch vành trái (left main coronary artery, viết tắt là LM) được mô tả lần đầu tiên bởi James Herrick năm 1912 ở bệnh nhân chết vì sốc tim sau khi bị nhồi máu cơ tim cấp. Tổn thương ở vị trí LM xuất hiện trong khoảng 3 đến 5% ở những bệnh nhân khi chụp mạch vành qua da và từ 10% đến 30% ở những bệnh nhân khi thực hiện phẫu thuật bắc cầu nối chủ vành.
Do chi phối một vùng cơ tim rộng lớn, tổn thương tại thân chung mạch vành trái thường có tỉ lệ biến cố và tỉ lệ tử vong cao, do đó phẫu thuật bắc cầu nối chủ vành (CABG) được coi là phương pháp điều trị tối ưu nhất. Tuy nhiên, vài thập kỷ trở lại đây có tiến bộ đáng kể về can thiệp mạch vành qua da (PCI), đặc biệt là sự ra đời các loại stent thế hệ mới, phát triển nhiều kỹ thuật can thiệp nâng cao và sự tối ưu trong điều trị nội khoa đã cải thiện đáng kể kết quả của PCI khi can thiệp tổn thương ở vị trí LM.
Việc sử dụng rộng rãi các loại stent phủ thuốc làm cho PCI ở tổn thương LM càng được thực hiện nhiều hơn và đem lại hiệu quả tốt hơn. Gần đây một vài thử nghiệm lâm sàng sử dụng các loại stent phủ thuốc thế hệ 1 và thế hệ 2 đã cho thấy tỉ lệ sống còn tương đương giữa PCI và CABG. Do đó can thiệp mạch vành ở tổn thương LM càng ngày càng được thực hiện nhiều hơn và trở thành lựa chọn ưu tiên ở những bệnh nhân có tổn thương LM.
2 Giải phẫu và hình thái tổn thương
Thân chung động mạch vành trái (LM) xuất phát từ xoang vành trái ngay phía dưới vị trí nối của gốc động mạch chủ với xoang vành. Khoảng 2/3 bệnh nhân LM sẽ chia nhánh thành động mạch liên thất trước (LAD) và động mạch mũ (LCX), 1/3 số bệnh nhân sẽ chia làm 3 nhánh là LAD, LCX và nhánh phân giác (Ramus).
LM cung cấp máu khoảng 75% cho cơ thất trái. Khảo sát khi mổ tử thi 100 trường hợp cho thấy LM có chiều dài trung bình 10,8 mm (±5,2 mm, 2 – 23 mm), đường kính trung bình là 4,9 mm (±0,8)mm), độ gập góc của các nhánh là 86,7° (±28,8, 40→165°).
Tổn thương LM được chia theo giải phẫu thành 3 vùng bao gồm: lỗ vào, vùng giữa và vùng chia nhánh. Về mô bệnh học thì lỗ vào LM có cấu trúc tương tự cấu trúc của động mạch chủ với chủ yếu là tế bào cơ trơn và sợi fibrin. Vùng mạch chỗ chia nhánh là phần của LM dễ hình thành xơ vữa động mạch bởi vì sự xáo trộn của các dòng chảy. Thành mạch đối bên cựa carina thường là vị trí tập trung xơ vữa nhiều hơn, trong khi tại carina thường trơn nhẵn.
3 Chỉ định và chống chỉ định
3.1 Theo khuyến cáo của Hiệp hội Tim mạch châu Âu năm 2018 (ESC)
Tái tưới máu LM được chỉ định khi có hẹp > 50% trên chụp mạch và có bằng chứng của thiếu máu cơ tim.
Nếu hình ảnh chụp mạch còn nghi ngờ, nên phối hợp với các thăm dò khác như siêu âm trong lòng mạch (IVUS), đo phân suất dự trữ lưu lượng vành (FFR). Chỉ định can thiệp khi:
- Diện tích lòng mạch tối thiểu (minimum lumen area – MLA) trên IVUS ≤ 6 mm2 và FFR ≤ 0,8 (lưu ý FFR có một hạn chế là trong trường hợp có tổn thương hẹp ở các nhánh LAD hay LCX thì kết quả FFR có thể thiếu chính xác).
- Việc lựa chọn chiến lược phẫu thuật bắc cầu nối chủ vành (CABG) hay can thiệp PCI phụ thuộc vào rất nhiều yếu tố như: mức độ phức tạp của tổn thương dựa vào thang điểm SYNTAX, các yếu tố nguy cơ của phẫu thuật, kinh nghiệm của từng trung tâm, và nguyện vọng của người bệnh…
Hiện nay, đối với mọi tổn thương LM, phẫu thuật CABG vẫn là chỉ định loại IA. Tuy nhiên, với sự phát triển của kỹ thuật can thiệp, sự ra đời của các loại stent phủ thuốc thế hệ mới, các nghiên cứu lớn gần đây đã cho thấy sự không thua kém của PCI so với CABG ở những trường hợp tổn thương LM có mức độ phức tạp thấp đến trung bình. Cụ thể, theo ESC 2018:
- Với điểm SYNTAX thấp (0 – 22 điểm), PCI được khuyến cáo ở mức IA;
- Với điểm SYNTAX trung bình (23 – 32 điểm), khuyến cáo PCI ở mức
- Điểm SYNTAX cao (≥ 33 điểm) vẫn là chống chỉ định với
3.2 Theo khuyến cáo năm 2021 của Trường môn Tim mạch, Hội Tim mạch, Hội chụp và can thiệp Tim mạch Hoa Kỳ (ACC/AHA/SCAI)
Chỉ định can thiệp động mạch vành qua da (PCI) với tổn thương LM tương đối đồng nhất với khuyến cáo của ESC 2018.
- Tổn thương LM với mức độ phức tạp từ thấp đến trung bình (điểm SYNTAX < 33) có thể lựa chọn làm PCI với mức khuyến cáo
- Khuyến cáo của AHA 2021 có thêm điểm mới, nếu tổn thương LM phức tạp (điểm SYNTAX > 32), mà có chống chỉ định hoặc không phù hợp với phẫu thuật bắc cầu nối chủ vành (CABG), nên thảo luận trong nhóm bác sĩ tim mạch (Heart Team) để quyết định điều trị nội khoa tối ưu và xem xét làm PCI nếu có thể.
- Ở bệnh nhân đái tháo đường, can thiệp PCI có thể cân nhắc thay thế phẫu thuật CABG với tổn thương LM có điểm SYNTAX < 33 với mức khuyến cáo
- Đối với nhồi máu cơ tim có ST chênh lên, nếu PCI khả thi thì chỉ định làm PCI với mọi trường hợp (kể cả tổn thương LM).
- Vai trò của Heart Team được nhấn mạnh trong việc quyết định lựa chọn giữa PCI hay phẫu thuật CABG ở bệnh nhân có hẹp đáng kể
4 Dụng cụ can thiệp
Tương tự can thiệp chỗ chia nhánh động mạch vành (Xin xem Chương 19: Can thiệp tổn thương chỗ chia nhanh động mạch vành)
5 Kỹ thuật can thiệp thân chung động mạch vành trái
5.1 Tổn thương tại vị trí lỗ vào và đoạn giữa LM
Đặt stent tại vị trí lỗ vào và đoạn giữa LM có thể thực hiện an toàn nếu kỹ thuật đặt guiding và theo dõi huyết động xâm lấn cẩn thận. Guiding catheter cần đồng trục để giảm nguy cơ gây tổn thương lỗ vào, đồng thời tạo thuận cho việc đưa bóng và stent đến vị trí tổn thương. Khi bóng hoặc stent ở vị trí thích hợp, guiding catheter có thể kéo lùi vào động mạch chủ 1 đến 2 cm để đảm bảo áp lực.
Khi can thiệp tại vị trí lỗ vào LM, đầu guiding có thể kéo vào xoang động mạch chủ, đầu stent có thể nhô nhẹ vào trong lòng động mạch chủ và cần phải nong rộng stent tối đa để stent áp sát thành động mạch chủ. Sau khi đặt stent, cần dùng các loại bóng áp lực cao để làm stent nở tối đa. Thời gian nong bóng ngắn (< 30 giây) để tránh nguy cơ thiếu máu cơ tim. Không bắt buộc phải phủ lỗ vào khi tổn thương chỉ ở đoạn giữa của LM.
5.2 Tổn thương chỗ chia nhánh
Can thiệp PCI ở vị trí chỗ chia nhánh của thân chung mạch vành luôn đòi hỏi kỹ thuật cao bởi vì tỷ lệ biến cố tim mạch cao, do đó kỹ thuật này nên được thực hiện bởi những bác sĩ can thiệp có nhiều kinh nghiệm và phải có sự cân nhắc lợi ích và nguy cơ khi can thiệp tại vị trí LM.
5.2.1 Lựa chọn chiến lược can thiệp chỗ chia nhánh LM
Dựa trên các thử nghiệm không ngẫu nhiên và sử dụng phép ngoại suy từ các thử nghiệm về can thiệp tổn thương chỗ chia nhánh không phải LM, chiến lược đặt 1 stent có vẻ được ưu tiên hơn chiến lược đặt 2 stent. Tuy nhiên do một vùng lớn cơ tim được cấp máu bởi nhánh LCX và nhánh này có thể bị mất sau khi đặt stent nhánh chính, thêm vào đó, tỉ lệ bị nhồi máu cơ tim và tái can thiệp sau 1 năm tăng lên khi can thiệp 1 stent tại tổn thương chỗ chia nhánh của LM mà lỗ vào LCX tổn thương có ý nghĩa, do đó, tổn thương lỗ vào LCX là một yếu tố quan trọng trong việc lựa chọn chiến lược đặt stent. Bảng 20.1 tóm tắt tiêu chuẩn lựa chọn chiến lược đặt stent dựa trên các đặc điểm giải phẫu liên quan đến tổn thương chỗ chia nhánh của LM. Chiến lược một stent được ưu tiên khi hẹp lỗ vào LCX không có ý nghĩa hoặc khi nhánh LCX nhỏ. Ngược lại, chiến lược 2 stent ưu tiên khi hẹp có ý nghĩa lỗ vào LCX và hệ mạch vành ưu năng bên trái. Có thể sử dụng siêu âm trong lòng mạch (IVUS) để đánh giá tổn thương lỗ vào LCX.
Bảng 20.1. Đặc điểm ưu tiên và không ưu tiên lựa chọn chiến lược 1 stent khi can thiệp tổn thương tại LM
| Đặc điểm giải phẫu | |
|---|---|
| Ưu tiên | – Hẹp nhẹ lỗ vào LCX với phân loại Medina là 1,1,0 hoặc 1,0,0. – Đường kính lòng mạch LCX < 2,5 mm và hệ mạch vành ưu năng bên phải. – Góc giữa LAD và LCX rộng. – Không có tổn thương tại LCX. – Tổn thương LCX khu trú. |
| Không ưu tiên | – Hẹp nhiều tại vị trí lỗ vào LCX với phân loại Medina là 1,1,1; 1,0,1 hoặc 0,1,1. – Đường kính LCX > 2,5 mm và hệ mạch vành ưu năng bên trái. – Góc giữa LAD và LCX hẹp. – Tổn thương phối hợp ở LCX. – Tổn thương tại LCX lan toả. |
Chú thích: LM: Thân chung động mạch vành trái; LCX: Động mạch mũ; LAD: Động mạch liên thất trước.
5.2.2 Chiến lược Provisional Stenting
Nếu bác sĩ can thiệp lựa chọn chiến lược đặt 1 stent thì luôn luôn phải dự phòng đặt stent thứ 2 vào nhánh mũ (LCX) nếu kết quả can thiệp không tối ưu, chiến lược này gọi là provisional stenting.
Trước khi đặt stent LAD, cần lái thêm một guidewire vào LCX nếu: (1) hẹp lỗ vào LCX, (2) xơ vữa nhiều ở nhánh chính có nguy cơ cao mảng xơ vữa dịch chuyển chèn ép lỗ vào LCX, (3) góc gập hẹp giữa LCX và nhánh chính, (4) lỗ vào LCX bị tổn thương sau khi nong bóng ở nhánh chính.
Những bệnh nhân xuất hiện triệu chứng thiếu máu cơ tim đòi hỏi phải can thiệp thêm nhánh bên. Thường sử dụng chiến lược Provisional T-stenting hoặc kỹ thuật Reverse
Crush nếu nong bóng thất bại hoặc có lóc tách tại vị trí lỗ vào LCX. Khi đó bắt buộc phải sử dụng kỹ thuật kissing bóng (final kissing balloon inflation – FKBI). Tuy nhiên kỹ thuật FKBI không thực hiện thường quy sau khi đặt 1 stent phủ qua chỗ chia nhánh ở LM, trừ khi dòng chảy ở LCX bị ảnh hưởng. Có thể dùng thăm dò đo phân suất dự trữ lưu lượng vành (FFR) để quyết định có cần can thiệp LCX sau khi đặt stent ở nhánh chính hay không.
So với chiến lược đặt 2 stent, chiến lược Provisional Stenting ở vị trí chỗ chia nhánh của LM thường có tỉ lệ các biến cố tim mạch, tử vong, nhồi máu cơ tim, huyết khối trong stent, và tỉ lệ phải can thiệp lại thấp hơn. Do đó, chiến lược Provisional Stenting nên được ưu tiên lựa chọn khi can thiệp tổn thương chỗ chia nhánh của LM. Hình dưới đây minh họa một ca can thiệp chỉ đặt stent 1 nhánh.
.jpg)
5.2.3 Chiến lược 2 stent
Nếu LCX lớn (hệ mạch vành ưu năng bên trái) và nguy cơ cao bị mất dòng LCX sau khi đặt stent vượt qua (góc gập hẹp và hẹp nặng lỗ vào LCX), nên ưu tiên chiến lược 2 stent. Có 4 kỹ thuật chính bao gồm: T-stenting, Crush stenting và các biến thể, Culotte stenting và kỹ thuật kissing stenting. Mặc dù có thử nghiệm ngẫu nhiên cho thấy kết quả của kỹ thuật Crush tốt hơn kỹ thuật Culotte, tuy nhiên đến nay vẫn chưa có nghiên cứu nào chứng minh được kỹ thuật can thiệp nào là tốt nhất. Do vậy việc lựa chọn kỹ thuật can thiệp nào nên dựa vào đặc điểm lâm sàng của bệnh nhân, hình thái tổn thương và kinh nghiệm của bác sĩ can thiệp. Các bước can thiệp, ưu nhược điểm của từng kỹ thuật đã được mô tả chi tiết ở Chương can thiệp tổn thương chỗ chia nhánh động mạch vành (xin xem CHƯƠNG 19: CAN THIỆP TỔN THƯƠNG CHỖ CHIA NHÁNH ĐỘNG MẠCH VÀNH ).
Một vài yếu tố có thể ảnh hưởng đến kết quả can thiệp 2 stent ở tổn thương chỗ chia đôi của LM. Kỹ thuật kiss- ing bóng (FKBI) nên được thực hiện ở tất cả các kỹ thuật đặt 2 stent để stent đúng vị trí và nở hết. Kỹ thuật tối ưu hoá đoạn đầu (proximal optimization technique – POT) cũng rất quan trọng, giúp stent áp sát thành mạch, tránh tình trạng đi lại wire bên ngoài stent đồng thời đi qua mắt stent dễ dàng hơn, đảm bảo việc bao phủ lỗ vào LCX. Cuối cùng, cần sử dụng các bóng áp lực cao nong lại để stent áp thành tối đa, có thể dùng IVUS đánh giá lại.
5.3 IVUS định hướng trong việc đặt stent LM
Siêu âm trong lòng mạch vành (IVUS) giúp cung cấp các dữ liệu chính xác hơn so với hình ảnh chụp mạch vành về các đặc tính tổn thương như kích thước lòng mạch, tính chất mảng xơ vữa, giúp các bác sĩ can thiệp lựa chọn loại stent thích hợp. Với những tổn thương LM chỗ chia nhánh, IVUS sẽ giúp bác sĩ can thiệp quyết định chiến lược đặt stent.
Sau khi can thiệp động mạch vành qua da (PCI), IVUS đánh giá sự áp thành của stent, mục đích cho stent nở tối đa bằng bóng áp lực cao. Ngoài ra, IVUS còn đo diện tích trong lòng stent để đánh giá nguy cơ tái hẹp, nguy cơ thấp nhất khi MLA (minimum lumen area) của lỗ vào LCX là 5,0 mm2, lỗ vào LAD là 6,3 mm2, đoạn ngã 3 là 7,2 mm2 và 8,2 mm2 với đoạn đầu LM (quy luật 5-6-7-8). Các bác sĩ can thiệp nên thực hiện IVUS đánh giá lại sau khi đặt stent để đo các diện tích lòng mạch đã đạt yêu cầu chưa và nếu cần có thể dùng bóng áp lực cao để tiếp tục nong sao cho đạt kết quả tối ưu nhất.
Gần đây, tất cả các nghiên cứu đều chỉ ra rằng can thiệp LM dưới hướng dẫn của IVUS cải thiện kết cục lâm sàng tốt hơn mặc dù vẫn còn những hạn chế do các nghiên cứu chỉ là các thử nghiệm không ngẫu nhiên.
Vì thế, khuyến cáo của ACC/AHA/SCAI năm 2021:
- Chỉ định siêu âm trong lòng mạch (IVUS) trong can thiệp LM: IVUS nên được sử dụng để hướng dẫn và tối ưu hóa kết quả can thiệp LM (mức chỉ định IIa).
- Ở những bệnh nhân hẹp LM mức độ trung bình, IVUS nên được sử dụng để đánh giá chính xác mức độ nặng của tổn thương (chỉ định loại IIa). Nguyên nhân là do hình ảnh chụp mạch vành có nhiều hạn chế trong đánh giá LM như chồng hình, co ngắn hình… IVUS sẽ giúp đánh giá chính xác đường kính lòng mạch, độ dài tổn thương, hình thái, phân bố mảng xơ vữa, huyết khối, lóc tách… cũng như sự nở và áp thành của stent. Diện tích lòng mạch tối thiểu (minimum lumen area – MLA) ≥ 6 mm2 được coi là an toàn, ngưỡng cut-off của bệnh nhân châu Á có thể thấp hơn (4,5-4,8 mm2).
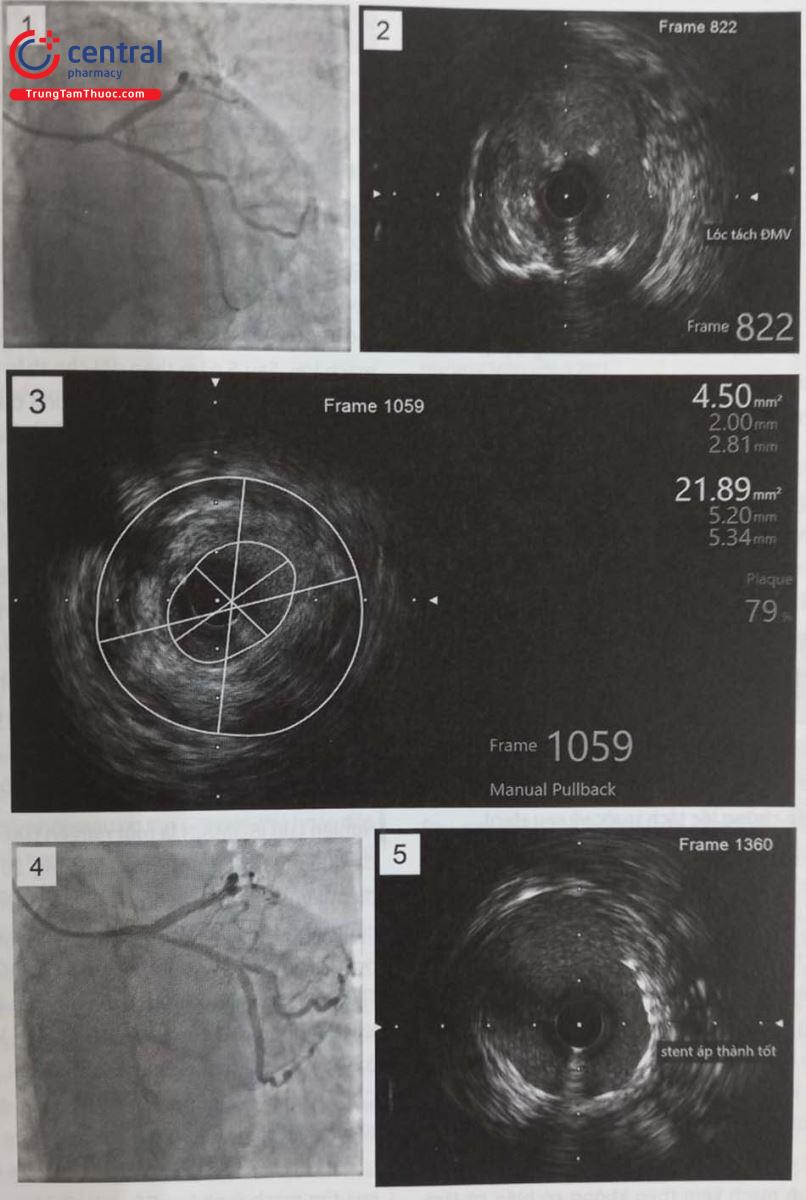
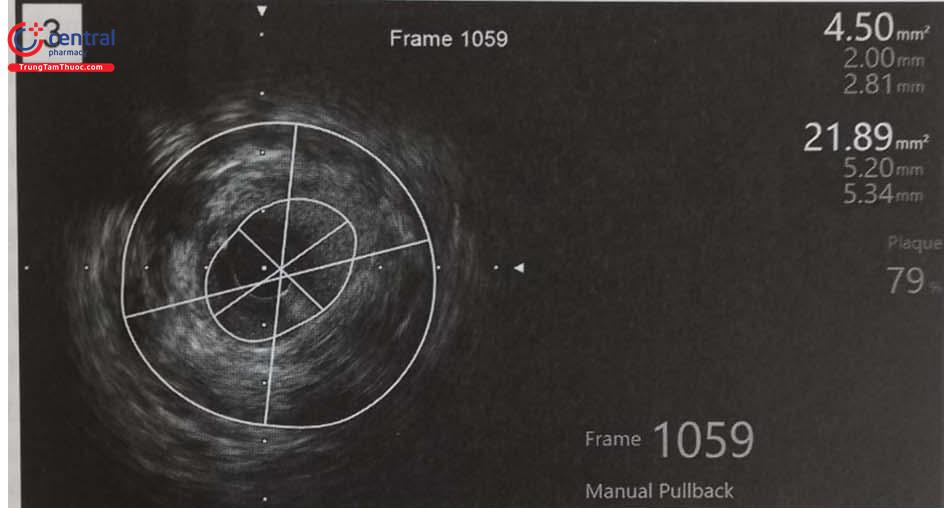
- : hình ảnh chụp mạch vành thấy hẹp đáng kể LM từ lỗ vào LM đến đầu stent cũ
- : IVUS LM phát hiện có lóc lóc tách ĐMV đoạn cuối LM, ngay đầu stent cũ LAD (trên hình ảnh chụp mạch không thấy được hình ảnh lóc tách ĐMV).
- : đo dựa vào IVUS thấy: MLA = 4,5mm2, mức độ hẹp LM: 79%. Qua hình ảnh IVUS và các thông số trên, có chỉ định can thiệp
- : hình ảnh chụp mạch sau đặt stent LM-LAD.
- : IVUS LM sau đặt stent và nong bóng áp lực cao: stent LM áp thành tốt.
Chú thích: IVUS: Siêu âm trong lòng mạch; ĐMV: Động mạch vành; LAD: Động mạch liên thất trước; LCX: Động mạch mũ; MLA (minimum lumen area): Diện tích lòng mạch tối thiểu.
5.4 Dụng cụ hỗ trợ huyết động và sốc tim
Những bệnh nhân có chức năng thất trái bình thường hầu hết sẽ dung nạp tốt với nguy cơ thiếu máu cơ tim trong thời gian lên bóng và đặt stent. Mặc dù bóng đối xung động mạch chủ IABP không được khuyến cáo thường quy trong quá trình can thiệp nhưng IABP vẫn nên được sử dụng để dự phòng nguy cơ suy sụp huyết động ở những bệnh nhân suy giảm chức năng thất trái nặng. Nhiều phương tiện hỗ trợ huyết động tiến bộ (Impella; Abiomed, Danvers, MA) có thể được chỉ định cho những bệnh nhân có nguy cơ cao như: phân suất tống máu thất trái thấp, tổn thương vôi hoá nặng hoặc huyết khối gây hẹp LM.
Mặc dù có nhiều phương tiện hỗ trợ huyết động, tuy nhiên kết cục lâm sàng của sốc tim do bệnh LM không cải thiện nhiều. Cần cân nhắc ghép tim hoặc sử dụng các dụng cụ hỗ trợ thất trái sớm, trừ khi bệnh nhân đáp ứng huyết động tốt với can thiệp và/hoặc các thuốc vận mạch.
Tiêu chí đánh giá thành công của thủ thuật
- Tiêu chí thành công về hình ảnh chụp mạch:
- Nhánh chính hẹp tồn dư < 10%, dòng chảy TIMI 3, không có biến chứng lóc tách trước và sau
- Nếu không đặt stent nhánh bên: lỗ vào nhánh bên hẹp tồn dư < 75%, dòng chảy TIMI 3, không có lóc tách, không có huyết khối.
- Tiêu chí thành công trên siêu âm trong lòng mạch (IVUS): stent áp thành tốt, không lóc tách trước và sau Đo diện tích lòng mạch trên IVUS đạt các tiêu chí sau: Diện tích lòng mạch tối thiểu (MLA) của lỗ vào LCX là 5,0 mm2, lỗ vào LAD là 6,3 mm2, đoạn ngã 3 là 7,2 mm2 và 8,2 mm2 với đoạn đầu LM (quy luật 5-6-7-8).
- Tiêu chí thành công về thủ thuật: Thành công về hình ảnh chụp mạch kèm theo không có biến cố lâm sàng lớn tại viện (tử vong, nhồi máu cơ tim, phẫu thuật bắc cầu chủ vành cấp cứu).
6 Kết quả qua các nghiên cứu lớn
6.1 Can thiệp động mạch vành qua da (PCI) so với phẫu thuật bắc cầu nối chủ vành (CABG) đối với tổn thương LM:
6.1.1 Nghiên cứu sổ bộ:
Nghiên cứu MAINCOMPARE trên 2240 bệnh nhân bị tổn thương tại LM được tái thông bằng PCI (BMS: n= 318, DES thế hệ 1: n= 784) hoặc CABG (n= 1138) tại 12 trung tâm tim mạch lớn. Sau 5 năm theo dõi cho thấy tỉ lệ tử vong, nhồi máu cơ tim hoặc đột quỵ não tương đương giữa 2 nhóm PCI và CABG. Tuy nhiên tỉ lệ tái can thiệp cao hơn có ý nghĩa ở nhóm PCI. Nghiên cứu DELTA 1 trên 1874 bệnh nhân PCI (hầu hết là DES thế hệ 1) và 900 bệnh nhân được CABG cũng cho kết quả tương tự sau 3,5 năm theo dõi. Tuy nhiên PCI cho kết quả tốt hơn so với CABG khi tổn thương ở vị trí lỗ vào hoặc đoạn giữa LM. Nghiên cứu DELTA 2 trên 3986 bệnh nhân được PCI với DES thế hệ 2 so sánh với nhóm bệnh nhân được CABG trong nghiên cứu DELTA 1, cho thấy tỉ lệ tử vong và nhồi máu cơ tim tương đương giữa 2 nhóm, nhưng tỉ lệ đột quỵ não cao hơn ở nhóm CABG và tỉ lệ tái can thiệp cao hơn ở nhóm PCI.
Nghiên cứu IRISMAIN là một nghiên cứu lớn đa trung tâm, đa quốc gia theo dõi trong khoảng 20 năm về các đặc điểm lâm sàng của bệnh nhân, các biện pháp can thiệp cũng như kết cục tim mạch. Nghiên cứu này chỉ ra, PCI ngày càng được sử dụng nhiều và CABG ngày càng ít đi. Tỉ lệ sống còn hiệu chỉnh theo nguy cơ và tỉ lệ phải tái can thiệp ở nhóm PCI cũng dần dần được cải thiện, trong khi ở nhóm CABG hầu như không thay đổi. Tính ưu việt của CABG so với PCI cũng dẫn bị thu hẹp do có sự thay đổi từ các loại stent BMS sang các loại stent DES thế hệ 1 và gần đây là các loại stent DES thế hệ mới nhất. Mặc dù kết cục tim mạch ở nhóm điều trị nội khoa đơn thuần cũng được cải thiện đáng kể, tuy nhiên hiệu quả thấp hơn nhiều khi so sánh với các chiến lược tái thông mạch vành (PCI hoặc CABG).
6.1.2 Nghiên cứu ngẫu nhiên có đối chứng
Nghiên cứu LEMANS là nghiên cứu ngẫu nhiên đầu tiên so sánh PCI (52 bệnh nhân) với CABG (53 bệnh nhân) khi điều trị hẹp LM có thể có tổn thương nhiều thân mạch vành. Có 35% bệnh nhân PCI được đặt stent DES và 72% bệnh nhân CABG sử dụng động mạch vú trong (LIMA). Kết quả theo dõi sau 1 năm thấy chức năng thất trái (LVEF) ở nhóm PCI cải thiện hơn nhiều so với nhóm CABG, trong khi tỉ lệ sống còn, biến cố tim mạch chính, hoặc đột quỵ não (MACCEs) tương đương giữa 2 nhóm.
Khi phân tích dưới nhóm ở những đối tượng tổn thương LM trong nghiên cứu SYNTAX, không thấy có sự khác biệt về MACCEs (37% với 31%), tỉ lệ tử vong (13% với 15% ) và tỉ lệ nhồi máu cơ tim (8% với 5%) giữa nhóm PCI dùng stent phủ thuốc Paclitaxel so với nhóm CABG sau 5 năm theo dõi. Tuy nhiên nhóm PCI có tỉ lệ đột quỵ não thấp hơn (2% so với 4%) nhưng tỉ lệ tái can thiệp cao hơn (27% với 16%). Nhóm bệnh nhân PCI có điểm SYNTAX cao (> 33 điểm) có tỉ lệ tử vong và tái can thiệp cao hơn.
Nghiên cứu PRECOMBAT trên các bệnh nhân chỉ tổn thương LM, so sánh PCI sử dụng stent DES phủ sirolimus với CABG. Sau 5 năm theo dõi, tỉ lệ MACCEs (18% với 14%), tử vong (6% với 8%), nhồi máu cơ tim (2% với 2%) hoặc đột quỵ não (1% với 1%) tương đồng giữa 2 nhóm. Tuy nhiên tỉ lệ tái can thiệp cao hơn ở nhóm PCI (11% với 6%).
Nghiên cứu EXCEL tiến hành trên 1905 bệnh nhân tổn thương LM và có điểm SYNTAX ≤ 32 được đặt stent DES thế hệ 2 phủ Everolimus. Sau 3 năm theo dõi, tỉ lệ tử vong, đột quỵ não và nhồi máu cơ tim tương tự nhau (15,4% với 14,7% ). Tỉ lệ biến cố sau 30 ngày ở nhóm PCI thấp hơn nhóm CABG (4,9% với 7,9% ). Một vài biến cố xảy ra nhiều hơn ở nhóm PCI so với CABG trong khoảng từ 30 ngày đến 3 năm. Tỉ lệ nhồi máu cơ tim sớm và các biến cố quanh thủ thuật trong vòng 30 ngày ở nhóm PCI thấp hơn có ý nghĩa so với nhóm CABG (lần lượt là 3,9% với 6,2% và 8,1% với 23,0%), tuy nhiên tỉ lệ tái can thiệp do thiếu máu lại cao hơn ở nhóm PCI (12,6% với 7,5%). Tóm lại, PCI dường như đem lại kết quả tốt hơn trong khoảng thời gian ngắn, còn CABG có kết quả tốt hơn khi theo dõi lâu dài.
Nghiên cứu NOBEL trên 1201 bệnh nhân, nhóm bệnh nhân PCI được sử dụng stent DES thế hệ 1 (11%) hoặc stent phủ biolimus (89%). Sau 5 năm theo dõi, tỉ lệ biến cố MACCEs (tử vong, nhồi máu cơ tim không liên quan thủ thuật, tái thông lại, đột quỵ) ở nhóm PCI cao hơn nhóm CABG (28% với 18%). Trong đó, tỉ lệ nhồi máu cơ tim không liên quan thủ thuật và tái can thiệp cao hơn ở nhóm PCI (lần lượt 6% với 2% và 15% với 10%). Đặc biệt sau 5 năm theo dõi, tỉ lệ đột quỵ não lại cao hơn ở nhóm PCI so với CABG (5% với 2%). Tuy nhiên tỉ lệ tử vong tương đương giữa 2 nhóm (36% với 32%).
6.1.3 Phân tích gộp:
Một phân tích tổng hợp từ 6 nghiên cứu với thời gian theo dõi trung bình là 39 tháng cho thấy không có sự khác biệt giữa 2 nhóm về tỉ lệ tử vong chung, tử vong do tim mạch, nhồi máu cơ tim và đột quỵ não. Dựa trên phân loại theo thang điểm SYNTAX, nghiên cứu cho thấy không có sự khác biệt giữa 2 nhóm PCI và CABG ở tất cả các điểm cắt, tuy nhiên tỉ lệ tái can thiệp ở nhóm CABG thấp hơn bất kể mức điểm SYNTAX.
7 Theo dõi sau can thiệp
Sau can thiệp LM, bệnh nhân cần được theo dõi lâm sàng định kỳ. Kế hoạch theo dõi có thể khác nhau tùy theo từng trung tâm.
Các tác giả gợi ý có thể làm siêu âm tim gắng sức hoặc xạ hình tưới máu cơ tim sau 3 tháng, chụp cắt lớp vi tính động mạch vành sau 6-9 tháng. Nếu bệnh nhân có triệu chứng cơ năng tái diễn, không ổn định, nên chỉ định chụp động mạch vành qua da sớm.
8 Tài liệu tham khảo
- Textbook of Interventional Cardiology (2019). 8th edition, Elsevier
- 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines | Circulation
- 2018 ESC/EACTS Guidelines on Myocardial
- Mukherjee và Bavry A., btv. (2011), Interventional Cardiology: Essential Clinician’s Guide, Oxford University Press.
- Redwood , Curzen N., và Banning A., btv. (2018), Oxford Textbook of Interventional Cardiology, Oxford University Press, New York.
- Chieffo A, Meliga E, Latib A, et al. Drug-eluting stent for left main coronary artery disease. The DELTA registry: a multicenter registry evaluating percutaneous coronary intervention versus coronary artery bypass grafting for left main treatment. JACC Cardiovasc Interv. 2012;5:718–727.
- Chieffo A, Tanaka A, Giustino G, et The DELTA 2 registry: a multicenter registry evaluating percutaneous coronary intervention with new-generation drug-eluting stents in patients with obstructive left main coronary artery disease. JACC Cardiovasc Interv. 2017;10: 2401–2410.
- Lee PH, Ahn JM, Chang M, et al. Left main coronary artery disease: secular trends in patient characteristics, treatments, and outcomes. J Am Coll Cardiol. 2016;68:1233–1246.
- Morice MC, Serruys PW, Kappetein AP, et al. Five-year outcomes in patients with left main disease treated with either percutaneous coronary intervention or coronary artery bypass grafting in the synergy between percutaneous coronary intervention with taxus and cardiac surgery trial. Circulation. 2014;129:2388–2394.
- Ahn JM, Roh JH, Kim YH, et al. Randomized trial of stents versus bypass surgery for left main coronary artery disease: 5-year outcomes of the PRECOMBAT study. J Am Coll Cardiol. 2015;65:2198–2206.
- Stone GW, Sabik JF, Serruys PW, et al. Everolimus-eluting stents or bypass surgery for left main coronary artery disease. N Engl J Med. 2016;375:2223–2235.
- Makikallio T, Holm NR, Lindsay M, et al. Percutaneous coronary angioplasty versus coronary artery bypass grafting in treatment of unprotected left main stenosis (NOBLE): a prospective, randomised, open-label, non-inferiority trial. Lancet. 2016;388:2743–2752.
- Palmerini T, Serruys P, Kappetein AP, et al. Clinical outcomes with percutaneous coronary revascularization vs coronary artery bypass grafting surgery in patients with unprotected left main coronary artery disease: a meta-analysis of 6 randomized trials and 4,686 patients. Am Heart J. 2017;190:54–63.

