Can thiệp nong bóng trong điều trị tăng áp mạch máu phổi do thuyên tắc huyết khối mạn tính (CTEPH)
Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS.Phạm Mạnh Hùng
Tác giả
TS.BSNT.Nguyễn Minh Hùng
BSNT.Lê Xuân Hùng
Nguyễn Hoàng Anh
BSNT.Nguyễn Đinh Hồng Phúc
Bùi Thị Thanh Huyền
PGS.TS.BS.Phạm Mạnh Hùng
Can thiệp nong bóng trong điều trị tăng áp mạch máu phổi do thuyên tắc huyết khối mạn tính (CTEPH) là phẫu thuật loại bỏ huyết khối trong lòng động mạch phổi. Kỹ thuật đó như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu trong bài viết sau đây.
1 Đại cương
Tăng áp mạch máu phổi do thuyên tắc huyết khối mạn tính (CTEPH), thuộc type 4 theo phân loại tăng áp mạch máu phổi (Pulmonary hypertension), là một dạng của tăng áp mạch máu phổi trước mao mạch được đánh giá qua thông tim phải với đặc trưng bởi áp lực động mạch phổi trung bình (mean Pulmonary Artery Pressure hay mPAP) ≥ 25 mmHg, áp lực động mạch phổi bít nhỏ hơn hoặc bằng 15 mmHg, sức cản mạch phổi lớn hơn 3 đơn vị Wood và không tương xứng tưới máu và thông khí khi đánh giá bằng VQ scan, cũng như có các dấu hiệu đặc trưng khi chụp mạch phổi bằng cắt lớp vi tính đa dãy (MSCT), chụp cộng hưởng từ, hoặc chụp mạch máu phổi qua đường ống thông, ở bệnh nhân đã dùng kháng đông hiệu quả ít nhất 3 tháng.
Bệnh là kết quả của sự lắng đọng các phức hợp trong quá trình hình thành huyết khối trong lòng mạch phổi; do không ly giải hết huyết khối; và hình thành cục huyết khối mạn tính, hiện tượng xơ hóa, hạn chế dòng chảy, tổ chức hóa huyết khối. CTEPH được coi là một hậu quả xảy ra sau thuyên tắc động mạch phổi cấp tính, xảy ra ở 0,4% đến 9,1% các bệnh nhân sống sót sau thuyên tắc phổi cấp tính nhưng tỉ lệ này sẽ tăng hơn 10% nếu bệnh nhân tái phát thuyên tắc động mạch phổi.
Phẫu thuật lấy bỏ nội mạc động mạch phổi (Pulmonary Endarterectomy hay PEA) hay còn được gọi là phẫu thuật lấy huyết khối và cắt bỏ mô sẹo ở động mạch phổi (Pulmonary Thromboendarterectomy hay PTE) cần hỗ trợ bởi ngừng tuần hoàn hoàn toàn với hạ thân nhiệt sâu để loại bỏ huyết khối trong lòng động mạch phổi. Các chỉ định cho PEA là áp lực động mạch phổi trung bình (mPAP) lớn hơn 30 mmHg, sức cản mạch phổi (PVR) lớn hơn 300 dynes/giây/cm5, và phân loại chức năng theo Hiệp hội Tim mạch New York (NYHA) độ III-IV. Tuy nhiên, hiện tại, chỉ định được mở rộng khi bệnh nhân chỉ cần có triệu chứng trên lâm sàng mà chưa tăng áp động mạch phổi. Chống chỉ định cho phẫu thuật khi vị trí tắc mạn tính ở những vị trí mạch phổi nhỏ, với kháng lực mạch máu phổi không tương đồng mức độ tắc nghẽn, khả năng giảm PVR sau mổ kém (< 50% mức ban đầu), và nguy cơ biến chứng phẫu thuật cao.
Tử vong trước mổ tăng lên rõ rệt khi mà PVR trước mổ cao hơn 1000 dynes/giây/cm5, và nguy cơ càng cao hơn khi còn tăng áp động mạch phổi tồn dư sau PEA, có thể gặp ở 35% bệnh nhân được phẫu thuật. Tuy nhiên, mức độ nặng của PVR trước phẫu thuật và mức độ tăng áp động mạch phổi không được coi là chống chỉ định can thiệp phẫu thuật vì những người bệnh cuối cùng có thể được hưởng lợi từ phẫu thuật. Bệnh nhân trải qua PEA có thể gặp các biến chứng khác nhau tương tự như các thủ thuật phẫu thuật tim mạch khác, chẳng hạn như loạn nhịp tim, tràn dịch màng tim hoặc màng phổi, xẹp phổi, nhiễm trùng vết mổ và mê sảng. Đáng chú ý là phù phổi tái tưới máu (RPE), loại phù phổi có tính thấm cao xảy ra ở 9,6% bệnh nhân sau PEA và có thể xuất hiện từ giảm oxy máu nhẹ sau phẫu thuật hay đến phù phổi xuất huyết nặng. Nguy cơ RPE tăng lên ở những bệnh nhân có tăng áp phổi dai dẳng trước và sau phẫu thuật PEA.
Sử dụng thuốc điều trị tăng áp mạch máu phổi được chỉ định ở những bệnh nhân CTEPH không thể phẫu thuật và những bệnh nhân có kết quả chức năng và huyết động chưa tối ưu sau phẫu thuật PEA. Hiện nay, riociguat là thuốc duy nhất được chấp thuận cho chỉ định này dựa trên kết quả của nghiên cứu CHEST-1. Tuy nhiên, phân nhóm bệnh nhân PEA được điều trị trước bằng các liệu pháp giảm áp động mạch phổi không có lợi thế đáng kể so với với những người không điều trị. Thậm chí, nhóm được điều trị thuốc có thời gian phẫu thuật chậm hơn đáng kể so với nhóm còn lại.
Nong động mạch phổi bằng bóng qua da (Balloon Pulmonary Angioplasty hay BPA) là phương pháp ban đầu được sử dụng để điều trị hẹp động mạch phổi bẩm sinh ở bệnh nhân trẻ tuổi. Một số nghiên cứu cho thấy lợi ích của BPA như là một phương pháp điều trị thay thế cho những bệnh nhân CTEPH không thể phẫu thuật được và cho đến gần đây các quy trình can thiệp này đã được cải tiến với các kết quả khả thi từ các trung tâm lớn khác nhau trên toàn thế giới.
2 Giải phẫu và hình thái tổn thương CTEPH cho can thiệp
2.1 Giải phẫu động mạch phổi
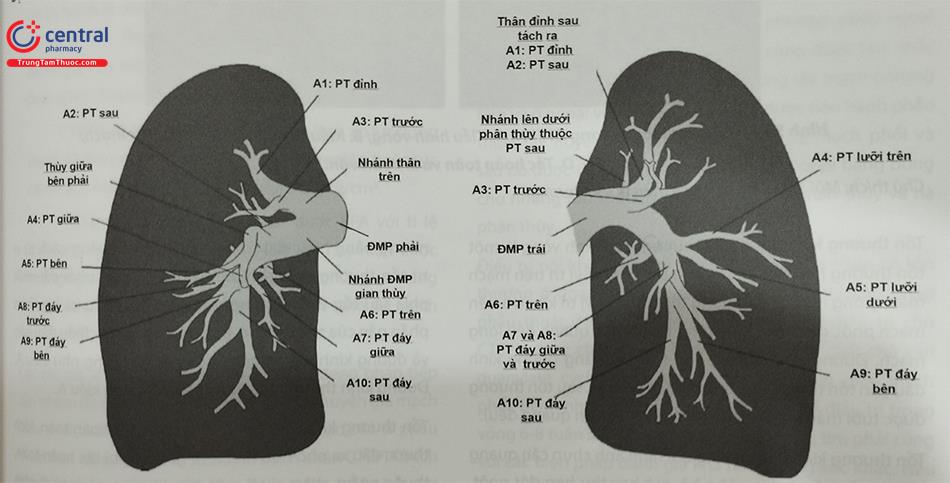
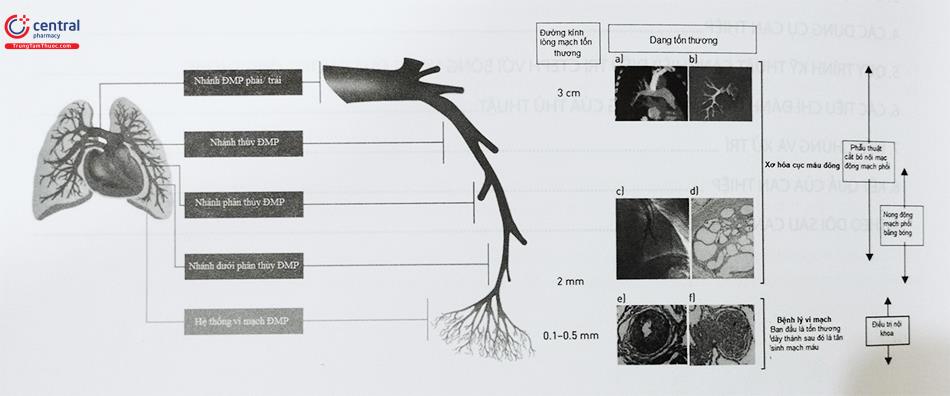
Động mạch phổi đi ra từ thất phải và lên trên khoảng 5cm trước khi phân chia thành động mạch phổi trái và phải (Hình 2). Động mạch phổi trái cho nhánh động mạch thuỳ trên trái, thường đi xuống và cho nhánh động mạch phổi thuỳ lưỡi và động mạch phổi trái phía dưới. Động mạch phổi phải chia thành động mạch phổi thuỳ trên đi lên và động mạch gian thuỳ phổi đi xuống chia thành động mạch phổi thuỳ giữa và thuỳ dưới. Động mạch phổi thường chia theo kiểu phân đôi. Các lần phân nhánh tiếp theo của các động mạch phổi thuỳ, phân thuỳ và dưới phân thuỳ thường có những thay đổi tuỳ từng người. Để xác định chính xác một nhánh động mạch thuỳ hay phân thuỳ, thường cần xác định nhánh phế quản liên quan. Các nhánh động mạch phổi dưới phân thuỳ thường có đường kính lên đến khoảng 6 – 7 mm tại vị trí khởi đầu, giảm dần còn < 1,5 mm ở vùng ngoại vi.
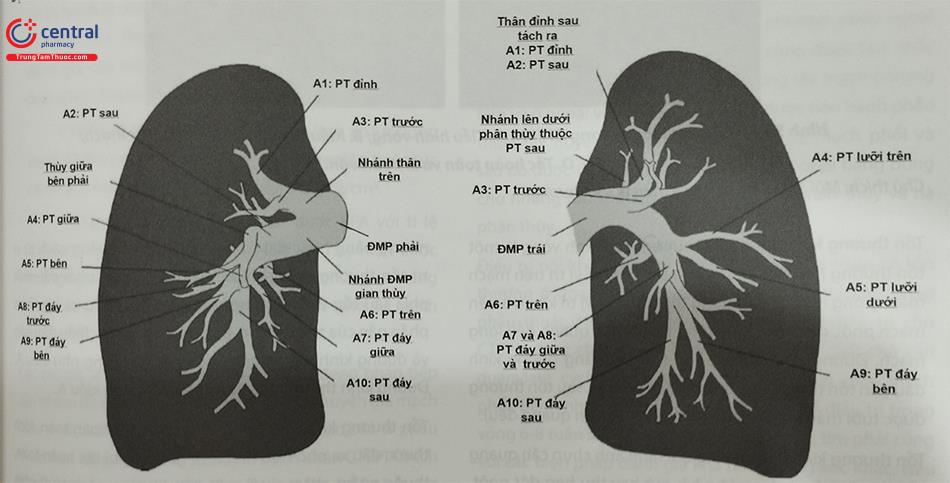
A1: Đỉnh, A2: Sau, A3: Trước, A4: Thuỳ giữa bên (Phải), hoặc thuỳ Lưỡi trên (Trái), A5: Thuỳ giữa trung gian (Phải), hoặc thuỳ lưỡi dưới (Trái), A6: Trên, A7: Đáy nền, A8: Đáy trước, A9: Đáy bên, A10: Đáy sau. ( ĐMP: động mạch phổi; PT: phân thùy phổi).
2.2 Phân loại tổn thương CTEPH
Phân loại tổn thương mạch máu này bằng cách sử dụng phân loại theo đề nghị bởi Kawakami và cộng sự :
Kiểu A: Kiểu hình vòng.
Kiểu B: Kiểu dạng màng.
Kiểu C: Bán tắc mạch.
Kiểu D: Tắc hoàn toàn.
Kiểu E: Xoắn vặn.
Chú thích: Mũi tên chỉ vị trí mạch máu bị tổn thương.
Tổn thương kiểu A hay tổn thương kiểu hình vòng là một tổn thương hẹp đồng tâm, khu trú tại một vị trí trên mạch máu, giống như có một vòng thắt tại một vị trí khu trú trên mạch phổi, do huyết khối hình thành bao quanh đều lòng mạch. Đường kính đầu xa tổn thương bằng đường kính đầu gần tổn thương, và phần mạch phía xa, sau tổn thương được tưới máu sớm nhanh (ngấm thuốc cản quang đều).
Tổn thương kiểu B đặc trưng bởi hình ảnh chụp cản quang của mạch máu ở dạng khe hở, mờ hay thu hẹp đột ngột. Nguyên nhân do huyết khối hình thành lan tỏa làm ngấm thuốc không đều, nham nhở hay thu hẹp đột ngột trong lòng mạch. Dòng chảy đoạn xa của tổn thương kém hơn nhưng bằng hoặc đạt tới hơn một nửa khoảng cách từ vị trí tổn thương đến phổi trong đoạn mạch phổi dài nhất phía sau tổn thương nhưng đường kính đầu xa hẹp hơn phần gần của tổn thương. Đường kính tham chiếu đầu gần và đường kính lòng mạch nhỏ nhất thì giống như kiểu A. Đường kính tham chiếu đầu xa thì nhỏ hơn kiểu A.
Tổn thương kiểu C là tổn thương bán tắc hoàn toàn, kích thước đầu xa nhỏ hơn nhiều và gần như bị tắc hoàn toàn, thuốc ngấm chậm dưới một nửa khoảng cách từ ở phía sau tổn thương đến phổi ở nhánh mạch phổi dài nhất phía sau tổn thương. Đường kính mạch tham chiếu đoạn gần thì giống như tổn thương kiểu A. Do bởi phần xa của mạch máu ngấm thuốc kém, các thông số đo đạc trên phim chụp khó xác định.
Tổn thương kiểu D là dạng tổn thương tắc hoàn toàn có dạng lõm ở đoạn mạch dưới phân thùy. Huyết khối hình thành tổ chức hóa gây tắc hoàn toàn đoạn gần động mạch phân thùy. Mạch phía xa không quan sát đượhc. Đường kính mạch tham chiếu đoạn gần là lớn nhất so với các dạng tổn thương khác. Do bởi mạch phía xa bị tắc nghẽn hoàn toàn nên các thông số thăm dò khác không đo được.
Tổn thương kiểu E là tổn thương xoắn vặn không có tổn thương đầu gần của động mạch dưới phân thùy. Có nhiều tổn thương dạng màng với các tổn thương mạch nhỏ xoắn vặn ở phần xa các động mạch dưới phân thùy, bao quanh hệ mao mạch như những sợi bông xơ xác. Trong hình ảnh chụp mạch tổn thương kiểu E này, đường kính tham chiếu đoạn gần là nhỏ nhất trong các tổn thương trên do bởi vị trí tổn thương ở đoạn xa các mạch dưới phân thùy.
3 Chỉ định và chống chỉ định nong bóng cho điều trị CTEPH
Đa số các trung tâm Tim mạch sử dụng các chỉ định sau để nong động mạch phổi bằng bóng (BPA):
- CTEPH không thể phẫu thuật được vì tuổi cao, nhiều bệnh lý nền, và tổn thương ngoại biên không điều trị bằng PEA (Pulmonary Endarterectomy) được theo đánh giá của một nhóm chuyên gia về điều trị CTEPH (bao gồm chuyên gia PEA).
- CTEPH có triệu chứng (NYHA II trở lên), áp lực động mạch phổi trung bình (mPAP) ≥ 25 – 30 mmHg, hoặc sức cản mạch máu phổi (PVR) > 300 dynes/giây/cm5.
- Những trung tâm thực hiện được BPA với tỉ lệ biến chứng rất thấp thì những tiêu chí này hiện được mở rộng ra các bệnh nhân đã có triệu chứng cơ năng hoặc có giảm oxy máu mà chưa có kèm tăng áp mạch máu phổi.
Các tác giả khuyến nghị nên áp dụng phương pháp tiếp cận nhóm đa chuyên ngành bao gồm các chuyên gia mạch máu phổi, bác sĩ tim mạch can thiệp và các bác sĩ phẫu thuật PEA để đánh giá và xác định bệnh nhân CTEPH thích hợp để thực hiện BPA. BPA được thực hiện ở hầu hết các bệnh nhân CTEPH có triệu chứng mà không có khả năng phẫu thuật hoặc còn tăng áp lực mạch phổi tái phát hoặc dai dẳng sau phẫu thuật. BPA cứu vãn cũng được báo cáo là một phương pháp điều trị bắc cầu ở những bệnh nhân CTEPH tiến triển nhanh để ổn định bệnh nhân trước khi PEA.
BPA cũng có thể sử dụng phối hợp với PEA ở một số bệnh nhân chọn lọc khi khả năng phẫu thuật chỉ áp dụng cho một bên phổi. Nhìn chung vị trí huyết khối nhánh thùy hoặc đoạn gần sẽ thuận lợi cho phẫu thuật, trong khi vị trí đoạn xa hoặc nhánh dưới phân thùy phù hợp với BPA hơn.
Vị trí và mức độ nặng của tổn thương được xác định trên MSCT động mạch phổi (đối với tổn thương trung tâm) và chụp động mạch phổi qua đường ống thông (đối với các tổn thương ngoại vi), đây chính là chìa khóa để xử trí CTEPH. Theo nguyên tắc thông thường, vị trí huyết khối trong hệ động mạch phổi càng xa đặc biệt ở các nhánh phân thùy và hạ phân thùy sẽ càng thách thức hơn, nguy cơ cao hơn và ít thành công hơn cho phương pháp phẫu thuật. Vì vậy, vị trí huyết khối ở gần trung tâm phù hợp hơn về giải phẫu cho phương pháp phẫu thuật, và đây cũng được coi là lựa chọn ưu tiên. Tuy nhiên, nếu phần huyết khối nằm ở các nhánh xa, thì phẫu thuật sẽ trở nên rất thách thức và thường không khả thi.
Nong động mạch phổi bằng bóng (BPA) được tiến hành ở người bệnh với huyết khối ở các nhánh xa của hệ mạch phổi và không tiếp cận được bằng phương pháp ngoại khoa. Nong động mạch phổi có thể cũng được cân nhắc với những người bệnh có cả tổn thương tắc mạch ở trung tâm và ở ngoại vi. Khi đó người bệnh được tiến hành phẫu thuật lấy huyết khối phần trung tâm hệ mạch phổi và sau đó được tiến hành nong động mạch phổi bằng bóng cho những tổn thương còn lại ở nhánh phân thùy và hạ phân thùy.
Điều trị nội khoa là bước đầu tiên nếu bệnh nhân có tổn thương ở đoạn xa và chưa phù hợp cho phương pháp phẫu thuật, Hiện nay chỉ duy nhất thuốc điều trị cho CTEPH được chấp thuận là riociguat là một chất chủ vận guanylate cyclase hòa tan. Thuốc này giúp giãn mạch phổi. Bệnh nhân được sử dụng riociguat để điều trị trong vòng 6-8 tuần sau đó được tiến hành thông tim phải cùng với các biện pháp đánh giá khả năng gắng sức khác. Nếu không có sự cải thiện sau điều trị nội khoa thì sẽ cân nhắc đến phương pháp nong động mạch phổi bằng bóng.
4 Các dụng cụ can thiệp
- Ống thông các loại: JR4, JL4, MP, AL1, …
- Dây dẫn can thiệp động mạch vành 0,014”: không ngậm nước (đôi khi sử dụng dây dẫn ngậm nước), đầu dây dẫn không quá cứng và dài (đoạn đầu mềm phía xa dưới 30 mm).
- Bóng nong: đủ kích cỡ từ 1 đến 4 mm (thông dụng nhất là 2 x 20 mm), bóng nong có đầu xa thuôn nhỏ hơn. Thường sử dụng bóng áp lực thường.

- Dựa vào độ đàn hồi và độ cứng của vật liệu, có hai loại bóng được sử dụng, đó là bóng áp lực thường (giãn) và bóng áp lực cao (không giãn). Bóng áp lực thường khi được bơm với áp lực cao hơn áp lực quy ước sẽ làm bóng giãn thêm 10-20%. Bóng áp lực cao, ngược lại, luôn giữ ổn định kích thước thậm chí kể cả bơm cao hơn nhiều áp lực quy ước.
- Dựa vào cấu tạo hệ thống vận chuyển, có hai loại bóng nong: hệ thống trượt toàn bộ trên dây dẫn (over-the-wire OTW) và hệ thống trượt một phần trên dây dẫn (monorail, rapid exchange).
5 Quy trình kỹ thuật can thiệp điều trị CTEPH với nong bóng qua đường ống thông
5.1 Chuẩn bị
Trước khi tiến hành nong động mạch phổi bằng bóng, nhóm can thiệp cẩn thận lập kế hoạch thực hiện. Đây là một bước rất quan trọng và cần dành đủ thời gian để lập kế hoạch với sự chuẩn bị về hình ảnh giải phẫu ba chiều phức tạp của hệ mạch phổi. Các nguyên tắc cơ bản nên được áp dụng mỗi khi chuẩn bị can thiệp:
Thủ thuật nong bóng ĐMP không nên tiến hành cho tất cả các nhánh trong 1 lần thủ thuật do nguy cơ phù phổi sau can thiệp, mà nên chia làm nhiều lần can thiệp (từ 3-4 lần). Mỗi lần can thiệp sẽ nhắm mục tiêu can thiệp cho khoảng ba phân nhánh động mạch và khoảng cách giữa các lần can thiệp cách nhau 1 khoảng thời gian tối thiểu là 3 đến 5 ngày, tùy thuộc vào tình trạng của người bệnh, độ phức tạp của giải phẫu và kết quả của các can thiệp trước đó. Khoảng thời gian có thể kéo dài cho tới 2 tuần để đảm bảo sự an toàn cần thiết.
Tình trạng lúc ban đầu của những bệnh nhân có thể không ổn định với dự trữ tim phổi thấp; vì thế ở lần điều trị đầu tiên bằng phương pháp nong động mạch phổi bằng bóng nên hướng tới các mạch nằm ở phần thấp nhất của vùng tưới máu trên kết quả chụp xạ hình thông khí tưới máu. Điều này vừa tận dụng lợi thế của phương pháp chụp mạch qua đường ống thông, đồng thời quan sát vào các tổn thương có giải phẫu phù hợp, cho phép nong mạch được thực hiện với tỷ lệ thành công cao và tỷ lệ biến chứng thấp. Các tổn thương phức tạp nên can thiệp muộn hơn, sẽ có thể được dung nạp tốt hơn trong các lần can thiệp sau đó do sự cải thiện huyết động của bệnh nhân.
Dự trữ tim phổi (Cardiopulmonary reserve) được xác định bằng mức độ nặng của áp lực động mạch phổi trung bình. Hơn nữa, áp lực ĐMP trung bình càng cao thì nguy cơ biến chứng thủ thuật như phù phổi cấp hoặc chảy máu ở vị trí xì/ rò mạch máu do dây dẫn sau thông tim càng cao. Do đó phương pháp tiếp cận an toàn được đảm bảo cho tất cả bệnh nhân và đặc biệt chú ý cẩn thận hơn ở những bệnh nhân có tăng áp ĐMP nặng.
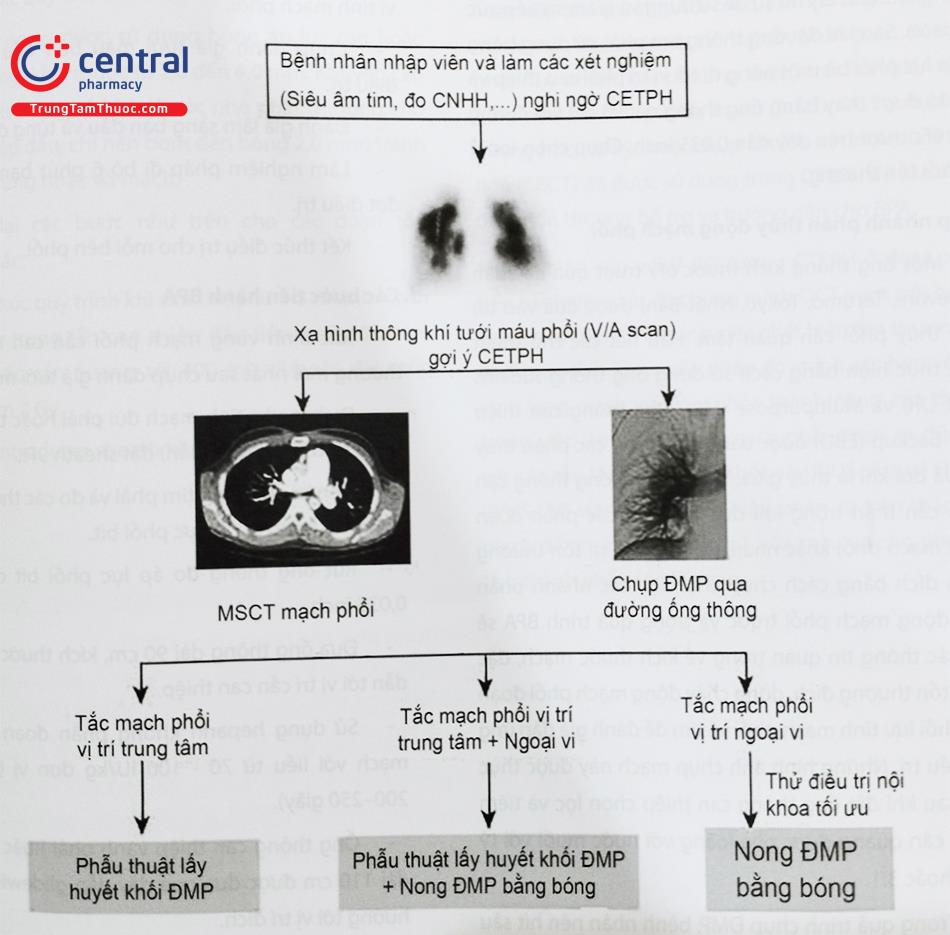
5.2 Thủ thuật nong bóng động mạch phổi (BPA)
Một kế hoạch điều trị hoàn chỉnh thường bao gồm 4 đến 6 quy trình BPA riêng biệt, cách nhau từ 3 đến 7 ngày và kết thúc bằng 1 lần điều trị cuối cùng ở mỗi phổi. Mạch máu đích được lựa chọn dựa trên các phương pháp chụp tưới máu phổi không xâm lấn với mục tiêu tái thông mạch máu ở vùng có rối loạn tưới máu lớn nhất. Chụp tưới máu phổi sẽ được tiến hành lặp lại để quan sát những thay đổi tổng thể tưới máu phổi so với ban đầu và sắp xếp lại các vùng bệnh lý.
Nghiệm pháp đi bộ 6 phút được thực hiện ở thời điểm ban đầu và lặp lại sau mỗi liệu trình để đánh giá đáp ứng lâm sàng của điều trị. Thông tim phải và đánh giá huyết động trước mỗi thủ thuật BPA để theo dõi hiệu quả tích lũy của điều trị trên huyết động tim phổi. Mỗi quy trình BPA được giới hạn ở mức phơi nhiễm bức xạ không quá 2 Gy và/ hoặc 300 mL chất cản quang được sử dụng.
5.2.1 Đường vào mạch máu
Thường sử dụng tĩnh mạch đùi dưới hướng dẫn của siêu âm và sử dụng sheath
Tĩnh mạch đùi được ưu tiên hơn tĩnh mạch cảnh và tĩnh mạch cánh tay do sự dễ sử dụng và giảm sự tiếp xúc với tia xạ. Sau khi đặt ống thông tim phải, sử dụng bóng đo áp lực phổi bít một nòng đi tới vị trí phổi can thiệp và sau đó được thay bằng ống thông dài 90 cm với đường kính 6Fr trượt trên dây dẫn 0,035 inch. Chụp chọn lọc vị trí phổi tổn thương.
5.2.2 Chụp nhánh phân thuỳ động mạch phổi
Một ống thông kích thước 6Fr trượt qua dây dẫn (Glidewire, Terumo, Tokyo, Nhật Bản) được đưa vào tới vị trí thùy phổi cần quan tâm. Hầu hết các thủ thuật được thực hiện bằng cách sử dụng ống thông Judkins Right (JR) và Multipurpose (MP). Ống thông can thiệp Extra Backup (EBU) được dành riêng cho các phân thùy lưỡi và đôi khi là thùy giữa. Thao tác với ống thông can thiệp cần thận trọng khi đưa tới vị trí các phân đoạn động mạch phổi khác nhau. Đánh giá vị trí tổn thương mạch đích bằng cách chụp chọn lọc các nhánh phân thùy động mạch phổi trước và trong quá trình BPA sẽ cho các thông tin quan trọng về kích thước mạch, đặc điểm tổn thương đích, dòng chảy động mạch phổi đoạn xa và hồi lưu tĩnh mạch phổi về tim để đánh giá đáp ứng với điều trị. Những hình ảnh chụp mạch này được thực hiện sau khi đặt ống thông can thiệp chọn lọc và tiêm thuốc cản quang được pha loãng với nước muối với tỷ lệ 2:1 hoặc 3:1.
Trong quá trình chụp ĐMP, bệnh nhân nên hít sâu nín thở (nếu được) và chụp ở tốc độ 7,5 đến 15 khung hình/ giây. Chụp mạch với tốc độ khung hình và chất lượng cao hơn có thể giúp mô tả chi tiết đặc điểm tổn thương nhưng không được sử dụng trong mọi trường hợp. Sử dụng máy chụp mạch hai bình diện sẽ cung cấp nhiều dữ liệu hình ảnh hơn, đặc biệt hữu ích cho các mạch quanh co hoặc bắt chéo nhau, nhưng các tác giả cũng khuyến cáo nên tiến hành chụp mạch một bình diện để giảm thiểu liều bức xạ cho bệnh nhân và sự phơi nhiễm của người làm thủ thuật.
5.2.3 Kế hoạch điều trị
4-6 lần can thiệp BPA riêng biệt.
Chụp động mạch phổi ban đầu (đánh giá ban đầu) có thể sử dụng hoặc không phương pháp chụp cắt lớp vi tính mạch phổi.
Chụp đánh giá tưới máu ban đầu và từng đợt điều trị.
Đánh giá lâm sàng ban đầu và từng đợt điều trị.
Làm nghiệm pháp đi bộ 6 phút ban đầu và từng đợt điều trị.
Kết thúc điều trị cho mỗi bên phổi.
5.2.4 Các bước tiến hành BPA
Xác định vùng mạch phổi cần can thiệp với tổn thương mới nhất sau chụp đánh giá tưới máu gần nhất.
Đường vào tĩnh mạch đùi phải hoặc trái (có thể sử dụng siêu âm hướng dẫn) đặt sheath
Tiến hành thông tim phải và đo các thông số huyết động với bóng đo áp lực phổi bít.
Rút ống thông đo áp lực phổi bít qua dây dẫn 0,035
Đưa ống thông dài 90 cm, kích thước 6Fr qua dây dẫn tới vị trí cần can thiệp.
Sử dụng heparin không phân đoạn đường tĩnh mạch với liều từ 70 – 100 IU/kg đơn vị (duy trì ACT 200–250 giây).
Ống thông can thiệp vành phải hoặc loại MP loại dài 110 cm được đưa qua dây dẫn glidewire đầu cong hướng tới vị trí đích.
Lái ống thông tới các đoạn động mạch phổi quan tâm.
Chụp động mạch phổi phân thùy được thực hiện, bệnh nhân hít vào sâu và tiêm thuốc cản quang được pha loãng.
Dây dẫn mạch vành 0,014 inch, đầu mềm, được hỗ trợ với bóng đường kính 2,0 mm, được sử dụng để đi qua các tổn thương đích. Khuyến nghị tránh các dây dẫn chuyên dụng có nguy cơ gây thủng cao hơn.
Có thể đo Pd/ Pa khi thở tự do hoặc thở sâu. Khuyến cáo các phép đo áp suất dựa trên vi ống thông (microcatheter) để sử dụng dễ dàng và lặp lại trong Các dây dẫn thường có thể thay đổi hình dạng và tráo đổi trong các quy trình BPA.
Bóng nong được sử dụng bóng áp lực cao hoặc bóng thường, kích thước từ 2,0 đến 4,0 mm. Khuyến cáo bơm dần từ bóng có kích thước nhỏ nhất (thường cho lần can thiệp đầu, chỉ nên bơm đến bóng 2,0 mm) tránh nguy cơ thủng hoặc vỡ mạch.
Lặp lại các bước như trên cho các đoạn tổn thương khác.
Kết thúc quy trình khi can thiệp từ 3-5 nhánh mạch phân thùy trong lần can thiệp đầu tiên, hoặc đã tiêm lượng thuốc cản quang tới 300 mL và/hoặc đạt mức phơi nhiễm 2
Rút introducer sheath khi ACT < 180 giây.
5.3 Các lưu ý và các mẹo mực trong can thiệp
Mô tả các tổn thương dựa trên chụp mạch về cơ bản vẫn không thay đổi so với mô tả ban đầu. Các dấu hiệu chụp mạch phổi đặc trưng gợi ý CTEPH bao gồm hình mạng lưới hoặc dải, bất thường nội mạc, tổn thương dạng túi, hẹp mạch máu đột ngột và tắc nghẽn hoàn toàn động mạch phổi. Tuy nhiên, các phương thức hình ảnh hiện đại, bao gồm siêu âm trong lòng mạch (IVUS), OCT (chụp cắt lớp quang học) và kỹ thuật chụp cắt lớp vi tính chùm tia hình nón (CBCT) đã được sử dụng trong CTEPH để xác định đặc điểm tổn thương bổ trợ và hướng dẫn cho BPA.
Một nghiên cứu với 9 đối tượng CTEPH ở đoạn xa được tiến hành tiến cứu đã chứng minh OCT vượt trội hơn IVUS trong quy trình BPA trong việc phát hiện tổn thương huyết khối mạn tính, cung cấp phép đo chính xác hơn về đường kính lòng mạch và tối ưu hóa thành công của thủ thuật trong việc làm giãn động mạch phổi đoạn xa đúng cách với các tổn thương huyết khối dài. IVUS-Virtual Histology (IVUS-VH) sử dụng các tín hiệu phản xạ trên thành động mạch để tạo ra hình ảnh mã hóa màu và cho phép phân tích thành phần tổn thương.
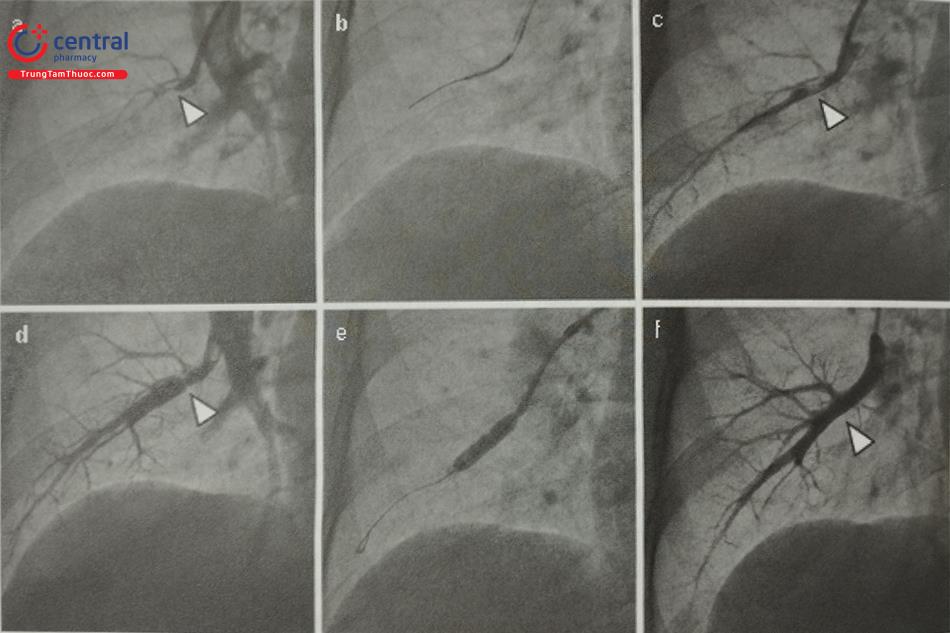
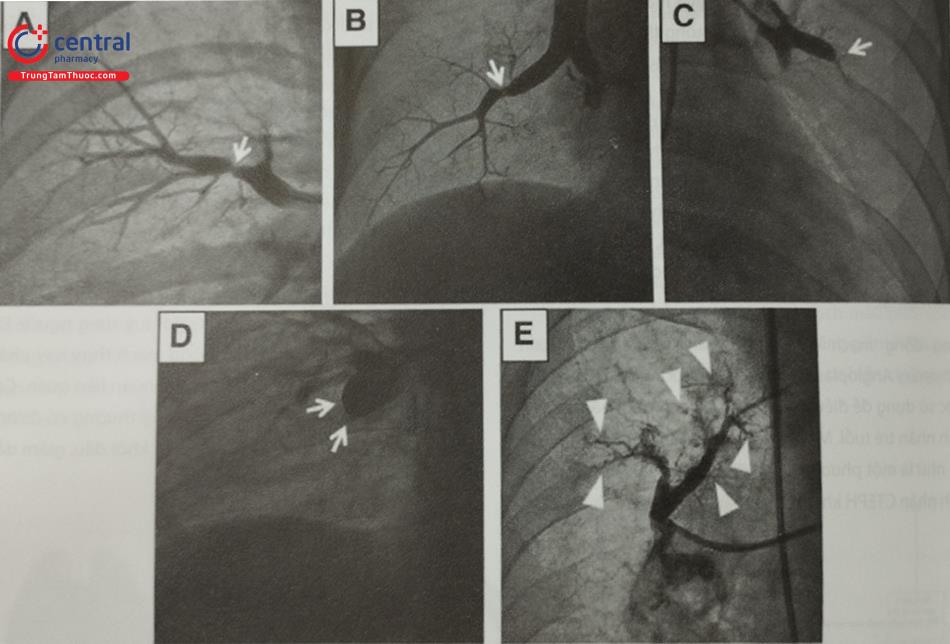
Hình (a): Chụp mạch máu phổi chọn lọc (PAG) của phân thùy trước của thùy dưới bên phải (A8) cho thấy tổn thương tắc nghẽn bán phần (đầu mũi tên). Hình (b): Mạch phổi sau lần can thiệp đầu tiên sử dụng bóng nong (2,0 × 20 Kaneka Medix, Osaka, Nhật Bản. Hình (c): PAG chọn lọc của thùy A8 bên phải sau khi nong. Hẹp (đầu mũi tên) vẫn còn sau khi tái tưới máu nhánh động mạch xa. Hình (d): PAG chọn lọc của A8 bên phải 1 tháng sau khi giãn nở ban đầu. Tổn thương (đầu mũi tên) và các mạch xa tổn thương được mở rộng một cách tự nhiên mà không cần can thiệp thêm. Hình (e): Nong tiếp tục với bóng lớn hơn (5,5×20 mm, Cordis/Cardinal Health Japan, Tokyo, Nhật Bản) để tối ưu can thiệp. Hình (f): Một năm sau lần nong thứ hai của tổn thương. Tổn thương đã được mở rộng hoàn toàn (đầu mũi tên).
Các tổn thương dạng lưới hoặc khe thường là thuận lợi hơn trong thủ thuật BPA. Các tổn thương tắc nghẽn nặng có thể được tiếp cận theo hướng xuôi dòng. Sugiyama và cộng sự đã đánh giá tính hữu ích của kỹ thuật chụp CBCT (Cone beam computed tomography) trong việc đánh giá tổ chức hóa huyết khối ở các đoạn động mạch phổi xa hơn trong CTEPH và đề xuất một phân loại mới về tổn thương đoạn xa (loại 1: màng, loại 2: mạng và khe, loại 3: khe và loại 4: hẹp hoặc tắc hoàn toàn. Trong báo cáo của họ, sự kết hợp giữa màng và khe được chỉ ra là loại tổn thương phổ biến nhất được tìm thấy ở các đoạn xa bởi CBCT không thể nhìn thấy rõ ràng bằng các kỹ thuật hình ảnh tiêu chuẩn khác.
Các kỹ thuật thực hiện BPA đã trải qua nhiều giai đoạn đáng kể kể từ các báo cáo ban đầu. Kỹ thuật BPA hiện nay nhằm mục đích phá vỡ các cấu trúc đã có tổ chức hóa và cải thiện phục hồi tưới máu mạch phổi đồng thời tránh các biến chứng. Không giống như các can thiệp động mạch vành và mạch máu ngoại vi, có thể giảm triệu chứng sau khi tái thông mạch máu đơn lẻ, cải thiện lâm sàng sau BPA thường được quan sát thấy sau khi tái thông mạch máu của nhiều phân thùy và vùng bị bệnh. Việc can thiệp tích cực vào từng tổn thương riêng lẻ với nguy cơ tổn thương mạch máu cao có thể làm giảm tác dụng của chiến lược điều trị tổng thể. Chúng tôi thường điều trị 1 đến 2 thùy phổi trong cùng một phổi trong bất kỳ quy trình BPA đơn lẻ nào.
Để giúp tránh chấn thương mạch máu, dây dẫn mạch vành 0,014’’ với đầu mềm, giúp giảm chấn thương được sử dụng cho BPA. Hầu hết tất cả các quy trình BPA của một vài tác giả đều được thực hiện bằng dây dẫn có trọng lượng trung bình cân bằng mô men xoắn cao (Abbott Vascular, Abbott Park, IL, USA). Ngay cả khi điều trị các mạch bị tắc, các tác giả cũng ưu tiên sử dụng dây dẫn mềm, kết hợp với ống thông hỗ trợ và sử dụng hợp lý các loại dây dẫn khác. Tuy nhiên các bác sĩ can thiệp cần thận trọng khi sử dụng loại dây dẫn ngậm nước vì có sự gia tăng tỷ lệ tổn thương và chảy máu động mạch phổi sau khi sử dụng dây dẫn có phủ polymer. Heparin không phân đoạn được sử dụng trong thủ thuật duy trì ACT trong giới hạn 200-250s. Bóng có đường kính nhỏ, phù hợp được lựa chọn để bắt đầu BPA, giúp xác định đường kính mạch và đáp ứng tổn thương trước khi sử dụng bóng lớn hơn. Hầu hết các tổn thương mạch máu phổi đoạn xa có thể được bắt đầu nong bằng cách sử dụng bóng đường kính 2,0 mm. Nong động mạch đoạn gần được thực hiện với bóng có đường kính lớn hơn, bóng áp lực cao nằm trong khoảng từ 2,5 đến 4,0 mm, và hiếm khi lên đến 5,0 mm. Bóng có đường kính nhỏ hơn mạch đích được ưu tiên để bảo tồn cấu trúc động mạch phổi và giảm thiểu nguy cơ bị bóc tách, thủng hoặc vỡ.
Trong một số trường hợp, các kỹ thuật đặc biệt được xem xét khi vị trí can thiệp của tổn thương mục tiêu chưa đạt yêu cầu mặc dù bơm bóng liên tục và kích thước bóng thích hợp. Đầu tiên, nhiều lần bơm bóng kéo dài trong thời gian lên đến 3 phút được thực hiện. Tiếp theo, có thể thử sửa đổi tổn thương bằng cách sử dụng các loại ống thông chuyên dụng như Chocolate (TriReme Medical LLC, Pleasanton, CA, USA) và AngioSculpt (Spectranetics Corp, Colorado Springs, CO, USA) kết hợp với bơm bóng kéo dài. Các phương pháp tiếp cận tích cực hơn bằng cách sử dụng bóng có dao“cutting balloon” làm tăng nguy cơ chấn thương mạch và nên tránh sử dụng. Có thể sử dụng stent có màng cho các tổn thương có nguy cơ hoặc bị nứt vỡ mạch máu.
Mặc dù dữ liệu dài hạn về tình trạng động mạch phổi sau BPA còn hạn chế, tái hẹp được coi là không phổ biến và đặt stent để ngăn tái hẹp sau khi nong động mạch bằng bóng không được khuyến cáo, đặc biệt vì có sự di động mạch phổi đáng kể trong giai đoạn hô hấp.
Chú ý đến sự an toàn của thủ thuật BPA được nhấn mạnh hơn nữa bằng cách tránh các kỹ thuật tích cực khi khởi đầu đợt điều trị, đặc biệt là khi có sự tắc nghẽn nghiêm trọng và áp lực động mạch phổi nền tăng cao (áp lực ĐMP trung bình > 35 mmHg) do nguy cơ phù phổi cao hơn và ho máu nhiều hơn sau can thiệp. Điều trị 1 đến 2 thùy của một phổi (3–5 phân đoạn) được khuyến nghị mỗi đợt để giảm nguy cơ biến chứng và hạn chế phơi nhiễm chất cản quang và bức xạ. Việc tái thông mạch máu ban đầu của các đoạn bị tắc nhằm mục đích khôi phục lưu lượng máu ở đoạn xa, cải thiện huyết động và cung cấp một đường vào để có thể tái can thiệp trong các lần can thiệp tiếp theo.
5.4 Đánh giá chức năng
Việc dự đoán bệnh động mạch phổi tắc nghẽn là khó khăn khi chỉ bằng chụp mạch và cũng như bằng hình ảnh không xâm lấn cũng như để đánh giá chức năng nội mạch. Trong trường hợp này việc sử dụng dây dẫn có gắn đầu đo áp lực (như hệ thống Navvus II Rapid Exchange FFR MicroCathe- ter của Acist Medical Systems, Eden Prairie, MN, USA) và đo áp lực mạch máu ở xa là hữu ích.
Trong 1 nghiên cứu, quy trình BPA được tiếp tục với mục đích đạt được áp lực động mạch phổi xa đến áp lực động mạch phổi gần (Pd/ Pa) lớn hơn 0,80 trừ khi áp lực ĐMP trung bình ban đầu lớn hơn 35 mmHg. Các nhà nghiên cứu cho rằng cách tiếp cận này giúp giảm biến chứng cùng các tác dụng ngoại ý liên quan đến thủ thuật và có thể tránh phù phổi sau tăng tưới máu (RPE) ở hầu hết bệnh nhân. Chiến lược của các tác giả là sử dụng tỷ lệ Pd/ Pa nhỏ hơn 0,75 để chỉ định cho tiếp tục nong với bóng (bóng nong có kích thước lớn hơn, hoặc lựa chọn bóng nong ban đầu có kích thước lớn hơn, scoring balloon). Bất kỳ sự cải thiện nào về Pd/Pa sau nong là đủ để kết thúc điều trị tại vị trí mạch đích cho thấy sự cải thiện tưới máu thông qua giải quyết tắc nghẽn huyết khối hoặc tăng lưu lượng trong đoạn phổi mới tái tạo.
6 Các tiêu chí đánh giá thành công của thủ thuật
Đạt được dòng chảy độ 3 trên hình ảnh chụp mạch qua đường ống thông trong các nhánh mạch tổn thương.
Nếu dây dẫn có gắn đầu đo áp lực được sử dụng để đánh giá sinh lý tổn thương, chênh áp ở tổn thương sau nong bóng Pd/Pa > 0,8 là một tiêu chuẩn của thành công.
Không có biến chứng đáng kể, và mức độ chiếu tia ít hơn 2 Gy và dưới 300 mL thuốc cản quang được sử dụng trong một lần can thiệp.
Bảng 1. Phân độ dòng chảy sau can thiệp nong bóng động mạch phổi trong điều trị CTEP
| Độ 1 | Không có dòng máu thì động mạch |
| Độ 2 | Có dòng máu thì động mạch Không có dòng máu thì tĩnh mạch |
| Độ 3 | Có dòng máu thì động mạch Có 1 phần dòng máu hồi lưu thì tĩnh mạch |
| Độ 4 | Có dòng máu thì động mạch Có dòng máu hồi lưu thì tĩnh mạch nhanh |
7 Biến chứng và xử trí
Kết quả thủ thuật của BPA phần lớn phụ thuộc vào việc lựa chọn bệnh nhân thích hợp, chuyên môn của bác sĩ và việc kết hợp các thiết bị và kỹ thuật mới được sử dụng trong can thiệp mạch vành vào mạch máu phổi. Kết quả tổng thể và tỷ lệ biến chứng khác nhau giữa các bệnh nhân với các mức độ thành thạo và khối lượng bệnh nhân được điều trị khác nhau. Trong các nghiên cứu gần đây, tỷ lệ tử vong do BPA dao động từ 0% đến 10%. Các biểu hiện lâm sàng để phát hiện biến chứng sớm liên quan đến tiến trình can thiệp bao gồm ho đột ngột có thể kèm theo khạc ra máu, tần số tim tăng hơn 20 chu kì/ phút; độ bão hòa oxy giảm hơn 5% và có sự thoát thuốc cản quang ra ngoài lòng mạch.
Hai biến chứng phổ biến nhất của BPA bao gồm phù phổi cấp sau tái tưới máu (Reperfusion pulmonary edema hay RPE) và tổn thương mạch máu phổi với thủng hoặc vỡ mạch hiếm gặp. Bất chấp những tiến bộ và cải tiến của quy trình, RPE vẫn là một biến chứng thường xuyên của BPA với tỷ lệ mắc bệnh cao từ 53% đến 60% trong một số nghiên cứu. Một số yếu tố liên quan đến RPE sau BPA bao gồm quy trình can thiệp, mức độ nặng của tình trạng tăng áp phổi ban đầu, và mức độ cao của peptide natri lợi niệu loại B trong huyết tương. Bệnh nhân CTEPH có động mạch phế quản kém phát triển có nhiều khả năng tiến triển RPE sau quy trình BPA. Trong một nghiên cứu trên 150 thủ thuật BPA liên tiếp trong CTEPH, Inami và các cộng sự đề xuất chỉ số “Chấm điểm Dự báo Phù phổi (PEPSI)” để dự đoán nguy cơ RPE sau khi tiến hành BPA. Điểm PEPSI được tính bằng cách nhân sức cản mạch phổi ban đầu trước can thiệp (PVR, đơn vị Wood) với tổng điểm số thay đổi tưới máu phổi của từng nhánh mạch phổi sau can thiệp. Trong nghiên cứu phân tích đa biến này, PEPSI được chứng minh là yếu tố tiên lượng độc lập mạnh nhất trong số các biến nghiên cứu, có tương quan rất có ý nghĩa với sự xuất hiện của RPE (P < 0,0001), là một dấu hiệu chỉ báo nguy cơ cao của RPE (giá trị ngưỡng 35,4, giá trị dự báo dương tính là 75,8% và giá trị dự báo âm tính là 92,3%).
Các nghiên cứu cũng đã đã báo cáo khi sử dụng dây có đầu đo áp lực và điểm PEPSI có thể hữu ích trong việc quản lý và giảm nguy cơ RPE và các biến chứng mạch máu. Cách tiếp cận này đánh giá sau khi kết thúc mỗi lần BPA bằng cách sử dụng PEPSI với mục tiêu của điểm dưới 35,4 và để đạt được áp lực động mạch trung bình đoạn xa dưới 35 mmHg ở mỗi tổn thương đích. Phương pháp kết hợp giữa nong bóng bằng bóng nhỏ và giảm số lượng mạch được điều trị mỗi lần có thể là một công cụ hiệu quả trong việc giảm nguy cơ phát triển RPE. Tuy nhiên, không có dữ liệu chính xác nào để hỗ trợ phương pháp này.
Bảng 2. Bảng phân độ mức độ phù phổi do tái tưới máu (RPE) sau can thiệp BPA
| Độ 1 | Không có hình ảnh phù phổi trên phim Xquang ngực. |
| Độ 2 | Phù phổi mức độ nhẹ trên phim Xquang ngực và sẽ đỡ dần sau khi thở oxy liều thấp trong vài ngày. Phù phổi mức độ trung bình trên phim |
| Độ 3 | Xquang ngực, bệnh nhân cần thở oxy liều cao qua mặt nạ mới duy trì được nồng độ oxy máu. |
| Độ 4 | Phù phổi nặng trên phim Xquang ngực cần hỗ trợ thông khí áp lực dương không xâm lấn. |
| Độ 5 | Phù phổi cực kì nghiêm trọng cần thông khí cơ học hỗ trợ. |
Thủng hoặc vỡ động mạch phổi là một biến chứng nghiêm trọng của BPA và được báo cáo ở 0% đến 7% các thủ thuật trong các nghiên cứu gần đây. Một số biện pháp được đề xuất để giảm nguy cơ thủng động mạch phổi bao gồm kiểm soát và định vị dây dẫn đưa vào, xác định kích thước bóng nong phù hợp và tránh các đoạn bị tắc mà không có dòng chảy xa. Thông khí áp lực dương không xâm lấn với oxy bổ sung và, trong các tình huống nghiêm trọng hơn, thở máy và oxy hóa qua màng ngoài cơ thể (ECMO), nên được coi là phương pháp điều trị quan trọng khi xảy ra chấn thương phổi nặng hoặc vỡ mạch máu sau BPA nhằm để duy trì oxy và duy trì huyết áp. Sử dụng bóng nong để chèn ép vào vị trí mạch bị thủng hoặc vỡ, ngừng hoặc đảo ngược chống đông, đặt stent có màng bọc, tiêm chất Gelfoam và hoặc bít chỗ thủng bằng coil là những kỹ thuật cứu trợ được đề xuất có hiệu quả để xử trí trong những tình huống này.
8 Kết quả của can thiệp
8.1 Ngắn hạn
Mặc dù dữ liệu hiện có về BPA xuất phát sau CTEPH còn hạn chế (Bảng 3), trong ngắn hạn, quy trình này có liên quan đến cải thiện huyết học tim phổi, tưới máu phổi, khả năng chịu đựng khi gắng sức, đánh giá theo phân loại gắng sức của Tổ chức Y tế Thế giới và đo khoảng cách đi bộ 6 phút. Cải thiện huyết động học, chẳng hạn như giảm áp lực động mạch phổi trung bình (mPAP) và sức cản mạch phổi (PVR), tỷ lệ thuận với số lần điều trị hoặc sau mỗi lần can thiệp BPA thành công và có thể mất vài tuần để quan sát các tác động tích cực của quy trình. Mặc dù chỉ giới hạn trong một số nghiên cứu hồi cứu, nhưng thời gian dài theo dõi dài hơn gần đây cho thấy sự tồn tại của lợi ích của kỹ thuật này lên huyết động (giảm PVR và áp lực động mạch phổi) của quy trình BPA với thời gian theo dõi trung bình là 2,8 năm sau khi BPA. Cải thiện chức năng thất phải đã được chứng minh bằng siêu âm tim qua lồng ngực, siêu âm tim 3 chiều và cộng hưởng từ (MRI) tim mạch trước và sau BPA. Huyết áp được cải thiện sau BPA có thể dẫn đến tái tạo ngược thất phải, cải thiện chức năng tâm thu, và giảm tổn thương cơ tim cận lâm sàng với giảm mức troponin T nhạy cảm cao.
Bảng 3. Các nghiên cứu và theo dõi lâu dài sau can thiệp CTEPH
| Tác giả, năm xuất bản | Số bệnh nhân (Quốc gia) | Số lần can thiệp (tổng) | Số lần can thiệp/1 bệnh nhân | Sống còn |
| Feinstein và CS, 2001 | 18 (USA) | 47 | 2,6 | 89% tại 34,2 tháng |
| Mizoguchi và CS, 2012 | 68 (Japan) | 255 | 3,8 | 97% tại 2,2 tháng 1,4 năm |
| Sugimura và CS,2012 | 12 (Japan) | NA | 5 | 100% tại 12 tháng |
| Andreassen và CS, 2013 | 20 (Norway) | 73 | 3,7 | 85% tại 51 tháng |
| Yanagisawa và CS 2014 | 70 (Japan) | 257 | 4 | 100% (<65 ) |
| Shimura và CS, 2015 | 110 (Japan) | 423 | 3,8 | 100% tại 1,97 năm |
| Inami và CS, 2016 | 170 (Japan) | 649 | 3,8 | 97,6% tại 2,8 năm |
Ảnh hưởng của BPA thứ phát lên chức năng thận đã được đánh giá trong một nghiên cứu gần đây bao gồm 46 đối tượng CTEPH có hoặc không có suy giảm chức năng thận ban đầu. Cải thiện có ý nghĩa thống kê của chức năng cầu thận, tăng tốc độ lọc ở nhóm suy giảm chức năng thận sau can thiệp BPA đã được báo cáo (47,0 so với 51,5 mL/ phút/ 1,73 m2; P < 0,018). Kết quả này phù hợp với một báo cáo trước đó về tác động tích cực của BPA đối với chức năng thận do suy tim phải nặng thứ phát sau CTEPH. Một nghiên cứu trên 9 bệnh nhân CTEPH có PVR xấu dần ở 4,1 (2,7–7,9) năm sau phẫu thuật lấy huyết khối và cắt bỏ mô sẹo ở động mạch phổi, báo cáo cải thiện đáng kể PVR với mức giảm tới 4,2 (2,8–4,8) đơn vị Wood (P <0,05) ở giai đoạn 1,9 (1,3–3,3) năm sau các quy trình BPA tiếp theo. Tính an toàn và hiệu quả của quy trình cũng đã được chứng minh ở bệnh nhân cao tuổi (65 tuổi) so với bệnh nhân trẻ hơn, có sự thay đổi tương tự về huyết động học, tỷ lệ biến chứng, thời gian nằm viện chăm sóc đặc biệt và thời gian nằm viện, và tử vong do mọi nguyên nhân.
8.2 Hướng tới tương lai cho phương pháp nong mạch phổi bằng bóng
Dữ liệu hiện có sẵn từ nhiều nước trên thế giới cho thấy lâm sàng tính khả thi của BPA để điều trị CTEPH. Trong số các vấn đề cần giải quyết là:
- Phát triển nhóm can thiệp
- Chuẩn hóa tối ưu quy trình kỹ thuật.
- Phát triển thiết bị can thiệp chuyên dụng.
- Tiêu chuẩn đào tạo phù hợp.
- Đánh giá đa trung tâm khách quan để đạt được thành công.
- Đánh giá kết quả lâu dài.
- Tiến hành các thử nghiệm lâm sàng ngẫu nhiên của BPA so với chỉ điều trị thuốc.
- Thử nghiệm lâm sàng ngẫu nhiên của can thiệp nong van ĐMP bằng bóng so với phẫu thuật lấy huyết khối và cắt bỏ mô sẹo ở động mạch phổi.
9 Theo dõi sau can thiệp
9.1 Theo dõi bệnh nhân sau can thiệp
Bệnh nhân được nhập viện để theo dõi qua đêm. Ống thông đường vào tĩnh mạch đùi được rút ra sau khi ACT giảm xuống dưới 200s. Nếu bệnh nhân đang sử dụng thuốc nhóm thuốc chống đông warfarin, nên tiêm bắc cầu với heparin trọng lượng phân tử thấp, và sử dụng lại thuốc cho đến khi chỉ số INR đạt liều điều trị. Nếu bệnh nhân đang sử dụng thuốc chống đông trực tiếp đường uống (DOAC), nên dùng lại thuốc ngay sau ngày hôm sau nếu không có chống chỉ định.
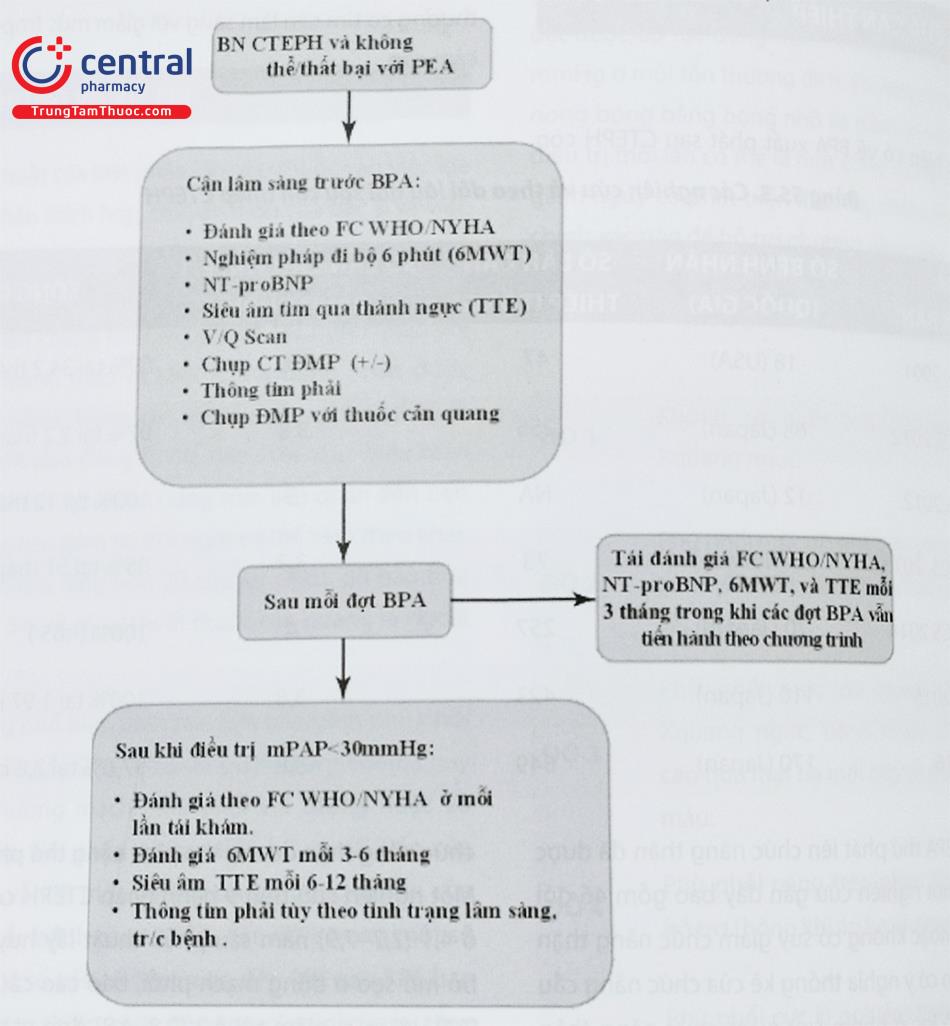
Chú thích: ĐMP: động mạch phổi; FC WHO: phân loại đánh giá chức năng theo Tổ chức Y tế Thế giới; NYHA: phân loại đánh giá chức năng theo Hội tim mạch New York.
Chụp Xquang ngực sau can thiệp nên được tiến hành để kiểm tra phù phổi huyết động. Bệnh nhân thường được cho ra viện vào ngày hôm sau trừ khi có chỉ định khác để ở lại bệnh viện. Nghiệm pháp đi bộ 6 phút được thực hiện trước lần can thiệp tiếp theo.
9.2 Theo dõi bệnh nhân lâu dài
Khi tái khám định kỳ bệnh nhân được khám lâm sàng, làm điện tâm đồ và siêu âm tim qua thành ngực, đánh giá phân loại chức năng theo WHO/NYHA.
Nghiệm pháp đi bộ 6 phút được thực hiện mỗi 3-6 tháng.
Siêu âm tim qua thành ngực mỗi 6-12 tháng.
Thông tim nhắc lại nếu cần, theo tình trạng lâm sàng của bệnh nhân.
10 Tài liệu tham khảo
- Kim NH, Delcroix M, Jais X, Madani MM, Matsubara H, Mayer E, et al. Chronic thromboembolic pulmonary hypertension. Eur Respir J. 2019;53:1.
- Shimura N, Kataoka M, Inami T, Yanagisawa R, Ishiguro H, Kawakami T, et al. Additional percutaneous transluminal pulmonary angioplasty for residual or recurrent pulmonary hypertension after pulmonary endarterectomy. Int J Cardiol. 2015;183:138–42.
- Yanagisawa R, Kataoka M, Inami T, Shimura N, Ishiguro H, Fukuda K, et al. Safety and efficacy of percutaneous transluminal pulmonary angioplasty in elderly patients. Int J Cardiol. 2014;175(2):285–9.
- Fukuda K, Date H, Doi S, Fukumoto Y, Fukushima N, Hatano M, et al. Guidelines for the treatment of pulmonary hypertension (JCS 2017/ JPCPHS 2017). Circ J. 2019;83(4):842–945.
- Wiedenroth CB, Olsson KM, Guth S, Breithecker A, Haas M, Kamp JC, et al. Balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic disease. Pulm Circ. 2018;8(1):2045893217753122.
- Inami T, Kataoka M, Kikuchi H, Goda A, Satoh Balloon pulmonary angioplasty for symptomatic chronic thromboembolic disease without pulmonary hypertension at rest. Int J Cardiol. 2019;289:116–8.
- Wiedenroth CB, Ghofrani HA, Adameit MSD, Breithecker A, Haas M, Kriechbaum S, et Sequential treatment with riociguat and balloon pulmonary angioplasty for patients with inoperable chronic thromboembolic pulmonary hypertension. Pulm Circ. 2018;8(3):2045894018783996.
- Ogawa A, Matsubara H. After the dawn-balloon pulmonary angioplasty for patients with chronic thromboembolic pulmonary hypertension. Circ J. 2018;82(5):1222–30.
- Kawakami T, Ogawa A, Miyaji K, Mizoguchi H, Shimokawahara H, Naito T, et Novel angiographic classification of each vascular lesion in chronic thromboembolic pulmonary hypertension based on selective angiogram and results of balloon pulmonary angioplasty. Circ Cardiovasc Interv. 2016;9:10.
- Ejiri K, Ogawa A, Fujii S, Ito H, Matsubara H. Vascular injury is a major cause of lung injury after balloon pulmonary angioplasty in patients with chronic thromboembolic pulmonary hypertension. Circ Cardiovasc Interv. 2018;11(12):e005884.
- Kitani M, Ogawa A, Sarashina T, Yamadori I, Matsubara H. Histological changes of pulmonary arteries treated by balloon pulmonary angioplasty in a patient with chronic thromboembolic pulmonary hypertension. Circ Cardiovasc Interv. 2014;7(6):857–9.
- Shimokawahara H, Ogawa A, Mizoguchi H, Yagi H, Ikemiyagi H, Matsubara H. Vessel stretching is a cause of lumen enlargement immediately after bal- loon pulmonary angioplasty: intravascular ultrasound analysis in patients with chronic thromboembolic pulmonary hypertension. Circ Cardiovasc Interv. 2018;11(4):e006010.
- Kurzyna M, Darocha S, Pietura R, Pietrasik A, Norwa J, Manczak R, et al. Changing the strategy of balloon pulmonary angioplasty resulted in a reduced compli- cation rate in patients with chronic thromboembolic pulmonary hypertension. A single-centre European experience. Kardiol Pol. 2017;75(7):645–54.
- Nagayoshi S, Ogawa A, Matsubara H. Spontaneous enlargement of pulmonary artery after success- ful balloon pulmonary angioplasty in a patient with chronic thromboembolic pulmonary hypertension. EuroIntervention. 2016;12(11):e1435.
- Inami T, Kataoka M, Shimura N, Ishiguro H, Yanagisawa R, Kawakami T, et al. Incidence, avoidance, and management of pulmonary artery injuries in percutaneous transluminal pulmonary angioplasty. Int J Cardiol. 2015;201:35–7.

