Tim mạch can thiệp: Can thiệp hẹp tắc đường vào lọc máu
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn:
TS.BSNT. Đinh Huỳnh Linh
ThS.BSNT. Lê Tuấn Minh
ThS.BSNT. Trần Đình Tuyên
PGS.TS.BS. Phạm Mạnh Hùng
Trungtamthuoc.com -Thận là cơ quan bài tiết chính của hệ tiết niệu có chức năng là lọc máu và đào thải độc tố theo đường niệu đạo dẫn đến bàng quang và thải ra ngoài,tái hấp thu nước,... Cho nên khi chức năng thận có vấn đề như hẹp đường vào lọc máu thì cần phải can thiệp các liệu pháp điều trị như sử dụng thuốc, thay thế thận,... Vậy can thiệp hẹp tắc đường vào lọc máu được thực hiện như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy tìmhiểu nhé!
1 Đại cương
Bệnh thận giai đoạn cuối là một vấn đề sức khỏe có tính toàn cầu, gây ảnh hưởng nghiêm trọng đến đời sống kinh tế và chất lượng cuộc sống của bệnh nhân. Với bệnh nhân suy thận mạn, các liệu pháp thay thế thận bao gồm: thẩm phân phúc mạc (6,4%), ghép thận (29,3%) và chạy thận nhân tạo (64,2%).
Lọc thận nhân tạo là phương pháp điều trị thay thế thận suy chủ yếu tại Việt Nam cũng như ở nhiều nước trên thế giới. Các bệnh nhân chạy thận nhân tạo chu kỳ phải sống phụ thuộc hoàn toàn vào việc chạy thận, do đó việc tạo lập và duy trì một con đường lọc máu ổn định là vô cùng cần thiết.
Theo Hiệp hội Thận học Hoa Kỳ (National Kidney Foundation – Kidney Disease Outcomes Quality Initiatives, viết tắt NKF-KDOQI hay KDOQI). thông động tĩnh mạch tự thân (Arteriovenous Fistula, AVF) là đường vào lọc máu tối ưu nhất. Các phương pháp khác bao gồm cầu nối động tĩnh mạch nhân tạo (Arteriovenous Graft, AVG) và lọc máu qua catheter.
Hẹp đường vào lọc máu là biến chứng thường gặp ở các bệnh nhân thận nhân tạo chu kỳ, chủ yếu do cơ chế tăng sinh lớp nội mạc. Hậu quả là cần sửa chữa hoặc tạo một đường lọc máu mới để người bệnh có thể tiếp tục chạy thận chu kỳ. Để sửa chữa một đường vào lọc máu bị hẹp tắc, có thể phẫu thuật hoặc can thiệp nội mạch để sửa chữa tổn thương. Nhiều nghiên cứu gần đây đã chỉ ra ưu thế của can thiệp nội mạch so với phẫu thuật truyền thống: tỉ lệ tái hẹp không khác biệt, giảm thiểu nguy cơ nhiễm khuẩn, ít xâm lấn, có thể sử dụng được ngay sau can thiệp mà không cần phải đặt catheter để chờ đợi mạch máu được phục hồi, bảo tồn được các nhánh tĩnh mạch để tạo đường vào lọc máu trong tương lai và cải thiện tiên lượng sống cho bệnh nhân lọc máu.
2 Giải phẫu và chức năng của đường vào mạch máu
2.1 Các thành phần của đường vào lọc máu
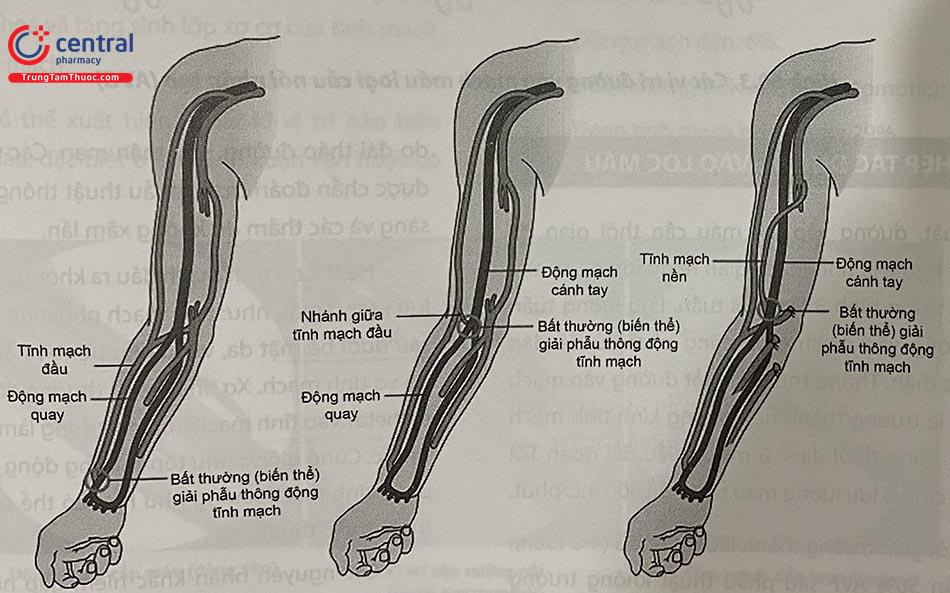
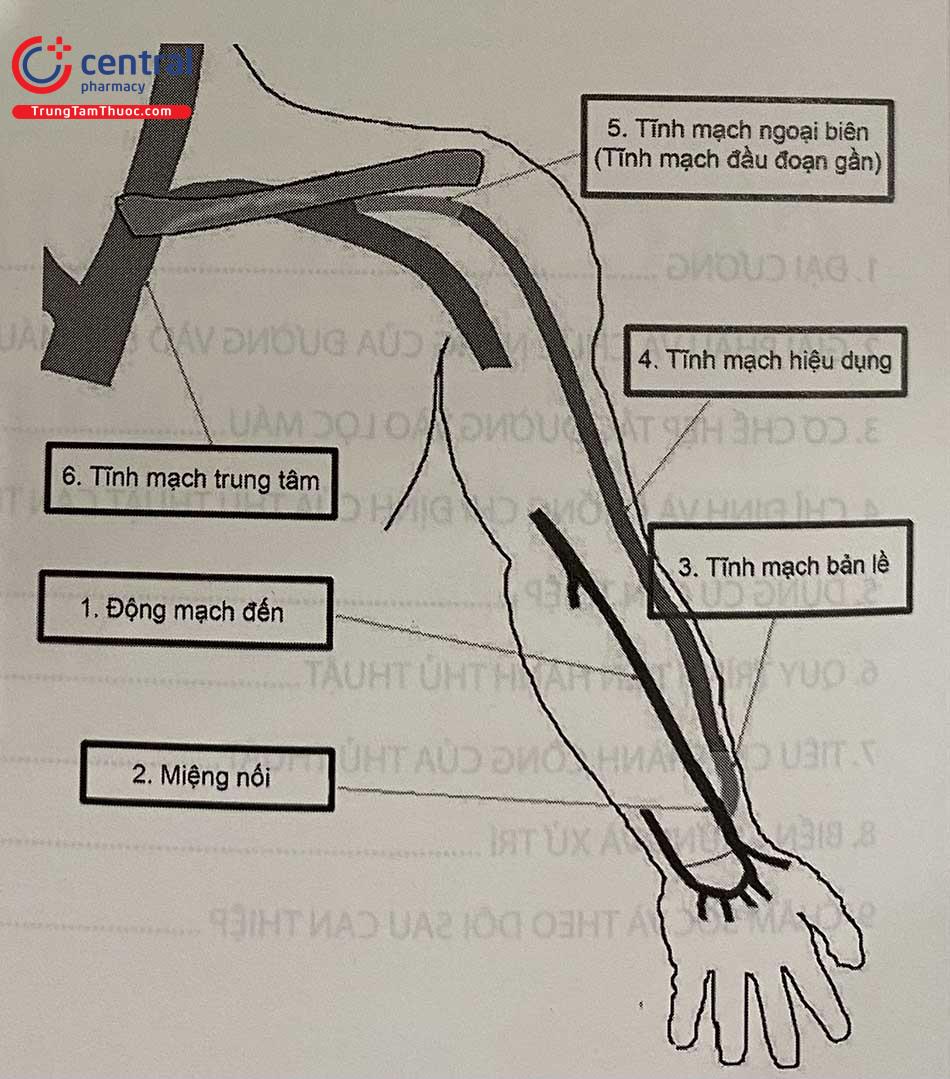
Về mặt giải phẫu, đường vào lọc máu được chia thành 6 phần khác nhau (Hình 60.1).
- Động mạch (ĐM) đến (inflow artery): phần động mạch trước miệng nối.
- Miệng nối (anastomosis): vị trí tạo ra sự thông thương trực tiếp giữa ĐM và tĩnh mạch (TM).
- Tĩnh mạch bản lề (swing vein) là phần tĩnh mạch ngay sau miệng nối, kéo dài
- Đoạn hiệu dụng (useable segment): là đoạn 8-10cm đầu tiên sau miệng nối. Đoạn tĩnh mạch này được sử dụng để cắm kim lọc máu.
- Tĩnh mạch dẫn lưu ngoại biên (outflow vein): phần TM dẫn lưu ngay sau đoạn hiệu dụng, có thể có một hoặc nhiều kênh dẫn lưu.
- Tĩnh mạch trung tâm (central venous): phần TM dẫn lưu gần gốc chi, thường đề cập đến TM dưới đòn, thân TM cánh tay đầu, TM chủ trên.
Thành phần nào của đường vào mạch máu cũng có thể bị hẹp, tắc, do những cơ chế khác nhau.
2.2 Các loại đường vào mạch máu dùng để chạy thận nhân tạo chu kỳ
2.2.1 Thông động-tĩnh mạch tự thân (AVF)
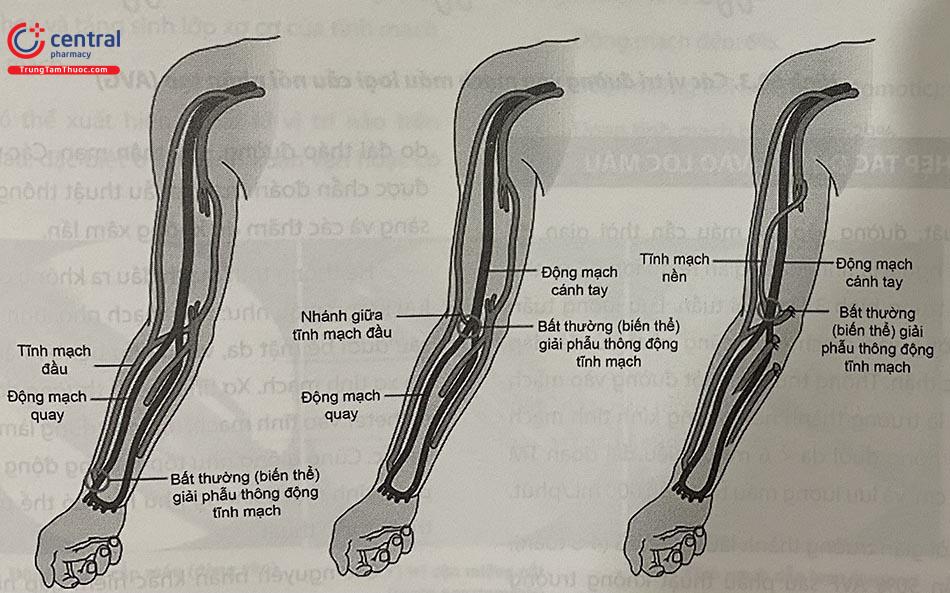
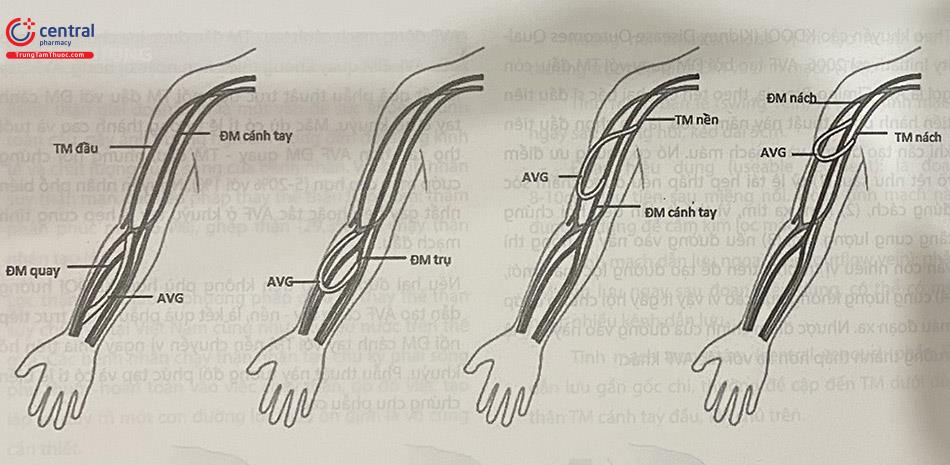
AVF (arteriovenous fistula) là kết quả của phẫu thuật nối trực tiếp tĩnh mạch (Xem hình 60.2 và 60.3). Có ba loại AVF phổ biến nhất bao gồm: AVF ĐM quay – TM đầu, AVF ĐM cánh tay – TM đầu, và AVF ĐM cánh tay – TM nền.
Theo khuyến cáo KDOQI (Kidney Disease Outcomes Qual- ity Initiatives) 2006, AVF tạo bởi ĐM quay với TM đầu, còn gọi là AVF Cimino-Brescia, theo tên của hai bác sĩ đầu tiên tiến hành phẫu thuật này năm 1966, là lựa chọn đầu tiên khi cần tạo đường vào mạch máu. Nó có những ưu điểm rõ rệt như sau: (1) tỷ lệ tái hẹp thấp nếu được chăm sóc đúng cách, (2) nằm xa tim, vì thế ít dẫn đến hội chứng tăng cung lượng tim, (3) nếu đường vào này bị hỏng thì vẫn còn nhiều vị trí phía trên để tạo đường lọc máu mới, (4) cung lượng không quá cao vì vậy ít gây hội chứng cướp máu đoạn xa. Nhược điểm chính của đường vào này là tỉ lệ trưởng thành thấp hơn so với các AVF khác.
AVF động mạch cánh tay – TM đầu được lựa chọn tiếp theo nếu AVF ĐM quay không thích hợp hoặc bị hỏng. AVF này là kết quả phẫu thuật trực tiếp nối TM đầu với ĐM cánh tay ở hố khuỷu. Mặc dù có tỉ lệ trưởng thành cao và tuổi thọ cao hơn AVF ĐM quay – TM đầu, nhưng hội chứng cướp máu cao hơn (5-20% với 1%). Nguyên nhân phổ biến nhất gây hẹp hoặc tắc AVF ở khuỷu tay là hẹp cung tĩnh mạch đầu.
Nếu hai đường vào trên không phù hợp, KDOQI hướng dẫn tạo AVF cánh tay – nền, là kết quả phẫu thuật trực tiếp nối ĐM cánh tay với TM nền chuyển vị ngay phía trên hố khuỷu. Phẫu thuật này tương đối phức tạp và có tỉ lệ biến chứng chu phẫu cao.
2.2.2 Cầu nối động-tĩnh mạch nhân tạo (AVG)
AVG (arteriovenous graft) là lựa chọn khác để tạo đường vào lọc máu mặc dù tuổi thọ dài hạn kém hơn so với AVF. AVG là kết quả phẫu thuật nối trực tiếp động mạch với tĩnh mạch thông qua đoạn mạch nhân tạo polytetrafluoroeth- ylene (PTFE). Ở chi trên, AVG phổ biến bao gồm: cầu nối giữa động mạch cánh tay với tĩnh mạch đầu ở cẳng tay hoặc cầu nối giữa động mạch cánh tay với tĩnh mạch nền ở cánh tay (Xem hình 60.3). Có hai dạng mạch nhân tạo là dạng thẳng hoặc dạng vòng. AVG ở đùi cũng có thể thực hiện bằng cách nối động mạch đùi với tĩnh mạch hiển lớn qua đoạn mạch nhân tạo.
Ưu điểm hàng đầu của AVF là có thể sử dụng sớm sau khi phẫu thuật, nhờ đó giảm thời gian người bệnh phải lọc máu qua catheter trung tâm. Tuy vậy, AVG có tỉ lệ hẹp hoặc tắc cao hơn đáng kể so với AVF, và tuổi thọ trung bình cũng ngắn hơn (12-18 tháng so với 3-7 năm). Đồng thời, phẫu thuật tạo cầu nối nhân tạo cũng có chi phí đắt hơn, do sử dụng vật liệu nhân tạo.
Do vậy, lựa chọn đường vào lọc máu dựa trên nguyên tắc “AVF đầu tiên” nghĩa là chọn AVF mỗi khi có thể, trước khi sử dụng AVG. Nếu cần tạo AVG, chọn tay không thuận trước tay thuận, cẳng tay sử dụng trước cánh tay, và chi trên sử dụng trước chi dưới.
3 Cơ chế hẹp tắc đường vào lọc máu
Sau phẫu thuật, đường vào lọc máu cần thời gian để trưởng thành, nghĩa là tĩnh mạch giãn ra đủ lớn để có thể chọc kim vào trung bình 3 lần mỗi tuần. Lưu lượng tuần hoàn qua đường vào mạch máu cũng phải đủ để đáp ứng tốc độ lọc thận. Thông thường, một đường vào mạch máu được coi là trưởng thành nếu đường kính tĩnh mạch 6 mm, nằm nông dưới da < 6 mm, chiều dài đoạn TM hiệu dụng > 6 cm, và lưu lượng máu tối thiểu 600 mL/phút.
AVF đòi hỏi thời gian trưởng thành lâu hơn AVG (4-8 tuần), và khoảng gần 50% AVF sau phẫu thuật không trưởng thành đầy đủ. Tuy vậy, tiên lượng lâu dài của AVF rất tốt, với tỉ lệ còn lưu thông mạch đạt 70% trong năm đầu tiên, 60% trong năm thứ hai.
Do đường vào lọc máu giữ vai trò sống còn với các bệnh nhân thận nhân tạo chu kỳ, hỏng đường vào là vấn đề nghiêm trọng ở những bệnh nhân này, khi số lượng tĩnh mạch trên cơ thể con người là hữu hạn. Hai cơ chế gây hẹp hoặc tắc AVF/AVG là cơ chế tiên phát và thứ phát.
3.1 Cơ chế tiên phát
Phần lớn các nguyên nhân gây hẹp hoặc tắc AVF/AVG tiên phát là giải phẫu không phù hợp dẫn đến lưu lượng đến tĩnh mạch dẫn lưu thấp:
Động mạch đến không cung cấp đủ lưu lượng máu do động mạch nhỏ hoặc xơ vữa gây hẹp mạch. Ngoài ra, vôi hóa động mạch cũng là một nguyên nhân phổ biến do đái tháo đường, suy thận mạn. Các vấn đề trên cần được chẩn đoán trước phẫu thuật thông qua khám lâm sàng và các thăm dò không xâm lấn.
Hệ thống tĩnh mạch đầu ra không cung cấp đầy đủ lưu lượng máu như: tĩnh mạch nhỏ, tĩnh mạch nằm quá sâu dưới bề mặt da, ví dụ như bệnh nhân béo phì hoặc do xơ tĩnh mạch. Xơ tĩnh mạch thường do tiền sử có đặt catheter vào tĩnh mạch, hoặc sử dụng làm đường truyền thuốc. Cũng giống như tổn thương động mạch, các giải phẫu tĩnh mạch không phù hợp có thể phát hiện được trước phẫu thuật.
Các nguyên nhân khác hiếm gặp như hội chứng cướp máu, sự phát triển của tuần hoàn bàng hệ tĩnh mạch gây giảm lưu lượng tĩnh mạch chính.
3.2 Cơ chế thứ phát huyết khối
2.2.2.1 Huyết khối
Một khi đường vào lọc máu trưởng thành, huyết khối là nguyên nhân phổ biến nhất gây ra hẹp hoặc tắc thứ phát. Về mặt thời gian, hẹp hoặc tắc đường vào lọc máu do huyết khối được chia thành 2 nhóm: huyết khối sớm xảy ra sau khi phẫu thuật (trong vòng 4 đến 6 tuần) và huyết khối muộn (> 6 tuần).
2.2.2.2 Các nguyên nhân gây huyết khối sớm
Các vấn đề về kĩ thuật trong quá trình phẫu thuật là những nguyên nhân phổ biến gây hẹp hoặc tắc AVF/ AVG như xoắn mạch máu, kéo căng, gập góc trong quá trình phẫu thuật.
Sử dụng quá sớm khi đường vào lọc máu chưa trưởng thành gây ra hẹp tĩnh mạch và dẫn đến hẹp hoặc tắc đường vào lọc máu.
Hẹp tĩnh mạch từ trước cũng là nguyên nhân gây huyết khối đường vào lọc máu sớm.
2.2.2.3 Cácnguyên nhân gây huyết khối muộn
Các nguyên nhân này bao gồm: tăng sinh lớp nội mạc, tăng sinh lớp tế bào cơ trơn, áp lực xé từ dòng rối ở miệng nối AVF, tổn thương thành mạch trực tiếp do kim chọc, nhiễm khuẩn.
Theo tác giả Romero, chính áp lực xé và tổn thương nội mạc do dòng chảy áp lực cao của động mạch là nguyên nhân dẫn đến xơ hoá và tăng sinh lớp xơ cơ của tĩnh mạch dẫn đến hẹp tĩnh mạch.
Quá trình hẹp có thể xuất hiện ở bất kì vị trí nào trên đường vào lọc máu, đặc biệt ở các vị trí xoắn vặn hoặc có dòng chảy rối. Một dòng chảy hỗn loạn gây ra tác động bất thường về áp lực lên thành mạch. Điều này đã làm giải phóng các hóa chất trung gian từ các tế bào nội mô, từ đó thúc đẩy quá trình tăng sản nội mạc gây hẹp lòng mạch và giảm lưu lượng dòng chảy. Nếu không điều trị, huyết khối thường là hậu quả cuối cùng gây tắc hoàn toàn lòng mạch.
Với AVF, tổn thương hẹp thường xuất hiện trong thời kỳ AVF đang trưởng thành, tỉ lệ này có thể lên tới 20-60%. Mặc dù hẹp có thể xảy ra ở bất cứ vị trí nào, nhưng những nơi có dòng chảy rối thường dễ bị hẹp hơn. Đó là vị trí miệng nối và cận miệng nối, đoạn tĩnh mạch dẫn lưu. Khi phân tích hàng loạt các trường hợp hẹp AVF, tỉ lệ phân bố các vị trí được ghi nhận như sau:
- Động mạch đến: 6%.
- Đoạn miệng nối (Juxta-anastomotic): 55%.
- Đoạn tĩnh mạch hiệu dụng: 29%.
- Đoạn tĩnh mạch dẫn lưu ngoại biên: 10%.

Hẹp dẫn tới xuất hiện huyết khối phổ biến hơn ở AVG so với AVF. Hầu hết tổn thương của AVG là ở đoạn miệng nối tĩnh mạch; tuy nhiên hẹp cũng có thể xuất hiện ở đoạn miệng nối phía động mạch. Trong một bài đánh giá trên 2300 trường hợp hẹp AVG, sự phân bố vị trí các tổn thương đã được ghi nhận như sau:
- Miệng nối tĩnh mạch: 60%.
- Tĩnh mạch hiệu dụng: 37,1%.
- Trong graft (thường liên quan tới chấn thương): 38,4%.
- Tĩnh mạch trung tâm: 3,2%.
- Động mạch đến: 5%.
- Hẹp nhiều vị trí: 31,3%.
3.3 Hậu quả của hẹp, tắc đường vào lọc máu
Đường vào lọc máu bị hỏng sẽ dẫn đến hai hậu quả chủ yếu: (1) không đảm bảo lưu lượng lọc, và (2) tăng áp lực hệ tĩnh mạch. Lưu lượng lọc thấp khiến thời gian mỗi lần chạy thận nhân tạo kéo dài hơn, người bệnh đau và mệt nhiều do hiệu quả thải trừ của thận nhân tạo giảm đi. Tăng áp lực hệ tĩnh mạch sẽ dẫn đến hiện tượng tái tuần hoàn, là tình trạng máu quay trở lại tuần hoàn hệ thống mà không đi qua máy chạy thận nhân tạo.
Nếu hẹp tắc tĩnh mạch dẫn lưu, áp lực hệ tĩnh mạch có thể tăng ngang với áp lực động mạch (150-200 mmHg), vì thế dòng máu thay vì đi từ máy chạy thận về tĩnh mạch để về tim thì lại đổ xuống tĩnh mạch phía dưới và đi về phía miệng nối AVF. Trong trường hợp hẹp miệng nối hay động mạch đến, áp lực tĩnh mạch dẫn lưu không thay đổi nhưng áp lực dòng đến thấp khiến máu cũng có xu hướng bị hút trở lại theo đường tĩnh mạch ra đoạn xa.
Tăng áp lực hệ tĩnh mạch sẽ dẫn đến các biểu hiện lâm sàng như người bệnh đau nhiều, sưng nề vùng chi do tắc mạch, thay đổi sắc tố da, nhiễm khuẩn chi trên, triệu chứng suy tim,…
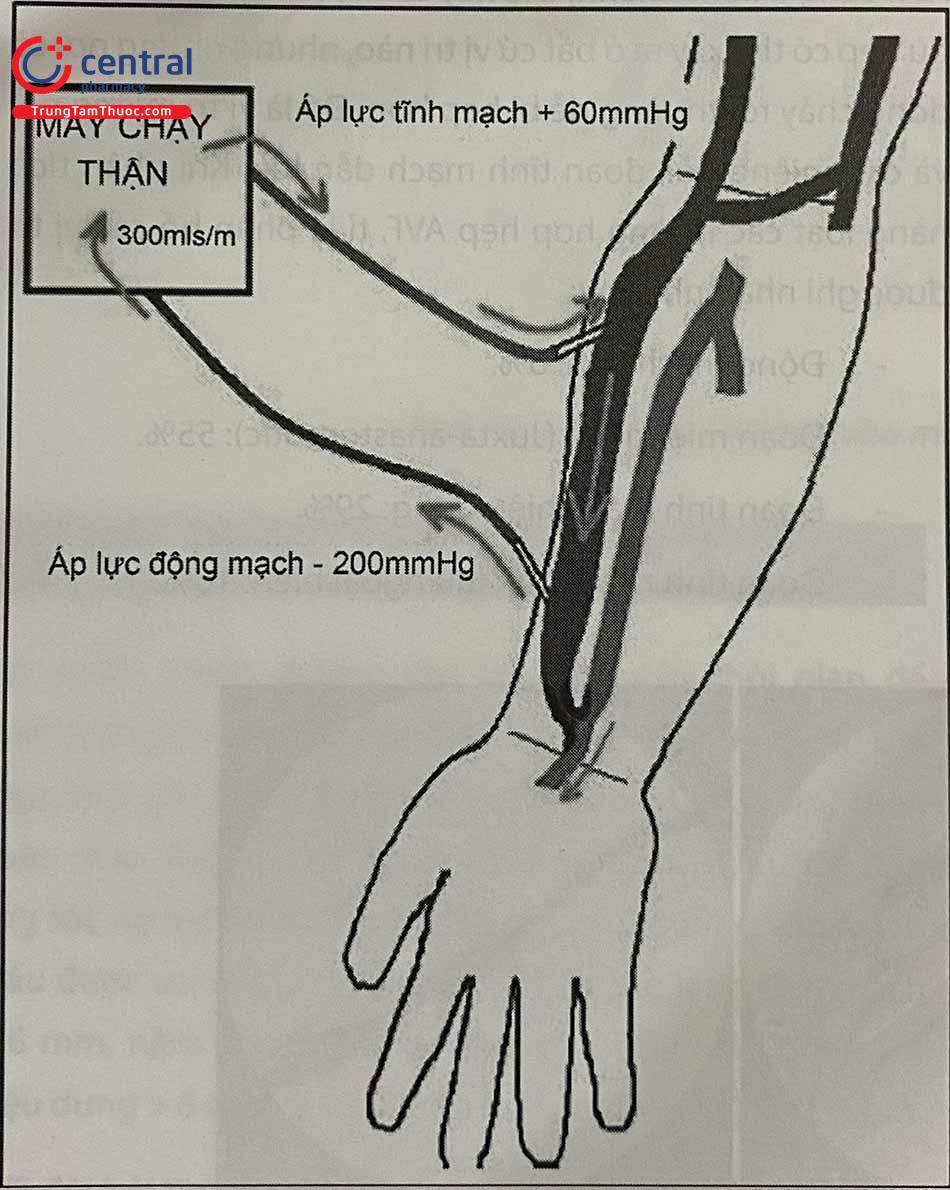
4 Chỉ định và chống chỉ định của thủ thuật can thiệp
4.1 Chỉ định can thiệp
4.1.1 Giảm lưu lượng lọc
Chỉ định cơ bản để can thiệp nội mạch đường vào mạch máu ở bệnh nhân lọc máu chu kỳ là khi có hẹp > 50% đường kính lòng mạch kèm/không kèm theo huyết khối trước đó. Các biểu hiện giảm lưu lượng lọc bao gồm:
- Bệnh nhân đau nhiều nếu lọc máu với tốc độ như cũ.
- Chỉ số Kt/V giảm > 0,2 đơn vị so với mức trước đó.
Trong đó K là tốc độ lọc (mL/phút), t là thời gian lọc (phút), V là thể tích dịch của của bệnh nhân (mL) (khoảng 60% trọng lượng).
VD: tốc độ lọc 300mL/phút, thời gian 3h (180 phút), bệnh nhân nặng 70kg là V= 70*0,6= 42L = 42000mL. Khi đó Kt/V= 300 * 180 /42000 = 1,3
Bình thường, yêu cầu của đường vào lọc máu tốt: Kt/V ≥ 1,2
4.1.2 Tăng áp lực hệ tĩnh mạch kèm theo các triệu chứng lâm snagf và cận lâm sàng của hẹp đường vào lọc máu
4.1.2.1 Biểu hiện của tăng áp lực hệ tĩnh mạch
- Khó đặt canuyn chạy thận.
- Chảy máu không cầm sau chạy thận
- Đánh giá áp lực trực tiếp khi chạy thận:
- Áp lực dòng ra tăng lên.
- Áp lực dòng vào giảm đi.
4.1.2.2 Biểu hiện lâm sàng, cận lâm sàng
Giảm tiếng thổi qua AVF khi thăm khám, tăng Kali máu và ure máu, giảm lưu lượng dòng chảy trên siêu âm Doppler.
4.1.3 AVF không trưởng thành
Một số trường hợp AVF sau phẫu thuật không trưởng thành hoặc trưởng thành chậm, có thể nong bóng nhiều lần để hệ tĩnh mạch giãn nở đủ kích thước sử dụng cho việc chạy thận nhân tạo chu kỳ.
4.2 Chống chỉ định
4.2.1 Chống chỉ định tuyệt đối
Nhiễm trùng cầu nối nhân tạo.
Dòng shunt phải – trái trung tâm.
Tăng áp lực động mạch phổi.
4.2.2 Chống chỉ định tương đối
Huyết khối mới AVF hoặc AVG trong vòng 30 ngày sau phẫu thuật tạo cầu hoặc sửa cầu. Trong hoàn cảnh này, huyết khối có khả năng được tạo ra từ vấn đề kỹ thuật hoặc giải phẫu không phù hợp với điều trị qua đường ống thông.
4.3 Lựa chọn biện pháp can thiệp nội mạch
Theo Khuyến cáo thực hành lâm sàng năm 2018 của Hội Phẫu thuật mạch máu châu Âu, lựa chọn biện pháp tái tưới máu như sau:
- Nong bóng qua da nên được áp dụng đầu tay cho các tổn thương hẹp động mạch đến.
- Nong bóng qua da nên được áp dụng điều trị hẹp tĩnh mạch dẫn lưu.
- Đặt stent nên được cân nhắc cho tổn thương hẹp tắc tĩnh mạch thân cánh tay đầu.
5 Dụng cụ can thiệp
Về cơ bản, can thiệp đường vào lọc máu cũng sử dụng các dụng cụ tương tự can thiệp mạch máu ngoại biên (Xem thêm Chương 28: Can thiệp động mạch chi dưới). Một số điểm cần lưu ý về dụng cụ được trình bày dưới đây.
5.1 Bóng áp lực cao
Hẹp AVF đặc biệt là hẹp tĩnh mạch bản lề thường có xu hướng xơ hóa nhiều, dẫn đến kháng lại với sự giãn của bóng. Các bóng áp lực cao và siêu cao nên được sử dụng trong trường hợp này (ví dụ bóng Conquest của hãng Bard Peripheral Vascular). Những trường hợp này có thể cần nong bóng đến áp lực 20-40 atm.
5.2 Bóng cắt
Sử dụng bóng cắt khi nong bóng áp lực cao không thành công do mạch xơ hoá quá nhiều. Lưu ý, bóng cắt có thể làm tăng nguy cơ vỡ mạch. Sử dụng bóng cắt điều trị hẹp tĩnh mạch dẫn lưu có tổn thương dài ít nhất 2 cm giúp cải thiện đáng kể tỉ lệ thông AVF tiên phát sau can thiệp.
Trong nghiên cứu của Boris Guiu và cộng sự thực hiện trên 29 bệnh nhân có hẹp tĩnh mạch dẫn lưu được chia thành 2 nhóm có sử dụng bóng cắt (20 bệnh nhân) và bóng thường (9 bệnh nhân); kết quả cho thấy ở nhóm dùng bóng cắt, tỉ lệ thông AVF có thể lọc máu tại thời điểm 6 tháng là 85%, 12 tháng là: 70% và 18 tháng: 32%. Tỉ lệ này ở nhóm dùng bóng thường là 56% sau 6 tháng và 21% sau 12 tháng (p = 0,009).
5.3 Bóng phủ thuốc
Sử dụng bóng phủ thuốc nhằm ngăn ngừa tái hẹp AVF và có kết quả tốt hơn bóng thường. Trong một nghiên cứu của tác giả Aytac Gulcu và cộng sự thực hiện trên 38 bệnh nhân bị hẹp vùng miệng nối của AVF ĐM quay – TM đầu đã trưởng thành được điều trị bằng nong bóng có phủ thuốc cho thấy tỉ lệ tái hẹp sau nong bóng thấp hơn đáng kể so với nong bóng thường. Tỉ lệ AVF còn thông sau 6 tháng là: 94,7%, 12 tháng: 81,2%, 24 tháng: 60,7% và 48 tháng: 53,1%.
5.4 Stent
Stent sử dụng trong can thiệp AVF là stent tự nở hoặc stent có màng bọc. Thường ít khi phải đặt stent, chỉ dùng cho trường hợp vỡ tĩnh mạch sau nong bóng, co hồi tĩnh mạch ngay sau nong bóng, hoặc tái hẹp sớm trong vòng 3 tháng đầu sau can thiệp.
6 Quy trình tiến hành thủ thuật
6.1 Chuẩn bị bệnh nhân
Bệnh nhân trước thủ thuật cần được thăm khám lâm sàng và đánh giá siêu âm Doppler mạch máu. Nếu kết quả siêu âm chưa rõ ràng, đặc biệt trong các trường hợp hẹp tắc tĩnh mạch trung tâm, có thể cần chụp MSCT mạch máu.
Nói chung chưa có khuyến cáo chính thức về liệu pháp kháng huyết khối trước thủ thuật. Các bệnh nhân thận nhân tạo chu kỳ thường xuyên phải sử dụng Heparin trong lúc chạy thận, vì thế nguy cơ chảy máu cao hơn những bệnh nhân khác. Một số tác giả thường cho người bệnh Aspirin liều thấp.
Kháng sinh dự phòng: cephazolin 1g truyền tĩnh mạch. Nếu dị ứng với Cephalosporin thì thay thế bằng Vancomycin 1g trước can thiệp 1 giờ.

6.2 Can thiệp đường vào lọc máu
6.2.1 Mở đường vào mạch máu
Tương tự các thủ thuật can thiệp động mạch ngoại biên, đường vào phù hợp giữ vai trò quan trọng khi tái thông AVF/AVG. Lựa chọn đường vào mạch máu tùy theo đặc điểm giải phẫu của AVF/AVG, cũng như mức độ lan rộng hay khư trú của tổn thương. Nói chung, ưu tiên lựa chọn hướng tiếp cận xuôi theo chiều chảy của dòng máu (xuôi dòng). Tiếp cận xuôi chiều sẽ giúp đánh giá tổn thương dễ dàng hơn vì khi chụp mạch, thuốc cản quang sẽ theo dòng chảy đến vị trí tổn thương.
Đường vào tĩnh mạch có ưu điểm so với đường vào động mạch là cầm máu dễ dàng. Tuy vậy, với tổn thương ở vị trí cận miệng nối động mạch quay – tĩnh mạch đầu, mở đường vào tĩnh mạch nông cánh tay đồng nghĩa phải tiếp cận ngược chiều dòng máu, vì thế khi bơm thuốc cản quang, rất khó để thuốc cản quang đi từ tĩnh mạch ở cánh tay xuống tĩnh mạch cẳng tay làm hiện hình tổn thương. Giải pháp là sử dụng một băng ga-rô ở tĩnh mạch cánh tay để hạn chế lượng thuốc cản quang theo dòng máu đi về tim.
Đường vào động mạch quay rất hữu ích để tiếp cận các tổn thương ở vị trí khuỷu tay. Nhưng những bệnh nhân có AVF/AVG ở khuỷu tay thường đã làm đường vào lọc máu ở cổ tay trước đó (AVF Cimino-Brescia), do vậy động mạch quay thường đã bị tắc hay teo nhỏ không sử dụng được. Mở đường vào động mạch quay cũng hạn chế tiếp cận các tổn thương tĩnh mạch đoạn gần (ví dụ hẹp tĩnh mạch trung tâm).
Với tổn thương tĩnh mạch trung tâm, ưu tiên chọn đường vào tĩnh mạch nông đoạn cánh tay. Lưu ý rằng đường vào này không cho phép tiếp cận các tổn thương ở vùng khuỷu hay cẳng tay. Một số trường hợp can thiệp tĩnh mạch trung tâm có thể cần phối hợp đường vào tĩnh mạch nông cánh tay với tĩnh mạch đùi.
Bảng 60.1. Các cách mở đường vào mạch máu
| TĨNH MẠCH SÂU CÁNH TAY | TĨNH MẠCH NÔNG CÁNH TAY | ĐỘNG MẠCH CÁNH TAY | ĐỘNG MẠCH QUAY | |
|---|---|---|---|---|
| Đòi hỏi siêu âm | Có | Không | Có | Không |
| Hướng can thiệp | Ngược dòng | Xuôi dòng/Ngược dòng | Xuôi dòng | Ngược dòng |
| Ưu điểm | Cầm máu dễ dàng Đẩy dụng cụ thuận lợi | Can thiệp được tĩnh mạch trung tâm | Đánh giá chính xác thương tổn Đánh giá chính xác thương tổn | Cầm máu dễ dàng |
| Nhược điểm | Không đánh giá chính xác thương tổn | Khó đánh giá đoạn tĩnh mạch dẫn lưu | Cầm máu khó Khó đẩy dụng cụ qua tổn thương như cầu nối Cimino-Brescia | Khó sử dụng trong các trường hợp can thiệp cầu nốiCimino-Brescia Khó sử dụng nếu nối tân-tận |
6.2.2 Chụp mạch xác định tổn thương
Chụp mạch để đánh giá giải phẫu của đường vào lọc máu cũng như tĩnh mạch dẫn lưu đến tận tĩnh mạch trung tâm trước bất kỳ thủ thuật can thiệp gì.
Mặc dù các bệnh nhân đa phần được đánh giá bằng siêu âm trước đó, chụp mạch số hóa nền (DSA) vẫn đem lại lợi ích trong việc đánh giá bản chất thương tổn, nguyên nhân bệnh lý, giúp lựa chọn dụng cụ can thiệp và kiểm soát các biến chứng.
Chống đông toàn thân (ví dụ heparin không phân đoạn) là không cần thiết trừ trường hợp liên quan đến huyết khối. Khi đó, liều heparin từ 2000 đến 3000 đơn vị tiêm tĩnh mạch giúp ngăn ngừa huyết khối tái phát trong cầu nối.
Khác với các mạch máu khác (động mạch vành, động mạch ngoại biên), nhìn chung không đánh giá mức độ hẹp đường vào lọc máu dựa trên so sánh đường kính vị trí hẹp với mạch máu hoặc cầu nối nhân tạo liền kề. Lý do là một đường vào lọc máu sau thời gian sử dụng thường có nhiều đoạn phình giãn khác nhau, cũng như hệ tĩnh mạch hay co thắt dẫn đến tổn thương “giả hẹp”. Điểm quan trọng là dựa vào đánh giá lâm sàng và siêu âm trước thủ thuật, cũng như áp lực và dòng chảy của hệ tĩnh mạch trong và sau thủ thuật.
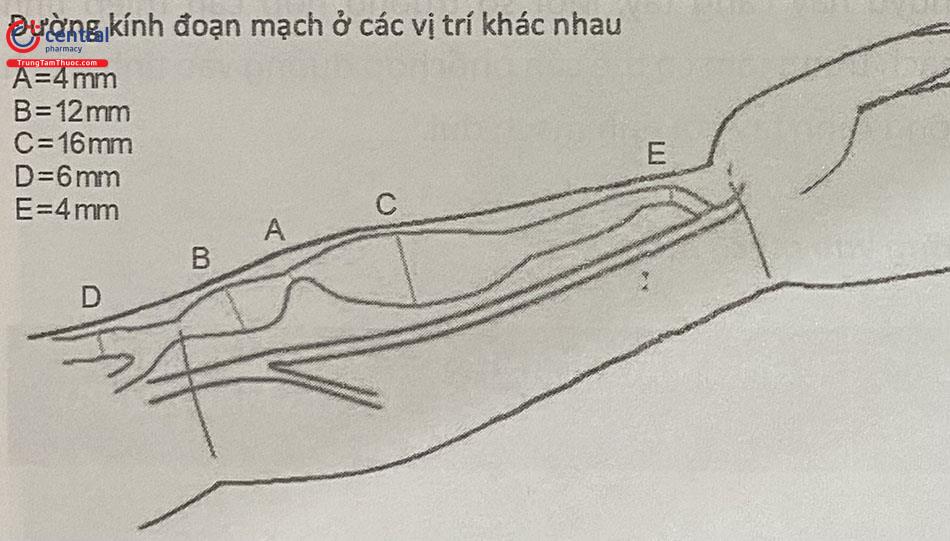
6.2.3 Lái dây dẫn qua thương tổn
Sử dụng dây dẫn 0,014’’, 0,018’’, hoặc 0,035” để lái qua vị trí tổn thương. Thông thường ta có thể bắt đầu bằng guidewire 0,035’’. Các dây dẫn mạch vành với ưu điểm dễ thao tác, có thể được sử dụng để lái qua các tổn thương khó hay tĩnh mạch xoắn vặn.
Với những đoạn mạch gập góc hoặc giải phẫu phức tạp, có thể dùng ống thông chẩn đoán JR, IM có hình dạng phù hợp để hướng dây dẫn về phía tổn thương.
Sau khi đầu guidewire đã qua tổn thương, tiếp tục đẩy tới đoạn tĩnh mạch trung tâm.
Một số trường hợp cần đi từ tĩnh mạch đùi can thiệp tĩnh mạch trung tâm rồi mới tiếp cận tổn thương ngoại vi, đảm bảo đường thoát của cầu nối lọc máu được mở rộng.
6.2.4 Nong bóng thương tổn
Khi nong tĩnh mạch, đường kính bóng được khuyên dùng lớn hơn đường kính mạch máu từ 10 đến 15% (khoảng 1-2 mm). Ngược lại, nong động mạch thì đường kính bóng nên bằng đường kính mạch.
Chiều dài thân bóng cũng như các dụng cụ khác (dây dẫn, ống thông can thiệp) cũng phải lựa chọn phù hợp để vượt qua được thương tổn. Ví dụ, toàn bộ thân bóng nên dài từ 145 đến 150 cm giúp can thiệp tối ưu, đủ chiều dài có thể đi từ cổ tay đến nhĩ phải.
Một số trường hợp tổn thương hẹp quá khít, không thể đẩy bóng ngoại biên qua tổn thương. Có thể cần dùng bóng động mạch vành với cấu hình nhỏ gọn hơn để nong mở đường, sau đó mới dùng bóng ngoại biên.
Áp lực nong bóng cho từng trường hợp là khác nhau, chưa có một khuyến cáo cụ thể nào được đưa ra. Điều quan trọng là ghi nhớ áp lực tối đa của các loại bóng để tránh vượt qua giới hạn. Một nghiên cứu của Trerotola và các cộng sự (2005) với 230 tổn thương hẹp cầu nối tự thân hoặc nhân tạo cho thấy đa số các ca cần áp lực từ 10 – 20 atm. Ngoài ra, 20% các ca can thiệp AVF và 9% các ca cầu nối nhân tạo cần áp lực > 20 atm.
Thời gian nong bóng kéo dài cũng không được khuyến cáo trừ khi kết quả ban đầu chưa được tối ưu. Thực hành thông thường là làm xẹp bóng sau khi thấy phần eo bóng được nở ra hoàn toàn.
Khi có cùng lúc nhiều vị trí tổn thương, ta nên ưu tiên can thiệp với các tổn thương đoạn gần dòng thoát hay trung tâm. Điều này giúp quá trình thủ thuật dễ dàng hơn, giảm trở lực và các hậu quả do tăng tưới máu.
6.2.5 Đặt Stent hệ tĩnh mạch
Nói chung không có chỉ định đặt stent tĩnh mạch ngoại biên. Cân nhắc đặt stent tĩnh mạch trung tâm, đoạn thân tĩnh mạch tay đầu và tĩnh mạch chủ dưới, nếu còn hẹp tồn lưu nhiều sau nong bóng, hoặc bệnh nhân đã nong bóng nhiều lần trước đó nhưng tái hẹp sớm.
Đặt stent tại vị trí hẹp tĩnh mạch không triệu chứng có thể gây tái hẹp nhanh và hẹp đồng thời nhiều vị trí khác trên tĩnh mạch của đường vào lọc máu, khi so sánh với điều trị nội khoa. Hạn chế dùng stent có màng bọc trừ trường hợp vỡ tĩnh mạch không cầm được máu, do stent có màng bọc sẽ có nguy cơ bít tắc các đường dẫn máu khác trở về tim.
6.2.6 Chụp kiểm tra và đóng mạch
Lưu lại dây dẫn tại chỗ cho đến khi đánh giá xong kết quả và biến chứng.
Trường hợp tĩnh mạch bị co thắt hoặc hẹp lại sau nong bóng, nên đợi 5 đến 10 phút để đánh giá lại kết quả.
Động mạch đến cũng có thể đánh giá bằng cả bắt mạch cũng như đánh giá dòng chảy trên phim chụp.
Sau khi rút introducer sheath, điểm chọc mạch có thể dễ dàng băng ép hoặc khâu da tại chỗ. Một số loại băng chuyên dụng cũng được áp dụng giúp cầm máu nhanh hơn trong ba đến năm phút như băng TipStop có nút Nhựa nhỏ với lớp Collagen ở trung tâm.
7 Tiêu chí thành công của thủ thuật
Do không thể dựa vào đoạn mạch tham chiếu để ước lượng mức độ hẹp, can thiệp đường vào mạch máu cần dựa vào nhiều thông số để đánh giá hiệu quả của thủ thuật.
- Khám lâm sàng: sờ thấy rung mưu.
- Hình ảnh chụp mạch số hóa nền (DSA): (1) Hẹp tồn lưu < 50% so với ban đầu, (2) đường kính miệng nối AVF tối thiểu đạt 4 mm, (3) giảm hoặc mất hình ảnh tuần hoàn bàng hệ.
Một số trường hợp, dòng chảy trong đường vào lọc máu được cải thiện cũng được coi là một tiêu chí thành công của thủ thuật. Hoặc đơn giản là bác sĩ can thiệp đã làm tối đa có thể và bệnh nhân có thể chạy thận nhân tạo trở lại với lưu lượng lọc > 250 mL/phút.
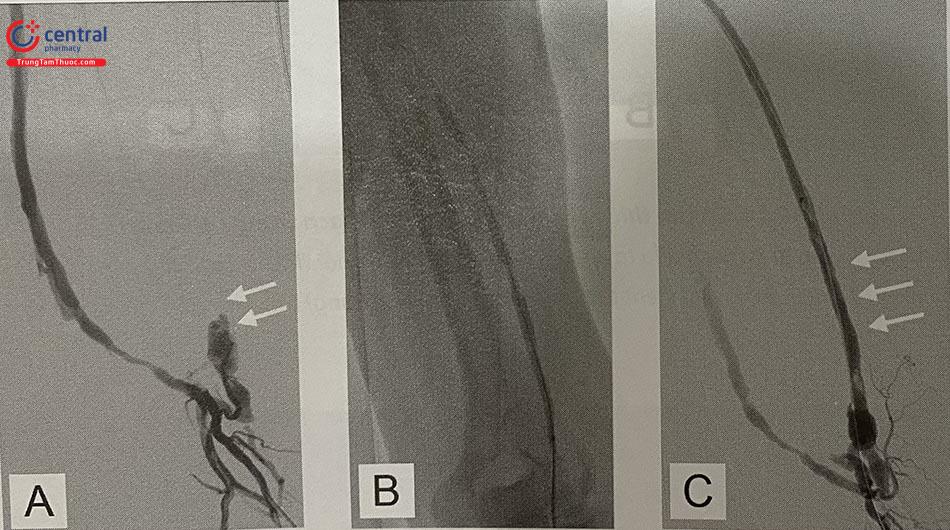
A: Tắc tĩnh mạch hiệu dụng ngay sau cầu nối động mạch cánh tay – tĩnh mạch cánh tay. B: Nong bóng thương tổn. C: Lòng mạch được tái thông, còn ít huyết khối tồn lưu) (nguồn: Viện Tim mạch Việt Nam)


Tiếp cận tổn thương từ đường tĩnh mạch đầu tay phải và tĩnh mạch đùi phải. Tắc thân tĩnh mạch cánh tay đầu bên phải (mũi tên trắng); B. Nong bóng 12 x 40 mm; C. Đặt stent tĩnh mạch sau khi nong bóng) (nguồn: Viện Tim mạch Việt Nam).
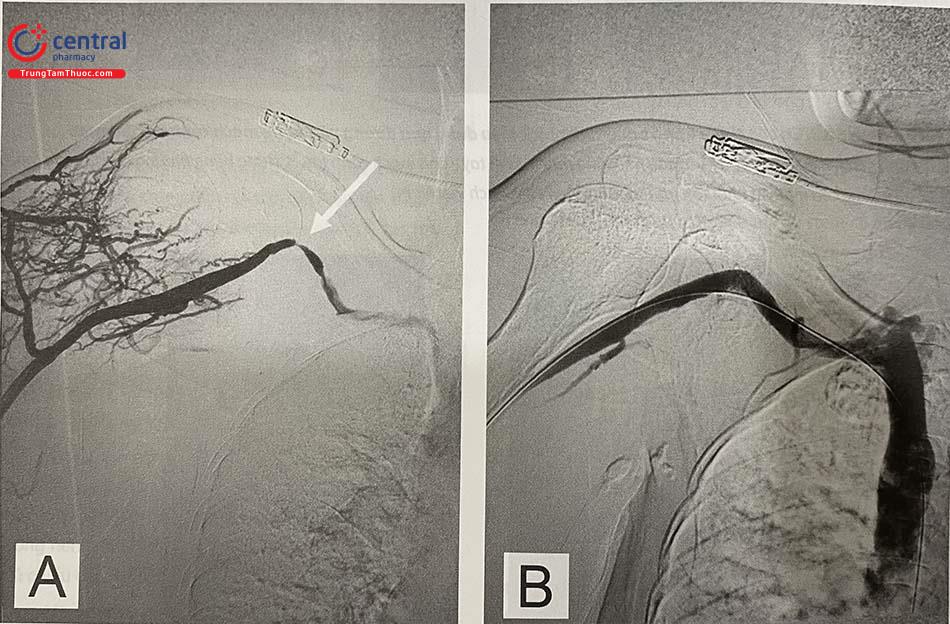
A. Hẹp khít tĩnh mạch dưới đòn bên phải (mũi tên trắng); B. Tĩnh mạch tái thông tốt sau nong bóng (nguồn: Viện Tim mạch Việt Nam)
8 Biến chứng và xử trí
Biến chứng sau can thiệp nội mạch đường vào lọc máu là hiếm gặp . Đa số biến chứng nhẹ và có thể kiểm soát được.
- Co thắt tĩnh mạch xảy ra khi dụng cụ nằm trong lòng tĩnh mạch. Co thắt nhiều có thể gây ra huyết khối. Biến chứng này thường tự hết sau thời gian ngắn hoặc có thể kéo dài 1-2 giờ, không để lại hậu quả. Liều tiêm tĩnh mạch Nitroglycerin 100 μg có thể giúp tăng hiệu quả giãn mạch.
- Bóc tách nội mạc có thể gây ảnh hưởng dòng chảy. Khi đó, ta cần nong bóng lại với áp lực thấp trong 3-5 phút khôi phục dòng chảy. Stent là cứu cánh nếu nong bóng 2 lần không thành công.
- Vỡ mạch máu xảy ra ở các mức độ khác nhau từ dạng vết nứt đơn giản cho đến chảy máu/ thoát thuốc cản quang ra khỏi lòng mạch. Khi xảy ra biến chứng này cần ép chặt, nong bóng áp lực thấp kéo dài và/hoặc đặt stent có màng bọc để cầm máu.
- Các biến chứng khác bao gồm gãy ống thông hoặc dụng cụ cần được lấy ra cùng với Hiếm gặp huyết khối động mạch phổi sau can thiệp huyết khối đường vào lọc máu.
9 Chăm sóc và theo dõi sau can thiệp
Cách chăm sóc đường vào lọc máu sau can thiệp tương tự như chăm sóc một bệnh nhân lọc máu bình thường.
- Băng ép thường quy vị trí chọc mạch sau can thiệp, phát hiện sớm các dấu hiệu chảy máu, tụ máu, sưng nề nóng đỏ để xử trí sớm.
- Sau tháo băng, vệ sinh bề mặt da bằng xà phòng kháng khuẩn sau đó lau khô.
- Đánh giá dấu hiệu rung miu ít nhất 3 lần/ngày. Giáo dục bệnh nhân nếu có bất thường cần báo nhân viên y tế.
- Người bệnh nên được lọc máu sớm sau can thiệp, giúp vừa đánh giá kết quả vừa tăng hiệu quả của quá trình tái thông.
- Không đo huyết áp, lấy đường truyền tĩnh mạch, bê vác vật nặng, đeo đồng hồ hay trang sức ở tay có đường vào lọc máu.
10 Tài liệu tham khảo
1. Am J 1997. Treatment modalities for ESRD patients. American Journal of Kidney Diseases. 30(2, Supplement 1): p. S54-S66.
2. Vascular Access Work Group (2006). Clinical practice guidelines for vascular Am J Kidney Dis Off J Natl Kidney Found, 48 Suppl 1, S248-273.
3. Mendelssohn, D.C., et al., Haemodialysis vascular access problems in Canada: results from the Dialysis Outcomes and Practice Patterns Study (DOPPS II). Nephrology Dialysis Transplantation, 21(3): p. 721-728
4. Dinh, D. and D.H. Nguyen, Vascular access for hemodialysis: Current practice in Vietnam. J Vasc Access, 2019. 20(1_suppl): p. 20-23.
5. Nguyễn Nguyên Khôi, Thận nhân tạo.Tài liệu chuyên đề thận học. 2001, Bệnh Viện Bạch 152 – 168.
6. Kern M.J. (2013). The interventional cardiac catheterization
7. Ravani P, Palmer S C, Oliver M J. et al.Associations between hemodialysis access type and clinical outcomes: a systematic review. J Am Soc Nephrol. 2013;24(3):465–473.
8. Quencer K B, Arici Arteriovenous fistulas and their characteristic sites of stenosis. AJR Am J Roentgenol. 2015;205(4):726–734
9. Lok et al. – 2020 – KDOQI Clinical Practice Guideline for Vascular pdf.
10. Rerkasem and Mai – Anatomy and Physiology of Vascular pdf.
11. Brescia M J, Cimino J E, Appel K, Hurwich B J. Chronic hemodialysis using venipuncture and a surgically created arteriovenous fistula
12. Zaleski G. Declotting, maintenance, and avoiding procedural complications of native arteriovenous fistulae. Semin Intervent Radiol. 2004;21(2):83–93
13. Weiswasser J M, Kellicut D, Arora S, Sidawy A Strategies of arteriovenous dialysis access. Semin Vasc Surg. 2004;17(1):10–18
14. Mickley Steal syndrome—strategies to preserve vascular access and extremity. Nephrol Dial Transplant. 2008;23(1):19–24.
15. Nassar G M, Nguyen B, Rhee E, Achkar K. Endovascular treatment of the “failing to mature” arteriovenous fistula. Clin J Am Soc Nephrol. 2006;1(2):275–280
16. Kakkos S K, Haddad G K, Weaver M R, Haddad R K, Scully M M. Basilic vein transposition: what is the optimal technique? Eur J Vasc Endovasc Surg. 2010;39(5):612–619
17. National Kidney Foundation-Dialysis Outcomes Quality Initiative . NKF-DOQI clinical practice guidelines for vascular Am J Kid- ney Dis. 1997;30(4) 03:S150–S191
18. John Bittl, MD. “Catheter Interventions for Hemodialysis Fistulas and Grafts. J Am Coll Cardiol Intv. 2010;3(1):1–11.
19. Huber T S, Carter J W, Carter R L, Seeger J M. Patency of autogenous and polytetrafluoroethylene upper extremity arteriovenous hemo- dialysis accesses: a systematic J Vasc Surg. 2003;38(5):1005–1011.
20. Albers J. (1994). Causes of Hemodialysis Access Failure. Adv Ren Replace Ther, 1(2), 107–118.
21. Romero A, Polo JR, Morato EG, et al: Salvage of angioaccess after late thrombosis of radiocephalic fistulas for hemodialysis. Int Surg 71:122-124,1986.
22. Lok CE, Sontrop JM, Tomlinson G, et al. Cumulative patency of contemporary fistulas versus grafts (20002010). Clin J Am Soc Nephrol 2013; 8:810.
23. Allon M, Robbin ML. Increasing arteriovenous fistulas in hemodialysis patients: problems and solutions. Kidney Int 2002; 62:1109.
24. Sivanesan S, How TV, Bakran Sites of stenosis in AV fistulae for haemodialysis access. Nephrol Dial Transplant 1999; 14:118.
25. Falk A, Teodorescu V, Lou WY, et Treatment of “swing point stenoses” in hemodialysis arteriovenous fistulae. Clin Nephrol 2003; 60:35.
26. TurmelRodrigues L, Mouton A, Birmelé B, et al. Salvage of immature forearm fistulas for haemodialysis by interventional radiology. Nephrol Dial Transplant 2001; 16:2365.
27. Phạm Mạnh Hùng (2019). Lâm sàng tim mạch học
28. Miller A., Hwang W., Preddie D., et al. (2011). Percutaneous Salvage of Thrombosed Immature Arteriovenous Fistulas: PERCUTANEOUS SALVAGE OF THROMBOSED IMMATURE AVFS. Semin Dial, 24(1), 107–114.
29. Gulcu , Sarioglu O., Peker A., et al. (2019). Drug-Eluting Balloon Angioplasty for Juxta-Anastomotic Stenosis in Distal Radiocephalic Hemodialysis Fistulas: Long-Term Patency Results. Cardiovasc Intervent Radiol, 42(6), 835–840.
30. Guiu , Loffroy R., Ben Salem D., et al. (2007). Angioplasty of Long Venous Stenoses in Hemodialysis Access: At Last an Indication for Cutting Balloon?. J Vasc Interv Radiol, 18(8), 994–1000.
31. Swinnen , Lean Tan K., Allen R., et al. (2015). Juxta-anastomotic stenting with aggressive angioplasty will salvage the native radioce- phalic fistula for dialysis. J Vasc Surg, 61(2), 436–442.
32. Patanè D., Failla G., Coniglio G., et al. (2019). Treatment of juxta-anastomotic stenoses for failing distal radiocephalic arteriovenous fistulas: Drug-coated balloons versus angioplasty. J Vasc Access, 20(2), 209–216
33. Bakken M., Protack C.D., Saad W.E., et al. (2007). Long-term outcomes of primary angioplasty and primary stenting of central venous stenosis in hemodialysis patients. J Vasc Surg, 45(4), 776–783.

