Các phương pháp can thiệp động mạch vành vôi hóa
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn:
ThS. BSNT Nguyễn Hữu Tuấn
ThS.BSNT Nguyễn Bá Ninh
ThS.BSNT Nguyễn Thiện Toàn
PGS.TS.BS Phạm Mạnh Hùng
Các vấn đề chung bao gồm các phương pháp đánh giá, cách tiếp cận và phương pháp sử dụng trong can thiệp tổn thương môi hóa động mạch vành,.. sẽ được Trung tâm thuốc Central Pharmacy(trungtamthuo.com) sẽ gửi đến các bạn đọc trong bài viết này.
1 Mở đầu
Trên 20% bệnh nhân can thiệp động mạch vành có tổn thương vôi hóa động mạch vành từ mức độ vừa đến nặng. Tổn thương vôi hóa động mạch vành gây ra nhiều khó khăn khi can thiệp mạch, đồng thời ảnh hưởng đến kết quả lâu dài như: khó đưa các dụng cụ can thiệp qua tổn thương (bóng, stent, đầu dò IVUS,…), stent không nở hết hoặc không áp thành tốt, hư hỏng lớp polyme tẩm thuốc, gãy mắt stent, lóc tách hoặc thủng mạch vành,… Do vậy, có thể dẫn tới các biến cố cấp như huyết khối trong stent hoặc lâu dài có thể làm tăng nguy cơ tái hẹp stent.
Trong can thiệp tổn thương mạch vành vôi hóa nặng, việc chuẩn bị tốt tổn thương rất quan trọng. Nong bóng áp lực thường sẽ không đủ để chuẩn bị tổn thương một cách tối ưu, do vậy cần sử dụng bóng áp lực cao để nong tổn thương; tuy nhiên, chỉ với bóng áp lực cao hoặc bóng áp lực siêu cao cũng không đem lại kết quả mở rộng tối ưu lòng mạch, thậm chí lại gây ra lóc tách động mạch vành ở nhiều mức độ khác nhau. Sự ra đời của một số dụng cụ đặc biệt giúp cho bác sỹ có thể tiếp cận can thiệp tổn thương vôi hóa ĐMVdễ dàng hơn và hiệu quả hơn thông qua việc chuẩn bị tổn thương tốt trước khi đặt stent ĐMV. Các dụng cụ này có cơ chế tiếp cận khác nhau như bóng đặc biệt (gắn lưỡi dao, gắng dây kim loại) hoặc dụng cụ khoan phá và gần đây nhất là sử dụng các sóng xung kích làm vỡ mảng vôi hóa. Trong chương này chúng tôi chỉ đề cập đến phương pháp chuẩn bị tổn thương vôi hóa tối ưu để giúp can thiệp đặt stent thành công ĐMV. Sau khi chuẩn bị tổn thương vôi hóa tốt thì quy trình can thiệp ĐMV trở lại như thường quy.
2 Các phương pháp đánh giá thương tổn vôi hóa động mạch vành
2.1 Chụp động mạch vành qua da
Thường đánh giá qua chủ quan của người đọc và được chia làm 3 mức độ:
Mức độ nhẹ: Thường khó quan sát trên phim chụp mạch hoặc phải quan sát thật kỹ mới thấy được.
Mức độ vừa: Quan sát được khi tim chuyển động và thường thấy ở một bên thành động mạch vành.
Mức độ nặng: Quan sát thấy ở hình tĩnh (dừng hình) và thường thấy ở cả hai bên thành động mạch vành (hình đường ray xe lửa).
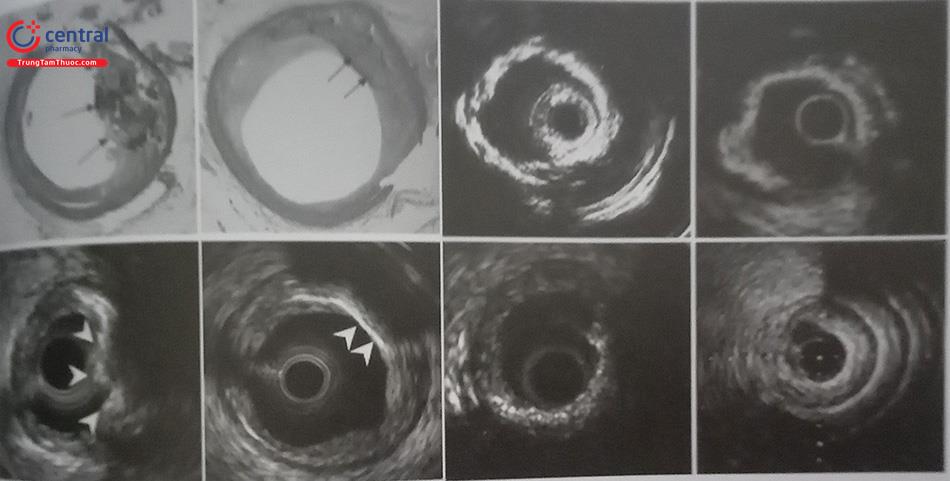
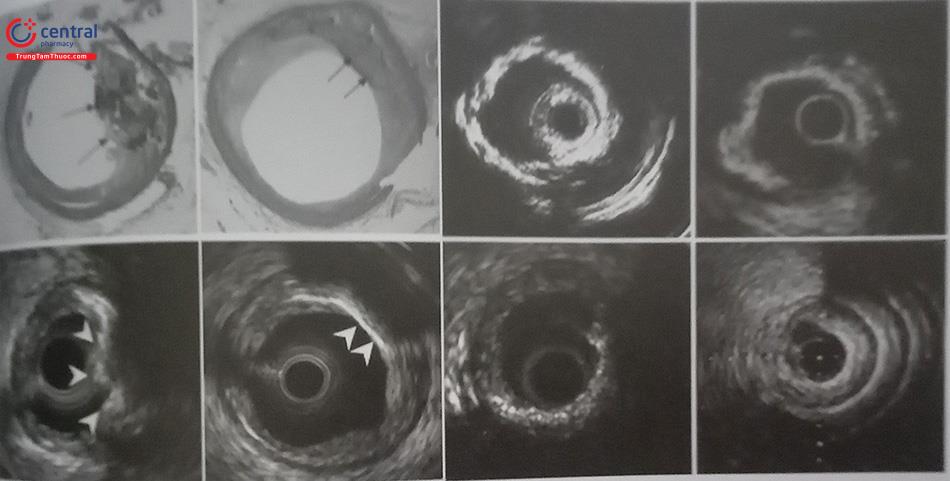
2.2 Siêu âm trong lồng mạch (IVUS)
2.2.1 Vai trò của IVUS trong chẩn đoán tổn thương vôi hóa động mạch vành
2.3 Nhận biết tổn thương có vôi hay không.
2.4 Đánh giá đặc điểm vôi: nằm ở bề mặt, nằm ở sâu hay là nốt vôi.
2.5 Đánh giá mức độ của mảng vôi (cung vôi) và độ dài của mảng vôi.
2.6 Tuy nhiên mảng vôi lại như là một bức tường cản âm ngăn cản sóng siêu âm xuyên qua nên IVUS không xác định được độ dày hay thể tích mảng vôi hóa.
Chú thích: IVUS: siêu âm trong lòng mạch.
2.6.1 Vai trò của IVUS trong can thiệp tổn thương vôi hóa trong lòng mạch vành
2.6.2 -Trước can thiệp:
- Đánh giá mức độ vôi hóa và đặc điểm của mảng vôi.
- Lựa chọn phương pháp phù hợp để điều trị tổn thương vôi hóa:
» Vôi hóa mức độ nhẹ, vừa (cung vôi <270 độ): bóng cắt (cutting balloon), bóng quấn lưới kim loại (scoring balloon),…
» Vôi hóa mức độ nặng (cung vôi >270 độ): sử dụng các dụng cụ khoan phá mảng xơ vữa vôi hóa như Rotablator, Orbital,…
- Lựa chọn được kích thước bóng hoặc mũi khoan phù hợp.
- Dự đoán các biến chứng có thể xảy ra khi nong bóng hoặc khoan phá mảng xơ vữa.
- Đánh giá hiệu quả của khoan hoặc nong bóng trước khi đặt
- Đánh giá sau đặt stent đã tối ưu hay chưa.
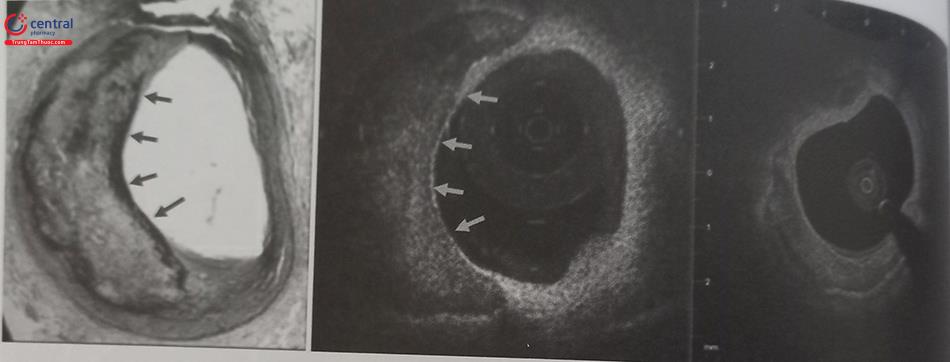
2.7 Optical Coherence Tomography (OCT): chụp cắt lớp quang học
OCT giúp đánh giá các đặc điểm của mảng vôi tương tự như
Một ưu điểm của OCT là: khác với đặc điểm của IVUS là sử dụng sóng siêu âm, OCT sử dụng ánh sáng nên có thể xuyên qua mảng vôi hóa do đó giúp đo đạc được độ dày, chiều dài, diện tích/thể tích mảng vôi.
Tuy nhiên, chưa có nhiều dữ liệu để khẳng định vai trò của OCT trong việc đo mảng xơ vữa vôi hóa liên quan đến độ nở và áp thành của stent.
3 Tiếp cận can thiệp tổn thương vôi hóa động mạch vành.
Tổn thương vôi, nhất là vôi hóa nặng là một thách thức lớn đối với bác sĩ can thiệp. Tổn thương vôi hoá cũng thường gặp ở bệnh nhân có nhiều bệnh nền nặng khác như: suy thận mạn, cao tuổi, đái tháo đường nhiều năm, bệnh phổi mạn tính, tăng huyết áp,… Do vậy đối với tổn thương mạch vành vôi hoá, cần cân nhắc can thiệp nếu cơ sở có đủ các phương tiện cần thiết, bác sĩ có kinh nghiệm và có đủ nguồn lực có thể xử trí các biến cố. Với sự phát triển của thiết bị can thiệp tổn thương vôi và kinh nghiệm ngày càng tốt hơn của bác sĩ can thiệp, cộng thêm sự hỗ trợ mạnh mẽ của các phương tiện chẩn đoán hình ảnh trong lòng mạch, các khuyến cáo gần đây đã được mở rộng hơn việc ứng dụng các biện pháp chuyên dụng để can thiệp các tổn thương này.
3.1 Khuyến cáo về can thiệp tổn thương vôi hóa
Bảng 22.1. Khuyến cáo về can thiệp tổn thương vôi hóa
Thiết bị | ACCF/AHA/SCAI 2011 | ESC/EAPCI 2014 | ESC 2018 |
|---|---|---|---|
Rotablator (Thiết bị khoan mảng xơ vữa) | Nên được lựa chọn ở những tổn thương vôi hóa nặng mà các bóng nong thông thường không thể đưa qua hoặc khi nong tổn thương không mở tối ưu trước khi đặt stent (Loaji IIa-C) Không nên thực hiện thường quy cho tất cả tổn thương hoặc tái hẹp trong stent (Loại III-A) | Là kỹ thuật cần thiết đối với những tổn thương vôi hóa nặng, tạo thuận lợi cho đẩy bóng nong qua tổn thương hoặc stent nở tốt hơn. | Bóng áp lực cao, bóng cắt, bóng quấn lưới kim loại, Rotablator đều có thể sử dụng để điều trị tổn thương vôi hóa... Tuy nhiên " ... Hiện tại các nghiên cứu cho thấy các phương pháp này chưa có lợi ích lâm sàng rõ ràng" Tuy nhiên các phương pháp trên sẽ giúp tăng tủ lệ thành công của thủ thuật. |
Bóng cắt | Nên được lựa chọn ở những tổn thương vôi hóa nhẹ, tái hẹp trong stent hoặc tổn thương lỗ vào các nhánh động mạch (Loại IIb-C). Không nên thực hiện một cách thường quy trong PCI (Loại III-A). | Có thể hữu ích trong tổn thương vôi hóa nhẹ hoặc tổn thương lỗ vào. |
|
Năng lượng laser | Các tổn thương có thể đưa bóng thông thường qua nhưng không nông rộng được (Loại IIb-C). Không nên thực hiện thường quy (Loại III-A) |
|
|
Bảng 22.2. Khuyến cáo AHA/ACC 2021 về điều trị tổn thương vôi hóa
Mức độ khuyến cáo | Mức độ bằng chứng | Khuyến cáo |
|---|---|---|
IIa | BR | Ở bệnh nhân có tổn thương vôi hóa mức độ nặng các phương pháp rotablator có thể hữu ích và tăng tỷ lệ thành công của thủ thuật. |
IIb | B-NR | Ở những bệnh nhân có tổn thương vôi hóa mức độ nặng các phương pháp như orbital, bóng cắt, bóng quấn khung kim loại, năng lượng laser, sóng cung kích có thể hữu ích và tăng tỷ lệ thành công của thủ thuật. |
3.2 Tiếp cận tổn thương động mạch vành vôi hóa

4 Các phương pháp kỹ thuật chuẩn bị tổn thương trong can thiệp động mạch vành vôi hóa
4.1 Bóng nong đặc biệt
4.1.1 Cutting Balloon (Bóng cắt)
Bóng có gắn ba hoặc bốn “lưỡi dao” – là những thanh thép nhỏ được gắn dọc trên bề mặt ngoài của quả bóng không nở. Khi bóng được bơm lên những “lưỡi dao” này tạo ra những đường cắt có định hướng lên mảng vôi hóa trong lòng động mạch vành giúp làm tăng khả năng phá vỡ cấu trúc của mảng vôi và giảm nguy cơ gây ra các tổn thương tách thành hoặc thủng động mạch vành như các bóng không nở thông thường. Các “lưỡi dao” trên bóng có các vị trí khuyết để có thể uốn cong sau mỗi 5 mm độ dài giúp làm tăng khả năng linh hoạt của bóng.
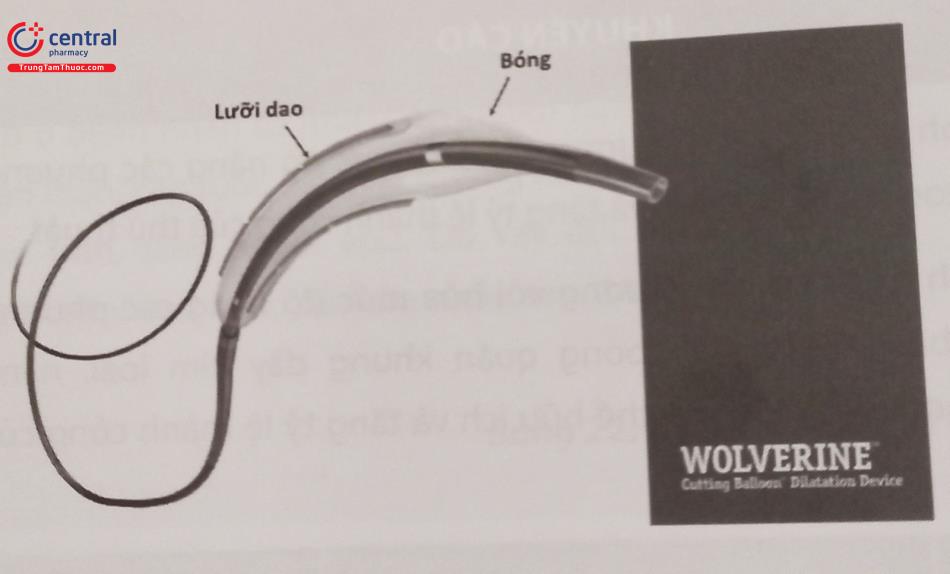
Bóng cắt quá lớn sẽ làm tăng nguy cơ thủng mạch vành, vì vậy để giảm thiểu nguy cơ biến chứng này đường kính của bóng cắt nên được chọn nhỏ hơn tỷ lệ 1:1 so với đường kính mạch tham chiếu đầu gần và đầu xa ngay sát tổn thương. Trường hợp tái hẹp trong stent, kích thước bóng cắt có thể lớn hơn kích thước stent từ 0,25-0,5 mm. Áp lực tối đa nên giới hạn ở 8-12 atm. Bóng cắt cần được bơm lên từ từ và sau khi xuống bóng thì nên đưa trở lại trong guiding giúp tái định hình bóng cắt, sau đó tiếp tục đưa bóng trở lại tổn thương và lên bóng nhằm tạo ra nhiều đường cắt theo những hướng khác nhau, thao tác được lặp lại từ 2-3 lần cho mỗi vị trí vôi.
Khi sử dụng bóng cắt cho tổn thương ở đầu xa stent cần hết sức cẩn thận vì nếu lái wire qua mắt bên stent, khi nong bóng cắt, các “lưỡi dao” của bóng có thể vướng vào các mắt stent ở thì xẹp bóng. Ngoài ra, khi can thiệp các tổn thương chỗ chia đôi, bóng cắt được sử dụng để chuẩn bị các tổn thương trước khi đặt stent nhưng không được đưa bóng cắt qua mắt stent để vào nhánh bên.
4.2 Scoring balloon (Bóng quấn lưới kim loại)
Bóng bao gồm ba dây kim loại làm từ nitinol linh hoạt được quấn theo hình xoắn ốc xung quanh một quả bóng không giãn nở. Đường kính của bóng quấn lưới kim loại xấp xỉ 2,7F; khi bóng được bơm lên (với áp lực tối đa 20 atm), khung nitinol sẽ cắt vào mảng vôi một cách chủ động giúp chuẩn bị tổn thương tốt hơn và stent nở tốt và áp thành tốt hơn.

4.3 Khoan phá mảng xơ vữa (Rotablation)
4.3.1 Giới thiệu
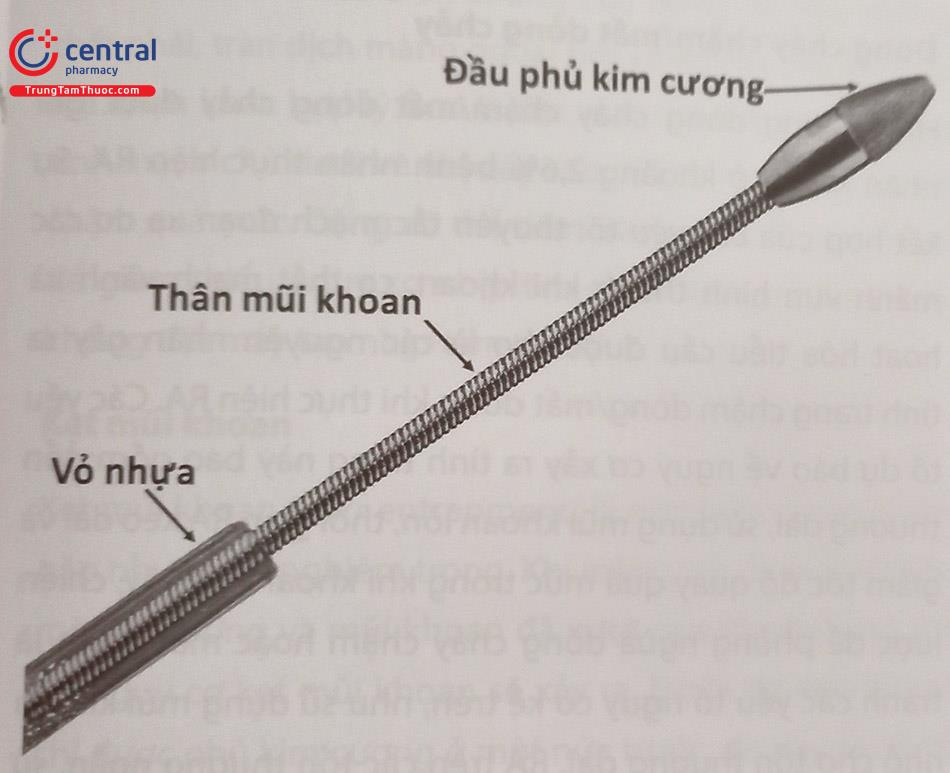
Khoan phá mảng xơ vữa là kỹ thuật sử dụng trong những trường hợp vôi hoá từ mức độ vừa đến nặng ở động mạch vành. Kỹ thuật này sử dụng mũi khoan làm bằng thép có hình elip, phủ tinh thể kim cương trên bề mặt ở một phần mũi khoan; khi mũi khoan quay với tốc độ cao (có thể tới
200.000 vòng/phút) tiếp xúc với mảng xơ vữa vôi hoá sẽ có tác dụng bào mòn/phá vỡ cấu trúc của mảng vôi trong ĐMV, giúp cho việc can thiệp ĐMV (nong và đặt stent) được thành công.

Mũi khoan với kích thước từ 1,25 đến 2,5 mm sẽ đánh tan các mảng vôi hóa thành các vi mảnh với kích thước từ 5-10 μm (nhỏ hơn kích thước của tế bào máu) và được hấp thu theo hệ tuần hoàn. Mũi khoan chỉ khoan chọn lọc những vật thể cứng (mảng vôi, stent) mà không ảnh hưởng đến mô đàn hồi của mạch máu, nhờ đó hạn chế gây tổn thương cho các cấu trúc này.
Dây khoan (Rotawire) gồm 2 loại là Floppy wire và Extra support wire. Dây khoan được chế tạo bằng lõi thép không gỉ đường kính 0,009” và phía đầu thon dần lại bằng platinum. Cấu tạo với phần đầu cứng ngắn hơn của Flop- py wire làm cho dây khoan này khá mềm mại, thích hợp cho phần lớn các tình huống khoan, nhất là với trường hợp mạch gập góc. Ngược lại, phần đầu cứng dài của Extra support wire làm cho wire cứng hơn, do vậy cho lực hỗ trợ mũi khoan mạnh hơn, thích hợp với những tổn thương lỗ vào mạch vành xuất phát từ động mạch chủ. Nhưng cần lưu ý khi sử dụng dây khoan Extra support là khả năng duỗi thẳng mạch máu của dây khoan này tốt nên có thể gây thủng động mạch vành do mũi khoan với những trường hợp mạch gập góc.
Rotaglide là dung dịch nhũ tương gốc lipid được chế tạo đặc biệt để sử dụng trong quá trình khoan mảng vôi giúp làm giảm ma sát của hệ thống khoan và giảm sinh nhiệt.
4.3.2 Chỉ định
Tổn thương động mạch vành vôi hoá vừa – nhiều, không đẩy bóng qua tổn thương được hoặc nong bằng bóng thông thường không chuẩn bị được tối ưu tổn thương.
Tổn thương nguyên bản có chiều dài < 25 mm.
4.3.3 Chống chỉ định
Thận trọng với các tổn thương sau:
Tổn thương lan toả, hẹp nhiều thân mạch vành.
Can thiệp thân chung không được bảo vệ.
Bệnh nhân có chức năng thất trái giảm (EF<30%).
Tổn thương nguyên bản có chiều dài >25
Tổn thương gập góc (>45 độ).
Chống chỉ định:
Có huyết khối trên phim chụp ĐMV.
Can thiệp cầu nối tĩnh mạch hiển.
Lóc tách động mạch vành từ type C trở lên.
Tổn thương gập góc nặng (> 90 độ).
4.3.4 Các bước thực hiện kỹ thuật
Mở đường vào động mạch: Những trường hợp cần khoan phá mảng xơ vữa thường là tổn thương vôi hoá nhiều, nên sử dụng đường động mạch đùi. Tuy nhiên, vẫn có thể dùng đường động mạch
Đặt máy tạo nhịp tạm thời dự phòng nếu thực hiện khoan phá mảng xơ vữa với động mạch vành phải hoặc động mạch mũ ưu năng.
Đặt ống thông can thiệp.
Lái dây khoan đến đầu xa mạch vành: Sử dụng wire thông thường và ống thông siêu nhỏ (microcatheter) để đưa microcatheter tới đầu xa mạch vành, sau đó rút dây dẫn thông thường ra và luồn dây khoan vào microcatheter đến đầu xa mạch vành rồi rút microcatheter. Có thể sử dụng ngay từ đầu dây khoan để lái qua tổn thương với một số tình huống thuận lợi, tuy vậy cần lưu ý dây khoan mảnh và khó lái hơn dây dẫn thường.
Chọn kích cỡ mũi khoan: Tốt nhất là chọn mũi khoan dựa vào đo trên IVUS với kích thước mũi khoan bằng 1/2 đường kính mạch. Nếu không có IVUS thì nên bắt đầu với mũi khoan nhỏ (1,25-1,5mm), sau đó tăng dần kích cỡ, và tránh vượt quá 80% đường kính mạch vành.
Cài đặt tốc độ quay của mũi khoan: tốc độ quay thường là 160.000 đến 180.000 vòng/phút, tuỳ theo kích cỡ mũi khoan. Mũi khoan nhỏ (1,25-1,5mm) có thể được cài đặt với tốc độ cao hơn, 180.000-200.000 vòng/phút.
Đẩy mũi khoan theo dây khoan vào đoạn mạch lành phía trước tổn thương.
Trước khi thực hiện khoan, bơm thuốc giãn mạch để tránh co thắt mạch vành.
Bật máy khoan ở chế độ khoan và đẩy từ từ mũi khoan qua tổn thương. Mỗi lần khoan không nên quá 20 giây để tránh sinh nhiệt quá mức tại vị trí khoan vì có thể làm kẹt mũi khoan. Tránh không để tốc độ mũi khoan giảm bớt 5000 vòng/phút trong vòng 5 giây do nguy cơ kẹt mũi
Sau khi đã khoan qua tổn thương, đưa mũi khoan qua lại vị trí đó thêm vài lần để đảm bảo tổn thương vôi đã được chuẩn bị tốt
Khảo sát thăm dò hình ảnh trong lòng mạch (IVUS/OCT) để đánh giá nhu cầu dùng mũi khoan lớn hơn hoặc các thiết bị đặc biệt khác.
Sau khi đã hoàn tất quá trình khoan phá mảng xơ vữa đưa mũi khoan ra, dùng microcatheter để thay dây khoan bằng dây dẫn thông thường rồi tiến hành nong bóng và đặt stent.
4.3.5 Các biến chứng và cách xử lý
Khoan phá mảng xơ vữa bằng Rotablator (RA) có liên quan đến nhiều biến chứng hơn so với nong mạch bằng bóng tiêu chuẩn và đặt stent. Trong những nghiên cứu về RA, tỷ lệ biến chứng từ 1 đến 14%. Tuy nhiên, nghiên cứu cũng cho thấy biến chứng liên quan đến sử dụng RA một phần cũng do bản chất phức tạp của tổn thương mạch vành và/ hoặc bệnh kèm theo của bệnh nhân được điều trị với RA thay vì chính kỹ thuật này.
Hầu hết các biến chứng của RA đều có thể gặp ở tất cả các ca can thiệp mạch vành thông thường, như: nhồi máu cơ tim, đột quỵ, biến chứng đường vào mạch máu, lóc tách mạch vành, thủng mạch vành, dòng chảy chậm,… Tuy nhiên có một số biến chứng đặc trưng liên quan đến quy trình RA như dòng chảy chậm hoặc không có dòng, nhịp tim chậm và blốc nhĩ thất, hoặc đối với hệ thống Rotablator chẳng hạn như kẹt mũi khoan và đứt/gãy dây khoan .
Dòng chảy chậm/mất dòng chảy
Hiện tượng dòng chảy chậm/mất dòng chảy được ghi nhận xảy ra ở khoảng 2,6% bệnh nhân thực hiện RA. Sự kết hợp của các yếu tố: thuyên tắc mạch đoạn xa do các mảnh vụn hình thành khi khoan, co thắt mạch vành và hoạt hóa tiểu cầu được cho là các nguyên nhân gây ra tình trạng chậm dòng/mất dòng khi thực hiện RA. Các yếu tố dự báo về nguy cơ xảy ra tình trạng này bao gồm: tổn thương dài, sử dụng mũi khoan lớn, thời gian RA kéo dài và giảm tốc độ quay quá mức trong khi khoan. Do vậy, chiến lược để phòng ngừa dòng chảy chậm hoặc mất dòng là tránh các yếu tố nguy cơ kể trên, như sử dụng mũi khoan nhỏ cho tổn thương dài, RA trên các tổn thương ngắn, sử dụng thuốc giãn mạch, rút ngắn thời gian mỗi lần khoan,… Ngoài ra, sử dụng đầy đủ các thuốc kháng ngưng tập tiểu cầu, thuốc chống đông và đảm bảo huyết động trong khi khoan cũng giúp hạn chế tình trạng trên.
Các thuốc để xử trí hiện tượng chậm dòng/mất dòng được đề cập chi tiết ở phần III. Một điều quan trọng cần lưu ý là dòng chảy chậm xảy ra trong quá trình khoan có thể do hiện tượng co thắt mạch vành nghiêm trọng hoặc lóc tách động mạch vành. Do vậy, sau khi đã dùng các thuốc để xử trí chậm dòng/mất dòng kể trên, cần đánh giá kỹ lưỡng xem có hiện tượng co thắt quá mức hay tách thành mạch vành hay không để đưa ra chiến lược xử trí kịp thời.
Nhịp tim chậm
Nhịp tim chậm hoặc block nhĩ thất thường được quan sát thấy trong khi thực hiện RA, nhất là đối với động mạch vành phải (RCA) hoặc động mạch mũ ưu năng. Cơ chế gây ra nhịp tim chậm chưa rõ ràng nhưng nó được cho là do một số nguyên nhân: các mảnh vụn tạo ra khi khoan gây tắc mạch làm hạn chế tưới máu nút nhĩ thất, nhịp tim chậm phản xạ do rung động mạch vành gây ra từ mũi khoan hoặc sinh nhiệt trong khi khoan. Nhịp tim chậm có thể xảy ra ở bất kỳ giai đoạn nào của thủ thuật RA; đôi khi nó xảy ra ngay sau khi bắt đầu khoan, nhưng thường thì nhịp tim giảm dần trong quá trình khoan và dần hồi phục trở lại khi ngừng khoan.
Một số phương án làm giảm tỷ lệ rối loạn nhịp tim bằng cách sử dụng các mũi khoan nhỏ hơn và hạn chế thời gian mỗi lần khoan. Máy tạo nhịp tạm thời được đặt trong trường hợp khoan động mạch vành phải hoặc động mạch mũ ưu năng. Tuy nhiên, việc đặt máy tạo nhịp tạm thời có thể dẫn đến các biến chứng của riêng nó như thủng thất phải, tràn dịch màng ngoài tim và ép tim. Do đó, một lựa chọn khác hợp lý hơn là đặt máy tạo nhịp tạm thời ở tĩnh mạch chủ dưới và chỉ đẩy vào thất phải nếu nhịp tim chậm quá mức. Cũng có thể tiêm atropin trước khi khoan để giảm thiểu nguy cơ nhịp tim chậm trong trường hợp không đặt máy tạo nhịp tạm thời.
Kẹt mũi khoan
Kẹt mũi khoan (Burr entrapment) là một biến chứng hiếm gặp nhưng rất nghiêm trọng. Khi mảng vôi chưa được bào mòn kỹ lưỡng và mũi khoan đã vượt qua tổn thương, khi đó nguy cơ kẹt mũi khoan sẽ xảy ra. Đó là do mũi khoan chỉ được phủ kim cương ở một nửa trước, do vậy nó sẽ dễ dàng tiến về phía trước khi quay với tốc độ cao. Tuy nhiên một nửa sau mũi khoan không được phủ kim cương nên sẽ bị hạn chế khả năng kéo lùi lại vì nó không có khả năng bào mòn mảng vôi khi kéo lùi. Kẹt mũi khoan thường xảy ra đối với tổn thương vôi lệch tâm hoặc liên quan đến kỹ thuật mà bác sĩ thực hiện: Nếu bác sĩ không để mũi khoan áp sát đủ lâu với mảng vôi thì sự bào mòn mảng vôi sẽ bị hạn chế, đồng thời bác sĩ lại dùng kỹ thuật “đẩy” mũi khoan quá mạnh, khi đó nguy cơ kẹt mũi khoan sẽ cao hơn. Bên cạnh đó, hiện tượng “búp bê Kokeshi Nhật Bản” cũng góp
phần lý giải cơ chế gây kẹt mũi khoan: nhiệt sinh ra trong khi khoan gây co thắt mạch quanh mũi khoan, với cấu tạo làm hạn chế việc kéo lùi của mũi khoan, tình trạng co thắt mạch như vậy làm tăng khả năng kẹt mũi khoan. Ngoài ra, sử dụng mũi khoan lớn và đẩy mũi khoan quá mạnh vào tổn thương vôi sẽ làm giảm dần tốc độ quay của mũi khoan và dẫn đến kẹt trong tổn thương.
Phương pháp đầu tiên để xử lý kẹt mũi khoan là kéo nhẹ mũi khoan trở về trong ống thông, trước đó nên bơm thuốc giãn mạch vào mạch vành để tăng cơ hội thành công. Việc rút mũi khoan có thể thuận lợi hơn bằng cách cho mũi khoan quay chậm trong khi rút với chế độ Dynaglide. Tuy nhiên kỹ thuật này không được khuyến khích vì nó có thể gây ra tách thành phức tạp động mạch vành do mũi khoan hoặc do guiding chui vào sâu gây lóc tách lỗ vào. Rút với một lực mạnh có thể gây đứt dây khoan làm tình trạng xấu hơn và cần phẫu thuật để lấy mũi khoan mắc kẹt.
Phương pháp thứ hai là dùng bóng nong để giải phón mũi khoan bị kẹt. Phương pháp này cần sử dụng đường vào mạch máu thứ hai, ống thông thứ nhất chứa mũi khoan được rút nhẹ ra để ngoài lỗ mạch vành và sử dụng ống thông thứ hai từ đó đưa dây dẫn mới (thường là dây dẫn cứng) để lái qua khe giữa mũi khoan và thành mạch rồi đẩy ra đoạn xa, trên dây dẫn mới này đẩy một quả bóng kích thước nhỏ đến vị trí tiếp giáp của mũi khoan với thành mạch và lên bóng; điều này có thể cho phép giải phóng mũi khoan và rút mũi khoan ra khỏi tổn thương.
Phương pháp thứ ba là sử dụng microcatheter để đi vào guiding chứa mũ khoan. Đầu tiên chúng ta phải cắt rời thân của mũi khoan, rút vỏ bọc Nhựa của thân mũi khoan và luồn ống thông nhỏ vào thân mũi khoan,đẩy microcatheter vào sâu sao cho đầu của microcatheter tiếp xúc với đầu mũi khoan bị kẹt và kéo toàn bộ hệ thống này ra ngoài. Microcatheter này tạo thành một hệ thống liên tục với đầu mũi khoan kẹt giúp làm tăng lực kéo mũi khoan ra ngoài đồng thời không gây tổn thương tách thành mạch máu do đầu mũi khoan gây ra.
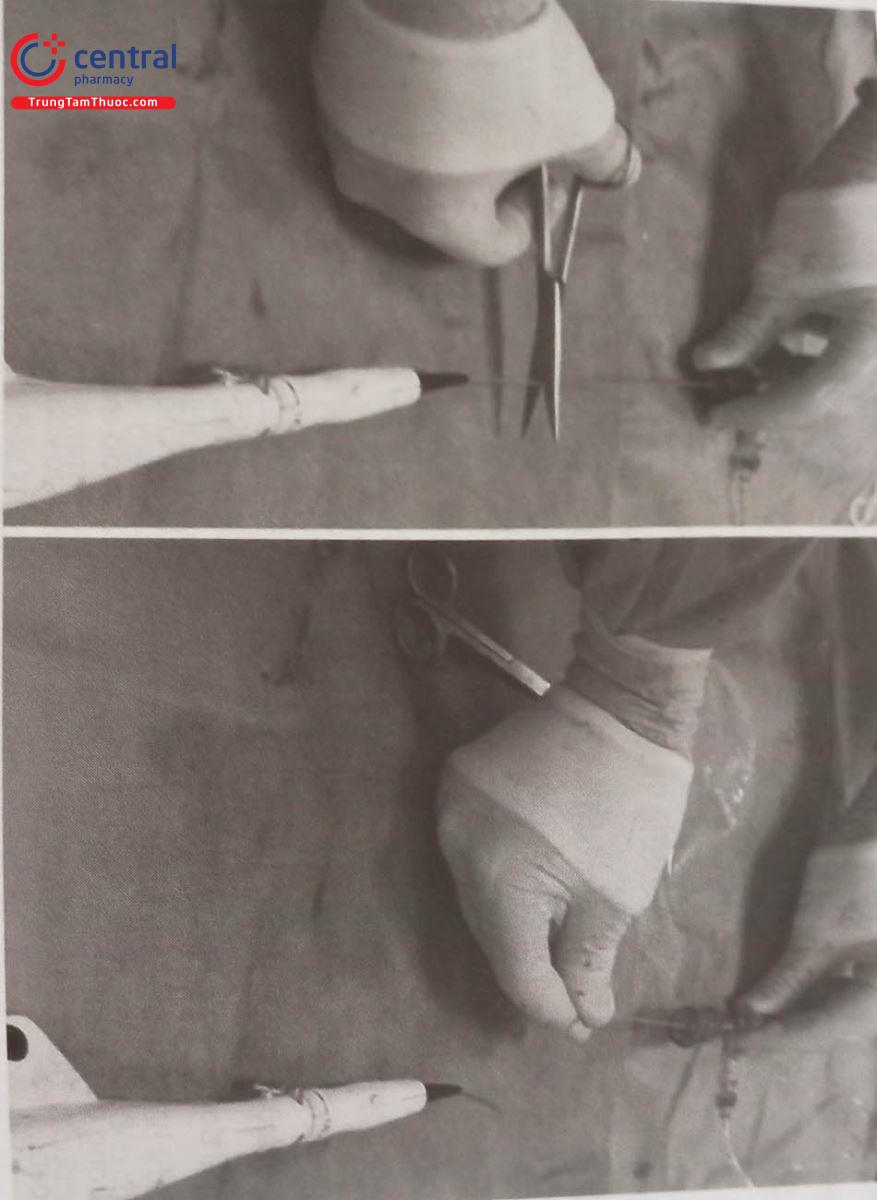
Phương pháp cuối cùng để xử lý kẹt mũi khoan là sử dụng snare. Kỹ thuật này cũng phải cắt rời thân mũi khoan, rút bỏ vỏ bọc nhựa rồi đưa snare vào đến sát mũi khoan bị kẹt, snare có tác dụng kéo với lực tập trung tại vị trí kẹt theo kiểu có kiểm soát giúp làm giảm các biến chứng khi chúng ta cố gắng rút mũi khoan bị kẹt như đứt dây khoan.
Nếu các phương pháp ở trên không thành công thì cần triển khai phương pháp phẫu thuật.
Đứt dây khoan (Rotawire Fracture)
Là một biến chứng không phổ biến. Vị trí thường bị đứt là tại vị trí tiếp nối giữa phần cản quang ở đầu xa với lõi thép – đây là phần yếu nhất của dây khoan và cần tránh đưa đầu mũi khoan đến vị trí này. Ngoài ra, dây khoan cũng có thể bị đứt ở đầu xa khi nó nằm kẹt ở một nhánh bên nên đầu tip của dây khoan không thể xoay được trong khi khoan và gây đứt wire. Tỷ lệ đứt dây khoan có thể giảm thiểu bằng cách luôn giữ dây khoan nằm trong lòng nhánh chính và tránh không cho đầu mũi khoan tiến sát đến phần đầu xa cản quang của dây khoan.
Xử lý trường hợp đứt dây khoan có thể dùng snare để đưa phần dây khoan bị đứt ra ngoài, tuy nhiên nếu chỉ đứt đầu xa thì việc điều trị bảo tồn có thể chấp nhận được và đầu dây khoan bị đứt sẽ nội mạc hóa theo thời gian
4.3.6 Dữ liệu lâm sàng
Trong một nghiên cứu tổng quan thực hiện bởi Cochrane và cộng sự. Trong số 12 thử nghiệm được công bố từ năm 1996 đến năm 2005 với 3474 bệnh nhân cho thấy không có sự khác biệt đáng kể về tình trạng tái hẹp trong stent và các biến cố tim mạch chính (MACE) ở thời điểm 6 tháng và 1 năm sau khi điều trị các tổn thương vôi hóa nặng bằng Rotablator so với nong mạch vành bằng bóng áp lực cao đơn thuần. Nhưng Rotablator cho thấy tỷ lệ biến chứng mạch máu cao hơn.
Gần đây hơn, trong thử nghiệm ROTAXUS đánh giá khoan phá mảng xơ vữa trước khi đặt stent TAXUS cho bệnh nhân vôi hóa nặng động mạch vành, 240 bệnh nhân được chia ngẫu nhiên thành hai nhóm: Thực hiện Rotablator trước đặt stent và đặt stent đơn thuần. Thử nghiệm cho thấy thành công thủ thuật cao hơn ở nhóm thực hiện Rota (92% so với 83,3%; p=0,03) và lòng động mạch vành được mở rộng hơn, nhưng tỷ lệ mất lòng mạch cao hơn sau 9 tháng, mặc dù thử nghiệm bị hạn chế bởi đã loại trừ các tổn thương vôi hóa nặng.
Các kết quả tích cực hơn đã xuất hiện từ nghiên cứu PREPARE-CALC được công bố vào năm 2018, trong đó 210 bệnh nhân được chọn ngẫu nhiên để điều trị bằng Rota hoặc bóng cắt/bóng quấn lưới kim loại, trong nghiên cứu đó tỷ lệ thành công thủ thuật với Rota cao hơn so với nong bóng đặc biệt (98% so với 81%; p= 0,001) và không có sự khác biệt về tỷ lệ mất lòng mạch muộn sau 9 tháng. Biến chứng thủng mạch vành cũng thấp hơn so với các nghiên cứu trước và tương tự ở hai nhóm, có thể do kinh nghiệm của bác sĩ đã tốt hơn. Rota cũng được khuyên là nên kết hợp với bóng nong đặc biệt theo báo cáo của Amemiya và cộng sự trong nghiên cứu quan sát đơn trung tâm với kết quả tốt về vết nứt, độ dày của mảng vôi hóa và sự nở stent được đánh giá bằng OCT.
Nghiên cứu đa trung tâm ROTATE trên 1176 bệnh nhân có tổn thương mạch vành mức độ nặng được điều trị bằng Rota và đặt stent phủ thuốc, tỷ lệ biến cố tim mạch chính (MACE) theo dõi sau 01 năm là 16%. Dữ liệu từ đa trung tâm ở châu Âu trên 963 bệnh nhân cho thấy tỷ lệ thành công thủ thuật là 92%, tỷ lệ tử vong là 12,5% và tỷ lệ MACE khi theo dõi trên 1 năm là 17% (trình bày tại Đại hội Tim mạch Can thiệp Châu Âu năm 2019).
4.4 Khoan bào mảng xơ vữa với thiết bị Orbital
4.4.1 Giới thiệu
Gần đây Orbital cũng là một thiết bị khoan phá mảng xơ vữa khác để điều trị các tổn thương mạch vành vôi hóa nặng. Orbital sử dụng lực quay ly tâm và bào mòn các tổn thương vôi hóa; không giống như hệ thống Rotablator, thiết bị này sử dụng một mũi khoan phủ kim cương được gắn lệch tâm, quay quanh dây khoan chuyên dụng ở tốc độ cao và giảm thiểu tổn thương cho thành mạch. Thao tác khoan tổn thương vôi được lặp lại nhiều lần cả theo chiều tiến về phía trước và lùi về phía sau, đường kính của quỹ đạo khoan được mở rộng dần thông qua lực ly tâm tạo ra một diện khoan lớn hơn 1,25 đến 1,75 lần so với kích thước của mũi khoan (tốc độ quay càng cao thì đường kính của mũi khoan càng lớn). Ưu điểm nổi bật của Orbital so với Rotablator là tạo ra các vi mảnh nhỏ hơn 2 μm (so với 5-10 μm tạo ra bởi Rotablator) giúp làm giảm nguy cơ dòng chảy chậm hoặc mất dòng. Ngoài ra quỹ đạo hình elip của Orbital khác hẳn với quỹ đạo đồng tâm của Rotablator nên không làm mất dòng chảy mạch vành lúc khoan, giảm tổn thương nhiệt tác động lên thành động mạch vành.
4.4.2 Chỉ định và chống chỉ định
Tương tự như đối với hệ thống Rotablator.
4.4.3 Các bước tiến hành
Mở đường vào động mạch: Những trường hợp cần khoan phá mảng xơ vữa thường là tổn thương vôi hoá nhiều, nên sử dụng đường động mạch đùi. Tuy nhiên, vẫn có thể dùng đường động mạch
Đặt máy tạo nhịp tạm thời dự phòng nếu thực hiện khoan phá mảng xơ vữa với động mạch vành phải hoặc động mạch mũ ưu năng.
Đặt ống thông can thiệp.
Lái dây khoan đến đầu xa mạch vành: Sử dụng dây dẫn thông thường và ống thông siêu nhỏ (microcatheter) để đưa microcatheter tới đầu xa mạch vành, sau đó rút dây dẫn thông thường ra và luồn dây khoan vào microcatheter đến đầu xa mạch vành rồi rút microcatheter. Có thể sử dụng ngay từ đầu dây khoan để lái qua tổn thương với một số tình huống thuận lợi, tuy vậy cần lưu ý dây khoan mảnh và khó lái hơn dây dẫn thường.
Mở khóa núm điều khiển và kiểm tra chắc chắn núm chuyển động tự do theo chiều dọc (núm điều khiển này sẽ giúp đẩy mũi khoan về phía trước hoặc kéo lùi lại phía sau).
Khóa phanh của dây khoan (do thiết bị chỉ hoạt động khi phanh của dây khoan đã được khoá).
Từ từ đẩy mũi khoan về phía trước để bắt đầu quá trình khoan phá tổn thương vôi với tốc độ 1 mm mỗi giây. Với tổn thương hẹp khít, động tác tiến và lùi mũi khoan cần thực hiện nhịp nhàng để đảm bảo tốc độ tiến:lùi là 1:1. Do mũi khoan bào mảng vôi cả theo chiều tiến và lùi nên cần tránh kéo mũi khoan lùi về quá mạnh.
Sau mỗi 20 giây khoan thì nên nghỉ một khoảng thời gian tương đương. Bảng điều khiển máy sẽ phát ra chuông cảnh báo sau mỗi khoảng thời ;gian khoan quá 25 giây. Tổng thời gian khoan phá mảng xơ vữa tối đa không quá 5 phút. Lưu ý vị trí dừng mũi khoan phải ở đoạn mạch lành, tránh dừng mũi khoan ở vị trí tổn thương.
Luôn theo dõi sát huyết áp và nhịp tim trong quá trình làm thủ thuật nếu có dấu hiệu tụt áp hoặc nhịp chậm thì có thể truyền dịch hoặc dùng thêm các thuốc vận mạch.
Sau khi khoan thành công, kích hoạt chế độ Glide Assist và từ từ đưa mũi khoan ra ngoài. Chụp mạch vành để loại trừ các biến chứng.
Đưa một dây dẫn can thiệp khác qua tổn thương song song với dây khoan và nong tổn thương bằng bóng không giãn nở.
Đưa stent kích thước phù hợp đến tổn thương, rút dây khoan của hệ thống Orbital và tiến hành nong, đặt
4.4.4 Dữ liệu lâm sàng
Thử nghiệm lâm sàng ORBIT I bao gồm 50 bệnh nhân đánh giá tính an toàn và hiệu quả của Orbital trong việc điều trị các tổn thương vôi hóa nặng cho thấy tỷ lệ thành công của thủ thuật là 94% và tỷ lệ MACE là 8% theo dõi trong 6 tháng.
Thử nghiệm lâm sàng ORBIT II bao gồm 443 bệnh nhân cho thấy tỷ lệ thành công thủ thuật là 98,6% và tỷ lệ bóc tách động mạch vành đáng kể là 2,3%, tỷ lệ MACE là 10,4% sau 30 ngày theo dõi. Kết quả theo dõi sau 3 năm tỷ lệ MACE là 23,5%.
Làm vỡ mảng vôi bằng năng lượng laser
Hiệu quả của laser để điều trị các tổn thương vôi hóa trong lòng động mạch vành đến nay còn hạn chế và hiện hiếm khi được sử dụng như một chiến lược đầu tay cho các tổn thương vôi hóa nặng. Hệ thống laser hoạt động dựa trên một ống thông laser bao gồm các sợi sắp xếp đồng tâm xung quanh một dây dẫn có khả năng tạo ra năng lượng lên đến 80 mJ/mm2 và phù hợp với hệ thống 6Fr. Hiệu quả phá vỡ vôi đạt được thông qua các hiệu ứng quang hóa,
quang cơ và quang nhiệt. Tiếp sau những hiệu ứng này là sự tương tác của tia laser với chất lỏng như nước muối sinh lý, máu và thuốc cản quang. Hiệu ứng quang cơ này được khuếch đại khi tương tác với chất có độ tương phản, do vậy khi tiến hành làm thủ thuật thì nước muối sinh lý sẽ được bơm liên tục vào động mạch vành.
Trên lâm sàng, dùng laser phá vôi chỉ thực hiện khi microcatheter hoặc các loại dây khoan không qua được tổn thương. Tuy nhiên những trường hợp này hiệu quả phá mảng vôi bằng laser đơn thuần là kém hơn so với hệ thống khoan. Để tăng hiệu quả, sự kết hợp của laser và khoan cho thấy những kết quả hứa hẹn. Laser có ưu thế hơn hẳn trong duy nhất một trường hợp là tái hẹp stent deo nguyên nhân stent không nở tối ưu, nhờ phá vỡ được mảng vôi nằm bên ngoài stent, kỹ thuật truyền thuốc cản quang liên tục vào lòng mạch vành được thực hiện để làm tăng hiệu quả phá vôi của laser.
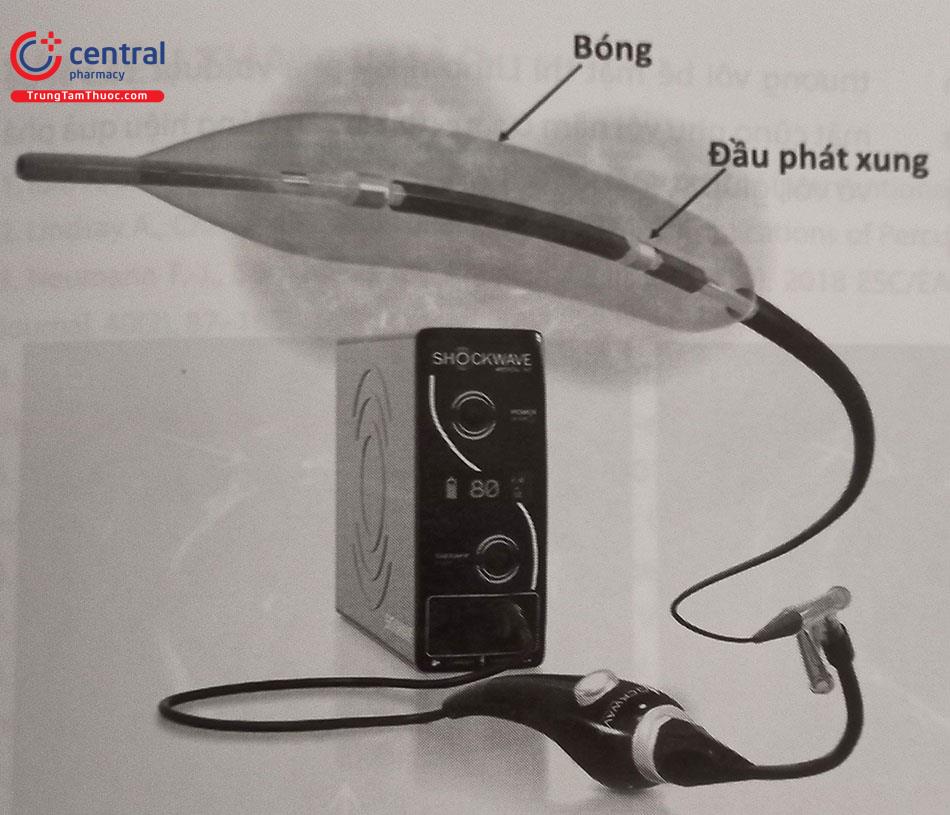
4.5 Làm vỡ mảng vôi bằng sóng xung kích (Lithotripsy: Shockwave)
Một trong những công nghệ mới nhất, mà trước kia được sử dụng để tán sỏi thận, thì gần đây đã được cải tiến phù hợp để điều trị các tổn thương vôi hóa trong lòng động mạch vành (thiết bị Shockwave). Thiết bị này phát ra sóng xung kích để phá vỡ mảng vôi hóa, đã được ứng dụng trong điều trị tổn thương vôi ở mạch ngoại biên và hiện nay được chế tạo để phù hợp cho sử dụng trong động mạch vành. Thiết bị này bao gồm một quả bóng bán giãn nở dài 12 mm, bên trong có 2 bộ phận phát xung cách nhau 6 mm và được đưa đến tổn thương qua dây dẫn 0,014 mm với ống thông 6Fr thông thường. Sau khi bóng được bơm lên với áp lực 4 atm, hai đầu phát xung sẽ hoạt động, thông qua những hiện tượng vật lý phức tạp xảy ra trong lòng bóng sẽ tạo ra sóngxung kích tác động tới mảng vôi mạch vành. Áp lực mà thiết bị này tạo ra có thể lên tới 50 atm và sâu 3 mm vào thành mạch, qua đó có thể phá vỡ vôi nằm ở nông hoặc ở sâu. Lưu ý tại vị trí tổn thương, mỗi lần phát xung không quá 10 giây và điều chỉnh vị trí bóng gối nhau mỗi 2 mm theo chiều dài của tổn thương. Sau khi đã kết thúc quá trình phát xung, tiếp tục lên bóng theo áp lực khuyến cáo để mở rộng tổn thương rồi đặt stent. Thiết bị này hiện đã có trên thị trường với kích thước từ 2,5 đến 4,0 mm và được FDA chấp thuận trong can thiệp động mạch vành từ đầu năm 2021.
Hiện nay, với sự ra đời của hệ thống bóng xung kích (lithotripsy), cách tiếp cận tổn thương vôi hóa ĐMV được đề xuất như sau:
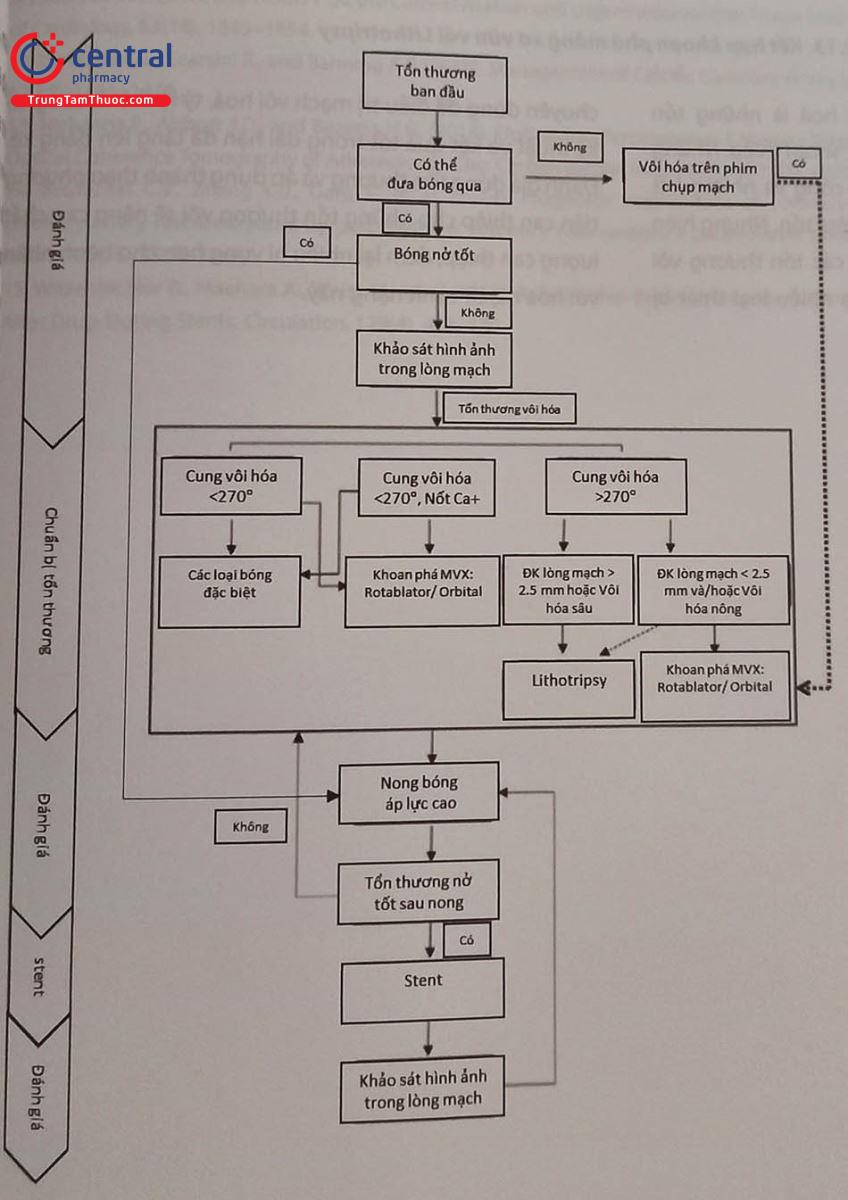
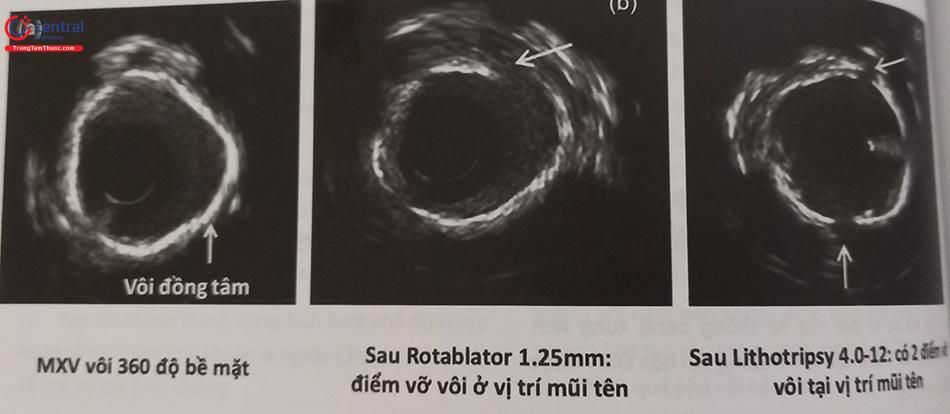
Một hướng tiếp cận đầy hứa hẹn trong can thiệp tổn thương vôi hoá hiện nay là kết hợp giữa khoan mảng xơ vữa và Lithotripsy do tận dụng được ưu điểm của từng phương pháp, trong khi khoan có hiệu quả với những tổn thương vôi bề mặt thì Lithotripsy phá vỡ được cả vôi bề mặt cũng như vôi nằm ở sâu, do vậy làm tăng hiệu quả phá vỡ vôi, giúp stent nở tốt hơn.
Tóm lại, tổn thương mạch vành vôi hoá là những tổn thương khó, là trở ngại lớn cho các bác sĩ can thiệp. Những năm trước đây, tỷ lệ can thiệp thành công và những kết quả tích cực về mặt lâu dài còn khá khiêm tốn. Nhưng hiện nay, với sự hiểu biết kỹ lưỡng hơn về các tổn thương vôi kết hợp với sự phát triển đa dạng của nhiều loại thiết bị
chuyên dùng để điều trị mạch vôi hoá, tỷ lệ thành công về kỹ thuật và kết quả tốt trong dài hạn đã tăng lên đáng kể. Đánh giá đúng tổn thương và áp dụng thành thạo phương tiện can thiệp cho những tổn thương vôi sẽ nâng cao chất lượng can thiệp, đem lại nhiều hi vọng hơn cho bệnh nhân vôi hóa mạch vành nặng này.
5 Tài liệu tham khảo
- Kini A. and Sharma S.K., eds. (2021), Practical Manual of Interventional Cardiology, Springer International Publishing,
- Lindsay A., Chitkara K., and Di Mario C. (2016), Complications of Percutaneous Coronary Intervention: The Survival Handbook, .
- Neumann -J., Sousa-Uva M., Ahlsson A., et al. (2019). 2018 ESC/EACTS Guidelines on myocardial revascularization. European Heart Journal, 40(2), 87–165.
- Lawton J.S., Tamis -Holland Jacqueline E., et al. (2022). 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization. Journal of the American College of Cardiology, 79(2), e21–e129.
- Shavadia J.S., Vo N., and Bainey K.R. (2018). Challenges With Severe Coronary Artery Calcification in Percutaneous Coronary Intervention: A Narrative Review of Therapeutic Options. Canadian Journal of Cardiology, 34(12), 1564–1572.
- Dini C.S., Nardi G., Ristalli , et al. (2019). Contemporary Approach to Heavily Calcified Coronary Lesions. Interv Cardiol, 14(3), 154–163.
- Cubero-Gallego , Tizón-Marcos, and H., and Vaquerizo B. (2021). Current options for the management of calcified lesions. RECICE, 3555.
- OTSUKA , SAKAKURA K., YAHAGI K., et al. (2014). Has Our Understanding of Calcification in Human Coronary Atherosclerosis Progressed?. Arterioscler Thromb Vasc Biol, 34(4), 724–736.
- Kassimis G., Raina , Kontogiannis N., et al. (2019). How Should We Treat Heavily Calcified Coronary Artery Disease in Contemporary Practice? From Atherectomy to Intravascular Lithotripsy. Cardiovascular Revascularization Medicine, 20(12), 1172–1183.
- Wang , Matsumura M., Mintz G.S., et al. (2017). In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC: Cardiovascular Imaging, 10(8), 869–879.
- Généreux , Madhavan M.V., Mintz G.S., et al. (2014). Ischemic Outcomes After Coronary Intervention of Calcified Vessels in Acute Coronary Syndromes: Pooled Analysis From the HORIZONS-AMI (Harmonizing Outcomes With Revascularization and Stents in Acute Myocardial Infarction) and ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) Trials. Journal of the American College of Cardiology, 63(18), 1845–1854.
- De Maria G.L., Scarsini R., and Banning P. (2019). Management of Calcific Coronary Artery Lesions. JACC: Cardiovascular Interventions, 12(15), 1465–1478.
- Mehanna E., Abbott J.D., and Bezerra H.G. (2018). Optimizing Percutaneous Coronary Intervention in Calcified Lesions: Insights From Optical Coherence Tomography of Atherectomy. Circ: Cardiovascular Interventions, 11(5),
- Bourantas C.V., Zhang -J., Garg S., et al. (2014). Prognostic implications of coronary calcification in patients with obstructive coronary artery disease treated by percutaneous coronary intervention: a patient-level pooled analysis of 7 contemporary stent trials. Heart, 100(15), 1158–1164.
- Witzenbichler B., Maehara A., Weisz G., et al. (2014). Relationship Between Intravascular Ultrasound Guidance and Clinical Outcomes After Drug-Eluting Stents. Circulation, 129(4), 463–470.

