Can thiệp động mạch vành trong một số trường hợp đặc biệt
Nguồn: Sách tim mạch can thiệp
Chủ biên:PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn
ThS.BSNT Nguyễn Hữu Tuấn
ThS.BSNT Nguyễn Bá Ninh
ThS.BSNT Nguyễn Thiện Toàn
PGS.TS.BS Phạm Mạnh Hùng
Các nội dung về can thiệp động mạch vành phải xuất phát bất thường, can thiệp tổn thương lỗ vào động mạch vành, can thiệp cầu nối chủ - vành,... sẽ được Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc trong bài viết dưới đây.
1 Can thiệp động mạch vành phải xuất phát bất thường
1.1 Đại cương
Bất thường vị trí xuất phát của động mạch vành không phổ biến, gặp ở khoảng 0,2-1,2% bệnh nhân can thiệp mạch vành. Trong số đó, khoảng 57% là những vị trí xuất phát bất thường của động mạch vành phải (RCA) và vị trí bất thường hay gặp của động mạch vành phải là từ xoang vành trái (chiếm khoảng 6-27% tổng số bệnh nhân bất thường mạch vành). Ngoài ra, RCA cũng có thể xuất phát từ động mạch phổi, đường ra thất trái, thân chung động mạch vành, kênh động mạch chủ-thất trái, xoang không vành và từ phía trên xoang valsalva.
Vị trí xuất phát bất thường của động mạch vành làm tăng mức độ khó về chiến lược tiếp cận cũng như thực hiện kỹ thuật can thiệp. Lựa chọn sonde chụp và guiding can thiệp phù hợp với vị trí của lỗ vành phải là yếu tố quan trọng trong đánh giá thương tổn và can thiệp động mạch vành.
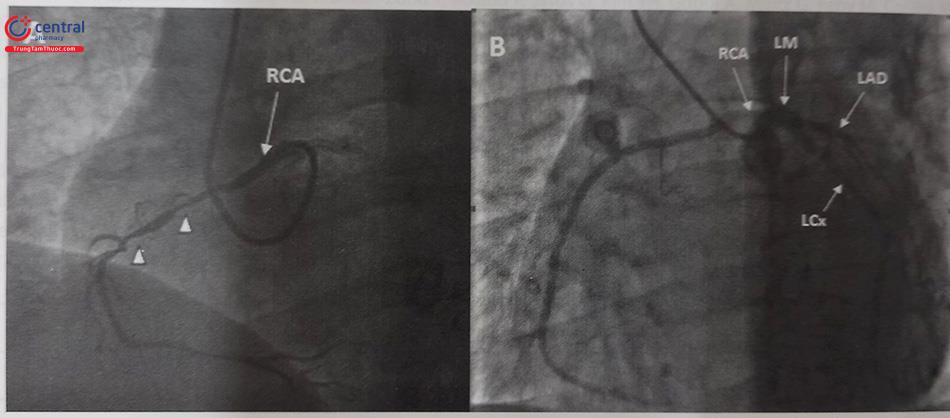
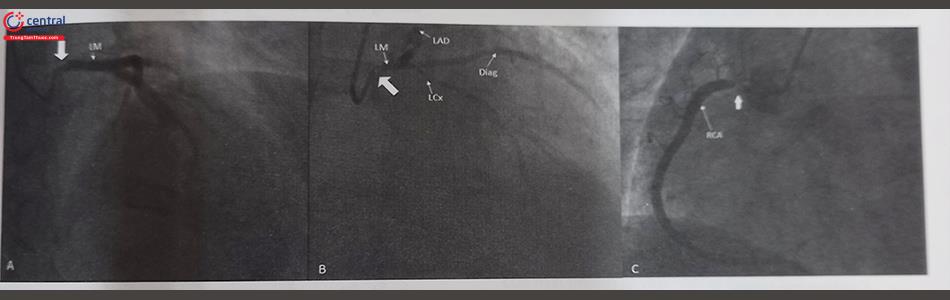
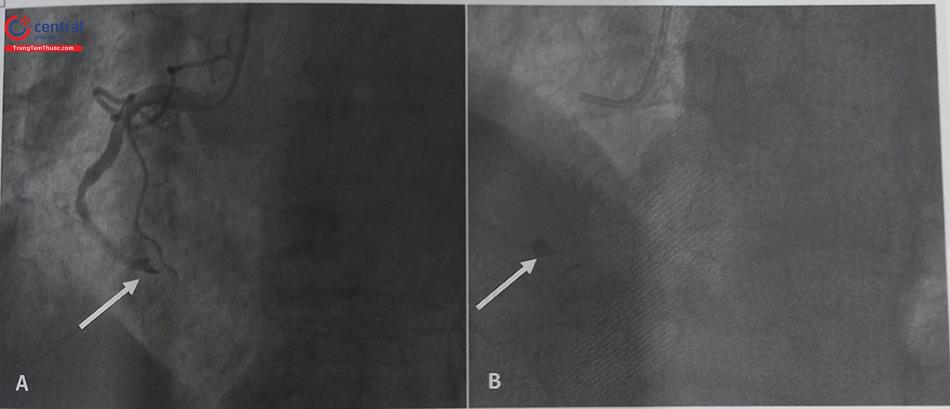
(A) RCA xuất phát từ xoang vành trái có tổn thương nặng đoạn 2 (tam giác trắng). (B) RCA xuất phát từ xoang vành trái sát lỗ LM (không có tổn thương ở RCA). Chú thích: RCA: Động mạch vành phải; LCx: Động mạch mũ; LAD: Động mạch liên thất trước, LM: thân chung động mạch vành trái.
1.2 Một số vị trí xuất phát bất thường hay gặp của động mạch vành phải
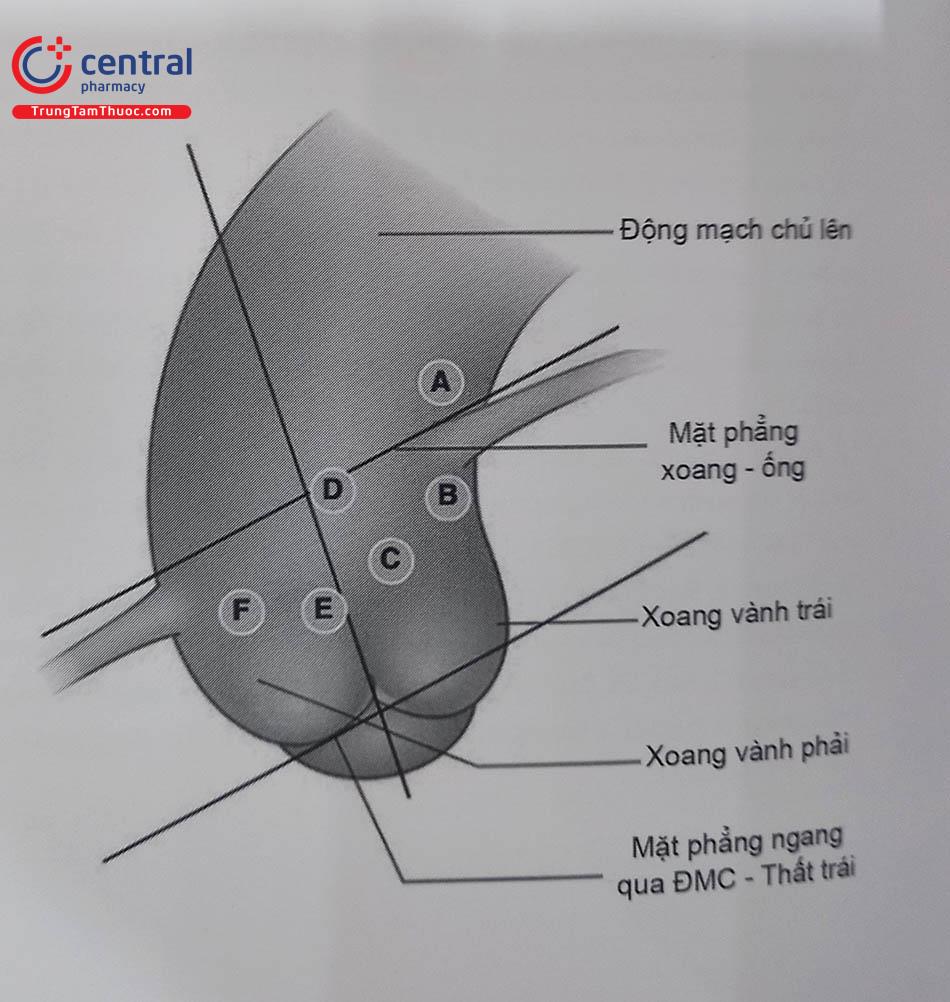
(A) Phía trên cao của động mạch chủ lên bên trái. (B)(C)(D) vành phải xuất phát từ xoang vành trái. (E)(F) vành phải xuất phát từ phía thấp của xoang vành phải. (Phân loại theo Johal và cộng sự). Chú thích: RCA: Động mạch vành phải. ĐMC: động mạch chủ.
Bảng 24.1. Lựa chọn Guiding cho những vị trí xuất phát bất thường động mạch vành phải (Phân loại theo Johal và cộng sự ).
| VỊ TRÍ | VỊ TRÍ XUẤT PHÁT CỦA RCA | LỰA CHỌN ƯU TIÊN |
|---|---|---|
| Từ xoang vành trái | ||
| A | Từ động mạch chủ phía trên mặt phẳng xoang ống | JL |
| B | Ngay dưới lỗ động mạch vành trái | EBU |
| C | Dưới mặt phẳng xoang ống giữa đường trục dọc động mạch chủ và lỗ động mạch vành trái | EBU |
| D | Gần đường giữa trục động mạch chủ | AL |
| Từ xoang vành phải | ||
| E | Gần đường giữa động mạch chủ | AR |
| F | Xuất phát phía trước | 3DRC |
1.3 Một số điểm lưu ý trong can thiệp động mạch vành phải xuất phát bất thường
RCA xuất phát từ bên trái và thành bên cao là biến thể hay gặp nhất, nên phần dưới đây sẽ tập trung vào phân tích việc chọn Guiding và các lưu ý khi can thiệp RCA xuất phát từ hai vị trí trên.
1.3.1 Động mạch vành phải xuất phát từ bên trái
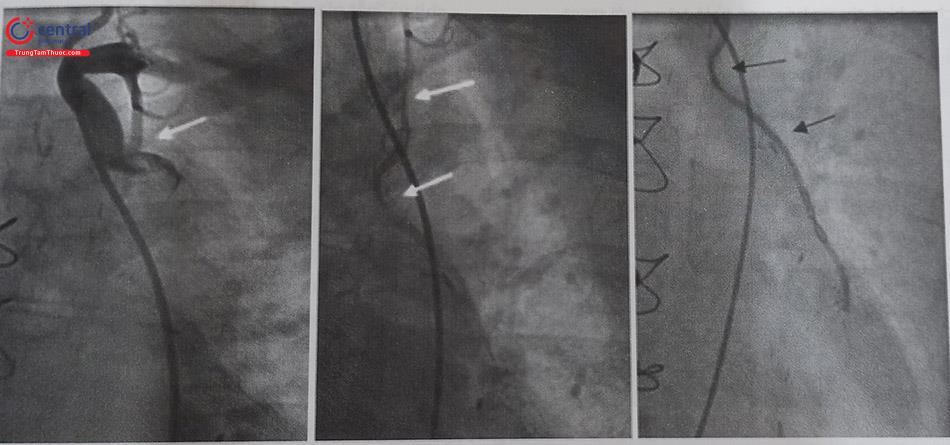
Can thiệp động mạch vành với trường hợp bất thường xuất phát RCA từ bên trái có những khó khăn nhất định. Thông thường, RCA sẽ hay xuất phát từ phía trước và phía trên của LM. Với vị trí bất thường này, lỗ vào RCA tạo ra một góc nhọn giữa gốc RCA và động mạch chủ làm cho việc đặt sonde chụp và Guiding khó khăn hơn, đồng thời việc cố định Guiding kém và không đồng trục gây ra nhiều khó khăn cho việc đẩy bóng, stent và các dụng cụ khác như hút huyết khối.
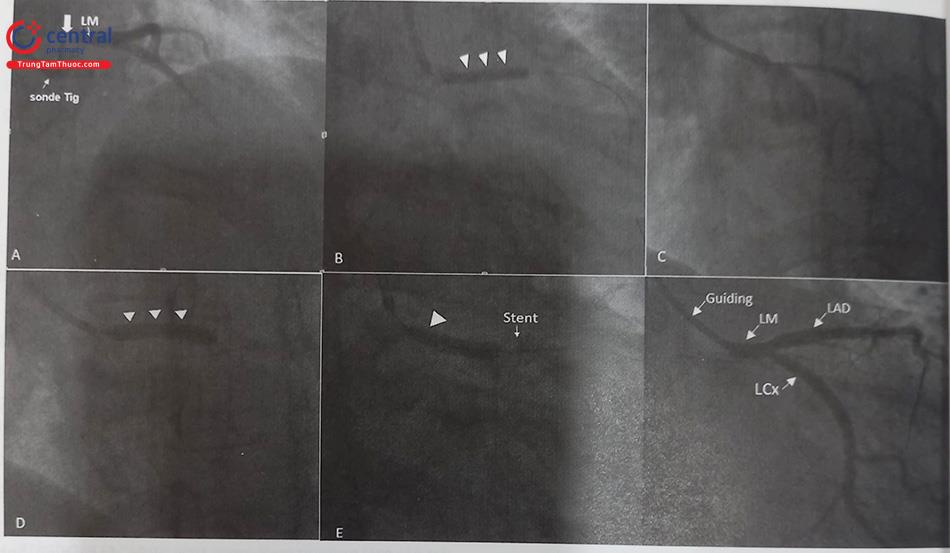
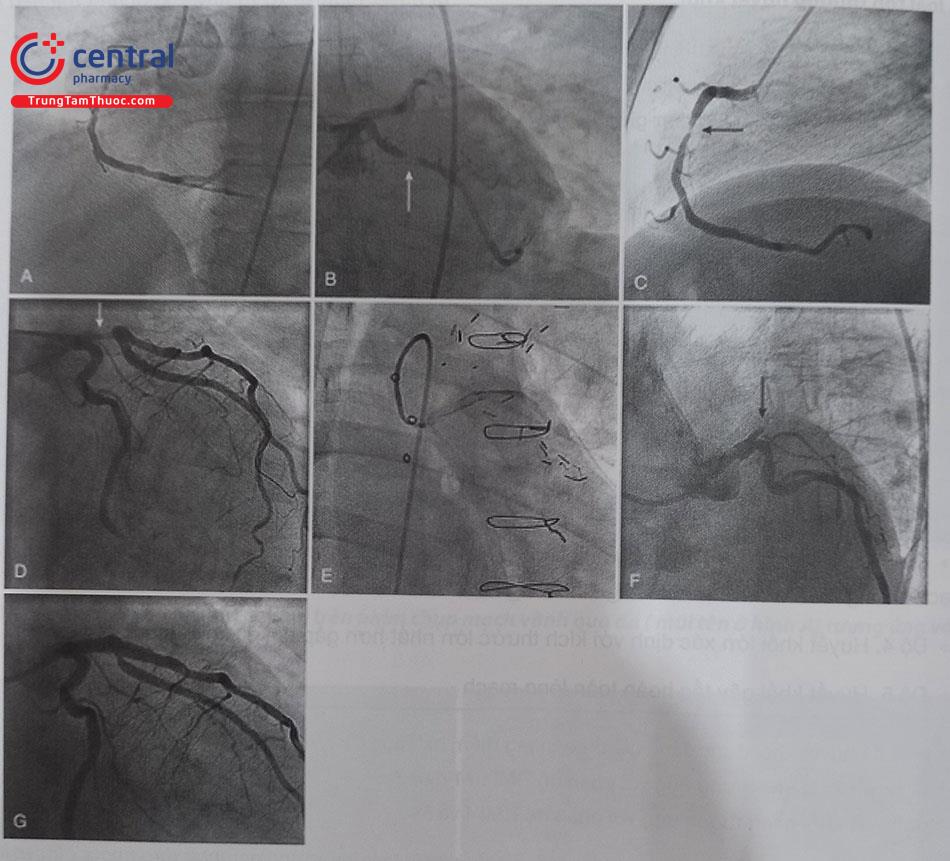
(A) Tổn thương đoạn xa RCA (mũi tên màu xám). (B) đưa dây dẫn qua tổn thương và nong bóng. (C) Đưa stent đến vị trí tổn thương. (D) Nong và đặt stent. (Nguồn Viện Tim Mạch Việt Nam) Chú thích: RCA: Động mạch vành phải; LM: thân chung động mạch vành trái.
1.3.2 Động mạch vành phải xuất phát từ phía trên cao của động mạch chủ lên
Chọn guiding can thiệp trong trường hợp này tương đối thuận lợi hơn so với trường hợp xuất phát từ bên trái. Với việc sử dụng guiding phù hợp (như AL1), guiding đồng trục hơn, không tạo ra góc nhọn gây cản trở dụng cụ đưa vào mạch vành. Tuy nhiên, do có ít điểm tì vào động mạch chủ nên hạn chế việc hỗ trợ lực từ guiding.

1.4 Những kinh nghiệm khi chụp và can thiệp RCA xuất phát bất thường
- Đường vào: đường vào thông thường để chụp động mạch vành là động mạch quay, nếu phát hiện ra bất thường của RCA, nên chuyển can thiệp qua động mạch đùi để tránh hiện tượng co thắt mạch quay và việc thao tác Guiding thuận lợi hơn.
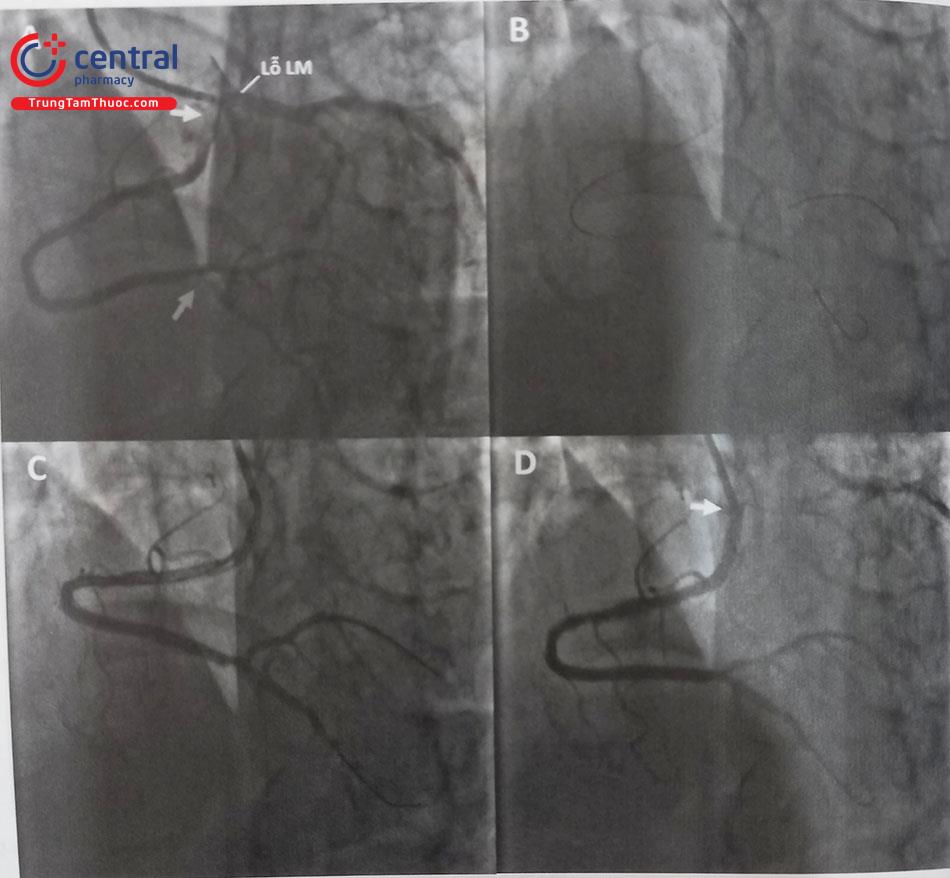
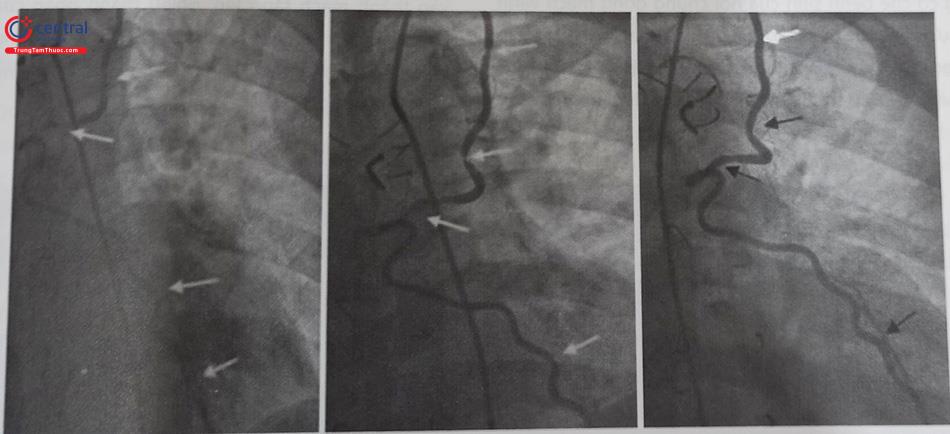
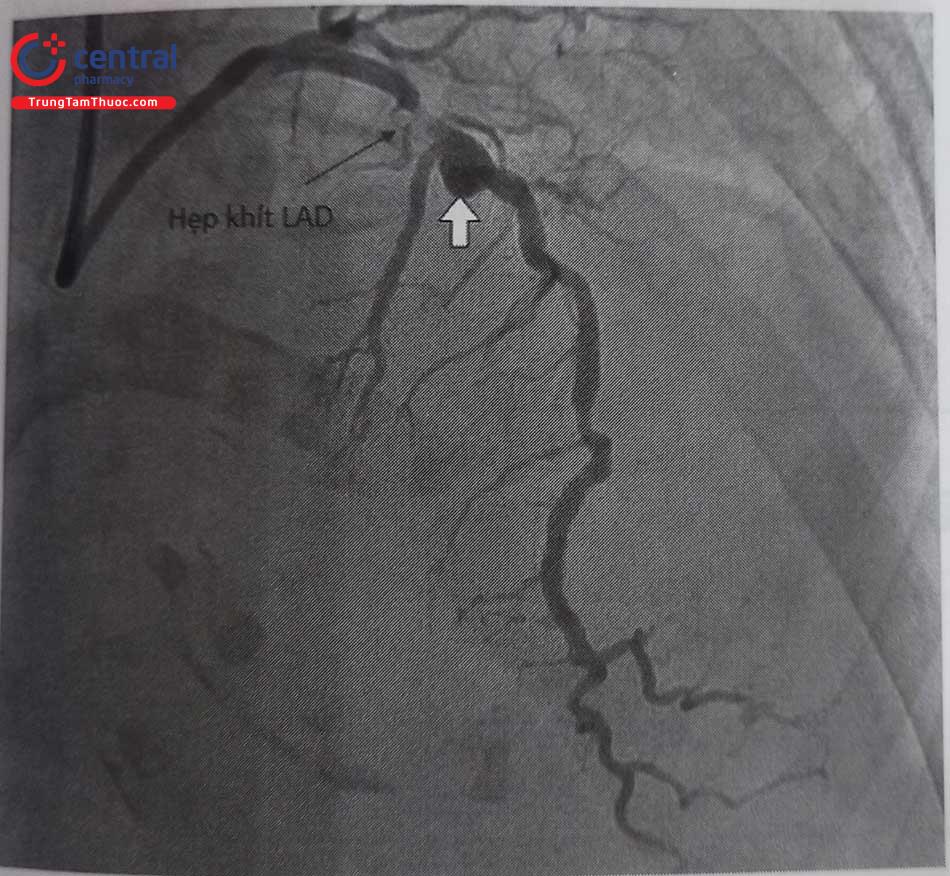
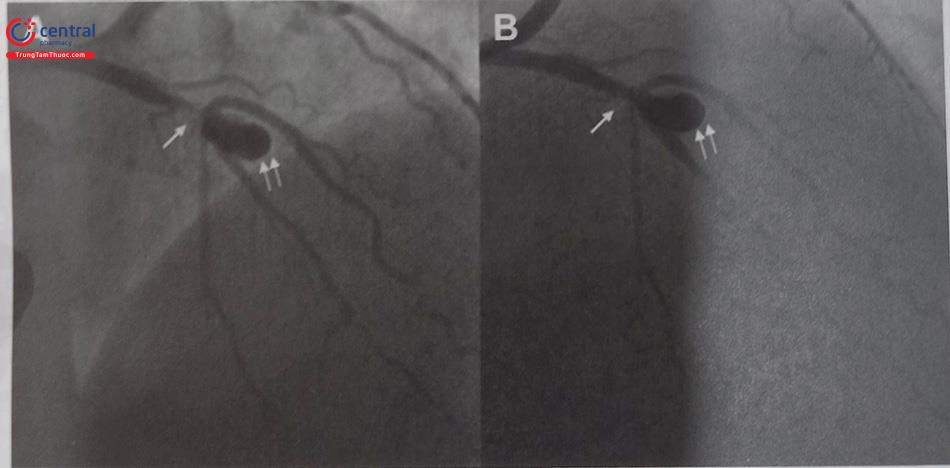
- Cần phải nghĩ tới bất thường xuất phát RCA khi đã tiêu tốn nhiều thời gian và nhiều loại sonde chụp mạch vành. Khi đó nên chụp gốc động mạch chủ để tìm được sơ bộ vị trí xuất phát của RCA rồi tùy theo vị trí xuất phát có thể lựa chọn được sonde chụp và guiding can thiệp phù hợp. Ví dụ minh hoạ ở hình dưới đây.
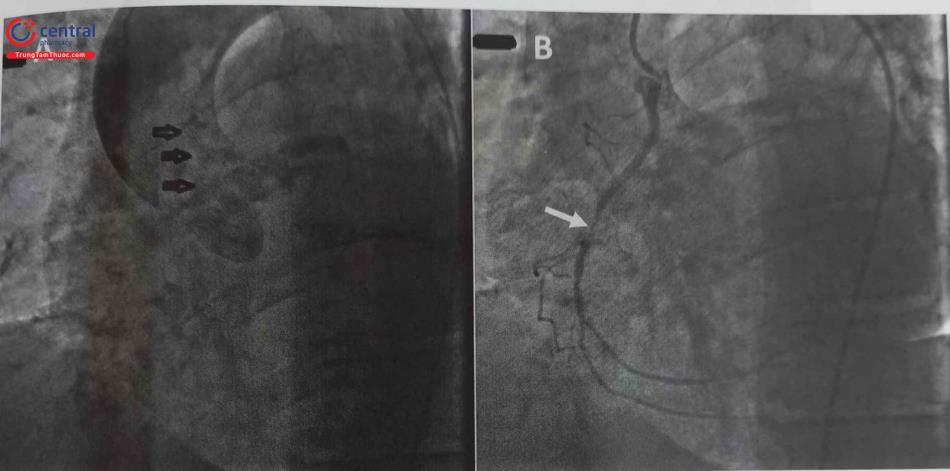
Chú thích: RCA: Động mạch vành phải.
- Lựa chọn Guiding can thiệp tuỳ thuộc vào vị trí xuất phát của RCA, đường kính động mạch chủ, độ cong của động mạch chủ, góc tạo giữa gốc RCA và động mạch chủ.
- Với các trường hợp Guiding can thiệp không hỗ trợ tốt, khó lái wire, có thể dùng microcatheter để hỗ trợ cho lái wire được dễ dàng hơn.
- Có thể dùng hai wire can thiệp giúp tăng lực hỗ trợ để đẩy bóng,
- Guiding hỗ trợ đẩy sâu (như Guidezilla, Guideliner,…) có thể luồn sâu vào lòng mạch vành mà ít gây sang chấn nội mạc giúp đưa các dụng cụ can thiệp đến tổn thương dễ dàng hơn. Các guiding đặc biệt này có ý nghĩa lớn nếu RCA vừa xuất phát bất thường lại kèm theo có vôi hoá hoặc mạch xoắn. Nên chọn kích thước guiding hỗ trợ đẩy sâu tương đối nhỏ (5Fr) để thuận lợi cho đẩy guiding này vào sâu.
- Trong một số trường hợp đặc biệt và bác sĩ có nhiều kinh nghiệm, có thể uốn lại hướng và độ cong đầu Guiding can thiệp để thuận lợi cho việc đặt guiding và đồng trục
- Nếu Guiding can thiệp chưa đồng trục, sau khi đưa wire can thiệp qua tổn thương, dùng bóng nong đẩy tới tổn thương và lên bóng, trong lúc bóng đang căng sẽ điều chỉnh Guiding vào chọn lọc và đồng trục hơn. Lưu ý là những trường hợp này cần vừa đưa ống thông vào vừa xoay chỉnh ống thông nhẹ nhàng, theo dõi áp lực, tránh đẩy guiding thô bạo gây lóc tách lỗ vào động mạch vành.
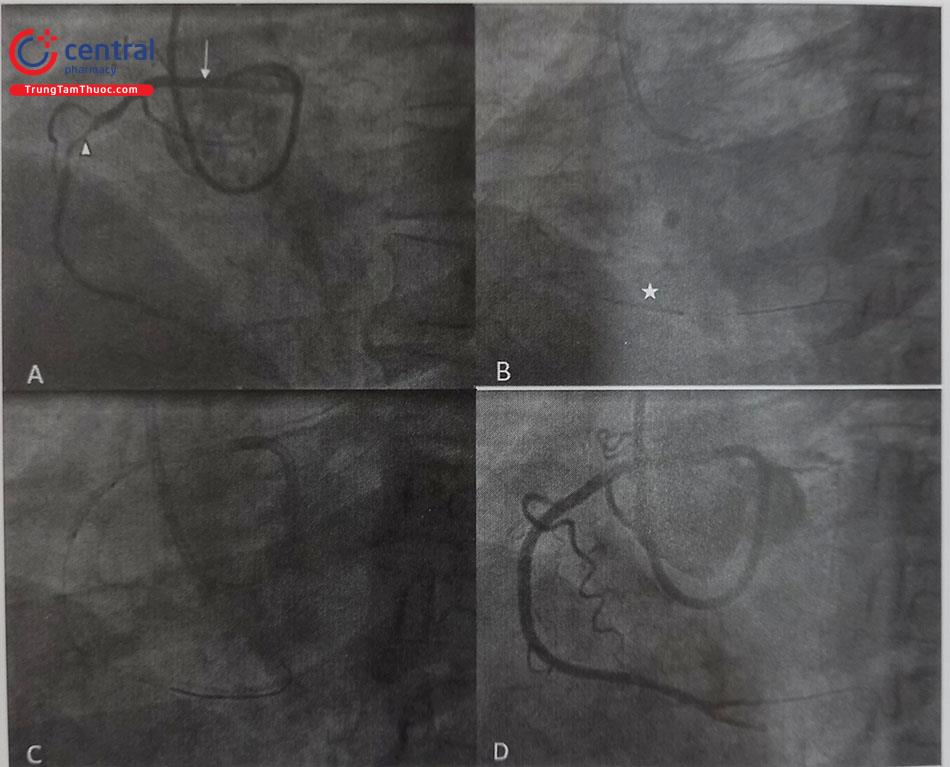
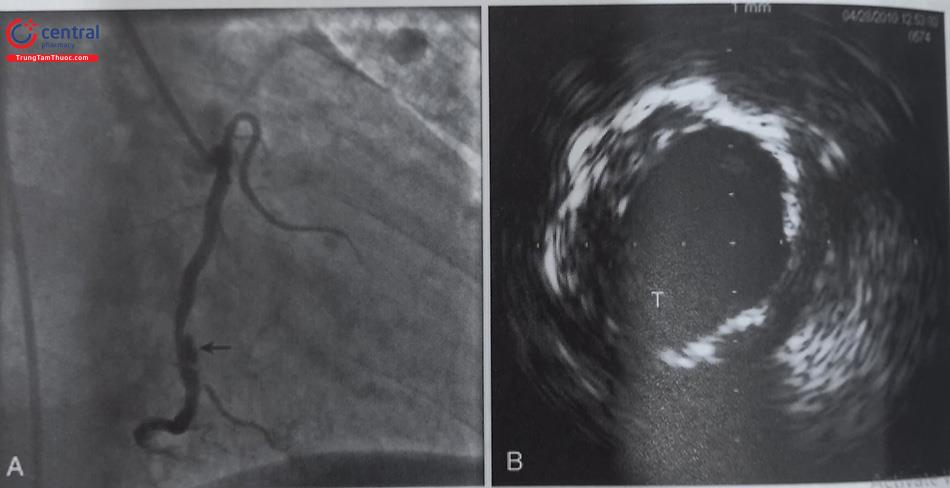
(A) Bất thường xuất phát RCA (mũi tên) từ xoang vành trái, hình ảnh hẹp khít (tam giác) đoạn giữa RCA được chụp bằng ống thông JL 3.75- 6F. (B) Một bóng (hình sao) kích thước 2mm x 15mm được bơm căng trên dây wire để điều hướng ống thông can thiệp vào lỗ RCA . (C ) Nong bóng vị trí tổn thương lên 12 atm sau khi đồng trục Guiding can thiệp vào lỗ RCA. (D) Kết thúc can thiệp dòng chảy TIMI 3. Chú thích: RCA: Động mạch vành phải.
- Do hướng xuất phát và góc gập bất thường của RCA nên có khả năng đánh giá không chính xác mức độ hẹp của lỗ vào và đoạn đầu của RCA dẫn tới việc đặt stent không cần thiết tại vị trí mạch cong gập đó. Vì vậy cần đánh giá kỹ tổn thương tại vị trí này, nếu cần có thể khảo sát siêu âm trong lòng mạch (IVUS) hoặc OCT (chụp cắt lớp quang học) để có thông tin chính xác.
- Có thể cần chụp MSCT động mạch vành sau đó để đánh giá tương quan giữa động mạch vành và các đại động mạch nhằm đưa ra hướng điều trị tiếp theo và giúp tiên lượng cho bệnh nhân.
2 Can thiệp tổn thương lỗ vào động mạch vành
2.1 Tổng quan
Đặc điểm của tổn thương lỗ vào động mạch vành thường là các tổn thương xơ, vôi hóa và tương đối cứng. Vì vậy sau khi nong bóng, tổn thương có xu hướng nhanh chóng bị tái hẹp lại. Do hẹp ngay tại lỗ vào nên chụp động mạch vành ở những trường hợp này tương đối khó khăn bởi khó chọn lọc sonde chụp vào lỗ động mạch vành và nếu chọn lọc được thì lại gây ra tụt áp. Trong một số trường hợp, cần chụp không chọn lọc ở các xoang vành trái hoặc vành phải để đánh giá sơ bộ và tìm lỗ vào động mạch vành. Bên cạnh đó, vì tổn thương ngay tại lỗ vào nên cần lưu ý các biến chứng có thể xảy ra trong lúc chụp mạch vành và nong bóng, như lóc tách động mạch vành, tắc mạch vành cấp, tách thành động mạch chủ. Mặc dù đã có nhiều tiến bộ về các dụng cụ hỗ trợ can thiệp (IVUS, bóng cắt, stent…), can thiệp tổn thương lỗ vào vẫn là một kỹ thuật khó và có nhiều thách thức như: chọn Guiding phù hợp với tổn thương, điều chỉnh Guiding, chuẩn bị tốt tổn thương, định vị stent đúng vị trí để bao phủ hết lỗ vào, biến dạng stent,…
2.2 Định nghĩa và phân loại tổn thương
2.2.1 Định nghĩa
Tổn thương lỗ vào là tổn thương hẹp trên 50% trong vòng 3mm tính từ gốc mạch. Cần luôn lưu ý phân biệt với tình trạng co thắt mạch vành bằng cách bơm Nitroglycerin vào mạch vành và đánh giá kỹ lỗ vào khi kéo sonde chụp ra khỏi lỗ mạch vành. Trường hợp có nghi ngờ mức độ tổn thương lỗ vào động mạch vành, sử dụng các phương pháp chẩn đoán hình ảnh và chức năng (IVUS, FFR) giúp chẩn đoán xác định và đưa ra quyết định can thiệp mạch vành.
2.2.2 Phân loại
Tổn thương lỗ vào mạch vành có thể được phân loại theo vị trí như tổn thương lỗ vào từ phía động mạch chủ và tổn thương lỗ vào nhánh bên. Tổn thương lỗ vào từ phía động mạch chủ (gọi tắt là tổn thương lỗ vào) liên quan đến phần tiếp giáp giữa động mạch chủ và lỗ của động mạch vành phải, thân chung động mạch vành trái, hoặc cầu vành. Về mặt mô học lỗ vào động mạch vành có cấu tạo gần giống như thành động mạch chủ là giàu tế bào cơ trơn và sợi đàn hồi. Tổn thương lỗ vào động mạch vành đơn độc thường gặp hơn ở phụ nữ và hay gặp ở động mạch vành phải hơn là ở thân chung động mạch vành trái.
Tổn thương lỗ vào nhánh bên liên quan đến điểm giao nhau giữa thân chung động mạch vành và lỗ của một nhánh chính (tổn thương lỗ vào LAD hoặc LCx). Trong phần này, chúng ta đề cập đến can thiệp tổn thương lỗ vào từ phía động mạch chủ.
.jpg)
Chú thích: RCA: Động mạch vành phải; LMS: Thân chung ĐMV; LCx: Động mạch mũ; LAD: Động mạch vành trái; SVG: Cầu nối tĩnh mạch, OM: nhánh bờ động mạch mũ.
2.3 Những khó khăn về giải phẫu và quá trình can thiệp
- Khó đặt guiding can thiệp và giữ guiding ở vị trí thích hợp mà không gây tụt áp.
- Nhiều mô xơ đàn hồi ở lỗ vào nên dễ bị hẹp lại.
- Thay đổi hướng của động mạch vành so với động mạch chủ.
- Rất khó để định vị stent chính xác.
- Hệ thống các thiết bị can thiệp di chuyển theo chu kỳ tim và nhịp thở, nhất là trường hợp can thiệp hẹp lỗ vào RCA qua động mạch
- Không có thiết kế stent nào có thể loe ra để bao phủ hết phần lỗ vào hình phễu.
- Dễ biến dạng stent (kéo giãn, chùn stent) trong quá trình thao tác bóng nong, ống thông can thiệp.
2.4 Lựa chọn dụng cụ và một số lưu ý khi can thiệp
- Guiding can thiệp:
- Nên chọn guiding với lực hỗ trợ không quá mạnh sẽ tạo ra sự đồng trục tốt và không vào quá sâu dễ gây ra tổn thương mạch vành, đồng thời dễ rút ra trong quá trình đặt stent để căn chỉnh stent
- Chọn guiding có lỗ bên với trường hợp hẹp gần tắc lỗ vào. Nếu không có guiding đục lỗ sẵn của nhà sản xuất, có thể tự đục lỗ bên nhưng cần làm cẩn thận để tránh gây ra các gờ phía trong lòng guiding làm cản trở việc đẩy bóng hoặc
- Lựa chọn Guiding còn phụ thuộc vào hướng xuất phát của mạch vành và một số yếu tố khác như mức độ vôi, tổn thương khác ở phía xa,…
- Điều khiển Guiding:
- Không nên để guiding tì mạnh vào lỗ vào hoặc vào quá sâu.
- Trường hợp lỗ vào hẹp khít, luồn sẵn wire can thiệp vào guiding trước khi đặt guiding để nhanh chóng đẩy wire qua tổn thương nhằm giảm thiểu thời gian tụt áp lực do ống thông.
- Có thể dùng thêm wire thứ 2 song song với wire thứ nhất để làm tăng sự ổn định của
- Kỹ thuật “Thả trôi dây dẫn” (Floating wire) để định vị chính xác lỗ vào mạch vành: một wire đưa vào mạch vành, wire số 2 đẩy vào động mạch chủ. Wire số 2 này giúp cho guiding không vào sâu trong lòng mạch và giúp nhận định rõ lỗ vào mạch vành để định
- vị stent chính xác đồng thời wire số 2 cũng giúp ổn định guiding tránh bị di động theo nhịp thở hoặc chu chuyển tim.
- Khi đã đưa được bóng, stent đến vị trí tổn thương, nhẹ nhàng rút guiding ra động mạch chủ và thực hiện lên bóng, stent. Sau đó, trong thì xuống bóng và rút bóng ra cần nhẹ nhàng đẩy guiding luồn vào mạch vành để tránh tổn thương đầu stent (tận dụng quả bóng như “đường ray” để dẫn đường cho guiding).
- Bóng nong: bóng áp lực thường, bóng áp lực cao hoặc các loại bóng chuyên dụng khác như bóng cắt, bóng quấn lưới kim loại để chuẩn bị tổn thương tốt hơn.
- Thiết bị khác: thiết bị khoan phá mảng xơ vữa, microcatheter, guiding hỗ trợ đẩy sâu,… trong những trường hợp cần thiết.
2.5 Những bước thực hiện kỹ thuật quan trọng
- Chuẩn bị tổn thương:
- Với đặc điểm tổn thương lỗ vào có nhiều thành phần như vôi và các mô xơ đàn hồi nên việc nong bóng thường hoặc bóng áp lực cao thường không làm nở đầy đủ tổn thương, do vậy nên sử dụng bóng cắt hoặc bóng quấn lưới kim loại.
- Khoan mảng xơ vữa trong trường hợp tổn thương vôi hóa nặng
- Trường hợp tái hẹp stent lỗ vào, sử dụng Laser tỏ ra có hiệu quả khá tốt
- Định vị stent:
- Do guiding phải rút ra trong khi đặt stent lỗ vào nên việc bơm cản quang để xác định vị trí stent sẽ khó. Bên cạnh việc căn chỉnh stent ở nhiều góc chụp khác nhau, việc tận dụng những bóng vôi ở lỗ vào cũng giúp ích cho bác sĩ.
- Trường hợp stent di động mạnh, có thể kết hợp thêm phương pháp lên nhẹ stent với áp lực thấp (1-2 atm) và rút dần stent về đến đúng vị trí rồi lên stent với áp lực
- Những stent nhìn “mờ” trên màn tăng sáng, chọn chế độ máy chụp mạch có mức chiếu tia mạnh hoặc dùng chế độ “stent boost” để làm tăng độ cản
- Một thiết bị giúp bác sĩ định vị stent tại lỗ vào thuận lợi hơn là thiết bị Ostial Pro (Hình 9). Thiết bị này giúp ổn định guiding và không cho guiding vào sâu trong động mạch vành (tương tự như kỹ thuật Floating wire nhưng thiết bị này cho phép guiding được ổn định hơn nhiều), tuy vậy trong thực tế thiết bị này ít được sử dụng.

- Nở stent:
- Stent nên được định vị lồi vào động mạch chủ 1-2mm để tránh hiện tượng “recoil” của tổn thương làm stent bị hụt lỗ vào.
- Tránh sử dụng stent quá ngắn (<12mm) để bao phủ hết tổn thương và hạn chế stent di chuyển.
- Chọn cỡ stent với tỷ lệ 1:1 so với đường kính mạch máu rồi lên stent với áp lực cao trên 12atm để đảm bảo áp thành tốt.
- Đặt stent ở lỗ vào LM cần lên và xuống bóng nhanh để giảm thời gian bóng bịt tắc LM gây ra tình trạng không tưới máu hệ mạch vành trái.
- Dùng bóng to hơn kích thước stent (khoảng hơn 0,5mm) để nong bóng với một phần bóng nằm trong động mạch chủ làm loe đầu stent áp sát vào lỗ mạch vành.
- Đối với can thiệp tổn thương ở lỗ vào, nên sử dụng IVUS để đánh giá trước can thiệp cũng như tình trạng nở/áp thành của stent sau khi đặt.
2.6 Vị trí của stent lỗ vào
Vị trí của stent tại lỗ vào chính xác nhất là tại vị trí sao cho toàn bộ chu vi của đầu gần stent nằm trong vùng lỗ vào – động mạch chủ (trong vòng 1mm so với của mặt phẳng lỗ vào – động mạch chủ).
Stent hụt lỗ vào hoặc quá lồi vào động mạch chủ là tình trạng stent sau khi nở, đầu gần của stent nằm hoàn toàn ở phía sau hoặc phía trước của vùng lỗ vào- động mạch chủ (Hình 24.10). Biến chứng này đòi hỏi phải đặt thêm stent trong trường hợp hụt lỗ hoặc nguy cơ tạo huyết khối và khó can thiệp lại nếu stent lồi vào động mạch chủ quá nhiều.
Sử dụng các phương tiện chẩn đoán hình ảnh trong mạch vành (IVUS, OCT) giúp lựa chọn stent chính xác hơn và làm giảm tỷ lệ đặt stent bị hụt hoặc quá lồi vào động mạch chủ.

2.7 Một số biến chứng hay gặp khi can thiệp tổn thương lỗ vào
- Lóc tách động mạch vành do
- Stent đặt không đúng vị trí tối ưu.
- Stent không nở tối ưu.
- Về lâu dài, tỷ lệ tái hẹp stent
- Nguy cơ mất nhánh bên nếu có.
- Rơi stent trong một số tình huống phức tạp.
Chú thích: RCA: Động mạch vành phải;LCx: Động mạch mũ;LAD: Động mạch liên thất trước, LM: thân chung động mạch vành trái.
3 Can thiệp cầu nối chủ vành (CABG)
3.1 Giới thiệu
Phẫu thuật bắc cầu nối chủ vành (CABG) là một phương pháp hiệu quả để điều trị những tổn thương mạch vành có giải phẫu phức tạp hoặc vôi hoá nặng không thích hợp cho can thiệp qua da. Gần đây, với sự tiến bộ trong phẫu thuật như sử dụng các cầu nối động mạch, thời gian ngừng tim ngắn, ứng dụng kỹ thuật phẫu thuật xâm lấn tối thiểu, CABG đã được thực hiện thường quy và đem lại hiệu quả tốt cho bệnh nhân. Ngoài ra, kết hợp điều trị nội khoa với thuốc chống kết tập tiểu cầu và statin kéo dài giúp làm tăng tuổi thọ cho cầu nối. Tuy vậy, sau 10 năm, một nửa số cầu tĩnh mạch và khoảng 10% cầu động mạch vú trong bị tắc.
Đối với phẫu thuật CABG lần hai, ngay cả ở những trung tâm có kinh nghiệm nhất, nguy cơ tử vong và nhồi máu cơ tim không tử vong cao gấp ba lần so với phẫu thuật lần đầu tiên. Ngoài ra, phẫu thuật lần hai làm giảm triệu chứng đau ngực ít hơn lần đầu tiên và giảm độ bền của cầu nối mới. Do vậy với những bệnh nhân có triệu chứng sau CABG, phương án can thiệp mạch tự nhiên được ưu tiên đặt ra mặc dù việc can thiệp cũng gặp nhiều khó khăn, trường hợp không thể can thiệp được mạch tự nhiên, can thiệp cầu nối được xem xét đến.
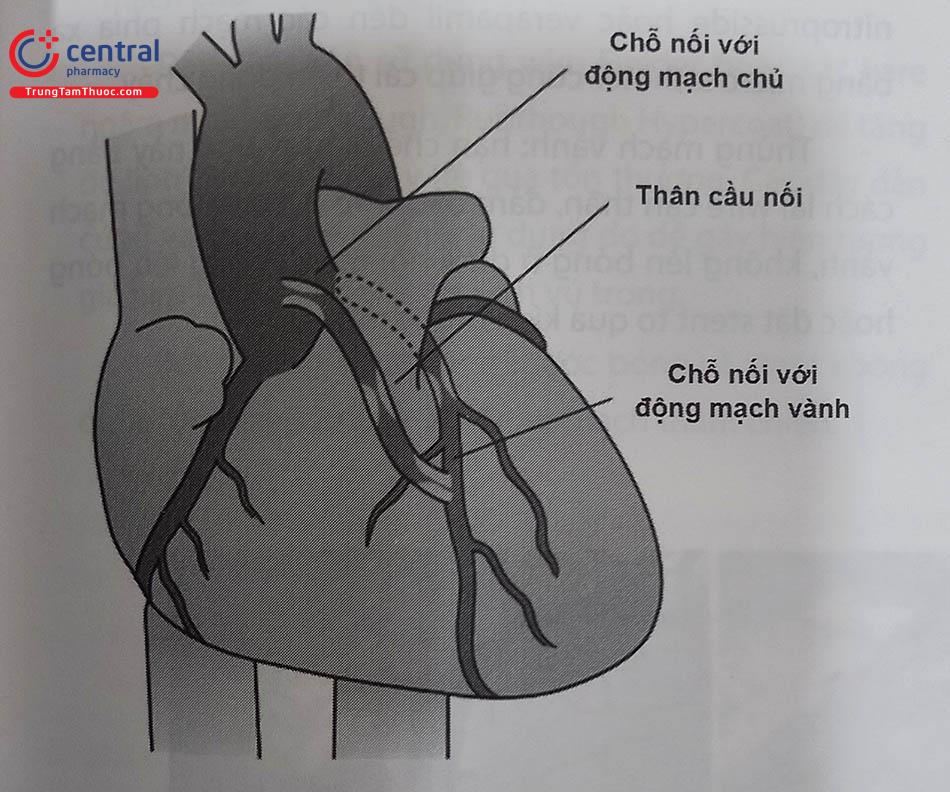
3.2 Can thiệp cầu nối tĩnh mạch (SVG)
3.2.1 Khái niệm cơ bản
- Với cầu SVG sau 03 năm, tỷ lệ can thiệp thành công không cao và những trường hợp can thiệp lỗ vào SVG chỗ nối với động mạch chủ có nguy cơ lớn thuyên tắc đoạn
- Không nên can thiệp tổn thương tắc mạn tính SVG ở bệnh nhân có triệu chứng, trừ khi có cơ hội can thiệp thành công (còn thấy được vệt chảy xuôi dòng nhỏ) và không thể can thiệp trên mạch vành tự nhiên (khuyến cáo ACC/AHA loại III).
- Đa số các thử nghiệm ngẫu nhiên có đối chứng ủng hộ việc sử dụng stent phủ thuốc so với stent thường trong can thiệp
- Hướng dẫn của ACC/AHA năm 2011: khuyến cáo sử dụng thiết bị bảo vệ chống huyết khối đầu xa (EPD) (loại I) trong các can thiệp SVG; tuy nhiên, dữ liệu gần đây không ủng hộ việc sử dụng thường xuyên EPD trong các can thiệp SVG, ngoại trừ trường hợp giải phẫu có nguy cơ cao như cầu nối bị thoái hóa nặng hoặc tổn thương huyết khối.
3.2.2 Lựa chọn thiết bị can thiệp
- Guiding can thiệp:
- Với cầu nối bên trái: sử dụng Guiding AR2, IM, AL 0,75, AL1 hoặc AL
- Với cầu nối bên phải: sử dụng Guiding MP1, AR2, AL 0,75 hoặc AL
- Wire: wire thông thường (như Runthrough) hoặc wire của EPD (FilterWire) nếu khả thi về mặt kỹ thuật.
- Bóng nong/stent: kích thước bóng và stent không lớn hơn đường kính tham chiếu của cầu nối.
3.2.3 Lựa chọn góc chụp
- Các góc chụp ban đầu là nghiêng trái đơn thuần cho tất cả các ca chụp cầu vành
- Góc chụp tiếp theo phụ thuộc vào vị trí cầu nối với mạch vành tự nhiên:
- Cầu nối vào LCX hoặc OM: chếch chân nghiêng phải hoặc chếch chân thẳng mặt.
- Cầu nối vào LAD hoặc Diagonal: nghiêng phải chếch đầu hoặc thẳng mặt chếch đầu.
- Cầu nối vào PDA: nghiêng trái chếch đầu hoặc thẳng mặt chếch đầu.
3.2.4 Thực hiện kỹ thuật
- Đặt guiding can thiệp ồng trục với lỗ vào cầu vành.
- Bơm chậm qua guiding các thuốc giãn mạch (verapamil, nitroprusside, Nicardipine, hoặc adenosine) để đề phòng hiện tượng dòng chảy chậm.
- Đưa dây dẫn 0,014 ” qua tổn thương.
- Thiết bị bảo vệ đoạn xa (EPDs) có thể được xem xét trong một số trường hợp nếu nguy cơ thuyên tắc đoạn xa cao. Đánh giá kích thước đoạn xa để lựa chọn EPD phù hợp. (Xin xem thêm phần “Can thiệp tổn thương có huyết khối” về giới thiệu một số EPD này).
- Đặt stent trực tiếp được ưu tiên cho tất cả các can thiệp SVG để giảm thiểu nguy cơ thuyên tắc đoạn
- Nếu khó đẩy stent qua vùng tổn thương, thực hiện các bước
- Khi đẩy stent cần bảo bệnh nhân thực hiện động tác hít sâu.
- Sử dụng một quả bóng nhỏ áp lực thường kích thước 2,0-2,5mm x 12-15 mm nong tổn thương.
- Sử dụng kỹ thuật hai dây dẫn (buddy wire). Nếu sử dụng EPD thì phải đảm bảo stent được đưa qua dây dẫn của EPD và cần rút wire bên cạnh ra trước khi lên
- Nếu đã dùng tất cả các kỹ thuật trên mà không đẩy stent qua được tổn thương, sử dụng guiding hỗ trợ đẩy sâu (Guideliner, Guidezilla) với đường kính nhỏ nhất có thể.
- Tránh nong bóng với áp lực quá cao sau đặt stent (không nên vượt quá 14 atm).
- Không nong bóng hoặc đặt stent to quá kích thước mạch. Có thể dùng IVUS/OCT để đánh giá tổn thương cầu SVG, đo đạc kích thước và chọn cỡ stent/bóng hợp lý.
3.2.5 Biến chứng
- Mất dòng: có nhiều nguyên gây mất dòng nhưng chủ yếu là thuyên tắc mạch đoạn xa do huyết khối. Sử dụng EPD ở những trường hợp cầu nối nguy cơ cao có thể hạn chế biến chứng này. Ngoài ra, bơm trực tiếp nitroprusside hoặc Verapamil đến các mạch phía xa bằng microcatheter cũng giúp cải thiện dòng chảy.
- Thủng mạch vành: hạn chế biến chứng này bằng cách lái wire cẩn thận, đảm bảo wire ở trong lòng mạch vành, không lên bóng ở dưới nội mạc, không lên bóng hoặc đặt stent to quá kích thước mạch.
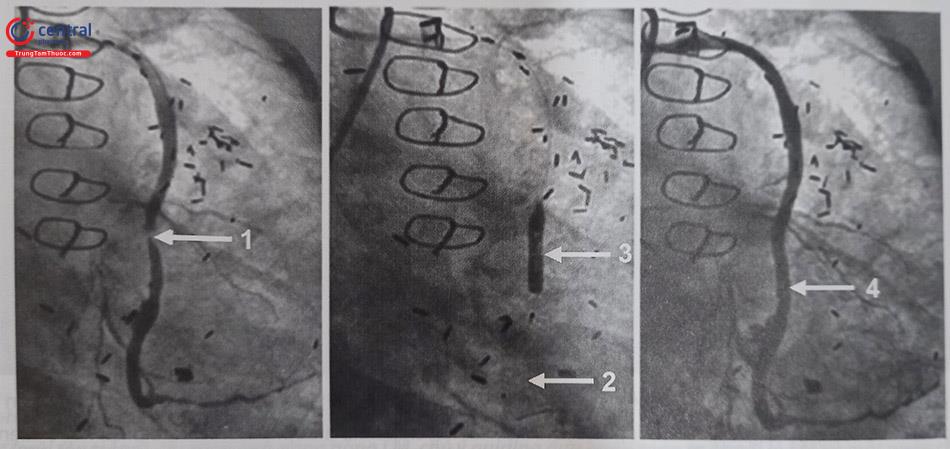
Chú thích: SVG: cầu nối tĩnh mạch; LCx: động mạch mũ; DES: stent phủ thuốc.
3.3 Can thiệp cầu nối động mạch
3.3.1 Khái niệm cơ bản
Cầu nối động mạch thường gặp là cầu nối từ động mạch vú trong trái (LIMA). Tỷ lệ hẹp của loại cầu nối này không cao, khoảng 5–10% sau 10 năm.
Can thiệp cầu nối động mạch có tỷ lệ thành công
Với can thiệp cầu LIMA, tỷ lệ mất dòng, thuyên tắc đoạn xa, nhồi máu cơ tim cấp, hoặc phẫu thuật bắc cầu nối chủ vành (CABG) khẩn cấp thấp hơn so với can thiệp cầu nối tĩnh mạch.
Thông thường, can thiệp không thành công thường liên quan đến khó hoặc không lái được wire qua tổn thương do giải phẫu cầu nối không thuận lợi: xoắn hoặc có đường đi phức tạp.
3.3.2 Dụng cụ can thiệp
- Guiding: nên sử dụng các guiding ngắn hơn thông thường (nếu có) để tiếp cận các tổn thương vì cầu nối từ động mạch vú trong dài, ngoằn ngoèo nên đoạn đường từ đầu guiding đến tổn thương dài hơn so với can thiệp các tổn thương mạch tự nhiên, trong khi độ dài thân của bóng/stent có giới hạn nên nhiều trường bóng/ stent không đủ độ dài để đưa tới tổn thương nếu dùng guiding thông thường.
- Với cầu nối từ động mạch vú trong trái (LIMA): sử dụng guiding IM 90
- Với cầu nối từ động mạch vú trong phải (RIMA): sử dụng guiding 3DRC
- Với cầu là động mạch quay: thường dùng guiding AR2 đối với cầu nối ở phía bên trái động mạch chủ và guiding MP1 đối với cầu nối ở phía bên phải động mạch chủ.
- Dây dẫn: nên sử dụng wire Fielder hoặc các wire ngậm nước (Runthough, Runthough Hypercoat) để tăng độ linh hoạt và dễ lái wire qua tổn thương. Các dây dẫn cứng và thẳng nên tránh sử dụng do dễ gây hiện tượng giả hẹp khi lái qua động mạch vú
- Bóng nong/stent: kích thước bóng và stent không được lớn hơn đường kính động mạch tham chiếu.
3.3.3 Đường vào mạch máu
Cầu LIMA: động mạch quay trái hoặc động mạch đùi.
Cầu RIMA: động mạch quay phải hoặc động mạch đùi.
3.3.4 Lựa chọn góc chụp
- Góc chụp ban đầu để đồng trục ống sonde hay guiding: góc chụp
- Các góc chụp tiếp theo phụ thuộc vào cầu nối là RIMA hay LIMA và nối tới mạch tự nhiên nào:
- Với lỗ vào LIMA: góc AP hoặc nghiêng phải hay nghiêng trái từ 45 tới 60 độ.
- Vị trí nối của LIMA với mạch tự nhiên: AP chếch đầu hoặc nghiêng phải.
- Vị trí nối của RIMA với mạch tự nhiên: góc chụp phụ thuộc vào động mạch tự nhiên được bắc cầu tới.
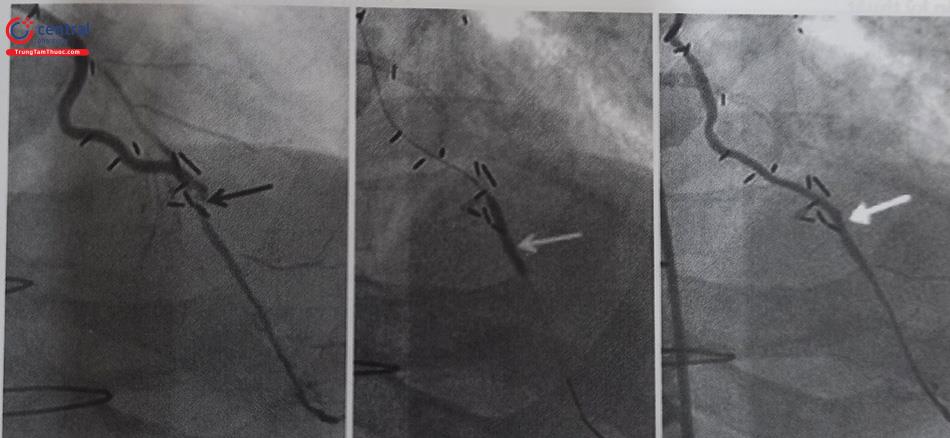
Chú thích: LIMA: động mạch vú trong trái; LAD: động mạch liên thất trước; DES: stent phủ thuốc.
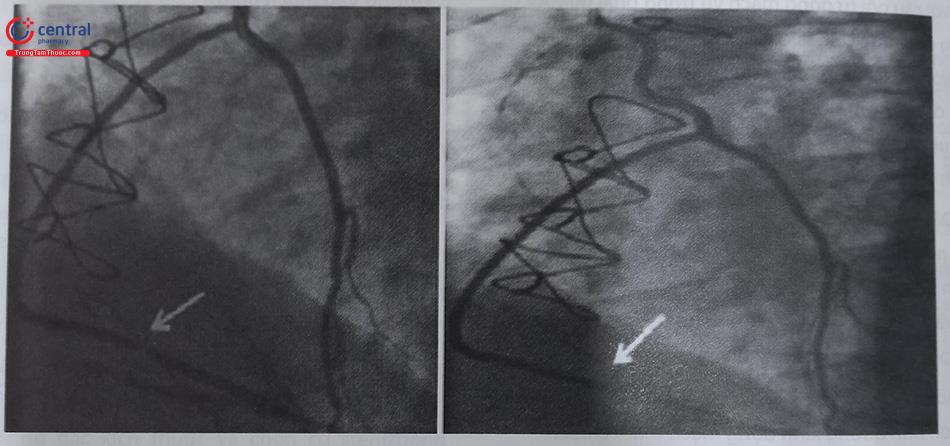
Chú thích: RIMA: động mạch vú trong phải; PDA: động mạch liên thất sau
3.3.5 Thực hiện kỹ thuật
- Đặt guiding có thể khó khăn. Điều quan trọng là cần tránh lóc tách lỗ vào các cầu động mạch, nhất là khi cầu nối IMA (động mạch vú trong) là mạch chính tưới máu cho
- Tránh co thắt khi đặt guiding: bơm nitroglycerin hoặc verapamil vào động mạch khi đặt guiding
- Tránh đẩy guiding quá sâu khi đặt guiding vào IMA, có thể gây lóc tách đoạn đầu
- Luôn theo dõi sát áp lực khi đặt guiding và can thiệp cầu
- Bơm chất cản quang bằng tay nhẹ nhàng vào IMA điều chỉnh vị trí guiding và để lái dây dẫn ngậm nước 0,014 ″ qua tổn thương.
- Trường hợp gặp khó khăn khi đặt guiding vào cầu LIMA:
- Nếu đường vào xoắn vặn nhiều, sử dụng long sheath ngay từ đường vào mạch máu.
- Ngửa đầu bệnh nhân một góc 45 tới 90 độ giúp làm thẳng động mạch dưới đòn và đặt guiding dễ dàng hơn.
- Có thể cần sử dụng bóng nhỏ hoặc microcatheter để lái
- Một số trường hợp, dùng wire dài 300 cm 0,014″ để đổi từ sonde chụp chẩn đoán sang guiding can thiệp.
- Trong các trường hợp khó đẩy dụng cụ có thể sử dụng GuideLiner/Guidezilla để hỗ trợ và dùng Guiding có đầu định hướng (Venture hoặc Supercross) để giúp việc can thiệp dễ dàng hơn.
3.3.6 Các biến chứng
- Lóc tách hoặc thủng động mạch vú trong (IMA): với những trường hợp can thiệp IMA cần chuẩn bị covered stent và sự hỗ trợ của phẫu thuật khi cần.
- Co thắt mạch.
- IMA dễ bị co thắt, do đó cần bơm thuốc giãn mạch vào trực tiếp trong lòng mạch (nitroglycerin hoặc thuốc chẹn kênh canxi).
- Xảy ra khi wire cứng làm duỗi thẳng các đoạn mạch khúc khuỷu làm co thắt của mạch máu. Trong những trường hợp như vậy, kéo phần mềm của wire tới vùng nghi tổn thương và bơm thuốc giãn mạch giúp phân biệt có hay không hẹp.
- Đảm bảo wire luôn nằm trong lòng mạch và kích thước bóng và stent không được lớn hơn đường kính mạch tham chiếu để tránh gây vỡ mạch.
Chú thích: LIMA: động mạch vú trong trái.
3.4 Một số lưu ý khi can thiệp cầu nối
- Cần cân nhắc kỹ lưỡng quyết định làm can thiệp cầu nối vì mức độ khó cao hơn nhiều so với can thiệp mạch tự nhiên.
- Ưu tiên can thiệp mạch vành tự nhiên nếu còn khả thi hơn là can thiệp cầu nối, đặc biệt trong trường hợp cầu SVG bị thoái hóa.
- Tránh nong bóng trước, trừ khi tổn thương bị hẹp
- quá nặng hoặc đã được đặt thiết bị EPD.
- Xem xét dùng EPD trong các trường hợp khả thi về mặt kỹ thuật.
- Sử dụng các thuốc giãn mạch/vi mạch ngay từ đầu, trước khi nong bóng/đặt
- Tránh đặt stent quá to với đường kính lòng mạch, nếu có thể nên dùng IVUS/OCT để lựa chọn kích thước stent chính xác.
- Tránh nong bóng sau đặt stent với áp lực quá cao và chọn kích thước bóng có tỷ lệ 1:1 so với stent
- Thực hiện nong stent và nong bóng chậm và kéo dài ở áp lực thấp.
- Cân nhắc đặt stent hơi nhỏ nhưng chiều dài của stent dài hơn để tránh hiện tượng mảng xơ vữa bị đẩy lồi vào lòng mạch qua mắt
- Giữ thời gian hoạt hoá đông máu (ACT) ở mức giá trị cao của ngưỡng chống đông
- Sử dụng liệu pháp kháng tiểu cầu kép kéo dài dựa trên thang điểm DAPT, vì can thiệp SVG được coi là can thiệp có nguy cơ cao đối với các biến cố thiếu máu cục bộ.
4 Can thiệp tổn thương huyết khối động mạch vành
4.1 Tổng quan
Trong cơ chế bệnh sinh của hội chứng động mạch vành cấp, sự nứt vỡ của mảng xơ vữa đã kích hoạt một loạt phản ứng tạo huyết khối trong lòng mạch vành. Huyết khối được tạo thành trên cơ sở phát triển của mạng lưới fibrin chằng chịt và “bắt giam” các thành phần của dòng máu vào trong đó như tiểu cầu, hồng cầu, các chất gây co mạch, các yếu tố đông máu,… Quá trình này tạo thành cục máu đông gây hẹp một phần hoặc tắc hoàn toàn lòng mạch.
Tổn thương mạch vành có huyết khối là một yếu tố tiên lượng xấu cho can thiệp động mạch vành do làm giảm tỷ lệ can thiệp thành công, kéo dài thời gian làm thủ thuật, tăng tỷ lệ tắc mạch phía xa, tắc vi mạch, giảm tưới máu cơ tim. Qua đó gây tổn thương cơ tim nhiều hơn, huyết khối trong stent, gia tăng số lần nhập viện, tăng tỉ lệ biến chứng, nhồi máu cơ tim tái phát trong 6 tháng và tử vong. Vì vậy, đánh giá đầy đủ gánh nặng huyết khối và giải phẫu mạch vành sẽ giúp lập kế hoạch can thiệp được hiệu quả.
4.2 Giải phẫu bệnh của tổn thương huyết khối
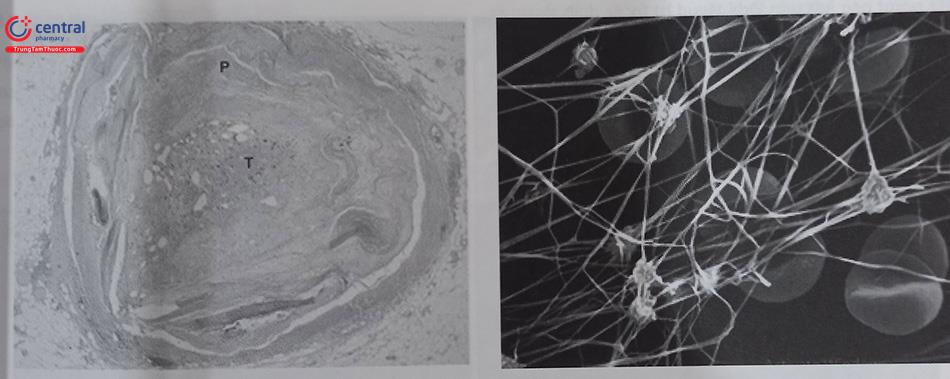
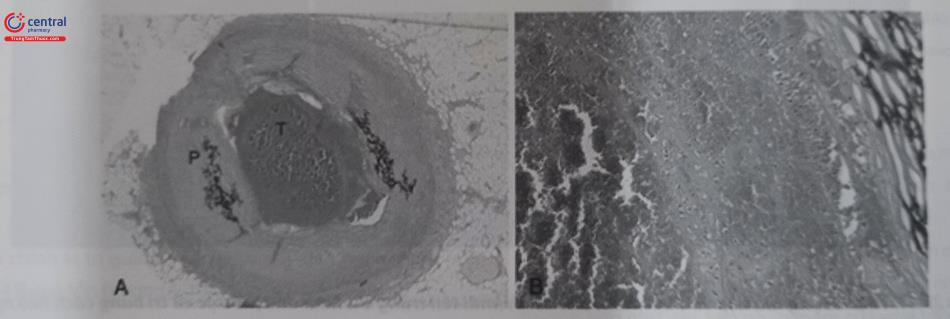
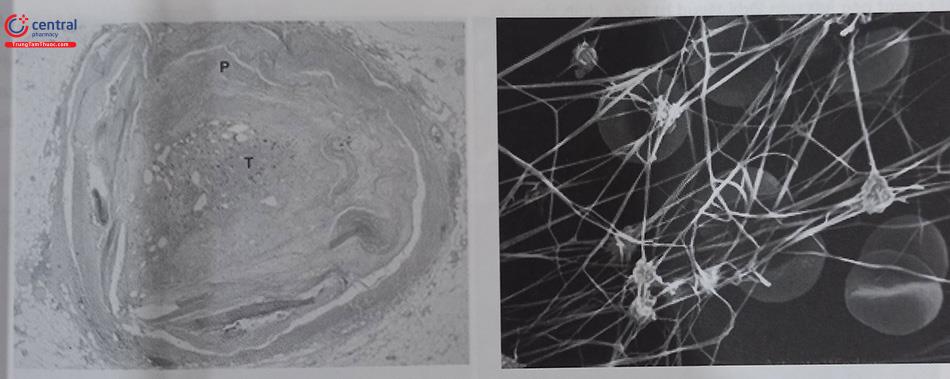
Huyết khối mới hình thành có độ bám dính vào thành mạch ít hơn, do đó thuận lợi cho việc lấy huyết khối. Ngược lại, với huyết khối đã tồn tại nhiều ngày thì độ bám vào thành mạch tăng lên, nhiều thành phần của huyết khối mất dần liên kết nên lỏng lẻo và dễ bị bong thành nhiều mảnh nhỏ hơn. Hình dưới đây cho thấy hình ảnh vi thể và mạng lưới fibrin của huyết khối.
4.3 Chẩn đoán huyết khối trong động mạch vành
Chụp động mạch vành qua da là phương pháp hiệu quả cũng như là tiêu chuẩn vàng thực tế để nhận biết huyết khối. Các đặc điểm của huyết khối bao gồm: giảm mật độ cản quang, nhạt màu so với mạch, hình mờ trong mạch vành lúc chụp, khối bên trong lòng mạch kèm theo viền, hình ảnh đọng thuốc sau chụp, hoặc một mặt lồi và nhẵn tại vị trí của huyết khối tắc hoàn toàn (Hình 24.20).
Tuy nhiên trong một số trường hợp, chẩn đoán xác định huyết khối rất khó nếu chỉ dựa vào phim chụp mạch vành như: huyết khối nhỏ, tổn thương kèm vôi hoá, tổn thương trên nền mạch vành phình giãn, vị trí nghi huyết khối bị chồng hình, hoặc chất lượng hình ảnh kém nếu bệnh nhân quá béo, giãn phế nang,… Khi đó, các kỹ thuật như IVUS/OCT được sử dụng và đây là những công cụ rất hữu ích để đánh giá sự có mặt của huyết khối cũng như thành phần mảng xơ vữa và các đo đạc cần thiết khác.
4.4 Phân loại tổn thương huyết khối
Phân loại huyết khối được dùng phổ biến là hệ thống phân loại của nhóm nghiên cứu TIMI. Phân loại này sẽ giúp đánh giá đầy đủ gánh nặng huyết khối nhằm giúp bác sĩ đưa ra quyết định sẽ xử trí huyết khối như thế nào trong khi can thiệp. Theo đó, phương pháp phân loại TIMI chia huyết khối trên phim chụp từ mức độ 0 tới 5.
Phân độ huyết khối
Phân loại huyết khối theo TIMI
» Độ 0. Không thấy huyết khối
» Độ 1. Có thể là huyết khối: các đặc điểm chụp mạch bao gồm giảm mật độ thuốc cản quang; đám mờ trong mạch vành; đường viền tổn thương không đều; hoặc một mặt khum nhẵn, lồi ở vị trí tắc toàn bộ gợi ý, nhưng không chẩn đoán được huyết khối
» Độ 2. Huyết khối xác định: hiện diện trong nhiều góc chụp; đường viền tổn thương không đều bao quanh một khối; kích thước lớn nhất nhỏ hơn một nửa đường kính mạch máu
» Độ 3. Huyết khối xác định trong nhiều góc chụp với kích thước lớn nhất hơn một nửa đường kính lòng mạch nhưng nhỏ hơn hai lần đường kính lòng mạch
» Độ 4. Huyết khối lớn xác định với kích thước lớn nhất hơn gấp đôi đường kính lòng mạch
» Độ 5. Huyết khối gây tắc hoàn toàn lòng mạch
Ngoài ra, mức độ huyết khối được đánh giá theo thang điểm hai mức (*):
• Mức huyết khối nhẹ tương ứng với phân độ TIMI từ 1 đến 3
• Mức huyết khối nặng tương ứng với phân độ TIMI 4 và 5
(*) From Niccoli G, Spaziani C, Marino M, et al: Effect of chronic Aspirin therapy on angiographic thrombotic burden in patients admitted for a first ST-elevation myocardial infarction. Am J Cardiol 105:587-591, 2010.
Phân loại huyết khối theo TIMI đánh giá mức độ huyết khối giúp bác sĩ lâm sàng có thái độ xử trí phù hợp và giúp cho các nghiên cứu được thuận lợi. Phân loại này có một số thuận lợi và hạn chế sau:
- Thuận lợi:
- Đánh giá dễ dàng trong khi chụp mạch vành.
- Là thang điểm hợp lý được áp dụng rộng rãi trên toàn cầu.
- Tạo sự thống nhất giữa bác sĩ trực tiếp làm thủ thuật và người quan sát.
- Tương quan tốt với kết quả lâm sàng nên giúp cho tiên lượng.
- Hệ thống phân loại rõ ràng với các thông số cụ thể giúp so sánh gánh nặng huyết khối giữa các hình ảnh chụp mạch vành với
- Hạn chế:
- Chỉ dựa vào đánh giá trực quan về huyết khối.
- Đánh giá thấp sự hiện diện và kích thước của huyết khối khi so sánh với
- Chủ yếu áp dụng cho các động mạch vành tự nhiên.
- Đánh giá thấp mức độ của huyết khối trong các cầu vành.
- Không thể phân biệt giữa các loại huyết khối.
- Không có khả năng phát hiện thành phần huyết khối của các tổn thương tắc mạn tính động mạch vành.
- Không định lượng hoặc định tính được gánh nặng của mảng xơ vữa.
4.5 Thuốc dùng trong điều trị các tổn thương huyết khối
Liệu pháp sử dụng thuốc để điều trị tổn thương huyết khối bao gồm heparin, aspirin, thienopyridine (clopidogrel, prasugrel, Ticagrelor), thuốc đối kháng thụ thể tiểu cầu GP IIb/IIIa, và thuốc ức chế thrombin trực tiếp. Lợi ích của những thuốc này đạt được trong cả trước và sau khi can thiệp để làm giảm nguy cơ thuyên tắc huyết khối đoạn xa và cải thiện kết quả PCI. Ví dụ liệu pháp aspirin kéo dài đã được chứng minh làm giảm gánh nặng huyết khối trước khi đặt stent; Heparin sử dụng để giảm hình thành fibrin và suy yếu lực hấp dẫn giữa các tiểu cầu; thuốc đối kháng GP IIb/IIIa có vai trò loại bỏ sự gắn của fibrinogen vào receptor trên tiểu cầu,… Tuy nhiên, với huyết khối đã hình thành, huyết khối đang mở rộng, đặc biệt là huyết khối mức độ nặng, các thuốc kể trên sẽ ít có vai trò hơn. Vì vậy đối với những bệnh nhân có gánh nặng huyết khối lớn cần sử dụng dụng cụ can thiệp chuyên dụng để hút huyết khối ra khỏi lòng mạch.
Thuốc giãn mạch: một số thuốc giãn mạch được bơm trực tiếp vào trong mạch vành có huyết khối trong PCI thì đầu với gánh nặng huyết khối lớn để giảm nguy cơ thuyên tắc đoạn xa và dòng chảy chậm. Các thuốc này được bơm vào mạch vành thông qua guiding can thiệp, hoặc thông qua các microcatheter và catheter hút huyết khối. Có thể sử dụng các loại thuốc như:
- Thuốc giãn mạch chủ yếu làm giãn động mạch mạch vành thượng tâm mạc có ít hoặc không ảnh hưởng đến vi tuần hoàn (ví dụ, nitroglycerin).
- Thuốc giãn mạch có hoạt tính hỗn hợp làm giãn cả động mạch lớn vùng thượng tâm mạc và các tiểu động mạch có sức cản nhỏ (ví dụ, nitroprusside).
- Thuốc giãn mạch chủ yếu làm giãn vi tuần hoàn mạch vành (ví dụ: adenosine; thuốc chẹn kênh Canxi như Diltiazem, verapamil, hoặc nicardipine).
Thuốc tiêu sợi huyết tại chỗ: về lý thuyết, việc bơm thuốc tiêu sợi huyết trong lòng mạch vành sẽ làm tăng nồng độ của thuốc tại vị trí huyết khối và có thể làm tan huyết khối hiệu quả hơn, đồng thời lại giảm nguy cơ chảy máu do lượng thuốc sử dụng ít hơn so với tiêu sợi huyết đường toàn thân. Nhưng các thử nghiệm lớn lại cho thấy sử dụng thuốc tiêu sợi huyết tại chỗ với bệnh nhân có gánh nặng huyết khối lớn trong can thiệp không cải thiện dòng chảy và không làm giảm các biến cố tim mạch chính so với can thiệp thông thường. Tuy nhiên đây cũng là một phương pháp có thể sử dụng trong bối cảnh không thể khai thông mạch vành do huyết khối quá nhiều.
4.6 Can thiệp tổn thương huyết khối
Nếu trên phim chụp mạch vành không có huyết khối rõ ràng, hoặc chỉ có huyết khối nhỏ (độ 1 hoặc 2), chiến lược PCI bao gồm nong bóng/đặt stent được thực hiện thường quy. Tuy nhiên, việc xử trí huyết khối đáng kể (độ 3) hoặc nặng (độ 4 và 5) là vấn đề khó và đòi hỏi kinh nghiệm của bác sĩ can thiệp. Khi nong bóng làm vỡ huyết khối sẽ tạo thành các mảnh nhỏ gây thuyên tắc và làm cản trở hoặc mất dòng chảy ở mạch phía xa, các nhánh bên và các vi mạch nuôi cơ tim. Theo nhiều nghiên cứu, tỷ lệ thuyên tắc đoạn xa xảy ra từ 6% đến 15% trong can thiệp hội chứng vành cấp và có liên quan đến gia tăng gấp bảy lần tỉ lệ nhồi máu cơ tim quanh thủ thuật. Trong hầu hết các trường hợp dòng chảy chậm sau can thiệp, hậu quả là gây thiếu máu cục bộ nghiêm trọng, nhồi máu vi mạch, phản ứng viêm và co thắt mạch, giảm dự trữ mạch vành và ảnh hưởng lớn đến phục hồi cơ tim cũng như khả năng cứu sống bệnh nhân. Mức độ huyết khối càng lớn thì nguy cơ càng cao bị dòng chảy chậm, mất dòng, thuyên tắc đoạn xa sau can thiệp, mặt khác huyết khối lớn cũng đi kèm với nguy cơ rơi huyết khối vào đại tuần hoàn khi hút. Trên thực tế, dòng chảy TIMI 3 sau can thiệp với các tổn thương huyết khối chỉ đạt được từ 28% đến 35% so với bệnh nhân can thiệp mạch vành thông thường. Do đó, huyết khối được coi như một nguồn vật chất nguy hiểm thúc đẩy các biến cố bất lợi và kết cục xấu nên cần được dự đoán và xử lý kịp thời trước, trong và sau can thiệp động mạch vành.
4.6.1 Hút huyết khối
Theo Khuyến cáo của Hội Tim mạch châu Âu năm 2017 về điều trị NMCT cấp có ST chênh lên, hút huyết khối thường quy ở mọi bệnh nhân là chống chỉ định. Tuy nhiên trên thực tế lâm sàng, nhiều bệnh nhân đến muộn, gánh nặng huyết khối lớn thì việc hút huyết khối vẫn là một lựa chọn hữu ích để giúp can thiệp mạch vành hiệu quả hơn.
-Hút huyết khối cơ học bằng tay
- Sử dụng những ống hút chuyên dụng để hút huyết khối, ngoài ra có thể dùng những ống thông lớn hơn để tăng hiệu quả (như ống thông ST). Cần lưu ý những điểm sau trong quá trình hút huyết khối động mạch vành:
- Đảm bảo guiding luôn nằm trong lỗ mạch vành trong suốt thời gian hút huyết khối để chắc chắn không có mảnh huyết khối nào rơi vào đại tuần hoàn.
- Bắt đầu hút âm trước khi đẩy ống hút qua huyết khối để tránh làm huyết khối bị trôi ra xa, có thể đẩy ống hút qua lại vài lần.
- Thay xilanh hút lớn hơn nếu cần.
- Luôn hút âm xilanh cho đến khi rút ống hút huyết khối ra khỏi hoàn toàn
- Trước khi rút ống hút huyết khối vào đầu guiding, nếu không chắc guiding còn nằm trong mạch vành, test một ít thuốc cản quang để khẳng định.
- Sau khi rút hoàn toàn ống hút huyết khối khỏi sheath, cần mở khoá chữ Y để cho máu chảy ngược ra ngoài, hoặc dùng xilanh hút máu ra để đảm bảo không có mảnh huyết khối nào nằm trong guiding và Chú ý: luôn kiểm tra áp lực của guiding sau mỗi lần hút huyết khối, nếu áp lực bị giảm nặng hoặc mất thì có khả năng mảnh huyết khối nằm trong và gây bít tắc guiding, khi đó cần rút toàn bộ hệ thống ra khỏi sheath và kiểm tra xem có huyết khối trong đó hay không.
- Luôn ghi nhớ: hút huyết khối có thể gây tắc mạch não.

- Hút huyết khối bằng máy
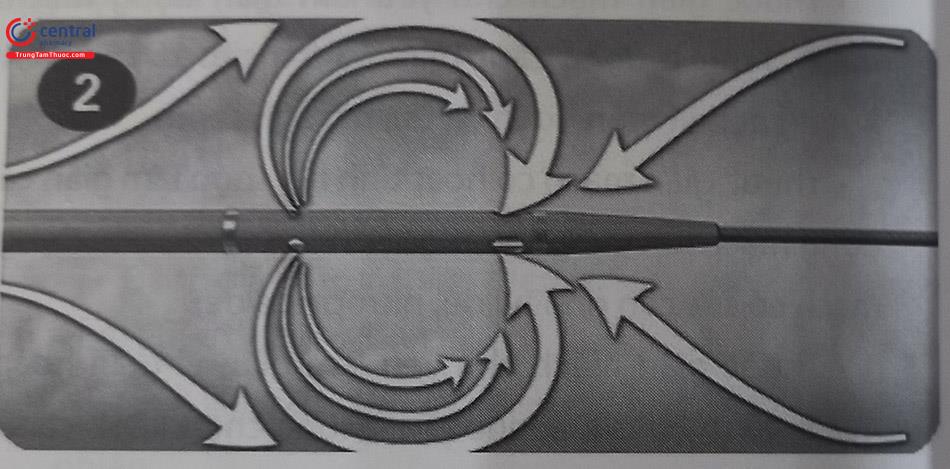
Thiết bị hút huyết khối bằng máy được sử dụng phổ biến nhất là hệ thống hút huyết khối Angiojet. Hệ thống Angiojet sử dụng các tia nước muối với tốc độ cao phun vào huyết khối làm tan huyết khối, đồng thời tạo ra lực hút mạnh ở đầu ống hút để hút huyết khối (hiệu ứng Venturi). Nghiên cứu JETSTENT (so sánh hút huyết khối bằng Angiojet trước khi đặt stent động mạch vành với đặt stent đơn thuần không hút huyết khối ở bệnh nhân nhồi máu cơ tim cấp) thu nhận 501 bệnh nhân STEMI có huyết khối nhìn thấy được (mức độ 1-5). Kết quả nghiên cứu không cho thấy sự khác biệt đáng kể giữa hai nhóm về giảm mức độ chênh đoạn ST, dòng chảy TIMI 3, hoặc kích thước ổ nhồi máu. Tuy nhiên, nhóm được lấy huyết khối cơ học bằng Angiojet đã giảm MACE ở 1 và 6 tháng và cải thiện tỷ lệ sống sót sau 1 năm. Ngoài ra theo nghiên cứu này, có thể thấy Angiojet có lợi ở những bệnh nhân có gánh nặng huyết khối lớn nhưng không có lợi ở nhóm bệnh nhân huyết khối ít. Tuy nhiên, do các ảnh hưởng vật lý rất mạnh của hệ thống Angiojet với mạch máu và dòng máu như lo ngại về tan máu, chấn thương mạch, vì thế tổng thời gian sử dụng thiết bị này được giới hạn trong 10 phút. Quá trình tan máu gây ra sự giải phóng Adenosine làm chậm nhịp tim, nên có thể cần đặt một dây tạo nhịp tạm thời, nhất là khi thực hiện hút huyết khối ở động mạch vành phải.
4.6.2 Lấy huyết khối bằng dụng cụ đặc biệt
Thiết bị lấy huyết khối Solitaire được dùng trong lấy huyết khối ở động mạch não có thể được sử dụng trong trường hợp huyết khối quánh và dính vào thành mạch vành nên không hút được. Lưu ý cần đảm bảo đủ thời gian nở ra của thiết bị này để có được khả năng lấy huyết khối tốt nhất.
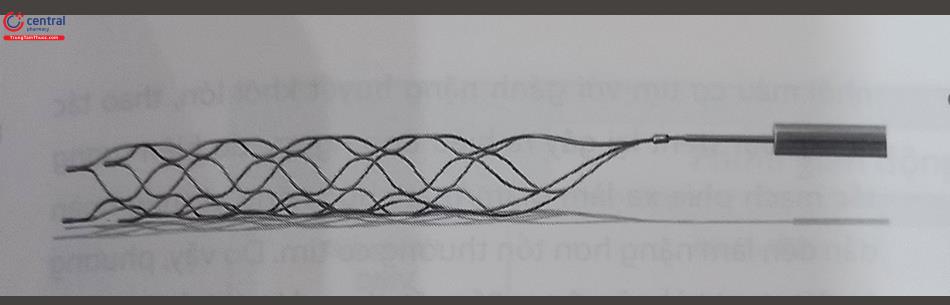
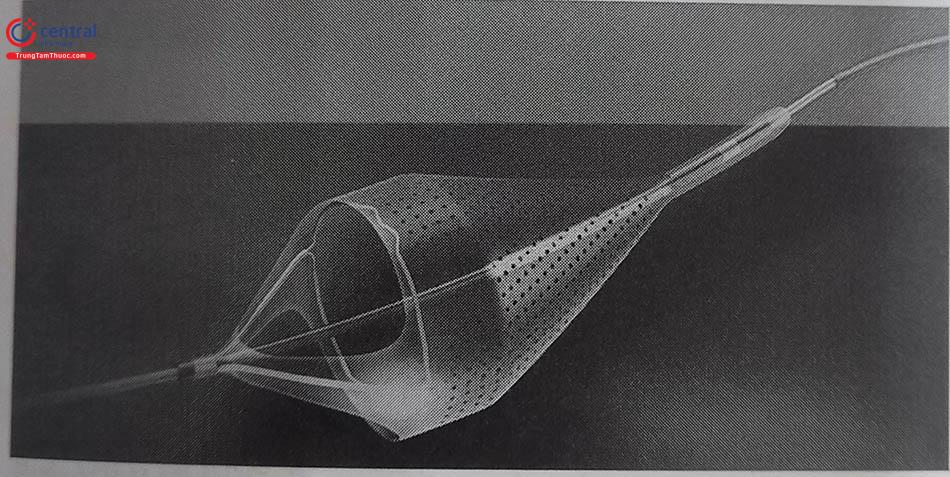
4.6.3 Dụng cụ bảo vệ ngăn tắc mạch đoạn xa (EPD)
Các dụng cụ bảo vệ ngăn tắc mạch đoạn xa EPD(Embolic Protection Device) đã được phát triển để giảm nguy cơ thuyên tắc mạch phía xa trong quá trình can thiệp cầu nối tĩnh mạch (SVG) và đặt stent động mạch cảnh. Vai trò của những thiết bị này đã được chứng minh trong can thiệp SVG, tuy nhiên chúng chưa được sử dụng rộng rãi trong can thiệp bệnh nhân STEMI. Một số loại EPD hay dùng được giới thiệu ở dưới đây.
4.6.4 Đặt stent động mạch vành
- Đặt stent trực tiếp
Chiến lược đặt stent trực tiếp trên thực tế có nhiều thuận lợi như làm giảm tỷ lệ thuyên tắc mạch phía xa do chỉ thực hiện thao tác tối thiểu và cố định huyết khối giữa stent và thành mạch vành, giảm thời gian thực hiện thủ thuật. Tuy nhiên nó cũng có một số nhược điểm: đánh giá sai kích thước thực sự của lòng mạch, không thể đưa stent đi qua tổn thương quanh co hoặc vôi hóa hoặc hẹp khít, đặt stent có thể sai vị trí cần đặt, stent không áp thành hoặc không nở hết làm tăng nguy cơ tái hẹp hoặc huyết khối trong stent.
Kết quả từ phân tích tổng hợp năm thử nghiệm với 754 bệnh nhân, đặt stent trực tiếp cải thiện được tưới máu cơ tim, bằng chứng là sự cải thiện đáng kể giảm chênh lên đoạn ST sau can thiệp và giảm tử vong do tim tại bệnh viện. Vì vậy, ở những bệnh nhân cụ thể, đặt stent trực tiếp với có hoặc không hút huyết khối, có thể được áp dụng một cách an toàn cho tình huống NMCT cấp.
- Vai trò của stent phủ thuốc.
Đặt stent mạch vành là kỹ thuật quan trọng được thực hiện trong PCI thì đầu để khôi phục dòng chảy và mở rộng mạch bị hẹp. So với stent thường (BMS), stent phủ thuốc thuốc (DES) làm giảm nguy cơ tái can thiệp mạch đích. Với những tiến bộ của công nghệ chế tạo stent, DES thế hệ mới cho thấy sự an toàn vượt trội, thậm chí cải thiện hiệu quả so với DES thế hệ đầu tiên, đặc biệt là giảm nguy cơ huyết khối trong stent và NMCT tái phát. Trong nghiên cứu so sánh các stent phủ thuốc Everolimus với stent thường trong nhồi máu cơ tim cấp có ST chênh lên (EXAMINATION), DES thế hệ mới đã được chứng minh có hiệu quả hơn hẳn BMS, chủ yếu là tiêu chí tái can thiệp stent. Ở một thử nghiệm khác, kết quả theo dõi 5 năm được công bố gần đây cho thấy giảm tỷ lệ tử vong do mọi nguyên nhân của DES so với BMS. Trong thử nghiệm Stent mạch vành Na Uy (NORSTENT), 9013 bệnh nhân thực hiện PCI (26% với STEMI) được chọn ngẫu nhiên dùng DES hoặc BMS. Không có sự khác biệt về tỷ lệ tử vong do mọi nguyên nhân hoặc nhồi máu cơ tim nguyên phát không tử vong sau 5 năm. Tuy nhiên, DES có liên quan đến tỷ lệ huyết khối trong stent thấp hơn (0,8% so với 1,2%; P = 0,0498)và tỷ lệ tái thông mạch đích thấp hơn (16,5% so với 19,8%; P <0,001) .
Vì vậy khuyến cáo của hội tim mạch châu Âu năm 2017 với NMCT ST chênh lên đã khuyến cáo đặt stent phủ thuốc thế hệ mới cho bệnh nhân (khuyến cáo IA)
– Stent đặc biệt chuyên dùng cho tổn thương huyết khối và cover stent
Stent MGuard (InspireMD,Tel-Aviv, Israel)được cấu tạo bởi khung stent thường và được phủ bởi một lưới polymer siêu mỏng với các mắt lưới rất nhỏ có tác dụng “giam” huyết khối giữa stent và thành mạch, giúp cố định huyết khối và làm huyết khối không bị lồi vào lòng mạch qua mắt stent, đồng thời vẫn bảo tồn được nhánh bên. Đây cũng là một ý tưởng tốt để đặt stent cho những trường hợp huyết khối nhiều không thể lấy ra hết.

Ngoài ra, đặt cover stent cũng theo nguyên lý tương tự stent MGuard, nhưng các thử nghiệm về cover stent trên bệnh nhân có gánh nặng huyết khối còn thiếu dữ liệu và chưa chứng minh lợi ích rõ ràng.
– Trì hoãn đặt stent
Đặt stent trong PCI thì đầu đã được nghiên cứu chứng minh là biện pháp quan trọng để khôi phục dòng chảy cho mạch vành bị tắc nghẽn, giảm tắc nghẽn vi mạch, bảo tồn chức năng vi tuần hoàn. Tuy nhiên ở một số bệnh nhân nhồi máu cơ tim với gánh nặng huyết khối lớn, thao tác nong/ đặt stent lại gây ra hiệu ứng ngược do hiện tượng tắc mạch phía xa làm giảm/mất chức năng vi tuần hoàn dẫn đến làm nặng hơn tổn thương cơ tim. Do vậy, phương án đặt stent trì hoãn được đề xuất, theo đó có thể cho phép đặt stent sau 24-48 giờ điều trị chống huyết khối cường độ cao, bao gồm ức chế GPIIb/IIIa tĩnh mạch kéo dài và chống đông máu bằng heparin với mục đích làm giảm bớt huyết khối sẽ giúp việc đặt stent sau đó thuận lợi hơn. Tuy nhiên các thử nghiệm DEFER-STEMI và DANAMI 3-DEFER đã chỉ ra đặt stent trì hoãn không làm giảm các biến cố tim mạch chính, tử vong do mọi nguyên nhân và cải thiện dòng chảy khi theo dõi sau 42 tháng. Một nghiên cứu tổng hợp gần đây (nghiên cứu PRIMACY) cũng không thấy rõ được lợi ích của đặt stent trì hoãn. Vì vậy đây vẫn là một vấn đề còn tra- nh luận và cân nhắc đặt stent trì hoàn ở một số tình huống cụ thể khi không thể xác định được tổn thương vì gánh nặng huyết khối quá lớn.
5 Phình động mạch vành
5.1 Tổng quan
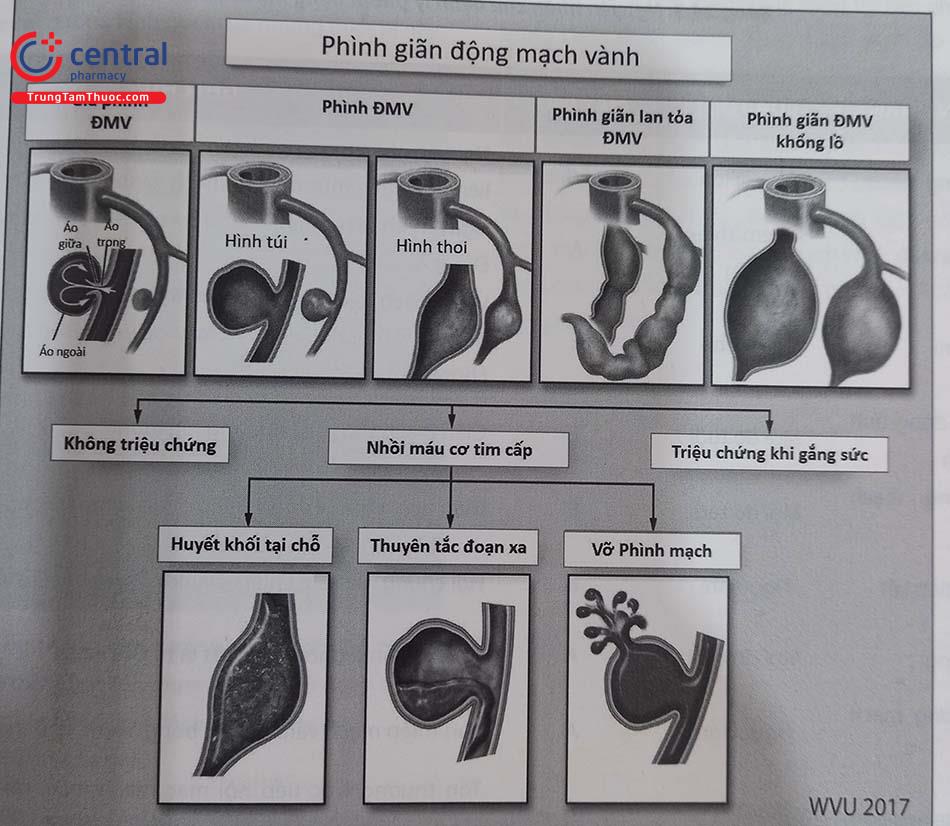
Thuật ngữ phình động mạch vành (Aneurysmal Coro- nary Artery Disease-ACAD) bao gồm chứng phình động mạch vành (Coronary Artery Aneurysm-CAA) và chứng phình giãn lan tỏa động mạch vành (Coronary Artery Ectasia-CAE) . CAA được định nghĩa là sự giãn nở của lòng mạch vành với đường kính lớn hơn 1,5 lần đoạn mạch vành bình thường liền kề. CAE là sự giãn nở lan tỏa của động mạch vành xảy ra ở trên 50% chiều dài của động mạch.
Phân loại phình động mạch vành.
A. Phình mạch khu trú
- Theo cấu tạo mạch máu
- Phình thật: phình gồm 3 lớp áo mạch
- Giả phình: phình chỉ có lớp áo ngoài
- Theo hình thái
- Phình mạch hình túi: đường kính ngang > đường kính dọc
- Phình mạch hình trám: đường kính dọc > đường kính ngang
- Phình mạch khổng lồ: đường kính phình trên 8 mm
B. Phình giãn lan toả (Ectasia)
- Type I: Phình giãn lan tỏa ở hai hoặc ba động mạch vành
- Type II: Phình giãn lan tỏa ở một động mạch và phình khu trú ở động mạch khác
- Type III: Phình giãn lan tỏa chỉ ở một động mạch
- Type IV: Phình khu trú chỉ ở một động mạch
5.2 Dịch tễ học
Tỷ lệ phát hiện phình động mạch vành (ACAD) dao động từ 0,3 đến 5% bệnh nhân chụp động mạch vành tuỳ thuộc vào các tiêu chuẩn về chụp mạch khác nhau để đưa ra định nghĩa phình động mạch vành (CAA) và phình giãn lan toả động mạch vành (CEA). Trong nghiên cứu khám nghiệm tử thi lớn nhất, tỷ lệ CAA vào khoảng 1,4%. Phình động mạch vành cũng gặp ở khoảng 2,7% trên phim chụp cắt lớp mạch vành. Tổn thương phình giãn lan toả thường gặp hơn phình và có thể gặp ở mọi lứa tuổi với tỷ lệ nam giới cao hơn nữ giới. Phình động mạch vành hay gặp nhất là động mạch vành phải (40,4%), tiếp đến là động mạch liên thất trước (32,3%), động mạch mũ (23,4%), và rất ít khi là thân chung vành trái (3,5%).
5.3 Nguyên nhân
Nguyên nhân của ACAD (Bảng 24.3) thay đổi theo vị trí địa lý và nhóm tuổi được nghiên cứu. Ở các nước phương Tây, xơ vữa động mạch là nguyên nhân phổ biến nhất của ACAD (50%) tiếp theo là bẩm sinh (17%) và nhiễm trùng (10%). Ở các nước Đông Á, bệnh Kawasaki là nguyên nhân chính của ACAD. Ngoài ra, các nguyên nhân khác của ACAD bao gồm bệnh viêm động mạch (viêm đa nút, viêm động mạch Takayasu, bệnh Behcet, giang mai), rối loạn mô liên kết (lupus ban đỏ hệ thống, thấp khớp, viêm khớp, viêm cột sống dính khớp, xơ cứng bì tiến triển), khuyết tật Collagen di truyền (hội chứng Marfan, hội chứng Ehler-Danlos), can thiệp mạch vành qua da (nong bóng, đặt stent, bào mảng xơ vữa), nhiễm nấm, chấn thương và cường aldosteron tiên phát. Nhìn chung, nguyên nhân phổ biến nhất ở người lớn là xơ vữa động mạch và ở trẻ em là bệnh Kawasaki.
Bảng 24.3. Nguyên nhân của bệnh lý phình động mạch vành
| NGUYÊN NHÂN | LỨA TUỔI | HAY GẶP | GHI CHÚ |
|---|---|---|---|
| Xơ vữa động mạch | Người lớn | A/E | Nguyên nhân hay gặp nhất ở người lớn. Triệu chứng lâm sàng liên quan đến mức độ hẹp mạch vành |
| Bệnh Kawasaki | Trẻ em/thiếu niên | A | Nguyên nhân hay gặp nhất ở trẻ em hoặc thiếu niên các nước Đông Á |
| Viêm nhiễm | Người trẻ | E | Viêm mạch Takayasu, lupus hệ thống, hội chứng Behcet, viêm đa nút, hội chứng Reiter, viêm khớp vảy nến, u hạt Wegner, hội chứng Churg-Strauss |
Thông động-tĩnh mạch vành | Mọi độ tuổi | E | Giãn mạch thứ phát do tăng lưu lượng |
Bất thường mạch vành | Mọi độ tuổi | E | Giãn mạch thứ phát do thiếu máu cơ tim |
| Bệnh mô kiên kết | Người trẻ | E | Hội chứng Marfan, Ehlers-Danlos, nang hoại tử lớp áo giữa |
| Nhiễm trùng | Mọi độ tuổi | A | Nhiễm trùng, phổ biến nhất là tụ cầu vàng |
Chấn thương mạch vành | Người lớn | A | Can thiệp mạch vành: nong bóng, stent, bào mảng xơ vữa |
| Cocaine | Người lớn | A | Tổn thương trực tiếp nội mạc mạch máu, rối loạn co giãn mạch và hình thành mảng xơ vữa |
Chú thích: A (Aneurysm)-phình mạch vành; E (Ectasia)- phình giãn lan tỏa
5.4 Triệu chứng lâm sàng
Hầu hết bệnh nhân phình mạch vành đều không có triệu chứng trên lâm sàng và chỉ được phát hiện tình cờ khi chụp động mạch vành qua da hoặc chụp cắt lớp vi tính mạch vành. Tuy nhiên, các triệu chứng lâm sàng xuất hiện do một trong những lý do sau:
- Triệu chứng của mảng xơ vữa gây hẹp động mạch vành dẫn đến đau thắt ngực khi gắng sức hoặc hội chứng mạch vành cấp.
- Huyết khối hình thành tại chỗ trong lòng của phình mạch lớn có thể dẫn đến tắc mạch phía xa và nhồi máu cơ
- Khối phình mở rộng có thể dẫn đến đè ép các cấu trúc liền kề như tâm nhĩ và tâm thất.
- Vỡ phình mạch (hiếm khi xảy ra) có thể gây tràn máu màng tim, ép tim cấp.
- Thiếu máu cục bộ cơ tim do rối loạn chức năng nội mạc và vi mạch đã được ghi nhận ngay cả khi không có hẹp đáng kể động mạch vành.
5.5 Chẩn đoán
Chụp động mạch vành qua da:
Chụp động mạch vành qua da là phương pháp phổ biến nhất để chẩn đoán phình động mạch vành. Tuy nhiên, để đạt được chất lượng hình ảnh đẹp và đánh giá đầy đủ phình mạch vành cần lưu ý bơm thuốc cản quang mạnh và kéo dài, qua đó giúp đánh giá cấu trúc phình, đánh giá hình ảnh nghi ngờ là huyết khối tại chỗ hay chỉ là hình ảnh của dòng quẩn, nhất là với phình khổng lồ. Trong những trường hợp nghi ngờ, sử dụng IVUS hoặc OCT để có được những thông tin về cấu trúc thành mạch giúp phân biệt giữa phình mạch thật, giả phình, mảng xơ vữa tại chỗ hoặc lân cận, huyết khối, vôi hoá,… Ngoài ra IVUS/OCT giúp đo chính xác kích thước CAA và chọn kích thước stent thích hợp trong trường hợp PCI. Tuy vậy, với những phình quá lớn, IVUS/OCT không đánh giá chính xác tổn thương được do bị giới hạn về đường kính quét của những thiết bị này.
Chụp cắt lớp động mạch vành:
Chụp cắt lớp vi tính mạch vành đang trở nên phổ biến hơn trong chẩn đoán phình động mạch vành do tính thuận tiện của nó, đồng thời cũng cho phép đánh giá chính xác hơn về kích thước túi phình và mức độ huyết khối và vôi hóa so với chụp mạch qua da (Hình 24.32). Chụp cắt lớp vi tính đặc biệt hữu ích ở bệnh nhân có phình mạch khổng lồ và những bệnh nhân có cầu nối mạch vành do khắc phục được hạn chế của chụp mạch mạch vành qua da cũng như đánh giá chính xác về biến chứng cơ học của những phình động mạch này.
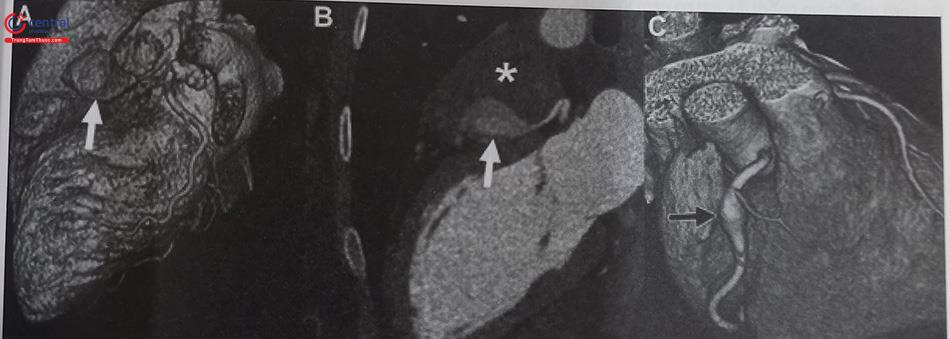
Một câu hỏi khá lý thú trong bệnh lý phình động mạch vành, đặc biệt là phình khổng lồ: liệu sự hỗn loạn của dòng chảy và động năng của dòng máu bị giảm đi khi qua vị trí phình có gây ra tình trạng giảm tưới máu phía xa như hẹp động mạch vành hay không? Vì về mặt vật lý, tưới máu phía xa sẽ bị suy giảm. Tuy nhiên, giả thuyết này đã bị bác bỏ trong nghiên cứu sử dụng phương tiện đo dự trữ lưu lượng mạch vành (FFR). Kết quả của nghiên cứu này cho thấy phân suất dự trữ mạch vành phía xa sau chỗ phình mạch vành vẫn bình thường. Bên cạnh đó, siêu âm tim gắng sức đánh giá thiếu máu cơ tim trên bệnh nhân phình mạch vành đơn thuần cũng cho thấy chức năng tim bệnh nhân không giảm khi siêu âm tim gắng sức.
5.6 Điều trị
Chiến lược điều trị bệnh nhân phình động mạch vành gặp phải một số khó khăn. Thứ nhất: quá trình diễn biến tự nhiên của bệnh còn chưa được biết rõ; do đó, phương pháp điều trị tối ưu CAA hoặc CAE ở bệnh nhân không có triệu chứng hoặc chỉ có phình đơn thuần mà không có hẹp nặng mạch vành là không rõ ràng. Thứ hai: đối với những bệnh nhân có biểu hiện đau thắt ngực hoặc nhồi máu cơ tim cấp có tổn thương thủ phạm liên quan đến đoạn mạch phình giãn thì việc lên kế hoạch can thiệp cũng gặp nhiều khó khăn. Và cuối cùng, cho đến nay vẫn chưa có những thử nghiệm ngẫu nhiên trên quy mô lớn để đưa ra hướng dẫn cụ thể. Tuy vậy, khi đối mặt với bệnh lý này, bác sĩ vẫn có thể đưa ra phương án điều trị tối ưu nhất cho người bệnh trên cơ sở cá thể hoá người bệnh dựa trên triệu chứng lâm sàng, giải phẫu của tổn thương và các bệnh lý khác kèm theo.

5.6.1 Điều trị nội khoa
Xơ vữa động mạch là nguyên nhân hay gặp nhất của bệnh lý phình mạch vành, nhất là ở người cao tuổi, do vậy việc điều chỉnh tích cực các yếu tố nguy cơ cho những bệnh nhân này cần được nhấn mạnh.
Vai trò của liệu pháp kháng tiểu cầu kép hoặc kháng đông để giảm thiểu nguy cơ hình thành huyết khối tắc mạch trong điều trị bệnh nhân CAA hoặc CAE, đặc biệt là những bệnh được phát hiện tình cờ, vẫn đang là một vấn đề còn chưa thống nhất. Tuy nhiên, với những bệnh nhân phình lớn, dòng chảy chậm khi chụp động mạch vành mà có nguy cơ xuất huyết thấp thì hoàn toàn có thể sử dụng các thuốc này để phòng biến chứng huyết khối.
Có thể dùng statin để làm giảm phản ứng viêm; Trimetazidine để cải thiện tưới máu mạch vành do làm tăng nồng độ adenosine.
Tránh dùng các thuốc giãn mạch như nitroglycerin vì khả năng làm giãn mạch vành gây trầm trọng thêm tiến triển của phình mạch vành.
Trẻ em mắc bệnh Kawasaki nên được điều trị sớm bằng globulin miễn dịch liều cao, corticoid và aspirin giúp làm giảm tiến triển của phình mạch vành trong tương lai.
5.6.2 Can thiệp động mạch vành qua da
Đối với những trường hợp bệnh nhân hội chứng mạch vành cấp có tổn thương thủ phạm liên quan đến mạch vành phình giãn, việc can thiệp để tái thông dòng chảy là cần thiết nhưng cũng phải đối mặt với nhiều khó khăn. Quyết định can thiệp vào CAA ở những bệnh nhân không có hội chứng mạch vành cấp thì phức tạp hơn, do thiếu dữ liệu hỗ trợ. Tuy nhiên, can thiệp được cân nhắc thực hiện dựa trên một số đặc điểm lâm sàng hoặc giải phẫu có nguy cơ cao và lựa chọn phương thức can thiệp nào sẽ tùy thuộc vào sự mở rộng của phình mạch cũng như sự liên quan đến những nhánh bên lớn.
- Can thiệp bệnh nhân hội chứng vành cấp có mạch phình giãn
Gánh nặng huyết khối: can thiệp động mạch thủ phạm bị CAA có liên quan đến tỷ lệ biến cố và tỷ lệ thất bại cao hơn so với động mạch không phình giãn, chủ yếu là do gánh nặng huyết khối. Huyết khối lấp đầy lòng mạch phình giãn với nhiều độ tuổi khác nhau, nhất là ở những bệnh nhân nhồi máu quá 24 giờ gây ra rất nhiều khó khăn cho việc tái lập dòng chảy cho mạch vành.
- Cần sử dụng những thiết bị lấy huyết khối cỡ lớn hoặc sử dụng máy hút huyết khối trong lòng mạch (xin xem thêm phần can thiệp mạch vành có huyết khối ở phía trên). Tuy nhiên, bất chấp những nỗ lực này, tình trạng mất dòng chảy hoặc tắc mạch đoạn xa là khá thường xuyên.
- Trường hợp hút được tương đối sạch huyết khối và tổn thương thủ phạm thích hợp cho đặt stent, tiến hành đặt stent để duy trì dòng chảy mạch vành
- Sau can thiệp hội chứng vành cấp ở bệnh nhân CAA/CEA, tỷ lệ biến cố như tử vong, huyết khối trong stent, tái nhồi máu cơ tim, tái thông mạch đích cao hơn so với mạch vành không phình giãn trong theo dõi trung hạn.
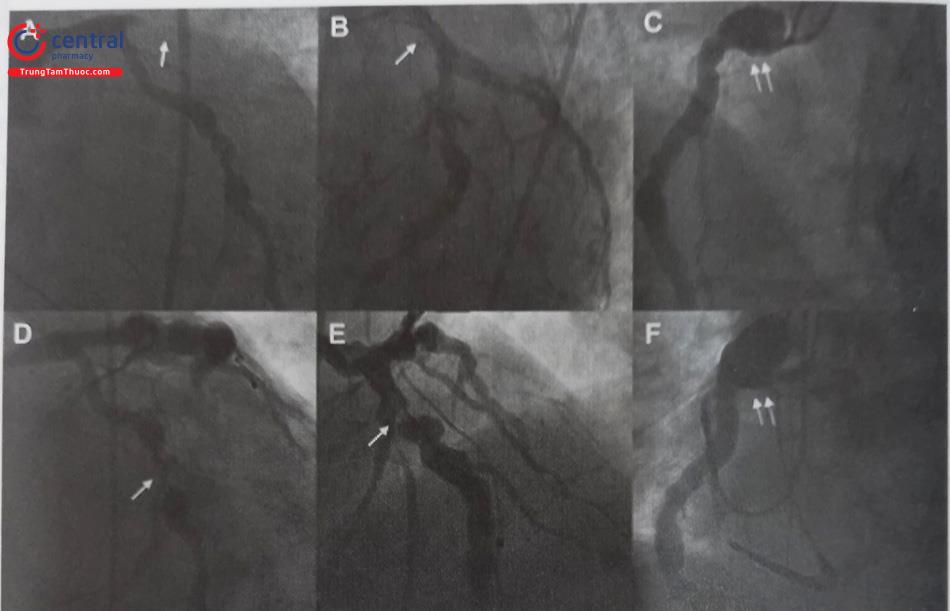
Chú thích: RCA: Động mạch vành phải; LCx: Động mạch mũ;LAD: Động mạch liên thất trước.
- Đặt stent có màng bọc (Covered stent)
- Stent có màng bọc là một phương pháp điều trị có triển vọng do khả năng cô lập đoạn mạch phình hiệu quả, ngăn được dòng máu vào trong khối phình và không làm phát triển khối phình, qua đó giảm được nguy cơ vỡ phình trong tương lai.
- Cover stent được áp dụng cho phình động mạch hình túi và các giả phình không liên quan đến một nhánh bên lớn.
- Cover stent cần phù hợp với giải phẫu của khối phình: Không có cover stent được thiết kế riêng để điều trị CAA. Tuy nhiên, một số hệ thống stent graft (không có khuyến cáo) đã được sử dụng để loại trừ CAA. Đối với đường kính từ 2,75 mm đến 5 mm, stent graft mạch vành GraftMaster (Abbott Vascular, Mỹ) thường được sử dụng. Stent GraftMaster được chế tạo bằng kỹ thuật sandwich với một lớp siêu mỏng polytetrafluoroeth- ylene có thể giãn nở được đặt giữa 2 lớp khung stent, sau đó được gắn trên một quả bóng. Cover stent PK Papyrus (Biotronik, Đức) có độ linh hoạt cao hơn và nhỏ hơn vượt trội so với Stent GraftMaster, do chỉ gồm một khung stent có phủ lớp màng bọc bên ngoài. Nếu cần stent có đường kính lớn hơn (5 đến 10 mm), những cover stent kích thước lớn hơn như Icast (Maquet, Mỹ) cũng đã được sử dụng thành công để điều trị CAA.
- Xác định kích thước CAA và vùng cần can thiệp: xác định đúng kích thước của CAA là chìa khóa để giảm nguy cơ huyết khối trong stent và di lệch stent. Tuy vậy, việc đánh giá chính xác chiều dài của CAA thường khó. Có thể sử dụng IVUS/OCT để đo đạc các kích thước của phình mạch chính xác hơn và giúp chọn kích thước
- Những khó khăn của việc đặt covered stent: covered stent thường to và cứng nên thường đòi hỏi sử dụng guiding lớn; covered stent rất khó đẩy qua đoạn mạch quanh co, xoắn hoặc vôi; nguy cơ gây tách thành mạch vành cao; nguy cơ rơi stent có thể xảy ra với những stent lớn.
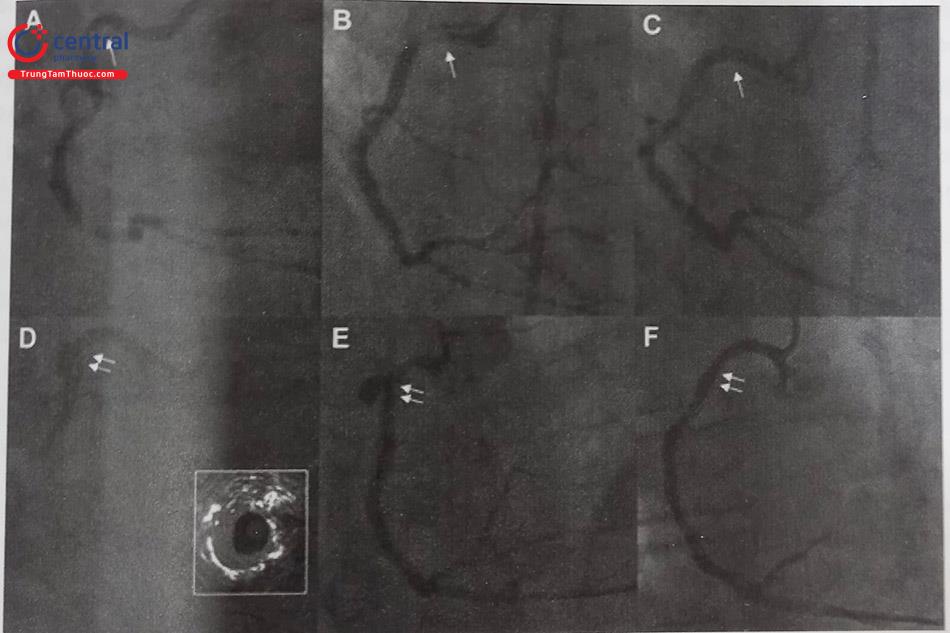
Bảng 24.4. Một số loại covered stent dùng trong điều trị phình động mạch vành
| LOẠI STENT | GRAFTMASTER | PK PAPYRUS | DIRECT -STENT | BEGAFT | ANEUGRAFT | ICAST ATRIUM |
|---|---|---|---|---|---|---|
| Nhà sản xuất | Abbott | Biotronik | InSite Tech | Bently | ITGI Medical | Atrium Medical |
Cỡ guiding | 6-7 Fr | 5-6 Fr | 6-7 Fr | 5-6 Fr | 6 Fr | 8-9 Fr |
| Đường kính | 2,8-4,8 mm | 2,5-5,0 mm | 2,25-6,0 mm | 2,5-5,0 mm | 2,5-4,0 mm | 5-10 mm |
| Chiều dài | 16-26 mm | 15-26 mm | 2,25-6.0 mm | 2,5-5.0 mm | 2,5-4,0 mm | 16-59 mm |
- Điều trị phình mạch vành với nút coil và đặt stent phủ thuốc
- Trường hợp phình động mạch vành hình túi hoặc hình quả trám liên quan đến một nhánh bên lớn có thể được điều trị bằng đặt stent phủ thuốc kết hợp nút phình mạch bằng coil.
- Kỹ thuật làm bít tắc túi phình mạch vành bằng coil được thực hiện tương tự bít coil điều trị phình động mạch não. Coil sẽ có tác dụng dần tạo huyết khối lấp đầy túi phình. Một vài kỹ thuật được mô tả ở hình dưới đây.
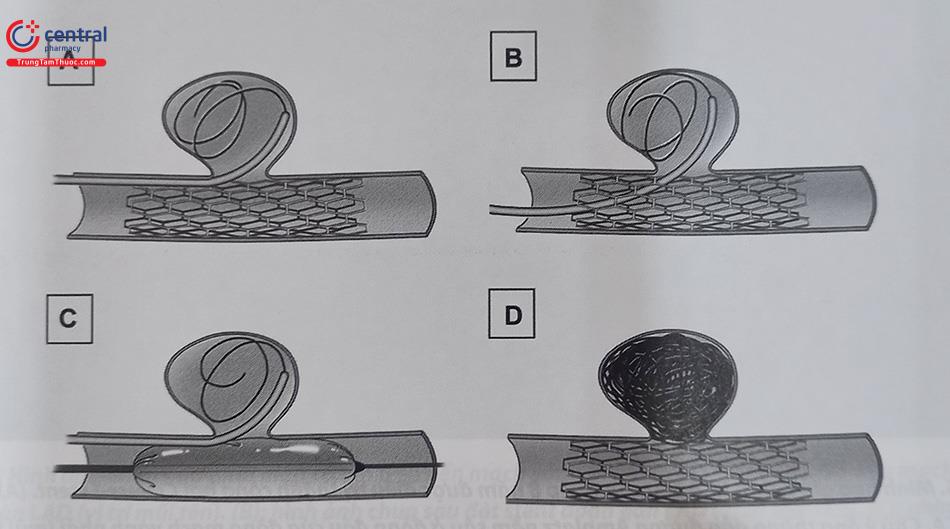
5.6.3 Phẫu thuật điều trị phình mạch vành
Cách tiếp cận phẫu thuật tối ưu để điều trị phình động mạch vành vẫn chưa được nghiên cứu chính thức. Các kỹ thuật phẫu thuật cho CAA được đề xuất bao gồm thắt túi phình, cắt bỏ túi phình, cắt bỏ phần mạch bị phình và thay bằng đoạn mạch nhân tạo. Tuy nhiên các phẫu thuật này cũng ít được thực hiện.
Đối với CAA liên quan đến thân chung động mạch vành, nhiều phình hoặc phình khổng lồ (trên 20 mm, hoặc gấp 4 lần đường kính trung bình mạch tham chiếu) thì phẫu thuật cắt bỏ được coi là liệu pháp đầu tay
Cần hội chẩn của Heart Team trong những trường hợp khó để có quyết định điều trị tối ưu nhất.
5.7 Chiến lược điều trị phình mạch vành và những câu hỏi còn bỏ ngỏ
Bản chất tổn thương CAA và CAE có giống nhau? Đây có phải là hai loại bệnh riêng biệt hay chỉ là các kiểu hình khác nhau của cùng một bệnh?
Phình mạch vành có làm tăng nguy cơ xảy ra các biến cố ở những bệnh nhân không có triệu chứng hay không?
Vai trò của kháng tiểu cầu kép dài hạn hoặc chống đông máu trong phòng ngừa nguyên phát và thứ phát các biến chứng huyết khối?
Các CAA phát hiện tình cờ có cần phải can thiệp hay không?
Đâu là phương pháp tối ưu để điều trị CAA? (stent thường hay stent phủ thuốc, cover stent, stent kết hợp với bít coil, phẫu thuật cắt bỏ túi phình,…)

6 Tài liệu tham khảo
- Kini A. and Sharma S.K., eds. (2021), Practical Manual of Interventional Cardiology, Springer International Publishing,
- Anomalous Aortic Origin of a Coronary Artery in Ann Thorac Surg 2021 Oct;112(4):1299-1305
- Kalaichelvan Uthayakumaran, et al, Coronary intervention in anomalous origin of the right coronary artery (ARCA) from the left sinus of valsalva (LSOV): A single center Indian Heart J. 2014 Jul; 66(4): 430–434.
- SamirKubba et al, Primary percutaneous coronary intervention (PCI) of an inferior wall myocardial infarction (IWMI) and cardiogenic shock, IHJ Cardiovascular Case Reports (CVCR) Volume 3, Issue 3, September–December 2019, Pages 87-90.
- Textbook of Catheter-Based Cardiovascular Interventions, https://doi.org/10.1007/978-3-319-55994-0_48
- Kapildeo Lotan, MD, FSCAI and et Tips & Tricks for Aorto-ostial Coronary Lesions , SCAI
- Ronen Jaffe et al, Percutaneous treatment of aorto-ostial coronary lesions: Current challenges and future directions, International Journal of Cardiology 186 (2015), 61-66.
- Dash D. Heart Asia 2014;6:41–45. doi:10.1136/heartasia-2013- 010478.
- Faisal Latif et al, Tips and Tricks for Saphenous Vein Graft SCAI, 10-2020.
- Amir Solomonica, Ariel Roguin Interventional Cardiology, Rambam Medical Center, B. Rappaport – Faculty of Medicine, Technion – Israel Institute of Technology, Haifa 31096,
- Management of Intracoronary Thrombus. Janarthanan Sathananthan, Timothy J. Watson,Dale Murdoch, Christopher Overgaard, Deborah Lee, Deanna Khoo, and Paul J. L. Ong, org/10.1007/978-981-13-1114-7_10
- Vinod Kumar et al, Large intracoronary thrombus and its management during primary PCI, Indian Heart Journal 72 ( 2020) 508-516
- Immediate vs Delayed Stenting in ST-Elevation Myocardial Infarction: Rationale and Design of the International PRIMACY Bayesian Randomized Controlled Can J Cardiol, 2020 Nov;36(11):1805-1814. doi: 10.1016/j.cjca.2020.01.019.
- Borja Ibanez et al, 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation, European Heart Journal (2017) 00, 1–66
- Eric J Topol et al, Textbook interventional cardiology 2016
- ElGuindy MS, ElGuindy AM. Aneurysmal coronary artery disease: An overview, Global Cardiology Science and Practice 2017:26 http:// dx.doi.org/10.21542/gcsp.2017.26.
- Kawsara, A. et al. Management of Coronary Artery Aneurysms, J Am Coll Cardiol Intv. 2018;11(13):1211–23, https://doi.org/10.1016/j. jcin.2018.02.041

