Can thiệp động mạch thận trong điều trị hẹp động mạch thận
Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS. Phạm Mạnh Hùng
Tác giả
TS.BSNT.Đinh Huỳnh Linh
ThS.BSNT.Trương Đình Phi
ThS.BSNT.Lê Tuấn Minh
ThS.BSNT.Phạm Đình Vụ
ThS.BSNT.Nguyễn Hữu Tuyển
PGS.TS.BS.Phạm Mạnh Hùng
Can thiệp động mạch thận ngày nay đang trở thành một hướng đi mới trong điều trị hẹp động mạch thận do xơ vữa, giúp tăng tưới máu và lưu lượng máu tới thận. Kỹ thuật này ra sao? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu trong bài viết sau đây.
1 Đại cương
Hẹp động mạch thận do xơ vữa là tình trạng giảm dòng máu tới thận do nguyên nhân xơ vữa, từ hẹp khu trú mạch thận, thiếu máu thận và teo thận cho tới tắc hoàn toàn dòng máu tới một hoặc hai thận. Hiện chưa có sự thống nhất về mức độ hẹp có ý nghĩa, theo ESC 2017, chẩn đoán hẹp động mạch thận được nghĩ đến khi mức độ hẹp trên 60%.
Hẹp nặng mạch thận làm giảm áp lực tưới máu thận và giảm lưu lượng dòng máu đến thận, dẫn đến tình trạng thiếu oxy tại vỏ thận, hoạt hoá hệ Renin – Angiotensin – Aldosterone kéo dài với chất chuyển hóa cuối cùng là Angiotensin II. Angiotensin II ngoài tác dụng gây co mạch mạnh, còn thúc đẩy quá trình xơ hóa ống kẽ thận thông qua giải phóng các cytokine và các yếu tố tăng trưởng. Hậu quả là gây tăng huyết áp, suy tim, thúc đẩy tiến triển của bệnh thận mạn, các biến cố tim mạch và tử vong.
Tuy vậy, nghiên cứu các bệnh nhân với nhiều mức độ hẹp động mạch thận khác nhau có kèm theo bệnh thận mạn tính đã không chứng minh được mối liên quan giữa mức độ tổn thương mạch thận với mức độ suy giảm chức năng thận. Suy thận có thể là sự tổng hợp của nhiều yếu tố chứ không đơn thuần do tình trạng giảm tưới máu thận. Điều này góp phần giải thích lý do đặt stent điều trị hẹp động mạch thận do xơ vữa không phải lúc nào cũng giúp cải thiện chức năng thận.
1.1 Nguyên nhân hẹp động mạch thận
Có nhiều nguyên nhân gây ra hẹp động mạch thận: do xơ vữa, bệnh lý loạn sản xơ cơ, do lóc tách động mạch thận hoặc nhồi máu thận, do bệnh lý bẩm sinh, viêm mạch Takayasu, tổn thương xơ hóa do nhiễm xạ….
1.1.1 Hẹp động mạch thận do xơ vữa
Xơ vữa động mạch chiếm khoảng 90% các trường hợp hẹp động mạch thận, thường do sự hình thành mảng xơ vữa ở thành động mạch chủ tiến triển vào gốc động mạch thận, dẫn đến sự xuất hiện điển hình của hẹp lệch tâm vị trí lỗ động mạch thận. Tỷ lệ hẹp động mạch thận do xơ vữa tăng lên theo tuổi, đặc biệt ở bệnh nhân đái tháo đường, tăng lipid máu, các loại bệnh động mạch ngoại biên, bệnh mạch vành hoặc tăng huyết áp. Đây là bệnh lý tiến triển theo thời gian, ngay cả với ở những động mạch ban đầu không bị tổn thương thì tỷ lệ tắc sau 1 năm có thể gặp từ 1% đến 18%.
Các nghiên cứu trước đây cho thấy đặt stent động mạch thận điều trị hẹp động mạch thận do xơ vữa là biện pháp an toàn và có hiệu quả hạ huyết áp tốt. Tuy nhiên, một số thử nghiệm lâm sàng có đối chứng lại cho thấy không có sự khác biệt giữa hai nhóm chỉ điều trị nội khoa tối ưu đơn thuần và nhóm có kết hợp can thiệp động mạch thận, do đó lựa chọn bệnh nhân được hưởng lợi ích từ can thiệp động mạch thận vẫn còn là chủ đề tranh cãi. Bên cạnh điều trị nội khoa và kiểm soát tốt các yếu tố nguy cơ, cần xác định đúng nhóm bệnh nhân được hưởng lợi ích từ can thiệp tái tưới máu động mạch thận.
1.1.2 Loạn sản xơ cơ
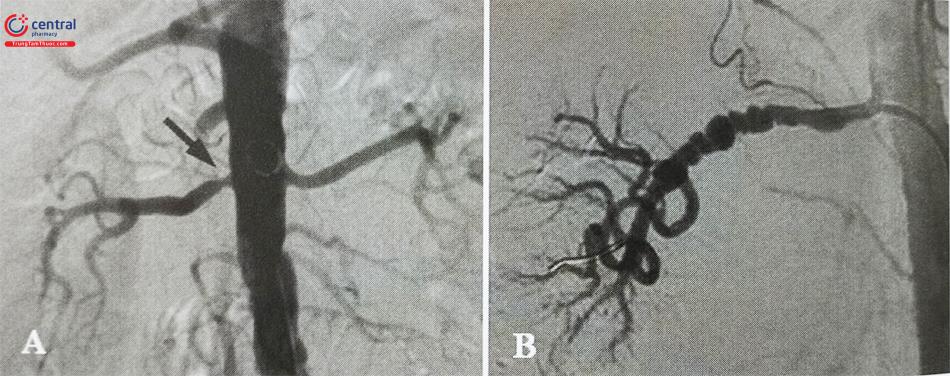
Loạn sản xơ cơ là nguyên nhân phổ biến thứ hai, hay gặp ở bệnh nhân nữ trẻ tuổi. Khác với hẹp động mạch thận do xơ vữa, loạn sản xơ cơ thường gây hẹp thân động mạch thận hoặc các nhánh bên, với hình ảnh đặc trưng là phình mạch dạng tràng hạt trên phim chụp mạch. Trong trường hợp tổn thương lớp nội mô, loạn sản xơ cơ có thể khu trú ở gần gốc động mạch thận và có hình ảnh tổn thương trên phim chụp tương tự như xơ vữa động mạch thận. Loạn sản xơ cơ hiếm khi dẫn đến tắc mạch hoặc bệnh thận do thiếu máu cục bộ.
1.2 Lâm sàng và cận lâm sàng
1.2.1 Lâm sàng
Cần nghĩ đến hẹp động mạch thận trong các trường hợp:
- Khởi phát tăng huyết áp sớm trước 30 tuổi.
- Khởi phát tăng huyết áp nặng sau 55 tuổi, đặc biệt khi kèm bệnh thận mạn hoặc suy
- Tăng huyết áp kèm theo tiếng thổi mạch thận.
- Tăng huyết áp tiến triển nhanh và dai dẳng ở bệnh nhân trước đó đã kiểm soát được huyết áp.
- Tăng huyết áp kháng trị (không đạt huyết áp mục tiêu mặc dù đã dùng tới 3 nhóm thuốc hạ áp ở liều tối ưu với một trong số đó là thuốc lợi tiểu).
- Cơn tăng huyết áp (kèm theo suy thận cấp, suy tim cấp, bệnh não do tăng huyết áp, hoặc tổn thương võng mạc độ 3-4).
- Tăng sản phẩm chuyển hóa nitơ trong máu hoặc giảm chức năng thận sau khi dùng thuốc ức chế hệ Renin – Angiotensin – Aldosterone.
- Tình trạng teo thận bất thường, kích thước thận không đồng nhất hoặc suy thận không rõ nguyên nhân.
- Cơn phù phổi cấp.
1.2.2 Cận lâm sàng
Siêu âm Doppler động mạch thận
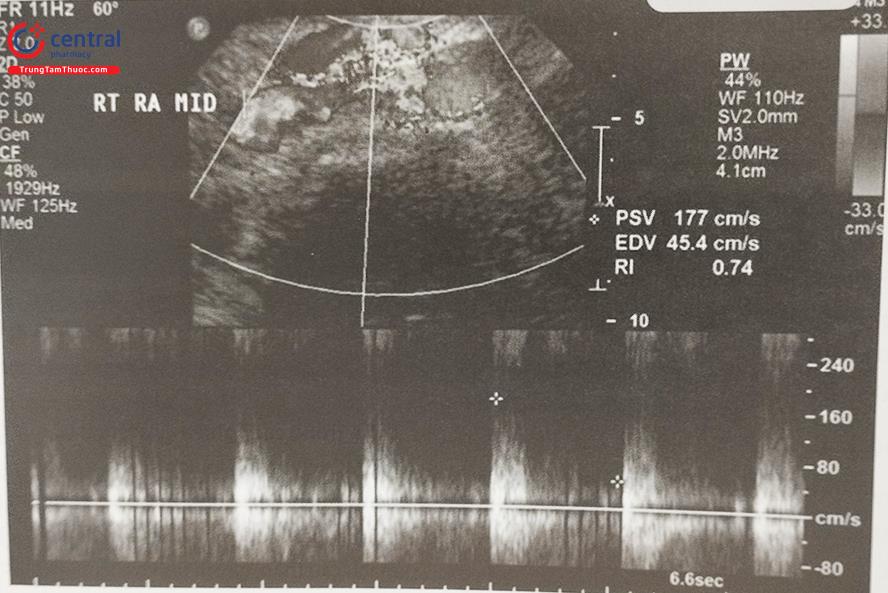
Đây là lựa chọn hàng đầu để sàng lọc những tổn thương hẹp động mạch thận có ý nghĩa (> 60%), là phương pháp có hiệu quả về kinh tế, không xâm lấn. Tuy vậy có hạn chế là phụ thuộc vào kinh nghiệm của người làm siêu âm, khó tiến hành ở những bệnh nhân quá béo và có thể ước tính quá mức tổn thương hẹp. Siêu âm có thể tiến hành nhiều lần để theo dõi tiến triển và hậu quả huyết động của hẹp động mạch thận, cũng như đánh giá hiệu quả của can thiệp tái tưới máu.
Các thông số trên siêu âm bao gồm vận tốc đỉnh tâm thu (PSV – Peak Systolic Velocity) và chỉ số sức cản mạch thận (RRI – Renal Resistive Index). Vận tốc đỉnh tâm thu có độ nhạy và độ đặc hiệu tốt nhất, vận tốc > 180 cm/s gợi ý hẹp động mạch thận trên 60%.
Chỉ số sức cản mạch thận là thông số giúp đánh giá tưới máu tại mô thận. Chỉ số này giúp tiên lượng bệnh nhân có thể đáp ứng với can thiệp động mạch thận hay không. Một số nghiên cứu cho thấy các bệnh nhân tăng sức cản mạch thận chính (trên 0.80) sẽ ít nhận được lợi ích từ can thiệp tái tưới máu. Ngược lại, sức cản thấp cho thấy tiên lượng tốt hơn.
Tuy nhiên, RRI có độ tin cậy thấp do dễ gặp sai số trong quá trình đo đạc, mặt khác cũng có nhiều bệnh lý ngoài hẹp động mạch thận ảnh hưởng đến RRI (như tắc nghẽn đường bài xuất hệ tiết niệu, huyết áp thấp, nhịp chậm …).
Chụp cắt lớp vi tính và cộng hưởng từ mạch máu
Hai thăm dò này cho kết quả tương đương nhau về độ nhạy (tương ứng 64-100% và 94-97%) và độ đặc hiệu (tương ứng 92-98% và 85-93%). Chụp CT cung cấp hình ảnh có độ phân giải cao hơn, nhưng có thể làm nặng thêm tình trạng suy thận.
Chụp MRI có tiêm thuốc đối quang từ Gadolinium cung cấp đặc điểm chi tiết của động mạch thận, các mạch máu xung quanh, các khối trong thận và có thể đánh giá được chức năng thận (chức năng bài tiết). Tuy nhiên, phương pháp này có xu hướng đánh giá quá mức mức độ hẹp, ít hiệu quả khi đánh giá những vị trí đã đặt stent do nhiễu ảnh.
Chụp mạch số hóa xóa nền (DSA)
Đây vẫn là tiêu chuẩn vàng để chẩn đoán bệnh lý hẹp động mạch thận. Do ít có sự tương quan giữa mức độ hẹp động mạch thận trên hình ảnh với ảnh hưởng của tình trạng hẹp lên huyết động, nên đánh giá chênh áp qua chỗ hẹp, đặc biệt hữu ích trong trường hợp hẹp mức độ vừa.
Chênh áp > 20 mmHg, hoặc tỷ số Pd/Pa < 0,90 (Pd: Áp lực đoạn xa sau vị trí hẹp, Pa: Áp lực động mạch chủ) được coi là có tình trạng hẹp đáng kể ở bệnh nhân có triệu chứng.
Phân suất dự trữ lưu lượng động mạch thận được đo sau khi sử dụng các thuốc để giãn tối đa động mạch thận như Papaverin hay dopamin. Đây là phương pháp thay thế để đánh giá mức độ hẹp và có thể dự đoán đáp ứng lâm sàng sau can thiệp.
Do có những rủi ro nhất định, thủ thuật xâm lấn chỉ nên tiến hành với mục đích đánh giá và định lượng mức độ hẹp trước khi tiến hành can thiệp, khi có nghi ngờ trên lâm sàng mà kết quả của các xét nghiệm không xâm lấn không thể kết luận.
Xạ hình thận
Biện pháp xạ hình thận và đo nồng độ renin huyết tương trước và sau kích thích bằng thuốc ức chế men chuyển không còn được khuyến cáo trong chẩn đoán hẹp động mạch thận.
Bảng 30.1. Tóm tắt khuyến cáo ESC 2017 về các phương pháp chẩn đoán hẹp động mạch thận
| Khuyến cáo | Mức độ khuyến cáo | Mức độ bằng chứng |
| DUS (lựa chọn đầu tay), CTAa, MRAb là phương tiện được khuyến cáo để chẩn đoán RAD. | I | B |
| DSA có thể cân nhắc để xác định chẩn đoán RAD khi lâm sàng nghi ngờ cao mà các phương tiện không xâm lấn không giải thích được. | IIb | C |
| Xạ hình thận, đo nồng độ renin huyết tương trước và sau kích thích bằng ACEI không được khuyến cáo trong sàng lọc hẹp động mạch thận do xơ vữa. | III | C |
ACEI (angiotensin-converting enzyme inhibitor) = ức chế men chuyển; CTA (computed tomography angiography) = chụp cắt lớp vi tính; DSA (digital subtraction angiography) = chụp mạch số hóa xóa nền; DUS (duplex ultrasound) = siêu âm Duplex; eGFR (estimated glomerular filtration rate) = mức lọc cầu thận; MRA (magnetic resonance angiography) = chụp cộng hưởng từ; RAD (renal artery disease) = bệnh động mạch thận.
a Khi eGFR ≥ 60 ml/ph.
b Khi eGFR ≥ 30 ml/ph.
1.3 Điều trị nội khoa
Đánh giá nguy cơ, thay đổi lối sống và điều trị nội khoa nên tuân theo các hướng dẫn hiện hành của Hội Tim mạch châu Âu (ESC).
Hầu hết các loại thuốc hạ huyết áp có hiệu quả để điều trị tăng huyết áp và có thể làm chậm tiến triển của bệnh
thận. Trong các nghiên cứu lớn, thuốc ức chế men chuyển (ƯCMC) cho thấy lợi ích trong việc giảm tỷ lệ tử vong ở bệnh nhân hẹp động mạch thận do xơ vữa. Tuy nhiên, những loại thuốc này có thể giảm áp suất thủy tĩnh mao mạch cầu thận, gây ra tình trạng giảm mức lọc cầu thận và tăng creatinin huyết thanh, do vậy cần thận trọng khi sử dụng và theo dõi chặt chẽ nếu hẹp động mạch thận 2 bên.
Statin có liên quan đến việc cải thiện tỷ lệ sống sót, làm chậm tiến triển tổn thương và giảm nguy cơ tái hẹp sau khi đặt stent động mạch thận.
Liệu pháp chống kết tập tiểu cầu cũng là một phần không thể thiếu trong chiến lược điều trị hẹp động mạch thận do xơ vữa.
Bảng 30.2. Khuyến cáo ESC 2017 về điều trị nội khoa hẹp động mạch thận
| Khuyến cáo | Mức độ khuyến cáo | Mức độ bàng chứng |
| Ức chế men chuyển/ ức chế thụ thể được khuyến cáo điều trị tăng huyết áp liên quan đến hẹp động mạch thận một bên. | I | B |
| Chẹn kênh Canxi, chẹn β (beta) giao cảm và lợi tiểu được khuyến cáo điều trị tăng huyết áp liên quan đến hẹp động mạch thận. | I | C |
| Ức chế men chuyển/ ức chế thụ thể có thể cân nhắc ở bệnh nhân hẹp động mạch thận hai bên và trường hợp hẹp động mạch thận trên thận duy nhất còn chức năng, nếu dung nạp tốt và cần theo dõi sát. | IIb | B |
1.4 Lịch sử phương pháp can thiệp điều trị hẹp động mạch thận
Ca nong bóng tạo hình động mạch thận lần đầu tiên được thực hiện bởi Felix Mahler ở Berne và Andreas Grüntzig ở Zurich năm 1977. Cho đến đầu những năm 1990, nong bóng là phương pháp duy nhất điều trị hẹp ĐM thận qua da với kết quả ngắn hạn và lâu dài tương đối tốt. Đối với nong bóng tổn thương hẹp thân ĐM thận do loạn sản cơ và xơ vữa, tỷ lệ thành công của thủ thuật đạt 82% đến 100% và tỷ lệ tái hẹp khoảng 10% trong 1 năm. Tuy nhiên, với tổn thương tại lỗ ĐM thận do xơ vữa thì tỷ lệ thành công của thủ thuật thấp 50% đến 62%, và tỷ lệ tái hẹp lên đến 47% do bóc tách, co hồi mạch và tổn thương vôi hóa không thể nong bằng bóng.
Việc đặt stent vào cuối những năm 1990 đã tạo ra một cuộc cách mạng trong việc tái thông mạch thận qua da. Sau các báo cáo đầy hứa hẹn của các trung tâm đơn lẻ, hai nghiên cứu đối chứng ngẫu nhiên đã chứng minh tính ưu việt của can thiệp đặt stent so với nong mạch bằng bóng thông thường trong điều trị tổn thương lỗ ĐM thận do xơ vữa, là nguyên nhân chủ yếu của hẹp ĐM thận. Đặt stent động mạch thận có tỷ lệ thành công cao, tỷ lệ tái hẹp thấp, dao động 0-10% trong 5 năm, tùy thuộc vào đường kính của ĐM thận và hệ thống stent được sử dụng.
2 Chỉ định, chống chỉ định can thiệp động mạch thận
2.1 Chỉ định
Chỉ định can thiệp ĐM thận hiện nay được đồng thuận theo khuyến cáo của ESC 2017 như sau:
Bảng 30.3. Chỉ định can thiệp tổn thương xơ vữa động mạch thận (ESC 2017)
| Khuyến cáo | Mức độ khuyến cáo | Mức độ bằng chứng |
| Tái thông động mạch thận thường quy không được khuyến cáo khi hẹp động mạch thận thứ phát do xơ vữa | III | A |
| Trong trường hợp tăng huyết áp và /hoặc các dấu hiệu của suy thận liên quan đến hẹp động mạch thận do loạn sản xơ cơ, nong mạch bằng bóng có hoặc không đặt stent có thể được xem xét. | IIa | B |
| Nong mạch bằng bóng, có hoặc không đặt stent, có thể được xem xét ở một số bệnh nhân hẹp động mạch thận chọn lọc có suy tim sung huyết tái phát không giải thích được hoặc phù phổi đột ngột. | IIb | C |
Trong trường hợp có chỉ định tái thông mạch thận, phẫu thuật nên được xem xét cho những bệnh nhân có giải phẫu động mạch thận phức tạp, hoặc nếu can thiệp nội mạch thất bại hoặc tiến hành kèm theo một chỉ định phẫu thuật khác của động mạch chủ | IIa | B |
2.2 Chống chỉ định
Hẹp động mạch thận không nhiều (< 70%) và chưa gây triệu chứng.
Các bệnh lý nhiễm trùng đang tiến triển, rối loạn đông máu, suy thận chưa khống chế được,…
Hẹp động mạch thận kèm theo các bệnh lý phức tạp khác…
3 Các bước tiến hành thủ thuật
3.1 Chuẩn bị bệnh nhân
Bệnh nhân cần được làm đầy đủ các thăm dò không xâm nhập chẩn đoán hẹp động mạch thận: siêu âm, chụp cắt lớp vi tính,…
Cần đảm bảo bệnh nhân đã dùng đầy đủ thuốc chống ngưng tập tiểu cầu (aspirin, clopidogrel) trước thủ thuật can thiệp.
Bù đủ dịch cho bệnh nhân để dự phòng bệnh thận do thuốc cản
Duy trì thuốc hạ áp nếu bệnh nhân đang dùng thuốc hạ áp.
3.2 Mở đường vào mạch máu
Thường sử dụng đường vào động mạch đùi, với introducer sheath 6F hoặc 7F, chiều dài 10-15 cm là đủ. Trong trường hợp ĐM chậu xoắn vặn nhiều, có thể cần dùng sheath dài (long sheath) để giúp tăng hỗ trợ và thao tác dụng cụ dễ dàng hơn. Dùng sheath dài đưa đến lỗ vào động mạch thận, qua đó không cần dùng ống thông can thiệp, sẽ giúp đẩy nhiều dụng cụ cấu hình lớn, đồng thời giảm thiểu các biến chứng liên quan đến đường vào mạch máu.
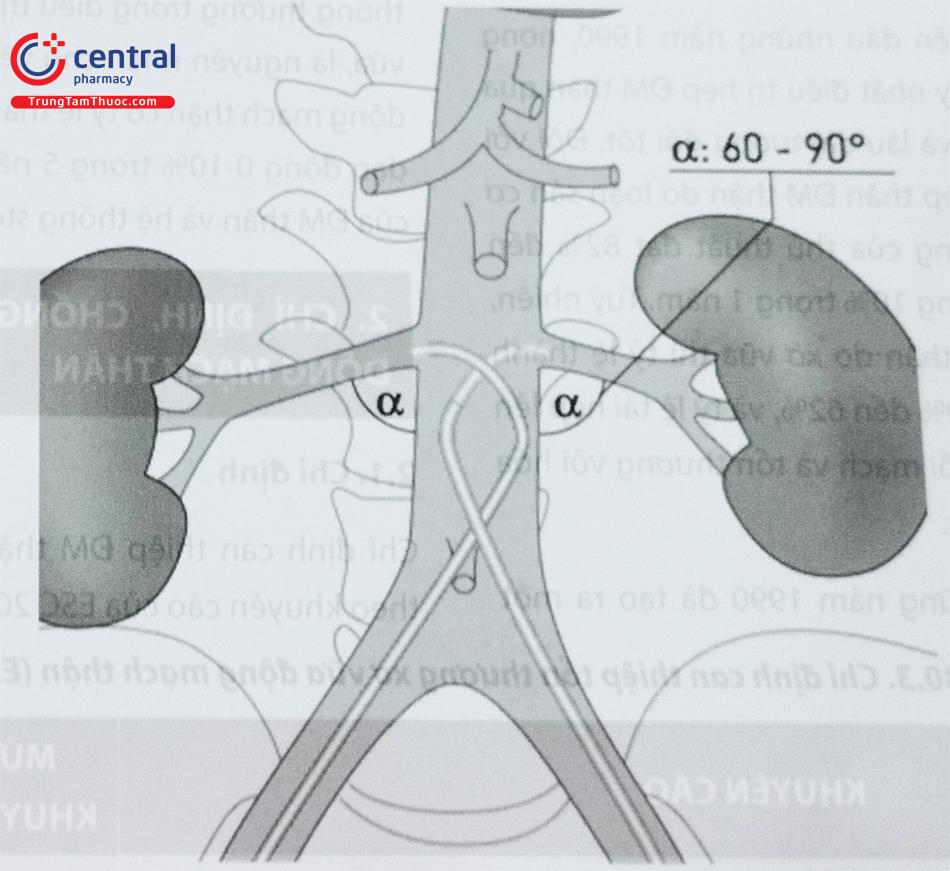
Can thiệp ĐM thận bên nào thì ưu tiên chọn đường ĐM đùi bên đó, do ống thông can thiệp có thể tì vào thành ĐMC bên đối diện và hỗ trợ tốt hơn (xem Hình 3). Tuy nhiên, điều này không hoàn toàn bắt buộc.
Nếu động mạch thận xuất phát theo hướng từ trên xuống, có thể cần mở đường vào động mạch cánh tay, sau đó đẩy sheath dài xuống ĐMC bụng tiếp cận lỗ vào động mạch thận.
Sau khi đã mở đường vào mạch máu, dùng thuốc chống đông (heparin liều 70-100 đơn vị/kg).
3.3 Chụp động mạch chủ
Chụp động mạch chủ bụng cho phép đánh giá vị trí lỗ vào động mạch thận, có hẹp lỗ vào động mạch thận hay không, có động mạch thận phụ hay không, mức độ vôi hóa động mạch chủ. Đưa ống thông pigtail vào vị trí ngang với đốt sống thắt lưng đầu tiên, bơm khoảng 6-12 mL thuốc cản quang. Nếu dùng bơm chụp máy, bơm thuốc với tốc độ 20 mL/giây.
Trường hợp giải phẫu bình thường, góc nghiêng 15-30 độ (LAO 30) cho phép quan sát rõ nhất gốc ĐM thận phải và trái, vì ĐM thận phải thường xuất phát trước phải (góc 10-11 giờ) và ĐM thận trái thường xuất phát sau trái (góc 4-5 giờ).
Khi chụp động mạch chủ, cần chụp đủ lâu để thuốc cản quang ngấm toàn bộ hệ động mạch thận, qua đó đánh giá kích thước và chức năng thận.
3.4 Đặt ống thông can thiệp
Có nhiều ống thông can thiệp có thể được sử dụng: JR4, Hockey stick (HS), Amplatz, hoặc IM , … với kích cỡ 6 Fr hoặc 7 Fr, dài khoảng 55 cm là đủ. Lưu ý rằng các loại stent động mạch thận nói chung có cấu hình lớn hơn stent ĐMV, vì thế đòi hỏi ống thông can thiệp kích cỡ lớn hơn.
Đặt ống thông can thiệp vào lòng động mạch thận. Kết nối ống thông với đường đo áp lực. Chênh lệch áp lực > 20 mmHg được coi là có hạn chế dòng chảy mạch thận.

3.5 Lái dây dẫn qua vị trí tổn thương
Có thể dùng guidewire 0,014 inch, 0,018 inch, hoặc 0,035 inch. Guidewire 0,014 inch được ưa chuộng hơn vì có thể tương thích với phần lớn thiết bị như stent, bóng… và ít gây biến chứng thủng động mạch thận. Tránh dùng loại guidewire ngậm nước và guidewire cứng vì nguy cơ gây thủng nhánh bên mạch thận và chảy máu.
Guidewire áp lực (pressure wire) không được khuyến cáo sử dụng thường quy, chỉ nên dùng nếu cần đánh giá chênh áp (gradient) qua chỗ hẹp, từ đó chẩn đoán hẹp ĐM thận có ý nghĩa: gradient tâm thu > 20 mmHg, hoặc tỷ số Pd/Pa < 0,90 (Pd: Áp lực đoạn xa sau vị trí hẹp, Pa: Áp lực động mạch chủ).
Luồn guidewire can thiệp qua vị trí tổn thương, sau khi đầu guidewire đã qua tổn thương, tiếp tục đẩy guidewire tới đầu xa của động mạch thận.
Một số tác giả đề xuất kỹ thuật can thiệp “không chạm”. Kỹ thuật này đòi hỏi ống thông can thiệp to hơn 1 Fr so với thông thường, sử dụng hai wire 0,014, một wire đi qua tổn thương, một wire để trong ĐM chủ bụng, nhằm mục đích hạn chế sự tiếp xúc trực tiếp ống thông can thiệp vào thành ĐM chủ và lỗ ĐM thận bị tổn thương, giảm thiểu biến chứng bóc tách ĐM thận do ống thông và giúp tối ưu hóa việc phủ lỗ tổn thương bởi stent.
Trong trường hợp khó khăn trong việc đưa wire qua tổn thương do giải phẫu mạch thận xoắn vặn, có thể sử dụng sự hỗ trợ của một ống thông chẩn đoán, kĩ thuật này được gọi là kĩ thuật “mẹ bồng con” (mother-and-child). Tức là sử dụng một ống thông chẩn đoán 5F có hình dạng phù hợp đi trong ống thông can thiệp 6-7 Fr, để giúp định hướng và lái wire qua tổn thương. Sau khi wire qua tổn thương, trượt ống thông can thiệp trên ống thông chẩn đoán này để tiếp cận được chọn lọc lỗ vào ĐM thận.
Trường hợp sử dụng sheath dài thay thế ống thông can thiệp, việc lái wire qua tổn thương phải cần đến sự trợ giúp của ống thông chẩn đoán, dây dẫn cũng phải đủ dài (khoảng 300 cm) để có thể dễ dàng rút ống thông chẩn đoán mà vẫn đảm bảo ổn định vị trí wire trong ĐM thận.
3.6 Nong bóng động mạch thận
Tiến hành nong bóng để làm nở rộng lòng mạch vị trí tổn thương. Kích cỡ bóng trung bình đường kính từ 3-5 mm, chiều dài 8 đến 15 mm. Những bóng dài hơn thường gây áp lực lên toàn bộ mạch thận, dẫn tới co thắt động mạch thận. Nên dùng bóng nhỏ hơn 1 mm so với kích thước thật của động mạch thận đo được. Nếu mạch thận hẹp khít, xơ vữa nhiều, có thể cần dùng bóng nhỏ hơn nữa. Tùy thuộc vào mục đích, chỉ nong bóng đơn thuần, không đặt stent hoặc nong bóng kết hợp đặt stent.
Trong trường hợp loạn sản xơ cơ, nong bóng đơn thuần là đủ. Một số trường hợp cần sử dụng bóng cắt (cutting balloon) hoặc bóng scoring (scoring balloon). Để tránh biến chứng vỡ ĐM thận, bóng cắt và bóng scoring nên được chọn có kích thước nhỏ hơn kích thước ĐM thận 1 mm, sau đó để tối ưu kết quả có thể nong lại bằng bóng thông thường với kích thước tương ứng ĐM thận.
Bóng phủ thuốc được sử dụng trong trường hợp tổn thương loạn sản xơ cơ mạch thận hoặc tái hẹp trong stent ĐM thận. Bóng phủ thuốc thường có cấu hình lớn hơn bóng thường, do vậy đôi khi đẩy vào lòng mạch không dễ dàng. Cần nong mạch thận nhiều lần bằng bóng thường để có thể đạt được hiệu quả tối đa khi sử dụng bóng phủ thuốc.
3.7 Đặt stent động mạch thận
Trong trường hợp nếu hẹp động mạch thận do xơ vữa, thường cần phải đặt stent. Thường sử dụng stent có bóng thay vì stent tự nở, nhất là khi can thiệp lỗ vào hay đoạn gần động mạch thận.
Đường kính stent nằm trong khoảng 5-8 mm, chiều dài 10-20 mm. Tỷ lệ đường kính stent/ ĐM thận nên là 1,1:1. Kích cỡ stent không nên to hơn 0,5 mm so với đường kính mạch máu vì nguy cơ vỡ hoặc bóc tách thành mạch. Thời gian lên bóng stent ít nhất là 20-30 giây. Chiều dài stent nên ngắn nhất có thể nhưng phải đảm bảo phủ hết toàn bộ tổn thương.
Trong trường hợp hẹp lỗ vào động mạch thận, stent cần bao phủ toàn bộ tổn thương và nhô vào động mạch chủ bụng khoảng 1 đến 2 mm.
Với trường hợp xơ vữa gây hẹp động mạch thận hai bên, bác sĩ can thiệp có thể lựa chọn can thiệp cả hai bên đồng thì hoặc hai thì.
3.8 Nong bóng sau khi đặt stent
Sau khi đặt stent, có thể cần nong lại bằng bóng áp lực cao để đảm bảo stent nở hoàn toàn.
Trong trường hợp, hẹp hai hoặc nhiều ĐM thận có thân chung ngắn hoặc không có thân chung, có thể cần nong đồng thời 2 bóng. Khi đó có 2 lựa chọn cho ống thông can thiệp, hoặc sử dụng ống thông 8F đi đường ĐM đùi hoặc sử dụng hai ống thông 6F tiếp cận đường ĐM đùi-đùi hoặc đùi-cánh tay trái.
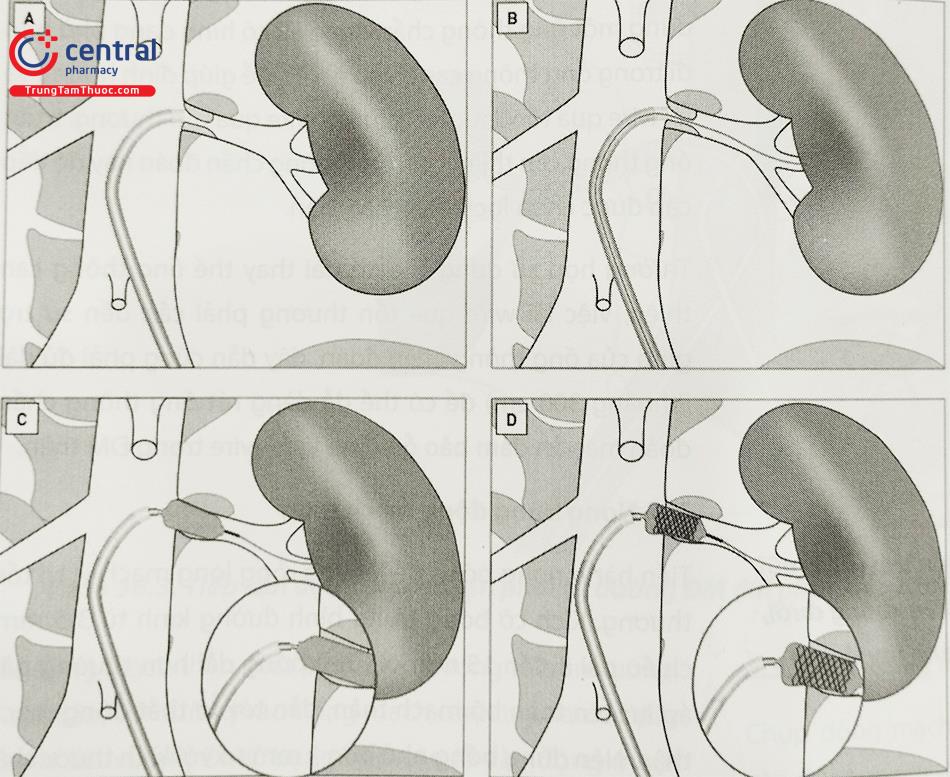
3.9 Chụp kiểm tra
Chụp kiểm tra đánh giá cẩn thận để phát hiện sớm các biến chứng: tắc mạch đoạn xa, thủng mạch thận, hay chảy máu nhu mô thận hay không.
3.10 Đóng đường vào mạch máu
Trước khi đóng mạch cần chụp lại vị trí chọc mạch có đúng ở ĐM đùi chung không và phát hiện các biến chứng tại chỗ: bóc tách, thông động tĩnh mạch, huyết khối,… Đóng mạch bằng các dụng cụ chuyên biệt nên được áp dụng có thể giúp bệnh nhân có thể vận động, đi lại sớm.
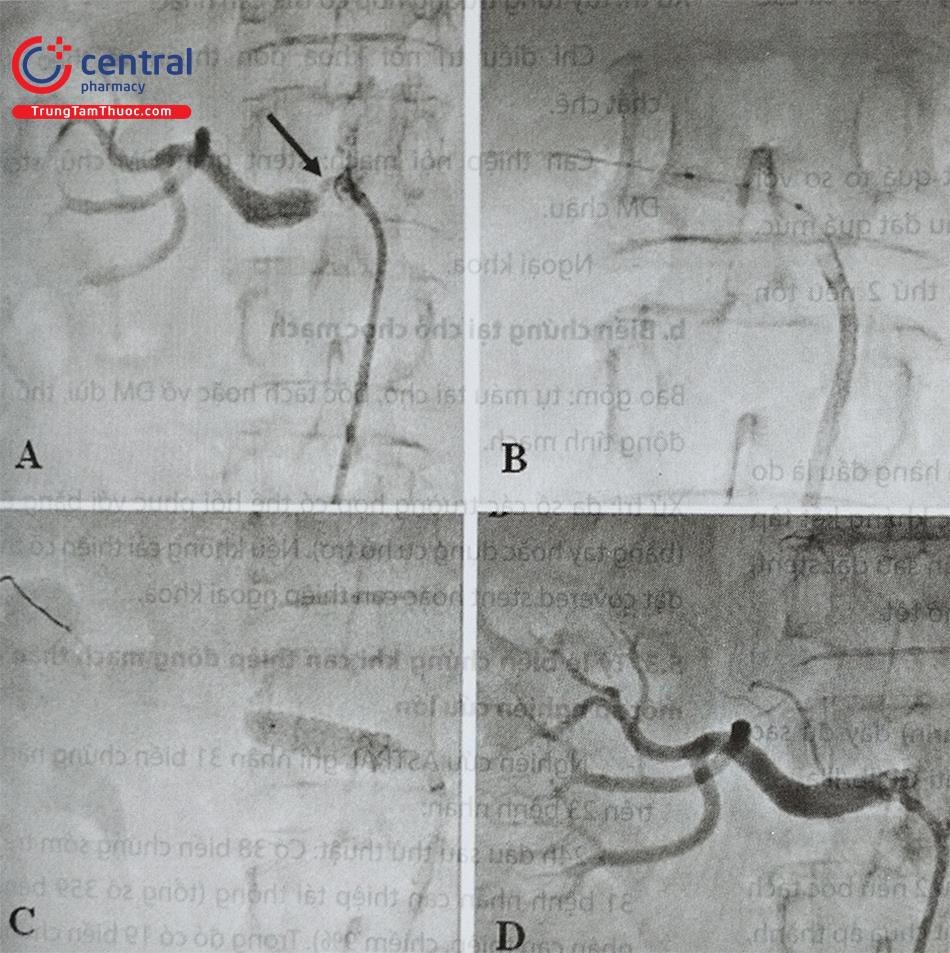
4 Tiêu chí đánh giá thành công thủ thuật
4.1 Về mặt hình ảnh chụp mạch
Hẹp tồn lưu dưới 30%, dòng chảy tốt.
Không có các biến chứng nặng: tắc đoạn xa ĐM thận; thủng vỡ ĐM thận gây chảy máu nhu mô thận, sau phúc mạc; lóc tách ĐM chủ bụng; huyết khối trong stent; lóc tách thành mạch có ý nghĩa.
4.2 Về mặt lâm sàng
Không có suy thận tiến triển sau can thiệp.
Không có hoặc rất nhẹ biến chứng đường vào mạch máu: tụ máu, thông động tĩnh mạch, xuất huyết sau phúc mạc.
5 Biến chứng của thủ thuật và xử lý
5.1 Biến chứng tại thận
5.1.1 Tắc động mạch thận đoạn xa, nhồi máu thận
Nguyên nhân: thuyên tắc mảng xơ vữa sau khi nong bóng, đặt stent hoặc huyết khối hoặc khí.
Xử trí:
- Đảm bảo chống đông máu (Heparin) đầy đủ sao cho ACT 250-300.
- Tăng áp lực tưới máu thận bằng bơm dịch muối sinh lý vào ĐM thận qua ống thông can thiệp.
- Hút huyết khối nếu gánh nặng huyết khối lớn, tắc nhánh mạch thận lớn. Nếu không thì ưu tiên điều trị nội khoa.
5.1.2 Thủng/vỡ động mạch thận
Đây là biến chứng rất nguy hiểm, có thể đe dọa tính mạch do gây chảy máu ổ bụng; chảy máu nhu mô thận, chảy máu bao thận; tụ máu sau phúc mạc…
Nguyên nhân thường do guidewire can thiệp không được kiểm soát tốt gây thủng mạch, đặc biệt sử dụng các guidewire cứng.
Cần phát hiện sớm và xử trí kịp thời:
- Cân nhắc trung hòa Heparin bằng Protamine, truyền tiểu cầu…
- Nong bóng kéo dài nhánh ĐM trước vị trí thủng, bít ĐM vỡ bằng mỡ tự thân, bóng cắt, keo sinh học,...
- Xử trí ngoại khoa nếu mức độ nặng mà tất cả các biện pháp trên không hiệu quả.
5.1.3 Tách thành động mạch thận
Nguyên nhân thường do kích thước stent quá to so với đường kính mạch thận, hoặc nong bóng sau đặt quá mức.
Cần phát hiện sớm và cân nhắc đặt stent thứ 2 nếu tổn thương có ý nghĩa, cản trở dòng chảy.
5.1.4 Tắc cấp stent do huyết khối
Đây là biến chứng khá ít gặp, nguyên nhân hàng đầu là do chống đông không đầy đủ (Heparin, thuốc kháng kết tập tiểu cầu). Ngoài ra còn do bóc tách ĐM thận sau đặt stent, stent không áp thành mạch, stent không nở tốt
Xử trí:
- Đảm bảo chống đông máu (Heparin) đầy đủ sao cho ACT 250-300 ms. Cân nhắc thêm Anti-GPIIb/IIIa.
- Hút huyết khối.
- Điều trị nguyên nhân: đặt stent thứ 2 nếu bóc tách ĐM thận sau stent, nong bóng nếu stent chưa áp thành, chưa nở tốt…
5.1.5 Dòng chảy chậm hoặc không có dòng chảy sau đặt stent (slow flow hoặc no reflow)
Nguyên nhân thường gặp: co thắt mạch máu, bóc tách hoặc tắc ĐM thận đoạn xa.
Xử trí: chẩn đoán và điều trị theo nguyên nhân:
- Co thắt mạch máu: tiêm trực tiếp qua ống thông các thuốc giãn mạch: Nitroglycerin, Nicardipine, …
- Bóc tách hoặc tắc ĐM thận đoạn xa: xử trí như trên.
5.1.6 Suy thận cấp sau can thiệp
Nguyên nhân do thuốc cản quang hoặc do tắc ĐM thận.
Xử trí: truyền dịch, truyền bicarbonat (còn tranh cãi), lọc máu (nếu có chỉ định).
5.2 Biến chứng ngoài thận
5.2.1 Tách thành ĐM chủ, ĐM chậu
Đây là biến chứng hiếm gặp nhưng nguy hiểm, có thể đe dọa tính mạng, do đó cần phát hiện sớm để xử trí kịp thời.
Nguyên nhân: thường xảy ra trên nền ĐM chủ – chậu bệnh lý (xơ vữa, xoắn vặn, vôi hóa nhiều), và/ hoặc do thao tác ống thông can thiệp một cách thô bạo.
Xử trí: tùy từng trường hợp có thể cân nhắc:
- Chỉ điều trị nội khoa đơn thuần và theo dõi chặt chẽ.
- Can thiệp nội mạch: stent graft ĐM chủ, stent ĐM chậu.
- Ngoại khoa.
5.2.2 Biến chứng tại chỗ chọc mạch
Bao gồm: tụ máu tại chỗ, bóc tách hoặc vỡ ĐM đùi, thông động tĩnh mạch.
Xử trí: đa số các trường hợp có thể hồi phục với băng ép (bằng tay hoặc dụng cụ hỗ trợ). Nếu không cải thiện có thể đặt covered stent hoặc can thiệp ngoại khoa.
5.3 Tỷ lệ biến chứng khi can thiệp động mạch thận ở một số nghiên cứu lớn
Nghiên cứu ASTRAL ghi nhận 31 biến chứng nặng trên 23 bệnh nhân:
24h đầu sau thủ thuật: Có 38 biến chứng sớm trên 31 bệnh nhân can thiệp tái thông (tổng số 359 bệnh nhân can thiệp, chiếm 9%). Trong đó có 19 biến chứng nặng, gồm 1 biến chứng phù phổi cấp, và 1 biến chứng nhồi máu cơ tim trên bệnh nhân khác. Có 5 biến chứng thuyên tắc mạch thận, 4 biến chứng tắc động mạch thận, 4 biến chứng thủng mạch thận, 3 ca tắc mạch cholesterol dẫn đến hoại tử ngoại vi và cắt cụt tay hoặc chân.
Tại thời điểm 1 tháng: Có 55/280 bệnh nhân xuất hiện các biến chứng. Bao gồm 12 biến chứng nặng (trên 11 bệnh nhân): 2 bệnh nhân tử vong (do nguyên nhân tim mạch), 4 trường hợp tụ máu vùng đùi hoặc chảy máu nặng cần nhập viện, 5 trường hợp suy thận cấp và 1 trường hợp tắc động mạch thận.
Nghiên cứu CORAL có 11/459 bệnh nhân biến chứng tách thành động mạch thận trong quá trình chụp, không có bệnh nhân cần phải lọc máu trong 30 ngày, 1 bệnh nhân ở nhóm can thiệp tái thông phải lọc máu.
6 Một số nghiên cứu lâm sàng về can thiệp động mạch thận qua da
6.1 Tác động trên kiểm soát tăng huyết áp
Hiệu quả hạ huyết áp đối với can thiệp động mạch thận đã được báo cáo ở một số nghiên cứu. Phân tích tổng hợp (Meta-analysis) của Weinberg I (2014) cho thấy 61% bệnh nhân can thiệp đặt stent cho hẹp động mạch thận do xơ vữa hạ được huyết áp tối đa > 10 mmHg so với trước can thiệp và không có sự thay đổi đáng kể ở chức năng thận, thậm chí có những bệnh nhân có thể dừng điều trị thuốc hạ huyết áp sau 9 tháng theo dõi.
Nghiên cứu của Cooper và cộng sự không cho thấy có sự khác biệt về số lượng thuốc hạ huyết áp cần sử dụng trên 2 nhóm bệnh nhân đặt stent và điều trị nội khoa đơn thuần (3,3±1,5 và 3,5±1,4 tương ứng; p=0,24). Xét về hiệu quả hạ huyết áp, nhóm đặt stent có giảm 2 mmHg huyết áp tâm thu so với nhóm chỉ điều trị nội khoa (95%CI, – 4,4 đến – 0,2 mmHg, p=0,03).
Ritchie nghiên cứu 467 bệnh nhân có xơ vữa gây hẹp động mạch thận ≥ 50%, bao gồm 3 bệnh cảnh lâm sàng là phù phổi cấp tiến triển nhanh (n = 37), tăng huyết áp kháng trị (n = 116), suy thận tiến triển nhanh (n= 46), các bệnh nhân còn lại không có dấu hiệu trên (n = 230). Nhóm bệnh nhân có biểu hiện lâm sàng, hoặc tăng huyết áp kháng trị đơn thuần, hoặc suy thận tiến triển nhanh: can thiệp động mạch thận không thay đổi tỷ lệ tử vong, biến cố tim mạch và tiến triển bệnh thận giai đoạn cuối. Nhóm bệnh nhân có biểu hiện kết hợp tăng huyết áp kháng trị và suy thận tiến triển nhanh (n= 31): can thiệp mạch thận làm giảm tỷ lệ tử vong (HR, 0,15; 95% CI, 0,02-0,9; p=0,04) và biến cố tim mạch (HR, 0,23; 95% CI, 0,1-0,6; p=0,02).
6.2 Tác động trên bệnh nhân phù phổi cấp tiến triển nhanh
Phù phổi cấp tiến triển nhanh (Flash Pulmonary Edema – FPE) là tình trạng suy tim mất bù cấp tính nghiêm trọng, thường liên quan đến hoạt động quá mức của hệ RAAS, quá tải dịch,. Nhiều nguyên nhân có thể dẫn đến FPE trong đó có hẹp động mạch thận. Chẩn đoán FPE chủ yếu dựa vào lâm sàng, hỏi bệnh và khám xét.
Nghiên cứu của Ritchie trên nhóm bệnh nhân có biểu hiện FPE (n =37): can thiệp mạch thận làm giảm tỷ lệ tử vong (HR, 0,4; 95% CI, 0,2-0,9; P = 0.01) nhưng không làm giảm các biến cố tim mạch hoặc tiến triển của bệnh thận mạn, so với điều trị nội khoa đơn thuần.
6.3 Tác động trên các biến cố khác
Cooper CJ và cộng sự tiến hành nghiên cứu CORAL trên 947 bệnh nhân xơ vữa mạch thận kèm theo tăng huyết áp tâm thu (đã dùng tối thiểu 2 loại thuốc hạ huyết áp) hoặc bệnh thận mạn tính, bệnh nhân được chia 2 nhóm điều trị nội khoa đơn thuần (n= 459) và nhóm điều trị nội khoa kết hợp đặt stent động mạch thận (n=472). Các bệnh nhân có mức độ hẹp từ 80 – dưới 100%, hoặc 60 – 80% kèm theo gradient tâm thu qua chỗ hẹp trên 20 mmHg. Kết quả trong thời gian 5 năm theo dõi, không có sự khác biệt về các biến cố chính (tử vong tim mạch hoặc do thận, đột quỵ, nhồi máu cơ tim, tỷ lệ nhập viện vì suy tim sung huyết, suy thận tiến triển, hoặc điều trị thay thế thận vĩnh viễn).
Điểm hạn chế của nghiên cứu là thủ thuật can thiệp đặt stent được tiến hành ở những bệnh nhân với mức độ hẹp chỉ trên 60% (kèm theo gradient qua chỗ hẹp > 20 mmHg). Tuy nhiên nghiên cứu cũng không cho thấy lợi ích khác biệt khi can thiệp ở những bệnh nhân có hẹp động mạch thận trên 80% so với hẹp dưới 80%. Nghiên cứu cũng không bao gồm thủ thuật nong bóng tạo hình.
7 Theo dõi sau can thiệp
7.1 Theo dõi ngắn hạn
Trong vòng 30 ngày sau khi xuất viện, bệnh nhân tiếp tục được theo dõi chặt chẽ để phát hiện sớm các biến chứng có thể xảy ra:
Các triệu chứng của nhồi máu thận hoặc tắc stent ĐM thận: đau bụng, thiểu niệu vô niệu, đái máu.
Chức năng thận: sau 48-72 giờ và 7 ngày, để phát hiện biến chứng suy thận do thuốc cản quang hoặc nhồi máu thận.
Bệnh nhân nên được siêu âm ĐM thận sau 1 tháng để đánh giá tình trạng stent (sự lưu thông, huyết khối stent, bóc tách thành mạch, …). Chụp CT mạch thận có thể cân nhắc thực hiện nếu cần thiết.
Vấn đề sử dụng thuốc chống huyết khối sau can thiệp:
Ở bệnh nhân không có chỉ định dùng thuốc chống đông: kháng kết tập tiểu cầu kép gồm Aspirin kết hợp một thuốc ức chế P2Y12: Clopidogrel hoặc Ticagrelor, prasugrel (trong trường hợp dùng với chỉ định nhồi máu cơ tim, đặt stent ĐM vành, …) được khuyến cáo ít nhất 1 tháng, sau đó dùng đơn độc 1 loại kháng kết tập tiểu cầu. Việc sử dụng liều kép kéo dài trên 1 tháng phụ thuộc vào từng trường hợp cụ thể, cần được xem xét kĩ bởi bác sĩ can thiệp.
Ở bệnh nhân có chỉ định dùng thuốc chống đông (rung nhĩ, van cơ học, …): aspirin được cân nhắc dùng thêm trong vòng 1 tháng sau can thiệp.
7.2 Theo dõi dài hạn
Trong 12 tháng đầu sau can thiệp, bệnh nhân nên được siêu âm ĐM thận 6 tháng một lần, sau đó là 12 tháng
một lần để phát hiện tái hẹp stent. Chụp CT mạch thận có thể cân nhắc để hỗ trợ chẩn đoán nếu cần thiết tùy trường hợp.
8 Tài liệu tham khảo
- 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS) | European Heart Journal | Oxford Academic [Internet]. [cited 2022 Jul 10]. Available from: https://academic.oup. com/eurheartj/article/39/9/763/4095038.
- Grüntzig A, Vetter W, Meier B, Kuhlmann U, Lütolf U, Siegenthaler Treatment of renovascular hypertension with percutaneous transluminal dilatation of a renal artery stenosis. Lancet. 1978;1:801-2. (http://www.ncbi.nlm.nih.gov/pubmed?term=Lancet. 1978;1:801-2.)
- Mahler F, Krneta A, Haertel M. Treatment of renovascular hypertension by transluminal renal artery dilatation. Ann Intern Med. 1979;90:56-7. (http://wwncbi.nlm.nih.gov/pubmed?term=Ann Intern Med. 1979;90:56-7.)
- Plouin PF, Chatellier G, Darne B, Raynaud A. Blood pressure outcome of angioplasty in atherosclerotic renal artery stenosis: A randomized trial. The EMMA-study group. Hypertension. 1998;31:823-9. (http://wwncbi.nlm.nih.gov/pubmed?term=Hypertension. 1998;31:823-9.)
- Van Bockel JH, Weibull H. Fibrodysplastic disease of renal arteries. Eur J Vasc Surg. 1994;8:655-7. (http://wwncbi.nlm.nih.gov/ pubmed?term=Eur J Vasc Surg. 1994;8:655-7.)
- Baert AL, Wilms G, Amery A, Vermylen J, Suy R. Percutaneous transluminal renal angioplasty: Initial results and long-term follow-up in 202 patients. Cardiovasc Intervent Radiology. 1990;13:22-8. (http://www.ncbi.nlm.nih.gov/pubmed?term=Cardiovasc Intervent Radiology. 1990;13:22-8.)
- Bonelli FS, McKusick A, Textor SC, Kos PB, Stanson AW, Johnson CM, Sheedy PF 2nd, Welch TJ, Schirger A. Renal artery angioplasty: Technical results and clinical outcome in 320 patients. Mayo Clin Proc. 1995; 70:1041-52. (http://wwncbi.nlm.nih.gov/pubmed?term= Mayo Clin Proc. 1995; 70:1041-52.)
- Cluzel P, Raynaud A, Beyssen B, Pagny JY, Gaux JC. Stenoses of renal branch arteries in Fibromuscular dysplasia: Results of percutaneous transluminal angioplasty. Radiology. 1994;193:227-32. (http://wwncbi.nlm.nih.gov/pubmed?term=Radiology. 1994;193:227-32.)
- Dorros G, Prince C, Mathiak L. Stenting of renal artery stenosis achieves better relief of the obstructive lesion than balloon angioplasty. Cath Cardiovasc Diagn. 1993;29:191-8. (http://wwncbi.nlm.nih.gov/pubmed?term=Cath Cardiovasc Diagn. 1993;29:191-8.)
- Blum U, Krumme B, Flügel P, Gabelmann A, Lehnert T, Buitrago-Tellez C, Schollmeyer P, Langer M. Treatment of ostial renal-artery stenoses with vascular endoprotheses after unsuccessful balloon angioplasty. N Engl J Med. 1997;336:459-65. (http://wwncbi.nlm.nih. gov/pubmed?term=N Engl J Med. 1997;336:459-65.)
- Dorros G, Jaà M, Mathiak L, Dorros II, Lowe A, Murphy K, He 4-year follow-up of Palmaz-Schatz stent revascularisation as treatment for atherosclerotic renal artery stenosis. Circulation. 1998;98:642-7. (http://www.ncbi.nlm.nih.gov/pubmed?term=Circulation. 1998;98:642-7.)
- Henry M, Amor M, Henry I, Ethevenot G, Allaoui M, Tricoche O, Porte JM, Touchot N. Stent placement in the renal artery: Three-year experience with the Palmaz stent. J Vasc Interv Radiol. 1996;7:343-50. (http://wwncbi.nlm.nih.gov/pubmed?term=J Vasc Interv Radiol. 1996;7:343-50.)
- White CJ, Ramee SR, Collins TJ, Jenkins JS. Renal artery stent placement: Utility in lesions difficult to treat with balloon angioplasty. J Am Coll Cardiol. 1999; 30:1445-50. (http://wwncbi.nlm.nih.gov/pubmed? term=J Am Coll Cardiol. 1999; 30:1445-50.)

