Can thiệp động mạch chủ bụng điều trị phình động mạch chủ bụng
Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS. Phạm Mạnh Hùng
Tác giả
ThS.BSNT.Lê Xuân Thận
ThS.BSNT.Lê Văn Đạt
TS.BS.Phạm Minh Tuấn
PGS.TS.BS.Nguyễn Ngọc Quang
PGS.TS.BS.Phạm Mạnh Hùng
Phình động mạch chủ bụng là bệnh lý có tỉ lệ tử vong cao. Can thiệp động mạch chủ bụng để điều trị bệnh lý này như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu những thông tin trong bài viết sau đây.
1 Tổng quan
Tỷ lệ phình động mạch chủ bụng tăng theo tuổi, chiếm khoảng 2,6% ở nam và 0,5% ở nữ ở độ tuổi 45-54. Tỷ lệ phình động mạch chủ bụng ở lứa tuổi 75 đến 84 gặp ở nam là 19,8% và ở nữ 5,2%. Tỷ lệ gặp ở nam cao gấp 4-6 lần ở nữ. Tỷ lệ vỡ phình động mạch chủ bụng ngoài viện tử vong đến 80%-90%. Chúng ta có thể làm giảm tỷ lệ tử vong bằng chẩn đoán và điều trị sớm phình động mạch chủ bụng. Can thiệp bệnh lý phình động mạch chủ bụng (Endovascular Aneurysm Repair -EVAR) là một tiến bộ quan trọng trong điều trị bệnh lý phình động mạch chủ bụng. EVAR được thực hiện bằng cách đưa các miếng Stent graft lót, phủ bên trong lòng mạch vị trí khối phình. Sau khi dụng cụ Stent graft được thả ra sẽ áp sát vào thành động mạch chủ đầu gần và các mạch chậu ở phía xa để loại trừ áp lực và dòng máu chảy vào khối phình động mạch chủ.
So với phẫu thuật mở điều trị phình động mạch chủ bụng EVAR là thủ thuật ít xâm lấn có hiệu quả làm giảm đáng kể tỷ lệ tử vong chu phẫu cũng như các biến chứng.
2 Đặc điểm giải phẫu
2.1 Giải phẫu động mạch chủ – chậu
Động mạch chủ bụng là một cấu trúc nằm sau phúc mạc, bắt đầu từ vị trí ĐMC chui qua cơ hoành và kéo dài đến chỗ chia đôi thành động mạch chậu chung phải và trái ở ngang mức đốt sống thắt lưng thứ tư. ĐMC bụng nằm hơi bên trái đường giữa cùng tĩnh mạch chủ dưới nằm ở bên cạnh. Các nhánh của động mạch chủ bụng bao gồm động mạch hoành trái và phải, động mạch thượng thận giữa trái và phải, động mạch thân tạng, động mạch mạc treo tràng trên, động mạch thận trái và phải, động mạch thận phụ, động mạch tuyến sinh dục trái và phải, động mạch mạc treo tràng dưới, động mạch chậu chung trái và phải, động mạch cùng giữa và các cặp động mạch thắt lưng (L1-L4).
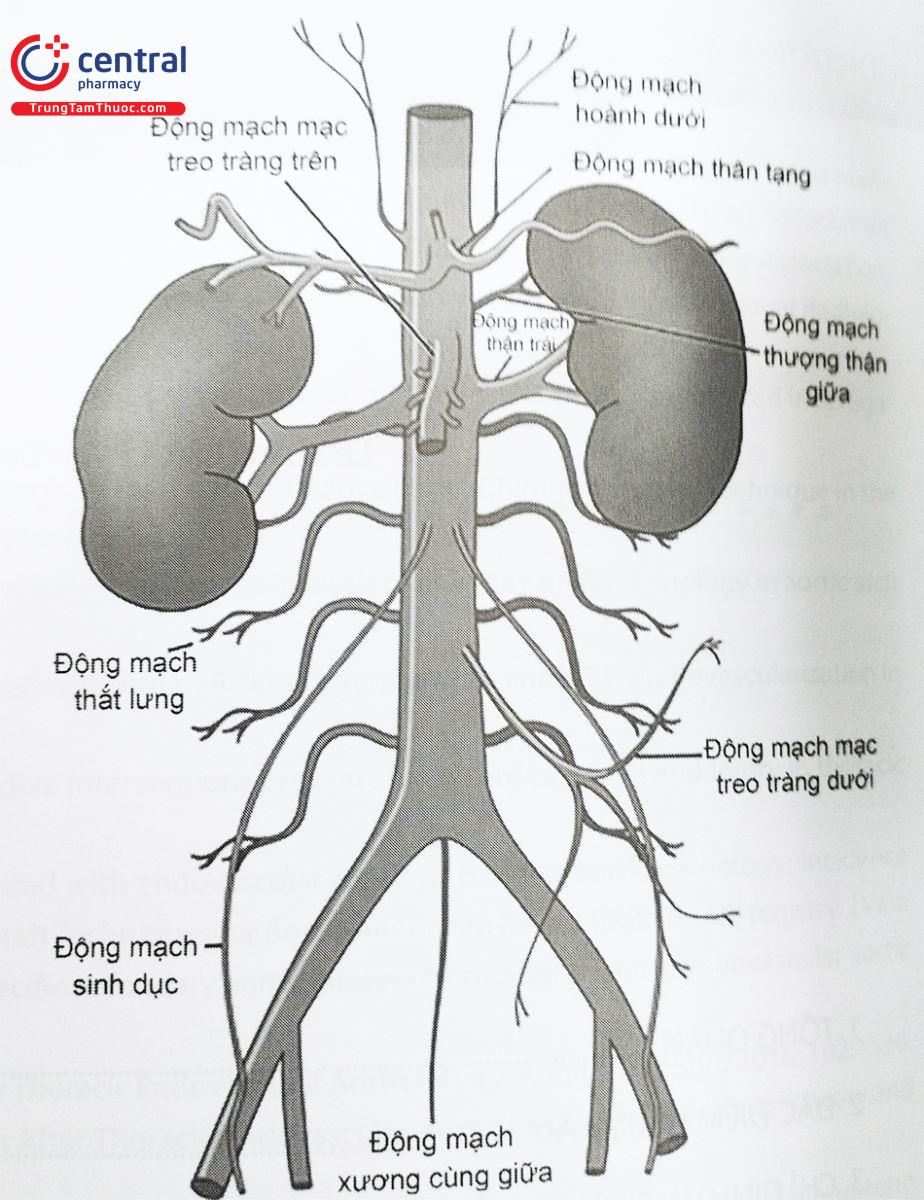
Động mạch chậu chung chia đôi thành động mạch chậu ngoài và động mạch chậu trong ngay trước khi vào khung chậu. Động mạch chậu trong còn được gọi là động mạch hạ vị cung cấp các nhánh trước và sau đến các cơ quan vùng chậu và cũng cung cấp máu nuôi cơ của vùng chậu hông. Động mạch chậu ngoài đi qua bên dưới dây chằng bẹn để trở thành động mạch đùi chung.
2.2 Phình ĐMC bụng
2.2.1 Định nghĩa phình ĐMC bụng
Phình động mạch chủ bụng được định nghĩa là khi có sự giãn cục bộ của động mạch chủ và đường kính của vùng giãn tăng hơn 50% so với đường kính động mạch chủ của người bình thường ở cùng độ tuổi, giới, chiều cao, cân nặng. Đường kính bình thường của động mạch chủ ở ngang mức động mạch thận là khoảng 2,0 cm (khoảng 1,4 cm đến 3,0 cm). Trong thực hành lâm sàng đường kính động mạch chủ lớn hơn 3,0 cm được coi là phình động mạch chủ bụng đối với hầu hết các bệnh nhân.
2.2.2 Phân loại phình ĐMC bụng
Theo hình thái phình động mạch chủ:
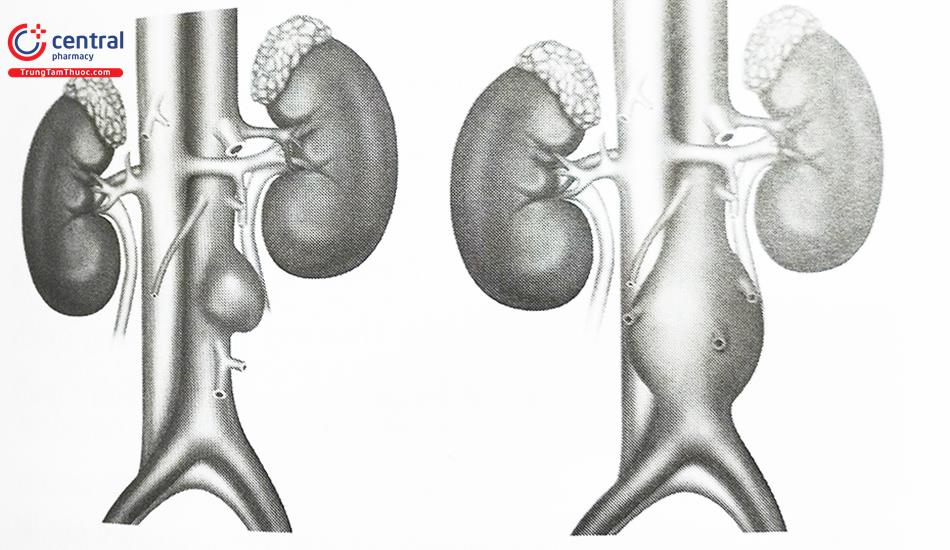
Phình động mạch chủ bụng hình thoi: Phình đồng tâm giãn theo chu vi động mạch chủ bụng gây ra phình hình
Phình hình túi: Giãn khu trú tại một phần động mạch chủ bụng không đồng tâm tạo khối phình hình túi.
Phình động mạch chủ bụng được mô tả với tương quan động mạch thận
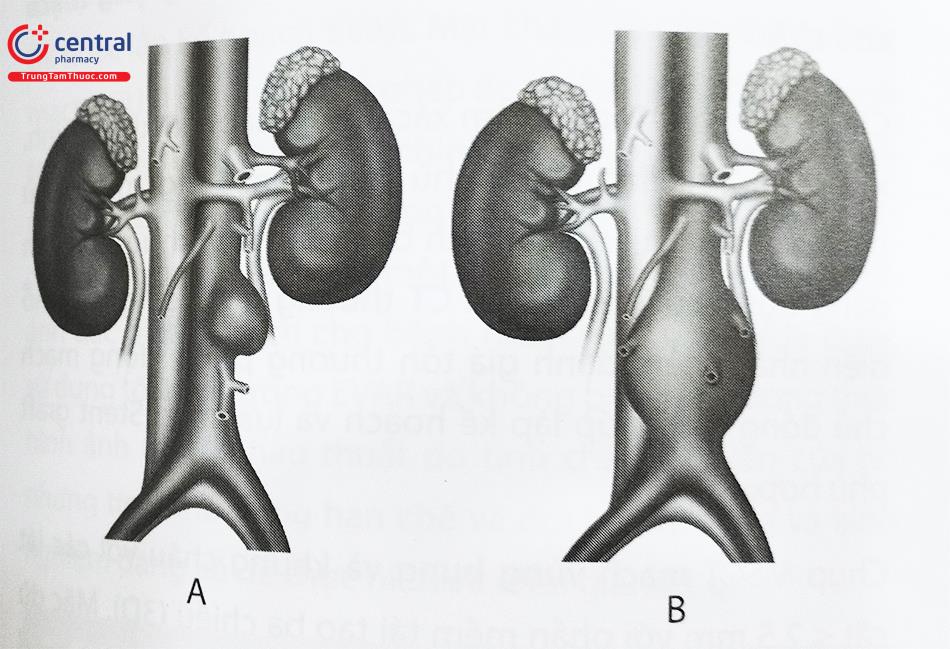
- Phình ĐMC bụng đoạn dưới thận – Phình ĐMC bắt đầu bên dưới động mạch thận.
- Phình ĐMC bụng ngang ĐM thận – Phình ĐMC bắt đầu từ ngang mức động mạch thận.
- Phình ĐMC bụng trên thận – Phình mạch bắt đầu từ phía trên động mạch thận.
.jpg)
Phình ĐMC bụng thường xảy ra nhất ở đoạn động mạch chủ dưới mức động mạch thận, Có tới 40% phình ĐMC bụng có liên quan đến (các) tổn thương phình động mạch chậu. Mặc dù phần lớn các ca can thiệp nội mạch điều trị phình động mạch được thực hiện trên tổn thương phình động mạch chủ đoạn dưới động mạch thận và động mạch chậu, việc sửa chữa nội mạch của các tổn thương phình động mạch chủ bụng đoạn trên động mạch thận hay ngang mức ĐM thận đã được thực hiện bằng cách sử dụng các kỹ thuật nội mạch đặc biệt với các thiết kế dụng cụ Stent graft chuyên biệt.
2.2.3 Định nghĩa các thuật ngữ cấu trúc giải phẫu
Một số kích thước động mạch chủ rất quan trọng để xác định tính khả thi của việc can thiệp nội mạch phình động mạch và xác định kích thước dụng cụ can thiệp.
Các thuật ngữ:
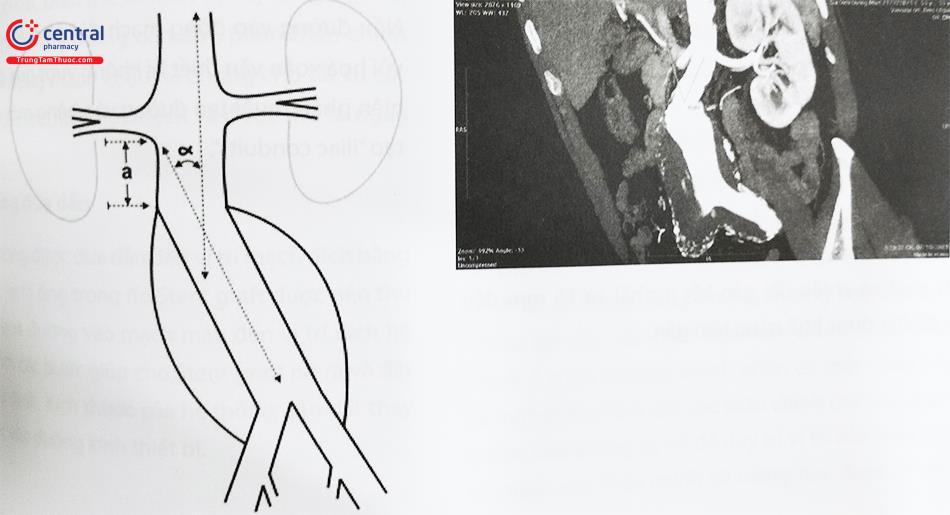
- Đường kính cổ khối phình động mạch chủ bụng: Đường kính động mạch chủ ở vị trí động mạch thận thấp nhất.
- Chiều dài cổ khối phình động mạch chủ bụng: Khoảng cách từ động mạch thận thấp nhất đến vị trí bắt đầu của túi phình.
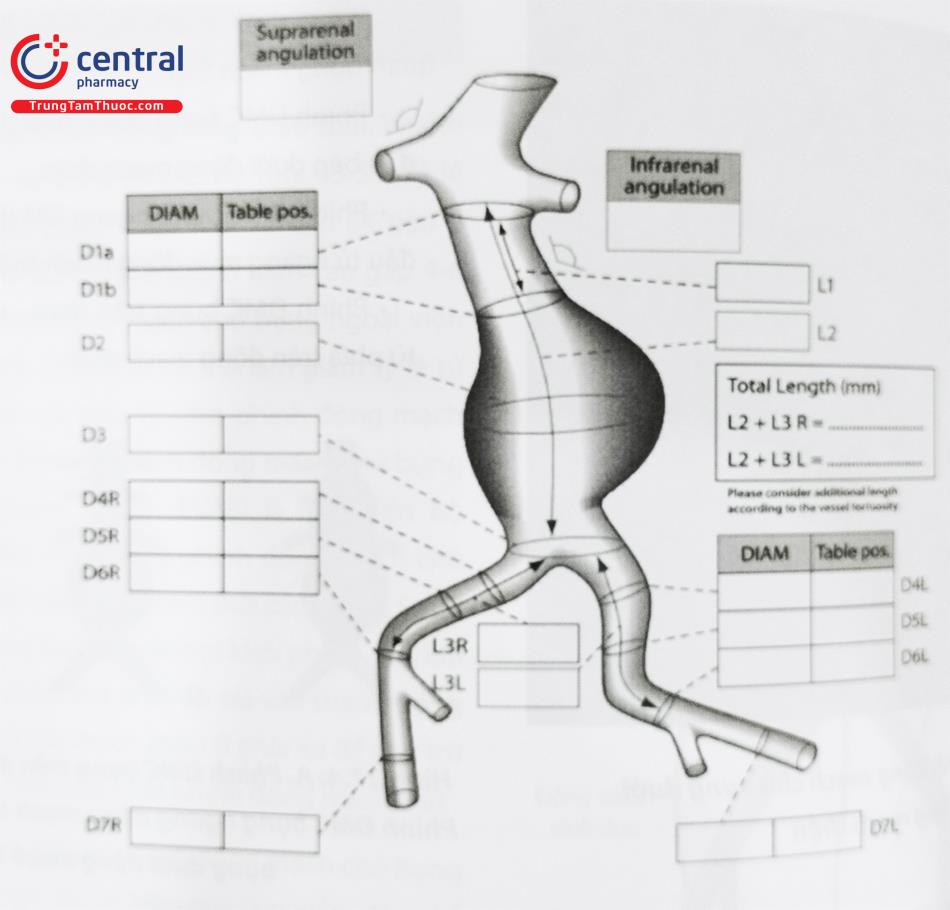
- Góc cổ túi phình: Góc hình thành giữa các điểm nối động mạch thận thấp nhất, bắt đầu của túi phình và chỗ chia đôi động mạch chủ.
- Cổ khối phình động mạch chủ hình nón/hình nón ngược: Gọi là cổ hình nón khi đường kính của động mạch chủ vị trí dưới 15 mm của động mạch thận thấp nhất lớn hơn đường kính của động mạch chủ ở động mạch thận thấp nhất là 10%.
- Chiều dài động mạch chủ dưới thận – Khoảng cách từ dưới động mạch thận thấp nhất đến chỗ chia đôi của động mạch chủ chậu.
Các kích thước khác quan trọng để xác định kích thước dụng cụ Stent graft bao gồm đường kính động mạch chậu chung tối đa, đường kính động mạch chậu ngoài tối thiểu, khoảng cách từ cổ động mạch chủ đến chỗ phân đôi và đường kính túi phình ĐMC bụng lớn nhất. Các tiêu chí xác định sự phù hợp về mặt giải phẫu để tiến hành can thiệp nội mạch động mạch chủ bụng.
Bất thường động mạch thận – Động mạch thận phụ có ở khoảng 30% dân số và thường bắt nguồn từ động mạch chủ đoạn bụng đoạn thắt lưng. Loại bỏ một mạch thận phụ bằng can thiệp nội mạch có thể dẫn đến nhồi máu một phần thận.
Thận hình móng ngựa, một bất thường hay gặp nhất ở thận, có liên quan đến nguồn cung cấp động mạch bất thường với nhiều động mạch thận có thể xuất phát từ động mạch chủ, hoặc mạch chậu (chung, ngoài hoặc trong) hoặc động mạch cùng giữa.
2.3 Chẩn đoán hình ảnh đánh giá phình động mạch chủ chậu
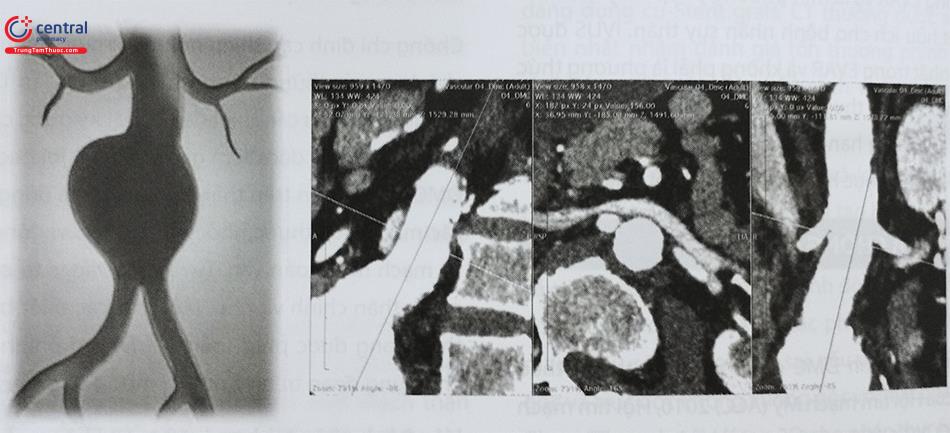
Chẩn đoán hình ảnh nhằm xác định giải phẫu khối phình, xác định các đặc điểm phù hợp của động mạch chủ bụng với can thiệp nội mạch bao gồm kích thước và hình dáng dụng cụ Stent graft. CT thường được sử dụng phổ biến nhất nhằm đánh giá tổn thương phình động mạch chủ đồng thời giúp lập kế hoạch và lựa chọn Stent graft phù hợp.
Chụp MSCT mạch vùng bụng và khung chậu với các lát cắt ≤ 2,5 mm với phần mềm tái tạo ba chiều (3D). Mặc dù có thể sử dụng hình ảnh CT hai chiều (2D), nhưng có thể xảy ra sai số đo đạc (đường kính động mạch chủ, chiều dài động mạch chủ. Ngoài ra các phép đo đường kính động mạch chủ sẽ bị đánh giá sai nếu động mạch chủ bị gập góc và trục dọc không vuông góc với mặt phẳng hình ảnh. Chụp CT mạch với tái tạo 3D cho phép thực hiện các phép đo vuông góc với trục của động mạch chủ. Các phép đo độ dài dựa trên hình tái tạo đường trung tâm cũng có thể được thực hiện bằng cách tái tạo 3D. Phép đo chiều dài 3D chính xác hơn phép đo 2D và có thể cải thiện khả năng chọn lựa chính xác kích cỡ stent graft, đặc biệt ở những bệnh nhân có mạch gập góc và xoắn vặn.
Chụp cộng hưởng từ (MRI) mạch chủ có thể được sử dụng để lập kế hoạch trước can thiệp; tuy nhiên, cần dùng MRI có tiêm đối quang từ gadolinium trong trường hợp bệnh nhân có rối loạn chức năng thận là một chống chỉ định tương đối.
Việc sử dụng kỹ thuật chụp động mạch kỹ thuật số xóa nền (DSA) để đo đạc kích thước động mạch chủ bị hạn chế bởi sai số đo đạc. Vì chụp được hình ảnh lòng trong của động mạch chủ chứ không phải thành động mạch chủ, nên DSA không thể đánh giá đường kính lòng mạch thực, mức độ huyết khối, mảng bám hoặc mức độ vôi hóa. Sai số trong phép đo chiều dài có thể xảy ra khi sử dụng các ống thông trong lòng mạch theo khoảng cách ngắn nhất quanh các đường cong của động mạch chủ. Chụp động mạch chủ có thể được sử dụng trong các tình huống khẩn cấp để ước tính đường kính động mạch chủ đầu gần và đường kính của vùng gắn kết của Stent graft khi điều trị bệnh nhân phình ĐMC vỡ, nhưng nếu không phải tình trạng vỡ thì nó không được khuyến cáo như một phương thức chẩn đoán hình ảnh trước EVAR thông thường.
Siêu âm thông thường qua bề mặt cơ thể không phải là một phương thức hình ảnh thích hợp để xác định tính khả thi hoặc lập kế hoạch EVAR. Mặt khác, siêu âm trong lòng mạch (IVUS) cung cấp các phép đo chiều dài và đường kính trong can thiệp một cách chính xác (dựa trên vị trí mạch nhánh), có thể được sử dụng làm phương thức hình ảnh duy nhất trong EVAR và là một phương pháp thay thế hình ảnh đặc biệt hữu ích cho bệnh nhân suy thận. IVUS được sử dụng tốt nhất trong EVAR và không phải là phương thức hình ảnh trước phẫu thuật do tính chất xâm lấn của nó nhưng tính khả dụng hạn chế và đòi hỏi kỹ năng và kinh nghiệm đáng kể để thực hiện và diễn giải kết quả.
3 Chỉ định và chống chỉ định
3.1 Chỉ định
Chỉ định điều trị phình ĐMC được sự đồng thuận theo hướng dẫn của Hội tim mạch Mỹ (ACC) 2010, Hội tim mạch châu Âu (ESC) 2014, Hội mạch máu châu Âu (ESVS) 2019
3.1.1 Phình động mạch chủ bụng có triệu chứng
Có 3 biểu hiện lâm sàng chính của phình động mạch chủ bụng:
- Vỡ hoặc dọa vỡ.
- Biến chứng thuyên tắc mạch.
- Chèn ép các cấu trúc lân cận do hiệu ứng khối.
Bộ ba triệu chứng lâm sàng kinh điển của phình động mạch chủ bụng bao gồm: khởi phát đột ngột đau bụng hoặc đau thắt lưng, khối có mạch đập ở bụng, hạ huyết áp tuy nhiên, bộ ba này xuất hiện ở dưới 40% bệnh nhân. Tiên lượng của vỡ phình động mạch chủ bụng rất xấu, phần lớn bệnh nhân tử vong trước khi tới bệnh viện và tử vong tại viện khoảng 40% – 50%. Ước tính 80% tử vong do phình động mạch chủ bụng là thứ phát sau vỡ phình, do đó tầm quan trọng của phát hiện và can thiệp sớm trước khi xảy ra biến chứng vỡ.
3.1.2 Phình động mạch chủ bụng không triệu chứng
Quyết định điều trị phình động mạch chủ bụng không triệu chứng bao gồm nguy cơ vỡ phình, nguy cơ thủ thuật, kỳ vọng sống của bệnh nhân. Đường kính lớn nhất của khối phình hiện nay được chấp nhận là yếu tố chính nhất quyết định nguy cơ vỡ phình. Nhìn chung, nguy cơ vỡ phình tăng đáng kể khi đường kính lớn hơn 5,5cm. Thêm vào đó, khối phình tăng nhanh, được định nghĩa là tăng hơn 1 cm đường kính trong 1 năm hoặc 0,5 cm đường kính trong 6 tháng, có nguy cơ vỡ phình cao hơn và được cân nhắc có chỉ định can thiệp. Tỷ lệ tử vong do mổ mở có kế hoạch phình động mạch chủ bụng được báo cáo là từ 5% đến 8%.
3.2 Chống chỉ định
Chống chỉ định can thiệp nội mạch của phình động mạch chủ bụng ở những bệnh nhân không đáp ứng các tiêu chuẩn giải phẫu cần thiết để đặt bất kỳ dụng cụ Stent graft có sẵn nào. Các đặc điểm giải phẫu bất lợi bao gồm phình ĐMC bụng đoạn trên thận hoặc có chứa động mạch thận, các mạch kích thước nhỏ, vôi hóa chu vi động mạch chủ, và mạch máu xoắn vặn. Tùy thuộc vào vị trí của các động mạch thận chính và phụ. Một loạt các thiết bị thế hệ tiếp theo đang được phát triển để điều trị phình động mạch chủ bụng đoạn trên và ngang mức động mạch thận.
Liệu bệnh nhân trẻ hơn (<60 tuổi) không có nguy cơ cao phẫu thuật mở có nên phẫu thuật mở sửa chữa hay không so với EVAR vẫn còn tranh cãi. Việc theo dõi trong một thời gian dài khiến bệnh nhân tiếp xúc và tích lũy mức độ bức xạ lớn hơn, và EVAR không loại bỏ hoàn toàn nguy cơ vỡ động mạch chủ trong tương lai. Hướng dẫn từ các hiệp hội y khoa và phẫu thuật lớn nhấn mạnh cách tiếp cận cá thể hoá khi lựa chọn can thiệp nội mạch, có tính đến tuổi của bệnh nhân và các yếu tố nguy cơ về bệnh tật và tử vong sau phẫu thuật.
4 Đo kích thước động mạch chủ bụng, lựa chọn dụng cụ, lập kế hoạch trong can thiệp nội mạch
Sự phù hợp về giải phẫu
Sự phù hợp về giải phẫu là yếu tố quyết định quan trọng nhất cho sự thành công của thủ thuật can thiệp nội mạch phình động mạch chủ bụng về lâu dài. Với các thiết kế dụng cụ ban đầu, có khoảng 50% bệnh nhân không phù hợp cho EVAR vì vị trí, mức độ hoặc hình thái của túi phình, hoặc sự không phù hợp của đường vào mạch máu. Tuy nhiên với sự cải tiến các thiết bị cho phép thực hiện đặt stent graft trên các bệnh nhân có chiều dài cổ túi phình ngắn hơn và các thiết bị có kích thước trong hệ thống nhỏ hơn đã mở rộng ứng dụng can thiệp EVAR cho gần 2/3 số bệnh nhân có phình động mạch chủ bụng đoạn dưới động mạch thận.
Để loại trừ dòng máu đi vào túi phình, dụng cụ Stent graft phải có vùng hàn gắn thích hợp nơi dụng cụ tiếp xúc với thành động mạch của cổ động mạch chủ đầu gần và ở xa trong mỗi động mạch chậu, hay còn gọi là vùng hàn gắn – landing zones. Dụng cụ can thiệp nội mạch chỉ dựa vào lực
hướng tâm được tạo ra bởi dụng cụ Stent graft tại các vùng hàn gắn nhằm cố định mảnh graft vào thành động mạch chủ. Do đó, các tiêu chí về giải phẫu nhất định phải được đáp ứng để thực hiện can thiệp nội mạch. Các tiêu chí này là số đo của cổ hàn gắn đầu gần phình động mạch chủ và động mạch chậu, động mạch đùi.
4.1 Đường kính cổ túi phình động mạch chủ
Đường kính dụng cụ Stent graft được xác định bằng cách đo đường kính cổ túi phình động mạch chủ (ví dụ: 20 mm) và thêm 15% đến 20% đường kính cổ động mạch. Stent graft phải đủ lớn để Stent graft áp sát cổ túi phình và dòng máu không đi qua khoảng hàn gắn giữa dụng cụ và thành mạch như vậy sẽ loại trừ được túi phình khỏi áp lực dòng máu. Kích thước Stent graft so với cổ túi phình đầu gần cần lớn hơn 15% đến 20% so với đường kính cổ động mạch chủ đo được như vậy đủ lực hướng tâm để áp thành và không bị sự di chuyển của thiết bị. Các thiết bị hiện có đường kính Stent graft động mạch chủ bụng lớn đến 36 mm, cho phép sửa chữa các bệnh lý phình động mạch đường kính cổ đầu gần động mạch chủ tối đa là 32 mm. Tuy nhiên, khả năng cố định stent graft với các trường hợp cổ túi phình lớn (nghĩa là ≥ 30 mm) vẫn cần được theo dõi dài hạn. Những cổ túi phình lớn như vậy có nguy cơ cao bị dò (endoleak) type I. Các tác giả cho rằng trong phân nhóm bệnh nhân này, nên tăng kích thước >15% và vùng hàn gắn nên xem xét đưa đến trên ĐM thận. Tuy nhiên, kích thước quá lớn của Stent graft so với đường kính ĐMC có thể dẫn đến sự nở không hoàn toàn của Stent graft có thể tạo các nếp gấp và sự áp thành không đủ. Kích thước quá lớn cũng có thể dẫn đến sự gấp khúc của thiết bị, có thể tạo thành ổ hình thành huyết khối hoặc cũng có thể dẫn đến endoleak.
4.2 Chiều dài cổ túi phình động mạch chủ bụng
Chiều dài cổ túi phình động mạch chủ ít nhất phải từ 10 mm đến 15 mm để tạo lên vùng gắn kết đầu gần thích hợp và giúp cố định dụng cụ Stent graft. Đánh giá định tính vùng cổ gần cũng rất quan trọng. Lý tưởng nhất là
động mạch chủ đầu gần phải có hình dáng bình thường, không có huyết khối hoặc vôi hóa đáng kể. Mặc dù không phải là chống chỉ định tuyệt đối đối với can thiệp nội mạch, nhưng lượng lớn huyết khối hoặc vôi hóa sẽ cản trở việc cố định stent graft và làm tăng nguy cơ di chuyển stent graft hoặc endoleak type I.

4.3 Góc cổ túi phình động mạch chủ
Lý tưởng nhất là góc cổ túi phình động mạch chủ nhỏ hơn 60º. Các góc lớn hơn dẫn đến khó thả Stent graft chính xác, dễ gấp khúc Stent graft, dễ bị endoleak và khả năng
di chuyển Stent graft. Với trường hợp góc quá lớn (>60°) thường được coi là chống chỉ định đối với EVAR, mặc dù các thiết bị hiện nay đang được thiết kế phù hợp hơn và có thể thích ứng trong các tình huống giải phẫu như vậy.
4.4 Hình thái động mạch chậu và đường vào mạch máu
Hình thái động mạch chậu thích hợp để đưa dụng cụ Stent graft thuận lợi. Các động mạch chậu phải có một lượng vôi hóa và độ xoắn vặn ở mức tối thiểu, và không có hiện tượng hẹp đáng kể hoặc huyết khối ở vùng gắn kết đầu xa. Vùng gắn kết đầu xa thường ở động mạch chậu chung, nhưng động mạch chậu ngoài cũng có thể được sử dụng. Khi động mạch chậu ngoài được sử dụng làm phần gắn kết đầu xa (ví dụ, phình động mạch chậu chung), động mạch hạ vị (tức là động mạch chậu trong) sẽ bị che phủ.
Mặc dù cần cố gắng bảo tồn động mạch hạ vị để duy trì tưới máu vùng chậu, nhưng một số trường hợp có thể cần phải tiến hành bít động mạch hạ vị trước khi tiến hành can thiệp nội mạch để ngăn chảy máu ngược vào túi phình. Điều này có thể không cần thiết nếu có hẹp nặng gốc động mạch chậu trong vì việc bao phủ stent graft trên toàn bộ gốc của động mạch chậu trong sẽ cho phép nó tạo huyết khối và ngăn ngừa sự hình thành endoleak. Với sự sẵn có của các thế hệ Stent động mạch chậu có nhánh đã được cấp phép sử dụng, cho phép bảo tồn một hoặc cả hai động mạch chậu trong khi can thiệp EVAR, bít tắc động mạch hạ vị thường ít cần thiết hơn để mở rộng vùng gắn kết đầu xa.
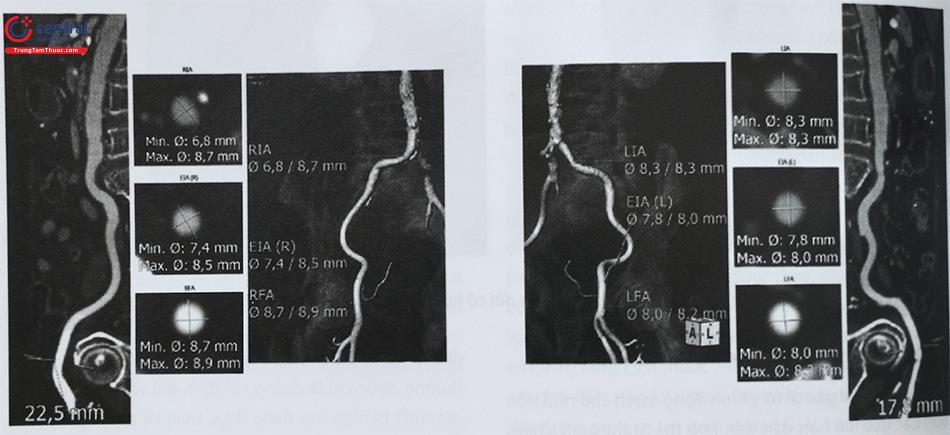
Đường kính động mạch chậu ngoài tối thiểu là 7 mm là cần thiết để cho phép phần lớn các dụng cụ và thiết bị đi qua an toàn. Tuy nhiên, các thiết bị có kích thước nhỏ có thể được đưa vào thông qua động mạch đùi có đường kính <6 mm. Đường kính động mạch chậu chung kích thước từ 8 mm đến 22 mm, và chiều dài của động mạch chậu chung có đường kính bình thường mà miếng chân của stent graft cố định phải có chiều dài gắn kết ít nhất từ 15 mm đến 20 mm để đạt được khả năng hàn gắn.
Nếu đường vào động mạch đùi có đường kính nhỏ hoặc vôi hoá xoắn vặn thiết bị không vượt qua được có thể thực hiện phẫu thuật tạo đường vào bằng một ống mạch nhân tạo “iliac conduits”.
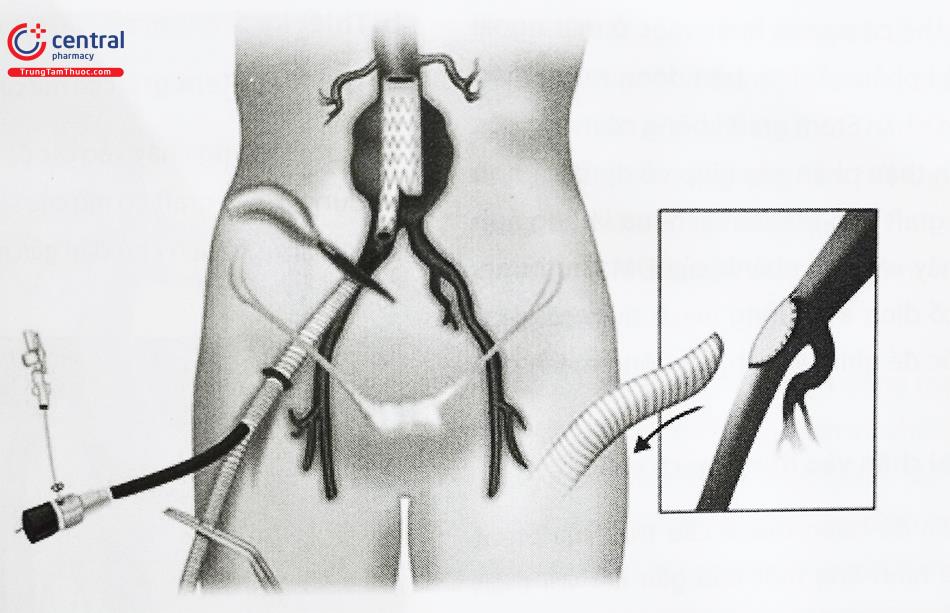
5 Cấu tạo Stent graft ĐMC bụng
5.1 Thiết kế stent graft
Các thiết kế Stent graft mới liên tục được cải tiến để nâng cao hiệu quả điều trị. Các cải tiến được nhằm mục tiêu tập trung vào cấu tạo thiết bị và hệ thống đưa dẫn có kích thước nhỏ hơn, triển khai chính xác hơn, cải thiện hệ thống cố định và tính linh hoạt trong điều trị ở những bệnh nhân có giải phẫu phức tạp.
5.1.1 Thiết kế Stent graft với 2 chân cơ bản
Can thiệp nội mạch để điều trị bệnh lý phình động mạch chủ bụng dưới động mạch thận có chung một thiết kế hai nhánh. Mặc dù có các biến thể từ thiết bị này sang thiết bị khác, ba thành phần (hệ thống dẫn đặt, phần thân chính và phần kéo dài động mạch chậu) là chung cho tất cả các hệ thống thiết bị can thiệp nội mạch và được mô tả ngắn gọn bên dưới.
- Hệ thống đưa dẫn
Stent graft thường được đưa dẫn đến vị trí mạch đích bằng một hệ thống hình ống trong đó Stent graft được nén thu nhỏ lại để đi qua đường vào mạch máu đến vị trí đích hệ thống này gồm các bước giúp cho Stent graft nở ra và đặt đúng vị trí dự định. Kích thước của hệ thống dẫn đặt thay đổi tùy thuộc vào đường kính thiết bị.
Phần thân chính Stent graft

Thiết bị phần thân chính thường là một mảnh thân chính và chia đôi hai nhánh chân, có thể thân chính thiết kế một chân để sử dụng trong những trường hợp đặc biệt (AUI). Chiều dài của các chân của thân chính khác nhau. Thân chính 2 chân thường thành phần có một chân phụ ngắn và một chân chính dài. Các thân chính chủ yếu dựa vào lực ly tâm của khung tự nở để duy trì vị trí của thân chính ở vị trí chính xác. Thân chính có màng bọc được cố định dưới động mạch thận có thể có ngạnh hoặc móc ở mặt ngoài của thiết bị, trong khi phần cố định trên động mạch thận được thiết kế với một phần Stent graft không có màng bọc phía trên động mạch thận phần này giúp cố định tốt hơn của hệ thống Stent graft vào thành mạch mà không ảnh hưởng đến dòng chảy vào các nhánh của ĐM chủ bụng, phần khung Stent cố định trên động mạch thận cũng có thể có ngạnh và móc để ghim vào thành động mạch chủ chắc hơn.
- Phần kéo dài chân vào động mạch chậu
Phần thiết bị kéo dài để hoàn thành cấu trúc của Stent graft đây là thiết kế hình ống một đầu gắn kết với thân chính và một đầu gắn kết với động mạch chậu để hệ thống Stent graft thành một cấu trúc hình chữ Y hoàn chỉnh kết nối phần cổ khối phình với hai ĐM chậu.
Stent graft được thiết kế dựa trên một khung kim loại nhớ hình (Stent nitinol hoặc thép không gỉ). Cấu trúc khung này được bọc bên ngoài bằng màng bọc, màng bọc thường được làm bằng Polyester (ví dụ, Dacron) hoặc polytetrafluoroethylene (PTFE).

5.1.2 Thiết kế Stent graft cấu tạo phức tạp
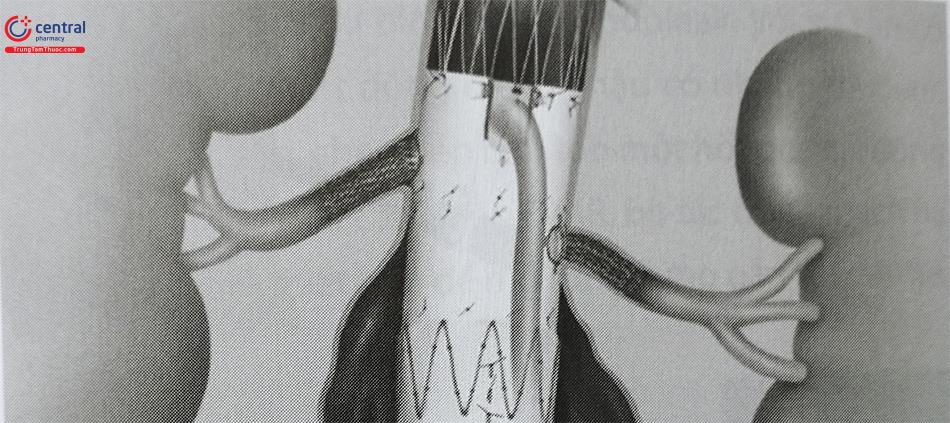
- Các Stent graft có mở cửa sổ lỗ bên (Fenestration)
Cho phép dòng chảy vào các động mạch nuôi tạng. Có thể sử dụng Stent graft có mở cửa sổ lỗ bên ở động mạch thận khi cổ động mạch chủ đầu gần ngắn (tức là <10 mm).
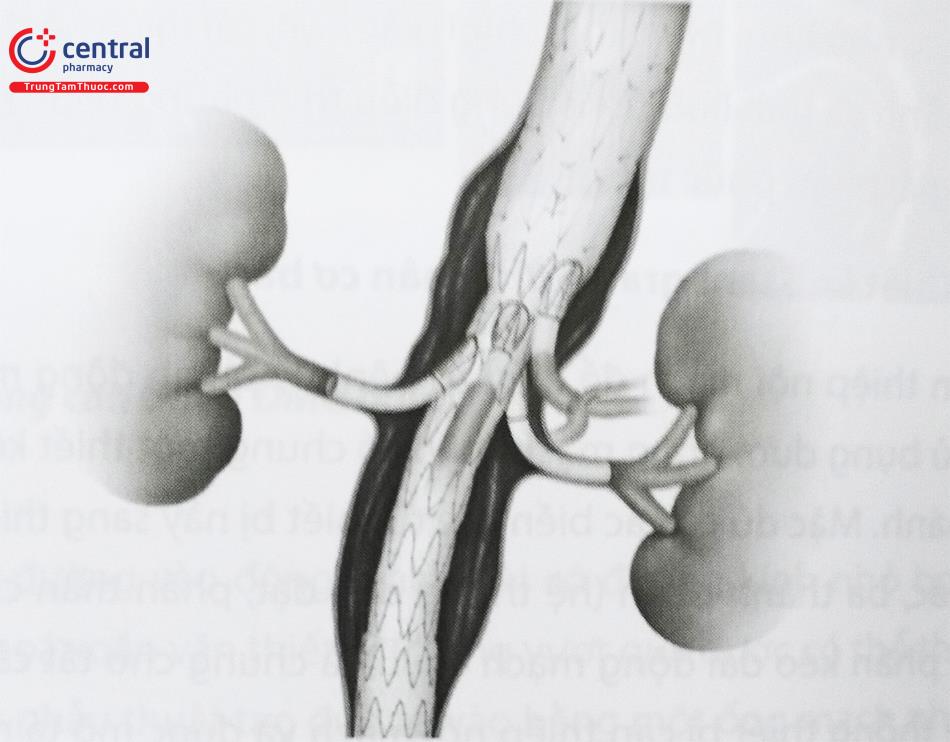
- Stent graft có nhánh: Stent graft có nhánh là các dụng cụ có nhánh phụ được khâu vào Stent graft ban đầu để khi được thả ra nhánh sẽ mở vào một mạch máu nhằm bảo tồn dòng chảy vào nó. Các nhánh phụ đã được thiết kế để phù hợp với các động mạch chậu trong và động mạch thận.
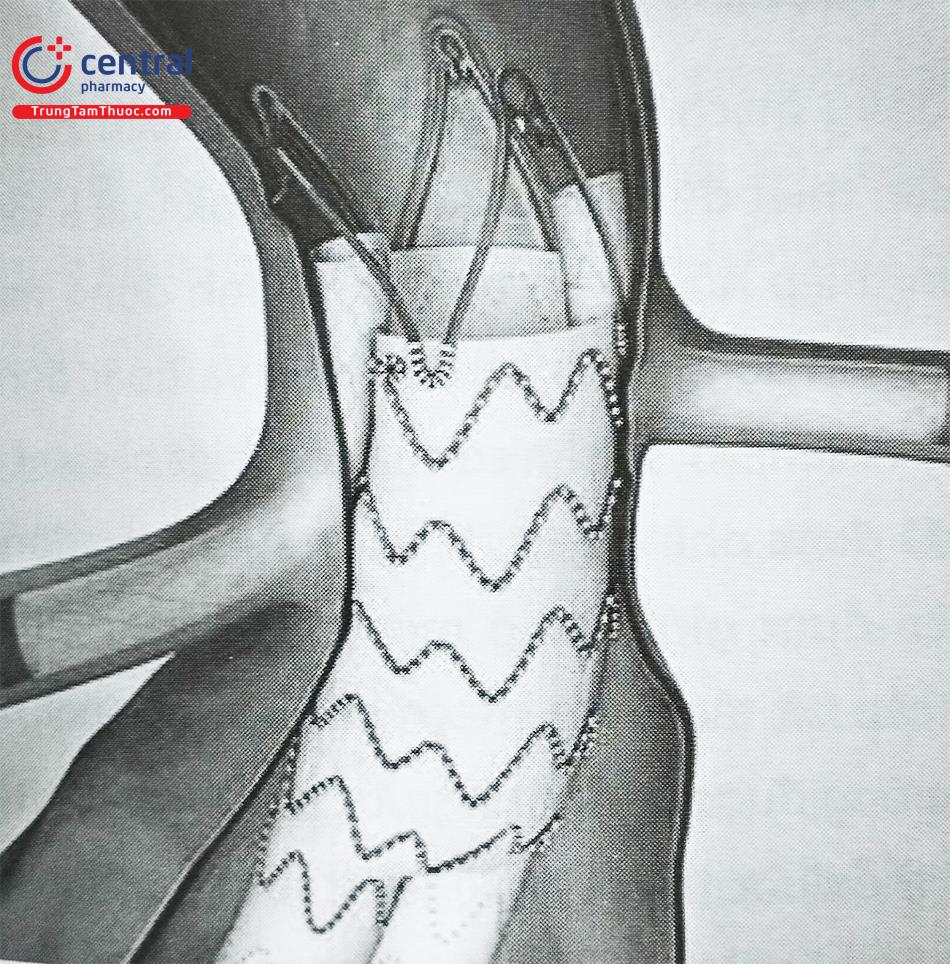
- Kỹ thuật Chimney – Kỹ thuật chimney (ống khói) hoặc snorkel (ống thở)
Kỹ thuật đặt Stent nhánh bên song song được sử dụng để bảo tồn tưới máu cho các mạch nhánh khi stent graft được đặt vượt lên trên qua ĐM thận để có thêm chiều dài cổ hàn gắn. Các stent ngoại vi được đặt vào các mạch nhánh trước khi thân chính stent graft được mở ra hoàn toàn. Stent mạch nhánh sẽ được thả dọc theo thân chính (vị trí song song giữa bên trong thành động mạch chủ và bên ngoài thân chính).
5.2 Lựa chọn dụng cụ
Nhìn chung, không có ưu điểm rõ ràng của một thiết kế Stent graft so với một thiết kế Stent graft khác. Một số thiết bị có thể hoạt động tốt hơn trong các tình huống giải phẫu cụ thể, chẳng hạn như thiết bị có cấu tạo hệ thống dẫn đặt nhỏ cho bệnh nhân có mạch chậu nhỏ hoặc, đối với những người có cổ động mạch chủ ngắn, thiết bị phù hợp với chiều dài cổ dưới 15 mm. Việc lựa chọn một thiết kế thiết bị cụ thể dựa trên nhiều yếu tố, bao gồm giải phẫu phình ĐMC của bệnh nhân.
Stent graft chia đôi 2 chân thường được sử dụng nhiều nhất nhưng không thích hợp cho những bệnh nhân bị hẹp hoặc tắc động mạch chậu nặng một bên. Trong trường hợp này, có thể sử dụng stent graft một nhánh hay thiết bị chủ chậu một bên aorto-uni-iliac (AUI), có thể được sử dụng. Các thiết bị AUI được sử dụng khi việc tiếp cận động mạch chậu bên đối diện là khó hoặc không thể, và để điều trị một số trường hợp phình động mạch bị vỡ nhằm kiểm soát nhanh tình trạng xuất huyết. Sau khi triển khai thiết bị AUI, một dụng cụ bít tắc động mạch chậu bên đối diện để ngăn dòng máu chảy ngược vào túi phình. Để cung cấp đầy đủ tưới máu cho chi dưới bên bị che phủ, có thể cần một cầu nối đùi đùi để tưới máu chi dưới bị bít tắc.
Việc sử dụng Stent graft đối với phình ĐMC bụng đoạn trên thận hay dưới ĐM thận vẫn còn được tranh luận. Cố định ở đoạn trên ĐM thận có thể giúp cố định Stent graft đoạn gần tốt hơn khi các đặc điểm giải phẫu không tối ưu, chẳng hạn như cổ động mạch chủ ngắn, động mạch chủ gập góc, cổ động mạch chủ hình nón, huyết khối hoặc vôi hóa đường viền quanh chu vi. Tuy nhiên, việc đặt các Stent
che phủ các mạch nội tạng đã làm tăng nguy cơ về tắc mạch cả tại thời điểm đặt stent và theo thời gian. Cố định phía trên động mạch thận có thể dẫn đến tỷ lệ nhồi máu thận nhỏ cao hơn, nhưng hầu hết không có biểu hiện lâm sàng. Tuy nhiên, khi đối mặt với tình trạng bệnh nhân có suy thận từ trước, cần thận trọng khi vị trí cố định phía trên động mạch thận.
Dụng cụ can thiệp nội mạch động mạch chủ thiết kế sẵn với nhiều kích cỡ đường kính và chiều dài khác nhau. Khi dụng cụ endograft đã được chọn, các thành phần thiết bị cụ thể được sử dụng được xác định bằng các phép đo và cấu trúc của khối phình động mạch được điều trị.
6 Đánh giá nguy cơ quanh can thiệp và các biện pháp dự phòng
Mặc dù can thiệp nội mạch bệnh lý phình động mạch chủ bụng có tỷ lệ biến chứng và tử vong sau thủ thuật thấp hơn so với phẫu thuật mở, nhưng vẫn có nguy cơ nhỏ phải chuyển từ can thiệp nội mạch chuyển sang phẫu thuật mở, do đó, bệnh nhân nên được đánh giá và chuẩn bị như thể đang trải qua một cuộc phẫu thuật mở. Bệnh động mạch vành là nguyên nhân hàng đầu gây tử vong sớm và muộn sau khi sửa chữa, và các bệnh đi kèm khác như bệnh phổi tắc nghẽn mạn tính và suy thận cũng làm tăng tỷ lệ mắc và tử vong chu phẫu. Hiệp hội Phẫu thuật Mạch máu và các hiệp hội khác khuyến nghị đánh giá toàn diện các bệnh đi kèm trước EVAR bao gồm đánh giá chức năng tim, phổi và thận, ngoài ra tăng huyết áp và tuổi bệnh nhân là các yếu tố nguy cơ liên quan làm tăng nguy cơ biến chứng và tử vong chu phẫu.
6.1 Dự phòng huyết khối
Bệnh nhân điều trị phình ĐMC bụng (can thiệp nội mạch hoặc phẫu thuật mở) được coi là có nguy cơ từ trung bình đến cao đối với huyết khối tĩnh mạch sâu và được chỉ định điều trị dự phòng huyết khối
Trong một nghiên cứu trên 193 bệnh nhân được sửa chữa AAA, tỷ lệ thuyên tắc huyết khối đối với việc sửa chữa phình động mạch nội mạch thấp hơn so với phẫu thuật mở; tuy nhiên, tỷ lệ huyết khối tĩnh mạch sâu sau EVAR là 5,3% mặc dù đã điều trị dự phòng huyết khối bằng thuốc. Việc trì hoãn bắt đầu điều trị dự phòng huyết khối bằng thuốc có liên quan đến xu hướng gia tăng tỷ lệ huyết khối tĩnh mạch sâu.
6.2 Dự phòng nhiễm trùng bằng kháng sinh
Trước khi can thiệp Stent graft, nên dự phòng bằng kháng sinh trong vòng 30 phút trước thủ thuật. Thuốc kháng sinh được ngừng sử dụng trong vòng 24 giờ do không có lợi ích bổ sung ngoài khung thời gian đó.
6.3 Phòng ngừa tổn thương thận cấp do thuốc cản quang
EVAR làm tăng nguy cơ biến chứng thận, chủ yếu do sử dụng thuốc cản quang đường tĩnh mạch, nhưng cũng có khả năng liên quan đến sự bong các mảng xơ vữa, huyết khối do thao tác của ống thông và dây dẫn gần động mạch thận, hoặc do sự che phủ của Stent graft một phần hay hoàn toàn động mạch thận.
Khi EVAR thực hiện ở một bệnh nhân suy thận từ trước, nên sử dụng các chiến lược để giảm nguy cơ tổn thương bệnh thận do thuốc cản quang.
6.4 Đặt stent động mạch thận dự phòng
Sự cần thiết đặt stent động mạch thận dự phòng ở những bệnh nhân có hẹp động mạch thận trước khi can thiệp nội mạch thì vẫn còn tranh cãi. Mặc dù nếu dụng cụ stent graft đặt che phủ một phần động mạch thận thì dường như không ảnh hưởng đến chức năng thận ở những bệnh nhân có động mạch thận bình thường, nhưng không rõ liệu điều này có đúng trong trường hợp hẹp động mạch thận nặng và suy thận từ trước hay không. Liệu có nên đặt stent động mạch thận dự phòng trong điều kiện này hay không vẫn chưa rõ ràng. Một đánh giá từ cơ sở dữ liệu của Chương trình Cải thiện Chất lượng Phẫu thuật Quốc gia của Trường môn Phẫu thuật Hoa Kỳ (ACS NSQIP, 2011 đến 2014) đã đánh giá kết quả của 281 bệnh nhân đã trải qua đồng thời nong và đặt stent động mạch thận trong EVAR. Ngay cả sau khi kiểm soát các yếu tố nguy cơ có thể góp phần gây rối loạn chức năng thận sau phẫu thuật, Can thiệp động mạch thận đồng thời có liên quan đáng kể với các kết quả bất lợi về chức năng thận sau EVAR đối với phình ĐMC bụng dưới động mạch thận. Nếu cần thiết bị cố định dụng cụ che phủ một phần động mạch thận, thì khả năng dòng chảy của động mạch thận sẽ bị tổn thương do dụng cụ endograft che phủ một phần ĐM thận cần được cân nhắc với những rủi ro và lợi ích tiềm tàng của việc đặt stent động mạch thận dự phòng.
6.5 Bít tắc động mạch chậu trong
Bít tắc động mạch hạ vị (tức là động mạch chậu trong) có thể cần thiết để ngăn ngừa endoleak loại II trong quá trình can thiệp nội mạch bệnh lý phình động mạch chủ liên quan đến động mạch chậu chung và/hoặc động mạch hạ vị. Tuy nhiên, với sự sẵn có của các thiết bị stent graft có nhánh đã được phê duyệt thì yêu cầu bít tắc động mạch hạ vị nên được giới hạn ở một nhóm bệnh nhân chọn lọc. Khi cần bít tắc động mạch chậu trong một bên, thủ thuật thường được tiến hành trước can thiệp tuy nhiên, nó cũng có thể được thực hiện ngay trước khi đặt Stent graft. Bệnh nhân bị phình động mạch chậu hai bên thường có cách tiếp cận theo từng giai đoạn. Bít tắc động mạch chậu trong làm tăng tỷ lệ bệnh nhân có giải phẫu phù hợp để can thiệp nội mạch bệnh lý phình động mạch chủ bụng.
6.6 Dự phòng hội chứng sau cấy ghép
Từ 13% đến 60% bệnh nhân trải qua hội chứng sau cấy ghép sau khi đặt nội mạch động mạch chủ và có thể trì hoãn sự hồi phục thường là nhanh chóng sau EVAR.
Các phương pháp dự phòng cụ thể trước phẫu thuật để ngăn ngừa hội chứng này hay không đã được đề cập đến trong thử nghiệm Methylprednisolone tiền phẫu thuật trong can thiệp nội mạch (POMEVAR), trong đó chỉ định ngẫu nhiên 153 bệnh nhân được truyền methylprednisolone hoặc giả dược 30mg trước khi can thiệp nội mạch động mạch chủ. Các chất chỉ điểm phản ứng viêm (interleukin huyết tương tối đa, protein C phản ứng, interleukin 8, yếu tố hoại tử khối u) thấp hơn ở nhóm dùng methylprednisolon. Các nhu cầu về sử dụng thuốc giảm đau sau phẫu thuật đã giảm đáng kể và việc đáp ứng các tiêu chuẩn xuất viện sớm hơn một ngày đối với nhóm được điều trị so với nhóm giả dược (hai so với ba ngày sau phẫu thuật).
7 Các bước can thiệp stent graft động mạch chủ bụng
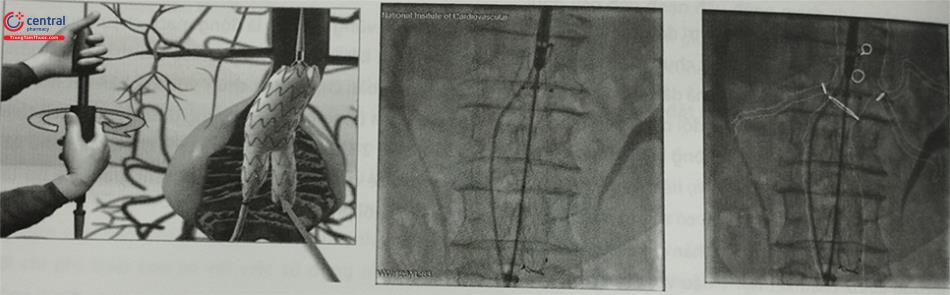
Can thiệp stent graft: Can thiệp nội mạch phình động mạch chủ bụng được thực hiện bằng cách đưa các thành phần của stent graft vào và ghép lại với nhau trong lòng động mạch chủ bụng để tạo ra stent graft hoàn chỉnh áp sát hàn gắn thành động mạch chủ phía đầu gần và các mạch chậu ở đầu xa để loại trừ túi phình động mạch chủ khỏi lưu lượng và áp lực máu tuần hoàn.
Các thiết bị đã được chọn và các thành phần của nó phải được chuẩn bị đầy đủ khi bắt đầu quy trình, và các thành phần thiết bị dự phòng như đoạn nối dài, dây dẫn và sheath phải luôn có sẵn để xử lý mọi tình huống vấn đề kỹ thuật có thể phát sinh trong quá trình can thiệp.
Sau khi bệnh nhân được gây mê, tiền mê hoặc gây tê tại chỗ can thiệp nội mạch stent graft phình động mạch chủ bụng được thực hiện thông qua một trình tự có trật tự bao gồm tiếp cận đường vào mạch máu, đặt các dây dẫn và sheath động mạch, chụp hình để xác nhận giải phẫu động mạch chủ, đặt thân chính kết nối phần cổ khối phình vào vị trí theo kế hoạch, mở lỗ vào chân bên đối diện, thả miếng chân 2 bên, nong bóng và chụp kiểm tra toàn diện. Kỹ thuật chung để can thiệp nội mạch thường quy được mô tả dưới đây và các biến thể điển hình cần thiết để khắc phục sự cố thường gặp.
7.1 Các phương pháp vô cảm
EVAR có thể được thực hiện dưới gây mê toàn thân, gây tê vùng, gây mê tĩnh mạch toàn bộ, hoặc gây mê cục bộ với thuốc an thần nhẹ.
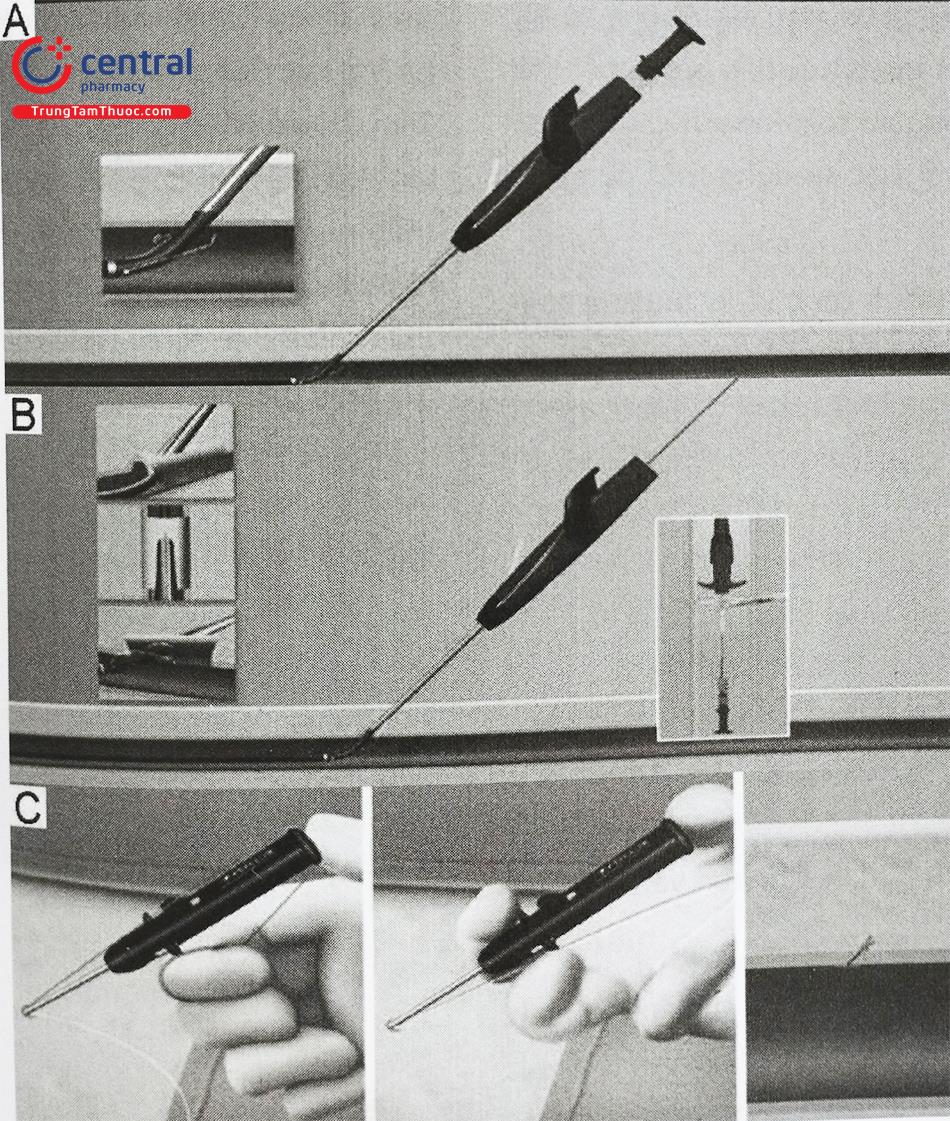
7.2 Tiếp cận đường vào mạch máu
Mở đường vào động mạch đùi hai bên để đưa dụng cụ stent graft vào lòng mạch. Can thiệp nội mạch phình ĐMC bụng có thể được thực hiện thông qua đường vào mở mạch đùi bằng phẫu thuật hoặc kỹ thuật đóng mạch qua da.
Phẫu thuật mở có thể khó khăn hơn ở bệnh nhân béo phì hoặc bệnh nhân đã phẫu thuật khớp háng trước đó. Việc tạo đường vào động mạch bằng thiết bị qua da là khả thi, ngay cả sau khi sử dụng các sheath có kích thước lớn.
Tiếp cận qua da sử dụng tiếp cận theo guide wire tiêu chuẩn và sau đó sử dụng que nong để đặt sheath vào vị trí chứ không phải qua cách tiếp cận mạch máu trực tiếp. Khi stent graft đã ở đúng vị trí và chụp kiểm tra kết quả tốt, vị trí đường vào mạch máu thường được thực hiện bằng cách sử dụng các thiết bị đóng mạch chuyên dụng.
Một đánh giá có hệ thống qua bốn thử nghiệm trong đó, thử nghiệm lớn nhất trong số này là thử nghiệm can thiệp nội mạch phình động mạch chủ qua da (PEVAR), 151 bệnh nhân có giải phẫu động mạch chậu – đùi phù hợp cho kỹ thuật mở đường vào mạch máu qua da được so sánh với tiếp cận mạch máu trực tiếp bằng phẫu thuật hoặc tiếp cận qua da bằng thiết bị Perclose ProGlide hoặc Prostar XL. Trong một thử nghiệm khác, 100 bệnh nhân được phân ngẫu nhiên để tiếp cận mạch máu qua da hoặc bằng phẫu thuật mở. Một phân tích tổng hợp không tìm thấy sự khác biệt giữa tiếp cận trực tiếp bằng phẫu thuật và tiếp cận qua da về tỷ lệ tử vong, loại trừ phình mạch, các biến chứng lớn và biến chứng chảy máu, nhưng thời gian mổ đã giảm đáng kể. Một đánh giá riêng biệt bao gồm các nghiên cứu này và các nghiên cứu quan sát khác cũng cho thấy thời gian thủ thuật ngắn hơn, tỷ lệ biến chứng thấp hơn và tỷ lệ thành công thủ thuật tương tự đối với tiếp cận qua da so với tiếp cận bằng phẫu thuật mở mạch.
Tỷ lệ thành công đường vào mạch máu được báo cáo của EVAR qua da là từ 90 đến 100%. Sự thay đổi dường như liên quan đến kích thước của sheath, mức độ vôi hóa động mạch đùi và kinh nghiệm của người thực hiện với kỹ thuật. Kích thước sheath và độ béo phì dường như không có tác động đáng kể. Kỹ thuật mở mạch trực tiếp trong một thử nghiệm cho thấy khâu đóng an toàn nhanh chóng hơn với chi phí thấp hơn so với việc sử dụng một dụng cụ đóng mạch.
Trong thử nghiệm PEVAR, thành công về kỹ thuật là 98% đối với phương pháp tiếp cận bằng phẫu thuật và 94% và 88% đối với nhóm ProGlide và Prostar, tương ứng. Sau một tháng, tỷ lệ điều trị thành công chính (thành công về kỹ thuật thủ thuật tổng hợp, các tác dụng phụ lớn và biến chứng mạch máu lần lượt là 78%, 88% và 78% đối với các nhóm phẫu thuật mở, ProGlide và Prostar. Sự khác biệt giữa các thiết bị dẫn đến kết luận là thiết bị ProGlide không thua kém, nhưng không phải thiết bị Prostar so với thiết bị tiếp cận mở mạch đùi. Phương pháp tiếp cận qua da có liên quan đến thời gian cầm máu và hoàn thành thủ thuật ngắn hơn, ít mất máu hơn, ít đau hơn và cải thiện chất lượng cuộc sống.
Kết quả kéo dài đến sáu tháng mà không có báo cáo nào về vỡ túi phình, chuyển phẫu thuật hở, di chuyển thiết bị hoặc tắc stent graft. Kết quả của thử nghiệm này xác nhận các kết quả quan sát được tại một số cơ sở nơi EVAR qua da
đã được sử dụng trong thực hành hàng ngày bằng cách sử dụng nhiều loại stent graft có cấu hình khác nhau.
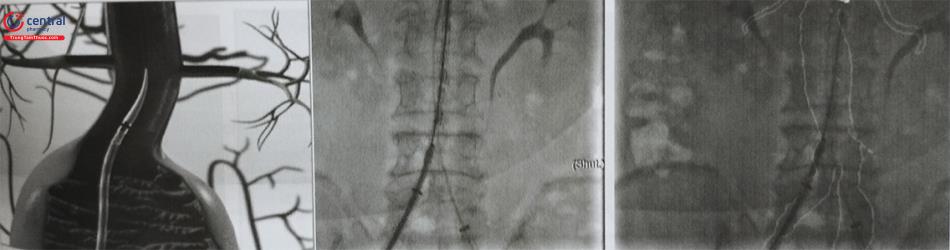
7.3 Chụp cản quang động mạch chủ (Aortogram)
Sau khi đặt hệ thống Sheath động mạch đùi hai bên, một ống thông pigtail được luồn qua bên đối diện với đường vào thân chính đã lựa chọn và lập kế hoạch được đặt ở ngay trên mức các động mạch thận. Tiến hành chụp mạch số hóa xóa nền và xác định được mức của động mạch thận thấp nhất được xác định.
7.4 Đưa dây dẫn đường siêu cứng từ đường vào động mạch đùi đến gần vị trí xuất phát động mạch dưới đòn trái
Dây dẫn đường thông thường giúp đưa ống thông pig- tail đến vị trí gốc động mạch chủ sau đó dây dẫn thông thường được đưa ra và thay bằng dây dẫn siêu cứng được luồn vào đến đoạn đầu động mạch chủ xuống trên nền ống thông pigtail giúp bảo vệ thành mạch ít bị tác động bởi dây dẫn siêu cứng và thay ống thông pigtail ra ngoài.
7.5 Đưa vào và đặt stent phủ nội mạch đúng vị trí
Khi đã xác định được động mạch thận thấp nhất. Điều quan trọng là phải chỉnh góc X quang vuông góc với mặt phẳng của động mạch chủ dưới thận để có vị trí phù hợp. Trên dây dẫn siêu cứng hệ thống stent graft được đưa đến vị trí cần đặt, thường đến gần chỗ xuất phát của ĐM thận thấp nhất chụp động mạch chủ hoặc các kỹ thuật khác như siêu âm nội mạch được sử dụng cùng để định vị và thả thân chính stent graft ĐMC chính xác tại các vị trí đích. Khi đặt stent graft tại vùng hàn gắn đầu gần, điều quan trọng là phải hiệu chỉnh một hình chiếu phù hợp thể hiện rõ vị trí xuất phát của động mạch thận thấp nhất. Hình chiếu nghiêng về bên có động mạch thận thấp nhất hoặc đã được xác định khi chúng ta phân tích trên hình ảnh MSCT tái tạo 3D khi chúng ta lên kế hoạch. Đối với vùng hàn gắn đầu gần, mỗi loại stent graft cung cấp trình tự chính xác của các bước cho các thiết bị để đặt chính xác vị trí đích cho thân chính để đạt được hàn gắn đầu gần tốt nhất.
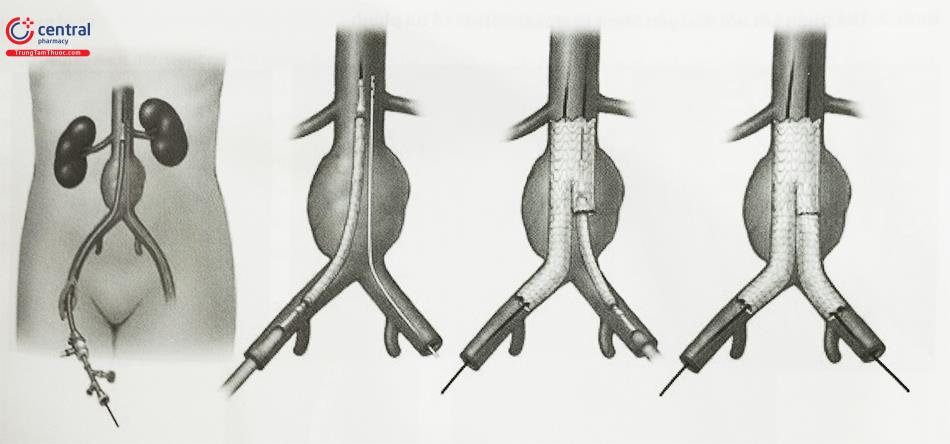
Chúng ta chụp xác định chính xác vị trí đặt stent graft giải phóng dần khoảng 2 mắt stent graft chụp kiểm tra chính xác chỗ hàn gắn đầu gần tốt sau đó thả dần stent graft đến khi giải phóng hoàn toàn chân bên đối diện, tiếp theo từ vị trí mạch đối diện sử dụng ống thông kèm với dây dẫn để luồn vào lỗ vào chân bên đối diện, tiếp theo chúng ta cần phải xoay ống thông hoặc chụp có thuốc cản quang để chắc chắn ống thông trong lòng thân chính stent graft. Tiếp theo sẽ đưa 2 chân kết nối 1 đầu với thân chính và
một đầu với vùng gắn kết là động mạch chậu chung phải hoặc trái. Sự kết hợp các bộ phận sẽ tạo thành hệ thống stent graft hoàn chỉnh hình chữ Y với bộ phận kết nối đầu gần ở cổ gần động mạch chủ bụng dưới động mạch thận và đầu xa là 2 chân vào 2 động mạch chậu phải như vậy dòng máu sẽ chảy trong hệ thống stent graft loại bỏ tác động vào khối phình.
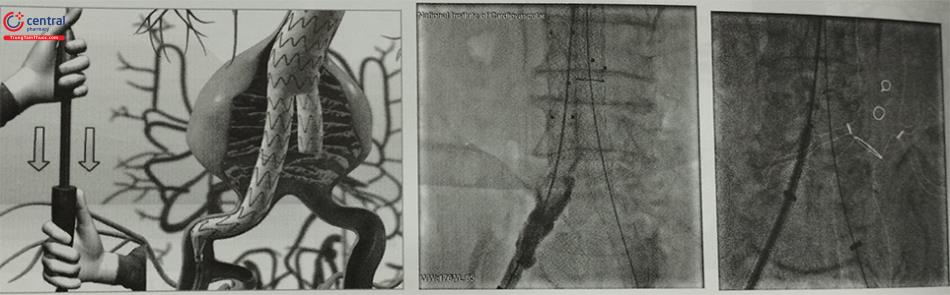
Bước 1: Đưa Stent Graft đến sát vị trí động mạch thận thấp nhất
Bước 2: Thả phần kết nối đầu gần Stent Graft kết nối với cổ túi phình
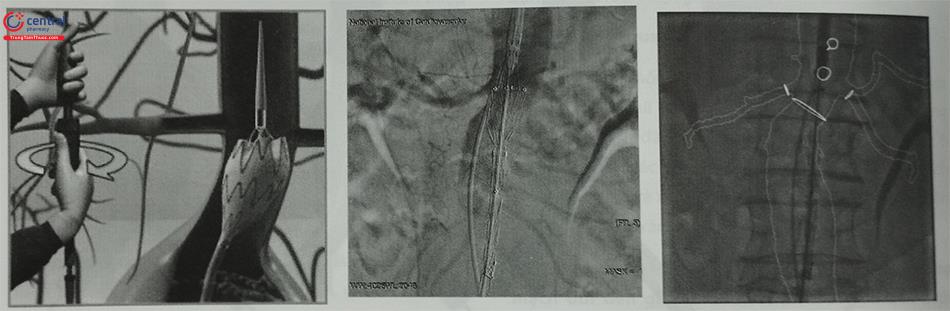
Bước 3: Thả phần thân chính Stent Graft
Bước 4: Thả phần nối dài chân Stent Graft kết nối ĐM chậu hai bên
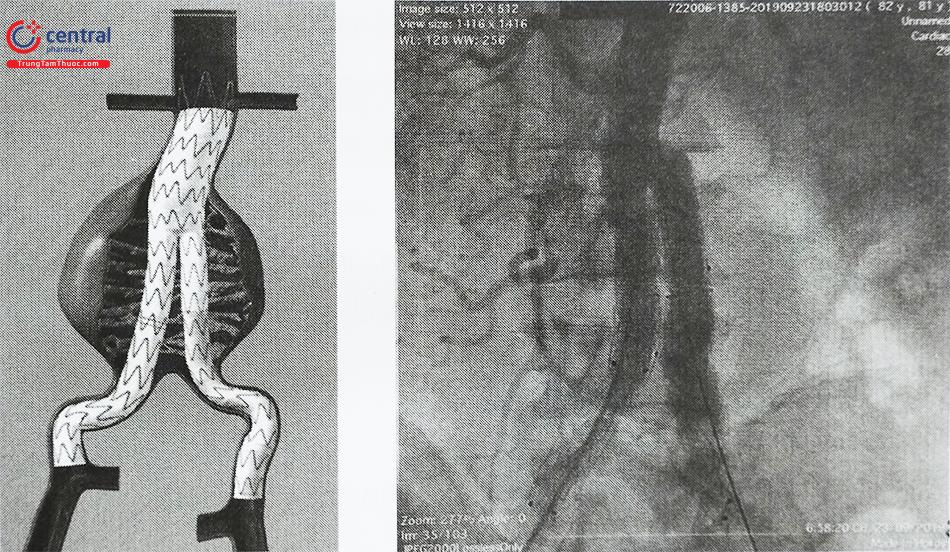
7.6 Nong bóng
Sau khi dụng cụ được đặt, stent graft thường được nong lại bằng bóng ở các vị trí hàn gắn đầu gần và xa, cũng như tại các điểm nối thân chính của stent graft với các chân.
Đánh giá dò mạch (endoleak) – Chụp động mạch chủ được thực hiện khi kết thúc quy trình để đảm bảo loại trừ túi phình hiệu quả, bảo tồn các mạch thiết yếu của động mạch chủ bụng và phát hiện hiện tượng dò mạch (endoleak).
7.7 Chụp đánh giá kết quả
Chụp đánh giá kết quả sau can thiệp xác định Stent graft kết nối tốt hay không, có áp thành không, có Endoleak không để xử trí đảm bảo dòng máu đi trong Stent graft bị loại bỏ hoàn toàn không đi vào khối phình và Stent graft thông tốt.
7.8 Đóng đường vào động mạch
Khi kết thúc thủ thuật sheath sẽ được lấy ra và phẫu thuật khâu mạch máu hoặc đóng lại bằng dụng cụ đóng mạch chuyên dụng.
8 Tiêu chí đánh giá thành công
8.1 Thành công của thủ thuật
Được xác định khi đặt Stent graft đúng vị trí đích mà hàn gắn cổ gần tốt không có endleak loại 1 hoặc loại 3, không có sự xoắn vặn tắc nghẽn các nhánh chân của Stent graft, không phải chuyển sang phẫu thuật cứu vãn, không tử vong trong vòng 24 giờ.
8.2 Thành công về mặt lâm sàng
Được xác định khi không có tử vong liên quan đến khối phình ĐMC bụng, không có endoleak loại 1 và loại 2, không có giãn khối phình trên 5mm, không có sự di lệch Stent graft, không hoàn thành được thủ thuật,vỡ khối phình hoặc phải chuyển sang phẫu thuật mở.
9 Biến chứng và xử lý biến chứng
Mặc dù tỷ lệ thành công về mặt kỹ thuật đối với can thiệp nội mạch động mạch chủ bụng là cao (99%), các biến chứng liên quan đến EVAR thường gặp, với tỷ lệ dao động từ 11% đến 30%. Tỷ lệ biến chứng khi can thiệp ban đầu dường như cao hơn với các túi phình có đường kính lớn hơn. Các biến chứng kỹ thuật liên quan đến can thiệp nội mạch bao gồm chấn thương mạch máu (ví dụ: động mạch chậu, động mạch đùi) trong quá trình tiếp cận hoặc triển khai thiết bị, dò mạch (endoleak ) do không có sự áp sáp đầu của stent graft vào mạch máu, hoặc sự cố của vật liệu ghép; gãy khung stent; rơi stent.
9.1 Biến chứng đường vào mạch máu
Biến chứng vị trí đường vào mạch máu là một trong những vấn đề phổ biến nhất sau khi can thiệp nội mạch động mạch chủ, xảy ra ở 9% đến 16% bệnh nhân sau sửa chữa AAA nội mạch. Các biến chứng tại đường vào mạch máu bao gồm tụ máu, huyết khối cấp tính của động mạch đùi chậu, tắc mạch đoạn xa, tách thành động mạch, giả phình mạch và lỗ dò động mạch đều đã được báo cáo.
9.2 Biến chứng không luồn Wire được vào chân đối diện
Khi chọn vị trí của stent graft với phần lỗ vào đặt thấp trong túi phình dưới chỗ chia đôi của động mạch chủ có thể dẫn đến tình huống lỗ vào bên đối diện không thể nở tốt khi đặt stent. Trong một vài trường hợp, đẩy thiết bị lên trên sẽ cho phép chân bên đối diện được nở ra. Nhiều thiết bị stent graft hiện tại cho phép thu hồi stent và chỉnh
hướng nơi mở của chân đối diện. Nếu chân đối diện của stent graft không thể di chuyển lên phía trên, chuyển sang chiến lược đặt chủ chậu 1 nhánh (AUI) hoặc chuyển mổ mở là cần thiết.
9.3 Xử trí rò mạch (endoleak) ngay trong thủ thuật
Endoleak là khái niệm dùng để chỉ sự tồn tại của dòng máu đi vào túi phình sau khi đặt stent graft, cho thấy sự thất bại trong việc cô lập túi phình khỏi tuần hoàn động mạch chủ.
Bảng 1. Phân loại endoleak
| Type | Định nghĩa | Nguyên nhân | Điều trị |
| 1 | Xuất phát từ các điểm gắn đầu xa và gần | Stent không đủ kích thước, áp thành kém, giãn cổ túi phình và di lệch stent graft | Nong bóng, đặt thêm đoạn stent graft để nối dài vùng hàn gắn, dùng EndoAnchor… |
| 2 | Túi phình dội ngược từ các động mạch thắt lưng, động mạch mạc treo tràng dưới hoặc các động mạch chậu trong mà đã bị loại ra bởi endograft | Tuần hoàn bàng hệ | Diễn biến lành tính. Nếu cần điều trị, thì gây thuyên tắc xuyên thắt lưng hoặc phẫu thuật thắt động mạch thắt lưng |
| 3 | Dò vị trí gắn kết của các thành phần stent graft | Xảy ra chủ yếu với các thành phần stent grafts ở các điểm gắn | Nong bóng để các thành phần stent graft áp thành với nhau hoặc đặt thêm một đoạn mới để gia tăng khả năng gắn kết |
| 4 | Thoát mạch qua vật liệu graft | Do tính chất xốp của chất liệu làm màng bọc | Diễn biến lành tính, thường có huyết khối túi phình và không có hậu quả lâm sàng |
| 5 | Sức căng nội mạch: khoảng không giữa graft động mạch chủ và động mạch chủ chính bị tăng áp lực, không có endoleak thực sự | Endoleak bị bỏ qua, huyết khối, endoleak, nang thanh dịch, nhiễm khuẩn | Chưa rõ |
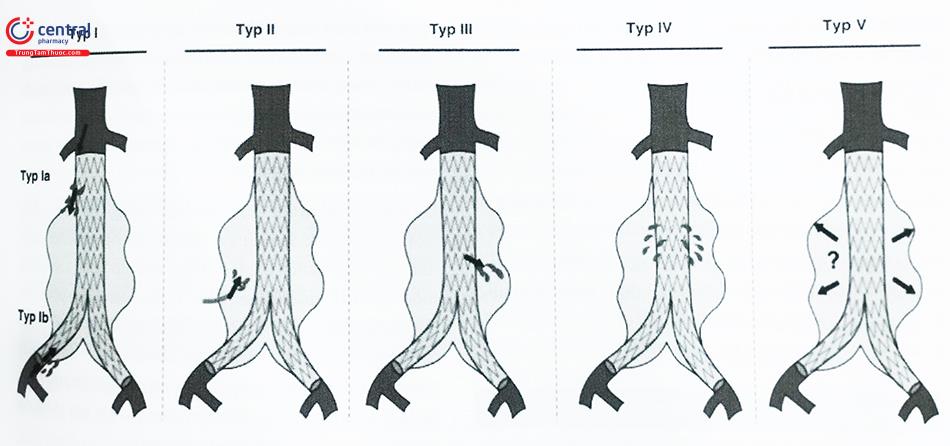
Endoleak type I hoặc type III được xác định ngay khi đặt stent graft và thường sửa chữa thành công bằng nong bóng tăng cường hoặc đặt thêm đoạn stent graft ngắn giúp nối dài tiếp vùng hàn gắn. Endoleak type II và type IV không cần thêm can thiệp đặc biệt nào nếu phát hiện trong thủ thuật.
9.4 Di chuyển Stent graft
Di chuyển stent graft theo thời gian là một trong những nguyên nhân chính của can thiệp lại sau khi sửa chữa can thiệp khối phình động mạch. Di chuyển stent graft là do giãn cổ động mạch chủ đầu gần, có thể liên quan đến sự thoái hóa tiếp tục tiến triển của khối phình thành động mạch chủ hoặc có thể là hậu quả của việc chênh lệch kích thước quá mức của thân chính stent graft và động mạch chủ.
9.5 Tách rời thành phần stent graft
Nguyên nhân do không gối nhau trong quá trình đặt giữa các mảnh bộ phận Stent graft, hoặc do lỗi của các mảnh stent graft theo thời gian hoặc cũng có thể do sau khi đặt stent graft túi phình bị thoái hóa co kéo các mảnh graft tạo nên endoleak type 3 hoặc type 1 do co đầu gần hoặc đầu xa của graft. Việc theo dõi khi đó giữ vai trò vô cùng quan trọng trong việc phát hiện sớm biến chứng tách rời các thành phần của stent graft. Việc điều trị tách các thành phần của stent graft có thể phải đặt một miếng graft mới để vá chỗ tách rời.
9.6 Tắc mạch chi sau đặt stent graft
Tắc mạch chi sau đặt stent graft là biến chứng hay gặp chiếm khoảng 2,3% – 3,7% sau can thiệp stent graft phình động mạch chủ bụng, tỷ lệ này cao hơn đáng kể so với tắc mạch chi sau phẫu thuật mở điều trị phình động mạch chủ bụng.
Điều trị: có thể phẫu thuật bắc cầu đùi – đùi với trường hợp tắc cấp mạch chi dưới sau đặt stent graft, chụp và can thiệp mạch chi bằng cách đặt thêm stent, nong bóng với các trường hợp bị đầu xa của stent graft bị gập, không áp sát có hoặc không kèm theo endoleak type IB. Tiêu sợi huyết qua đường ống thông cũng có thể được cân nhắc tuỳ vào giải phẫu của tổn thương và tình trạng lâm sàng nếu không có chống chỉ định.
9.7 Nhiễm trùng stent graft
Nhiễm trùng stent graft – Tỷ lệ nhiễm stent graft dao động từ 0,4% đến 3%, với tỷ lệ tử vong liên quan là 25% đến 50%. Trong một nghiên cứu, 42% bệnh nhân được chẩn đoán nhiễm trùng mảnh ghép xuất hiện trong vòng ba tháng sau khi can thiệp nội mạch động mạch chủ, cho thấy có sự nhiễm trùng stent graft. Trong một đánh giá khác, thời gian trung bình từ khi đặt stent graft đến khi chẩn đoán là 20 tháng; 6 trong số 26 trường hợp có dò động mạch chủ.
Các chiến lược điều trị để kiểm soát nhiễm trùng stent graft tương tự như các chiến lược được sử dụng để quản lý nhiễm trùng mảnh ghép sau khi sửa chữa chứng phình động mạch. Cả hai chiến lược tích cực và thận trọng đã được áp dụng trong điều trị nội tạng bị nhiễm trùng.
9.8 Biến chứng toàn thân
- Nhồi máu cơ tim.
- Tổn thương thận do thuốc cản quang.
- Dị ứng thuốc, sốc phản vệ với thuốc cản quang và các thuốc khác trong quá trình can thiệp.
- Biến chứng thiếu máu cơ quan : thiếu máu chi dưới, thiếu máu ruột, thiếu máu thận, thiếu máu sinh dục, thiếu máu các cơ vùng chậu.
- Hội chứng hậu cấy ghép.
10 Kết quả từ các nghiên cứu
Tỷ lệ biến chứng chung cho việc can thiệp nội mạch động mạch chủ bụng bao gồm cả các vấn đề liên quan đến đường vào là khoảng 10%.
Các biến chứng liên quan đến stent graft có thể bao gồm tổn thương mạch máu khi nở stent graft và endoleak. Sau khi sửa chữa thành công, túi phình sẽ bị huyết khối, và hầu hết các túi phình dần dần thu nhỏ lại. Việc sửa chữa nội mạch có thể phản ứng với sự thay đổi hình dáng của túi phình, có thể dẫn đến các biến chứng nội mạch muộn như tạo nút, gấp khúc, huyết khối hoặc di chuyển hệ thống stent graft. Do đó, cần theo dõi thăm khám lâu dài.
Tỷ lệ thành công về kỹ thuật ngắn hạn trong sửa chữa phình động mạch đã được cải thiện sự cải tiến dụng cụ và với kinh nghiệm của chuyên gia y tế. Chuyển mổ mở tại thời điểm sửa chữa là không phổ biến và xảy ra ở ít hơn 2% số bệnh nhân. Tỷ lệ thành công kỹ thuật trong ba mươi ngày nằm trong khoảng từ 77% đến 100%.
Một tổng quan hệ thống đã xác định bốn thử nghiệm bao gồm 1532 bệnh nhân được coi là ứng cử viên thích hợp để sửa chữa nội mạch hoặc mổ mở của phình động mạch chủ bụng không vỡ có đường kính lớn hơn 5,0 cm. Tỷ lệ tử vong do mọi nguyên nhân trong 30 ngày thấp hơn đáng kể khi sửa chữa nội mạch (1,6% so với 4,8%). Lợi thế sống sót ngắn hạn của việc sửa chữa nội mạch dường như lớn hơn nhiều phẫu thuật được giới hạn ở những bệnh nhân có nguy cơ phẫu thuật cao nhất. Điều này được minh họa trong một nghiên cứu về 454 bệnh nhân trải qua sửa chữa theo chương trình (206 ca can thiệp nội mạch và 248 ca mổ mở) phình động mạch chủ bụng. Tỷ lệ tử vong chung trong 30 ngày không khác biệt đáng kể đối với can thiệp nội mạch và phẫu thuật (tương ứng là 2,4% và 4,8%). Tuy nhiên, trong số những bệnh nhân có nguy cơ phẫu thuật cao nhất (Hiệp hội bác sĩ gây mê Hoa Kỳ [ASA] tỷ lệ tử vong trong 30 ngày đối với can thiệp nội mạch thấp hơn so với mổ mở (4,7% so với 19,2%).
Sử dụng cơ sở dữ liệu Medicare của Hoa Kỳ, khả năng sống sót lâu dài được đánh giá ở 22.830 cặp bệnh nhân được điều trị có kế hoạch bằng kỹ thuật mổ mở hoặc can thiệp nội mạch từ năm 2001 đến 2004. Tỷ lệ tử vong chu phẫu khi sửa chữa nội mạch thấp hơn đáng kể (1,2% so với 4,8%), lợi ích rõ rệt hơn đã được nhìn thấy khi tuổi bệnh nhân ngày càng tăng. Tuy nhiên, như đã thấy với các nghiên cứu khác, tỷ lệ tử vong chung ba đến bốn năm sau khi sửa chữa nội mạch là gần như giống nhau ở hai nhóm.
Tuy nhiên, kết quả lâu dài, người ta vẫn chưa xác định chắc chắn rằng sửa chữa nội mạch tốt hơn phẫu thuật mở, ngay cả ở những bệnh nhân có nguy cơ phẫu thuật cao nhất. Mặc dù tỷ lệ tử vong liên quan đến phình động mạch vẫn giảm 3% trong suốt thời gian theo dõi ở cả hai thử nghiệm DREAM và EVAR1, mức giảm ban đầu về tỷ lệ tử vong do mọi nguyên nhân đã được loại bỏ trong vòng một đến hai năm với tỷ lệ sống thêm tương đương ở cả hai nhóm. Một phân tích sau đó từ cơ sở dữ liệu Medicare trên 4529 bệnh nhân được điều trị từ năm 2003 đến năm 2007 và theo dõi trong thời gian trung bình 2,4 năm cho thấy kết quả tương tự trong giai đoạn chu phẫu. Tỷ lệ tử vong liên quan đến túi phình và tỷ lệ tử vong chu phẫu (30 ngày) đã giảm ở nhóm can thiệp nội mạch. Trong số những bệnh nhân sống sót >30 ngày, không có sự khác biệt về tử vong do mọi nguyên nhân (tỷ số nguy cơ [HR] 1,01; khoảng tin cậy 95% (0,84-1,22)). Tuy nhiên, trong nghiên cứu này, lợi thế sống sót do sửa chữa nội mạch được duy trì trong suốt thời gian nghiên cứu do đó nguy cơ tử vong do mọi nguyên nhân đối với mổ mở liên quan đến sửa chữa nội mạch vẫn tăng (HR 1,24; khoảng tin cậy 95% (1,05-1,47)). Tuổi trung bình của những bệnh nhân được sửa chữa nội mạch không khác biệt đáng kể so với những người được điều trị bằng phương pháp mổ mở (75 so với 76).
Dữ liệu theo dõi dài hạn củng cố khái niệm rằng lợi thế sống sót ban đầu với EVAR có thể không được duy trì sau giai đoạn chu phẫu so với mổ mở. EVAR dường như không làm tăng tuổi thọ chung ở những bệnh nhân không đủ điều kiện để mổ mở nhưng có thể làm giảm tỷ lệ tử vong liên quan đến chứng phình động mạch. Hơn nữa, một phân tích tổng hợp dữ liệu cá nhân của bệnh nhân từ các thử nghiệm EVAR-1, DREAM, OVER, và ACE đã so sánh kết quả của sửa chữa nội mạch hoặc mổ mở cho phình động mạch chủ bụng trong 5 năm và xác nhận lợi thế sống còn trong giai đoạn sớm ở nhóm EVAR và giảm đi sau đó. Trong hơn 5 năm, những bệnh nhân có thể trạng yếu không có lợi thế sống còn sớm từ EVAR so với mổ mở. Tỷ lệ tử vong liên quan đến túi phình và bệnh nhân có chỉ số API thấp góp phần làm giảm lợi thế sống còn sớm của nhóm EVAR.
11 Theo dõi sau thủ thuật và dài hạn
Sau can thiệp nội mạch phình động mạch chủ bụng, bệnh nhân có thể được chuyển về khoa phòng thường sau khi tỉnh. Bệnh nhân có thể uống nước và ăn bình thường nếu dung nạp được. Điều trị giảm đau tồn tại sau can thiệp dùng chủ yếu NSAID và hoặc opioids.
Bệnh nhân có thể đi lại được trong ngày đầu tiên sau phẫu thuật. Phần lớn bệnh nhân có thể ra viện trong vòng 48 giờ sau EVAR, và không có biến chứng đặc biệt nào xảy ra. Truyền dịch thường được duy trì để tránh nguy cơ tổn thương thận do thuốc cản quang, đặc biệt trên bệnh nhân suy thận trước phẫu thuật.
Bắt mạch ngoại vi thường xuyên, định kỳ nên được thực hiện và so sánh với mạch nền của bệnh nhân từ trước phẫu thuật. Bất kỳ bất thường nào cũng nên được kiểm tra lại bằng siêu âm mạch để phát hiện biến chứng mạch.
11.1 Bắt đầu lại kháng ngưng tập tiểu cầu
Sau EVAR thành công, bệnh nhân nên được dùng lại các thuốc thường ngày, bao gồm Aspirin, chỉ định dự phòng thứ phát ở bệnh nhân bệnh động mạch ngoại vi.
Việc dùng thuốc kháng huyết khối (kháng ngưng kết tiểu cầu, warfarin) có tăng nguy cơ endoleak hay không chưa được nghiên cứu rõ ràng.
11.2 Thăm khám và theo dõi dài hạn Stent graft
Thất bại của việc đặt stent graft động mạch chủ đã được ghi nhận và có thể dẫn đến tiếp tục gia tăng kích thước khối phình và nguy cơ vỡ. Do vậy, bệnh nhân bắt buộc phải được thăm khám lại thường quy để chắc chắn hệ thống stent graft bình thường. Mối quan tâm chủ yếu là endoleak, gia tăng kích thước túi phình, và dịch chuyển stent graft tại vị trí vùng kết nối, hay sự chia tách của các
thành phần cấu tạo stent graft. Phim chụp X quang bụng không chuẩn bị là phương án nhanh và tiết kiệm chi phí để đánh giá sự toàn vẹn của cấu trúc kim loại trong stent graft và sự gắn kết, kết nối của stent graft có thể thực hiện ngay trước khi ra viện. Để theo dõi bệnh nhân sau đó, khảo sát lại động mạch chủ nên được thực hiện 1 tháng sau can thiệp nội mạch và mỗi năm sau đó nếu không có biến chứng. Mặc dù tất cả các nghiên cứu của stent graft đều bắt buộc chụp lại sau 6 tháng, một nghiên cứu cho rằng chụp lại tại thời điểm này không ảnh hưởng đến chiến lược quản lý bệnh nhân. Do đó, không cần thiết chụp lại động mạch chủ tại thời điểm này nếu phim chụp sau 1 tháng không có gì đặc biệt.
Trong 1 tổng quan hệ thống Medicare của Mỹ, khảo sát cho 8000 bệnh nhân cho thấy 50% bệnh nhân không được khảo sát đầy đủ. Khi so sánh các bệnh nhân được khảo sát đầy đủ, không có khác biệt đáng kể tỷ lệ tử vong liên quan đến khối phình (0,3% so với 0,6%). Các bệnh nhân không được khảo sát đầy đủ có tỷ lệ can thiệp lại thấp hơn (1.4 so với 10%) và nguy cơ vỡ muộn thấp hơn (0,7% so với 1,4%). Mặc dù vậy, dữ liệu hạn chế của tổng quan, không đủ cung cấp đầy đủ thông tin lâm sàng như sự hiện diện của endoleak, nên các con số đưa ra không đủ để thay đổi thực hành lâm sàng.
Phương tiện chẩn đoán hình ảnh phổ biến nhất để khảo sát stent graft trong lòng mạch là CT mạch máu có tiêm thuốc cản quang và siêu âm mạch. Các phương tiện khác bao gồm MRI và đo áp lực khối phình. Trong một nghiên cứu tổng quan và phân tích gộp, tỷ lệ phát hiện endoleak cao nhất ở cách tiếp cận sử dụng nhiều phương tiện khác nhau. Phần lớn nghiên cứu báo cáo tỷ lệ phát hiện các kết cục quan trọng ở bệnh nhân sau 1, 6, 12, 24, 36, 48 và 60 tháng. Không có đủ dữ liệu để đưa ra chiến lược tốt nhất để theo dõi biến cố liên quan EVAR (ví dụ: thiếu máu chi, vỡ, biến chứng thận).
Chụp mạch CT với các lát cắt muộn là phương tiện thường được sử dụng nhất để theo dõi sau EVAR. Phương thức chụp này chính xác để đo đường kính tối đa và phát hiện endoleak và các biến chứng khác liên quan EVAR. Mặc dù vậy, chụp CT mạch máu tốn kém và việc lặp lại phơi nhiễm tia xạ nhiều lần tăng nguy cơ ung thư. Tiêm cản quang nhắc lại nhiều lần cũng gia tăng nguy cơ suy giảm chức năng thận. Hướng dẫn điều trị phình động mạch chủ bụng của Hội phẫu thuật mạch máu ủng hộ phương án chụp CT sau 1 tháng và 12 tháng trong năm đầu sau EVAR. Không còn khuyến cáo chụp lại thường quy sau can thiệp tại thời điểm 6 tháng trừ khi phim chụp sau 1 tháng cho thấy bất thường. Nếu không phát hiện endoleak sau năm đầu tiên thì khảo sát sau đó có thể dùng siêu âm mạch thay thế cho chụp CT.
Siêu âm mạch và CT thường có thể thay thế CT có thuốc để tránh tiêm thuốc cản quang nhiều lần. Một lợi ích của siêu âm mạch là phương tiện hình ảnh không xâm lấn và giá thành thấp hơn so với CT có thuốc, nhưng siêu âm cần được thực hiện bởi người có kinh nghiệm được trang bị tốt. Nhiều nghiên cứu đã được thực hiện để đánh giá hiệu quả của siêu âm để phát hiện túi phình gia tăng kích thước. Mặc dù vậy, vài nghiên cứu cho thấy độ nhạy thấp của siêu âm thường so với siêu âm có cản âm nên có xu hướng ưu tiên siêu âm cản âm hơn. Trong một nghiên cứu tổng quan, siêu âm có cản âm đạt độ nhạy gần bằng CT có thuốc cản quang. Độ nhạy và độ đặc hiệu của SA cản âm cho các loại endoleak khác nhau lần lượt là 96% đến 98% và 85% đến 88% khi lấy CT có thuốc là tiêu chuẩn. So sánh siêu âm cản âm với siêu âm thường trong tất cả các loại endoleak khác nhau độ nhạy siêu âm cản âm cao hơn nhưng độ đặc hiệu kém hơn; mặc dù vậy, không có sự khác biệt khi phát hiện endoleak loại I và III. Vậy nên, có thể độ nhạy cao hơn của siêu âm cản âm liên quan đến phát hiện endoleak loại II, loại không rõ ràng chỉ định can thiệp.
Mặc dù MRI có khả năng phát hiện endoleak cao hơn trong một vài nghiên cứu tổng quan hệ thống khi so với CT có thuốc, MRI không phải 1 phương tiện chẩn đoán hình ảnh để khảo sát EVAR thường quy nhưng có thể được dùng khi chống chỉ định chụp cắt lớp có tiêm thuốc cản quang. Lợi ích của MRI là không cần tiêm thuốc cản quang chứa ion hoá. Nhược điểm là độ phổ biến và khó đánh giá khi xảy ra nhiễu. Phần đầu stent graft làm bằng nitinol không hiện hình trên MRI, do vậy MRI chống chỉ định trên stent graft không có thành phần kim loại (ví dụ: cook, Zenith).
Đo trực tiếp áp lực trong túi phình sau EVAR có thể được thực hiện và là một chỉ số đáng tin cậy về áp lực trong túi, nhưng không xâm lấn. Các phép đo áp lực túi phình không xâm lấn bằng cách sử dụng hệ thống cảm biến áp suất không dây có thể mang theo người đã được phát triển, nhưng độ chính xác có thể bị hạn chế do sự hiện diện của huyết khối. Đối với endoleak loại II có ý nghĩa lâm sàng không rõ ràng, cảm biến có thể hỗ trợ quản lý điều trị. Tuy nhiên, cảm biến áp suất từ xa không cung cấp bất kỳ thông tin nào về tính toàn vẹn của stent graft và các thiết bị này không có khả năng được sử dụng làm giám sát độc lập sau EVAR, nhưng có thể bổ sung cho các phương thức rủi ro thấp khác như siêu âm. Chụp động mạch kỹ thuật số được sử dụng để đánh giá các vấn đề cụ thể như giảm lưu lượng chi, huyết khối, endoleak, hoặc để đo áp lực túi phình khi xác định túi phình tăng kích thước mà không có endoleak.
Trong quá trình theo dõi sau can thiệp nội mạch, một phát hiện phổ biến là lắng đọng huyết khối trong mạch nhân tạo; tuy nhiên, ý nghĩa lâm sàng của chúng còn được tranh luận. Trong một tổng quan hệ thống, năm nghiên cứu liên quan đến 808 bệnh nhân đã được phân tích. Phát hiện huyết khối trong quá trình theo dõi xảy ra ở 20,8% bệnh nhân. Các lắng đọng nội mạch thường được phát hiện trong năm đầu tiên sau khi sửa chữa. Huyết khối trong thành không liên quan đáng kể với biến cố huyết khối tắc mạch trong quá trình theo dõi. Các yếu tố rủi ro bao gồm vật liệu màng bọc graft polyester (tỷ lệ chênh lệch [OR] 2,34; 95% CI (1,53-3,58)) và tạo hình động mạch chủ chậu của endograft (OR 3,27; 95% CI (1,66-6,44)).
12 Tóm tắt
Động mạch chủ bụng được xác định là phình động mạch khi xác định được sự phình giãn cục bộ và đường kính của vùng đó tăng hơn 50% so với đường kính động mạch chủ bình thường. Đối với hầu hết các cá nhân, đường kính động mạch chủ bụng lớn hơn 3,0 cm thường được coi là phình động mạch chủ.
Sửa chữa nội mạch phình động mạch chủ bụng (EVAR) là một giải pháp thay thế rộng rãi cho phẫu thuật mở. Tuy nhiên, vai trò chính xác của EVAR vẫn cần tiếp tục được xác định. Các hướng dẫn từ các hiệp hội y tế và phẫu thuật lớn khuyến nghị một cách tiếp cận cá thể hoá cho bệnh nhân khi lựa chọn giữa phẫu thuật mở và can thiệp nội mạch, có tính đến tuổi của bệnh nhân, các yếu tố nguy cơ về bệnh tật và tử vong sau phẫu thuật, các yếu tố giải phẫu và kinh nghiệm của bác sĩ làm thủ thuật.
Việc đánh giá nguy cơ trước phẫu thuật đối với bệnh nhân đang sửa chữa nội mạch đòi hỏi phải đánh giá nguy cơ và đánh giá định lượng và định tính cẩn thận về giải phẫu động mạch chủ để xác định tính phù hợp cho việc can thiệp nội mạch. Với các thiết kế stent graft động mạch chủ ban đầu, khoảng 50% bệnh nhân không phải là thuận lợi lựa chọn cho EVAR vì vị trí, mức độ giãn hoặc hình thái của túi phình, hoặc không có đường vào mạch máu thích hợp. Sự sẵn có của các thiết bị mới cho phép vùng gắn kết của stent graft ngắn hơn và các stent graft mới đã mở rộng việc sử dụng EVAR cho gần hai phần ba bệnh nhân bị phình động mạch chủ bụng dưới động mạch thận.
Theo dõi chẩn đoán hình ảnh trong can thiệp nội mạch là bắt buộc trong thời gian sống mong đợi của bệnh nhân để đánh giá tính toàn vẹn và vị trí của stent graft. Có thể kết hợp chụp X quang bụng không chuẩn bị để đánh giá cấu trúc stent kim loại. Chụp cắt lớp vi tính và siêu âm 2D để đánh giá stent graft vào thời điểm 1 và 12 tháng sau can thiệp, và mỗi năm sau đó. Các mảnh stent graft nội mạch để can thiệp động mạch chủ bụng dưới động mạch thận có chung một thiết kế thân chính gồm 2 chân và hệ thống kéo dài kết nối 2 chân với động mạch chậu. Không có lợi thế rõ ràng của thiết kế này so với thiết kế khác. Stent graft nội mạch được cấu thành bằng cách triển khai tuần tự các thành phần stent graft trong lòng mạch.
Tỷ lệ tử vong ngắn hạn của can thiệp nội mạch khả quan hơn so với phẫu thuật mở trong các thử nghiệm ngẫu nhiên và các nghiên cứu quan sát lớn. Lợi ích lớn nhất đối với những bệnh nhân có nguy cơ phẫu thuật cao, trong đó tỷ lệ tử vong ngắn hạn khi can thiệp nội mạch thấp hơn đáng kể so với mổ mở (4,7% so với 19,2% trong 30 ngày, trong một báo cáo). Người ta vẫn chưa xác định chắc chắn rằng sửa chữa nội mạch là tốt hơn phẫu thuật mở về lâu dài, ngay cả ở những bệnh nhân có nguy cơ phẫu thuật cao nhất.
Tỷ lệ biến chứng chung cho việc can thiệp nội mạch phình động mạch chủ bụng, bao gồm cả các vấn đề liên quan đến đường vào, là khoảng 10%. Các thất bại kỹ thuật có thể do biến chứng hoặc không có khả năng giải quyết endoleak type I nhưng chúng thường có thể được xử trí bằng cách sử dụng các thủ thuật can thiệp nội mạch hỗ trợ. Chuyển mổ mở có thể cần thiết nhưng không phổ biến, xảy ra ở ít hơn 2% bệnh nhân tại thời điểm can thiệp. Các biến chứng liên quan đến stent graft bao gồm tổn thương mạch máu khi nở stent graft và endoleak.
13 Tài liệu tham khảo
- Schanzer A, Greenberg RK, Hevelone N, et al. Predictors of abdominal aortic aneurysm sac enlargement after endovascular repair. Circulation 2011; 123:2848.
- Higashiura W, Kichikawa K, Sakaguchi S, et al. Accuracy of centerline of flow measurement for sizing of the Zenith AAA endovascular graft and predictive factor for risk of inadequate Cardiovasc Intervent Radiol 2009; 32:441.
- EVAR trial participants. Endovascular aneurysm repair versus open repair in patients with abdominal aortic aneurysm (EVAR trial 1): randomized controlled trial. Lancet 2005; 365:2179.
- Chaikof EL, Blankensteijn JD, Harris PL, et al. Reporting standards for endovascular aortic aneurysm repair. J Vasc Surg 2002; 35:1048.
- Moll FL, Powell JT, Fraedrich G, et Management of abdominal aortic aneurysms clinical practice guidelines of the European society for vascular surgery. Eur J Vasc Endovasc Surg 2011; 41 Sup pl 1:S1.
- Ruppert V, Leurs LJ, Steckmeier B, et Influence of anesthesia type on outcome after endovascular aortic aneurysm repair: an analysis based on EUROSTAR data. J Vasc Surg 2006; 44:16.
- Cao Z, Wu W, Zhao K, et al. Safety and Efficacy of Totally Percutaneous Access Compared With Open Femoral Exposure for Endovascular Aneurysm Repair: A Meta-analysis. J Endovasc Ther 2017; 24:246.
- Orgera G, Tipaldi MA, Laurino F, et al. Techniques and future perspectives for the prevention and treatment of endoleaks after endovascular repair of abdominal aortic aneurysms. Insights Imaging 2019; 10:91.
- Samura M, Morikage N, Otsuka R, et Endovascular Aneurysm Repair With Inferior Mesenteric Artery Embolization for Preventing Type II Endoleak: A Prospective Randomized Controlled Trial. Ann Surg 2020; 271:238.
- Garg T, Baker LC, Mell Postoperative Surveillance and Long-term Outcomes After Endovascular Aneurysm Repair Among Medicare Beneficiaries. JAMA Surg 2015; 150:957.
- Perini P, Bianchini Massoni C, Azzarone M, et al. Significance and Risk Factors for Intraprosthetic Mural Thrombus in Abdominal Aortic Endografts: A Systematic Review and Meta-analysis. Ann Vasc Surg 2018; 53:234.
- Jackson RS, Chang DC, Freischlag Comparison of long-term survival after open vs endovascular repair of intact abdominal aortic aneurysm among Medicare beneficiaries. JAMA 2012; 307:1621.
- Sweeting MJ, Patel R, Powell JT, et al. Endovascular Repair of Abdominal Aortic Aneurysm in Patients Physically Ineligible for Open Repair: Very Long-term Follow-up in the EVAR-2 Randomized Controlled Ann Surg 2017; 266:713.
- Powell JT, Sweeting MJ, Ulug P, et Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg 2017; 104:166.
- Brown LC, Powell JT, Thompson SG, et The UK EndoVascular Aneurysm Repair (EVAR) trials: randomized trials of EVAR versus standard therapy. Health Technol Assess 2012; 16:1.

