Can thiệp điều trị suy tĩnh mạch mạn tính chi dưới

Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
ThS.BSNT. Nguyễn Tuấn Hải
ThS.BS. Doãn Hữu Linh
ThS.BSNT. Nguyễn Anh Quân
ThS.BSNT. Trần Huyền Trang
PGS.TS.BS. Phạm Mạnh Hùng
Trungtamthuoc.com - Can thiệp điều trị suy tĩnh mạch mạn tính chi dưới là một trong những thủ thuật quan trọng trong tim mạch can thiệp. Vậy thực hiện thủ thuật này cần làm như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy tìm hiểu trong bài viết dưới đây.
1 Tiếp cận suy tĩnh mạch chi dưới mạn tính
1.1 Đại cương
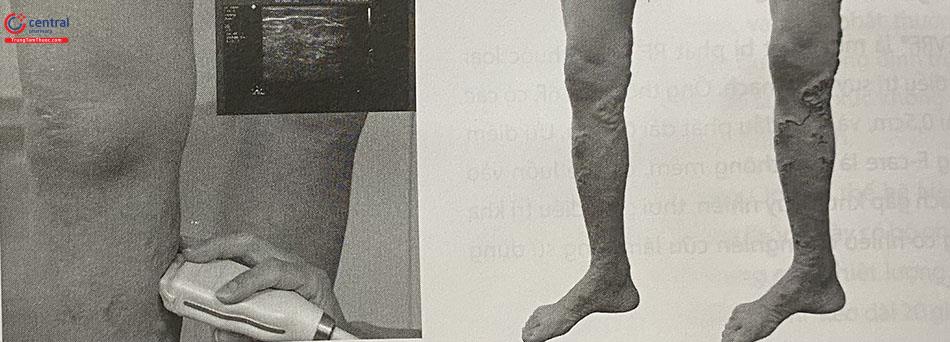
Bệnh tĩnh mạch mạn tính (CVD/chronic venous disease) gồm bất kỳ bất thường về hình thái hoặc chức năng nào của hệ thống tĩnh mạch, có tính chất kéo dài, gây ra triệu chứng lâm sàng cần được chẩn đoán và điều trị. Triệu chứng phổ biến của bệnh tĩnh mạch mạn tính là cảm giác đau, tức nặng, tê bì, chuột rút chi dưới thay đổi theo thời gian. Các dấu hiệu của bệnh rất đa dạng, từ giãn tĩnh mạch dạng lưới, mạng nhện, búi giãn tĩnh mạch nông, đến phù chi, rối loạn sắc tố và loét da.
Suy tĩnh mạch mạn tính (CVI/chronic venous insufficiency) là thuật ngữ chỉ bệnh tĩnh mạch mạn tính tiến triển do những bất thường chức năng của hệ thống tĩnh mạch, gây phù, rối loạn sắc tố da hoặc loét tĩnh mạch. Cơ chế bệnh sinh chính của những rối loạn này là sự gia tăng áp lực kéo dài lên hệ tĩnh mạch nông và/hoặc sâu chi dưới, có hoặc không kèm theo tắc nghẽn, dẫn đến dòng trào ngược bệnh lý trong lòng tĩnh mạch. Vì vậy mục tiêu điều trị là loại bỏ dòng trào ngược này, song song với điều trị các triệu chứng và dấu hiệu nói trên. Phẫu thuật tuốt bỏ tĩnh mạch hiển (stripping) và các nhánh tĩnh mạch nông là phương pháp kinh điển để điều trị suy tĩnh mạch mạn tính chi dưới. Tuy nhiên, tỷ lệ tái phát sau phẫu thuật khá cao (25 – 50% sau 5 năm), thời gian nằm viện kéo dài, có thể để lại nhiều sẹo… là những hạn chế chính của phẫu thuật. Nhờ sự tiến bộ của khoa học kỹ thuật, các phương pháp can thiệp ít xâm lấn, gồm các kỹ thuật can thiệp nội tĩnh mạch nhiệt và không nhiệt, đang ngày một phát triển, và dần thay thế phẫu thuật truyền thống. Nhiều nghiên cứu được thực hiện trong, và ngoài nước đã chứng minh hiệu quả điều trị lâu dài của can thiệp nội tĩnh mạch, về tiêu chí gây tắc hoàn toàn tĩnh mạch bệnh lý không kém hơn phẫu thuật, nhưng đau ít hơn, thời gian nằm viện ngắn hơn và ít các tác dụng ngoại ý hơn, đồng thời có giá trị thẩm mỹ cao, làm người bệnh hài lòng hơn, góp phần đáng kể nâng cao chất lượng cuộc sống sau can thiệp.
1.2 Giải phẫu hệ tĩnh mạch chi dưới
1.2.1 Giải phẫu hệ tĩnh mạch nông chi dưới
Giải phẫu hệ tĩnh mạch nông chi dưới được mô tả chi tiết trong Chương 7: Giải phẫu và sinh lý hệ tĩnh mạch ứng dụng trong can thiệp. Nhìn chung, hệ tĩnh mạch chi dưới được chia ra làm ba hệ thống hợp lưu trong một mạng lưới chung, cuối cùng đổ vào tĩnh mạch chậu ngoài. Hệ thống tĩnh mạch này bao gồm hệ thống tĩnh mạch hiển,hệ thống tĩnh mạch sâu và hệ thống tĩnh mạch xiên (xuyên) nối hai hệ thống trên với nhau.
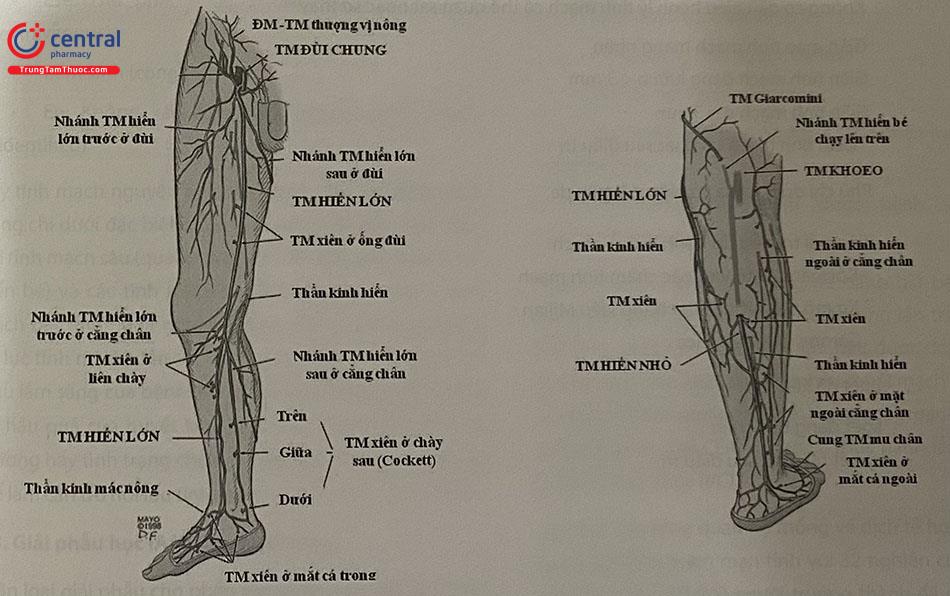
Chú thích: ĐM: Động mạch; TM: Tĩnh mạch.
1.2.2 Các hình thái tổn thương của hệ tĩnh mạch nông chi dưới
Có 3 dạng hình thái tổn thương là giãn thân và nhánh tĩnh mạch (> 3 mm), giãn tĩnh mạch dạng lưới (1- 3 mm) và giãn tĩnh mạch nhỏ dạng mạng nhện (< 1 mm).
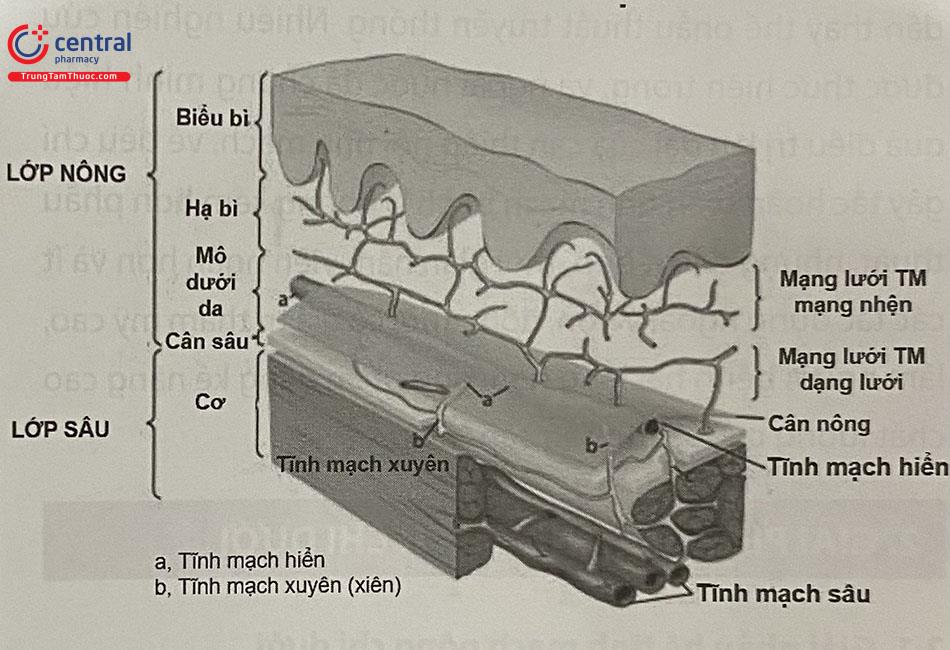
Chú thích: TM: Tĩnh mạch
1.3 Phân loại tĩnh mạch chi dưới mạn tính
Phân loại CEAP được giới thiệu trong khoảng hai mươi năm nay, là công cụ phổ biến nhất để mô tả các rối loạn mạn tính của hệ tĩnh mạch chi dưới ở bốn khía cạnh: lâm sàng, nguyên nhân, giải phẫu và sinh lý bệnh. Được giới thiệu lần đầu tiên vào năm 1995 với tên gọi “Phân loại CEAP của bệnh tĩnh mạch mạn tính”, phân loại này đã được sửa đổi năm 2004, và cập nhật năm 2020 dưới sự bảo trợ của Diễn đàn Tĩnh mạch Hoa Kỳ (AVF/American Venous Forum).
1.3.1 Lâm sàng ( C/Clinical Class)
Chia làm các mức độ từ C0 đến C6. Mặc dù phân loại C tăng nhìn chung phản ánh mức độ tiến triển của bệnh, nhưng không nên coi đây là sự phát triển tuyến tính, hay là thang điểm chỉ ra mức độ trầm trọng của bệnh.
Bảng 57.1. Mô tả phân loại lâm sàng theo CEAP
| PHÂN LOẠI | MÔ TẢ |
|---|---|
| C0 | Không có dấu hiệu bệnh lý tĩnh mạch có thể quan sát hoặc sờ thấy |
| C1 | Giãn mao tĩnh mạch mạng nhện Giãn tĩnh mạch dạng lưới ø < 3 mm |
C2 C2r | Giãn tĩnh mạch ø > 3 mm Giãn tĩnh mạch tái phát sau điều trị |
| C3 | Phù chi dưới, chưa có biến đổi trên da |
C4 C4a C4b C4c | Biến đổi trên da do bệnh lý tĩnh mạch Rối loạn sắc tố và/hoặc chàm tĩnh mạch Xơ mỡ da và/hoặc teo trắng kiểu Milian Corona phlebectatica |
| C5 | Loét đã liền sẹo |
| C6 C6r | Loét đang tiến triển Loét tái phát sau điều trị |
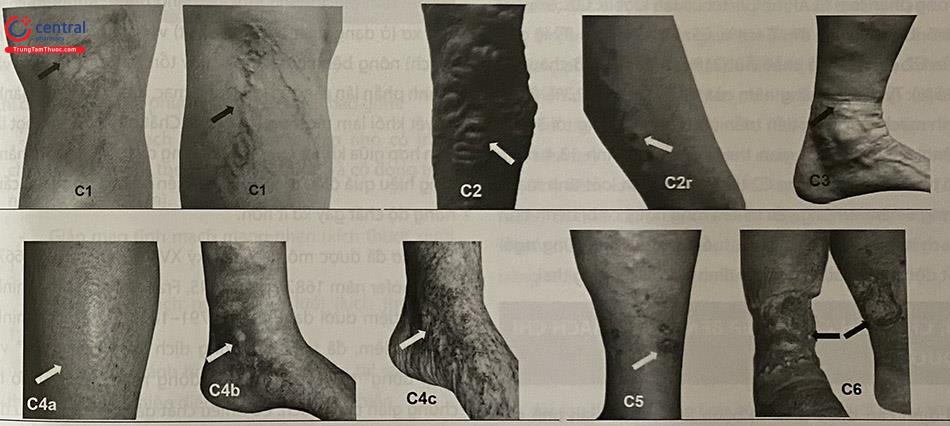
1.3.2 Nguyên nhân (E/etiological class)
Nguyên nhân của bệnh tĩnh mạch mạn tính chi dưới được chia làm:
- Ep: Nguyên phát (primary)
- Es: Thứ phát (secondary)
- Esi: Thứ phát – trong tĩnh mạch (secondary- intravenous)
- Ese: Thứ phát – ngoài tĩnh mạch (secondary- extravenous)
- Bẩm sinh (congenital)
- En: Không xác định được nguyên nhân (none identified)
Suy tĩnh mạch nguyên phát liên quan đến suy tĩnh mạch nông chi dưới đặc biệt ở các vị trí nối giữa tĩnh mạch hiển với tĩnh mạch sâu (quai tĩnh mạch hiển lớn, quai tĩnh mạch hiển bé) và các tĩnh mạch xuyên. Dòng trào ngược tĩnh mạch bất thường là nguyên nhân gây ra tình trạng tăng áp lực tĩnh mạch, dẫn tới một loạt các triệu chứng và dấu hiệu lâm sàng của bệnh. Bệnh tĩnh mạch thứ phát thường do hậu quả của huyết khối tĩnh mạch sâu, mặc dù chấn thương hay tình trạng chèn ép tĩnh mạch trong ổ bụng có thể làm cản trở hồi lưu tĩnh mạch và gây ra các triệu chứng.
1.3.3 Giải phẫu học (A/Anatomical Class)
Phân loại giải phẫu cho phép xác định chính xác vị trí tĩnh mạch bệnh. Đó là các tĩnh mạch có dòng trào ngược bệnh lý được phát hiện trên siêu âm Doppler, gồm:
- As: Hệ TM nông (superficial)
- Ad: Hệ TM sâu (deep)
- Ap: Hệ TM xuyên (perforating)
- An: Vị trí tĩnh mạch không xác định (no identifiable venous location)
1.3.4 Cơ chế bệnh sinh (P/Pathophysiological Class)
1.3.5 Cơ chế bệnh sinh được xác định là:
- Pr: Có dòng trào ngược (reflux)
- Po: Tắc nghẽn (obstruction)
- Pr,o: phối hợp trào ngược + tắc nghẽn (reflux and obstruction)
- Pn: Không xác định được bệnh sinh (no pathophysiology identified)
Phân loại CEAP được sử dụng để đánh giá bệnh nhân bệnh tĩnh mạch mạn tính chi dưới trong lần thăm khám đầu tiên, và sau mỗi lần tái khám đều được đánh giá lại. Khuyến cáo năm 2022 của Hội phẫu thuật mạch máu châu Âu (ESVS/European Society for Vascular Surgery) đề nghị áp dụng phân loại CEAP trong cả thực hành lâm sàng và nghiên cứu y khoa (I/C).
Một báo cáo tổng quan hệ thống về dịch tễ học toàn cầu của bệnh tĩnh mạch mạn tính với 32 nghiên cứu từ 6 lục địa gồm trên 300.000 người trưởng thành đã ước tính tỷ lệ gộp, không hiệu chỉnh cho từng giai đoạn lâm sàng C trong phân loại CEAP, từ C0s tới C6 lần lượt là: C0s: 9%, C1: 26%, C2: 19%, C3: 8%, C4: 4%, C5: 1%, C6: 0.4%. Tỷ lệ gộp của C2 cao nhất ở châu Âu (21%), thấp nhất ở châu Phi (5,5%). Tỷ lệ mắc hàng năm của C2 từ 0,2 đến 2,3%. Bệnh tĩnh mạch mạn tính tiến triển ước tính tác động tới 31,9% bệnh nhân với thời gian theo dõi trung bình 13,4 năm. Có tới 22% trường hợp C2 tiến triển thành loét tĩnh mạch trong 6 năm. Những yếu tố làm tăng nguy cơ bị bệnh tĩnh mạch mạn tính gồm giới nữ, tuổi cao, béo phì, đứng/ngồi bất động kéo dài, tiền sử gia đình và số lần mang thai.
1.4 Chỉ định can thiệp bệnh tĩnh mạch chi dưới
Chỉ định can thiệp điều trị bệnh tĩnh mạch mạn tính chi dưới phụ thuộc vào lâm sàng (tiền sử, triệu chứng, dấu hiệu) và kết quả phát hiện dòng trào ngược tĩnh mạch bệnh lý trên siêu âm Doppler (dòng trào ngược trên 500 mili giây tại thân tĩnh mạch hiển).
Nhiều nghiên cứu lâm sàng đã chỉ ra lợi ích rõ rệt của can thiệp trong cải thiện triệu chứng, nâng cao chất lượng cuộc sống và sự hài lòng của bệnh nhân, không chỉ ở giai đoạn bệnh tiến triển (C4 – C6), mà ngay khi bệnh mới ở giai đoạn C2. Tuy nhiên, với bệnh nhân chỉ có phù mà không thấy búi giãn tĩnh mạch (C3), cần tìm các nguyên nhân khác không phải tĩnh mạch có thể gây ra phù, nhất là khi phù xuất hiện ở cả hai chân. Chỉ định can thiệp đúng cho bệnh nhân giai đoạn C3 sẽ giúp cải thiện triệu chứng và giảm phù.
Với những bệnh nhân chỉ có giãn tĩnh mạch dạng lưới hay mạng nhện (C1), can thiệp xóa những tĩnh mạch này không phải là chỉ định bắt buộc, vì vấn đề chính thường chỉ là yếu tố thẩm mỹ. Trước khi được điều trị, bệnh nhân cần được giải thích rõ ràng về sự lành tính, nguy cơ thấp gây ra các biến chứng của bệnh ở giai đoạn C1, cũng như chi phí phải trả khi can thiệp. Chỉ định, chống chỉ định cụ thể sẽ được đề cập trong từng phương pháp can thiệp.
2 Phương pháp can thiệp: Tiêm xơ
2.1 Đại cương
Tiêm xơ là phương pháp can thiệp điều trị bệnh tĩnh mạch mạn tính chi dưới bằng cách tiêm vào trong lòng tĩnh mạch một hóa chất gây xơ hóa và tắc lòng tĩnh mạch. Các tĩnh mạch được điều trị có thể là tĩnh mạch hiển, tĩnh mạch xuyên, tĩnh mạch dạng lưới và mạng nhện. Khi tiêm chất gây xơ (ở dạng dịch hay dạng bọt) vào lòng TM (TM/tĩnh mạch) nông bệnh lý, chất này gây tổn thương nội mạc và thành phần lân cận của lớp trung mạc, dẫn đến hình thành huyết khối làm tắc lòng TM bị suy. Chất gây xơ dạng bọt là hỗn hợp giữa khí và chất gây xơ dạng dịch, mục đích nhằm tăng hiệu quả điều trị, giảm tỷ lệ biến chứng trong khi cần nồng độ chất gây xơ ít hơn.
Tiêm xơ đã được mô tả từ thế kỷ XVII (Esholtz năm 1667, Zollikhofer năm 1682). Năm 1845, Francis Rynd phát minh ra kim tiêm dưới da. Pravaz (1791–1853), nhờ phát minh ra ống tiêm, đã tiêm các dung dịch “gây kích thích” và “làm đông” trong bệnh phình động mạch, và sau đó là chứng giãn tĩnh mạch. Có nhiều chất gây xơ khác nhau đã từng được sử dụng như Sắt perchloride (1851), dung dịch iodo-tannic (1854), cồn 5% (1878), axit carbolic (1904), dung dịch iodo-iodurea (1906), Glucose ưu trương (1917), natri salicylat (1919), quinin sulfate (1922), muối ưu trương (1929), natri morrhuate (1930), Crom Glycerin (1931). Tuy nhiên những chất này có nhiều biến chứng, thậm chí gây hoại tử mô, nhiễm khuẩn huyết và thuyên tắc phổi. Sự ra đời của các chất gây xơ an toàn hơn như natri tetradecyl sulfat (1946), polidocanol (1966) đã góp phần thúc đẩy sự phát triển mạnh mẽ của phương pháp này, lấn át cả phẫu thuật truyền thống trong điều trị giãn tĩnh mạch (phẫu thuật Müller, stripping).
Tuy nhiên, các dung dịch gây xơ đặt ra hai vấn đề phải giải quyết, đó là nồng độ không quá đậm đặc để làm tổn thương mô, nhưng cũng không quá loãng, để bị dòng máu hòa tan và làm mất tác dụng lên thành tĩnh mạch. Để khắc phục, Mac Ausland đã lắc sodium morrhuate tạo thành bọt để tiêm xơ điều trị giãn tĩnh mạch dạng lưới (1939). Năm 1944, Orbach trộn 0,3 – 0,5 ml không khí với chất gây xơ tạo thành bọt, để làm giảm sự pha loãng, tăng khả năng co thắt mạch, và gọi kỹ thuật này là “air-block”. Năm 1957, Mayer và Brücke mô tả cách thức sử dụng bơm tiêm kiểu pít-tông kép để tạo ra vi bọt (microfoam). Trong những năm 1990, Cabrera, Monfreux và Tessari tiếp tục cải tiến phương pháp tạo vi bọt. Knight, sau đó là Wollmann đã áp dụng tiêm xơ dưới hướng dẫn của siêu âm, và kể từ năm 1995, tiêm xơ đã trở thành một kỹ thuật được ưa chuộng và chỉ định rộng rãi trong điều trị các thể khác nhau của bệnh lý tĩnh mạch mạn tính chi dưới.
2.2 Chỉ định, chống chỉ định
2.2.1 Chỉ định
Chỉ định chung của phương pháp tiêm xơ bao gồm:
- Suy tĩnh mạch hiển lớn hoặc hiển nhỏ có triệu chứng (từ C2 – C6 theo phân loại CEAP, và có dòng trào ngược trên siêu âm).
- Giãn mao tĩnh mạch mạng nhện (kích thước dưới 1 mm).
- Giãn tĩnh mạch nông dạng lưới (kích thước từ 1 – 3 mm).
- Giãn các nhánh tĩnh mạch nông tồn tại sau phẫu thuật hoặc can thiệp điều trị suy tĩnh mạch hiển.
- Dị dạng tĩnh mạch có kích thước nhỏ, thể khu trú.
- Suy tĩnh mạch xuyên, hoặc suy tĩnh mạch nông tái phát.
- Giãn tĩnh mạch sinh dục.
Tiêm xơ, đặc biệt là tiêm xơ bằng bọt dưới hướng dẫn của siêu âm, trong một thời gian dài đã là một trong những phương pháp phổ biến nhất để điều trị suy tĩnh mạch hiển lớn, hiển nhỏ, tĩnh mạch hiển phụ hoặc tĩnh mạch xuyên. Khuyến cáo châu Âu về tiêm xơ (European guidelines for sclerotherapy in chronic venous disorders) năm 2014 xếp chỉ định tiêm xơ điều trị suy tĩnh mạch hiển vào nhóm I/A, tương tự như chỉ định của Diễn đàn Tĩnh mạch Hoa Kỳ. Tiêm xơ bằng bọt được ưu tiên khuyến cáo hơn tiêm xơ bằng dịch trong điều trị suy tĩnh mạch hiển (I/B).
Với sự phát triển mạnh mẽ của các kỹ thuật can thiệp nhiệt nội tĩnh mạch, và qua theo dõi trong thời gian dài, các báo cáo lâm sàng đều chỉ ra tỷ lệ đóng hoàn toàn tĩnh mạch lâu dài sau tiêm xơ thấp hơn có ý nghĩa so với phẫu thuật truyền thống, hoặc các phương pháp can thiệp mới, đặc biệt với các tĩnh mạch có kích thước lớn. Hội phẫu thuật mạch máu châu Âu trong khuyến cáo mới nhất năm 2022, đã không lựa chọn tiêm xơ là phương pháp ưu tiên để điều trị suy thân tĩnh mạch hiển. Tuy nhiên, đây vẫn là phương pháp hàng đầu để điều trị giãn các tĩnh mạch dạng lưới, hay tĩnh mạch mạng nhện.
Bảng 57.2. Khuyến cáo của Hội Phẫu thuật mạch máu châu Âu về chỉ định can thiệp nhiệt điều trị suy tĩnh mạch mạn tính
| KHUYẾN CÁO | MỨC ĐỘ KHUYẾN CÁO | MỨC ĐỘ BẰNG CHỨNG |
|---|---|---|
| Bệnh nhân suy thân tĩnh mạch hiển lớn có chỉ định can thiệp, có thể chỉ định tiêm xơ tạo bọt dưới hướng dẫn của siêu âm nếu đường kính tĩnh mạch nhỏ hơn 6 mm | IIb | B |
| Phương pháp tiêm xơ bằng bọt cần được thực hiện dưới hướng dẫn của siêu âm | I | C |
| Tiêm xơ là phương pháp lựa chọn hàng đầu để điều trị giãn tĩnh mạch dạng lưới | I | A |
| Có thể cân nhắc lựa chọn tiêm xơ để điều trị giãn tĩnh mạch mạng nhện | IIa | A |
2.2.2 Chống chỉ định
2.2.2.1 Chống chỉ định tuyệt đối
- Dị ứng với chất gây xơ.
- Huyết khối tĩnh mạch chi dưới cấp tính.
- Nhiễm trùng tại vị trí gây xơ, hoặc nhiễm trùng cấp tính toàn thân.
- Tồn tại lỗ bầu dục đã biết, có triệu chứng (chống chỉ định tiêm xơ bằng bọt).
2.2.2.2 Chống chỉ định tương đối
- Phụ nữ có thai hoặc cho con bú (nếu bắt buộc phải gây xơ, ngừng cho con bú 2 – 3 ngày).
- Bệnh động mạch chi dưới trầm trọng.
- Nguy cơ cao bị thuyên tắc huyết khối tĩnh mạch (tiền sử thuyên tắc huyết khối, bệnh lý tăng đông bẩm sinh, ung thư đang tiến triển).
- Bất động hoặc nằm liệt giường kéo dài.
- Với tiêm xơ bằng bọt: Tồn tại lỗ bầu dục đã biết, không triệu chứng. Tiền sử bị cơn đau nửa đầu nặng.
2.3 Các chất tiêm xơ và cơ chế tác dụng
2.3.1 Phân loại
Dựa vào cơ chế tác dụng, chất tiêm xơ được chia làm 3 nhóm:
Các chất có tác dụng thẩm thấu (glucose hoặc dung dịch muối ưu trương): tác dụng gây mất nước và phá hủy lớp áo trong của thành tĩnh mạch khá chậm, vì vậy chỉ dùng điều trị những mạch máu có kích thước nhỏ, và không được pha loãng, vì làm giảm tác dụng của chất gây xơ.
Các chất có tác dụng bào mòn (lauromacrogol hoặc polidocanol, tetradecyl sulfat natri): tác dụng bào mòn màng tế bào nội mô, làm thay đổi cấu trúc lớp trung – ngoại mạc tĩnh mạch đến rất nhanh chóng, và tỷ lệ thuận với nồng độ của chất gây xơ, cũng như dạng bọt hay dịch. Các chất gây xơ thuộc nhóm này có thể tạo thành dạng bọt khá dễ dàng bằng những thiết bị khác nhau. Ưu điểm của chất gây xơ dạng bọt so với dạng dịch:
- Tăng thời gian tiếp xúc của chất gây xơ với thành nội mạc của TM, nhờ đó tăng khả năng gây xơ.
- Khả năng lan tỏa và làm đầy TM tốt hơn, đồng thời có thể quan sát được dễ dàng trên siêu âm sau khi hoàn thành thủ thuật.
- Thủ thuật ít gây đau hơn, do lượng chất gây xơ được sử dụng ít hơn, và nồng độ loãng hơn so với dạng dịch.
- Ít hại hơn, và có thể phát hiện dễ dàng bằng siêu âm trong trường hợp tiêm ra ngoài
- Gây tắc đoạn TM dài hơn so với chất gây xơ dạng dịch có cùng nồng độ và số lượng.
- Khả năng gây co thắt TM ngay sau tiêm cao hơn, và đó là yếu tố dự báo sự thành công của thủ thuật.
Các chất gây kích ứng về hóa học (iốt, glycerin crôm): có tác dụng biến đổi và phá hủy lớp tế bào nội mô.
Ngoài ra, chất tiêm xơ có thể được phân loại theo mức độ tác động:
- Mạnh: iốt, natri tetradecyl
- Trung bình: natri salicylat,
- Yếu: glycerin crôm, polidocanol nồng độ thấp.
2.3.2 Các chất tiêm xơ chính
Polidocanol (Aetoxisclerol®)
Polidocanol được áp dụng từ năm 1936 như một chất gây tê cục bộ (phổ biến trong lĩnh vực da liễu và hậu môn trực tràng). Từ năm 1966, polidocanol bắt đầu được sử dụng để gây xơ. Đây là một hóa chất không màu, dạng lỏng, pH từ 5–7, nồng độ từ 0,25 đến 3%, không gây thâm da, rất ít gây dị ứng, có thể được sử dụng ở dạng bọt.
Natri tetradecyl sulfat (Trombovar® 1% và 3%, Fibrovein® 0,2%, 0,5%, 1% và 3%)
Đây là chất không màu, pH từ 6,5 – 9, có tác dụng gây xơ rất mạnh. Thuốc không gây đau, kể cả khi tiêm ra ngoài tĩnh mạch, và khuếch tán tốt vào mô, nhưng có thể để lại những vệt rối loạn sắc tố sau tiêm. Dị ứng thuốc được ghi nhận, nhưng sốc phản vệ rất hiếm gặp.
2.3.3 Cơ chế tác dụng
Chất gây xơ sau khi được tiêm vào trong lòng tĩnh mạch sẽ gây biến đổi một phần lớp nội mạc và trung mạc của thành tĩnh mạch. Nghiên cứu thực nghiệm (ex vivo) cho thấy sau khi chịu tác dụng trực tiếp của chất gây xơ, tế bào nội mạc bị tổn thương tiết ra các các yếu tố viêm và yếu tố tiền hủy tế bào theo chương trình, có thể xuyên sâu 250 – 300 μm vào trong thành tĩnh mạch gây phá hủy lớp trung mạc.
Sau giai đoạn viêm và chết tế bào theo chương trình là quá trình xơ hóa, tiến triển từ từ trong vòng ít nhất 6 tháng. Thành tĩnh mạch bị xốp do viêm gây ra, có thể làm hồng cầu thoát ra ngoài dẫn đến tình trạng rối loạn sắc tố da, không chỉ gặp sau tiêm xơ mà còn sau các can thiệp tĩnh mạch khác, tương tự như khi bị huyết khối tĩnh mạch nông.
Lòng tĩnh mạch bệnh lý bị hẹp lại có thể coi là hiệu quả, giúp cải thiện về huyết động, nhưng mục tiêu chính của tiêm xơ là gây tắc và xơ hóa tĩnh mạch. “Huyết khối” lớn trong lòng mạch là nguồn gốc của sự tái thông, và tái phát về sau. Vì vậy, cần giảm tối đa hiện tượng này, trong khi phải đảm bảo hiệu quả tối ưu của chất gây xơ lên thành tĩnh mạch, bằng cách chọn đúng “liều lượng và nồng độ” của chất gây xơ, phù hợp với tĩnh mạch bệnh lý của từng người bệnh.
Trong thực tế, dù can thiệp nhiệt nội tĩnh mạch hay tiêm xơ, trong lòng mạch luôn tồn tại một số thành phần nhất định, mà chỉ có thể xơ hóa hoàn toàn sau vài tháng can thiệp (laser), hoặc muộn hơn đối với tiêm xơ bằng bọt. Hiệu quả của tiêm xơ có thể giảm nếu tĩnh mạch quá giãn, thành tĩnh mạch quá dày (chất tiêm xơ chỉ xuyên qua được tối đa 250 – 300 μm). Bên cạnh đó, người bệnh đang dùng thuốc chống đông không phải là một chống chỉ định với tiêm xơ, vì sự tổn thương và phá hủy lớp nội – trung mạc có ý nghĩa quyết định chứ không phải sự xuất hiện của huyết khối gây tắc lòng mạch.
2.3.4 Phương pháp tạo bọt tiêm xơ
Năm 2006, Hội nghị đồng thuận châu Âu tại Tegernsee, Đức đã đưa ra định nghĩa về bọt tiêm xơ: “Bọt tiêm xơ là sự phân tán không ổn định của các bọt khí trong dung dịch chất gây xơ”. Dung dịch phải chứa các phân tử chất hoạt động bề mặt và khí phải được dung nạp tốt về mặt sinh lý. Bọt tiêm xơ được đặc trưng bởi các thông số sau:
Loại và nồng độ của chất hoạt động bề mặt (chất tạo bọt);
- Loại khí;
- Tỷ lệ thể tích giữa khí và chất lỏng;
- Phương pháp chuẩn bị;
- Kích thước bọt;
- Thời gian tồn tại của bọt kể từ khi chuẩn bị.
Kỹ thuật tạo bọt được tiến hành ngay trước khi tiêm xơ. Khí thường được sử dụng nhất là không khí, nhưng một số bác sĩ can thiệp dùng khí O2, CO2 hoặc hỗn hợp CO2 và O2. Chất tạo bọt là các thuốc tiêm xơ nhóm polidocanol hoặc natri tetradecyl sulfat. Ưu điểm của chất tiêm xơ dạng bọt so với dạng dịch là:
- Kéo dài thời gian tiếp xúc của chất tiêm xơ với nội mạc tĩnh mạch, làm tăng hiệu quả gây xơ.
- Làm đầy tốt hơn và co thắt tốt hơn các đoạn tĩnh mạch được điều trị.
- Chất lượng hồi âm cao, giúp siêu âm dễ dàng đánh giá sự phân bố của bọt tiêm xơ.
- Với cùng nồng độ và thể tích, tiêm xơ dạng bọt điều trị được đoạn tĩnh mạch dài hơn so với tiêm xơ dạng dịch.
Hơn 20 kỹ thuật tạo bọt tiêm xơ đã được công bố, trong đó phương pháp Tessari sử dụng khóa 3 đầu (chạc ba), hoặc sử dụng bộ nối 2 đầu, là phổ biến nhất.
Bảng 57.3. Khuyến cáo về phương pháp tạo bọt tiêm xơ của châu Âu và của Cơ quan quản lý dược phẩm Pháp (ANSM/Agence nationale de sécurité du médicament et des produits de santé)
| KHUYẾN CÁO CỦA CHÂU ÂU | KHUYẾN CÁO CỦA ANSM | |
|---|---|---|
| Phương pháp | Tessari (chạc ba hoặc bộ nối hai đầu) | Tessari hoặc thiết bị chuyên dụng |
| Khí | Khí trời hoặc Hỗn hợp khí CO2 và O2 | Khí trời được lọc hoặc vô trùng |
| Chất gây xơ tạo bọt | Polidocanol Natri tetradecyl sulfat | Aetoxisclerol® Fibrovein® |
| Nồng độ | Không hạn chế | |
| Tỷ lệ thuốc + khí | 1 + 4 hoặc 1 + 5 | 1 + 4 Kit EasyFoam (1 + 4,6) |
| Kích cỡ kim nhỏ nhất | 25G | 25G |
| Thời gian từ khi chuẩn bị bọt tới khi kết thúc tiêm xơ | Ngắn nhất có thể | Tối đa 60 giây |
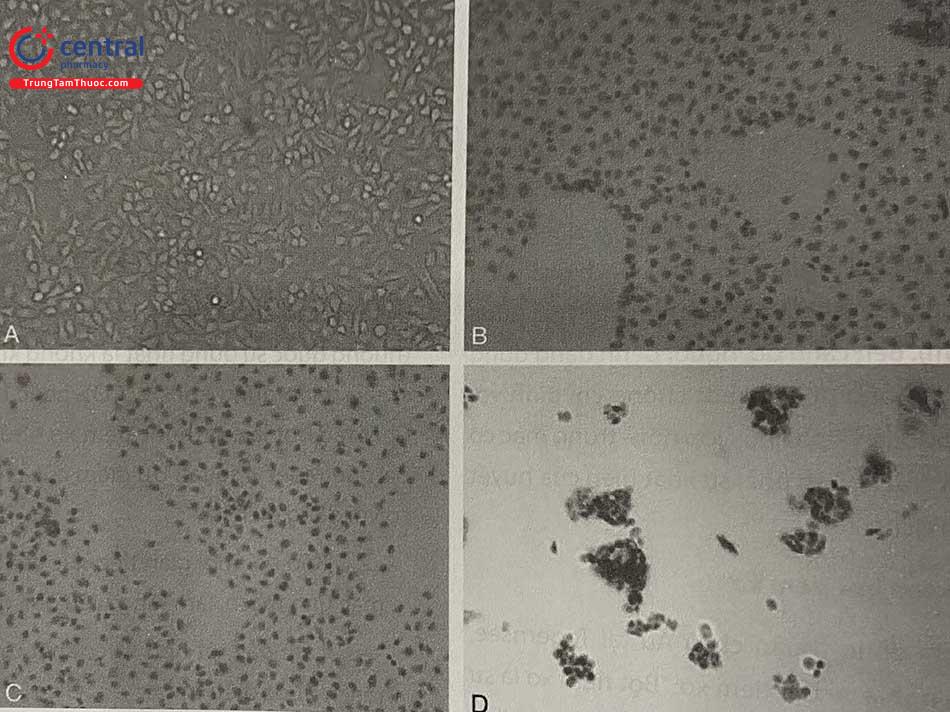
Sau 1,5 giây tiếp xúc với nước muối sinh lý: chưa có thay đổi, tế bào còn sống, với nhân sáng bóng
Sau 1,5 giây tiếp xúc với polidocanol 3% dạng dịch: nhân sẫm màu, tế bào chết và phân rã; có những khoảng trống trong lớp nội mô.
Sau 1,5 giây tiếp xúc với polidocanol 0,5% dạng bọt: hình ảnh giống trong hình B, với nồng độ thuốc thấp hơn rõ rệt.
Sau 1,5 giây tiếp xúc với polidocanol 3% dạng bọt: hầu hết nội mô đã bị phá hủy và biến mất
2.4 Quy trình tiêm xơ
2.4.1 Chuẩn bị bệnh nhân
Tiêm xơ được thực hiện bởi bác sĩ chuyên khoa được đào tạo về kỹ thuật này, tại phòng làm thủ thuật tiêm xơ có đủ ánh sáng, sạch sẽ, để đảm bảo được các thủ thuật vô trùng. Bệnh nhân được giải thích đầy đủ, và cam kết đồng ý làm thủ thuật.
Với chỉ định tiêm xơ bọt điều trị suy tĩnh mạch hiển, suy tĩnh mạch hiển phụ hoặc tĩnh mạch xuyên, bệnh nhân cần được siêu âm đánh dấu tĩnh mạch trước can thiệp, để đánh dấu các vị trí cần chọc mạch và bơm chất tiêm xơ. Với các tĩnh mạch dạng lưới hoặc mạng nhện, không cần phải siêu âm đánh dấu trước khi làm thủ thuật.
2.4.2 Chuẩn bị dụng cụ
Máy siêu âm được trang bị đầu dò siêu âm Doppler mạch máu 7,5
Thuốc: Thuốc tiêm xơ Aetoxisclerol từ 0,25% đến 3%, hoặc Fibrovein từ 0,35% đến 3%. Các thuốc thiết yếu trong cấp cứu.
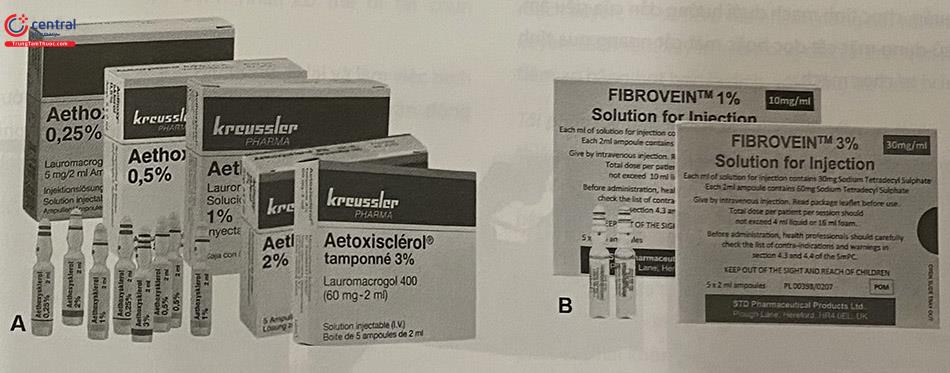
Các dụng cụ cần thiết:
- Xi lanh các loại từ 2 ml – 5 ml – 10
- Kim tiêm 22G, 23G, 26G, 30G, kim bướm được lựa chọn tùy theo đường kính và độ sâu TM được tiêm xơ.
- Chạc ba, dùng để tạo bọt gây xơ (Hoặc dụng cụ chuyên dụng EasyFoam).
- Săng vô khuẩn
2.4.3 Các bước tiến hành tiêm xơ
2.4.3.1 Tiêm xơ bằng phương pháp tạo bọt (foam sclerotherapy)
Tư thế bệnh nhân (BN):
- Đối với tĩnh mạch hiển lớn: BN nằm nghiêng phải hoặc trái tùy theo vị trí chân được tiêm xơ, một chân co, một chân duỗi nhằm bộc lộ rõ vị trí tiêm.
- Đối với tĩnh mạch hiển nhỏ: BN nằm sấp, chân duỗi thẳng.
- Đối với các tĩnh mạch nông khác: BN nằm ở tư thế thuận tiện nhất để có thể tiến hành thủ thuật.
Trước tiêm xơ cần thăm dò lại bằng siêu âm tĩnh mạch được điều trị, xem xét những mao động mạch lân cận (có thể là căn nguyên gây ra biến chứng tại chỗ), đo đường kính tĩnh mạch, từ đó tính thể tích và nồng độ bọt gây xơ phù hợp. Xác định và đánh dấu vị trí chọc kim, hướng đưa kim vào tĩnh mạch. Vị trí chọc kim ở cách quai 15 – 20 cm với TM hiển lớn (1/3 giữa đùi), 5 – 10 cm với TM hiển bé (1/3 giữa cẳng chân).
Tiến hành tạo bọt gây xơ theo kỹ thuật Tỷ lệ khí : thuốc gây xơ = 4:1.

Sát khuẩn, chọc tĩnh mạch dưới hướng dẫn của siêu âm.
Có thể sử dụng mặt cắt dọc hoặc mặt cắt ngang qua tĩnh mạch tại vị trí chọc mạch.
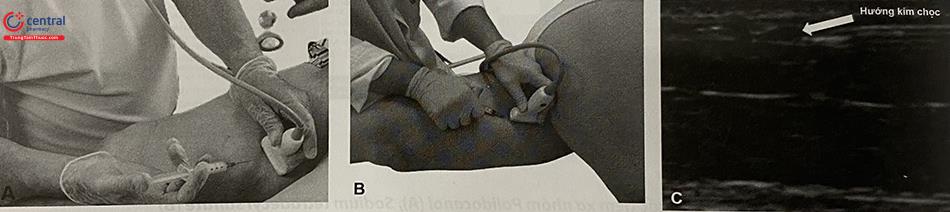
Kiểm tra vị trí của kim xem đã chắc chắn vào trong lòng TM, xác định bằng dấu hiệu có máu chảy khi rút ra, và nhìn thấy đầu kim nằm trong lòng TM qua siêu âm. Sau đó tiêm chất gây xơ bọt vào lòng TM dưới hướng dẫn của siêu âm. Sau khi tiêm hết thuốc, rút kim và dùng tay hoặc đầu dò siêu âm chẹn phía quai tĩnh mạch nông, để thuốc tập trung lan vào hệ TM nông, tránh vào TM sâu có nguy cơ tạo thành huyết khối.
Kiểm tra bằng siêu âm ngay sau tiêm, cho phép đánh giá kết quả tức thì của thủ thuật: tĩnh mạch co thắt, bọt tiêm xơ lan tỏa đều trong lòng tĩnh mạch.
Kết thúc thủ thuật: sát khuẩn và dùng bông vô khuẩn băng chặt lại vị trí chọc Đi tất chun độ II và/ hoặc băng chun bên chân được tiêm xơ cho bệnh nhân.
2.4.3.2 Tiêm xơ thẩm mỹ (microsclerotherapy)
Tiêm xơ thẩm mỹ được áp dụng cho các búi giãn mao tĩnh mạch mạng nhện hoặc giãn tĩnh mạch nông dạng lưới dưới
Bệnh nhân nằm ở tư thế phù hợp, sao cho vùng tĩnh mạch cần tiêm xơ được bộc lộ rõ nhất, thuận tiện nhất cho bác sĩ làm thủ thuật.
Thuốc gây xơ có nồng độ từ 0,125% đến 0,5%, thường tiêm xơ dưới dạng dịch mà không cần tạo bọt.
Sau khi sát khuẩn da tại vị trí tiêm xơ, bác sĩ lựa chọn nhánh tĩnh mạch chính trong đám giãn tĩnh mạch nông, và bơm chất gây xơ vào trong lòng tĩnh mạch, sao cho từ nhánh này chất gây xơ lan tỏa khắp các nhánh của đám giãn tĩnh mạch.
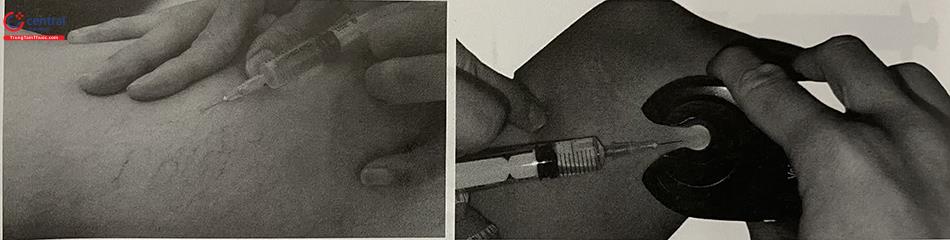
Sau thủ thuật, bệnh nhân có thể đi tất chun hoặc không.
Bệnh nhân có thể vận động, đi lại và làm việc bình thường ngay sau tiêm, tuy nhiên tránh các vận động nặng trong thời gian tối thiểu 2 tuần.
Tránh để vùng được tiêm xơ tiếp xúc trực tiếp với ánh nắng mặt trời, nước nóng, nước biển trong thời gian 2 tuần, nhằm hạn chế biến chứng rối loạn sắc tố
Khi phát hiện có vết loét tại vị trí tiêm, chân sưng, đau nhiều, cần đến khám lại
2.4.4 Tiêm xơ một số tĩnh mạch đặc biệt
Tiêm xơ là phương pháp hiệu quả và an toàn để can thiệp các tĩnh mạch hiển phụ, tĩnh mạch xuyên, hoặc tĩnh mạch nông tái phát sau phẫu thuật/can thiệp.
Nhánh hiển lớn trước ở đùi: đoạn tĩnh mạch nằm trong cân thường ngắn, sau đó đi ra ngoài cân, ở rất nông dưới da. Vì vậy, vị trí tiêm xơ đầu tiên ở nhánh tĩnh mạch trong cân, với thể tích bọt gây xơ chỉ khoảng 2,5 – 3 ml, nồng độ 0,5 – 1%. Tiếp theo sẽ gây xơ ở các nhánh nông hơn, với nồng độ bọt gây xơ từ 0,25 – 0,5%.
Nhánh tĩnh mạch Giacomini: là nhánh nối giữa tĩnh mạch hiển lớn và hiển nhỏ, ở phía sau trong của đùi. Suy tĩnh mạch Giacomini có thể điều trị bằng bọt tiêm xơ 0,5%.
Tĩnh mạch xuyên: không bao giờ tiêm xơ trực tiếp vào tĩnh mạch xuyên do nguy cơ chọc vào động mạch đi kèm tĩnh mạch xuyên, mà sẽ tiêm vào nhánh nông nối với tĩnh mạch xuyên, cách vị trí xuyên vào trong cân vài cm. Nên lựa chọn tiêm xơ bằng bọt hơn là dịch, với nồng độ từ 0,5 – 1%.
Tái phát suy tĩnh mạch sau phẫu thuật/can thiệp: sau can thiệp tĩnh mạch hiển, thân tĩnh mạch hiển sau một thời gian có thể tái thông và xuất hiện trở lại dòng trào ngược bệnh lý trên siêu âm, có biểu hiện lâm sàng hoặc không. Nếu phải can thiệp lại thân tĩnh mạch hiển trước đó đã tiêm xơ, nên lựa chọn bọt gây xơ có nồng độ cao hơn một chút, thay vì bơm nhiều bọt gây xơ hơn. Trường hợp tái phát thứ hai không phải tái thông tại thân tĩnh mạch hiển mà xuất hiện các nhánh nông giãn, từ TM hiển lớn (nhánh tĩnh mạch thẹn trong, tĩnh mạch hiển lớn phụ, tĩnh mạch xuyên) hoặc tĩnh mạch hiển nhỏ (nhánh tĩnh mạch hố khoeo, tĩnh mạch xuyên ở cẳng chân). Tiêm xơ bằng bọt là phương pháp tối ưu để điều trị các nhánh này, có thể dưới hướng dẫn siêu âm hoặc không.
2.5 Tiêu chí đánh giá thành công
Phương pháp tiêm xơ được đánh giá là thành công khi:
- Quá trình can thiệp diễn ra thuận lợi, không xảy ra biến chứng.
- Với tĩnh mạch hiển lớn, hiển nhỏ và hiển phụ: siêu âm thấy lòng tĩnh mạch được lấp kín hoàn toàn bởi chất tiêm xơ, không còn ghi được dòng chảy.
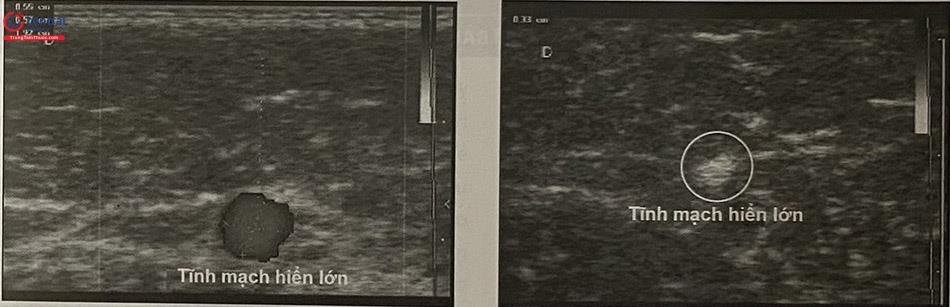
- Với tĩnh mạch dạng lưới và mạng nhện: Quan sát bằng mắt thường không thấy các đám tĩnh mạch này nữa, mà thay thế bằng hình ảnh viêm đỏ dọc đường đi tĩnh mạch, sẽ tự biến mất sau một vài ngày.
- Bệnh nhân có thể đứng dậy và đi lại ngay sau khi can thiệp.
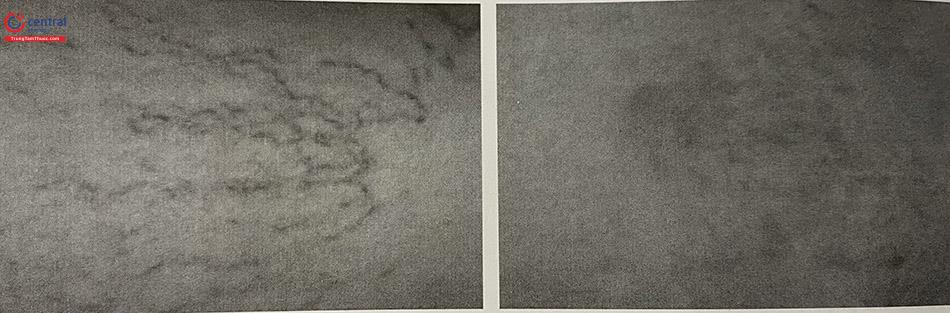
2.6 Biến chứng và xử trí
Tiêm xơ được coi là một phương pháp can thiệp tĩnh mạch có lịch sử lâu đời nhất, hoàn toàn lành tính và an toàn, ít nhất là tương đương phẫu thuật lấy bỏ tĩnh mạch. Tuy nhiên, có rất nhiều các tác dụng ngoại ý, chủ yếu là tại chỗ, liên quan đến thẩm mỹ, và một số biến chứng toàn thân nghiêm trọng, mặc dù rất hiếm, mà bác sĩ can thiệp phải cảnh giác để xử trí kịp thời, hiệu quả.
Bảng 57.4. Biến chứng có thể gặp của phương pháp tiêm xơ (*)
| PHÂN LOẠI BIẾN CHỨNG | TẦN SUẤT XẢY RA | |
|---|---|---|
| TIÊM XƠ BẰNG DỊCH | TIÊM XƠ BẰNG BỌT | |
* Biến chứng nặng: – Hoại tử mô nặng – đột quỵ não, thiếu máu não thoáng qua – Huyết khối TM sâu đầu xa – Huyết khối TM sâu đầu gần – Tắc mạch phổi – Tổn thương TK vận động |
Vài trường hợp Vài trường hợp Vài trường hợp
Hiếm Rất hiếm Vài trường hợp Vài trường hợp | Vài trường hợp Vài trường hợp Vài trường hợp
Không thường gặp Rất hiếm Vài trường hợp Vài trường hợp |
* Biến chứng nhẹ: – Rối loạn thị giác – Đau nửa đầu – Tổn thương TK cảm giác – Tức ngực – Ho khan – Dị ứng da – Đám giãn mao mạch – Rối loạn sắc tố da – Hoại tử da khu trú |
Rất hiếm Rất hiếm Không báo cáo Rất hiếm Rất hiếm Rất hiếm Thường gặp Thường gặp Hiếm |
Không thường gặp Không thường gặp Hiếm Rất hiếm Rất hiếm Rất hiếm Thường gặp Thường gặp Rất hiếm |
(*) Bảng tổng hợp các biến chứng của phương pháp tiêm xơ theo Hội tĩnh mạch châu Âu (tỷ lệ biến chứng ≥ 10%: rất thường gặp; 1 – 10%: thường gặp; 0,1 – 1%: không thường gặp ; 0,01 – 0,1%: hiếm; < 0,01%: rất hiếm, vài trường hợp). TM: Tĩnh mạch; TK: Thần kinh.
2.6.1 Biến chứng toàn thân
Phản ứng dị ứng hiếm gặp (dưới 0,3%), với mức độ khác nhau, từ ngứa đến co thắt phế quản và sốc phản vệ, một biến chứng tức thì, cực kỳ hiếm gặp nhưng đe dọa tính mạng. Vì vậy hộp chống sốc không thể thiếu trong danh mục chuẩn bị dụng cụ trước tiêm xơ. Cần phân biệt phản ứng nổi mày đay khu trú xảy ra ngay sau khi điều trị và biến mất tự nhiên trong vòng 30 phút với các phản ứng dị ứng. Chúng tương ứng với sự giải phóng các yếu tố nội mô và sự suy giảm của các đại thực bào quanh mạch thứ phát sau tác dụng gây xơ và tổn thương thành tĩnh mạch.
Phản xạ cường phế vị hiếm gặp, xử trí bằng nâng cao chân, đôi khi phải cho bệnh nhân thở oxy và tiêm dưới da Atropine 0,25 – 0,5 mg.
Rối loạn thần kinh có thể gặp với cả hình thức tiêm xơ bọt và dạng dịch, được chia làm 2 nhóm: (1) các rối loạn nhẹ như chứng đau nửa đầu, đau đầu, rối loạn thị giác hay ngôn ngữ, và (2) các rối loạn nghiêm trọng như tai biến mạch máu não hoặc cơn thiếu máu não thoáng qua. Về cơ chế bệnh sinh, luồng thông phải – trái (tồn tại lỗ bầu dục) trong tim có thể đẩy “bong bóng” gây xơ vào tuần hoàn động mạch và gây ra triệu chứng thần kinh. Vào năm 2012, nghiên cứu đa phân tích từ 1.023 báo cáo về tiêm xơ (với 10.819 bệnh nhân) của Sarvananthan đã thống kê số lượng các rối loạn thần kinh xuất hiện sau tiêm xơ (63% sau khi tiêm bọt và 37% sau khi tiêm xơ dạng dịch). Có mười hai trường hợp đột quỵ được xác định bằng hình ảnh chụp sọ não, và chín trường hợp tai biến mạch máu não thoáng qua. Trong số này, 11 bệnh nhân có luồng thông phải – trái (chủ yếu là tồn tại lỗ bầu dục), không bệnh nhân nào để lại di chứng kéo dài. Tổng cộng, có 97 trường hợp (0,90%) rối loạn thần kinh được báo cáo, với 0,78% rối loạn thị giác, 0,70% đau đầu và 0,27% đau nửa đầu kèm tiền triệu. Đến thời điểm hiện tại, các biện pháp như nâng cao chân, ép chặt vị trí nối TM hiển – TM sâu, đeo tất chun sớm … chưa được chứng minh tính hiệu quả để ngăn ngừa được rối loạn thần kinh sau khi tiêm xơ bằng bọt. Biện pháp dự phòng chung là yêu cầu bệnh nhân đứng dậy từ từ, tránh vận động đột ngột ngay lập tức.
Thuyên tắc huyết khối: Jia qua tổng hợp từ 25 nghiên cứu lâm sàng về tiêm xơ đã ước tính tỷ lệ HKTMSCD trung bình khoảng 0,6% (0 – 5,7%). Trong một nghiên cứu sổ bộ của Pháp với hơn 12.000 thủ thuật tiêm xơ bọt hoặc dịch, tỷ lệ HKTMSCD là 0,02%. Nghiên cứu của Hamel – Desnos thấy có sự tăng D-dimer nhẹ và thoáng qua sau thủ thuật tiêm xơ bằng bọt ở các tĩnh mạch hiển. Điều trị HKTMSCD đoạn gần sau liệu pháp tiêm xơ cũng tuân theo khuyến cáo chung với TT- HKTM. Đôi khi có thể quan sát thấy thuốc tiêm xơ bám vào một phần vị trí nối tĩnh mạch hiển với tĩnh mạch đùi chung ở thành trước, tạo thành huyết khối bám thành không hoàn toàn, không gây tắc, sẽ tự hết trong vòng vài tuần, ngay cả khi không điều trị. Biện pháp tốt nhất để dự phòng thuyên tắc huyết khối là tuân theo đúng các chống chỉ định, và các hướng dẫn kỹ thuật tiêm xơ, không tiêm số lượng lớn bọt gây xơ (không được phép quá 10ml theo Khuyến cáo của châu Âu, và quá 16 ml theo ANSM), yêu cầu bệnh nhân ngồi dậy và vận động ngay sau khi tiêm.
2.6.2 Phản ứng tại chỗ
Hoại tử mô do tiêm nhầm vào động mạch: Mặc dù rất hiếm gặp, đã có những báo cáo về biến chứng của chất gây xơ khi bị tiêm vào động mạch, có thể gây hoại tử mô lan rộng, thậm chí cắt cụt chi. Cách duy nhất để dự phòng biến chứng trầm trọng này, là thành thạo kỹ thuật tiêm xơ, sử dụng siêu âm để hướng dẫn thủ thuật, đặc biệt ở những vị trí nguy hiểm như vùng Scarpa, hố khoeo, 1/3 dưới mặt trong cẳng chân hay tiêm xơ tĩnh mạch xuyên. Trong trường hợp tiêm nhầm vào động mạch, cần bơm ngay 10.000 đơn vị Heparin qua kim chọc vẫn lưu tại chỗ, kèm theo 20 mg Prednisolone đường tĩnh mạch và chuyển gấp bệnh nhân đến cơ sở chuyên khoa để cấp cứu và theo dõi.
Viêm da cơ địa Nicolau là một biến chứng thiếu máu cục bộ hiếm gặp, dễ gây nhầm lẫn do vô tình tiêm vào động mạch một loại thuốc được sử dụng để tiêm bắp (embolia cutis medicamentosa). Biến chứng này có thể gặp sau tiêm xơ vào một tiểu động mạch nuôi da hoặc mô lân cận, đặc biệt tại vùng hố khoeo, và có nguy cơ hoại tử lan rộng nếu không cấp cứu kịp thời. Ngoài ra, hoại tử da khu trú có thể xảy ra mặc dù chất gây xơ không bị tiêm vào động mạch. Theo Schuller-Petrovic, kết quả thử nghiệm trên chuột chỉ ra polidocanol với thể tích ít hơn 0,5 ml khi tiêm ngoài mạch sẽ không gây ra hoại tử. Nhưng trên 0,5 ml polidocanol ở dạng dịch với nồng độ 1%, và ở dạng bọt từ nồng độ 2% sẽ gây hoại tử da. Cơ chế sinh lý bệnh là hiện tượng chất gây xơ di chuyển vào trong tiểu động mạch thông qua các thông động tĩnh mạch siêu nhỏ (micro-shunts), dưới tác dụng của áp lực cao hay thể tích chất tiêm xơ quá lớn. Để dự phòng biến chứng này, không bao giờ được sử dụng bơm tiêm Insulin 1 ml để tiêm xơ (áp lực cao), không tiêm xơ các tĩnh mạch mạng nhện quá thô bạo, và không tiêm quá 0,5 ml cho mỗi vị trí gây xơ.
Viêm và rối loạn sắc tố da dọc đường đi tĩnh mạch: đôi khi bị nhầm với huyết khối tĩnh mạch nông, là phản ứng viêm tại chỗ, xuất hiện trên đường đi của tĩnh mạch sau khi tiêm xơ được một vài tuần, tự thoái triển sau vài tuần hoặc vài tháng, nhưng thường để lại vết rối loạn sắc tố da. Cơ chế của rối loạn sắc tố là do tế bào hồng cầu thoát ra khỏi thành tĩnh mạch, tiếp sau là sự phân hủy hemoglobin, với sự tích tụ của hemosiderin trong lớp hạ bì. Tĩnh mạch càng gần da thì càng dễ bị rối loạn sắc tố. Tỷ lệ rối loạn sắc tố da dao động từ 1 đến 10%. Sau một năm, tỷ lệ này còn 1 – 2%. Trong một số trường hợp, thủ thuật lấy bỏ huyết khối (thrombectomy) qua một vết chọc nhỏ trên đường đi của tĩnh mạch bị viêm và đọng máu, có thể làm giảm nguy cơ rối loạn sắc tố da về sau. Điều quan trọng là thủ thuật này phải được thực hiện đúng thời điểm (sau tiêm xơ 3 – 4 tuần), và đúng kỹ thuật.
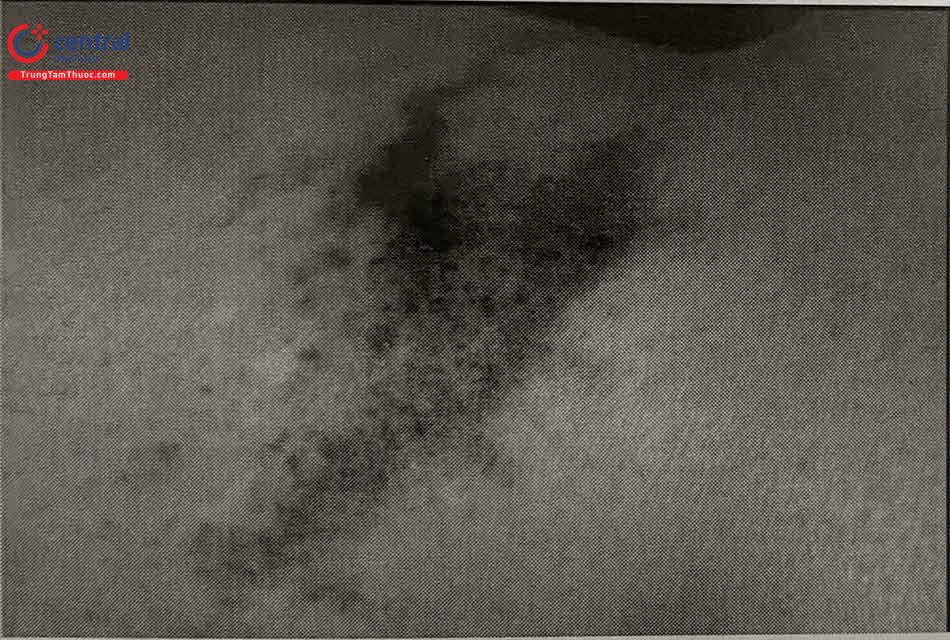
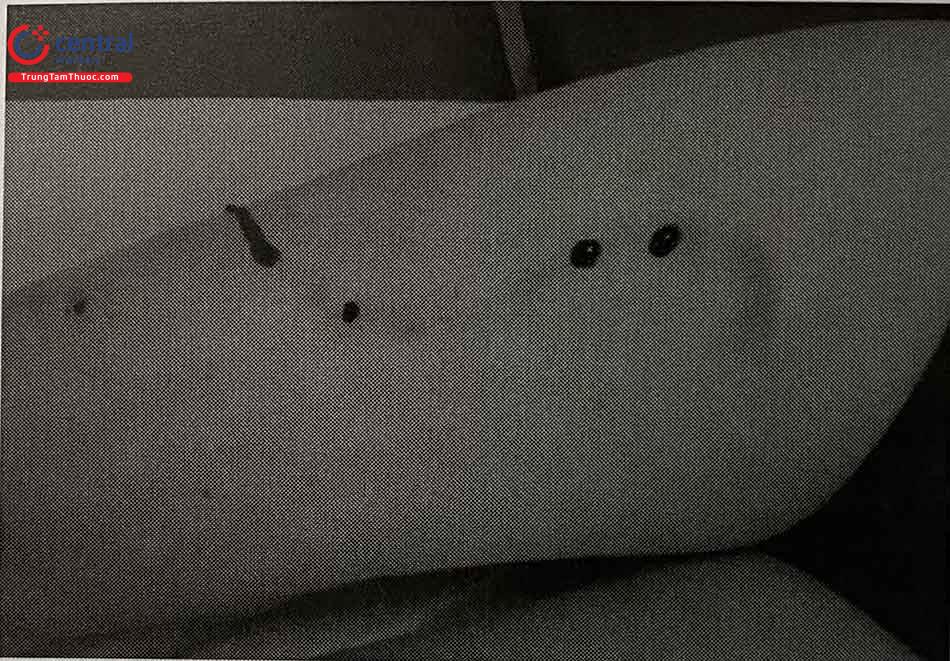
2.7 Kết quả can thiệp tiêm xơ
2.7.1 So sánh tiêm xơ dạng bọt và dạng dịch
Có 6 báo cáo lâm sàng, 4 trong số này là thử nghiệm ngẫu nhiên có đối chứng, so sánh tiêm xơ dạng bọt và tiêm xơ dạng dịch trong điều trị suy tĩnh mạch hiển. Với ưu điểm của trạng thái bọt, tiêm xơ dạng bọt mặc dù sử dụng ít thể tích chất gây xơ hơn, nhưng hiệu quả hơn tiêm xơ dạng dịch với sự khác biệt dao động từ 20 đến 50%. Phân tích tổng hợp chỉ ra tỷ lệ hiệu quả của bọt tiêm xơ là 76,8% (95% CI: 71–82%) so với 39,5% khi tiêm xơ dạng dịch (95% CI: 33–46; Chi2 = 60,9740; p <0,0001). Tuy nhiên không có sự khác biệt nào được ghi nhận trong điều trị các tĩnh mạch dạng lưới và mạng nhện.
2.7.2 Hiệu quả của phương pháp tiêm xơ bằng bọt
Tổng hợp từ 69 nghiên cứu lâm sàng với hơn 9000 bệnh nhân tiêm xơ bằng bọt, theo dõi trong vòng 3 năm, Jia báo cáo tỷ lệ hiệu quả trung bình của bọt tiêm xơ là 87%, tỷ lệ tái phát của giãn tĩnh mạch nông hoặc sự xuất hiện của giãn tĩnh mạch mới vào khoảng 8,1%. Hiệu quả gây xơ giảm khi đường kính của tĩnh mạch tăng. Theo Coleridge Smith và Myers, “ranh giới” này là 6 mm. Barett so sánh kết quả tiêm xơ bằng bọt trên hai nhóm: một nhóm có đường kính vị trí nối hiển – đùi chung (quai tĩnh mạch hiển) ≥ 10 mm và một nhóm có đường kính < 10 mm, thu được kết quả tốt hơn ở nhóm có đường kính < 10 mm. Trong nghiên cứu của Venermo, tỷ lệ tắc tĩnh mạch hiển sau 12 tháng là 75% đối với đường kính nhỏ hơn 6 mm, giảm rõ rệt đối với đường kính tĩnh mạch từ 6 đến 8 mm, và dưới 40% đối với đường kính từ 9 mm trở lên.
So sánh tiêm xơ bằng bọt với phẫu thuật: Nghiên cứu đối chứng ngẫu nhiên, theo dõi trong vòng 5 năm kết quả điều trị suy tĩnh mạch hiển bằng tiêm xơ và phẫu thuật của Kalodiki chỉ ra hiệu quả tương đương của hai phương pháp. Tuy nhiên, những bệnh nhân tiêm xơ bằng bọt được thực hiện đồng thời thủ thuật thắt vị trí nối hiển – đùi một cách hệ thống.
So sánh tiêm xơ bằng bọt với can thiệp nhiệt nội tĩnh mạch: Năm 2009, phân tích tổng hợp của Van den Bos từ 64 nghiên cứu với 12.320 tĩnh mạch hiển được điều trị, so sánh 4 kỹ thuật: phẫu thuật truyền thống, tiêm xơ bọt, can thiệp bằng sóng cao tần, can thiệp laser nội tĩnh mạch, theo dõi trong vòng 3 năm. Tỷ lệ thành công của phẫu thuật là 78%, tiêm xơ là 77%, thấp hơn so với can thiệp sóng cao tần (84%), laser (94%). Năm 2013, Rasmussen và cộng sự công bố kết quả 3 năm của một nghiên cứu ngẫu nhiên có đối chứng so sánh bốn phương pháp: laser (sợi trần), sóng cao tần (closure Fast®), tiêm xơ bọt và phẫu thuật. Năm trăm bệnh nhân được nhận vào nghiên cứu, tất cả đều được phẫu thuật/can thiệp trong điều kiện an thần, gây tê quanh tĩnh mạch, phối hợp phẫu thuật lấy bỏ tĩnh mạch nông một cách hệ thống. Các tác giả kết luận rằng hiệu quả của 4 nhóm là tương đương nhau về điểm số lâm sàng và sự tái phát của giãn tĩnh mạch sau 3 năm, tuy nhiên tiêm xơ bằng bọt có tỷ lệ thành công thấp hơn, về tiêu chí tắc và biến mất của tĩnh mạch hiển so với 3 nhóm còn lại. Sau 5 năm, tỷ lệ tái thông tĩnh mạch sau tiêm xơ vẫn cao hơn. Nghiên cứu này có một số hạn chế, đặc biệt với nhóm tiêm xơ. Trên thực tế, bệnh nhân tiêm xơ không cần phải an thần, gây tê quanh tĩnh mạch, và cũng không phải thực hiện thủ thuật lấy bỏ tĩnh mạch nông kèm theo. Trong một nghiên cứu khác tại 11 trung tâm ở Vương quốc Anh với 798 người tham gia, kết quả của việc điều trị bằng laser, tiêm xơ bọt và phẫu thuật đã được so sánh trên các tiêu chí chất lượng cuộc sống, và chi phí. Tại thời điểm 5 năm, theo điểm Aberdeen, bọt có hiệu quả thấp hơn so với phẫu thuật và laser; nhưng không có sự khác biệt về chất lượng cuộc sống chung giữa ba nhóm.
2.8 Theo dõi sau tiêm xơ
2.8.1 Băng ép, đeo tất áp lực sau can thiệp
Quấn băng chun hoặc đeo tất áp lực (15 – 20 mmHg, hoặc 23 – 32 mmHg) được chỉ định sau tiêm xơ, về mặt lý thuyết giúp cải thiện hiệu quả điều trị và giảm tác dụng phụ (huyết khối tĩnh mạch nông, viêm, đau, giãn tĩnh mạch mạng nhện tái phát). Tuy nhiên, trên thực tế chỉ định này rất thay đổi giữa các “trường phái”. Bên cạnh đó phải tính đến sự tuân thủ hay dung nạp của bệnh nhân đối với băng chun hay tất áp lực. Chỉ có một thử nghiệm lâm sàng ngẫu nhiên, có đối chứng, so sánh hiệu quả của tiêm xơ tĩnh mạch mạng nhện có và không có phối hợp liệu pháp tất áp lực kèm theo. Kết quả cho thấy hiệu quả điều trị tốt hơn ở những bệnh nhân đeo tất áp lực 23 – 32 mmHg từ 2 – 3 tuần, nhưng lại không có khác biệt về sự hài lòng của bệnh nhân, liên quan đến hiệu quả về thẩm mỹ. Tương tự như vậy, Hamel -Desnos và cộng sự cũng không thấy có khác biệt về hiệu quả điều trị, các tác dụng ngoại ý, thang điểm đánh giá sự hài lòng và cải thiện chất lượng cuộc sống ở 30 bệnh nhân đeo tất áp lực (15 – 20 mmHg trong 3 tuần) sau tiêm xơ, so với 30 bệnh nhân chỉ tiêm xơ mà không đeo tất. Vì vậy, lựa chọn dùng tất áp lực hay băng chun là tùy thuộc vào từng trung tâm, với từng bệnh nhân cụ thể.
2.8.2 Siêu âm kiểm tra sau can thiệp
Siêu âm Doppler kiểm tra sau can thiệp nên được thực hiện ở thời điểm 4 – 6 tuần sau can thiệp, để đánh giá hiệu quả điều trị cũng như phát hiện các tác dụng không mong muốn. Siêu âm có thể thấy huyết khối “đồng âm” trong lòng tĩnh mạch được tiêm xơ, thoái triển dần dần theo thời gian và xơ hóa, tĩnh mạch không ghi được tín hiệu dòng chảy, và không có các nhánh nông giãn đi ra từ thân tĩnh mạch hiển được điều trị.
3 Phương pháp can thiệp: Nhiệt nội tĩnh mạch bằng sóng có tần số Radio
3.1 Đại cương
Can thiệp nhiệt nội tĩnh mạch điều trị suy tĩnh mạch mạn tính chi dưới là phương pháp sử dụng ống thông (catheter) luồn vào trong lòng tĩnh mạch bị suy dưới hướng dẫn của siêu âm, để gây tắc và xơ hóa tĩnh mạch bệnh lý bằng năng lượng nhiệt, được phát ra dưới dạng sóng có tần số radio hoặc laser.
Sóng có tần số radio (RF/radiofrequency) phóng thích một năng lượng dưới dạng nhiệt vào trong lòng tĩnh mạch, gây phá hủy lớp nội mạc, co thắt và dày các sợi Collagen của lớp trung – ngoại mạc, từ đó gây tắc và xơ hóa tĩnh mạch.
Hệ thống phát RF đầu tiên là Closure plus, được ứng dụng trong điều trị suy tĩnh mạch từ 1998 đến 2007. Từ một máy phát lưỡng cực, sóng RF được tạo ra, qua ống thông tác động lên thành tĩnh mạch ở mức nhiệt năng là 85ºC. Trong quá trình điều trị, ống thông RF được rút liên tục với vận tốc 2 – 3 cm/phút. Nhược điểm lớn nhất của thế hệ RF này là tính không ổn định, thời gian làm thủ thuật kéo dài, nguy cơ hình thành cục máu đông ở đầu ống thông làm giảm hiệu quả điều trị. Từ 2007, Closure plus được thay bằng hệ thống VNUS Closure Fast với nhiều cải tiến hơn. Hệ thống này gồm một máy phát sóng RF với năng lượng nhiệt ổn định ở mức 120ºC, và một ống thông có đầu mút dài 7 cm, được phủ teflon, là phần phát ra nhiệt năng. Mỗi lần máy phát RF, một đoạn tĩnh mạch dài 7 cm được điều trị bằng nhiệt năng trong vòng 20 giây, tương đương mức năng lượng 60J/cm.
3.2 Chỉ định và chống chỉ định và hạn chế của nhiệt nội tĩnh mạch bằng sóng có tần số Radio
3.2.1 Chỉ định
Chỉ định điều trị của phương pháp can thiệp nhiệt nội tĩnh mạch gồm sóng có tần số radio và laser tương tự như phẫu thuật. Đó là các trường hợp suy thân và gốc tĩnh mạch hiển lớn, suy tĩnh mạch hiển nhỏ và suy tĩnh mạch xuyên. So với phẫu thuật, can thiệp là phương pháp ít xâm lấn hơn, không phải thắt quai tĩnh mạch hiển, do đó có thể chỉ định được cả cho những bệnh nhân béo phì, có phù bạch mạch, hay người đang điều trị thuốc chống đông. Các thế hệ máy RF hay laser mới cho phép mở rộng điều trị cho những tĩnh mạch giãn trên 12 – 15 mm. Tuy nhiên, phương pháp can thiệp thường không được chỉ định trong trường hợp tĩnh mạch bệnh lý ở quá nông trên da (dưới 5 mm), có nguy cơ làm bỏng da.
Theo Khuyến cáo của Diễn đàn Tĩnh mạch Hoa Kỳ năm 2017 và Hội Tĩnh mạch quốc tế năm 2014:
- Điều trị nhiệt nội TM là chỉ định an toàn và hiệu quả trong suy tĩnh mạch hiển, với mức độ khuyến cáo/bằng chứng loại I/B.
- Nên lựa chọn phương pháp điều trị nhiệt nội TM hơn là phẫu thuật do ít đau và thời gian hồi phục nhanh hơn, với mức độ khuyến cáo/ bằng chứng loại I/B.
Khuyến cáo mới nhất của Hội phẫu thuật mạch máu châu Âu năm 2022 đưa chỉ định can thiệp nhiệt nội tĩnh mạch điều trị STM hiển lớn lên mức độ khuyến cáo/bằng chứng là I/A.
Bảng 57.5. Khuyến cáo của Hội Phẫu thuật mạch máu châu Âu về chỉ định can thiệp nhiệt điều trị suy tĩnh mạch mạn tính
| KHUYẾN CÁO | MỨC ĐỘ KHUYẾN CÁO | MỨC ĐỘ BẰNG CHỨNG |
|---|---|---|
| Can thiệp nhiệt nội tĩnh mạch được khuyến cáo điều trị cho bệnh nhân suy tĩnh mạch có triệu chứng và có dòng trào ngược trong TM hiển lớn, hơn là phẫu thuật hoặc tiêm xơ | I | A |
| Với BN suy thân tĩnh mạch hiển lớn có chỉ định can thiệp nhiệt, việc lựa chọn loại dụng cụ can thiệp (laser, RF) do bác sĩ can thiệp quyết định | I | B |
| Can thiệp nhiệt nội tĩnh mạch được khuyến cáo điều trị BN suy tĩnh mạch có triệu chứng và có dòng trào ngược trong TM hiển nhỏ, hơn là phẫu thuật hoặc tiêm xơ | I | A |
| Khi lựa chọn can thiệp bằng phương pháp nhiệt nội tĩnh mạch với suy tĩnh mạch hiển nhỏ, cần hết sức chú ý tránh tổn thương thần kinh nếu điểm chọc mạch ở 1/3 dưới cẳng chân | I | B |
Chú thích: TM: Tĩnh mạch; RF: Sóng có tần số radio.
Trên thực tế lâm sàng, chỉ định cụ thể của can thiệp nhiệt nội tĩnh mạch trong suy tĩnh mạch hiển lớn hoặc hiển nhỏ như sau:
Bệnh nhân suy tĩnh mạch chi dưới mạn tính:
- Có triệu chứng lâm sàng: tê bì, chuột rút, phù …
- Phân loại lâm sàng (CEAP) từ C2 →
- Siêu âm Doppler phát hiện dòng trào ngược bệnh lý kéo dài trên 500 miligiây trong thân tĩnh mạch hiển (với tĩnh mạch hiển lớn, tối thiểu là đoạn trên gối).
Đáp ứng kém với điều trị nội khoa
Với tĩnh mạch xuyên, can thiệp nội tĩnh mạch chỉ chứng minh lợi ích rõ rệt trong trường hợp bệnh nhân có suy tĩnh mạch xuyên (đường kính tĩnh mạch ≥ 3,5 mm, dòng trào ngược ≥ 500 mili giây), và là thủ phạm gây ra loét chi dưới (C5, C6).
3.2.2 Chống chỉ định
Chống chỉ định tuyệt đối điều trị can thiệp nội tĩnh mạch trong các trường hợp:
Huyết khối tĩnh mạch sâu và/hoặc nông chi dưới cấp.
Nhiễm trùng cấp tính da, mô mềm tại vị trí chọc mạch.
Chống chỉ định tương đối (cần cân nhắc giữa lợi ích/nguy cơ) trong những trường hợp sau:
Bệnh nhân hạn chế vận động, toàn trạng kém.
Phối hợp với bệnh động mạch ngoại biên nặng (ABI < 0,5).
Có thai (nên trì hoãn đến ít nhất là 6 tuần sau khi sinh).
Hệ tĩnh mạch nông đóng vai trò chính đưa máu trở về tim do tắc hoặc thiểu sản/bất sản hệ tĩnh mạch sâu.
3.2.3 Hạn chế của phương pháp can thiệp nhiệt nội tĩnh mạch
Liên quan đến đặc điểm giải phẫu của tĩnh mạch, những hạn chế của phương pháp can thiệp nhiệt nội tĩnh mạch có thể được khắc phục tùy thuộc vào kinh nghiệm của bác sĩ can thiệp:
- Tĩnh mạch bệnh lý bị xơ cứng, có di tích huyết khối cũ, hay đi xoắn vặn: cản trở việc luồn ống thông. Biện pháp khắc phục là dùng dây dẫn (với ống thông ClosureFast), hoặc chọc mạch ở nhiều vị trí.
- Tĩnh mạch có kích thước quá lớn, hoặc giãn trong trường hợp suy tim phải, béo phì: ảnh hưởng đến sự tiếp xúc giữa ống thông với thành tĩnh mạch, làm giảm hiệu quả can thiệp nhiệt. Kích thước lớn của tĩnh mạch không phải là một chống chỉ định của can thiệp nội tĩnh mạch, tuy nhiên với những tĩnh mạch giãn trên 20 mm và/hoặc có các vị trí phình, nhất là sát ngay vị trí đổ vào tĩnh mạch sâu, phẫu thuật là phương án được ưu tiên hơn can thiệp.
- Tĩnh mạch quá nông, ở người thể trạng gày (< 19 kg/m2): có nguy cơ bị bỏng da do nhiệt trong quá trình can thiệp, và rối loạn sắc tố da, viêm quanh tĩnh mạch sau can thiệp. Các biến chứng này có thể tránh được dễ dàng nếu kỹ thuật gây tê quanh tĩnh mạch tốt.
3.3 Dụng cụ và thiết bị can thiệp RF
3.3.1 Hệ thống Clousure
Các ống thông RF thế hệ đầu tiên (Closure plus) sử dụng điện cực lưỡng cực ở đầu ống thông để áp vào thành tĩnh mạch dòng điện xoay chiều có tần số 200–1200 kHz. Thành tĩnh mạch hoạt động như một chất dẫn điện với điện trở đã biết, từ đó chuyển đổi năng lượng tần số radio thành nhiệt năng, làm nóng thành tĩnh mạch, gây ra sự biến tính của sợi collagen và xơ hóa, tắc lòng tĩnh mạch. Để chuyển dòng điện, các điện cực của ống thông phải tiếp xúc tốt với tĩnh mạch, với nhiệt độ từ 85°C – 90°C. Ống thông được rút ra từ từ (2–3 cm/phút) để đảm bảo điều trị đầy đủ cho thành tĩnh mạch. Mặc dù hiệu quả lâm sàng khá cao, ống thông Closure plus có thời gian điều trị rất chậm so với laser, vì tốc độ rút chậm, và máy phát thường xuyên bị “ngắt” khi trở kháng vượt qua ngưỡng định trước. Kết quả cũng không nhất quán do sự tiếp xúc không ổn định của đầu ống thông với thành tĩnh mạch.
Từ năm 2007, ống thông Closure thế hệ hiện tại đã thay thế loại Closure plus. Ống thông này có bộ phận phát nhiệt dài 7 cm ở đầu, được cung cấp nhiệt lượng lên tới 120ºC mỗi khi phát RF. Một lần phát RF kéo dài 20 giây, ống thông được giữ cố định trong thời gian này, và nhiệt độ truyền tới thành tĩnh mạch vào khoảng 110°C. Sau đó ống thông được rút ra từng đoạn dài 6,5 cm, như vậy mỗi đoạn sẽ có 0,5 cm được điều trị củng cố. Loại ống thông mới làm tăng đáng kể tốc độ và hiệu quả của quy trình can thiệp. Một đoạn tĩnh mạch bệnh lý dài khoảng 45 cm có thể được điều trị chỉ trong thời gian 3 – 5 phút. Vì vậy, ống thông thế hệ này được mang tên Closure Fast. Với tĩnh mạch hiển nhỏ, có thể dùng loại ống thông với đầu đốt ngắn hơn, chỉ dài 3,5 cm.
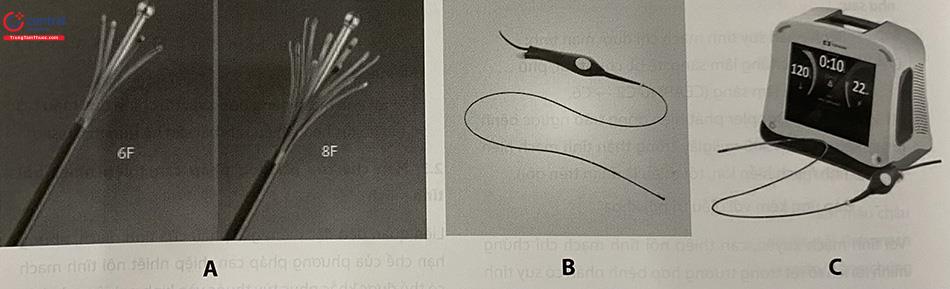
3.3.2 Hệ thống EVRF® F – care
Hệ thống EVRF® là một thiết bị phát RF khác, thuộc loại đơn cực, để điều trị suy tĩnh mạch. Ống thông cỡ 6F, có các vạch chia dài 0,5cm, và một đầu phát dài 0,5 cm. Ưu điểm của hệ thống F-care là ống thông mềm, có thể luồn vào trong tĩnh mạch gấp khúc. Tuy nhiên, thời gian điều trị khá dài, và không có nhiều các nghiên cứu lâm sàng sử dụng hệ thống này.

3.4 Quy trình can thiệp bằng sóng có tần số Radio
3.4.1 Chuẩn bị bệnh nhân
Bệnh nhân được giải thích đầy đủ, làm các xét nghiệm cơ bản và ký hồ sơ bệnh án.
Siêu âm đánh dấu tĩnh mạch trước can thiệp.
Bệnh nhân ở tư thế đứng: Dùng siêu âm Doppler lập bản đồ tĩnh mạch bị suy, đánh dấu vị trí chọc mạch và các nhánh tĩnh mạch nông cần điều trị kèm theo (nếu có).
Siêu âm Doppler được tiến hành một cách hệ thống trước can thiệp có vai trò quan trọng để khẳng định lại chỉ định can thiệp, cũng như lựa chọn phương pháp can thiệp. Ngoài ra, siêu âm giúp:
- Chọn vị trí chọc mạch phù hợp: để tránh nguy cơ tổn thương thần kinh, vị trí chọc mạch với tĩnh mạch hiển lớn thường không vượt quá 1/3 trên cẳng chân, với tĩnh mạch hiển nhỏ không vượt quá 1/3 giữa mặt sau cẳng chân.
- Xác định đường đi của ống thông, đặc biệt trong trường hợp tĩnh mạch có thành xơ hóa, di tích huyết khối bám thành, hay tĩnh mạch đi gấp khúc, xoắn vặn.
- Phân tích các dạng trào ngược khác nhau (tại quai, trước quai, hay thân tĩnh mạch) để tối ưu hóa kỹ thuật can thiệp, và chọn phương pháp điều trị nhánh nông phối hợp được hiệu quả (RF, tiêm xơ, lấy bỏ nhánh nông).
- Xác định các biến thể giải phẫu, đặc biệt là vị trí đổ vào tĩnh mạch sâu trong trường hợp can thiệp suy tĩnh mạch hiển nhỏ; hoặc tồn tại hai thân tĩnh mạch hiển…
Các thuốc sử dụng trong can thiệp:
- Các thuốc chống ngưng tập tiểu cầu như Aspirin hay chống viêm non-steroid đôi khi được tạm dừng ngay trước can thiệp để tránh nguy cơ bầm tím sau can thiệp. Tuy nhiên việc tiếp tục dùng các thuốc này không làm thay đổi hiệu quả can thiệp.
- Các thuốc chống đông như kháng vitamin K, DOACs: RF có thể thực hiện thành công ngay cả ở bệnh nhân đang điều trị bằng thuốc chống đông liều hiệu quả.
- Thuốc chống đông dự phòng TT-HKTM nhìn chung không cần chỉ định cho bệnh nhân làm RF, tuy nhiên có thể dự phòng sau can thiệp cho bệnh nhân có nguy cơ cao bị TT-HKTM
- Kháng sinh dự phòng: không cần thiết, nhưng có thể cân nhắc cho kháng sinh với những bệnh nhân có phối hợp làm phẫu thuật lấy tĩnh mạch nông (Muller), và có nguy cơ cao nhiễm trùng (ví dụ béo phì).
3.4.2 Chuẩn bị dụng cụ
- Máy siêu âm được trang bị đầu dò siêu âm Doppler mạch máu 7,5
- Máy phát RF và ống thông (Closure Fast) đã được
- cài đặt chế độ phát sóng 20 giây/lần, với mức nhiệt năng 120ºC.
- Máy bơm dung dịch gây tê làm mát quanh tĩnh mạch.
- Thuốc: Lidocain 1-2%. Thuốc thiết yếu trong cấp cứu.
- Kim chọc dò 18G, 21G, xy lanh 5ml, 10 ml, 20
- Introducer và sheath 7Fr/11cm – 8Fr/11cm.
- Dây dẫn (Guidewire) 0,028 inch – 0,035
- Bao vô khuẩn bọc đầu dò siêu âm, và bọc bàn điều khiển máy siêu âm.
3.4.3 Các bước can thiệp bằng sóng có tiền số Radio
Bệnh nhân nằm lên bàn can thiệp: sát trùng và bộc lộ toàn bộ bên chân can thiệp từ bẹn tới mắt cá chân. Phủ săng bảo vệ các phần cơ thể còn lại, và vùng bàn chân.
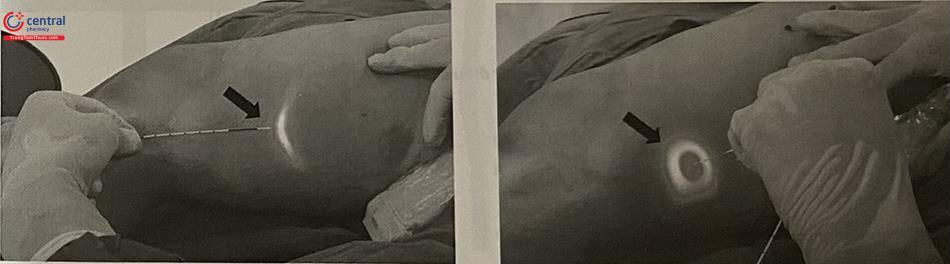
3.4.3.1 Bước 1: Chọc mạch và mở đường vào tĩnh mạch
Gây tê tại vị trí sẽ chọc mạch bằng Lidocain (thường ở vị trí ngang gối, hoặc 1/3 trên cẳng chân với tĩnh mạch hiển lớn; 1/3 giữa cẳng chân với tĩnh mạch hiển nhỏ).
Chọc mạch dưới hướng dẫn của siêu âm theo kỹ thuật Seldinger cải tiến.
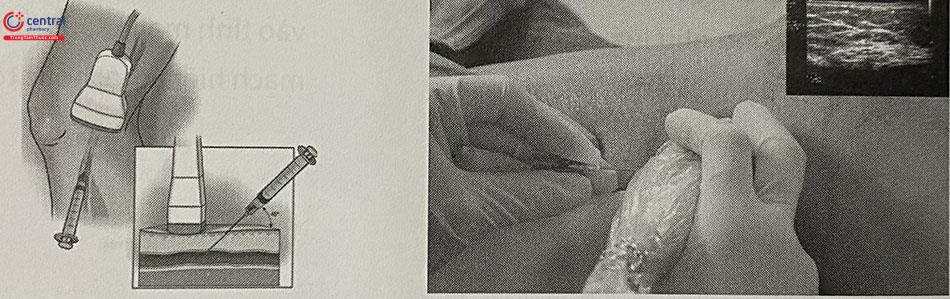
Luồn dây dẫn, rút kim chọc dò ra ngoài. Tiếp tục đặt introducer và sheath, sau đó rút dây dẫn.
Khó khăn và xử trí: Co thắt tĩnh mạch hiển, đặc biệt khi đường kính tĩnh mạch can thiệp nhỏ hơn 5 mm, là nguyên nhân cản trở quá trình chọc mạch. Khắc phục bằng cách để bệnh nhân nằm ở tư thế Trendelenburg, đông viên để bệnh nhân cảm thấy thư giãn và thoải mái; cũng như tránh chọc mạch nhiều lần ở cùng một vị trí. Nếu chọc mạch thất bại, có thể thay đổi vị trí chọc cao hơn hoặc thấp hơn 20 mm so với vị trí cũ, làm ga rô tĩnh mạch; một số trường hợp phải mở một vết nhỏ trên da để bộc lộ tĩnh mạch sau đó luồn sheath vào lòng tĩnh mạch cần điều trị.
3.4.3.2 Bước 2: Luồn ống thông RF lên vị trí quy định
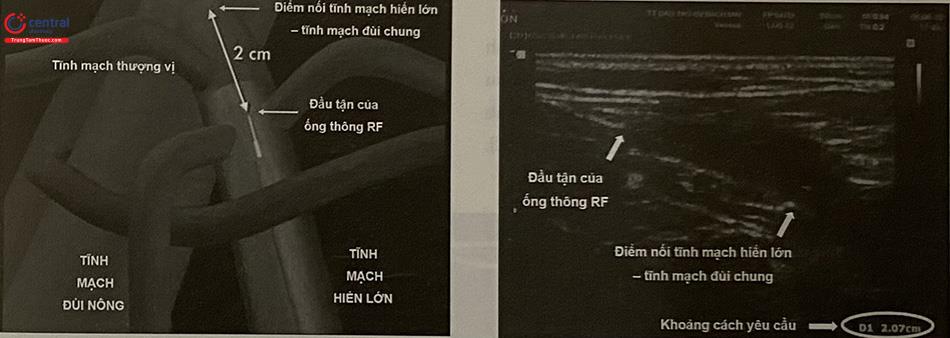
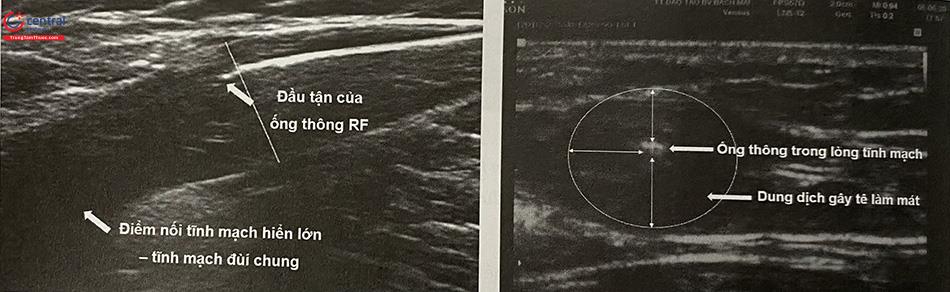
Bật máy RF và nối ống thông vào máy. Đánh dấu chiều dài của ống thông từ đầu xa ống tới vị trí đã chọc tĩnh mạch. Luồn ống thông nhẹ nhàng dưới hướng dẫn của siêu âm lên vị trí cách điểm nối tĩnh mạch hiển lớn tĩnh mạch đùi chung khoảng 20 mm, sau đó sử dụng khóa đánh dấu có sẵn trên ống thông để cố định không cho ống thông di lệch.
Xác định đúng vị trí đầu tận của ống thông là bước quan trọng bậc nhất của kỹ thuật, yêu cầu bác sĩ can thiệp phải làm chủ được đầu dò siêu âm, để phân biệt đầu tận ống thông với mô cơ thể, cũng như tìm đúng điểm nối quai tĩnh mạch hiển – tĩnh mạch sâu
Khó khăn và khắc phục: Động tác luồn ống thông phải hết sức nhẹ nhàng để giảm co thắt mạch. Nếu quá trình đẩy ống thông lên bị vướng, do phình mạch hoặc tĩnh mạch xoắn vặn: (1) có thể nắn chỉnh hướng đi của ống thông dưới hướng dẫn siêu âm; (2) sử dụng một dây dẫn 0,028 inch – 0,035 inch mềm, dài luồn vào lõi ống thông để dẫn đường; hoặc (3) tiếp tục mở đường vào mạch máu thứ 2 ở phía trên vị trí phình, xoắn.
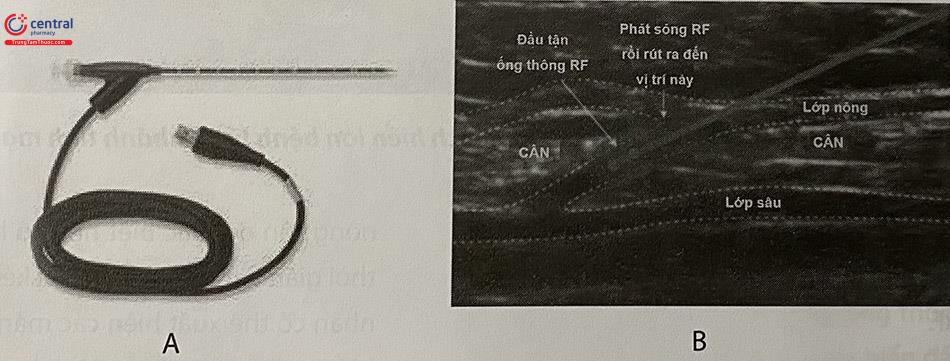
3.4.3.3 Bước 3: Gây tê làm mát quanh tĩnh mạch
Dưới hướng dẫn của siêu âm, bơm dung dịch gây tê và làm mát vào xung quanh đoạn tĩnh mạch hiển được can thiệp. Mục đích là tách rời tĩnh mạch hiển ra khỏi da và các cấu trúc dưới cân, đặc biệt là thần kinh nhằm bảo vệ mô khỏi nhiệt năng của sóng cao tần, đồng thời, tĩnh mạch hiển cũng bị ép và co thắt lại, nâng cao hiệu quả của thủ thuật.
Vị trí gây tê đầu tiên có thể là 1/3 giữa đùi, hoặc ngay tại vị trí nối tĩnh mạch hiển với tĩnh mạch sâu (theo kinh nghiệm tại Viện Tim mạch Việt Nam), một mặt làm tăng sự co thắt tĩnh mạch, mặt khác làm giảm nguy cơ đẩy cục máu đông (nếu có) vào hệ tĩnh mạch sâu. Tiếp tục gây tê từng đoạn 5 – 10 cm tới hết chiều dài của ống dẫn trong lòngtĩnh mạch.Tổngthể tích dungdịchgâytê khôngvượt quá 200 – 350 Nếu can thiệp đồng thời cả hai chân, lượng Lidocaine sử dụng không được lớn hơn 200 mg (20 ml Lidocaine loại 10 mg/ml).
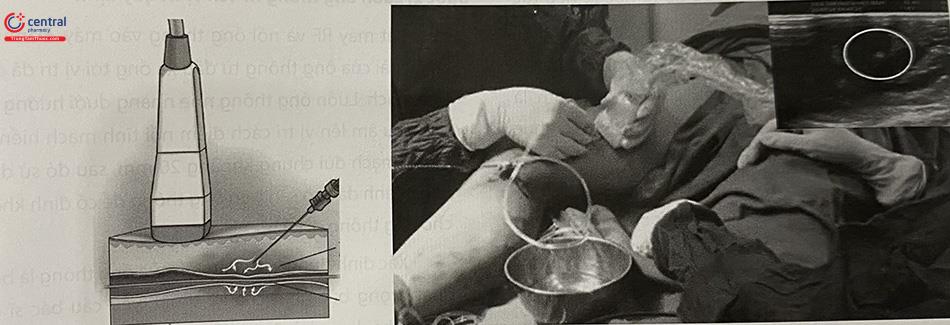
Ngay sau khi hoàn thành bước gây tê quanh tĩnh mạch, dùng siêu âm kiểm tra lần cuối cùng: (1) vị trí đầu tận của ống thông so với điểm nối tĩnh mạch hiển-tĩnh mạch đùi chung (siêu âm 2D trên mặt cắt trục dọc), (2) toàn bộ đoạn tĩnh mạch sẽ được can thiệp đã được cô lập hoàn toàn khỏi mô lân cận bằng dung dịch làm mát hay chưa (siêu âm 2D trên mặt cắt trục ngang).
Khó khăn và xử trí: Gây tê quanh tĩnh mạch là một kỹ thuật khó, yêu cầu bác sĩ can thiệp vừa làm chủ được đầu dò siêu âm, vừa kiểm soát được vị trí kim và tốc độ tiêm dung dịch làm mát. Sử dụng một máy bơm tự động được khuyên dùng hơn là phương pháp bơm tê bằng tay. Trong trường hợp tĩnh mạch ở quá nông, dung dịch làm mát phải đảm bảo đẩy tĩnh mạch (và ống thông) xuống sâu cách mặt da ít nhất từ 10 – 20 mm.
3.4.3.4 Bước 4: Phát sóng RF điều trị đoạn tĩnh mạch bệnh lý
Thông báo cho bệnh nhân để bắt đầu điều trị Đề nghị bệnh nhân phản hồi lại ngay nếu xuất hiện đau trong quá trình đốt.
Khởi động chế độ phát RF trên máy. Bấm nút phát sóng RF ở đầu tay cầm của ống thông để đốt TM hiển. Phát sóng 2 lần cho đoạn TM hiển đầu tiên. Tiếp tục rút dần catheter ra từng đoạn 6,5 cm để phát sóng và đốt các đoạn còn lại, trong khi đè ép đoạn TM vừa đốt

Đến vị trí đánh dấu quy ước, rút sheath ra khỏi lòng mạch để đốt đoạn TM hiển cuối cùng. Sau đó rút hẳn ống thông và sheath ra ngoài, sát trùng lại vị trí đã chọc mạch.
Dùng siêu âm để kiểm tra lại toàn bộ đoạn tĩnh mạch hiển đã điều trị.
3.4.3.5 Bước 5: Các thủ thuật, phẫu thuật phối hợp
Sau can thiệp thân tĩnh mạch hiển, những nhánh tĩnh mạch nông ở chân có thể được điều trị bổ sung bằng các biện pháp khác nhau, phụ thuộc vào kinh nghiệm, thói quen và chuyên khoa của bác sĩ làm can thiệp:
Điều trị bằng sóng cao tần nhánh tĩnh mạch nông giãn: Yêu cầu là các nhánh nông này phải đủ dài, và không quá gấp khúc để có thể luồn được ống thông RF vào lòng mạch. Vị trí nhánh nông điều trị đã được đánh dấu bằng siêu âm trước can thiệp, và chọc mạch được thực hiện đồng thời ở cả vị trí thân tĩnh mạch hiển lớn và ở nhánh nông giãn.

Điều trị nhánh nông bằng phương pháp tiêm xơ: Yêu cầu phải chọc mạch và lưu kim gây xơ từ trước khi làm can thiệp RF.
Lấy bỏ nhánh nông giãn bằng phương pháp Muller: là phương pháp lấy bỏ triệt để được các nhánh nông tồn dư, đặc biệt nếu có huyết khối cũ. Tuy nhiên, thời gian làm can thiệp sẽ bị kéo dài. Sau can thiệp bệnh nhân có thể xuất hiện các mảng bầm tím lớn, nhưng sẽ biến mất trong vòng vài ngày.

3.4.4 Các đặc trưng liên quan đến kỹ thuật can thiệp RF các loại tĩnh mạch khác nhau
Tĩnh mạch hiển lớn: Trong can thiệp, yêu cầu vị trí đầu tận của ống thông RF nằm trong lòng tĩnh mạch hiển lớn và cách điểm nối tĩnh mạch hiển lớn – tĩnh mạch đùi chung 20 mm. Mặt khác, đầu tận cũng phải cách xa vị trí đổ về của tĩnh mạch thượng vị nông ít nhất 5 mm để tránh biến chứng thuyên tắc huyết khối tĩnh mạch do nhiệt. Nếu trên đoạn tĩnh mạch điều trị những vị trí phình, giãn: cần đánh dấu bằng siêu âm trước can thiệp, để gây tê quanh tĩnh mạch tại vị trí này thật tốt, và có thể phát sóng RF 2 lần liên tiếp để củng cố hiệu quả gây tắc.
Tĩnh mạch hiển nhỏ: Để giảm biến chứng dị cảm do chạm vào thần kinh nông, điểm chọc mạch không được thấp hơn đầu dưới của cơ bụng trong chân (1/3 giữa mặt sau cẳng chân). Có nhiều sợi thần kinh vùng cẳng chân, vì vậy quá trình gây tê quanh tĩnh mạch cần hết sức thận trọng. Ngoài ra, chỉ 83% tĩnh mạch hiển nhỏ có quai thực sự, tức là nối với tĩnh mạch khoeo ở vị trí bình thường. Siêu âm đóng vai trò quan trọng khi lập bản đồ tĩnh mạch, cũng như khi xác định khoảng cách giữa đầu tận của ống thông tới vị trí đổ vào tĩnh mạch sâu ở khoeo chân.
Tĩnh mạch hiển phụ: Kỹ thuật can thiệp tĩnh mạch hiển phụ tương tự như với tĩnh mạch hiển lớn. Tuy nhiên, đoạn tĩnh mạch hiển phụ đủ thẳng để can thiệp RF thường khá ngắn, phần còn lại đi gấp khúc và ở nông. Vì vậy, thường kết hợp can thiệp RF với phẫu thuật lấy bỏ phần tĩnh mạch nông giãn. Chú ý vị trí đầu tận của ống thông vẫn phải đặt cách xa nơi đổ vào tĩnh mạch đùi chung từ 20 – 25 mm.
Tĩnh mạch xuyên: tĩnh mạch xuyên bị suy có thể được can thiệp bằng RF với ống thông dạng chuyên dụng dưới hướng dẫn siêu âm. Vị trí của đầu tận ống thông ở 1 – 2 mm dưới lớp cân sâu, nhưng cách tĩnh mạch sâu tối thiểu 5 mm, sau đó gây tê làm mát tĩnh mạch ở cả trên cân và dưới cân để hiệu ứng nhiệt không gây tổn thương tĩnh mạch sâu.
3.5 Tiêu chí đánh giá thành công
Can thiệp nhiệt nội tĩnh mạch bằng sóng có tần số radio (RF) được đánh giá là thành công khi:
Quá trình can thiệp diễn ra thuận lợi, không xảy ra biến chứng.
Đoạn tĩnh mạch hiển bệnh lý được đóng hoàn toàn ngay sau can thiệp: Sau điều trị RF, kiểm tra bằng siêu âm có thể thấy tĩnh mạch co nhỏ, thành dày, và không còn dòng chảy trong lòng tĩnh mạch đã được can thiệp.
Bệnh nhân có thể đứng dậy và đi lại ngay sau khi can thiệp, trừ một số trường hợp đặc biệt.

3.6 Biến chứng và xử trí
Huyết khối tĩnh mạch nông: có thể gặp ở các nhánh tĩnh mạch nông giãn thuộc hệ hiển lớn. Yếu tố thuận lợi dễ dẫn đến sự hình thành HKTM nông là không điều trị đồng thời các nhánh TM nông giãn, và/hoặc không băng ép đủ chặt sau thủ thuật can thiệp RF. Điều trị HKTM nông theo các khuyến cáo hiện hành. Nếu huyết khối ở xa vị trí đổ vào các tĩnh mạch sâu (trên 30 mm), thì chỉ cẩn thuốc giảm viêm thông thường.
Tổn thương thần kinh: chiếm 0 – 22% ở bệnh nhân sau điều trị suy tĩnh mạch hiển lớn bằng RF, thường chỉ thoáng qua. Tổn thương thần kinh hiển liên quan đến vị trí chọc mạch ở quá thấp (dưới 1/3 giữa cẳng chân), do ở vị trí này thần kinh hiển đi rất sát tĩnh mạch hiển lớn. Can thiệp tĩnh mạch hiển nhỏ phối hợp với lấy bỏ nhánh nông mặt ngoài cẳng chân có nguy cơ chạm vào thần kinh mác chung hoặc thần kinh chày.
Huyết khối tĩnh mạch sâu: rất hiếm gặp (dưới 1%), thường liên quan đến kỹ thuật can thiệp, gọi là huyết khối tĩnh mạch do nhiệt (EHIT/Endovenous heat-induced thrombus). Biến chứng này được mô tả chi tiết hơn trong phương pháp điều trị bằng laser.
Biến chứng liên quan đến kỹ thuật: Siêu âm Doppler có vai trò quan trọng phát hiện thất bại của thủ thuật, gọi là thất bại về mặt giải phẫu (để phân biệt với những trường hợp thất bại về lâm sàng: BN tái phát triệu chứng lâm sàng và/ hoặc búi giãn tĩnh mạch nông). Có thể chia làm 3 nhóm thất bại giải phẫu sau:
- Nhóm 1: TM không đóng: mặc dù đã điều trị RF nhưng TM hoàn toàn không đóng, và vẫn tồn tại tình trạng này trong suốt quá trình theo dõi về
- Nhóm 2: Tái thông: sau điều trị RF, TM đóng nhưng sau đó tái thông một phần hoặc hoàn toàn.
- Nhóm 3: Tồn tại dòng trào ngược tại quai: sau điều trị RF, thân TM đóng hoàn toàn, nhưng vẫn tồn tại dòng trào ngược tại quai, thường liên quan với nhánh hiển lớn phụ.
Tốc độ rút ống thông quá nhanh, và chỉ số khối cơ thể (BMI) lớn là hai yếu tố quan trọng nhất ảnh hưởng đến thất bại về mặt giải phẫu. Những bệnh nhân này cần được theo dõi thường xuyên hơn, để có chỉ định can thiệp/phẫu thuật nếu cần thiết.
Với hệ thống VNUS Closure Fast, báo cáo của Proebstle T. và cộng sự về tỷ lệ các biến chứng sau can thiệp bao gồm bầm tím (6,4%), dị cảm (3,2%), rối loạn sắc tố (2%), tụ máu (1,6%) viêm tĩnh mạch (0,8%), không có trường hợp nào bị huyết khối tĩnh mạch sâu. Có 29,9% bệnh nhân phàn nàn vì đau sau can thiệp, nhưng điểm VAS (từ 0 đến 10) trung bình chỉ là 0,7 ± 1,6 điểm.
3.7 Kết quả can thiệp nhiệt nội tĩnh mạch bằng sóng có tần số Radio (RF)
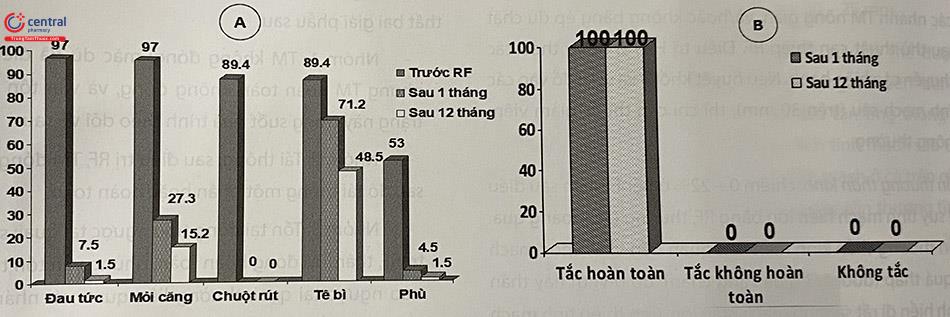
Kết quả tổng hợp 5 nghiên cứu so sánh giữa điều trị nhiệt nội tĩnh mạch bằng Closuse Plus và phẫu thuật stripping trong điều trị STMMT chi dưới đã cho thấy hai phương pháp này có hiệu quả tương đương nhau về tỷ lệ thành công của thủ thuật, sự tắc nghẽn hoàn toàn của tĩnh mạch bệnh lý ngay sau điều trị (95 – 100%), và lâu dài (trên 90%). Tuy nhiên, những bệnh nhân điều trị bằng RF có thời gian phải ngừng làm việc ngắn hơn, mức độ giảm triệu chứng nhanh hơn, chất lượng cuộc sống sau 1 tuần cao hơn, và đặc biệt là có biến chứng đau hay tụ máu sau thủ thuật thấp hơn. Nghiên cứu đa trung tâm tại 8 nước châu Âu, đánh giá hiệu quả điều trị của Closure Fast chỉ ra tỷ lệ tắc hoàn toàn tĩnh mạch bệnh lý là 99,7% sau 6 tháng, 96,3% sau 1 năm và 92,6% sau 3 năm. Không có trường hợp nào bị biến chứng huyết khối tĩnh mạch sâu hay thuyên tắc phổi. Sau 1 năm, chỉ có 3,4% BN than phiền về dị cảm, và 1% có cảm giác tê bì. Tỷ lệ tái phát, hay tắc không hoàn toàn rất thấp (1%). Có 5% BN xuất hiện giãn nhánh tĩnh mạch hiển lớn trước sau khi đã điều trị RF thân tĩnh mạch hiển chính. Trong một nghiên cứu đa phân tích, tỷ lệ thành công của RF sau điều trị suy tĩnh mạch hiển lớn 3 tháng là 89%, và sau 5 năm là 80%. Nghiên cứu lớn nhất được thực hiện trên 1006 BN (1222 chi), cho thấy kết quả đóng hoàn toàn TM bệnh lý sau 5 năm là 87,2%. Có sự cải thiện rõ rệt về triệu chứng đau, mỏi và phù chi, mặc dù có tới 27% BN tái phát giãn tĩnh mạch nông sau 5 năm.
Trong nghiên cứu EVOLVeS theo dõi trong vòng 2 năm các BN sau điều trị RF hoặc phẫu thuật, tỷ lệ thành công lần lượt là 91% và 92%. Các BN điều trị RF có chất lượng cuộc sống và thang điểm đau tốt hơn (p < 0,05). Kết quả đánh giá thang điểm VCSS của các BN điều trị RF cho thấy điểm VCSS giảm từ 4,8 xuống 2,5 chỉ sau 3 tuần điều trị.
Viện Tim mạch Việt Nam đã bắt đầu triển khai kỹ thuật can thiệp bằng RF cho bệnh nhân suy tĩnh mạch từ năm 2012, sử dụng dụng cụ VNUS Closure Fast với tỷ lệ thành công trung hạn rất khả quan. Cùng với laser nội tĩnh mạch và các phương pháp điều trị không nhiệt, không gây tê, kỹ thuật này đã được chuyển giao cho nhiều bệnh viện trong cả nước.
3.8 Theo dõi sau can thiệp
3.8.1 Băng ép, đeo tất áp lực sau can thiệp
Quấn băng ép hoặc đeo tất chun áp lực (15 – 20 mmHg) làm giảm đáng kể triệu chứng đau sau can thiệp (theo Lugli). Bệnh nhân được khuyên quấn băng chun hay đeo tất áp lực liên tục ít nhất 48 giờ sau can thiệp, sau đó đeo vào ban ngày trong vòng từ 2 – 4 tuần, đặc biệt nếu có phối hợp phẫu thuật lấy bỏ nhánh nông. Duy trì kéo dài việc dùng tất chun hay băng ép chỉ chứng minh lợi ích rõ rệt ở những bệnh nhân có rối loạn sắc tố hoặc loét da do nguyên nhân tĩnh mạch.
3.8.2 Dự phòng huyết khối sau can thiệp
Hội phẫu thuật mạch máu châu Âu yêu cầu đánh giá nguy cơ thuyên tắc huyết khối tĩnh mạch ở các bệnh nhân suy tĩnh mạch được chỉ định can thiệp/phẫu thuật, với mức độ khuyến cáo/mức độ bằng chứng là I/B (thường sử dụng thang điểm Caprini). Vì bệnh nhân có thể dậy và đi lại ngay sau can thiệp nội tĩnh mạch, chỉ định dự phòng TT-HKTM một cách hệ thống không được khuyến cáo. Tuy nhiên, những bệnh nhân có tiền sử thuyên tắc tĩnh mạch, có bệnh lý tăng đông bẩm sinh, béo phì, cao tuổi, hạn chế bất động hoặc đang bị ung thư thuộc nhóm nguy cơ cao bị TT-HKTM và được khuyên dùng Heparin TLPT thấp, Fondaparinux liều thấp hoặc thuốc chống đông trực tiếp đường uống (DOACs/Direct oral anticoagulants) với liều dự phòng, kéo dài 8 – 10 ngày kể từ thời điểm sau can thiệp.
3.8.3 Chế độ sinh hoạt và vận động
Sau can thiệp, bệnh nhân có thể tự đứng dậy ngay, và được theo dõi tại phòng bệnh từ 2 – 4 tiếng, sau đó xuất viện trong ngày. Bệnh nhân được dặn dò đi lại nhẹ nhàng, gác chân cao khi nghỉ ngơi, không tháo tất trong vòng 48 – 72 giờ, tránh vận động mạnh trong vòng 5 ngày, có thể dùng thêm thuốc giảm đau, chống viêm, giảm phù nề nếu cần thiết.
Bác sĩ can thiệp có thể giải thích trước cho bệnh nhân về một số tác dụng ngoại ý như cảm giác tê bì và sờ thấy tĩnh mạch như sợi thừng dưới da ở vùng can thiệp, để họ không lo lắng quá mức. Yêu cầu bệnh nhân chú ý phát hiện và khám lại ngay nếu xuất hiện các triệu chứng sau:
- Đau nhiều.
- Sưng nề, căng chân đột ngột hoặc viêm đỏ dọc vị trí đường đi của tĩnh mạch.
- Tức ngực, khó thở.
- Chảy máu, tụ máu tại vị trí chọc mạch.
3.8.4 Siêu âm kiểm tra sau can thiệp
Siêu âm Doppler kiểm tra sau can thiệp lý tưởng được thực hiện sau 2 – 3 ngày, nhằm phát hiện sự xuất hiện của huyết khối trong tĩnh mạch sâu sát vị trí đổ vào của các tĩnh mạch nông bệnh lý. Tuy nhiên, với các bác sĩ can thiệp giàu kinh nghiệm, và bệnh nhân không có các biến chứng sau can thiệp, thì lịch tái khám và siêu âm có thể thực hiện vào thời điểm 1 – 3 tháng sau can thiệp, và định kỳ hàng năm.
4 Phương pháp can thiệp: Nhiệt nội tĩnh mạch bằng Laser
4.1 Đại cương
Laser là tên viết tắt của cụm từ Light Amplification by Stim- ulated Emission of Radiation, có nghĩa là “khuếch đại ánh sáng bằng phát xạ kích thích”. Sóng laser là một dạng ánh sáng được phát ra nhờ vào bức xạ cưỡng bức, có tính đơn sắc, đồng hướng và được khuếch đại nên có công suất cực lớn. Trong điều trị suy tĩnh mạch, tia laser được truyền qua một sợi quang học (sợi đốt laser) tác động vào mô đích là hemoglobin hoặc nước, thông qua một loạt phản ứng nhiệt để gây tắc lòng tĩnh mạch bệnh lý. Có hai loại máy phát tia laser: một loại phát ra tia laser với các bước sóng 810, 940, 980 nm, được hấp thụ bởi hemoglobin, và một loại phát tia laser với các bước sóng 1320, 1470, 1500, 1940 nm, được hấp thụ bởi nước. Nước là thành phần phổ biến trong tế bào thành tĩnh mạch, hệ số hấp thụ của tia laser có bước sóng 1470 nm cao gấp hàng chục lần so với hệ số hấp thụ hemoglobin của các tia laser có bước sóng thấp hơn, vì vậy đạt được hiệu quả cao hơn, trong khi mức năng lượng phát ra thấp hơn.
Puglisi là người đầu tiên báo cáo về ứng dụng của laser trong điều trị suy tĩnh mạch vào năm 1989. Từ đó đến nay, đã có rất nhiều nghiên cứu được công bố, với hiệu quả điều trị của laser nội tĩnh mạch lên tới 97 – 100%.
4.2 Chỉ định và chống chỉ định
Chỉ định của laser nằm trong chỉ định chung của phương pháp nhiệt nội tĩnh mạch đã mô tả ở phần can thiệp bằng phương pháp sóng cao tần.
4.3 Dụng cụ và thiết bị can thiệp Laser
Điều trị bằng laser là một quá trình phát nhiệt khá phức tạp, đã được giải thích bằng một số cơ chế, nhưng vẫn còn những điểm còn đang thảo luận.
Ánh sáng sẽ được hấp thụ bởi vùng phân tử đích chịu trách nhiệm về màu sắc (chromophore), có thể là nước (trong thành tĩnh mạch), oxyhemoglobin và hemoglobin (trong máu). Trên thực tế, giống như RF, quy trình laser nội mạch phải xảy ra trên tĩnh mạch không có máu. Sự có mặt của máu gây ra hai hậu quả tiêu cực quan trọng: (1) làm giảm sự truyền ánh sáng đến thành tĩnh mạch, (2) tạo ra sự đóng cặn (carbon hóa) và nóng chảy của đầu sợi quang học. Sự chiếu xạ có chọn lọc vào các lớp của thành tĩnh mạch bằng ánh sáng laser dẫn đến sự biến tính của các sợi collagen và phá hủy lớp nội mạc. Các nghiên cứu mô học đã chỉ ra rằng các sợi laser trần được sử dụng trong giai đoạn đầu của can thiệp laser sẽ tiếp xúc trực tiếp vào thành tĩnh mạch, có thể dẫn đến sự phá hủy thành tĩnh mạch (theo Weiss, nhiệt độ trung bình quan sát được ở phần cuối của sợi quang là 729°C). Hiện tượng này giải thích sự xuất hiện của vết bầm tím và đau sau can thiệp nội tĩnh mạch bằng loại sợi trần.
Thiết bị can thiệp laser nội tĩnh mạch được đặc trưng bởi hai thành phần là bước sóng laser và sợi quang học (sợi phát tia laser).
4.3.1 Bước sóng Laser
Có nhiều loại bước sóng laser, từ 1064 nm, 810 nm, 940 nm, 980 nm đến 1320 nm, 1470 nm và 1940 nm. Laser Nd-Yag 1064 nm là loại laser dạng khối, do giá thành quá cao, đã không còn được ứng dụng trong điều trị nội tĩnh mạch.
Laser dạng diode có giá rẻ hơn nhiều, trong đó laser diode 810 nm, 940 nm và 980 nm đã từng được sử dụng rộng rãi nhất. Theo phổ điện từ và đường cong hấp thụ của oxyhemoglobin, hemoglobin và nước, laser 980 nm về lý thuyết cho thấy sự hấp thụ tốt hơn đối với các chromophore này, so với laser 810 và 940 nm. Sau đó, các bước sóng khác đã được đề xuất như laser Nd-Yag 1320 nm, điều trị giãn tĩnh mạch mạng nhện, và đặc biệt là laser diode 1470 nm. Các bước sóng này hấp thụ trong nước là chính. Trên lý thuyết, dựa vào quang phổ điện từ, ánh sáng có bước sóng 1470 nm được hấp thụ trong nước cao hơn gấp 40 lần so với laser 810, 940 hoặc 980 nm và có thể ít hơn 4 lần so với laser 1320 nm. Đây là lý do tại sao Mac Kay xếp laser 810, 940 và 980 nm vào nhóm bước sóng hấp thụ đặc hiệu bởi hemoglobin (HSLW/Hemoglobin Specific Laser Wavelenght) còn laser 1320 và 1470 nm xếp vào nhóm hấp thụ đặc hiệu bởi nước (WSLW/Water Specific Laser Wavelenght). Khái niệm hấp thụ này đã được Mordon làm sáng tỏ hơn. Bằng mô hình toán học của mình, ông chỉ ra phụ thuộc vào độ dài bước sóng, photon được hấp thụ nhiều hay ít bởi máu, thành tĩnh mạch, hoặc các mô quanh tĩnh mạch. Hệ số hấp thụ (μa) càng lớn, càng có nhiều photon bị hấp thụ.
Mặc dù đã có một số nghiên cứu so sánh các bước sóng khác nhau (810 nm so với 980 nm, 940 nm so với 1320 nm, 980 nm và 1500 nm) cho thấy hiệu quả điều trị cũng như tác dụng ngoại ý gần như không khác nhau, nhưng vì cỡ mẫu thấp, và tính ngẫu nhiên không cao, không thể đi đến một kết luận thống nhất, ngoại trừ sự đồng thuận cao liên quan đến hiệu quả của bước sóng 1470 nm. Gần đây, các máy phát laser cung cấp bước sóng 1940 nm đang được tung ra thị trường. Bước sóng này cho phép hấp thụ tốt hơn năng lượng trong nước của thành mạch và công suất có thể giảm xuống. Vì vậy, mật độ năng lượng tuyến tính (LEED/Linear Endovenous Energy Density) có thể giảm xuống 20 – 40 J/cm thay cho mức năng lượng tối thiểu thường được khuyến cáo là 60 J/cm. Sự phá hủy thành tĩnh mạch sẽ “êm dịu hơn” nhưng vẫn đảm bảo hiệu quả, nguy cơ tổn thương thần kinh cũng sẽ thấp hơn, bệnh nhân cảm thấy dễ chịu hơn.

4.3.2 Sợi quang học
Sợi quang học (sợi phát tia laser) là một loại sợi thủy tinh hoặc Nhựa có đặc tính dẫn ánh sáng. Cấu trúc bao gồm một lõi, bao quanh bởi một lớp vỏ bọc quang học. Do chỉ số chiết suất khác nhau giữa vỏ và lõi, ánh sáng bị giới hạn giữa 2 cấu trúc này. Toàn bộ sợi được phủ một lớp vỏ nhựa bảo vệ. Một trong những tiêu chí để đánh giá chất lượng của sợi quang là không nhìn thấy bất kỳ ánh sáng nào dọc theo nó khi được kết nối với máy phát laser. Tuy nhiên, cần chú ý không để sợi bị uốn cong quá mức, tránh làm thất thoát một phần năng lượng ánh sáng trong vỏ bọc.
Các sợi quang có đường kính 600μm được sử dụng phổ biến nhất nhưng cũng có một số loại sợi khác với đường kính nhỏ hơn như 200 μm hoặc 360 μm, mềm dẻo hơn, đặc biệt thích hợp để xử lý các tĩnh mạch có kích thước nhỏ hơn 5 mm. Hiện tại, những loại sợi này đã được thay thế bằng các sợi xuyên tâm 400 μm, gọi là sợi “mỏng”, thuận tiện để điều trị tĩnh mạch hiển nhỏ hoặc tĩnh mạch hiển phụ có kích thước từ 6 mm trở xuống, thông qua một cathlon 16G hoặc một introducer 4Fr.
Các sợi quang thế hệ đầu tiên là loại sợi cứng, đầu trần, tia phát theo hướng ra phía trước, đã không còn được sử dụng vì tỷ lệ biến chứng cao. Những tiến bộ hiện tại gồm:
Chia vạch trên sợi quang, giúp động tác rút liên tục sợi đốt laser trong quá trình can thiệp được ổn định và thuận lợi hơn.
Phát tia hướng tâm, với đầu tận của sợi quang tù, và được bảo vệ bằng một lớp vỏ thủy tinh. Với loại sợi này, bề mặt nhận được ánh sáng lớn hơn và với một công suất nhất định, tất cả các photon được phân bố theo chu vi (tỏa tròn), từ đó làm giảm các biến chứng của laser thế hệ cũ như bầm tím, đau sau phẫu thuật, viêm tĩnh mạch và dị cảm.
Công suất áp dụng cho sợi trần là khoảng 12-15W; với các loại sợi quang hiện tại, công suất giảm xuống 8 hoặc 10 W, trong khi năng lượng vẫn đạt được 60 – 80 J/cm, thậm chí nhiều hơn nếu cần. Công nghệ phát tia hướng tâm với hệ thống vòng kép (double ring) được phát triển, cho phép công suất phân phối giữa hai vòng này giảm đi một nửa; do đó nhiệt độ ở đầu tận sợi laser được giảm xuống, làm giảm nguy cơ cacbon hóa, đồng thời cho phép cùng một đoạn tĩnh mạch được chiếu tia hai lần.

Hình 57.27. Các loại sợi quang học khác nhau
4.3.3 Các thông số chụp
Năng lượng (E, tính bằng Joules) = Công suất (P, tính bằng Watts) × Thời gian (T, tính bằng giây). Trong điều trị bằng laser, thay đổi một hoặc cả hai thông số công suất và thời gian sẽ làm thay đổi năng lượng truyền đến thành tĩnh mạch. Tuy nhiên, cùng một năng lượng tổng có thể tạo ra các hiệu ứng khác nhau nếu thay đổi nghịch đảo các thông số này. Vì vậy, tăng mạnh công suất trong một thời gian rất ngắn sẽ gây ra sự carbon hóa; ngược lại, cung cấp một công suất thấp trong thời gian rất dài sẽ hình thành một kích thích sinh học. Trong can thiệp laser nội mạch, công suất hiệu dụng từ 8 đến 15 W, và được đặt cố định trước khi bắt đầu điều trị. Còn thời gian phát tia laser phụ thuộc vào tốc độ rút sợi quang học. Quy trình can thiệp hiện nay yêu cầu phương pháp rút sợi laser liên tục, với tốc độ 1 – 3 mm/s, tốc độ càng nhanh thì năng lượng phân phối càng thấp. Năng lượng được cung cấp trên mỗi cm tĩnh mạch (năng lượng tuyến tính) được biểu thị bằng J/cm. Hiện nay, các máy phát laser bước sóng 1470 nm đều đặt ngưỡng năng lượng tuyến tính là từ 60 đến 70 J/cm. Mức năng lượng chuẩn (J/cm) phù hợp với đường kính tĩnh mạch được tính bằng đường kính tĩnh mạch (mm) nhân với 10.
Trong thực tế, sau khi đặt trước năng lượng mong muốn trên mỗi cm, sử dụng sợi đốt laser có chia độ cm, phối hợp với âm thanh (tiếng bip từ máy phát) giúp điều chỉnh tốc độ rút, đảm bảo sự phân phối nhiệt năng đồng đều lên thành tĩnh mạch.
Tóm tắt lại, thiết bị và thông số chuẩn để can thiệp laser nội tĩnh mạch hiện tại như sau:
- Máy phát laser bước sóng 1470
- Sợi đốt laser phát tia hướng tâm, vòng kép tỏa tròn, đường kính 400 hoặc 600 µm, rút với tốc độ 1 – 3 mm/s theo chế độ phát tia liên tục.
- Công suất quy ước từ 8 – 10
- Năng lượng cung cấp từ 60 – 70 J/cm.
4.4 Quy trình can thiệp
4.4.1 Chuẩn bị bệnh nhân
Tương tự như phương pháp can thiệp nội tĩnh mạch bằng
4.4.2 Chuẩn bị dụng cụ
- Các dụng cụ chuẩn bị cũng tương tự, ngoại trừ:
- Máy phát laser 1470 nm thay cho máy phát
- Sợi đốt laser 400 hoặc 600 µm, vì vậy cần dùng Introducer và sheath 4Fr/11cm hoặc 6Fr/11cm.
4.4.3 Các bước can thiệp laser nội tĩnh mạc
4.4.3.1 Bước 1: Chọc mạch và mở đường vào tĩnh mạch
Tương tự như kỹ thuật được mô tả trong can thiệp nội tĩnh mạch bằng
4.4.3.2 Bước 2: Luồn sợi đốt laser lên vị trí quy định
Sợi đốt laser được lắp vào máy phát, và phát ra ánh sáng ở đầu.
Quá trình siêu âm theo dõi việc luồn sợi đốt laser lên vị trí quy ước (20 mm tính từ đầu sợi đốt đến vị trí nối giữa tĩnh mạch hiển và tĩnh mạch sâu) có thể thuận lợi hơn luồn ống thông RF nhờ vào ánh sáng phát ra ở đầu tận sợi
4.4.3.3 Bước 3: Gây tê làm mát quanh tĩnh mạch
Tương tự như kỹ thuật được mô tả trong can thiệp nội tĩnh mạch bằng
4.4.3.4 Bước 4: Phát tia laser điều trị đoạn tĩnh mạch bệnh lý
Trước khi phát tia laser, tất cả mọi người trong phòng đều phải được đeo kính bảo vệ.
Thông báo cho bệnh nhân để bắt đầu điều trị Đề nghị bệnh nhân phản hồi lại ngay nếu xuất hiện đau trong quá trình đốt.
Khởi động chế độ phát tia laser trên máy. Các thế hệ máy laser hiện tại đều đặt chế độ phát tia laser liên tục. Nếu lựa chọn công suất 10 W sẽ cho phép cung cấp năng lượng 70 J cho mỗi 10 mm tĩnh mạch.
Bác sĩ can thiệp đồng thời thực hiện các thao tác sau:
- Một tay ấn nhẹ lên mặt da dọc đường đi của sợi đốt laser trong tĩnh mạch, cũng có thể dùng đầu dò siêu âm nhưng không ấn mạnh như với can thiệp bằng RF vì có thể gây tổn thương đầu sợi đốt.
- Một tay giữ phần sợi đốt laser bên ngoài tĩnh mạch, và rút liên tục với tốc độ 1 – 2 mm/s, đồng thời với thời gian phát tia laser liên tục.
- Một chân nhấn liên tục vào bàn đạp (pedale) nối với máy siêu âm để duy trì phát tia laser liên tục.
Vị trí TM hiển đầu tiên tiếp xúc với đầu tận của sợi laser được đốt ở mức năng lượng 120J – 140J, sau đó bắt đầu rút sợi đốt laser. Chú ý duy trì tốc độ rút đều đặn và liên tục. Để đảm bảo tốc độ rút ổn định, cần chú ý 2 chi tiết:
- Sợi đốt laser có đánh dấu từng vạch 10
- Máy phát laser phát ra âm thanh “bip” kéo dài 5 giây.
Bác sĩ can thiệp rút liên tục 10 mm trong 1 lần “bip”, sẽ đạt được tốc độ 2 mm/giây. Ít nhất 10 cm đầu tiên phải duy trì được tốc độ 1 – 2 mm/s. Sau đó có thể rút nhanh hơn, với tốc độ 3 – 4 mm/s.
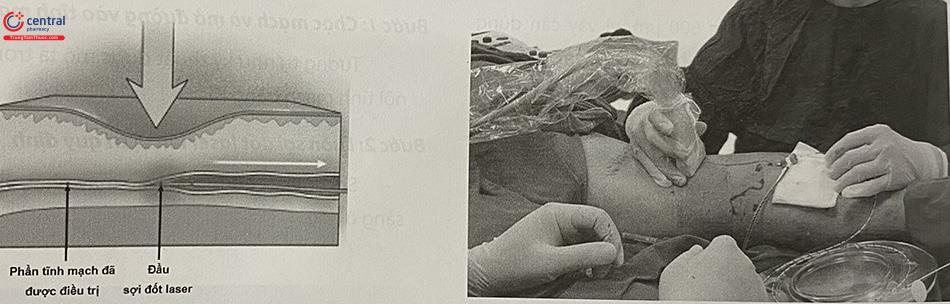
Đến vị trí đánh dấu quy ước, rút sheath ra khỏi lòng mạch để đốt đoạn TM hiển cuối cùng. Sau đó rút hẳn sợi đốt và sheath ra ngoài, sát trùng lại vị trí đã chọc mạch.
Dùng siêu âm để kiểm tra lại toàn bộ đoạn tĩnh mạch hiển đã điều trị.
Chú ý: Ngay trước khi rút sợi đốt ra khỏi tĩnh mạch, phải ngừng phát tia laser bằng cách nhấc chân ra khỏi bàn đạp, đồng thời nhân viên phụ bên ngoài tắt chế độ phát tia trên máy
4.4.3.5 Bước 5: Các thủ thuật phối hợp
Với các nhánh nông lớn (đường kính ≥ 8 mm), có thể đồng thời tiến hành các thủ thuật điều trị như laser, tiêm xơ hay phẫu thuật Muller.
Phần lớn những nhánh nông nhỏ, ít ngoằn ngoèo có thể thoái triển hoàn toàn sau 4 – 6 tuần.
4.4.4 Các đặc trưng liên quan đến kỹ thuật can thiệp các loại tĩnh mạch khác nhau
Laser là phương pháp hiệu quả để điều trị được cả tĩnh mạch hiển lớn, tĩnh mạch hiển nhỏ, tĩnh mạch hiển phụ hay tĩnh mạch xuyên, nhưng đặc biệt được ưu tiên với tĩnh mạch hiển nhỏ vì đường kính sợi đốt nhỏ, phát tia hướng tâm và tỏa tròn 3600 nên phạm vi điều trị rất tập trung, ít nguy cơ gây tổn thương thần kinh hay làm thủng tĩnh mạch, nhất là khi sử dụng laser với các bước sóng lớn 1470 nm, 1940 nm.
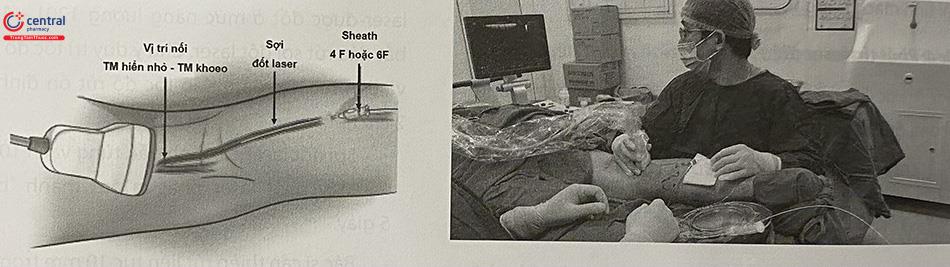
Trong quá trình siêu âm đánh dấu tĩnh mạch trước can thiệp, cũng như khi siêu âm xác định vị trí đầu tận của sợi đốt laser, cần hết sức chú ý đến vị trí nối giữa tĩnh mạch hiển nhỏ với tĩnh mạch khoeo, do biến thể giải phẫu phức tạp.

4.5 Tiêu chí đánh giá thành công
Can thiệp laser nội tĩnh mạch được đánh giá là thành công khi:
- Quá trình can thiệp diễn ra thuận lợi, không xảy ra biến chứng.
- Đoạn tĩnh mạch hiển bệnh lý được đóng hoàn toàn ngay sau can thiệp: Sau điều trị, kiểm tra bằng siêu âm có thể thấy tĩnh mạch co nhỏ, thành dày, và không còn dòng chảy trong lòng tĩnh mạch đã được can thiệp.
- Bệnh nhân có thể đứng dậy và đi lại ngay sau khi can thiệp, trừ một số trường hợp đặc biệt.
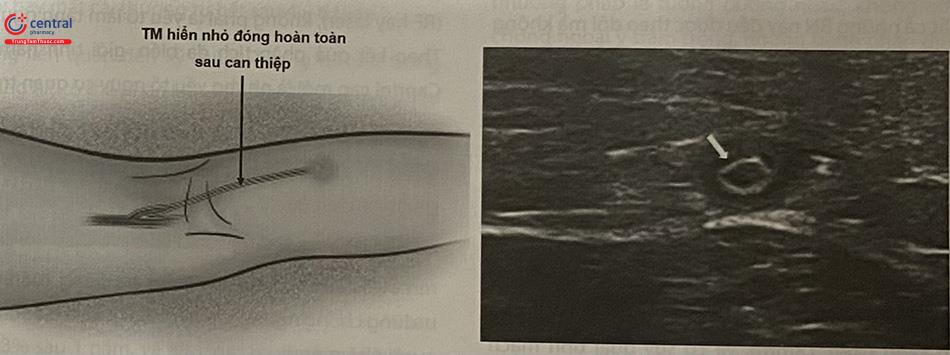
4.6 Biến chứng và xử trí
Bầm tím/Tụ máu: khoảng 60% bệnh nhân điều trị laser có bầm tím nhưng sau 2 tuần tất cả đều trở về bình thường. Tụ máu gặp ở 1 – 5% bệnh nhân sau điều trị tĩnh mạch hiển lớn, thấp hơn nhiều so với bệnh nhân phẫu thuật.
Bỏng da: Bỏng da rất hiếm gặp, thường chỉ ghi nhận trong các báo cáo lâm sàng sử dụng laser với các bước sóng thấp, hấp thụ bởi hemoglobin. Nếu thực hiện gây tê làm mát tĩnh mạch tốt, đảm bảo tĩnh mạch cách da tối thiểu 1 – 2 cm sẽ dự phòng được biến chứng này
Huyết khối tĩnh mạch do nhiệt (EHIT): Huyết khối tĩnh mạch do nhiệt xảy ra khi đầu tận của sợi đốt laser (hoặc ống thông RF) quá gần vị trí nối giữa tĩnh mạch hiển và tĩnh mạch sâu (đùi chung, khoeo), thậm chí nằm hẳn trong tĩnh mạch sâu.
- Nhóm I: Huyết khối có thể gây tắc TM thượng vị nông nhưng chưa vào TM sâu
- Nhóm II: Huyết khối gây hẹp dưới 50% lòng TM sâu
- Nhóm III: Huyết khối gây hẹp trên 50% lòng TM sâu
- Nhóm IV: Huyết khối gây tắc hoàn toàn lòng TM sâu
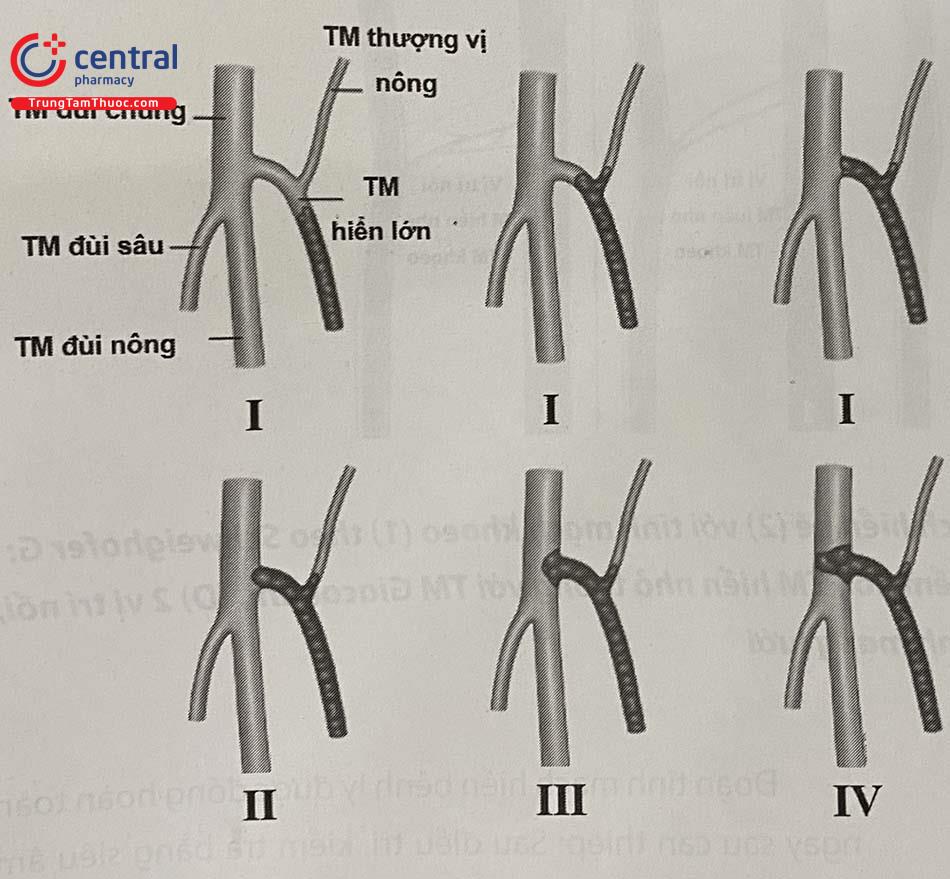
Trong một báo cáo tổng kết 500 thủ thuật laser, có 4,9% bị huyết khối tĩnh mạch do nhiệt (EHIT) tại vị trí nối hiển – đùi. Trong tổng số 25 BN EHIT, có 3 thuộc nhóm II, 7 thuộc nhóm II. Tất cả những BN này đều được theo dõi mà không dùng chống đông, kết quả hồi phục hoàn toàn sau 1 – 7 tuần. Có 12 BN bị EHIT nhóm III, trong đó 6 BN tự hồi phục sau 1 tuần, và 6 BN cần điều trị chống đông, với kết quả về bình thường sau 2 – 6 tuần. Có 3 BN bị EHIT nhóm IV, cần điều trị chống đông 6 tuần, và cũng hồi phục hoàn toàn.
Từ kết quả can thiệp nhiệt nội tĩnh mạch 312 tĩnh mạch hiển lớn, Judith C.Linn báo cáo tỷ lệ EHIT là 3,2%. Theo tác giả này, yếu tố làm tăng nguy cơ EHIT là đường kính tĩnh mạch hiển tăng (trên 13mm), và có suy quai tĩnh mạch hiển phối hợp. Tổng kết hơn 4000 trường hợp can thiệp laser nội mạch cho thấy nếu tăng khoảng cách đầu tận sợi đốt tới vị trí đổ vào tĩnh mạch sâu, thì sẽ làm giảm nguy cơ EHIT (1,3% EHIT nếu khoảng cách ≥ 25 mm, so với 2,3%
EHIT khi khoảng cách là 20 mm). Tuy nhiên, một phân tích chi tiết của Rhee SJ. và cộng sự đã xác định đường kính tĩnh mạch hiển, khoảng cách tới vị trí quai, loại can thiệp (RF hay laser), không phải là yếu tố làm tăng nguy cơ EHIT. Theo kết quả phân tích đa biến, giới tính nam và điểm Caprini cao mới là những yếu tố nguy cơ quan trọng nhất.
Phương pháp điều trị và theo dõi EHIT đã thống nhất từ đồng thuận của Diễn đàn tĩnh mạch Hoa Kỳ và Hội Phẫu thuật mạch máu, bao gồm:
- Nhóm I: Không cần điều trị và theo dõi chặt chẽ.
- Nhóm II: Siêu âm kiểm tra hàng tuần, cân nhắc dùng chống ngưng tập tiểu cầu hoặc thuốc chống đông với nhóm nguy cơ
- Nhóm III: Điều trị bằng thuốc chống đông và theo dõi hàng tuần tới khi không còn huyết khối trong tĩnh mạch sâu.
- Nhóm IV: Điều trị bằng thuốc chống đông, và theo dõi hàng tuần, với liều dùng và thời gian điều trị như trong các khuyến cáo về điều trị thuyên tắc huyết khối tĩnh mạch sâu.
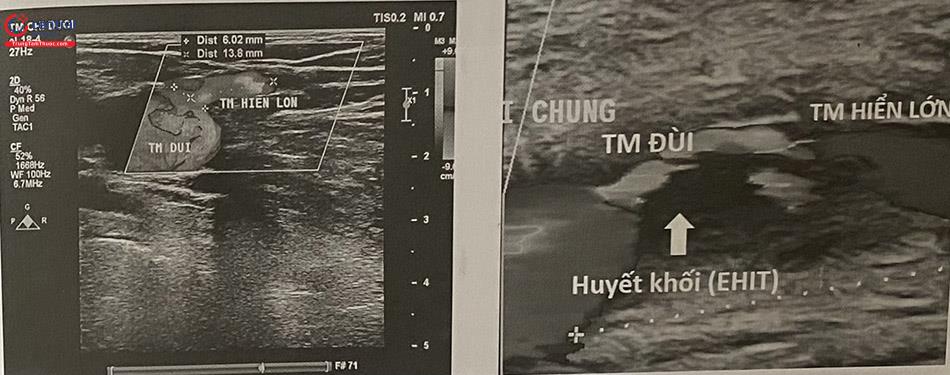
Huyết khối tĩnh mạch nông: có tỷ lệ 0 – 5,2%, được điều trị bằng phương pháp bảo tồn với chườm mát và giảm đau, chống viêm.
Huyết khối tĩnh mạch sâu: hiếm gặp, hầu hết có liên quan đến EHIT, cần được theo dõi chặt chẽ trên siêu âm và điều trị bằng thuốc chống đông.
Tổn thương thần kinh: triệu chứng về thần kinh gặp ở 1 – 7% BN sau điều trị laser. Biểu hiện là cảm giác tê, đau dọc mặt trong cẳng chân, mặt ngoài bàn chân, đôi khi ở quanh gối hay mắt cá, thường tự hết sau 4 – 6 tuần.
Biến chứng liên quan đến kỹ thuật: Tương tự như trong điều trị bằng RF, có thể phân làm 3 nhóm thất bại giải phẫu sau điều trị laser.
4.7 Kết quả can thiệp nhiệt độ nội tĩnh mạch bằng Laser
Kết quả điều trị của laser với bước sóng từ 810 - 980 nm cho thấy tỷ lệ tắc hoàn toàn tĩnh mạch bệnh lý là 95% sau 6 tháng, 93% sau 1 năm và 88,1% sau 2,2 năm. Hiệu quả điều trị bằng laser bước sóng 1470 nm thậm chí còn cao hơn. Pannier là người đầu tiên báo cáo về kết quả điều trị của laser 1470 với tỷ lệ thành công là 100% sau 1 năm. Một số nghiên cứu về sau cũng cho hiệu quả tương tự: 100% sau 6 tháng, 98,6% sau 1 năm. Tổng kết của Viện Tim mạch Việt Nam về những bệnh nhân đầu tiên được can thiệp bằng laser 1470 nm cũng chỉ ra tỷ lệ tĩnh mạch đóng hoàn toàn sau 1 tháng, 3 tháng đều là 100%, với sự cải thiện rõ rệt về triệu chứng lâm sàng.
Tổng hợp 59 nghiên cứu lâm sàng, trong đó có 7 nghiên cứu so sánh trực tiếp giữa laser nội tĩnh mạch và phẫu thuật kinh điển, cho thấy hiệu quả điều trị của cả hai phương pháp là tương đương nhau, không có các biến chứng ngoại ý trầm trọng, nhưng bệnh nhân điều trị laser có tỷ lệ huyết khối tĩnh mạch nông thấp hơn (1,6% so với 7%), ít bị nhiễm trùng, tụ máu hơn là phẫu thuật (0,3% so với 2,4%, 2,3% so với 7% tương ứng).
Bảng 57.6. Tổng hợp kết quả so sánh giữa laser và phẫu thuật kinh điển về hiệu quả điều trị suy tĩnh mạch chi dưới
| NGHIÊN CỨU | THỜI GIAN THEO DÕI | KHÔNG CÒN DÒNG TRÀO NGƯỢC | TÁI PHÁT | ||
|---|---|---|---|---|---|
| Phẫu thuật | Laser | Phẫu thuật | Laser | ||
| Darwood và cộng sự | 12 tháng | 91,7% | 87,8% | 8,3% | 6,1% |
| Medeiros | 3 tháng | 100% | 95% | … | 5,0% |
| Kalteis và cộng sự | 16 tuần | 100% | 100% | … | … |
| Mekako và cộng sự | 12 tuần | … | 95,7% | … | … |
| Rasmussen và cộng sự | 6 tháng | 98% | 94,4% | … | 5,6% |
| Vuylsteke và cộng sự | 9 tháng | … | 94,1% | … | 5,9% |
| Wu và cộng sự | 12 tháng | 94,4% | 95,5% | 5,6% | 4,5% |
Bảng 57.7. Tổng hợp kết quả so sánh giữa laser và phẫu thuật kinh điển về tác dụng ngoại ý sau điều trị suy tĩnh mạch chi dưới
| TÁC DỤNG NGOẠI Ý | PHẪU THUẬT | LASER |
|---|---|---|
| Thuyên tắc động mạch phổi | 0% | 0,1% |
| HKTM sâu | 1,5% | 0,4% |
| HKTM nông | 7% | 1,6% |
| Tổn thương thần kinh | 2,4% | 0,8% |
| Dị cảm | 10% | 4,4% |
| Nhiễm trùng | 2,4% | 0,3% |
| Tụ máu | 7% | 2,3% |
| Bỏng da | … | 0,5% |
| Chảy máu | 0,6% | … |
Chú thích: HKTM: huyết khối tĩnh mạch.
So sánh kết quả điều trị của laser 980 nm và laser 1470 nm: Các tác giả Doganci và Demirkilic chia ngẫu nhiên 60 BN suy tĩnh mạch hiển lớn làm hai nhóm, một nhóm điều trị bằng laser 980 nm và nhóm kia điều trị bằng laser 1470 nm. Kết quả cho thấy nhóm BN điều trị bằng laser 1470 nm đau ít hơn, và sớm quay trở lại sinh hoạt bình thường hơn là nhóm điều trị 980 nm. Tỷ lệ tụ máu hay bầm tím cũng thấp hơn nhóm điều trị laser 980 nm.
So sánh kết quả điều trị của RF và laser: Nghiên cứu Recovery so sánh 46 trường hợp suy tĩnh mạch hiển lớn được điều trị bằng Closure Fast và 41 trường hợp điều trị bằng laser 980 nm. Kết quả cho thấy thời gian thực hiện thủ thuật ở cả hai phương pháp là như nhau (16 phút), với hiệu quả điều trị tương đương (100%). Tuy nhiên, nhóm điều trị bằng laser có tỷ lệ bị đau, viêm và bầm máu lớn hơn (5,3% so với 2,2%). Trong nghiên cứu của Shepherd và cộng sự, ở thời điểm 3 ngày, 10 ngày sau can thiệp, các bệnh nhân điều trị bằng RF ít đau hơn rõ rệt so với các bệnh nhân điều trị bằng laser 980 nm, trong khi hiệu quả lâm sàng và thang điểm đánh giá chất lượng cuộc sống của hai nhóm không có sự khác biệt. Một trong những nguyên nhân lý giải tình trạng trên là do sợi đốt laser với bước sóng 980 nm có công suất lớn, nhiệt năng phát ra ở đầu sợi đốt có thể bị lệch tâm gây thủng tĩnh mạch được điều trị. Việc chuyển sang sử dụng tia laser 1470 nm hấp thụ bởi nước trong thành tĩnh mạch, có thể làm giảm mức năng lượng, đồng thời đạt được hiệu quả cao hơn, do tia laser phát ra đồng tâm, và tỏa tròn ở đầu sợi đốt.
4.8 Theo dõi sau can thiệp
Sau can thiệp laser, quy trình theo dõi bệnh nhân tương tự như trong can thiệp bằng sóng cao tần.
5 Phương pháp can thiệp: Bơm keo sinh học
5.1 Đại cương
Sóng cao tần và laser nội tĩnh mạch là những phương pháp điều trị được lựa chọn đầu tiên cho bệnh suy tĩnh mạch nông chi dưới. Tuy nhiên, các kỹ thuật này yêu cầu phải gây tê quanh tĩnh mạch. Đây là bước mất nhiều thời gian nhất, và theo một số bác sĩ can thiệp, là bước có kỹ thuật khó nhất. Mặt khác, sử dụng kim chọc nhiều lần để gây tê, làm cho không ít bệnh nhân khó chịu và không thể dung nạp được. Các phương pháp can thiệp không nhiệt, không tê đã được phát triển để khắc phục những nhược điểm này, bao gồm: can thiệp bằng keo sinh học (CAE/cyanoacrylate embolization), hóa cơ học (MOCA/ mechanical occlusion chemically assisted ablation), hóa lý học (LAFOS: Laser – assisted Foam Sclerotherapy), và siêu âm hội tụ cường độ cao (HIFU/High Intensity Focused Ultrasound).
Bơm keo sinh học là phương pháp can thiệp dùng chất keo sinh học bơm vào trong lòng tĩnh mạch hiển bệnh lý. Phản ứng sinh học giữa chất keo có tên là Cyanoacrylate adhesive (CA) và các thành phần trong máu xảy ra ngay sau đó gây bít tắc lòng tĩnh mạch được điều trị và dần dần gây xơ hóa tĩnh mạch. Cyanoacrylate adhesive có tên đầy đủ là n-butyl cyanoacrylate, đã được ứng dụng rộng rãi trong y học từ lâu. Từ những năm 1950 người ta đã sử dụng keo sinh học để cầm máu và điều trị các vết thương. Trải qua gần 70 năm, hợp chất này đã được sử dụng rộng rãi ở nhiều chuyên ngành như phẫu thuật mắt, thẩm mỹ, nha khoa … Đặc biệt CA được dùng trong nội soi để cầm máu giãn vỡ tĩnh mạch thực quản với hiệu quả và độ an toàn cao qua theo dõi dài hạn trong 10 năm. CA được sử dụng an toàn trên hàng triệu bệnh nhân, không ghi nhận nguy cơ ung thư trên người (1986 nghiên cứu). Gần đây, ứng dụng mới của CA trong điều trị nội mạch đã mang lại những thành công lớn như điều trị rò típ I, II trong phình tách thành động mạch chủ bụng, suy van tĩnh mạch, hội chứng chảy máu vùng chậu và dị dạng động tĩnh mạch. CA đã được phép sử dụng trong can thiệp nội mạch ở châu Âu trong vài thập niên trở lại đây nhưng ở Hoa Kỳ đến tận năm 2000 mới được FDA phê duyệt chỉ định can thiệp điều trị dị dạng động – tĩnh mạch não. Với các đặc tính vật lý hoàn hảo như độ nhớt lý tưởng, khả năng gây polymer hóa cao, duy trì tác dụng dính mạnh, không cần đeo tất áp lực, CA đã được ứng dụng để điều trị suy tĩnh mạch hiển tại châu Âu, Mỹ, Canada và một số nước châu Á phát triển như Singapore, Hong Kong.
5.2 Chỉ định và chống chỉ định
5.2.1 Chỉ định
Chỉ định điều trị của phương pháp can thiệp không nhiệt, không tê như keo sinh học và MOCA cũng tương tự như chỉ định của can thiệp nhiệt nội tĩnh mạch và phẫu thuật. Đó là các trường hợp suy thân và gốc tĩnh mạch hiển lớn, suy tĩnh mạch hiển nhỏ.
Theo Khuyến cáo của Diễn đàn Tĩnh mạch Hoa Kỳ năm 2017:
Bảng 57.8. Khuyến cáo của Diễn đàn tĩnh mạch Hoa Kỳ về chỉ định can thiệp không nhiệt điều trị suy tĩnh mạch mạn tính
| NỘI DUNG | MỨC KHUYẾN CÁO | MỨC BẰNG CHỨNG |
|---|---|---|
| Keo sinh học và các phương pháp can thiệp không nhiệt, không tê khác được khuyến cáo chỉ định cho bệnh nhân suy tĩnh mạch hiển lớn tầng trên gối, có đường kính dưới 12 mm | I | B |
Can thiệp bằng keo sinh học có thể được chỉ định cho bệnh nhân: – Suy tĩnh mạch hiển nhỏ | II | C |
| Không nên điều trị bằng keo sinh học cho các tĩnh mạch ở ngoài cân, và nông ngay dưới da. | II | C |
Can thiệp bằng phương pháp hóa cơ học (MOCA) có thể được chỉ định cho bệnh nhân: – Suy tĩnh mạch hiển nhỏ có đường kính < 10 mm – Suy tĩnh mạch hiển lớn tầng dưới gối, từ giai đoạn C2 – C6 | II | C |
| Có thể điều trị bằng phương pháp hóa cơ học cho các tĩnh mạch ở ngoài cân, và nông ngay dưới da | II | C |
| Không nên điều trị bằng phương pháp không nhiệt, không tê cho bệnh nhân suy tĩnh mạch hiển có đường kính lớn (trên 12 mm) | II | B |
| Không nên điều trị bằng phương pháp không nhiệt, không tê cho bệnh nhân suy tĩnh mạch đã từng bị huyết khối thân tĩnh mạch, sau đó tái thông | II | C |
Khuyến cáo năm 2015 của Hội Phẫu thuật mạch máu châu Âu còn chưa đề cập đến chỉ định của các phương pháp can thiệp không nhiệt, không gây tê. Nhưng đến năm 2022, các phương pháp trên đã được đưa vào chỉ định điều trị suy tĩnh mạch chi dưới trong bản cập nhật của Khuyến cáo này.
Bảng 57.9. Khuyến cáo của Hội Phẫu thuật mạch máu châu Âu về chỉ định can thiệp không nhiệt trong điều trị suy tĩnh mạch mạn tính
| KHUYẾN CÁO | MỨC ĐỘ KHUYẾN CÁO | MỨC BẰNG CHỨNG |
|---|---|---|
| Bệnh nhân suy tĩnh mạch hiển lớn có chỉ định can thiệp, nếu lựa chọn phương pháp không nhiệt, không gây tê, thì có thể sử dụng keo sinh học | IIa | A |
| IIb | A | |
| IIb | B |
Chỉ định cụ thể trong thực hành lâm sàng của can thiệp không nhiệt, không tê điều trị suy tĩnh mạch hiển lớn hoặc hiển nhỏ như sau:
Bệnh nhân suy tĩnh mạch chi dưới mạn tính:
Có triệu chứng lâm sàng: tê bì, chuột rút, phù …
Phân loại lâm sàng (CEAP) từ C2 →
Siêu âm Doppler phát hiện dòng trào ngược bệnh lý kéo dài trên 500 miligiây trong thân tĩnh mạch hiển.
Đáp ứng kém với điều trị nội
5.2.2 Chống chỉ định
Chống chỉ định của các phương pháp can thiệp không nhiệt, không gây tê cũng tương tự như trong điều trị can thiệp nhiệt nội tĩnh mạch. Ngoài ra, những bệnh nhân được xác định là dị ứng với keo sinh học hay chất tiêm xơ cũng không được chỉ định điều trị bằng các phương pháp này.
5.3 Dụng cụ can thiệp
Hiện nay có hai hệ thống bơm keo sinh học đã được FDA của Hoa Kỳ cấp phép để điều trị suy tĩnh mạch chi dưới là Venaseal (Metronic, Minneapolis, Minnesota, USA) và VariClose (Biolas Health Inc., Ankara, Turkey).
CA có tác dụng như là một tác nhân gây phản ứng viêm cấp trong thành mạch và mô xung quanh. Khi tiếp xúc với các ion như nội mạc tế bào máu hoặc plasma, chất dính này bị polymer hóa. Sự polymer hóa này phá hủy nội mạc mạch máu và gây ra một tình trạng đáp ứng miễn dịch, sự tái hấp thu của các nút polymer dần dần xuất hiện khi polymer hóa hoàn toàn. Sau khoảng 1 tháng thì tiến triển thành dạng u hạt là các tế bào ngoại lai khổng lồ và cuối cùng là xơ hóa.
Cấu tạo của hệ thống Venaseal gồm một ống thông 4Fr màu trắng để bơm chất keo sinh học vào trong lòng tĩnh mạch, ống thông này được gắn với 1 xilanh 3 ml chứa chất keo, xilanh được lắp vào súng phân phối CE bằng cách bóp cò để đẩy pittong sau mỗi lần bóp cò. Hỗ trợ đưa được ống thông vào tĩnh mạch điều trị là một hệ thống catheter 7Fr (introducer sheath/ introducer) và J wire 0,035 inch.
Cấu tạo của hệ thống VariClose tương tự như hệ thống Venaseal nhưng chất keo cyanoacrylate của hệ thống này có tốc độ polymer hoá nhanh hơn do vậy khoảng cách của đầu ống thông có thể đặt cách quai tĩnh mạch hiển là 3 cm và kéo ngược 2 cm sau mỗi lần bơm 0,3 ml.
Bảng 57.10. Bảng so sánh hai hệ thống Venaseal và VariClose
| TÊN HỆ THỐNG | VENASEAL | VARICLOSE |
|---|---|---|
| Tên hệ thống | VenaSeal | VariClose |
| Quốc gia sản xuất | Mỹ | Thổ Nhĩ Kỳ |
| Bộ luồn ống thông | Có | Có |
| Chất keo | Cyanoacrylate | Cyanoacrylate |
| Kết nối ống thông với súng | Có | Có |
| Kéo ngược ống thông | Từng đoạn | Liên tục |
| Ép bên ngoài | Từng đoạn | Liên tục |
| Tốc độ polymer hoá | Chậm | Nhanh |
| Khoảng cách từ đầu ống thông đến quai tĩnh mạch hiển | 5 cm | 3 cm |
| Đeo tất áp lực sau thủ thuật | Không | Không |
Bảng 57.11. So sánh chất keo cyanoacrylate của hai hệ thống VenaSeal và VariClose
| TÊN HỆ THỐNG | VENASEAL | VARICLOSE |
|---|---|---|
| Màu | Trắng trong | Xanh |
| Đặc tính | Nhớt | Loãng |
| Tốc độ polymer hoá | Chậm | Nhanh |
| Đặc tính sau polymer hoá | Mềm | Cứng |
5.4 Quy trình can thiệp bằng keo sinh học
5.4.1 Chuẩn bị bệnh nhân
Quy trình chuẩn bị và siêu âm đánh dấu trước can thiệp cũng tương tự các phương pháp khác.
5.4.2 Chuẩn bị dụng cụ
Máy siêu âm được trang bị đầu dò siêu âm Doppler mạch máu 7,5 MHz.
Bộ súng bơm keo sinh học.
Thuốc: Lidocain 1-2%. Thuốc thiết yếu trong cấp cứu.
Kim chọc dò 18G, 21G, xy lanh 5ml, 10
Introducer và sheath 7Fr/11 cm – 8Fr/11
Bao vô khuẩn bọc đầu dò siêu âm, và bọc bàn điều khiển máy siêu âm.
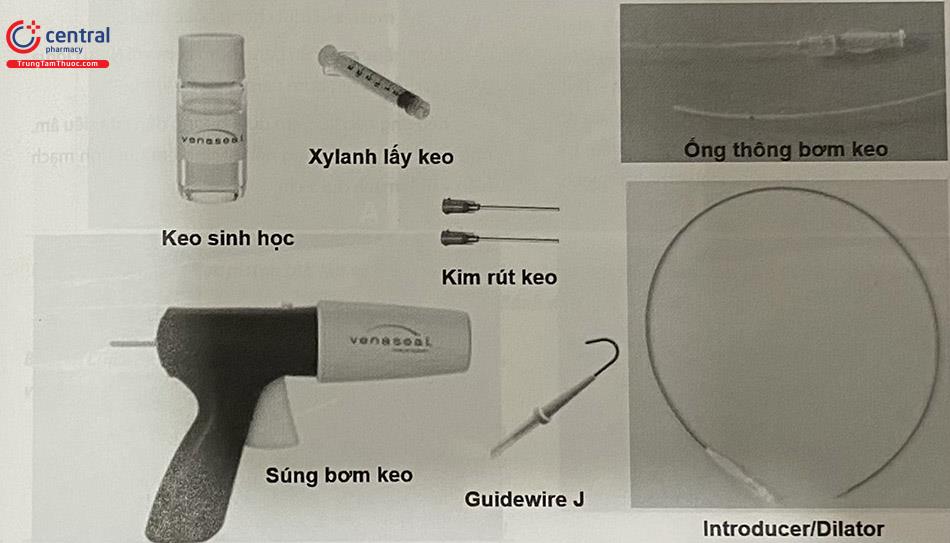
5.4.3 Các bước can thiệp bằng keo sinh học
Bệnh nhân nằm lên bàn can thiệp: sát trùng và bộc lộ toàn bộ bên chân can thiệp từ bẹn tới mắt cá chân. Phủ săng bảo vệ các phần cơ thể còn lại, và vùng bàn chân.
5.4.3.1 Bước 1: Chọc mạch và mở đường vào tĩnh mạch
Tương tự như phương pháp can thiệp nhiệt nội tĩnh mạch bằng RF hay laser. Chọc mạch và luồn sheath theo phương pháp Seldinger cải tiến.
Luồn J wire qua sheath đến tận vị trí nối giữa tĩnh mạch hiển – tĩnh mạch sâu dưới hướng dẫn của siêu âm, sau đó rút sheath ra.
Trong lúc này, người phụ mở bộ bơm keo sinh học, và xếp lên bàn can thiệp, chú ý phần “khô” hoàn toàn không dính nước, là vị trí đặt bộ bơm keo, lọ keo.
5.4.3.2 Bước 2: Luồn ống dẫn (introducer) lên vị trí quy định
Lắp ống nong (dilator) vào trong ống dẫn (introducer) rồi luồn qua dây dẫn (J wire) vào trong lòng tĩnh mạch hiển đến tận vị trí nối tĩnh mạch hiển -tĩnh mạch sâu. Dùng siêu âm kiểm tra vị trí chính xác, sau đó rút cả ống nong và dây dẫn ra khỏi tĩnh mạch, kiểm tra mốc đánh dấu chiều dài của ống dẫn tại vị trí chọc mạch, chính là chiều dài đoạn tĩnh mạch bệnh lý, tính từ vị trí nối với tĩnh mạch sâu (đùi chung hoặc khoeo).
- Bơm tráng ống dẫn bằng bơm tiêm với Natri clorua 0,9% tại chỗ, rồi giữ bơm tiêm nguyên vị trí.
- Kéo ống dẫn lại 5 cm dưới hướng dẫn của siêu âm, như vậy đầu tận của ống dẫn cách điểm nối tĩnh mạch hiển – tĩnh mạch đùi 5

5.4.3.3 Bước 3: Lắp hệ thống bơm keo sinh học
Dùng kim và bơm tiêm trong bộ bơm keo, hút toàn bộ chất keo trong lọ vào trong bơm tiêm.
Đuổi khí, tháo kim ra khỏi bơm tiêm và gắn bơm tiêm đã lấy keo vào ống thông bơm
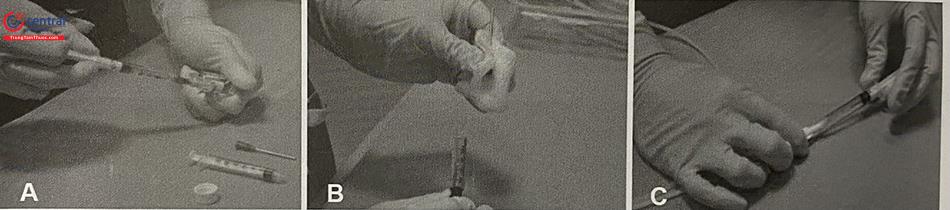
Chuẩn bị súng bơm keo: Ấn vào nút trắng phía đuôi súng và kéo ngược hết cỡ piston về phía sau. Lắp bơm tiêm đã kết nối với ống thông vào súng, xoay 90otheo chiều kim đồng hồ để cố định. Bóp cò súng và giữ để đẩy keo vào trong ống thông lên đến điểm đánh dấu quy ước.
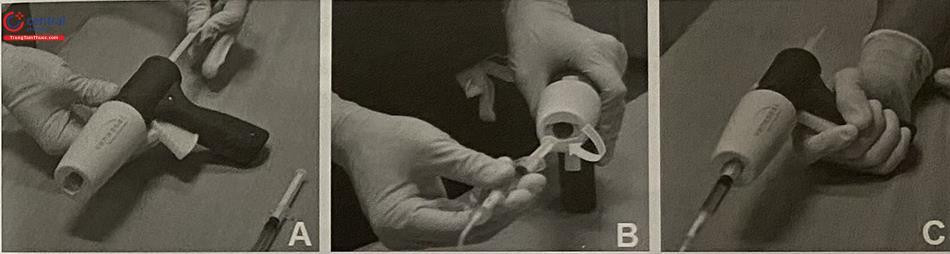
5.4.3.4 Bước 4: Luồn ống thông bơm keo vào lòng tĩnh mạch đến vị trí quy ước
Tháo bơm tiêm ra khỏi đuôi ống dẫn, nhanh chóng luồn ống thông vào trong ống dẫn đến điểm đánh dấu trên ống thông (một tay giữ cố định đuôi của ống dẫn, một tay luồn nhẹ nhàng ống thông từng đoạn, không được luồn quá nhanh gây gập ống thông).
Giữ cố định ống thông, rút ống dẫn ra 5 cm và khóa vào ống thông. Như vậy đầu của ống thông sẽ cách vị trí nối TM hiển – TM sâu 10 cm, còn đầu ống thông cách vị trí này 5 Kiểm tra lại bằng siêu âm.
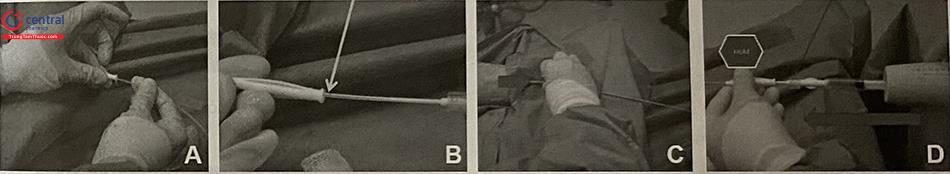
5.4.3.5 Bước 5: Bơm keo kết hợp ấn tĩnh mạch
Đặt đầu dò siêu âm cách quai tĩnh mạch 3 cm, ấn và giữ để làm xẹp phần đầu của Bóp và giữ cò súng bơm keo 3 giây, để bơm đủ 0,1 ml keo vào lòng tĩnh mạch, rút tiếp ống thông ra 1 cm. Bóp và giữ cò súng bơm keo 3 giây, bơm tiếp 0,1 ml keo vào lòng tĩnh mạch, rồi lập tức rút ống thông ra 3 cm, ấn và giữ đầu dò siêu âm tối thiểu trong 3 phút.
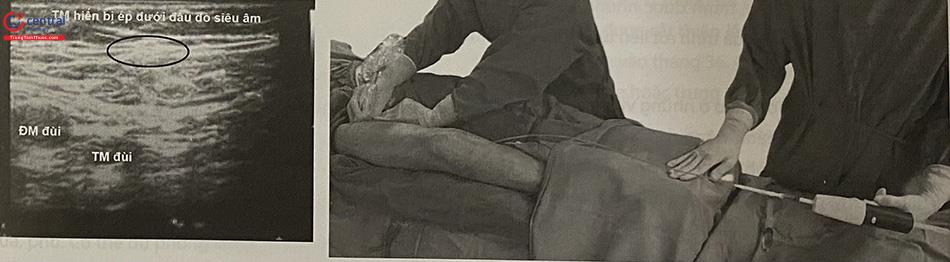
Sau thời gian đó, kiểm tra lại đầu ống thông bằng siêu âm, tiếp tục quy trình bóp, giữ cò súng 3 giây, bơm 0,1 ml keo vào lòng mạch, rút catheter 3 cm, ấn và giữ đầu dò siêu âm tối thiểu 30 giây. Tiếp tục điều trị toàn bộ tĩnh mạch tới khi đầu ống thông cách điểm chọc mạch 5cm thì bơm keo lần cuối, dùng tay ép và rút nhanh đoạn ống thông còn lại (5 cm) ra khỏi tĩnh mạch, ép tiếp đến khi cầm máu. Dùng siêu âm kiểm tra lại toàn bộ đoạn tĩnh mạch được điều trị.

5.4.4 Một số chú ý về mặt kỹ thuật
Đảm bảo đúng khoảng cách của ống dẫn (cách 10 cm), và khoảng cách của ống thông bơm keo (cách 5 cm) với vị trí nối của tĩnh mạch hiển và tĩnh mạch sâu có vai trò quan trọng về mặt kỹ thuật để tránh nguy cơ bơm keo vào trong lòng tĩnh mạch sâu gây ra huyết khối tĩnh mạch do keo (EGIT/Endovenous glue-induced throm- bosis).
Đảm bảo ép đúng 3 phút sau hai lần bơm keo đầu tiên để bảo vệ và cô lập hoàn toàn tĩnh mạch hiển lớn hoặc hiển nhỏ bệnh lý với hệ tĩnh mạch sâu.
Bơm keo sinh học với dụng cụ Venaseal được thực hiện từng đoạn, giống như can thiệp bằng RF, vì vậy keo được phân phối đều, tránh được những hạn chế về kỹ thuật liên quan đến quá trình rút liên tục không đều như phương pháp
Nên tránh bơm keo ở những vị trí đổ vào thân tĩnh mạch hiển của nhánh nông ngoài cân, hoặc vị trí tĩnh mạch xuyên nối tĩnh mạch hiển với tĩnh mạch sâu, để giảm nguy cơ CA gây viêm tĩnh mạch nông, hay gây huyết khối tĩnh mạch sâu.
5.5 Tiêu chí đánh giá thành công
Can thiệp không nhiệt, không gây tê được đánh giá là thành công khi:
Quá trình can thiệp diễn ra thuận lợi, không xảy ra biến chứng.
Đoạn tĩnh mạch hiển bệnh lý được đóng hoàn toàn ngay sau can thiệp: Sau bơm keo, kiểm tra bằng siêu âm có thể thấy tĩnh mạch co nhỏ mặc dù không ép, và không còn dòng chảy trong lòng tĩnh mạch đã được can thiệp.
Bệnh nhân có thể đứng dậy và đi lại ngay sau khi can thiệp, trừ một số trường hợp đặc biệt.
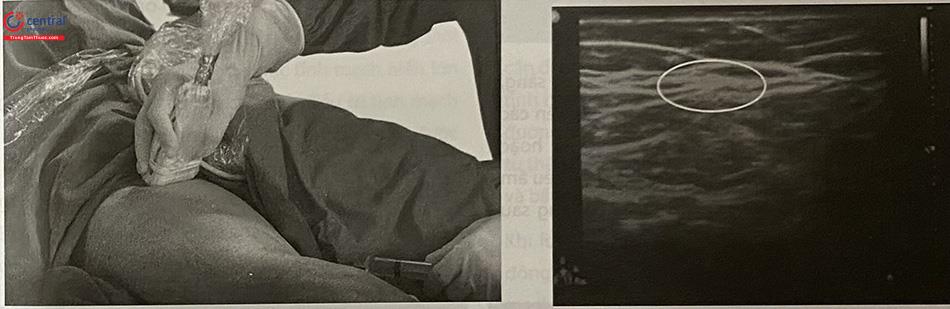
5.6 Biến chứng và xử trí
Tác dụng không mong muốn phổ biến nhất là phản ứng viêm tại chỗ của da và tổ chức dưới da trên đường đi của tĩnh mạch được điều trị, trong hầu hết các nghiên cứu được mô tả là “viêm tĩnh mạch” (0,5% – 20%), có khả năng liên quan đến phản ứng quá mẫn tại chỗ với CA. Phần lớn các trường hợp là thoáng qua, lành tính và tự khỏi. Trong nghiên cứu gần đây, tỷ lệ phản ứng quá mẫn với CA là 6% – 7% (trong đó mức độ nhẹ chiếm 4,2%, vừa chiếm 1,3%, và nặng chiếm 0,3%). Quá mẫn với CA nên được coi là chống chỉ định đối với điều trị bằng keo sinh học. Mặc dù số lượng lớn bệnh nhân được thực hiện thủ thuật trên toàn thế giới, chỉ có một số trường hợp u hạt muộn đã được báo cáo. Cần theo dõi đầy đủ tiếp những ca bệnh hiếm gặp này, vì các phản ứng bất lợi muộn có thể xảy ra thậm chí lên đến một năm sau thủ thuật. Các biến chứng khác bao gồm huyết khối tĩnh mạch sâu (0% – 3,5%), tiêm cyanoacrylate vào tổ chức dưới da hoặc huyết khối do keo nội mạc gây ra (1,4% - 5,8%), tăng sắc tố (1,6% – 3%), nhiễm trùng vị trí can thiệp hoặc viêm mô tế bào (1,4% – 3%), tụ máu (1,4% – 1,6%), tổn thương thần kinh hoặc dị cảm (0% – 2%).
Huyết khối tĩnh mạch sâu do keo (EGIT) tương tự như EHIT, thường nhẹ và có thể tự thoái triển. Trong một tổng kết từ 191 bệnh nhân được điều trị bằng keo sinh học, có 11 bệnh nhân (5,8%) bị EGIT, trong đó típ I là 63,6% và típ II là 36,4%.
Triệu chứng của viêm tĩnh mạch bao gồm đau tại chỗ, đỏ da, ngứa, phù. Có thể dự phòng bằng đi bộ sớm hoặc đeo tất áp lực sớm. Nguyên nhân viêm tắc tĩnh mạch nông có thể do tĩnh mạch được can thiệp gây bịt đường vào hoặc đường ra của các nhánh tĩnh mạch nông lớn từ thân tĩnh mạch hiển. Vì vậy, có thể phối hợp lấy bỏ các nhánh này ngay sau khi điều trị keo sinh học.
5.7 Kết quả can thiệp bơm keo sinh học
Đã có nhiều nghiên cứu về phương pháp bơm keo sinh học như Feasibility, eSCOPE, VeClose… đều báo cáo tỷ lệ dính hoàn toàn tĩnh mạch hiển là rất cao: 98,9% sau 3 tháng và 98,9% sau 6 tháng, so với RF lần lượt là 95,4% và 94,3% (p < 0,001). Kết quả theo dõi dài hạn trong nghiên cứu VeClose mở rộng chỉ ra tỷ lệ tắc tĩnh mạch hiển lớn sau 5 năm là 93,6%.
Trong nghiên cứu của Almeida JI và cộng sự, các bệnh nhân suy tĩnh mạch sau can thiệp bằng keo sinh học được theo dõi liên tục 3 năm. Ở tháng thứ 36, có 29 bệnh nhân được theo dõi. Các tĩnh mạch được điều trị đã tắc hoàn toàn được xác định bằng siêu âm Doppler ở tất cả các đối tượng, có hai bệnh nhân có biểu hiện tái thông ở tháng thứ 1 và tháng thứ 3. Phân tích Kaplan-Meier cho thấy tỷ lệ tắc mạch ở tháng thứ 36 là 94,7% (khoảng tin cậy 95%, 87,9% – 100%). Thang điểm đánh giá mức độ nặng lâm sàng VCSS được cải thiện rõ rệt ở tháng 36 (P <0,0001). Đau, phù và giãn tĩnh mạch được cải thiện lần lượt ở 75,9%, 62,1% và 41,4% bệnh nhân vào tháng 36. Các tác dụng ngoại ý rất ít gặp, chỉ ở mức nhẹ hoặc trung bình.
Nghiên cứu WAVES đã chứng minh thêm về hiệu quả của điều trị bằng keo sinh học cho tĩnh mạch hiển nhỏ, tĩnh mạch hiển phụ, hoặc tĩnh mạch hiển lớn có kích thước lớn (đường kính tối đa lên đến 20 mm), với tỷ lệ gây tắc là 98%, mặc dù theo một nghiên cứu khác, đường kính tĩnh mạch hiển lớn trung bình > 8 mm có giá trị dự báo sự tái lập lại dòng chảy (p < 0,021).
5.8 Theo dõi sau can thiệp
Đánh giá kết quả điều trị dựa trên triệu chứng lâm sàng, giảm cảm giác đau, tê mỏi, khó chịu, phù… dựa trên các thang điểm VCSS (Venous Clinical Severity score) hoặc AVVQ (Aberdeen Varicose Veins Questionnaire) và siêu âm Doppler có thể tiến hành sau 10 ngày hoặc 1 tháng sau điều trị.
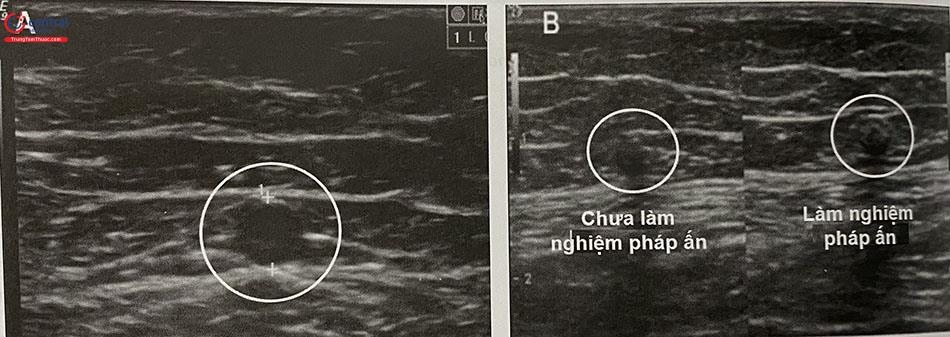
6 Phương pháp can thiệp: Hoá cơ học
6.1 Đại cương
Can thiệp bằng hóa cơ học là một phương pháp điều trị “lai” (hybride) với tác động hóa học của các chất tiêm xơ (STS/sodium tetradecyl sulfate hoặc POL/polidocanol) lên thành tĩnh mạch, được củng cố bằng tác động cơ học, gây xước thành tĩnh mạch làm tăng hiệu quả của hóa chất tiêm xơ. Đây cũng là phương pháp can thiệp không nhiệt, và không cần gây tê làm mát tĩnh mạch, do đó khắc phục những nhược điểm của laser hay sóng cao tần.
Phương pháp can thiệp hoá cơ học được Michael Tal và John Marano giới thiệu lần đầu, sử dụng hệ thống ClariVein là bộ dụng cụ can thiệp đầu tiên không dùng nhiệt và không cần gây tê và được FDA của Hoa Kỳ cấp phép chỉ định điều trị suy tĩnh mạch chi dưới từ năm 2010.
6.2 Chỉ định và chống chỉ định
6.2.1 Chỉ định
Xem trong phần chỉ định của phương pháp bơm keo sinh học. Ưu điểm của hóa cơ học (MOCA) là có thể điều trị các nhánh tĩnh mạch ở nông ngoài cân.
6.2.2 Chống chỉ định
Chống chỉ định tương tự như các phương pháp can thiệp nhiệt và không nhiệt khác, ngoài ra còn có các chống chỉ định liên quan đến hóa chất tiêm xơ (trong phần phương pháp tiêm xơ).
6.3 Dụng cụ can thiệp
Thiết bị Clarivein có 2 thành phần: 1 động cơ cầm tay chạy bằng pin 9V và 1 ống thông dài 45 hoặc 65 cm. Thời gian điều trị được tính toán từ các vạch chia độ trên ống thông. Cả hai loại ống thông dài 65 cm và 45 cm đều được sử dụng tùy thuộc vào độ dài tĩnh mạch cần điều trị. Ống thông 65 cm thường được sử dụng để điều trị đồng thời tĩnh mạch hiển lớn và hiển nhỏ, hoặc tĩnh mạch hiển lớn dài. Ống thông 45 cm thường chỉ định điều trị tĩnh mạch hiển nhỏ. Bên trong ống thông có 1 sợi dây kim loại được nối từ động cơ đến đầu ngoài của ống thông, đầu dây kim loại gắn với 1 quả bóng kim loại. Kích thước của đầu xoay là 6,5 mm. Một bơm tiêm chứa chất gây xơ (STS hoặc POL) được gắn với tay cầm.
Khi quả bóng kim loại quay thông qua điều khiển, bộ động cơ sẽ gây tổn thương nội mạc lòng tĩnh mạch, đồng thời đầu ống thông sẽ bơm dung dịch tạo bọt gây xơ thấm sâu trực tiếp vào lớp nội mạc trong lòng tĩnh mạch gây ra phản ứng viêm và làm tắc lòng tĩnh mạch do xơ hoá sau đó. Dung dịch tạo bọt được chứa trong 1 bơm tiêm gắn với bộ động cơ. Chất làm bọt thường được sử dụng là STS 2,0%. Bọt được tạo ra bằng cách trộn các thể tích bằng nhau của 1% STS và 3% STS hoặc pha loãng 4 ml 3% STS với 2 ml nước muối bình thường. Thể tích chất pha loãng được sử dụng là 0,1– 0,2 ml cho mỗi 1 cm kéo ngược, xác định bằng đường kính tĩnh mạch và tổng chiều dài đoạn tĩnh mạch cần điều trị, theo hướng dẫn của nhà sản xuất. Đường kính tĩnh mạch được xác định bằng phép đo siêu âm Doppler đường kính ngang lớn nhất của tĩnh mạch được điều trị, ở tư thế nằm ngửa, không bao gồm 2 cm tĩnh mạch đầu tiên và bất kỳ nhánh tĩnh mạch nào.
Khi lớp nội mạc bị tổn thương, dung dịch gây xơ sẽ tác động vào dưới lớp nội mạc này và gây tắc hoàn toàn lòng mạch. Đầu của dụng cụ có 1 thiết bị quay với tốc độ 3000 - 3500 vòng/phút, đặt cách quai tĩnh mạch hiển lớn 2 cm, ngoài tác dụng gây tổn thương lớp nội mạc còn gây co thắt tĩnh mạch để chất gây xơ có thể lấp đầy lòng tĩnh mạch, làm tăng cường hiệu quả của hóa chất tiêm xơ.
Trong khi kéo ống thông ra khỏi lòng mạch thì quá trình gây tổn thương lớp nội mạc và bơm dung dịch gây xơ tạo bọt được thực hiện song song, cho phép chất tiêm xơ tiếp xúc sâu vào dưới lớp nội mạc.
6.4 Quy trình can thiệp
Tương tự như các phương pháp khác.
6.4.1 Chuẩn bị dụng cụ
Tương tự như các phương pháp khác, với bộ dụng cụ Clarivein, và thuốc tiêm xơ.
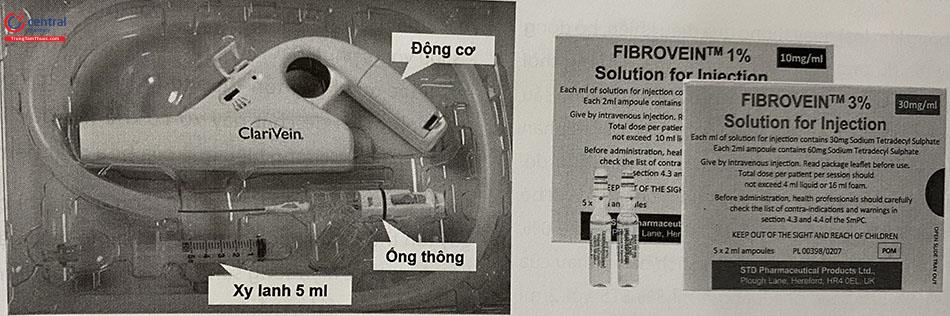
6.4.2 Các bước can thiệp bằng MOCA
Trong can thiệp tĩnh mạch hiển lớn, bệnh nhân được yêu cầu nằm ngửa với một túi cát dưới đầu gối để tăng cường khả năng tiếp cận tĩnh mạch. Với tĩnh mạch hiển nhỏ, bệnh nhân ở tư thế nằm nghiêng hoặc nằm nghiêng với bàn chân buông thõng ra khỏi mép bàn mổ để cho phép gập bàn chân và tiếp cận tĩnh mạch qua da dễ dàng hơn.
6.4.2.1 Bước 1: Chọc mạch và mở đường vào tĩnh mạch
- Tương tự như phương pháp can thiệp nhiệt khác: chọc mạch và luồn sheath 4Fr theo phương pháp Seldinger cải tiến dưới hướng dẫn của siêu âm.
- Người phụ mở bộ Clarivein, và chuẩn bị hóa chất tiêm xơ dạng bọt theo tỷ lệ quy ước.
6.4.2.2 Bước 2: Luồn ống thông lên vị trí quy định
- Luồn đầu ống thông ClariVein qua sheath vào trong lòng tĩnh mạch đến tận vị trí nối tĩnh mạch hiển – tĩnh mạch sâu.
- Kéo ống thông lại để đầu tận của ống thông cách vị trí này 20 mm.
- Lắp bộ phận động cơ và bơm tiêm chứa chất gây xơ vào ống thông.
- Thể tích chất gây xơ được tính theo chiều dài và đường kính của tĩnh mạch được điều trị (tính theo bảng có sẵn): Tĩnh mạch hiển lớn: 8 – 10 ml chất gây xơ; Tĩnh mạch hiển nhỏ: 4 – 5 ml chất gây xơ
6.4.2.3 Bước 3: Khởi động động cơ, bắt đầu quá trình điều trị
- Cho đầu quay hoạt động trong 3 giây và kéo ngược ống thông lại 1 cm để gây co thắt tĩnh mạch, sau đó mới bắt đầu bơm chất gây xơ (cách quai 3 cm) để tránh cho chất gây xơ tràn vào tĩnh mạch sâu.
- Sau khi đầu quay được rút lại 1 cm và thuốc được bơm thì bệnh nhân cảm nhận được sự rung động của đầu
- Tốc độ kéo ngược ống thông luôn duy trì với tốc độ 1,5 mm/s và chất gây xơ được bơm liên tục hoặc được rút đều đặn 10 mm sau mỗi 8 giây.
- Nạp lại chất gây xơ cho bơm tiêm nếu hết.
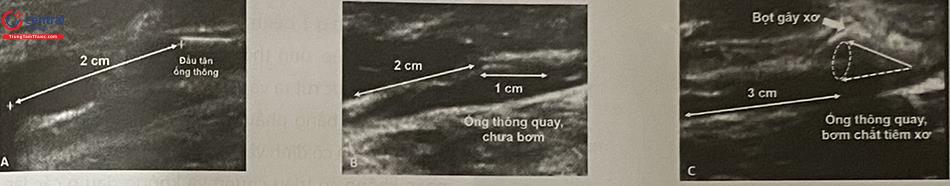

6.4.2.4 Bước 4: Kết thúc điều trị
Sau khi quá trình bơm thuốc hoàn thành thì vuốt dọc theo tĩnh mạch để tránh chất gây xơ lan vào tĩnh mạch sâu.
Đeo tất áp lực cho bệnh nhân.
Kiểm tra lại bằng siêu âm xác nhận sự toàn vẹn của hệ thống tĩnh mạch sâu, bằng cách ép đầu dò siêu âm vào hệ tĩnh mạch sâu. Bàn chân bên can thiệp được đẩy về phía mu chân vài lần để giảm tình trạng ứ đọng tĩnh mạch sâu vào cuối thủ thuật.
Phối hợp các thủ thuật lấy bỏ các nhánh tĩnh mạch nông đồng thời nếu cần thiết.
6.4.3 Một số chú ý về mặt kỹ thuật
Tốc độ rút ống thông quan trọng hơn là số lượng thuốc gây xơ được bơm vào. Hầu hết thất bại về mặt kỹ thuật là do bác sĩ can thiệp kéo quá nhanh khiến bề mặt thành tĩnh mạch không đủ thời gian tiếp xúc với chất gây xơ. Tốt nhất là kéo chậm đúng theo thời gian đã khuyến cáo. Thuốc gây xơ được bơm vào nhiều cũng không ảnh hưởng lớn đến kết quả điều trị. Trong một nghiên cứu, người ta đã bơm tổng cộng 12 ml chất gây xơ 1,5% vào trong tĩnh mạch bệnh lý, mà không tính đến chiều dài khác nhau giữa các tĩnh mạch. Kết quả gây tắc là 96%, mà không có biến chứng huyết khối tĩnh mạch hay tổn thương da, thần kinh nào.
Xác định vị trí đầu tận ống thông trước khi điều trị bằng siêu âm. Nếu đường kính tĩnh mạch > 8 – 10 mm thì có thể kết hợp sử dụng đầu dò siêu âm ép thêm từ bên ngoài để hiệu quả điều trị tốt hơn nhưng không được ép liên tục hoặc ép mạnh quá sẽ làm đầu ống thông trong lúc quay bị kẹt trong lòng tĩnh mạch.
6.5 Tiêu chí thành công
Tiêu chí thành công của phương pháp hóa cơ học tương tự như các phương pháp khác. Tuy nhiên, khác với can thiệp nhiệt, khi kiểm tra bằng siêu âm ngay sau khi điều trị MOCA, mặc dù tĩnh mạch đã tắc hoàn toàn, kích thước tĩnh mạch trên siêu âm 2D vẫn giãn, sau 3-6 tháng mới co lại. Vì vậy, cần sử dụng siêu âm Doppler màu để xác định không còn dòng chảy trong lòng tĩnh mạch.
Kích thước tĩnh mạch không đổi, nhưng không còn tín hiệu dòng chảy trên siêu âm Doppler màu.
6.6 Biến chứng và xửa trí
Phương pháp này không có các biến chứng nặng như huyết khối tĩnh mạch sâu, thuyên tắc phổi, nhưng có một vài biến chứng nhẹ như bầm tím, viêm tắc tĩnh mạch nông hoặc tụ máu tại vị trí chọc mạch.
Thần kinh bắp chân có thể bị tổn thương khi can thiệp tĩnh mạch hiển nhỏ, do nằm quá sát tĩnh mạch, tuy nhiên nguy cơ bị biến chứng này rất thấp (0,2% theo Dermody).
Trong một báo cáo lâm sàng với 449 bệnh nhân sau can thiệp MOCA, tỷ lệ viêm tắc tĩnh mạch là 2% (12/558). Một nghiên cứu khác trên 117 bệnh nhân, so sánh MOCA và RF chỉ ra 3% (2/59) bệnh nhân sau can thiệp RF bị viêm tắc tĩnh mạch, trong khi không gặp trường hợp nào ở nhóm điều trị bằng phương pháp hóa cơ học (0/60).
Đau và ban đỏ được ghi nhận ở 1% (6/558) chi trong loạt trường hợp 449 bệnh nhân sau can thiệp MOCA. Cũng trong nghiên cứu này, có 1 trường hợp bị áp xe tại vị trí chọc dò. Cứng và đau tại chỗ tiêm được báo cáo ở 18% (13/73) chân trong loạt trường hợp 63 bệnh nhân.
Tụ máu tại vị trí chọc mạch gặp ở 1 bệnh nhân trong trong tổng số 449 bệnh nhân. Trong một nghiên cứu so sánh không ngẫu nhiên ở 68 bệnh nhân điều trị bằng RF hoặc MOCA, tụ máu được báo cáo ở 6% (2/34) bệnh nhân được điều trị bằng MOCA và 12% (4/34) bệnh nhân được điều trị bằng phương pháp RF (p = 0,67). Tỷ lệ rối loạn sắc tố da là tương đương nhau (9%) ở cả hai nhóm điều trị bằng MOCA và RF.
Biến chứng tách ngược dòng của tĩnh mạch hiển nhỏ đã được báo cáo ở 1 bệnh nhân can thiệp MOCA. Trong quá trình can thiệp, ống thông bị kẹt và động cơ bị tắt. Ống thông đã được rút ra và toàn bộ tĩnh mạch hiển nhỏ cũng được rút bỏ bằng phẫu thuật. Đầu của ống thông được tìm thấy dính cố định vào một nhánh nhỏ bị vôi hóa. Bệnh nhân không có triệu chứng và không đau ở các lần theo dõi 6 tuần và 6 tháng, không có tái phát, không có dấu hiệu tái thông mạch và không có tổn thương thần kinh.
6.7 Kết quả can thiệp hoá cơ học
Báo cáo tổng hợp từ 16 nghiên cứu lâm sàng với hơn 60.000 bệnh nhân được can thiệp bằng dụng cụ ClariVein™ đã cho thấy tỷ lệ thành công của phương pháp này đạt trên 90% và có sự cải thiện rõ rệt chất lượng cuộc sống sau 2 năm theo dõi. Tỷ lệ tắc tĩnh mạch hiển nhỏ sau can thiệp hóa cơ học trong nghiên cứu của Boersma cũng đạt 94% qua theo dõi 12 tháng, không thấy có tổn thương thần kinh. Boersma và cộng sự đã báo cáo kết quả điều trị suy tĩnh mạch hiển nhỏ bằng MOCA sau 1 năm tỉ lệ tắc là 94%, không có tổn thương thần kinh. Ưu điểm của các phương pháp can thiệp không nhiệt, không gây tê là an toàn, hầu như không có nguy cơ gây tổn thương thần kinh khi điều trị tầng dưới gối. Những trường hợp suy tĩnh mạch giai đoạn C6 với dòng trào ngược đến tận cổ chân, có thể kèm theo loét hoặc xơ mỡ, sẽ rất khó khăn nếu lựa chọn phương pháp can thiệp nhiệt và gây tê quanh tĩnh mạch. Kết quả can thiệp thành công suy tĩnh mạch hiển nhỏ giai đoạn C6 bằng MOCA cũng được ghi nhận trong nghiên cứu của Moore và cộng sự.
So sánh phương pháp hóa cơ học với can thiệp nhiệt Nghiên cứu MARADONA phân nhóm ngẫu nhiên 213 bệnh nhân điều trị bằng MOCA hoặc RF, hiệu quả lâm sàng sau 1 và 2 năm tương tự nhau giữa hai nhóm. Nhóm điều trị bằng MOCA có điểm đau thấp hơn, nhưng số lượng bệnh nhân bị rối loạn sắc tố da cao hơn (7 so với 2 bệnh nhân). Trong nghiên cứu LAMA, 150 bệnh nhân được phân nhóm ngẫu nhiên điều trị bằng MOCA hoặc laser, nhóm bệnh nhân điều trị MOCA có điểm đau trong can thiệp thấp hơn. HIệu quả gây tắc tĩnh mạch trên siêu âm của nhóm MOCA thấp hơn (77% so với 91%), nhưng sự cải thiện triệu chứng lâm sàng và thang điểm đánh giá chất lượng cuộc sống của cả hai nhóm là tương tự nhau.
6.8 Theo dõi sau can thiệp
Sau thủ thuật bệnh nhân có thể tự đứng dậy, sau đó có thể làm thủ tục ra viện ngay trong ngày. Tất chun hoặc băng ép có chiều dài đầy đủ được áp dụng cho (các) chi được điều trị từ bàn chân đến tận nếp lằn bẹn. Sau đó, bệnh nhân được khuyên nên tập thể dục nhẹ nhàng (3 lần đi bộ 15 phút trong cùng một ngày). Băng được tháo ra sau 24 giờ và chỉ nên đeo tất dài đến đùi trong thời gian một tuần vào ban ngày.
Đánh giá kết quả điều trị dựa trên triệu chứng lâm sàng, giảm cảm giác đau, tê mỏi, khó chịu, phù… dựa trên các thang điểm VCSS (Venous Clinical Severity score) hoặc AVVQ (Aberdeen Varicose Veins Questionnaire) và siêu âm Doppler.
7 Một số phương pháp can thiệp khác
7.1 Can thiệp bằng xung hơi nước
Nguyên tắc của phương pháp can thiệp nhiệt này là sử dụng nhiệt tiềm ẩn của các xung hơi nước, khi ngưng tụ, giải phóng năng lượng tích trữ trong quá trình chuyển từ nước sang dạng hơi, làm co thắt lòng tĩnh mạch.
Trang thiết bị: Máy Vbox® Hybrid (2015) kết hợp điều trị thân tĩnh mạch hiển bị suy bằng sóng cao tần và điều trị các nhánh nông bằng xung hơi nước.
Kết quả nghiên cứu: Trong một nghiên cứu đa trung tâm, (bốn trung tâm của Pháp), Milleret báo cáo tỷ lệ tắc hoàn toàn tĩnh mạch hiển là 96% sau 6 tháng, tác dụng ngoại ý và đau sau can thiệp thấp. Nghiên cứu đối chứng ngẫu nhiên với 117 chi được điều trị bằng hơi nước (EVSA/ Endovenous Steam Ablation) và 110 chi được điều trị bằng laser 940 nm (EVLA/Endovenous Laser Ablation) cho thấy tỷ lệ thành công tại thời điểm 12 tháng của EVSA không thấp hơn EVLA, bệnh nhân điều trị bằng phương pháp này đau ít hơn, thời gian nghỉ ngắn hơn và hài lòng hơn.
7.2 Can thiệp bằng vi sóng
Nguyên tắc: là một phương pháp can thiệp nhiệt, sử dụng một ống thông đưa vào tĩnh mạch cần điều trị (kỹ thuật tương tự như ống thông RF); và kết nối với một máy phát tạo ra vi sóng ở tần số 2400 MHz (hình 102,20). Quá trình rút được thực hiện liên tục, vi sóng được phát ra bằng xung từ 2 – 4 mm/s với công suất từ 20 – 50 W tùy thuộc vào kích thước của tĩnh mạch điều trị, năng lượng ước tính khoảng 80 J/cm.
Trang thiết bị: máy phát vi sóng © ECO® kèm theo ống thông mềm, có đánh dấu vạch để thuận lợi cho quá trình rút.
Kết quả: nghiên cứu không ngẫu nhiên của các tác giả Trung Quốc, so sánh EVLA với EMA (EMA/Endovenous microwave ablation) kèm theo thủ thuật cắt quai tĩnh mạch hiển, cho thấy sự ưu điểm vượt trội của EMA về biến chứng, thời gian tiến hành thủ thuật, và thời gian phục hồi sau can thiệp. Theo các tác giả này, nguy cơ biến chứng thấp là vì nhiệt độ điều trị với EMA thấp hơn (70 đến 100°C) so với nhiệt độ điều trị với EVLA (>100 °C).
Nguyên tắc: phương pháp điều trị không nhiệt này tên là LAFOS (LAFOS/Laser – assisted Foam Sclerotherapy), được chỉ định để điều trị tĩnh mạch hiển có kích thước lớn (trên 8 mm), sử dụng laser holmium (Yag 2100 nm, như Sclerolux®, Techlamed, cung cấp nhiệt độ chỉ 67°C: không cần gây tê quanh mạch) tác động lên lớp collagen của trung mạc gây co thắt tĩnh mạch. Sau đó sử dụng chất tiêm xơ bọt để gây tắc tĩnh mạch đã co thắt.
Trang thiết bị: Máy laser holmium loại Yag Sclerolux® 2100 nm, với sợi đốt laser 600 nm. Sợi đốt được luồn vào trong tĩnh mạch hiển lớn lên cách vị trí nối tĩnh mạch hiển – tĩnh mạch đùi chung 1 – 2 cm, phát tia laser trong lúc rút liên tục sợi đốt mà không cần gây tê quanh tĩnh mạch, làm cho tĩnh mạch co nhỏ còn 3 – 5 mm, sau đó tĩnh mạch tiếp tục gây tắc bằng tiêm xơ bọt:
- TM hiển lớn: 5-6 ml polidocanol 3% bọt
- TM hiển nhỏ: 2 – 3 ml polidocanol 2% bọt
Kết quả: Trong nghiên cứu đầu tiên được công bố, 50 tĩnh mạch hiển kích thước lớn (38 TM hiển lớn có đường kính trung bình 9,2 mm; 12 TM hiển nhỏ có đường kính chỏm trung bình 8 mm) đã được gây tắc hoàn toàn 100% sau theo dõi 30 ngày.
7.3 Can thiệp bằng siêu âm hội tụ cường độ cao
Nguyên tắc: Dựa vào đặc tính xuyên thấu, định hướng và hội tụ của sóng siêu âm. Máy phát sóng siêu âm có mức năng lượng và độ tập trung cao, hội tụ tại một tiêu điểm bên trong cơ thể (tĩnh mạch bệnh lý), tại tiêu điểm này, nhiệt độ sẽ được đưa lên trên 70°C trong thời gian ngắn, từ đó gây phá hủy nội mạc và tắc lòng tĩnh mạch.
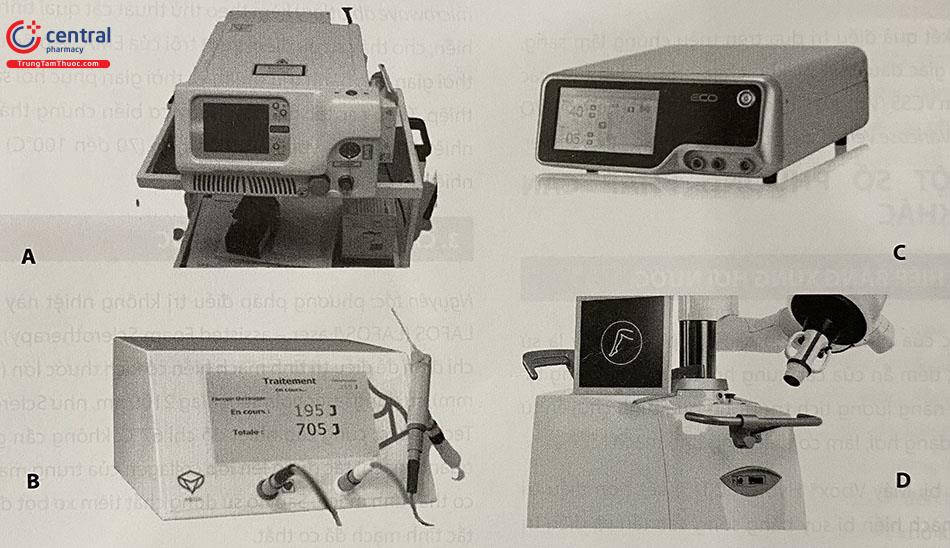
Trang thiết bị: máy siêu âm hội tụ cường độ cao HIFU (HIFU/ High Intensity Focused Ultrasound) SONOVEIN.
Kết quả: Báo cáo đầu tiên được Whiteley công bố vào năm 2020 cho thấy tỷ lệ tắc tĩnh mạch hiển sau 6 tháng (n = 11, 4 TM hiển lớn, 4 TM hiển nhỏ, 3 TM hiển phụ) là 100%, tỷ lệ tắc TM xuyên là 82% (n = 34).
8 Kết luận
Bảng 57.12. Tổng hợp các phương pháp can thiệp điều trị suy tĩnh mạch hiển và so sánh với phẫu thuật cắt quai và lấy bỏ tĩnh mạch hiển
| PHƯƠNG PHÁP | BÁO CÁO THỜI GIAN THEO DÕI (NĂM) | BIẾN MẤT DÒNG TRÀO NGƯỢC | CẢI THIỆN CHẤT LƯỢNG CUỘC SỐNG | YÊU CẦU GÂY TÊ QUANH TM | NGUY CƠ TỔN THƯƠNG THẦN KINH CẲNG CHÂN | MỨC ĐỘ KHUYẾN CÁO VÀ BẰNG CHỨNG |
|---|---|---|---|---|---|---|
| Tiêm xơ bọt | ≥ 5 | +/++ | +/++ | Không | Không | IIb/B |
| RF, laser | ≥ 5 | +++ | +++ | Có | Có | I/A |
| Keo sinh học | 3 – 5 | +++ | +++ | Không | Không | IIa/A(*) IIb/B (**) |
| MOCA | 3 | ++ | +++ | Không | Không | IIa/A(*) IIb/B (**) |
| Phẫu thuật | ≥ 5 | +++ | +++ | Có | Có | IIa/A |
Chú thích: (*) dành cho tĩnh mạch hiển lớn; (**) dành cho tĩnh mạch hiển nhỏ; RF: Sóng có tần số radio; MOCA: hóa cơ học.
Trong điều trị bệnh tĩnh mạch mạn tính chi dưới, phẫu thuật đã gần như được thay thế bằng các phương pháp can thiệp, từ đơn giản như tiêm xơ dưới hướng dẫn siêu âm, đến tiên tiến và phức tạp như sóng cao tần, laser nội mạch, hóa cơ học, hay keo sinh học. Với bằng chứng từ các nghiên cứu lâm sàng, can thiệp nhiệt nội tĩnh mạch bằng sóng cao tần hoặc laser đã trở thành lựa chọn đầu tiên để đóng hoàn toàn và vĩnh viễn dòng trào ngược bệnh lý trong thân tĩnh mạch hiển. Các phương pháp can thiệp mới hơn, với ưu điểm không nhiệt, không gây tê đang phát triển mạnh mẽ trong thời gian gần đây, tuy nhiên còn phải theo dõi và tổng kết hiệu quả lâu dài cũng như cân nhắc gánh nặng chi phí y tế. Về vấn đề này, tiêm xơ dưới hướng dẫn siêu âm vẫn có vai trò nhất định trong can thiệp từng trường hợp cụ thể.
Tóm lại, bác sĩ can thiệp luôn phải cân nhắc ưu, nhược điểm và hạn chế của các kỹ thuật can thiệp khác nhau, nhằm đem lại lợi ích tối đa cho người bệnh, góp phần quan trọng cải thiện chất lượng cuộc sống và nâng cao sự hài lòng của bệnh nhân được can thiệp.
9 Tài liệu tham khảo
1. Alan M. Dietzek and Stuart Blackwood. Radiofrequency treatment of the incompetent saphenous vein. Handbook of Venous and Lymphatic Disorders-Guidelines of the American Venous Forum-CRC Press (2017), 443-453.
2. Almeida J.I., Javier J.J., Mackay E.G. Thirty-sixth-month follow-up of first-in-human use of cyanoacrylate adhesive for treatment of saphenous vein J Vasc Surg Venous Lymphat Disord. 2017;5:658–666.
3. Nick Morrison. Laser treatment of the incompetent saphenous vein. Handbook of Venous and Lymphatic Disorders-Guidelines of the American Venous Forum-CRC Press (2017), 455-463.
4. Steve Elias. Emerging endovenous technology for chronic venous disease: Mechanical occlusion chemically assisted ablation (MOCA), cyanoacrylate embolization (CAE), and V block-assisted sclerotherapy (VBAS). Handbook of Venous and Lymphatic Disorders-Guidelines of the American Venous Forum-CRC Press (2017), 465-473.
5. Marianne G De Maeseneer et European Society for Vascular Surgery (ESVS) 2022 Clinical Practice Guidelines on the Management of Chronic Venous Disease of the Lower Limb. Eur J Vasc Endovasc Surg (2022) 63, 184-267.
6. Jose Almeida. Endovenous Thermal Ablation of Saphenous Reflux. Atlas of Endovascular Venous Surgery. Elservier (2019), 121-213.
7. Mikel Sadek and Lowell Kabnick. Laser Thermal Ablation: Current Data Atlas of Endovascular Venous Surgery. Elservier (2019), 233-242.
8. M. Hamel-Desnos, B.J. Guias, P.R. Desnos, A. Mesgard, 2010. Foam Sclerotherapy of the Saphenous Veins Randomised Controlled Trial with or without Compression. Eur J Vasc Endovasc Surg 39, 500 – 507.
9. Pichot O., de Maeseneer M. Treatment of varicose veins : does each technique have a formal indication ?. Perspect Vasc Surg Endovasc 2011;23:250–254
10. Giordana , Miserey G. Société française de médecine vasculaire. Recommandations de bonne pratique concernant la sécurité et l’environnement en médecine vasculaire, notamment pour le traitement des varices, proposées par la Société française de médecine vasculaire. J Mal Vasc. 2014;39:394–408.
11. Proebstle , Vago B., Alm J. for the ClosureFast Clinical Study Group. Treatment of the incompetent great saphenous vein by endovenous radiofrequency powered segmental thermal ablation : first clinical experience. J Vasc Surg. 2008;47:151–156.
12. Sadek M., Kabnick L.S., Rockman C.B. Increasing ablation distance peripheral to the saphenofemoral junction may result in a diminished rate of endothermal heat-induced J Vasc Surg : Venous Lymphat Disord. 2013;1:257–262.
13. De Araujo J.B., Timi J.R.R., Kotze L.R. Comparison of the effects of endovenous laser ablation at 1470 nm versus 1940 nm and different energy densities. Phlebology. 2019;34:162–170.
14. Lurie , Creton D., Eklof B. Radiofrequency obliteration (closure procedure) versus ligation and stripping in a selected patient population (EVOLVeS Study). J Vasc Surg. 2003;38:207–214.
15. Hamel-Desnos C., Gérard J.L., Desnos Endovenous laser procedure in a clinic room : feasibility and side effects study of 1,700 cases. Phlebology. 2009;24:125–130 Phlebology 2009 ; 24 (4) : 190.
16. Hamel-Desnos C. Particularités de la sclérothérapie chez le patient sous anticoagulant. Angéiologie. 2013;64:43–46.
17. Rabe E., Breu , Cavezzi A. European guidelines for sclerotherapy in chronic venous disorders. Phlebology. 2014;29:338–354.
18. Nicolaides N., Kakkos S., Eklof B. Management of chronic venous disorders of the lower limbs. Int Angiol. 2014;33:87–208.
19. Lane , Bootun R., Dharmarajah B. A multi-centre randomised controlled trial comparing radiofrequency and mechanical occlusion chemically assisted ablation of varicose veins – Final results of the Venefit versus Clarivein for varicose veins trial. Phlebology. 2017;32: 89–98.
20. Tawfik M., Sorour W.A., El-Laboudy M.E. Laser ablation versus mechanochemical ablation in the treatment of primary varicose veins : A randomized clinical trial. J Vasc Surg Venous Lymphat Disord. 2020;8:211–215.

