Can thiệp bít tiểu nhĩ trái - Phương pháp cơ học không dùng thuốc
Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS.Phạm Mạnh Hùng
Tác giả
ThS.BSNT.Trần Bá Hiếu
ThS.BSNT.Trần Ngọc Cầm
PGS.TS.BS.Phạm Mạnh Hùng
Can thiệp bít tiêu nhĩ trái như một phương pháp cơ học phòng ngừa đột quỵ. Kỹ thuật đó như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu trong bài viết sau đây.
1 Đại cương
Rung nhĩ là rối loạn nhịp thường gặp nhất trong thực hành lâm sàng, ảnh hưởng đến 33 triệu người trên toàn thế giới. Tuổi càng tăng thì tỷ lệ mắc rung nhĩ càng tăng. Một trong những biến chứng nguy hiểm nhất của rung nhĩ là huyết khối gây tắc mạch dẫn tới đột quỵ não, có thể tử vong hoặc tàn phế. Để phòng ngừa biến cố tắc mạch thuốc chống đông đường uống được khuyến cáo ở đa số bệnh nhân rung nhĩ, tuy nhiên một số bệnh nhân có chống chỉ định với thuốc chống đông lâu dài.
Một nghiên cứu kiểm tra vị trí của huyết khối trong tâm nhĩ trái (bằng siêu âm tim qua thực quản (TEE), phẫu thuật tim hở hoặc khám nghiệm tử thi) cho thấy rằng ở những bệnh nhân rung nhĩ không do bệnh tim van tim, 90% huyết khối tâm nhĩ trái nằm trong tiểu nhĩ trái (LAA). Do đó LAA là nguồn gốc chủ yếu của huyết khối và việc bít (hoặc loại trừ) LAA là một lựa chọn tốt để dự phòng đột quỵ não.
Thủ thuật bít tiểu nhĩ trái (LAA) qua đường ống thông là một hướng tiếp cận mới, không sử dụng thuốc mà bằng phương pháp cơ học để phòng ngừa đột quỵ.
2 Giải phẫu tiểu nhĩ trái trên chẩn đoán hình ảnh
Tiểu nhĩ trái có cấu trúc rất thay đổi và khó có thể mô tả một cách cụ thể. Tuy nhiên, việc xác định chính xác hình thái của tiểu nhĩ trái là điều quan trọng để tối ưu hóa thành công của thủ thuật bít qua da. Cách tốt nhất để xác định hình dạng của LAA là chụp cắt lớp vi tính (CLVT) tim và/hoặc chụp LAA qua da, lỗ vào và cổ LAA cũng có thể dễ dàng kiểm tra được bằng TEE.
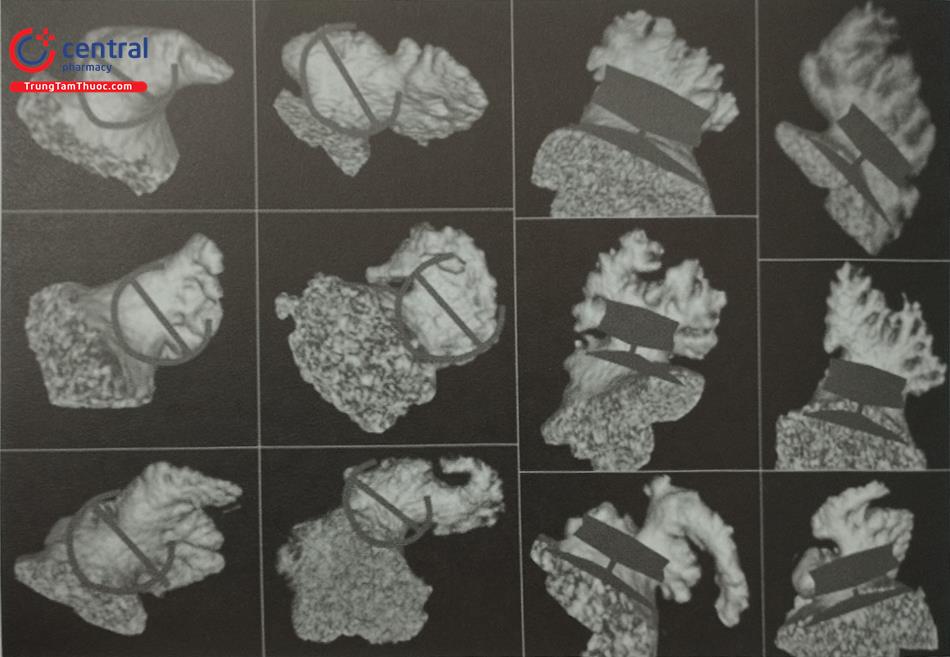
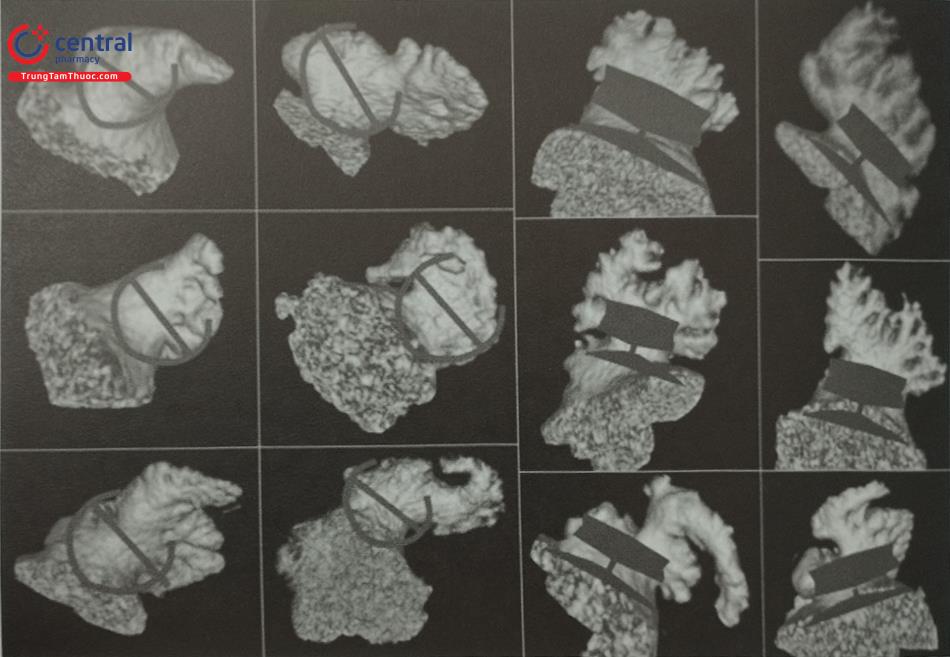
Thông thường, LAA có 4 hình thái thường gặp:
- Hình cánh gà: LAA có phần cổ ngắn và uốn cong rõ ràng ở phần gần;
- Hình bít tất: LAA với thùy chính có chiều dài > 4 cm làm cấu trúc chính.
- Hình súp lơ: LAA có chiều dài giới hạn < 4 cm mà không có bất kỳ thùy chia nào cả;
- Hình cây xương rồng: Thùy trung tâm chi phối và chia ra các thùy nhỏ hơn.
Tần suất của các hình thái khác nhau tùy thuộc từng nghiên cứu khác nhau.
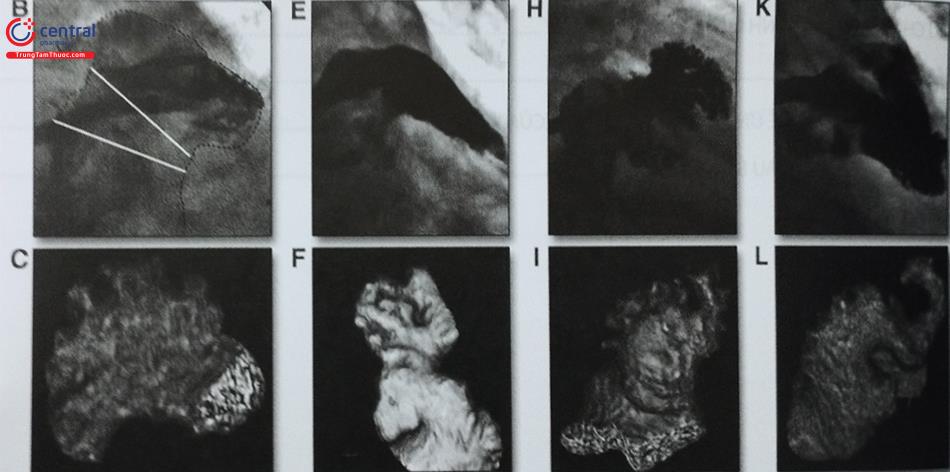
Tiểu nhĩ trái có thể được phân thành bốn loại: (B, C) Loại súp lơ; (E, F) Loại diều gió; (H, I) Loại xương rồng; (K, L) Loại cánh gà.
Dữ liệu gần đây cho thấy hình thái ‘cánh gà’ có thể liên quan đến đột quỵ não thấp hơn, tuy nhiên hình thái này là một thách thức của kỹ thuật bít LAA qua da. Ngược lại hình thái ‘súp lơ’ có cổ lớn hơn và đường kính rộng hơn nên nguy cơ đột quỵ não cao hơn.
Trong can thiệp bít tiểu nhĩ trái qua da, việc nắm được hình thái cụ thể của tiểu nhĩ trái là rất quan trọng, vì các dụng cụ được neo ở phần cổ và bao phủ lỗ vào của nó. Hình thái khác nhau của lỗ vào và cổ của LAA: (1) hình sừng: lỗ vào rộng hơn cổ, (2) ống song song: lỗ vào và cổ có kích thước tương đương, (3) cánh thiên thần: lỗ vào có kích thước lớn hơn miệng. Các cấu trúc khác nhau LAA có thể ảnh hưởng đến việc chọn dụng cụ và sự thành công của thủ thuật. Nguy cơ rơi tuột dụng cụ cao nhất ở những bệnh nhân có cấu trúc LAA dạng sừng. Ở những bệnh nhân này, việc lựa chọn dụng cụ đủ lớn để cho phủ hết lỗ vào LAA nhưng vẫn duy trì mức độ tối ưu để neo vào cổ an toàn là một thách thức.
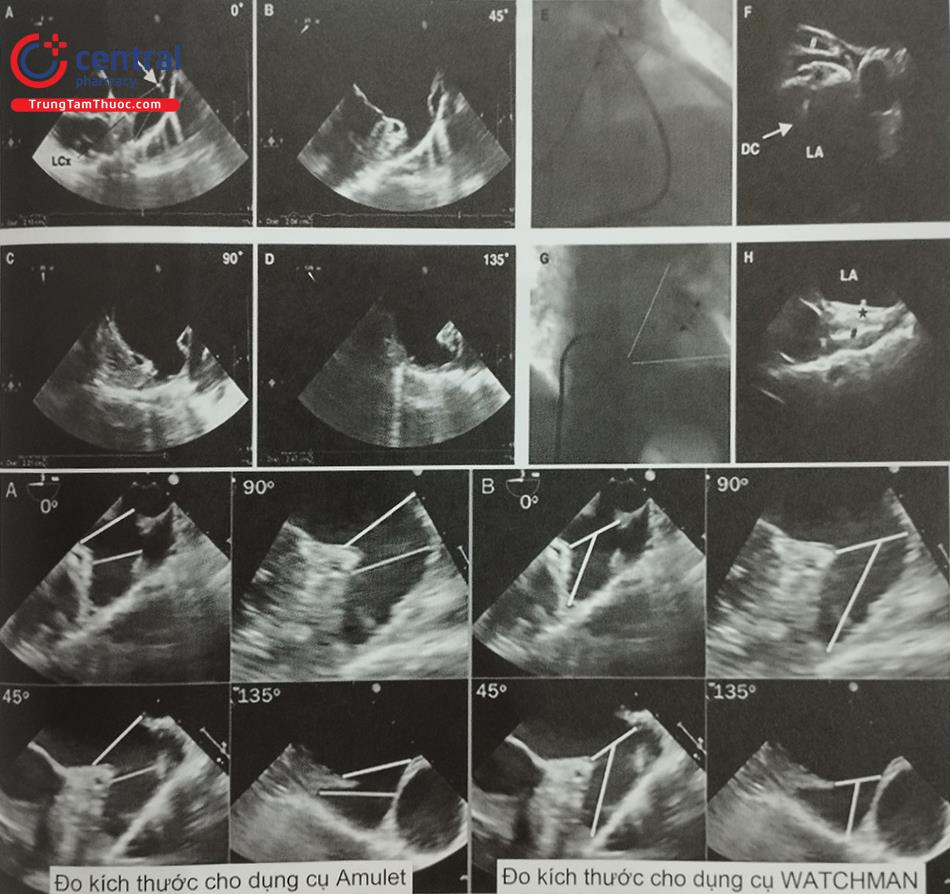
Amulet measurements: Đo kích thước cho dụng cụ Amulet.
Watchman measurements: Đo kích thước cho dụng cụ Watchman.
Đánh giá giải phẫu xác định tính khả thi của thủ thuật
Siêu âm tim qua thực quản là một công cụ cần thiết ở tất cả các giai đoạn của thủ thuật bít tiểu nhĩ trái qua da:
TEE giúp xác định hình thái và kích thước tiểu nhĩ trái để lựa chọn dụng cụ phù hợp, (2) hướng dẫn quá trình thả dụng cụ và hạn chế các biến chứng của thủ thuật và
Sau thủ thuật bít vai trò theo dõi kết quả lâu dài.
Cần đánh giá kích thước và hình dạng tiểu nhĩ trái để xác định tính khả thi thủ thuật bít tiểu nhĩ trái bằng dụng cụ Watchman: chiều rộng đường vào của tiểu nhĩ trái phải đủ để tạo được độ nén dụng cụ bít phù hợp (8% – 20%), đồng thời tiểu nhĩ trái phải đủ độ sâu để chứa dụng cụ (chiều dài dụng cụ tương đương với đường kính của nó). Siêu âm tim qua thực quản (TEE) là chẩn đoán hình ảnh tiêu chuẩn để xác định những vấn đề trên. Các đặc điểm sau đây cần được xác định qua siêu âm tim qua thực quản trước khi tiến hành thủ thuật:
- Huyết khối tiểu nhĩ trái (nếu có, chống chỉ định bít tiểu nhĩ trái).
- Tràn dịch màng ngoài tim và mức độ, nếu có, để làm thông tin tham khảo cơ sở sau khi cấy ghép thiết bị.
- Hình dạng tiểu nhĩ trái (cụ thể, cánh gà).
- Đường kính tối đa của đường vào tiểu nhĩ trái.
- Độ sâu tối đa của tiểu nhĩ trái.
Trong trường hợp bề ngang tiểu nhĩ trái lớn (trên 2 cm) hoặc giải phẫu phức tạp, nên xem xét chụp CLVT hoặc cộng hưởng từ tim. Bởi vì các dụng cụ bít đều có kích thước giới hạn nhất định, và sự chuẩn bị kỹ càng có giúp thủ thuật thuận lợi hơn. Cuối cùng, điều quan trọng cần lưu ý là kích thước của tiểu nhĩ trái phụ thuộc vào áp lực cũng như sự hiện diện của nhịp xoang hay rung nhĩ. Do đó, một số chuyên gia khuyến nghị đo kích thước tiểu nhĩ trái trong suốt quá trình làm thủ thuật sau khi thiết lập áp suất trên 10 mmHg bằng cách truyền nước muối đẳng trương.
3 Chỉ định và chống chỉ định
3.1 Chỉ định
- Bệnh nhân rung nhĩ mà không thể dùng thuốc chống đông đường uống.
- Bệnh nhân không dung nạp thuốc chống đông đường uống.
- Bệnh nhân có tiền sử chảy máu do dùng chống đông trước đây.
- Bệnh nhân không tuân thủ dùng thuốc chống đông đường uống.
- Bệnh nhân mang thai không sử dụng được thuốc chống đông đường uống.
- Bệnh nhân có biến cố đột quỵ não tái phát do huyết khối nhĩ trái mặc dù vẫn đang dùng thuốc chống đông đạt liều.
Bảng 1. Chỉ định bít LAA qua đường ống thông theo các khuyến cáo hiện hành
| Khuyến cáo bít tiểu nhĩ trái qua đường ống thông | Loại | Bằng chứng |
Bít tiểu nhĩ trái được chỉ định để ngăn ngừa đột quỵ não ở bệnh nhân rung nhĩ và có chống chỉ định dùng thuốc chống đông lâu dài (VD chảy máu nội sọ không rõ nguyên nhân, chảy máu tiêu hóa tái phát…) (Theo Hiệp hội phẫu thuật Tim – Lồng ngực châu Âu (EACTS) 2020 về Chẩn đoán và điều trị rung nhĩ) | IIb | B |
Bít tiểu nhĩ trái được chỉ định với các bệnh nhân rung nhĩ để dự phòng đột quỵ não mà có chống chỉ định dùng thuốc chống đông lâu dài và người có nguy cơ cao gặp các biến cố tắc mạch. (Theo khuyến cáo cập nhật năm 2019 của AHA/ACC/HRS về Quản lý bệnh nhân rung nhĩ). | IIB | B |
Hiện tại FDA (Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ) đã chấp nhận cả hai loại dụng cụ là Watchman và Amulet cho chỉ định bít tiểu nhĩ trái qua đường ống thông.
3.2 Chống chỉ định
- Bệnh nhân có tiền sử đã phẫu thuật sửa/vá vách liên nhĩ hoặc can thiệp đặt dụng cụ vào vách liên nhĩ.
- Bệnh nhân đang có tình trạng bệnh lý nặng không thể thực hiện được thủ thuật.
- Bệnh nhân có huyết khối tiểu nhĩ trái hoặc nhĩ trái.
- Bệnh nhân có thể tạng dễ chảy máu: rối loạn đông máu, số lượng tiểu cầu thấp,….
- Bệnh nhân có LAA quá lớn hoặc quá nhỏ so với các kích cỡ hiện có của dụng cụ hiện có.
4 Các dụng cụ bít tiểu nhĩ trái qua da
PLAATO là dụng cụ đầu tiên được sử dụng để bít tiểu nhĩ trái thành công trên người. Tuy nhiên dụng cụ này đã không còn được sử dụng và rút khỏi thị trường vào năm 2006. Cho đến nay, dụng cụ WATCHMAN và ACP đã được sử dụng rộng rãi nhất trong thực hành lâm sàng. Gần đây, dụng cụ coherex wavecrest cũng đã được chứng nhận an toàn CE Mark cho thủ thuật bít tiểu nhĩ trái qua da.
4.1 PLAATO
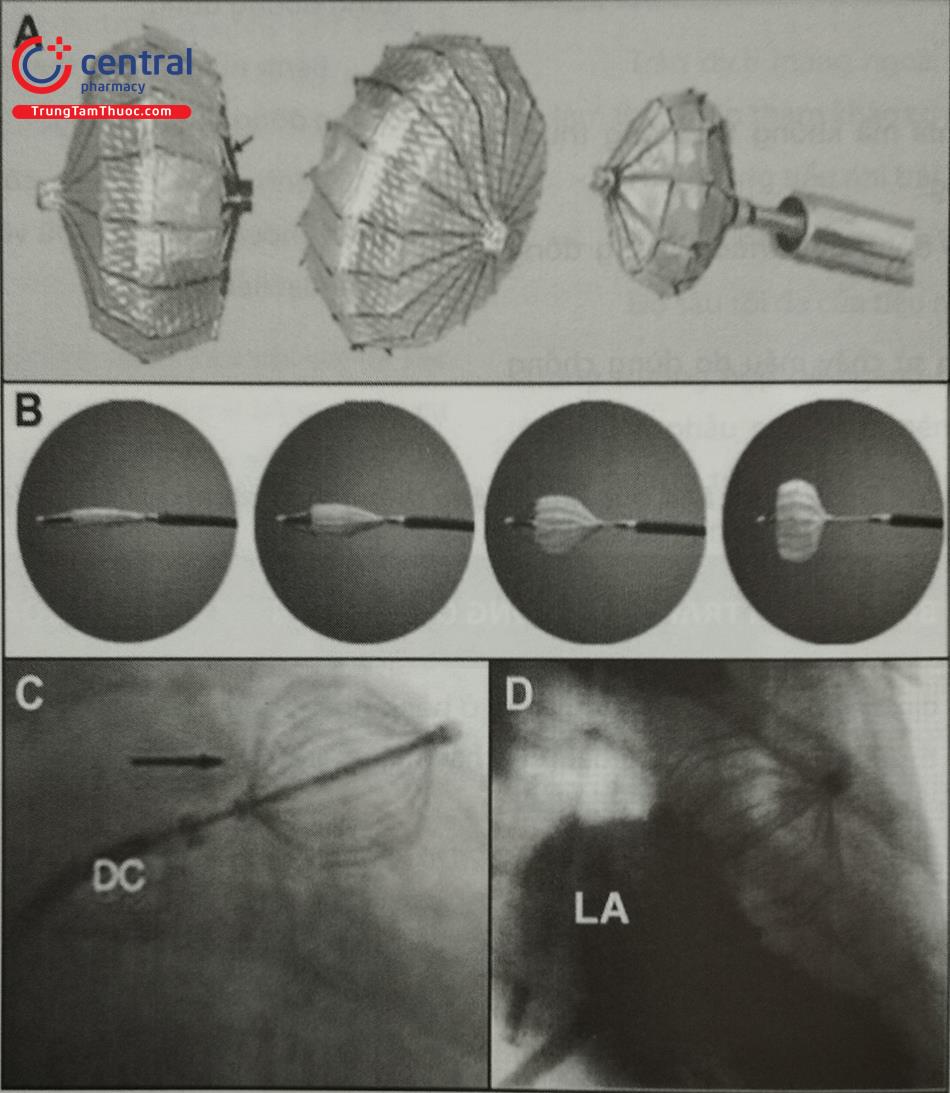
Hệ thống PLAATO là dụng cụ đầu tiên được phát triển đặc biệt cho tắc phần phụ nhĩ trái (LAA). Nó bao gồm một lồng nitinol tự mở rộng với ba neo trên mỗi thanh chống và được bao phủ bởi một màng bọc ngăn huyết khối. Các ngạnh neo cung cấp sự ổn định; màng bọc ngăn chặn huyết khối từ LAA và thúc đẩy quá trình nội mạc hóa. Đường kính dụng cụ dao động từ 15 đến 32 mm và thường được chọn lớn hơn 20–40% so với đường kính của lỗ vào Dụng cụ này không còn khả dụng để sử dụng trong lâm sàng sau khi rút khỏi thị trường vào năm 2006.
Từ trái sang phải – một dụng cụ được thu gọn hoàn toàn, mở rộng một phần và mở rộng hoàn toàn thông qua ống thông 12-Fr.
(C, D) Minh họa hình ảnh chụp nghiêng trước bên phải qua màn huỳnh quang tăng sáng ở một bệnh nhân cho thấy hình ảnh cản quang dụng cụ PLAATO đang chuẩn bị được bít vào LAA (C) và (D) Hình ảnh dụng củ bít đã đúng vị trí.
4.2 WATCHMAN
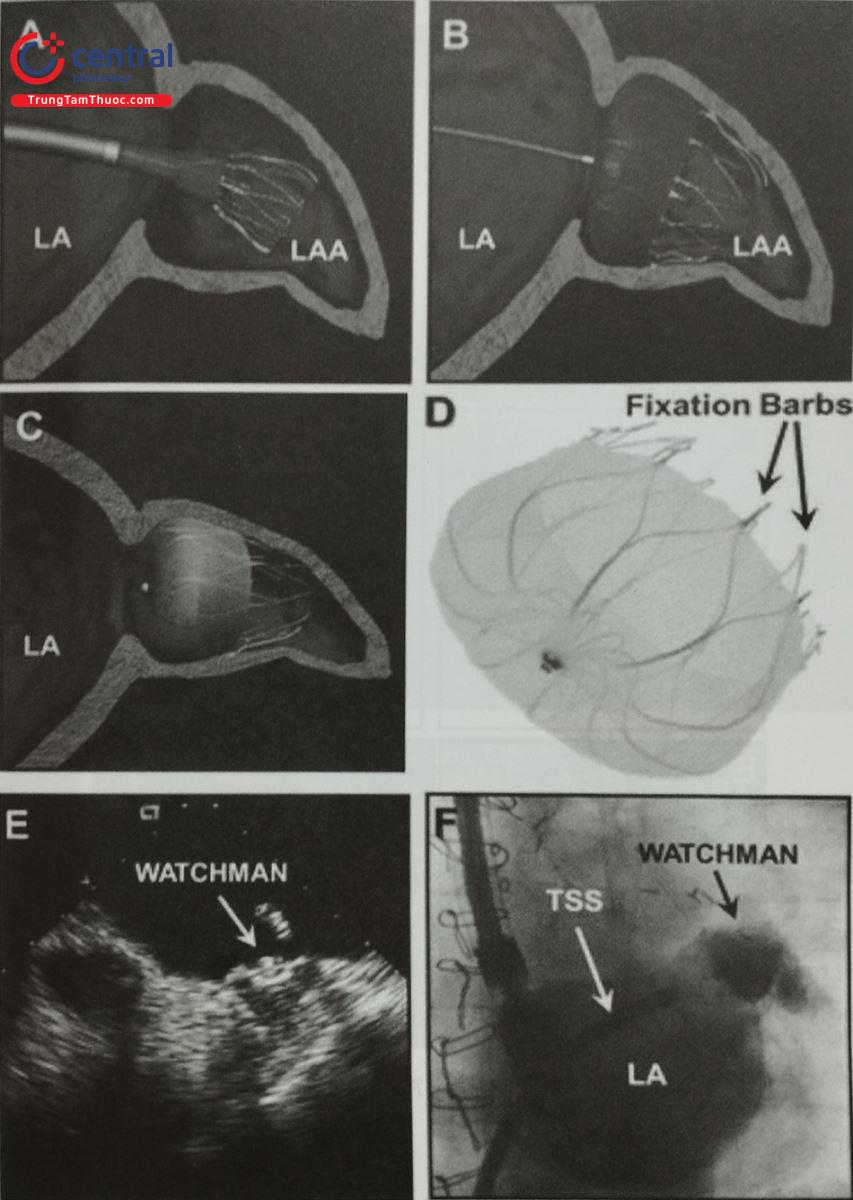
(A – C) Quá trình bít LAA: (A) Đưa dụng cụ vào LAA
(B) Bung dụng cụ và (C) Thả dụng cụ của dụng cụ WATCH- MAN thông qua delivery sheath 12 Fr.
(D) Hình ảnh cận cảnh của dụng cụ WATCHMAN bao gồm một khung nitinol tự giãn nở được bao phủ bởi một màng bọc. Sự ổn định của dụng cụ được đảm bảo bởi các thanh cố định nằm theo chu vi; màng bọc hoạt động như một bộ lọc ngăn chặn huyết khối và thúc đẩy quá trình nội mạc hóa. Dụng cụ này có năm kích thước khác nhau, từ 21 đến 33 mm và thường được chọn lớn hơn 10–20% so với đường kính lỗ vào LAA để đảm bảo neo giữ chắc chắn của thiết bị. Dụng cụ có thể được lấy lại và thu hồi trong trường hợp cố định chưa tối ưu. Dụng cụ WATCHMAN đã nhận được sự chấp thuận của CE vào năm 2005 và hiện đang được sử dụng trong thực hành lâm sàng.
(E) Hình ảnh siêu âm tim qua thực quản của một LAA bị bít sau khi triển khai dụng cụ WATCHMAN – cáp vẫn được kết nối với thiết bị.
(F) Hình ảnh chụp trên màn huỳnh quang tăng sáng chứng tỏ dụng cụ WATCHMAN được đưa đúng vị trí bên trong
4.3 Dụng cụ ACP-AMPLATZER TM Cardiac Plug/ AMULET
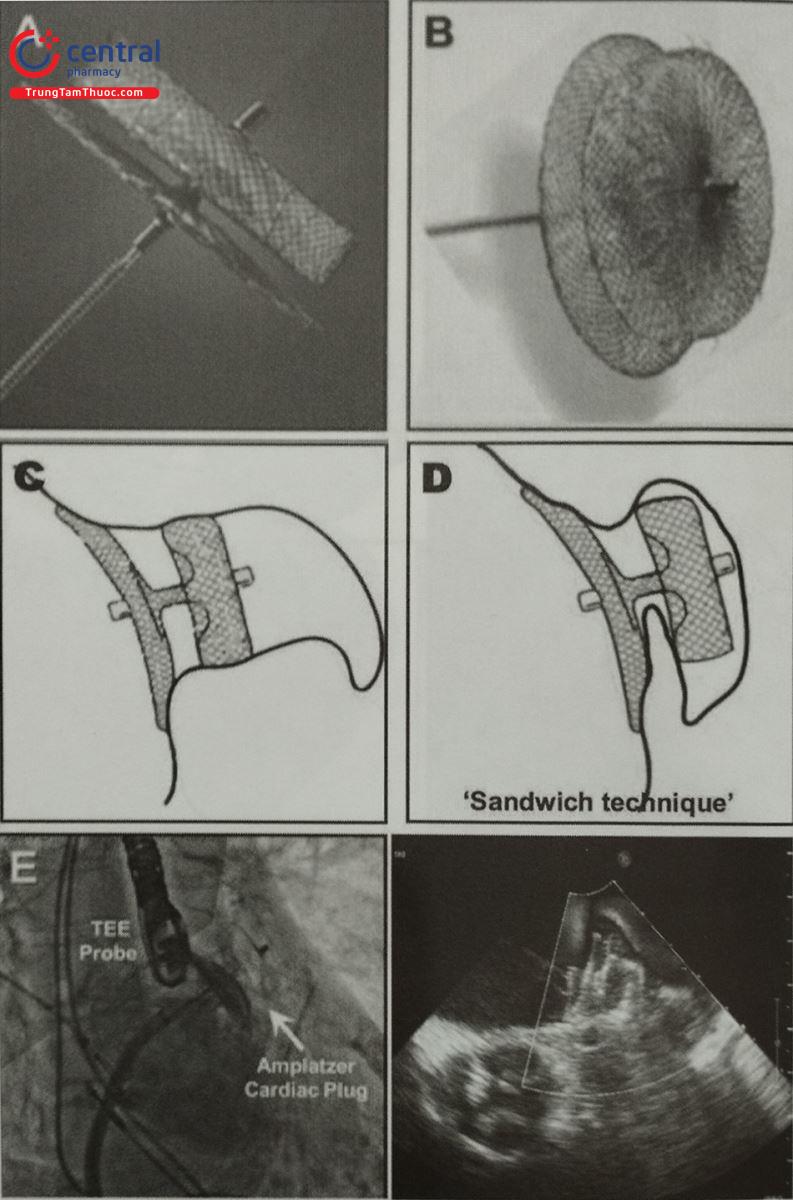
Hình (A,B) dụng cụ ACP bao gồm một thùy và một đĩa được nối với nhau bằng một nút thắt linh hoạt, ngắn. Cả thùy và đĩa đều được cấu tạo từ một lưới nitinol được bao phủ bởi một màng mỏng Polyester. Thùy được cấy vào cổ của LAA (cái gọi là ‘vùng hạ cánh’), và đạt được sự ổn định và duy trì dụng cụ nhờ một số dây ổn định. Hệ thống đưa dụng cụ là ống thông kích thước 9-13Fr tùy thuộc vào kích thước của thiết bị. Kích thước thùy từ 16-30 mm và đĩa từ 20-36 mm; kích thước của thùy nên được chọn lớn hơn đường kính của ‘bãi đáp’ từ 3 đến 5 mm. Dụng cụ ACP không được thiết kế để lấp đầy LAA mà để bịt kín lỗ vào của nó bằng một đĩa lớn hơn. Do đó, dụng cụ ACP có thể là lựa chọn tốt hơn khi được thử thách với cấu trúc giải phẫu phức tạp hơn của LAA. Dụng cụ ACP đã nhận được dấu CE vào năm 2008 và hiện đang được sử dụng trong thực hành lâm sàng.
(C,D) cho thấy việc cấy dụng cụ ACP theo cách thông thường (C), hoặc sử dụng ‘kỹ thuật kẹp’ khi đối đầu với LAA cánh gà có cổ ngắn (D).
(E) hình ảnh X-quang chụp mạch nhĩ trái được thực hiện qua ống thông xuyên vách sau khi đưa dụng cụ ACP (mũi tên trắng) bên trong LAA – khi được đặt đúng vị trí, thùy có hình thái ‘lốp xe’ điển hình với sự nén nhẹ ở hai bên.
(F) hình ảnh siêu âm tim qua thực quản của một dụng cụ ACP được đặt đúng vị trí, cho thấy không có rò rỉ xung quanh thiết bị, sự liên kết tốt của đĩa với lỗ vào LAA và không có hiện tượng chèn ép lên tĩnh mạch phổi trên bên trái.
4.4 Coherex Wavecrest LAA
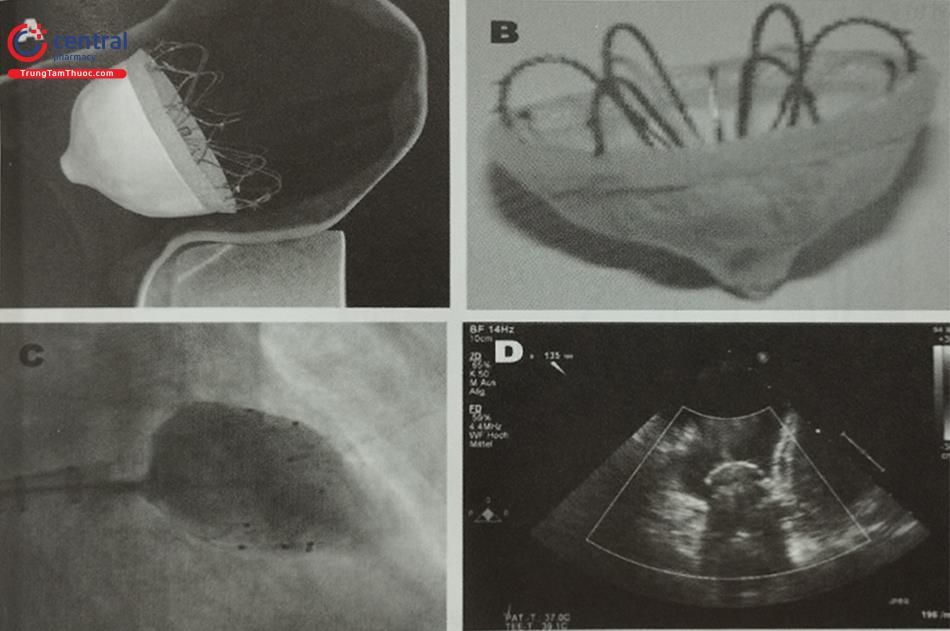
Hình (A,B) Hệ thống Coherex WaveCrest bít LAA là sự phát triển mới nhất trong các dụng cụ bít LAA. Nó bao gồm một khung nitinol với các cuộn dây có thể thu vào và neo để cho phép định vị dụng cụ tối ưu. Dụng cụ bao gồm một màng bọc bao gồm một màng PTFE ở mặt LA của dụng cụ và một chất nền bọt trên bề mặt đối diện LA để giảm thiểu rò rỉ còn sót lại. Gần đây, thử nghiệm lâm sàng WAVECREST I đã được hoàn thành – CE Mark đã được phê duyệt vào tháng 9 năm 2013.
(C) Hình ảnh cản quang của dụng cụ trên màn huỳnh quang tăng sáng để đánh giá việc bít LAA hoàn toàn hay chưa.
(D) Hình ảnh TTE xác nhận dụng cụ được đặt ở vị trí tốt và không bị rò rỉ.
5 Quy trình kĩ thuật can thiệp
Bít LAA qua da thường được thực hiện dưới gây mê toàn thân và sự hướng dẫn của siêu âm tim qua thực quản và màn huỳnh quang tăng sáng. Dự phòng kháng sinh được sử dụng trước khi làm thủ thuật.
Bước 1: Tạo đường vào mạch máu
- Sát trùng da rộng rãi khu vực tạo đường vào mạch máu
- Tạo đường vào: thường là tĩnh mạch đùi phải.
Bước 2: Tiêm Heparin cho bệnh nhân
- Trước khi đưa dụng cụ can thiệp phải cho bệnh nhân dùng heparin. Liều heparin thông thường là 70 – 100 IU/kg.
- Khi thủ thuật kéo dài, kiểm tra thời gian đông máu hoạt hóa (ACT), mục tiêu là ACT từ 250-350 giây. Nếu ACT thấp phải bổ sung liều heparin. Trong thực hành, co thể cho thêm 1000 đơn vị heparin sau 1 giờ thủ thuật tiến hành.
Bước 3: Chọc vách liên nhĩ
- Thông tim phải, chụp chọn lọc động mạch phổi để xác định vị trí và hình dạng của nhĩ trái.
- Chọc vách liên nhĩ bằng kim chọc vách (nếu còn lỗ bầu dục có thể không cần thủ thuật chọc vách liên nhĩ).
- Tiến hành nong vách liên nhĩ bằng que
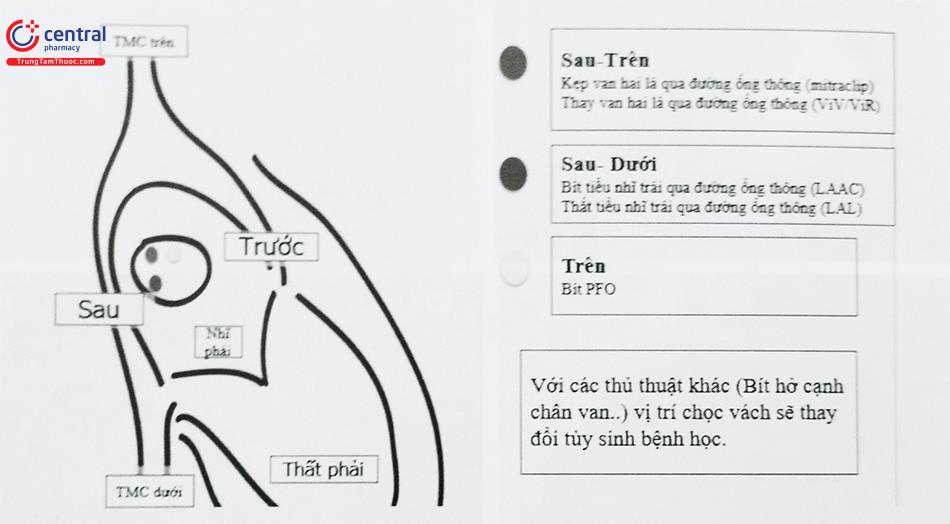
Chú thích: PFO: Còn lỗ bầu dục; TMC: Tĩnh mạch chủ
Bước 4: Bít tiểu nhĩ trái
- Lái ống thông MP trượt trên dây dẫn terumo từ tĩnh mạch đùi lên nhĩ phải sang nhĩ trái, rút dây dẫn
- Đưa dây dẫn super stiff (siêu cứng) vào ống thông MP vào tiểu nhĩ trái.
- Đưa hệ thống delivery sheath (ống chuyển dụng cụ) trượt trên super stiff wire đến miệng tiểu nhĩ trái, rút super stiff wire và nòng ống thông. Chú ý hạ thấp đầu ống thông tránh khí lọt vào ống thông, đến khi thấy máu chảy ra.
- Tiến hành chụp tiểu nhĩ trái xác định kích thước tiểu nhĩ trái.
- Lựa chọn kích thước dụng cụ phù hợp với kích thước tiểu nhĩ trên phim chụp.
- Kết nối dụng cụ với que thả (cable), thu dụng cụ vào hệ thống que thả – van một chiều (loader), đuổi khí bằng nước muối sinh lý có tráng
- Đưa dụng cụ vào lòng ống thông, bơm nước trước khi kết nối để đảm bảo hệ thống kín.
- Đẩy dụng cụ trượt trong ống thông lên tiểu nhĩ trái, thao tác được tiến hành nhẹ nhàng, trượt ống thông về phía nhĩ trái để dụng cụ nở ra lấp kín tiểu nhĩ trái.
- Chụp kiểm tra kết hợp với siêu âm qua thực quản khẳng định vị trí của dụng cụ, không còn shunt giữa nhĩ trái – tiểu nhĩ trái.
- Tiến hành thả dụng cụ, chụp kiểm tra một lần nữa.
- Rút hệ thống ống thông, que thả, khâu cầm máu vết chọc mạch, băng ép.
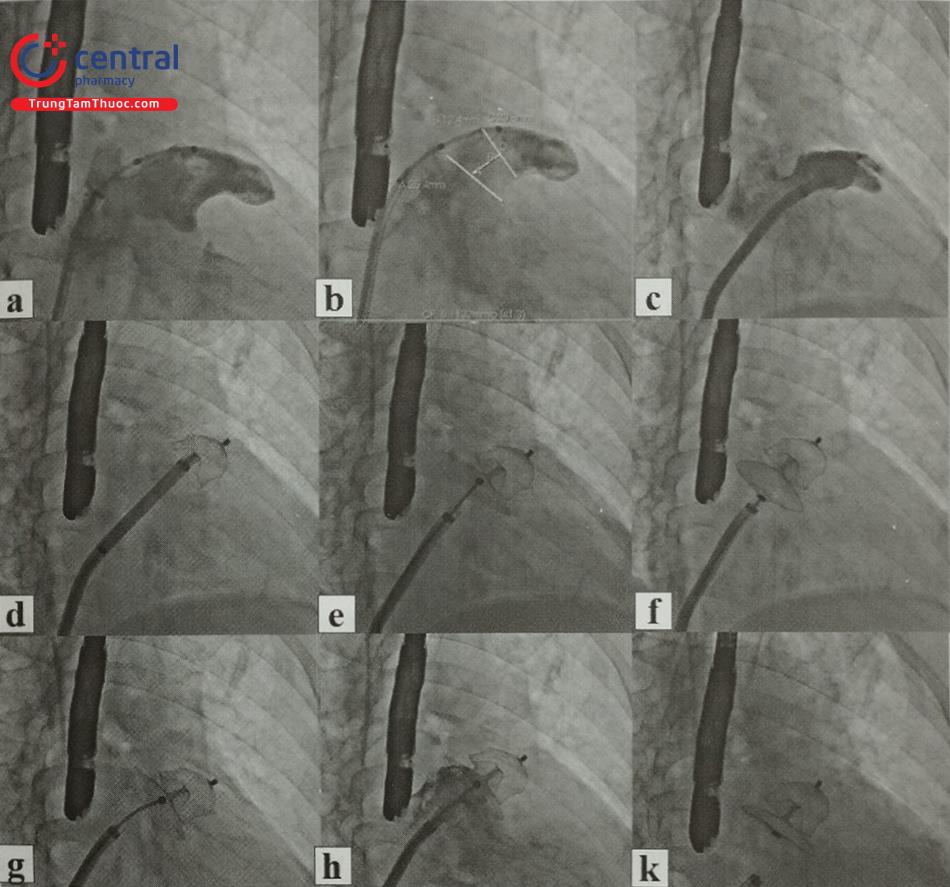
a: Chụp tiểu nhĩ trái, b: xác định kích thước tiểu nhĩ trái, c: đưa dụng cụ bít vào tiểu nhĩ trái và chụp kiểm tra, d: tiến hành thả cánh đầu tiên của dụng cụ Amulet, e: tiến hành thả cánh thứ 2 của dụng cụ Amulet, f, g: kiểm tra tính chắc chắn bằng cách kéo và đẩy dụng cụ Amulet, h: chụp kiểm tra không có dòng rò vào tiểu nhĩ trái, K: tiến hình thả dụng cụ, dụng cụ đúng vị trí.
6 Tiêu chí đánh giá thành công của thủ thuật
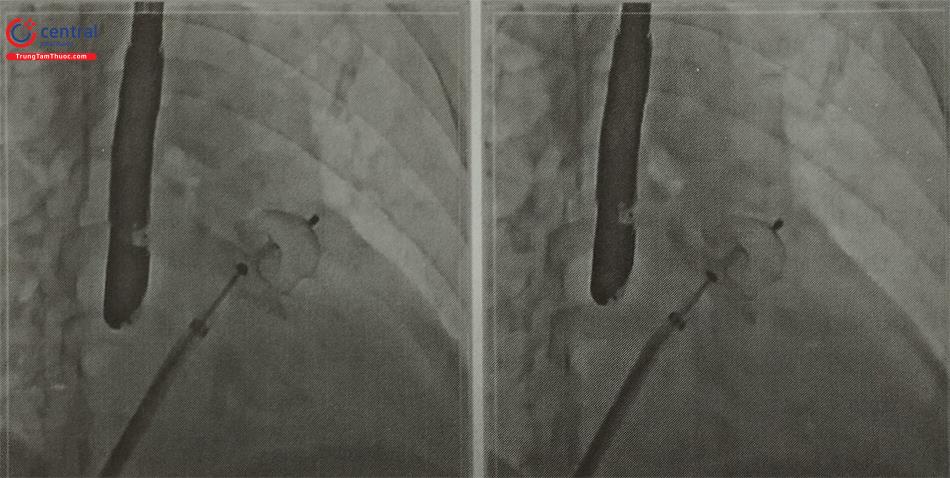
Hình chụp trên màn tăng sáng: dụng cụ bít đúng vị trí tiểu nhĩ trái, với dụng cụ ACP mặt đĩa hướng tiểu nhĩ trái có
hình lõm để áp sát tiểu nhĩ trái, phần thùy có độ lõm ở bề mặt áp sát tiểu nhĩ trái để ép nhẹ lên tiểu nhĩ trái phần đĩa và phần thùy phải có khoảng cách tùy thuộc vào kích thước đo cổ tiểu nhĩ trái.
- Điện tâm đồ: Không có biến đổi điện tâm đồ do biến chứng dụng cụ chèn vào động mạch mũ gây nhồi máu cơ
- Siêu âm tim: dòng shunt tồn dư giữa tiểu nhĩ trái và nhĩ trái đối với dụng cụ WATCHMAN là < 5 mm, dụng cụ Amplatzer/Amulet < 3 mm. Siêu âm tĩnh mạch phổi không có chèn ép dòng chảy tĩnh mạch phổi.
- Không có bất kỳ biến chứng nặng nào khác: như tràn máu màng tim,shunt tồn lưu lớn, chèn ép vào tĩnh mạch phổi…
7 Biến chứng và xử lý
7.1 Tràn máu màng tim do thủng tim
Biểu hiện bằng hội chứng ép tim cấp và thiếu máu cấp.
Xử trí: chọc dẫn lưu dịch màng tim cấp cứu, truyền dịch, truyền máu đảm bảo khối lượng tuần hoàn, liên hệ ngoại khoa phẫu thuật khâu lỗ thủng.
7.2 Shunt tồn lưu nhĩ trái – tiểu nhĩ trái
Cần tiếp tục dùng thuốc chống đông đường uống lâu dài.
7.3 Tuột, rơi dụng cụ
Dùng thòng lọng (snare) kéo vào ống delivery sheath đưa ra ngoài.
Liên hệ phẫu thuật cấp cứu trong trường hợp lấy dụng cụ rơi thất bại.
7.4 Tắc mạch do khí, do cục máu đông hình thành trên bề mặt dụng cụ
Có thể phát hiện sớm cục máu đông hình thành trên bề mặt của dụng cụ bằng siêu âm tim qua thực quản trong thủ thuật.
Dự phòng bằng đuổi khí đúng quy trình, dùng đủ liều
7.5 Các biến chứng khác
Biến chứng cường phế vị do đau gây nhịp chậm, tụt huyết áp (cho atropin, thuốc vận mạc nếu cần).
Dị ứng thuốc cản quang, sốc phản vệ: cần phát hiện sớm để xử trí.
Nhiễm trùng (ít gặp).
Biến chứng tại chỗ chọc mạch: chảy máu, máu tụ, thông động – tĩnh mạch…
8 Một số nghiên cứu về ứng dụng và an toàn của kỹ thuật
Bít tiểu nhĩ trái qua da là một kỹ thuật phòng ngừa đột quỵ não ở bệnh nhân rung nhĩ và do đó tính an toàn thủ thuật là rất quan trọng.
Trong thử nghiệm PROTECT AF (2009), so sánh dụng cụ WATCHMAN (n=463) với Warfarin (n = 244) với bệnh nhân AF có nguy cơ đột quỵ não cao, tiêu chí an toàn chính (gồm tràn dịch màng tim, huyết khối thiết bị, chảy máu và đột quỵ não liên quan đến thủ thuật) đã tăng lên ở nhóm WATCHMAN (7,4 biến cố/100 bệnh nhân). Hầu hết các biến cố xảy ra trong 7 ngày đầu tiên sau khi cấy ghép thiết bị, khoảng 50% là tràn dịch màng tim cần dẫn lưu.
Tuy nhiên, dữ liệu gần đây hơn từ CAP (n = 566, WATCHMAN), nghiên cứu PREVAIL (n = 296, WATCHMAN)
và một nghiên cứu đa trung tâm lớn liên quan đến dụng cụ ACP (n = 969) cho thấy mức độ an toàn thủ thuật được cải thiện, với biến chứng trong 7 ngày lần lượt là 4,1%; 4,4%; 4,1% so với > 7% so với nghiên cứu PROTECT AF (2009). Tỷ lệ này thấp hơn do kỹ thuật này ngày càng được thành thạo và hoàn thiện hơn.
Thử nghiệm ngẫu nhiên, tiến cứu duy nhất được công bố đến nay là thử nghiệm PROTECT AF trong 707 bệnh nhân bị rung nhĩ không do bệnh lý van tim (NVAF) chia ngẫu nhiên theo tỷ lệ 2:1 cho bít LAA qua da bằng WATCHMAN và điều trị bằng warfarin. Nghiên cứu được thiết kế để so sánh dụng cụ và liệu pháp OAC kéo dài. Bệnh nhân NVAF kịch phát, dai dẳng đủ điều kiện nếu có CHADS2 > 1 điểm. Thử nghiệm khẳng định WATCHMAN không thua kém hiệu quả dự phòng đột quỵ, và tử vong do tim mạch (RR=0,62; KTC 95% 0,35-1,25).
Kết quả theo dõi 4 năm từ thử nghiệm PROTECT AF đã được trình bày. Điểm cuối về hiệu quả chính đột quỵ não xảy ra ở 2,3% nhóm dụng cụ so với 3,8% ở nhóm dùng Warfarin (RR=0,6, KTC 95%, 0,41-1,05), chứng tỏ hiệu quả chính giảm 40% nguy cơ đột quỵ não so với nhóm dùng OAC. Tử vong do tim mạch xảy ra 1% ở nhóm sử dụng dụng cụ so với 2,5% ở nhóm dùng Warfarin (RR= 0,4, KTC 95%, 0,21-0,72, p < 0,05). Tỷ lệ xuất huyết não là 0,2% ở nhóm dùng dụng cụ so với 1% ở nhóm dùng Warfarin (RR= 0,18, KTC 95% 0,04-0,06, p< 0,05). Kết luận, những dữ kiện này cho thấy lợi ích của việc bít LAA qua da bằng dụng cụ như một giải pháp tiềm năng thay thế cho OAC ở những bệnh nhân NVAF.
Thử nghiệm SWISS-APERO công bố tại hội nghị ACC 2021 để so sánh tính ưu việt của dụng cụ Amulet so với Watchman cho thủ thuật bít LAA. Nghiên cứu nhãn mở, đa trung tâm, trên 221 bệnh nhân chia hai nhóm ngẫu nhiên 1:1. kết quả khi đánh giá tình trạng không ngấm thuốc trong lòng tiểu nhĩ trái bằng chụp cắt lớp vi tính tim sau can thiệp 45 ngày cho thấy dụng cụ Amulet không vượt trội hơn so với Watchman. Tỷ lệ rò cạnh dụng cụ là cao hơn ở nhóm can thiệp bằng dụng cụ Watchman, trong khi rò xuyên màng dụng cụ lại cao hơn ở nhóm dùng Amulet trên chụp cắt lớp vi tính mặc dù tỷ lệ này được cải thiện theo thời gian do quá trình nội mạc hóa màng dụng cụ. Amulet gặp nhiều hơn các biến chứng khi can thiệp như chảy máu lớn (BARC 3-5), tràn dịch màng tim. Trong khi các biến cố tim mạch có hại chính (Tử vong tim mạch, đột quỵ não, thuyên tắc mạch hệ thống và xuất huyết) là như nhau ở cả 2 nhóm.
Thử nghiệm Amulet IDE nhằm đánh giá sự an toàn và hiệu quả của dụng cụ Amulet cho can thiệp bít LAA so với dụng cụ Watchman ở bệnh nhân rung nhĩ không do bệnh van tim. Nghiên cứu gồm 1878 bệnh nhân được phân ngẫu nhiên thành 2 nhóm theo tỷ lệ 1:1 với thời gian theo dõi trung bình là 18 tháng. Kết quả tiêu chí an toàn là tỷ lệ tổng hợp của tử vong do mọi nguyên nhân, biến chứng liên quan đến thủ thuật, chảy máu tại thời điểm 1 năm là 14,5% với dụng cụ Amulet và 14,7% với dụng cụ Watchman, không có sự khác biệt thống kê. Các biến cố gộp liên quan đến đột quỵ não do nhồi máu, thuyên tắc mạch hệ thống là như nhau ở 2 nhóm. Trong khi các biến chứng liên quan đến thủ thuật (khuyết khối thiết bị/ tràn dịch màng tim) cao hơn có ý nghĩa thống kê ở nhóm Amulet là 4,5% so với nhóm Watchman là 2,5% (p=0,002), ngược lại rò quanh dụng cụ mức trung bình đến nặng thấp hơn có ý nghĩa thống kê ở nhóm Amulet (10%) so với nhóm Watchman (22%) tại thời điểm 12 tháng.
Phân tích SURPASS mới được công bố vào tháng 3/2022 về kết quả đời thực qua 45 ngày sau can thiệp với dụng cụ Watchman FLX ™ trên 16.000 bệnh nhân cho thấy bít LAA là hiệu quả và an toàn trong chỉ định làm giảm nguy cơ đột quỵ não ở bệnh nhân rung nhĩ không do bệnh van tim. Tỷ lệ bít LAA thành công là 97,6%. Điểm cuối chính tại thời điểm 7 ngày sau can thiệp hoặc lúc xuất viện có
0,37% bệnh nhân gặp các biến cố tim mạch bất lợi chính (tử vong do mọi nguyên nhân, đột quỵ, thuyên tắc hệ thống, các biến cố liên quan đến thiết bị, phẫu thuật tim). Tại thời điểm 45 ngày tỷ lệ các tác dụng ngoại ý là 0,91% bệnh nhân tử vong, 0,38% đột quỵ, 0,28% đột quỵ não do nhồi máu, 0,01% có thuyên tắc hệ thống, 0,23% huyết khối liên quan đến thiết bị, 0,03% thuyên tắc biết bị và 3,55% bệnh nhân có chảy máu BARC 3-5. Sau can thiệp có 95,3% bệnh nhân không có rò cạnh dụng cụ và 99,1% bệnh nhân không có rò hoặc rò < 3 mm, tại thời điểm 45 ngày tỷ lệ này lần lượt là 82% và 95,4%. Dụng cụ Watchman FLX cũng đang được tiến hành thử nghiệm RCT để so sánh với thuốc chống đông máu trong hai nghiên cứu OPTION và CHAMPION-AF. Hai thử nghiệm này nhằm thúc đẩy việc mở rộng chỉ định bít LAA với các bệnh nhân nguy cơ chảy máu thấp.
Cuối cùng, tỷ lệ shunt tồn lưu sau khi bít LAA, thường được đánh giá bằng TEE và được phân loại: (1) nghiêm trọng – dòng chảy tự do, (2) nặng: chiều rộng của dòng máu rỉ qua dụng cụ > 3 mm, (3) vừa: chiều rộng của dòng máu rỉ qua dụng cụ 1-3 mm, (4) nhỏ: chiều rộng của dòng máu rỉ qua dụng cụ < 1 mm. Rò rỉ lớn còn tồn tại được báo cáo ở 62%, 32% và 10% sau khi cấy các dụng cụ PLAATO, WATCHMAN và ACP. Tỷ lệ rò rỉ còn thấp hơn khi cấp ACP có cấu trúc đĩa kép, điều này có thể góp phần bít LAA kín hơn. Tuy nhiên, quan trọng nhất, sự hiện diện của lỗ rò rỉ qua dụng cụ không liên quan đến bất kỳ biến cố tim mạch sau này. Thông thường khi phát hiện những rò rỉ lớn qua màng dụng cụ, liệu pháp OAC nên được dùng trong vài tuần đến 1 tháng cho đến khi TEE đánh giá bề rộng dòng máu chảy ngược qua dụng cụ < 3 mm.
9 Theo dõi và điều trị sau bít tiểu nhĩ
Xquang tim phổi và siêu âm tim qua thành ngực được khuyến cáo thực hiện trước khi bệnh nhân xuất viện để loại trừ huyết khối dụng cụ và tràn dịch màng tim. Sau 45 ngày, Siêu âm tim qua thực quản nên được thực hiện để xác định việc bít hoàn toàn của LAA và không có huyết khối.
Nhiều phác đồ điều trị chống đông khác nhau đã được sử dụng sau khi LAA đã bít. Trong thử nghiệm PROTECT AF, OAC (thuốc chống đông đường uống, gồm warfarin và thuốc chống đông trực tiếp đường uống DOAC) được dùng trong 45 ngày và dừng OAC nếu sau 45 ngày siêu âm tim qua thực quản cho thấy LAA bít hoàn toàn hoặc nếu độ rộng của dòng chảy qua dụng cụ còn lại < 5 mm. Sau khi ngừng điều trị OAC, bệnh nhân được sử dụng liệu pháp kháng kết tập tiểu cầu kép (DAPT) gồm Aspirin và Clopidogrel cho đến sau 6 tháng khi bệnh nhân kiểm tra lại siêu âm tim qua thực quản LAA đã bít hoàn toàn. Sau đó aspirin được điều trị kéo dài. Ở 14% bệnh nhân, OAC được tiếp tục sau 45 ngày và 8% bệnh nhân OAC được tiếp tục điều trị sau 6 tháng vì LAA bít không hoàn toàn hoặc bị huyết khối thiết bị.
Một nghiên cứu gần đây hơn trên 150 bệnh nhân được bít bằng dụng cụ Watchman báo cáo rằng việc bít bằng dụng cụ Watchman thực hiện một cách an toàn mà không cần chuyển tiếp OAC và DAPT bao gồm clopidogrel được kê từ 1- 6 tháng sau đó chỉ dùng aspirin lâu dài là có thể chống huyết khối phù hợp. Với việc bít bằng dụng cụ ACP, không cần dùng OAC và DAPT bao gồm clopidogrel được kê trong thời gian thay đổi từ 1-6 tháng, sau đó chuyển thành aspirin dùng kéo dài.
Tuy nhiên, một nghiên cứu cho thấy tỷ lệ huyết khối thiết có tỷ lệ dao động từ 4% đến 17%. Tỷ lệ hình thành huyết khối dụng cụ cao hơn trong vòng vài tuần đến 1 tháng đầu tiên và giảm đáng kể khi bề mặt dụng cụ đã được nội mạc hóa. Trong trường hợp huyết khối thiết bị, heparin tiêm dưới da được dùng liên tục trong 2 tuần và sau khi siêu âm tim qua thực quản không còn huyết khối thì DAPT có thể dùng kéo dài.
Một nghiên cứu khác trên 34 bệnh nhân bít tiểu nhĩ bằng dụng cụ Amulet đã cho thấy rằng nguy cơ hình thành huyết khối trên dụng cụ này tăng lên ở những bệnh nhân có số lượng tiểu cầu cao, thang điểm nguy cơ đột quỵ não cao và phân suất tống máu thấp. Những phát hiện này nhấn mạnh tầm quan trọng của việc theo dõi chặt chẽ những bệnh nhân này và cần một nghiên cứu lớn hơn để có thể đưa ra khuyến nghị về chống đông một cách tối ưu hơn về thời gian ở những bệnh nhân nguy cơ cao này.
10 Tài liệu tham khảo
- Blackshear J.L. and Odell J.A. (1996). Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann Thorac Surg, 61(2), 755–759.
- Mechanical antithrombotic intervention by LAA occlusion in atrial fibrillation | Nature Reviews
- Kimura , Takatsuki S., Inagawa K., et al. (2013). Anatomical characteristics of the left atrial appendage in cardiogenic stroke with low CHADS2 scores. Heart Rhythm, 10(6), 921–925.
- Khurram M., Dewire J., Mager M., et al. (2013). Relationship between left atrial appendage morphology and stroke in patients with atrial fibrillation. Heart Rhythm, 10(12), 1843–1849.
- Left Atrial Appendage Dimensions Predict the Risk of Stroke/TIA in Patients With Atrial Fibrillation – BEINART – 2011 – Journal of Cardiovascular Electrophysiology – Wiley Online
- Aryana A., Saad E.B., and d’Avila (2012). Left Atrial Appendage Occlusion and Ligation Devices: What Is Available, How to Implement Them, and How to Manage and Avoid Complications. Curr Treat Options Cardio Med, 14(5), 503–519.
- Coherex Medical (2015), Coherex WAVECREST I Left Atrial Appendage Occlusion Study, Clinical trial registration, gov.
- Krishnaswamy A., Patel N.S., Ozkan A., et al. (2012). Planning left atrial appendage occlusion using cardiac multidetector computed tomography. International Journal of Cardiology, 158(2), 313–317.
- Analysis of the left atrial appendage by magnetic resonance angiography in patients with atrial fibrillation – Heart Rhythm. <https:// heartrhythmjournal.com/article/S1547-5271 (06)01827-3 /fulltext>, accessed: 07/16/2021.
- Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial – The Lancet. <https://w thelancet.com /journals/lancet/article/PIIS0140-6736(09)61343-X/fulltext>, accessed: 07/16/2021.
- Reddy Y., Möbius-Winkler S., Miller M.A., et al. (2013). Left Atrial Appendage Closure With the Watchman Device in Patients With a Contraindication for Oral Anticoagulation: The ASAP Study (ASA Plavix Feasibility Study With Watchman Left Atrial Appendage Closure Technology). Journal of the American College of Cardiology, 61(25), 2551–2556.
- Risk Factors for Thrombus Formation on the Amplatzer Cardiac Plug After Left Atrial Appendage Occlusion – ScienceDirect. <https: //sciencedirect.com/science/article/pii/S1936879813007486?via%3Dihub>, accessed: 07/16/2021.
- Krumsdorf U., Ostermayer S., Billinger K., et al. (2004). Incidence and clinical course of thrombus formation on atrial septal defect and patient foramen ovale closure devices in 1,000 consecutive patients. Journal of the American College of Cardiology, 43(2), 302–309.
- Safety of Percutaneous Left Atrial Appendage Closure | <https://www.ahajournals.org/doi/full/10.1161/ CIRCULATIONAHA.110.976449>, accessed: 07/16/2021.
- Holmes D.R. (2013). Randomized trial of LAA closure vs warfarin for stroke/thromboembolic prevention in patients with non-valvular atrial fibrillation (PREVAIL). Late breaking trial session, American College of
- Tzikas A. (2013). LAAO for stroke prevention in AF: multicenter experience with the Amplatzer Cardiac Plug. Transcatheter Cardiovascular
- Reddy Y., Doshi S., Sievert H., et al. (2013). Long term results of PROTECT AF: The mortality effects of left atrial appendage closure versus warfarin for stroke prophylaxis in AF. Heart Rhythm Society 34th Annual Scientific Sessions.
- Incomplete occlusion of the left… – Google Scholar. <https:// scholar. com/scholar_lookup?author=JF+Viles.
- Freixa: Left atrial appendage closure with the Amplatzer… – Google

