Ảnh hưởng của các thuốc điều trị ung thư lên hệ nội tiết
Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 NGUYÊN LÝ CHUNG
1.1 Tăng đường máu

Tăng đường máu khá phổ biến ở các bệnh nhân đang điều trị ung thư, cả ở người có và không có tiền sử đái tháo đường và có thể rất khó kiểm soát.
Glucocorticoid được dùng ở bệnh nhân ung thư vì nhiều lý do. Dexamethason vẫn là thuốc chính của điều trị dự phòng buồn nôn do hóa chất hoặc tia xạ.
- Liều thông thường là từ 4 – 20 mg, có thể tiêm tĩnh mạch một lần mỗi khi truyền hóa chất hoặc uống trước và sau mỗi liệu trình hóa chất [1].
- Dexamethason còn được dùng để điều trị phù não ở những bệnh nhân có u hệ thần kinh trung ương nguyên phát hoặc ung thư di căn đến não.
- Glucocorticoids có tác dụng gây độc tế bào trực tiếp trong bệnh ung thư máu và được dùng liều cao cho phần lớn các bệnh lymphoma, leukemia và đa u tủy xương.
- Steroids còn được dùng bôi và đường toàn thân để kiểm soát hiện tượng thải loại mảnh ghép ở những bệnh nhân đang điều trị tế bào gốc.
Điều trị đích hoặc ức chế tyrosine kinase (TKIs) ám chỉ một nhóm lớn các thuốc phân tử nhỏ bắt chước ATP và ức chế tín hiệu trong các con đường tăng sinh tế bào như PI3-kinase và Akt. Nó có thể gây đề kháng Insulin bằng cách ức chế một phần dòng tín hiệu xuôi dòng của thụ thể insulin.
- Nhiều thuốc trong nhóm này vẫn đang được nghiên cứu. Dabrafenib, một chất ức chế BRAF kinase, gây tăng đường máu ở 49% các bệnh nhân [2].
- Các thuốc ức chế mTOR (everolimus, temsirolimus) có tác dụng tương đương và còn có thể gây tăng lipid máu do làm thay đổi thủy phân lipid và hoạt tính của enzym lipoprotein Lipase [3].
- Mức độ và thời gian tăng đường máu phụ thuộc thuốc nhưng thường có thể điều trị được.
Liệu pháp miễn dịch, đặc biệt là các kháng thể nhắm vào protein lập chương trình chết tế bào 1 (PD - 1) hoặc phối tử chết theo chương trình 1 (PD - L1), được báo cáo có thể gây bệnh đái tháo đường tự miễn (được trình bày trong phần rối loạn chức năng nội tiết do liệu pháp miễn dịch).
Có thể cần điều chỉnh phác đồ điều trị bằng thay đổi chế độ ăn hoặc cho nuôi dưỡng qua ống thông hoặc nuôi dưỡng tĩnh mạch hoàn toàn ở những bệnh nhân có tổn thương ở đường tiêu hóa.
1.2 Loãng xương

Nhiều thuốc điều trị ung thư có thể gây giảm mật độ xương.
Glucocorticoids, được dùng để chống thải ghép, khi dùng liều cao hơn mức sinh lý trong thời gian dài (Prednisone 7,5 mg/ngày hoặc cao hơn trong hơn 3 tháng) có thể gây giảm mật độ xương nhiều. Lúc đầu, Steroids ức chế hoạt động của tạo cốt bào, gây giảm tạo xương. Nếu dùng kéo dài (hơn 6 đến 9 tháng) nó có thể ức chế chức năng hủy cốt bào và hủy xương [4]. Glucocorticoids cũng làm giảm nồng độ Canxi máu do giảm hấp thu ở đường tiêu hóa và tăng thanh thải qua thận. Điều trị nội tiết thường được dùng trong ung thư tuyến tiền liệt và ung thư vú có dương tính với thụ thể estrogen/progesteron.
- Các thuốc ức chế Aromatase như Anastrozol, letrozol và exemestan, tác dụng bằng cách ức chế aromatase, một enzym xúc tác cho quá trình chuyển androgens thành estrogens. Aromatase có mặt ở buồng trứng, nhau thai, tinh hoàn, não, xương, mạch máu và mô mỡ. Ở phụ nữ sau mãn kinh, thuốc ức chế aromatase được dùng như là điều trị bổ trợ đầu tay cho ung thư vú dương tính với thụ thể hormon. Ở phụ nữ chưa mãn kinh, nó được dùng kết hợp với cắt buồng trứng. Sử dụng thuốc này gây giảm mật độ xương và tăng nguy cơ gãy xương do ức chế các tác dụng có lợi của estrogen lên xương [5].
- Thuốc điều biến chọn lọc thụ thể estrogen (SERMs), như Tamoxifen và raloxifen, có thể được sử dụng để dự phòng ung thư vú dương tính với thụ thể hormon và điều trị ung thư vú dương tính với thụ thể hormon ở những phụ nữ trước mãn kinh có nguy cơ tái phát thấp. Điều lý thú là thuốc SERMs có các tác dụng đối nghịch nhau lên mật độ xương tùy thuộc tình trạng kinh nguyệt. Ở người chưa mãn kinh, nó tác dụng như chất đối kháng thụ thể estrogen gây giảm mật độ xương. Ngược lại, ở người đã mãn kinh, nó lại hoạt động như chất đồng vận thụ thể estrogen làm tăng mật độ xương.
- Liệu pháp khử Androgen, gồm thuốc đồng vận hoặc đối kháng GnRH (gonadotropin-releasing hormon), gây giảm nồng độ testosteron máu là điều trị chính ở nam giới có ung thư tuyến tiền liệt đã di căn. Các thuốc đồng vận GnRH (leuprolide, Goserelin, buserelin) và đối kháng (degarelix) làm giảm mật độ xương nhiều hơn do làm tăng chu chuyển xương. Nó cũng có thể làm tăng nguy cơ gãy xương [6].
Ghép tủy xương được chứng minh là một yếu tố nguy cơ độc lập gây giảm mật độ xương. Giảm mật độ xương thường xảy ra trong vòng 6 -12 tháng điều trị đầu sau ghép và phục hồi sau 12 tháng [7]. Các cơ chế có thể là:
- Tăng tái hủy xương do:
- Suy thận: giảm sản xuất 1,25 dihydroxyvitamin D3 và cường cận giáp thứ phát.
- Ức chế calcineurin (Tacrolimus): giảm chức năng thận và hoạt hóa hủy cốt bào.
- Hóa trị liệu: suy sinh dục gây giảm estrogen và testosteron.
- Xạ trị: suy sinh dục.
- Giảm tạo xương do:
- Giảm hấp thu canxi và vitamin D.
- Suy thận: mất canxi và magne.
- Hóa trị liệu: trực tiếp ức chế tạo cốt bào.
- Xạ trị: trực tiếp ức chế tác dụng của tạo cốt bào và giảm sản xuất hormon GH.
1.3 Miễn dịch trị liệu gây rối loạn chức năng nội tiết
Miễn dịch trị liệu hiện đại sử dụng các kháng thể để làm gián đoạn tín hiệu giữa các tế bào ức chế trình diện kháng nguyên (APCs) và tế bào T, thường có chức năng ức chế hoạt hóa tế bào T và ngăn chặn quá trình tự miễn.
Bằng cách ức chế những “điểm kiểm soát” này và hạ thấp ngưỡng tự dung nạp miễn dịch, hệ miễn dịch có thể dễ dàng nhận ra “các kháng nguyên tân sinh” được tạo ra bởi các tế bào ung thư bị đột biến.
Các tác dụng ngoại ý của liệu pháp miễn dịch thường là các biến thể của các bệnh tự miễn đã biết, mặc dù biểu hiện và diễn biến lâm sàng có thể mạnh và nhanh hơn so với tự nhiên thông thường. Tổn thương tại các cơ quan nội tiết thường là vĩnh viễn.
Có hai nhóm kháng thể miễn dịch trị liệu chính:
- Các kháng thể nhắm đích protein liên kết với lympho T gây độc tế bào 4 (CTLA- 4) trên tế bào T làm gián đoạn tương tác của nó với CD28 trên tế bào trình diện kháng nguyên (ipilimumab)
- Các kháng thể nhắm đích PD- 1 (pembrolizumab, nivolumab) hoặc PDL- 1 (atezolizumab, avelumab, durvalumab) trên tế bào T và tế bào trình diện kháng nguyên.
- Vì những biến cố này hiếm xảy ra nên hiện không rõ là có su khác biệt về tỷ lệ mới mắc các biến cố ngoại ý của các thuốc trong cùng nhóm hay không
- FDA chấp thuận cho sử dụng phối hợp hai nhóm để điều trị melanoma di căn.
Kháng thể CTLA- 4 chủ yếu gây viêm tuyến yên, xảy ra ở 17% số bệnh nhân [8].
- Trong một nghiên cứu, các biểu hiện chính ở bệnh nhân là đau đầu (86%) và mệt (66%) [9]. Có 79% các trường hợp được chụp cộng hưởng từ, kết quả thấy phù hợp với viêm tuyến yên [9].
- Đái tháo nhạt ít gặp hơn nhưng cũng đã được báo cáo.
- Rối loạn chức năng tuyến giáp nguyên phát hiếm gặp.
Các kháng thể PD- 1/PDL- 1 có thể gây rối loạn chức năng tuyến giáp ở 19% bệnh nhân [10].
- Rối loạn chức năng tuyến giáp phổ biến nhất khi điều trị các thuốc này là pha cường giáp nhẹ tạm thời, sau đó là tiến triển nhanh đến suy giáp nặng. Độ tập trung iodine phóng xạ và siêu âm tuyến giáp phù hợp với viêm tuyến giáp và có thể khẳng định chẩn đoán nếu không có nghi ngờ gì khác. Có rất ít báo cáo về bệnh basedow mới xuất hiện.
- đái tháo đường typ 1 và suy thượng thận nguyên phát cũng đã được báo cáo.
1.4 Hệ sinh sản
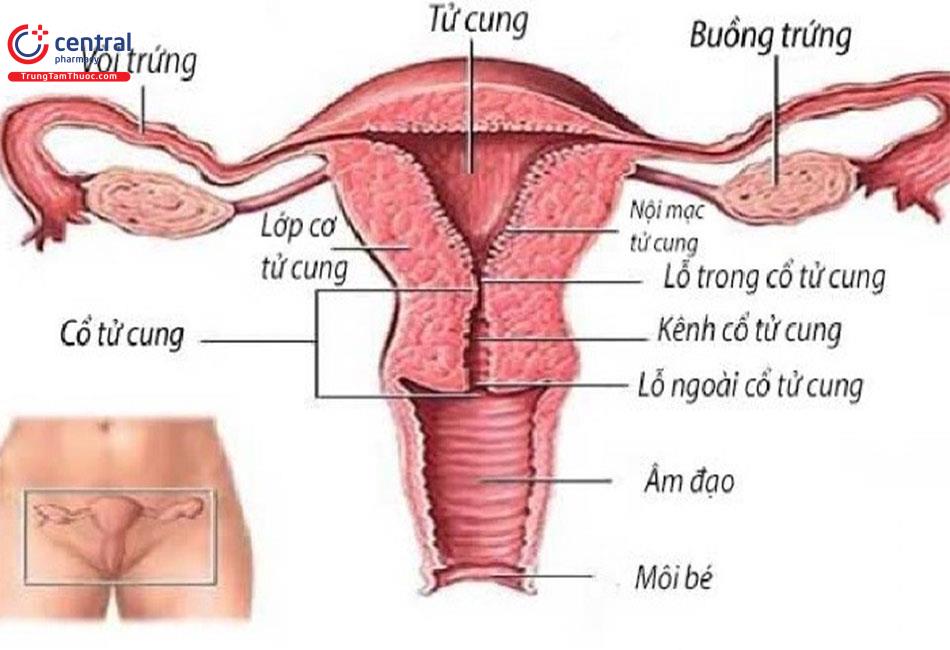
Các thuốc chống ung thư và xạ trị thường gây vô sinh, do tác dụng gây độc trực tiếp lên buồng trứng và tinh hoàn.
Các hoá chất phổ biến gây suy sinh dục là:
- Các thuốc alkylating: cyclophosphamid, melphalan, dacarbazin.
- Vinca alkaloids: vinblastin, Vincristin.
- Các thuốc chống chuyển hóa: cytosine arabinoside (Ara-C), methotrexat, fluorouracil, 6-mercaptopurin.
Có mối liên quan giữa liều chiếu xạ với nguy cơ vô sinh.
1.5 Tuyến giáp
Xét nghiệm chức năng tuyến giáp có thể không tin cậy ở những bệnh nhân đang điều trị ung thư do bệnh (ung thư) hoặc do TSH bị ức chế bởi sử dụng steroid thường xuyên. Một số trị liệu ung thư có thể trực tiếp ảnh hưởng, đôi khi là vĩnh viễn đến chức năng tuyến giáp.
Một số thuốc TKI có thể làm giảm chức năng tuyến giáp, chủ yếu do ức chế lượng máu đến tuyến giáp, điều này được chứng minh qua các nghiên cứu về siêu âm thấy giảm dòng máu và giảm kích thước tuyến giáp [11].
- Tác dụng này được thấy khi điều trị sunitinib, sorafenib và các thuốc khác. Các thuốc TKI đang tiếp tục được phát triển với tốc độ nhanh nên cần kiểm tra rối loạn chức năng tuyến giáp do thuốc ở mọi bệnh nhân có điều trị một trong những thuốc này.
- Có một số bằng chứng về việc thuốc TKI cũng có thể tác động lên enzym deiodinases để ức chế chuyển T4 thành T3, gặp trên lâm sàng ở những bệnh nhân đã cắt tuyến giáp và có điều trị các thuốc sorafenib, imatinib và motesanib, cần tăng liều levothyroxin hoặc cần liều levothyroxin cao bất thường [12].
Xạ trị vùng cổ, thường được chỉ định cho ung thư hầu họng hoặc thanh quản hoặc u lympho Hodgkin, cũng có thể gây phá hủy tuyến giáp và suy giáp.
Các tác dụng miễn dịch của các kháng thể mới như CTLA- 4 và PD-1/ PD- L1 đã được mô tả nhưng các thuốc điều trị ung thư cũ cũng được gọi là liệu pháp miễn dịch như aldesleukin (interleukin-2 tái tổ hợp), interferon-a và thalidomide/lenalidomide vẫn được dùng và có thể gây tổn thương tuyến giáp tự miễn, đôi khi có pha nhiễm độc giáp [13].
Bexarotene, thuốc đối kháng thụ thể retinoid X hiện ít được dùng cho u lympho tế bào T dưới da, có thể gây suy giáp trung ương và làm tăng thanh thải hormon giáp ở gần như toàn bộ các bệnh nhân được điều trị thuốc này do ức chế sản xuất TSH [14].
Hội chứng bình giáp bệnh lý (Euthyroid sick syndrome) phổ biến ở bệnh nhân ung thư nhưng thường không cần điều trị.
==> Bạn đọc có thể tham khảo: Ung Thư Tuyến Giáp: Sự Tăng Sinh Bất Thường Các Tế Bào Tuyến Giáp
1.6 Tuyến yên

Chúng ta đã biết rất rõ dùng liều cao glucocorticoid kéo dài sẽ ức chế sản xuất ACTH nội sinh của tuyến yên, gây suy thượng thận thứ phát. Tương tự, glucocorticoid ngoại sinh thường ức chế sản xuất GH và FSH và gây suy sinh dục trung ương. Tiết TSH cũng có thể bị giảm nhưng không gây được suy giáp lâm sàng. Các thuốc giảm đau opioid có tác dụng tương tự trên tuyến yên.
Xạ trị tuyến yên và vùng dưới đồi gây rối loạn chức năng ở phần lớn các bệnh nhân nhưng nó có thể xảy ra cả khi xạ trị vùng sọ không nhắm vào tuyến yên, phụ thuộc vào dạng và liều xạ trị, vị trí chiếu xạ [15].
Tác dụng của bexaroten và miễn dịch trị liệu lên tuyến yên được thảo luận lần lượt ở các phần về tuyến giáp và rối loạn chức năng nội tiết do miễn dịch trị liệu.
Bảng 40.1 trình bày tóm tắt các tác động phổ biến nhất của thuốc ung thư lên hệ nội tiết.
2 CHẨN ĐOÁN
2.1 Tăng đường máu
Đường máu thường được kiểm tra cùng khi lấy máu trước mỗi lần điều trị hóa chất. Tăng đường máu do hoặc nặng lên bởi steroids có thể bị bỏ sót cho tới khi bệnh nhân xuất hiện các triệu chứng điển hình của tăng đường máu hoặc tăng đường máu tồn tại đến tận khi bắt đầu chu kỳ điều trị hóa chất mới.
Nồng độ HbAlc thường không đáng tin cậy ở những bệnh nhân điều trị ung thư vì đời sống hồng cầu thay đổi do hóa trị hoặc truyền máu.
Các bệnh nhân điều trị đích có gây tăng đường máu thường cần theo dõi đường máu thường xuyên hơn, đặc biệt nếu họ được chọn vào các thử nghiệm lâm sàng. Nếu tăng đường máu liên quan trực tiếp đến thuốc thì nó được coi là một biến cố ngoại ý. Tăng đường máu kéo dài có thể dẫn đến phải giảm liều hoặc ngừng điều trị. Các biến cố ngoại ý của hóa trị liệu được phân mức độ theo Tiêu chuẩn Thông dụng để Đánh giá những biến cố bất lợi (CTCAE). Ở đa số các thử nghiệm, phải giảm liều hoặc ngừng điều trị nếu tăng đường máu ở mức độ 3 (đường máu đói từ 251 - 500 mg/dL) hoặc độ 4 (đường máu đói > 500 mg/dL) mà không đáp ứng với điều trị [3].
2.2 Loãng xương
Phần lớn các bệnh nhân có mật độ xương thấp sẽ không có triệu chứng cho đến khi bị gãy xương. Do đó những bệnh nhân điều trị glucocorticoid dài hạn (hơn 7,5 mg/ngày trong hơn 3 tháng) cần được sàng lọc loãng xương (xem Chương 26).
2.3 Liệu pháp miễn dịch gây rối loạn chức năng nội tiết
Các bệnh nhân điều trị kháng thể CTLA-4 nên được xét nghiệm TSH và FT4 trước mỗi kỳ điều trị để phát hiện các dấu hiệu sớm của viêm tuyến yên. Khi thấy có các dấu hiệu gợi ý suy giáp trung ương, các triệu chứng mới liên quan đến suy thượng thận hoặc đau đầu mới cấp tính thì nên xét nghiệm các hormon tuyến yên và chụp cộng hưởng từ [16].
Các bệnh nhân điều trị thuốc PD-1 và PDL-1 nên được xét nghiệm chức năng tuyến giáp và đường máu trước mỗi lần truyền. Sự xuất hiện đái tháo đường thường nhanh nên đường máu chỉ tăng nhẹ trước khi bệnh nhân có biểu hiện của tăng đường máu cấp tính hoặc nhiễm toan xêtôn (DKA).
Các bệnh nhân nên được cảnh báo về các triệu chứng của tăng đường máu và được đề nghị đi khám cấp cứu ngay khi thấy đái nhiều và uống nhiều. Ở bệnh nhân đã biết có đái tháo đường từ trước nên nghĩ đến tế bào B bị phá hủy bởi liệu pháp miễn dịch nếu họ có tăng nặng đường máu cấp tính mà không đáp ứng với điều trị thông thường hoặc cần thêm insulin kèm theo nồng độ C-peptide thấp. Kháng thể GAD-65 dương tính ở một số nhưng không phải tất cả các trường hợp được báo cáo [17].
Có một số rối loạn nội tiết hiếm gặp khác cũng được báo cáo, bao gồm suy thượng thận nguyên phát đơn độc và suy cận giáp.
2.4 Tuyến giáp
Nên tiến hành xét nghiệm chức năng tuyến giáp nếu bệnh nhân đang điều trị bằng các phương pháp được biết có thể gây rối loạn chức năng tuyến giáp hoặc xuất hiện các triệu chứng gợi ý bệnh.
Bexarotene chắc chắn sẽ gây suy giáp trung ương trong vòng vài giờ sau khi dùng liều đầu tiên và điều trị theo kinh nghiệm được khuyến cáo.
Các bệnh nhân có xạ trị vùng cổ nên được theo dõi chức năng tuyến giáp lâu dài. Suy giáp có thể xuất hiện sau xạ trị hơn 10 năm [18].
2.5 Hệ sinh sản
Nam giới bị suy sinh dục thường phàn nàn về giảm ham muốn tình dục, rối loạn cương dương, mệt mỏi/không có năng lượng. Các dấu hiệu thực thể như giảm khối cơ, lông mọc thưa hoặc vú to không phải luôn luôn có vì nó cần thời gian dài mới xuất hiện. Các xét nghiệm bao gồm đo nồng độ testosteron toàn phần và tự do vào buổi sáng (lý tưởng là lấy máu lúc 8 - 10 giờ sáng), LH và FSH (xem Chương 20).
Phụ nữ trước tuổi mãn kinh bị vô kinh, nó có thể phục hồi sau khi hoàn thành hóa trị liệu. Các xét nghiệm bao gồm Estradiol, FSH và LH. AMH (Anti-mullerian hormon) được sử dụng như là một marker sinh hóa của dự trữ buồng trứng.
Nhìn chung, hóa trị liệu gây suy sinh dục nguyên phát, với nồng độ testosteron/estradiol thấp và FSH/LH cao. Glucocorticoids và các thuốc khác ảnh hưởng đến tuyến yên sẽ gây suy sinh dục thứ phát (trung ương), với nồng độ testosteron/estradiol thấp và FSH/LH thấp.
2.6 Tuyến yên
Suy tuyến yên biểu hiện bằng các triệu chứng của suy giáp, suy sinh dục hoặc suy thượng thận (xem chi tiết ở Chương 6).
Các bệnh nhân được tia xạ sọ não có thể bị rối loạn chức năng tuyến yên sau điều trị nhiều năm nên phải được theo dõi thường xuyên. Trong một phân tích gộp, thiếu GH là phổ biến nhất, tiếp sau là thiếu prolactin, FSH, LH, TSH và ACTH [15].
| Bảng 40.1. Tác động của các thuốc chống ung thư lên hệ nội tiết | |||||||||
| Thuốc hoặc nhóm thuốc | Tế bào beta | Tuyến giáp | Tuyến thượng thận | Tuyến yên | Xương | Sinh sản | |||
| Tăng đường máu | Đái tháo đường tự miễn | Cường giáp | Suy giáp | Suy thượng thận nguyên phát | Suy thượng thận thứ phát | Suy tuyến yên | Loãng xương | Suy dinh dục | |
| Glucocorticoids | X | X | X | ||||||
| TKIsd | X | X (b) | X | ||||||
| PD-1/PD-L1 | X | X (b) | X | X | X | X | |||
| CTLA-4 | X | X | X | ||||||
| Ức chế aromatase | X | ||||||||
| SERMS | X (a) | ||||||||
| Liệu pháp khử androgen | X | ||||||||
| Thuốc alkylating | X | ||||||||
| Vinca alkaloids | X | ||||||||
| Thuốc chống chuyển hóa | X | ||||||||
| Bexarotene | X(c) | ||||||||
(a) SERMs gây mất xương ở phụ nữ tiền mãn kinh và tăng mật độ xương ở phụ nữ đã mãn kinh. (b) Cường giáp thoáng qua, rồi tiến trển nhanh đến suy giáp. (c) Bexarotene gây suy giáp trung ương (d) Phụ thuộc vào thuốc - không phải là tác dụng nhóm. ADT (Androgen deprivation therapy): Liệu pháp ức chế androgen; Al (Adrenal insufficiency): Suy thượng thận; CTLA (Cytotoxic T-lymphocyte-associated protein): Protein liên kết với lympho T gây độc tế bào; DM (diabetes mellitus): Đái tháo đường; PD - 1 (Programmed cell death protein 1): Protein lập chương trình chết tế bào 1 ; PD-L1 (Programmed death-ligand 1): Phối tử chết theo chương trình 1; SERMs (Selective estrogen receptor modulators): Điều biến chọn lọc thụ thể estrogen; TKI (Tyrosine kinase inhibitor): Ức chế tyrosine kinase. | |||||||||
3 ĐIỀU TRỊ
3.1 Tăng đường máu
Điều trị tăng đường máu trong khi điều trị ung thư tập chung chủ yếu vào làm giảm các triệu chứng và biến chứng cấp tính, vì tác nhân gây tăng đường máu thường chỉ là tạm thời. Tuy nhiên, steroids đôi khi được dùng kéo dài cho những bệnh nhân đa u tủy mạn tính hoặc để chống thải mảnh ghép. Điều trị tích cực hơn được chỉ định cho những bệnh nhân có nguy cơ mất nước hoặc nhiễm khuẩn hoặc những người sẽ phải phẫu thuật trong tương lai gần.
Ở những bệnh nhân mới xuất hiện tăng đường máu do steroid, metformin làm giảm đường máu có ý nghĩa nhưng thường không đủ để kiểm soát tăng đường máu cấp tính trong vòng 1-2 ngày sau điều trị hóa chất. Thêm thuốc như sulfonylurea tác dụng ngắn có thể có hiệu quả nếu đơn trị liệu metformin là không đủ. Metformin có thể không được khuyến cáo ở những bệnh nhân có chức năng thận dao động hoặc có suy gan hoặc có tiêu chảy nhiều khi điều trị hóa chất. Ở nhiều bệnh nhân, đa số là bệnh nhân có đái tháo đường từ trước, sẽ cần tiêm insulin nhiều mũi để kiểm soát đường máu đạt mục tiêu. Liều insulin có thể phải tái phân bố từ 60 - 70% dành cho tiêm trước bữa ăn ở những bệnh nhân dùng glucocorticoid liều cao.
Tăng đường máu liên quan với điều trị đích thường khá nhẹ và có thể được quản lý giống như đái tháo đường typ 2. Ở những bệnh nhân được chọn vào các thử nghiệm lâm sàng các thuốc này, có thể cần điều trị tích cực hơn để kiểm soát được đường máu, nhằm đảm bảo họ không bị loại khỏi nghiên cứu hay phải giảm liều thuốc, có hiệu quả tốt với bệnh ung thư, do tăng đường máu. Nếu có triệu chứng, có thể cần giãn cách điều trị ung thư một thời gian bằng 3 - 5 thời gian bán hủy của thuốc trong khi bắt đầu điều trị tăng đường máu [19].
3.2 Xương
Bảng 40.2 trình bày nguy cơ gãy xương ở những bệnh nhân điều trị glucocorticoids theo Trường môn Thấp khớp học Hoa Kỳ [20]. Những người này nên được đánh giá nguy cơ gãy xương trên lâm sàng trong vòng 6 tháng kể từ khi bắt đầu điều trị steroid. Điều trị được khuyến cáo cho những bệnh nhân có nguy cơ gãy xương trung bình và cao và những bệnh nhân trên 30 tuổi có dùng glucocorticoid liều rất cao (trên 30 mg/ngày hoặc liều tích lũy trên 5g trong năm trước đó).
- Thay đổi lối sống: chế độ ăn cân đối, bỏ thuốc lá, thực hiện các bài tập rèn luyện sức bền và sức nặng, uống tối đa 1 - 2 phần đồ uống có cồn/ngày.
- Bổ sung đủ canxi và vitamin D: 1.000 - 1.200 mg canxi và 600 - 800 UI Vitamin D mỗi ngày.
- Điều trị nội khoa: bisphosphonate đường uống, bisphosphonate truyền tĩnh mạch, teriparatid, denosumab, raloxifen (cho phụ nữ mãn kinh).
Những bệnh nhân đang điều trị thuốc ức chế aromatase và phụ nữ mãn kinh điều trị SERMs nên được điều trị dự phòng mất xương [21].
- T score > - 2,0 và không có thêm yếu tố nguy cơ: Thay đổi lối sống, bổ sung canxi và vitamin D và đo mật độ xương mỗi 1 - 2 năm/lần.
- T score < - 2,0 và có 2 yếu tố nguy cơ bất kỳ (tuổi > 65, T score < -1,5, hút thuốc lá, BMI < 20, tiền sử gia đình bị gãy cổ xương đùi, tiền sử bản thân dễ gãy xương, điều trị glucocorticoid < 6 tháng): Điều trị nội khoa như trên và đo mật độ xương mỗi 2 năm/lần.
3.3 Liệu pháp miễn dịch gây rối loạn chức năng nội tiết
Trong khi phần lớn các biến cố ngoại ý của liệu pháp miễn dịch như phát ban, viêm đại tràng, viêm gan, viêm phổi được điều trị bằng cách trì hoãn liệu pháp và cho glucocorticoids, vẫn chưa rõ liệu steroids có lợi ích gì không với đa số các biến cố ngoại ý về nội tiết. Thay vào đó, điều trị tập trung vào phát hiện các thiếu hụt, điều trị thay thế hormon cần thiết và theo dõi khả năng hồi phục.
Điều trị viêm tuyến yên bằng steroids liều cao (prednison 1 mg/kg/ngày) vẫn còn tranh cãi. Một số chuyên gia khuyến cáo điều trị cho tất cả các trường hợp, một số khác khuyến cáo chỉ điều trị cho những trường hợp có đau đầu nhiều hoặc có thay đổi thị lực [9].
Nhiều chức năng của tuyến yên có thể phục hồi nhưng cũng có chức năng có thể bị thiếu hụt kéo dài, đặc biệt ACTH hiếm khi phục hồi. Nghiệm pháp kích thích ACTH có thể giúp đánh giá sự phục hồi. Tuyến yên to phù hợp với sự phục hồi trong quá trình theo dõi [9].
Đái tháo đường do liệu pháp miễn dịch nên được điều trị như đái tháo đường typ 1 bằng insulin và cho nhập khoa Hồi sức tích cực nếu bị nhiễm toan xêtôn. Thường thì bệnh nhân không có giai đoạn tuần trăng mật và nồng độ C-peptide sẽ nhanh chóng giảm đến mức không đo được. Một số rất ít bệnh nhân được báo cáo là có thể ngừng được insulin.
Pha nhiễm độc giáp của viêm tuyến giáp phá hủy do PD-1/PDL-1 thường ngắn và nhẹ. Propranolol có thể giúp kiểm soát triệu chứng, còn methimazole không có tác dụng. Tiến triển nhanh thành suy giáp. Nên theo dõi chặt TSH và cho điều trị ngay khi thấy TSH tăng lên [22].
Các bệnh nội tiết tự miễn hiếm gặp khác như suy thượng thận nguyên phát và suy cận giáp cũng được báo cáo và nên được điều trị như các rối loạn nội tiết điển hình.
Có ít bằng chứng về việc tạm ngừng miễn dịch trị liệu sẽ đảo ngược rối loạn chức năng nội tiết và nếu không đe dọa tính mạng thì nên tiếp tục điều trị liệu pháp miễn dịch.
3.4 Tuyến giáp
Nên bổ sung Levothyroxin với mục tiêu đưa TSH về giới hạn bình thường. Tac dụng của phần lớn các thuốc ung thư là vĩnh viễn và nên tiếp tục dùng levothyroxin ngay cả khi đã ngừng điều trị ung thư nhưng có thể cần giảm liều.
Các bệnh nhân điều trị TKIs có thể cần liều Levothyroxine cao hơn thông thường mới có thể đưa được TSH về bình thường.
Suy giáp trung ương do bexarotene tự hết rất nhanh sau khi ngừng điều trị nhưng trong khi điều trị các bệnh nhân có thể cần liều hormon giáp cao gấp 2 – 3 lần bình thường [13].
| Bảng 40.2. Nguy cơ gãy xương ở các bệnh nhân điều trị glucocorticoid | ||
| Người trưởng thành ≥ 40 tuổi | Người trưởng thành < 40 tuổi | |
| Nguy cơ gãy xương cao | Gãy xương trước loãng xương T score cổ xương đùi hoặc cột sống ≤ - 2,5 ở nam ≥ 50 tuổi và phụ nữ mãn kinh. Nguy cơ FRAX® (đã điều chỉnh cho điều trị CG) trong 10 năm của gãy xương lớn ≥ 20%. Nguy cơ FRAX® (đã điều chỉnh cho điều trị CG) trong 10 năm của gãy cổ xương đùi ≥ 3%. | Gãy xương trước loãng xương |
| Nguy cơ gãy xương trung bình | Nguy cơ FRAX® (đã điều chỉnh cho điều trị CG) trong 10 năm của gãy xương lớn 10 - 19%. Nguy cơ FRAX® (đã điều chỉnh cho điều trị CG) trong 10 năm của gãy cổ xương đùi 1–3% | Z score cổ xương đùi hoặc cột sống < 3 hoặc Mất xương nhanh (≥ 10% ở cổ xương đùi hoặc cột sống trong 1 năm) và Điều trị GC liên tục ≥ 7,5 mg/ngày trong ≥ 6 tháng. |
| Nguy cơ gãy xương thấp | Nguy cơ FRAX® (đã điều chỉnh cho điều trị CG) trong 10 năm của gãy xương lớn <10%. Nguy cơ FRAX® (đã điều chỉnh cho điều trị CG) trong 10 năm của gãy cổ xương đùi ≤ 1%. | Không có yếu tố nguy cơ nào nêu trên ngoại trừ điều trị GC. |
(a) Cách tính FRAX sẵn có trên: https://www.sheffield.ac.uk/FRAX/tool. aspx?country=9. (b) Nguy cơ theo FRAX tăng lên 1,15 cho gãy xương nặng do loãng xương và 1,2 cho gãy cổ xương đùi nếu điều trị glucocorticoid (GC) liều > 7,5 mg/ngày. (c) Gãy xương lớn do loãng xương gồm lún xẹp đốt sống (có biểu hiện lâm sàng), gãy cổ xương đùi, xương cổ tay hoặc cánh tay. | ||
3.5 Hệ sinh sản
Các lựa chọn để bảo tồn khả năng sinh sản ở phụ nữ bao gồm ức chế buồng trứng và trữ lạnh phôi và trứng. Phương thức bảo tồn khả năng sinh sản ở nam là gửi vào ngân hàng tình trùng.
3.6 Tuyến yên
Suy tuyến yên nên được điều trị bằng thay thế các hormon bị thiếu hụt.
Viêm tuyến yên có thể phục hồi và có thể phát hiện bằng xét nghiệm hormon thường xuyên. Không nên ngừng điều trị thay thế glucocorticoids khi không làm nghiệm pháp kích thích ACTH để khẳng định chức năng tuyến thượng thận đã bình thường chưa.
4 TÀI LIỆU THAM KHẢO
1. Basch E, Prestrud AA, Hesketh PJ, et al. Antiemetics: American Soci- ety of Clinical Oncology clinical practice guideline update. J Clin Oncol 2011;29(31):4189-4198.
2. Welsh SJ, Corrie PG. Manage- ment of BRAF and MEK inhibitor toxicities in patients with metastatic melanoma. Ther Adv Med Oncol 2015;7(2):122–136.
3. Busaidy NL, Farooki A, Dowlati A, et al. Management of metabolic effects associated with anticancer agents targeting the PI3K-Akt- mTOR pathway. J Clin Oncol 2012;30(23): 2919-2928.
4. Canalis E, Mazziotti G, Giustina A, Bilezikian JP. Glucocorticoid-in- duced osteoporosis: patho- physi- ology and therapy. Osteoporos Int 2007;18(10):1319-1328.
5. Eastell R, Adams JE, Coleman RE, et al. Effect of anastrozole on bone mineral density: 5-year results from the anastrozole, tamoxifen, alone or in combination trial 18233230. J Clin Oncol 2008;26(7):1051–1057.
6. Nguyen PL, Alibhai SM, Basaria S, et al. Adverse effects of androgen deprivation therapy and strate- gies to mitigate them. Eur Urol 2015;67(5):825–836.
7. McClune BL, Polgreen LE, Bur- meister LA, et al. Screening, prevention and management of osteoporosis and bone loss in adult and pediatric hematopoietic cell transplant recipients. Bone Marrow Transplant 2011;46(1):1-9.
8. Corsello SM, Barnabei A, Marchetti P, De Vecchis L, Salvatori R, Torino F. Endocrine side effects induced by immune checkpoint inhibitors. J Clin Endocrinol Metab 2013;98(4): 1361-1375.
9. Faje A. Immunotherapy and hy- pophysitis: clinical presentation, treatment, and biologic insights. Pituitary 2016;19(1):82–92.
10. González-Rodríguez E, Rodrí- guez-Abreu D; Spanish Group for Cancer Immuno-Biotherapy (GETI- CA). Immune checkpoint inhibitors: review and management of endo- crine adverse events. Oncologist 2016;21(7):804–816.
11. Makita N, Miyakawa M, Fujita T, Iiri T. Sunitinib induces hy- pothyroidism with a markedly reduced vascularity. Thyroid 2010;20(3):323–326.
12. Abdulrahman RM, Verloop H, Hoftijzer H, et al. Sorafenib-in- duced hypothyroidism is associ- ated with increased type 3 deiodin- ation. J Clin Endocrinonl Metab 2010;95(8):3758-3762.
13. Hamnvik OP, Larsen PR, Marqu- see E. Thyroid dysfunction from antineoplastic agents. J Natl Cancer Inst 2011;103(21):1572-1587.
14. Sherman SI. Etiology, diagnosis, and treatment recommendations for central hypothyroid- ism associated with bexarotene therapy for cutane- ous T-cell lymphoma. Clin Lympho- ma 2003;3(4):249–252.
15. Appelman-Dijkstra NM, Kokshoorn NE, Dekkers OM, et al. Pituitary dysfunction in adult patients after cra- nial radiotherapy: systematic review and meta-analysis. J Clin Endocrinol Metab 2011;96(8):2330-2340.
16. Dadu R, Zobniw C, Diab A. Manag- ing adverse events with immune checkpoint agents. Cancer J 2016;22(2):121–129.
17. Hughes J, Vudattu N, Sznol M, et al. Precipitation of autoimmune diabe- tes with anti-PD-1 immunotherapy. Diabetes Care 2015;38(4):e55-e57.
18. Kumpulainen EJ, Hirvikoski PP, Virtaniemi JA, et al. Hypothy- roidism after radiotherapy for laryngeal cancer. Radiother Oncol 2000;57(1):97–101.
19. Goldman JW, Mendenhall MA, Rettinger SR. Hyperglycemia associated with targeted onco- logic treatment: mechanisms and management. Oncologist 2016;21(11):1326–1336.
20. Buckley L, Guyatt G, Fink HA, et al. 2017 American College of Rheu- matology Guidelie for the preven- tion and treatment of glucocorti- coid-induced osteoporosis. Arthritis Rheumatol 2017;69(8):1521-1537. Available at: https://www.rheuma- tology.org/Portals/0/Files/Guideline- for-the-Prevention-and-Treatment- of-GIOP.pdf
21. Hadji P, Aapro MS, Body JJ, et al. Management of aromatase inhibitor-associated bone loss in postmenopausal women with breast cancer: practical guidance for pre- vention and treatment. Ann Oncol 2011;22(12):2546-2555.
22. Morganstein DL, Lai Z, Spain L, et al. Thyroid abnormalities following the use of cytotoxic T-lymphocyte antigen-4 and programmed death receptor protein-1 inhibitors in the treatment of melanoma. Clin Endo- crinol (Oxf) 2017;86(4):614–620.

