Cai máy hay không cai máy: Hướng dẫn thực hành tập trung vào bệnh nhân về cai máy thở

Trungtamthuoc.com - Từ khi ra đời y học chăm sóc tích cực và thông khí nhân tạo, nghiên cứu về cai máy thở đã làm thay đổi việc chăm sóc bệnh nhân tại các đơn vị chăm sóc đặc biệt. Bài viết này cung cấp một cái nhìn bao quát về phân loại cai máy, nguyên nhân thất bại trong việc cai máy, bằng chứng đằng sau các yếu tố dự đoán cai máy và các phương thức cai máy.
Bản dịch của Bác sĩ Đặng Thanh Tuấn – Bệnh viện Nhi Đồng 1
Tải PDF bản dịch TẠI ĐÂY
1 Tóm tắt
Kể từ khi ra đời y học chăm sóc tích cực và thông khí nhân tạo, tài liệu và nghiên cứu về cai máy thở đã làm thay đổi việc chăm sóc bệnh nhân hàng ngày tại các đơn vị chăm sóc đặc biệt (intensive care unit ICU). Khi kiến thức của chúng tôi về thở máy (mechanical ventilation - MV) được cải thiện, nhu cầu nghiên cứu sự tương tác giữa bệnh nhân-máy thở và các yếu tố dự đoán cai máy cũng tăng theo. Các thử nghiệm ngẫu nhiên đã đánh giá việc sử dụng cai máy dựa trên phác đồ (so với chăm sóc thông thường) để nghiên cứu thời gian MV trong ICU, các kỹ thuật khác nhau để tiến hành các thử nghiệm thở tự nhiên (spontaneous breathing trials – SBT) và các chiến lược để rút ống nội khí quản cho một bệnh nhân có SBT ban đầu không thành công. Bất chấp những cột mốc đáng kể trong việc quản lý nhiều bệnh góp phần gây suy hô hấp có thể đảo ngược, trong việc áp dụng các biện pháp can thiệp phục hồi chức năng sớm để bảo tồn tính toàn vẹn của cơ và trong công nghệ máy thở giúp giảm thiểu chấn thương và rối loạn đồng bộ của máy thở, những rào cản lớn để giải phóng thành công khỏi MV vẫn tồn tại. Đánh giá này cung cấp một cái nhìn bao quát về phân loại cai máy, nguyên nhân thất bại trong việc cai máy và bằng chứng đằng sau các yếu tố dự đoán cai máy và các phương thức cai máy.
2 Giới thiệu/Lịch sử
Cai máy là một can thiệp phức tạp đòi hỏi sự chú ý và chuyên môn của các chuyên gia chăm sóc tích cực. Bảy mươi năm trước, Tiến sĩ Ibsen đã giới thiệu kỹ thuật thông khí áp suất dương mang tính cách mạng trong trận dịch bại liệt ở Copenhagen đã cứu sống vô số người.1,2 Năm 1955, Tiến sĩ Carl- Gunnar Engstrom giới thiệu máy thở định hướng thể tích đầu tiên.3 Năm 1961, TS. Henrik Bendixin và Henning Pontoppidan đã thành lập đơn vị chăm sóc đặc biệt về hô hấp (ICU) đầu tiên tại Bệnh viện Đa khoa Massachusetts và tiến hành nghiên cứu cai máy thở.4 Đến năm 1977, Henning, Shubin và Weil đã sử dụng ống thông bóng thực quản để thực hiện các phép đo chi tiết về công thở.5 Vào những năm 1970, thông khí bắt buộc ngắt quãng đồng bộ (SIMV) đã được sử dụng rộng rãi làm chế độ cai máy được lựa chọn ở hầu hết các ICU. Trước khi áp dụng SIMV, các kỹ thuật cai máy bao gồm ngắt kết nối bệnh nhân khỏi máy thở trong 3-4 phút, kéo dài cứ sau ba mươi phút và xác định khả năng chịu đựng của họ đối với việc ngừng đột ngột. Vào những năm 1980, các nghiên cứu về tương tác giữa bệnh nhân và máy thở cho thấy những hạn chế của SIMV trong chế độ cai máy thở. Vào giữa những năm 1990, đã có sự thay đổi trong số những người theo chủ nghĩa tích cực so sánh các phương thức cai máy khác nhau khỏi MV.1
3 Định nghĩa và phân loại
Cai máy được định nghĩa là sự giảm dần khả năng hỗ trợ thở máy ở những bệnh nhân có nguyên nhân cơ bản gây suy hô hấp đang được cải thiện và nên được coi là một quá trình liên tục.6,7 Ban đầu, bệnh nhân cần hỗ trợ thở máy hoàn toàn để kiểm soát suy hô hấp cấp. Sau đó, việc khôi phục tỷ lệ PaO2/FiO2, yêu cầu FiO2 thấp hơn và cài đặt máy thở thấp hơn có thể cho thấy việc bắt đầu đánh giá mức độ sẵn sàng cai thở máy. Phải đáp ứng các tiêu chí đánh giá mức độ sẵn sàng lâm sàng và khách quan khác nhau.8 Một bệnh nhân được đo các yếu tố dự đoán cai máy trong khi thử nghiệm thở tự nhiên (SBT) trong một khoảng thời gian quy định. Cai máy thành công được xác định bằng việc rút ống nội khí quản và không hỗ trợ thở máy 48 giờ sau khi rút ống.9 Ngược lại, thất bại cai máy được định nghĩa là không có khả năng vượt qua SBT hoặc cần đặt lại ống nội khí quản trong vòng 48 giờ sau rút ống10
Việc cai máy có thể được phân loại là đơn giản, khó khăn hoặc kéo dài. Cai máy đơn giản có tỷ lệ thành công cao hơn (30-60%) và tỷ lệ từ vong thấp hơn (5-10%). Mục tiêu chính của nhóm này là xác định sự sẵn sàng cai máy càng sớm càng tốt và đảm bảo cách tiếp cận có hệ thống đối với việc ngừng máy thở. Trong trường hợp cai máy khó, bệnh nhân cần tới ba SBT hoặc bảy ngày để cai máy. Đối với bệnh nhân khó cai máy, mục tiêu chính là xác định và giải quyết các nguyên nhân có thể khắc phục được gây ra thất bại SBT. Cuối cùng, việc cai máy kéo dài xảy ra khi bệnh nhân thất bại hơn 3 lần SBT hoặc cần hơn 7 ngày để thoát khỏi MV. Kết hợp lại, các nhóm cai máy khó khăn và kéo dài có tỷ lệ thành công thấp hơn (15-40%) và tỷ lệ tử vong cao hơn (10-30%). Ở bệnh nhân cai máy kéo dài, các biện pháp phòng ngừa như khuyến khích thở tự nhiên sớm, sử dụng thuốc an thần có kiểm soát tốt và vận động sớm có thể giúp ích.
4 Sinh lý bệnh của cai máy thất bại
Để giải quyết các nguyên nhân có thể khắc phục được của thất bại cai máy, một cách tiếp cận có cấu trúc đơn giản cho phép xem xét một cách có hệ thống về sinh lý bệnh của thất bại cai máy (Bảng 1). Thất bại trong việc ngừng thở máy có thể phụ thuộc vào nhiều yếu tố và thường là hậu quả của nhiều nguyên nhân. Bất kể rối loạn tiềm ẩn dẫn đến nhu cầu về MV, cơ chế phổ biến nhất nói chung là sự mất cân bằng giữa khả năng tạo lực của cơ hô hấp và tải trọng mà chúng phải đối mặt khi ngừng MV.
4.1 Rối loạn chức năng đường thở và phổi
Rối loạn chức năng đường thở và phổi có thể được nhìn nhận một cách rộng rãi qua lăng kính các bệnh làm tăng sức cản đường thở và những bệnh làm giảm độ giãn nở. Nguyên nhân gây cản trở đường hô hấp trên là do có ống nội khi quản, tổn thương khí quản như hẹp khí quản, mềm sụn khí quản, hình thành mô hạt và các bệnh đường hô hấp nhỏ như hen suyễn và bệnh phổi tắc nghẽn mạn tính (COPD), Tuy nhiên, nói chung, có một quan niệm sai lầm rằng, sau khi rút nội khí quản, sức cản đường hô hấp trên sẽ giảm. Trên thực tế, công thờ ở bệnh nhân được thở máy trong ± 5,5 ngày đã tăng lên sau khi rút ống nội khí quản, một hậu quả có thể xảy ra là phù nề đường hô hấp trên. Trong một nghiên cứu về bệnh nhân COPD thất bại với SBT, sức cản đường thở tăng đáng kể (9 ± 2 cm H2O lên đến 15 ± 2 cm H2O; p <0,05), trong khi bệnh nhân cai máy thành công, sức cản đường thở vẫn giữ nguyên. Ngoài ra, sức cản đường thở tăng lên có liên quan đến sự phát triển của áp lực dương cuối thì thở ra tự động (intrinsic positive end-expiratory pressure - PEEPi). PEEPi có thể phát triển do tăng sức cản với lưu lượng, hạn chế lưu lượng thở ra, tần số thở cao và mất khả năng đàn hồi của phổi. Tình trạng siêu căng phồng (hyperinflation) phối do PEEPi đặt cơ hoành ở vị trí dưới mức tối ưu trên đường cong chiều dài – áp lực, làm suy giảm khả năng tạo áp lực âm. PEEPi có liên quan đến sự không đồng bộ của bệnh nhân máy thở và đặc biệt là việc kích hoạt không hiệu quả (Hình 1).
Bảng 1. Sinh lý bệnh của cai máy thất bại
Nguyên nhân cai máy thất bại | Can thiệp |
Rối loạn chức năng đường thở và phổi
| Thuốc giãn phế quản dạng hít Tắc nghẽn đường hô hấp Tính toán PEEP nội tại Chẩn đoán nội soi phế quản trong khi SBT Dùng thuốc lợi tiểu Chọc dịch màng phổi |
Rối loạn chức năng tim do cai máy | Điện tâm đồ trong SBT Siêu âm tim trước và sau SBT POCUS tim tại giường Chiến lược giảm hậu tải |
Rối loạn chức năng nhận thức | Công cụ sàng lọc mê sảng Kỹ thuật định hướng lại Vận động sớm Giảm tiếng ồn/ánh sáng trong khi ngủ Trị liệu hành vi Thuốc giải lo âu |
Rối loạn nội tiết và chuyển hóa | Điện giải và khí máu Nồng độ cortisol và hormone tuyến giáp trong huyết tương |
Rối loạn chức năng cơ hoành | Vận động sớm EMG cơ hoành Áp lực xuyên cơ hoành sử dụng ống thông bóng dạ dày và thực quản Sinh thiết cơ hoành |
Dinh dưỡng | Đo nhiệt lượng gián tiếp |
EKG = điện tâm đồ: PEEP = áp lực dương cuối thì thở ra; SBT = thử nghiệm thở tự nhiên; POCUS = siêu âm tại điểm chăm sóc; EMG - điện cơ đồ.
Nguyên nhân làm giảm độ giãn nở bao gồm: phù phổi, dịch màng phổi, cổ trướng, tăng áp lực ổ bụng, béo phì, viêm phổi, bệnh phổi kẽ (interstitial lung diseases – ILD) và phù phế nang. Độ giãn nở của hệ hô hấp (Cs) phụ thuộc vào PEEP và áp lực cao nguyên (Pplat) và được tính theo: Vt/(Pplat PEEP total). Độ giãn nở phối tĩnh bình thường là 200 mL/cm H2O đối với bệnh nhân không đặt nội khí quản và 60 mL/cm H2O hoặc thấp hơn đối với bệnh nhân cần thở máy.
Nội soi phế quản ống mềm là tiêu chuẩn vàng để đánh giá chẩn đoán các nguyên nhân tiềm ẩn gây cản trở đường hô hấp trên như tổn thương khí quản, mở khí quản sai vị trí, mềm khí quản và dịch tiết đường hô hấp đặc. Có thể sử dụng các biện pháp can thiệp như thông khí không xâm lấn và đặt stent nội khí quản để giảm sức đề kháng. Hơn nữa, ở những bệnh nhân mắc bệnh đường hô hấp nhỏ, PEEP được áp dụng phải phù hợp với mức PEEPi, theo ước tính bằng kỹ thuật tắc nghẽn thì thở ra. Co thắt phế quản có thể được giảm bớt bằng cách sử dụng thuốc giãn phế quản thường xuyên. Thuốc lợi tiểu có thể làm giảm phù phổi và thành ngực, trong khi chọc dịch màng phổi và chọc dịch màng bụng có thể giải quyết dịch màng phổi và dịch báng tương ứng, và giúp cải thiện tình trạng xẹp phổi do đó cải thiện độ giãn nở và tạo điều kiện cai máy.
Phủ thanh quản có liên quan đến việc đặt nội khí quản kéo dài và gây ra thở rít sau rút nội khí quản, làm tăng nguy cơ đặt lại nội khí quản. Thử nghiệm rò rỉ bỏng chèn (cuff leak test) có thể được sử dụng như một chỉ số thay thế cho phù thanh quản và hướng dẫn các quyết định quan trọng để rút ống nội khí quản cho bệnh nhân hoặc tiếp tục thở máy. Một phân tích tổng hợp và đánh giá hệ thống gần đây chỉ ra tính đặc hiệu tuyệt vời và độ nhạy vừa phải của thử nghiệm rò rỉ bóng chèn để dự đoán tắc nghẽn đường thở sau rút ống. Các yếu tố nguy cơ nổi bật nhất đối với thở rít sau rút ống bao gồm đặt nội khí quản sau chấn thương, đặt nội khí quản lâu hơn sáu ngày, ống nội khí quản lớn, giới tính nữ và đặt lại ống nội khí quản sau khi rút ống nội khí quản ngoài kế hoạch. Thử nghiệm rò rỉ bóng chèn là một công cụ hữu ích trong việc ra quyết định rút ống nội khí quản, nhưng độ nhạy thấp cho thấy xét nghiệm âm tính không thể loại trừ hoàn toàn tắc nghẽn đường thở sau rút ống và bệnh nhân vẫn cần được theo dõi chặt chẽ sau rút ống. Hơn nữa, liệu pháp steroid toàn thân làm giảm cả tỷ lệ đặt lại ống nội khí quản và tỷ lệ thở rít sau rút ống (post- extubation stridor – PES). Hướng dẫn thực hành lâm sàng ATS/ACCP đề xuất thực hiện xét nghiệm rò rỉ bóng chèn ở người lớn thở máy đáp ứng các tiêu chí rút ống nội khi quản và được coi là có nguy cơ cao mắc PES và đề xuất rằng đối với những người lớn đã thất bại trong xét nghiệm rò rỉ bóng chèn nhưng đã sẵn sàng rút ống nội khí quản, nên sử dụng steroid toàn thân dùng ít nhất 4 giờ trước khi rút nội khí quản.
Trong bối cảnh các rối loạn hô hấp nguyên phát đặc biệt, chẳng hạn như bệnh phổi tắc nghẽn mạn tính, xơ nang, hội chứng giảm thông khí do béo phì, rối loạn thần kinh cơ và rối loạn nhi khoa dễ bị suy hô hấp tăng CO₂ mạn tính, IMV và thông khí không xâm lấn đã trở thành một lựa chọn điều trị được thiết lập tốt. Cần phải cân nhắc đặc biệt khi quản lý những bệnh nhân này trong quá trình cai máy và các thuật toán được xác định rõ ràng đã được Hiệp hội Hô hấp Đức đề xuất để điều trị suy hô hấp mãn tính.
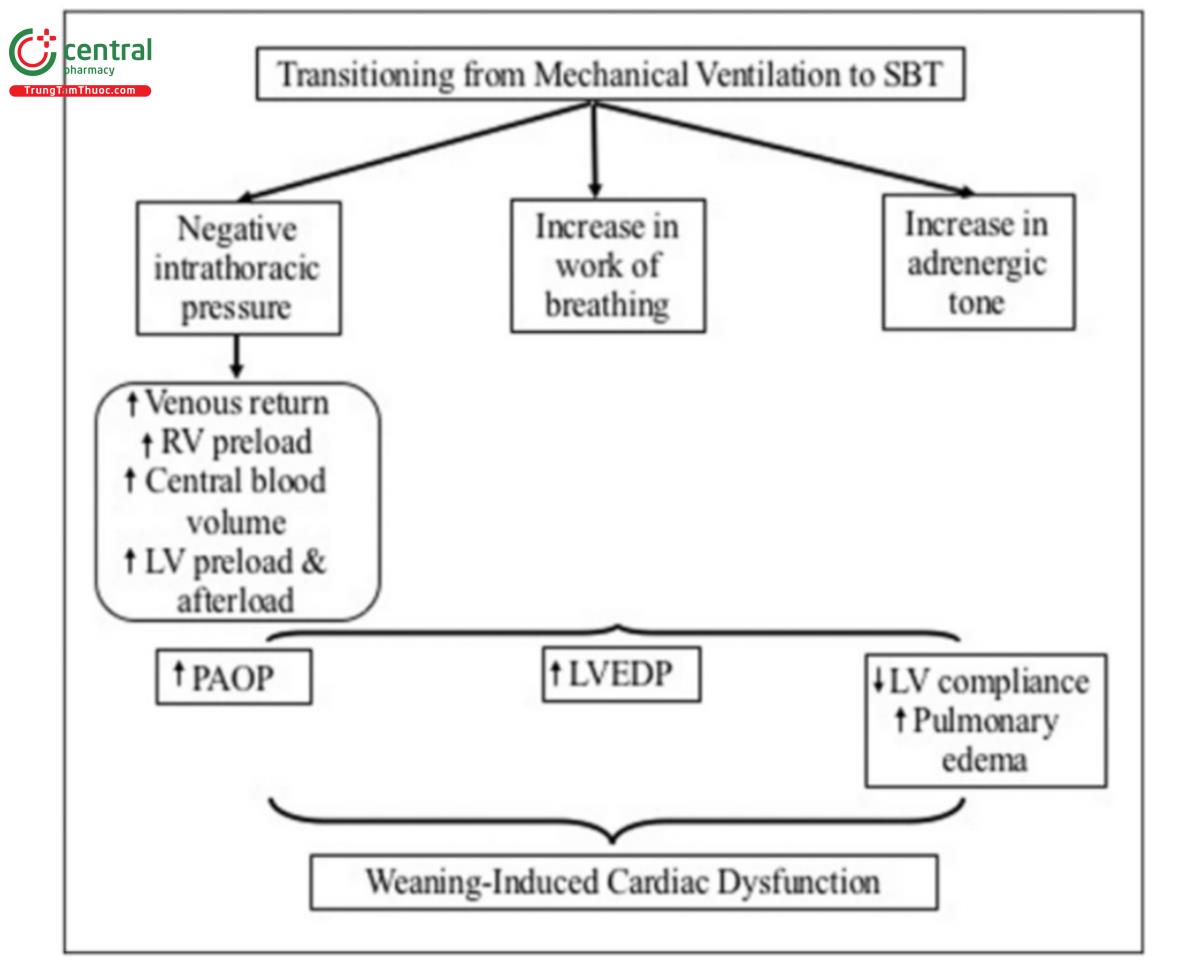
4.2 Rối loạn chức năng tim do cai máy
Rối loạn chức năng tim do cai máy được mô tả lần đầu tiên cách đây 30 năm. Các nhà điều tra đã sử dụng các thủ thuật đánh giá tim đơn giản tại giường để nghiên cứu những bệnh nhân thở máy có thể bị suy tim sung huyết tiềm ẩn, thiếu máu cơ tim hoặc bệnh động mạch vành trong giai đoạn cai máy. Có nhiều cơ chế được đề xuất cho rối loạn chức năng tim và rối loạn chức năng tâm thất trái (left ventricular - LV) do cai máy (Hình 2). Giảm rõ rệt áp lực trong lồng ngực, kích hoạt trương lực adrenergic, giảm oxy máu, tăng CO2 và tăng công thở là những hậu quả quan trọng của việc cai máy không thành công mà cuối cùng có thể dẫn đến tăng cấp tính áp lực cuối tâm trương thất trái (left ventricular end-diastolic pressure - LVEDP) và các bệnh lý tim mạch phù phổi.
Nghi ngờ cai máy thất bại do yếu tố tim mạch có thể thúc đẩy việc sử dụng sớm các kỹ thuật chẩn đoán để xác định nguyên nhân cụ thể. Điện tâm đồ có thể tiết lộ những thay đổi do thiếu máu cục bộ (ví dụ: sóng T đảo ngược hoặc đoạn ST chênh lên). Siêu âm tim qua thành ngực (transthoracic echocardiography - TTE) tại giường và siêu âm phổi có thể chẩn đoán rối loạn chức năng tâm trương. TTE cũng có thể chứng minh một cách đáng tin cậy sự thư giãn của LV (sóng e) và mức độ rối loạn chức năng tâm trương LV bằng cách tính tỷ lệ E/e'. Các dấu ấn sinh học về tình trạng thể tích và chức năng tim, chủ yếu là peptide natriuretic loại B (BNP) và/hoặc N-terminal (NT)-proBNP trong huyết thanh, đã được sử dụng làm dấu hiệu thay thế của rối loạn chức năng tim mạch. Bệnh nhân được phát hiện tăng áp lực tắc động mạch phối (pulmonary artery occlusion pressure - PAOP) trong SBT, thường bị giảm đáng kể độ bão hòa oxy tĩnh mạch hỗn hợp trong SBT, cho thấy sự góp phần của rối loạn chức năng tim mạch vào sự mất cân bằng nghiêm trọng giữa cung cấp oxy và tăng tiêu thụ oxy. Tăng cấp tính nồng độ protein huyết tương hoặc hemoglobin, cả hai đều lớn hơn 5% trong SBT, phản ảnh sự co lại thể tích do hình thành phù phổi, có tương quan với mức tăng PAOP trên 18 mm Hg.
Đối với các trường hợp nghi ngờ hoặc xác nhận rối loạn chức năng tim, các chiến lược quản lý và giảm nhẹ hiệu quả bao gồm thuốc lợi tiểu, nitrat và các thuốc vận mạch khác. Thuốc lợi tiểu có thể làm giảm tình trạng quá tải thể tích toàn cầu bằng cách giảm thể tích cuối tâm trương thất trái (left ventricular end diastolic volume LVEDV). Trên thực tế, LVEDV giảm một chút sẽ dẫn đến LVEDP giảm rõ rệt. Furosemide có liên quan đến cân bằng dịch âm, thời gian thở máy ngắn hơn và tác dụng mạnh hơn ở bệnh nhân rối loạn chức năng tâm thu LV. Nitrat gây giãn tĩnh mạch hệ thống dẫn đến giảm thể tích máu trung tâm, giãn mạch động mạch và do đó làm giảm hậu tải LV và giãn mạch vành nhờ cải thiện khả năng cung cấp oxy cho cơ tim.
Chất nhạy cảm Canxi và thuốc mở kênh Kali nhạy cảm ATP, thuốc ức chế levosimendan và phosphodiesterase-3 như milrinone, amrinone và enoximone có tác dụng giãn mạch trong việc giảm hậu tài RV và giảm suy RV, đồng thời chúng đã cho thấy bằng chứng về việc cải thiện chức năng LV dẫn đến cai máy thành công. Thuốc ức chế Phosphodiesterase-5, chẳng hạn như Sildenafil, đã cho thấy hiệu quả ở bệnh nhân mắc COPD và tăng huyết áp phổi. Thuốc chẹn beta như Atenolol và esmolol đã được sử dụng kết hợp với thuốc ức chế men chuyển angiotensin và thuốc chẹn kênh canxi, trong một nhóm nhỏ bệnh nhân bị phù phổi do tim liên quan đến rối loạn chức năng tâm trương LV được bộc lộ trong SBT.21 Những lựa chọn điều trị này có thể giải quyết vấn đề rối loạn chức năng tim do cai máy khi áp dụng cho bệnh nhân khó cai máy.
4.3 Rối loạn chức năng nhận thức
Mê sảng, trầm cảm, lo âu và rối loạn giấc ngủ chiếm phần lớn nguyên nhân cai máy thất bại ở bệnh nhân ICU nhập viện kéo dài. Điều quan trọng là các yếu tố điều trị và bệnh nhân dẫn đến rối loạn điều hòa nhịp sinh học và góp phần gây ra rối loạn chức năng nhận thức ở những bệnh nhân khó cai máy. Việc theo dõi thường xuyên như xét nghiệm trong phòng thí nghiệm, nghiên cứu X quang và vận chuyển nội bệnh viện để thực hiện các thủ thuật có thể góp phần làm giấc ngủ bị phân mảnh. Các loại thuốc như opioid, benzodiazepin và MV cũng có thể dẫn đến rối loạn cấu trúc giấc ngủ và rối loạn chức năng nhận thức. Tuổi già, rối loạn điều hòa nhiệt độ, bệnh đi kèm và một số bệnh tâm thần tiềm ẩn cũng có thể ảnh hưởng xấu đến việc cai máy.
4.4 Rối loạn chức năng cơ hoành
Các nguyên nhân phổ biến của rối loạn chức năng cơ hoành bao gồm COPD, yếu cơ mắc phải tại ICU (ICU-acquired weakness ICUAW) chẳng hạn như bệnh đa dây thần kinh nghiêm trọng và bệnh đa cơ bệnh nghiêm trọng, rối loạn thần kinh cơ như nhược cơ, rối loạn chức năng cơ hoành do máy thở và tổn thương dây thần kinh cơ hoành.
Để hiểu rối loạn chức năng cơ hoành, các phép đo như áp lực hít vào tối đa (maximal inspiratory pressure - MIP), áp lực xuyên cơ hoành (transdiaphragmatic pressure - Pdi), đo siêu âm cơ hoành và điện cơ cơ hoành (EMG) có thể hữu ích. MIP và áp lực thở ra tối đa (maximal expiratory pressure – MEP) là các bài kiểm tra sức mạnh cơ hô hấp tổng thể và có thể được đo bằng thiết bị cầm tay kết nối với đường thở nhân tạo." MIP trên 30 cm H2O có liên quan đến thời gian rút ống thành công ngắn hơn. Việc ghi lại áp lực thực quản (esophageal pressure - Pes) và áp lực dạ dày (gastric pressure Pga) bằng bóng chuyên dụng cho phép tính toán áp lực xuyên cơ hoành (APdi = APga - APes), một thước đo cụ thể về độ co bóp của cơ hoành. Việc thu thập và giải thích các biện pháp này đòi hỏi phải có chuyên môn. Siêu âm cơ hoành là một công cụ thiết thực và không xâm lấn để đánh giá độ lệch và độ dày của cơ hoành. Tỷ lệ độ dày cơ hoành >30-36% có liên quan đến việc tăng khả năng cai máy thành công sau SBT. EMG cơ hoành, một chỉ số tốt về điều khiển hô hấp thần kinh đến cơ hoành, có thể cung cấp dữ liệu quan trọng về việc dỡ tải cơ hô hấp, tương tác giữa bệnh nhân và máy thở và ảnh hưởng của thuốc an thần còn lại lên điều hòa hô hấp.
Gần đây hơn, các thiết bị kích thích dây thần kinh cơ hoành đã làm giảm bớt tình trạng thất bại cai máy do dây thần kinh cơ hoành gây ra. Lungpacer DPT SystemTM được thiết kế để kích thích điện các dây thần kinh cơ hoành của bệnh nhân thông qua ống thông kích thích đa điện cực tạm thời, sử dụng một lần (LIVE Catheter). Có một điện cực gần nhắm vào dây thần kinh cơ hoành bên trái và điện cực xa nhắm vào dây thần kinh cơ hoành bên phải. Như được thể hiện trong thử nghiệm tỉnh an toàn và khả thi của RESCUE 1, MIP tăng 105% ở những trẻ cai máy thành công (thay đổi trung bình 19,7 ± 17,9 cm H2O; p = 0,03), trong khi chỉ số thở nông nhanh trung bình (RSBI) được cải thiện 44% ( thay đổi trung bình -63,5 ± 64,4; p = 0,04).35 Trong thử nghiệm đối chứng ngẫu nhiên RESCUE 2 ở Châu Âu, sự thay đổi về MIP so với đường cơ sở là đáng kể [chênh lệch 15 ± 4 cmH2O, p = 0,0002]; sự thay đổi RSBI so với đường cơ sở cũng rất đáng kể [chênh lệch -30 ± 15, p = 0,049]; và cả hai biển số đều cho thấy mối quan hệ giữa liều lượng kích thích và đáp ứng ở các ứng cử viên kích thích thần kinh cơ hoành qua đường tĩnh mạch tạm thời.
4.5 Rối loạn chuyển hóa và nội tiết
Hạ kali máu, hạ phosphat máu và hạ Magie máu có thể dẫn đến cai máy thất bại. Suy tuyến thượng thận và suy giáp cũng có liên quan đến việc cai máy thất bại. Việc sử dụng corticosteroid và kiểm soát đường huyết chặt chẽ có thể làm giảm tình trạng cai máy thất bại. Việc bổ sung corticosteroid ở liều stress trước khi rút ống nội khí quản ở bệnh nhân suy tuyến thượng thận dẫn đến tỷ lệ thành công cao hơn đáng kể trong việc giải phóng máy thở và thời gian cai máy ngắn hơn.37 Bệnh suy giáp có tỷ lệ cai máy thất bại là 3% và việc bổ sung tuyến giáp được cho là có liên quan đến việc giải phóng thành công khỏi MV.
4.6 Rối loạn chức năng đường tiêu hóa và thận
Các tình trạng trong ổ bụng và tổn thương thận cấp tính (AKI) đã cho thấy kết quả xấu đi trong khi giải phỏng bệnh nhân khỏi MV. Tăng huyết áp trong ổ bụng, tràn khí phúc mạc, tràn máu phúc mạc, chấn thương bụng, viêm tụy, bệnh gan giai đoạn cuối, ghép gan có thể dẫn đến ARDS. Khi đường cong áp suất-thể tích dịch chuyển sang phải do độ giãn nở giảm so với độ lệch hướng lên của vị trí ban đầu của cơ hoành; khối lượng công hô hấp tăng lên và áp lực hít vào cần thiết để thông khí cũng tăng lên. Hơn nữa, so với những bệnh nhân không có AKI, bệnh nhân AKI ít có khả năng cai máy và khó cai máy. Họ cũng có nhiều khả năng có thời gian MV dài hơn trong ICU và tăng LOS trong ICU. Những rối loạn chức năng cụ thể của cơ quan này làm trầm trọng thêm khả năng ngắt kết nối thành công khỏi MV của một số bệnh nhân.
4.7 Dinh dưỡng
Suy dinh dưỡng thường xuyên xảy ra ở bệnh nhân thở máy và có tiên lượng xấu. Tình trạng dinh dưỡng có thể được đánh giá bằng cách xác định chỉ số khối cơ thể, nồng độ Albumin huyết tương và cân bằng nitơ. Lý tưởng nhất là nhu cầu năng lượng nên được xác định bằng phép đo nhiệt lượng gián tiếp để ngăn ngừa việc cho ăn quá ít hoặc quá nhiều.
5 Quy trình cai máy thông thường
Giai đoạn cai máy bao gồm chiến lược hai bước bao gồm đánh giá mức độ sẵn sàng và SBT. Để đánh giá mức độ sẵn sàng, trước tiên các bác sĩ lâm sàng phải giải quyết các tiêu chí lâm sàng và khách quan ngay từ 48-72 giờ sau khi nhập viện ICU. Kỳ nghỉ an thần đóng một vai trò quan trọng trong việc đánh giá mức độ sẵn sàng. Cần điều chỉnh các tác nhân có thể đảo ngược gây suy hô hấp (ví dụ, rối loạn điện giải, quá tải thể tích, viêm phổi và các yếu tố sinh lý bệnh khác). Sau đó, nên áp dụng các tiêu chí khách quan để đánh giá thêm mức độ sẵn sàng (Bảng 2).
Bảng 2. Tiêu chí khách quan để đánh giá mức độ sẵn sàng.
Cải thiện nguyên nhân gây suy hô hấp PaO2/FiO2 ≥ 150 hoặc SpO2 ≥ 90% trên FiO2 ≤40% và PEEP ≤ 5 cmH2O pH >7,25 Ổn định huyết động (không dùng hoặc dùng thuốc vận mạch liều thấp) Bắt đầu nỗ lực hô hấp Huyết sắc tố ≥7 mg/dL Thân nhiệt < 38°C Tỉnh táo và lanh lợi hoặc dễ đánh thức. |
Bảng 3. Các thông số máy thở được nghiên cứu khi cai máy.
Thông số | Giá trị ngưỡng | Phạm vi tỷ lệ khả năng dương tính |
Các phép đo của máy thở | ||
VE | 10-15 L/phút | 0,81-2,37 |
Lực hít vào âm | -20 đến -30 cm H2O | 0,23-2,45 |
PImax | -15 đến -30 cm H2O | 0,98-3,01 |
P0,1/PImax | 0,30 | 2,14-25,3 |
chỉ số CROP | 13 | 1,05-19,74 |
Các thông số được đo trong SBT | ||
f/VT | 60-105 nhịp thở/phút/L | 0,84-4,67 |
VE – thể tích phút; PImax - áp lực hít vào tối đa; P0,1 - áp lực tắc đường thở 0,1 giây sau khi bắt đầu lưu lượng hít vào; Chỉ số CROP = chỉ số độ giãn nở, tần số, oxygen hóa và áp suất; RSBI (f/VT) = chỉ số thở nhanh nông: Chuyển thể từ Tài liệu tham khảo.
Khi các tiêu chí này được đáp ứng, bệnh nhân có thể được đánh giá các thông số dự đoán cai máy thành công. Năm 2012, Đại học McMaster đã đánh giá vai trò của tám thông số với tỷ lệ khả năng đáng kể trong việc dự đoán thành công việc ngừng máy thở (Bảng 3). Bất chấp ý nghĩa thống kê của các thông số này, tỷ lệ khả năng nói chung thấp cho thấy rằng khả năng áp dụng lâm sàng của các thông số này cho từng bệnh nhân là không quan trọng.
Trong một nghiên cứu mang tính bước ngoặt, RSBI <105 có liên quan đến xác suất rút ống nội khí quản thành công là 97% trong khi RSBI >105 có xác suất rút ống nội khí quản thất bại là 64%. Tuy nhiên, phân tích tổng hợp tiếp theo cho thấy độ nhạy và độ đặc hiệu gộp thấp hơn nhiều, lần lượt là 84% và 44%. Ngoài ra, so sánh RSBI với quyết định cai máy trên lâm sàng cho thấy thời gian cai máy trung bình ngắn hơn đáng kể khi không sử dụng RSBI (2,0 vs 3,0 ngày, p = 0,04).
6 Thử nghiệm thở tự nhiên
Nhiều kỹ thuật SBT khác nhau đã được đề xuất với nhiều loại hỗ trợ khác nhau. Thử nghiệm ống T đòi hỏi phải ngắt kết nối bệnh nhân khỏi máy thở và cung cấp thêm oxy (thử nghiệm ống T). Thử nghiệm thông khí hỗ trợ áp lực (PSV) được thực hiện mà không ngắt kết nối bệnh nhân khỏi máy thở, sử dụng mức hỗ trợ áp lực thấp (PS 5-8 cm H₂O, PEEP 5 cm H2O, F₁O2 ≤0,4-0,5). Chức năng bù ổng tự động (automated tube compensation ATC) dựa trên nguyên lý làm việc vòng kín giản tiếp. Nó bù đắp cho sự sụt giảm áp lực phụ thuộc vào lưu lượng qua ống khí quản trong cả thì hít vào và thở ra. Các nghiên cứu ATC đã cho thấy làm giảm công thở, tăng sự thoải mái về hô hấp và cho phép dự đoán rút ống nội khí quản thành công. ATC không phải là chế độ thông khí độc lập mà là một thành phần hỗ trợ áp lực tỷ lệ với lưu lượng có thể kết hợp với tất cả các chế độ thông khí thông thường.
Khả năng chịu đựng SBT từ 30 đến 120 phút sẽ nhanh chóng được xem xét giải phóng máy thở vĩnh viễn. Tuy nhiên, nếu bệnh nhân thất bại trong SBT dựa trên các tiêu chí cụ thể (Bảng 4), nguyên nhân dẫn đến SBT bị thất bại phải được xác định. Khi các nguyên nhân thất bại có thể đảo ngược được khắc phục, SBT nên được thử lại sau mỗi 24 giờ và kết hợp với các thử nghiệm đánh thức tự phát. Sau SBT thất bại, bệnh nhân sẽ nhận được hình thức hỗ trợ thở máy ổn định, không mệt mỏi, thoải mái.
Bảng 4. Tiêu chí thất bại của SBT.
Nhịp thở >35 nhịp/phút Tăng hoạt động cơ hô hấp phụ SpO2 liên tục < 92% (hoặc < 88% trong trường hợp có bệnh phổi mãn tính tiềm ẩn) với FiO2 ≥ 0,4 hoặc ít nhất 6L/phút oxy Huyết động không ổn định được xác định khi tần số tim >140 nhịp/phút hoặc huyết áp tâm thu > 180 mmHg, có dấu hiệu giảm tưới máu (xuất hiện tím tái hoặc da nổi bông) Trạng thái tinh thần chán nản hoặc kích động |
7 An thần, phong tỏa thần kinh cơ, vận động sớm và cai máy thở
Mục tiêu của thuốc an thần đầy đủ là giảm thiểu đau đớn và lo lắng khi thở máy mà không làm gián đoạn khả năng thờ tự nhiên của bệnh nhân. Thuốc an thần thường được sử dụng bao gồm Propofol, Fentanyl, dexmedetomidine và benzodiazepin. Việc ngừng sử dụng thuốc an thần hàng ngày liên quan đến thử nghiệm cai máy đã được chứng minh là giúp tối đa hóa khả năng thở của bệnh nhân và giảm thời gian dành cho MV, tần suất biến chứng và chỉ phi. Vào năm 2013, lực lượng đặc nhiệm ACCM/SCCM đã tán thành các chiến lược an thần ưu tiên sử dụng thuốc an thần nonbenzodiazepine (propofol hoặc dexmedetomidine) hơn các thuốc benzodiazepin (Midazolam hoặc lorazepam) để cái thiện kết quả lâm sàng ở bệnh nhân trưởng thành thở máy tại ICU (Bằng chứng + 2B), ATS/ACCP khuyến nghị sử dụng một phác đồ để giảm thiểu tình trạng an thần ở những bệnh nhân nhập viện cấp tỉnh được thở máy > 24 giờ.
Một trong những hạn chế đối với việc sử dụng thuốc phong tỏa thần kinh cơ (neuromuscular blocking agents - NMBA) trong ICU là sự xuất hiện của ICUAW. Tỷ lệ mắc ICUAW là 34-60% ở bệnh nhân mắc ARDS. Giới nữ, rối loạn chức năng đa cơ quan (22), thời gian MV, sử dụng corticosteroid, thời gian hỗ trợ thuốc vận mạch, thời gian nằm ICU (LOS), tăng đường huyết, albumin huyết thanh thấp và suy thần kinh đều là các yếu tố nguy cơ độc lập đối với ICUAW. Hơn nữa, việc sử dụng đồng thời NMBA và corticosteroid và truyền NMBA trong hơn 48 giờ sẽ tạo thuận lợi cho sự phát triển của ICUAW. Tuy nhiên, trong một phân tích tổng hợp gần đây về việc sử dụng NMBA trong ARDS, cisatracurium không liên quan đến việc tăng nguy cơ ICUAW, NMBA không làm tăng nguy cơ ICUAW khi sử dụng trong thời gian ngắn và không dùng steroid đồng thời.
Việc vận động sớm đã được chứng minh là làm giảm tỷ lệ mắc ICUAW, cải thiện năng lực chức năng, tăng số ngày không thở máy và giảm tình trạng mê sảng, tái nhập ICU và ICU LOS. Ở những bệnh nhân thở máy > 24 giờ, phục hồi chức năng theo phác đồ hưởng tới vận động sớm đã được khuyến nghị. Các bác sĩ lâm sàng ICU phải nhận thức được một số rào cản đối với việc vận động sớm, bao gồm những rào cản liên quan đến bệnh nhân và quy trình chăm sóc, thuốc phục hồi chức năng và nhân viên ICU không đầy đủ, cũng như văn hóa trong ICU và các tổ chức chăm sóc sức khỏe.
8 Kỹ thuật cai máy: Bằng chứng là gì?
Vào những năm 1990, hai loại SBT (ống T và PSV) đã được biểu diễn với tần số gần như nhau. Tuy nhiên, hai kỹ thuật này không tương đương về nỗ lực hô hấp của bệnh nhân. Các nghiên cứu sinh lý đã chỉ ra rằng công thở được đo trong quá trình đặt ống chữ T tương tự như công thở sau khi rút ống nội khí quản. Ngược lại, công thở trong quá trình thử nghiệm PSV thấp hơn rõ rệt so với khi dùng ống chữ T. Do đó, mặc dù thử nghiệm PSV có thể đẩy nhanh quá trình rút ống, nhưng nó cũng có thể làm tăng nguy cơ đặt lại ống nội khí quản do đánh giá thấp công thở cần thiết sau khi rút ống.
Một số thử nghiệm đã đánh giá các kỹ thuật nói trên. Trong thử nghiệm Lung Failure ở Tây Ban Nha, bốn kỹ thuật cai máy được so sánh: SIMV, PSV, thử nghiệm ngắt quãng về thở tự nhiên và thử nghiệm thở tự nhiên một lần mỗi ngày bằng ống chữ T. Sau khi điều chỉnh các đặc điểm cơ bản trong mô hình tỷ lệ nguy cơ Cox, tỷ lệ cai máy thành công với thử nghiệm tự thở một lần mỗi ngày cao hơn 2,83 lần so với SIMV (p < 0,006) và cao hơn 2,05 lần so với PSV (p < 0,04). Khoảng thời gian từ khi bắt đầu cai máy đến khi rút ống thành công ở nhóm thử nghiệm ngắt quãng và dùng một lần mỗi ngày ngắn hơn so với nhóm SIMV/PSV. Tuy nhiên, trong cùng năm đó, Brochard cho thấy kết quả hoàn toàn trái ngược. Số lần cai máy thất bại được phát hiện với PSV thấp hơn so với ống T và SIMV (8% PSV; 43% ống T; 42% SIMV; p = 0,05). Với PSV, xác suất còn lại trên MV thấp hơn (p < 0,03), và cà thời gian cai máy và ICU LOS đều ngắn hơn (lần lượt là p < 0,05 và p < 0,001). Những thử nghiệm sơ bộ này đã mở đường cho các khuyến nghị xã hội hiện tại của chúng tôi, đối với những bệnh nhân nhập viện cấp tỉnh được thở máy > 24 giờ, SBT ban đầu nên được tiến hành với tăng áp lực hít vào (5-8 cm H2O) thay vì không có (ống T hoặc CPAP). Tuy nhiên, họ không thông báo cách thông khí cho bệnh nhân giữa các lần SBT không thành công.
Trong một thử nghiệm để xác định xem liệu SBT ban đầu sử dụng PSV có thể làm tăng tỷ lệ rút ổng thành công ở những bệnh nhân có nguy cơ thất bại rút ống cao hay không bằng cách so sánh PSV hoặc ống T là kỹ thuật cai máy, các tác giả đã kết luận rằng PSV có thể đẩy nhanh quá trình rút ống mà không làm tăng nguy cơ đặt lại ống nội khí quản. Hơn nữa, ở những bệnh nhân có nguy cơ cao thất bại trong việc rút ống nội khí quản sau khi được thở máy trong > 24 giờ và đã hoàn thành thành công SBT ban đầu, nên rút ống nội khí quản để thông khí không xâm lấn (NIV) phòng ngừa.
Trong nỗ lực nhằm tăng cơ hội rút ống nội khí quản và cai MV thành công cho bệnh nhân, người ta đã yêu cầu rằng việc cho cơ hô hấp nghỉ ngơi sau SBT sẽ ngăn ngừa thất bại khi rút ống nội khí quản. Tuy nhiên, việc kết nối lại với MV sau SBT thành công so với rút nội khí quản trực tiếp không dẫn đến giảm đáng kể về mặt thống kê (12,9% so với 18,2%, 95% CI [-2,49 đến 13,12]; p = 0,18) về nguy cơ đặt lại nội khí quản trong người bệnh MV.
Hơn nữa, một thử nghiệm đa trung tâm gần đây đã điều tra các phương pháp cai máy và ngừng sử dụng máy thở cho những bệnh nhân bị bệnh nặng ở 142 ICU trong khoảng thời gian ba năm. Trong số 1868 bệnh nhân tham gia nghiên cứu, 68,7% sống sót và được rút ống nội khí quản sau SBT. Trong SBT, 49,1% sử dụng PSV mức độ thấp, 25,4% sử dụng thử nghiệm ống chữ T và 10,8% sử dụng CPAP. Các bệnh nhân còn lại (31,3%) được rút ống nội khí quản trực tiếp mà không cần thử thở. Ở Mỹ, SBT được sử dụng rộng rãi so với các nước khác. Kết quả cho thấy những bệnh nhân sử dụng SBT có tình trạng tồi tệ hơn so với những bệnh nhân rút ống nội khí quản trực tiếp (10,3% so với 4,7%), thời gian MV xâm lấn dài hơn (4,1 so với 2,9 ngày) và ICU LOS dài hơn (8,1 so với 6,7 ngày). 60 Sự thay đổi theo khu vực có thể là do sự khác biệt trong việc sử dụng công cụ sàng lọc, quản lý máy thở và vận động sớm.
9 Quy trình cai máy được tiêu chuẩn hóa
Việc sử dụng các phác đồ cai máy ban đầu xuất hiện sau ba thử nghiệm ngẫu nhiên có đổi chứng với tổng số khoảng 1000 bệnh nhân. Năm 1996, một nghiên cứu về các đơn vị chăm sóc y tế và tim mạch quan trọng đã chứng minh thời gian thở máy giảm, chi phí thấp hơn và số lần đặt lại ống nội khí quản ít hơn trong nhóm tuân thủ quy trình cai máy. Những phát hiện tương tự đã được chứng thực vào năm 1997.62 Năm 2000, việc cai máy theo quy trình có liên quan đến xu hướng giảm tỷ lệ viêm phổi liên quan đến máy thở ở một nhóm nhỏ bệnh nhân chấn thương tại các đơn vị chăm sóc đặc biệt trong phẫu thuật. Trong một đánh giá hệ thống và phân tích tổng hợp, cai máy theo quy trình so với chăm sóc thông thường cho thấy những tác dụng có lợi trong ICU nội khoa, phẫu thuật và hỗn hợp. Tuy nhiên, trong hầu hết các ICU đóng cửa với đội ngũ bác sĩ, nhà trị liệu hô hấp và y tá dồi dào, và với các đợt cai máy dựa trên hệ thống đa ngành có cấu trúc, sự trang bị lâm sàng tồn tại dựa trên giá trị và vai trò của cai máy theo quy trình.
10 Kết luận
Nhóm ICU phải đánh giá mức độ sẵn sàng cai máy càng sớm càng tốt và giảm thiểu các yếu tố rủi ro dẫn đến thất bại cai máy. Đối với những bệnh nhân thất bại trong thử nghiệm cai máy, một cách tiếp cận có cấu trúc chi tiết là rất quan trọng trong việc cố gắng xác định các nguyên nhân và cơ chế tiềm ẩn. Nếu những nguyên nhân này có thể khắc phục được thì phải tiến hành các biện pháp khắc phục kịp thời để giúp bệnh nhân khắc phục được tình trạng lâm sàng và đạt được khả năng dung nạp tim phổi phù hợp với SBT. Quy trình cai máy được tiêu chuẩn hóa rất hấp dẫn và hấp dẫn đối với hầu hết các ICU. Trong thời đại chăm sóc theo yêu cầu của bệnh nhân, điều quan trọng là chọn chế độ cai máy phù hợp với bệnh nhân. Cuối cùng, với tư cách là những nhà nghiên cứu chuyên sâu, khi chúng ta giải quyết câu hỏi: cai máy hay không cai máy, chúng ta hãy cho phép bệnh nhân trở thành những người hướng dẫn tốt nhất cho chúng ta.

