Tìm hiểu các thuốc cơ bản dùng trong tim mạch can thiệp
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn:
PGS.TS.BS. Phạm Mạnh Hùng
ThS.BSNT. Nguyễn Thiện Toàn
ThS.BSNT. Nguyễn Đức Nhương
BSCKII. Nguyễn Trung Hậu
TS.BSNT. Đinh Huỳnh Linh
TS.BSNT.Phan Tuấn Đạt
PGS.TS.BS. Tạ Mạnh Cường
Trungtamthuoc.com -Để có kết quả tốt trong can thiệp động mạch vành, tim cấu trúc và mạch máu ngoại biên, ngoài việc cần có các dụng cụ phù hợp như bóng, dây dẫn và stent, thì còn phụ thuộc vào việc sử dụng các thuốc trong can thiệp. Các thuốc chống đông hoặc thuốc kháng kết tập tiểu cầu là rất cần thiết để đảm bảo cho quá trình can thiệp an toàn và hiệu quả, trong khi các thuốc giãn mạch và co mạch khác được sử dụng ở một số bệnh nhân nhất định. Những tiến bộ y học gần đây đã cho ra đời các thuốc với tác dụng tương tự nhau, hiểu được tính chất của mỗi thuốc giúp điều chỉnh dược lý học phù hợp với nguy cơ chảy máu và huyết khối của mỗi bệnh nhân.
1 Thuốc chống đông và kháng kết tập tiểu cầu
1.1 Heparin không phân đoạn (UFH)
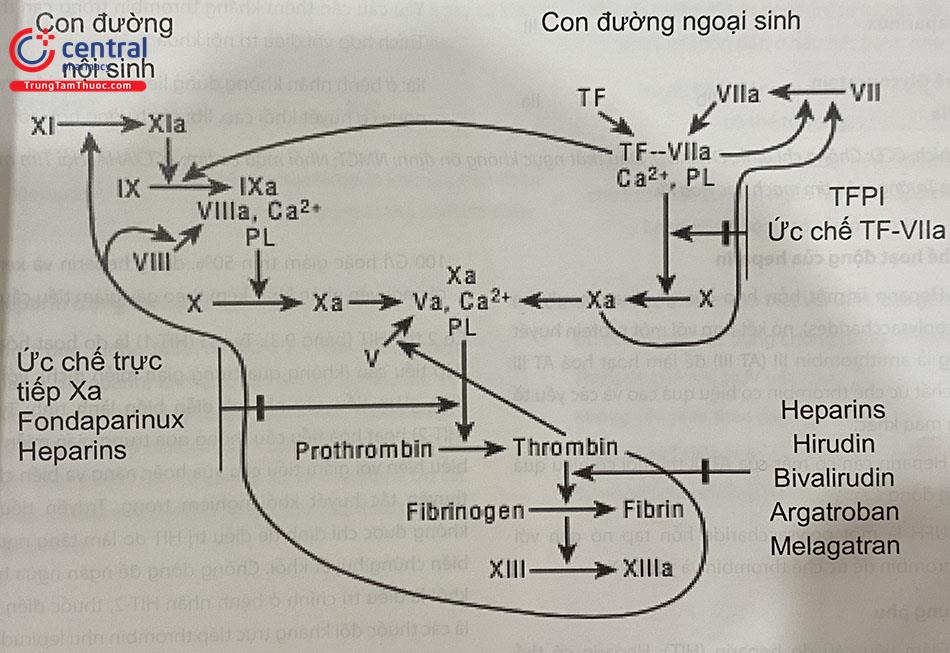
UFH là tập hợp của các phân tử polysaccharide, 1/3 trong đó bao gồm các pentasaccharide có khả năng gắn với các antithrombin. UFH kích thích sự hoạt hoá của antithrombin III (AT III), là phân tử có tác dụng làm giáng hoá yếu tố tiền đông máu IIa (thrombin) và yếu tố Xa bởi hình thành phức hợp với AT III và thrombin. Hình 9.1 minh hoạ quá trình đông máu và vai trò của antithrombin.
1.1.1 Sử dụng lâm sàng
Do sự đa dạng trong các chế phẩm heparin và sự gắn với protein khác nhau, nên việc theo dõi tác dụng chống đông là cần thiết, với mục tiêu là aPTT từ 50-75 giây hoặc aPTT bệnh chứng từ 1,5-2,5. aPTT không được sử dụng trong phòng can thiệp do nó bị bão hoà đối với liều heparin sử dụng trong PCI. Thay vào đó, để đo lường tác dụng chống đông trong PCI người ta sử dụng ACT, với mục tiêu từ 250-350 giây hoặc 200-250 giây nếu sử dụng thuốc ức chế GP IIb/IIIa. ACT tối ưu phụ thuộc vào dụng cụ và phòng thí nghiệm, dữ liệu gợi ý rằng tỷ lệ chảy máu cao hơn ở mức độ ACT cao hơn. Liều bolus tĩnh mạch UFH trong phòng can thiệp thông thường là 70-100 đơn vị/kg hoặc 50-60 đơn vị/kg với thuốc ức chế GP IIb/IIIa. Đo lặp lại ACT nên được thực hiện khoảng mỗi 20-30 phút trong khi can thiệp. Mặc dù về lý thuyết có nguy cơ tái hoạt hoá đông máu khi dừng UFH, tuy nhiên việc tiếp tục duy trì heparin sau khi PCI thành công không được khuyến cáo do làm tăng nguy cơ chảy máu và không có lợi hơn về mặt thiếu máu cục bộ.
Thời gian bán thải của UFH là 1,5 giờ, cho phép kiểm soát tốt hơn tác dụng chống đông. Dừng UFH đường truyền tĩnh mạch có thể bình thường hoá quá trình đông máu trong vài giờ. Nếu cần dừng tác dụng chống đông của UFH ngay lập tức, protamine sulfate có thể được sử dụng, nó sẽ hình thành cặp ion với UFH để trung hòa tác dụng của UFH. Liều của protamine để đảo ngược tác dụng của UFH là 1-1,5 mg tĩnh mạch mỗi 100 đơn vị UFH có hoạt tính còn lại, dựa trên thời gian sử dụng UFH (tối đa 50 mg/ liều). Mặc dù hầu hết protamine sulfate sử dụng ngày nay là tái tổ hợp, vẫn phải cẩn thận khi sử dụng thuốc ở bệnh nhân dị ứng với cá, bởi vì có một tỷ lệ nhất định dẫn xuất từ cá. Phản ứng dị ứng điển hình với protamine bao gồm: tụt huyết áp và co thắt phế quản do giải phóng histamin. Truyền chậm, đồng thời quan sát cẩn thận bệnh nhân, có thể làm giảm bớt mức độ nặng của phản ứng. Cẩn thận ở những bệnh nhân đái tháo đường sử dụng chế phẩm Insulin có chứa protamine (VD: Insulin NPH) bởi vì chúng làm tăng nguy cơ phản ứng nặng với protamine, bao gồm phản vệ.
Bảng 9.1. Các thuốc chống đông và kháng kết tập tiểu cầu sử dụng cho can thiệp động mạch vành qua da
Chống đông: – Heparin trọng lượng phân tử thấp (enoxaparin [Lovenox], dalteparin [Fragmin], tinzaparin [Innohep]). – Ức chế thrombin trực tiếp – ức chế Polypeptide (bivalirudin [Angiomax]) – chất ức hệ trọng lượng phân tử thấp (argatroban [Acova]). Kháng kết tập tiểu cầu: – Ức chế receptor ADP (clopidogrel [Plavix], prasugrel [Effient], ticlopidine [Ticlid]). – Ức chế phosphodiesterase (cilostazol [Pletal]). – Ức chế receptor Glycoprotein IIb/IIIa (abciximab [ReoPro], eptifibatide [Intergrilin], tirofiban [Aggrastat]). – Ức chế tái hấp thu adenosine (dipyridamole [Persantine]). – Ức chế chọn lọc và gắn có phục hồi với thụ thể P2Y12 (ticagrelor [Brilinta]). – Đối vận receptor hoạt hoá tiểu cầu (PAR-1) (vorapaxar [Zontivity]). |
.jpg)
Bảng 9.2. Khuyến cáo ACC/AHA 2013-2014 về sử dụng thuốc ở bệnh nhân hội chứng vành cấp được can thiệp động mạch vành qua da
| THUỐC | ĐTNKÔĐ/ NMCT KHÔNG ST CHÊNH | NMCT ST CHÊNH | KHUYẾN CÁO |
|---|---|---|---|
| Aspirin | IA | IA | Liều nạp 162-325 mg, duy trì 81 mg/ngày |
| Clopidogrel | IB | IB | Liều nạp 600 mg, liều duy trì 75 mg/ngày |
Prasugrel |
|
| CCĐ: đột quỵ, tai biến mạch não thoáng qua. Không chỉ định trước PCI |
Ticagrelor | IB | IB | Khuyến cáo ưu tiên hơn clopidogrel ở bệnh nhân can thiệp (IIa) |
Heparin không phân đoạn |
| IC | |
Heparin trọng lượng phân tử thấp |
| IA (chỉ cho sau tiêu huyết khối) | Không khuyến cáo bệnh nhân can thiệp PCI thì đầu |
| Bivalirudin | IB | IB | Đặc biệt cho bệnh nhân nguy cơ chảy máu cao |
| Fondaparinux | IB | III | Yêu cầu cần thêm kháng thrombin trong can thiệp. Thích hợp với điều trị nội khoa |
| Ức chế Glycoprotein IIb/ IIIa | IIb | IIa | IIa: ở bệnh nhân không dùng liều nạp clopidogrel và nguy cơ huyết khối cao. IIb: các trường hợp còn lại |
Chú thích: CCĐ: Chống chỉ định, ĐTNKÔĐ: Đau thắt ngực không ổn định; NMCT: Nhồi máu cơ tim; ACC/AHA: Hội Tim mạch học và Trường môn tim mạch học Hoa Kỳ.
1.1.2 Cơ chế hoạt động của Heparin
Heparin là một hỗn hợp của glycosaminoglycan (mucoplysaccharides), nó kết hợp với một protein huyết tương là antithrombin III (AT III) để làm hoạt hoá AT III một chất ức chế thrombin có hiệu quả cao và các yếu tố đông máu khác.
Heparin cần có mặt của AT III thì mới có hiệu quả kháng đông
UFH là một polysaccharide hỗn tạp nó gắn với antithrombin để ức chế thrombin và yếu tố Xa
1.1.3 Tác dụng phụ
Giảm tiểu cầu do heparin (HIT): Heparin có thể gây giảm tiểu cầu qua trung gian miễn dịch và dẫn đến huyết khối, đột quỵ, tắc mạch chi hoặc các biến cố thiếu máu khác (giảm tiểu cầu do heparin kèm huyết khối). Nếu heparin được cho sau thủ thuật, cần theo dõi số lượng tiểu cầu hằng ngày. Nếu tiểu cầu giảm xuống dưới 100 G/l hoặc giảm trên 50%, dừng heparin và xem xét các nguyên nhân khác kèm theo gây giảm tiểu cầu.
Có 2 thể HIT (bảng 9.3): Type I (HIT-1) là do hoạt hóa trực tiếp tiểu cầu (không qua trung gian miễn dịch), với biểu hiện giảm tiểu cầu nhẹ và diễn biến lành tính; Type II (HIT-2) hoạt hoá tiểu cầu thông qua trung gian miễn dịch, biểu hiện với giảm tiểu cầu vừa hoặc nặng và biến chứng thuyên tắc huyết khối nghiêm trọng. Truyền tiểu cầu không được chỉ định để điều trị HIT do làm tăng nguy cơ biến chứng huyết khối. Chống đông để ngăn ngừa huyết khối là điều trị chính ở bệnh nhân HIT-2, thuốc điển hình là các thuốc đối kháng trực tiếp thrombin như lepirudin và argatroban.
Chảy máu nhỏ (vị trí chọc mạch, chân răng): Dừng heparin, theo dõi dấu hiệu sinh tồn, aPTT, hemoglobin, hematocrit, tiểu cầu, ACT.
Chảy máu lớn (sau phúc mạc, đường tiêu hoá): Với chảy máu lớn hoặc để đảo ngược tác dụng chống đông, dừng truyền heparin. Protamine sulfate (Dung dịch 1%) được sử dụng với liều 1mg/100UI heparin hoặc xấp xỉ 5 mg tiêm tĩnh mạch chậm trong vòng 10 phút. Dấu hiệu sinh tồn, aPTT, hemoglobin, hematocrit, tiểu cầu, ACT nên được theo dõi, và truyền máu nếu cần thiết. Vị trí chảy máu nên được xem xét đánh giá để chỉ định can thiệp. Nếu sử dụng liều cao heparin tiêm dưới da, có thể phải nhắc lại liều protamine sau 1 giờ.
Theo dõi phản ứng dị ứng với protamine và chuẩn bị sẵn thiết bị hồi sức là cần thiết do nguy cơ dị ứng cao. Morphine hoặc meperidine có thể cân nhắc sử dụng khi bệnh nhân có biểu hiện rét run.
Bảng 9.3. Giảm tiểu cầu do heparin
| GIẢM TIỂU CẦU DO HEPARIN (HIT – HEPARIN-INDUCED THROMBOCYTOPENIA) | ||
|---|---|---|
| HIT TYP 1 | HIT TYP 2 | |
| Tỷ lệ | 10% | Hiếm (0,2%) |
| Cơ chế | Phản ứng kết tập tiểu cầu trực tiếp của heparin | Tự kháng thể (IgG) chống lại phức hợp yếu tố IV tiểu cầu – heparin |
| Khởi phát | Sớm (trong 2 ngày) | Muộn (4-10 ngày) |
| Số lượng tiểu cầu | 50.000-150.000/mm3 | <50.000/mm3 |
| Kéo dài | Tạm thời, thường cải thiện ngay cả khi heparin được tiếp tục | êu cầu dừng tất cả heparin, số lượng tiểu cầu phục hồi dần dần ở hầu hết bệnh nhân |
| Lâm sàng | Nhẹ | Huyết khối động mạch, tĩnh mạch; có thể tử vong |
| Heparin | Có thể tiếp tục heparin không phân đoạn hoặc heparin trọng lượng phân tử thấp | Argatroban để điều trị kéo dài hơn. Bivalirudin
|
1.2 Heparin trọng lượng phân tử thấp (LMWH)
Heparin trọng lượng phân tử thấp (LMWH: enoxaparin, tinzaparin, dalteparin) là một phân đoạn của heparin với trọng lượng phân tử trong khoảng 3000 đến 7000 daltons (UFH từ 3000-30.000 daltons). Giống UFH, LMWH gắn với antithrombin và gây ức chế yếu tố Xa và thrombin. Do cải thiện hấp thu dưới da, LMWH có thể sử dụng tiêm dưới da hoặc tĩnh mạch.
LMWH có các đặc điểm phân biệt với UFH, bao gồm:
- Dự đoán được tác dụng chống đông dễ dàng hơn.
- Thiếu ức chế yếu tố IV tiểu cầu.
- Không cần phải theo dõi.
- Nguy cơ HIT thấp hơn.
- Sử dụng bolus đường tĩnh mạch hoặc tiêm dưới da.
Bảng 9.4. So sánh đặc điểm của heparin không phân đoạn (UFH) với Heparin trọng lượng phân tử thấp (LMWH)
| ĐẶC ĐIỂM | HEPARIN KHÔNG PHÂN ĐOẠN | HEPARIN TRỌNG LƯỢNG PHÂN TỬ THẤP |
|---|---|---|
| Thành phần | Hỗn hợp không đồng nhất các polysaccharide; trọng lượng phân tử 3000 – 30000 daltons. | Các glycosaminoglycan đồng nhất; trọng lượng phân tử 4000- 6000 daltons. |
| Cơ chế tác dụng | Hoạt hóa antithrombin III*; hoạt tính kháng yếu tố Xa và thrombin tương đương; giải phóng TFPI từ tế bào nội mô; không bất hoạt được thrombin đã gắn cục máu đông hoặc các sản phẩm thoái hóa của fibrin; bất hoạt được thrombin trong máu. | Hoạt hóa antithrombin III kém hơn; hoạt tính kháng Xa mạnh hơn kháng thrombin; giải phóng TFPI từ tế bào nội mô; không bất hoạt được thrombin đã gắn với cục máu đông hoặc các sản phẩm thoái hóa của fibrin; tác dụng bất hoạt thrombin trong máu yếu hơn. |
| Dược động học | Gắn với protein huyết tương, tế bào nội mô và đại thực bào dẫn tới khó dự đoán tác dụng chống đông (ít tương tác với antithrombin III); thời gian bán thải ngắn. | Gắn rất ít với protein huyết tương, tế bào nội mô và đại thực bào nên dễ dự đoán tác dụng chống đông; thời gian bán thải dài hơn. |
| Theo dõi trên xét nghiệm | Không dự đoán tác dụng chống đông được; sử dụng aPTT hoặc ACT để theo dõi. | Không dùng aPTT hoặc ACT để theo dõi trừ trường hợp suy thận, bệnh nhân có cân nặng |
| Chỉ định trên lâm sàng | Huyết khối tĩnh mạch; đau thắt ngực không ổn định, nhồi máu cơ tim cấp, nhồi máu não, PCI. | Huyết khối tĩnh mạch ở bệnh nhân chấn thương hoặc phẫu thuật, đau thắt ngực không ổn định, nhồi máu cơ tim. Không hiệu quả cho PCI. |
| Đảo ngược tác dụng | Protamin trung hòa hoạt tính antithrombin. | Protamin trung hòa hoạt tính antithrombin nhưng chỉ đảo ngược một phần hoạt tính anti-Xa. |
| Tiền sử mắc giảm tiểu cầu do heparin typ 2 | Không nên dùng | Không nên dùng |
| Chi phí | Rẻ | Đắt gấp 10 – 20 lần so với heparin không phân đoạn |
Chú thích: PCI: Can thiệp động mạch vành qua da.
1.2.1 Hấp thu và thải trừ
Đỉnh huyết thanh của anti-Xa đạt được 3-4 giờ sau khi tiêm dưới da và kéo dài tới 12 tiếng sau. LMWH bị thải trừ thông qua thận, cẩn thận khi sử dụng ở những bệnh nhân có mức lọc cầu thận nhỏ hơn 30 mL/phút. LMWH có thể sử dụng tiêm tĩnh mạch hoặc dưới da, nhưng không được tiêm vào cơ. Thời gian bán thải 2-4 giờ, dài hơn UFH.
1.2.2 Theo dõi
Xét nghiệm ACT không đáng tin cậy trong đo lường tác dụng của LMWH. Hoạt tính của LMWH được đo bởi nồng độ anti-Xa trong huyết thanh. Theo dõi thường quy không được chỉ định ở hầu hết bệnh nhân và không thực hiện được ở nhiều phòng can thiệp. LMWH có tác dụng có thể dự đoán trước, theo dõi và điều chỉnh liều là cần thiết ở bệnh nhân béo phì (BMI > 40) hoặc bệnh nhân suy thận.
1.2.3 Sử dụng trong lamm sàng
Enoxaparin là LMWH được nghiên cứu nhiều nhất cho hội chứng vành cấp. Liều điều trị là 1 mg/kg tiêm dưới da mỗi 12h hoặc 0,75-1 mg/kg tiêm tĩnh mạch cho PCI trong trường hợp không có thuốc chống đông khác. Để tối ưu hoá hoạt tính của anti-Xa cho PCI, thêm 0,3 mg/kg tiêm tĩnh mạch nếu PCI được thực hiện 8-12 giờ sau liều tiêm dưới da trước đó, đặc biệt nếu bệnh nhân được tiêm ít hơn 3 liều trước đó. Chuyển từ một thuốc chống đông này sang thuốc chống đông khác (VD: LMWH sang UFH) đi kèm với tăng nguy cơ chảy máu và không được khuyến khích. Protamine có thể đảo ngược một phần hoạt tính của LMWH. Bảng 9.5 mô tả các liều gợi ý cho PCI
Các nghiên cứu ban đầu so sánh giữa LMWH và UFH ở bệnh nhân hội chứng vành cấp cho thấy giảm nhồi máu cơ tim (MI; 10,1% vs 11%) mà không làm tăng nguy cơ chảy máu. Tuy nhiên, nhiều thử nghiệm trong số này được thực hiện mà không có can thiệp động mạch vành. Thử nghiệm SYNERGY bao gồm 9978 bệnh nhân được thực hiện PCI cho NSTE-ACS cho thấy hiệu quả tương đương giữa enoxaparin và UFH (14% vs 14,5%; p = NS) đi kèm với nhiều biến cố chảy máu lớn hơn (9,1% vs 7,6%; p = 0,008), có thể do chuyển đổi giữa UFH và LMWH.
Nói chung, LMWH được xem như có hiệu quả tương đương UFH trong ACS và PCI. Lợi thế của nó bao gồm: không cần theo dõi, dễ dàng sử dụng, nguy cơ HIT thấp hơn. Việc không cần theo dõi tác dụng chống đông của thuốc có thể là con dao hai lưỡi, bởi vì không có khả năng đánh giá hiệu quả chống đông đầy đủ tại thời điểm PCI có thể gây ra các nguy cơ nhất định trong quá trình can thiệp.
1.3 Fondaparinux
Fondaparinux là một pentasaccharide tổng hợp từ vùng gắn của UFH và LMWH. Nó ức chế yếu tố Xa, antithrombin có hiệu lực cao, với liều tiêm dưới da 2,5 mg/ngày. Nó bị đào thải qua thận với thời gian bán thải 17 giờ. So với LMWH, sử dụng fondaparinux được chứng minh không kém hơn về biến chứng thiếu máu trong thử nghiệm OASIS-5 nhưng giảm tỷ lệ chảy máu lớn từ 4,1% xuống 2,2% (HR 0,52; p < 0,001). Chảy máu lớn đi kèm với tử vong giảm với fondaparinux (2,9% với 3,5%; p = 0,02). Tắc ống thông đã được ghi nhận với fondaparinux (0,9 với 0,4%) nhưng có thể tránh với liều tiêu chuẩn bolus UFH vào lúc PCI.
Fondaparinux được khuyến cáo mức độ I cho chống đông ở bệnh nhân ACS nhưng mức độ bằng chứng thấp hơn UFH, LMWH và bivalirudin. Mặc dù lợi thế về tỷ lệ tử vong trong thử nghiệm OASIS-5, fondaparinux không được chấp nhận sử dụng rộng rãi bởi các nhà can thiệp do nguy cơ huyết khối ống thông. Tuy nhiên, nó là thuốc được ưu tiên sử dụng hơn ở bệnh nhân điều trị nội khoa không can thiệp.
Bảng 9.5. Liều enoxaparin trước khi can thiệp động mạch vành
| LIỀU LƯỢNG ĐỀ XUẤT CỦA ENOXAPARIN TRƯỚC KHI CAN THIỆP MẠCH VÀNH QUA DA (PCI) | |
|---|---|
| TIỀN SỬ DỤNG ENOXAPARIN | LIỀU ENOXAPARIN BOLUS TĨNH MẠCH TẠI THỜI ĐIỂM PCI |
| Chưa dùng enoxaparin trước đó | 0,75 mg/kg TM |
| Chỉ dùng Enoxaparin liều dự phòng | 0,5 mg/kg TM |
| 1-2 liều 1mg/kg tiêm dưới da trước can thiệp <8h | 0,3 mg/kg TM |
| 1-2 liều 1mg/kg tiêm dưới da, trước can thiệp 8- 12h | 0,3-0,5 mg/kg TM |
| Đủ liều (>3) tiêm dưới da trước can thiệp <8h | Không bổ sung thêm |
| Đủ liều (>3) tiêm dưới da trước can thiệp 8- 12h | 0,3 mg/kg TM |
| Bất kể liều, trước can thiệp >12h | Có thể sử dụng antithrombin thay thế |
Chú thích: TM: Tĩnh mạch.
1.4 Thuốc ức chế trực tiếp Thrombin
Các thuốc ức chế thrombin trực tiếp là polypeptide hoặc chất ức chế trọng lượng phân tử thấp, chúng không yêu cầu phải có antithrombin cho tác dụng chống đông (Bảng 9.6-9.7). Các chất ức chế trọng lượng phân tử thấp, ví dụ: argatroban bất hoạt thrombin trong tuần hoàn nhưng không bất hoạt thrombin gắn với cục máu đông. Tiêm tĩnh mạch argatroban được ủng hộ trong điều trị HIT, số trường hợp sử dụng trong PCI tương đối ít. Dabigatran đường uống là thuốc ức chế trực tiếp thrombin được cấp phép trong điều trị rung nhĩ và huyết khối tĩnh mạch sâu.
Bivalirudin là một polypeptide có 20 Amino acid với cấu trúc hoá học tương tự với hirudin, chất thường xuyên được sử dụng trong PCI. Nó gắn với hai vị trí (vị trí hoạt động và exosite-1), có thể đảo ngược cả thrombin trong tuần hoàn và thrombin gắn với cục máu đông. Vùng amino tận cùng của bivalirudin bị phân cắt bởi thrombin từ vị trí hoạt động, sẽ làm yếu liên kết giữa đoạn còn lại của bivalirudin và exosite-1, vì vậy chức năng của thrombin sẽ được phục hồi nhanh chóng sau khi ngừng thuốc (thời gian bán thải là 25 phút). Đặc điểm dược lý này làm giảm nguy cơ chảy máu và tăng hiệu quả chống đông.
1.4.1 Dược động hoc
Bivalirudin được tiêm bolus tĩnh mạch 0,75 mg/kg, và truyền tĩnh mạch liên tục 1,75 mg/kg/giờ. Bắt đầu có tác dụng nhanh sau 5 phút. Thuốc không gắn với protein huyết tương hoặc nội mạc vì vậy có thể dự đoán được tác dụng chống đông với xét nghiệm aPTT và ACT. Bivalirudin được bài tiết bởi thận, thời gian bán thải là 25 phút ở bệnh nhân có chức thận bình thường. Thời gian bán thải ngắn cho phép rút sheath ngay sau khi dừng truyền bivalirudin. Nên điều chỉnh liều ở bệnh nhân suy thận, mặc dù PCI tương đối ngắn nên điều chỉnh liều có thể là không cần thiết trừ khi tiếp tục truyền sau khi PCI.
1.4.2 Sử dụng trong lâm sàng
So với UFH, bivalirudin chứng minh hiệu quả tương đương với giảm nguy cơ chảy máu ở bệnh nhân với đau ngực không ổn định/nhồi máu cơ tim không ST chênh (REPLACE-2 và ACUITY) và trong STEMI (HORIZONS-AMI).
Những thử nghiệm này yêu cầu sử dụng clopidogrel trước thủ thuật, tuy nhiên có thể truyền bivalirudin ở liều tối đa kéo dài trong 4 giờ sau thủ thuật nếu thuốc chống ngưng tập tiểu cầu được dùng chậm. Không truyền kéo dài bivalirudin có thể làm tăng nguy cơ huyết khối trong stent cấp ở bệnh nhân, bởi vì thời gian tác dụng ngắn có thể không đủ bảo vệ chống lại huyết khối trong khi chờ thuốc ức chế ngưng tập tiểu cầu phát huy tác dụng.
Bảng 9.6. Thuốc ức chế trực tiếp thrombin
Ức chế polypeptide
|
Bảng 9.7. So sánh heparin không phân đoạn và bivalirudin
| HEPARIN KHÔNG PHÂN ĐOẠN | BIVALIRUDIN | |
|---|---|---|
| Tác dụng trên thrombin gắn cục máu đông | Không | Bất hoạt |
| Tác dụng trên thrombin | Tương tác với ái lực cao; ức chế cả thrombin và yếu tố Xa | Tương tác với ái lực cao |
| Tác dụng trên yếu tố Xa gắn với tiểu cầu | Không | Bất hoạt |
| Gắn với tế bào nội mô và protein huyết tương | Cao; dẫn tới còn lượng nhỏ heparin hoạt hóa antithrombin | Không |
| Nguy cơ gây giảm tiểu cầu do heparin | Cao | Không |
| Tác dụng chống đông | Rất thay đổi | Dự đoán được |
| Theo dõi bằng xét nghiệm | Cần thiết | Có thể cần thiết |
1.5 Warfarin
Warfarin là dẫn xuất coumarin, hoạt động thông qua ức chế gamma-carboxylation của acid glutamic trong các protein đông máu II (prothrombin), VII, IX và X. Thuốc được chỉ định ở bệnh nhân rung nhĩ, van cơ học, bệnh cơ tim, huyết khối tĩnh mạch sâu. Dữ liệu hạn chế về dự phòng đột quỵ sau nhồi máu trước rộng. Trước khi thienopyridines được phát triển, warfarin được sử dụng cho PCI nhưng mang lại lợi ích ít về chống huyết khối trong stent đồng thời làm tăng nguy cơ chảy máu quanh thủ thuật, vì vậy có ít giá trị trong kỷ nguyên hiện tại. Tuy nhiên thuốc thường dùng trong các bệnh mắc kèm bệnh lý động mạch vành.
Hấp thu qua đường uống nhanh và gần như hoàn toàn. Warfarin được đào thải khỏi máu bởi gan trong vài giờ. Cần 4 đến 7 ngày để đạt được INR cần thiết. Liều tải lớn không làm rút ngắn thời gian để đạt được tác dụng đầy đủ. Sau khi thay liều, hoặc chế độ ăn mới, hoặc tương tác thuốc, cần 4-5 ngày để đạt được tình trạng chống đông ổn định mới.
Warfarin thông thường được dừng 5 ngày trước thủ thuật để chức năng đông máu được hồi phục. Các thủ thuật liên quan đến đường động mạch đùi thì INR trước thủ thuật nên đạt được < 1,8 do tăng nguy cơ chảy máu, ngược lại các thủ thuật thông qua động mạch quay có thể thực hiện
an toàn bất kể mức INR. Điều trị chống đông bắc cầu với LMWH hoặc UFH trước hầu hết các phẫu thuật cho thấy đem lại hiệu quả không nhiều đồng thời với tỷ lệ chảy máu cao hơn. Điều trị chống đông bắc cầu nên dành riêng cho bệnh nhân với van cơ học hoặc huyết khối tĩnh mạch sâu đang hoạt động. Với việc chăm sóc đường vào mạch máu cẩn thận, thủ thuật can thiệp cũng có thể thực hiện mà không cần phải dừng warfarin.
1.6 Thuốc ức chế trực tiếp anti-Xa đường uống
Các thuốc ức chế anti-Xa thế hệ mới có thể được chứng minh có vai trò trong ACS. Rivaroxaban, là thuốc đầu tiên trong số này, gần đây đã được chứng minh có lợi ích trong ACS sau khi can thiệp ổn định (ATLAS ACS 2-TIMI 52) cùng với aspirin và clopidogrel. Dùng kéo dài với liều thấp đường uống 2,5 mg hoặc 5 mg/ngày giúp giảm nguy cơ tử vong do tim mạch, nhồi máu cơ tim, đột quỵ từ 10,7% xuống 8,9% (HR 0,84; p = 0,008) nhưng làm tăng nguy cơ chảy máu từ 0,6% lên 2,1% (p < 0,001). Các nghiên cứu thêm có thể xác nhận vai trò của những thuốc này trong tương lai, bao gồm có tác dụng chống đông trong PCI, nhưng hiện tại những thuốc này tốt nhất nên dừng trước thủ thuật vì nó làm tăng nguy cơ chảy máu do các thuốc chống đông trong lúc PCI.
1.7 Thuốc kháng kết tập tiểu cầu
1.7.1 Aspirin
Aspirin acetyl hoá không hồi phục, gắn và bất hoạt cyclooxygenase của tiểu cầu, từ đó ức chế sản xuất thromboxane A2 (TXA2), là chất có hiệu lực gây kết tập tiểu cầu và co thắt mạch thông qua sản xuất cyclic adenosine monophosphate (cAMP). Tiểu cầu kháng với aspirin hiếm gặp. Liều từ 81mg đến 325 mg/ngày đường uống. Sau khi uống, hấp thụ xảy ra nhanh, với đỉnh trong huyết tương trong vòng 20 phút. Nó nhanh chóng bị thải trừ, nhưng tác dụng của nó kéo dài suốt đời sống của tiểu cầu. Thời gian đông máu có thể dùng để đo lường tác dụng của aspirin trên chức năng tiểu cầu, nhưng hiếm khi cần thiết.
Chỉ định:
- đau ngực ổn định
- Đau ngực không ổn định
- Nhồi máu cơ tim cấp
- Can thiệp mạch vành
- Dự phòng tiên phát và thứ phát nhồi máu cơ tim
- Bệnh động mạch cảnh hoặc mạch não nguyên phát (dự phòng đột quỵ)
- Bệnh động mạch ngoại vi
- Rung nhĩ (không có tác dụng như warfarin; sử dụng khi có chống chỉ định với warfarin).
- Van nhân tạo (điều trị thêm với warfarin).
Aspirin nên sử dụng thận trọng ở những bệnh nhân dị ứng aspirin (asthma), loét dạ dày tiến triển, cơ địa dễ chảy máu.
1.7.2 Clopidogrel
Cùng với aspirin, thuốc kháng kết tập tiểu cầu được sử dụng nhiều nhất là clopidogrel, một thuốc thienopyridine. Thuốc này ảnh hưởng đến quá trình hoạt hoá ngưng tập tiểu cầu phụ thuộc ADP thông qua receptor IIb/IIIa (hình 9.2).
.jpg)
Receptor IIb/IIIa của tiểu cầu là một glycoprotein đảm nhiệm vai trò kết nối với fibrinogen và yếu tố von Willebrand. Sự liên kết này tạo ra gắn kết tiểu cầu-tiểu cầu (fibrinogen) và tiểu cầu-thành mạch (yếu tố von Willebrand). Clopidogrel hấp thụ rất nhanh với đỉnh huyết tương trong vòng 2 giờ, nó có thời gian bán thải trong huyết tương là 6-8 giờ và đạt được trạng thái ổn định trong vòng 14-21 ngày.
Chất chuyển hoá qua gan của clopidogrel gây trở ngại cho chức năng màng tiểu cầu bằng cách ức chế gắn tiểu cầu-fibrinogen thông qua ADP và ức chế tương tác tiểu cầu-tiểu cầu. Tiểu cầu tiếp xúc với chất chuyển hóa của clopidogrel sẽ bị bất hoạt suốt thời gian sống của nó, khoảng 7-10 ngày. Bệnh nhân với sự thay đổi gen CYP2C19 sẽ chuyển hoá kém clopidogrel và sẽ kháng thuốc.
Liều của clopidogrel là 300-600 mg nạp trước khi hoặc vào thời gian can thiệp, sau đó 75mg/ngày kéo dài 6-12 tháng. Bởi vì hiếm gặp giảm tiểu cầu, bạch cầu hoặc xuất huyết giảm tiểu cầu xảy ra với ticlopidine, xét nghiệm công thức máu thường quy với thuốc này được khuyến cáo. Tuy nhiên, không có trường hợp nào bị xuất huyết giảm tiểu cầu ở hơn 32.000 bệnh nhân sử dụng clopidogrel trong thử nghiệm phase III, xuất huyết giảm tiểu cầu được ước tính xảy ra khoảng 4/1.000.000, vì vậy theo dõi thường quy có thể được lựa chọn.
Chỉ định:
- Dự phòng huyết khối trong stent như một thuốc trong liệu pháp kháng kết tập tiểu cầu kép
- Ngăn ngừa nhồi máu cơ tim và đột quỵ ở bệnh nhân mà không thể dùng aspirin hoặc thất bại với aspirin
- Điều trị nhồi máu cơ tim cấp
- Dự phòng đột quỵ ở bệnh nhân có nhiều yếu tố nguy cơ hoặc tiền sử đột quỵ.
1.7.3 Prasugrel
Prasugrel là một tiền thuốc thienopyridine, chất chuyển hoá của nó ức chế không hồi phục receptor ADP. Tương tự với clopidogrel, nó yêu cầu sự chuyển hoá qua 2 bước, tuy nhiên một bước là bắt buộc bởi esterases huyết thanh. Prasugrel biểu hiện ức chế tiểu cầu mức độ cao bất kể ức chế CYP. Khởi phát tác dụng nhanh sau 30 phút. Thời gian tác dụng của nó kéo dài hơn so với clopidogrel khoảng 5-10 ngày và do đó nên dừng thuốc 7 ngày trước phẫu thuật lớn.
Thử nghiệm TRITON-TIMI 38 phân ngẫu nhiên 13.608 bệnh nhân ACS dùng prasugrel (60 mg liều nạp và 10 mg liều duy trì) hoặc clopidogrel (300 mg liều nạp và 75 mg liều duy trì). Những bệnh nhân được PCI, prasugrel được uống sau khi chụp động mạch vành. Tỷ lệ tử vong do tim mạch, nhồi máu cơ tim, đột quỵ xảy ở 9,9% bệnh nhân dùng prasugrel với 12,1% bệnh nhân uống clopidogrel (HR 0,81; p < 0,001), chủ yếu là giảm tỷ lệ tái nhồi máu cơ tim. Tuy nhiên, tỷ lệ chảy máu lớn tăng với prasugrel từ 1,8% lên 2,4% (HR 1,32; p=0.03), bao gồm chảy máu gây tử vong và chảy máu liên quan đến CABG. Bệnh nhân có tiền sử đột quỵ hoặc TIA, tuổi lớn hơn 75, bệnh nhân thấp cân có nguy cơ chảy máu cao hơn và không có lợi hơn so với clopidogrel.
1.7.4 Ticagrelor
Ticagrelor là một thuốc đối kháng ADP-receptor thế hệ mới gọi là cyclopentyl triazolo pyrimidine. Nó gắn có hồi phục với receptor P2Y12 và có thời gian bán thải 12 giờ. Ticagrelor không yêu cầu chuyển hoá cho tác dụng, có thời gian khởi phát tác dụng ngắn và tạo ra ức chế ngưng tập tiểu cầu ở mức độ cao. Dựa trên thời gian bán thải ngắn và ức chế có hồi phục, ticagrelor có thể dừng trong thời gian ngắn khoảng 1-2 ngày trước khi CABG. Nhưng phải dùng 2 lần một ngày. Tác dụng gặp phải lên tới 15% có biểu hiện khó thở, tăng block dẫn truyền với ticagrelor, là yếu tố phức tạp sau nhồi máu.
Thử nghiệm PLATO phân bố ngẫu nhiên 18.624 bệnh nhân ACS dùng clopidogrel (300 mg liều nạp và 75mg/ngày liều duy trì) hoặc ticagrelor (180 mg liều nạp và 90 mg 2 lần/ ngày với liều duy trì). Bệnh nhân được PCI sẽ được uống thêm 300 mg clopidogrel, 90 mg ticagrelor nếu PCI được thực hiện sau 24 giờ kể từ liều nạp ban đầu. Biến cố tim mạch lớn được giảm xuống từ 11,7% ở nhóm clopidogrel xuống 9,8% ở nhóm ticagrelor (HR 0,84; p < 0.001). Trong khi tỷ lệ chảy máu lớn không khác biệt giữa 2 nhóm (11,2% vs 11,6%; p = 0,43). Cuối cùng ticagrelor có lợi ích trên tỷ lệ tử vong chung so với clopidogrel (4,7% vs 9,7%; p < 0,01), chủ yếu bởi giảm tử vong do tim mạch.
1.7.5 Cilostazol
Cilostazol là chất ức chế phosphodiesterase-3 với hoạt tính ức chế tiểu cầu vừa phải do làm tăng cAMP trong tiểu cầu. Cilostazol làm giãn mạch, cải thiện chức năng nội mạc và có thể giảm tái hẹp sau PCI. Nó có vai trò lâm sàng trong điều trị đau cách hồi do bệnh động mạch ngoại vi. Dựa trên các nghiên cứu nhỏ, cilostazol có thể giảm nguy cơ huyết khối trong stent hoặc biến cố tim mạch chính khi dùng cùng các thuốc ức chế tiểu cầu khác sau PCI, đặc biệt ở cộng đồng châu Á có kháng clopidogrel. Nó chống chỉ định tương đối với bệnh nhân suy tim.
1.7.6 Dipyridamole
Dipyridamole là một chất ức chế tái hấp thu adenosine và phosphodiesterase với tác dụng ức chế tiểu cầu vừa phải. Nó thường được sử dụng trong dự phòng đột quỵ như một một thuốc thêm vào với aspirin, trong quá khứ nó được sử dụng trong test gắng sức hạt nhân. Nó được sử dụng ít trong tim mạch can thiệp ngày nay. Tuy nhiên, sự có mặt của dipyramidal có thể kéo dài và tăng tác dụng của adenosin tĩnh mạch trong đánh giá huyết động ở phòng can thiệp. Sự kết hợp nên tránh nếu có thể.
1.7.7 Vorapaxar
Vorapaxar là chất đối kháng receptor thrombin (PAR-1), một cơ chế khác với thuốc kháng tiểu cầu khác. Thuốc thế hệ mới này ban đầu được thử nghiệm dùng với aspirin và clopidogrel trong thử nghiệm TRACER ở 12.944 bệnh nhân ACS. Vorapaxar không làm giảm biến cố tim mạch chính, nhưng đi kèm với tăng tỷ lệ chảy máu lớn, đặc biệt là chảy máu nội sọ. Vorapaxar sau đó được thử nghiệm cho dự phòng thứ phát trong nghiên cứu TRA 2P-TIMI 50 bao gồm 26.449 bệnh nhân với tiền sử nhồi máu cơ tim, PAD, đột quỵ. Sau 30 tháng, so với điều trị tiêu chuẩn với aspirin hoặc clopidogrel, vorapaxar làm giảm nguy cơ MACE (9,3% vs 10,5%; p < 0,001) nhưng làm tăng nguy cơ chảy máu vừa hoặc lớn. Bệnh nhân có tiền sử đột quỵ tăng nguy cơ chảy máu nội sọ với vorapaxar, do đó thuốc có lợi ích trong dự phòng thứ phát ở bệnh nhân nguy cơ chảy máu thấp, nhưng không có vai trò trong giai đoạn cấp tính.
1.7.8 Ức chế receptor glycoprotein IIb/IIIa
Thuốc có hiệu lực kháng kết tập tiểu cầu mạnh nhất là thuốc ức chế receptor glycoprotein IIb/IIIa (abciximab, eptifibatide, tirofiban), được dùng đường tĩnh mạch. Những thuốc này thể hiện ức chế tiểu cầu ở mức độ cao (>90%) bởi vì chúng tác động lên bước cuối cùng trong kết tập tiểu cầu, sự gắn tiểu cầu với fibrinogen. Những thuốc này làm giảm biến chứng thiếu máu cục bộ (giảm nguy cơ tương đối 9%) nhưng làm tăng nguy cơ chảy máu.
Thuốc này được chứng minh hiệu quả chủ yếu ở nhóm bệnh nhân điều trị can thiệp, bệnh nhân điều trị nội khoa với aspirin và clopidogrel có thể không có hiệu quả. Lợi ích của thuốc này là cao nhất ở những bệnh nhân điểm TIMI-risk tăng >4, đặc biệt những người có xét nghiệm troponin tăng. Hợp lý nhất khi sử dụng thuốc ức chế GPIIb/IIIa vào lúc can thiệp.
Mặc dù lợi ích thiếu máu của thuốc ức chế GPIIb/IIIa chủ yếu đến từ kỷ nguyên chưa có clopidogrel, nhưng chúng được chứng minh còn hiệu quả trong những nghiên cứu hiện nay. Vai trò của chúng trong thời đại của thuốc ức chế P2Y12 hiệu quả cao đường uống với prasugrel và ticagrelor vẫn còn chưa rõ. Tuy nhiên, ở những bệnh nhân STEMI và NSTEMI không được điều trị trước với thuốc ức chế P2Y12, thời gian bắt đầu tác dụng của các thuốc ức chế P2Y12 đường uống là chậm khoảng 2-6 giờ, do đó bệnh nhân có nguy cơ bị huyết khối trong stent sau PCI. Như vậy, thuốc kháng kết tập tiểu cầu đường tĩnh mạch có thể là biện pháp bắc cầu tới khi các thuốc clopidogrel, prasugrel hoặc ticagrelor có tác dụng.
Bảng 9.8. Thuốc đối kháng glycoprotein IIb/ IIIa tiểu cầu dùng cho can thiệp mạch vành qua da
| ABCIXIMAB | EPTIFIBATIDE | TIROFIBAN | |
|---|---|---|---|
Liều dùng cho PCI | 0,25 mg/kg bolus tĩnh mạch, sau đó liều 0,125 µg/kg/phút (tối đa 10 µg/phút) truyền tĩnh mạch trong 12h. Heparin liều thấp và rút sheath sớm để giảm thiểu chảy máu. Với bệnh nhân đau thắt ngực không ổn định mà có kế hoạch PCI trong vòng 24h, abciximab liều bolus và liều truyền tĩnh mạch (liều PCI) có thể bắt đầu trong vòng 24h trước khi PCI và tiếp tục liều này cho tới 1h sau thủ thuật. | Hội chứng vành cấp (liều PURSUIT): 180 µg/kg bolus tĩnh mạch sau đó duy trì 2µg/kg/ phút tĩnh mạch. Nếu thời gian đến phòng thông tim trên 4h sau khi bắt đầu dùng thuốc, không cần bolus thêm thuốc. Can thiệp mạch vành qua da (liều ESPRIT): 2x 180 µg/phút bolus tĩnh mạch mỗi 10 phút, sau đó 2 µg/kg/ phút truyền tĩnh mạch trong 18 – 24h. | 25 µg/kg bolus tĩnh mạch (trong 5 phút) sau đó truyền 0,15 µg/kg/phút trong 18h (bolus liều cao). Bệnh nhân có Độ thanh thải creatinine dưới 60 ml/phút vẫn dùng liều bolus như trên nhưng tốc độ truyền bằng 1/2 bình thường |
| Heparin (không phân đoạn) | Duy trì thời gian đông máu toàn bộ (ACT) từ 200 – 250 giây để giảm thiểu chảy máu. Bắt đầu truyền heparin tĩnh mạch, tính liều dựa vào ACT: <150s, liều 70 µg/kg; 150- 199s: liều 50 µg/ kg; >200s: không cần thêm. Dừng heparin ngay sau khi PCI | 100 µg/kg bolus, chỉnh liều để đạt ACT 300 – 350s. Có thể xem xét dùng liều thấp hơn, như khuyến cáo với abciximab. Trong nghiên cứu ESPIRIT, liều heparin khuyến cáo ban đầu là 60 µg/kg để đạt ACT mục tiêu là 200- 300s | 100 µg/kg bolus, chỉnh liều để ACT đạt 300- 350s. Có thể xem xét liều thấp hơn như khuyến cáo với abciximab |
| Aspirin | 325 mg dùng ít nhất 1 ngày trước PCI và tiếp tục dùng sau đó; 4 viên aspirin dạng nhai liều thấp (tổng cộng 325 mg) dùng cho can thiệp cấp. Khi đặt stent, uống thêm 300 mg clopidogrel liều nạp, sau đó duy trì uống 75 mg trong 2- 4 tuần | Xem abciximab | Xem abciximab |
1.7.9 Cangrelor
Cangrelor là thuốc kháng P2Y12 đường tĩnh mạch được cấp phép gần đây, với thời gian khởi phát tác dụng nhanh (2-3 phút) và phục hồi chức năng của tiểu cầu sau khi dừng. Trong thử nghiệm CHAMPION-PHOENIX, so sánh bệnh nhân điều trị với clopidogrel đường uống lúc PCI hoặc ngay sau PCI, bệnh nhân điều trị với cangrelor có nguy cơ thấp hơn tái nhồi máu cơ tim hoặc huyết khối trong stent nhưng làm tăng nguy cơ chảy máu nhỏ. Như vậy, ở bệnh nhân không được điều trị đầy đủ trước đó với clopidogrel, cangrelor có thể tạo ra sự ức chế tiểu cầu đủ mạnh để PCI an toàn.
Hiệu quả của cangrelor so sánh với ticagrelor hoặc prasugrel đường uống lúc can thiệp là chưa rõ, nhưng có thể vẫn còn do sự chậm trễ trong hấp thu và hoạt hoá của các thuốc ức chế P2Y12 đường uống. Cangrelor gắn cạnh tranh với receptor P2Y12 và ngăn chặn sự gắn của prasugrel hoặc clopidogrel. Các thuốc ức chế ngưng tập đường uống chỉ nên được dùng khi đã dừng cangrelor, vì vậy cangrelor ít hiệu quả hơn thuốc ức chế glycoprotein trong điều trị bắc cầu. Hiệu quả của ticagrelor là không thay đổi bởi sự có mặt của cangrelor.
1.7.10 Đánh giá chức năng tiểu cầu
Một tỷ lệ đáng kể bệnh nhân kháng với clopidogrel hoặc aspirin trên xét nghiệm chức năng tiểu cầu. Một số lượng lớn xét nghiệm đánh giá chức năng tiểu cầu có trên thị trường (bảng 9.9), sử dụng các xét nghiệm khác nhau cung cấp thông tin khác nhau về chức năng tiểu cầu.
Mặc dù có nhiều y văn về xét nghiệm chức năng tiểu cầu và kháng tiểu cầu, bằng chứng liên quan đến phản ứng của tiểu cầu sau điều trị với biến cố thiếu máu lâu dài còn ít. Vẫn còn chưa rõ ràng về chức năng của tiểu cầu nên thay đổi như thế nào, bởi vì nghiên cứu GRAVITAS gần đây
đã cho thấy quy trình sử dụng thường quy liều gấp đôi clopidogrel ở bệnh nhân kháng clopidogrel (được xác định bởi xét nghiệm VerifyNow) không làm cải thiện tiên lượng. Các thuốc kháng P2Y12 khác (prasugrel, ticagrelor) có tỷ lệ kháng tương đối thấp và nên được sử dụng khi kháng clopidogrel được xác định hoặc nghi ngờ.
Cho đến thời điểm hiện tại, việc xét nghiệm thường quy đánh giá chức năng tiểu cầu khi dùng thuốc kháng kết tập tiểu cầu là không được khuyến cáo.
Xét nghiệm chức năng tiểu cầu có thể hữu ích ở các bệnh nhân bị huyết khối bán cấp trong stent, mặc dù những bệnh nhân này nên thay bằng các thuốc có hiệu lực kháng tiểu cầu mạnh. Những bệnh nhân đặt stent gần đây yêu cầu phẫu thuật, có thể hưởng lợi từ xét nghiệm chức năng tiểu cầu. Nếu chức năng tiểu cầu bình thường, có thể tiến hành phẫu thuật. Nếu chức năng tiểu cầu bị suy giảm đáng kể, thời gian của phẫu thuật phải cân bằng với thời gian ngừng các thuốc kháng ngưng tập tiểu cầu.
Bảng 9.9. Xét nghiệm đánh giá chức năng tiểu cầu
| XÉT NGHIỆM CHỨC NĂNG TIỂU CẦU TẠI GIƯỜNG | |||
|---|---|---|---|
| XÉT NGHIỆM | CƠ CHẾ | PHƯƠNG PHÁP | GHI CHÚ |
| VerifyNow (Accumetrics, San Diego, CA) | Tiểu cầu đã hoạt hóa gắn với fibrinogen bọc vỏ polystyrene nhờ chất chủ vận | Máu toàn phần cho vào buồng trộn với các thụ thể khác nhau được bọc vỏ gây ra ngưng kết; ánh sáng phản xạ truyền qua buồng trộn bị giảm đi. Xét nghiệm P2Y12, ADP và IIb/ IIIa có sẵn | Lợi ích: Thiết bị tại giường có cartridge tự động, xét nghiệm nhanh với aspirin. |
| Hệ thống Plateletworks (Phòng xét nghiệm Helena, Beaumont, TX) | Từng tiểu cầu biến mất, thể hiện kết quả dưới dạng số lượng tiểu cầu sau khi tiếp xúc với ADP | Chuẩn bị mẫu tối thiểu để xét nghiệm kết tập tiểu cầu | Tốn thời gian chuẩn bị mẫu |
| PFA-100 Analyzer (Dade Behring, Marburg, Germany) | Tiểu cầu dính và kết tập trong máu toàn phần với điều kiện áp lực cao, tiểu cầu tiếp xúc với collagen- epinephrine và/ hoặc collagen- ADP | Máu toàn phần cho vào ống citrate, sau đó đưa vào mao mạch phủ Collagen có màng đã ngấm ADP hoặc epinephrine. Đo quá trình hình thành nút tiểu cầu | Ưu điểm: Đo lường được nhiều rối loạn chức năng tiểu cầu Nhược điểm: Cartridge không nhạy với clopidogrel. Thiết bị này chỉ dùng cho nghiên cứu. |
Cone and Platelet Analyzer (DiaMed, Cressier sur Morat, Switzerland) | Đo lường tương tác giữa tiểu cầu với tiểu cầu và với lực shear | Máu toàn phần có citrate được ủ với ADP. Kiểm tra môi trường sinh lí của high shear stress. Xét nghiệm các vi kết tập sau khi cho tiếp xúc với clopidogrel | Xét nghiệm tiểu cầu chính xác hơn so với xét nghiệm ngoài cơ thể (ex vivo). Hạn chế: Chưa có nghiên cứu đã xuất bản giải thích độ bao phủ bề mặt thấp với đáp ứng với clopidogrel. |
| Impedance Aggregometer (Chrono-Log, Havertown, PA) | Điện trở giữa 2 điện cực nhúng trong máu toàn phần | 500 µL máu toàn phần pha loãng và cho vào cuvet để ủ. Chất chủ vận được thêm vào mẫu và đo điện trở | Có mối liên quan với máy đo độ kết tập tiểu cầu quang học. Chuẩn bị mẫu trong 2 phút, kết quả có sau 10 phút. Hạn chế: Chưa có nghiêncứu tiến cứu. |
2 Thuốc giãn mạch
2.1 Adenosine
Adenosine là nucleoside nội sinh với những hoạt tính khác nhau trong cơ thể. Receptor A2a gây giãn mạch và sung huyết (tăng dòng) trong tuần hoàn vành, ngược lại, receptor A1 gây nhịp chậm; receptor A2b gây co thắt phế quản. Adenosine bị bất hoạt nhanh chóng bởi adenosine deaminase ở tế bào hồng cầu và nội mạc, vì vậy có thời gian tác động ngắn.
Adenosine ngoại sinh là thuốc được sử dụng nhiều nhất trong đánh giá huyết động đòi hỏi giãn mạch do giá thành thấp, thời gian bán thải thấp và tương đối ít tác dụng phụ kéo dài. Thuốc được tiêm qua tĩnh mạch (140 µg/kg/phút) hoặc tiêm vào mạch vành (40-200 µg). Tiêm vào mạch vành adenosine (60-100 mg) có thể hữu ích trong giải quyết các trường hợp dòng chảy chậm sau PCI, liều thấp hơn có thể ngăn chặn no reflow. Adenosine được sử dụng với liều cao hơn (6-12 mg IV) cho ức chế dẫn truyền nhĩ thất, đây là phương pháp điều trị các rối loạn nhịp nhanh trên thất do vòng vào lại. Adenosine nên được sử dụng cẩn thận ở bệnh nhân có nguy cơ bị co thắt phế quản và là chống chỉ định ở bệnh nhân đang điều trị với dipyridamole. Caffeine ở liều cao có thể ức chế đáp ứng với adenosine.
2.2 Regadenoson
Regadenoson là thuốc đối kháng chọn lọc receptor A2a được chế tạo để tạo hiệu ứng giãn mạch giống như adenosine với nguy cơ thấp có tác dụng ngoài mục tiêu như: nhịp chậm hoặc co thắt phế quản. Bởi vì nó có thời gian bán thải dài hơn adenosine 2-3 phút, được sử dụng với liều bolus đơn 0,4 mg/5 ml để thuận tiện. Các thử nghiệm lâm sàng sử dụng thuốc này trong hình ảnh tưới máu hạt nhân gợi ý rằng nó không thua kém so với adenosine. Mặc dù đối kháng receptor A2a, tác dụng phụ có thể gặp khó thở và đau ngực xảy ra với tỷ lệ tương tự với adenosine và thỉnh thoảng yêu cầu đảo ngược bằng aminophylline. Regadenoson đã được sử dụng trong phòng thông tim như chất thay thế cho adenosine trong khi đánh giá huyết động, tuy nhiên, do giá thành tăng và thiếu các lợi ích rõ ràng nên nó được dùng tương đối ít.
2.3 Nitroglycerin
Nitroglycerin là thuốc giãn mạch có nhiều công dụng trong phòng can thiệp. Nó được sử dụng đường động mạch để giảm co thắt mạch vành và ngăn ngừa co thắt mạch vành do dụng cụ can thiệp như IVUS hoặc dây dẫn. Nitroglycerin giảm đau ngực và suy tim bởi gây giãn mạch mạch vành và giảm tiền gánh và hậu gánh.
Nitroglycerin có thể tiêm vào mạch vành, tĩnh mạch, qua da, đường dưới lưỡi. Liều tiêm mạch vành từ 50-300 µg, tĩnh mạch từ 20-200 µg/phút, 0,3 đến 0,4 mg dưới lưỡi. Liều có thể được lặp lại tới khi đạt được hiệu quả mong muốn hoặc bắt đầu xuất hiện tụt áp. Quen thuốc có thể xảy ra nếu sử dụng kéo dài nitroglycerin. Nitroglycerin không có tác dụng ở các mạch máu có đường kính nhỏ hơn 200 microm, vì vậy không nên sử dụng để điều trị no-reflow trừ khi có kèm co thắt mạch thượng tâm mạc.
2.4 Nicorandil
Nicorandil là thuốc chống đau ngực với tính chất của nitrate và chủ vận K+ATPase. Nicorandil kích thích guanylate cyclase từ đó tăng cyclic guanosine monophosphate (cGMP), từ đó tăng protein kinase G gây tăng hoạt tính của K+ATPase, kết quả là ưu phân cực và ức chế co thắt cơ trơn. Nó gây giãn các động mạch vành thượng tâm mạc ở nồng độ thấp và giảm sức cản mạch vành ở nồng độ cao. Nó được chứng minh là hiệu quả và có khả năng bảo vệ tim trong lúc can thiệp. Nicorandil (2 mg tiêm vào mạch vành) được sử dụng trong đánh giá huyết động và có ít tác dụng phụ hơn (block nhĩ thất) so với adenosine. Nicorandil có thể hữu ích để ngăn ngừa và điều trị no reflow. Nicorandil đường uống đi kèm với tác dụng phụ như đau đầu và loét miệng.
2.5 Papaverine
Papaverine là một dẫn xuất opioid, nó ức chế phosphodiesterase, kết quả làm tăng cAMP. Nó có tác dụng trực tiếp lên cơ trơn, tác động lên cả mạch vành và tuần hoàn ngoại vi. Nó được sử dụng để điều trị co thắt đường tiêu hoá và sử dụng để điều trị rối loạn xuất tinh và đau đầu migraine. Ở dạng tiêm, nó gây giãn mạch và sung huyết, vì vậy hữu ích trong đo FFR. Tuy nhiên nó đi kèm với tác dụng phụ như: nhịp nhanh thất đa hình thái và rung thất (2-3%), tụt áp, nhịp nhanh.
2.6 Verapamil
Verapamil là thuốc chẹn kênh Canxi non-dihydropyridine được sử dụng trong nhịp nhanh trên thất. Mặc dù, so với dihydropyridine, nó có tác dụng giãn mạch tối thiểu, ở bệnh nhân có hiện tượng no reflow hoặc slow flow sau PCI, verapamil có hiệu quả trong cải thiện tưới máu đoạn xa. Liều từ 100 µg đến 1000 µg tiêm vào mạch vành, tác dụng phụ chủ yếu là nhịp chậm và block nhĩ thất.
2.7 Nitroprusside
Nitroprusside là thuốc giãn động mạch trực tiếp, hoạt động bởi cung cấp nitric oxide tới cơ trơn tiểu động mạch. Thuốc được sử dụng cho bệnh nhân bị tăng huyết áp cấp cứu với đường truyền tĩnh mạch liên tục. Tiêm vào mạch vành nitroprusside (0,6 µg/kg) gây ra giãn mạch sử dụng trong đo lường huyết động, nhưng ít được dùng do gây tụt huyết áp. Nitroprusside có thể có lợi ở bệnh nhân có hiện tượng no reflow, đặc biệt ở liều 100 µg , nhưng lợi ích này không được xác nhận ở các thử nghiệm lớn hơn.
Nitroprusside bị bất hoạt bởi ánh sáng, vì vậy phải bảo quản trong tối. Nó có thời gian khởi phát tác dụng tương đối ngắn nhỏ hơn 3 phút. Ngộ độc cyanide có thể xảy ra ở bệnh nhân suy thận nếu sử dụng kéo dài.
2.8 Nicardipine
Nicardipine là một thuốc ức chế kênh canxi dihydropyridine đường tĩnh mạch, nó gây giãn các tiểu động mạch mà ít tác dụng lên tim. Nó thường được sử dụng trong tăng huyết áp cấp cứu, có thể truyền với liều tối đa 15 mg/giờ. Nó có thể hữu ích trong ngăn ngừa hoặc điều trị hiện tượng no reflow.
Bảng 9.10 và 9.11 liệt kê các thuốc giãn mạch và liều thông thường được sử dụng trong đánh giá huyết động và điều trị không tái lập dòng chảy (no-reflow).
Bảng 9.10. Thuốc giãn mạch tăng tưới máu
| THUỐC | ĐƯỜNG DÙNG | LIỀU | GHI CHÚ |
|---|---|---|---|
| Adenosine | Tĩnh mạch | 140 µg/kg/phút | Thuốc tiêu chuẩn được sử dụng trong thử nghiệm. Tác dụng phụ: khó thở, đau ngực, nhịp chậm. Đôi khi gây giãn mạch kéo dài. |
| Adenosine | Trực tiếp vào trong lòng mạch vành | 60 – 100 µg (Động mạch vành phải) 100 – 200 µg (Động mạch vành trái) | Ít tác dụng phụ toàn thân hơn đường tĩnh mạch, khởi phát tác dụng giãn mạch nhanh, kéo dài 15- 20 giây. Có thể dùng liều lặp lại nhanh |
| Regadenoson | Trực tiếp vào trong lòng mạch vành | 0,4 mg | Giá thành cao. Thời gian tác dụng giãn mạch rất thay đổi, có thể kéo dài. |
| Nitroprusside | Trực tiếp vào trong lòng mạch vành | 0,6 µg/kg | Dễ dùng, nhưng gây tụt áp nặng |
| Nicorandil | Trực tiếp vào trong lòng mạch vành | 2mg | Ít tác dụng phụ hơn adenosine. |
| Papaverine | Trực tiếp vào trong lòng mạch vành | 10- 20 mg | Tác dụng phụ hiếm gặp là nhịp nhanh thất đa dạng (2 – 3%) |
Bảng 9.11. Xử trí không tái lập dòng chảy (no-reflow)
| Thuốc đầu tay | Adenosine (10–100 µg đường nội mạch vành (IC) trong điều trị, 24–48 µg trong dự phòng Verapamil (100 µg IC, tổng liều tối đa 1500 µg) Nitroprusside (100 µg IC, lặp lại liều bolus) Nicorandil (2 mg IC, liều duy nhất) |
|---|---|
| Lựa chọn thứ 2 | Diltiazem (0,5–2,5 mg IC bolus, tối đa 5–10 mg) Papaverine (10 mg IC) Nicardipine (200 µg IC, liều trung bình là 460 µg) |
Còn đang tranh cãi, có thể không có hiệu quả | Thuốc ức chế glycoprotein (hiệu quả trong dự phòng nhưng lợi ích trong điều trị còn chưa rõ) Truyền nước muối sinh lý áp lực cao |
| Không có hiệu quả | Nitroglycerin (tuy nhiên có thể giúp xử trí tình trạng co thắt kèm theo) Đặt stent, phẫu thuật bắc cầu Thuốc tiêu huyết khối |
3 Thuốc tăng co bóp cơ tim
Dobutamine là thuốc tăng co bóp cơ tim ngoại sinh, nó kích thích receptor adrenergic beta-1 và beta-2. Nó làm tăng sức co bóp cơ tim và nhịp tim, vì vậy có lợi trong suy tim ứ huyết, shock tim, nhịp chậm. Trong phòng can thiệp, dobutamine được sử dụng không thường xuyên để phân biệt hẹp chủ cung lượng thấp, chênh áp thấp với giả hẹp chủ.
4 Thuốc co mạch
4.1 Dopamine
Dopamine là amin nội sinh với các hoạt tính đa dạng. Ở người bình thường, dopamine kích thích receptor dopamine ở liều thấp (3,5 µg/kg mỗi phút IV), receptor beta ở liều trung bình (5-10 µg/kg mỗi phút) và receptor alpha ở liều cao (10-20 µg/kg mỗi phút). Hoạt tính đặc hiệu của dopamine có thể thay đổi với liều và tình trạng của bệnh nhân. Ở liều thấp, dopamine tăng tưới máu thận, mặc dù tác dụng không có ý nghĩa về mặt lâm sàng. Dopamine là sẵn sàng và hữu ích cho shock, nhưng bởi vì tác dụng thay đổi nên đã bị thay thế phần lớn bởi norepinephrine.
4.2 Norepinephrine
Norepinephrine kích thích receptor alpha và kích thích ít hơn receptor beta adrenergic. Nó tạo ra tác dụng co mạch và một chút co bóp cơ tim, vì vậy được ưa dùng hơn trong sốc. Nó hữu ích ở thủ thuật PCI nguy cơ cao hoặc ở bệnh nhân tụt áp.
4.3 Phenylephrine
Phenylephrine là chất chủ vận chọn lọc alpha adrenergic, gây co thắt động mạch. Phenylephrine tăng hậu gánh mà không tăng co bóp cơ tim, nguy cơ làm giảm cung lượng tim. Là thuốc hồi sinh tim phổi do làm tăng huyết áp nhanh chóng khi dùng đường tĩnh mạch. Nó không tác dụng và nên tránh ở bệnh nhân sốc tim do làm tăng sức cản mạch hệ thống.
Bảng 9.12. Liệt kê sự hoạt hoá các receptor của các catecholamines được sử dụng phổ biến
| THUỐC | HOẠT TÍNH TRÊN CÁC RECEPTOR | ||||
|---|---|---|---|---|---|
| α1 | α2 | β1 | β2 | Dopamine | |
| Dobutamine | + | – | +++ | + | – |
| Dopamine | ++ | + | ++ | +++ | ++++ |
| Norepinephrine | +++ | +++ | + | – | – |
| Epinephrine | +++ | ++ | +++ | ++ | – |
| Phenylephrine | +++ | + | – | – | – |
5 Tài liệu tham khảo
1. Phạm Mạnh Hùng, Phạm Trần Linh et Thuốc tim mạch trong thực hành lâm sàng, 2020, Nhà xuất bản Y học.
2. Bertram G. Katzung. Basic & Clinical Pharmacology, Fourteenth Edition 2018, by McGraw-Hill Kanu Chatterjee, Eric J Cardiac Drugs, Second Edition 2015, by Jaypee Brothers Medical Publishers.
3. Xian Y, Wang TY, McCoy LA, et Association of Discharge Aspirin Dose With Outcomes After Acute Myocardial Infarction: Insights From the Treatment with ADP Receptor Inhibitors: Longitudinal Assessment of Treatment Patterns and Events after Acute Coronary Syndrome (TRANSLATE-ACS) Study. Circulation 2015; 132:174.
4. Levine GN, Bates ER, Bittl JA, et 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2016; 68:1082.
5. Juhani Knuuti, William Wijns, Antti Saraste, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal, Volume 41, Issue 3, 14 January 2020, 407–477.
6. Borja Ibanez, Stefan James, Stefan Agewall, et 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal, Volume 39, Issue 2, 07 January 2018, 119–177.
7. Marco Roffi, Carlo Patrono, Jean-Philippe Collet, et 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). European Heart Journal, Volume 37, Issue 3, 14 January 2016, 267–315.
8. Müllner M, Urbanek B, Havel C, et Vasopressors for shock. Cochrane Database Syst Rev 2004; :CD003709.
9. Rouleau JL, Roecker EB, Tendera M, et al. Influence of pretreatment systolic blood pressure on the effect of Carvedilol in patients with severe chronic heart failure: the Carvedilol Prospective Randomized Cumulative Survival (COPERNICUS) study. J Am Coll Cardiol. 2004;43:1423-9.

