Các thiết bị hỗ trợ suy thất trái ứng dụng trong tim mạch can thiệp
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn:
BSCKII. Nguyễn Trung Hậu
ThS.BSNT. Võ Duy Văn
PGS.TS.BS. Phạm Mạnh Hùng
Trungtamthuoc.com - Khi thất trái bị suy giảm chức năng thì các hoạt động tuần hoàn thay đổi tiêu cực bao gồm:giảm tưới máu tạng, tăng áp lực đổ đầy, giảm tưới máu động mạch vành,... thì sự ra đời của những thiết bịnhư làIABP,Impella, Tandemheart,....sẽ thay thếnhiệm vụ cơ học tuần hoàn của thất trái. Vậy các thiết bị này có nguyên lý hoạt động như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy tìm hiểu nhé!
1 Đại cương
Các thiết bị hỗ trợ tuần hoàn cơ học thất trái được sử dụng để hỗ trợ huyết động trong nhiều bệnh cảnh lâm sàng. Các thiết bị sẽ hỗ trợ bằng việc thực hiện một phần công việc của thất trái. Việc sử dụng các thiết bị này giúp cải thiện các thông số chức năng tuần hoàn:
- Tăng tưới máu tạng.
- Giảm áp lực đổ đầy
- Giảm thể tích và áp lực thất trái, giảm tiêu thụ oxy cơ
- Tăng tưới máu động mạch vành.
Một số thiết bị hỗ trợ tuần hoàn cơ học thất trái được dùng gồm bóng đối xung động mạch chủ (IABP), Impella, Tandemheart và oxy hoá máu màng ngoài cơ thể động - tĩnh mạch (VA ECMO). Trong đó, IABP và Impella 2.5 thường được sử dụng do quy trình thực hiện đơn giản, thời gian hỗ trợ dài và ít gây rối loạn đông máu. Tandemheart hiện nay ít được sử dụng.
Chỉ định các thiết bị hỗ trợ thất trái
Sốc
Rối loạn chức năng thất trái nặng.
Các biến chứng cơ học của nhồi máu cơ tim cấp.
Can thiệp các tổn thương động mạch vành phức tạp (như tổn thương thân chung động mạch vành trái không được bảo vệ, tổn thương nghiêm trọng nhiều nhánh mạch vành, tổn thương mạch vành còn lại cuối cùng, tổn thương mạch cầu nối).
Là bước cầu nối để thực hiện các liệu pháp điều trị cao hơn:
- Hỗ trợ tạm thời ở những bệnh nhân tổn thương hẹp nặng thân chung động mạch vành trái.
- Suy tim nặng mất bù.
- Thiếu máu cơ tim trầm trọng.
- Rối loạn nhịp thất trầm trọng.
Sốc tim là tình trạng giảm tưới máu hệ thống mô, do suy giảm chức năng bơm máu của thất trong điều kiện thể tích tuần hoàn bình thường. Sốc tim được xác định khi huyết áp tâm thu < 90 mmHg kéo dài > 30 phút kèm theo:
- Không đáp ứng với truyền dịch.
- Phải duy trì huyết áp tâm thu > 90 mmHg bằng thuốc vận mạch.
- Chỉ số tim < 2,2 l/phút/m2, áp lực mao mạch phổi bít >15
- Giảm tưới máu mô: đầu chi lạnh, thiểu niệu, nước tiểu < 30 ml/giờ.
- Thay đổi ý thức, vật vã kích thích hay li bì hôn mê.
Trong đó, nguyên nhân phổ biến nhất của sốc tim là hội chứng vành cấp (nhồi máu cơ tim ST chênh lên và hội chứng vành cấp ST không chênh lên), chiếm khoảng 80% các trường hợp; một số nguyên nhân khác bao gồm đợt cấp suy tim, bệnh lý van tim, rối loạn nhịp tim phức tạp và viêm cơ tim. Sốc tim là biến chứng gặp ở 5-8% những trường hợp nhồi máu cơ tim cấp ST chênh lên và là nguyên nhân của 50% tử vong trong viện. Các thuốc vận mạch và thuốc làm tăng sức co bóp cơ tim mặc dù được sử dụng rộng rãi nhưng không làm giảm được tỉ lệ tử vong. Sự hỗ trợ cơ tim bằng thiết bị cơ học ở những bệnh nhân sốc tim có thể hạn chế kích thước ổ nhồi máu, tăng tưới máu cơ quan đích và làm giảm nhu cầu oxy của cơ tim.
Những tiến bộ trong tim mạch can thiệp hiện nay đã dẫn đến sự chuyển hướng từ phẫu thuật bắc cầu nối chủ-vành (CABG) sang can thiệp động mạch vành qua da (PCI) với các tổn thương mạch vành nguy cơ cao, đặc biệt trên các bệnh nhân không thể phẫu thuật. Những trường hợp mạch vành nguy cơ cao được đồng thuận là sự phối hợp của tổn thương mạch vành phức tạp (như tổn thương thân chung động mạch vành trái không được bảo vệ, tổn thương nghiêm trọng nhiều nhánh mạch vành, tổn thương mạch vành còn lại cuối cùng, tổn thương mạch cầu nối) với bệnh cảnh lâm sàng đặc biệt (hội chứng vành cấp, suy giảm chức năng thất trái nghiêm trọng), kèm theo các yếu tố không thuận lợi của bệnh nhân (như tuổi cao, thể trạng suy nhược, nhiều bệnh lý kèm theo). Các thiết bị hỗ trợ thất trái được đặt trong quá trình can thiệp động mạch vành để hạn chế nguy cơ suy sụp huyết động có thể xảy ra, cũng như hỗ trợ huyết động sau khi tái thông mạch. Việc sử dụng các thiết bị hỗ trợ thất trái đã làm tăng tỷ lệ thành công, giảm tỷ lệ tử vong, giảm tổng chi phí điều trị và chăm sóc sức khỏe ở nhóm bệnh nhân này. Bảng 64.1 đưa ra hướng dẫn cho việc sử dụng thiết bị hỗ trợ thất trái trong can thiệp động mạch vành nguy cơ cao.
Bảng 64.1. Lựa chọn thiết hỗ trợ thất trái trong can thiệp động mạch vành nguy cơ cao
TỔN THƯƠNG THÂN CHUNG, | DỰ KIẾN QUÁ TRÌNH CAN THIỆP KHÔNG QUÁ KHÓ KHĂN | DỰ KIẾN QUÁ TRÌNH CAN THIỆP KHÓ KHĂN, HOẶC THỜI GIAN CAN |
|---|---|---|
| Chức năng thất trái bình thường hoặc giảm nhẹ | Không cần | IABP hoặc Impella |
Chức năng thất trái giảm nặng (EF < 35%) hoặc đang suy tim tiến triển | IABP hoặc Impella | Impella hoặc TandemHeart |
2 Bóng đối xung động mạch chủ (Intra Aortic Balloon Pump - IABP):
2.1 Giới thiệu thiết bị
Một trong những thiết bị hỗ trợ tuần hoàn cơ học thường dùng nhất là bóng đối xung động mạch chủ (Intra Aortic Balloon Pump – IABP). IABP có thể được đặt dễ dàng và nhanh chóng, ít tốn kém nhất trong số các thiết bị; ngoài ra, việc hoạt động của IABP không yêu cầu nhân viên hỗ trợ kỹ thuật giám sát liên tục. Hoạt động của IABP làm tăng huyết áp tâm trương và huyết áp trung bình động mạch, từ đó giúp tăng tưới máu mạch vành, giảm hậu gánh, giảm nhu cầu oxy cơ tim.
Trước đây, bóng đối xung động mạch chủ được chỉ định cho các trường hợp sốc tim, tuy nhiên các nghiên cứu gần đây cho thấy hiệu quả hỗ trợ hạn chế của IABP trên nhóm bệnh nhân này. Hiện nay, IABP được chỉ định cho các trường hợp suy tim mất bù, sau phẫu thuật tim mạch và hỗ trợ trong các thủ thuật can thiệp tim mạch nguy cơ cao.
Dù đã được sử dụng thường xuyên và rộng rãi, hiện vẫn thiếu các nghiên cứu ngẫu nhiên ủng hộ việc sử dụng IABP một cách thường quy. Một bất lợi khác của IABP là sự hạn chế trong việc hỗ trợ lưu lượng dòng với chỉ 0,5 L/phút, kèm theo làm gia tăng biến cố chảy máu và các biến cố mạch máu.
2.2 Mô tả thiết bị
2.2.1 Cấu tạo và nguyên lý hoạt động
Bóng đối xung động mạch chủ bao gồm một quả bóng polyurethane, bao quanh một ống thông hai nòng được gắn vào một trục linh hoạt và kết nối với bảng điều khiển. Nó được bơm bởi một hệ thống kiểm soát khí. Sau khi lựa chọn kích cỡ phù hợp, IABP được đặt qua da từ động mạch đùi (hoặc động mạch cánh tay) vào động mạch chủ. Nòng trong được dùng để theo dõi huyết áp và nòng ngoài là để bơm khí vào ống. Helium là loại khí thường được sử dụng nhất do tỷ trọng thấp và đặc tính vật lý phù hợp để vận chuyển nhanh chóng đến bóng; CO, cũng được sử dụng ở một vài trung tâm khác. Sự giãn nở hoàn toàn của bóng cần được kiểm tra trước khi bắt đầu hoạt động bơm xả và việc đánh giá mạch máu ngoại biên cũng cần được tiến hành để đảm bảo tưới máu chi đầy đủ, bao gồm mạch chi dưới và mạch quay.
.jpg)
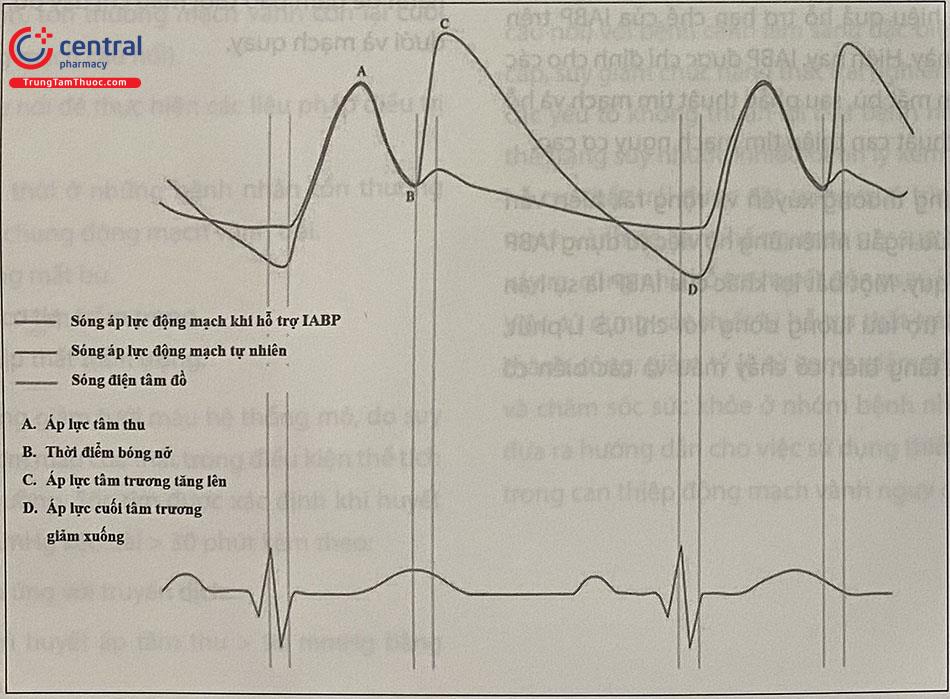
Thời điểm làm căng và xẹp bóng nên được điều chỉnh để đạt được hiệu quả tối đa. Thông thường, bóng được kích hoạt dựa trên điện tâm đồ bề mặt. Bóng được bơm căng vào đầu thời kỳ tâm trương, tương ứng thời điểm giữa sóng T. Thời điểm hút xẹp bóng là đầu thời kỳ tâm thu – vị trí bắt đầu kết thúc phức bộ QRS trên đường theo dõi điện tâm đồ.
Các rối loạn nhịp tim, nhiễu hoặc chất lượng điện tâm đồ kém đều có thể ảnh hưởng đến hoạt động bơm/xả của bóng. Trong các trường hợp này, hoạt động của bóng sẽ được kích hoạt bởi hình dạng sóng áp lực động mạch. Bóng sẽ được bơm căng lên sau khi van động mạch chủ đóng lại (tương ứng với dấu lõm trong hình dạng sóng áp lực động mạch) và hút xẹp xuống ngay lập tức trước khi mở van động mạch chủ. Tần suất bơm xả bóng có thể được điều chỉnh theo thời gian: từ mỗi nhịp 1:1 đến mỗi hai hay ba, thậm chí là bốn nhịp.
2.2.2 Hiệu quả lên huyết động
Bóng được bơm căng trong thời kỳ tâm trương, khi van động mạch chủ đóng, làm gia tăng máu ở đoạn lên và đoạn quai động mạch chủ, từ đó dẫn đến:
- Tăng huyết áp tâm trương: huyết áp tâm trương động mạch chủ có thể tăng thêm 30%, từ đó làm tăng huyết áp trung bình động mạch chủ.
- Tăng lưu lượng máu tới động mạch vành, tăng tưới máu động mạch vành, tăng tưới máu cơ tim, tăng cung cấp oxy cơ
- Tăng lưu lượng máu tới não và chi trên.
Bóng được hút xẹp trong thời kỳ tâm thu, lúc van động mạch chủ mở ra, tạo thêm một lực âm trong lòng động mạch chủ, từ đó dẫn đến:
- Giảm huyết áp tâm thu: có thể giảm tới 20%.
- Giảm hậu gánh, giảm thể tích và áp lực cuối tâm thu và cuối tâm trương thất trái, từ đó làm giảm công cơ tim, giảm nhu cầu tiêu thụ oxy cơ
- Tăng tưới máu tới các vùng xa của cơ thể.
Một vài tác động khác của bóng đối xung động mạch chủ:
- Giảm nhịp tim: do giảm công cơ
- Giảm áp lực mao mạch phổi bít trung bình 20%.
.jpg)
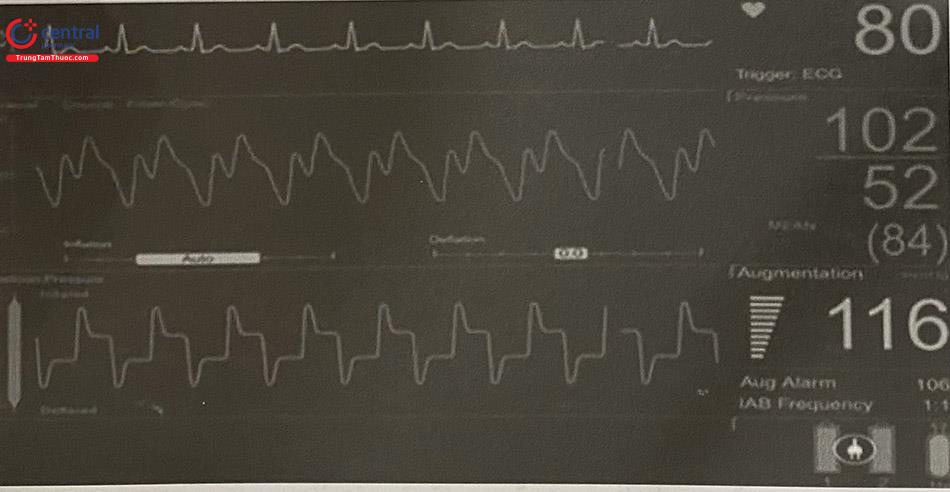
Các tác động trên có thể thay đổi, và chúng còn phụ thuộc vào thể tích bóng, vị trí bóng trong động mạch chủ, nhịp tim, tần số tim, sức cản mạch hệ thống và sự đàn hồi của động mạch chủ. Nhịp tim không đều, tần số tim quá nhanh đều làm rút ngắn thời gian bơm căng bóng làm giảm hiệu quả của bóng. Độ đàn hồi của động mạch chủ càng cao, khả năng cải thiện huyết động của bóng càng tốt.
2.3 Chỉ định và chống chỉ định
2.3.1 Chỉ định
Sốc tim do bất cứ nguyên nhân nào (nhồi máu cơ tim, tổn thương van tim nặng, viêm cơ tim…).
Loạn nhịp tim trơ với thuốc điều trị.
Đau thắt ngực không ổn định kháng trị với thuốc.
Cung lượng tim thấp sau phẫu thuật
Làm biện pháp điều trị cầu nối trong khi chờ đợi các thiết bị hỗ trợ.
Can thiệp động mạch vành qua da (PCI) nguy cơ cao với chức năng thất trái giảm nhiều.
PCI nguy cơ cao liên quan đến thân chung động mạch vành trái chưa được bảo vệ hoặc mạch còn thông duy nhất.
Can thiệp rối loạn nhịp nguy cơ
2.3.2 Chống chỉ định
Chống chỉ định tuyệt đối:
- Hở van động mạch chủ vừa tới nặng.
- Phình hoặc tách động mạch chủ.
Chống chỉ định tương đối:
- Bệnh động mạch chi dưới trầm trọng.
- Rối loạn đông máu nặng chưa được kiểm soát.
- Nhiễm trùng nặng chưa được được kiểm soát.
2.4 Quy trình kỹ thuật
2.4.1 Lựa chọn kích thước bóng đối xung động mạch chủ
Lựa chọn kích thước bóng đối xung phù hợp thường dựa vào: Chiều cao bệnh nhân, thế hệ bóng, được mô tả chi tiết ở bảng dưới đây.
Bảng 64.2. Hướng dẫn lựa chọn kích thước bóng đối xung
| HƯỚNG DẪN CHỌN KÍCH THƯỚC BÓNG (THẾ HỆ BÓNG SENSATION PLUS – MAQUET) | ||
|---|---|---|
| Chiều cao bệnh nhân | Kích cỡ bóng | Kích cỡ introducer sheath |
| <152 cm | 30 cc | 7,5Fr |
| 152 – 162 cm | 40 cc | 7,5Fr |
| > 162 cm | 50 cc | 8Fr |
| HƯỚNG DẪN CHỌN KÍCH THƯỚC BÓNG (THẾ HỆ BÓNG LINEAR – MAQUET) | ||
| Chiều cao bệnh nhân | Kích cỡ bóng | Kích cỡ introducer sheath |
| <152 cm | 25 cc | 7,5Fr |
| 152 – 162 cm | 34 cc | 7,5Fr |
| >162 cm | 40 cc | 7,5Fr |
2.4.2 Đặt bóng đối xung động mạch chủ
Đầu tiên, sát khuẩn vị trí chọc mạch, tiếp cận đường vào động mạch đùi và đưa dây dẫn có đầu chữ J đến cung động mạch chủ.
Sau khi đưa introducer sheath vào lòng động mạch, bóng đối xung được đưa lên qua dây dẫn hướng tới vị trí được đánh dấu nằm trong đoạn động mạch chủ ngay gần gốc động mạch dưới đòn trái (thường ở ngang mức chỗ chia đôi khí quản). Đầu xa của bóng nên đặt ở dưới đỉnh quai động mạch chủ 1 đến 2 cm, đầu gần cao hơn chỗ chia động mạch thận, tránh nguy cơ thiếu máu thận khi bóng hoạt động.
Chụp cản quang dẫn đường (nếu có) được sử dụng để xác định vị trí IABP. Nếu không có chụp cản quang, khoảng cách từ góc Louis (hoặc giữa khoang liên sườn thứ hai và thứ ba) đến rốn và vị trí tiếp cận động mạch đùi có thể được đo để xác định gần đúng khoảng cách đưa bóng lên cao. Sau khi xác định được vị trí IABP, kết nối với đường dẫn khí heli từ bảng điều khiển. Bóng đối xung được bắt đầu cài đặt ở chế độ 1: 2 theo điện tâm đồ và chụp cản quang lại để khẳng định bóng đóng mở đồng nhất. Việc tiếp cận không dùng sheath đôi khi được thực hiện trong trường hợp bệnh nhân mắc bệnh mạch máu ngoại vi để giảm tỷ lệ mắc bệnh thiếu máu cục bộ chi dưới. Tuy nhiên, việc tiếp cận không dùng sheath không cho phép điều chỉnh lại vị trí đặt bóng một khi bóng được đặt, và thường có liên quan đến tỷ lệ nhiễm trùng cao hơn.
Sau khi tiến hành đặt xong bóng đối xung động mạch chủ và kiểm tra bóng hoạt động bơm căng và hút xẹp tốt dưới
màn tăng sáng, vị trí đường vào (sheath) và ống thông được cố định bằng chỉ khâu. Trong một số trường hợp cấp cứu, bóng đối xung động mạch chủ có thể được tiến hành đặt vào cho bệnh nhân ngay tại giường hồi sức tích cực. Trong cả 2 trường hợp, cần chụp Xquang để kiểm tra vị trí của bóng đối xung, đảm bảo đầu xa của bóng nằm sau động mạch dưới đòn trái.
2.4.3 Theo dõi trong quá trình hoạt động bóng
- Chụp Xquang phổi thẳng ngay sau khi đặt bóng và hàng ngày để theo dõi vị trí của đầu xa bóng. Vị trí tốt nhất của đầu xa bóng trên Xquang nên ở ngang chỗ chia đôi của phế quản chính trái và phải (carina).
- Áp lực động mạch trung tâm ở thời điểm trước, sau khi bóng hoạt động và 3 lần mỗi ngày.
- Dạng sóng áp lực (cần một người có kinh nghiệm) 2 lần mỗi ngày.
- Xét nghiệm hematocrit, số lượng tiểu cầu và creat- inin hàng ngày.
- Chống đông máu: trước đây, chống đông toàn thân được khuyên dùng cho tất cả bệnh nhân đặt IABP do lo ngại huyết khối hình thành trên bóng và ống thông. Các tài liệu gần đây cho thấy việc sử dụng chống đông thường xuyên dẫn đến tăng chảy máu, và bệnh nhân không dùng heparin không có tỷ lệ huyết khối cao hơn. Trong thực hành lâm sàng, các rủi ro và lợi ích của thuốc chống đông toàn thân nên được cân nhắc ở từng bệnh nhân cụ thể. Ở những người có nguy cơ xuất huyết cao hoặc từng có biến chứng xuất huyết, dừng thuốc chống đông dường như an toàn với tỷ lệ bơm bóng 1:1.
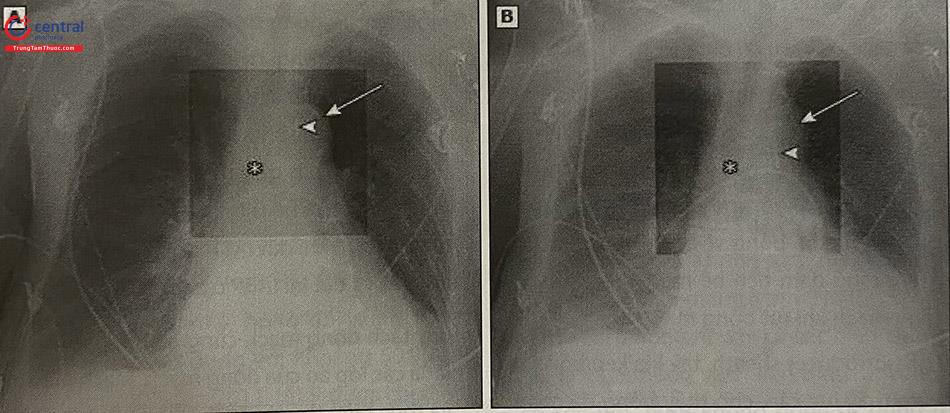
A: đầu của bóng đối xung (mũi tên) ở vị trí cao, trong cung động mạch chủ (đầu mũi tên) và phía trên carina (dấu hoa thị). B: bóng được chỉnh rút xuống ngang với carina, thấp hơn ít nhất 2 cm cung động mạch chủ.
2.4.4 Thời gian dùng bóng đối xung động mạch chủ
Có thể tiếp tục hỗ trợ huyết động bằng IABP kéo dài, miễn là lợi ích mang lại nhiều hơn nguy cơ. Tuy nhiên, nguy cơ các biến chứng sẽ tăng lên theo thời gian sử dụng bóng. Trong trường hợp IABP được dùng như cầu nối, cố gắng thực hiện các can thiệp dứt điểm (tái thông mạch, ghép tim…) để rút ngắn thời gian lưu bóng trong động mạch chủ. IABP nên được loại bỏ ngay khi bệnh nhân ổn định hoặc xuất hiện các biến chứng nặng của việc dùng bóng.
2.4.5 Dừng bóng đối xung động mạch chủ
Khi bệnh nhân đã ổn định huyết động và dừng hoặc giảm được liều thuốc vận mạch xuống rất thấp, có thể dần cai và dừng IABP bằng cách giảm các mức hỗ trợ tim bằng bóng từ 1:1 xuống 1:2, sau đó là 1:3. Tốc độ dừng nhanh hay chậm phụ thuộc vào tình trạng và thời gian được hỗ trợ của bệnh nhân. Những bệnh nhân đặt IABP chỉ để dự phòng sẽ cai nhanh hơn nhiều so với những người cần được hỗ trợ trong vài ngày.
Cần theo dõi cẩn thận các thông số của bệnh nhân như: điện tim, dấu hiệu sinh tồn, lượng nước tiểu và ý thức; bất kỳ rối loạn nào đều cho thấy bệnh nhân chưa sẵn sàng để cai bóng và cần được hỗ trợ tiếp tục. Nhìn chung, nếu một bệnh nhân đã dung nạp với tỷ lệ hỗ trợ 1: 3 trong một giờ, có thể ngừng được IABP. Hiện nay, các máy IABP có khả năng tự động chuyển từ chế độ kích hoạt theo điện tim sang kích hoạt theo áp lực và do đó không cần để IABP ở chế độ chờ khi hồi sức tim phổi (CPR) trong trường hợp ngừng tim.
2.4.6 Rút bóng đối xung ra khoỉ cơ thể
Cần tuân thủ các bước sau để rút bóng:
- Tháo tất cả các nút khâu cố định và chỉ khâu.
- Ngắt kết nối bóng từ bàn điều khiển. Huyết áp của bệnh nhân sẽ tự làm xẹp bóng, nhưng quy trình tại một số cơ sở vẫn yêu cầu phải gắn van một chiều và hút bằng bơm Chúng tôi không khuyến khích điều này bởi nếu hút quá nhiều khí, bóng sẽ cuộn lại, tạo thành những “cánh” làm tăng diện tích bề mặt và có thể gây tổn thương động mạch khi rút bóng ra.
- Một tay giữ introducer sheath, tay kia kéo bóng ra cho đến khi cảm thấy lực cản, cho thấy bóng đã chạm đến phần cuối của sheath. Không cố kéo bóng qua sheath vì nó có thể gây đứt bóng. Tiếp tục rút bỏ bóng và sheath cùng lúc. Trong quá trình này, nếu cảm thấy
- bất kỳ lực cản quá mức nào, bóng có thể đã bị kẹt và phải lấy ra bằng phẫu thuật.
- Ép lên động mạch đùi gần đường vào, kéo bóng và sheath cùng lúc.
- Cho phép chảy máu 1-2 giây để tống huyết khối tiềm tàng ra bên ngoài cơ thể. Sau đó ép động mạch đùi phía trên vị trí đường vào thả lỏng phía dưới đường vào để máu chảy ngược ra ngoài 1-2s.
- Ép mạnh vào vị trí chọc động mạch trong khoảng 20-30 phút (hoặc lâu hơn nếu cần thiết) để cầm máu hoàn toàn, đặc biệt là ở những bệnh nhân dùng chống đông. Có thể sử dụng các thiết bị ép như FemoStop (Abbott Jude Medical) để cầm máu.
2.5 Các biến chứng
Các biến chứng liên quan đến bóng đối xung động mạch chủ có thể chia thành các biến cố mạch máu và biến cố không mạch máu. Trong một đánh giá trên 17000 bệnh nhân được đặt IABP từ năm 1996 đến năm 2000, tổng tỷ lệ biến chứng là 7%, trong đó các biến chứng nặng (thiếu máu chi dưới cấp nặng, chảy máu nặng, tử vong liên quan trực tiếp đến việc đặt IABP) xảy ra ở 2,6% bệnh nhân. Tỷ lệ tử vong liên quan đến IABP chỉ là 0,5%.
2.4.6.1 Biến cố mạch máu
Các biến chứng mạch máu thường gặp nhất của việc đặt bóng đối xung động mạch chủ, xảy ra trong 6-25% các trường hợp. Các biến chứng phổ biến nhất gồm:
- Thiếu máu cục bộ ở chi dưới và tạng.
- Vết rách mạch máu cần phẫu thuật sửa chữa.
- Xuất huyết nặng.
Một vấn đề quan trọng là IABP phải được đưa vào động mạch đùi chung chứ không phải một trong các nhánh của nó (động mạch đùi nông hoặc sâu). Nhìn chung, cả hai nhánh đều không đủ lớn để cho phép đặt thiết bị. Việc chọc mạch quá thấp vào các động mạch nhỏ này là nguyên nhân phổ biến nhất của biến chứng thiếu máu chi dưới cục bộ khi đặt IABP. Khi biến chứng này xảy ra, cần rút thiết bị và đặt lại IABP ở chân đối diện.
Bóc tách động mạch cũng có thể gặp khi đưa dây dẫn vào giữa các lớp áo của động mạch. Mạch máu xoắn vặn, xơ vữa và thực hiện thủ thuật thô bạo cũng là các yếu tố thúc đẩy nguy cơ biến chứng này. Lúc này, dây dẫn và thậm chí bóng có thể đi vào lòng giả. Biến chứng bóc tách có thể chẩn đoán bằng siêu âm, và khi xảy ra cần rút bóng ngay lập tức.
Các biến chứng mạch máu ít gặp hơn, do hoạt động IABP làm tăng tổn thương sự tưới máu, bao gồm thiếu máu cục bộ tủy sống và thiếu máu cục bộ thận và các nội tạng khác. Việc lựa chọn bóng có kích cỡ không phù hợp, bóng lớn và dài hơn mức tối ưu giải phẫu hoặc đặt vị trí bóng không chính xác là nguyên nhân chính của biến chứng này.
2.4.6.2 Các biến chứng không mạch máu
- đột quỵ não hoặc thiếu máu não thoáng qua: là biến chứng hiếm gặp, vì bóng đối xung thường nằm ở xa động mạch dưới đòn trái. Thiếu máu cục bộ não chỉ xảy ra khi đặt IABP quá gần hoặc bị di chuyển tới gần, hoặc huyết khối hình thành và di chuyển lên các mạch nuôi não khi bị bóng đối xung dội ngược.
- Nhiễm trùng: xảy ra khi thời gian lưu bóng đối xung quá dài hoặc chăm sóc tại vị trí đường vào không tốt.
- Vỡ bóng: biến chứng ít gặp, thường liên quan với tình trạng xoắn vặn và vôi hóa động mạch. Vỡ bóng có thể kéo theo tình trạng hình thành huyết khối trên bóng, gây khó khăn cho việc rút bỏ bóng. Để ngăn chặn tình trạng tắc mạch khí heli do vỡ bóng, bảng điều khiển IABP sẽ rút khí heli ra khỏi bóng và tắc hệ thống khi phát hiện tình trạng mất áp lực.
- Các biến chứng khác: giảm tiểu cầu, tan máu, bệnh thần kinh ngoại vi…
Bảng 64.3. Các yếu tố ảnh hưởng đến biến chứng
| CÁC YẾU TỐ LÀM TĂNG NGUY CƠ BIẾN CHỨNG |
|---|
|
| CÁC YẾU TỐ LÀM GIẢM NGUY CƠ BIẾN CHỨNG |
|
2.6 Khuyến cáo và nghiên cứu
IABP đã được sử dụng từ những năm 1960 và thường được sử dụng trong việc hỗ trợ huyết động ở các bệnh nhân can thiệp, đặc biệt trong các trường hợp sốc tim. Theo một nghiên cứu quốc gia của Hoa Kỳ, bóng đối xung động mạch chủ là thiết bị được sử dụng với khoảng 50.000 – 70.000 ca/năm từ năm 2007 đến 2011. IABP được chỉ định nhóm IB trong guideline của ACC/AHA 2004. Tuy nhiên, thử nghiệm IABP-SHOCK II trên 600 bệnh nhân NMCT cấp có sốc tim, IABP không cho thấy sự khác biệt về kết cục lâm sàng so với việc không sử dụng tại thời điểm sau 30 ngày, 12 tháng cũng như sau 6 năm theo dõi. Do vậy, hướng dẫn mới ACC/AHA 2013 đã hạ khuyến cáo sử dụng IABP xuống nhóm IIa, với việc không sử dụng thường quy IABP trên các bệnh nhân nhồi máu cơ tim (NMCT) cấp có sốc tim, và chỉ xem xét sử dụng nó khi có các biến chứng cơ học (hở van hai lá cấp, thủng vách liên thất…). Với NMCT cấp không có sốc tim, IABP không được sử dụng thường quy. Thử nghiệm CRISP-AMI thực hiện trên 337 BN NMCT cấp, các bệnh nhân được ngẫu nhiên sử dụng IABP hoặc không, cho thấy không có sự khác biệt về biến cố chính cũng như kích thước ổ nhồi máu ở 2 nhóm.
Bóng đối xung động mạch chủ dự phòng đã được ủng hộ để cải thiện kết cục ở cả bệnh nhân ổn định và bệnh nhân có hội chứng vành cấp cần can thiệp qua da có nguy cơ cao hoặc phức tạp. Các khuyến nghị này dựa trên kết quả của một số nghiên cứu quan sát nhỏ. Tuy nhiên, với thử nghiệm BCIS-1, 301 bệnh nhân trải qua can thiệp động mạch vành nguy cơ cao, được đặt IABP hoặc không, không cho thấy sự khác biệt đáng kể về các biến cố tim mạch chính tại thời điểm 28 ngày giữa 2 nhóm bệnh nhân. Nguy cơ cao được xác định là rối loạn chức năng thất trái nghiêm trọng (phân suất tống máu thất trái ≤30%) và tổn thương mạch vành phức tạp, tổn thương nhiều nhánh mạch vành. Chính vì vậy, các khuyến cáo mới không ủng hộ cho việc đặt IABP thường quy. Mặc dù vậy, sau thời gian theo dõi trung bình 51 tháng các bệnh nhân trong thử nghiệm BICIS-1, tỷ lệ tử vong do mọi nguyên nhân thấp hơn ở những người được điều trị IABP. Năm 2015, một đồng thuận của các chuyên gia về sử dụng thiết bị hỗ trợ tuần hoàn cơ học của SCAI/ACC khuyến nghị, IABP có thể là sự hỗ trợ cho các trường hợp can thiệp động mạch vành nguy cơ cao, bao gồm các trường hợp chức năng thất trái bình thường hoặc giảm nhẹ nhưng tổn thương mạch vành phức tạp và dự kiến quá trình can thiệp kéo dài; và các trường hợp tổn thương mạch vành không phức tạp nhưng có chức năng thất trái giảm nhiều (EF<35%) hoặc đang có tình trạng suy tim tiến triển.
3 TANDEMHEART
3.1 Giới thiệu thiết bị
Thiết bị hỗ trợ thất trái qua da TandemHeart có thể được sử dụng để hỗ trợ tuần hoàn ở những bệnh nhân sốc tim (cho đến khi tim hồi phục ) hoặc bắc cầu trước thủ thuật ở những bệnh nhân can thiệp động mạch vành nguy cơ cao, đặc biệt là những bệnh nhân có bệnh lý thân chung nặng và suy chức năng thất trái nặng.
TandemHeart là một bơm dòng liên tục tốc độ thấp lấy máu giàu oxy từ tâm nhĩ trái (thông qua một ống thông xuyên vách liên nhĩ 21F đi từ tĩnh mạch đùi) và được bơm lại hệ tuần hoàn thông qua ống thông động mạch đùi 15-17 Fr. Thiết bị có thể hỗ trợ tuần hoàn ngắn hạn (6 giờ) và được chứng nhận an toàn trong thời gian lên đến 30 ngày. Những đặc tính này giúp giảm thiểu tan máu và hình thành huyết khối. Hệ thống này có thể vận chuyển dòng máu lên đến 5 L/phút ở tốc độ 7.500 vòng/phút khi dùng qua da và lên đến 8 L/phút nếu dùng phương pháp tạo đường hầm trực tiếp bằng phẫu thuật. Hệ thống này được thiết kế để hỗ trợ tuần hoàn bất kể nhịp tim của bệnh nhân.
3.2 Mô tả thiết bị
TandemHeart thường được đặt trong phòng thông tim và cần chọc xuyên qua vách liên nhĩ vào nhĩ trái thông qua đường vào tĩnh mạch đùi. Ống thông xuyên vách có kích thước 21 Fr với đầu có 1 lỗ vào lớn và 14 lỗ bên để hỗ trợ hút máu từ nhĩ trái. Bơm ly tâm là một thiết bị có thể tích là 10 mL, gồm 6 cánh quạt xoay được cung cấp năng lượng qua một motor nam châm xử lý vi mạch điện 1 chiều. Hệ thống gồm 2 bảng điều khiển, 1 chính và 1 phụ, được sẵn sàng để sử dụng và có chế độ tự xử lý mở rộng có báo hiện để đảm bảo hỗ trợ tuần hoàn xuyên suốt. Ngoài ra còn có pin dự phòng để đảm bảo hỗ trợ không bị ngắt quãng trong vòng 1 giờ để vận chuyển hoặc khi bị ngắt điện. Hơn nữa, một bộ chuyển đổi áp lực được sử dụng để theo dõi áp lực truyền khí và báo hiệu khi có tắc nghẽn trong bộ dẫn truyền. Ống thông dòng ra có đường kính 15- 17 Fr và được đưa vào động mạch đùi chung.
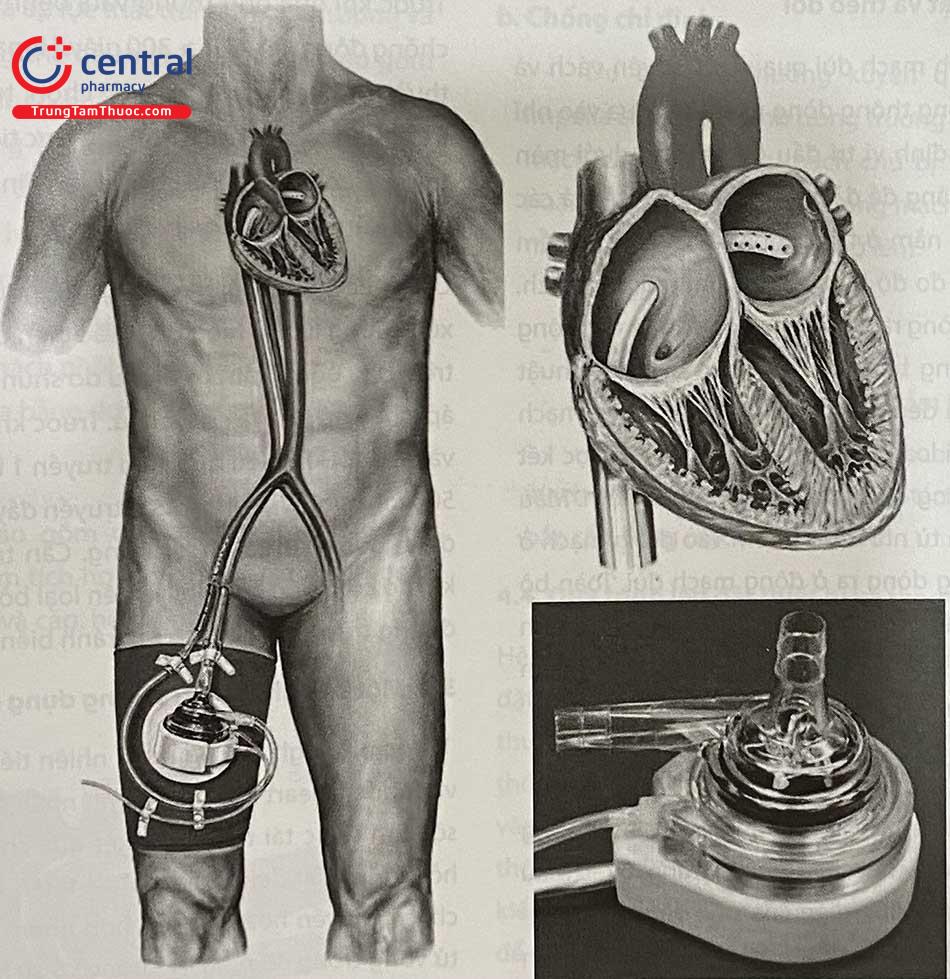
Tandemheart bao gồm một ống thông 21 Fr thông qua đường vào tĩnh mạch đùi và xuyên qua vách liên nhĩ và một ống thông 15-17 Fr để bơm máu vào động mạch đùi chung, động cơ ly tâm bên ngoài quay với tốc độ tối đa 7500 vòng/phút và có thể vận chuyển dòng máu lên đến 5 L/phút.
3.3 Chỉ định và chống chỉ định
3.3.1 Chỉ định
Tandemheart có thể được dùng để hỗ trợ tạm thời ở những bệnh nhân sốc tim hoặc để hỗ trợ bệnh nhânkhi can thiệp mạch vành nguy cơ cao, đặc biệt là khi có suy thất trái nặng. Thông thường, những bệnh nhân này không phù hợp để phẫu thuật do bệnh đồng mắc nặng hoặc các bệnh không thể can thiệp được cũng như những bệnh nhân mà hỗ trợ bằng IABP đơn thuần không đủ để duy trì ổn định huyết động.
3.3.2 Chống chỉ định
Tandemheart phụ thuộc vào chức năng thất phải còn toàn vẹn để hỗ trợ tuần hoàn tối ưu, vì vậy, nếu có kèm suy thất phải hoặc nhồi máu cơ tim thất phải, là chống chỉ định của đặt thiết bị này. Tuy vậy, hệ thống TandemHeart có thể trở thành thiết bị hỗ trợ thất phải, hoặc hai hệ thống có thể sử dụng phối hợp để hỗ trợhai thất.
- Một chống chỉ định khác là có thông liên thất do nguy cơ shunt phải – trái và làm giảm oxy máu sau đó.
- Bệnh van động mạch chủ nặng là nguy cơ của giãn thất trái và thiếu máu cơ tim dưới nội mạc.
- Bệnh động mạch ngoại vi trầm trọng.
- Rối loạn đông máu.
3.4 Quy trình lắp đặt và theo dõi
Sau khi đi vào từ tĩnh mạch đùi qua da và xuyên vách và giãn lỗ bầu dục thì ống thông dòng vào được đưa vào nhĩ trái và cố định, xác định vị trí đầu ống thông dưới màn huỳnh quang tăng sáng để đảm bảo chắc chắn tất cả các lỗ bên của ống đều nằm ở trong nhĩ trái và có thể kiểm tra thêm bằng cách đo độ bão hòa oxy máu động mạch. Sau đó, ống thông dòng ra động mạch được đưa vào động mạch đùi chung cùng bên hoặc đối bên bằng kỹ thuật seldinger và đưa lên đến khi đầu trên nằm ở động mạch chậu chung. Sau khi loại bỏ khí, các ống thông được kết nối với máy bơm bằng ống Tygon có tráng heparin. Máu giàu oxy được lấy ra từ nhĩ trái và bơm vào động mạch ở bụng qua ống thông dòng ra ở động mạch đùi. Toàn bộ hệ thống hỗ trợ tuần hoàn này có thể được đặt thành công trong 30 phút bởi bác sĩ hoặc kỹ thuật viên có kinh nghiệm, và có thể sử dụng đến 14 ngày.
3.5 Các biến chứng và xử lý
Các biến chứng thông thường liên quan đến ống thông mạch máu đùi bao gồm chảy máu, nhiễm trùng, thiếu máu chi cục bộ. Biến chứng kinh điển của việc dùng Tandem- Heart bao gồm huyết khối do ống thông xuyên vách liên nhĩ, đâm nhầm xoang vành hoặc thành sau nhĩ phải gây chèn ép tim. Tắc ống thông có thể là biến chứng nghiêm trọng trong bệnh cảnh sốc hoặc khi tiến hành can thiệp mạch vành phức tạp.
Tần suất biến chứng và mức độ nghiêm trọng của việc đặt ống thông dựa trên kinh nghiệm của trung tâm và tay nghề của thủ thuật viên. Những nghiên cứu ban đầu được thực hiện dưới gây mê toàn thân, có sự chuẩn bị của hồi sức ngoại khoa khi có biến chứng trong quá trình xuyên vách hoặc đặt ống thông. Chế phẩm máu nên được chuẩn bị sẵn trong phòng và đội phẫu thuật nên được chuẩn bị và tốt nhất là có kế hoạch sẵn sàng trong trường hợp cấp cứu khẩn. Nên có sẵn đường truyền tĩnh mạch ngoại biên và trung tâm. Monitor theo dõi huyết áp động mạch xâm lấn, tĩnh mạch trung tâm và có hoặc không có catheter động mạch phổi. Cung lượng tim ban đầu sẽ cao với hỗ trợ tuần hoàn (7-8 L/phút) nhưng thường sẽ giảm trong giai đoạn thủ thuật chính khi mà thất trái ngừng co bóp. Ở những bệnh nhân suy tim nặng, việc dùng siêu âm tim qua thực quản, theo dõi cung lượng tim liên tục qua catheter động mạch phổi hoặc theo dõi oxy tĩnh mạch trộn có thể giúp điều chỉnh huyết động trước, trong và sau hỗ trợ tuần hoàn bằng thiết bị.
Trước khi đưa ống thông vào, bệnh nhân cần được dùng chống đông đạt ACT > 300 giây. Heparin không phân đoạn thường là chống đông được chọn, tuy vậy có những pro- tocol sử dụng ức chế thrombin trực tiếp, nhưng bivalirudin trong trường hợp có chống chỉ định dùng chống đông (như giảm tiểu cầu do heparin).
Cần theo dõi sát biến chứng trong lúc đặt ống thông để xử lý đúng lúc và hiệu quả. Các biến chứng đã được nêu ở trên, bao gồm giảm oxy máu do shunt phải- trái, tụt huyết áp, chèn ép tim và chảy máu. Trước khi khởi đầu máy bơm và để đuổi khí hiệu quả, nên truyền 1 lít dịch tinh thể hoặc 500 mL dung dịch keo được truyền đầy buồng tim vào thời điểm bơm bắt đầu hoạt động. Cẩn trọng với thuyên tắc khí do có thông liên nhĩ và nên loại bỏ khí trong tất cả các đường truyền tĩnh mạch để tránh biến chứng này.
3.6 Một số nghiên cứu về ứng dụng của thiết bị
Trong một nghiên cứu ngẫu nhiên tiến cứu so sánh IABP và TandemHeart ở những bệnh nhân nhồi máu cơ tim có sốc tim được tái tưới máu, kết quả cho thấy nhóm được hỗ trợ bởi TandemHeart có cải thiện huyết động và các chỉ số chuyển hóa đáng kể hơn nhóm IABP, tuy vậy, tỷ lệ tử vong trong 30 ngày là không có sự khác biệt, nhóm sử dụng TandemHeart có tỷ lệ các biến chứng chảy máu nặng và thiếu máu cục bộ cấp tính chi dưới cao hơn. Những kết quả tương tự cũng được ghi nhận trong một số nghiên cứu ngẫu nhiên nhỏ khác.
4 IMPELLA
4.1 Giới thiệu thiết bị
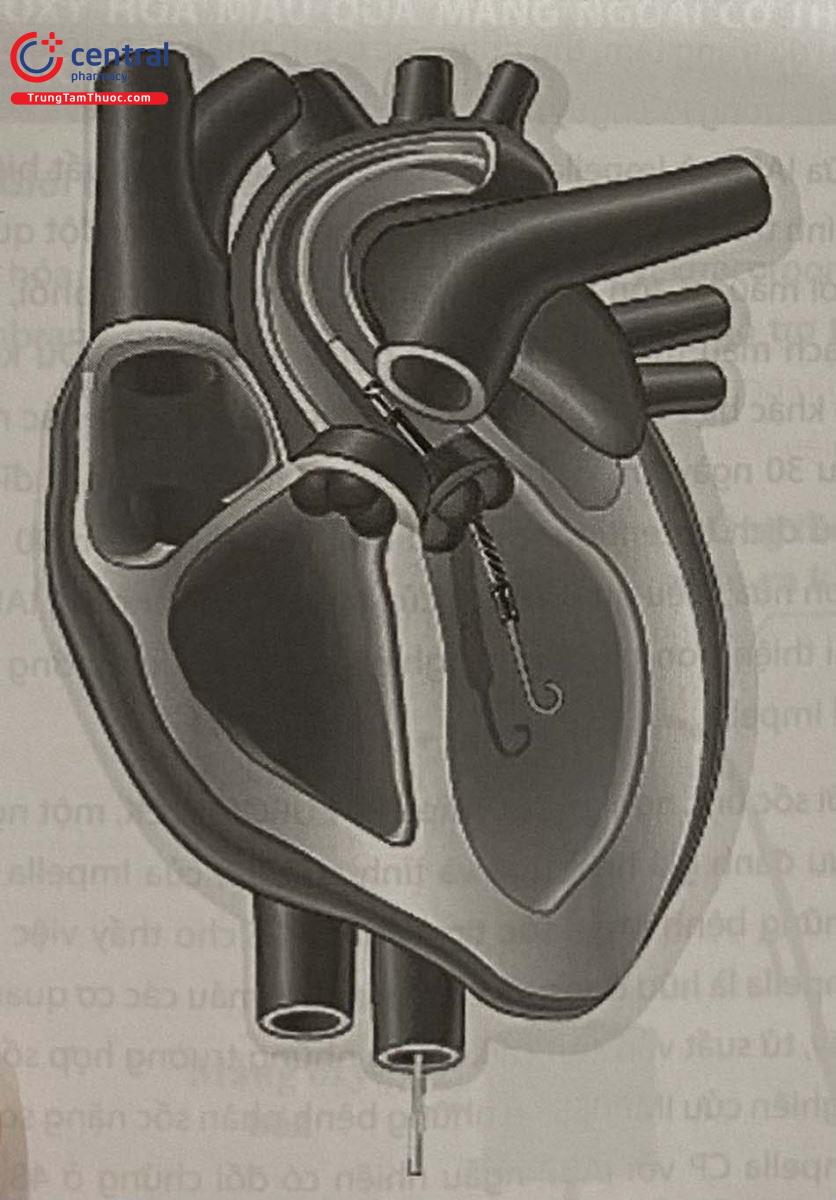
Impella là một thiết bị hỗ trợ thất trái qua da tạm thời, giúp giảm tải thất và hỗ trợ tuần hoàn. Thiết bị bao gồm một bơm máu qua van động mạch chủ. Hệ thống chủ động giảm tải thất trái bằng cách hút máu ở trong tâm thất ở đầu xa và bơm máu vào động mạch chủ ở đầu gần. Bơm được đặt qua động mạch đùi và đến van động mạch chủ dưới hướng dẫn của màn huỳnh quang tăng sáng. Thiết bị này giúp hỗ trợ thất ngắn hạn trong vài giờ đến vài ngày và có các phiên bản: 2,5L, CP-14 Fr (hỗ trợ huyết động 3-4 L/phút) được đặt qua da và LD -21 Fr (hỗ trợ huyết động 5 L/phút) được đặt qua phẫu thuật.
Hiện nay đã có những thiết bị mới hơn bao gồm công nghệ hỗ trợ thông minh (SmartAssist) giúp định vị mà không cần hình ảnh và được dẫn bởi cảm biến quang học giúp phát hiện chênh áp giữa áp lực thất trái cuối tâm trương và động mạch chủ. Những thế hệ thiết bị mới hơn bao gồm Impella CP SmartAssist có khả năng đạt lưu lượng đỉnh4,3 L/phút và hệ thống đặt qua phẫu thuật Impella 5,5 SmartAssist. Cả hai hệ thống đều được gắn với một ống thông pigtail 9 Fr linh hoạt. Dù tiếp cận qua đường động mạch đùi là phổ biến nhất trong hỗ trợ thất trái, chúng ta có thế tiếp cận qua đường động mạch chủ lên (Impella LD) hoặc qua động mạch nách phải. Hệ thống này có thể dùng hỗ trợ thất phải qua da bằng đường tĩnh mạch đùi.
4.2 Mô tả thiết bị
Hệ thống Impella bao gồm các thành phần sau: ống thông Impella với bơm tích hợp, bảng điều khiển Impella kèm pin, nguồn điện và cáp, hệ thống bơm truyền cơ bản Braun vista.
4.3 Chỉ định và chống chỉ định
4.3.1 Chỉ định
Tương tự Tandemheart, chỉ định của Impella bao gồm những bệnh nhân sốc tim cần hỗ trợ tuần hoàn để bắc cầu đợi hồi phục hoặc tiến hành PCI phức tạp, nguy cơ cao.
4.3.2 Chống chỉ định
Do cần đặt thường xuyên qua van, hệ thống Impella chống chỉ định trong trường hợp thay van động mạch chủ, van động mạch chủ bị vôi hóa nặng kèm hoặc không kèm hẹp van động mạch chủ, hở van động mạch chủ có ý nghĩa (độ 2 trở lên).
Huyết khối thất trái.
Thông liên thất.
Bệnh động mạch chi dưới trầm trọng.
Chống chỉ định tương đối bao gồm: Phình động mạch chủ bụng hoặc ngực, bóc tách động mạch chủ, bắc cầu động mạch đùi –
4.4 Quy trình lắp đặt thiết bị và theo dõi
Hệ thống Impella LP 2.5 và CP được thiết kế để có thể đặt qua da, trong khi đó hệ thống LP 5.0 cần phải phẫu thuật động mạch (đùi hoặc nách) để đặt ống thông. Hệ thống đặt qua da sử dụng ống thông 13 Fr hoặc 14 Fr đặt vào động mạch đùi bằng kỹ thuật Seldinger. Sau đó, ống thông pigtail 5 Fr được dùng để tiếp cận tâm thất theo kiểu ngược dòng. Ống thông này nối với hệ thống dây dẫn để trao đổi qua hệ thống bơm 12 Fr hoặc 14 Fr, và sau khi kiểm tra xác định vị trí ở trong tâm thất trái, việc hỗ trợ tuần hoàn được bắt đầu bằng cách dùng các mức hỗ trợ khác nhau, P1 đến P9, lưu lượng tối đa tương ứng lên đến 2,5 L/phút hoặc 4 L/phút. Mức P1, P9 được thiết kế dùng để khởi đầu hoặc cai việc hỗ trợ tuần hoàn cũng như tăng tốc, vì vậy, thường chỉ sử dụng trong vài phút.
Thông thường, Impella hoạt động trong các mức P2 đến P8 trong một đợt hỗ trợ huyết động. Vị trí ống thông phải được kiểm tra trước khi bắt đầu cũng như sau mỗi lần bệnh nhân cần được vận chuyển để thực hiện các thủ thuật hoặc xét nghiệm chẩn đoán. Để đánh giá ống thông đúng vị trí, cần thực hiện siêu âm tim qua thành ngực (mặt cắt dọc thực quản giữa 120-135 độ). Việc điều chỉnh hệ thống đã trở nên dễ dàng và thuận tiện hơn nhờ các bơm thế hệ mới với công nghệ SmartAssist bao gồm các cảm biến vị trí quang học. Đầu vào của ống thông (không phải đoạn J) nên ở dưới van động mạch chủ 4-4,5 cm, trong khi đó, đầu ra cần được đặt trên van động mạch chủ và ống thông phải hướng về phía mỏm thất trái và không chạm thành tim cũng như không cuộn lại hoặc chèn vào van hai lá.
4.5 Các biến chứng và xử lý
Cũng giống như các dụng cụ hỗ trợ thất qua da khác, các biến chứng gồm liên quan đến mạch máu, biến chứng cơ học, nhiễm trùng, thần kinh và huyết học.
Các biến chứng bao gồm đột quỵ não, tổn thương van động mạch chủ, rối loạn nhịp tim, chèn ép tim, nhiễm trùng, tổn thương mạch máu, thiếu máu chi, chảy máu, rối loạn đông máu. Dụng cụ này cũng như các thiết bị sử dụng bơm ly tâm khác có thể gây tình trạng huyết tán và giảm tiểu cầu. Do đó cần phải theo dõi công thức máu và các chỉ điểm cho tình trạng huyết tán như Hb, haptoglobulin, LDH hàng ngày.
Ngoài ra cũng cần lưu ý do những thay đổi huyết động của hệ thống gây ra có thể dẫn đến tình trạng quá tải thể tích thất trái liên quan đến việc đặt sai vị trí (quá sâu) hoặc do rò xì xung quanh ống thông làm hạn chế hoạt động các lá van động mạch chủ. Siêu âm tim để theo dõi kích thước và chức năng thất trái là cần thiết cũng như công nghệ SmartAssist cũng góp phần giảm thiểu tình trạng này và giúp việc sử dụng dễ dàng hơn.
4.6 Một số nghiên cứu về ứng dụng của thiết bị
Có ít nhất 1 nghiên cứu theo dõi dài hạn đã xác định độ an toàn khi sử dụng thiết bị này ở những bệnh nhân can thiệp động mạch vành nguy cơ cao. Việc dùng Impella 2.5 ở những bệnh nhân sốc tim do nhồi máu cơ tim đã được nghiên cứu qua thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng bởi Seyfath, cho kết quả an toàn, khả dụng và vượt trội so với điều trị chuẩn với IABP. Tuy vậy, một phân tích gộp những nghiên cứu nhóm chứng so sánh Impella với IABP bởi Cheng và cộng sự không cho thấy lợi ích trên sống còn 30 ngày. Impella 5.0 ở những bệnh nhân sốc tim sau nhồi máu cơ tim ST chênh lên gợi ý có cải thiện sống còn so với Impella 2.5.
Nghiên cứu sổ bộ Uspella là một nghiên cứu ở những bệnh nhân được hỗ trợ tuần hoàn bằng Impella 2.5. Kết quả của nghiên cứu này cho thấy chiến lược trái ngược của đặt Impella 2.5 trước và sau can thiệp động mạch vành ở những bệnh nhân nhồi máu cơ tim (NMCT) có sốc tim. Hỗ trợ tuần hoàn sớm (trước PCI) cải thiện sống còn nội viện (65,1% so với 40,2%, p = 0,003) và là một yếu tố tiên đoán độc lập sau khi hiệu chỉnh với các biến số khác (odds ratio: 0,37, p= 0,01). Khởi đầu hỗ trợ tuần hoàn sớm cũng giúp tái thông mạch vành hoàn toàn hơn (1,57 0,67 so với 1,30 ± 0,57 số mạch mạch máu được điều trị, P= 0,01).
Nghiên cứu Uspella là tiền thân của các nghiên cứu vVAD, thu nhận 3.339 bệnh nhân trong năm 2016 và được dùng để đánh giá kết cục của Impella trên tất cả các phương thức hỗ trợ tuần hoàn (2,5/CP, 5,0/LAD và RP) . Nghiên cứu cVAD hiện nay là một nghiên cứu toàn cầu với sự tham gia của Hoa Kỳ, Canada, Đức, Anh, Tây Ban Nha, Pháp, Hà Lan, Thụy Sỹ và tương lai sẽ là Nhật Bản, Đan Mạch và Ý. Tương tự như nghiên cứu INTERMACS về cấy ghép LVAD, mục đích của cVAD là để hướng dẫn những nỗ lực sắp tới trong việc tối ưu hóa thời điểm và hỗ trợ tuần hoàn trong thế giới thực. Việc sử dụng ngày càng rộng rãi của Impella CP đã hỗ trợ tuần hoàn cũng như chức năng của tim tốt hơn là Impella 2.5, và cũng có thể tiếp cận đường dưới da, do vậy nó được kỳ vọng sẽ cho kết quả tương tự hoặc thậm chí là tốt hơn, và gần như thay thế Impella 2.5 trong điều trị sốc tim.
Nghiên cứu PROTECT II, một nghiên cứu ngẫu nhiên tiến cứu đa trung tâm, thu nhận các bệnh nhân cần hỗ trợ tuần hoàn trong PCI nguy cơ cao, đã so sánh hiệu quả và kết cục giữa IAPB và Impella 2.5. Kết cục chính là tần suất biến cố chính trong vòng 30 ngày (tử vong, NMCT cấp, đột quỵ, tái tưới máu lại, tổn thương thận cấp, hồi sức tim phổi, chụp mạch máu thất bại và bệnh động mạch chủ). Dù không có khác biệt trong biến cố tim mạch chính giữa các nhóm sau 30 ngày, thì xu hướng kết cục tốt cho nhóm điều trị chủ đích (intention-to-treat: ITT) vào thời điểm 90 ngày. Hơn nữa, hiệu quả điều trị của Impella so sánh với IABP đã cải thiện trong thời gian nghiên cứu, gợi ý xu hướng thiên về Impella.
Với sốc tim, nghiên cứu Impella- EUROSHOCK, một nghiên cứu đánh giá hiệu quả và tính an toàn của Impella 2.5 ở những bệnh nhân sốc tim sau NMCT cho thấy việc dùng Impella là hữu dụng và cải thiện tưới máu các cơ quan, tuy vậy, tử suất vẫn còn cao. Trong những trường hợp sốc tim, nghiên cứu IMPRESS ở những bệnh nhân sốc nặng so sánh Impella CP với IABP ngẫu nhiên có đối chứng ở 48 bệnh nhân thở máy bị sốc tim nặng cho kết quả không cải thiện về sống còn. Hơn nữa, một phân tích gộp gần đây gồm 4 CRT so sánh các thiết bị hỗ trợ thất và IAPB không ủng hộ việc dùng các thiết bị này không chọc lọc trong sốc tim, so với IABP. Các thiết bị được dùng trong phân tích gộp này bao gồm Tandemheart (2 nghiên cứu), Impella 2.5 trong 1 nghiên cứu dựa trên dữ liệu có ghép cặp trên 3.300 bệnh nhân nhồi máu cơ tim có sốc tim so sánh với IABP đã cho kết quả nguy cơ tử vong nội viện và biến chứng chảy máu chính cao hơn.
Trong sốc tim, có vẻ như thời điểm sử dụng và lý do sử dụng là điều tạo nên sự khác biệt khi chỉ dùng các thiết bị này. National cardiogenic Shock Initiative đã ghi nhận được lợi ích trên sống còn thực sự khi thiết lập một protocol về thời điểm sử dụng Impella trong cách thức tiếp cận dựa trên mục tiêu điều trị. Sống còn khi xuất viện là 7,2%, khái niệm thời gian “cửa- hỗ trợ” dưới hướng dẫn bởi các bằng chứng quan về áp lực đổ đầy thất trái và dùng PVAD trước khi can thiệp PCI cũng như tiếp tục đánh giá thang hỗ trợ đã tạo được khác biệt quan trong. Cách tiếp cận này tiếp tục được đánh giá trên quy mô toàn quốc ở Hoa Kỳ với hơn 30 trung tâm và dường như sẽ có kết quả hứa hẹn để đưa ra hướng dẫn về việc sử dụng PVAD trong sốc tim. Tuy vậy, nghiên cứu này thiếu nhóm chứng, và do đó, không thể đưa ra các kết luận so sánh khi thực hành lâm sàng.
5 Oxy hoá máu qua màng ngoài cơ thể (ECMO)
5.1 Giới thiệu thiết bị
Oxy hóa máu qua màng ngoài cơ thể (Extracorporeal membrane oxygenation – ECMO) là hệ thống hỗ trợ tim
phổi cơ học kéo dài, một cải tiến của hệ thống tim phổi nhân tạo trong phẫu thuật tim hở. Sự khác biệt cơ bản giữa ECMO với các thiết bị khác là không cần thiết phải có chức năng phổi đầy đủ để hỗ trợ tuần hoàn hiệu quả, với khả năng hỗ trợ sự sống ngoài cơ thể (ECLS), ECMO thường được sử dụng trong các trường hợp suy tim – phổi trơ, nhằm mục đích điều trị căn nguyên bằng các biện pháp khác. Bên cạnh giá trị của nó trong điều trị suy hô hấp cấp hoặc suy tim cấp đe dọa sinh mạng, vai trò của ECMO trong tim mạch can thiệp ngày càng được được mở rộng với can thiệp động mạch vành qua da (PCI) nguy cơ cao, đặc biệt khi liên quan đến biến chứng sốc tim cấp tính. Trong phần này, chúng tôi tập trung phân tích ảnh hưởng của ECMO lên sinh lý tim mạch, vai trò của nó trong hồi sức tim mạch, từ đó thấy được ý nghĩa của ECMO trong tim mạch can thiệp.
5.2 Mô tả về thiết bị
5.2.1 Cấu tạo và nguyên lý hoạt động
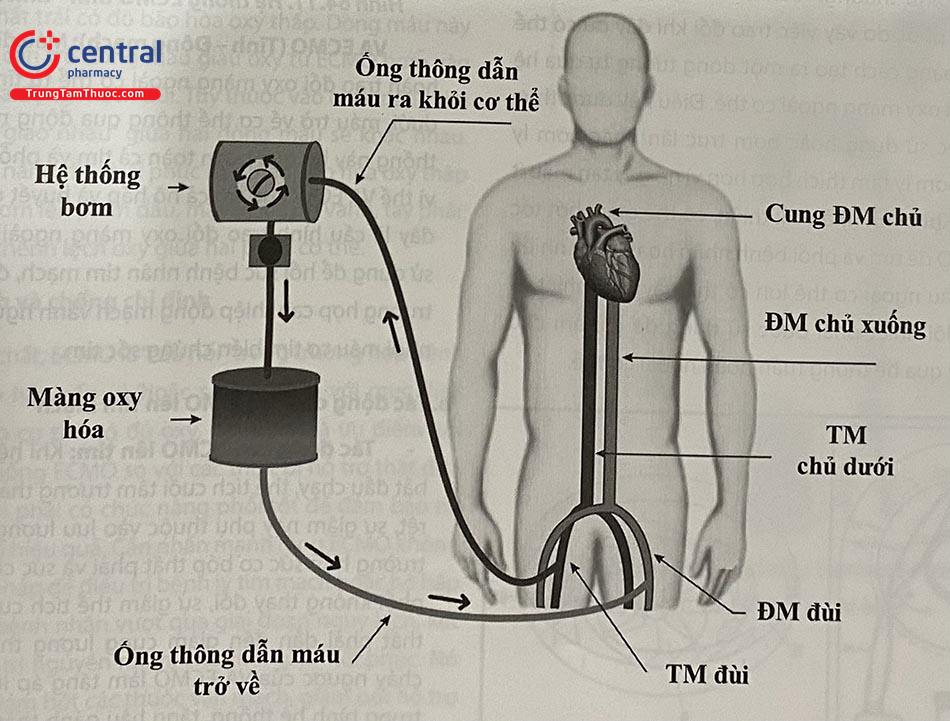
Hệ thống tuần hoàn ECMO về cơ bản bao gồm: Các ống thông đường vào mạch máu, màng trao đổi oxy, hệ thống bơm máu và bộ trao đổi nhiệt (Hình 64.8).

Chú thích: ĐM: Động mạch; TM: Tĩnh mạch.
Khi chạy ECMO, máu được rút ra khỏi cơ thể, bơm qua một màng gọi là màng trao đổi oxy, sau đó trở về tuần hoàn cơ thể. Máu được tiếp xúc với khí lưu thông có một nồng độ phân suất oxy đặt sẵn. Điều này đã tạo ra sự chênh lệch áp suất riêng phần giữa khí lưu thông và máu, làm cho O2 đi vào và CO2 đi ra, màng trao đổi oxy hiện đại được cấu tạo bởi hàng ngàn các sợi rỗng cho phép hồng cầu đi vào để tiếp xúc gần với khí lưu thông (Hình 64.9)

Cho thấy sự di chuyển của khí lưu thông và máu theo hai hướng ngược nhau. Cấu trúc sợi rỗng tinh xảo cho phép hồng cầu tiếp xúc gần với khí lưu thông.
Trong cơ thể bình thường, toàn bộ cung lượng tim phải được đẩy qua phổi, do vậy việc trao đổi khí đầy đủ có thể đạt được chỉ bằng cách tạo ra một dòng tương tự qua hệ thống trao đổi oxy màng ngoài cơ thể. Điều này được thực hiện bằng việc sử dụng hoặc bơm trục lăn hoặc bơm ly tâm, mặc dù bơm ly tâm thích hợp hơn vì nó gây tan máu ít (Hình 64.10). Khi bệnh nhân cải thiện, có thể giảm bớt tốc độ dòng ECMO để tim và phổi bệnh nhân hoạt động nhiều hơn. Dòng máu ngoài cơ thể lớn có thể gây mất nhiệt, vì vậy bộ trao đổi nhiệt phải được sử dụng để giữ ấm cho máu khi nó đi qua hệ thống tuần hoàn ngoài cơ thể.

ECMO bao gồm 2 loại chính là V-V ECMO (Tĩnh – Tĩnh mạch) và V-A ECMO (Tĩnh – Động mạch):
VV ECMO (Tĩnh – Tĩnh mạch): Máu thường đi vào hệ tuần hoàn trao đổi oxy màng ngoài cơ thể qua một ống thông lớn được đặt qua da vào tĩnh mạch đùi và đi lên tĩnh mạch chủ dưới. Máu trở về tĩnh mạch chủ trên qua một ống thông luồn vào tĩnh mạch cảnh trong phải. Như vậy trong VV ECMO, hệ thống trao đổi khí ở phổi đã bị bỏ qua, do vậy đây là hệ thống được sử dụng trong trường hợp suy hô hấp nặng đơn thuần (ARDS…)
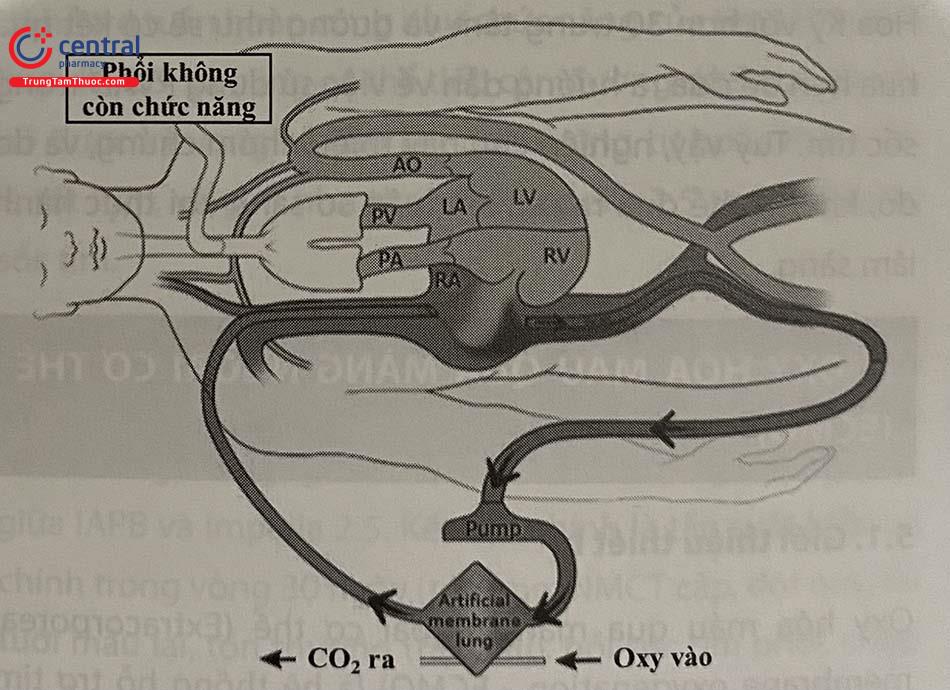
VA ECMO (Tĩnh – Động mạch): Máu đi vào hệ tuần hoàn trao đổi oxy màng ngoài cơ thể từ tĩnh mạch chủ dưới, máu trở về cơ thể thông qua động mạch đùi. Hệ thống này bỏ qua hoàn toàn cả tim và phổi bệnh nhân, vì thế VA ECMO hỗ trợ cả hô hấp và huyết động. Do vậy đây là cấu hình trao đổi oxy màng ngoài cơ thể được sử dụng để hồi sức bệnh nhân tim mạch, đặc biệt trong trường hợp can thiệp động mạch vành nguy cơ cao như nhồi máu cơ tim biến chứng sốc
5.2.2 Tác động củaVA ECMO lên tim mạch
Tác động của ECMO lên tim: Khi hệ thống ECMO bắt đầu chạy, thể tích cuối tâm trương thất phải giảm rõ rệt, sự giảm này phụ thuộc vào lưu lượng ECMO, trong trường hợp sức co bóp thất phải và sức cản động mạch phổi không thay đổi, sự giảm thể tích cuối tâm trương thất phải dẫn đến giảm cung lượng thất phải. Dòng chảy ngược của VA ECMO làm tăng áp lực động mạch trung bình hệ thống, tăng hậu gánh thất trái; trong khi tiền gánh thất trái giảm đi, bởi vậy, cung lượng tim trái giảm đi.
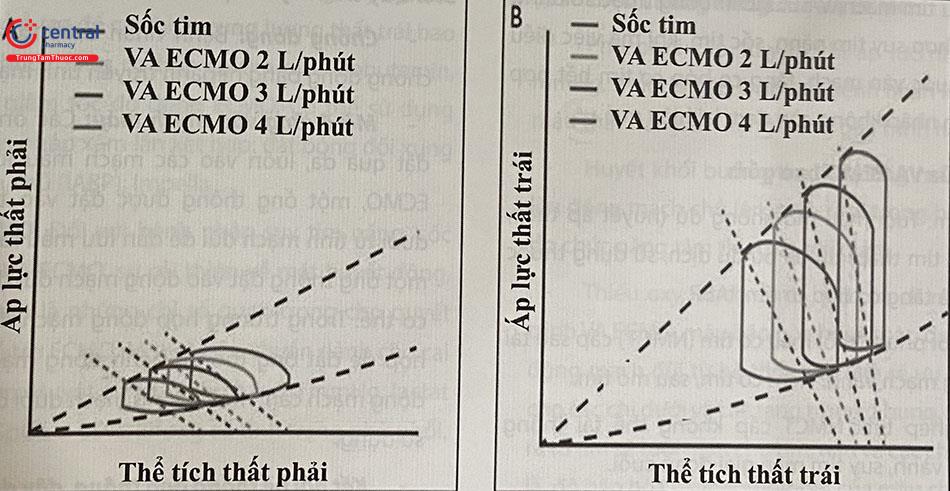
Hình A: Tác động VA ECMO lên thất phải, với sự giảm thể tích cuối tâm trương và giảm thể tích nhát bóp phụ thuộc vào lưu lượng ECMO, với sức co bóp thất phải và áp lực ĐM phổi không thay đổi. Hình B: Tác động VA ECMO lên thất trái, với thể tích nhát bóp giảm khi lưu lượng ECMO tăng lên
– Hội chứng Harlequin: Là sự chênh lệch bão hòa oxy giữa phần trên (mạch vành, não, tay phải) và phần dưới cơ thể khi thực hiện VA ECMO ngoại biên. Điều này xảy ra khi chức năng tim phục hồi trong khi khả năng oxy hóa máu ở phổi vẫn còn kém, dẫn đến việc máu bơm từ thất trái có độ bão hòa oxy thấp. Dòng máu này sẽ gây ra cản trở dòng máu giàu oxy từ ECMO bơm vào cơ thể qua động mạch đùi. Tùy thuộc vào chức năng tim mà vị trí “giao nhau” giữa hai dòng máu sẽ khác nhau. Nếu chức năng thất trái phục hồi, máu bão hòa oxy thấp sẽ được bơm lên phần đầu, mặt cổ, mạch vành, tay phải; tạo ra sự chênh lệch oxy giữa hai phần cơ thể.
5.3 Chỉ định và chống chỉ định
Về mặt bản chất, ECMO là “cầu nối” trong trường hợp bệnh nhân suy hô hấp cấp và/hoặc suy tim cấp với mục đích đảm bảo cho cơ thể có đủ oxy, đây cũng là ưu điểm nổi bật của hệ thống ECMO so với các thiết bị hỗ trợ thất đơn thuần đòi hỏi phải có chức năng phổi tốt để đảm bảo hỗ trợ tuần hoàn hiệu quả. Cần nhấn mạnh rằng ECMO không phải là biện pháp để điều trị bệnh lý tim mạch hoặc hô hấp mà chỉ giúp bệnh nhân vượt qua giai đoạn nguy kịch, kết hợp với điều trị nguyên nhân, chờ thời gian hồi phục. Nó có thể giúp giảm bớt các thuốc vận mạch, giảm bớt hỗ trợ máy thở, giảm nguy cơ tổn thương phổi do thở máy.
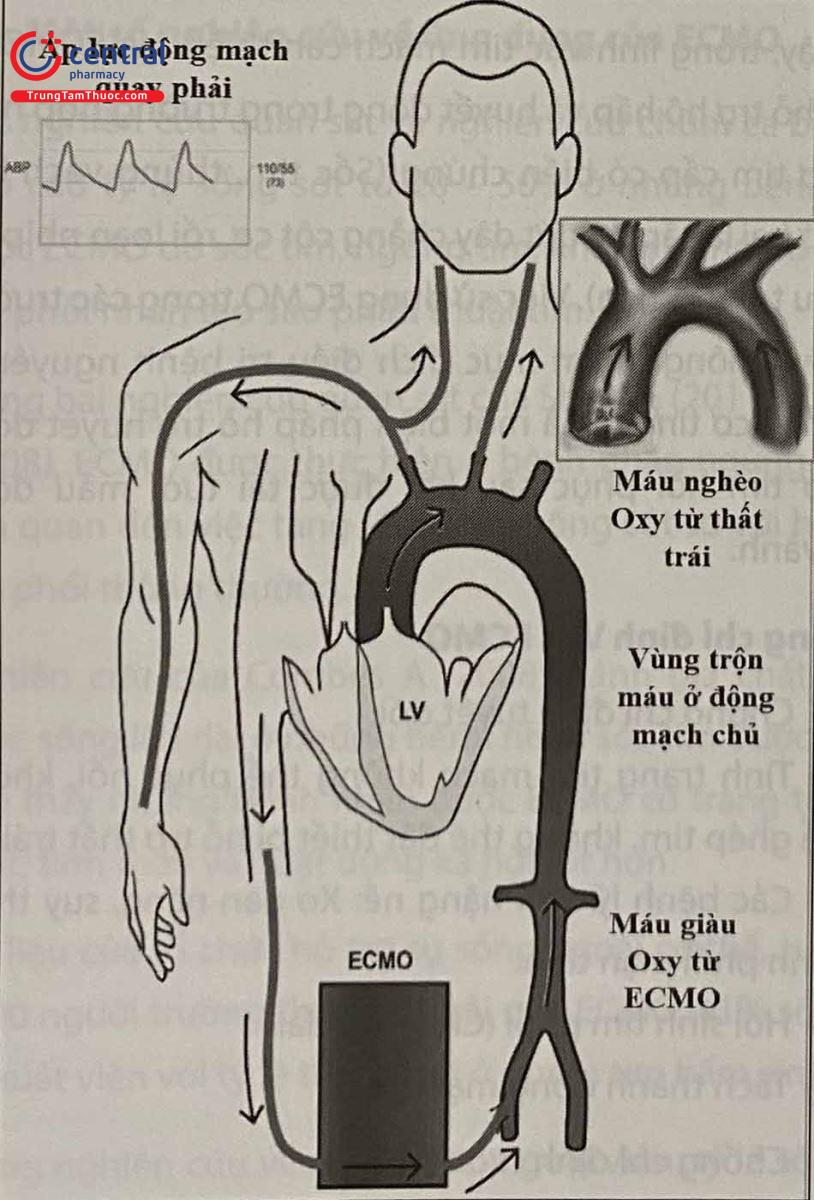
Trong cấp cứu tim mạch, VA ECMO thường được sử dụng trong trường hợp suy tim nặng, sốc tim, khi mà việc điều trị sử dụng thuốc vận mạch, tăng co bóp cơ tim hết hợp thông khí xâm nhập không còn đem lại hiệu quả.
5.3.1 Chỉ định của VA ECMO
Sốc tim: Tưới máu mô không đủ (huyết áp thấp, cung lượng tim thấp) dù đã bù đủ dịch, sử dụng thuốc vận mạch và tăng co bóp cơ tim,
Chờ hồi phục: Nhồi máu cơ tim (NMCT) cấp sau tái thông động mạch vành, viêm cơ tim, sau mổ
Chờ ghép tim: NMCT cấp không thể tái thông động mạch vành, suy tim mạn giai đoạn cuối.
Chờ đặt các thiết bị hỗ trợ tuần hoàn lâu dài.
Ngưng tuần hoàn thất bại với điều trị chuẩn (CPR) sau 5 – 30 phút.
Sốc nhiễm trùng có giảm sức co bóp cơ nặng.
Huyết khối động mạch phổi cấp.
Như vậy, trong lĩnh vực tim mạch can thiệp, VA ECMO có vai trò hỗ trợ hô hấp và huyết động trong trường hợp nhồi máu cơ tim cấp có biến chứng (Sốc tim, thủng vách liên thất, hở hai lá cấp do đứt dây chằng cột cơ, rối loạn nhịp trơ với điều trị nội khoa). Việc sử dụng ECMO trong các trường hợp này không nhằm mục đích điều trị bệnh nguyên là nhồi máu cơ tim mà là một biện pháp hỗ trợ huyết động cho cơ tim hồi phục sau khi được tái tưới máu động mạch vành.
5.3.2 Chống chỉ định của VA ECMO
Chống chỉ định tuyệt đối:
- Tình trạng tim mạch không thể phục hồi, không thể ghép tim, không thể đặt thiết bị hỗ trợ thất trái.
- Các bệnh lý nền nặng nề: xơ gan nặng, suy thận, bệnh phổi mạn tính.
- Hồi sinh tim phổi (CPR) kéo dài.
- Tách thành động mạch chủ.
Chống chỉ định tương đối:
- Rối loạn đông máu nặng hoặc chống chỉ định dùng chống đông.
- Đường vào mạch máu khó khăn: Bệnh động mạch ngoại biên, cắt cụt chi dưới.
5.4 Quy trình kỹ thuật
Chống đông: Bệnh nhân thường được sử dụng chống đông bằng heparin truyền tĩnh mạch liên tục.
Mở đường vào mạch máu: Các ống thông được đặt qua da, luồn vào các mạch máu lớn. Đối với VA ECMO, một ống thông được đặt vào tĩnh mạch chủ dưới từ tĩnh mạch đùi để dẫn lưu máu ra khỏi cơ thể và một ống thông đặt vào động mạch đùi để đưa máu vào cơ thể. Trong trường hợp động mạch đùi không thích hợp để đặt ống thông (bệnh động mạch ngoại biên), động mạch cảnh hoặc động mạch dưới đòn có thể được sử dụng.
Kết nối hệ thống ống thông, dây dẫn với hệ thống máy ECMO: Sau khi mở đường vào mạch máu thành công, bệnh nhân được kết nối thông qua hệ thống dây dẫn với máy ECMO, tốc độ dòng tăng lên cho đến khi các thông số về hô hấp và huyết động đạt yêu cầu:
- Độ bão hòa oxy máu động mạch > 90%.
- Sự tưới máu mô đầy đủ: Độ bão hòa oxy tĩnh mạch, mức lactat máu.
Theo dõi: Theo dõi các thông số về hô hấp và huyết động để điều chỉnh kịp thời, bên cạnh đó cần chú ý đông máu được đảm bảo trong thời gian ECMO bằng cách truyền liên tục heparin không phân đoạn, tiểu cầu duy trì lớn hơn 50 G/L. Hệ thống ECMO là nguồn cung cấp oxy duy nhất, phụ thuộc vào nồng độ Hemoglobin và tốc độ dòng, do đó Hb được duy trì trên 12 g/dL ở bệnh nhân Máy thở nên được giảm bớt mức hộ hỗ trợ trong thời gian ECMO để tránh chấn thương phổi do áp lực và ngộ độc oxy, áp lực đường thở nên dưới 20 mmHg và FiO2 dưới 50%, giảm hỗ trợ máy thở làm tăng lượng máu trở về, cải thiện cung lượng tim.
Một số lưu ý đặc biệt
- Tốc độ dòng: Trong VA ECMO, tốc độ dòng đủ cao để cung cấp đủ áp lực tưới máu và độ bão hòa oxy, nhưng cũng đủ thấp để tránh giảm tiền gánh, làm suy giảm cung lượng thất trái.
- Bài niệu: Đa số bệnh nhân quá tải dịch lúc bắt đầu ECMO, bài niệu tích cực nên được sử dụng sau khi bệnh nhân ổn định với Siêu lọc có thể sử dụng nếu mức độ bài niệu của bệnh nhân không đủ.
- Cung lượng thất trái: Cung lượng thất trái phải được theo dõi sát trong quá trình ECMO vì nó có thể xấu đi. Có nhiều yếu tố ảnh hưởng đến cung lượng thất trái: Suy chức năng tâm thu thất trái do nhồi máu cơ tim, viêm cơ tim; tiền gánh thất trái không đầy đủ. Các biện pháp hỗ trợ để cải thiện cung lượng thất trái bao gồm các thuốc tăng co bóp cơ tim như Dobutamin, Milrinone; giảm tốc độ dòng ECMO. Có thể sử dụng một số biện pháp xâm lấn kết hợp: đặt bóng đối xung động mạch chủ (IABP); Impella…
Cai ECMO: Đối với bệnh nhân suy tim nặng, sốc tim sử dụng VA ECMO, sự cải thiện về mặt huyết động, cung lượng tim là những chỉ số quan trọng cho quyết định dừng hỗ trợ ECMO. Một số tiêu chuẩn dành cho cai VA ECMO gồm: Huyết áp trung bình > 70 mmHg, lactat < 2 mmol/L, SpO2 > 95%, không có tình trạng phù phổi, EF > 25%.
5.5 Biến chứng
Thiếu máu chi: 20 – 30% các trường hợp. Yếu tố thuận lợi: Sử dụng ống thông lớn, bệnh nhân có bệnh động mạch ngoại biên, huyết động giảm, vận mạch liều cao, tổn thương mạch máu do đặt ống thông.
Rối loạn đông máu: Giảm tiểu cầu, giảm tiểu cầu liên quan heparin, đông máu nội mạc rải rác.
Chảy máu: Gặp 30 – 50% bệnh nhân ECMO và có thể đe dọa tính mạng, do duy trì chống đông, rối loạn chức năng tiểu cầu.
Tan máu: 5 – 18%, tan máu nặng 9%. Yếu tố tạo thuận: cấp cứu ngừng tuần hoàn, tăng đông, nhiễm khuẩn, tốc độ dòng
Biến chứng thần kinh trung ương: 13,3% bệnh nhân, bao gồm thiếu máu và xuất huyết. Yếu tố tạo thuận: Thời gian chạy ECMO kéo dài, suy thận, mất cân bằng đông máu, huyết khối trong ống thông, oxy liều cao kéo dài.
Nhiễm trùng vị trí đặt ống thông: nhiễm khuẩn huyết 3 – 18%. Thường gặp ở bệnh nhân thời gian hỗ trợ ECMO kéo dài, VA ECMO trung tâm, tuổi cao, bệnh tự miễn…
Tắc mạch khí: ECMO có thể có biến chứng tắc mạch khí, nó có thể là hậu quả của việc mồi hệ thống tuần hoàn ngoài cơ thể không đúng, hình thành các bong bóng nhỏ trong hệ thống tuần hoàn ngoài cơ thể.
5.3.2.1 Một số biến chứng riêng của VA ECMO:
Phù phổi cấp: Xảy ra khi áp lực nhĩ trái trên 25 mmHg, thường gặp ở những bệnh nhân khả năng tống máu thất trái giảm nặng trong quá trình hỗ trợ
Huyết khối buồng tim: Do dòng máu phụt ngược lên động mạch chủ lên, máu ứ lại trong buồng thất trái do chức năng tâm thu thất trái giảm.
Thiếu oxy mạch vành hoặc mạch não: Trong quá trình VA ECMO, máu bão hòa hoàn toàn được truyền vào động mạch đùi từ hệ thống ECMO sẽ ưu tiên tưới máu cho các chi dưới và các tạng trong ổ bụng. Máu được đẩy ra từ tim sẽ tưới máu cho tim, não và các chi trên. Kết quả là, độ bão hòa oxyhemoglobin của máu chi dưới và tạng ổ bụng có thể cao hơn đáng kể so với máu tưới cho tim, não và chi trên. Tình trạng thiếu oxy ở tim và não có thể tồn tại và không được phát hiện nếu chỉ theo dõi ở chi dưới. Để tránh biến chứng này, cần theo dõi độ bão hòa oxyhemoglobin động mạch ở tay phải.
Một số nghiên cứu về ứng dụng củaECMO
Các nghiên cứu quan sát và nghiên cứu chùm ca bệnh đã báo cáo tỷ lệ sống sót từ 20 – 50% ở những bệnh nhân được ECMO do sốc tim, ngừng tim, không dừng được máy tim phổi nhân tạo sau phẫu thuật tim.
Trong hai nghiên cứu quan sát của Shin TG (2011), Chen YS (2008), ECMO được thực hiện ở bệnh nhân ngừng tim có liên quan đến việc tăng khả năng sống sót so với hồi sinh tim phổi thông thường.
Nghiên cứu của Combes A (2008) đánh giá chất lượng cuộc sống lâu dài ở những bệnh nhân sốc tim được ECMO cho thấy những bệnh nhân được ECMO có trạng thái thể chất, tinh thần và hoạt động xã hội tốt hơn.
Dữ liệu của tổ chức hỗ trợ sự sống ngoài cơ thể, trong số 9000 người trưởng thành đã trải qua ECMO, 41% sống sót và xuất viện với tỷ lệ thấp nhất ở nhóm tim bẩm sinh.
Trong nghiên cứu về ngừng tim ngoại viện, tỷ lệ sống sót là 22% trong số 833 bệnh nhân được ECMO, một nửa trong số này có chức năng thần kinh tốt.
6 Tài liệu tham khảo
1. Baim DS, Grossman Cardiac catheterization, angiography and intervention. Baltimore: Williams and Wilkins; 2000.
2. Antman EM, Anbe DT, Armstrong PW, et al. ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction—executive A report of the American College of Cardiology/American Heart Association Task Force on Practice Guide- lines. J Am Coll Cardiol. 2004;44:671.
3. Ferguson JJ, Cohen M, Freedman RJ, et al. The current practice of intra-aortic balloon counterpulsation: results from the Benchmark registry. J Am Coll Cardiol. 2001;38:1456
4. Thiele H, Smalling RW, Schuler GC. Percutaneous left ventricular assist devices in acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 2007;28(17):2057-2063. doi:10.1093/ eurheartj/ehm191
5. Naidu SS. Novel Percutaneous Cardiac Assist Devices. Circulation. 2011;123(5):533-543. doi:10.1161/CIRCULATIONAHA.110.945055
6. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in CardiovascularCare: Endorsed by the American Heart Association, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention – Accessed July 11, 2021.
7. Percutaneous left ventricular assist device with TandemHeart for high‐risk percutaneous coronary intervention: The Mayo Clinic experience – Alli – 2012 -Catheterization and Cardiovascular Interventions – Wiley Online Library. Accessed July 11,
8. Vranckx P, Meliga E, De Jaegere PPT, Van den Ent M, Regar ES, Serruys The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. EuroIntervention. 2008;4(3):331-337. doi:10.4244/ eijv4i3a60
9. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock | European Heart Journal | Oxford Academic. Accessed July 11, 2021. https:// academic.oup.com/eurheartj/article /26/13/1276/565581.
10. Burkhoff D, Cohen H, Brunckhorst C, O’Neill A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 2006;152(3):469.e1-469.e8. doi:10.1016/j.ahj. 2006.05.031
11. Seyfarth M, Sibbing D, Bauer I, et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 2008;52(19):1584-1588. doi:10.1016/j.jacc.2008.05.065
12. Cheng JM, den Uil CA, Hoeks SE, et al. Percutaneous left ventricular assist devices vs. intra-aortic balloon pump counterpulsation for treatment of cardiogenic shock: a meta-analysis of controlled trials. European Heart Journal. 2009;30(17):2102-2108. doi:10.1093/ eurheartj/ehp292
13. The Impella 2.5 and 5.0 devices for ST-elevation myocardial… : Critical CareMedicine. Accessed July 12, 2021. https://journals.lww.com/ ccmjournal/Abstract/2011/09000/The_Impella_2_5_and_5_0_devices_for_ST_elevation. aspx
14. Lemaire A, Anderson MB, Lee LY, et al. The Impella Device for Acute Mechanical Circulatory Support in Patients in Cardiogenic Shock. The Annals of Thoracic 2014;97(1):133-138. doi:10.1016/ j.athoracsur.2013.07. 053
15. Real‐world use of the Impella 2.5 circulatory support system in complex high risk percutaneous coronary intervention: The USpella Registry – Maini – 2012 -Catheterization and Cardiovascular Interventions – Wiley Online Library. Accessed July 12, 2021. https://onlinelibrary.wiley.com/doi/10.1002/ccd.23403
16. Vetrovec GW, Anderson M, Schreiber T, et al. The cVAD registry for percutaneous temporary hemodynamic support: A prospective registry of Impella mechanical circulatory support use in high-risk PCI, cardiogenic shock, and decompensated heart failure. American Heart Journal. 2018;199:115-121. doi:10.1016/j.ahj.2017.09.007
17. Percutaneous Left-Ventricular Support With the Impella-2.5–Assist Device in Acute Cardiogenic Shock | Circulation: Heart Failure. Accessed July 12, 2021. https://www.ahajournals.org/doi/10.1161/CIRCHEARTFAILURE.112.967224 url_ver=Z39.882003&rfr_ id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
18. Ouweneel DM, Schotborgh JV, Limpens J, et al. Extracorporeal life support during cardiac arrest and cardiogenic shock: a systematic review and meta-analysis. Intensive Care Med. 2016;42(12):1922-1934. doi:10.1007/s00134-016-4536-8
19. Dhruva SS, Ross JS, Mortazavi BJ, et al. Association of Use of an Intravascular Microaxial Left Ventricular Assist Device vs Intra-aortic Balloon Pump With In-Hospital Mortality and Major Bleeding Among Patients With Acute Myocardial Infarction Complicated by Cardiogenic Shock. JAMA. 2020;323(8):734. doi:10.1001/jama.2020.0254
20. Sidebotham D, Mc George A, McGuinness S, et al. Extracorporeal membrane oxygenation for treating severe cardiac and respiratory disease in adults. Part 1: Overview of extracorporeal membrane oxygenation. J Cardiothorac Vasc Anesth 2009; 23:886-892
21. Sidebotham D, Mc George A, McGuinness S, et al. Extracorporeal membrane oxygenation for treating severe cardiac and respiratory disease in Part 2: Technical considerations. J Cardiothorac Vasc Anesth 2009; 23:886-892
22. Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure. Lancet 2009; 374: 1351-1363
23. Shin TG, Choi JH, Jo IJ, et Extracorporeal cardiopulmonary resuscitation in patients with inhospital cardiac arrest: A comparison with conventional cardiopulmonary resuscitation. Crit Care Med 2011; 39:1.
24. Chen YS, Lin JW, Yu HY, et al. Cardiopulmonary resuscitation with assisted extracorporeal life-support versus conventional cardiopulmonary resuscitation in adults with in-hospital cardiac arrest: an observational study and propensity analysis. Lancet 2008; 372:554.
25. Ortega-Deballon I, Hornby L, Shemie SD, et al. Extracorporeal resuscitation for refractory out-of-hospital cardiac arrest in adults: A systematic review of international practices and outcomes. Resuscitation 2016; 101:12.
26. Combes A, Leprince P, Luyt CE, et al. Outcomes and long-term quality-of-life of patients supported by extracorporeal membrane oxygenation for refractory cardiogenic shock. Crit Care Med 2008; 36:1404.
27. Thiagarajan RR, Barbaro RP, Rycus PT, et al. Extracorporeal Life Support Organization Registry International Report 2016. ASAIO J 2017; 63:60.
28. Divaka P, Rodney S, Tim L, et al. Long-term mortality data from the balloon pump-assisted coronary intervention study (BCIS-1): a randomized, controlled trial of elective balloon counterpulsation during high-risk percutaneous coronary intervention. Circulation. 2013 Jan 15;127(2):207-12.
29. Divaka P, Rodney S, Martyn T, et al. Elective Intra-aortic Balloon Counterpulsation During High-Risk Percutaneous Coronary Intervention A Randomized Controlled Trial. JAMA. 2010;304(8):867-874.
30. Holger T, Uwe Z, et Intraaortic Balloon Support for Myocardial Infarction with Cardiogenic Shock. N Engl J Med 2012; 367:1287-1296
31. Manesh R, Richard W, Holder T, et al. Intra-aortic Balloon Counterpulsation and Infarct Size in Patients With Acute Anterior Myocardial Infarction Without ShockThe CRISP AMI Randomized JAMA. 2011;306(12):1329-1337.
32. Santa-Cruz RA, Cohen MG, Ohman EM. Aortic counterpulsation: a review of the hemodynamic effects and indications for use. Catheter Cardiovasc Interv 2006; 67:68.
33. Barnett MG, Swartz MT, Peterson GJ, et Vascular complications from intraaortic balloons: risk analysis. J Vasc Surg 1994; 19:81.
34. Patrick TO, Frederick GK, Deborah DA, et al. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction. Journal of the American College of Vol. 61, No.4, 2013

