Thăm dò xâm lấn đánh giá giải phẫu sinh lý động mạch vành: IVUS, ORT, FFR
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
TS.BSNT. Đinh Huỳnh Linh
ThS.BSNT. Nguyễn Phương Anh
BSCKII. Nguyễn Trung Hậu
ThS.BSNT. Trương Đình Phi
ThS.BSNT. Bùi Nguyên Tùng
PGS.TS.BS. Phạm Mạnh Hùng
Trungtamthuoc.com - Hiện nay, trong tim mạch can thiệp có một số thiết bị hỗ trợ thăm dò xâm lấn đánh giá giải phẫu và sinh lý động mạch vành như: IVUS, ORT, FFR. Vậy những thiết bị này có cấu tạo, nguyên lý hoạt động như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy tìm hiểu trong bài viết dưới đây.
1 Siêu âm trong lòng mạch (IVUS)
1.1 Đại cương
1.1.1 Giới thiệu lịch sử siêu âm trong lòng mạch
Hệ thống đầu dò siêu âm lần đầu tiên được thực hiện bởi tác giả Bonn và cộng sự ở Rotterdam vào năm 1971, với mục đích khảo sát buồng thất trái và van tim. Đến năm 1988, hình ảnh siêu âm trong lòng mạch máu (Intravascular Ultrasound, viết tắt IVUS) lần đầu tiên được Yock và cộng sự ghi lại ở trên người. Sau đó một năm, ca IVUS đầu tiên đã được tiến hành bởi nhóm tác giả này. Cho đến nay, kỹ thuật IVUS đã có những bước tiến quan trọng trong việc nâng cao chất lượng hình ảnh và thu nhỏ dần kích cỡ đầu dò siêu âm.
1.1.2 Nguyên lý hoạt động và cấu tạo IVUS
IVUS là phương pháp chẩn đoán hình ảnh sử dụng năng lượng của sóng siêu âm. Đầu dò IVUS là thiết bị dùng để chuyển điện năng thành âm năng và ngược lại. Đầu dò IVUS được gắn trên một thiết bị cấu tạo với thân tương tự bóng can thiệp mạch vành, vì thế có thể đưa vào trong lòng ĐMV nhờ trượt trên một dây dẫn 0,014”. Đầu dò sẽ phát ra các sóng siêu âm (MHz) đi qua các lớp của thành mạch máu. Sóng siêu âm tiếp xúc các mô có tỉ trọng khác nhau phản xạ, ngược lại đầu dò. Sau khi bị dội lại từ mô, các sóng âm quay trở lại đầu dò, tạo ra xung điện và chuyển thành hình ảnh. Hệ thống tái tạo ra hình ảnh dựa trên cường độ của sóng dội. Hình ảnh thu nhận được biểu hiện dưới dạng thiết diện cắt ngang.
Có hai loại đầu dò IVUS khác nhau: đầu dò cơ và đầu dò số. Đầu dò cơ có liên quan đến hệ thống IVUS cơ học và đầu dò số có liên quan đến hệ thống IVUS cố định. Các đầu dò IVUS của hãng Boston Scientific, Terumo và Ascist đều là đầu dò cơ. Đầu dò IVUS của hãng Volcano có cả hai loại cơ và số.
1.1.2.1 Đầu dò cơ học
Đầu dò cơ có khả năng xoay quanh trục với tốc độ 1800 vòng/phút (30 vòng/giây) để tạo ra chùm tia siêu âm gần như vuông góc với ống thông. Cứ khoảng xấp xỉ 1º, đầu dò lại phát ra và nhận về các tín hiệu siêu âm. Mỗi hình ảnh sẽ có 256 lần phát nhận tia.
Trong khi sử dụng đầu dò cơ cần bơm nước muối bởi vì các bóng khí dù rất nhỏ cũng gây ảnh hưởng đến chất lượng hình ảnh. Trong hầu hết các hệ thống cơ học, đầu dò siêu âm quay trong một ống thông có nhiệm vụ bảo vệ đầu dò khi đầu dò di chuyển. Điều này tạo thuận lợi cho quá trình kéo ngược đầu dò từ đoạn xa về đoạn gần ĐMV trong khi tiến hành làm IVUS.
.jpg)
1.1.2.2 Đầu dò số
Đầu dò số sử dụng một dãy các tinh thể đóng vai trò là các đầu dò, khác với một đầu dò duy nhất quay quanh trục như trong đầu dò cơ. Dãy tinh thể này được thiết kế để cho thành phần này phát thì thành phần khác thu tín hiệu đồng thời. Hình ảnh thu được là sự tổng hợp của các tín hiệu từ các đầu dò. Hình ảnh có thể được điều chỉnh để tập trung tối ưu vào một dải rộng. Đầu dò số hiện nay cung cấp các hình ảnh màu của dòng chảy.
1.1.2.3 So sánh đầu dò cơ và đầu dò số
Hệ thống đầu dò cơ có lợi thế về chất lượng hình ảnh cao hơn so với hệ thống đầu dò số. Khoảng cách ngắn hơn từ đầu dò tới đầu ống thông của hệ thống cơ học cũng có lợi trong can thiệp với tổn thương tắc toàn hoàn mạn tính động mạch vành (CTO).
Ngược lại, hệ thống đầu dò số có thể giúp điều hướng tốt hơn hệ thống cơ học trong trường hợp giải phẫu mạch vành phức tạp. Ngoài ra, hệ thống đầu dò số không bao gồm các bộ phận chuyển động và do đó không bị méo hình ảnh trong khi hệ thống cơ học hay xuất hiện hình ảnh nhiễu này (hiện tượng méo ảnh không đồng dạng NURD).
1.1.3 Các dạng hình ảnh IVUS
1.1.3.1 IVUS đen trắng (IVUS- grey scale)
Được coi như là tiêu chuẩn vàng cho đánh giá hình ảnh trên “in vivo” của thành động mạch vành. Tuy nhiên, đánh giá hình thái mảng xơ vữa tương tự như mô bệnh học thì có một phần hạn chế. Hạn chế này sẽ được khắc phục một phần nhờ các IVUS cải tiến mới như: IVUS mô học ảo (VH- IVUS), IVUS tán xạ ngược tích hợp (IVUS-IB).
1.1.3.2 IVUS mô học ảo-VH (Virtual histology)
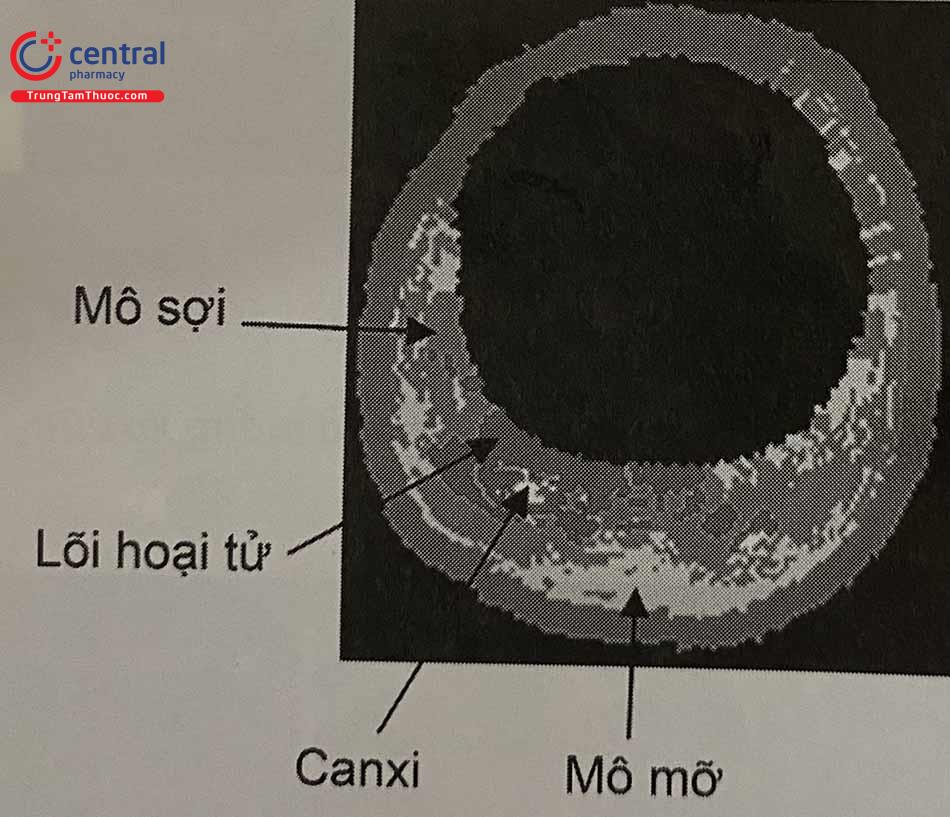
Công cụ phân tích thành phần mô dựa trên tín hiệu sóng cao tần (RF-radiofrequency) lần đầu tiên có mặt trên thị trường là phần mềm có tên là mô học ảo. Nguyên tắc chính của kỹ thuật này là nó không chỉ sử dụng biên độ bao của tín hiệu RF phản xạ (như IVUS đen trắng), mà còn sử dụng tần số cơ bản để phân tích các thành phần mô có trong mảng xơ vữa. Thông tin kết hợp này được xử lý sau đó, xác định bốn thành phần cơ bản của mô mảng xơ vữa: (1) mô sợi (xanh đậm); (2) mô mỡ (xanh nhạt); (3) lõi hoại tử (đỏ); và (4) Canxi (trắng).
Trong nghiên cứu so sánh thành phần mảng xơ vữa ở các bệnh nhân có hội chứng ĐMV cấp và đau ngực ổn định bằng IVUS-VH. IVUS được tiến hành trước khi can thiệp trên 318 bệnh nhân (123 bệnh nhân hội chứng ĐMV cấp và 195 bệnh nhân đau ngực ổn định). Kết quả cho thấy bệnh nhân bị hội chứng ĐMV cấp có tổn thương không ổn định hơn (89% so với 62%, p < 0,001) so sánh với bệnh nhân đau ngực ổn định. Nghiên cứu cũng đưa ra định nghĩa mảng xơ vữa vỏ mỏng là khi có lõi hoại tử ≥ 10% và không được bao phủ bởi mô xơ, với các trường hợp mạch vành có gánh nặng mảng xơ vữa ≥ 40%. Dựa vào đó, tác giả kết luận rằng “nghiên cứu sự hình thái của các tổn thương không ổn định (các mảnh vỡ hoặc mảng xơ vữa vỏ mỏng) có thể góp phần vào theo dõi tiến triển lâm sàng và đưa ra chỉ định can thiệp khi có triệu chứng ở nhiều bệnh nhân đau ngực ổn định”.
1.1.3.3 iMAP-IVUS
Gần đây, một phương pháp xử lý dựa trên RF khác để xác định đặc điểm mô mảng xơ vữa động mạch vành được gọi là iMAP-IVUS (Boston Scientific). Về nguyên tắc, phần mềm này xử lý bằng cách sử dụng mô hình hồi quy và phân biệt các đặc tính của bốn loại mô. Hình ảnh từng mô được mã hóa các màu khác nhau: (1) mô sợi (xanh lục nhạt); (2) mô lipid (vàng); (3) lõi hoại tử (hồng); và (4) vôi hoá (xanh lam) với độ chính xác ở mức độ tin cậy cao nhất là: 97%, 98%, 95% và 98% cho các vùng hoại tử, lipid, xơ và vôi hóa tương ứng.
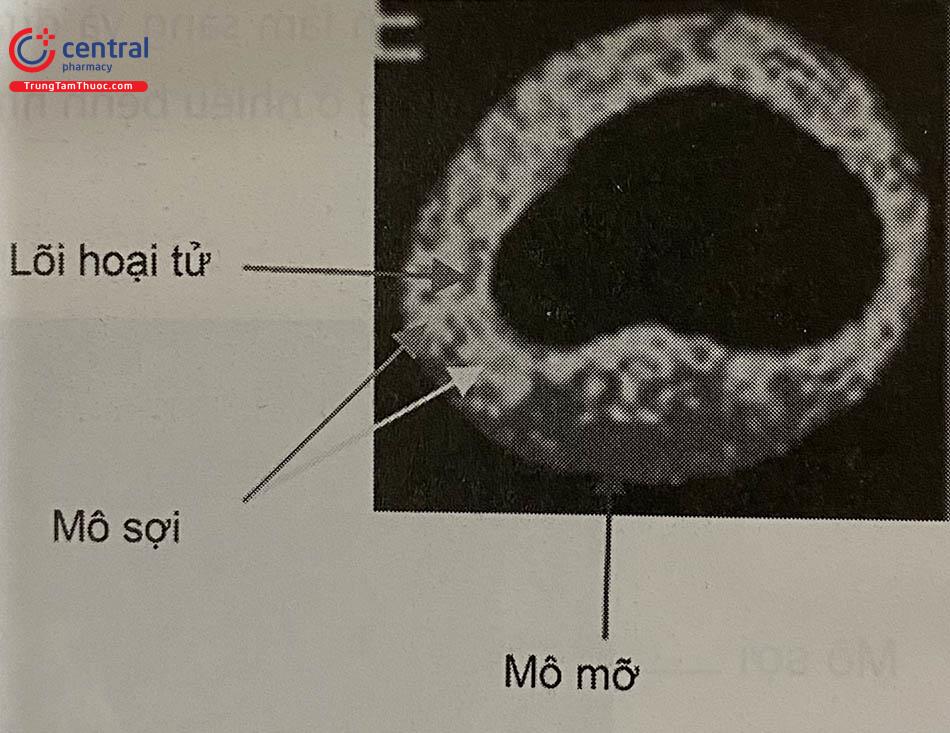
1.1.3.4 IVUS tán xạ ngược tích hợp (IVUS-IB)
IB-IVUS phân tích tín hiệu RF được tạo ra bởi ống thông IVUS xoay cơ học 40 MHz bằng cách áp dụng phép biến đổi Fourier nhanh của các thành phần tần số của tín hiệu tán xạ ngược, tính toán cường độ của tín hiệu được đo bằng decibel (dB). Các thành phần mô khác nhau phản ánh tín hiệu RF ở các mức công suất khác nhau, do đó, có thể được sử dụng để phân biệt các thành phần mô khác nhau. Tương tự với các phương pháp khác, hình ảnh từng mô được mã hóa các màu khác nhau: mô sợi, mô mỡ, vôi, lõi hoại tử.
1.1.3.5 IVUS đen trắng tái tạo
Đây là một phương pháp xử lý tái tạo hình ảnh để phát hiện các thành phần mảng xơ vữa động mạch vành. Khác với các phương pháp phân tích tín hiệu RF được mô tả trước đây, nó sử dụng sự khác biệt về cường độ trong hình ảnh IVUS đen trắng do đặc tính phản âm khác nhau của các thành phần mô khác nhau tạo nên. Ví dụ cấu trúc sợi (có màu trắng không kèm bóng cản), cấu trúc mỡ (có màu tối), còn cấu trúc canxi (có màu trắng sáng kèm bóng cản đen phía sau vì tín hiệu siêu âm không xuyên qua được lớp canxi và bị phản xạ ngược lại hoàn toàn).
1.1.3.6 IVUS quang phổ cận hồng ngoại (NIRS: Near Infrared Spectroscopy)
Sự ra đời của phương pháp quang phổ cận hồng ngoại (NIRS) như một phương thức có thể phát hiện hàm lượng lipid của các mảng xơ vữa động mạch, đã mở ra tiềm năng nghiên cứu các mảng mạch vành giàu lipid “dễ bị tổn thương” hoặc dễ vỡ trong hội chứng động mạch cấp.
Thử nghiệm ATHEROREMO-NIRS, một nhánh của nghiên cứu ATHEROREMO-IVUS trên gần 600 bệnh nhân đã đưa ra các kết quả đầy hứa hẹn về khả năng của công nghệ. Giá trị chỉ số gánh nặng lõi lipid (Lipid core burden index-LCBI) là tương tự nhau ở bệnh nhân hội chứng vành cấp và đau ngực ổn định. Trong một nghiên cứu gần đây, Matsumura đã sử dụng NIRS-IVUS để kiểm tra các đặc điểm của tổn thương mạch vành với xuất huyết trong mảng xơ vữa (thủ phạm chính dẫn đến sự tiến triển của tổn thương mạch vành) có xác nhận mô bệnh học và chứng minh sự hiện diện của nhiều xơ vữa và chỉ số gánh nặng lõi lipid nhiều hơn trong các mảng xơ vữa có xuất huyết so với đến các mảng xơ vữa không có xuất huyết bên trong.

Nghiên cứu đa trung tâm gần đây (2019) là The LRP- Lipid Rich Plaque Study đã sử dụng hệ thống NIRS-IVUS ở các nhánh động mạch vành không phải thủ phạm. Nghiên cứu cho thấy 9% bệnh nhân có các biến cố tim mạch liên quan đến động mạch không phải thủ phạm, tỷ lệ biến cố cao hơn ở nhóm có LCBI tối đa (trên đoạn dài 4 mm) > 400 (HR 3,39; CI 1,85– 6,20). Sau những kết quả này, FDA đã thông qua chỉ định IVUS-NIRS trong phát hiện và xác định những tổn thương tăng nguy cơ bị biến cố tim mạch.
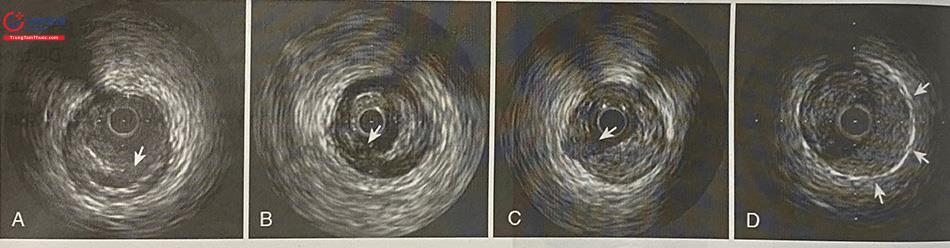
1.1.4 Hiện tượng nhiễu hình ảnh khi làm IVUS
Có nhiều nguyên nhân dẫn đến nhiễu ảnh khi khảo sát IVUS. Các tình trạng này có thể khắc phục bằng cách đuổi khí, nắn thẳng ống thông, giảm bớt độ căng trên guidewire dẫn đường hoặc nới lỏng van cầm máu của chạc chữ Y.
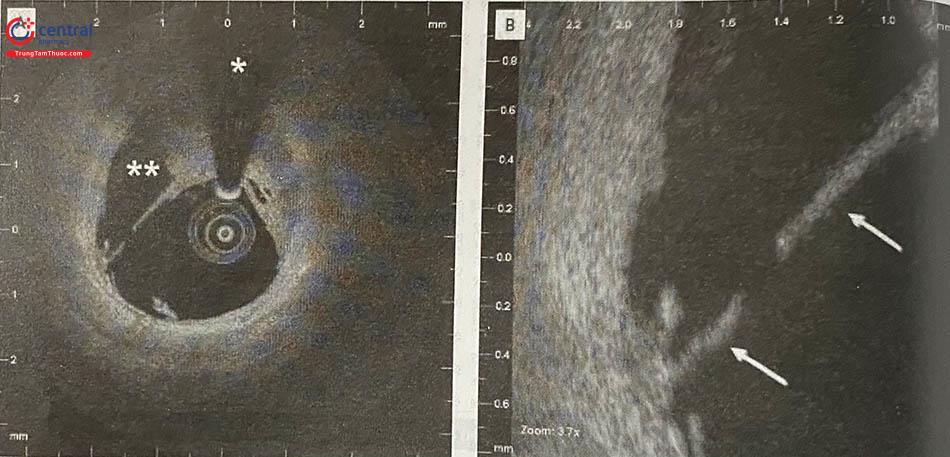
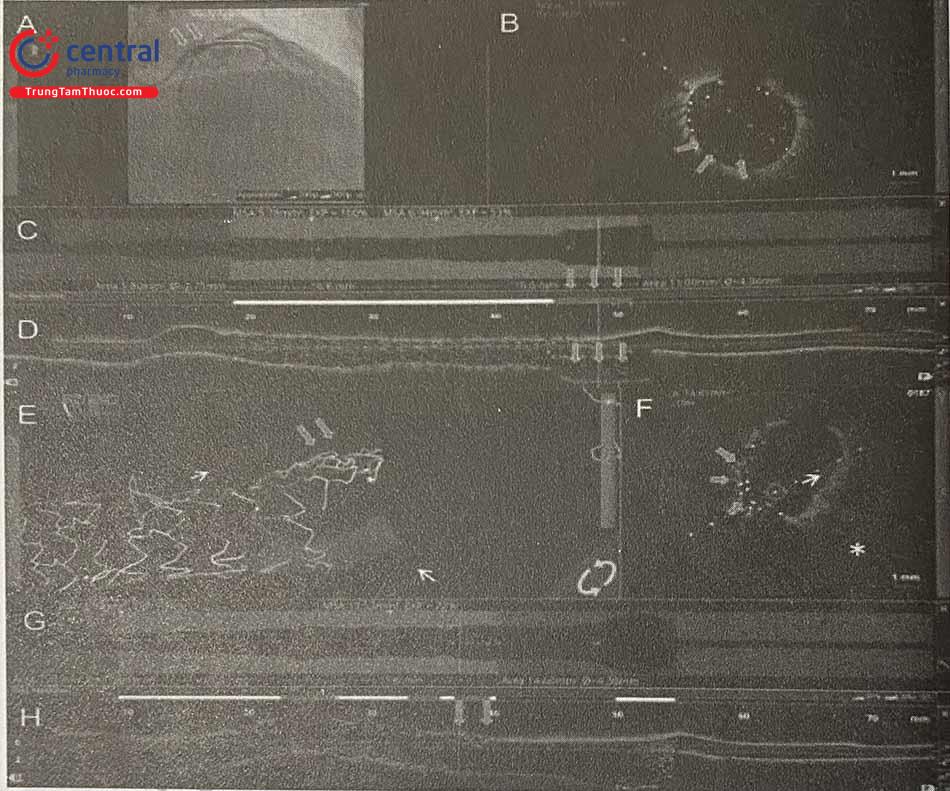
Nhiễu dạng “vòng sáng” hoặc nhiều vòng sáng bao quanh ống thông IVUS cơ học (mũi tên) thường do bọt khí và do đó cần bơm rửa để đẩy chúng ra ngoài (hình 14.6 A).
Nhiễu tần số vô tuyến (mũi tên) xuất hiện dưới dạng nan hoa xuyên tâm hoặc các chấm trắng ở vùng phía xa, thường là do các thiết bị điện khác trong phòng gây ra (hình 14.6 B).
Nhiễu do các cấu trúc phản xạ âm mạnh như khung stent hoặc điểm vôi hóa (hình 14.6 C). Hình ảnh này có thể dẫn đến nhầm lẫn rằng các khung stent nhô ra vào lòng mạch, và có khả năng gây nhầm lẫn cho các phép đo diện tích và việc đánh giá áp sát, lóc tách,…
Hiện tượng méo ảnh không đồng dạng (Non Uniform Rotational Distortion – NURD) dẫn đến xuất hiện vùng nhòe hình nêm (trong ví dụ này là từ vị trí 9 giờ đến 4 giờ) (hình 6 D).
Nhiễu gây ra bởi sự xoắn vặn của mạch máu kết hợp với thiết bị đo đạc nội mạch (dây dẫn hoặc ống thông) (hình 14.6 E); điều này dẫn đến sự thay đổi đột ngột của kích thước động mạch và sự chèn ép bên ngoài bởi một cấu trúc không đồng nhất hoặc ít dội âm (các mũi tên) bao quanh một phần động mạch.
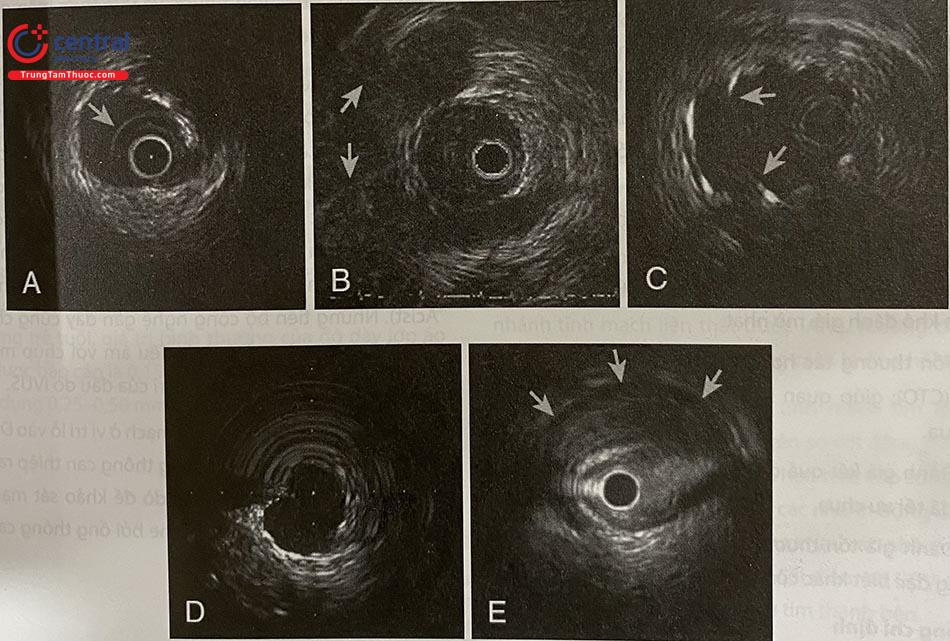
Hình A: Nhiễu dạng “Vòng sáng”; Hình B: Nhiễu tần số vô tuyến; Hình C: Nhiễu do các cấu trúc phản xạ âm mạnh; Hình D: Hiện tượng méo ảnh không đồng dạng; Hình E: Nhiễu gây ra bởi sự xoắn vặn của mạch máu kết hợp với thiết bị đo đạc nội mạch. (Nguồn: Intravascular Ultrasound (2014), Yasuhiro Honda, Peter Fitzgerald, Paul Yock)
1.1.5 Độ an toàn của IVUS
Khảo sát IVUS có độ an toàn cao. Các biến chứng chính, bao gồm lóc tách hoặc tắc mạch thường ít gặp (nhỏ hơn 0,5%), và thường xảy ra ở bệnh nhân được can thiệp mạch vành hơn là thăm dò chẩn đoán. Co thắt mạch vành thoáng qua, đáp ứng nhanh chóng với nitroglycerin, xảy ra trong 1-3% các trường hợp. Thiếu máu cục bộ thoáng qua, do đưa ống thông vào một mạch nhỏ hoặc qua tổn hẹp khít, thường xảy ra trong quá trình can thiệp.
Khi so sánh các nhánh ĐMV được thăm dò bằng IVUS với những nhánh ĐMV không được khảo sát IVUS, không nhận thấy sự tiến triển của mảng xơ vữa tại thời điểm sau 1 năm theo dõi
1.2 Chỉ định vàchống chỉ định
1.2.1 Chỉ định
Khảo sát chính xác và chi tiết các tổn thương động mạch vành giúp đưa ra chỉ định can thiệp đúng trong các trường hợp mà chỉ hình ảnh chụp động mạch vành khó đưa ra quyết định như:
Tổn thương thân chung động mạch vành trái.
Tổn thương hẹp mức độ vừa trên chụp mạch (hẹp từ 40% – 70% đường kính lòng động mạch vành).
Tổn thương chỗ phân nhánh, tổn thương dài lan tỏa.
Khảo sát tình hình tái hẹp sau khi đã đặt stent trước đây.
Khi hình ảnh tổn thương trên chụp động mạch vành khó đánh giá, mờ nhạt.
Tổn thương tắc hoàn toàn mạn tính động mạch vành (CTO): giúp quan sát thấy lòng thật để đưa dây dẫn
Đánh giá kết quả can thiệp/đặt stent động mạch vành đã tối ưu chưa.
Đánh giá tổn thương, mảng xơ vữa và một số dị thường đặc biệt khác của động mạch vành.
1.2.2 Chống chỉ định
Không có chống chỉ định tuyệt đối.
Thận trọng khi tiến hành IVUS: hẹp quá nặng, vôi hóa nhiều, mạch gập góc, nhiều huyết khối, đoạn mạch xa quá nhỏ.
1.3 Các bước thực hiện kỹ thuật
Trước khi làm IVUS, nên tiêm tĩnh mạch Heparin tương tự các ca can thiệp ĐMV thông thường. Nếu không có chống chỉ định, bơm Nitroglycerin liều 150µg vào động mạch vành trước khi đưa đầu dò siêu âm vào để tránh hiện tượng co thắt mạch.
Khi sử dụng đầu dò cơ học cần phải xả nước muối trước khi đưa vào để loại bỏ không khí vì các bong bóng nhỏ có thể dẫn đến chất lượng hình ảnh kém. Nếu có nhiễu dạng quầng sáng ở đầu dò cơ học, có thể do các bóng khí, cần lặp lại các quy trình bơm rửa nước muối cho đến khi nhiễu bị loại bỏ.
Đưa ống thông IVUS vào lòng ĐMV qua ống thông can thiệp 6 Fr, tương tự khi nong bóng hay đặt stent mạch vành. Đầu dò IVUS được trượt trên một dây dẫn 0,014 inch, đi qua vùng tổn thương, đến vị trí mạch tham chiếu (mạch tương đối lành) cách vùng tổn thương. Tốt nhất đẩy đầu dò quá tổn thương tối thiểu 10 mm, sau đó kéo ngược lại. Đầu dò vừa được kéo ngược về vừa thực hiện quét hình ảnh một cách có hệ thống suốt chiều dài của mạch máu.
Các thiết bị kéo lại tự động có khả năng thu thập hình ảnh với tốc độ ổn định, cho phép đảm bảo độ chính xác của từng lát cắt để đánh giá liên tiếp hoặc đo chiều dài tổn thương. Hệ thống IVUS thông thường có tốc độ kéo lại là 0,5 hoặc 1,0 mm/s, trong khi thế hệ mới có tốc độ thu nhận hình ảnh cao hơn, cho phép kéo nhanh hơn với tốc độ lên đến 9 mm/s (Terumo) hoặc 10 mm/s (hệ thống Acist). Những tiến bộ công nghệ gần đây cũng cho phép ghi nhận đồng bộ hình ảnh siêu âm với chụp mạch cản quang, phản ánh chính xác vị trí của đầu dò IVUS.
Khi kiểm tra tổn thương động mạch ở vị trí lỗ vào ĐM vành, điều quan trọng là phải rút ống thông can thiệp ra khỏi lỗ vào trước khi kéo ngược đầu dò để khảo sát mạch. Nếu không, tổn thương có thể bị che bởi ống thông can thiệp dẫn đến bỏ sót tổn thương.
1.4 Hình ảnh IVUS trong chẩn đoán bệnh động mạch vành
1.4.1 Hình ảnh động mạch vành bình thường
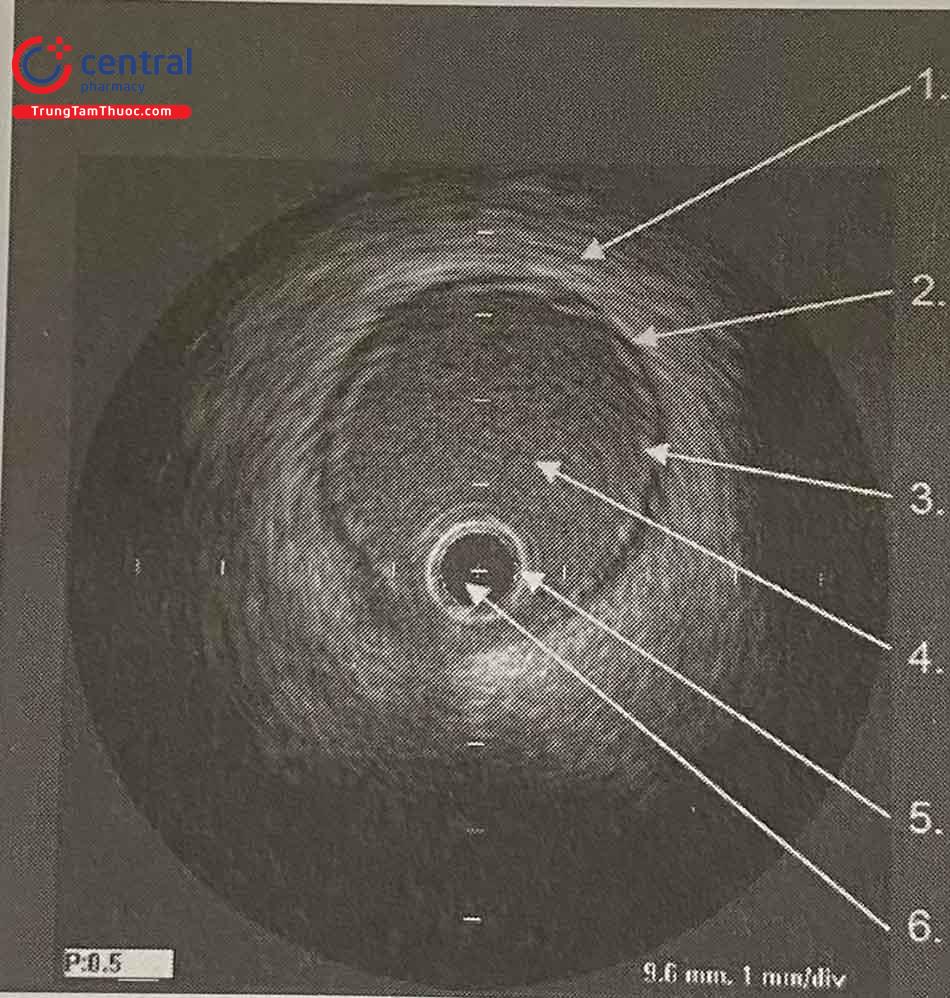
Về mặt giải phẫu, thành mạch cấu tạo bởi 3 lớp:
Lớp áo trong (intima): bao gồm các tế bào nội mạc, các tế bào cơ trơn phía dưới và chất ngoại bào dày 150- 200 μm, ngăn cách với lớp áo giữa bởi màng chun
Lớp áo giữa (media): bao gồm các tế bào cơ trơn, sợi đàn hồi, chất tạo keo dày 100-350 μm và được bao quanh bởi màng chun xơ ngoài (EEM).
Lớp áo ngoài (Adventitia): bao gồm các tổ chức xơ, giàu collagen, dày 300-500 μm, được bao quanh bởi chất đệm mạch máu và lớp mỡ màng.
Hình ảnh cắt ngang lòng động mạch vành trên IVUS với thiết bị siêu âm nằm ở giữa, được bao quanh bởi lòng mạch, thành mạch và các cấu trúc lân cận.
Thành mạch hiển thị ba lớp: lớp nội mạc tăng âm, lớp áo giữa trống âm và lớp áo ngoài tăng âm hơn. Có hai ranh giới thường được quan sát rõ nhất: một là ranh giới giữa máu – lớp nội mô và thứ hai là màng chun giãn ngoài (EEM) nằm giữa lớp áo ngoài và lớp áo giữa. Mặt ngoài của lớp áo trong khó xác định rõ, đôi khi dẫn đến đánh giá quá mức độ dày của lớp nội mạc. Ranh giới bên ngoài của lớp áo ngoài cũng không rõ ràng, hòa vào các mô xung quanh. Với hình ảnh chất lượng cao, lớp áo giữa đôi khi có thể được hình dung như một lớp giảm âm tương đối riêng biệt tạo ra hình ảnh 3 tầng: sáng-tối-sáng (Hình 14.7). Ở những đối tượng trẻ tuổi, giá trị bình thường của độ dày lớp áo trong được báo cáo là 0,15 ± 0,07 mm. Hầu hết các nghiên cứu sử dụng 0,25–0,50 mm làm giới hạn bình thường trên.
1.4.2 Các cấu trúc mô lân cận trên IVUS
Các cấu trúc mô lân cận bao gồm các nhánh động mạch, tĩnh mạch tim, và các tổ chức lân cận. Trong khi kéo ngược đầu dò trong lòng mạch, các nhánh động mạch xuất hiện ở ngoại vi của khuôn hình và sau đó thì đổ vào mạch chính. Theo mặc định, các hệ thống IVUS hiện tại hiển thị hình ảnh mặt cắt ngang với hướng nhìn từ lỗ vào của mạch vành hướng về phía xa của mạch máu. Do đó ở động mạch liên thất trước (LAD), động mạch mũ (LCx) và các nhánh chéo (Diagonal) sẽ nhô ra ở vị trí khoảng 90º ngược chiều kim đồng hồ từ màng tim, ngược lại các nhánh vách (Septal) thường nổi lên ở phía đối diện với màng ngoài tim (tức là bên phía cơ tim). LAD đoạn xa đi kèm với một hoặc hai các nhánh tĩnh mạch liên thất trước (AIV), thường chạy song song với LAD trong một khoảng cách không hằng định.
Trong động mạch mũ (LCx), tĩnh mạch tim lớn (Great cardiac vein, GCV) chạy phía trên so với động mạch mũ ở hầu hết các trường hợp và thấp hơn trực tiếp so với nhĩ trái. Do đó, nhìn từ động mạch mũ, các nhánh động mạch mọc ra theo hướng chỉ về GCV. Ngược lại, các nhánh bờ (OM) của động mạch mũ xuất hiện đối diện với GCV và hướng xuống dưới để cấp máu cho cơ tim thành bên.
Không giống như các động mạch vành tim khác thường đi kèm bởi các cấu trúc tĩnh mạch song song, đoạn gần và giữa của động mạch vành phải cho thấy sự xuất hiện của một tĩnh mạch duy nhất: vòng cung tĩnh mạch bắt chéo xung quanh động mạch vành phải theo mô hình “móng ngựa”, thường ở vị trí tiếp giáp với các nhánh bờ của thất phải.
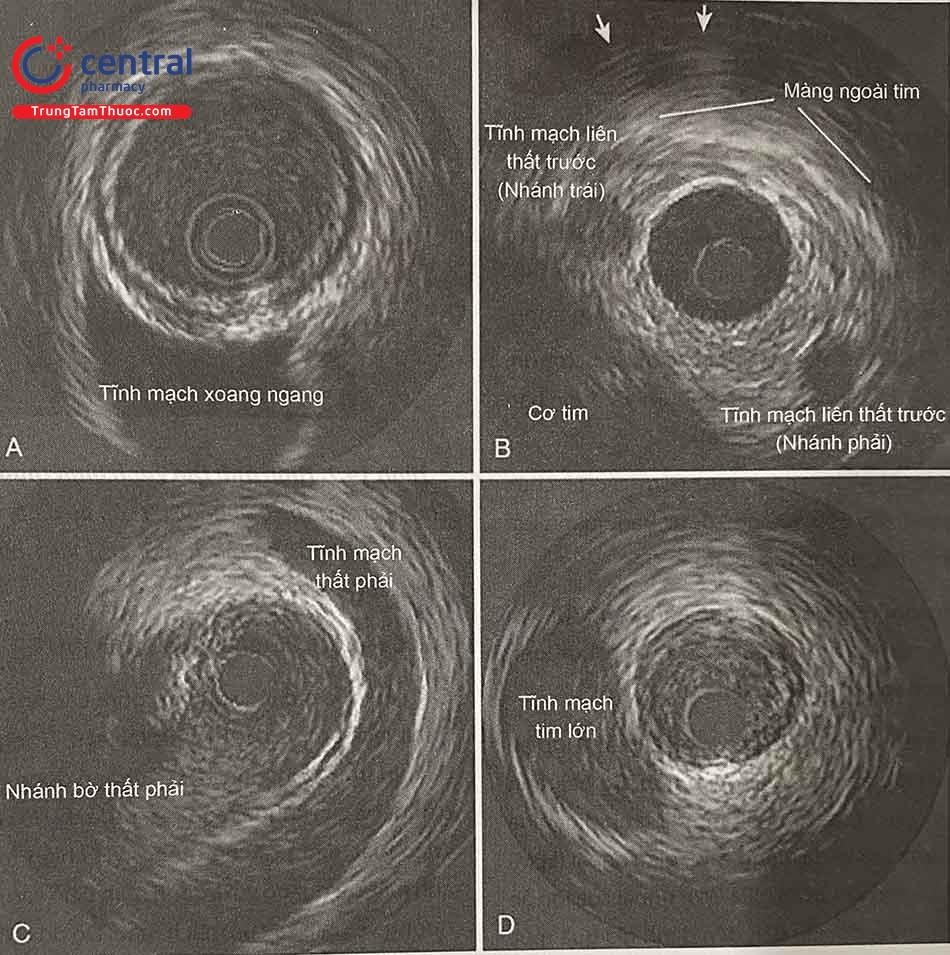
Ở phần gần của thân chung động mạch vành trái là tĩnh mạch xoang ngang (Transverse sinus), ở liền kề, ngay bên ngoài bờ bên trái của gốc động mạch chủ.
Ở mặt cắt xa của động mạch liên thất trước, các nhánh bên phải (R) và trái (L) của tĩnh mạch liên thất trước (AIV) được nhìn thấy ở 2 bên. Màng ngoài tim (Pericardium) có hình ảnh một sọc sáng điển hình với các tia phát ra (mũi tên).
Ở giữa của động mạch vành phải, tĩnh mạch (RV vein) vòng cung trên động mạch, điển hình là tại một vị trí gần với nhánh bờ thất phải (RV marginal branch).
Tĩnh mạch tim lớn (GCV), chạy phía trên so với động mạch mũ (LCx), xuất hiện như một cấu trúc lớn giảm âm với các đốm máu. Các nhánh tâm nhĩ đi ra từ LCx ở phía GCV, trong khi các nhánh tù xuất phát đối diện với GCV và ở phía dưới hơn để cấp máu cho thành bên cơ
(Nguồn Intravascular Ultrasound (2014), Yasuhiro Honda, Peter Fitzgerald, Paul Yock)
1.4.3 Chẩn đoán các hình thái tổn thương trên IVUS
1.4.3.1 Mảng xơ vữa
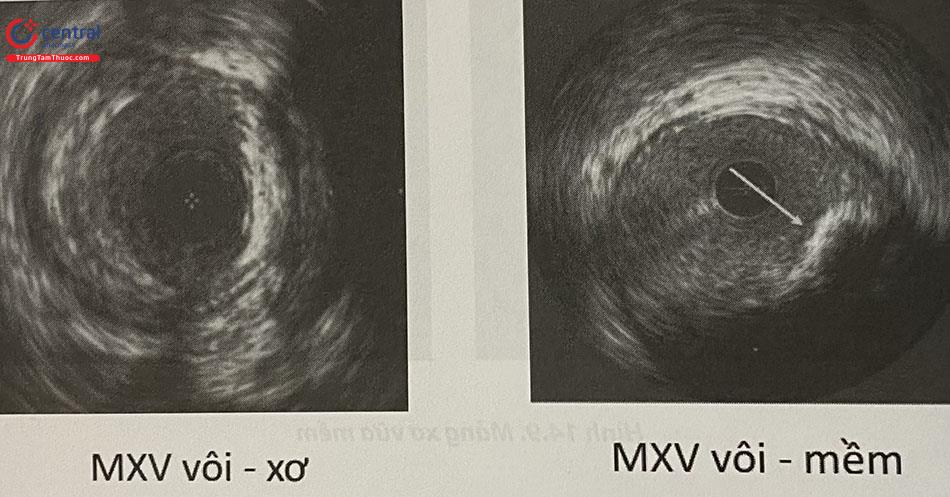
Mảng xơ vữa mềm
Thuật ngữ “mềm” ám chỉ đặc điểm cấu trúc của mảng xơ vữa hơn là mật độ âm của cấu trúc. Hầu hết đây là hậu quả của hàm lượng lipid cao trong các tổn thương, hầu hết các mảng xơ vữa mềm đều chứa rất ít sợi Collagen hoặc sợi chun. Tuy nhiên, cần lưu ý vùng giảm âm cũng có thể là vùng hoại tử nằm trong mảng xơ vữa, hoặc xuất huyết trong thành mạch hoặc huyết khối.

Mảng xơ vữa xơ hóa
Những mảng xơ vữa này có đậm độ âm ở mức trung gian giữa mảng xơ vữa mềm và mảng xơ vữa bị canxi hóa. Mảng xơ vữa nhiều xơ gặp ở phần lớn tổn thương. Nhìn chung, mảng xơ vữa càng nhiều xơ, đậm độ âm càng nhiều (sáng bằng hoặc sáng hơn lớp áo ngoài nhưng khác với mảng vôi là không có bóng cản). Tuy nhiên, có một số mảng xơ vữa đặc có thể gây ra bóng cản âm, dễ nhầm với canxi hóa.
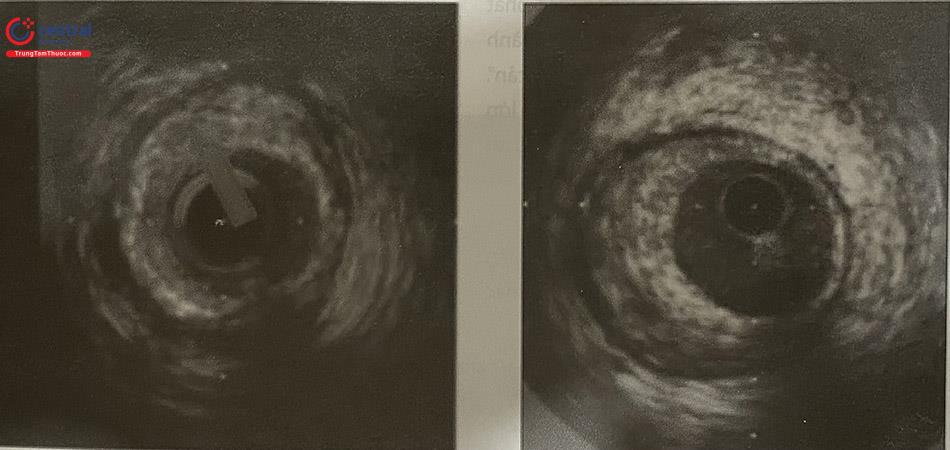
Mảng xơ vữa hỗn hợp
Mảng xơ vữa sẽ có hỗn hợp âm. Thường diễn tả đặc điểm này bằng cụm từ “canxi xơ hóa”“xơ mỡ”.
(Nguồn: Steven E. (2001) Intravascular Ultrasound Novel Pathophysiological Insights and Current Clinical Applications. Circula- tion. 103:604-61678)
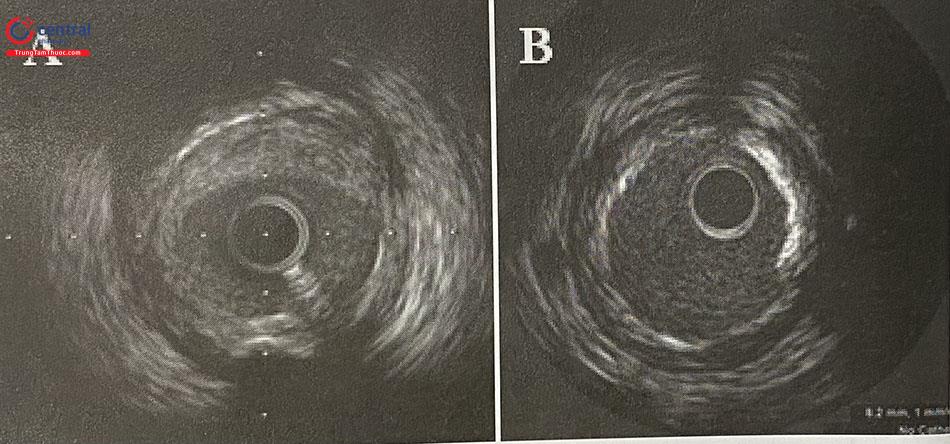
Mảng xơ vữa canxi (vôi hoá)
IVUS là một phương tiện hữu hiệu nhất trong việc phát hiện các tổn thương canxi hóa động mạch vành. Thành phần canxi biểu hiện bằng sự sáng âm kèm “bóng cản”. Do sóng siêu âm tần số cao không thể đâm xuyên qua lớp canxi nên IVUS chỉ có thể phát hiện được lớp canxi ngoài cùng mà không xác định được độ dày của mảng canxi. Có 2 loại:
- Lớp canxi bề mặt: lớp canxi và bóng cản xuất hiện từ 50% lớp ngoài cùng của mảng xơ vữa, từ trung mạc trở lại lòng mạch. Trong loại này đặc biệt chú ý đến nốt vôi bề mặt, gây khó khăn nhiều cho quá trình can thiệp.
- Lớp canxi ở sâu: xuất hiện ở từ khoảng 50% lớp đáy của mảng xơ vữa, từ trung mạc ra ngoại mạc.
IVUS cũng có thể cho phép xác định mức độ vôi hoá của mảng xơ vữa:
- Nhẹ: cung canxi < 90 độ.
- Vừa: 90 đến 180 độ.
- Nặng: 180 đến 270 độ.
- Rất nặng: > 270 độ.
(Nguồn: Steven E. (2001) Intravascular Ultrasound Novel Pathophysiological Insights and Current Clinical Applications. Circula- tion. 103:604-61678)
.jpg)
.jpg)
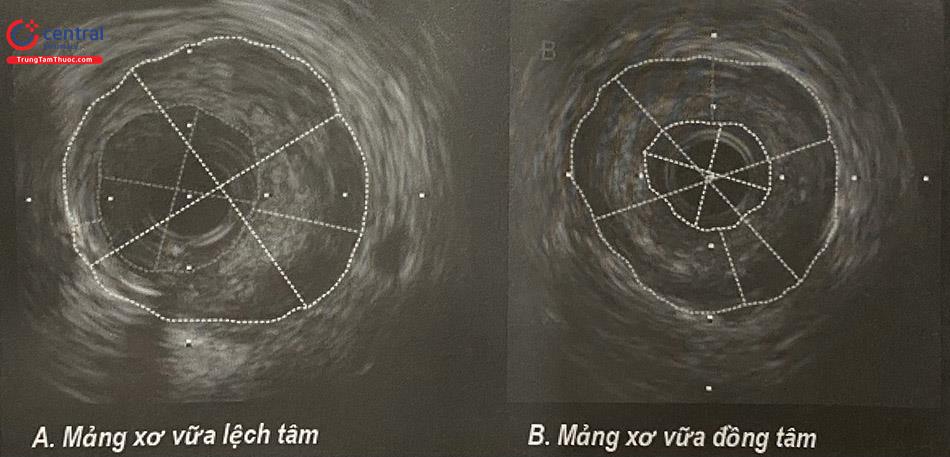
Mảng xơ vữa đồng tâm, lệch tâm
Trên mặt cắt ngang qua tổn thương, tiến hành đo kích thước dày nhất và mỏng nhất của mảng xơ vữa để tính chỉ số lệch tâm.
Chỉ số lệch tâm = kích thước dày nhất / kích thước mỏng nhất của màng xơ.

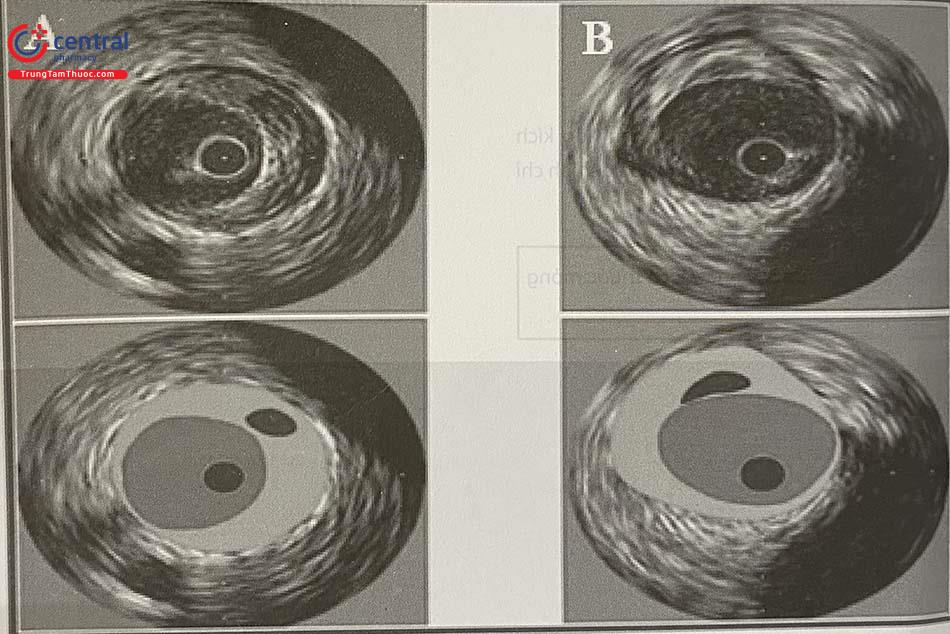
Mảng xơ vữa không ổn định
Trên IVUS đen trắng có thể phát hiện được các đặc điểm hình thái liên quan đến mảng xơ vữa không ổn định hoặc nguy cơ cao. Việc tái cấu trúc dương trên diện rộng cũng đã được chứng minh là có mối tương quan với mảng xơ vữa không ổn định. Các tổn thương thủ phạm gây ra hội chứng vành cấp thường thể hiện sự tái cấu trúc dương lan rộng. Nhiều nghiên cứu lâm sàng cũng đã chỉ ra rằng việc tái cấu trúc dương hoặc gánh nặng mảng xơ vữa lớn được đánh giá bởi IVUS trước can thiệp dự báo kết quả ngắn hạn và lâu dài sau can thiệp ĐMV. Các nghiên cứu bệnh học ủng hộ phát hiện này bằng cách chứng minh rằng các tổn thương với sự tái cấu trúc dương thường có dạng các mảng xơ vữa lớn, mềm, giàu lipid với sự tăng thâm nhiễm tế bào viêm. Một nghiên cứu lâm sàng với sự kết hợp của IVUS và kết hợp OCT cũng đã cho thấy mối liên quan giữa việc tái cấu trúc dương với sự mỏng đi của nắp xơ trong các cuộc kiểm tra mạch vành liên tiếp.
Mảng xơ vữa không ổn định thường giàu lipid với mảng xơ mỏng. Phát hiện trên IVUS thấy có lõi lipid lớn và vỏ xơ mỏng, xâm nhập đại thực bào. Mảng xơ vữa được coi là không ổn định khi đạt tiêu chuẩn: diện tích lõi lipid (diện tích vùng trống âm) ≥ 1 mm2 hoặc diện tích lõi lipid chiếm 20% diện tích mảng xơ vữa và chiều dày vỏ xơ chỗ mỏng nhất < 0,7
(Nguồn: Paul Schoenhagen et al. (2007) IVUS made easy. International Standard Book Number-13: 978-0-203-09022-082)
Mảng xơ vữa giảm âm
Trên hình ảnh IVUS, mảng xơ vữa giảm âm xuất hiện với dải giảm âm mà không có tổn thương vôi hoặc xơ dày đặc. Mảng xơ vữa giảm âm thường gặp ở bệnh nhân nhồi máu cơ tim, hay kèm theo huyết khối, vỡ mảng xơ vữa hoặc tái cấu trúc dương.
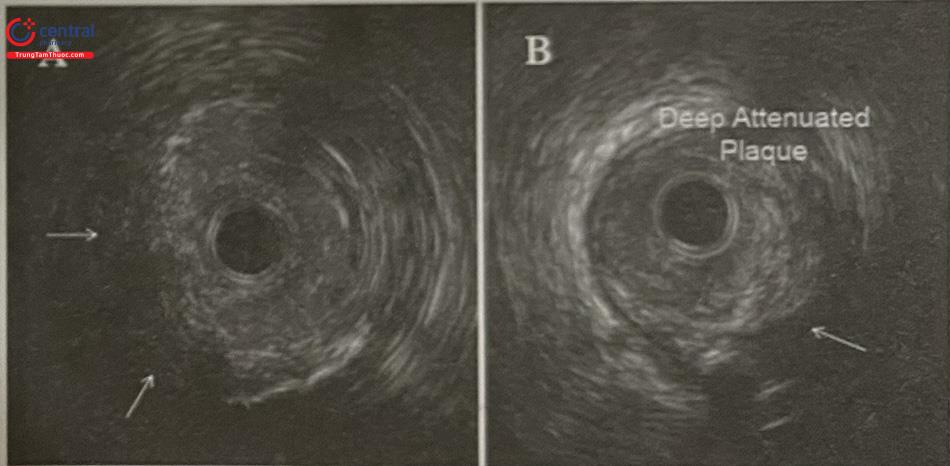
Chú thích: Deep Attenuated Plaque: Mảng xơ vữa có vùng giảm âm ở sâu
Mảng xơ vữa vỡ
Mảng xơ vữa loét có vết rách ở vỏ xơ. Sự có mặt của huyết khối có thể làm cho khả năng phát hiện vết nứt hoặc chỗ loét của IVUS giảm đi.
(Nguồn: Paul Schoenhagen et al. (2007) IVUS made easy. International Standard Book Number-13: 978-0-203-09022- 082)
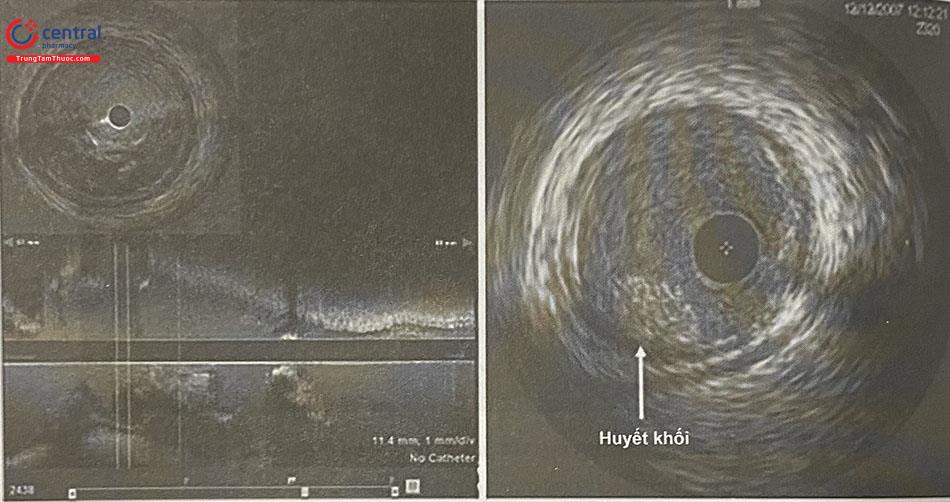
1.4.3.2 Huyết khối
Trên hình ảnh IVUS, huyết khối có thể có hình thái tăng âm (huyết khối mới) hoặc giảm âm (huyết khối cũ) tùy theo thời gian hình thành, vị trí nằm ở trong lòng mạch máu và có sự tách biệt giữa huyết khối và mạch máu (lồi vào trong lòng mạch) và thường di động. Ngoài ra, có thể quan sát thấy các đốm máu trong huyết khối do có các vi kênh trong huyết khối.
So với chụp mạch thông thường, IVUS có tỷ lệ phát hiện huyết khối cao hơn, tuy nhiên tỷ lệ phát hiện và phân biệt huyết khối không thực sự ấn tượng so với OCT. Để tăng khả năng phân biệt huyết khối, chúng ta có thể sử dụng flush nước hoặc cản quang vào lòng mạch để có thể quan sát huyết khối rõ hơn.
1.4.3.3 Lóc tách, tụ máu trong thành ĐM vành
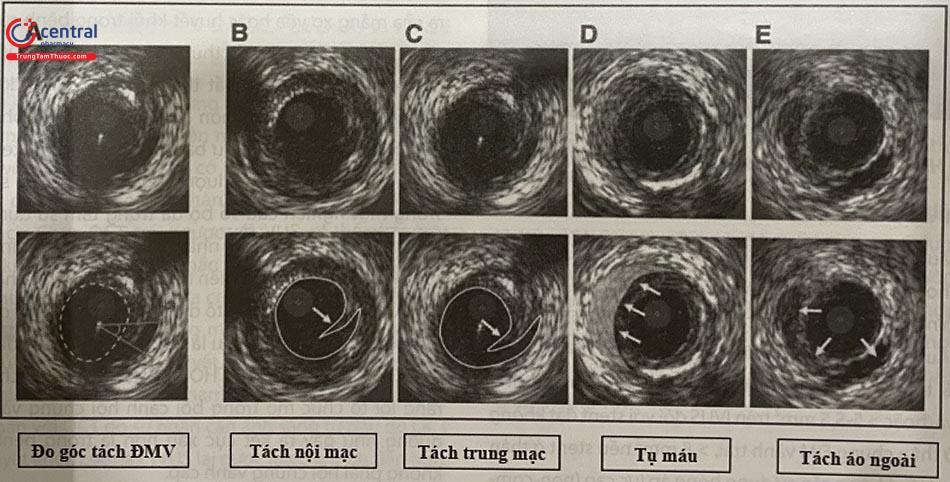
Lóc tách xuất hiện như một vết nứt hoặc sự phân tách trong nội mạc hoặc mảng xơ vữa. Mức độ nghiêm trọng của lóc tách có thể được định lượng theo chiều sâu (nội mạc, áo giữa hoặc áo ngoài) và chiều rộng (theo chu vi và theo chiều dọc).
(Nguồn Intravascular Ultrasound (2014), Yasuhiro Honda, Peter Fitzgerald, Paul Yock)
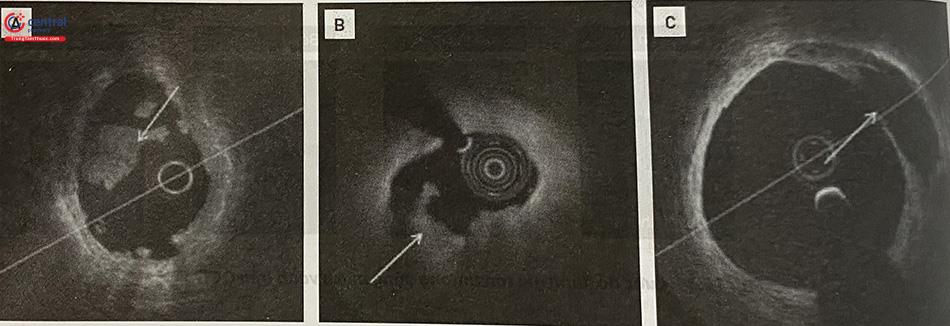
Lóc tách nội mạc (mũi tên) bắt đầu lúc 6 giờ và kéo dài theo chiều kim đồng hồ. Vạt lóc tách không kéo dài vào lòng mạch.
Lóc tách sâu hơn (áo giữa) (mũi tên) với một vạt mở rộng vào lòng mạch có thể làm ảnh hưởng đến dòng chảy. Tiêm thuốc cản quang trong trường hợp này có thể giúp thấy dòng chảy tự do phía sau vạt để xác định rõ hơn mức lan rộng của rách.
Mảng xơ vữa lệch tâm với một đường lóc tách sâu (mũi tên) ở vị trí 8 giờ, xuyên qua lớp màng xơ chun trong và mở rộng vào lớp áo giữa.
Tụ máu trong thành mạch (mũi tên) xuất hiện dưới hình ảnh tích tụ máu trong khoang của lớp giữa, gây đè đẩy màng đàn hồi trong vào trong và màng đàn hồi ngoài ra ngoài.
1.4.3.4 Cầu cơ ĐM vành
Cầu cơ động mạch vành là một bệnh lý mạch vành bẩm sinh phổ biến, thường gặp nhất ở LAD. Mặc dù phần lớn bệnh nhân không có triệu chứng, một số trường hợp cầu cơ có thể gây ra cơn đau thắt ngực, loạn nhịp tim hoặc nhồi máu cơ tim (NMCT), có thể là do tác động ép trực tiếp lên đoạn mạch tại vị trí cầu cơ hoặc làm tăng nhanh quá trình xơ vữa động mạch trong đoạn gần cầu cơ. Chẩn đoán cầu cơ được thực hiện trên chụp động mạch vành. Tuy nhiên, cầu cơ có thể bị sót chẩn đoán nếu cầu cơ gây hẹp không đáng kể mạch vành thì tâm thu. IVUS có thể phát hiện cầu cơ với độ nhạy cao hơn nhiều.
Trên IVUS, tại vị trí mạch vành có cầu cơ, lòng mạch bị co nhỏ lại nhịp nhàng theo nhịp tim vào thì tâm thu và xuất hiện ‘viền bán nguyệt’ bao quanh động mạch (Hình 14.20). Một nghiên cứu cho thấy cầu cơ đã được xác định bằng IVUS ở 23% trong số 331 bệnh nhân, trong khi chụp động mạch vành chỉ phát hiện được 3%. Việc đánh giá trực tiếp mô cơ bằng IVUS về chiều dài, độ dày và vị trí, kết hợp với phép đo chức năng của động mạch ở thì tâm thu, có thể cung cấp thông tin tiên lượng ở những bệnh nhân cụ thể nhằm xác định chỉ định và chiến lược điều trị, đặc biệt là khi cân nhắc phẫu thuật cắt cầu cơ (7% đến 9% bệnh nhân cầu cơ có triệu chứng có thể yêu cầu phẫu thuật do đau thắt ngực trơ với điều trị nội khoa).

A: thì tâm trương. B: thì tâm thu (lòng mạch co nhỏ hơn). Mũi tên trắng: viền bán nguyệt (half-moon)
1.4.3.5 Co thắt động mạch vành
Về mặt nguyên tắc, để hạn chế tối đa co thắt ĐMV khi tiến hành IVUS, phẫu thuật viên cần bơm trực tiếp nitroglycerin vào trong lòng ĐMV trước khi đưa đầu dò IVUS vào trong lòng ĐMV. Tuy vậy, có nhiều trường hợp mạch vành vẫn co thắt sau khi đưa đầu dò vào, nếu nhận thấy đường kính lòng mạch trên IVUS nhỏ hơn nhiều so với hình ảnh chụp mạch, phẫu thuật viên cần cho thêm nitroglycerin vào trong lòng ĐMV và kiểm tra lại đường kính lòng mạch sau đó sẽ cải thiện lên đáng kể. Phát hiện này rất quan trọng để loại trừ tối đa các sai số khi đo đạc giúp chọn đường kính các dụng cụ (bóng, stent) chính xác hơn.

1.5 Ứng dụng của IVUS trong can thiệp động mạch vành
1.5.1 Trước can thiệp
1.5.1.1 Đánh giá hình thái tổn thương
Đánh giá hình thái tổn thương trên IVUS tạo thuận cho việc chuẩn bị tổn thương trước can thiệp. Trong các tổn thương vôi hóa, IVUS có thể phác họa được cung vôi hóa nhưng không thể xác định độ dày vì bóng cản lớn sau mảng canxi. Hệ thống tính điểm các tổn thương vôi hóa trên IVUS giúp xác định hình thái vôi hóa nào dẫn đến việc stent không nở tối ưu gồm: vôi hóa toàn bộ chu vi thành mạch 360° (1 điểm), chiều dài liên tiếp của mảng vôi hóa 5 mm (1 điểm), đường kính lọc mạch tại mảng vôi < 3,5 mm (1 điểm) và sự hiện diện của nốt vôi (1 điểm). Các tổn thương có tổng số điểm ≥ 3, đặc biệt có sự hiện diện của nốt vôi sẽ làm cho stent khó đạt được độ giãn nở tối đa, do đó cần thiết phải chuẩn bị tổn thương bằng khoan phá hoặc sóng siêu âm (Lithotripsy) để phá vỡ mảng vôi, trong khi các tổn thương ≤ 2 điểm thì stent có thể giãn nở dễ dàng hơn.
1.5.1.2 Đo chiều dài tổn thương
Phần mềm IVUS cung cấp hình ảnh động mạch vành dưới dạng hai chiều, mặt cắt ngang và cắt dọc theo lòng động mạch. Trước tiên cần xác định và đánh dấu (bookmark) vị trí tham chiếu gần và xa của tổn thương, chiều dài tổn thương chính là khoảng cách giữa tham chiếu gần và tham chiếu xa.
Việc có thể sử dụng hệ thống tích hợp IVUS (hoặc OCT) và chụp mạch là một công cụ quan trọng để tạo điều kiện thuận lợi cho việc lựa chọn chiều dài stent và đặt stent một cách chính xác, giúp đơn giản hóa việc đặt stent có hướng dẫn bằng chẩn đoán hình ảnh nội mạch vành.
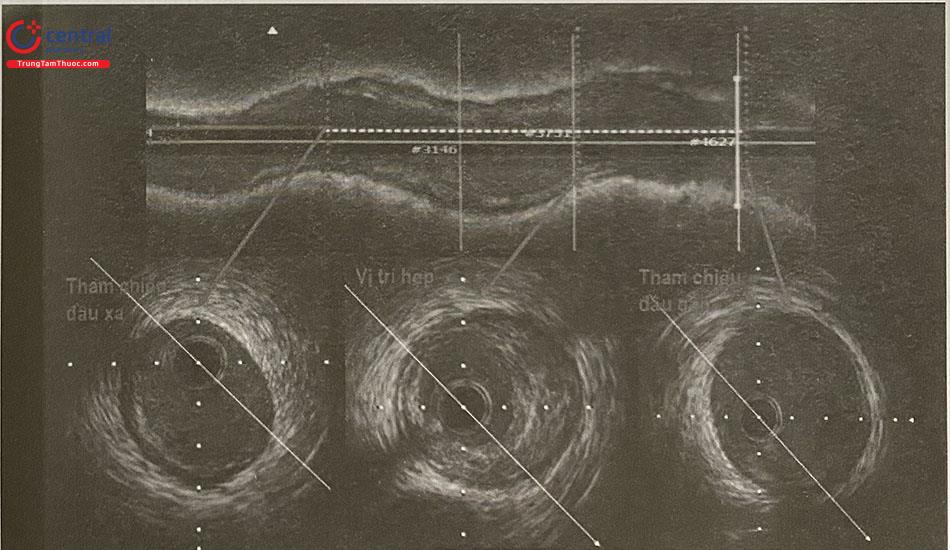
1.5.1.3 Đo các đường kính cơ bản
Các phép đo đường kính và diện tích được thực hiện ở 3 mặt cắt: mặt cắt ngang tại vị trí có tổn thương lòng mạch hẹp nhất và hai vị trí tham chiếu nằm ở đầu gần và xa của tổn thương. Tham chiếu được chọn là mặt cắt trông bình thường nhất: có lòng mạch lớn nhất với gánh nặng xơ vữa nhỏ nhất < 50% và không có bể lipid lỏng (vì điều này có liên quan đến tái hẹp cạnh stent sau đặt stent phủ thuốc thế hệ mới), nằm trong khoảng cách 10 mm của tổn thương và không có nhánh bên lớn nào.
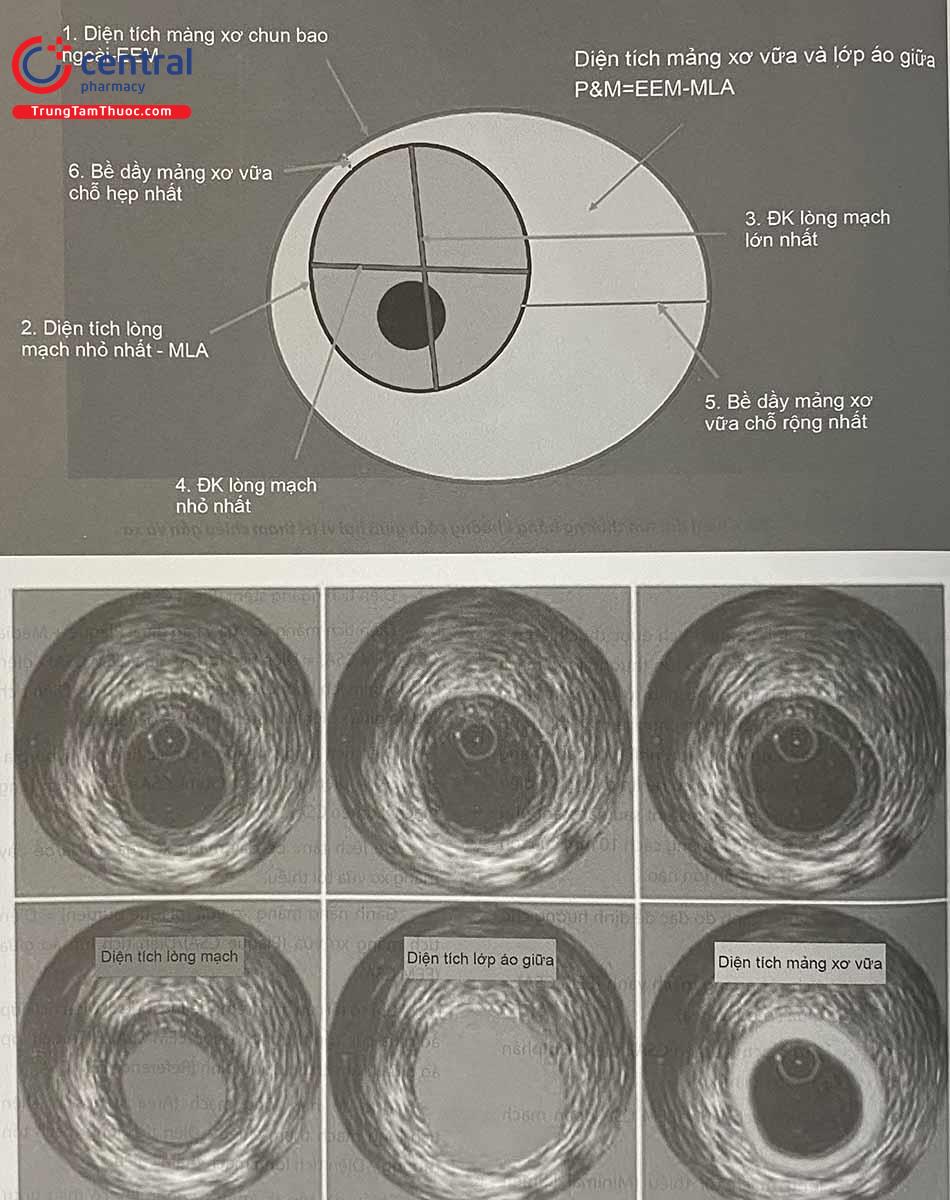
Một số thông số cần tiến hành đo đạc để định hướng cho can thiệp:
- Tổng diện tích cắt ngang mạch vành (EEM CSA) = diện tích lớp áo giữa (‘media’ area).
- Diện tích lòng mạch (Lumen CSA): diện tích phần lòng mạch tạo bởi lớp nội mô.
- Diện tích phần mạch lành (EEM CSA đoạn mạch lành): Reference EEM CSA
- Diện tích lòng mạch tối thiểu (Minimal Lumen Area, MLA).
- Đường kính lòng mạch tối thiểu/ tối đa (Minimal/ Maximum Lumen Diameter, MLD).
- Diện tích ngang stent (Stent CSA).
- Diện tích mảng xơ vữa và áo giữa: Plaque + Media CSA (P+M CSA) = Diện tích lớp áo giữa (EEM CSA) – diện tích lòng mạch không có stent (Lumen CSA) = Diện tích lớp áo giữa – diện tích stent (nếu đã đặt stent).
- Diện tích tăng sinh lớp nội mạc (intimal hyperpla- sia CSA) = diện tích stent (Stent CSA) – diện tích lòng mạch (Lumen CSA).
- Độ lệch tâm: bề dày mảng xơ vữa tối đa/bề dày mảng xơ vữa tối thiểu.
- Gánh nặng mảng xơ vữa (plaque burden) = Diện tích mảng xơ vữa (Plaque CSA)/Diện tích lớp áo giữa (EEM CSA).
- Chỉ số tái cấu trúc (remodeling index): Diện tích lớp áo giữa của tổn thương (lesion EEM CSA)/Diện tích lớp áo giữa tham chiếu trung bình (Reference EEM CSA).
- Mức độ hẹp lòng mạch (Area stenosis): (Diện tích lòng mạch tham chiếu – Diện tích lòng mạch tổn thương)/ Diện tích lòng mạch tham chiếu.
- Chiều dài tổn thương: sử dụng khi có thiết bị tự động kéo đầu dò về, lí tưởng ở tốc độ 0,5 mm/giây.
Các phép đo đường kính mạch máu rất quan trọng trong thực hành lâm sàng để định cỡ chính xác các dụng cụ cần sử dụng. Tất cả các phép đo đường kính được thực hiện bằng cách tham chiếu từ trung tâm khối (tức là thông qua điểm trung tâm của lòng mạch) chứ không phải từ trung tâm của ống thông IVUS. Điểm quan trọng cần lưu ý là việc chọn lựa đường kính stent nên sử dụng đường kính đo theo lớp áo giữa mạch vành (media to media) hơn là sử dụng đường kính lòng mạch (nội mạc) để làm tham chiếu. Với cách chọn này, phẫu thuật viên nên sử dụng các dụng cụ (bóng hoặc stent) cho tham chiếu gần và tham chiếu xa có đường kính thấp hơn khoảng 0,25-0,5 mm với đường kính lớp áo giữa để tránh các biến cố có thể xảy ra như lóc tách thành mạch, vỡ mạch. Một trường phái khác lại khuyên nên sử dụng đường kính tham chiếu được đo từ giữa thành mạch (midwall) để lấy đó làm thông số lựa chọn dụng cụ phù hợp. Trong một số trường hợp nếu lựa chọn đường kính lòng mạch để làm tham chiếu thì cần lựa chọn dụng cụ có đường kính lớn hơn khoảng 0-0,25 mm.
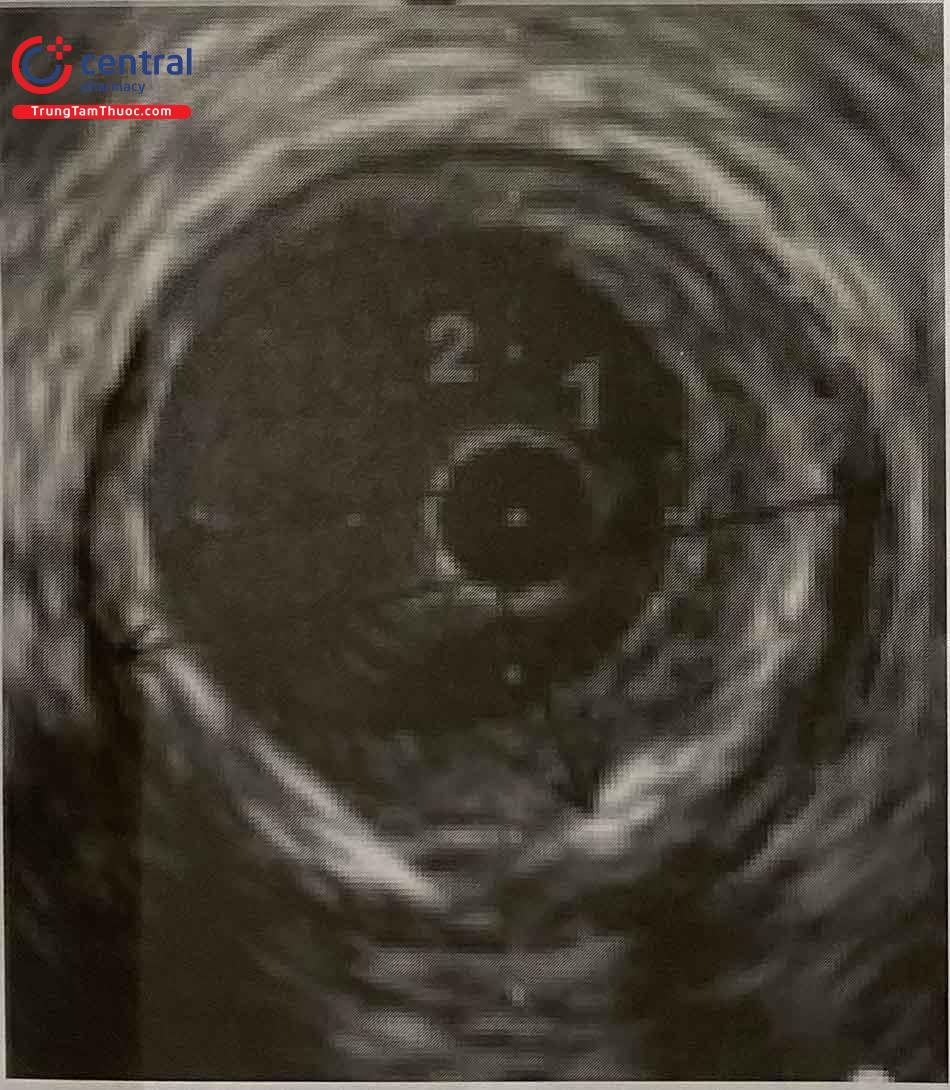
Đường kính lòng mạch (intimal): nếu được lựa chọn để làm tham chiếu thì cần lựa chọn dụng cụ có đường kính lớn hơn khoảng 0-0,25 mm
Đường kính giữa thành (midwall): có thể lấy căn cứ để lựa chọn kích thước dụng cụ.
Đường kính lớp áo giữa (media): nên chọn dụng cụ bé hơn đường kính này xấp xỉ 0,25-0,5 mm.
Các phép đo diện tích của lòng mạch và stent được đo đạc trên phần mềm chuyên dụng. Diện tích của mảng xơ vữa trên mặt cắt ngang – CSA (CSA: cross sectional area, bao gồm diện tích mảng xơ vữa cộng với lớp áo giữa) được tính bằng sự hiệu số giữa diện tích của lớp xơ chun bao ngoài trên mặt cắt ngang (EEMA) và diện tích lòng mạch nhỏ nhất trên mặt cắt ngang (MLA – Minimum Lumen Area). Gánh nặng mảng xơ vữa, còn được gọi là tỉ lệ diện tích mảng mảng xơ vữa, được tính là tỉ lệ giữa CSA mảng xơ vữa/ CSA lớp xơ chun bao ngoài EEM. Tăng sinh nội mạc mới trong stent (IH – Intimal Hyperplasia) được phát hiện khi theo dõi bằng IVUS và diện tích phần này được tính bằng hiệu số giữa diện tích stent trên CSA và diện tích lòng mạch nhỏ nhất-MLA. Với đầu dò IVUS tự động, có thể tính thể tích xơ vữa bằng cách sử dụng quy tắc Simpson. Để chuẩn hóa dữ liệu, thể tích được trình bày dưới dạng chỉ số thể tích hoặc thể tích trung bình, được tính bằng thể tích tuyệt đối chia cho độ dài của đoạn mạch được phân tích.
Tái cấu trúc động mạch là một phản ứng hai chiều của mạch máu được biểu hiện bằng sự tăng hoặc giảm kích thước mạch máu xảy ra trong quá trình phát triển của mảng xơ vữa động mạch. Trong lâm sàng, bằng chứng của tái cấu trúc là những thay đổi liên tiếp diện tích cắt ngang của lớp xơ chun bao ngoài (CSA-EEM) ở hai hoặc nhiều lần đo IVUS khác nhau. Phân loại tái cấu trúc động mạch bao gồm tái cấu trúc dương (còn gọi tái cấu trúc giãn), hoặc tái cấu trúc âm (hay là tái cấu trúc co). Trong tái cấu trúc âm, mảng xơ vữa xu hướng phát triển trong lòng mạch gây hẹp mạch. Trong khi đó với tái cấu trúc dương, mảng xơ vữa có xu hướng phát triển ra phía ngoài, tạo gánh nặng xơ vữa lớn. Chỉ số tái cấu trúc được tính bằng tỷ lệ CSA của EEM tại vị trí tổn thương/ CSA của EEM tại vị trí tham chiếu, tái cấu trúc dương khi chỉ số tái cấu trúc > 1,05; tái cấu trúc âm khi chỉ số tái cấu trúc < 0,95.

(Nguồn: Paul Schoenhagen et al. (2007) IVUS made easy. International Standard Book Number-13: 978-0-203-09022-082)
1.5.2 IVUS sau khi đặt stent
Sau khi cấy stent, IVUS có thể phát hiện những bất thường có thể sửa chữa được liên quan đến stent và thành mạch lân cận, chẳng hạn như stent không giãn nở tốt, stent không áp thành, lóc tách cạnh stent, stent quá lớn so với mạch, lồi tổ chức vào trong stent, …. Những bất thường này nếu không được phát hiện và xử trí phù hợp sẽ gây ra những kết cục bất lợi sau can thiệp động mạch vành qua da (PCI).
Các mục tiêu có thể thực hiện được để tối ưu hóa việc đặt stent bao gồm:
Tham chiếu đoạn gần và xa nơi đặt 2 đầu stent: có gánh nặng xơ vữa < 50% và không có bể lipid (vì có liên quan đến tỷ lệ tái hẹp cạnh stent khi đặt stent phủ thuốc).
Lóc tách thành mạch cạnh stent: không vượt quá lớp nội mạc, chiều dài < 2 mm và chiều rộng < 60°.
Không có thành phần xơ vữa lồi ra trong stent.
Stent nở tốt: diện tích lòng mạch tối thiểu của stent (Stent MLA) > 5,5 mm2 và > 80% diện tích trung bình lòng mạch tham chiếu. Đối với OCT, con số này chỉ là > 4,5 mm2.
Stent áp thành tốt: khoảng cách từ stent đến lớp áo trong < 0,4 mm, trên chiều dài < 1 mm.

1.5.2.1 Lóc tách động mạch vành
IVUS sẽ được kéo ngược dọc theo đoạn mạch vành sau can thiệp để kiểm tra loại trừ hiện tượng lóc tách và tụ máu trong thành hay không. Vì độ phân giải kém hơn nhiều so với OCT, do vậy khả năng phát hiện lóc tách thành mạch của IVUS tương đối hạn chế so với OCT, nhưng vẫn tốt hơn so với chụp mạch đơn thuần.
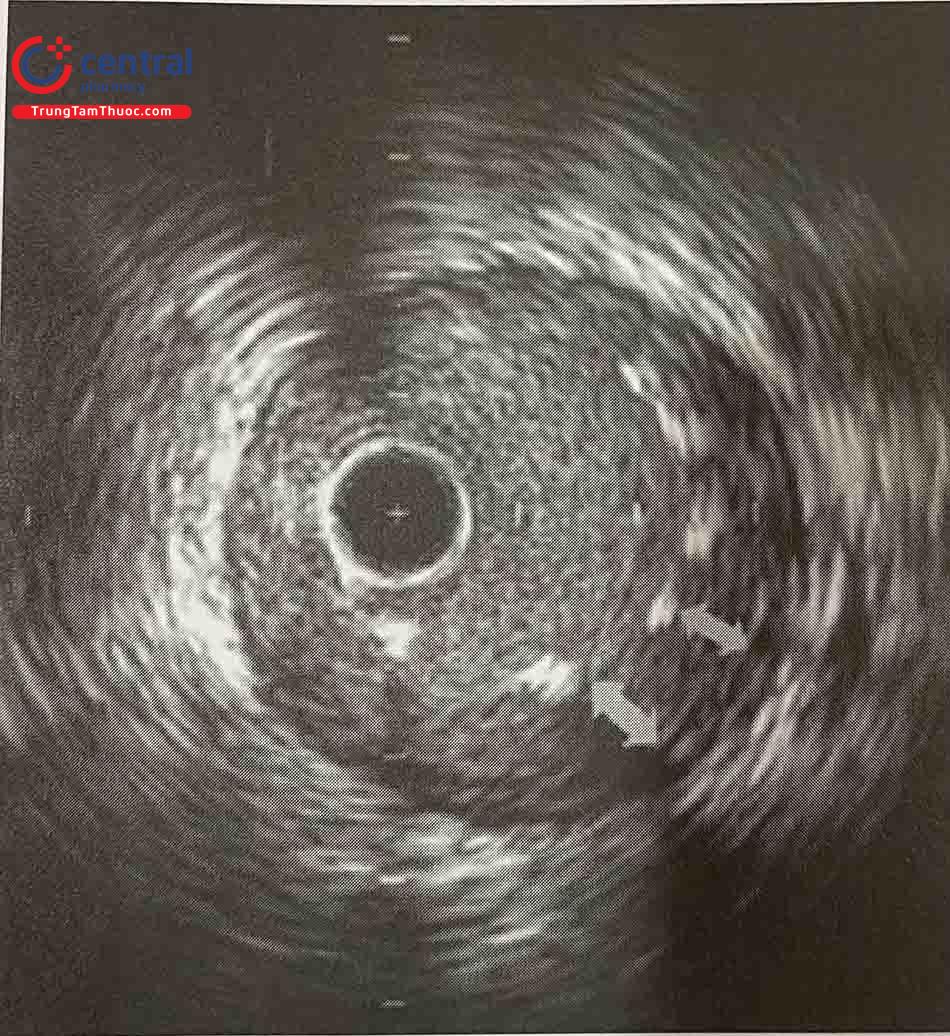
Lóc tách cạnh stent được coi là có nguy cơ nếu lóc tách kéo dài ≥ 3 mm và/hoặc rộng ≥ 60°, trong trường hợp này đặt thêm stent để phủ lóc tách được chỉ định để phòng ngừa lóc tách tiến triển dẫn đến huyết khối cấp, slow flow – no reflow.
1.5.2.2 Tình trạng áp thành của stent
Stent không áp thành là tình trạng không tiếp xúc hoàn toàn của khung stent với thành mạch sau can thiệp. Hiện tượng này có thể xuất hiện ngay sau khi đặt stent (cấp tính) hoặc ở giai đoạn sau đó (không áp thành muộn). Stent không áp thành cấp tính xuất hiện khá phổ biến sau khi đặt stent, được phát hiện thấy ở 15% trường hợp bằng IVUS và với hơn 50% trường hợp bằng OCT.
Stent không áp thành có nguy cơ nếu chiều dài đoạn không áp thành > 3 mm, trong trường hợp này cần sử dụng bóng bán giãn nở (semi-compliant) nong lại tổn thương ở áp lực nominal. Việc sử dụng bóng áp lực cao có thể không cần thiết, thậm chí có thể làm tăng biến chứng vỡ mạch.
1.5.2.3 Độ giãn nở của stent
Nếu sau khi đặt stent mà đường kính stent giãn nở gần bằng hoặc bằng đường kính của động mạch, thì được coi là giãn nở tốt. Theo khuyến cáo hiện nay của Hội Tim mạch châu Âu, stent nở tốt nếu diện tích stent tối thiểu (MSA) ≥ 80%, tốt nhất là ≥ 90% diện tích lòng tham chiếu trung bình và/hoặc > 5-5,5 mm2 trên IVUS đối với stent đặt không phải ở thân chung ĐM vành trái, > 8 mm2 nếu stent ở thân chung. Nếu không cần sử dụng bóng áp lực cao (non-com- pliant) > 18 atm để nong lại nhằm đạt đường kính tối ưu.
Kiểm tra lại IVUS mà stent vẫn chưa nở ra tối ưu, thường do nguyên nhân mảng vôi hóa cứng, cần sử dụng các thiết bị phá mảng vôi nhằm tăng khả năng giãn nở của mạch máu. Thiết bị nên được sử dụng là Shockwave sử dụng nguyên lí sóng siêu âm có thể đi xuyên qua các mắt stent mà không làm hỏng cấu trúc stent để phá vỡ mảng vôi. Các thiết bị khoan phá khác như Rotablator, Orbital không được khuyên dùng vì có thể phá vỡ cấu trúc stent.

1.5.2.4 Phát hiện lồi tổ chức mô vào trong lòng stent
Lồi tổ chức mô vào bên trong stent có thể bao gồm sự nhô ra của mảng xơ vữa hoặc huyết khối trong bệnh cảnh hội chứng vành cấp hoặc tổn thương cơ tim sau PCI. IVUS vẫn có thể phát hiện được bất thường này nhưng độ chính xác và rõ ràng hạn chế hơn so với OCT do độ phân giải kém hơn. Đây là yếu tố dự báo của huyết khối stent sớm và có liên quan đến tiên lượng ngắn hạn bất lợi sau PCI. Trong một nghiên cứu sổ bộ đa trung tâm sử dụng OCT sau can thiệp ở 780 bệnh nhân (50% mắc hội chứng vành cấp), lồi tổ chức mô phổ biến hơn ở những bệnh nhân nhồi máu cơ tim và là một yếu tố dự báo độc lập về kết quả lâm sàng trong 1 năm, chủ yếu là tái can thiệp mạch đích. Các nghiên cứu CLI-OPCI và HORIZONS-AMI cũng cho thấy rằng lồi tổ chức mô trong bối cảnh hội chứng vành cấp dường như gây ra kết cục xấu hơn là trong bệnh cảnh không phải hội chứng vành cấp.
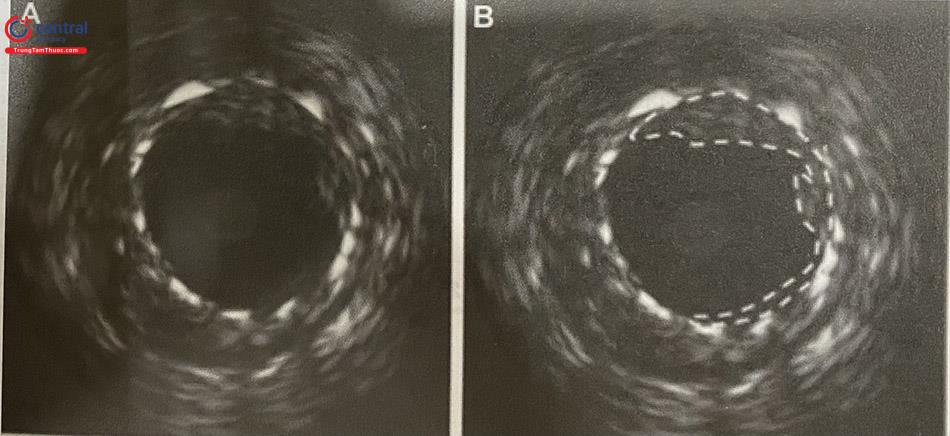
1.5.3 Đánh giá cơ chế tái hẹp hoặc huyết khối trong stent
Thất bại sau đặt stent (stent failure) được định nghĩa là tái hẹp trong stent và/ hoặc huyết khối trong stent.
Các nguyên nhân tái hẹp trong stent ngoài tăng sản nội mạc bao gồm stent không giãn nở mạn tính (chiếm khoảng 18–40%), gãy stent (<5%) và hình thành xơ vữa mới (thường sau 1 năm đặt stent phủ thuốc). Hai bất thường đầu tiên có thể được phát hiện dễ dàng bằng IVUS hoặc OCT, trong khi bất thường sau cùng chỉ có thể phát hiện một cách rõ ràng bởi OCT. Gãy stent có thể được xác định dễ dàng hơn bằng hình ảnh OCT ba chiều so với chỉ hình ảnh hai chiều đơn thuần trên IVUS.
Đối với khoảng 60% các trường hợp tái hẹp trong stent, cơ chế hàng đầu vẫn là tăng sản nội mạc mạch máu. Ngược lại, huyết khối trong stent có nhiều cơ chế và hầu hết những cơ chế này có thể nhận biết được bằng hình ảnh nội mạch. Chụp OCT, trái ngược với IVUS, có thể phân biệt huyết khối với các thành phần mô khác, do đó, được coi là kỹ thuật hình ảnh được lựa chọn ưu tiên cho huyết khối trong stent. Tuy nhiên, trong một số trường hợp, sự hiện diện của một lượng lớn huyết khối có thể làm cho việc đánh giá các mắt stent và thành mạch bên ngoài trở bên khó khăn với OCT do sự ngăn cản ánh sáng từ đầu dò OCT bởi huyết khối. Lúc này, IVUS lại được lựa chọn ưu tiên hơn.
Bằng việc sử dụng thuốc ức chế GP IIb/IIIa giúp phục hồi dòng chảy mạch vành TIMI 3 và tiến hành OCT sau đó là chiến lược phù hợp giúp khắc phục phần nào nhược điểm của OCT trong trường hợp này, giúp ích cho việc phân tích cơ chế gây huyết khối trong stent.
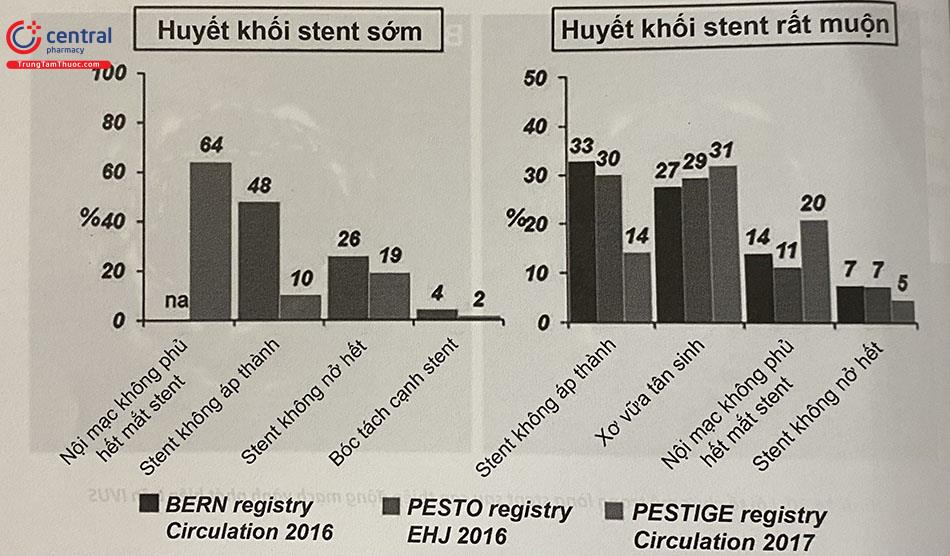
Ba nghiên cứu thuần tập gần đây (BERN, PESTO, PRESTIGE) sử dụng OCT để khảo sát mối tương quan của huyết khối trong stent xảy ra tại các thời điểm khác nhau cho thấy rằng các nguyên nhân chính gây huyết khối sau đặt stent phủ thuốc ở giai đoạn sớm (trong 30 ngày), theo thứ tự thường gặp là mắt stent không được che phủ hết bởi nội mạc, stent không áp thành, stent không nở hết và lóc tách cạnh stent. Còn nguyên nhân thường gặp gây huyết khối rất muộn (sau 12 tháng), khác với các nghiên cứu IVUS trước đây, OCT tìm thấy các cơ chế thường gặp theo thứ tự lần lượt là: stent không áp thành, mảng xơ vữa tân sinh, mắt stent không được che phủ hết, sau cùng là stent không nở hết. Việc tiếp cận điều trị theo cơ chế được phát hiện trên OCT (ví dụ như đặt thêm stent trong trường hợp mảng xơ vữa tân sinh, nong bóng trong trường hợp stent không áp thành hoặc không nở hết) dường như hợp lý về mặt lâm sàng, mặc dù thiếu dữ liệu để hỗ trợ chiến lược điều trị như vậy.
1.5.4 Các tình huống lâm sàng cụ thể
1.5.4.1 Hẹp thân chung động mạch vành trái
Trong đánh giá bệnh lý của thân chung động mạch vành trái (LMCA), gập góc, vôi hóa, hoặc co thắt ở vị trí này có thể dẫn đến khó đặt ống thông và gây nhiễu khi phân tích phim chụp mạch. Một số nhà nghiên cứu thấy rằng tỷ lệ cao những bệnh nhân có LMCA bình thường trên phim chụp mạch lại phát hiện bệnh lý khi kiểm tra bằng IVUS. Thêm nữa, một nghiên cứu IVUS gần đây đã chứng minh rằng gần một nửa số thân chung hẹp không rõ ràng ở chụp mạch lại thực ra có hẹp đáng kể. Điều này đặc biệt đúng đối với bệnh của lỗ vào LMCA, nơi có 36% các tổn thương hẹp đáng kể và 41% có gánh nặng mảng xơ vữa < 50% trên IVUS.
Ngưỡng MLA chẩn đoán có thiếu máu cục bộ cho LMCA được coi là 6 mm2 dựa trên đánh giá sinh lý với phân số dự trữ lưu lượng vành (FFR) cũng như tính toán lý thuyết sử dụng định luật Murray. Giá trị giới hạn này gần đây đã được xác nhận trong nghiên cứu tiến cứu đa trung tâm LITRO, trong đó tiêu chí IVUS xác định MLA ≥ 6 mm2 được sử dụng để trì hoãn tái thông mạch ở bệnh nhân mắc bệnh thân chung mức độ trung bình. Trong thời gian 2 năm theo dõi, tỉ lệ tử vong do tim mạch và sống sót không có biến cố là tương đương giữa nhóm trì hoãn và nhóm được tái thông. Một nghiên cứu khác cũng cho thấy sự an toàn của việc trì hoãn tái thông mạch máu cho bệnh thân chung mức độ trung bình dựa trên hướng dẫn IVUS nhưng sử dụng ngưỡng MLA lớn hơn (7,5 mm2 ) được xác định trước dựa trên giới hạn bình thường dưới của MLA thân chung từ cơ sở dữ liệu lâm sàng của họ. Tuy vậy, trên thực tế sự đánh giá cần được đưa ra cùng với với các thông tin khác, chẳng hạn như sự hiện diện của bệnh đái tháo đường và gánh nặng mảng xơ vữa tại vị trí lòng mạch nhỏ nhất (MLA).
1.5.4.2 Tổn thương nhánh bên
Tổn thương nhánh bên động mạch vành được định nghĩa là khi có tổn thương động mạch vành (hẹp >50%) xảy ra liền kề và/hoặc bao gồm cả gốc của các nhánh xa lớn, như vậy về mặt giải phẫu tổn thương nhánh bên bao gồm: đoạn gần nhánh chính, đoạn xa nhánh chính và nhánh bên (từ phần bắt đầu tới chiều dài 3–5mm của nó). Tổn thương nhánh bên chiếm 15% đến 20% tổn thương trong can thiệp mạch động mạch vành qua da. Đây là một thách thức lớn cho bác sĩ can thiệp PCI do sự chồng chéo của các nhánh chính và nhánh bên, hơn nữa tình trạng hẹp lỗ của nhánh bên có thể trở nên trầm trọng hơn khi đặt stent nhánh chính vì có thể dẫn đến tắc hoàn toàn các lỗ vào nhánh bên.
Tại các tổn thương nhánh bên, mức độ liên quan của các nhánh bên có thể khó đánh giá chỉ bằng chụp mạch và quyết định tái thông hoặc bảo vệ nhánh bên thường phụ thuộc vào cảm nhận về độ phức tạp của thương tổn. Sự kết hợp giữa mảng xơ vữa và chạc ba thay đổi theo quá trình nong bóng hoặc đặt stent có thể gây hẹp hoặc tắc nghiêm trọng của một nhánh bên, đặc biệt là khi có bệnh lý ở lỗ vào từ trước. Mặc dù sự lắng đọng mảng xơ vữa trong tổn thương lỗ vào của một nhánh bên có thể được đánh giá bằng cách nhìn từ động mạch chính hướng tới lỗ vào của nhánh bên, việc đánh giá chính xác yêu cầu hình ảnh trực tiếp của nhánh bên. Sau khi can thiệp mạch vành qua da trên các tổn thương nhánh bên, cả diện tích stent nhỏ và tăng sinh nội mạc đều là cơ chế chính gây ra tăng tỷ lệ tái hẹp ở lỗ vào nhánh bên. Hình ảnh IVUS hỗ trợ kỹ thuật giúp nở stent tối ưu; ngăn ngừa tăng sinh nội mạc ở nhánh bên và có thể cải thiện kết cục lâm sàng.
1.5.4.3 Tổn thương tắc hoàn toàn mạn tính động mạch vành (CTO)
IVUS hữu ích ở một số trường hợp trong quá trình can thiệp tổn thương tắc hoàn toàn mạn tính động mạch vành CTO. Trong CTO, điểm vào ở lỗ CTO thường khó xác định bằng chụp mạch. Nếu có một nhánh bên nằm gần lối vào của CTO, ống thông IVUS có thể được đưa vào nhánh bên để phát hiện lỗ vào nhánh chính đã bị tắc. Ngoài ra, ống thông IVUS có thể được lách vào khoảng cận nội mạc để xác định hướng của lòng thật. Lòng thật sẽ được bao quanh bởi cả ba lớp của mạch máu (nội mạc, áo giữa, và áo ngoài). Các nhánh bên có thể gợi ý thêm một manh mối khác vì chúng thông với lòng thật chứ không phải lòng giả.
Tuy nhiên điều quan trọng cần lưu ý là việc đưa ống thông IVUS vào khoảng cận nội mạc mang nguy cơ tiềm ẩn làm rộng khoảng cận nội mạc. Đối với kỹ thuật này, ống thông số hoá thường được ưu tiên sử dụng, vì nó có khoảng cách từ đầu dò tới đầu ống thông ngắn hơn hệ thống cơ học. Ngoài ra, so với ống thông IVUS cơ học, thiết kế đơn ray dài hơn của ống thông số hoá có thể cung cấp khả năng bám đường tốt hơn và ít mắc kẹt hơn. IVUS phát hiện tốt các trường hợp tụ máu trong thành, ngoài thành (hoặc thủng) không hiếm xảy ra trong quá trình CTO. Phát hiện sớm và đánh giá chính xác các biến chứng này là rất quan trọng để điều trị an toàn và hiệu quả cho bệnh nhân CTO.
1.6 Kết luận về IVUS
Siêu âm trong lòng mạch (IVUS) là phương pháp chẩn đoán hình ảnh đầu tiên cho phép “nhìn” trực tiếp vào mảng xơ vữa và mô bệnh học của thành động mạch vành.
Những cải tiến trong công nghệ IVUS đã mang lại hình ảnh có độ phân giải cao hơn và thuận tiện hơn cho người sử dụng.
IVUS cung cấp những hiểu biết đáng kể về sinh bệnh học mạch máu, như sự tiến triển của mảng xơ vữa, quá trình tái cấu trúc mạch máu và tái hẹp mạch vành.
IVUS là một công cụ hữu ích trong thực hành trong các tình huống chụp mạch không rõ ràng hoặc khó diễn giải, giúp lựa chọn phương án can thiệp thích hợp và giúp tối ưu hóa quá trình can thiệp mạch vành.
Việc cải tiến các kỹ thuật để nâng cao hơn tính hữu dụng của IVUS trong cả nghiên cứu và lâm sàng vẫn được tiến hành, đặc biệt với các kỹ thuật cao trong điều trị nhằm mục đích thay đổi diễn biến bệnh lý mạch máu.
2 OPTICAL COHERENCE TOMOGRAPHY (OCT)
2.1 Đại cương
2.1.1 Giới thiệu
Chụp động mạch vành qua da là phương pháp cơ bản trong chẩn đoán và điều trị bệnh lý ĐMV. Tuy nhiên phương pháp này có những hạn chế cố hữu như chỉ mô tả được một cách cơ bản hình ảnh hai chiều của hệ ĐMV về mặt đại thể mà không đánh giá được cụ thể, chi tiết cấu tạo, hình thái tổn thương thành mạch, là nơi mà quá trình bệnh lý xảy ra. Sự ra đời của siêu âm trong lòng mạch (IVUS) và đặc biệt là Optical Coherence Tomography (OCT) giúp giải quyết được nhược điểm này và cung cấp rất nhiều thông tin quan trọng cho việc chẩn đoán và điều trị bệnh.
Optical Coherence Tomography (OCT), tạm dịch “cắt lớp quang học” ngày càng được sử dụng nhiều trong chẩn đoán và điều trị bệnh lý ĐMV. Mặc dù mang đến nhiều tiện ích như độ phân giải cao, hình ảnh sắc nét, tuy vậy ứng dụng của OCT trong thực tiễn lâm sàng còn rất hạn chế, do chi phí tốn kém, không sẵn có ở trung tâm can thiệp, phiên giải kết quả còn khó trong nhiều trường hợp phức tạp, thiếu thuật toán chuẩn hóa để hướng dẫn can thiệp mạch vành, cũng như còn khá ít dữ liệu từ các thử nghiệm lâm sàng.
2.1.2 Lịch sử phát triển của OCT
Bắt đầu từ năm 1990, David Huang đã bắt đầu sử dụng phản xạ miền kết hợp quang học (OCDR) để nghiên cứu các phép đo khác nhau trong mắt, đặc biệt là võng mạc, tuy nhiên việc phiên giải kết quả còn gặp rất nhiều khó khăn. Bằng cách sử dụng giao thoa kế, lần đầu tiên người ta có thể ghi lại sóng phản xạ từ các độ sâu khác nhau trong một mô sinh học, giúp việc mã hóa và phiên giải các hình ảnh trở nên dễ dàng hơn. Cùng với sự phát triển khoa học kĩ thuật theo thời gian, đến năm 1996 đã bắt đầu có những báo cáo ứng dụng OCT trong chẩn đoán thương tổn ĐM vành. Ngày nay, sự phát triển công nghệ OCT từ “miền thời gian” sang “miền Fourier” đã làm thay đổi đáng kể cách thức nghiên cứu cho phép ứng dụng trong lĩnh vực động mạch vành rộng rãi hơn trên lâm sàng.
2.2 Hệ thốngOCT
2.2.1 Nguyên lý hoạt động của OCT
OCT sử dụng ánh sáng hồng ngoại chiếu trực tiếp vào thành mạch máu thông qua một sợi quang đơn có thể quay được kết hợp với một thấu kính nằm bên trong một đoạn ống dẫn ngắn trượt được trên dây dẫn can thiệp. Bằng cách đo biên độ và độ trễ thời gian của ánh sáng tán xạ ngược, OCT tạo ra hình ảnh thể tích ba chiều, mặt cắt ngang và độ phân giải cao của vi cấu trúc mạch. Do tốc độ ánh sáng nhanh, cần phải có giao thoa kế để phát hiện tán xạ ngược: điều này liên quan đến việc tách ánh sáng thành các chùm tín hiệu và chùm tham chiếu, với cường độ giao thoa được tính toán theo sự khác biệt về tần số giữa hai chùm tia. Vì máu làm phân tán ánh sáng mạnh và làm suy giảm tín hiệu OCT, cần phải phun nước muối sinh lý hoặc thuốc cản quang để loại bỏ máu trong quá trình thu nhận tín hiệu.
Bước sóng của ánh sáng hồng ngoại trong OCT (1,3 μm) ngắn hơn so với sóng siêu âm trong IVUS (~ 40 μm ở 40 MHz) mang lại độ phân giải theo trục dọc lớn hơn (10-20 μm so với 50-150 μm) nhưng ngược lại độ đâm xuyên thấp hơn (1-2 mm so với 5-6 mm), điều này làm hạn chế hình ảnh OCT trong một số trường hợp khi có các cấu trúc đậm đặc như huyết khối đỏ hoặc lipid/lõi hoại tử.
2.2.2 Các hệ thống máy OCT hiện nay
Đến nay, nhiều hệ thống OCT đã được phát triển. Hai hệ thống được sử dụng nhiều nhất là hệ thống OPTIS ™ (Abbott Vascular, Santa Clara, CA, USA), cung cấp hình ảnh chụp ĐMV và OCT kết hợp và hệ thống Lunawave® (Terumo, Tokyo, Nhật Bản).
Nhiều công ty khác đã phát hành sản phẩm hoặc đang trong quá trình gia nhập thị trường, đặc biệt kể đến hệ thống máy Novasight Hybrid ™ (Conavi Medical Inc., To- ronto, Canada) và Dual Sensor (Terumo) sử dụng hệ thống ống thông kết hợp OCT/IVUS được tích hợp sẵn được sử dụng cho mục đích nghiên cứu, với tiềm năng cung cấp các ưu điểm của OCT và IVUS trong một ống thông duy nhất trong thực hành lâm sàng.
Hệ thống máy OCT thế hệ đầu (St. Jude/LightLab Imag- ing Inc., Westford, MA, USA) sử dụng nguyên lý “miền thời gian” trong khi các hệ thống máy thế hệ thứ 2 như OPTIS ™ (Abbott Vascular, Santa Clara, CA, USA) áp dụng nguyên lý “miền Fourier” trong phân giải cấu trúc mạch máu.
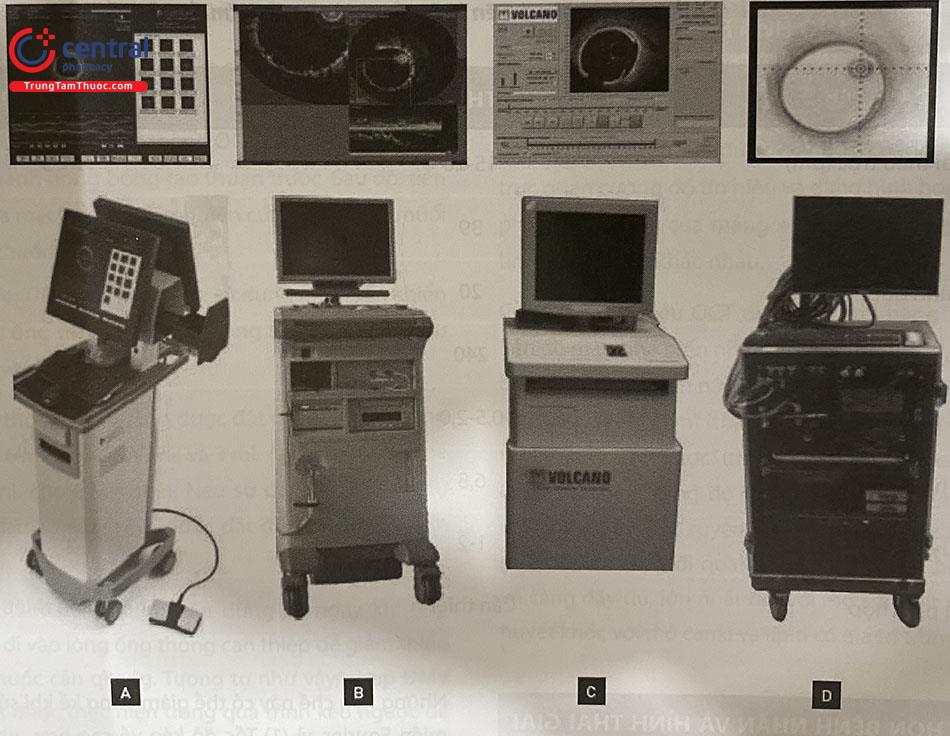
(A) St. Jude/LightLab Imaging Inc., Westford, MA, Hoa Kỳ; (B) Terumo Corp., Tokyo, Nhật Bản; (C) Volcano Corp., Billerica, MA, USA;
(D) MGH, G. Tearney & B. Bouma, Boston, MA, Hoa Kỳ.
2.2.2.1 Hệ thống máy OCT sử dụng miền thời gian
Trong nguyên lý miền thời gian, thấu kính thu nhận không cố định mà có thể di chuyển được dọc theo đoạn mạch khảo sát. Thực tế thấu kính được đặt quá đoạn mạch cần đánh giá thêm một khoảng vài mm. Bằng cách quét chùm tia dọc theo mô, theo kiểu quay để chụp ảnh nội mạch, hình ảnh được dựng lên từ các đường lân cận.
2.2.2.2 Hệ thống máy OCT sử dụng miền Fourier (miền tần số)
Hệ thống này sử dụng nguồn phát băng thông rộng như trong các hệ thống miền thời gian và phân giải kết quả dựa trên phổ bước sóng, hoặc sử dụng kết hợp với phương thức mới để quét laser bước sóng. Kỹ thuật thứ hai còn được gọi là “OCT nguồn quét”, hoặc hình ảnh miền tần số quang (OFDI) là kỹ thuật hiệu quả nhất nhờ độ nhạy cao hơn và tỷ lệ tín hiệu nhiễu thấp hơn. Phương pháp này giúp tốc độ thu nhận hình ảnh nhanh hơn, độ đâm xuyên lớn hơn, mà không làm giảm chi tiết hoặc độ phân giải quan trọng. Đây là sự cải tiến vượt bậc nhất trong các hệ thống OCT hiện nay.
Bảng 14.1. So sánh các đặc tính giữa nguyên lý “miền thời gian” và “miền tần số/Fourier”
| ĐẶC TÍNH | MIỀN THỜI GIAN | MIỀN TẦN SỐ /FOURIER |
|---|---|---|
| Độ phân giải theo trục (µm) | 15-20 | 12-15 |
| Độ phân giải bên (µm) | 39 | 19 |
| Số khung hình quét (/giây) | 20 | 100 |
| Số lượng đường quét/hình | 240 | 500 |
| Tốc độ kéo (mm/giây) | 0,5-2,0 | 10-25 |
| Đường kính quét (mm) | 6.8 | 10 |
| Độ đâm xuyên mô (mm) | 1-2 | 1-2 |
| Bơm bóng phối hợp | Cần thiết | Không cần thiết |
2.3 Lựa chọn bệnh nhân và hình thái giải phẫu động mạch vành phù hợp
Về nguyên tắc, tất cả các động mạch vành, tĩnh mạch hoặc động mạch có thể tiếp cận được bằng ống thông can thiệp đều đủ điều kiện để làm OCT. Tuy nhiên có một số trường hợp cần cân nhắc về giải phẫu và đặc điểm lâm sàng của bệnh nhân, chẳng hạn:
Vì quy trình chẩn đoán hình ảnh yêu cầu loại bỏ và xả máu tạm thời (bằng dung dịch Ringer lactat hoặc thuốc cản quang), nên chống chỉ định ở các bệnh nhân có huyết động không ổn định hoặc suy tim nặng, suy giảm chức năng thận nghiêm trọng.
OCT cũng nên được chỉ định thận trọng cho các trường hợp chỉ còn một nhánh mạch vành còn chức năng ở các bệnh nhân có tổn thương nặng nhiều thân động mạch vành.
Các tổn thương ở vị trí lỗ vào hoặc đoạn gần không thể khảo sát được bằng cách sử dụng phương pháp bơm bóng và gây tắc đoạn gần, do đó kỹ thuật không bơm bóng có thể được ưu tiên trong những trường hợp này.
Các mạch lớn hoặc ngoằn ngoèo thường khó đánh giá hình ảnh chu vi hoàn chỉnh do vị trí không chính giữa, không đồng trục của đầu dò OCT.
Những hạn chế này có thể giảm đáng kể khi sử dụng OCT miền Fourier, vì (1) Tốc độ kéo về cao hơn, nhờ vậy thời gian thiếu máu cục bộ và lượng cản quang sử dụng thấp hơn đáng kể; (2) Tăng độ đâm xuyên và phạm vi quét cho phép chụp ảnh toàn bộ chu vi của các mạch lớn và gập góc; (3) Thiết kế của đường dẫn đầu dò trượt trên wire ngắn phối hợp với lựa chọn wire thích hợp tạo thuận khi đi qua các tổn thương phức tạp.
2.4 Các bước thực hành sử dụng OCT trên lâm sàng
Bước 1: Chuẩn bị ống thông OCT: bơm rửa và đuổi khí hoàn toàn trong ống thông OCT bằng nước muối sinh lý có pha heparin, sau đó gắn ống thông vào bộ điều khiển.
Bước 2: Chuẩn bị động mạch vành
- Để đạt chất lượng hình ảnh tốt khi kéo ống thông OCT về, cần đảm bảo đầu ống thông can thiệp phải được đặt chọn lọc vào lỗ của ĐMV. Tuy nhiên việc để đầu ống thông chui quá sâu vào ĐMV là không cần thiết và có thể phản tác dụng, vì khi bơm thuốc cản quang có thể đẩy ống thông can thiệp ra ngoài, dẫn đến việc bơm thuốc không tối ưu.
- Bơm nitroglycerine vào ĐMV trước khi làm OCT để loại trừ co thắt có thể do kích ứng của ống thông.
Bước 3: Đưa ống thông OCT qua tổn thương
Trượt ống thông OCT trên dây dẫn can thiệp và được đưa đến đoạn xa của tổn thương đích (~10 mm). Nếu các tổn thương hẹp rất khít mà ống thông OCT không đi qua được thì nên tiến hành nong bóng tạo thuận trước. Sau đó, tiến hành bơm rửa mạch vành cần nghiên cứu bằng nước muối sinh lý hoặc thuốc cản quang.
Bước 4: Thu nhận hình ảnh: sử dụng máy điều khiển kéo ngược ống thông OCT về, đồng thời bơm rửa máu trong ĐM vành.
Tốc độ bơm thuốc cản quang được đặt ở 4 mL/s cho tổng thể tích 14-16 mL cho ĐMV trái và 3 mL / giây cho tổng thể tích 12-14 mL cho ĐMV phải. Nếu sử dụng kim phun tự động, giới hạn áp suất phải được đặt ở 300 psi hoặc gần nhất có sẵn.
Việc bơm thuốc cản quang nên dừng lại ngay khi ống thông OCT đi vào lòng ống thông can thiệp để giảm thiểu số lượng thuốc cản quang. Tương tự như vậy, chụp ĐMV qua da nên được thực hiện trong quá trình kéo ngược để tận dụng thuốc cản quang cho chụp mạch và để sử dụng tính năng đồng bộ OCT nếu tính năng này có sẵn.
2.5 Đánh giá hình ảnh OCT
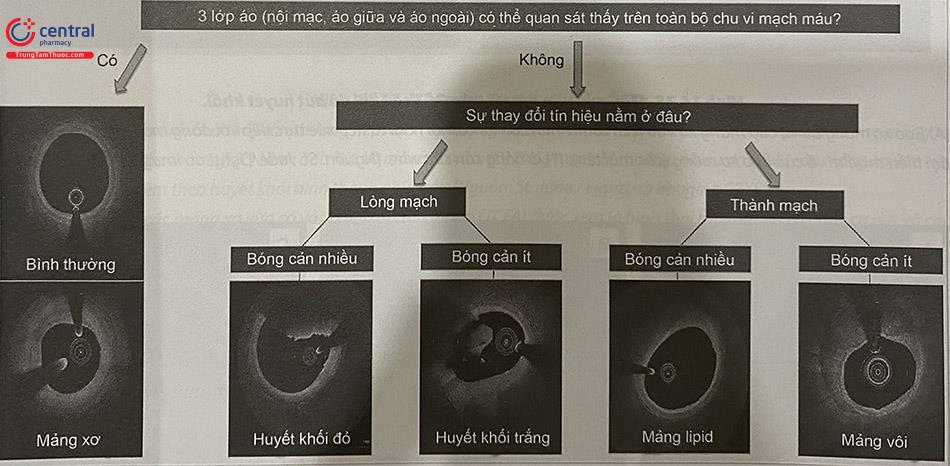
2.5.1 Quy ước màu trong nhận định hình ảnh
Hình ảnh OCT có thể được giải thích bằng cách đánh giá trực quan cường độ tín hiệu và dạng hình học vì các thành phần khác nhau của mảng xơ vữa động mạch có các đặc tính quang học khác nhau.
Cường độ tín hiệu OCT được hiển thị bằng bản đồ màu. Bản đồ màu phổ biến nhất là tỷ lệ “nâu đỏ”, từ màu đen (tín hiệu OCT thấp) đến nâu, vàng và trắng (tín hiệu OCT cao). Ngoài ra, tỷ lệ “xám” (thấp là màu đen, cao là trắng) hoặc tỷ lệ màu “xám ngược” (thấp là màu trắng, cao là màu đen) (Hình 14.33). Cường độ tín hiệu thu nhận lại phụ thuộc vào khả năng đâm xuyên mô của chùm ánh sáng, mô cho phép chùm sáng đi qua càng nhiều thì tín hiệu nhận lại về càng đầy đủ, lớn nhất đối với mô sợi và ít nhất đối với huyết khối; với mô canxi và lipid có giá trị trung gian.

Terumo Corp., Tokyo, Nhật Bản.
MGH, Tearney & B. Bouma, Boston, MA, Hoa Kỳ.
Jude/LightLab Imaging Inc., Westford, MA, Hoa Kỳ.
2.5.2 Hình ảnh động mạch vành bình thường trên OCT
Cấu trúc ba lớp bình thường của động mạch vành được hiển thị rõ trên OCT. Lớp áo giữa có hình dạng một dải tối phân định rõ bởi lớp màng đàn hồi bên trong và lớp màng đàn hồi bên ngoài. Độ dày trung bình của lớp áo giữa là 200 pm nên có thể dễ dàng nhìn thấy trên OCT. Khi có sự xuất hiện của hiện tượng tái cấu trúc mạch máu (biểu thị bởi sự giãn nở của thành mạch tại các vị trí mảng xơ vữa) thì lớp áo giữa lại trở nên mỏng hơn. Tuy nhiên, do hạn chế về mặt khảo sát các mô ở sâu của OCT (1-1,5 mm) nên OCT không phù hợp để đánh giá hiện tượng tái cấu trúc, vì thành mạch và mảng xơ vữa dày lên làm mờ hình ảnh lớp áo giữa.
Lớp nội mạc bình thường bao gồm một lớp collagen dưới nội mô mỏng được bao phủ về phía lòng mạch bởi một lớp tế bào nội mô đơn. Cấu trúc giải phẫu này vượt quá khả năng phân giải của OCT. Tuy nhiên, OCT có thể phát hiện được hiện tượng dày nội mạch trong giai đoạn sớm, được mô tả như một vành mô mỏng, đồng nhất, giàu tín hiệu.
Do đó, OCT có thể khẳng định có hay không sự hiện diện của mảng xơ vữa có ý nghĩa, đồng thời cho biết mức độ tổn thương của mảng xơ vữa khi chưa có biểu hiện lâm sàng. Sử dụng OCT đánh giá các lần liên tiếp có thể theo dõi được những thay đổi về mặt cấu trúc thành mạch theo trình tự thời gian. Các dữ liệu thu thập được hữu ích cho việc nghiên cứu sự phát triển của mảng xơ vữa và ảnh hưởng của các liệu pháp điều trị khác nhau đối với sự thoái triển/tiến triển của mảng xơ vữa từ giai đoạn sớm. Do đó, việc xác định chính xác vị trí mạch để khảo sát trong lần đánh giá theo thời gian đóng vai trò tối quan trọng. Tuy nhiên, vẫn có sự sai lệch nhất định trong việc lựa chọn vị trí mảng xơ vữa có vỏ mỏng nhất từ đó ảnh hưởng đến kết quả. Vì vậy, việc sử dụng phần mềm chuyên dụng là giải pháp khả thi để hạn chế sự sai lệch này.
2.5.3 Hình ảnh mảng xơ vữa trên OCT
2.5.3.1 Mảng xơ
Mảng xơ thường giàu collagen hoặc tế bào cơ và có tín hiệu OCT đồng nhất kèm theo độ tán xạ ngược cao và bóng cản thấp, tạo nên hình ảnh OCT sáng và có cường độ tín hiệu mạnh.
2.5.3.2 Mảng vôi hóa
Hiện diện trong các mảng xơ vữa và được xác định bởi sự có mặt của các vùng không đồng nhất có ranh giới rõ ràng, độ tán xạ ngược thấp, cường độ tín hiệu thấp. Nhìn chung, mảng vôi hóa ở bề mặt có thể được đánh giá và đo bằng OCT trừ khi độ dày của chúng lớn hơn 1,0-1,5 mm (giới hạn khảo sát của OCT). Trong trường hợp này, việc chẩn đoán độ lớn thực sự và vị trí của mảng vôi hóa thực sự gặp khó khăn. Mảng vôi hóa có tín hiệu thấp có thể bị nhầm lẫn với cấu trúc giàu lipid tín hiệu thấp. Bằng việc đánh giá các hình ảnh OCT liên tiếp thay vì trên một mặt cắt đơn lẻ giúp làm tăng độ chính xác trong chẩn đoán.
2.5.3.3 Các lõi hoại tử hoặc các mô giàu lipid
Trên OCT các tổn thương này có ranh giới không rõ ràng khi so với hình ảnh mảng vô hóa, đặc trưng bởi các vùng nghèo tín hiệu, có ranh giới lan tỏa với các dải giàu tín hiệu bên trên, tương ứng với vỏ xơ. Một số báo cáo cho thấy OCT có độ nhạy và độ đặc hiệu cao hơn giúp phát hiện và phân tích các thành phần của mảng xơ vữa giàu lipid so với IVUS. Trong phần lớn các trường hợp, độ dày của thành phần mảng xơ vữa giàu lipid không thể đo chính xác được bằng OCT vì độ đâm xuyên không đủ. Ngược lại, độ dày của vỏ xơ bao phủ lớp lipid bề ngoài về phía lòng mạch lại có thể được đo chính xác. Các nghiên cứu mô bệnh học về mảng xơ vữa mạch vành dẫn đến tử vong do tim mạch và nhồi máu cơ tim cấp đã xác định 65 pm là ngưỡng độ dày bao xơ để xác định là mỏng hay dày, dễ bị tổn thương, có xu hướng nứt vỡ và gây ra huyết khối mạch vành.
Độ dày của bao xơ không đồng nhất trong toàn bộ mảng xơ vữa, do đó không nên bỏ qua việc đánh giá sự thay đổi bề dày dọc theo mạch máu trên hình ảnh 3 chiều. Kích thước của mảng xơ vữa hoại tử giàu lipid có thể được phân loại một cách bán định lượng theo số lượng các góc phần tư liên quan trên hình ảnh OCT ở mặt cắt ngang, và ước tính hàm lượng lipid của một tổn thương có thể được tính từ số lượng các góc phần tư có mặt bể lipid hoại tử. Bằng cách áp dụng phương pháp phân loại bán định lượng như vậy, các bể lipid hoại tử có thể được phân loại là không có hoặc trải rộng trên 1, 2, 3 hoặc 4 góc phần tư.
2.5.3.4 Huyết khối
Được xác định là những khối nhô ra trong lòng mạch, không có sự liên tục từ bề mặt của thành mạch. Huyết khối đỏ gồm chủ yếu là các tế bào hồng cầu. Trên hình ảnh OCT, huyết khối đỏ có đặc điểm là độ tán xạ ngược cao và bóng cản lớn. Trong khi đó, huyết khối trắng chủ yếu gồm tiểu cầu và bạch cầu, được đặc trưng bởi khối giàu tín hiệu, độ tán xạ ngược thấp, ít bóng cản nhô vào lòng mạch. Trên thực tế, hiếm khi tìm thấy huyết khối màu trắng hoặc đỏ đơn thuần mà chủ yếu là huyết khối hỗn hợp, hoặc kết hợp với mạch của mạch (vasa vasorum) và tân mạch. Các tân mạch xuất hiện bên trong lớp nội mạc dưới dạng các khoảng trống kém tín hiệu có ranh giới rõ ràng và có thể nhìn thấy trên các lát cắt liên tiếp.
Huyết khối thường xuất hiện ở các tổn thương thủ phạm của bệnh nhân bị hội chứng vành cấp. Cục huyết khối mới hoặc kích thước lớn có thể cản trở việc đánh giá các đặc điểm của mảng xơ vữa phía dưới, chẳng hạn như vết loét trên bề mặt. Để giải quyết vấn đề này khi bắt gặp huyết khối, cần đánh giá cẩn thận từng mặt cắt ngang của OCT trong đoạn mạch vành có huyết khối để tìm kiếm vị trí có thể nhìn thấy rõ hình thái thành mạch và mảng xơ vữa.
2.5.3.5 Đại thực bào
Hình ảnh đại thực bào trên OCT là những chấm nhỏ giàu tín hiệu vượt quá cường độ của nhiễu lốm đốm xung quanh. Các đại thực bào thường được nhìn thấy ở vùng ranh giới giữa đáy của vỏ xơ và đỉnh của lõi hoại tử. Phần mềm chuyên dụng đã được phát triển để xác định các dải đại thực bào với độ chính xác cao hơn so với việc đánh giá đơn giản bằng mắt thường.
Mảng xơ vữa nguy cơ cao
Hội chứng động mạch vành cấp (ACS) xảy ra do nứt vỡ mảng xơ vữa và hình thành huyết khối trong lòng mạch vành, là bệnh lý nguy hiểm có thể gây đột tử ở ngay cả ở nhóm người khỏe mạnh bình thường trước đó. Vì vậy, vấn đề phát hiện sớm các tổn thương có nguy cơ nứt vỡ cao (được gọi là “mảng xơ vữa dễ tổn thương”) rất quan trọng để phòng ngừa biến cố ACS xảy ra trong tương lai. OCT đã nổi lên như một trong những công cụ đầy hứa hẹn để thực hiện điều này (Hình 14.35, 14.36 và 14.37).
Bao xơ mỏng đã vỡ của mảng xơ vữa lệch tâm. Phần còn lại của lõi hoại tử tiếp xúc trực tiếp với dòng máu (**). (B) Độ phóng đại hiển thị vị trí vỡ của bao xơ mỏng (các mũi tên). (*) là bóng cản của (Nguồn: St. Jude/LightLab Imaging C7XR)
(A) Huyết khối trắng trong lòng mạch (mũi tên), nằm chồng trên một mảng xơ nhẹ không có vỏ xơ bọc. (B) Một ổ hoại tử lipid nứt vỡ (mũi tên) với huyết khối nội mạch nhỏ. (C) Mảng xơ vữa cũ với lõi lipid đã bắt đầu vỡ ra và tiếp xúc với lòng mạch không kèm theo huyết khối trong lòng mạch (mũi tên) (Nguồn: St. Jude/LightLab Imaging C7XR).
Hình chụp mạch vành cho thấy tổn thương hẹp khí vị trí đoạn giữa động mạch liên thất trước; (B) Bể lipid lớn trong mảng xơ vữa nằm phía trên tổn thương; (C) Hình ảnh nứt vỡ mảng xơ vữa; (D) Lòng mạch bị thu hẹp nhiều do vỏ xơ của mảng xơ vữa nứt lồi vào lòng mạch kèm theo huyết khối hình thành phía trên (Nguồn: Jude / LightLab Imaging C7XR).
Trên hình ảnh OCT, các mảng xơ vữa có vỏ xơ bao quanh mỏng (TCFA) được xem là hình thái tổn thương có nguy cơ nứt vỡ cao nhất. Độ dày, cấu trúc của vỏ xơ cũng như kích thước và độ lan rộng của lõi hoại tử là các yếu tố giúp tiên đoán khả năng nứt vỡ. OCT cho phép chẩn đoán xác định TCFA với độ nhạy và độ đặc hiệu lần lượt là 90% và 79% khi so sánh với chẩn đoán bằng mô bệnh học.
Hiện tại, OCT là phương pháp chẩn đoán hình ảnh xâm lấn duy nhất cho phép đánh giá chính xác kích thước vỏ xơ trên lâm sàng. Nhiều nghiên cứu cho thấy sự tương đồng chặt chẽ giữa kết quả chẩn đoán TCFA bằng OCT và mô bệnh học, các kết quả này càng củng cố vai trò hàng đầu của OCT trong chẩn đoán hình thái tổn thương này. Trong một nghiên cứu so sánh OCT, IVUS và chụp động mạch vành qua da đơn thuần ở bệnh nhân hội chứng vành cấp, Kubo và cộng sự đã báo cáo rằng OCT là công nghệ hình ảnh duy nhất có thể ước tính độ dày bao xơ (FCT – Fibrous cap thickness) (độ dày trung bình là 49 ±21 µm).
Độ ổn định của mảng xơ vữa không chỉ phụ thuộc vào độ dày của vỏ xơ mà còn phụ thuộc vào hàm lượng collagen. Một số thử nghiệm đã cho thấy sự hiện diện của hàm lượng collagen thấp, sợi collagen mỏng hơn và ít tế bào cơ trơn hơn trong các mảng xơ vữa không ổn định. OCT phân cực (PS – OCT) là công nghệ OCT tăng cường mới được thực hiện bằng cách đo độ lưỡng chiết, một đặc điểm khá đặc trưng của các mô chứa protein với trật tự cấu trúc như collagen và sợi actin/myosin của tế bào cơ trơn. PS – OCT đã được chứng minh có thể đánh giá được hàm lượng collagen, độ dày sợi collagen; mật độ tế bào cơ trơn trong vỏ xơ và bên trong mảng xơ vữa. Những dữ liệu này liên quan đến độ ổn định cơ học của vỏ xơ và từ đó giúp nâng cao khả năng xác định các tổn thương nguy cơ cao ở bệnh nhân.
Xing và cộng sự đã thực hiện nghiên cứu sổ bộ về OCT trên 1.474 bệnh nhân ACS tại bệnh viện Massachusetts (MGH) nhằm đánh giá tác động lâm sàng của các mảng xơ vữa không nằm ở mạch thủ phạm. Tiêu chí đánh giá là các biến cố tim mạch (MACE), gồm tử vong do tim, nhồi máu cơ tim cấp và tái thông mạch vành do thiếu máu cục bộ nhiều hơn một cách ý nghĩa ở những bệnh nhân có mảng xơ vữa giàu lipid trong thời gian trung bình 2 năm (3,5% với 1,8%).
Ngoài ra, các mảng xơ vữa ở bệnh nhân có biến cố MACE có lượng lipid nhiều hơn (p <0,001), vòng cung lipid tối đa rộng hơn (p = 0,023), và diện tích lòng mạch tối thiểu nhỏ hơn (p = 0,003).
Một nghiên cứu gần đây đã nhấn mạnh về sự xuất hiện của đại thực bào tại bề mặt mảng xơ cần được xem như một chỉ điểm về nguy cơ nứt vỡ mảng xơ vữa. Nghiên cứu 99 tổn thương thủ phạm gây ACS bằng phương pháp quang phổ cận mạch – siêu âm trong lòng mạch – hồng ngoại (IVUS-NIRS) và OCT cho thấy OCT có thể xác định sự hiện diện của 3 đặc điểm của tính dễ bị tổn thương (MLA < 4 mm2, FCT < 75 µm và đại thực bào bề mặt) trong phần lớn các thương tổn. Phát hiện này đặt cơ sở cho một hệ thống phân loại mới tính dễ bị tổn thương bằng OCT bao gồm sự xuất hiện đại thực bào bề mặt sau đó đã được áp dụng trong nghiên cứu CLIMA, với 1003 bệnh nhân được khảo sát tổn thương chưa can thiệp tại vị trí đoạn gần động mạch liên thất trước bằng OCT. Tổng số 1776 mảng xơ vữa chứa lipid đã được nghiên cứu, sự hiện diện của MLA < 3,5 mm2 (HR 2,1; [Cl] 95% 1,1-4,0), FCT < 75pm (HR 4,7; Cl 95% 2,4-9,0), chu vi vòng cung lipid > 180 độ (HR 2,4; Cl 95% 1,2-4,8), và đại thực bào (HR 2,7; Cl 95% 1,2-6,1) sẽ làm tăng nguy cơ xuất hiện biến cố trên lâm sàng. Sự hiện diện đồng thời của 4 tiêu chí trên trong cùng một mảng xơ vữa được phát hiện thấy ở 19,4% bệnh nhân xuất hiện các biến cố tim mạch (tử vong và hoặc nhồi máu cơ tim do tổn thương đích) và là một yếu tố dự báo độc lập về các biến cố (HR 7,54; Cl 95% 3,1 -18,6).
Nghiên cứu CLIMA đã giúp mở rộng các kết luận đạt được từ các nghiên cứu trước đó, lý giải tác động trên lâm sàng của hiện tượng viêm cục bộ và FCT như các đặc điểm bổ sung của tính dễ bị tổn thương, bên cạnh sự có mặt và lan rộng của bể lipid. Cần có các nghiên cứu trong tương lai để xác định xem OCT đơn thuần hay kết hợp với các phương thức thăm dò hình ảnh khác, chẳng hạn như IVUS/OCT kết hợp, OCT phối hợp huỳnh quang cận hồng ngoại (OCT – NIRAF) để phát hiện lõi hoại tử hoặc xuất huyết trong mảng xơ vữa, hoặc OCT với quang phổ cận hồng ngoại (OCT – NIRS) để phát hiện lõi lipid (Hình 14.38), sẽ có tác động đến thực hành lâm sàng.
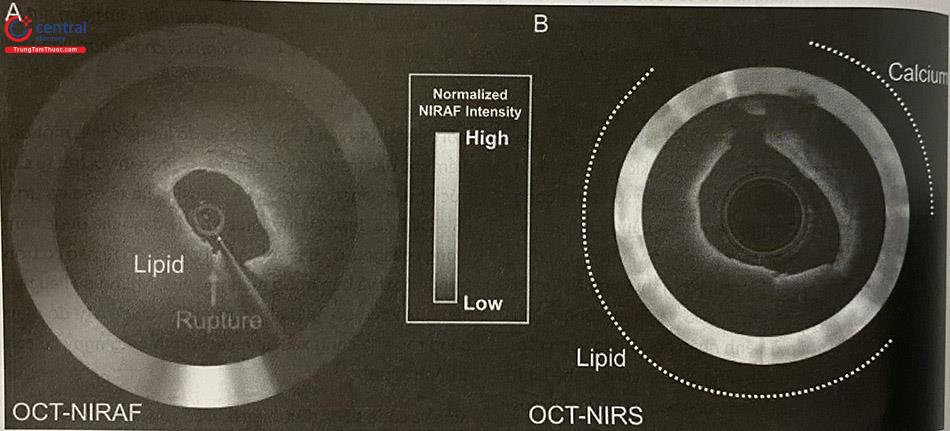
Quang phổ hồng ngoại gần OCT – NIRS trong một mẫu tử thiết, làm nổi bật khả năng phát hiện lipid của NIRS.
(Nguồn: Gary Tearney, Ali Fard, Farouc Jaffer, Giovanni Ughi)
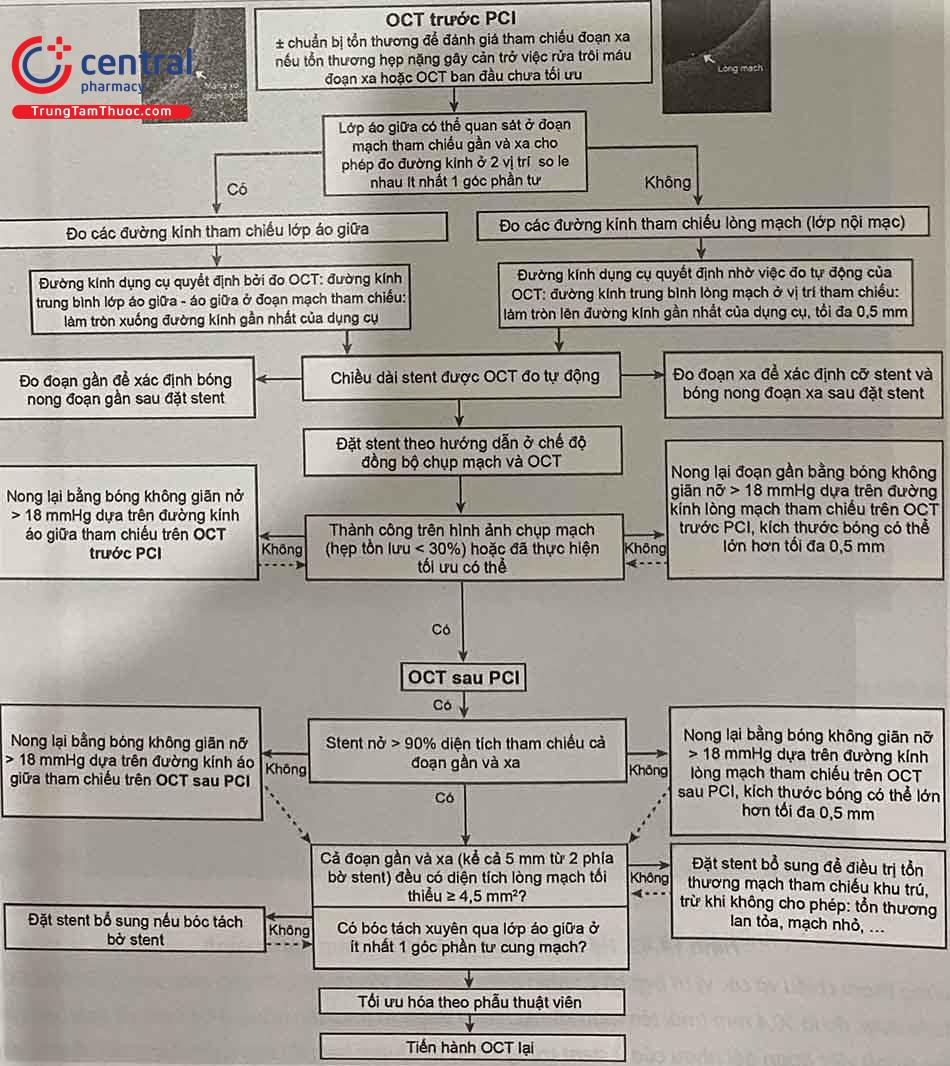
2.6 OCT trong can thiệp động mạch vành qua da
OCT được sử dụng để đánh giá tổn thương trước khi tiến hành PCI nhằm tối ưu hóa thủ thuật, giảm thiểu biến chứng, nâng cao hiệu quả điều trị, giảm nguy cơ tái hẹp về sau. Cụ thể, OCT trước can thiệp giúp phẫu thuật viên dễ dàng xác định tổn thương thủ phạm, đánh giá hình thái tổn thương, mô tả đặc điểm của vùng đặt stent, cho phép lựa chọn chính xác chiều dài và đường kính của bóng và stent. OCT sau thiệp giúp đánh giá tình trạng giãn nở, biến dạng của stent, các biến chứng kèm theo như lóc tách mạch vành cạnh stent, tụ máu trong thành…
2.6.1 Trước khi can thiệp
2.6.1.1 Đánh giá hình thái tổn thương
Đánh giá hình thái tổn thương trên OCT tạo thuận lợi cho việc chuẩn bị tổn thương. Nong bóng tạo thuận lợi bằng bóng có kích thước nhỏ hoặc đặt stent trực tiếp có thể thích hợp khi có nhiều mảng xơ lớn hoặc mảng xơ vữa nhiều lipid, trong khi đó, ở những tổn thương có mức độ vôi hóa vừa hoặc nặng, nong tạo thuận lợi bằng bóng cứng ít giãn nở, sử dụng bóng cắt, khoan phá mảng xơ vữa, hoặc tán vôi nội mạch nên được xem xét.
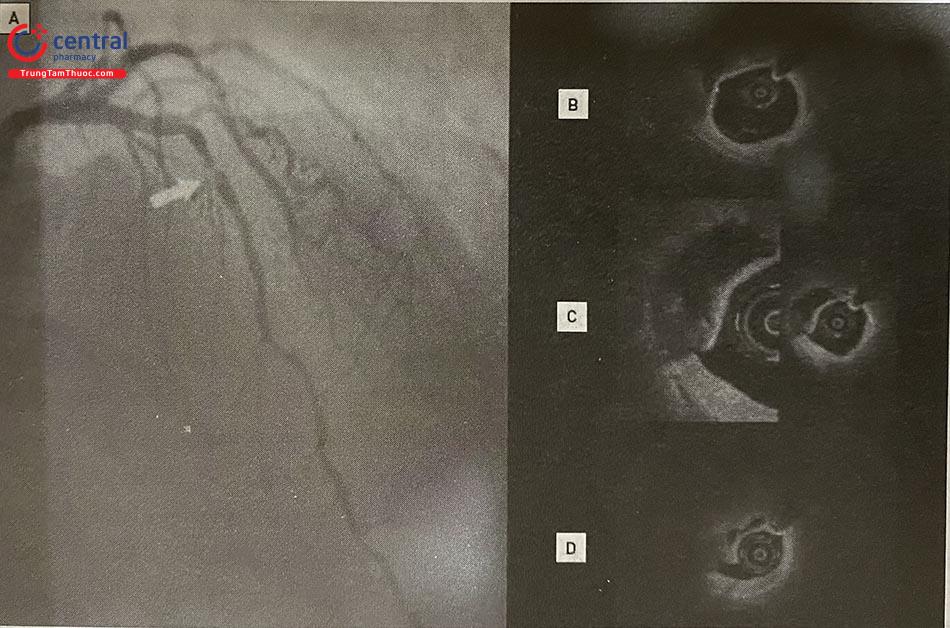
Trong các tổn thương vôi hóa, IVUS có thể phác họa được cung vôi hóa nhưng không thể xác định độ dày vì bóng cản lớn sau mảng canxi. Ngược lại, OCT cho phép xác định cả độ dày và cung vôi hóa trong hầu hết các trường hợp. Hệ thống tính điểm các tổn thương vôi hóa trên OCT giúp xác định hình thái vôi hóa nào dẫn đến việc stent không nở tối ưu gồm: độ dày mảng vôi tối đa > 0,5 mm (1 điểm), chiều dài liên tiếp của mảng vôi hóa > 5 mm (1 điểm), và 1 điểm cho vòng cung canxi lớn nhất > 50% chu vi mạch máu (nghĩa là > 180°). Các tổn thương có tổng số điểm ≥ 3 sẽ làm cho stent khó đạt được độ giãn nở tối đa, do vậy cần phải chuẩn bị tổn thương bằng khoan phá hoặc sóng siêu âm (Lithotripsy) để phá vỡ mảng vôi, trong khi các tổn thương ≤ 2 điểm thì stent có thể giãn nở dễ dàng hơn. Trong trường hợp không có các biện pháp hỗ trợ khác để chuẩn bị tổn thương, có thể sử dụng bóng để phá mảng xơ vữa với hiệu quả tốt nhất nếu góc canxi < 225° và độ dày mảng canxi tối đa là 0,24 mm. Nếu sau khi xử lý các tổn thương vôi hóa mà có hiện tượng nứt gãy mảng vôi hóa trên OCT thì stent có khả năng giãn nở tốt hơn so với không có nứt gãy. Do đó, sự hiện diện của nứt gãy mảng vôi hóa, dễ dàng xác định bằng OCT (Hình 14.39), là một mục tiêu cần đạt được khi chuẩn bị tổn thương trước khi PCI. Tuy nhiên, mối quan hệ giữa nứt gãy mảng vôi hóa trên OCT và khả năng giãn nở stent cần được nghiên cứu thêm.
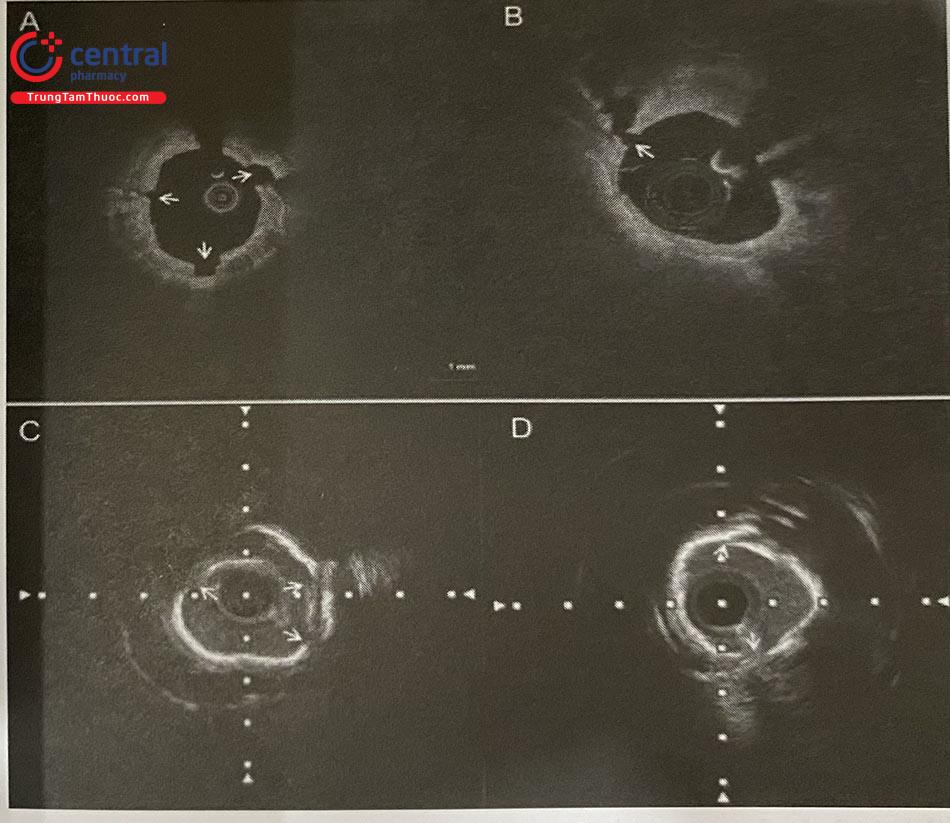
(A và B) Vị trí đứt gãy của mảng vôi hóa (đầu các mũi tên) (C và D) Mảng vôi hóa trên IVUS là các cung tăng âm và có bóng cản phía sau, các vị trí không có hiện tượng phản xạ âm là các vị trí đứt gãy. OCT: Chụp cắt lớp quang học; IVUS: Siêu âm trong lòng mạch.
2.6.1.2 Đo chiều dài tổn thương
Phần mềm OCT cung cấp hình ảnh động mạch vành dưới dạng hai chiều, kết hợp việc tái tạo đa mặt phẳng bằng dữ liệu ba chiều. Trước tiên, đường kính tham chiếu lớn nhất ở đoạn gần và xa của tổn thương trên mặt cắt ngang được sử dụng để tạo ra trường hình ảnh cần đánh giá. Sau đó, bằng cách kéo ngược qua các mặt cắt ngang của OCT giữa các vị trí này, các phân đoạn “bình thường” nhất trong vòng 5 mm được sử dụng làm khung tham chiếu đoạn gần và đoạn xa (thường là vị trí có thương tổn tối thiểu và có chất lượng hình ảnh OCT đủ tốt để hiển thị rõ ràng lớp áo giữa và áo ngoài của động mạch).
Chiều dài tổn thương được phần mềm OCT tính toán tự động, tuy nhiên do giới hạn về các kích thước sẵn có hiện nay của các loại stent nên phẫu thuật viên cần điều chỉnh chỉ số này (tăng hoặc giảm một vài mm trong giới hạn vùng lành đoạn gần hoặc đoạn xa tổn thương) để lựa chọn được stent phù hợp.
Lựa chọn chiều dài stent theo hướng dẫn của OCT giúp giảm thiểu nguy cơ lóc tách ở cạnh stent, huyết khối sớm, tái hẹp sớm sau đặt stent do bỏ sót tổn thương các tổn thương nguy cơ cao dưới nội mạc không thể nhìn thấy được bằng mắt thường.

(A) Hình ảnh chụp động mạch vành qua da. (B) và (C) Hình ảnh OCT dựng hình 3D. Đoạn mạch tham chiếu (mũi tên xám) nằm giữa mặt cắt ngang tham chiếu đoạn xa và gần, với đường kính lớn nhất được ước tính trực quan (mũi tên trắng). Vùng được xem là an toàn để đặt stent nếu tại vị trí đó có thể nhìn thấy rõ ràng lớp áo giữa mạch vành trên toàn bộ chu vi 360 độ. Phần mềm sẽ tự tính toán chiều dài tổn thương khi đã xác định vị trí đặt stent đoạn gần và đoạn xa
2.6.1.3 Đo đạc các đường kính
Hướng dẫn các bước lần lượt để đo đường kính trung bình và lựa chọn đường kính stent phù hợp được mô tả trong Hình 14.41. Điểm quan trọng cần lưu ý là việc chọn lựa đường kính stent nên sử dụng đường kính đo theo lớp áo giữa mạch vành hơn là sử dụng đường kính lòng mạch (nội mạc) để làm tham chiếu. Điều này sẽ giúp lựa chọn được stent có kích thước sai lệch thấp (≈ 0,5mm), nhờ đó diện tích lòng mạch sau đặt stent lớn hơn mà không làm tăng nguy cơ biến chứng sau thủ thuật.
Để tối ưu hóa việc ước lượng đường kính stent thì nên đo đường kính tổn thương tại ít nhất 2 vị trí khác nhau và so le nhau ít nhất 1 góc phần tư chu vi động mạch. Đường kính đo được trên OCT theo lớp áo giữa nên được làm tròn xuống để xác định kích cỡ stent. Trong trường hợp lớp áo giữa không đủ rõ ràng để làm căn cứ xác định đường kính thì có thể sử dụng đường kính lòng mạch (được đo tự động bởi phần mềm OCT), sẽ được sử dụng ước lượng kích thước stent. Vì vậy, các chỉ số này phải được làm tròn lên, trong khoảng từ 0,25 đến 0,5 mm. Các chỉ số đo ở đoạn xa dùng để xác định kích thước stent và kích thước bóng dùng để nong đoạn xa sau đặt stent, trong khi đó các chỉ số đo ở đoạn gần dùng để xác định kích thước bóng dùng để nong đoạn gần stent sau khi đặt.
2.6.1.4 Đồng bộ hóa chụp động mạch vành qua da và OCT
Phần mềm tự động đồng bộ hoạt động giữa máy chụp mạch và hệ thống OCT theo thời gian thực đã được phát triển bởi các kỹ sư để giảm thiểu tối đa sai lệch khi đo đạc và can thiệp. Phần mềm sẽ lựa chọn vị trí thích hợp đặt stent tại đoạn gần và đoạn xa, sau đó đánh dấu trên hình ảnh chụp mạch vành đã được đồng bộ trước đó giúp tối ưu hóa việc đặt stent (Hình 14.42).
Trong một nghiên cứu ngẫu nhiên, việc đồng bộ hóa này đã hỗ trợ việc triển khai stent chính xác hơn, loại bỏ được sai sót khi lựa chọn đoạn tham chiếu trên hình ảnh chụp mạch, nhờ đó giúp hạn chế đáng kể hiện tượng lóc tách ở cạnh stent. Các kết quả tương tự được báo cáo cũng cho thấy nếu chỉ sử dụng chụp mạch vành qua da đơn thuần hướng dẫn can thiệp thì có đến 70% các trường hợp bệnh nhân đặt stent có đoạn gần hoặc đoạn xa stent di lệch ít nhất 5mm so với vùng đặt stent an toàn, trong khi đó tỉ lệ này ở các bệnh nhân sử dụng phương pháp đồng bộ hướng dẫn can thiệp chỉ là 20%.
Phương pháp này cũng giúp nhanh chóng định khu được các vị trí stent giãn nở kém và giúp xác định kích thước giãn nở an toàn cần đạt được, do đó tránh được sự giãn nở quá mức, đặc biệt là gần các cạnh của stent nơi thường xảy ra hiện tượng lóc tách sau nong bóng tối ưu stent.
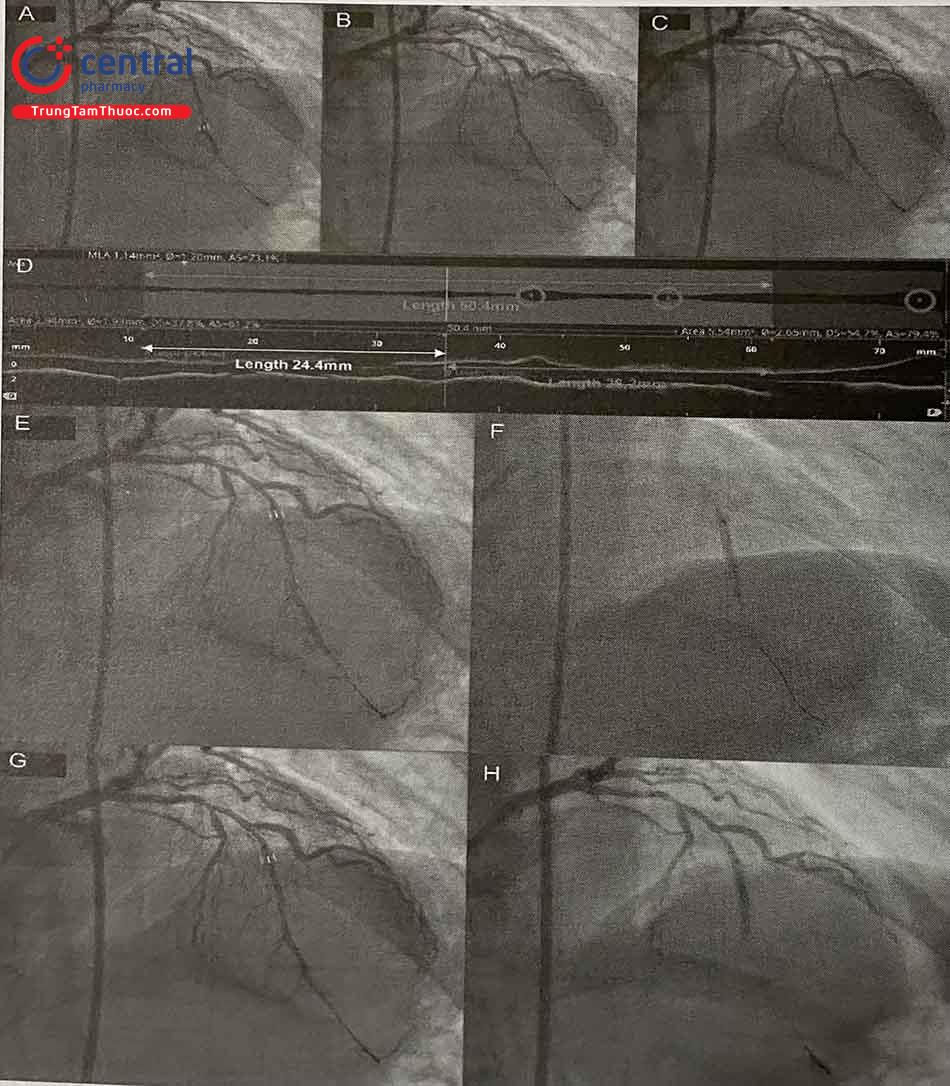
(A)(B)(C) Các vùng tham chiếu và các vị trí hẹp có ý nghĩa trên đoạn dài tổn thương (thanh màu xám); (D) Trên OCT, tổng chiều dài stent tối thiểu được đo là 50,4 mm (mũi tên màu xám),chia ra đoạn xa (mũi tên trắng, 24,4 mm) và đoạn gần (mũi tên xanh, 26,2 mm) nhằm tránh việc đoạn gối nhau của 2 stent trùng với vị trí nhánh bên; (E) Đặt stent đoạn xa (28 mm) căn cứ vào các điểm đánh dấu trên hình ảnh chụp mạch; (F)(G) Đặt stent đoạn gần tương tự (28 mm); (H) Hình chụp cản quang khẳng định 2 stent đã gối.
2.6.2 OCT sau khi đặt stent
2.6.3 OCT giúp đánh giá kết quả của việc đặt stent, giúp tối ưu hóa kết quả, đồng thời phát hiện các biến chứng để có chiến lược xử lý phù hợp.
2.6.3.1 Lóc tách mạch vành
OCT sẽ được kéo ngược dọc theo đoạn mạch vành sau can thiệp để kiểm tra loại trừ hiện tượng lóc tách và tụ máu trong thành hay không (Hình 14.43). Độ phân giải cao của OCT cung cấp rất nhiều thông tin quý giá, giúp xác định được hiện tượng lóc tách đến hơn 40% các trường hợp can thiệp, trong đó khoảng 80% không thể phát hiện được bằng chụp mạch đơn thuần. Các nghiên cứu gần đây cho thấy sự xuất hiện của lóc tách cạnh stent có ý nghĩa phát hiện được trên OCT là một yếu tố xấu dự báo tiên lượng lâu dài. Trong nghiên cứu sổ bộ CLI-OPCI, vết rách có chiều rộng > 200 μm được coi là lóc tách đáng kể, hình thái tổn thương này làm tăng 2,5 lần các biến cố tim mạch chính -MACE (tử vong, nhồi máu cơ cấp, tái thông do thiếu máu cơ tim).
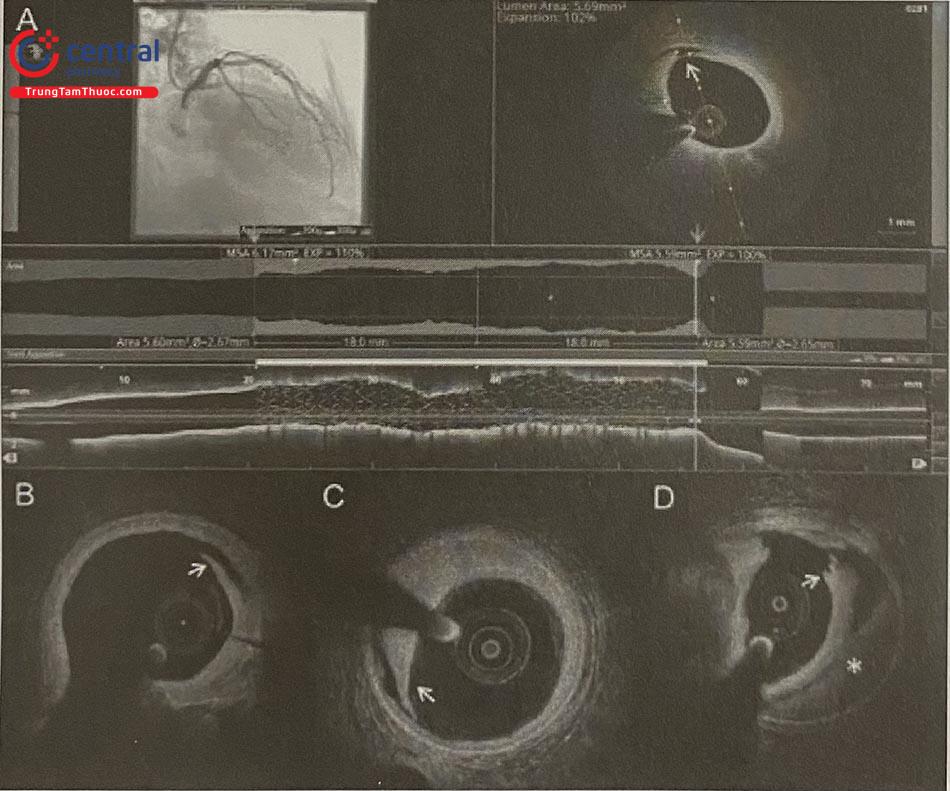
(A) Vết rách (mũi tên trắng) được phát hiện dễ dàng bằng cách xem xét nhanh các cạnh stent; (B) Các vết lóc tách giới hạn ở vùng nội mạc được xem là lành tính vì hiếm khi tiến triển; (C) Các vết lóc tách xuyên qua lớp áo giữa có thể tiến triển thành; (D) tụ máu trong thành và do đó nên được xem xét can thiệp nếu kích thước đáng kể (> 1/4 chu vi mạch), đặc biệt là ở đoạn xa stent vì tăng nguy cơ xảy ra các biến cố.
2.6.3.2 Tình trạng áp thành của stent
Stent không áp thành là tình trạng không tiếp xúc hoàn toàn của khung stent với thành mạch sau can thiệp. Hiện tượng này có thể xuất hiện ngay sau khi đặt stent (cấp tính) hoặc ở giai đoạn sau đó (không áp thành muộn). Stent không áp thành cấp tính xuất hiện khá phổ biến sau khi đặt stent, được phát hiện thấy ở 15% trường hợp bằng IVUS và với hơn 50% trường hợp bằng OCT do độ phân giải OCT cao hơn, và khả năng tự động phát hiện các vị trí mắt lưới stent không áp sát (Hình 14.44).
OCT tự động phát hiện stent không áp thành, các vị trí được phát hiện sẽ được đánh dấu màu đỏ trên phim chụp mạch vành của hệ thống đồng bộ chụp mạch – OCT (B) mặt cắt ngang (C) dựng hình chiều dọc (D) hình ảnh stent được tích hợp (đầu mũi tên chỉ là đoạn stent không áp thành). (E) Chế độ tích hợp 3D cho thấy hậu quả của việc wire đi qua các mắt stent và sau đó dùng bóng nong gây biến dạng (F) mặt cắt ngang (G) thanh ứng dụng các phép đo tự động (H) và stent được tích hợp (đầu mũi tên chỉ là đoạn không áp thành).
Ảnh hưởng của stent không áp thành cấp tính đến kết cục PCI (gồm tái hẹp và huyết khối trong stent) là vấn đề còn đang gây tranh cãi. Trong khi các thí nghiệm in vitro về sinh lý bệnh và các nghiên cứu sử dụng phương pháp hình ảnh nội mạch quy mô nhỏ ủng hộ quan điểm về có mối liên quan giữa stent không áp thành với huyết khối trong stent, một số nghiên cứu sử dụng hình ảnh nội mạch quy mô lớn hơn lại cho thấy không có mối liên quan giữa stent không áp thành đến hiện tượng huyết khối sớm, muộn hoặc rất muộn trong stent (Bảng 14.2).
Bảng 14.2. Biến cố tim mạch liên quan đến stent không áp thành
| PHƯƠNG PHÁP CHẨN ĐOÁN HÌNH ẢNH | SỐ BỆNH NHÂN (SỐ TỔN THƯƠNG) | THEO DÕI LÂM SÀNG (THÁNG) | KẾT CỤC | p | |||
|---|---|---|---|---|---|---|---|
TÁC GIẢ | TÊN NGHIÊN CỨU | IVUS | KHÔNG ÁP THÀNH* | ÁP THÀNH | |||
| Van der Hoeven | MISSION | IVUS | 184 | 12 | 0% HK | 0% HK | NS |
| Guo | HORI- ZONS-AMI | IVUS | 241 (263) | 12 | 0% TV or HK | 0% TV or HK | NS |
| Steinberg | TAXUS IV, V, VI, và ATLAS | 1,580 | 9 | 11,6% MACE | 8,8% MACE | 0,45 | |
| 24 | LASM: 8,3% MACE | 8,1% MACE | 0,87 | ||||
| Wang | ADAPT-DES | IVUS | 2,072(2,446) | 24 | 5,2% MACE | 4,5% MACE | 0,58 |
| Im | OCT | 351 (356) | 24 | LPSM vs LASM | 3,2% MACE | 1,00 | |
| Soeda | MGHOCT registry | OCT | 786 (900) | 12 | 1,7% DoCE | 2,9% DoCE | NS |
Prati | CLI-OPCI II | OCT | 832 (1,002) | 12 | MACE HR: 1,15 (0,8-1,7) | 0,52 | |
| Prati | CLI-OPCI ACS | OCT | 507 (588) | 12 | MACE HR: 0,84 (0,5-1,5) | 0,57 | |
| Romagnoli | CLI-OPCI registry | OCT | 864 (1,020) | 24 | MACE HR: 0,79 (0,5-1,2) | 0,26 | |
| Prati | CLI-OPCI LATE | OCT | 1,211 | 36 | DoCE HR: 0,92 (0,7-1,2) | 0,56 | |
| Im | OCT | 351 (356) | 96 | LSM 7,3% MACE | 10,5% MACE | 0,82 | |
LPSM vs LASM | 10,5% MACE | 0,47 | |||||
*Stent không áp thành cấp; DoCE: biến cố tim mạch liên quan đến thiết bị; LASM: huyết khối muộn liên quan đến stent không áp thành; LPSM: stent không áp thành muộn, mạn tính; LSM: stent không áp thành muộn; MACE: biến cố tim mạch chính; NS: không có ý nghĩa; HK: huyết khối trong stent, TV: tử vong.
Mặc dù tình trạng này không liên quan đến việc tăng tỷ lệ thất bại của PCI, nhưng nếu stent không áp thành ở vị trí cạnh stent có thể gây trở ngại cho việc lái wire. Nếu không áp thành trên đoạn dài (> 3 mm) hoặc do stent chưa giãn nở tối ưu thì cần phải can thiệp điều chỉnh. Vì lực cần thiết để làm stent áp thành khác với lực để bung và làm nở stent, nên việc sử dụng bóng áp lực cao có thể không cần thiết mà chỉ cần sử dụng bóng áp lực thấp hoặc bóng bán giãn nở (semi – compliant) là đủ.
2.6.3.3 Độ giãn nở của stent
Nếu sau khi đặt stent mà đường kính stent giãn nở gần bằng hoặc bằng đường kính của động mạch, thì được coi là giãn nở tốt (Hình 14.45). Theo khuyến cáo hiện nay của hội tim mạch châu Âu nếu diện tích stent tối thiểu (MSA) ≥ 80% diện tích lòng tham chiếu trung bình và/hoặc 4,5 mm2 trên OCT thì được coi là chấp nhận được. Tuy nhiên, nhiều tiêu chí về stent giãn nở phù hợp được đề xuất và tiến hành nghiên cứu, với mục tiêu chung là tối đa hóa MSA là yếu tố dự báo quan trọng nhất về kết cục PCI dài hạn. Phần mềm OCT cho phép đo đường kính, mức độ giãn nở và phát hiện các đoạn stent giãn nở chưa phù hợp một cách tự động như phần mềm AptiVue ™, được áp dụng trên hệ thống OPTIS ™ (Abbott).
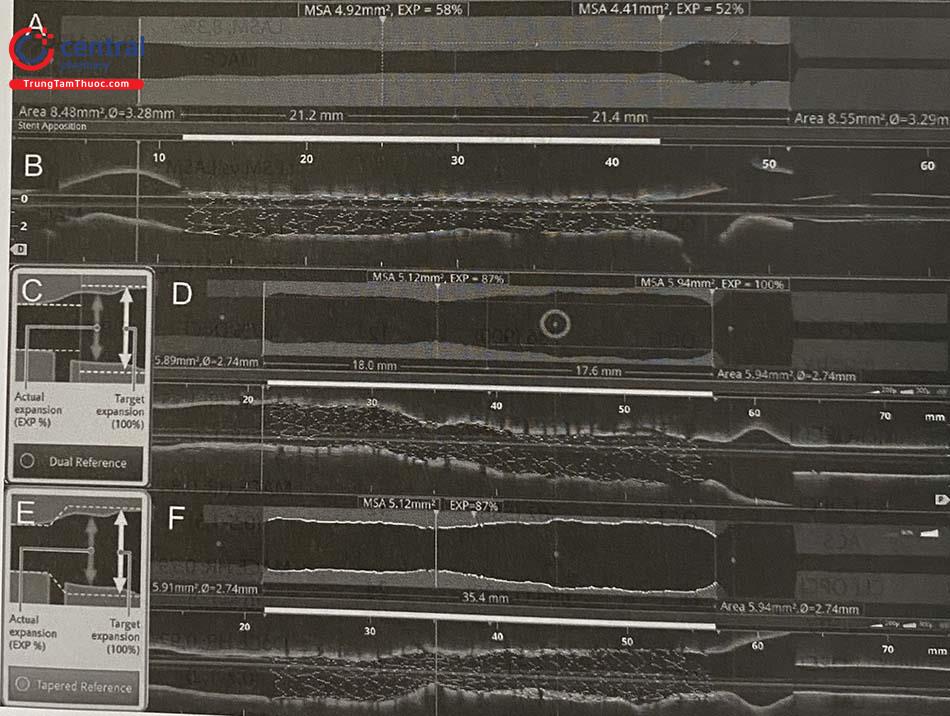
Hệ thống tự động cho thấy độ giãn nở của stent là 58% ở đoạn xa và 52% ở đoạn gần của stent; (B) Tích hợp thêm hình ảnh stent; (C) Sử dụng chế độ tham chiếu kép, stent tự động được chia thành hai nửa; (D) Độ giãn nở 87% ở đoạn xa và 100% ở đoạn gần; (E) Sử dụng chế độ tham chiếu giảm dần, độ giãn nở được tính toán dựa trên phép nội suy; (F) Độ giãn nở 87%.
Nếu đường kính mạch máu tại vị trí đặt stent sau PCI không thay đổi so với trước PCI mặc dù đã được nong bóng áp lực cao ≥18 atm, thì có thể xem như đã đáp ứng được yêu cầu tối thiểu về độ giãn nở phù hợp. Nếu cần sử dụng bóng mới thì nên dùng bóng cứng, ít giãn nở với áp lực cao (≥18 atm) để đạt được đường kính tối ưu. Sau khi đã sử dụng bóng mới mà kết quả chạy OCT sau đó vẫn chưa cho kết quả như mong đợi, việc tối ưu hóa thêm phụ thuộc vào quyết định của phẫu thuật viên. Có thể sử dụng các biện pháp đơn giản (bóng cứng, áp lực cao, thời gian lên bóng kéo dài) hoặc các thủ thuật phức tạp hơn (tán vôi hóa trong lòng mạch, laser excimer, bóng áp lực siêu cao OPN (SIS Medical, Frauenfeld, Thụy Sĩ)) để đạt được độ giãn nở tối ưu nếu cần thiết.
Sau khi tối ưu hóa độ giãn nở của stent dưới hướng dẫn của OCT, các đoạn tham chiếu gần và xa (trong vòng 5 mm tính từ các cạnh của stent) nên được kiểm tra. Nếu diện tích lòng mạch tối thiểu (MLA) ≥ 4,5 mm2, thì không cần xử lý thêm. Nếu vẫn còn tổn thương khu trú đáng kể hay MLA < 4,5 mm2 ở đoạn gần hoặc xa stent, thì nên đặt thêm stent trừ khi có hạn chế về mặt giải phẫu (ví dụ: mạch đoạn xa quá bé, tổn thương lan tỏa không có đoạn lành để đặt stent).
2.6.4 Vai trò của OCT trong hội chứng vành cấp (ACS)
Độ phân giải cao của OCT cho phép xác định các chi tiết liên quan của thương tổn giúp thiết lập chiến lược PCI phù hợp trong ACS, chẳng hạn như nứt vỡ hoặc loét mảng xơ vữa, huyết khối, lóc tách, tụ máu trong thành, nốt vôi hóa.
2.6.4.1 Nứt vỡ và loét mảng xơ vữa
Tổn thương thủ phạm phổ biến nhất ở bệnh nhân bị ACS là hiện tượng nứt vỡ mảng xơ vữa. Trên OCT, hiện tượng này được xác định sự mất liên tục của vỏ xơ khiến bể lipid tiếp xúc với lòng mạch (Hình 14.46A-Hình 14.46E). Huyết khối hình thành tại vị trí nứt vỡ khá thường gặp, nhưng không phải là yếu tố bắt buộc để chẩn đoán vì việc sử dụng sớm các thuốc chống huyết khối và chống kết tập tiểu cầu có thể làm tan huyết khối trước khi chụp mạch vành. Bên cạnh đó, các nghiên cứu bệnh học đã chứng minh loét mảng xơ vữa xuất hiện ở khoảng 20-30% bệnh nhân ACS (Hình 14.47F-Hình 14.47J). Vấn đề phân biệt giữa nứt vỡ và loét mảng xơ vữa giúp định hướng chiến lược điều trị, ví như có thể trì hoãn việc đặt stent ở những bệnh nhân có loét mảng xơ vữa mức độ nhẹ, vừa (Hình 14.48), mặc dù vậy cần thêm các kết quả từ các nghiên cứu so sánh ngẫu nhiên để có thể áp dụng rộng rãi trên lâm sàng.

(A) và (B) Chụp mạch không xác định được tổn thương thủ phạm rõ ràng. (C) Dựa trên đoạn ST chênh lên ở các chuyển đạo trước, gợi ý nhồi máu cơ tim với động mạch vành không tắc nghẽn (MINOCA), OCT được thực hiện ở nhánh LAD, xác định (D) huyết khối tại vị trí lỗ vào nhánh vách đầu tiên (đầu mũi tên). Sau khi hút huyết khối (E), lặp lại OCT cho thấy sự xuất hiện điển hình của hình ảnh “miệng núi lửa” với bề mặt bên trong nhẵn (đầu mũi tên).
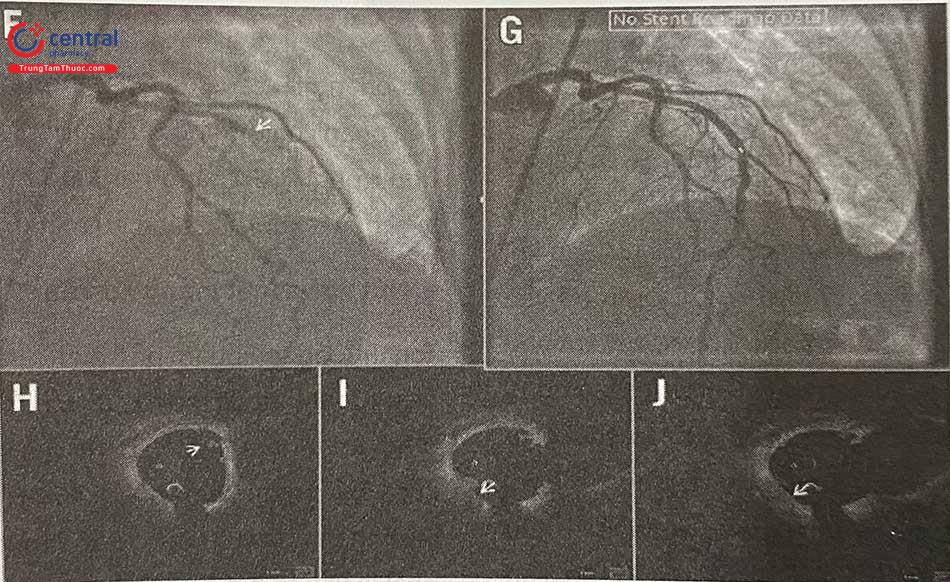
(F) Chụp mạch xác định tắc ở đoạn giữa LAD (đầu mũi tên). (G) Sau khi hút huyết khối cho thấy mạch đã thông (H) huyết khối trắng (đầu mũi tên) không có mảng bám bên dưới bị vỡ. (I) và (J) Đáng chú ý, huyết khối màu trắng dính vào một mảng xơ mỏng có độ giảm tín hiệu cao (low attenuation) (đầu mũi tên), cho thấy khả năng cơ chế gây nhồi máu cơ tim là loét mảng xơ vữa. Bệnh nhân được bắt đầu điều trị kháng tiểu cầu kép và không đặt stent
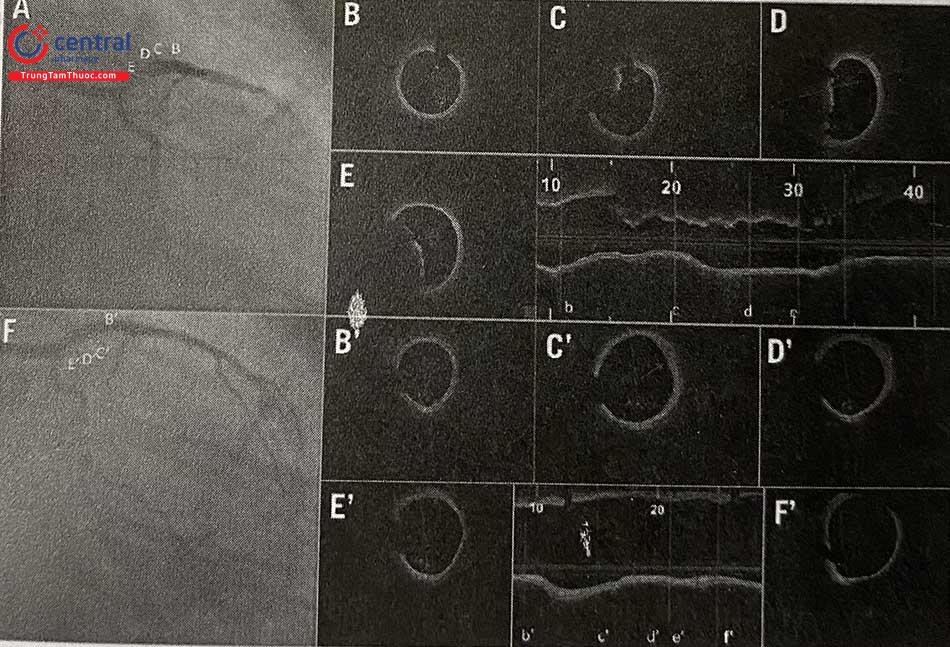
(A) Chụp động mạch vành cho thấy tổn thương nghi ngờ ở đoạn gần động mạch liên thất trước (LAD). Trên hình ảnh OCT cắt ngang và dọc (B, b) cho thấy một đoạn bình thường ở đoạn giữa LAD nhưng tại (C-E, c-e) có huyết khối lớn không gây tắc (diện tích lòng mạch tối thiểu: 9 mm2). Bệnh nhân được điều trị bằng thuốc kháng glycoprotein IIb/IIIa trong 48 giờ và sau đó được xuất viện khi điều trị với warfarin, Aspirin và Clopidogrel. Bệnh nhân quay lại chụp mạch và OCT sáu tuần sau đó. Trên mặt cắt và dọc tại các vị trí giống lần thứ 1 có (B’, b’) và một đoạn mạch LAD bình thường và (C’-F ‘, c’-f’) cho thấy sự phân giải hoàn toàn của huyết khối và có thể vị trí loét đã lành lại (C’, c’). (Nguồn Mullasari Ajit Sankardas, MD, DM, FRCP).
Tiêu chí mô bệnh học quan trọng để xác định hiện tượng loét mảng xơ vữa là sự vắng mặt của lớp nội mô phủ phía trên. Mặc dù có độ phân giải cao, nhưng OCT không thể đánh giá sự hiện diện của sự gián đoạn nội mạc. Do đó, chẩn đoán trên OCT chủ yếu dựa vào việc loại trừ vỏ xơ bị vỡ. Một số dấu hiệu gợi ý loét mảng xơ vữa có thể quan sát thấy trên OCT là (a) cục huyết khối màu trắng trên nắp vỏ xơ nguyên vẹn, (b) không có huyết khối nhưng có bề mặt lòng mạch không đều, hoặc (c) huyết khối kèm giảm tín hiệu phía sau trong trường hợp không có mảng xơ vữa đi kèm hoặc mảng vôi hóa và mảng lipid ngay đầu gần hoặc đầu xa vị trí huyết khối. Loét mảng xơ vữa có thể được xem “xác định” khi có hình ảnh huyết khối trên một nắp xơ nguyên vẹn hoặc “có thể xảy ra” trong trường hợp không có huyết khối hoặc nứt vỡ nhưng bề mặt nội mạc không đều.
2.6.4.2 Nốt vôi hóa
Các nốt vôi hóa là nguyên nhân ít phổ biến nhất của ACS. Tuy vậy, các nghiên cứu về bệnh học và hình ảnh học đã xác nhận sự tồn tại của các nốt vôi hóa và tác động lâm sàng của chúng trong ACS. Có 3 loại hình thái khác nhau của nốt vôi hóa gồm (Hình 14.49) :
- Mảng vôi hóa dạng phun trào (chiếm 25,5%): đặc trưng bởi tổn thương canxi nhỏ xù xì lồi vào lòng mạch
- Mảng vôi hóa dạng lồi (chiếm 67,4%): tổn thương canxi lồi vào lòng mạch nhưng có bề mặt nhẵn.
- Mảng vôi hóa dạng tấm (chiếm 7,1%): được xác định là mảng canxi hóa bề mặt giống như một tấm phẳng với sự nứt vỡ tối thiểu hoặc không có sự nứt vỡ của mô xơ bên cạnh và chỉ gây hẹp nhẹ lòng mạch.
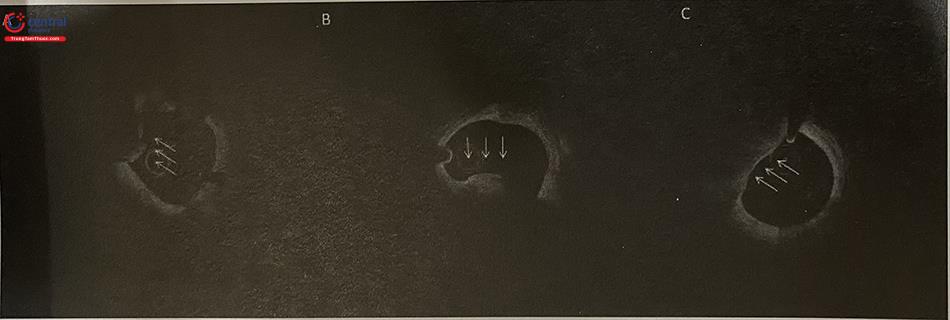
(A) mảng vôi hóa dạng phun trào; (B) mảng vôi hóa dạng lồi; (C) mảng vôi hóa dạng tấm phẳng.
Trong phân loại này, các mảng vôi hóa dạng phun trào được chứng minh là nguyên nhân gây ra hội chứng vành cấp (ACS) trong các nghiên cứu mô bệnh học, trong khi mảng vôi hóa dạng tấm phẳng và dạng lồi không được cho là nguyên nhân của ACS. Thật vậy, một nghiên cứu gần đây của Prati và cộng sự đã chỉ ra rằng các nốt vôi hóa có sự phá vỡ của bao xơ làm tăng nguy cơ tử vong do tim mạch cao gấp gần 6,5% so với những tổn thương không có sự phá vỡ. Tuy nhiên, cả ba loại mảng vôi hóa đều có thể làm tăng nguy cơ biến chứng quanh thủ thuật đồng thời giảm sự tối ưu hóa kết quả PCI so với các tổn thương không có mảng vôi hóa (Hình 14.50). Các nốt vôi hóa dạng phun trào thường nằm ở động mạch vành phải (44,4%), trong khi các nốt vôi hóa bề mặt thường thấy ở động mạch liên thất trước (68,4%).
2.6.4.3 Lóc tách và tụ máu trong thành
Các hình thái lóc tách tự nhiên và tụ máu trong thành động mạch vành ở bệnh nhân bị hội chứng vành cấp cũng có thể được xác định dễ dàng trên OCT (Hình 14.51).
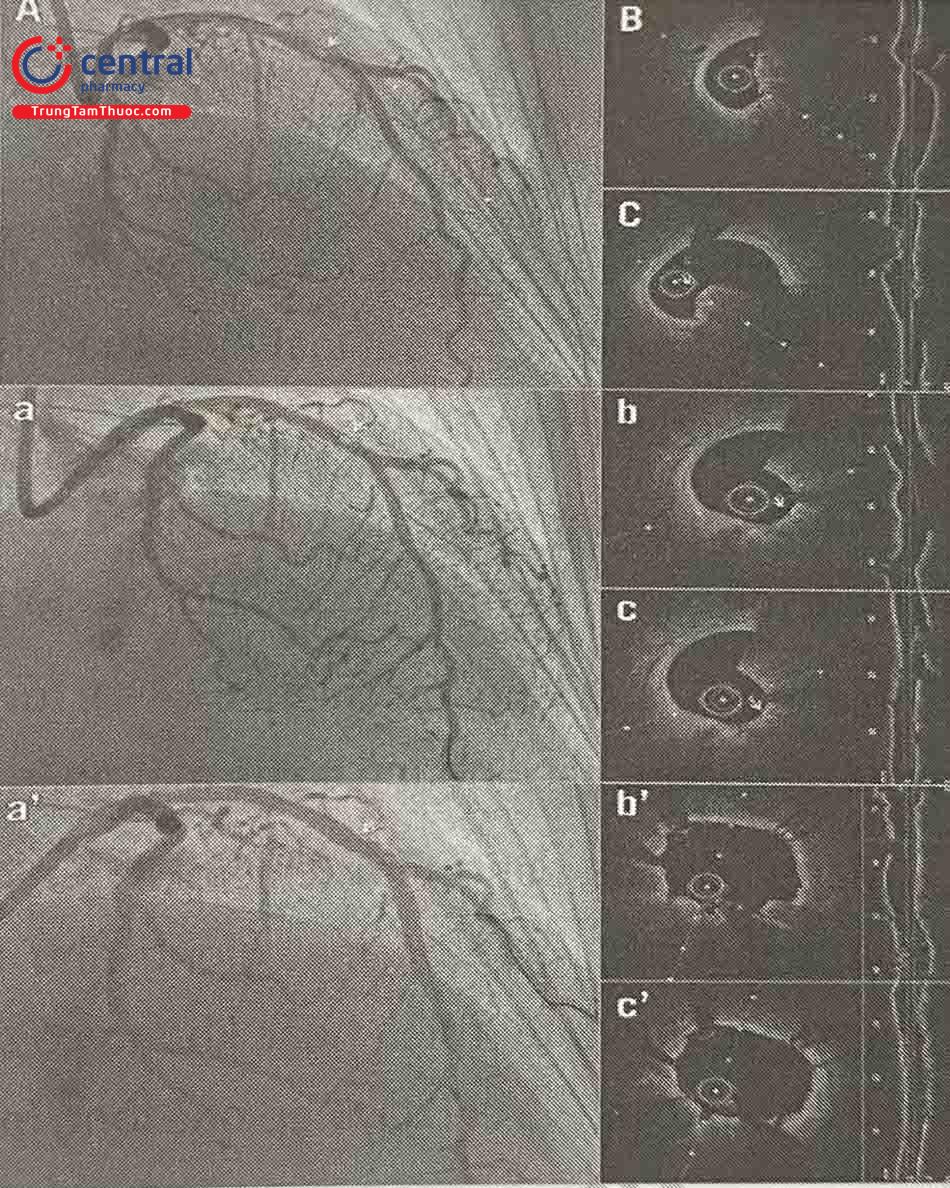
Chụp mạch cho thấy tổn thương dạng nốt gây hẹp mạch tại đoạn giữa LAD (đầu mũi tên). (B) Hình ảnh OCT cho thấy vị trí lòng mạch hẹp nhất và (C) xác nhận nguyên nhân của hẹp mạch là một nốt lồi vôi hóa (đầu mũi tên). (a) Sau khoan cắt nốt vôi, tổn thương đã giảm thiểu so với hình ảnh chụp mạch (đầu mũi tên). (b, c) Hình OCT cho thấy nốt vôi hóa bị vỡ ra đáng kể (đầu mũi tên). (a’) Cho thấy chỉ còn tồn dư mức độ nhẹ (đầu mũi tên). (b’, c’) Hình ảnh OCT xác nhận stent đã nở ra tốt hơn và không còn thấy hình vôi hóa, với độ lệch tâm và stent chưa áp thành ở mức tối thiểu.
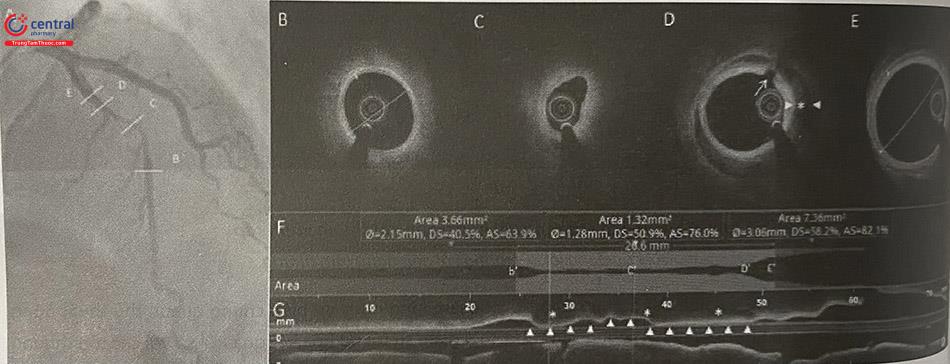
Tổn thương gây hẹp ở đoạn giữa (B) – (E) Hình ảnh mặt cắt ngang OCT của các đoạn xa (B) và đoạn gần (E) gần như bình thường, hình ảnh gián đoạn nội mạc (mũi tên) và tụ máu trong thành (*) trong lòng giả ở lớp áo giữa (các đầu mũi tên) trên mặt cắt (D), gây hẹp có ý nghĩa lòng mạch (C). (F) Chiều dài của đoạn lóc tách và đường kính và diện tích hẹp được hiển thị tự động theo trục dọc (G), chiều dài của các đoạn hẹp (đầu mũi tên) và phạm vi lan rộng của tụ máu trong thành (dấu *).
2.6.4.4 Vai trò của OCT trong bệnh cảnh MINOCA
Gần đây, OCT đã được ứng dụng khá hiệu quả trong chẩn đoán nhồi máu cơ tim không có hẹp tắc động mạch vành (MINOCA). Đặc biệt ở các bệnh nhân nữ giới bị MINOCA (có thương tổn động mạch vành nhưng hẹp < 50% đường kính trên chụp mạch), OCT có thể xác định được tổn thương nghi ngờ là thủ phạm ở khoảng 46% các trường hợp. Các hình thái tổn thương phổ biến được phát hiện bởi OCT là nứt vỡ mảng xơ vữa, lõi hoại tử nằm trong mảng xơ vữa và mảng xơ vữa không đồng nhất (Hình 14.52). Tương tự, ở những bệnh nhân bị nhồi máu cơ tim (NMCT) không có đoạn ST chênh lên (NMCT không ST chênh) và tổn thương nhiều thân ĐMV, đôi khi chỉ chụp động mạch đơn thuần là không đủ để xác định tổn thương thủ phạm, OCT cũng rất hữu ích khi cung cấp các thông tin bổ sung hỗ trợ chẩn đoán.
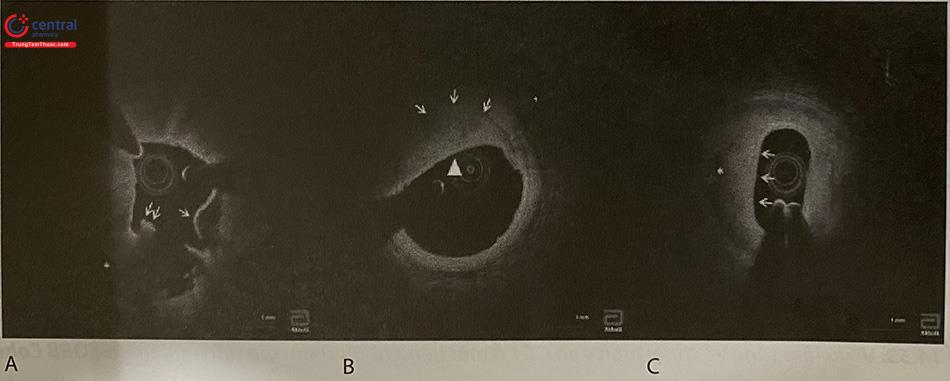
(A): Mảng xơ vữa nứt vỡ: Hình ảnh mất liên tục của một nắp xơ mỏng (mũi tên). Bên cạnh là cục huyết khối đỏ tiếp giáp với vị trí vỡ (mũi tên kép). Phía dưới là mảng lipid (*) (B) Mảng xơ vữa có lõi hoại tử: vùng giảm tín hiệu kèm huyết khối và /hoặc hiện tượng thuốc cản quang thâm nhập vào lõi hoại tử đã vỡ (đầu mũi tên), bên ngoài là lớp vỏ có tính tán xạ cao (mũi tên) (C) Mảng xơ vữa nhiều lớp không đồng nhất: có một lớp không đồng nhất (mũi tên) phủ lên trên bể lipid (*) cho thấy mảng xơ vữa đã từng bị nứt vỡ nhưng tự lành.
2.6.5 Vai trò của OCT trong theo dõi kết quả đặt stent (ngắn hạn và dài hạn)
OCT rất hữu ích trong việc theo dõi kết quả đặt stent sinh học tự tiêu, đặc biệt là trong đánh giá tân sinh, sự thay đổi cấu trúc của khung stent, tìm hiểu cơ chế đặt stent thất bại và huyết khối trong stent.
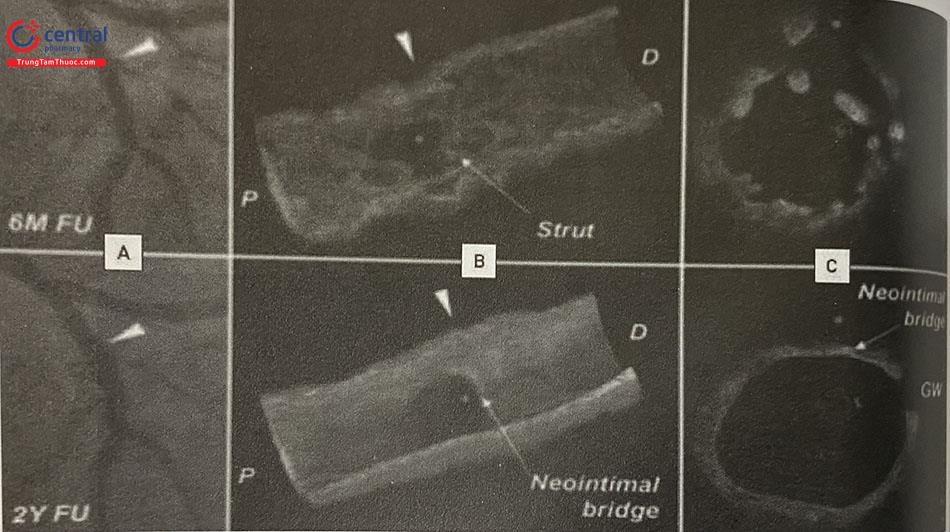
Chụp động mạch vành; (B) Kết xuất 3D OCT; (C) Hình cắt ngang OCT thể hiện sự thay đổi khung stent theo thời gian. Sau hai năm, khung stent không còn nhìn thấy rõ trong khi lỗ vào nhánh bên đã mở rộng ra. Chú thích: 6M FU: theo dõi sau 6 tháng (6 months follow-up); 2Y FU: theo dõi sau 2 năm (2 years follow-up); P: đoạn tham chiếu gần (proximal); D: đoạn tham chiếu xa (distal); Strut: khung stent; Neointimal bridge: cầu nội mạc tân sinh; GW: guidewire.
(Okamura et al Eur Heart J. 2010. Nguồn ảnh OCT: St. Jude / LightLab Imaging M3 & C7XR)
Viêm mạn tính và suy giảm chức năng nội mô cùng với tăng hấp thu lipid góp phần vào sự phát triển tân sinh muộn trong stent, đây là cơ chế gây tái hẹp stent và huyết khối trong stent muộn (> 30 ngày) và rất muộn (> 12 tháng). Việc đặt stent sai vị trí và không giãn nở tối ưu liên quan đến huyết khối stent cấp tính (< 24 giờ sau PCI) và huyết khối stent bán cấp (1-30 ngày). Điều quan trọng cần lưu ý là các dữ liệu OCT về huyết khối trong stent có thể liên quan về mặt cơ học, tuy nhiên đây cũng mới chỉ là khả năng chứ chưa thể khẳng định được. Dựa trên những quan sát này, các hướng dẫn của Hiệp hội Tim mạch châu Âu về tái thông mạch máu khuyến cáo rằng, trong trường hợp đặt stent thất bại, nên xem xét sử dụng OCT để xác định và có biện pháp xử lý các yếu tố cơ học ảnh hưởng.
2.7 Những hạn chế và các loại nhiễu ảnh OCT
Để phân tích chính xác hình ảnh OCT, bên cạnh chất lượng hình ảnh thì việc xác định các hình ảnh nhiễu cũng rất quan trọng. Một số dạng nhiễu ảnh có thể được loại bỏ với những điều chỉnh thích hợp trong quá trình làm thủ thuật.

Máu trong lòng ống thông; B: Bơm rửa máu không tốt; C: Giả loét; D: Giả huyết khối, E: Sa ống thông; F,G: Méo ảnh không đồng dạng (NURD); H: Giả lớp vỏ xơ vữa mỏng (TCFA).
Hình ảnh nhiễu trên OCT được phân loại gồm nhiễu ảnh liên quan đến truyền ánh sáng trong ống thông, lòng ống hoặc thành mạch, hoặc liên quan đến vị trí và chuyển động của ống thông (Hình 14.54). Đôi khi, bản thân lòng mạch hoặc thành phần ở thành mạch làm suy yếu nhanh tín hiệu OCT, gây ra sự xuất hiện của bóng cản làm giảm cường độ của tín hiệu OCT trong thành động mạch. Hệ thống bơm rửa máu không đủ tạo ra các khu vực giàu tín hiệu trong lòng mạch, gây ra nhiễu làm giảm cường độ tín hiệu OCT tới thành động mạch (Hình 14.54A, Hình 14.54B). Ngoài ra, máu xoáy, đặc biệt là ở thời điểm đầu hoặc cuối của pha kéo ngược, có thể tạo ra hình ảnh giống huyết khối hoặc loét mảng xơ vữa (Hình 14.54C, Hình 14.54D). Huyết khối màu đỏ làm suy giảm chùm tia sáng từ OCT, trong khi khung stent bằng kim loại và dây dẫn hướng dẫn cản toàn bộ chùm tia này, tạo bóng cản trên thành mạch.
Vị trí ống thông trong lòng mạch và đường kính mạch có thể ảnh hưởng đến hình ảnh OCT. Ống thông có thể sa xuống nếu dùng lực quá mức (Hình 14.54E). Ngoài ra, sự di chuyển của ống thông OCT, do tốc độ quay và kéo ngược, có thể làm thay đổi hình ảnh OCT. Hiện tượng méo ảnh không đồng dạng (NURD) xuất hiện trên mặt cắt ngang như vết gãy thành mạch nhưng vẫn giữ nguyên các lớp thành mạch và trên mặt cắt dọc như những vệt mờ hoặc nhòe theo hướng vào trong lòng mạch. Hiện tượng méo ảnh không đồng dạng xảy ra do lực cản việc quay trong ống thông do mạch quanh co hoặc hẹp, van tĩnh điện không chặt hoặc vỏ bọc ống thông bị gấp khúc (Hình 14.54F, Hình 14.54G). Khi ống thông OCT được đặt gần thành động mạch khiến cho ánh sáng được phát ra song song với bề mặt mô, phần đó của thành động mạch có thể làm suy giảm ánh sáng khi thực tế chùm tia quang học không xuyên qua vùng đó. Loại nhiễu này có thể bị nhầm lẫn với sự xuất hiện của các mảng xơ vữa có vỏ xơ bao quanh mỏng (TCFA), đại thực bào, vùng lipid hoặc lõi hoại tử (Hình 14.54H).
OCT có một số hạn chế nhất định như không đánh giá được vị trí lỗ động mạch vành (trên thành động mạch chủ). Nhược điểm này thuộc về mặt kỹ thuật do khó đạt được việc loại bỏ máu tối ưu tại vị trí này. Sử dụng các kỹ thuật như rút ống thông can thiệp nhẹ nhàng trong khi bơm cản quang, mặc dù hữu ích, nhưng cũng không đạt được việc loại bỏ máu tối ưu. Một số tác giả đã báo cáo các kinh nghiệm sử dụng OCT để hướng dẫn PCI ở thân chung động mạch vành trái, có vẻ khả thi đối với các tổn thương nằm ở đoạn giữa và đoạn xa nhưng vẫn còn hạn chế với vị trí lỗ vào ngay cả với phẫu thuật viên có nhiều độ kinh nghiệm.
2.8 Các nghiên cứu về hiệu quả của OCT
Trong các thử nghiệm ngẫu nhiên, IVUS hướng dẫn can thiệp động mạch vành qua da (PCI) làm giảm các biến cố tim mạch chính và trong các phân tích tổng hợp còn làm giảm được tỷ lệ tử vong do tim mạch, nhồi máu cơ tim (NMCT) và huyết khối trong stent so với chụp mạch vành đơn thuần. Sự khác biệt giữa IVUS và OCT nằm ở giá trị tương đối của từng phương pháp, ứng dụng cụ thể vào các loại tổn thương và các tình huống lâm sàng khác nhau.
Vì OCT mới được đưa vào sử dụng, nên hiện còn thiếu các bằng chứng mạnh mẽ khi so sánh với IVUS. Các thử nghiệm đã hoàn thành về sử dụng OCT hướng dẫn PCI được thể hiện trong Bảng 14.3. Trong các nghiên cứu sớm nhất, OCT đã được chứng minh là có tác động đáng kể đến chiến lược can thiệp. Trong thử nghiệm CLI-OPCI trên 670 bệnh nhân so sánh PCI hướng dẫn bằng chụp mạch với OCT, các tổn thương có ý nghĩa cần can thiệp thêm được xác định trong 35% trường hợp sử dụng OCT. Hơn nữa, PCI dưới hướng dẫn của OCT còn làm giảm nguy cơ NMCT hoặc tử vong do tim sau một năm theo dõi.
Bảng 14.3. Tổng hợp các nghiên cứu so sánh hiệu quả can thiệp dưới hướng dẫn OCT
| NGHIÊN CỨU | THIẾT KẾ | SO SÁNH VÀ CỠ MẪU | KẾT CỤC CHÍNH | KẾT QUẢ |
|---|---|---|---|---|
| CLI-OPCI | RCT | 335 OCT với 335 PCI bằng chụp mạch vành đơn thuần | Tử vong do tim mạch và nhồi máu cơ tim không tử vong trong 1 năm | OCT làm giảm tử vong tim mạch (1,2% với 4,5%; p=0,010), tử vong tim mạch hoặc NMCT (6,6% với 13,0%; p=0,006), |
| ILUMIEN III: OPTIMIZE PCI | RCT | 158 OCT với 146 IVUSvới 146 PCI bằng chụp mạch vành đơn thuần | MSA đánh giá bằng OCT sau PCI | MSA trung bình trên OCT 5,79 mm² (IQR 4,54-7,34), IVUS 5,89 mm² (4,67- |
Buccheri và CS | Phân tích gộp | 31 trung tâm với 17.882 bệnh nhân | Tử vong do mọi nguyên nhân trong 36 tháng | Giảm có ý nghĩa MACE: IVUS (OR 0,79; 95% CI: 0,67-0,91); OCT (OR 0,68; 95% |
DOCTORS | RCT | 120 OCT với 120 PCI bằng chụp mạch vành đơn thuần | Chỉ số FFR sau PCI | FFR cao hơn khi sử dụng OCT hướng dẫn PCI (0,94±0,04 với 0,92±0,05, p=0,005) |
| Pan-London PCI cohort | Sổ bộ | 1.149 OCT với 10.971 IVUS- với 75.046 PCI bằng chụp mạch vành đơn thuần | Tử vong do mọi nguyên nhân trong 4,8 năm | Giảm tử vong khi sử dụng OCT hướng dẫn PCI (7,7%) với IVUS (12,2%) hoặc chụp mạch đơn thuần (15,7%, p<0,0001) |
| OPINION | RCT | 414 OCT với 415 IVUS hướng dẫn PCI | Thất bại tổn thương đích (TLF) trong 1 năm | TLF của PCI sử dụng OFDI (5,2%) không dưới khi sử dụng IVUS (4,9%) (HR 1,07; 95% CI: 1,80; p=0,042). |
| OCCUPI (NCT03625908) | RCT | OCT với chụp mạch đơn thuần hướng dẫn PCI trên 1.604 bệnh nhân | MACE trong 1 năm | Tổn thương phức tạp: hội chứng vành cấp, CTO, tổn thương dài, chiều dài stent dự kiến ≥28 mm, tổn thương vôi hóa, chia đôi, thân chung không bảo vệ, mạch nhỏ (<2,5 mm), huyết khối trong lòng mạch vành, huyết khối stent, tái hẹp stent |
| OCTIVUS (NCT03394079) | RCT | OCT với chụp mạch đơn thuần PCI trên 2.000 bệnh nhân | TVF trong 1 năm | Nghiên cứu nhãn mở |
| ILUMIEN IV | RCT | OCT với chụp mạch đơn thuần hướng dẫn PCI trên 2.550 bệnh nhân nguy cơ PCI cao | MSA đánh giá bằng OCT sau PCI; TVF trong 1-2 năm | Nguy cơ lâm sàng cao: đái tháo đường. |
| OCTOBER | RCT | OCT với chụp mạch đơn thuần hướng dẫn PCI trên 1.200 tổn thương chỗ chia đôi phức tạp | MACE trong 2 năm | Sử dụng kĩ thuật 2 stent hoặc 1 stent có kissing bóng |
Chú thích: RCT: Ngẫu nhiên có đối chứng; PCI: Can thiệp động mạch vành qua da; MACE: Biến cố tim mạch lớn; NMCT: Nhồi máu cơ tim; NSTEMI: Nhồi máu cơ tim không ST chênh; STEMI: Nhồi máu cơ tim ST chênh lên; CTO: Tắc hoàn toàn mạn tính (động mạch vành); OCT: Chụp cắt lớp quang học; MSA: Diện tích stent tối thiểu; TVF: Tử vong do tim.
Thử nghiệm OPINION 22, bao gồm 829 bệnh nhân, là thử nghiệm ngẫu nhiên đánh giá kết quả lâm sàng đầu tiên so sánh PCI có hướng dẫn của OCT và IVUS. Mặc dù kết cục chính không có sự khác biệt ý nghĩa giữa hai phương pháp (OCT không kém hơn so với IVUS). Tương tự, các tiêu chí phụ cũng không khác nhau ở thời điểm 8 tháng. Tuy nhiên trong nghiên cứu này việc lựa chọn kích thước stent trên IVUS theo chỉ số đường kính lớp áo giữa, trong khi với OCT, stent được chọn dựa đường kính lòng mạch do việc xác định lớp áo giữa trên OCT khó hơn trên IVUS, đặc biệt khi có mảng bám lipid. Thử nghiệm OPINION và các nghiên cứu trước đây đã chỉ ra rằng lựa chọn kích thước stent dựa trên đường kính lớp áo giữa dẫn đến việc lựa chọn bóng và stent có đường kính lớn hơn so với việc chọn stent theo đường kính lòng mạch. Vì diện tích lòng mạch tối thiểu thấp hơn đã được chứng minh là nguyên nhân chính làm tăng tỉ lệ tái hẹp stent muộn, nên sự khác biệt về phương thức chọn đường kính stent trong các nghiên cứu trước đây có thể là bất lợi cho OCT so với IVUS.
Nghiên cứu ILUMIEN III can thiệp mạch vành dưới hướng dẫn của OCT hoặc IVUS hoặc chỉ chụp mạch đơn thuần lại lựa chọn đường kính stent dựa vào đường kính lớp áo giữa. Trong 450 bệnh nhân, nhánh sử dụng OCT không thua kém PCI có hướng dẫn IVUS về tiêu chí MSA muộn (nhưng không vượt trội so với chụp mạch); tuy nhiên, lóc tách cạnh stent phát hiện bằng OCT (vết lóc tách > 60° hoặc chiều dài > 3 mm) ít hơn ở nhóm can thiệp dưới hướng dẫn OCT so với nhóm sử dụng IVUS. Thêm vào đó, ở nhóm OCT cũng ghi nhận stent giãn nở tốt hơn, kích thước bóng nong sau đặt stent tối đa lớn hơn và áp lực bóng cao hơn khi so sánh với chụp mạch đơn thuần. Kết quả lâm sàng trong một năm theo dõi là tương tự nhau ở cả 3 nhóm, mặc dù thử nghiệm này không đủ mạnh để đánh giá thêm bất kỳ sự khác biệt nào.
Những dữ liệu ý nghĩa hơn về cải thiện kết cục lâm sàng khi can thiệp dưới hướng dẫn OCT đến từ một phân tích gộp lớn với 17.882 bệnh nhân. Trong phân tích này, đã cho thấy OCT làm giảm đáng kể cả về các biến cố tim mạch chính và tỷ lệ tử vong do tim mạch PCI có hướng dẫn bằng OCT hoặc IVUS so với chụp mạch đơn thuần. Các kết quả này được củng cố thêm từ báo cáo từ nghiên cứu sổ bộ Pan-London. Các bệnh nhân sử dụng OCT hướng dẫn PCI có tỷ lệ thành công của thủ thuật cao hơn và giảm tỷ lệ các biến cố tim mạch nghiêm trọng tại bệnh viện. Một sự khác biệt đáng kể về tỷ lệ tử vong cũng được quan sát thấy ở những bệnh nhân được PCI có hướng dẫn OCT (7,7%) so với những bệnh nhân PCI có hướng dẫn IVUS (12,2%) hoặc chụp mạch đơn thuần (15,7%) (p <0,0001).
2.9 Độ an toàn và biến chứng của OCT
Mức năng lượng sử dụng OCT tương đối thấp (công suất đầu ra trong khoảng 5,0-8,0 mW) và không có khả năng gây tổn thương chức năng hoặc cấu trúc cho mô. Do đó, các vấn đề an toàn chủ yếu xuất phát từ việc bơm rửa máu để thu nhận hình ảnh.
Một nghiên cứu được công bố gần đây đã đánh giá tính an toàn và tính khả thi của OCT ở 76 bệnh nhân trên lâm sàng bằng cách sử dụng kỹ thuật gây tắc mạch đoạn gần. Thời gian tắc mạch vành là 48,3+13,5 giây. Các biến chứng thường gặp nhất thường chỉ thoáng qua, chẳng hạn như cảm giác khó chịu ở ngực, nhịp tim chậm hoặc nhanh, và thay đổi ST-T trên điện tâm đồ, tất cả đều hồi phục ngay sau thủ thuật; không có biến chứng lớn, bao gồm nhồi máu cơ tim, tái thông mạch khẩn cấp hoặc tử vong. Các tác giả cũng báo cáo không thấy các biến chứng thủ thuật cấp tính như tắc mạch cấp tính, lóc tách, huyết khối.
Sự ra đời của kỹ thuật không gây tắc mạch trong thực hành lâm sàng đã làm giảm đáng kể thời gian tiến hành thủ thuật, tỷ lệ đau ngực và thay đổi điện tâm đồ trong quá trình thu nhận hình ảnh. Những tác dụng phụ này được giảm bớt khi sử dụng các hệ thống OCT dùng nguyên lý miền Fourier. Trong OCT miền Fourier, tốc độ kéo ngược cao lên đến 40 mm/s cho phép thu thập dữ liệu của một đoạn mạch vành dài trong vòng vài giây và làm giảm thiểu thời gian thiếu máu cơ tim. Imola và cộng sự đã đề cập đến tính an toàn của FD-OCT trong 114 tổn thương được làm OCT, được thực hiện trên 90 bệnh nhân. Thủ tục thành công trong 99% các trường hợp, không có bệnh nhân nào bị tổn thương thận và không có biến chứng lớn nào được ghi nhận. Chỉ có một bệnh nhân bị co thắt mạch thoáng qua được giải quyết khi sử dụng nitrat nội mạch. Trong quá trình thu nhận hình ảnh FD-OCT, không có biến đổi điện tâm đồ nào do thiếu máu cục bộ xảy ra. Rối loạn nhịp không phải nhịp thất chỉ được tìm thấy ở 3 bệnh nhân trong khi các rối loạn nhịp tim nguy hiểm khác (nhịp nhanh thất hoặc rung thất) không xuất hiện.
3 Phân số dự trữ lưu lượng vành (FFR)
3.1 Sơ lược về lịch sử phát triển
Mục tiêu điều trị bệnh mạch vành là cải thiện triệu chứng và tiên lượng của người bệnh. Trong trường hợp bệnh nhân có hội chứng vành cấp, tái tưới máu mạch vành là chiến lược hàng đầu để điều trị triệu chứng và giảm các biến cố tim mạch sau đó. Với bệnh nhân đau ngực ổn định hay bệnh nhân nghi ngờ bệnh mạch vành, điều quan trọng là cần trả lời câu hỏi liệu tổn thương mạch vành có thực sự liên quan đến triệu chứng lâm sàng hay không. Những thăm dò đánh giá chức năng hệ mạch vành (như điện tâm đồ gắng sức, siêu âm tim gắng sức, xạ hình tưới máu cơ tim, MRI tim) giữ vai trò thiết yếu, tuy nhiên không phải bệnh nhân nào cũng được làm đầy đủ những thăm dò này trước khi vào phòng can thiệp.
Ngay từ những ngày đầu tiên của kỷ nguyên nong bóng động mạch vành (ĐMV), Gruentzig và các nhà tim mạch can thiệp khác đã nhận thấy có thể dựa vào đo áp lực để xác định mức độ hẹp động mạch vành và đánh giá hiệu quả điều trị. Mặc dù vậy, kỹ thuật này ít được triển khai do còn thiếu cơ sở lý thuyết vững chắc. Nhất là trong những năm 1980, khi đo diện tích lòng mạch theo phương pháp QCA (Chụp mạch vành định lượng) phát triển mạnh mẽ, nhiều người tin rằng phim chụp mạch cản quang là đủ và không cần tiến hành thêm các thăm dò chức năng khác.
Tuy nhiên, thực tế đã chứng minh chụp mạch vành đơn thuần có nhiều hạn chế trong đánh giá và tiên lượng tổn thương. Chính vì vậy, các bác sĩ can thiệp lại bắt đầu quan tâm tới lưu lượng và áp lực mạch vành. Nhiều thông số như dự trữ vành (Coronary Flow Reserve, CFR), chỉ số sức cản tuần hoàn mao mạch (Index of Microcirculatory Resistance, IMR), phân số dự trữ lưu lượng vành (Fractional Flow Reserve, FFR) được nghiên cứu nhằm đưa ra một chỉ số tối ưu để đánh giá chức năng cấp máu của mạch vành. Nhiều loại dây dẫn (guidewire) cho phép đo vận tốc dòng chảy và áp lực nội mạch được sản xuất và triển khai trong thực hành lâm sàng.
Năm 1993, bác sĩ Pijls và cộng sự tiến hành thực nghiệm kinh điển trên chó, xây dựng cơ sở lý thuyết để tính toán FFR. Năm 1996, De Bruyne và Pijls so sánh FFR với các thăm dò không xâm nhập khác, như siêu âm tim gắng sức, MRI tim gắng sức, chụp xạ hình tưới máu cơ tim, đề ra ngưỡng FFR để chẩn đoán thiếu máu cơ tim. Kể từ đó, FFR dần được ứng dụng rộng rãi, và ngày càng chứng tỏ vai trò của mình trong chẩn đoán và điều trị bệnh mạch vành.
3.2 Khái niệm phân số dự trữ lưu lượng vành
3.2.1 Công thức tính FFR
Phân số dự trữ lưu lượng vành (Fractional Flow Reserve, FFR) được định nghĩa là tỉ số giữa lưu lượng tối đa cấp máu cho cơ tim của động mạch vành bị hẹp so với lưu lượng tối đa của động mạch đó khi không tổn thương. FFR thể hiện ảnh hưởng của chỗ hẹp đối với khả năng tưới máu của mạch vành, qua đó gián tiếp đánh giá mức độ nặng của tổn thương. FFR bằng 0,6 nghĩa là lưu lượng mạch vành chỉ đạt được 60% giá trị lý tưởng, và đòi hỏi sau đặt stent phải nâng FFR lên con số lý thuyết 1,0.
FFR là tỉ lệ của hai lưu lượng, lưu lượng thực qua chỗ hẹp và lưu lượng lý thuyết khi mạch vành không bị hẹp. Trong nghiên cứu của mình tiến hành trên chó thực nghiệm, Pijls so sánh áp lực đo bởi đầu dò áp lực đưa vào lòng ĐMV với lưu lượng máu đo bởi một đầu dò siêu âm Doppler đặt trực tiếp trên mạch vành ở thượng tâm mạc. Thực nghiệm chứng minh, khi mạch vành giãn tối đa, tỉ lệ hai lưu lượng có thể được tính gần đúng qua tỉ lệ hai áp lực. Công thức thể hiện mối liên quan được thể hiện dưới đây:
Theo định nghĩa, FFR là tỉ số giữa lưu lượng máu tối đa của ĐMV bị hẹp (QSmax) với lưu lượng máu tối đa của ĐMV không bị hẹp (QNmax)
FFR = Qsmax/ QNmax
Lưu lượng được tính bằng chênh lệch áp lực qua hệ thống ĐMV chia cho sức cản hệ mao mạch. Vì thế ta có công thức:
FFR = [(Pd-Pv) / Rsmax] / [ (Pa- Pv)/ RNmax]
Trong điều kiện giãn mạch tối ưu, sức cản của hệ mao mạch là tối thiểu và tương tự nhau ở mọi điểm. Do đó:
FFR =(Pd-Pv) / [ (Pa- Pv)
Áp lực của hệ tĩnh mạch quá nhỏ so với áp lực động mạch, nên có thể bỏ qua Pv. Do đó công thức tính FFR có thể viết như sau:
FFR = Pd/Pa
Pa: Áp lực động mạch chủ
Pd: Áp lực đầu xa của ĐMV
Pv: Áp lực của hệ tĩnh mạch
Qsmax: Lưu lượng máu tối đa đi qua chỗ hẹp
QNmax: Lưu lượng máu tối đa của ĐMV bình thường
Rsmax: Sức cản của hệ mao mạch ở ĐMV bị hẹp
RNmax:Sức cản của hệ mao mạch ở ĐMVbình thường
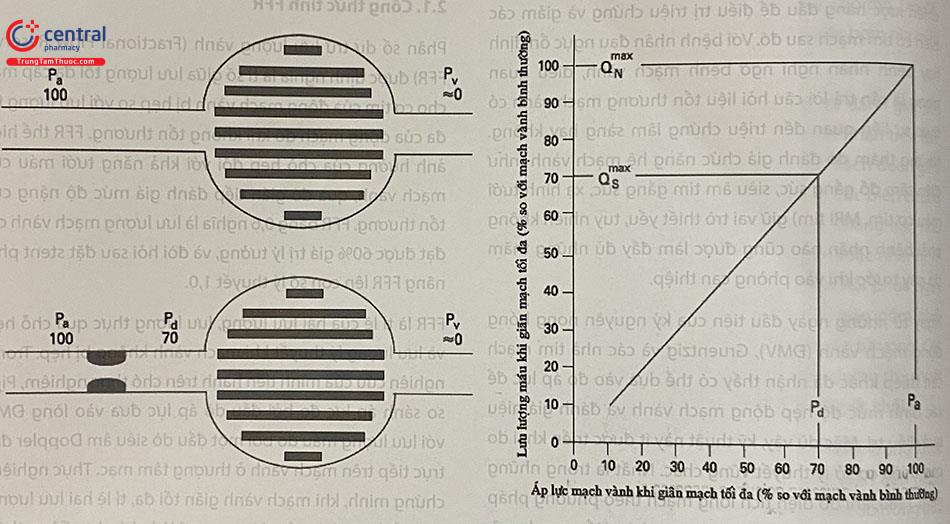
Dựa trên lý thuyết của Pijls, việc tính toán FFR khá đơn giản. Người ta đo Pa (áp lực động mạch chủ) theo cách thông thường nhờ ống thông can thiệp, và đo Pd nhờ một cảm biến áp lực đưa qua chỗ hẹp đến đầu xa của mạch vành. Có thể tiến hành đo FFR một cách an toàn cả khi chụp mạch vành chẩn đoán lẫn trong quá trình can thiệp.
3.2.2 Các đặc điểm của FFR
FFR có một số đặc điểm dưới đây:
- Không bị ảnh hưởng bởi nhịp tim, huyết áp, chức năng thất trái.
- Đánh giá cho cả tuần hoàn bàng hệ.
- Liên quan đến mức độ nặng của hẹp mạch vành với mức độ giảm tưới máu của vùng cơ tim chi phối.
- Dễ dàng thực hiện và phân tích.
- Liên quan trực tiếp đến lưu lượng máu cơ
- Tương quan với các thăm dò chức năng không xâm lấn khác như xạ hình tưới máu cơ tim, MRI
3.2.3 Ưu điểm của FFR
Về lý thuyết, phân số dự trữ lưu lượng vành có nhiều ưu điểm khiến nó có thể đánh giá chính xác mức độ hẹp chức năng của động mạch vành, đồng thời giúp bác sĩ đưa ra các quyết định can thiệp.
Trước hết, FFR không phụ thuộc vào tình trạng huyết động của bệnh nhân. Ở bệnh nhân chụp và can thiệp mạch vành, huyết áp, nhịp tim và sức co bóp cơ tim có xu hướng dao động và không ổn định so với trạng thái bình thường. Tuy nhiên, các biến đổi huyết động ít ảnh hưởng đến giá trị FFR; một phần nhờ áp lực đầu gần và đầu xa của động mạch được đo đồng thời, phần khác nhờ đặc tính giãn mạch tối đa của hệ mao mạch. Do đó, FFR có độ chính xác và độ tin cậy cao.
Thứ hai, FFR tính đến ảnh hưởng của tuần hoàn bàng hệ. Mô cơ tim có thể được cấp máu “xuôi chiều” nhờ hệ động mạch vành theo giải phẫu, hoặc “ngược chiều” qua hệ thống tuần hoàn bàng hệ. Áp lực đầu xa động mạch vành khi mạch vành giãn tối đa phản ánh vai trò tưới máu của cả hai hệ thống trên.
Thứ ba, FFR phản ánh mức độ hẹp động mạch vành chứ không phải diện tích tuyệt đối của lòng mạch. Chúng ta biết rằng các mạch máu có kích thước khác nhau (như thân chung ĐMV trái có kích thước lớn hơn nhánh chéo của động mạch liên thất trước), cũng như phụ thuộc kích cỡ của bệnh nhân (người cao thì mạch máu lớn hơn). Tuy nhiên với bất kì mạch máu nào, giá trị FFR đo được (ví dụ: FFR = 0,7) luôn gây ra một ảnh hưởng huyết động tương tự.
Cuối cùng, FFR đặc hiệu cho một tổn thương cụ thể. Nếu như xạ hình tưới máu cơ tim chỉ cung cấp thông tin về vùng cơ tim tổn thương, qua đó xác định nhánh động mạch vành tổn thương, thì cảm biến áp lực trên guidewire giúp bác sĩ can thiệp biết đích xác vị trí hẹp mạch vành gây triệu chứng lâm sàng, với biên độ dao động chỉ khoảng vài mm. Nhờ đó đưa ra quyết định can thiệp thích hợp.
3.2.4 Giá trị của FFR
Ở mạch vành không bị hẹp, giá trị của FFR là
Dựa trên các thử nghiệm FAME và FAME II:
- FFR ≤ 0,8 được coi là thay đổi đáng kể và có thể có lợi từ việc tái thông mạch vành.
- Bệnh nhân có FFR > 0,8 có tiên lượng tốt khi điều trị nội khoa đơn thuần.
- Theo nghiên cứu, chỉ 0,2% bệnh nhân có FFR ≥ 0,8 có xuất hiện biến cố nhồi máu cơ tim trong vòng 2 năm theo dõi.
3.2.5 Các chỉ số tương tự FFR
Ngoài FFR, một số chỉ số khác như cFR, iFR cũng được sử dụng. Về cơ bản, chúng đánh giá sinh lý dòng chảy động mạch vành (ĐMV) dựa trên chênh lệch áp lực trước và sau vị trí hẹp.
Bảng 14.4. Các tiêu chí sinh lý học và ứng dụng trên lâm sàng FFR và các chỉ số giống FFR
| CHỈ SỐ | GIÁ TRỊ BÌNH THƯỜNG | NGƯỠNG THIẾU MÁU CỤC BỘ | GHI CHÚ |
|---|---|---|---|
| FFR | 1 | 0,8 | |
| cFR | 1 | ≈ 0,83 | Không sử dụng adenosine, thay vào đó là thuốc cản quang; mối tương quan với FFR cao hơn iFR và Pd/Pa |
| iFR | 1 | ≈ 0,9 | Không cần giãn mạch tối đa; độ chính xác đạt 80% so với FFR |
Pd/Pa khi nghỉ | 1 | ≈ 0,92 | Không cần giãn mạch tối đa; độ chính xác đạt 80% so với FFR |
Chú thích: Pa: áp lực động mạch chủ; Pd: Áp lực đầu xa động mạch vành; FFR: Phân số dự trữ lưu lượng vành.
FFR khác với lưu lượng dự trữ vành tuyệt đối (CFR, lưu lượng tối đa/lưu lượng nền) vì FFR không phụ thuộc vào lưu lượng nền mà chỉ được tính toán dựa vào lưu lượng tối đa (giãn mạch tối đa). So với CFR, FFR không bị ảnh hưởng nếu huyết động hoặc tình trạng vi tuần hoàn thay đổi, đồng thời nó cũng đặc hiệu cho hẹp động mạch vành thượng tâm mạc.
3.3 Chỉ định, chống chỉ định khảo sát FFR
3.3.1 Chỉ định
Theo khuyến cáo của Hiệp hội Tim mạch châu Âu (ESC), chỉ định khảo sát FFR trong các trường hợp sau:
- Đánh giá ảnh hưởng sinh lý và huyết động của tổn thương hẹp động mạch vành (ĐMV) mức độ vừa.
- Xác định nhánh ĐMV thủ phạm trong các trường hợp tổn thương nhiều thân ĐMV
- Đánh giá ảnh hưởng của chỗ hẹp đối với dòng chảy ĐMV trong trường hợp có tuần hoàn bàng hệ đoạn
- Xác định vị trí chính xác của chỗ hẹp ĐMV trong trường hợp hình ảnh phim chụp ĐMV không rõ ràng.
- Đưa ra quyết định can thiệp tái tưới máu ở bệnh nhân hội chứng động mạch vành mạn tính.
3.3.2 Chống chỉ định
- Không có chống chỉ định tuyệt đối.
- Những bệnh nhân hen phế quản nặng cần thận trọng khi đo FFR, do adenosine sử dụng trong lúc khảo sát FFR có thể làm nặng thêm tình trạng hen phế quản.
3.4 Quy trình đo FFR
3.4.1 Thiết bị đo FFR
Để đo áp lực trong lòng mạch vành, người ta sử dụng một dây dẫn đặc biệt có gắn cảm biến áp lực. Cảm biến này nằm cách đầu xa của dây dẫn 3 cm. Áp lực đo được sẽ truyền về bộ phận nhận cảm, qua hệ thống xử lý và hiện lên màn hình theo dõi, cho phép bác sĩ tim mạch can thiệp đánh giá trực tiếp FFR trong lúc làm thủ thuật. Dây dẫn áp lực có kích cỡ 0,014 inch, thao tác hoàn toàn tương tự dây dẫn can thiệp mạch vành thông thường. Nó được đưa vào các nhánh động mạch vành qua ống thông can thiệp 5Fr, 6Fr hoặc 7Fr, mặc dù một số nghiên cứu cũng sử dụng cả ống thông chẩn đoán 5Fr.
Hiện nay có hai loại dây dẫn được FDA chấp thuận sử dụng là PressureWire của hãng Radi Medical và Volcano Wave- Wire của hãng Volcano Inc.
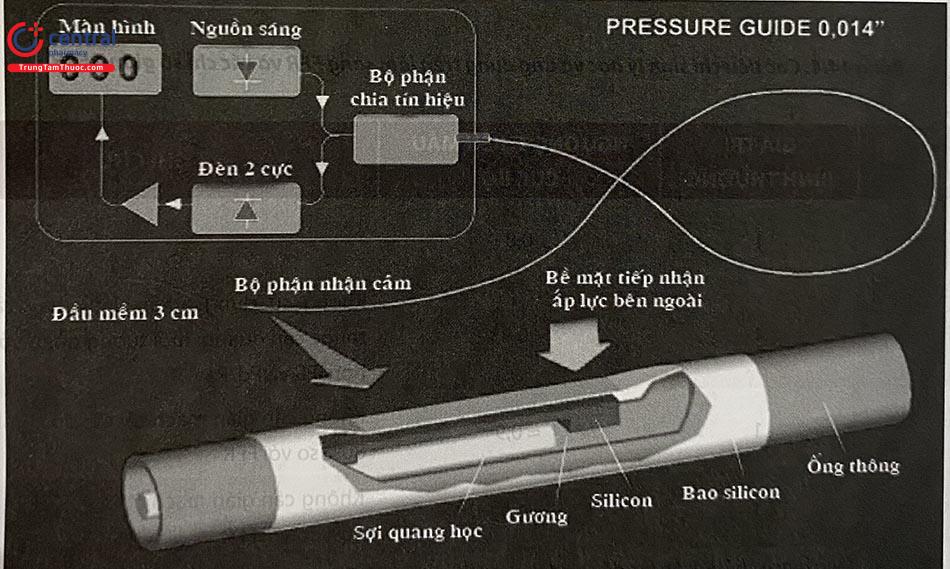
3.4.2 Quy trình kỹ thuật đặt ống thông can thiệp tại lỗ vào ĐMV
- Dây dẫn áp lực nối với hệ thống phân tích áp lực.
- Tiêm heparin như thủ thuật can thiệp ĐMV thông thường.
- Bơm nitroglycerin vào ĐMV (100-200 µg) để gây giãn tối đa ĐMV ở thượng tâm mạc.
- Trước khi đưa dây dẫn qua ống thông vào mạch vành, tiến hành cân bằng áp lực. Đặt dây dẫn ở vị trí sao cho cảm biến áp lực nằm ngay tại đầu ống thông can thiệp (Hình 57). Nhấn nút Equalizer trên máy đo. Áp lực đo ở đầu ống thông can thiệp và đo ở đầu cảm biến áp lực (khi dây dẫn còn nằm ngoài ĐMV) phải trùng nhau, chênh lệch không quá 5 mmHg.
- Đưa dây dẫn áp lực qua chỗ hẹp đến đầu xa của động mạch vành tổn thương.
- Gây trạng thái giãn mạch vành tối đa bằng adenos- ine tiêm mạch vành (50 µg với ĐMV phải, 60-100 µg với ĐMV trái), hoặc truyền adenosine tĩnh mạch liên tục.
- Khảo sát FFR bằng cách tính chỉ số Pd/Pa. FFR được đo tại thời điểm chỉ số Pd/Pa thấp nhất sau khi thuốc giãn mạch khởi phát tác dụng, thường trong vòng 2 phút sau tiêm adenosine tĩnh mạch và 15-20 giây sau tiêm adenosine nội mạch vành.
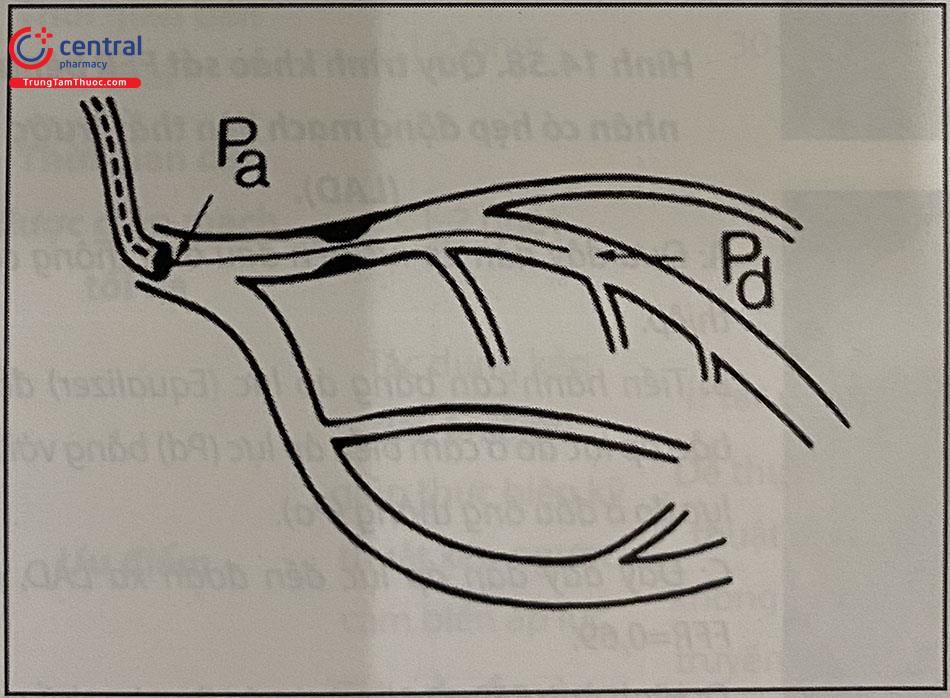
- Trường hợp FFR < 0,8, có tương quan chặt chẽ với thiếu máu cục bộ và là một chỉ định để tái tưới máu ĐMV. Nếu FFR ≥ 0,8, cho thấy tổn thương hẹp không gây ảnh hưởng dòng chảy ĐMV, vì thế có thể điều trị bảo tồn.
- Nếu cần can thiệp mạch vành qua da, tiến hành nong bóng và đặt stent ĐMV với dây dẫn áp lực, tương tự các ca can thiệp ĐMV thông thường.
- Khi đưa bóng vào chỗ hẹp và bơm bóng, áp lực đầu xa sẽ giảm đi, chênh áp sẽ tăng nhẹ (Pd/Pa giảm). Lúc bơm căng bóng tối đa, mạch vành bị tắc tạm thời, nhưng vẫn có thể tiếp tục đo áp lực ở đầu tận guide wire (Pw), qua đó đánh giá vai trò của tuần hoàn bàng hệ. Tỉ số Pw/Pa <0,25 thường gây đau ngực cùng biến đổi trên điện tâm đồ.
- Sau thủ thuật, đo lại FFR để đánh giá hiệu quả can thiệp và ảnh hưởng của phần hẹp còn lại lên các đoạn mạch khác.
- FFR sau thủ thuật dưới 0,75 đồng nghĩa với can thiệp ĐMV chưa đạt hiệu quả tối ưu, mặc dù có thể không còn hẹp trên phim chụp mạch. FFR nằm trong khoảng từ 0,75 đến 0,9 tương ứng với tỉ lệ tái hẹp sau 6 tháng cao tới 30%.
- FFR sau đặt stent phải đạt mức tối thiểu 0,9. Trong các trường hợp hẹp nhiều chỗ, hẹp lan tỏa mạch vành, cần đo thêm áp lực ở đầu gần và đầu xa stent sau can thiệp. Tỉ lệ áp lực đầu xa/đầu gần ≥ 0,94 tương ứng với kết quả can thiệp tối ưu khi đánh giá bằng
- Cuối cùng, tại thời điểm kết thúc thủ thuật, kéo dây dẫn áp lực lại vào trong ống thông để chắc chắn rằng tín hiệu áp lực ổn định (các kết quả áp lực bằng nhau) và không có chênh áp.

A: Đưa dây dẫn áp lực đến đầu ống thông can thiệp.
B: Tiến hành cân bằng áp lực (Equalizer) đảm bảo áp lực đo ở cảm biến áp lực (Pd) bằng với áp lực đo ở đầu ống thông (Pa).
C: Đẩy dây dẫn áp lực đến đoạn xa LAD, đo FFR=0,69.
D: Hình ảnh FFR=0,69 trên máy đo, cho thấy tổn thương hẹp LAD có ý nghĩa về huyết động.
E: Sau khi đặt stent LAD, FFR đo ở đoạn xa LAD là 0,94 cho thấy kết quả đặt stent tốt, tuy nhiên có hẹp nhánh bên (Diagonal), đo FFR ở Diagonal là 0,74.
F: Nong bóng Diagonal.
G: Khảo sát FFR nhánh Diagonal sau nong bóng là 0,83.
H: Hình ảnh chụp động mạch vành sau khi hoàn thành thủ thuật, hẹp LAD1 mức độ vừa tuy nhiên không gây ảnh hưởng sinh lý dòng chảy mạch vành (do FFR LAD=0,94), kết thúc thủ thuật.
3.4.3 Giãn mạch tối đa khi đo phân suất dự trữ lưu lượng vành
3.4.3.1 Vai trò của giãn ĐMV tối đa
Giãn mạch vành tối đa tạo tình trạng gắng sức huyết động là điều kiện tiên quyết để có thể đo chính xác FFR. Trong điều kiện bình thường, cơ tim có khả năng thích nghi. Tuy nhiên khi giãn mạch tối đa (hyperemia), lưu lượng máu tăng lên, mạch vành bị hẹp sẽ không thể đảm bảo chức năng cấp máu cho cơ tim như mạch vành không tổn thương. Nếu mạch vành chưa được giãn tối đa, chênh áp qua chỗ hẹp sẽ không tương quan chặt chẽ với chênh lệch lưu lượng, FFR đo được sẽ thấp hơn FFR thực, dẫn đến đánh giá thấp mức độ nặng của tổn thương.
3.4.3.2 Hoạt chất gây giãn ĐMV tối đa
Tuần hoàn mạch vành bao gồm hai thành phần chính: dòng chảy trong động mạch vành ở thượng tâm mạc và trở kháng của hệ vi mạch. Tiêm bolus 200 µg isosorbide nitrates trực tiếp vào mạch vành cho phép loại bỏ hiện tượng co thắt mạch và tối ưu hóa lưu lượng mạch vành ở thượng tâm mạc.
Để giãn tối đa hệ vi mạch, nhiều hoạt chất đã được thử nghiệm như adenosine, adenosine 5’-triphosphate, Dipyridamole, natri nitroprusside. Trong thực hành lâm sàng, thuốc giãn mạch vành lý tưởng phải đáp ứng được các tiêu chí: giá thành thấp, thời gian tác dụng ngắn, dễ sử dụng, ít tác dụng phụ. Xét trên khía cạnh đó, adenosine truyền tĩnh mạch hoặc tiêm trực tiếp vào mạch vành được dùng phổ biến nhất, tất cả các nghiên cứu lớn về FFR đều sử dụng một trong hai phương pháp này để gây giãn mạch vành. Ưu, nhược điểm của các thuốc giãn mạch được trình bày trong bảng dưới đây.
Bảng 14.5. Các thuốc gây giãn mạch tối đa
| ADENOSINE | ADENOSINE | PAPAVERINE | NTP | REGADENOSON | |
|---|---|---|---|---|---|
| Đường dùng | Tĩnh mạch | Nội mạch vành | Nội mạch vành | Nội mạch vành | Tĩnh mạch |
| Liều | 140 µg/kg/phút | 60-100 µg với | 15mg mạch vành trái, 10mg mạch vành phải | 50- 100µg | 0,4mg |
| Thời gian bán thải | 1-2 phút | 30-60 giây | 2 phút | 1- 2 phút | 2- 4 phút (lên tới 30 phút) |
| Thời gian đạt được giãn mạch tối đa | <1-2 phút | 5- 10 giây | 20- 60 giây | 10- 20 giây | 1- 4 phút |
| Ưu điểm | Tác dụng kéo dài, ổn định, giúp thực hiện kỹ thuật kéo ngược cảm biến áp lực. Tiêu chuẩn vàng để khảo sát FFR | Ít tác dụng phụ. Dễ thực hiện, thủ thuật đơn giản, không cần đường truyền tĩnh mạch trung tâm. | Dễ thực hiện | Dễ thực hiện | Bolus tĩnh mạch |
| Nhược điểm | Tụt áp, đau ngực kiểu bỏng rát. | Block nhĩ thất, giảm huyết áp. | Xoắn đỉnh, giảm huyết áp | Tụt huyết áp | Tăng nhịp tim, tác dụng kéo dài, tiêm liều lặp lại |
Chú thích: NTP: nitroprusside; FFR: Phân số dự trữ lưu lượng vành; ĐMV: Động mạch vành.
Mặc dù truyền adenosine tĩnh mạch là tiêu chuẩn khi đo FFR trong hơn ba thập kỉ; một số nghiên cứu gần đây cho thấy sử dụng adenosine tĩnh mạch có thể làm thay đổi huyết động, do vậy bác sĩ can thiệp có xu hướng dùng adenosine tiêm trực tiếp vào ĐMV. Tiêm adenosine trực tiếp vào lòng ĐMV cũng đơn giản hơn và giảm thời gian tiến hành thủ thuật. Liều tối ưu là khoảng 60µg với động mạch vành phải và 60-100µg với động mạch vành trái.
Khoảng hơn 10% bệnh nhân xuất hiện block nhĩ thất khi dùng adenosine tiêm ĐMV phải với liều này. Adenosine nội mạch vành nên được pha đến nồng độ 10-20µg/ml. 1 lít hỗn hợp muối và adenosine có thể đáp ứng nhu cầu cho phòng cathlab trong vòng một ngày. Sử dụng chạc ba và bơm tiêm nối với bình chứa adenosine giúp dùng thuốc dễ dàng hơn.
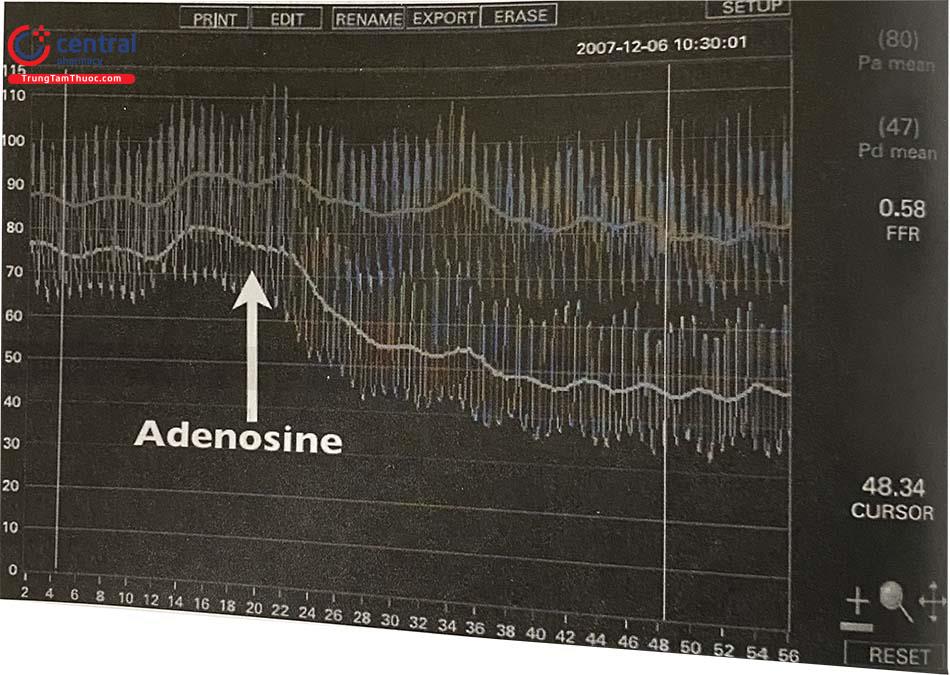
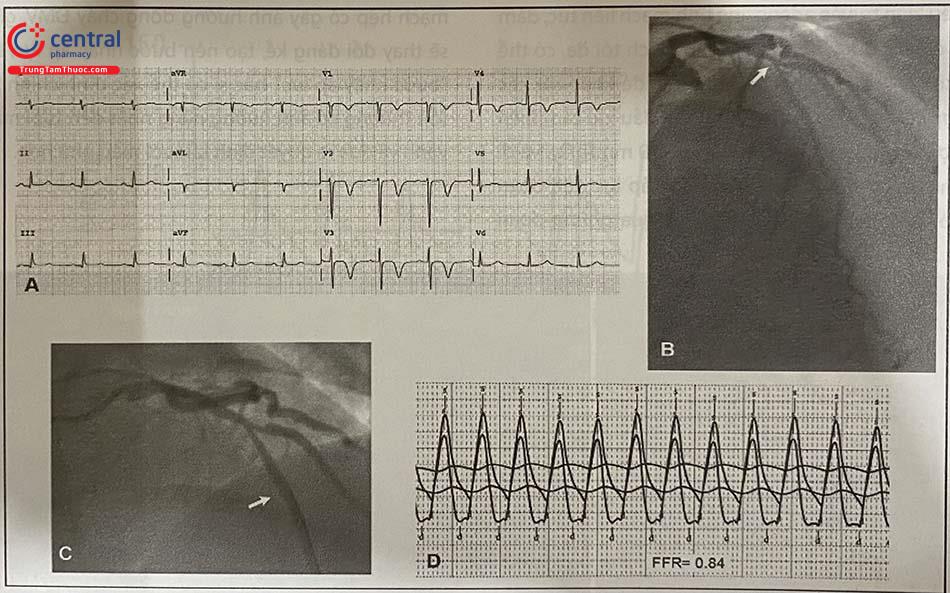
Kết quả điện tim và chụp mạch vành của một bệnh nhân đau thắt ngực không ổn định. Kết quả FFR sau khi tiêm adenosine là 0,84. Bệnh nhân không can thiệp mạch vành mà được điều trị nội khoa tối ưu. Không xuất hiện cơn đau thắt ngực cũng như các biến cố tim mạch lớn trong 7 tháng theo dõi (nguồn: Viện Tim mạch Việt Nam)
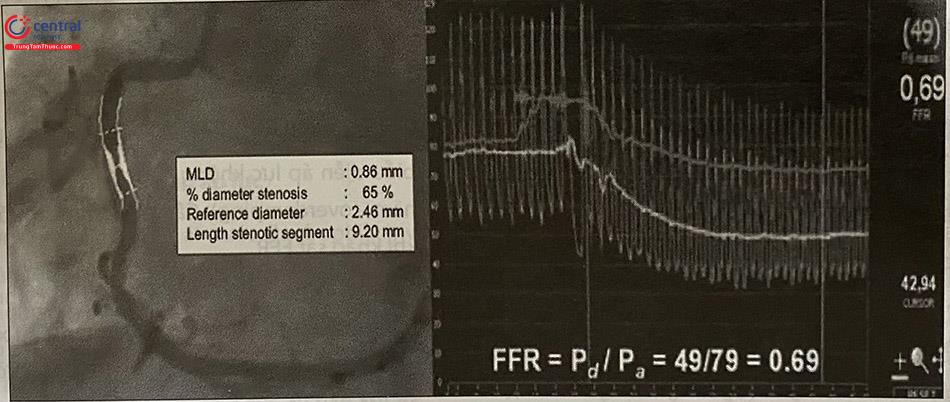
Chú thích: QCA (Quantitative Coronary Angiography): Chụp mạch vành định lượng; FFR: Phân số dự trữ lưu lượng vành; MLD (Minimal lumen diameter): Đường kích lòng mạch tối thiểu;% diameter stenosis:% đường kính hẹp; Reference diameter: Đường kính tham chiếu; Length stenotic segment: Chiều dài đoạn hẹp.
Nếu có điều kiện truyền adenosine tĩnh mạch liên tục, đảm bảo ĐMV duy trì được trạng thái giãn mạch tối đa, có thể dùng kỹ thuật kéo ngược đầu dò áp lực để khảo sát các trường hợp tổn thương lan toả ĐMV. Từ đầu xa, cảm biến áp lực được kéo về với tốc độ khoảng 5-10 mm/giây, và đi qua chỗ hẹp một lần nữa. Đưa dây dẫn áp lực đến đoạn xa, sau đó từ từ kéo dây dẫn về. Khi đi qua những đoạn mạch hẹp có gây ảnh hưởng dòng chảy ĐMV, giá trị FFR sẽ thay đổi đáng kể, tạo nên bước nhảy áp lực. Dựa trên “bước nhảy áp lực”, bác sĩ có thể xác định chính xác vị trí tổn thương có ảnh hưởng nặng nhất đến tưới máu mạch vành và đưa ra quyết định tái tưới máu phù hợp.
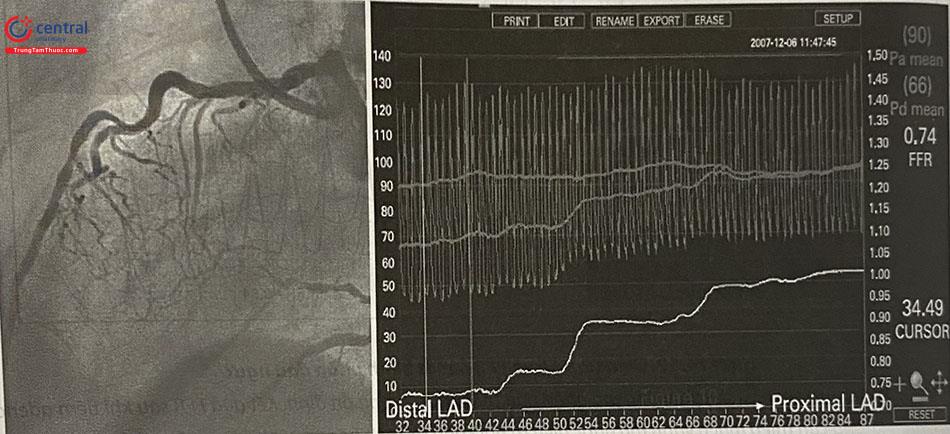
Kết quả đo FFR ở một bệnh nhân hẹp lan tỏa động mạch liên thất trước. Tỉ lệ Pd/Pa khi đo ở đầu xa LAD là 0,74. Kĩ thuật kéo ngược đầu dò áp lực phát hiện 3 “bước nhảy” áp lực, chứng tỏ động mạch hẹp nhiều đoạn hơn là tổn thương một vị trí duy nhất.
3.4.4 Sai số khi đo phân suất lưu lượng dự trữ vành
- Không tiến hành cân bằng áp lực trước khi đẩy dây dẫn áp lực đi vào ĐMV.
- Chiều cao của bộ cảm biến áp lực không chính xác.
- Mất áp lực do hệ thống hở. Cần đảm bảo hệ thống kín hoàn toàn.
- Tụt áp lực do đầu ống thông. Ống thông can thiệp kích cỡ lớn có thể gây giảm đường kính lỗ ĐMV, ảnh hưởng đến dòng chảy ĐMV, đặc biệt trong hoàn cảnh hẹp lỗ vào ĐMV. Kéo ống thông can thiệp ra khỏi ĐMV sau khi dùng thuốc giãn mạch sẽ tránh được sai lầm này. Quan sát đường sóng áp lực động mạch chủ.
- Ống thông can thiệp kích cỡ nhỏ (5Fr) có thể gây tụt áp giả tạo.
- Ống thông can thiệp có lỗ bên sẽ tạo ra giả hẹp tại vị trí lỗ mạch vành. Ống thông có lỗ bên gây chênh áp ở đoạn động mạch gần và khiến cho việc đánh giá chênh áp ở đoạn xa thêm khó khăn.
- Thuốc cản quang có độ nhớt cao sẽ làm đường biểu diễn áp lực không còn chính xác (hiện tượng quá hãm – overdamping). Cần phụt nước muối sinh lý trước khi khảo sát FFR.
- Hiện tượng trôi tín hiệu áp lực (pressure signal drift): Biểu hiện là sóng áp lực đo ở đầu xa (Pd) và đầu gần (Pa) có hình thái giống hệt nhau. Đường biểu diễn áp lực đầu xa cũng có dạng khía (notch) như đường áp lực ĐMC. Hiện tượng trôi tín hiệu này có thể dẫn đến FFR dương tính giả tạo. Nếu nghi ngờ có trôi tín hiệu áp lực, kéo dây dẫn ngược về đầu ống thông và tiến hành cân bằng áp lực lại. Hiếm gặp và có thể phát hiện bằng cách quan sát cẩn thận sóng biểu diễn áp lực và sự xuất hiện của sóng đôi. Nếu nghi ngờ, kiểm tra xem các tín hiệu đã trùng nhau chưa khi rút khỏi vị trí động mạch chủ.
.jpg)
Đường áp lực đoạn xa (Pd) có dạng giống hệt áp lực động mạch chủ và có khía (notch, dấu mũi tên).
- Các sai số do không đạt được tình trạng giãn mạch tối đa. Tốt nhất là dùng adenosine truyền tĩnh mạch. Nếu sử dụng adenosine tiêm trực tiếp ĐMV, ghi lại giá trị FFR ngay lập tức, trong khoảng thời gian adenosine còn tác dụng.
3.4.5 Các biến chứng có thể gặp khi khảo sát FFR
Biến chứng của đo FFR chủ yếu do hai nguyên nhân: các thao tác liên quan đến dây dẫn áp lực, và tác dụng phụ của adenosine tiêm mạch vành.
3.4.5.1 Biến chứng liên quan dây dẫn áp lực
Dây dẫn áp lực là một dây dẫn ái nước (hydrophilic), với kích thước hoàn toàn tương tự các dây dẫn thông thường, chính vì vậy không gây khó khăn cho bác sĩ can thiệp trong quá trình thao tác. Tuy nhiên dây dẫn này có thể dẫn đến co thắt ĐMV, hoặc gây thủng ĐMV nếu thao tác không thận trọng. Trong trường hợp co thắt ĐMV, có thể tăng liều nitroglycerin tiêm mạch vành để làm giãn tối đa hệ mạch vành ở thượng tâm mạc.
Kết thúc thủ thuật khảo sát FFR, bất kể cho can thiệp ĐMV hay không, sau khi rút dây dẫn áp lực vào lòng ống thông can thiệp cần chụp lại ĐMV nhiều góc khác nhau để đảm bảo không có tổn thương mạch vành do dây dẫn.
3.4.5.2 Biến chứng liên quan thuốc giãn mạch vành
Các liên quan adenosine bao gồm:
- Tụt huyết áp.
- Nhịp chậm xoang và ngưng
- Block nhĩ thất.
- Khó thở.
- Đau rát ngực.
Adenosine có tác dụng giãn mạch và ức chế dẫn truyền qua nút nhĩ thất. Do vậy, tụt áp, nhịp chậm, ngưng xoang là những biến chứng do thuốc phổ biến nhất. Nghiên cứu tại Viện Tim mạch Việt Nam cho thấy khi khảo sát FFR có 71% trường hợp xuất hiện nhịp chậm thoáng qua, trong đó 65% là ngưng xoang kéo dài trên 3 giây. Trong đó có một trường hợp xuất hiện cơn Adam-Stokes sau tiêm adenosine mạch vành. Tuy nhiên không có trường hợp nào cần phải dùng máy tạo nhịp do biến chứng nhịp chậm. Tỉ lệ tụt huyết áp khá cao (37%) tuy nhiên không có trường hợp nào cần dùng thuốc vận mạch để nâng áp.
Các tác dụng phụ của adenosine phổ biến và rõ rệt hơn nếu truyền thuốc bằng bơm tiêm điện qua đường tĩnh mạch trung tâm. Nếu tiêm adenosine trực tiếp vào mạch vành, gần như không gây các rối loạn hệ thống trầm trọng. Thời gian bán hủy của adenosine rất ngắn (chỉ từ 10-20 giây), vì thế tác dụng phụ của thuốc, nếu có, đều tự phục hồi.
3.5 Câc nghiên cứu về ứng dụng của FFR trong các trường hợp tổn thương động mạch vành
Rất nhiều nghiên cứu đã được tiến hành chứng minh vai trò của FFR trong can thiệp ĐMV. Kết quả nghiên cứu cho thấy dựa vào FFR để đưa ra quyết định can thiệp sẽ đem lại lợi ích lớn hơn, so với chỉ dựa vào hình ảnh chụp ĐMV đơn thuần.
Bảng 14.6. Tổng hợp một số nghiên cứu về ứng dụng của FFR trong đánh giá tổn thương động mạch vành
| THỬ NGHIỆM | THIẾT KẾ NGHIÊN CỨU | N | ĐIỀU TRỊ | KẾT QUẢ |
|---|---|---|---|---|
| DEFER | Ngẫu nhiên đa trung tâm | 325 | PCI và FFR có hướng dẫn | Không cải thiện lợi ích sống còn khi tái thông mạch với FFR ≥ 0,75 |
| FAME | Ngẫu nhiên đa trung tâm | 750 | PCI dưới hướng dẫn của FFR so với chụp mạch thông thường | Các biến cố tim mạch lớn (tử vong, nhồi máu cơ tim hoặc tái can thiệp) ít hơn ở nhóm PCI dưới hướng dẫn của FFR trong tổn thương ĐMV đa mạch. |
| FAME II | Ngẫu nhiên đa trung tâm | 1220 | PCI dưới hướng dẫn của FFR + điều trị nội khoa với điều trị nội khoa đơn thuần | Các biến cố tim mạch lớn ít hơn ở nhóm PCI dưới hướng dẫn của FFR + điều trị nội khoa. |
Chú thích: ĐMV: động mạch vành; PCI: Can thiệp động mạch vành qua da; FFR: Phân số dự trữ lưu lượng vành.
3.5.1 Tổn thương hẹp vừa động mạch vành hoặc tổn thương khó đánh giá trên phim chụp mạch
Chỉ định chính của FFR là dùng để đánh giá chính xác mức độ tổn thương trong các trường hợp hẹp ĐMV khó đánh giá trên phim chụp mạch.
Trong nghiên cứu mang tính đột phá năm 1996, Pijls, De Bruyne và cộng sự so sánh FFR với điện tâm đồ gắng sức, xạ hình tưới máu cơ tim, siêu âm tim gắng sức ở 45 bệnh nhân có hẹp ĐMV mức độ vừa trên phim chụp mạch. Chẩn đoán bệnh mạch vành khi có ít nhất một thăm dò không xâm nhập cho kết quả dương tính ở thời điểm ban đầu, đồng thời âm tính sau can thiệp tái tưới máu (đặt stent hoặc phẫu thuật). Kết quả nghiên cứu cho thấy ngưỡng FFR < 0,75 có giá trị chẩn đoán thiếu máu cục bộ cơ tim, với độ nhạy và độ đặc hiệu là 88% và 100%, giá trị chẩn đoán dương tính và âm tính lần lượt là 88% và 93%.
Sau đó, nhóm nghiên cứu đánh giá tính an toàn của trì hoãn can thiệp mạch vành dựa theo FFR. Trong nghiên cứu DEFER, bệnh nhân hẹp mạch vành mức độ vừa có FFR ≥0,75 được chia ngẫu nhiên vào hai nhóm can thiệp tái tưới máu hoặc điều trị nội khoa. Tỉ lệ biến cố tim mạch sau 2 năm là như nhau ở hai nhóm. Sau 5 năm, tỉ lệ tử vong và nhồi máu cơ tim ở nhóm điều trị nội khoa thấp hơn 50% so với nhóm được đặt stent. Mặc dù nghiên cứu DEFER sử dụng stent thường chứ không phải stent phủ thuốc, một phân tích meta tiến hành năm 2006 cho thấy tỉ lệ tử vong và NMCT sau 1 năm của bệnh nhân hẹp vừa ĐMV được đặt stent phủ thuốc tương đương tỉ lệ biến cố sau 5 năm của nhóm điều trị nội khoa trong nghiên cứu DEFER.
Trong một nghiên cứu tiến cứu tiến hành trong 4 năm, với 407 bệnh nhân hẹp vừa ĐMV (hẹp 40-60% theo QCA) được đo FFR, quyết định can thiệp mạch vành hay trì hoãn dựa trên FFR< 0,8 hay FFR ≥ 0,8. Sau 1 năm theo dõi, tỉ lệ biến cố tim mạch ở nhóm sử dụng FFR là 6%, thấp hơn hẳn nhóm không dùng FFR (15%, p=0,01).
Kết quả từ những nghiên cứu trên đã chứng minh vai trò của FFR trong đánh giá tổn thương hẹp vừa ĐMV.
3.5.2 FFR và tổn thương nhiều thân động mạch vành
Với bệnh nhân hẹp nhiều thân ĐMV, việc xác định động mạch thủ phạm liên quan đến triệu chứng thiếu máu cơ tim đôi khi không đơn giản. Vai trò của các thăm dò không xâm nhập rất hạn chế. Gần đây, nghiên cứu FAME đăng trên tạp chí New England Journal of Medicine đánh giá trực tiếp vai trò của FFR trong việc đưa ra quyết định can thiệp ở bệnh nhân tổn thương nhiều thân mạch vành. Đây là một nghiên cứu ngẫu nhiên, đa trung tâm, gồm 1005 bệnh nhân có hẹp trên 50% ít nhất hai ĐMV, không có hội chứng vành cấp, không hẹp thân chung, không có phẫu thuật cầu nối chủ vành trước đó. Bệnh nhân được chọn ngẫu nhiên vào hai nhóm: nhóm can thiệp (đặt stent phủ thuốc) hoặc điều trị bảo tồn dựa theo phim chụp mạch, nhóm còn lại can thiệp nếu FFR < 0,8 và điều trị nội khoa nếu FFR ≥ 0,8.
Nghiên cứu FAME đã chứng minh, FFR giảm được 30% số ca đặt stent không cần thiết, cùng với đó là giảm chi phí điều trị, giảm lượng thuốc cản quang sử dụng, trong khi thời gian làm thủ thuật không thay đổi. Sau một năm, tỉ lệ biến cố tim mạch (tử vong, NMCT, cần tái thông mạch đích) ở nhóm FFR thấp hơn nhóm dựa trên phim chụp mạch (13,2% so với 18,4%, p=0,02). Kết quả theo dõi sau hai năm cho thấy tỉ lệ tử vong và NMCT ở nhóm sử dụng FFR chỉ là 8,4%, thấp hơn có ý nghĩa thống kê so với nhóm không dùng FFR (12,7%, p=0,03).
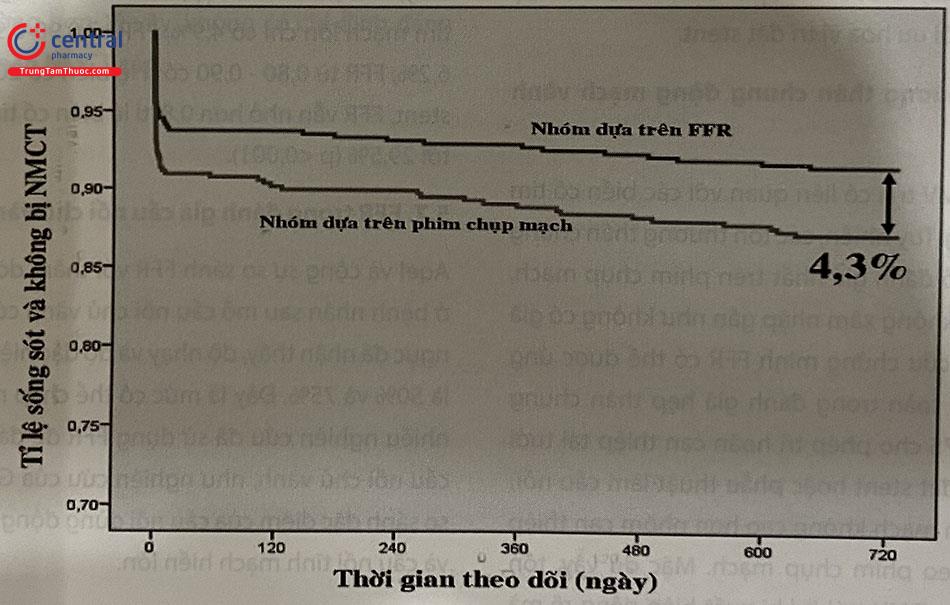
Chú thích: NMCT: nhồi máu cơ tim
Với quy mô nhỏ hơn, Wongprapaut và cộng sự so sánh kết quả can thiệp dựa theo phim chụp mạch và dựa theo FFR ở 137 bệnh nhân tổn thương nhiều thân mạch vành (tổng cộng 312 động mạch bị hẹp). Nghiên cứu cho thấy chi phí trung bình ở nhóm sử dụng FFR thấp hơn hẳn nhóm không dùng FFR (2572 ± 934 USD, so với 3167 ± 1194 USD, p <0,001), tỉ lệ biến cố tim mạch lớn (MACEs) sau 30 tháng theo dõi cũng thấp hơn (11% so với 41%, p <0,01).
3.5.3 FFR và tổn thương lan tỏa động mạch vành
Siêu âm trong lòng mạch (IVUS) cho thấy phần lớn các trường hợp xơ vữa ĐMV là tổn thương lan tỏa, rất hiếm ĐMV chỉ hẹp một chỗ duy nhất. Trong trường hợp hẹp nhiều đoạn ĐMV, câu hỏi đặt ra là có nên can thiệp tất cả các tổn thương hay không. Bỏ sót tổn thương thì tình trạng tưới máu cơ tim ít được cải thiện, trong khi đặt quá nhiều stent đồng nghĩa với tăng nguy cơ (tái hẹp trong stent, tắc lại stent) và chi phí cho người bệnh. Đo chênh áp qua từng chỗ hẹp bằng kỹ thuật kéo ngược đầu dò áp lực, phối hợp với IVUS, sẽ giúp thầy thuốc xác định chính xác mức độ hẹp mạch máu và tối ưu hóa vị trí đặt stent.
3.5.4 FFR và tổn thương thân chung động mạch vành trái
Hẹp thân chung ĐMV trái có liên quan với các biến cố tim mạch nghiêm trọng. Tuy nhiên, các tổn thương thân chung lại thuộc nhóm khó đánh giá nhất trên phim chụp mạch, trong khi thăm dò không xâm nhập gần như không có giá trị. Một số nghiên cứu chứng minh FFR có thể được ứng dụng một cách an toàn trong đánh giá hẹp thân chung ĐMV trái. FFR > 0,75 cho phép trì hoãn can thiệp tái tưới máu thân chung (đặt stent hoặc phẫu thuật làm cầu nối) với tỉ lệ biến cố tim mạch không cao hơn nhóm can thiệp dựa đơn thuần theo phim chụp mạch. Mặc dù vậy, tổn thương thân chung ĐMV trái ít khi xuất hiện riêng rẽ mà thường đi kèm hẹp đoạn gần động mạch liên thất trước hoặc động mạch mũ. Trong những trường hợp đó, FFR có thể bị ảnh hưởng và khiến bác sĩ dễ đánh giá mức độ hẹp thân chung nặng hơn thực tế.
3.5.5 FFR và tổn thương tại chỗ phân nhánh
Các tổn thương tại chỗ chia đôi thường hay gặp hiện tượng chồng hình (overlapping) khiến việc đánh giá trên phim chụp mạch không đơn giản, trong khi can thiệp tại chỗ chia đôi lại khó khăn hơn can thiệp một vị trí hẹp đơn thuần. Koo BK và cộng sự đã tiến hành một loạt nghiên cứu tìm hiểu vai trò của FFR trong tổn thương tại chỗ chia đôi, chứng minh vai trò của FFR khi so sánh với QCA (chụp mạch vành định lượng) trong đánh giá mức độ nặng thực sự của chỗ hẹp, mọi trường hợp hẹp lỗ vào dưới 75% (đo bằng QCA) đều có FFR ≥ 0,75. Ngoài ra, dựa trên FFR có thể đưa ra quyết định có tiếp tục can thiệp nhánh bên sau can thiệp nhánh chính hay không.
3.5.6 FFR trong đánh giá hiệu quả can thiệp ngay sau đặt stent
FFR đã được chứng minh có vai trò đánh giá hiệu quả đặt stent. FFR cho bác sĩ can thiệp biết chính xác những vị trí stent chưa giãn nở tối ưu. Nghiên cứu gần đây của Klauss cho thấy FFR sau can thiệp lớn hơn 0,95 là một yếu tố tiên lượng độc lập của các biến cố tim mạch (tử vong, nhồi máu cơ tim, cần tái can thiệp mạch vành). Trong 6 tháng theo dõi, nhóm FFR ≤ 0,95 có tỉ lệ biến cố cao gấp 6 lần nhóm FFR > 0,95. Pijls NH khi nghiên cứu 750 trường hợp đặt stent có kết quả tốt dựa trên phim chụp mạch cũng nhận thấy, FFR (sau can thiệp) trên 0,95 tương ứng tỉ lệ biến cố tim mạch lớn chỉ có 4,9%; FFR từ 0,90-0,95 có tỉ lệ biến cố 6,2%; FFR từ 0,80 – 0,90 có tỉ lệ biến cố 20,3%. Nếu sau đặt stent, FFR vẫn nhỏ hơn 0,8, tỉ lệ biến cố tim mạch nặng lên tới 29,5% (p <0,001).
3.5.7 FFR trong đánh giá cầu nối chủ vành
Aqel và cộng sự so sánh FFR với thăm dò tưới máu cơ tim ở bệnh nhân sau mổ cầu nối chủ vành có triệu chứng đau ngực đã nhận thấy, độ nhạy và độ đặc hiệu của FFR lần lượt là 50% và 75%. Đây là mức có thể chấp nhận được. Vì thế, nhiều nghiên cứu đã sử dụng FFR để đánh giá tình trạng cầu nối chủ vành, như nghiên cứu của Glineur và cộng sự so sánh đặc điểm của cầu nối dùng động mạch ngực trong và cầu nối tĩnh mạch hiển lớn.
3.5.8 FFR và tái hẹp trong stent
Năm 2005, Kruger và cộng sự nghiên cứu tác dụng của FFR khi đánh giá tái hẹp trong stent sau can thiệp mạch vành. Kết quả cho thấy FFR < 0,75 có tương quan với mức độ hẹp trên phim chụp mạch. Những bệnh nhân FFR ≥ 0,75 không xuất hiện triệu chứng của bệnh mạch vành trong 6 tháng theo dõi. Một nghiên cứu khác của Ramon Lopez chứng minh có thể trì hoãn can thiệp mạch vành ở bệnh nhân tái hẹp trong stent có FFR ≥ 0,75.
3.6 Hạn chế của FF
3.6.1 Bệnh nhân có phì đại thất trái
Ở các bệnh nhân có phì đại thất trái, hệ thống mao mạch phát triển không tương xứng với khối lượng cơ thất phì đại. Đồng thời, các triệu chứng thiếu máu cơ tim có thể xuất hiện dù không có hẹp đáng kể hệ động mạch vành. Hệ quả là FFR ≥ 0,75 chưa thể loại trừ hoàn toàn tổn thương mạch vành. Các nghiên cứu lớn trên thế giới đều khuyến cáo nên thận trọng khi đo FFR ở các bệnh nhân phì đại thất trái, tốt nhất là nâng ngưỡng chẩn đoán lên cao hơn 0,75.
3.6.2 Bệnh nhân nhồi máu cơ tim cấp
Với bệnh nhân nhồi máu cơ tim (NMCT) cấp, có nhiều yếu tố như huyết khối vi mạch, hiện tượng đờ cơ tim,… ảnh hưởng tới giãn hệ mao mạch tối ưu. Những yếu tố này biến đổi liên tục khiến việc đo FFR trở nên mất chính xác. Bên cạnh đó, triệu chứng lâm sàng, điện tâm đồ, và kết quả chụp ĐMV cho phép xác định động mạch thủ phạm trong phần lớn các trường hợp. Vì vậy, không có chỉ định đánh giá FFR ở bệnh nhân NMCT cấp.
4 Tài liệu tham khảo
1. Bon N, Lancee, Van Egmond FC (1972): An ultrasonic intracardiac Ultrasonic 1972;10:72-76
2. Bon N, Ten Hoff, Lancee CT (1989): Early and recent intraluminal ultrasound devices. Int J Card Imaging 1989; 4:79-88
3. York PG, Linker D, Saether O (1988) Intravascular two dimensional catheter ultrasound: Initial clinical stusies. Circulation 1988; 78:II-21
4. Eric Topol, Paul Textbook of Interventional Cardiology. 8th ed: Elsevier; 2019.
5. Guédès A, Keller PF, L’Allier PL, Lespérance J, Grégoire J, Tardif Long-term safety of intravascular ultrasound in nontransplant, nonintervened, atherosclerotic coronary arteries. J Am Coll Cardiol. 2005;45(4):559-564.
6. Ramasubbu K, Schoenhagen P, Balghith MA, et Repeated intravascular ultrasound imaging in cardiac transplant recipients does not accelerate transplant coronary artery disease. J Am Coll Cardiol. 2003;41(10):1739-1743.
7. MD Paul Schoenhagen, FAHA and Steven Nissen, MD, FACC (2004), “An Atlas and Manual of coronary intravascular ultrasound imaging”.
8. Hand Kushner. G, Smith. C, et al (2009), “2009 focused updates: ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction (updating the 2004 guideline and 2007 focused update) and ACC/AHA/SCAI guidelines on percutaneous coronary intervention “, J Am Coll Cardiol, 54, tr. 2205-41.
9. Kolh S. Windecker, F. Alfonso, J.P. Collet, J. Cremer, V. Falk, G. Filippatos, C. Hamm et al, (2014), “The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI)”, Eur. Heart J, 35, tr. 2541–2619.
10. 3983/QĐ-BYT (2014), “Bộ Y Tế – Hướng dẫn quy trình kỹ thuật Nội khoa, chuyên ngành Tim mạch”.
11. Nissen SE, Yock Intravascular Ultrasound: Novel Pathophysiological Insights and Current Clinical Applications. Circulation. 2001;103(4):604-616. doi:10.1161/01.CIR.103.4.604.
12. Kawasaki M, Sano K, Okubo M, et al. Volumetric quantitative analysis of tissue characteristics of coronary plaques after statin therapy using three-dimensional integrated backscatter intravascular ultrasound. J Am Coll Cardiol. 2005;45(12):1946-1953.
13. Serruys PW, García-García HM, Buszman P, et al. Effects of the direct lipoprotein-associated phospholipase A(2) inhibitor darapladib on human coronary atherosclerotic plaque. Circulation. 2008;118(11):1172-1182.
14. Kini AS, Baber U, Kovacic JC, et al. Changes in plaque lipid content after short-term intensive versus standard statin therapy: the YELLOW trial (reduction in yellow plaque by aggressive lipid-lowering therapy). J Am Coll 2013;62(1): 21-29.
15. Yamada R, Tremmel JA, Tanaka S, et al. Functional Versus Anatomic Assessment of Myocardial Bridging by Intravascular Ultrasound: Impact of Arterial Compression on Proximal Atherosclerotic Plaque. J Am Heart Assoc. 2016;5(4):e001735.
16. Nakamura S, Colombo A, Gaglione A, et al. Intracoronary ultrasound observations during stent implantation. Circulation. 1994;89(5):2026-2034.
17. Colombo A, Hall P, Nakamura S, et al. Intracoronary stenting without anticoagulation accomplished with intravascular ultrasound guidance. Circulation. 1995;91(6):1676-1688.
18. Lassen JF, Holm NR, Banning A, et Percutaneous coronary intervention for coronary bifurcation disease: 11th consensus document from the European Bifurcation Club. EuroIntervention. 2016;12(1):38-46.
19. Rathore S, Terashima M, Suzuki Value of intravascular ultrasound in the management of coronary chronic total occlusions. Catheter Cardiovasc Interv. 2009;74(6):873-878.
20. Kim BK, Shin DH, Hong MK, et Clinical Impact of Intravascular Ultrasound-Guided Chronic Total Occlusion Intervention WithZotarolimus-Eluting Versus Biolimus-Eluting Stent Implantation: Randomized Study. Circ Cardiovasc Interv. 2015;8(7):e002592.
21. Garcìa-Garcìa HM, Gogas BD, Serruys PW, Bruining IVUS-based imaging modalities for tissue characterization: similarities and differences. Int J Cardiovasc Imaging. 2011;27(2):215-224. doi:10.1007/s10554-010-9789-7.
22. Matsumura M, Mintz GS, Kang SJ, et al. Intravascular ultrasound and near-infrared spectroscopic features of coronary lesions with intraplaque haemorrhage. Eur Heart J – Cardiovasc Imaging. 2017;18(11):1222-1228. doi:10.1093/ehjci/jew217.
23. Kini AS, Baber U, Kovacic JC, et al. Changes in Plaque Lipid Content After Short-Term Intensive Versus Standard Statin Therapy. J Am Coll Cardiol. 2013;62(1):21-29. doi:10.1016/j.jacc.2013.03.058.
24. Park SJ, Ahn JM, Kang SJ, et al. Intravascular Ultrasound-Derived Minimal Lumen Area Criteria for Functionally Significant Left Main Coronary Artery Stenosis. JACC Cardiovasc Interv. 2014;7(8):868-874. doi:10.1016/j.jcin.2014.02.015.
25. Hong MK, Mintz GS, Lee CW, et Comparison of Virtual Histology to Intravascular Ultrasound of Culprit Coronary Lesions in Acute Coronary Syndrome and Target Coronary Lesions in Stable Angina Pectoris. Am J Cardiol. 2007;100(6): 953-959. doi:10.1016/j.amjcard.2007.04.034
26. Matsumura M, Mintz GS, Kang SJ, et Intravascular ultrasound and near-infrared spectroscopic features of coronary lesions with intraplaque haemorrhage. Eur Heart J – Cardiovasc Imaging. 2017;18(11):1222-1228. doi:10.1093/ehjci/jew217.
27. Xie Y, Mintz GS, Yang J, et al. Clinical Outcome of Nonculprit Plaque Ruptures in Patients With Acute Coronary Syndrome in the PROS- PECT Study. JACC Cardiovasc Imaging. 2014;7(4):397-405. doi:10.1016/j.jcmg.2013.10.010.
28. Roleder T, Wojakowski Intravascular ultrasound, optical coherence tomography and near infrared spectroscopy. Cor Vasa. 2015;57(6):e439-e445. doi:10.1016/j.crvasa.2015.10.004.
29. Yonetsu T, Suh W, Abtahian F, et al. Comparison of near-infrared spectroscopy and optical coherence tomography for detection of lipid: Comparison Between NIRS and OCT. Catheter Cardiovasc Interv. 2014;84(5):710-717. doi:10.1002/ccd.25084.
30. Sathyanarayana S, Carlier S, Li W, Thomas Characterisation of atherosclerotic plaque by spectral similarity of radiofrequency intravascular ultrasound signals. EuroIntervention 5:133–139. EuroIntervention. 2009;(5):133-139.
31. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):87-165. doi:10.1093/eurheartj/ehy394.
32. Patel MR, Dehmer GJ, Hirshfeld JW, Smith PK, Spertus ACCF/SCAI/STS/AATS/AHA/ASNC/HFSA/SCCT 2012 Appropriate Use Criteria for Coronary Revascularization Focused Update. J Am Coll Cardiol. 2012;59(9):857-881. doi:10.1016/j. jacc.2011.12.001.

