Các phương pháp tiếp cận chẩn đoán sớm ung thư phổi: quá khứ, hiện tại và triển vọng nghiên cứu
Nguyễn Thị Phụng, Nguyễn Văn Thọ, Lâm Nguyễn Ngọc Anh
Tải bản PDF TẠI ĐÂY
1 Đặt vấn đề
Theo số liệu thống kê toàn cầu về ung thư, ung thư phổi có tỷ lệ mắc và tử vong cao [1,2]. Ở các nước Châu Á, tỉ lệ ung thư vú là cao nhất ở nữ giới và nam giới thì ung thư phổi đứng hàng đầu [3]. Tỉ lệ mắc ung thư phổi cao khi bệnh nhân có các yếu tố nguy cơ như hút thuốc lá, gia đình có người bị ung thư phổi, phơi nhiễm khí độc, độc chất, tiền sử lao, hen, bệnh phổi tắc nghẽn mạn tính,… Hiện nay, hầu hết bệnh nhân ung thư phổi đều được chẩn đoán ở giai đoạn tiến triển, nhất là ở các nước đang phát triển [1, 3, 4]. Lý do là hầu hết bệnh nhân ung thư phổi có triệu chứng mơ hồ dễ nhầm lẫn trong giai đoạn sớm và nhiều bệnh nhân chỉ được chẩn đoán chắc chắn ở giai đoạn tiến triển. Tiên lượng ung thư phổi có liên quan chặt chẽ với giai đoạn chẩn đoán trên lâm sàng, khi được chẩn đoán sớm có thể cải thiện trực tiếp tiên lượng sống còn của bệnh nhân [1,5].
Do đó, việc lựa chọn phương pháp sàng lọc và chẩn đoán hiệu quả là rất quan trọng để cải thiện tỉ lệ chẩn đoán sớm, điều trị hiệu quả và tiên lượng tốt hơn cho bệnh nhân ung thư phổi.
2 Các phương pháp tiếp cận chẩn đoán sớm ung thư phổi
2.1 Chẩn đoán hình ảnh sàng lọc ung thư phổi
2.1.1 Chụp X-quang ngực tiêu chuẩn
Hiện nay, không nên sử dụng chụp X-quang ngực để phát hiện ung thư phổi do khó phát hiện các tổn thương trong phổi khi tổn thương vùng mù và/hoặc các tổn thương nhỏ. Hơn nữa, theo một số nghiên cứu, cho dù có kết hợp với xét nghiệm tế bào đờm hay không, sàng lọc chụp X-quang ngực không thể làm giảm tỷ lệ tử vong do ung thư phổi.
2.1.2 CT ngực liều thấp (CLDCT)
LDCT được khuyến nghị là phương pháp sàng lọc sớm cho các nhóm có nguy cơ cao [6]. Kết quả nghiên cứu chứng minh rằng so với chụp X-quang ngực, sàng lọc LDCT có thể làm giảm tỷ lệ tử vong 20,0%. Hiệp hội Ung thư Hoa Kỳ (ACS) và nhiều tổ chức y tế khác khuyến cáo rằng sàng lọc LDCT nên được xem xét đầu tiên đối với những bệnh nhân đáp ứng các tiêu chí tuyển chọn có nguy cơ cao như đã nêu trên. Ngoài ra, các hướng dẫn của NCCN cũng đề xuất rằng LDCT được sử dụng để sàng lọc các nhóm có nguy cơ cao, và không nên áp dụng đối với các nhóm có nguy cơ thấp và trung bình [7].
Ưu điểm của LDCT bao gồm liều bức xạ thấp, tốc độ quét nhanh và độ nhạy tương đương với CT. Tuy nhiên, nó không chỉ cho thấy tỷ lệ dương tính giả (FPR) là 23,3% trong NLST, tương tự như kết quả của các nghiên cứu khác, mà còn có một số nhược điểm như chẩn đoán quá mức, phơi nhiễm bức xạ và chi phí cao so với X-quang tiêu chuẩn [8]. Do đó, việc áp dụng LDCT để sàng lọc sớm ung thư phổi vẫn còn nhiều vấn đề cần khắc phục. Ví dụ, làm rõ hơn khoảng thời gian sàng lọc để cân bằng lợi ích và tác hại tiềm ẩn; phân loại chính xác nhóm dân số có nguy cơ cao mắc ung thư phổi để tránh chẩn đoán quá mức và điều trị; và loại mô hình nào nên được thiết lập để đánh giá các loại đặc điểm hình ảnh phổi nào dễ phát triển thành ung thư phổi. Đây là những vấn đề cấp bách cần được giải quyết trong giai đoạn hiện nay.
2.1.3 Chụp cắt lớp phát xạ positron/CT (PET/CT)
PET/CT là sự kết hợp tích hợp giữa thiết bị PET và CT và hình ảnh, có thể hiển thị hình ảnh giải phẫu chính xác và hình ảnh chức năng chuyển hóa mô. Nó đã được sử dụng rộng rãi để xác định tính chất và giai đoạn của khối u. Wang và cộng sự [9] đã tích hợp 1330 bệnh nhân bị tổn thương phổi trong bốn nghiên cứu lâm sàng và phát hiện ra rằng PET/CT có độ nhạy cao hơn (98,7%) và độ đặc hiệu cao hơn (58,2%) trong việc phân biệt các tổn thương phổi lành tính hay ác tính. Tuy nhiên, PET/CT cũng có FPR cao trong sàng lọc ung thư phổi và việc giảm FPR vẫn là một vấn đề nan giải trong chẩn đoán sớm ung thư phổi thông qua PET/CT [10]. Ngược lại với CT, PET/CT có thể nâng cao độ chính xác của chẩn đoán u phổi đơn độc (SPN) [11, 12]. Giá trị hấp thụ chuẩn (SUV) của PET/CT phản ánh quá trình chuyển hóa và độ ác tính của các mô bị bệnh trong một số hoàn cảnh nhất định [13]. Tuy nhiên, PET/CT cũng có những nhược điểm của nó, ví dụ, có các hiện tượng chuyển động hô hấp làm sai lệch kết quả, quá trình chuyển hóa FDG không chỉ có ở khối u và đặc biệt chi phí rất cao, thiết bị rất khó tiếp cận.
2.2 Nội soi phế quản chẩn đoán sớm và chẩn đoán ung thư phổi
Giải phẫu bệnh lý (mô bệnh học) được coi là tiêu chuẩn vàng để chẩn đoán ung thư. Có nhiều phương pháp để lấy mẫu mô học, trong đó, nội soi phế quản, siêu âm nội soi hoặc sinh thiết u phổi xuyên qua da dưới hướng dẫn của siêu âm hoặc CT thường được áp dụng trong thực hành. Trong số đó, nội soi phế quản đã phát triển nhanh chóng và được thực hiện rộng rãi trong những năm gần đây. Nó không chỉ mở rộng tầm nhìn để chẩn đoán mà còn cải thiện hiệu quả chẩn đoán, đã có nhiều nghiên cứu chứng minh điều này.
2.2.1 Nội soi phế quản ánh sáng trắng (WLB)
Chủ yếu được sử dụng để phát hiện và chẩn đoán sớm ung thư phổi trung tâm, và tỷ lệ chẩn đoán có thể đạt hơn 95% trong việc phát hiện loạn sản cấp độ cao hoặc tệ hơn. Tuy nhiên, đối với một số tổn thương sớm ở niêm mạc, dưới niêm mạc và tổn thương tiền ung thư, tỷ lệ chẩn đoán rất thấp (<30%) [14].
2.2.2 Nội soi phế quản tự huỳnh quang (AFB)
Nguyên lý hoạt động của AFB là phổ khác nhau xuất hiện trong các mô bình thường, loạn sản và ung thư biểu mô tại chỗ [15]. Là một phương tiện quan trọng để phát hiện sớm các tổn thương tiền ác tính ở phế quản, một số nghiên cứu đã đề xuất rằng so với tế bào học đờm, độ nhạy của AFB trong việc phát hiện tăng sản và chuyển sản cao hơn. Bất kể kết quả của tế bào học đờm, AFB có thể được khuyến nghị cho những bệnh nhân có nguy cơ cao. Hơn nữa, khi kết hợp với chụp cắt lớp vi tính xoắn ốc (SCT), xét nghiệm đờm hoặc WLB, AFB rõ ràng có thể nâng cao tỷ lệ chẩn đoán các tổn thương tiền ác tính và ung thư biểu mô tại chỗ [16]. Tuy nhiên, do chi phí thiết bị và đòi hỏi kỹ thuật cao nên phương pháp này vẫn chưa được chấp nhận rộng rãi và cũng chưa có trong thực hành lâm sàng ở Việt nam.
2.2.3 Chụp ảnh dải hẹp (NBI)
NBI là một kỹ thuật chụp ảnh có thể hình dung hình thái mạch máu và cấu trúc niêm mạc. Một phân tích tổng hợp chỉ ra rằng NBI có độ nhạy cao hơn (80%), độ đặc hiệu (84%) và tỷ lệ chênh lệch chẩn đoán (DOR 31,49%) so với AFB trong việc phát hiện các tổn thương đường thở tiền ác tính [17]. Một phân tích tổng hợp khác cho thấy NBI cũng vượt trội hơn WLB trong việc phát hiện ung thư phổi giai đoạn sớm và xâm lấn [18]. Bên cạnh đó, một nghiên cứu triển vọng cho thấy rằng mô hình thị giác mạch máu chấm hỗ trợ mạnh mẽ mô học ung thư biểu mô tuyến của ung thư phổi và các mạch máu ngoằn ngoèo ủng hộ ung thư biểu mô tế bào vảy [19]. Do đó, khi kiểm tra các tổn thương chiếm chỗ phổi bằng NBI, không chỉ có thể cải thiện tỷ lệ chẩn đoán mà còn có thể đánh giá ban đầu loại bệnh lý. Vì vậy, trong việc phát hiện ung thư phổi giai đoạn đầu, NBI có thể được sử dụng như một phương pháp hiệu quả.
2.2.4 Nội soi phế quản và siêu âm nội soi (EBUS)
EBUS kết hợp với kim sinh thiết hút đặc biệt có thể được sử dụng để sinh thiết hút kim xuyên phế quản dưới hướng dẫn siêu âm khi tiến hành nội soi phế quản, cụ thể là EBUS-TNAB [20]. Trong một thử nghiệm có đối chứng ngẫu nhiên [21], khi EBUS-TBNA được sử dụng làm phương pháp kiểm tra ban đầu sau khi chụp CT ở những bệnh nhân nghi ngờ ung thư phổi, phương pháp này có thể cung cấp chẩn đoán chính xác và phân loại hạch bạch huyết. So với các chiến lược chẩn đoán truyền thống, EBUS-TNAB có thể rút ngắn thời gian ra quyết định điều trị và có thể cải thiện khả năng sống sót của bệnh nhân ung thư phổi mà không làm tăng chi phí. Hiện tại, ở Việt nam, một số bệnh viện lớn đã trang bị máy móc và thực hành cũng như có kế hoạch đào tạo kỹ năng bài bản, hướng đến một giai đoạn chẩn đoán ung thư phổi nhanh chóng – chính xác tiết kiệm thời gian và chi phí.
Do tính không đồng nhất của khối u, sinh thiết mô chỉ biểu thị trạng thái của khối u tại một thời điểm nhất định và chỉ một phần của khối u ác tính, không thể phản ánh quá trình phát triển động của bệnh [22]. Hơn nữa, nhiều lần sinh thiết sẽ rất xâm lấn đối với bệnh nhân nếu kết quả âm tính khi tiếp cận lần đầu, do đó cần thiết kế các công nghệ mới để cải thiện tình trạng tiến thoái lưỡng nan này. Sinh thiết lỏng có thể thay thế và bổ sung cho phương pháp này với cơ sở khoa học sinh thiết lỏng dựa vào giả thiết hình thành khối u được chấp nhận rộng rãi nhất hiện nay [23, 24] (Hình 1).
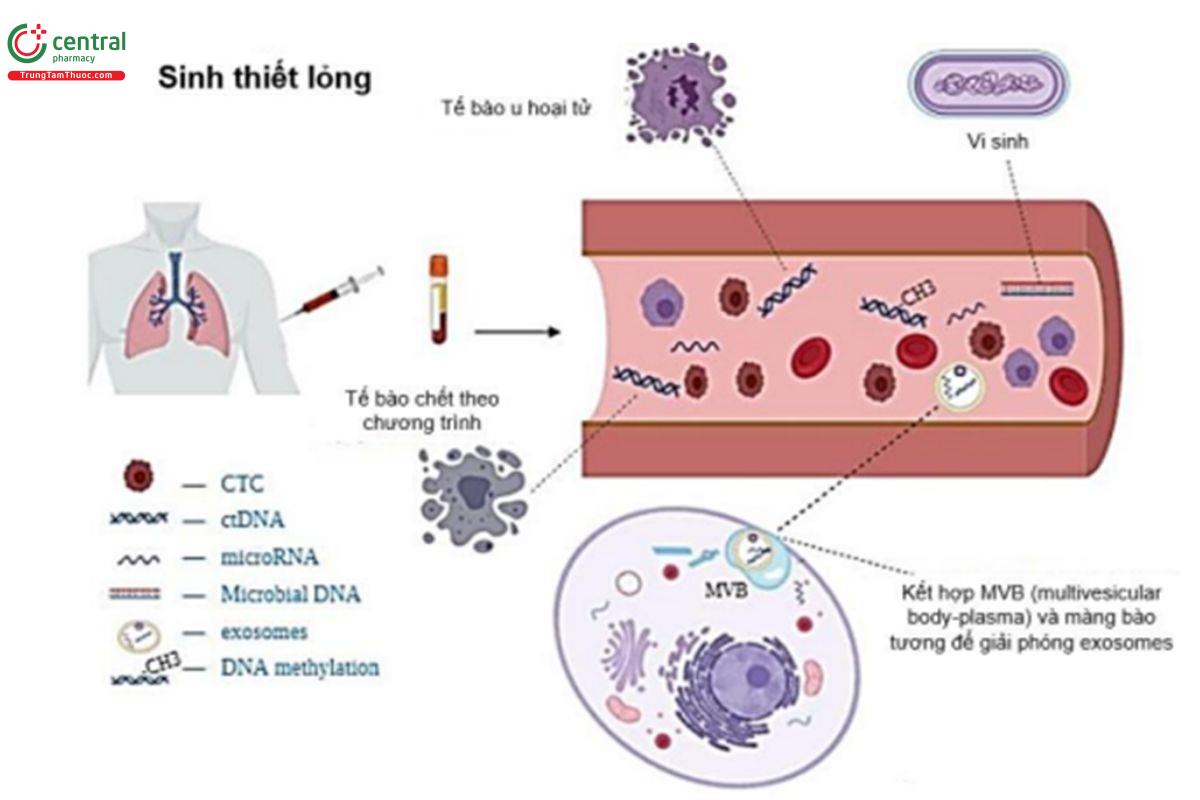
2.3 Sinh thiết lỏng và vai trò sàng lọc trong ung thư phổi
2.3.1 Tế bào khối u trong tuần hoàn (CTCs)
Là tế bào ung thư được giải phóng vào máu ngoại vi từ một khối u nguyên phát hoặc di căn [23]. Việc thu thập tế bào u có ý nghĩa rất lớn đối với việc phát hiện sớm, chẩn đoán, tiên lượng và theo dõi điều trị ung thư, cũng như hiểu được sinh học cơ bản của quá trình di căn [25]. Hàm lượng tế bào ung thư cực kỳ thấp (1-10 tế bào/1ml máu ngoại vi), làm cho công nghệ tách và làm giàu tế bào u trở nên khó khăn. Hệ thống CellSearch đã được FDA chấp thuận là phương pháp đầu tiên và duy nhất để phát hiện tế bào ung thư trong hệ tuần hoàn [26]. Bộ dụng cụ phát hiện CellSearch CTC chứa thuốc thử thu thập dựa trên ferrofluid và thuốc thử miễn dịch huỳnh quang.
Thuốc thử gốc ferrofluid là hạt có lõi từ, bề mặt của hạt được phủ kháng thể nhận diện kháng nguyên EpCAM. EpCAM là kháng nguyên đặc hiệu tế bào ung thư. Do đó, các hạt từ có thể bắt giữ tế bào u được tìm thấy. Sau khi bắt giữ miễn dịch và làm giàu, thuốc thử huỳnh quang được sử dụng để xác định tế bào u và đếm số lượng tế bào. Các tế bào EpCAM (+) CK (+) DAPI (+) CD45 (-) được định nghĩa là tế bào ung thư trong tuần hoàn. Ngoài ra, còn có những cách phổ biến khác để phát hiện tế bào u trong tuần hoàn (Bảng 1).
Lou và cs [27] và Zhang và cs. [28] cho rằng tế bào u trong tuần hoàn có thể được phát hiện trong ung thư phổi, đặc biệt là giai đoạn I đến IIIA. He và cs [29] đã đánh giá rằng tỷ lệ phát hiện tế bào u tuần hoàn (CTC>1) của ung thư phổi giai đoạn I và giai đoạn II cao tới 62,5% khi sử dụng CellCollector và có 71,6% điểm tương đồng giữa tế bào tuần hoàn và mô khối u tại vị trí đột biến gen của TP53, FGFR1, HER2, PDGFRA và CFS1R. Đây là lần đầu tiên các đặc điểm biến đổi phân tử và di truyền của tế bào u tuần hoàn là ung thư phổi giai đoạn đầu được phát hiện và cung cấp dữ liệu mới hỗ trợ cho ứng dụng lâm sàng của CTC như một chẩn đoán phân tử của ung thư phổi giai đoạn đầu.
Tóm lại, như một dấu hiệu chẩn đoán sớm, tìm tế bào ung thư du mục trong tuần hoàn cũng có một số hạn chế nhất định. Các phương pháp khuếch đại hợp lý và hiệu quả là những quan trọng và cấp bách nhất cần phải nghiên cứu. Thách thức chính cho phương pháp này là thu được đủ số lượng tế bào u tuần hoàn trong điều kiện tối ưu để đánh giá thêm. Công nghệ đánh giá các đặc điểm phân tử của CTC vẫn đang phát triển và cách chuẩn hóa chúng để ứng dụng lâm sàng cần phải được nghiên cứu sâu rộng.
2.3.2 Gien khối u lưu thông tự do (ctDNA)
Những đoạn gien được giải phóng bởi các tế bào hoại tử hoặc chết theo chương trình vào máu, được gọi là gien tự do lưu thông (cfDNA). Trong máu của bệnh nhân ung thư, có một phần gien được phóng thích từ các tế bào khối u chết được định nghĩa là ctDNA [30]. Thông thường, ctDNA chỉ chiếm 0,01-1% cfDNA và được giải phóng từ nhiều vùng khối u, có thể khắc phục tính không đồng nhất của khối u [31]. Theo nghiên cứu báo cáo rằng huyết tương là nguồn ctDNA tốt [32].
Công nghệ dựa trên bốn thành phần chính là hạt, nhũ tương, khuếch đại và từ tính có thể phát hiện ctDNA một cách định lượng, trong khi công nghệ CAPP-sequencing để phân tích ung thư được cá nhân hóa thông qua giải trình tự sâu đã thay đổi phương thức chẩn đoán ctDNA [33, 34].
Cho đến nay, ctDNA là vật liệu tốt nhất để có được chẩn đoán, tiên lượng và thông tin dự đoán về những thay đổi liên quan đến khối u trong máu của bệnh nhân ung thư [1]. Nghiên cứu của Szpechcinski và cộng sự [35] cho thấy mức ctDNA huyết tương ở những bệnh nhân ung thư phổi không phải tế bào nhỏ (NSCLC) không chỉ cao hơn mức ở những người khỏe mạnh mà còn cao hơn những người mắc bệnh viêm đường hô hấp mãn tính. Liang và cs [20] kết hợp ctDNA và metyl hóa DNA để phân biệt ung thư phổi và các nốt lành tính.
Độ nhạy và độ đặc hiệu của phương pháp phân biệt khối u ác tính và tổn thương lành tính là 79,5% (63,5%~90,7%) và 85,2% (66,3%~95,8%). Phương pháp xác định ung thư phổi giai đoạn IB (độ nhạy = 85,7%) cũng tốt hơn giai đoạn IA (độ nhạy = 75,0%). Hơn nữa, Chen và cs [36] đã đo ctDNA và DNA mô khối u (tDNA) ở những bệnh nhân mắc NSCLC giai đoạn I đến III bằng phương pháp giải trình tự có mục tiêu. Họ đã tìm thấy các đột biến điều khiển thường gặp trong ctDNA và tDNA, điều này đã xác nhận tính khả thi của phát hiện ctDNA máu ngoại vi trong việc phát hiện sớm các đột biến gen NSCLC. Tuy nhiên, Sozzi và cs [37] báo cáo rằng so với các đối tượng không bị ung thư, mức độ DNA cơ bản của nhóm đối tượng phát triển ung thư trong giai đoạn 5 năm (n = 38) không có sự khác biệt đáng kể (AUC = 0,496), chỉ cao hơn một chút so với mức cơ bản tại thời điểm chẩn đoán. Nhưng mức độ ctDNA cao có nhiều khả năng phát triển ung thư phổi ở những cá nhân hút thuốc nhiều trong một giai đoạn kéo dài.
Mặc dù phân tích ctDNA cung cấp một lựa chọn khả thi để chẩn đoán sớm ung thư phổi, các kỹ thuật hiện có vẫn không thể khắc phục được những khó khăn của phân tích độ nhạy. Ngoài ra, còn nhiều vấn đề cần giải quyết, bao gồm thiếu giá trị ngưỡng đáng tin cậy, độ tinh khiết cần thiết của ctDNA, tỷ lệ thấp ctDNA phản ánh tất cả các đột biến gen và hơn nữa là xét nghiệm này rất đắc tiền cũng như trang thiết bị rất khó tiếp cận [23].
Bên cạnh những phương pháp phát hiện tế bào u, gien đột biến, những nghiên cứu về sinh thiết lỏng có thể tìm thấy Microbial DNA (mbDNA), MicroRNA(miRNA), Circulating exosomes, DNA methylation trong ung thư phổi; tuy nhiên, ở Việt nam chúng ta những kỹ thuật này chưa có ứng dụng rộng rãi.
2.4 Hợp chất hữu cơ dễ bay hơi (VOCS) và sàng lọc ung thư phổi (breath biopsy)
Trong những năm gần đây, việc phát hiện VOC có ưu điểm là nhanh chóng, không xâm lấn, thuận tiện, độ nhạy cao và khả năng lặp lại tốt [20]. Hơi thở thở ra chứa rất nhiều chất, hầu hết là VOCs [38]. Sinh thiết hơi thở (breath biopsy) là một phương pháp chẩn đoán mới, nó đã trở thành chủ đề nghiên cứu rất được quan tâm. Ví dụ, Zhong và cs [39] đã xây dựng một mảng màu dùng một lần từ nhiều chất tạo màu phản ứng hóa học khác nhau. Thông qua tương tác hóa học với VOCs, các mảng này có thể phân biệt 20 loại VOC khác nhau liên quan đến ung thư phổi trong quá trình thở ra với độ chính xác ít nhất là 90%. Li và cs [40] đã phát triển phổ khối quang ion hóa áp suất thấp hỗ trợ doping (DA-LPPI), chứng minh hiệu quả của công nghệ DA-LPPI ichloromethane trong việc phát hiện các VOC phân cực liên quan đến ung thư phổi.
Hiện nay, có nhiều loại VOC và nguồn gốc của chúng rất phức tạp. Khó khăn chính là nhiều kỹ thuật và phương pháp thử nghiệm được sử dụng trong việc thu thập, xử lý, lưu trữ và thử nghiệm mẫu vẫn thiếu các tiêu chuẩn thống nhất [41]. Do đó, mặc dù vẫn còn nhiều thách thức lớn trong việc chuyển đổi sang các ứng dụng lâm sàng, nhưng triển vọng to lớn trong việc phát hiện ung thư phổi của “sinh thiết hơi thở” là không thể phủ nhận.
3 Kết luận
Trong số các phương pháp sàng lọc và chẩn đoán sớm ung thư phổi nêu trên, sàng lọc bằng X quang tiêu chuẩn không được khuyến cáo. CT ngực liều thấp (LDCT) có những ưu điểm rõ ràng và là phương pháp chẩn đoán hình ảnh hứa hẹn nhất trong sàng lọc sớm ung thư phổi. Nội soi phế quản có ưu điểm lớn hơn trong việc quan sát trực tiếp các tổn thương trong lòng phế quản và có thể được sử dụng như một công cụ thế mạnh trong chẩn đoán xác định. Sinh thiết lỏng, sinh thiết hơi thở là hai kỹ thuật đặc biệt, rất đơn giản và không xâm lấn nhưng khó tiếp cận trong hiện tại. Đặc biệt, sinh thiết lỏng, đang là điểm nóng và là hướng nghiên cứu tiềm năng về chẩn đoán sớm ung thư phổi trong những năm gần đây. Tuy nhiên, hiện tại không có ngưỡng rõ ràng và giao thức vận hành tiêu chuẩn cho sinh thiết lỏng, cũng như giai đoạn khối u không thể được đánh giá như CT. Do đó, nghiên cứu việc kết hợp LDCT và sinh thiết lỏng để chẩn đoán ung thư phổi hoặc phát triển một phương pháp chẩn đoán hợp lý hơn có thể đạt được mục tiêu phát hiện sớm, chẩn đoán sớm và điều trị sớm, có lợi cho bệnh nhân ung thư phổi rất đáng được quan tâm.
4 Tài liệu tham khảo
1. The National Lung Screening Trial: Overview and Study Design. 2011;258(1):243-53. doi: 10.1148/radiol.10091808. PubMed PMID: 21045183.
2. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. 2018;68(6):394-424. doi: https://doi.org/10.3322/caac.21492.
3. Dee EC, Laversanne M, Bhoo-Pathy N, Ho FDV, Feliciano EJG, Eala MAB, et al. Cancer incidence and mortality estimates in 2022 in southeast Asia: a comparative analysis. The Lancet Oncology. 2025. Epub 2025/03/03. doi: 10.1016/s1470-2045(25)00017-8. PubMed PMID: 40024257.
4. Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M, Nikšić M, et al. Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. The Lancet. 2018;391(10125):1023-75. doi: 10.1016/S0140-6736(17)33326-3.
5. Goldstraw P, Chansky K, Crowley J, Rami-Porta R, Asamura H, Eberhardt WEE, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. Journal of Thoracic Oncology. 2016;11(1):39-51. doi: 10.1016/j.jtho.2015.09.009.
6. Shen H. Low-dose CT for lung cancer screening: opportunities and challenges. Frontiers of Medicine. 2018;12(1):116-21. doi: 10.1007/s11684-017-0600-1.
7. Smith RA, Andrews KS, Brooks D, Fedewa SA, Manassaram-Baptiste D, Saslow D, et al. Cancer screening in the United States, 2019: A review of current American Cancer Society guidelines and current issues in cancer screening. 2019;69(3):184-210. doi: https://doi.org/10.3322/caac.21557.
8. Infante M, Cavuto S, Lutman FR, Passera E, Chiarenza M, Chiesa G, et al. Long-Term Follow-up Results of the DANTE Trial, a Randomized Study of Lung Cancer Screening with Spiral Computed Tomography. American journal of respiratory and critical care medicine. 2015;191(10):1166-75. Epub 2015/03/12. doi: 10.1164/rccm.201408-1475OC. PubMed PMID: 25760561.
9. Wang HQ, Zhao L, Zhao J, Wang Q. Analysis on early detection of lung cancer by PET/CT scan. Asian Pacific journal of cancer prevention: APJCP. 2015;16(6):2215-7. Epub 2015/04/01. doi: 10.7314/apjcp.2015.16.6.2215. PubMed PMID: 25824740.
10. Deppen SA, Blume JD, Kensinger CD, Morgan AM, Aldrich MC, Massion PP, et al. Accuracy of FDG-PET to diagnose lung cancer in areas with infectious lung disease: a meta-analysis. Jama. 2014;312(12):1227-36. Epub 2014/09/24. doi: 10.1001/jama.2014.11488. PubMed PMID: 25247519; PubMed Central PMCID: PMC4315183.
11. Spadafora M, Pace L, Mansi L. Segmental (18)F-FDG-PET/CT in a single pulmonary nodule: a better cost/effectiveness strategy. European journal of nuclear medicine and molecular imaging. 2017;44(1):1-4. Epub 2016/10/04. doi: 10.1007/s00259-016-3532-0. PubMed PMID: 27695909.
12. Chang CY, Tzao C, Lee SC, Cheng CY, Liu CH, Huang WS, et al. Incremental value of integrated FDG-PET/CT in evaluating indeterminate solitary pulmonary nodule for malignancy. Molecular imaging and biology. 2010;12(2):204-9. Epub 2009/06/23. doi: 10.1007/s11307-009-0241-0. PubMed PMID: 19543947.
13. Hui Z, Wei F, Ren H, Xu W, Ren X. Primary tumor standardized uptake value (SUVmax) measured on (18)F-FDG PET/CT and mixed NSCLC components predict survival in surgical-resected combined small-cell lung cancer. Journal of cancer research and clinical oncology. 2020;146(10):2595-605. Epub 2020/06/05. doi: 10.1007/s00432-020-03240-8. PubMed PMID: 32494919; PubMed Central PMCID: PMC7467962.
14. Inage T, Nakajima T, Yoshino I, Yasufuku K. Early Lung Cancer Detection. Clinics in chest medicine. 2018;39(1):45-55. Epub 2018/02/13. doi: 10.1016/j.ccm.2017.10.003. PubMed PMID: 29433724.
15. Hung J, Lam S, LeRiche JC, Palcic B. Autofluorescence of normal and malignant bronchial tissue. Lasers in surgery and medicine. 1991;11(2):99-105. Epub 1991/01/01. doi: 10.1002/lsm.1900110203. PubMed PMID: 2034016.
16. Loewen G, Natarajan N, Tan D, Nava E, Klippenstein D, Mahoney M, et al. Autofluorescence bronchoscopy for lung cancer surveillance based on risk assessment. Thorax. 2007;62(4):335-40. Epub 2006/11/15. doi: 10.1136/thx.2006.068999. PubMed PMID: 17101735; PubMed Central PMCID: PMC2092474.
17. Iftikhar IH, Musani AI. Narrow-band imaging bronchoscopy in the detection of premalignant airway lesions: a meta-analysis of diagnostic test accuracy. Therapeutic advances in respiratory disease. 2015;9(5):207-16. Epub 2015/06/19. doi: 10.1177/1753465815589698. PubMed PMID: 26085510.
18. Zhu J, Li W, Zhou J, Chen Y, Zhao C, Zhang T, et al. The diagnostic value of narrow-band imaging for early and invasive lung cancer: a meta-analysis. Clinics (Sao Paulo, Brazil). 2017;72(7):438-48. Epub 2017/08/10. doi: 10.6061/clinics/2017(07)09. PubMed PMID: 28793005; PubMed Central PMCID: PMC5525163.
19. Zaric B, Perin B, Stojsic V, Carapic V, Eri Z, Panjkovic M, et al. Relation between vascular patterns visualized by Narrow Band Imaging (NBI) videobronchoscopy and histological type of lung cancer. Medical oncology (Northwood, London, England). 2013;30(1):374. Epub 2013/01/01. doi: 10.1007/s12032-012-0374-x. PubMed PMID: 23275117.
20. Aberle DR, Adams AM, Berg CD, Black WC, Clapp JD, Fagerstrom RM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. The New England journal of medicine. 2011;365(5):395-409. Epub 2011/07/01. doi: 10.1056/NEJMoa1102873. PubMed PMID: 21714641; PubMed Central PMCID: PMC4356534.
21. Navani Nea. Lung cancer diagnosis and staging with endobronchial ultrasound-guided transbronchial needle aspiration compared with conventional approaches: an open-label, pragmatic, randomised controlled trial. The Lancet Respiratory Medicine. 2015;3(4):282-9.
22. Tan DS, Camilleri-Broët S, Tan EH, Alifano M, Lim WT, Bobbio A, et al. Intertumor heterogeneity of non-small-cell lung carcinomas revealed by multiplexed mutation profiling and integrative genomics. International journal of cancer. 2014;135(5):1092-100. Epub 2014/02/01. doi: 10.1002/ijc.28750. PubMed PMID: 24482041.
23. Rijavec E, Coco S, Genova C, Rossi G, Longo L, Grossi F. Liquid Biopsy in Non-Small Cell Lung Cancer: Highlights and Challenges. Cancers. 2019;12(1). Epub 2019/12/22. doi: 10.3390/cancers12010017. PubMed PMID: 31861557; PubMed Central PMCID: PMC7017364.
24. Strotman LN, Millner LM, Valdes R, Jr., Linder MW. Liquid Biopsies in Oncology and the Current Regulatory Landscape. Molecular diagnosis & therapy. 2016;20(5):429-36. Epub 2016/06/22. doi: 10.1007/s40291-016-0220- 5. PubMed PMID: 27324559.
25. Sequist LV, Nagrath S, Toner M, Haber DA, Lynch TJ. The CTC-chip: an exciting new tool to detect circulating tumor cells in lung cancer patients. Journal of thoracic oncology: official publication of the International Association for the Study of Lung Cancer. 2009;4(3):281-3. Epub 2009/02/28. Doi: 10.1097/JTO.0b013e3181989565. PubMed PMID: 19247082; PubMed Central PMCID: PMC4486079.
26. Andree KC, van Dalum G, Terstappen LW. Challenges in circulating tumor cell detection by the CellSearch system. Molecular oncology. 2016;10(3):395-407. Epub 2016/01/23. doi: 10.1016/j.molonc.2015.12.002. PubMed PMID: 26795350; PubMed Central PMCID: PMC5528971.
27. Lou J, Ben S, Yang G, Liang X, Wang X, Ni S, et al. Quantification of rare circulating tumor cells in non-small cell lung cancer by ligand-targeted PCR. PloS one. 2013;8(12):e80458. Epub 2013/12/11. doi: 10.1371/journal.pone.0080458. PubMed PMID: 24324600; PubMed Central PMCID: PMC3855610 Genosaber Biotech. At the same time, he holds minor stock options (<5%). During the period of research, Dr. Yang only provides technical support to us for completing the clinical research. This technical support includes data analysis and technical description of the method in the manuscript. This does not alter the authors' adherence to all the PLOS ONE policies on sharing data and materials.
28. Zhang Z, Shiratsuchi H, Lin J, Chen G, Reddy RM, Azizi E, et al. Expansion of CTCs from early stage lung cancer patients using a microfluidic co-culture model. Oncotarget. 2014;5(23):12383-97. Epub 2014/12/05. doi: 10.18632/oncotarget.2592. PubMed PMID: 25474037; PubMed Central PMCID: PMC4323004.
29. He Y, Shi J, Schmidt B, Liu Q, Shi G, Xu X, et al. Circulating Tumor Cells as a Biomarker to Assist Molecular Diagnosis for Early Stage Non-Small Cell Lung Cancer. Cancer management and research. 2020;12:841-54. Epub 2020/02/28. doi: 10.2147/cmar.S240773. PubMed PMID: 32104066; PubMed Central PMCID: PMC7008188.
30. Spellman PT, Gray JW. Detecting cancer by monitoring circulating tumor DNA. Nature medicine. 2014;20(5):474- 5. Epub 2014/05/09. doi: 10.1038/nm.3564. PubMed PMID: 24804754.
31. Santarpia M, Liguori A, D'Aveni A, Karachaliou N, Gonzalez-Cao M, Daffinà MG, et al. Liquid biopsy for lung cancer early detection. Journal of thoracic disease. 2018;10(Suppl 7):S882-s97. Epub 2018/05/22. doi: 10.21037/jtd.2018.03.81. PubMed PMID: 29780635; PubMed Central PMCID: PMC5945693.
32. Vallée A, Marcq M, Bizieux A, Kouri CE, Lacroix H, Bennouna J, et al. Plasma is a better source of tumor-derived circulating cell-free DNA than serum for the detection of EGFR alterations in lung tumor patients. Lung cancer (Amsterdam, Netherlands). 2013;82(2):373-4. Epub 2013/09/07. doi: 10.1016/j.lungcan.2013.08.014. PubMed PMID: 24007628.
33. Herbreteau G, Vallée A, Charpentier S, Normanno N, Hofman P, Denis MG. Circulating free tumor DNA in non small cell lung cancer (NSCLC): clinical application and future perspectives. Journal of thoracic disease. 2019;11(Suppl 1):S113-s26. Epub 2019/02/19. doi: 10.21037/jtd.2018.12.18. PubMed PMID: 30775034; PubMed Central PMCID: PMC6353745.
34. Moding EJ, Diehn M, Wakelee HA. Circulating tumor DNA testing in advanced non-small cell lung cancer. Lung cancer (Amsterdam, Netherlands). 2018;119:42-7. Epub 2018/04/17. doi: 10.1016/j.lungcan.2018.02.019. PubMed PMID: 29656751.
35. Szpechcinski A, Chorostowska-Wynimko J, Struniawski R, Kupis W, Rudzinski P, Langfort R, et al. Cell-free DNA levels in plasma of patients with non-small-cell lung cancer and inflammatory lung disease. British journal of cancer. 2015;113(3):476-83. Epub 2015/07/01. doi: 10.1038/bjc.2015.225. PubMed PMID: 26125447; PubMed Central PMCID: PMC4522634.
36. Chen KZ, Lou F, Yang F, Zhang JB, Ye H, Chen W, et al. Circulating Tumor DNA Detection in Early-Stage Non Small Cell Lung Cancer Patients by Targeted Sequencing. Scientific reports. 2016;6:31985. Epub 2016/08/25. doi: 10.1038/srep31985. PubMed PMID: 27555497; PubMed Central PMCID: PMC4995492 Valley Biotechnology Inc. in Beijing, China. All other authors declare no conflict of interest.
37. Sozzi G, Roz L, Conte D, Mariani L, Andriani F, Lo Vullo S, et al. Plasma DNA quantification in lung cancer computed tomography screening: five-year results of a prospective study. American journal of respiratory and critical care medicine. 2009;179(1):69-74. Epub 2008/09/13. doi: 10.1164/rccm.200807-1068OC. PubMed PMID: 18787214.
38. Wang M, Sheng J, Wu Q, Zou Y, Hu Y, Ying K, et al. Confounding effect of benign pulmonary diseases in selecting volatile organic compounds as markers of lung cancer. Journal of breath research. 2018;12(4):046013. Epub 2018/08/14. doi: 10.1088/1752-7163/aad9cc. PubMed PMID: 30102249.
39. Zhong X, Li D, Du W, Yan M, Wang Y, Huo D, et al. Rapid recognition of volatile organic compounds with colorimetric sensor arrays for lung cancer screening. Analytical and bioanalytical chemistry. 2018;410(16):3671- 81. Epub 2018/04/15. doi: 10.1007/s00216-018-0948-3. PubMed PMID: 29654337.
40. Li Z, Xu C, Shu J, Yang B, Zou Y. Doping-assisted low-pressure photoionization mass spectrometry for the real time detection of lung cancer-related volatile organic compounds. Talanta. 2017;165:98-106. Epub 2017/02/06. doi: 10.1016/j.talanta.2016.12.039. PubMed PMID: 28153325.
41. Zhou J, Huang ZA, Kumar U, Chen DDY. Review of recent developments in determining volatile organic compounds in exhaled breath as biomarkers for lung cancer diagnosis. Analytica chimica acta. 2017;996:1-9. Epub 2017/11/16. doi: 10.1016/j.aca.2017.09.021. PubMed PMID: 29137702

