Các phác đồ kích thích buồng trứng trong điều trị vô sinh hiếm muộn

Đại học Huế - Trường ĐH Y Dược
Đồng chủ biên
GS.TS. Nguyễn Vũ Quốc Huy
GS.TS. Cao Ngọc Thành
PGS.TS. Lê Minh Tâm
PGS.TS. Trương Thành Vinh
Cùng nhiều tác giả tham gia biên soạn.
1 CHỈ ĐỊNH KÍCH THÍCH BUỒNG TRỨNG
1.1 Phân loại của Tổ chức y tế thế giới về rối loạn phóng noãn
1.1.1 Nhóm I: Suy vùng dưới đói – tuyến yên
Nhóm này gồm những bệnh nhân được chẩn đoán là vô kinh do suy vùng dưới đói, gồm vô kinh do stress, chán ăn thần kinh và các biến thể, hội chứng Kallman (không có tế bào chế tiết GnRH) và khiếm khuyết gonadotropin độc lập. Những bệnh nhân này biểu hiện thiểu năng tuyến sinh dục do thiếu năng tuyến yên (hypogonadotropic hypogonadism) với nồng độ gonadotropin và estrogen thấp, nồng độ prolactin bình thưởng, thử nghiệm progestins âm tính.
1.1.2 Nhóm II: Rối loạn chức năng vùng dưới đôi – tuyến yên
Nhóm này bao gồm những người có nồng độ gonadotropin bình thường estrogen bình thường, không phóng noãn, kinh thưa. Hội chúng buồng trứng đa nang cũng được xếp vào nhóm này.
1.1.3 Nhóm III: Suy buồng trứng
Bệnh nhân nhóm này gồm những người thiểu năng tuyến sinh dục với cường chức năng tuyến yên, nồng độ estrogen thấp. Các biến thể của suy buồng trứng và kháng buồng trứng cũng thuộc nhóm này. Trường hợp rối loạn phóng noãn tăng prolactin máu được điều trị đặc hiệu riêng.
1.2 Chỉ định kích thích buồng trứng
1.2.1 Rối loạn phóng noãn
Gồm không phóng noãn và ít phóng noãn, những trường hợp giai đoạn nang noãn kéo dài, không có đỉnh Estradiol phù hợp, không có đỉnh LH phù hợp, thiếu năng giai đoạn hoàng thể.
1.2.2 Kích thích buồng trứng trong hỗ trợ sinh sản
Nhằm tăng số lượng nang noãn phát triển, trưởng thành và phóng noãn tự nhiên hay chọc hút.
2 CÁC PHÁC ĐỒ KÍCH THÍCH BUỒNG TRỨNG
2.1 Clomiphene citrate
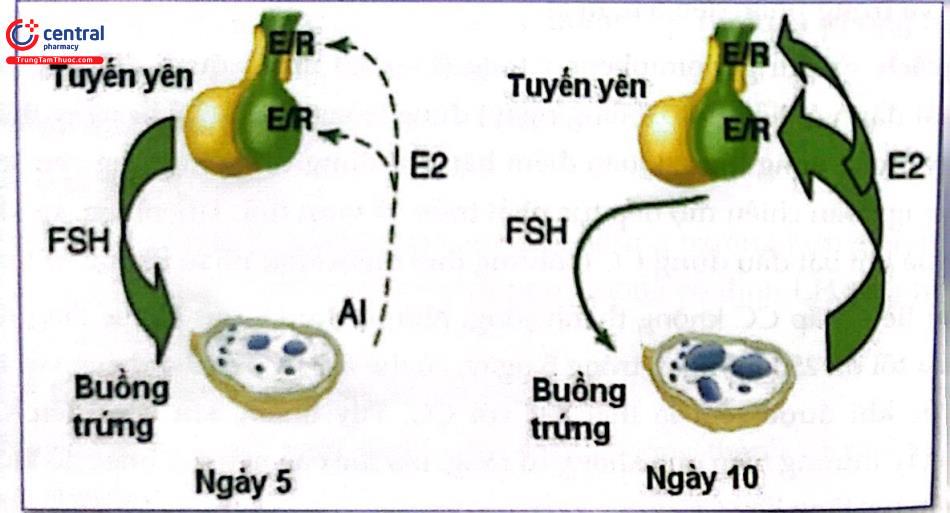
Clomiphene biểu hiện hoạt tính estrogenic rất yếu. Nhờ cấu trúc tương tự với estrogen mà nó có thể gắn lên các thụ thể của estrogen. Clomiphene có thể gắn vào thụ thể nhân trong một thời gian dài, đến vài tuần lễ, làm thay đổi hoạt động của vùng dưới đôi bằng cách ảnh hưởng nồng độ các thụ thể estrogen nội bào. Đặc biệt, nồng độ thụ thể estrogen giảm đi do quá trình “phục hồi” bị ức chế.
Vì thế, khi tiếp xúc với clomiphene, vùng dưới đồi – tuyến yên không thể nhận biết nồng độ estrogen nội sinh thật sự trong tuần hoàn, do số thụ thể giảm đi và tín hiệu “giả” về nồng độ estrogen tuần hoàn đang rất thấp, cơ chế điều hòa ngược âm tính bị mất tác dụng làm hoạt hóa sự chế tiết GnRH.
Do có hoạt tính estrogenic, khi có hiện diện estrogen, clomiphene tăng đáp ứng của tuyến yên với GnRH, thúc đẩy chế tiết FSH, tác động trực tiếp lên buồng trúng. Khi không có hiện diện của estrogen, clomiphene hoạt động như một đồng vận của estrogen, thúc đẩy trực tiếp sự kích thích của FSH trong việc hình thành thụ thể LH trên tế bào hạt.
Đối với tử cung, cổ tử cung và âm đạo, clomiphene biểu hiện hoạt tính kháng estrogen. Nó tác động đối vận làm mỏng biểu mô âm đạo, chất nhầy cổ tử cung ít và đặc, nội mạc tử cung kém phát triển, ảnh hưởng đến sự di chuyển của tinh trùng, khả năng làm tổ và phát triển của phôi.
Clomiphene không có tác dụng progestational, corticotropic, androgenic hay antiandrogenic. Nó không liên quan đến chức năng tuyến thượng thận hay tuyến giáp. Sau khi uống clomiphene 5 ngày, thì chỉ có 51% bị đào thải, nồng độ đáng kể đồng phân zuclomiphene citrate có thể phát hiện trong huyết thanh đến 1 tháng sau uống và trong phân đến 6 tuần lễ.
Về cách sử dụng clomiphene citrate, có nhiều quan điểm khác nhau, thường bắt đầu với liều thấp (50mg/ngày) dùng trong 5 ngày kể từ ngày thứ 2, 3, 4, hoặc ngày 5 của vòng kinh. Quan điểm bắt đầu dùng clomiphene citrate sớm trong chu kỳ nhằm tăng số nang noãn chiêu mộ tiếp tục phát triển và vượt trội. Tuy nhiên, sự khác biệt về hiệu quả khi bắt đầu dùng clomiphene citrate ở những thời điểm khác nhau không rõ ràng.
Nếu liều thấp clomiphene citrate không thành công, những chu kỳ sau có thể tăng liều mỗi 50mg, liều tối đa 250mg/ngày trong 5 ngày, có thể lập lại đến 3-4 tháng với liều cao nhất trước khi được xem là thất bại với clomiphene citrate. Tuy nhiên, khi tăng liều clomiphene citrate trên 150mg/ngày thường hiệu quả không rõ ràng, mà lúc này nên đổi phác đồ kích thích hơn là tiếp tục tăng liều clomiphene citrate.
Một số tác dụng phụ của Clomiphene được ghi nhận: nóng bừng (10%), căng bụng (5%), đau ngực (2%), buồn nôn (2,2%), mờ mắt (1,5%), nhức đầu (1,3%), rụng tóc (0,5%)... Tuy nhiên, các triệu chứng thường biểu hiện nhẹ và tự khỏi sau vài ngày, ít khi phải ngưng điều trị vì tác dụng phụ. Clomiphene citrate hiện có trên thị trường dạng viên nén hàm lượng 50mg như Clomid (Merrell), Serophene (Serono) hay ovofar (Organon), Clomhexal (Hexal), Duinum...
2.2 Chất ức chế men thơm hóa
Aromatase là thành viên của họ enzyme chứa heamoprotein P450 cytochrome (P450arom) xúc tác quá trình thơm hóa sản xuất estrogen, cụ thể là chuyển androstenedione và Testosterone tương ứng thành estrone và estradiol. Hoạt động thơm hóa diễn ra ở nhiều loại mô khác nhau như mô buồng trứng não, mỡ, gan, cơ, mô vú. Nguồn estrogen chủ yếu lưu hành ở phụ nữ độ tuổi sinh sản là từ buồng trứng, phụ nữ sau mãn kinh là từ mô mỡ.
Quá trình thơm hóa là bước cuối cùng trong sinh tổng hợp estrogen. Khi sử dụng AI, đặc biệt là AI thế hệ thứ ba, vào đầu chu kỳ kinh nguyệt, nó sẽ ngăn chặn sản xuất estrogen do ức chế quá trình thơm hóa. Vì thế nồng độ estrogen trong tuần hoàn giảm đi thật sự. Vùng dưới đồi và tuyến yên lúc này không còn bị ức chế do điều hòa ngược âm tính của estrogen sẽ tăng hoạt động kích thích sản xuất gonadotropin nội sinh. Ở ngoại biên, AI tác động lên buồng trứng gây tăng nhạy cảm của nang noãn với FSH. Đây có thể là do sự tích tụ androgen trong nang noãn do quá trình thơm hóa bị ngăn chặn trước đó.
AI được dùng để kích thích buồng trứng bắt đầu từ ngày 2 của chu kỳ, kéo dài trong 5 ngày. Liều đề nghị Letrozole (Femara 2,5mg. Norvatis) 2,5 – 5mg/ngày hoặc Anastrozole (Arimidex 1mg, Astra Zeneca) liều 2 – 5mg/ngày.
Các nghiên cứu ban đầu về tác dụng của AI cho thấy, AI có tác dụng kích thích buồng trứng ở bệnh nhân không rụng trứng, gia tăng rụng trứng ở bệnh nhân có rụng trứng, kích thích buồng trứng ở những bệnh nhân thất bại với clomiphene citrate và giảm liều FSH trong kích thích buồng trứng. So với clomiphene citrate, Al có thời gian bán hủy ngắn nên không tích lũy trong cơ thể, không có tác dụng điều hòa giảm thụ thể estrogen tại mô đích do không có tác dụng kháng estrogen, không gây các tác động bất lợi như làm mỏng nội mạc tử cung hay giảm chất nhầy cổ tử cung. Một số nghiên cứu cho thấy, dù nồng độ E2 khi dùng AI có thể thấp hơn so với khi dùng clomiphene citrate, nhưng nội mạc tử cung dày hơn và tỷ lệ có thai có vẻ như cải thiện hơn so với clomiphene citrate. Tuy nhiên, thời gian bán hủy ngắn cũng là một khuyết điểm của AI khi không thể duy trì tác dụng được lâu sau khi ngừng thuốc, nhưng nếu dùng kéo dài sẽ làm thiếu estrogen.
2.3 Gonadotropins
Trong hơn 30 năm qua, chế phẩm gonadotropin được sử dụng là gonadotropin của phụ nữ mãn kinh (human menopausal gonadotropin - hMG) được chiết xuất từ nước tiểu của phụ nữ mãn kinh. Những năm gần đây các chế phẩm FSH nước tiểu tinh khiết cao xuất hiện trên thị trường sau khi tách bỏ phần lớn lượng LH. Sản phẩm này có thể tiêm bắp hoặc tiêm dưới da. Các nghiên cứu tổng hợp đã cho thấy hiệu quả điều trị với hMG cho hiệu quả tương đương với các loại FSH tái tổ hợp.
FSH tái tổ hợp được sản xuất từ các tế bào buồng trứng chuột Chinese Hamster sau khi chuyển gene của FSH người vào. FSH tái tổ hợp đồng nhất và tinh khiết cao, hoạt tính sinh học hiệu quả và ổn định, an toàn vì không sợ lây nhiễm bệnh, có thể dùng đường tiêm dưới da. HCG và LH tái tổ hợp hiện nay cũng đã có trên thị trường. Các chế phẩm này cho phép bệnh nhân tự tiêm vào dưới da.
Để bắt đầu điều trị với gonadotropin ngoại sinh, bệnh nhân cần phải được giải thích rõ ràng mục đích, chế độ điều trị, phương pháp theo dõi và những nguy cơ có thể xảy ra. Kết quả tối ưu tùy vào kinh nghiệm và khả năng xét đoán của người thầy thuốc chứ không phải tùy loại thuốc sử dụng.
Liều lượng thuốc sử dụng rất khác nhau, thay đổi giữa các bệnh nhân, cũng như trên cùng một bệnh nhân ở những thời điểm khác nhau, trong đó liều khởi đầu là một yếu tố quan trọng. Thường người ta bắt đầu với FSH liều thấp 50-75IU/ngày, từ ngày 2-3 chu kỳ kinh, dùng liên tục hoặc cách ngày. Đánh giá đáp ứng của bệnh nhân vào ngày 7 chu kỳ qua hình ảnh siêu âm nang noãn đầu dò âm đạo, quan sát số lượng và kích thước của nang noãn. Đồng thời theo dõi nồng độ estrogen do các nang noãn đang phát triển chế tiết vào tuần hoàn. Lúc này là thời điểm quan trọng trong việc quyết định liều FSH tiếp theo cho bệnh nhân, liên quan đến khả năng thành công của kích thích buồng trứng. Sau ngày 7, theo dõi bệnh nhân mỗi ngày hoặc cách ngày để điều chỉnh liều thuốc tương ứng với đáp ứng của buồng trứng. Hiệu quả kích thích buồng trứng thường sau 7-12 ngày dùng gonadotropin tốt nhất là trên 10 ngày. Nếu dưới 10 ngày, tỷ lệ sảy thai thường tăng hơn. HCG tiêm bắp được chỉ định với liều 5.000-10.000IU khi có nang trên I8mm và không có nguy cơ quá kích buồng trứng.
2.3.1 Kết hợp clomiphene citrate/Al với gonadotropin
Thật sự bên cạnh các ưu điểm, gonadotropin ngoại sinh biểu hiện những tôn tài như là nguy cơ quá kích cao và giá thành tốn kém. Để khắc phục nhược điểm này, người ta có thể kết hợp domiphene citrate hay Al với gonadotropin. clomiphene citrate hay Al được sử dụng vào đầu chu kỳ làm tăng nồng độ FSH nội sinh, tăng chiêu mộ nang noãn, sau đó FSH ngoại sinh sẽ được bổ sung vào nhằm duy trì và thúc đẩy sự phát triển hơn nữa các nang noãn.
clomiphene citrate thường được sử dụng đường uống với liều 100mg bắt đầu từ ngày 26 chu kỳ, hoặc AI dùng đường uống liều 5mg/ngày cũng từ ngày 2-6. FSH được dùng tiêm dưới da vào ngày 5 và ngày 7 liều từ 50-150IU/ngày. Đánh giá sự đáp ứng của bệnh nhân vào ngày 8 qua siêu âm và điều chỉnh liều FSH cho phù hợp với sự phát triển nang noãn. Nói chung, khi nang noãn lớn nhất đạt đến 18mm và nội mạc tử cung trên 8mm có thể cho hCG. Phương pháp này cho phép giảm đi khoảng 50% lượng gonadotropin so với khi dùng gonadotropin đơn thuần. Tuy nhiên, nguy cơ đa thai và quá kích buồng trứng không cải thiện đáng kể.
2.3.2 Phác đồ tăng liều đầu
FSH được bắt đầu với liều thấp, khoảng 37,5 – 50 IU/ngày liên tục trong 14 ngày. Siêu âm và xét nghiệm nội tiết đánh giá lần đầu vào ngày 14. Nếu có đáp ứng vẫn duy trì liều cũ đến khi cho HCG. Nếu chưa có đáp úng, nang nhỏ dưới 10mm, có thể tăng 37,5 IU/tuần. Liều tối đa 200 IU/ngày và không quá 35 ngày cho toàn bộ chu kỳ điều trị.
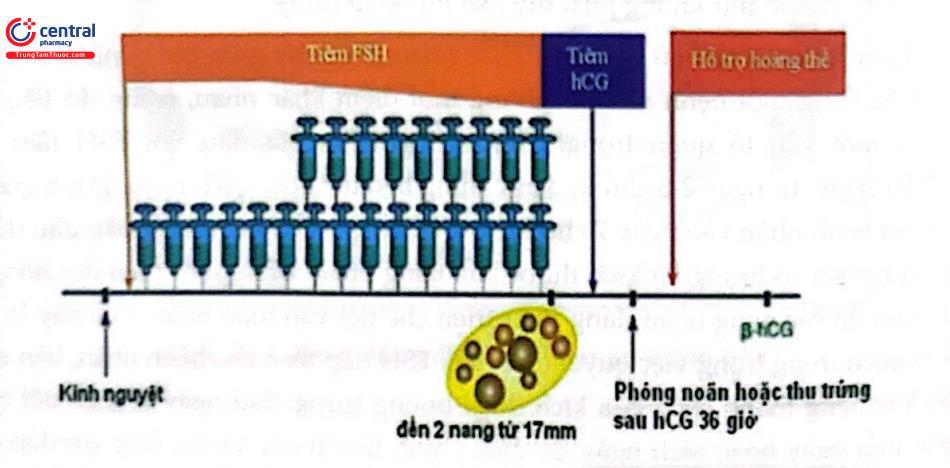
Nếu không đảm bảo các điều kiện trên (không có nang vượt trội khi dùng liều tối đa 1 tuần hay tổng thời gian điều trị quá 35 ngày) chu kỳ được xem như thất bại và phải ngung. Ưu điểm phác đồ này là an toàn hơn cho bệnh nhân, liều thuốc sử dụng ít hơn, tuy nhiên thời gian thường kéo dài.
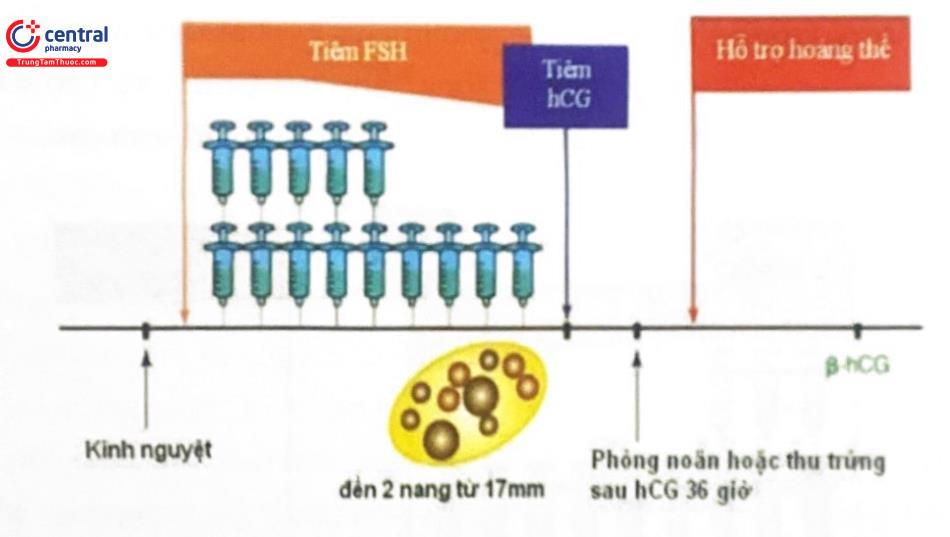
2.3.3 Phác đồ giảm liều đầu
Phác đồ này nhằm tạo ra nồng độ FSH trong tuần hoàn giống với sinh lý hơn. Liều cao FSH được sử dụng ngay đầu chu kỳ, thường tham khảo liều tối đa đã thất bại trong phác đồ step-up, có thể bắt đầu với 150 IU/ngày. Liều này được duy trì cho đến khi có nang vượt trội (đường kính trên 10mm) thì bắt đầu giảm liều. Liều giảm FSH khoảng 37,5 IU/ngày cách mỗi 3 ngày cho đến khi liều dùng còn 50 – 75 IU/ngày và nang noãn đạt chuẩn thì cho HCG.
2.4 Gonadotropin Releasing Hormone agonist (GnRHa)
GnRH tự nhiên bị phân hủy nhanh chóng do các liên kết giữa Amino acid 5-6, 6-7 và 9-10 rất dễ bị cắt đứt. Vì thế, bằng cách thay thế các amino acid ở các vị trí này người ta có thể tổng hợp nên các GnRH đồng dạng với các đặc tính khác nhau. GnRH agonist (đồng vận) được tạo ra do thay thế amino acid vị trí thứ 6 hoặc vị trí thứ 10. Chúng có ái lực mạnh hơn đối với các thụ thể của GnRH, thời gian bán hủy dài hơn nên hoạt tính sinh học mạnh hơn gấp 50-100 lần.
Ban đầu GnRHa có dụng đồng vận (còn gọi là tác dụng flare-up - kích hoạt) làm tăng nồng độ FSH và LH tuần hoàn tương đương với nồng độ các chất này giữa chu kỳ. Tác dụng này thấy rõ trong giai đoạn sớm pha nang noãn. Sau 2-3 tuần sử dụng, GnRHa gây nên sự trơ hóa và điều hòa giảm thụ thể GnRH trên tuyến yên dẫn đến tình trạng giảm hoạt động tuyến sinh dục do giảm hoạt động tuyến yên.
Sự chế tiết gonadotropin của tuyến yên không phải mất đi mà vẫn duy trì ở mức độ cơ bản, trừ một số trường hợp tuyến yên bị ức chế quá mức. Hiệu quả quan trọng của GnRH là ngăn chặn sự xuất hiện đỉnh LH sớm khi nang noãn đang phát triển. Tuy nhiên, sau khi ngưng thuốc, sự chế tiết FSH và LH sẽ phục hồi.
Trong kích thích buồng trứng thực hiện hỗ trợ sinh sản, đặc biệt là thụ tính trong ống nghiệm, GnRHa tỏ ra rất hiệu quả trong cả hai tác dụng kích hoạt và điều hòa giảm khi phối hợp với gonadotropin.
2.4.1 Phác đồ cực ngắn
Đây là phác đồ kích thích buồng trứng dựa vào tác dụng flare-up của GnRHa nhằm tăng nồng độ gonadotropin nội sinh phối hợp với gonadotropin ngoại sinh thêm vào tăng khả năng phát triển của nang noãn.
GnRHa được dùng chỉ trong 3 ngày đầu chu kỳ, bắt đầu từ ngày 2 với liều thấp. FSH cũng được cho vào từ ngày 2 song song với GnRH và kéo dài cho đến thời điểm tiêm hCG. Với phác đồ này, tỷ lệ xuất hiện đỉnh LH sớm cao.

2.4.2 Phác đồ ngắn
GnRHa được dùng từ đầu chu kỳ cùng với FSH và kéo dài đến khi tiêm hCG. Phác đồ này tận dụng cả hai hiệu quả hoạt hóa (flare-up) và ức chế (down regulation) của GnRHa. Nói chung hai phác đồ trên có ưu điểm là (1) thời gian cho thuốc ngắn hơn; (2) số lượng thuốc dùng ít hơn và (3) khả năng thành công ở một số phụ nữ lớn tuổi. Tuy nhiên, khuyết điểm tồn tại vẫn là nguy cơ cao xuất hiện đỉnh LH sớm, các nang noãn phát triển không đồng bộ.
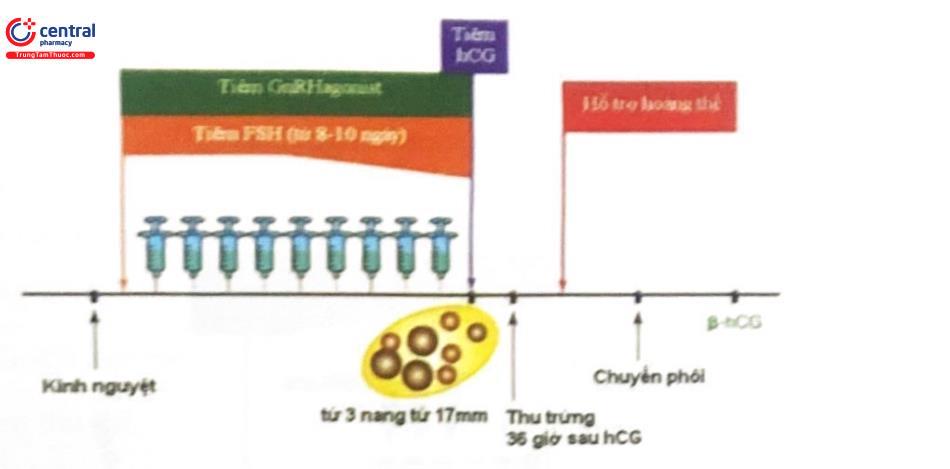
2.4.3 Phác đồ dài
Đây là phác đồ kinh điển được nhiều trung tâm lựa chọn trong các chu kỳ thụ tinh ống nghiệm. Phác đồ này dùng GnRHa trong 2-3 tuần từ chu kỳ trước nhằm đạt được tình trạng trơ hóa của tuyến yên. Thời điểm bắt đầu có thể là đầu chu kỳ trước hoặc từ pha hoàng thể (ngày 21 chu kỳ).
Sau khi khống chế được nồng độ gonadotropin đến mức cơ bản và buồng trứng không có nang chức năng, FSH được cho vào để kích thích nang noãn song song với GnRHa duy trì ở liều thấp cho đến thời điểm tiêm hCG. Phác đồ này tỏ ra có nhiều ưu điểm như: (1) sự phát triển các nang đồng bộ hơn, (2) giảm đến mức tối thiểu nồng độ LH nội sinh đảm bảo chất lượng các nang noãn không bị ảnh hưởng bởi androgen, (3) tránh được đỉnh LH sớm và hiện tượng hoàng thể hóa sớm và (4) ngăn phóng noãn sớm. Tuy nhiên nó vẫn có một số khuyết điểm như: (1) thời gian dùng GnRH kéo dài và tăng thêm chi phí, (2) liều dùng FSH ngoại sinh tăng lên và thời gian dùng kéo dài hơn, (3) cần tăng cường hỗ trợ giai đoạn hoàng thể.
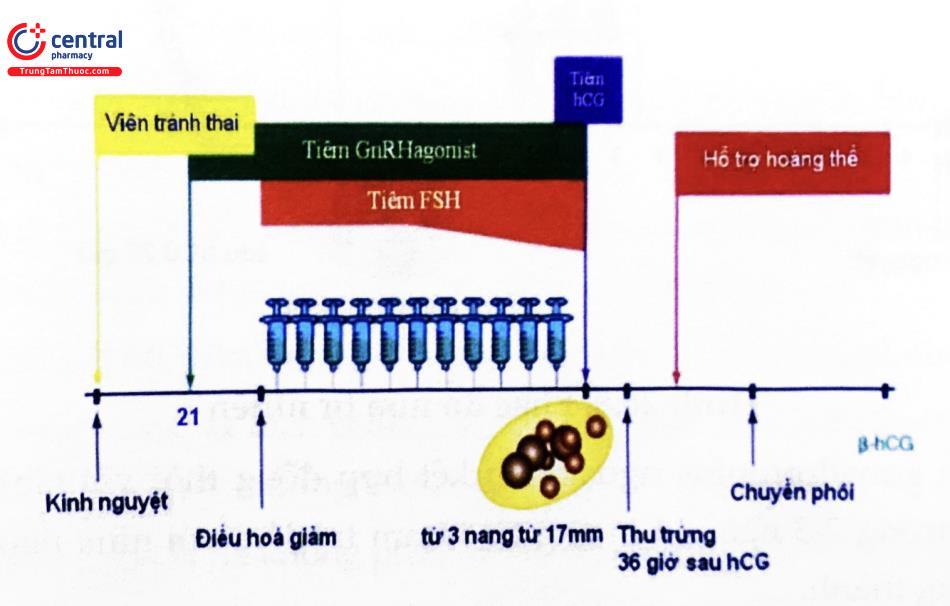
2.4.4 Phác đồ cực dài
GnRHa được dùng với liều cao, thời gian kéo dài, có thể từ 3 – 6 tháng trước khi kích thích buồng trứng với gonadotropin ngoại sinh.
2.4.5 Phác đồ kích thích nhẹ

Bắt đầu gonadotropin ngoại sinh sau ngày 5-6 chu kỳ để tận dụng tác dụng của gonadotropins nội sinh trước đó. Kết hợp GnRHantagonist khi có nang trội và tiêu chuẩn trigger bằng hCG tương tự như phác đồ ngắn.
2.4.6 Phác đồ nửa tự nhiên
.jpg)
Chỉ định gonadotropins ngoại sinh kết hợp đồng thời với GnRHantagonist chỉ thực hiện trong 2-3 ngày khi nang từ 14mm trở lên, với mục tiêu thu được từ 1-2 nang trưởng thành.
2.5 Gonadotropin Releasing Hormone antagonist (GnRH anta)
GnRH antagonist ra đời và được đưa vào sử dụng từ năm 1998. Đây là một đồng dạng khác của GnRH, được tạo thành do thay thế nhiều amino acid. GnRH antagonist khi gắn vào thụ thể của GnRH và gây ức chế cạnh tranh với GnRH, làm giảm ngay lập tức nồng độ gonadotropin tuyến yên chỉ vài giờ sau khi sử dụng
GnRH agonist | GnRH antagonist |
Điều hòa giảm thụ thể Tro hóa tuyến yên Tác dụng hoạt hóa ban đầu (flare-up) Hồi phục chậm sau ngưng thuốc (trung bình 2 tuần, tối đa 6 tuần) | Ức chế cạnh tranh. Ức chế thụ thế mà không hoạt hoá. -Ức chế ngay lập tức và phụ thuộc liều sử dụng.. Hồi phục nhanh sau khi ngưng thuốc (trong vòng 2 ngày đối với loại tác dụng ngắn 0,25mg) |
GnRHanta có thể được dùng một liều duy nhất hay đa liêu, theo thời điểm cổ định của chu kỳ kích thích buồng trứng (chương trình hoá) hay theo đáp ứng của từng bệnh nhân. Nếu điều trị theo chương trình, ngày bệnh nhân bắt đầu dùng FSH được tính là ngày 1, thì GnRHanta sẽ cho vào ngày 6 (120 giờ sau FSH), liêu duy nhất 3mg tiêm dưới da. Với cách sử dụng đa liều, tiêm dưới da 0,25mg/ngày. Theo dõi sự phát triển nang noãn và cho hCG như trong phác đồ dài. Nếu cho theo đáp ứng bệnh nhân thì GnRHanta sẽ được cho khi nang lớn nhất trên siêu âm có đường kính từ 14mm, vì thường khi có nang phát triển trên 14mm mới có thể xuất hiện đỉnh LH. Tuy nhiên người ta nhận thấy nếu kéo dài sau ngày 8 của chu kỳ thì nguy cơ xuất hiện đỉnh LH sớm rất cao.
GnRH anta tỏ ra trụ điểm hơn so với GnRHa như:
Tác dụng ức chế ngay đỉnh LH (6-8giờ), so với 2-3 tuần của GnRHa, giúp tiết kiệm thời gian, thuận tiện cho bệnh nhân.
Thời gian kích thích buồng trứng với gonadotropin ngắn hơn (1-2 ngày/chu kỳ), liều FSH ngắn hơn, nên giảm được chi phí.
Vào ngày tiêm HCG, số lượng nang nhỏ và trung bình ít hơn so với phác đồ dùng GnRHa nên giảm được nguy cơ quá kích buồng trứng.
Không gây hình thành nang cơ năng như trong down regulation.
Khi có nguy cơ quá kích buồng trứng với phác đồ GnRHanta, có thể dùng GnRHa thay cho HCG gây trưởng thành và phóng noãn.
Tuy nhiên, GnRHanta không phải không có những khuyết điểm so với GnRHa:
Sự phát triển của các nang trong chu kỳ không đồng bộ.
Nguy cơ xuất hiện đỉnh LH sớm vẫn cao hơn do việc theo dõi không thể chặt chẽ.
Có thể gây tình trạng thiếu hụt LH trong giai đoạn nang noãn phát triển do tác động ức chế quá mức.
2.6 Kết hợp LH tái tổ hợp trong kích thích buồng trứng
Theo thuyết hệ thống hai tế bào như trình bày trên đây thì vai trò của LH trong sự phát triển nang noãn là rất đáng kể. Ở một nồng độ phù hợp, LH kích thích tế bào vỏ tổng hợp androgen làm tiền chất cho sự tổng hợp estrogen. Vì thế trong một số trường hợp kích thích buồng trứng sự cần thiết bổ sung LH nhằm thúc đẩy nang noãn phát triển một cách đầy đủ.
Nói chung, một số trường hợp cần thiết bổ sung LH như:
Thiểu năng tuyến sinh dục do thiểu năng tuyến yên (hypogonadotropic hypogonadism), nhóm I theo phân loại WHO, định lượng LH<1,2IU/L và FSH<5IU/L
Đáp úng kém với kích thích buồng trứng.
Đáp ứng quá mức với GnRHa trong phác đồ dài (LH<1,2IU/L).
Sử dụng phác đồ GnRHanta.
Qua các nghiên cứu nhằm mục đích tìm hiểu liều LH tái tổ hợp tối ưu để sử dụng nhằm đạt hiệu quả kích thích buồng trứng tốt nhất mà không vượt qua giá trị trần của LH, nhiều tác giả đã thống nhất liều LH 75IU/ngày là vừa đủ cho đa số bệnh nhân. Thời điểm sử dụng LH tái tổ hợp có thể bắt đầu từ ngày đầu tiên kích thích buồng trứng hoặc nửa sau của pha nang noãn, đối tượng sử dụng có hiệu quả đáng kể là phụ nữ lớn tuổi (trên 38 tuổi).
2.7 Các phương pháp khác
2.7.1 Bromocriptin
Nồng độ prolactin trong tuần hoàn cao có thể gây ức chế tiết GnRH vùng dưới đòi, dẫn đến sự giảm chế tiết gonadotropin tuyến yên và ảnh hưởng đến khả năng phóng noãn, bệnh nhân thường kèm theo tiết sữa ở vú và vô kinh.
Bromocriptin là một đồng vận của dopamine, có thể ức chế trực tiếp sự chế tiết prolactin của tuyến yên. Nhờ đó, trục dưới đồi – tuyến yên hồi phục và tăng đáp ứng của buồng trứng. Các biểu hiện khác như tiết sữa, vô kinh vì thế cũng cải thiện khi nồng độ prolactin bình thường. Liều điều trị thường bắt đầu với 2,5mg uống trước khi ngủ, nếu biểu hiện không dung nạp nên bẻ đôi viên thuốc trước khi uống. Liều thứ hai tiếp tục sau 1 tuần lúc ăn sáng hay ăn trưa. Một số bệnh nhân đáp ứng rất tốt, chỉ với liều bromocriptin rất nhỏ khoảng 0,625-1,25mg. Nếu bệnh nhân quá nhạy cảm, biểu hiện tác dụng phụ (buồn nôn, tiêu chảy, đau đầu, mệt mỏi) của dopaminergic, có thể dùng bromocriptin đặt âm đạo một viên 2,5mg.
2.7.2 Metformin
Metformin là một biguanide, được hấp thu vào cơ thể quá đường tiêu hóa, từ trước đến nay dùng trong điều trị tiểu đường type II. Thuốc có tác dụng ức chế tổng hợp Glucose ở gan, giảm hấp thu glucose ở ruột và tăng sử dụng glucose ở mô ngoại biên. Metformin có thể làm tăng số thụ thể của Insulin nhưng không làm tăng nồng độ insulin vì thế không gây giảm đường huyết ở những bệnh nhân có đường huyết bình thường.
Mối liên hệ giữa tăng insulin máu và không rụng trứng đã được xác định thông qua cơ chế gây cường androgen, thể hiện rất điển hình trong hội chứng buồng trứng đa nang. Vì thế, đối với những bệnh nhân cưởng insulin máu, đặc biệt là PCOS, metformin thể hiện tính hiệu quả và an toàn trong cải thiện insulin máu, thông qua đó gián tiếp ổn định chức năng phóng của buồng trứng.
2.7.3 Hormone tăng trưởng (Growth hormone-GH)
Một số nghiên cứu cho thấy, hormone tăng trưởng (GH) có tác dụng tích cực lên đáp ứng của nang noãn khi kích thích buồng trứng có bổ sung GH. GH có thể tác động trực tiếp lên các thụ thể của nó trên tế bào hạt kích thích sự hoạt động các gen quy định yếu tố nội tại IGF, đặc biệt IGF I phụ thuộc GH và liên quan đến khả năng tác động của FSH cả nội sinh và ngoại sinh lên buồng trứng. Vì thế nhiều nhà nghiên cứu đã đánh giá hiệu quả của bổ sung GH trong kích thích nang noãn không những tăng lên rõ rệt mà còn giảm được thời gian kích thích.
2.7.4 Phẫu thuật trên buồng trứng
Phương pháp can thiệp phẫu thuật đầu tiên trên buồng trứng để cải thiện chức năng phóng noãn được Stein và Leventhal đưa ra vào năm 1935 ở những bệnh nhân buồng trứng đa nang. Từ đó đến nay, nhiều phương pháp phẫu thuật cùng những kỹ thuật hiện đại được áp dụng đối với những bệnh nhân này.
Hiện nay, ở một số trung tâm có thể áp dụng phương pháp đốt điểm buồng trứng qua nội soi. Tại bờ tự do của buồng trứng dùng đầu kim đốt điện đơn cực chuyên dùng (đầu kim Corson) chọc thẳng góc tạo 10 – 15 lỗ trên bề mặt buồng trứng với dòng điện 40W, kéo dài 2 giây ở mỗi điểm. Dù vậy, cơ sở khoa học và hiệu quả của các phương pháp phẫu thuật này đến nay vẫn không rõ ràng cùng với nhiều biến chứng đáng kể của phẫu thuật làm cho chỉ định phẫu thuật không được rộng rãi. Các dữ liệu y văn cho đến nay không ủng hộ phẫu thuật đốt điểm buồng trứng là một lựa chọn trong điều trị kích thích phóng noãn ở bệnh nhân HCBTDN.
3 CÁC VẤN ĐỀ CẦN CHÚ Ý KHI KÍCH THÍCH BUỒNG TRỨNG
Khoảng cách giữa đáp ứng tốt với kích thích buồng trứng và quá kích buồng trứng là rất hẹp.
Sự đáp ứng với kích thích buồng trứng của từng người là khác nhau, do đó, việc quyết định loại thuốc, liều thuốc, phác đó kích thích và theo dõi trong quá trình kích thích buồng trứng phải được cán nhắc kỹ.
Quá trình phát triển nang noãn hoàn chỉnh cần thiết cả FSH và LH.
Điều chỉnh liều gonadotropin dựa vào sự đáp ứng của bệnh nhân thông qua triệu chứng lâm sàng, hình ảnh siêu âm và xét nghiệm nội tiết.
Quyết định thời điểm tiêm hCG đúng đắn sẽ mang lại hiệu quả cao cũng như hạn chế được biến chúng của quá kích buồng trứng.
Nếu chu kỳ điều trị thất bại, thay đổi phác đồ thường mang lại hiệu quả cao hơn so với thay đổi thuốc đang sử dụng.
Nói tóm lại, kích thích buồng trứng là một can thiệp lâm sàng đặc biệt. Các phác đồ nêu trên chỉ có tính nguyên lý, không thể áp dụng một cách cứng nhắc. Tùy mỗi bệnh nhân khác nhau, mục đích điều trị, theo quan điểm và kinh nghiệm của thầy thuốc và những điều kiện khách quan khác mà chọn loại thuốc, liều lượng, cách sử dụng, thời điểm sao cho đạt được hiệu quả tối ưu. Do vai trò rất quan trọng mang tính quyết định của kích thích buồng trứng trong sự thành công của hỗ trợ sinh sản.
4 TÀI LIỆU THAM KHẢO
1. Aboulghar MA, Mansour RT, Serour Gl, et al. Increasing the dose of human menopausal gonadotrophins on day of GnRH antagonist administration: randomized controlled trial. Reprod Biomed Online 2004; 8: 524-7.
2. Balasch J, Fabregues F, Carmona R, et al. Ovarian luteinizing hormone priming preceding Follicle-Stimulating hormone stimulation: clinical and endocrine effects in women with long-term hypogonadotropic hypogonadism. J Clin Endocrinol Metab 2009; 94: 2367-2373.
3. Catt KJ, Martinez-Fuentes AJ, Hu L, et al. Recent insights into the regulation of pulsatile GnRH secretion (abstract O-004). Gynecol Endocrinol 2003; 17:2.
4. Dada T, Salaha O, Allgar V, et al. Utero-ovarian blood flow characteristics of pituitary desensitisation. Hum Reprod 2002; 16: 1663-1670.
5. Egbase PE, Grudzinskas JG, Al Sharhan M, et al. HCG or GnRH agonist to trigger ovulation in GnRH antagonist-treated intrauterine insemination cycles: a prospective randomized study. Hum Reprod 2002; 17:206-217.
6. Malizia BA, Hacker MR, Penzias AS. Cumulative live-birth rates after in vitro fertilization. N Engl J Med 2009; 360:236.
7. Klipstein S, Regan M, Ryley DA, et al. One last chance for pregnancy: a review of 2,705 in vitro fertilization cycles initiated in women age 40 years and above. Fertil Steril 2005; 84:435.
8. Practice Committee of the American Society for Reproductive Medicine. Electronic address: asrm@asrm.org. Definitions of infertility and recurrent pregnancy loss: a committee opinion. Fertil Steril 2020; 113:533.
9. Roth A. (Queer) Family Values and "Reciprocal IVF": What Difference Does Sexual Identity Make? Kennedy Inst Ethics J 2017; 27:443.
10. Zegers-Hochschild F, Adamson GD, Dyer S, et al. The International Glossary on Infertility and Fertility Care, 2017. Hum Reprod 2017; 32:1786.

