To đầu chi: Sự phát triển quá mức bộ xương và phì đại các mô mềm
Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 NGUYÊN LÝ CHUNG
To đầu chi là một rối loạn được đặc trưng bằng tình trạng sản xuất quá nhiều GH và yếu tố tăng trưởng giống Insulin typ 1 (IGF-1), nguyên nhân hay gặp nhất là do adenoma tuyến yên.
Tăng sản xuất GH và IGF-1 dẫn đến tăng trưởng của hệ cơ xương, da và các cơ quan, các rối loạn chuyển hóa, tình trạng này kết hợp với gia tăng có ý nghĩa tỷ lệ mắc bệnh và tử vong sớm nếu không được điều trị.
1.1 Định nghĩa
To đầu chi là tình trạng tăng tiết GH quá mức xảy ra ở giai đoạn sau tuổi dậy thì của người bệnh.
Khi tình trạng tăng tiết GH xảy ra trước tuổi dậy thì, nó có thể gây tăng trưởng nhanh và suy sinh dục với giảm khả năng cốt hóa của sụn phát triển (growth-plate closure) gây ra chứng khổng lồ.
1.2 Dịch tễ học
Tỷ lệ bệnh lưu hành dao động trong khoảng 2,8 đến 13,7 trường hợp cho 100.000 người dân và tỷ lệ mắc mới hằng năm dao động trong khoảng từ 0,2 đến 1,2 trường hợp cho 100.000 người dân [1]. Độ tuổi trung bình vào lúc bệnh được chẩn đoán là tuổi 50 với thời gian chẩn đoán được bệnh muộn trung bình 4,5 đến 5 năm [1]. Tỷ lệ bệnh lưu hành tương đương nhau ở nam và nữ.
1.3 Sinh lý bệnh
To đầu chi thường gặp nhất là do adenoma tuyến yên tiết kích tố hướng thân (60%). Các adenoma tiết kết hợp GH và prolactin ít gặp hơn (25%), trong khi adenoma tiết GH và TSH hiếm gặp [2].
Các nghiên cứu sinh học phân tử về sinh bệnh học của adenoma tế bào tiết kích tố hướng thân đang được thực hiện. Đột biến của protein Gsa đã được tìm thấy tới 40% các adenoma tế bào tiết kích tố hướng thân [2].
Chế tiết GH được kích thích bởi hormon gây phóng thích hormon tăng trưởng (GHRH) từ vùng dưới đồi, gây tăng tiết IGF-1 từ gan. Bình thường, chế tiết GH bị ức chế bởi cả somatostatin từ vùng dưới đồi và IGF-1 từ các mô ngoại biên.
Chế tiết GH tự động từ các adenoma tế bào tiết kích tố hướng thân làm tăng chế tiết IGF-1, chất này gây tăng trưởng xương và sụn, giảm dung nạp glucose, thay đổi chuyển hóa protein và mỡ.
2 CHẨN ĐOÁN
Chẩn đoán to đầu chi đầu tiên là cần phát hiện kiểu hình (biểu hiện bên ngoài của bệnh nhân), sau đó tiến hành các quy trình thăm dò chẩn đoán hormon thích hợp. Cuối cùng, cần tiến hành các đánh giá hình ảnh học tuyến yên.
2.1 Biểu hiện lâm sàng
Bệnh nhân bị to đầu chi được biểu hiện bằng tình trạng phát triển quá mức bộ xương và phì đại các mô mềm. Các thay đổi này có thể kín đáo qua thời gian, được phát hiện tốt nhất bằng cách so sánh với các hình chụp bệnh nhân trước đó. Các triệu chứng liên quan với thiếu hụt hormon có thể xuất hiện do hậu quả của tình trạng chèn ép phần tuyến yên còn lại do khối u phát triển.
2.1.1 Khai thác tiền sử bệnh
Bệnh nhân có thể báo cáo về tình trạng tăng kích thước mũ, nhẫn hoặc cỡ giày.
Đau đầu là triệu chứng thứ hai thường gặp, ngay cả khi adenoma có kích thước nhỏ.
Giọng nói có xu hướng trầm hay khàn hơn liên quan với phì đại xoang và thanh quản.
Có thể xảy ra tình trạng mồ hôi có mùi khó chịu, nhất là về đêm.
Dị cảm xảy ra có liên quan với hội chứng đường hầm cổ tay và các bệnh lý dây thần kinh ngoại biên khác, cũng như các rối loạn thị giác do tăng phát triển quá mức của hệ xương trong hộp sọ hoặc do adenoma tuyến yên chèn ép giao thoa thị giác.
Đau khớp và đau cơ xảy ra ở 30 - 70% bệnh nhân với chủ yếu là các khớp lớn bị tác động. Viêm xương - khớp cột sống gây đau lưng, thường xảy ra ở cột sống thắt lưng. Hiếm gặp hơn, tổn thương cột sống gây chèn ép dây thần kinh dẫn tới hẹp ống sống thắt lưng hoặc đau thần kinh tọa [3].
Khó thở lúc nghỉ hoặc gắng sức có thể xuất hiện khi bệnh tiến triển ở giai đoạn nặng do tình trạng tái cấu trúc cơ tim.
Các triệu chứng nội tiết liên quan với chèn ép phần tuyến yên còn lại có thể là triệu chứng suy giáp (kém chịu lạnh, mệt mỏi, tăng cân), suy sinh dục (giảm ham muốn tình dục, vô sinh, kinh nguyệt không đều) và tăng nồng độ prolactin máu (kinh không đều, tiết sữa).
2.1.2 Khám thực thể
Tăng huyết áp xảy ra ở khoảng 50% các bệnh nhân [4].
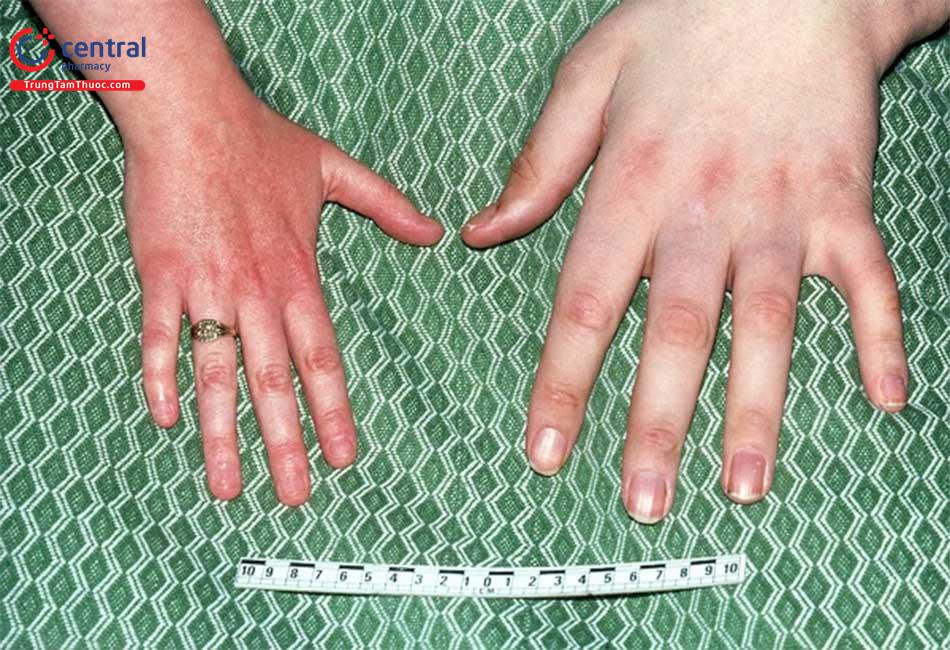
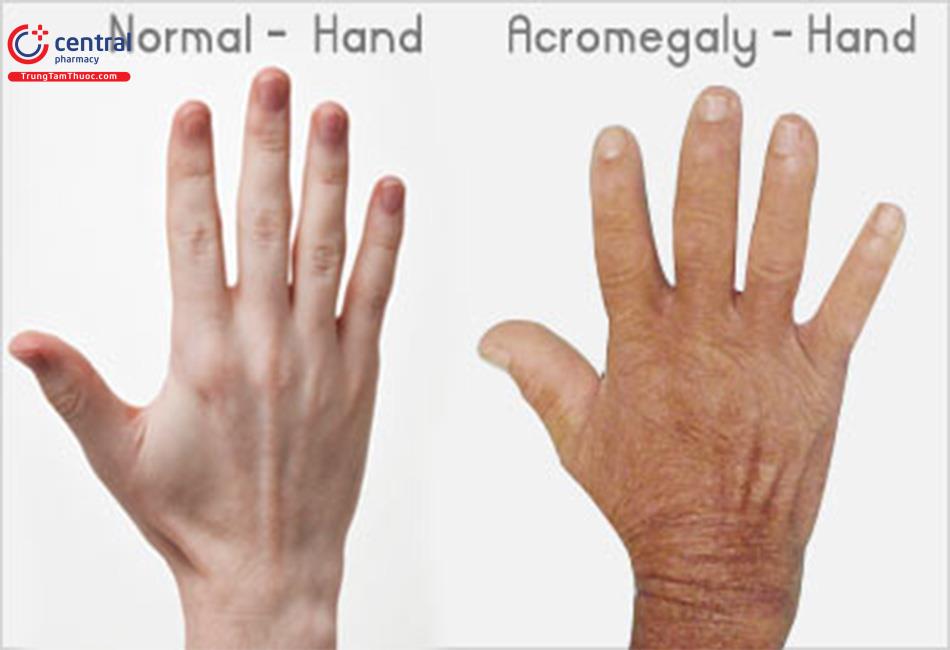
Bàn tay và bàn chân phì đại bất thường với các ngón tay, ngón chân to ra, dày lên và mập mạp.
Mũi bệnh nhân to và dày lên, trán và xương gò má nổi ụ, các đường hay nếp nhăn trên mặt hiện rõ hơn. Xương hàm dưới phát triển quá mức dẫn tới tình trạng vẩu, răng thưa và hàm cắn không chặt hay lệch khớp cắn.
Da có thể tiết nhiều mồ hôi và dạng da dầu (70%), đồng thời da trở nên thô và dày lên. Các mụn lồi và hạt cơm trên da có thể xuất hiện nhiều hơn và to lên.
Trong khi tình trạng bệnh lý khớp thường gặp nhưng các dấu hiệu khách quan thường không thấy rõ. Giảm vận động khớp có thể gặp ở giai đoạn muộn của bệnh, song tràn dịch khớp và các dấu hiệu viêm hiếm gặp.
2.2 Chẩn đoán phân biệt
Các nguyên nhân gây tăng GH khác phải được loại trừ. Sử dụng GH ngoại sinh cần được xem xét ở các bệnh nhân tuổi vị thành niên và các vận động viên thể hình.
Carcinoma tuyến yên tiết kích tố hướng thân cực kỳ hiếm gặp.
Tăng chế tiết GH ngoài tuyến yên hiếm gặp song có thể xảy ra trong các adenoma tuyến yên lạc chỗ khu trú trong xoang bướm hoặc khoang mũi - hầu hoặc hiếm gặp hơn nữa là từ các u ngoại biên như u thần kinh nội tiết tụy. Tăng tiết GHRH khiến cho các tế bào tiết kích tố hướng thân của tuyến yên tăng tiết GH cũng đã được gặp trong các u carcinoid ở tụy và phế quản.
Các hội chứng di truyền kết hợp với to đầu chi bao gồm adenoma tuyến yên đơn độc có tính gia đình gây ra do tình trạng đột biến của gen chi phối protein tương tác - thụ thể aryl-hydrocarbon (AIP) ở 20% các trường hợp, hội chứng McCune - Albright, phức hợp Carney và u tân sinh đa tuyến nội tiết typ 1 (MEN1) [5].
2.3 Chẩn đoán cận lâm sàng
2.3.1 Cận lâm sàng
Xét nghiệm cận lâm sàng khởi đầu đối với một bệnh nhân nghi ngờ bị to đầu chi là IGF-1 và nồng độ GH. Các hướng dẫn hiện tại khuyến cáo một gia tăng nồng độ IGF-1 và suy giảm ức chế GH trong OGTT giúp khẳng định chẩn đoán [6,7]. Tuy nhiên, không cần phải làm nghiệm pháp dung nạp Glucose đường uống nếu nồng độ GH và IGF-1 tăng cao ở một bệnh nhân có các dấu hiệu và triệu chứng to đầu chi rõ ràng.
Trong nghiệm pháp dung nạp glucose đường uống (OGTT), lấy mẫu máu để định lượng nồng độ đường máu và GH cơ sở, cho bệnh nhân uống 75 g glucose, sau đó lấy các mẫu máu để định lượng GH và nồng độ đường máu mỗi 30 phút/lần trong 2 giờ. Mặc dù hướng dẫn điều trị khuyến cáo sử dụng điểm cắt GH thấp nhất <0,4ng/mL bằng cách làm các thử nghiệm siêu nhạy để khẳng định chẩn đoán to đầu chi [6,7], các nghiên cứu chỉ ra rằng nếu nồng độ GH giảm xuống<0,3 ng/mL trong khi trong khi làm nghiệm pháp dung nạp glucose đường uống, chẩn đoán to đầu chi được loại trừ [4]. Kết quả dương tính giả có thể xảy ra ở bệnh nhân đái tháo đường, viêm gan mạn, suy thận và chán ăn. Ngoài ra, bệnh nhân bị to đầu chi nhẹ có thể có nồng độ GH bị ức chế (< 0,3 ng/mL) trong khi làm nghiệm pháp dung nạp glucose đường uống [8]. Cũng cần phải tiến hành đánh giá các hormon tuyến yên khác, bao gồm định lượng nồng độ prolactin, TSH, thyroxin tự do (FT4), nồng độ cortisol lúc 8 giờ sáng, LH, FSH và testosteron (chỉ ở nam giới). Nếu được chỉ định dựa theo triệu chứng và/hoặc nếu nồng độ cortisol lúc 8 giờ sáng < 15 ug/dL, có thể cần tiến hành nghiệm pháp kích thích bằng cosyntropin để chẩn đoán suy thượng thận.
2.4 Hình ảnh học
Chẩn đoán hình ảnh học ban đầu nên là chụp MRI não có tiêm hoặc không tiêm chất đối quang từ gadolinium để đánh giá adenoma tuyến yên. Chụp Xquang chi và hộp sọ sẽ cho thấy các bất thường liên quan với sự tăng trưởng quá mức của xương và sun.
Siêu âm tim có thể cho thấy có phì đại vách liên thất và thành sau thất trái cũng như rối loạn chức năng tâm trương và ít gặp hơn là rối loạn chức năng tâm thu.
3 ĐIỀU TRỊ
Mục tiêu điều trị bao gồm: làm giảm bớt triệu chứng, làm giảm thể tích u, cải thiện tỷ lệ tàn phế và tử vong lâu dài. Đích điều trị là đạt được nồng độ GH < 1 ng/mL và nồng độ IGF-1 trong giới hạn bình thường [6,9].
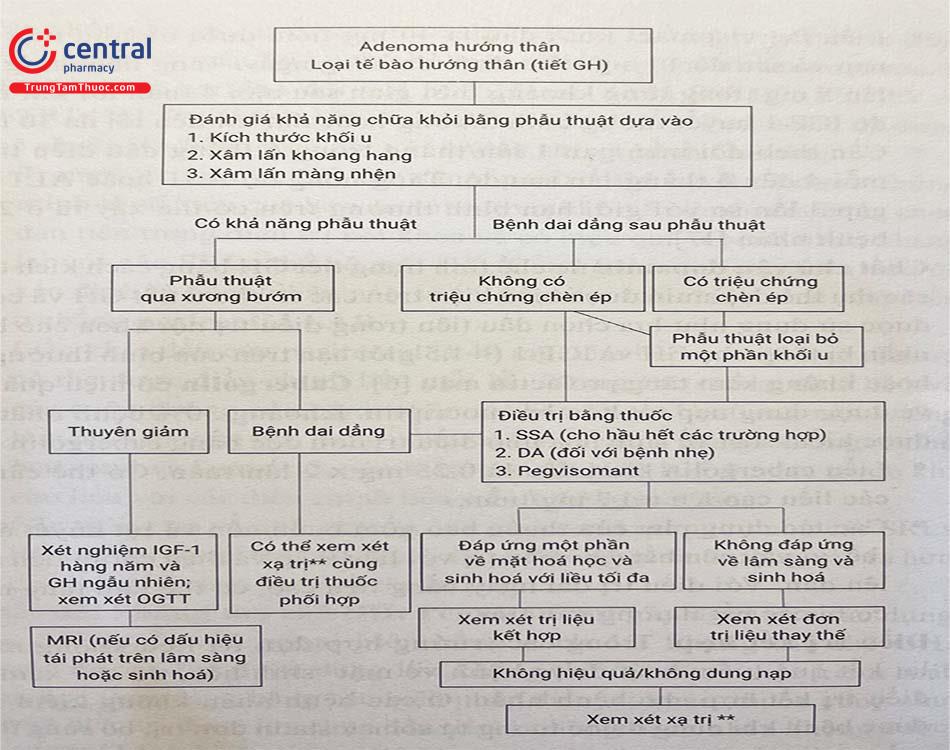
Lược đồ về 3 cách điều trị chính đối với to đầu chi được trình bày trong Hình 3.1 [6].
3.1 Điều trị ngoại khoa
Phẫu thuật giúp làm giảm nhanh nhất nồng độ GH. Đây là phương pháp điều trị đầu tiên được áp dụng cho các microadenoma và hầu hết các macroadenoma. Hiệu quả của điều trị này phụ thuộc vào kích thước của u tuyên yên, tình trạng xâm lấn của u và kinh nghiệm của phẫu thuật viên.
Các tỷ lệ kiểm soát u được trích dẫn trong các nghiên cứu đạt kết quả tốt nhất với các phẫu thuật viên thần kinh có kinh nghiệm, tiến hành ít nhất 50 ca mổ tuyến yên mỗi năm [10].
Phẫu thuật qua xương bướm là lựa chọn thích hợp đối với các microadenoma trong hố yên, macroadenoma không xâm lấn, khi các u này gây các triệu chứng chèn ép và để loại bỏ một phần đối với các u xâm lấn. Hiếm khi cần phải mở hộp sọ. Tỷ lệ kiểm soát được u đối với macroadenoma thấp hơn so với microadenoma (45 - 68% so với 81 - 100%) [5]. Các u tác động tới xoang tĩnh mạch hang hoặc xấm lấn vào khoang dưới nhện xuyên bao (transcapsular intra-arachnoid invasion) thậm chí có tỷ lệ điều trị triệt để thấp hơn nữa.
3.2 Các thuốc điều trị
Chỉ định điều trị bằng thuốc khi phẫu thuật đơn độc không làm giảm được nồng độ GH và IGF-1 về mức bình thường. Các thuốc làm giảm GH cũng được dùng như điều trị chủ yếu khi phẫu thuật bị chống chỉ định hoặc trong trường hợp bị macroadenoma chế tiết GH với nhiều khả năng là phẫu thuật sẽ không lấy bỏ được hoàn toàn khối u. Thuốc cũng có thể sử dụng như một biện pháp bắc cầu tới khi điều trị tia xạ có được tác dụng đầy đủ.
Nói chung, tất cả các thuốc điều trị to đầu chi phải được dừng lại nếu bệnh nhân có thai vì hiện còn thiếu các thông tin về tính an toàn của thuốc đối với phụ nữ có thai.
Xem Bảng 3.1 để biết các thuốc được sử dụng trong điều trị to đầu chi [11, 12, 13, 14].
Chất gắn thụ thể somatostatin (Somatostatin receptor ligands [SRLs): Thụ thể somatostatin dưới typ 2 (SSTR2) được thấy ở > 95% các adenoma sản xuất GH, SSTR5 được thấy ở > 85%, SSTR1 và SSTR3 được thấy ở 40% khối u [11]. Chất gắn thụ thể somatostatin (SRLs), bao gồm octreotid, lanreotid và pasireotid, tác động như một chất chủ vận đối với các thụ thể somatostatin (SSTRs) trên khối u để làm giảm tiết GH.
Các chất gắn thụ thể somatostatin (SRLs) thế hệ một: Octreotid và lanreotid gắn ái lực cao đối với SSTR2 và SSTR5 [11]. Thuốc được khuyến cáo như điều trị bước một cho các bệnh nhân nhiều khả năng sẽ không thể được điều trị triệt để bằng phẫu thuật hoặc các bệnh nhân ít có chỉ định phẫu thuật [6]. Thuốc cũng có thể được sử dụng như một biện pháp tạm thời trước khi phẫu thuật, nhằm cải thiện tình trạng bệnh lý đồng mắc, kiểm soát triệu chứng trước khi xạ trị để đạt được hiệu quả mong muốn hoặc sau phẫu thuật vẫn không kiểm soát được bệnh qua kết quả xét nghiệm hóa sinh.
- Kiểm soát được bệnh qua kết quả xét nghiệm hóa sinh chỉ đạt được ở 20 - 54% các bệnh nhân [15]. Tỷ lệ hiệu quả thay đổi được báo cáo qua các nghiên cứu nhiều khả năng có liên quan với các khác biệt trong tiền sử điều trị và tiêu chuẩn để xác định đạt được kiểm soát về sinh hóa qua các nghiên cứu. Các nghiên cứu bao gồm những bệnh nhân được biết có đáp ứng với chất tương tự với somatostatin báo cáo tỷ lệ đáp ứng cao hơn so với các nghiên cứu chỉ bao gồm các bệnh nhân chưa từng được điều trị.
- Giảm kích thước u từ 10% đến > 45% gặp ở 36,6% các bệnh nhân điều trị bằng SRLs thế hệ một [7].
- Liều khởi đầu của octreotide LAR (dạng phóng thích với tác dụng kéo dài) là 20 mg tiêm bắp x 1 lần/tháng. Liều được tăng trong từng khoảng thời gian 3 tháng một tới khi nồng độ IGF-1 huyết tương bình thường hoặc đạt tới liều tối đa là 40 mg.
- Liều khởi đầu của lanreotide depot là 90 mg, tiêm sâu dưới da x 1 lần/ tháng. Liều được điều chỉnh trong từng khoảng thời gian 3 tháng một cho tới khi nồng độ IGF-1 bình thường hoặc đạt tới liều tối đa là 120 mg. Bệnh nhân được kiểm soát bệnh với liều tiêm dưới da 60 hoặc 90 mg có thể chuyển sang liều 120 mg tiêm dưới da mỗi 6 đến 8 tuần/lần.
- Phải kiểm tra nồng độ IGF-1 ngay trước khi cho dùng octreotid hoặc lanreotid và tiến hành điều chỉnh liều mỗi 3 tháng/lần.
- Các tác dụng phụ thường nhẹ và thoáng qua bao gồm buồn nôn, tiêu
- chảy, chướng bụng và chuột rút. Các tác dụng phụ này xảy ra sớm và thường cải thiện trong vòng sau vài tháng đầu điều trị. Sỏi túi mật xuất hiện với tần suất gia tăng song thường không gây viêm túi mật cấp. Hiếm gặp, viêm tụy có thể xảy ra. Tăng đường máu cũng có thể xảy ra hoặc diễn biến tồi đi.
Các chất gắn thụ thể somatostatin (SRLs) thế hệ hai: Pasireotid, trái ngược với các SRLs thế hệ một, tác động tới nhiều dưới nhóm SSTR với ái lực cao đối với SSTR5 sau đó là SSTR2, SSTR3 và SSTR1 [16]. Do ái lực gắn dưới nhóm của thuốc, Pasireotid đã được phê chuẩn để điều trị cả đối với to đầu chỉ và bệnh Cushing.
- Trong các thử nghiệm lâm sàng, pasireotid LAR đã được chứng minh là có hiệu quả hơn so với octreotid LAR, thuốc được lựa chọn đầu tiên trong điều trị nội khoa và có hiệu quả ở bệnh nhân kháng lại với các SRLs thế hệ một [11]. Cần có thêm các nghiên cứu để xác định là bệnh nhân nào sẽ có được lợi ích nhiều nhất nhờ điều trị bằng pasireotid LAR.
- Liều khởi đầu của pasireotid là 40 mg tiêm bắp mỗi 28 ngày/lần và
- có thể được điều chỉnh liều mỗi lần 20 mg theo nồng độ IGF-1 và các triệu chứng của bệnh nhân tới liều tối đa là 60 mg nếu không làm bình thường hóa được nồng độ IGF-1 sau 3 tháng. Tương tự như octreotid và lanreotid, nên kiểm tra nồng độ IGF-1 ngay trước khi cho liều với các điều chỉnh liều mỗi 3 tháng một lần.
- Các thông tin về tính an toàn của pasireotid tương tự như các SRLs thế hệ một ngoại trừ tình trạng tăng đường máu thường xảy ra hơn do tính gắn chọn lọc của thuốc [16].
Chất đối kháng thụ thể GH: Pegvisomant gây ngăn cản tác dụng của GH ở các mô ngoại biên bằng cách đối kháng thụ thể GH. Thuốc này có thể được dùng khi không thể đạt được việc kiểm soát sinh hóa thỏa đáng bằng các biện pháp điều trị khác, thuốc cũng như là một điều trị được lựa chọn đầu tiên ở những bệnh nhân không được kiểm soát bệnh bằng phẫu thuật, hoặc khi kết hợp với một chất tương tự somatostatin.
- Mặc dù các nghiên cứu khởi đầu đã báo cáo việc làm bình thường hóa nồng độ IGF-1 ở > 90% các bệnh nhân, trong thực hành lâm sàng khoảng 62% các bệnh nhân đạt được kiểm soát về sinh hóa [14]. Pegvisomant không tấn công tới đích là tuyến yên tiết GH, vì vậy nồng độ GH tăng cao và không thể theo dõi được. Pegvisomant được cho là không gây ra tăng trưởng khối u có ý nghĩa [17,18]. Tuy vậy, nghiên cứu hình ảnh học định kỳ liên tục với chụp MRI vẫn được khuyến cáo để đánh giá kích thước u [6].
- Liều Pegvisomant khởi đầu là 40 mg tiêm dưới da như một liều nạp và sau đó 10 mg tiêm dưới da hàng ngày. Tăng liều dùng mỗi lần 5 mg trong từng khoảng thời gian sau mỗi 4 tuần tới khi nồng độ IGF-1 huyết tương bình thường hoặc đạt tới liều tối đa 30 mg.
- Cần theo dõi men gan 1 lần/tháng trong 6 tháng đầu điều trị và mỗi 4 đến 6 tháng/lần sau đó. Tăng nồng độ AST hoặc ALT hơn gấp 3 lần so với giới hạn bình thường trên có thể xảy ra ở 2,5% bệnh nhân [17].
Chất chủ vận dopamin ức chế tình trạng tiết GH bằng cách kích thích các thụ thể dopamin được biểu hiện trên các tế bào u tiết GH và có thể được sử dụng như lựa chọn đầu tiên trong điều trị nội khoa cho bệnh nhân bị tăng nhẹ GH và IGF-1 (< 1,5 giới hạn trên của bình thường) có hoặc không kèm tăng prolactin máu [6]. Cabergolin có hiệu quả hơn và được dung nạp tốt hơn Bromocriptin. Khoảng 30% bệnh nhân đạt được kiểm soát về sinh hóa nhờ điều trị đơn độc bằng cabergolin [13].
- Liều cabergolin khởi đầu là 0,25 mg x 2 lần/tuần. Có thể cần tới các liều cao lên tới 7 mg/tuần.
- Các tác dụng phụ của thuốc bao gồm buồn nôn và tụt huyết áp tư thế, vì vậy nên bắt đầu điều trị với liều thấp và điều chỉnh liều tăng lên dần. Với điều trị dài ngày bằng liều cao, có thể làm tăng nguy cơ bị các bất thường van tim.
Điều trị kết hợp: Trong các trường hợp đơn trị liệu không mang lại kết quả kiểm soát được bệnh về mặt sinh hóa, có thể xem xét điều trị kết hợp cho bệnh nhân. Ở các bệnh nhân không kiểm soát được bệnh khi dùng thuốc tương tự somatostatin đơn trị, bổ sung thêm cabergolin hoặc pegvisomant sẽ giúp làm bình thường hóa IGF-1 lần lượt ở 30% đến 60% [16] và 58% đến 100% bệnh nhân [19]. Phối hợp pegvisomant và cabergolin đôi khi cũng được sử dụng.
Các điều trị tiềm năng: Các điều trị đang được nghiên cứu bao gồm octreotid dùng đường uống, octreotid tiêm dưới da có tác dụng kéo dài, thuốc gắn thụ thể somatostatin chọn lọc cao gây ức chế GH và chẹn thụ thể GH [20].
IGF-1 (insulin-like growth factor 1): Yếu tố tăng trưởng giống insulin typ 1; GH (growth hormone): Hormon tăng trưởng; OGTT (oral glucose tolerance test): Nghiệm pháp dung nạp glucose đường uống; SSA (somatostatin analog): Chất tương tự somatostatin; DA (dopamine agonist): Chất chủ vận dopamin.
* Ảnh hưởng của kích thước khối u đến kết quả phẫu thuật là không chắc chắn. Nhìn chung, khối u nhỏ hơn 2 cm có cơ hội phẫu thuật thành công cao hơn.
** Xạ phẫu (SRS) được ưu tiên hơn so với xạ trị thông thường (CRT).
‡ Ở những bệnh nhân không có triệu chứng chèn ép và không muốn điều trị phẫu thuật, điều trị nội khoa từ đầu hoặc phẫu thuật giải tỏa khối u sau điều trị nội khoa có thể được xem xét. Phỏng theo Katznelson L, Laws E, Sholomo M và Cộng sự. Acromegaly: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014;99(11):3933-3951.
| Bảng 3.1. Các thuốc trong điều trị to đầu chỉ | |||||
| Thành phần | Mô tả | Chỉ định | Liều lượng | Hiệu quả | Tác dụng phụ |
| SRLs thế hệ 1 | |||||
| Octreotide LAR | Octreotide tác dụng kéo dài. Có ái lực với SSTR2, SSTR3 và SSTR5 Tiêm bắp 4 tuần 1 lần | Liệu pháp đầu tay trong trường hợp chống chỉ định với phẫu thuật. Bệnh dai dẳng sau phẫu thuật. Liệu pháp điều trị trong thời gian đợi xạ trị phát huy hiệu quả tối ưu. | 10 - 40 mg tiêm bắp (IM) mỗi 4 tuần. Bắt đầu 20 mg mỗi 4 tuần, tăng 10 mg mỗi 3 tháng dựa vào nồng độ IGF1. | Bình thường hóa IGF-1 ở 38–85% GH < 2,5 ng/mL ở 33-75% | Tăng đường máu lên đến 42%. Hay gặp nhất là buồn nôn, đi ngoài, đau bụng, đầy bung. Ít gặp hơn là rụng tóc, sỏi mật, nhịp tim chậm. |
| Lanreotide depot | Lanreotide tác dụng kéo dài Có ái lực với SSTR2, SSTR3 và SSTR5. Tiêm dưới da sâu mỗi 4 tuần. | Tương tự octreotide LAR | 60-120 mg tiêm dưới da mỗi 4 tuần. Bắt đầu 90 mg tiêm dưới da mỗi 4 tuần, chỉnh liều 30 mg mỗi 3 tháng dựa vào nồng độ IGF-1. Có thể dùng liều 120 mg tiêm dưới da mỗi 6-8 tuần nếu kiểm soát được bệnh với liều 60 đến 90 mg tiêm dưới da. | Bình thường hóa IGF-1 ở 39-80% GH < 2,5 ng/mL ở 38–80% | Tương tự octreotide LAR |
| Bảng 3.1 (tiếp). Các thuốc trong điều trị to đầu chỉ | |||||
| SRLs thế hệ 2 | |||||
| Thành phần | Mô tả | Chỉ định | Liều lượng | Hiệu quả | Tác dụng phụ |
| Pasireotide LAR | Pasireotide tác dụng kéo dài Có ái lực với SSTR1, SSTR2, SSTR3 và SSTR5. Tiêm bắp mỗi 4 tuần. | Xem xét ở những bệnh nhân không đáp ứng với SRLs thế hệ 1. Là điều trị đầu tay ở bệnh nhân không có chỉ định phẫu thuật, bệnh dai dẳng sau phẫu thuật và trong lúc đợi xạ trị phát huy hiệu quả tối ưu. | 20-60 mg tiêm bắp mỗi 4 tuần. Bắt đầu 40 mg tiêm bắp mỗi 4 tuần, chỉnh liều 20 mg mỗi 3 tháng dựa vào nồng độ IGF-1. | Kiểm soát sinh hóa ở 31,3% so với 19,2% bệnh nhân dùng octreotide LAR. Kiểm soát sinh hóa ở 20% bệnh nhân kháng với SRLs thế hệ 1. | Tăng đường máu ở 57,3-65%. Tác dụng phụ khác tương tự SRLs thế hệ 1. |
Chất đối kháng thụ thể GH | |||||
| Pegvisomant | Chất đối vận GH dẫn đến giảm sản xuất IGF-1 Tiêm dưới da hằng ngày | Lựa chọn thứ 2 ở những bệnh nhân mắc bệnh dai dẳng sau phẫu thuật. Có thể sử dụng như liệu pháp điều trị đầu tay. Không khuyến cáo ở những bệnh nhân có khối u tuyến yên phát triển hoặc những bệnh nhân lo ngại khối u phát triển. | 10-30 mg tiêm dưới da mỗi ngày. Bắt đầu 40 mg tiêm dưới da × 1 lần, sau đó 10 mg tiêm dưới da hằng ngày, tăng 5 mg mỗi ngày trong 4-6 tuần dựa vào nồng độ IGF-1. | Bình thường hóa IGF-1 ở 60%. Có thể rối loạn đường máu lúc đói, insulin và mức HbA1c. | Tăng men gan ở 2,5%, kiểm tra men gan mỗi tháng trong 6 tháng đầu, sau đó mỗi 4-6 tháng. Ban ngứa da, loạn dưỡng mỡ ở vị trí tiêm. Chụp MRI định kỳ để theo dõi khối u. Tăng nồng độ GH và không nên theo dõi thường quy GH. |
| Bảng 3.1 (tiếp). Các thuốc trong điều trị to đầu chi | |||||
| Thành phần | Mô tả | Chỉ định | Liều lượng | Hiệu quả | Tác dụng phụ |
| Chất chủ vận dopamin | |||||
| Cabergolin | Có ái lực với D2R Ức chế tiết GH bởi kích thích thụ thể dopamin bộc lộ trên somato- tropinomas. Liều uống 2 lần một tuần. | Tăng nhẹ đến trung bình IGF-1/GH (< 1,5 x ULN) Điều trị u tiết hỗn hợp prolactin/GH. | Liều 0,3-7 mg/tuần Bắt đầu 0,25 mg 2 lần mỗi tuần x 1 tháng, chỉnh liều dựa trên nồng độ IGF-1. | Kiểm soát sinh hóa ở 30% đơn trị liệu. Kiểm soát sinh hóa khi kết hợp với SRL ở 40-50%. | Buồn nôn, đau đầu, táo bón, hạ áp tư thế, chóng mặt, ngạt mũi. Rối loạn tâm thần và rối loạn kiểm soát xung động (hiếm gặp). |
| D2R (dopamine D2 receptor): Thu thể dopamin D2; GH (growth hormone): Hormon tăng trưởng; HbA1c (glycosylated hemoglobin A1c): Hemoglobin gån glucose; IGF-1 (insulin-like growth factor 1): Yếu tố tăng trưởng giống insulin typ 1; IM (intramuscular): Tiêm bắp; LFTs (liver function tests): Test chức năng, gan; LAR (long-acting release): Dạng phóng thích với tác dụng kéo dài; SRL (somatostatin receptor ligand): Chất gắn thụ thể somatostatin; SSTR (somatostatin receptor subtype): Thụ thể somatostatin dưới nhóm. | |||||
| Dữ liệu từ Paragliola RM, Corsello SM, Salvatori R. Somatostatin receptor ligands in acromegaly: clinical response and factors predicting resistance. Pituitary 2017;20:109-115; Gadelha MR, Wildemberg LE, Bronstein MD, Gatto F, Ferone D. Somatostatin receptor ligands in the treatment of acromegaly. Pituitary 2017;20:100-108; Kuhn E, Chanson P. Cabergoline in acromegaly. Pituitary 2017;20:121-128; and Sandret L, Maison P, Chanson P. Place of cabergoline in acromegaly: a meta-analysis. J Clin Endocrinol Metab. | |||||
3.3 Các điều trị không dùng thuốc khác
Xạ trị được xem xét như một điều trị bước hai hoặc bước ba ở các bệnh nhân không đáp ứng hoàn toàn với phẫu thuật hoặc điều trị nội khoa [7].
Cả xạ trị thường quy (CRT) và xạ phẫu định vị (ví dụ, dao Gamma, CyberKnife, máy gia tốc tuyến tính và chùm tia proton) đã được sử dụng để điều trị adenoma tiết kích tố hướng thân. Điều trị bằng xạ phẫu não định vị (SRS) là kỹ thuật cung cấp liều tia xạ cao đối với một đích được xác định, giúp kiểm soát được khối u ở 93% đến 100% bệnh nhân và kiểm soát được sinh hoá ở 44% đến 55% bệnh nhân trong thời gian 5 năm. Xạ phẫu não định vị ít làm tổn hại mô não xung quanh hơn, vì vậy ít gây hậu quả không mong muốn hơn so với xạ trị thường quy, tuy nhiên kỹ thuật này bị hạn chế bởi kích thước khối u và mức độ gần kề của u với thần kinh thị giác. Xạ trị thường quy giúp kiểm soát được u ở 80% đến 100% các trường hợp và kiểm soát được sinh hóa ở 60% đến 80% bệnh nhân, song có khởi phát tác dụng chậm hơn và có thể cần phải chờ tới 15 năm mới thấy có đáp ứng đầy đủ hay hoàn toàn với điều trị [21].
Tình trạng suy tuyến yên xảy ra ở > 50% bệnh nhân khi được điều trị bằng xạ trị thường quy hay xạ phẫu não định vị trong 5 đến 10 năm điều trị [6]. Có thể tăng nguy cơ bị khối u thứ phát và đột quỵ với cả hai kiểu xạ trị nói trên [21].
4 CÁC BIẾN CHỨNG
Tỷ lệ tử vong được chuẩn hóa đối với bệnh nhân bị to đầu chi là 1,7 so với dân số chung trong đó hầu hết tử vong do bệnh lý tim mạch, hô hấp và mạch não [22].
Bệnh lý tim mạch đồng mắc gia tăng liên quan với tăng huyết áp, phì đại thất trái, rối loạn chức năng tâm trương và tâm thu, loạn nhịp tim. Bệnh van tim cũng thường gặp. Bệnh nhân phải được tiến hành đánh giá nguy cơ tim mạch với đo huyết áp và xét nghiệm chuyển hóa lipid máu. Cần xem xét ghi điện tâm đồ và/hoặc siêu âm tim, hội chẩn bác sĩ chuyên khoa tim mạch đối với các bệnh nhân có bệnh tim đã biết trước khi tiến hành phẫu thuật [7].
Các biến chứng hô hấp của to đầu chi bao gồm ngừng thở khi ngủ (> 50% các bệnh nhân) [4] và suy hô hấp. Mặc dù tình trạng này có thể cải thiện nhờ điều trị to đầu chi, một số bệnh nhân sẽ tiếp tục cần hỗ trợ thông khi không xâm lấn áp lực dương cuối thì thở ra (CPAP)
vào ban đêm.
Tình trạng kháng insulin xuất hiện như hậu quả của cả rối loạn chức năng tế bào B tụy và kháng insulin ở gan, cơ vân và mô mỡ. đái tháo đường typ 2 xảy ra ở 19% đến 56% bệnh nhân, vì vậy tất cả các bệnh nhân này phải được tiến hành sàng lọc phát hiện bệnh đái tháo đường [23].
Rối loạn chức năng tuyến yên bao gồm suy giáp thứ phát, suy sinh dục, suy thượng thận và giảm nồng độ prolactin máu có thể xảy ra do tác động tại chỗ của u, phải được sàng lọc thỏa đáng như đã được trình bày ở Chương 1 (Các khối u hố yên và trên hố yên) và Chương 6 (Suy tuyến yên).
Nguy cơ bị polyp đại tràng tăng lên ở bệnh nhân to đầu chi, tình trạng này có thể được kết hợp với tăng nguy cơ bị ung thư đại trực tràng mặc dù bệnh nhân bị to đầu chi không có gia tăng nguy cơ bị chết do ung thư. Soi đại tràng vào thời điểm chẩn đoán bệnh to đầu chi được khuyến cáo với các thăm dò theo dõi như các hướng dẫn lâm sàng cho quần thể bệnh nhân chung [7,24].
Nguy cơ bị nhân tuyến giáp và ung thư tuyến giáp ở bệnh nhân to đầu chỉ thường cao. Siêu âm tuyến giáp được khuyến cáo đối với bệnh nhân có nhân tuyến giáp có thể sờ được khi khám song không được ủng hộ cho mục đích sàng lọc rộng rãi [6].
To đầu chi đã được chứng minh có kết hợp với tình trạng tăng cao hơn tỷ trọng xương vùng cổ xương đùi và gia tăng nguy cơ gãy đốt sống có thể do tác động của tăng GH và IGF-1 trên chu chuyển xương [25]. Nên tiến hành đo tỷ trọng xương ở bệnh nhân có tiền sử bị gãy xương và nên được xem xét ở bệnh nhân có nguy cơ bị gãy xương cao, chẳng hạn như bệnh nhân bị suy sinh dục.
5 KIỂM TRA VÀ THEO DÕI
Làm các xét nghiệm sinh hóa
- Ở bệnh nhân đã được phẫu thuật, nồng độ GH vào ngày thứ nhất sau mổ < 2 ng/mL đã được chứng minh là có tương quan với tỷ lệ lui bệnh trong dài hạn. Nồng độ IGF-1 cần được định lượng sau phẫu thuật 12 tuần và xét nghiệm nhắc lại sau đó 9 đến 12 tuần nếu thấy nồng độ này vẫn tăng cao có thể do tình trạng bình thường hóa nồng độ IGF-1 bị chậm lại [7].
- Một nồng độ IGF-1 trong giới hạn bình thường và nồng độ GH làm ngẫu nhiên bằng kỹ thuật siêu nhạy < 1 ng/mL chứng tỏ bệnh đã được kiểm soát [9].
- Cũng có thể sử dụng nghiệm pháp dung nạp glucose đường uống để đánh giá kết quả. Mặc dù nhiều tác giả khuyến cáo sử dụng nồng độ GH thấp nhất <0,3 ng/mL để xác nhận bệnh đã được kiểm soát, các hướng dẫn điều trị gần đây khuyến cáo một nồng độ GH thấp nhất < 0,4 ng/mL.
- Chỉ cần theo dõi nồng độ IGF-1 khi điều trị bằng thuốc đối kháng thụ thể GH và không thể sử dụng nghiệm pháp dung nạp glucose đường uống cho bệnh nhân đang điều trị bằng chất tương tự somatostatin.
- Đánh giá đầy đủ chức năng tuyến yên nên thực hiện từ 4 đến 6 tuần sau phẫu thuật.
- Cần đánh giá liên tục tình trạng rối loạn chức năng tuyến yên sau xạ trị.
Theo dõi bằng hình ảnh

- Có thể thực hiện chụp MRI sau phẫu thuật 3 đến 4 tháng để thiết lập các dữ liệu cơ sở [7]. Thời gian tiến hành chụp các phim MRI tiếp theo tùy thuộc vào việc có kiểm soát được bệnh hay không. Nếu đạt được khả năng kiểm soát bệnh bằng phẫu thuật, có thể chỉ cần chụp MRI 2-3 năm một lần. Ở bệnh nhân không kiểm soát được bệnh một cách thỏa đáng nên tiến hành chụp MRI hằng năm để theo dõi.
- Với điều trị bằng chất đối kháng thụ thể GH nên tiến hành chụp MRI 6 tháng sau khi bắt đầu điều trị và sau đó hằng năm do nguy cơ tiềm ẩn là khối u tiếp tục phát triển.
6 KẾT CỤC VÀ TIÊN LƯỢNG
Nếu không được điều trị, tuổi thọ trung bình của bệnh nhân to đầu chỉ giảm đi 10 năm so với các bệnh nhân nhóm chứng. Tử vong ở các bệnh nhân này thường gặp nhất là do bệnh lý tim mạch.
Phẫu thuật khi được các phẫu thuật viên giàu kinh nghiệm thực hiện mang lại kết quả tốt nhất cho bệnh nhân.
7 TÀI LIỆU THAM KHẢO
1. Lavrentaki A, Paluzzi A, Wass JA, Karavitaki N. Epidemiology of acromegaly: review of population studies. Pituitary 2017;20(1):4-9.
2. Melmed S. Acromegaly pathogenesis and treament. J Clin Invest 2009;119:3189-3202.
3. Chanson P, Salenave S, Kamenicky P, Cazabat L, Young J. Acromegaly. Best Pract Res Clin Endocrinol Metab 2009;23:555-574.
4. Melmed S. Acromegaly. In: Melmed S, ed. The Pituitary. 4th ed. Cambridge, MA: Academic Press; 2017.
5. Capatina C, Wass JAH. 60 years of neuroendocrinology: acromegaly. J Endocrinol 2015;226 (2):T141-T160.
6. Katznelson L, Laws E, Sholomo M, et al. Acromegaly: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014;99(11):3933–3951.
7. Katznelson L, Atkinson JL, Cook DM, et al. American association of clinical endocrinologists medical guidelines for clinical practice for the diagnosis and treatment of acromegaly-2011 update. Endocrine Practice 2011;17(Suppl 4):1-44.
8. Ribeiro-Oliveira A, Faje AT, Barkan AL. Limited utility of oral glucose tolerance test in biochemically active acromegaly. Eur J Endocrinology 2011;164(1):17–22.
9. Guistina A, Chanson P, Bronstein D, et al. A consensus on criteria for cure of acromegaly. J Clin Endocrinol Metab 2010;95:3141-3148.
10. Casanueva FF, Barkan AL, Buchfelder M, et al. Criteria for the definition of Pituitary Tumor Centers of Excellence (PTCOE): a pituitary society statement. Pituitary 2017;20:489–498.
11. Gadelha MR, Wildemberg LE, Bronstein MD, Gatto F, Ferone D. Somatostatin receptor ligands in the điều trị of acromegaly. Pituitary 2017;20:100–108.
12. Paragliola RM, Corsello SM, Salva- tori R. Somatostatin receptor ligands in acromegaly: clinical response and factors predicting resistance. Pitu- itary 2017;20:109–115.
13. Sandret L, Maison P, Chanson P. Place of cabergoline in acromegaly: a meta-analysis. J Clin Endocrinol Metab 2011;96(5):1327-1335.
14. Kuhn E, Chanson P. Cabergoline in acromegaly. Pituitary 2017;20:121–128.
15. Shanik MH, Cao PD, Ludlam WH. Historical response rates of somatostatin analogues in the điều trị of acromegaly: a systematic review. Endocr Pract 2016;22(3):350–356.
16. Cuevas-Ramos D, Fleseriu M. Pasireotide: a novel treament for patients with acromegaly. Drug Des Devel Ther 2016;10:227-239.
17. Van der Lely AJ, Biller BM, Brue T, et al. Long-term safety of pegvisomant in patients with acro- megaly: comprehensive review of 1288 subjects in ACROSTUDY. J Clin Endocrinol Metab 2012;97(5): 1589-1597.
18. Buhk JH, Jung S, Psychogios MN, et al. Tumor volume of growth hormone-secreting pituitary adenomas during treatment with pegvisomant: a prospective mul- ticenter study. J Clin Endocrinol Metab 2010;95(2):552–558.
19. Lim DST, Fleseriu M. The role of combination medical therapy in the điều trị of acromegaly. Pituitary 2017;20:136–148.
20. Melmed S. New therapeutic agents for acromegaly. Nat Rev Endocrinol 2016;12(2):90–98.
21. Gheorghiu ML. Updates in outcomes of stereotactic radiation therapy in acromegaly. Pituitary 2017;20:154–168.
22. Sherlock M, Reulen RC, Alonso AA, et al. ACTH deficiency, higher doses of Hydrocortisone replacement, and radiotherapy are independent predictors of mortality in patients with acromegaly. J Clin Endocrinol Metab 2009;94:4216-4223.
23. Pivonello R, Auriemma RS, Grasso LF, et al. Complications of acromegaly: cardiovascular, respiratory and metabolic comor- bidities. Pituitary 2017;20:46-62.
24. Melmed S, Casanueva FF, Klibanski A, et al. A consensus on the diagnosis and treament of acromegaly complications. Pituitary 2013;16:294–302.
25. Mazziotti G, Biagioli E, Maffezzoni F, et al. Bone turnover, bone mineral density, and fracture risk in acromegaly: a meta-analysis. J Clin Endocrinol Metab 2015;100(2):384–394.

