Bệnh thận liên quan đến sử dụng thuốc cản quang ở người cao tuổi
Đại học Y Dược Thành phố Hồ Chí Minh - Bộ môn Lão khoa
Chủ biên PGS.TS.BS. Nguyễn Văn Tân
PGS.TS.BS. Nguyễn Văn Trí
TS.BS. Nguyễn Thanh Huân
Các tác giả tham gia biên soạn
Nguyễn Văn Tân
Bệnh thận do thuốc cản quang là tình trạng xuất hiện suy thận cấp hoặc tăng mức độ suy giảm chức năng thận sau khi sử dụng thuốc cản quang có chứa I-od bằng đường tĩnh mạch. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc thông tin về bệnh thận do thuốc cản quang ở người cao tuổi.
1 MỞ ĐẦU
Trường hợp đầu tiên của tổn thương thận cấp do thuốc cản quang (CI-AKI) được mô tả vào năm 1954, khi thuốc cản quang có chứa i-ốt được tiêm vào tĩnh mạch ở một bệnh nhân để chụp bể thận đồ (pyelogram). Trong những năm qua, việc sử dụng ngày càng nhiều các quy trình chẩn đoán và can thiệp yêu cầu sử dụng thuốc cản quang có chứa i-ốt đã dần dần làm tăng dân số có nguy cơ mắc CI-AKI (Hình 1). Đặc biệt, trong 30 năm qua, cùng với sự phổ biến của các thủ thuật can thiệp nội mạch, sự chú ý ngày càng tăng về khả năng hoặc xác nhận vai trò của thuốc cản quang có chứa i-ốt trong việc làm suy giảm chức năng thận trên những bệnh nhân trải qua các khảo sát chẩn đoán và can thiệp tim mạch cũng như các chiến lược phòng ngừa hậu quả.
Ngày nay, dự đoán số bệnh nhân bị tổn thương thận do thuốc cản quang gây ra lên đến hàng triệu. CI-AKI thường được xem là nguyên nhân đứng hàng thứ ba trong số các nguyên nhân gây ra tổn thương thận cấp mắc phải tại bệnh viện dựa trên dữ liệu từ một bệnh viện tại Hoa Kỳ. Trong nghiên cứu này, tần suất của CI-AKI cao hơn cả tần suất của tổn thương thận cấp do giảm tưới máu thận (ví dụ như giảm lưu lượng máu đến thận, hạ huyết áp hoặc suy tim sung huyết) và suy giảm chức năng thận do thuốc gây ra. Nếu đưa thuốc cản quang vào trong danh mục thuốc, thì thuốc cản quang sẽ được xếp hàng thứ hai trong tất cả các nguyên nhân của tổn thương thận cấp, chiếm 13%.
2 CẤP CỨU CÁC BỆNH THƯỜNG GẶP Ở NGƯỜI CAO TUỔI
Tổn thương thận cấp do thuốc cản quang có ảnh hưởng nghiêm trọng đến tử suất và bệnh suất của người bệnh. Do đó, tìm hiểu về dịch tễ, cơ chế bệnh sinh, yếu tố nguy cơ và các chiến lược dự phòng CI-AKI đóng vai trò rất quan trọng trong lĩnh vực tim mạch học can thiệp. Bài viết này của chúng tôi sẽ trình bày một số điểm liên quan đến các vấn đề nêu trên.
3 KHÁI NIỆM VỀ CÁC THUẬT NGỮ VÀ ĐỊNH NGHĨA BỆNH THẬN DO THUỐC CẢN QUANG
3.1 Khái niệm về các thuật ngữ
Trong thập kỷ qua, một số nghiên cứu dịch tễ học lớn cho thấy tổn thương thận cấp sau khi tiếp xúc với thuốc cản quang có chứa i-ốt không nhất thiết là do thuốc cản quang gây ra. Một số báo cáo thậm chí còn đặt câu hỏi liệu đây có phải là một bệnh lý thực sự hay không. Điều này đã làm dấy lên nhiều cuộc tranh luận và dẫn đến những cái tên mới hơn cho tình trạng này, bao gồm cả tổn thương thận cấp sau dùng cản quang và tổn thương thận cấp liên quan đến thuốc cản quang (Bảng 1). Cơ sở lý luận trong số các định nghĩa mới này là để loại bỏ mối quan hệ nhân quả liên quan đến thuật ngữ CI-AKI.
Bảng 1. Thuật ngữ và định nghĩa tổn thương thận liên quan thuốc cản quang có chứa i-ốt
| Thuật ngữ | Định nghĩa |
| Bệnh thận do thuốc cản quang | Thuật ngữ truyền thống để chỉ chức năng thận xấu đi trong vòng 48 giờ sau khi dùng thuốc cản quang có chứa i-ốt. Thuật ngữ này phần lớn đã được thay thế bằng tổn thương thận cấp do thuốc cản quang. |
| Tổn thương thận cấp liên quan đến thuốc cản quang | Bất kỳ tổn thương thận cấp tính nào xảy ra trong vòng 48 giờ sau khi dùng thuốc cản quang có chứa i-ốt. Thuật ngữ này ngụ ý chẩn đoán tương quan và không gợi ý mối quan hệ nhân quả giữa tổn thương thận cấp và thuốc cản quang có chứa i-ốt |
| Tổn thương thận cấp sau dùng thuốc cản quang | Đồng nghĩa với tổn thương thận cấp do thuốc cản quang. Thuật ngữ này xuất hiện trong các y văn về X quang. Tương tự như tổn thương thận cấp liên quan đến thuốc cản quang, nó ngụ ý chẩn đoán tương quan mà không gợi ý mối quan hệ nhân quả giữa tổn thương thận cấp và thuốc cản quang có i-ốt. |
| Tổn thương thận cấp do thuốc cản quang | hay thế bệnh thận do thuốc cản quang làm thuật ngữ được chấp nhận khi tổn thương thận cấp có liên quan nhân quả với thuốc cản quang có chứa i-ốt. Nó là một tập hợp con của tổn thương thận cấp liên quan đến thuốc cản quang. |
Nguồn: Mehdi A, 2020.
3.2 Định nghĩa tổn thương thận cấp do thuốc cản quang
Định nghĩa CI-AKI theo truyền thống được dựa trên creatinin huyết thanh, dấu hiệu phổ biến nhất của bệnh thận cấp và bệnh thận mạn. Một số định nghĩa đã được sử dụng trong nhiều thập kỷ qua và trong các chuyên ngành khác nhau, cho thấy thách thức đối với việc ước tính mức độ liên quan đến dịch tễ học của tình trạng này và làm phức tạp các so sánh trong nghiên cứu.
Trong số rất nhiều định nghĩa về CI-AKI (Bảng 2) thì gần đây nhất định nghĩa được đưa ra bởi Hội Thận học Quốc tế - KDIGO (Kidney Disease Improving Global Outcomes) và sự kết hợp các biến số chính cho phép hiểu được nhiều dạng biểu hiện lâm sàng khác nhau của CI-AKI: tăng creatinin huyết thanh ở mức thấp nhưng hằng định trong vài ngày (21,5 lần so với giá trị cơ bản ban đầu trong vòng 7 ngày), sự gia tăng đột ngột creatinin huyết thanh trong khoảng thời gian ngay sau khi tiếp xúc với thuốc cản quang (20,3 mg/dL trong vòng 48 giờ) và sự xuất hiện của thiểu niệu (thể tích nước tiểu <0,5 mL/kg/giờ trong thời gian >6 giờ). Hơn nữa, KDIGO cũng cung cấp một hệ thống phân giai đoạn, điều này đặc biệt hữu ích để đánh giá tác động lâm sàng của CI-AKI trên sự thay đổi lớn về mức độ nghiêm trọng của biểu hiện lâm sàng (từ tăng creatinin huyết thanh không triệu chứng đến suy thận trên lâm sàng với nhu cầu cần phải điều trị thay thế thận khẩn cấp).
Bảng 2. Định nghĩa tổn thương thận cấp do thuốc cản quang
| Định nghĩa | Tác giả |
| Tăng creatinin huyết thanh 20,5 mg/dL hoặc ≥25% tại thời điểm 48 giờ | Mehran và cộng sự, 2004 |
| Tăng creatinin huyết thanh >0,5 mg/dL hoặc >25% trong 72 giờ | Hội Hình ảnh học Tiết niệu Sinh dục Châu Âu (ESUR) |
| Tăng creatinin huyết thanh 20,5 mg/dL so với giá trị cơ bản ban đầu | BMC27 |
| Tăng creatinin huyết thanh >50% hoặc giảm hơn 25% độ lọc cầu thận (GFR) hoặc thiểu niệu (<0,5 mL/kg/giờ trong thời gian >6 giờ) Các giai đoạn: - Nguy cơ: creatinin huyết thanh tăng 1,5 - 2 lần so với giá trị cơ bản ban đầu hoặc GFR giảm >25%; thể tích nước tiểu (<0,5 mL/kg/giờ trong thời gian 26 giờ - Tồn thương: creatinin huyết thanh tăng 2 ~ 3 lần so với giá trị cơ bản ban đầu hoặc GFR giảm >50%; thể tích nước tiểu (<0,5 mL/kg/giờ trong thời gian 212 giờ - Suy thận: creatinin huyết thanh tăng >3 lần so với giá trị cơ bản ban đầu hoặc GFR giảm >75% hoặc creatinin huyết thanh 24 mg/dL với tăng cấp tỉnh 20,5 mg/dL hoặc thể tịch nước tiểu (<0,3 mL/kg/giờ trong thời gian ≥24 giờ hoặc vô niệu trong khoảng thời gian 212 giờ - Mất chức năng thận: suy thận cấp dai dẳng hay kéo dài: mất hoàn toàn chức năng thận >4 tuần (cần phải lọc máu) - Bệnh thận giai đoạn cuối mất hoàn toàn chức năng thận >3 tháng (cần phải lọc máu) | RIFLEB |
| Tăng creatinin huyết thanh ≥0,3 mg/dL hoặc ≥50% so với giá trị cơ bản ban đầu hoặc thiểu niệu (<0,5 mL/kg/giờ trong khoảng thời gian >6 giờ) trong vòng 48 giờ - Giai đoạn 1: tăng creatinin huyết thanh 20,3 mg/dL hoặc tăng 2150% đến 200% (gấp 1,5 - 2 lần) so với giá trị cơ bản ban đầu; thể tích nước tiểu <0,5 mL/kg/giờ trong khoảng thời gian >6 giờ - Giai đoạn 2: tăng creatinin huyết thanh >150% đến 200% (>2 - 3 lần) so với giá trị cơ bản ban đầu; thể tích nước tiểu <0,5 mL/kg/giờ trong khoảng thời gian >6 giờ - Giai đoạn 3: tăng creatinin huyết thanh >300% (>3 lần) so với giá trị cơ bản ban đầu, creatinin huyết thanh 24 mg/dL với tăng cấp tính >0,5 mg/dL; thể tích nước tiểu (<0,3 mL/kg/giờ trong thời gian ≥24 giờ hoặc vô niệu trong khoảng thời gian ≥12 giờ | AKIN |
| Tăng creatinin huyết thanh ≥1,5 lần so với giá trị cơ bản ban đầu trong vòng 7 ngày hoặc tăng creatinin huyết thanh ≥0,3 mg/dL trong vòng 48 giờ hoặc thể tích nước tiểu <0,5 mL/kg/giờ trong khoảng thời gian >6 giờ - Giai đoạn 1: creatinin huyết thanh tăng 1,5 -1,9 lần so với giá trị cơ bản ban đầu hoặc ≥0,3 mg/dL; thể tích nước tiểu <0,5 mL/kg/giờ trong khoảng thời gian >6 giờ - Giai đoạn 2: creatinin huyết thanh tăng 2,0 -2,9 lần so với giá trị cơ bản ban đầu; thể tích nước tiểu <0,5 mL/kg/giờ trong khoảng thời gian ≥12 giờ - Giai đoạn 3: creatinin huyết thanh tăng 23 lần so với giá trị cơ bản ban đầu hoặc creatinin huyết thanh 24 mg/dL hoặc bắt đầu điều trị thay thế thận; thể tích nước tiểu (<0,3 mL/kg/giờ trong thời gian ≥24 giờ hoặc vô niệu trong khoảng thời gian ≥12 giờ | KDIGO |
Định nghĩa CI-AKI dựa trên các dấu ấn sinh học thay thế cũng đã được đề xuất. Cystatin C nhạy hơn creatinin huyết thanh để phát hiện nhanh những thay đổi cấp tính của chức năng thận". Briguori và cộng sự đã xác định sự gia tăng cystatin C trong huyết thanh lớn hơn hoặc bằng 10% so với mức ban đầu tại thời điểm 24 giờ sau khi tiếp xúc với thuốc cản quang là ngưỡng tối ưu để xác định sớm những bệnh nhân có nguy cơ mắc CI-AKI (giá trị tiên đoán âm 100% và giá trị tiên đoán dương 39,1%, sử dụng mức tăng creatinin huyết thanh lớn hơn hoặc bằng 0,3 mg/dL trong vòng 48 giờ như là tiêu chuẩn vàng). Định nghĩa CI-AKI như vậy cũng cho thấy mối tương quan tốt với dự hậu tại thời điểm 1 năm. Một dấu ấn sinh học sớm khác của tổn thương thận cấp có thể phù hợp để phát hiện CI-AKI là lipocalin liên quan với gelatinase của bạch cầu trung tính (NGAL). Quintavalle và cộng sự nhận thấy rằng giá trị NGAL tại thời điểm 6 giờ lớn hơn hoặc bằng 179 ng/mL có giá trị tiên đoán âm tính 93% và giá trị tiên đoán dương tính 20% đối với CI-AKI được xác định bởi Briguon và cộng sự. Mặc dù các xét nghiệm mới này có giá trị tiềm năng của nó, nhưng việc sử dụng các định nghĩa này và các định nghĩa CI-AKI mới khác dựa trên các dấu ấn sinh học thay thế bị cản trở do hạn chế về sự phổ biến và công nhận của các xét nghiệm này.
4 DỊCH TỄ HỌC CỦA TỔN THƯƠNG THẬN CẤP DO THUỐC CẢN QUANG
Do sự không đồng nhất của các định nghĩa CI-AKI và thiếu sự kiểm soát có hệ thống đối với creatinin huyết thanh sau các thủ thuật chẩn đoán và can thiệp có sử dụng thuốc cản quang, một loạt các tỷ lệ mắc CI-AKI được báo cáo trong các y văn là không đáng ngạc nhiên. Do đó, dịch tễ học của CI-AKI sẽ thay đổi tùy theo loại thủ thuật được thực hiện.
4.1 Chụp mạch vành
Vẫn còn nhiều thách thức để xác định dịch tễ học của CI-AKI sau khi chụp mạch vành, bởi vì hầu hết các ghi nhận đều tập trung vào bệnh nhân chủ yếu (hoặc thậm chí chỉ riêng) trải các can thiệp. Hình 2 trình bày tỷ lệ mắc CI-AKI qua các nghiên cứu chụp động mạch vành.
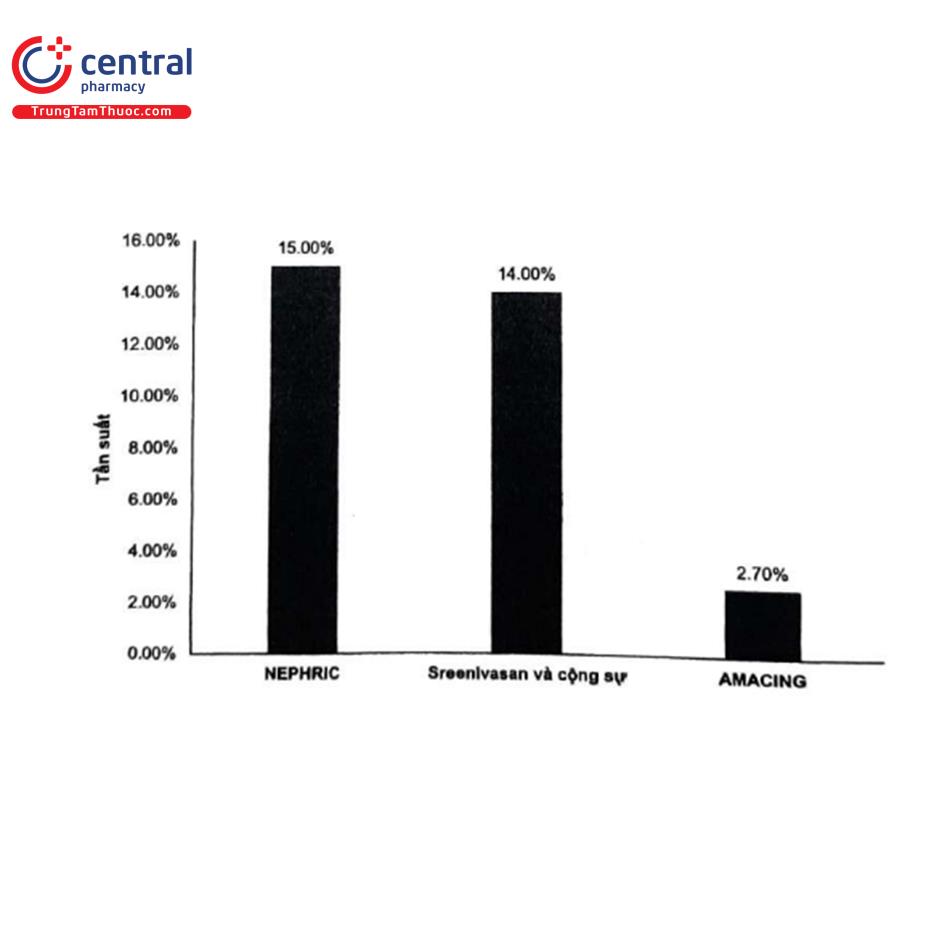
Nguồn: Aspelin P, 2003, Sreenivasan J, 2018, Nijssen EC, 2017
Thử nghiệm NEPHRIC chọn ngẫu nhiên 129 bệnh nhân được chụp động mạch vành hoặc động mạch chủ có hoặc không can thiệp với 1 trong 2 loại thuốc cản quang có i-ốt: iodixanol hoặc iohexol' CI-AKI được định nghĩa là sự gia tăng creatinin huyết thanh trên 0,5 mg/dL sau 72 giờ và được ghi nhận là 15%. Thể tích thuốc cản quang trung bình được sử dụng khá cao (khoảng 160 mL) và 21% bệnh nhân trong nghiên cứu này đã trải qua can thiệp. Tương tự, trong một nghiên cứu hồi cứu đơn trung tâm của Sreenivasan và cộng sự, CI-AKI được định nghĩa là sự gia tăng creatinin huyết thanh >0,3 mg/dL trong vòng 48 giờ, tỷ lệ được ghi nhận là 145. Thể tích thuốc cản quang được sử dụng là 131 ± 89 mL, đây là một giá trị cao hơn nhiều so với dự kiến ở nhóm bệnh nhân chỉ trải qua chụp mạch vành, vì chỉ có 34% bệnh nhân trải qua PCI đồng thời. Những bệnh nhân không có sẵn giá trị creatinin huyết thanh sau điều trị đã bị loại khỏi nghiên cứu này, do đó có thể đã đánh giá quá mức tỷ lệ mắc CI-AKI thực sự. Cuối cùng, thử nghiệm AMACING trong đó lựa chọn ngẫu nhiên 660 bệnh nhân được dự phòng bằng truyền dịch qua đường tĩnh mạch trước khi tiếp xúc với thuốc cản quang so với không dự phòng, bao gồm 48% bệnh nhân được sử dụng thuốc cản quang để chụp mạch vành hoặc mạch ngoại biên và chỉ 16% bệnh nhân được can thiệp Thể tích thuốc cản quang trung bình được dùng khoảng 90 mL. Do đó, dữ liệu từ thử nghiệm này có thể cung cấp một con số đáng tin cậy về tỷ lệ mắc CI-AKI ở những bệnh nhân được chụp mạch chẩn đoán hiện nay. CI-AKI được định nghĩa là sự gia tăng creatinin huyết thanh hơn 25% hoặc lớn hơn 0,5 mg/dL trong vòng 2 đến 6 ngày sau khi tiếp xúc với thuốc cản quang, được ghi nhận chỉ 2,7% trên tổng số bệnh nhân.
4.2 Can thiệp mạch vành qua da
Một số lượng lớn dữ liệu có sẵn về dịch tễ học của CI-AKI ở bệnh nhân được điều trị can thiệp mạch vành qua da (PCI) (Hình 3A)". Một nghiên cứu quan trọng của tác giả Mehran và cộng sự đã định nghĩa CI-AKI là sự gia tăng creatinin huyết thanh 0,5 mg/dL hoặc 25% sau 48 giờ. Định nghĩa này kể từ đó đã được sử dụng rộng rãi trong y văn. Tỷ lệ CI-AKI trong nghiên cứu này là 13,1%. Trong một nghiên cứu sổ bộ đơn trung tâm gần đây từ nhóm tác giả của tổ chức AKIN đã xác định tỷ lệ CI-AKI là 11,7% và CI-AKI cần lọc máu là 0,3%. Trong một phân tích tổng hợp gồm 36 thử nghiệm ngẫu nhiên bao gồm 7.166 bệnh nhân, CI-AKI được định nghĩa là sự gia tăng creatinin huyết thanh 0,5 mg/dL, được ghi nhận chiếm 6,0%'. Khi một định nghĩa thay thế về sự gia tăng creatinin huyết thanh lớn hơn 25% được sử dụng, tỷ lệ mắc bệnh đã tăng lên 9,0%. Dữ liệu hiện nay về tỷ lệ CI-AKI đã có sẵn từ các nghiên cứu sổ bộ quốc gia lớn. Dữ liệu từ nghiên cứu sổ bộ bệnh tim mạch quốc gia (NCDR) bao gồm 985.737 bệnh nhân liên tiếp trải qua can thiệp mạch vành qua da (PCI), cho thấy tỷ lệ chung của CI-AKI theo định nghĩa AKIN là 7,1%, trong đó tổn thương thận cấp giai đoạn 1, 2 và 3 đã được chẩn đoán tương ứng là 6,0%, 0,5% và 0,3% với 0,3% cần phải bắt đầu lọc máu.
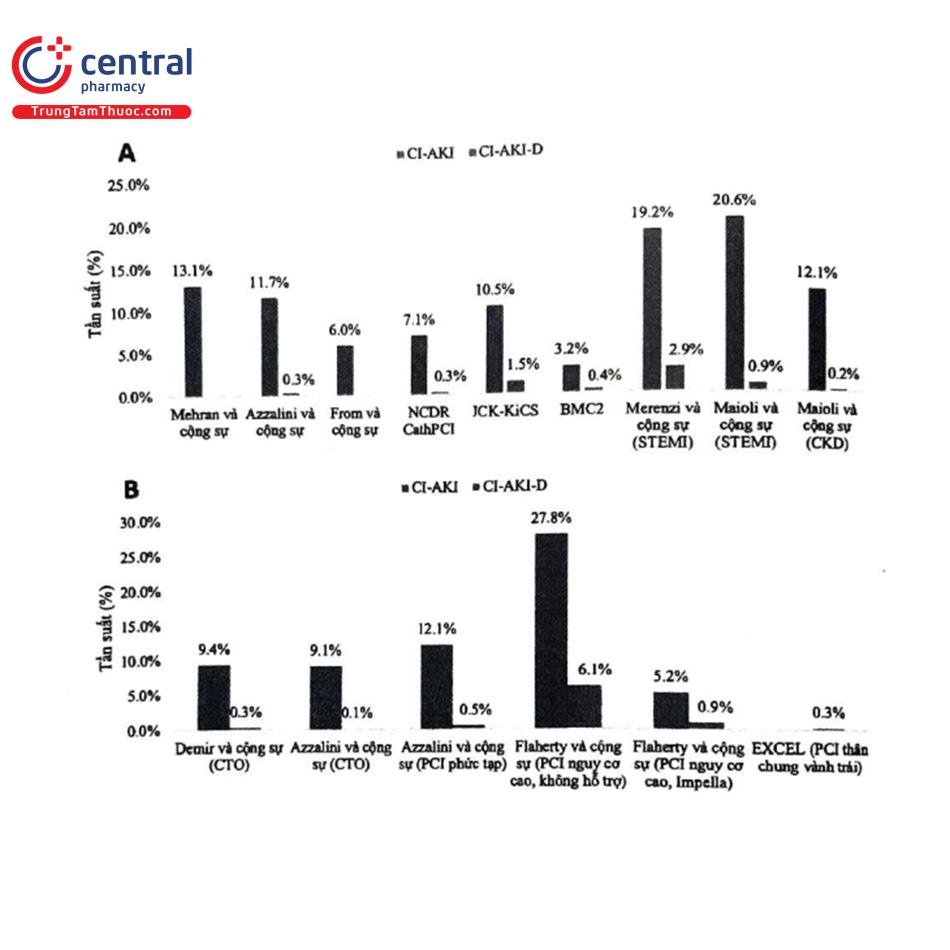
Khi các định nghĩa tương tự được áp dụng cho các nghiên cứu sổ bộ trên cơ sở dữ liệu tim mạch Nhật Bản - Cơ sở dữ liệu tim mạch liên viện Keio (JCD-KiCS), tỷ lệ mắc CI-AKI và CI-AKI cần lọc máu lần lượt là 10,5% và 1,5%2. Các tỷ lệ cao hơn này có thể phản ánh sự khác biệt về đặc điểm cơ bản của dân số nghiên cứu, tính nhạy cảm sinh học với CI-AKI ở dân số Nhật Bản và/hoặc các mô hình thực hành liên quan đến cả kỹ thuật PCI và ngưỡng bắt đầu lọc máu' Trong một phân tích từ BMC2, Gurm và cộng sự đã ghi nhận tỷ lệ mắc CI-AKI và CI-AKI cần lọc máu lần lượt là 3,2% và 0,4%22. Kết quả tỷ lệ thấp hơn này có thể được giải thích từ định nghĩa CI-AKI được sử dụng (tăng creatinin huyết thanh 0,5 mg/dL trong tuần sau PCI) ít nhạy hơn các định nghĩa bao gồm ngưỡng tuyệt đối thấp hơn hoặc thay đổi tương đối”. Hơn nữa, nhận thức ngày càng tăng về mối liên quan của thể tích thuốc cản quang νόι nguy cơ CI-AKI có thể dẫn đến sự thay đổi trong thực hành theo hướng sử dụng liều thuốc cản quang thấp hơn cho tất cả bệnh nhân đang điều trị PCI ở Michigan.
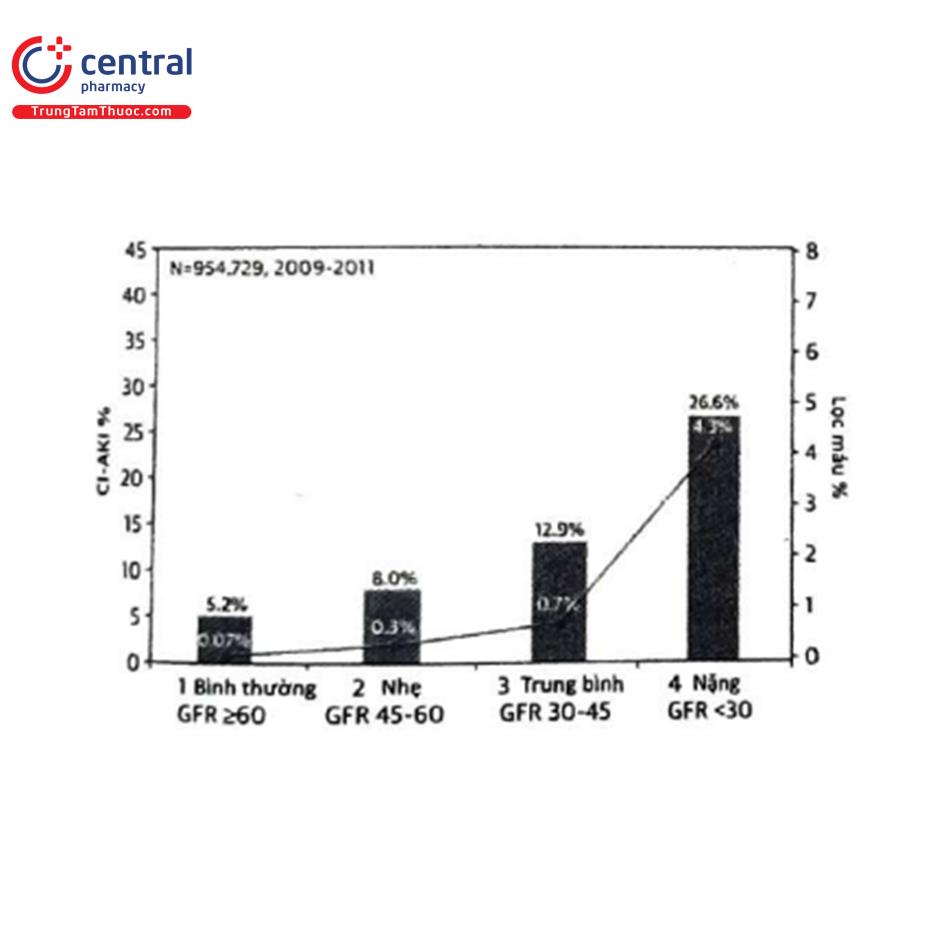
Tỷ lệ mắc CI-AKI cao hơn được ghi nhận trong các báo cáo tập trung chủ yếu trên những bệnh nhân có các tình trạng nguy cơ cao. Ví dụ hội chứng mạch vành cấp có liên quan đến tình trạng viêm toàn thân và thường có hạ huyết áp. Marenzi và cộng sự ghi nhận tỷ lệ mắc CI-AKI (tăng SCr >0,5 mg/dL) là 19,2% ở bệnh nhân trải qua PCI tiên phát trong bệnh cảnh nhồi máu cơ tim cấp có ST chênh lên (STEMI), trong đó 2,9% cần lọc máu”. Các số liệu tương tự (tương ứng là 20,6% và 0,9%) đã được ghi nhận trong các báo cáo khác trên các bệnh cảnh này2%. Bệnh thận mạn là một trong những yếu tố tiên đoán mạnh nhất của CI-AKI027. Maioli và cộng sự đã ghi nhận tỷ lệ mắc CI-AKI (tăng SCr >0,5 mg/dL trong vòng 3 ngày) là 12,1% ở bệnh nhân có độ thanh thải creatinin dưới 60 mL/phút trải qua chụp động mạch vành có hoặc không có can thiệp, nhu cầu cần phải lọc máu mới được ghi nhận là 0,2%28. Trong nghiên cứu sổ bộ NCDR CathPCI, tỷ lệ CI-AKI theo định nghĩa AKIN tăng lên khi giảm độ lọc cầu thận ước tính (eGFR) từ 5,2% ở bệnh nhân có eGFR 60 mL/phút/1,73 mẻ đến 26,6% ở bệnh nhân có eGFR dưới 30 mL/phút/1,73 m220 Tỷ lệ này được thấy cao hơn ở bệnh nhân STEMI (tương ứng từ 7,8% lên 36,9%). Sự gia tăng gần đây về mức độ phức tạp liên quan đến bệnh nhân và thủ thuật trong lĩnh vực tim mạch can thiệp đã dẫn đến việc ghi nhận một nhóm bệnh nhân cần tái thông mạch máu qua da và có nguy cơ biến chứng cao hơn, bao gồm cả CI-AKI. Ở nhóm bệnh nhân có nguy cơ cao (và được chỉ định) phức tạp này (CHIP), các tình trạng dễ dẫn đến CI-AKI (tuổi cao, bệnh thận mạn, đái tháo đường, suy tim mất bù, huyết động không ổn định, sử dụng các kỹ thuật PCI tích cực...) thường rất phổ biến. Tóm tắt về tỷ lệ mắc CI-AKI qua các nghiên cứu đoàn hệ về PCI trên nhóm bệnh nhân CHIP được trình bày trong Hình 2B. Demir và cộng sự không tìm thấy sự khác biệt về tỷ lệ CI-AKI theo định nghĩa AKIN giữa bệnh nhân trải qua PCI với tổn thương tắc hoàn toàn mạn tính (CTO) và không CTO (9,4% so với 12,1%, p= 0,17)30. Điều này đã được xác nhận trong một phân tích độ nhạy chỉ bao gồm những bệnh nhân trải qua PCI các tổn thương CTO với tình trạng lâm sàng ổn định (7,7% so với 8,5%, p = 0,66) và đã điều chỉnh đa biến.
Trong một nghiên cứu đa trung tâm chỉ tập trung vào những bệnh nhân trải qua can thiệp tổn thương CTO, tỷ lệ mắc CI-AKI theo định nghĩa AKIN là 9,1% và cao gần gấp đôi ở bệnh nhân bệnh thận mạn so với bệnh nhân không bệnh thận mạn (15,0% so với 7,8%, p = 0,001). Tỷ lệ CI-AKI cần lọc máu cũng tương tự (0,5% so với 0%, p=0,03). Trong một nghiên cứu khác từ một nhóm tác giả cho thấy không có sự khác biệt về tỷ lệ CI-AKI theo định nghĩa AKIN và CI-AKI cần lọc máu ở những bệnh nhân trải qua PCI với các tổn thương phức tạp (12,1% so với 11,5%, p = 0,63) và không phức tạp (0,5% so với 0,2%, p = 0,25) Gần đây, Flaherty và cộng sự đã ghi nhận tỷ lệ cao CI-AKI theo định nghĩa AKIN và CI-AKI cần lọc máu ở những bệnh nhân bị rối loạn chức năng thất trái nặng trải qua PCI có nguy cơ cao (tương ứng là 27,8% và 6,1%). Trong bệnh cảnh này, hỗ trợ tuần hoàn cơ học bằng Impella có liên quan đến giảm rõ rệt nguy cơ các biến chứng như vậy (tương ứng là 5,2% và 0,9%). Cuối cùng, trong một phân tích dưới nhóm của thử nghiệm EXCEL, đánh giá kết quả của tái tưới máu thân chung động mạch vành trái bằng PCI so với phẫu thuật bắc cầu nối động mạch vành, Giustino và cộng sự đã sát thấy một tỷ lệ suy thận cấp (được định nghĩa là tăng creatinin huyết thanh ≥5,0 mg/dL so với ban đầu hoặc cần phải lọc máu mới) và nhu cầu lọc máu sau 30 ngày tương ứng là 0,6% và 0,3% ở bệnh nhân đã được PCI thân chung động mạch vành trái. Một lần nữa, bệnh nhân bệnh thận mạn có tỷ lệ mắc các biến chứng như vậy cao hơn (lần lượt là 2,3% so với 0,3% và 1,1% so với 0,1%).
4.3 Can thiệp mạch máu ngoại biên
So với dữ liệu trên mạch vành thì dữ liệu có sẵn về tỷ lệ CI-AKI trong chụp và can thiệp mạch máu ngoại biên tương đối ít hơn (Hình 4). Bệnh nhân trải qua nhóm thủ thuật này thường bị bệnh xơ vữa động mạch lan tỏa, nhiều mạch máu bị ảnh hưởng và thường có một số yếu tố nguy cơ CI-AKI (tuổi cao, đái tháo đường, tăng huyết áp,...). Do đó, những bệnh nhân này vốn đã có nguy cơ bị CI-AKI cao hơn và bệnh động mạch ngoại biên được xem là một yếu tố nguy cơ”. Một nghiên cứu từ những năm 1990 đã ghi nhận tỷ lệ tương đối thấp (6,9%) của CI-AKI (được định nghĩa là sự gia tăng SCr >25% so với ban đầu) ở những bệnh nhân được chụp mạch ngoại biên và được dùng trung bình khoảng 55 mL thuốc cản quang”. Tương tự, một báo cáo từ nghiên cứu sổ bộ BMC2 PVI)36 trên 7.769 bệnh nhân trải qua các can thiệp ngoại biên chi dưới cho thấy tỷ lệ CI-AKI (tăng SCr 0,5 mg/dL) từ 3% đến 7% (tăng theo nhóm tuổi). Tuy nhiên, nhiều nghiên cứu hiện nay đã thách thức những phát hiện này. Arora và cộng sự ghi nhận tỷ lệ mắc CI-AKI theo định nghĩa AKIN là 11% ở những bệnh nhân trải qua điều trị can thiệp nội mạch cho bệnh động mạch ngoại biên mạn tính”. Kim và cộng sự đã đánh giá tỷ lệ mắc CI-AKI theo định nghĩa của Mehran trên những bệnh nhân trải qua điều trị can thiệp nội mạch vì đau cách hồi hoặc thiếu máu cục bộ chỉ nghiêm trọng và đã ghi nhận tỷ lệ mắc CI-AKI chung là 11,7%38. Gần đây nhất, Prasad và các cộng sự đã thực hiện một phân tích tổng hợp 15 nghiên cứu, bao gồm 11.311 bệnh nhân được chụp và can thiệp động mạch ngoại biên”. Các định nghĩa CI-AKI khác nhau tùy theo các nghiên cứu và hầu hết đều liên quan đến sự thay đổi tuyệt đối (>0,5 mg/dL) và/hoặc tương đối (>25%) creatinin huyết thanh so với ban đầu. Thể tích thuốc cản quang trung bình trong các nghiên cứu là 138 mL. Tỷ lệ CI-AKI được ghi nhận thay đổi trong 15 nghiên cứu, từ 0% đến 45%, với mức trung bình là 10,0%. Tỷ lệ CI-AKI cao hơn được ghi nhận khi có liên quan đến việc mở rộng thủ thuật lên động mạch chủ, chẳng hạn như trong các trường hợp sửa chữa túi phình nội mạch (9 - 19%)
.jpg)
4.4 Thay van động mạch chủ qua da (TAVR)
Tiếp xúc với thuốc cản quang chỉ là một trong các yếu tố gây ra tổn thương thận cấp ở những bệnh nhân được điều trị TAVR do hẹp van động mạch chủ nặng. Các yếu tố có thể bao gồm các bệnh đi kèm của bệnh nhân (tuổi, bệnh thận mạn, đái tháo đường, bệnh động mạch ngoại biên, thiếu máu...), các yếu tố liên quan đến thủ thuật (bong tróc mảng xơ vữa dẫn đến thuyên tắc động mạch thận thứ phát sau thao tác sử dụng các ống thông lỗ lớn trong lòng động mạch chủ) và các biến chứng (xuất huyết, truyền máu, hạ huyết áp, nhiễm trùng...). Vì những lý do này, hầu hết các y văn hiện có tập trung vào tổn thương thận cấp liên quan đến TAVR hơn là CI-AKI. Nghiên cứu hiện nay về TAVR tuân theo sự đồng thuận của Hiệp hội Nghiên cứu Học thuật Van 2 (VARC-2)41 sử dụng định nghĩa dựa trên AKIN và kéo dài thời gian chẩn đoán CI-AKI lên đến 7 ngày sau thủ thuật. Tuy nhiên, các nghiên cứu trước đây đã sử dụng các định nghĩa không đồng nhất về CI-AKI, do đó hạn chế sự so sánh giữa chúng và với các dữ liệu hiện nay.
Dữ liệu từ các thử nghiệm
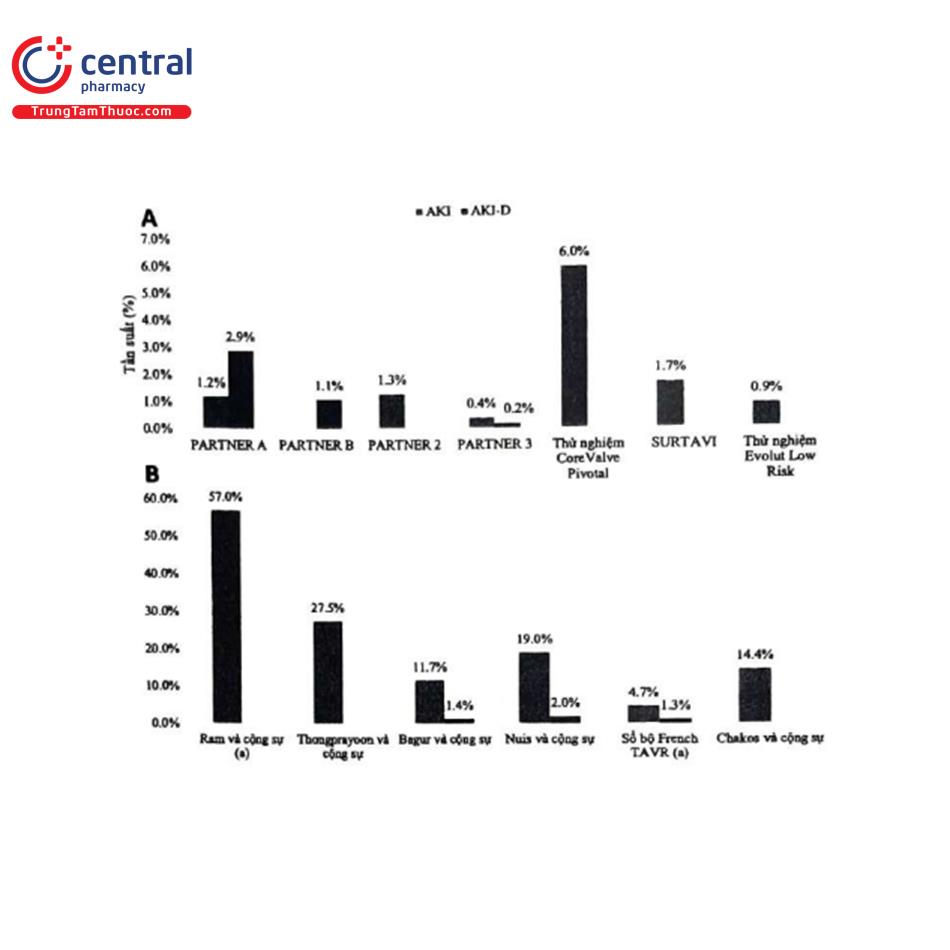
Hình 4A trình bày tỷ lệ mắc tổn thương thận cấp qua các thử nghiệm TAVR. Trong PARTNER A đã chọn ngẫu nhiên những bệnh nhân có nguy cơ cao làm TAVR với van bung bằng bóng hoặc phẫu thuật thay van, tỷ lệ tăng creatinin huyết thanh trong 30 ngày cao hơn 3 mg/dL là 1,2% và cần phải điều trị thay thế thận là 2,9% ở nhóm TAVR42 Các con số này lần lượt là 0% và 1,1% trong nhóm TAVR của thử nghiệm PARTNER B với sự phân bổ ngẫu nhiên các bệnh nhân hẹp van động mạch chủ không phẫu thuật được thực hiện TAVR hoặc điều trị tiêu chuẩn. PARTNER 2 so sánh TAVR và phẫu thuật ở những bệnh nhân có nguy cơ trung bình và cho thấy tỷ lệ mắc AKI giai đoạn 2 theo định nghĩa VARC-2/AKIN trong 30 ngày là 1,3% ở nhóm TAVR4. Cuối cùng, PARTNER 3 tập trung vào những bệnh nhân có nguy cơ thấp, đã chứng minh tỷ lệ mắc AKI giai đoạn 2 hoặc 3 theo định nghĩa VARC-2/AKIN trong 30 ngày chỉ 0,4% và nhu cầu điều trị thay thế thận chỉ 0,2 % trong nhóm TAVR.
Thử nghiệm Core Valve Pivotal của Hoa Kỳ đã lựa chọn ngẫu nhiên những bệnh nhân nguy cơ cao được điều trị bằng TAVR với van tự bung hoặc điều trị phẫu thuật và cho thấy kết quả tỷ lệ tổn thương thận cấp theo định nghĩa RIFLE (giai đoạn không được xác định) bao gồm nguy cơ, tổn thương, suy thận, mất chức năng thận và bệnh thận giai đoạn cuối là 6,0% trong nhóm TAVR. Thử nghiệm SURTAVI tập trung vào những bệnh nhân có nguy cơ trung bình và ghi nhận tỷ lệ mắc CI-AKI giai đoạn 2 hoặc giai đoạn 3 theo định nghĩa AKIN là 1,7% ở nhóm TAVR4.
Cuối cùng, thử nghiệm Evolut Low Risk ghi nhận tỷ lệ mắc bệnh CI-AKI giai đoạn 2 hoặc 3 theo định nghĩa AKIN là 0,9% trong nhóm TAVR.
Dữ liệu từ nghiên cứu sổ bộ
Các con số tương đối thấp về tỷ lệ tổn thương thận cấp từ các thử nghiệm ngẫu nhiên trái ngược với những con số được ghi nhận trong nghiên cứu sổ bộ TAVR ngoài đời thực (Hình 4B). Có nhiều lý do cho sự khác biệt này và chủ yếu xuất phát từ việc ghi nhận một cách có chọn lọc các giai đoạn tiến triển của tổn thương thận cấp trong các thử nghiệm ngẫu nhiên và nguy cơ tổn thương ban đầu của bệnh nhân cao hơn trong các nghiên cứu sổ bộ. Ram và các cộng sự ghi nhận sự thay đổi lớn về số liệu tổn thương thận cấp giữa các nghiên cứu sổ bộ từ 15% đến 57%. Một phân tích từ Mayo Clinic cho thấy tỷ lệ mắc tổn thương thận cấp theo định nghĩa KDIGO là 27,5% (giai đoạn 1: 22,0%; giai đoạn 2: 1,6%; và giai đoạn 3: 3,9%). Bagur và các cộng sự đã tiến hành một phân tích đơn trung tâm trên những bệnh nhân trải qua TAVR với van bung bằng bóng thế hệ đầu tiên qua đường động mạch đùi hoặc qua mỏm tim và ghi nhận tỷ lệ tổn thương thận cấp (được định nghĩa là giảm eGFR >25% trong vòng 48 giờ sau TAVR hoặc cần phải lọc máu) là 11,7%, với 1,4% cần phải lọc máu”. Nuis và các cộng sự đã thực hiện một nghiên cứu tương tự ở những bệnh nhân được điều trị với van tự bung thế hệ đầu tiên và cho thấy tỷ lệ tổn thương thận cấp theo định nghĩa AKIN là 19% với 2% cần phải điều trị thay thế thận”2. Một phân tích tổng hợp gần đây trên 31 nghiên cứu với tổng số 13.857 bệnh nhân, cho thấy tỷ lệ tổn thương thận cấp trong 30 ngày là 14,4%. Cuối cùng, một phân tích lớn từ nghiên cứu sổ bộ TAVR ở Pháp (n = 16,969) cho thấy có sự giảm tỷ lệ tổn thương thận cấp theo định nghĩa AKIN (từ 4,7% xuống 3,8%) và nhu cầu phải lọc máu (từ 1,3% xuống 0,7%) trong khoảng thời gian từ 2010 đến 2012 và từ 2013 đến 2015. Những phát hiện này, cùng với dữ liệu từ các thử nghiệm ngẫu nhiên song song ở các quần thể dân số có nguy cơ thấp cho thấy khi gánh nặng bệnh đồng mắc giảm thì tỷ lệ tổn thương thận cấp sau TAVR cũng giảm.
4.5 Can thiệp van hai lá
Can thiệp van hai lá qua catheter hiện nay chủ yếu bằng phương pháp sửa chữa từ mép van sang mép van qua da (MitraClip), đây là một thủ thuật không dùng thuốc cản quang, vì vậy theo định nghĩa, bất kỳ trường hợp tổn thương thận cấp nào sau thủ thuật đều có liên quan đến các yếu tố gây tổn thương khác với thuốc cản quang (ví dụ: hạ huyết áp hoặc chảy máu). Tuy nhiên, có rất ít dữ liệu về tỷ lệ tổn thương thận cấp sau MitraClip. Taramasso và cộng sự đã ghi nhận tỷ lệ tổn thương thận cấp giai đoạn 2 hoặc 3 theo định nghĩa RIFLE là 23,8% với 6,8% cần phải lọc máu”. Spieker và cộng sự ghi nhận tỷ lệ tổn thương thận cấp theo định nghĩa AKIN là 18% và không có bệnh nhân nào cần phải điều trị thay thế thận.
Tuy nhiên, thuốc cản quang đôi khi được sử dụng trong quá trình thay van hai lá qua catheter. Trong một nghiên cứu đơn trung tâm được thực hiện bởi Ye và các cộng sự, tỷ lệ tổn thương thận cấp giai đoạn 3 theo định nghĩa AKIN cần phải lọc thận là 3,2%. Trong một nghiên cứu sổ bộ đa trung tâm lớn nhất cho đến nay, tỷ lệ tổn thương thận cấp giai đoạn 2 hoặc 3 theo định nghĩa AKIN là 6,0% và cao hơn ở nhóm sửa vòng van (valve-in-ring) so với nhóm đặt van trong van (valve-in-valve) (11,1% so với 4,0%, p=0,03).
4.6 Đóng (bít dù) tiểu nhĩ trái
Bệnh nhân trải qua đóng tiểu nhĩ trái thường có nhiều bệnh đi kèm (tuổi cao, bệnh thận mạn, cơ địa dễ chảy máu,...) nên có nguy cơ cao bị CI-AKI. Trong một nghiên cứu đa trung tâm gần đây của Nombela-Franco và các cộng sự với thể tích thuốc cản quang sử dụng trung bình là 150 mL thì tỷ lệ CI-AKI theo định nghĩa AKIN là 9,0% (7,0% giai đoạn 1; 1,1% giai đoạn 2 và 0,8% giai đoạn 3). Hai bệnh nhân (0,6%) cần điều trị thay thế thận sau thủ thuật và 1 bệnh nhân tiếp tục trong quá trình theo dõi. Sedaghat và các cộng sự cũng ghi nhận tỷ lệ CI-AKI chung theo định nghĩa AKIN là 13,7%, trong đó 92,3% ở giai đoạn 1 và 7,7% ở giai đoạn 2 hoặc 360 Thể tích thuốc cản quang trung bình trong nghiên cứu này là 112 mL ± 90 mL.
5 CƠ CHẾ BỆNH SINH TỔN THƯƠNG THẬN CẤP DO THUỐC CẢN QUANG
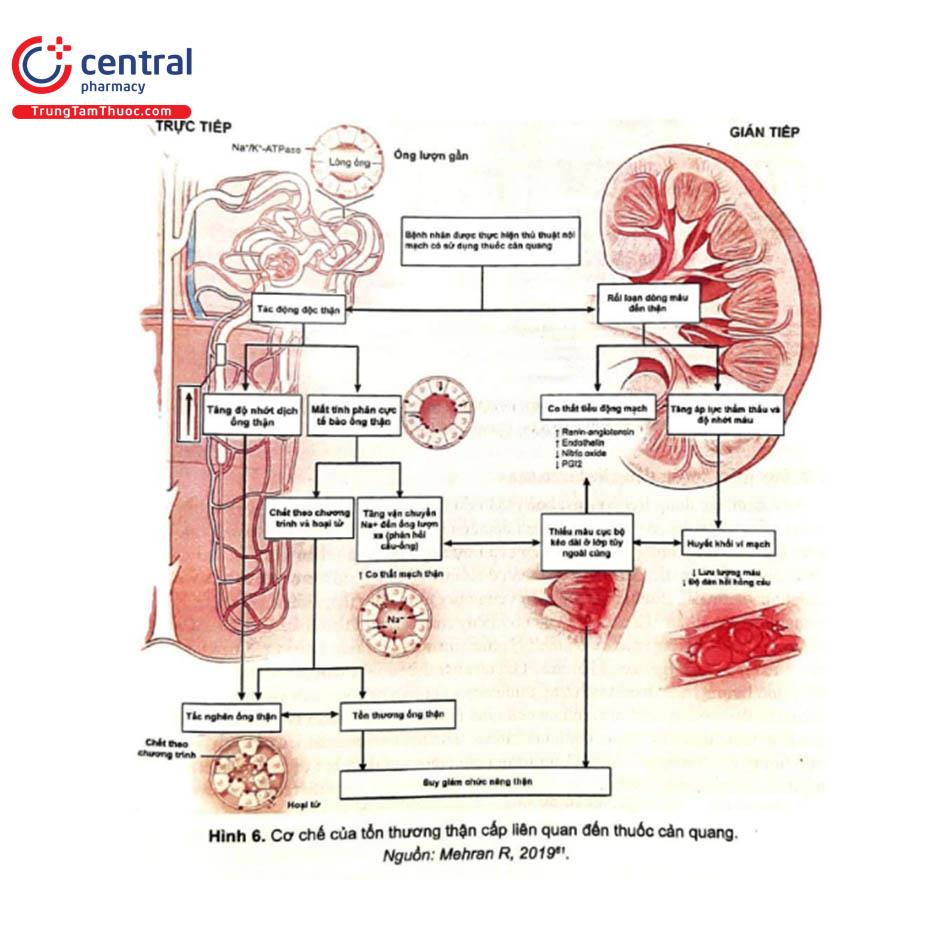
Mặc dù các cơ chế sinh lý bệnh mà chất cản quang gây tổn thương thận vẫn chưa được làm sáng tỏ hoàn toàn, nhưng các tác động trực tiếp và gián tiếp, cũng như rối loạn huyết động học, được xem là các cơ chế có liên quan đến CI-AKI (Hình 6)5. Thuốc cản gây độc trực tiếp cho các tế bào biểu mô ống thận, dẫn đến mất chức năng, hoại tử và chết tế bào theo chương trình. Cơ chế gián tiếp liên quan đến tổn thương thiếu máu cục bộ do thay đổi vận mạch qua trung gian của các chất vận mạch như endothelin, nitric oxide và prostaglandin. Tuy thận ngoài cùng có áp suất riêng phần oxy tương đối thấp, do đó khi nhu cầu trao đổi chất gia tăng cùng với các thay đổi trên huyết động học của thuốc cản quang sẽ làm cho nó dễ nhạy cảm với tổn thương hơn.
Cơ chế gây độc trực tiếp của thuốc cản quang trên tế bào ống thận
Thuốc cản quang là các dẫn xuất benzen tri-iot hóa. I-ốt ở dạng ion (I), phân tử (I,) hoặc dạng H,OI, ngậm nước là một chất khử trùng có khả năng ly giải vách vi khuẩn do khả năng oxy hóa của nó. I-ốt chứa trong tất cả các loại thuốc cản quang áp lực thẩm thấu cao, áp lực thẩm thấu thấp và đồng áp lực thẩm thấu, có tác động gây độc trực tiếp lên các tế bào của con người và đặc biệt là trên các tế bào biểu mô ống thận và trên các tế bào nội mô. Cơ chế sinh lý bệnh chính xác của độc tính tế bào này vẫn chưa được biết rõ; tuy nhiên, một số cơ chế tiềm năng đã được đề xuất. Thuốc cản quang có thể tác động bằng cách kích thích trực tiếp các con đường tín hiệu liên quan đến quá trình chết tế bào theo chương trình thông qua sự hoạt hóa của caspase-3, caspase-9 và con đường bcl2 và bằng cách gây ra sự phân bố lại các protein màng, phá hủy DNA, phá vỡ các điểm nối gian bào, giảm sự tăng sinh tế bào và thay đổi chức năng ti thể thông qua rối loạn điều hòa canxi. Gần đây, sự biểu hiện quá mức của microRNA-188 đã được chứng minh là gây ra quá trình chết tế bào theo chương trình bằng cách điều chỉnh gen SRSF7, gen này có thể đóng vai trò là mục tiêu tiềm năng cho can thiệp điều trị CI-AKI. Nói chung, tác động độc hại của thuốc cản quang có áp lực thẩm thấu cao được ghi nhận có ảnh hưởng rõ rệt hơn các thuốc có áp lực thẩm thấu thấp hoặc đồng áp lực thẩm thấu, nhưng tất cả các loại thuốc cản quang đều có tác động bất lợi trên những tế bào được nuôi cấy.
Stress hóa và tình trạng thiếu oxy
Độc tính nội tại của thuốc cản quang càng được rõ ràng hơn bởi những tác động độc hại khác do chính nó gây ra, chẳng hạn như stress oxy hóa và tình trạng thiếu oxy68, do sự oxy hóa mạnh của thuốc cản quang kích thích tổng hợp các gốc oxy tự do và các chất oxy phản ứng (ROS) gây độc cho các tế bào nội mô và tế bào biểu mô ống thận. Gốc oxy tự do là những phân tử có chứa một hoặc nhiều điện tử chưa ghép đôi, chẳng hạn như superoxide (O2) và gốc hydroxyl (OH) Trong các phản ứng khử liên tiếp, các phân tử có khả năng phản ứng cao này được chuyển thành nước. Các phân tử phản ứng yếu hơn, chẳng hạn như H,O,, được gọi là ROS67. Trong sinh lý bệnh của CI-AKI, các loại phân tử này đóng một vai trò quan trọng, bởi vì chúng tương tác với các con đường khác. Các phân tử có mức độ phản ứng cao tạo ra sự mất cân bằng giữa chất oxy hóa và chất chống oxy hóa trong nội bào tạo xu hướng nghiêng về phía chất oxy hóa, ảnh hưởng đến ti thể và nhân DNA, lipid màng và protein tế bào. ROS kích hoạt các c-Jun N-terminal kinases và p38MAPK stress kinases góp phần vào sự chết theo chương trình và hoại tử tế bào”. Ngoài ra, ROS gây tăng tổng hợp endothelin, angiotensin II, adenos- in và thromboxan A2 và giảm tổng hợp nitric oxide (NO) dãn mạch. Các mạch thẳng vasa recta, mao mạch quanh ống thận và mao mạch cầu thận có hiện tượng co mạch, gây ra sự thay đổi vi tuần hoàn thận và thiếu máu cục bộ đoạn xa.
Ngược lại, thiếu máu cục bộ dẫn đến tăng hình thành các gốc oxy tự do và ROS, vì vậy cả hai quá trình này tăng cường lẫn nhau (Hình 7)”. Do đó, một khi được hình thành trong quá trình thiếu oxy và/hoặc tổn thương tế bào và vượt quá khả năng thu dọn của tế bào, các gốc oxy tự do và ROS gây ra tổn thương thiếu máu cục bộ/tái tưới máu, một sự kết hợp của cả tình trạng thiếu oxy và tổn thương do oxy hóa. Tổn thương nội mô trong mao mạch quanh ống thận do tác dụng trực tiếp của thuốc cản quang hoặc qua ROS có thể làm ảnh hưởng nghiêm trọng đến tình trạng thiếu oxy vùng tủy thận. Đáng chú ý là khả năng thích ứng với tổn thương oxy hóa giảm dần theo tuổi475. Hơn nữa, những bệnh nhân bệnh thận mạn và đái tháo đường đã có hiện tượng tăng stress oxy hóa, co mạch và rối loạn chức năng nội mô nên những bệnh nhân này và người cao tuổi là các đối tượng rất dễ bị CI-AKI.
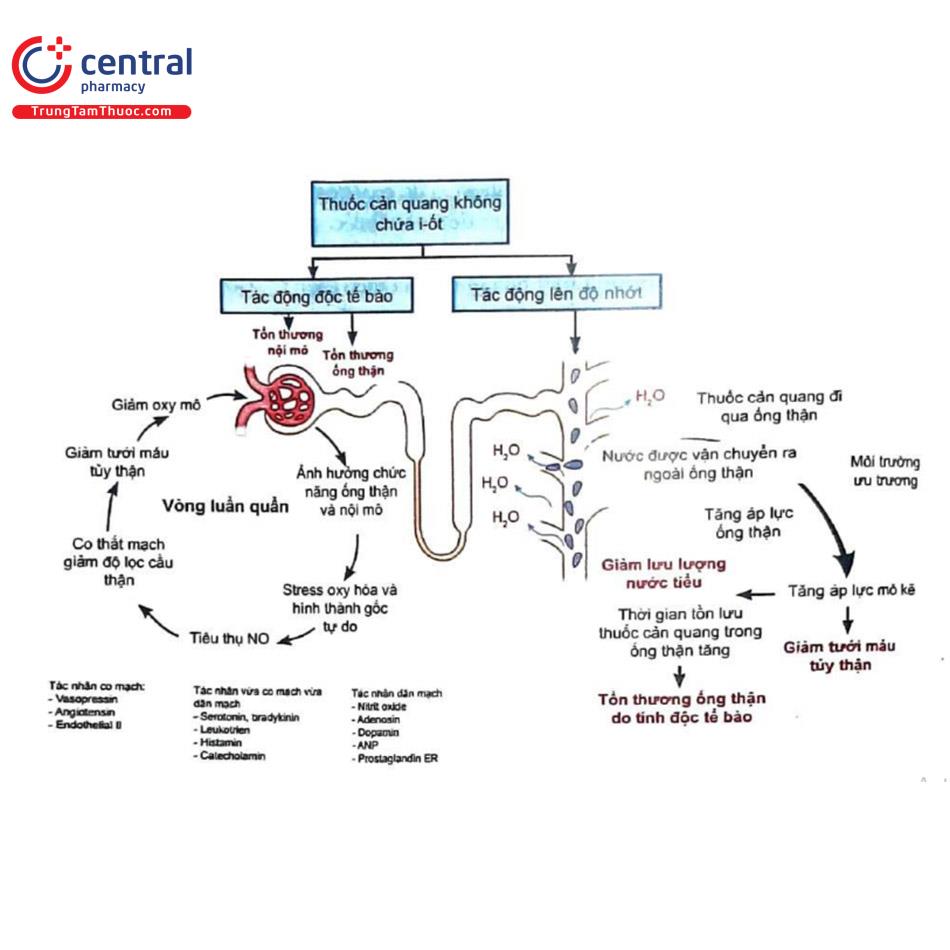
Nguồn: Morcos R, 2019.
5.1 Suy giảm huyết động học trên thận
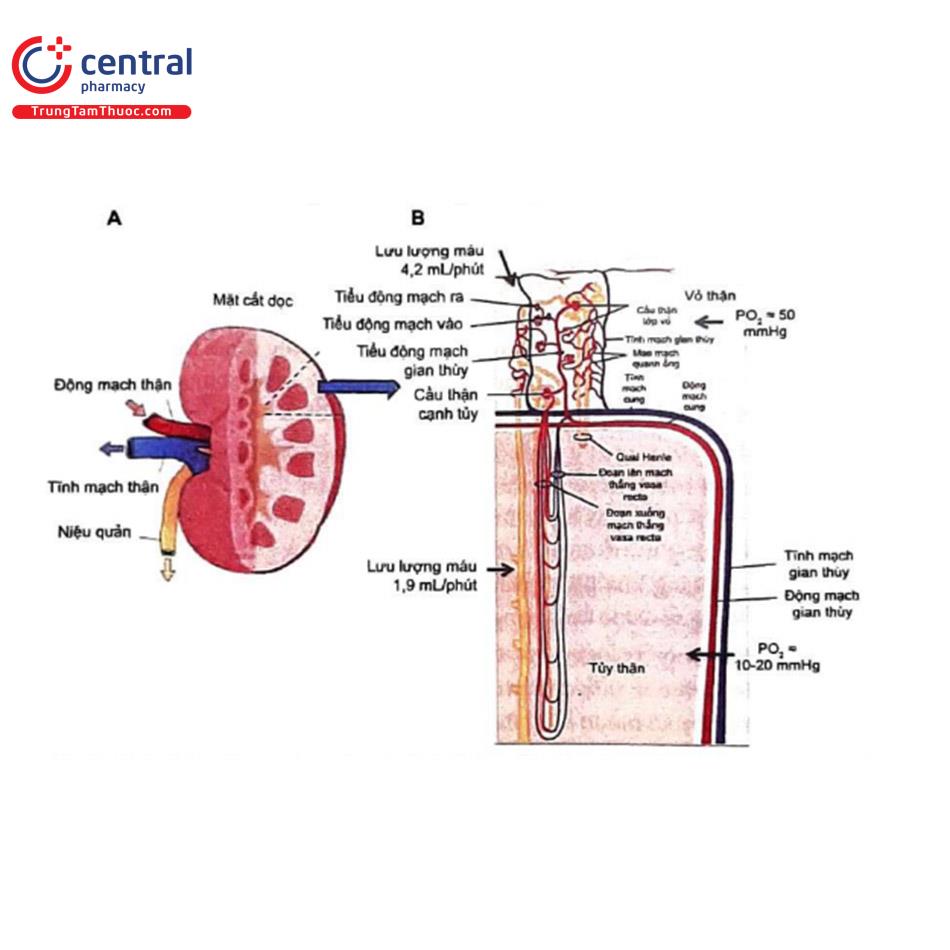
Bên cạnh tác dụng trên vi tuần hoàn thận do nhiễm độc tế bào và tăng stress oxy hóa, thuốc cản quang còn có ảnh hưởng trực tiếp đến hệ mạch thận. Trong điều kiện nghỉ ngơi sinh lý, 25% cung lượng tim được cung cấp trực tiếp đến thận. Phần lớn cung lượng tim được cung cấp trực tiếp đến vùng vỏ thận để tối ưu hóa quá trình lọc ở cầu thận và tái hấp thu nước và muối”. Lưu lượng máu đến vùng tủy tương đối thấp, chiếm khoảng 10% lưu lượng máu đến thận. Chức năng của nó là duy trì gradient thẩm thấu và tăng cường cô đặc nước tiểu”. Trong điều kiện sinh lý, mức áp suất oxy riêng phần (PO,) của vỏ thận vào khoảng 50 mmHg, trong khi mức PO, của tủy thận có thể thấp tới 20 mmHg”,7%. Phần dễ bị tổn thương nhất trong tình trạng thiếu oxy là phần sâu hơn của vùng tủy ngoài chứa đoạn lên dày có hoạt tính chuyển hóa của quai Henle. Trong phần này của hệ thống ống gradient thẩm thấu được tạo ra bởi quá trình tái hấp thu tích cực natri, quá trình này đòi hỏi một lượng oxy tương đối lớn”. Lưu lượng máu đến tủy thận bắt nguồn từ các tiểu động mạch ra của cầu thận cạnh tủy (juxtamedullary glomeruli). Tại điểm nối của tủy-vỏ, các tiểu động mạch ra này hình thành nên đoạn xuống của mạch thẳng vasa recta (descending vasa recta - DVR). Các DVR này dần dần tạo thành một giường mao mạch thâm nhập sâu vào bên trong vùng tủy. Các mao mạch này cuối cùng kết hợp với nhau để tạo thành đoạn lên của mạch thẳng vasa recta (ascending vasa recta) (Hình 8)980. Sự chuyển đổi từ DVR sang mao mạch và dẫn đến hình thành đoạn lên của mạch thẳng vasa recta xảy ra một cách từ từ, kèm theo những thay đổi về mô học trong thành phần của thành mạch.
Sau khi được tiêm vào nội mạch, thuốc cản quang được phân bố nhanh chóng trong lòng mạch và mô kẽ. Thời gian bán hủy phân bố thường là vài phút, thay đổi từ 2 đến 30 phút. Chỉ 1% đến 3% thuốc được liên kết với protein huyết tương Thuốc cản quang không được chuyển hóa ở người, nhưng được thải trừ nhanh chóng qua quá trình lọc ở cầu thận. Thời gian bán hủy đào thải hay thời gian để đào thải một nửa lượng thuốc cản quang trong máu khoảng 1 đến 2 giờ. Trong 24 giờ đầu tiên sau khi dùng thuốc cản quang trong lòng mạch, khoảng 100% thuốc cản quang được bài tiết qua nước tiểu ở những bệnh nhân có chức năng thận bình thường; tuy nhiên, thời gian này có thể kéo dài thành 40 giờ hoặc hơn nữa ở bệnh nhân suy giảm chức năng thận? Các con đường thải trừ thay thế, chẳng hạn như qua đường mật diễn ra chậm. Đáp ứng huyết động khi tiêm thuốc cản quang vào động mạch thường diễn ra qua hai pha: lưu lượng máu đến thận tăng nhanh ban đầu, tiếp theo là sự sụt giảm kéo dài từ 10% đến 25% của mức cơ bản. Quá trình này chủ yếu phản ánh sự giảm lưu lượng máu ở vùng vỏ, vì 10% lưu lượng máu đến thận là cung cấp cho vùng tủy. Giảm PO2 vùng tủy ngoài từ 50% đến 67% sau khi tiêm thuốc cản xuống còn 9 đến 15 mmHg đã được ghi nhận trong y văn.
Trong những năm gần đây, một số nghiên cứu trên động vật đã giúp hiểu rõ hơn về đáp ứng huyết động học của vi mạch thận, đặc biệt DVR đối với thuốc cản quang. Đường kính DVR trung bình là 12 đến 18 km, gần bằng đường kính của hồng cầu. Trên các DVR của chuột bị cô lập, người ta đã chứng minh được iodixanol làm giảm đường kính khoảng 48%, gây ra do giảm sản xuất NO và tăng khả năng phản ứng của DVR với angiotensin II. Việc loại bỏ các gốc tự do giúp ngăn ngừa được tình trạng co mạch do iodixanol và angiotensin II gây ra.
Ngoài ra, giảm lượng NO sẵn có và tăng sản xuất superoxide cũng dẫn đến tác dụng co mạch rõ rệt hơn trên các tiểu động mạch vào so với các tiểu động mạch ra sau khi cho thuốc cản quang trong các mạch máu thận chuột được phân lập. Hơn nữa, tưới máu động mạch thận (gian thùy) của người và chuột bằng thuốc cản quang cho thấy có thể gây ra tổn thương tế bào nội mô và tăng tính thẩm của nội mạc. Người ta đã công nhận rằng sự co thắt DVR là hậu quả của tổn thương nội mô và giảm khả năng tồn tại của NO”. Cùng một quan điểm như vậy, người ta đã tiến hành điều trị trước trên động vật với chất ức chế 5- phosphodiesterase và cho thấy rằng việc làm tăng nồng độ NO hoặc truyền nitrit làm cho tổn thương mô học ít hơn và giảm được các dấu ấn của tổn thương thận cấp. Tóm lại, các thí nghiệm này gợi ý rằng việc sử dụng thuốc cản quang làm giảm sự hiện hữu của NO do tổn thương nội mô và dẫn đến co thắt các tiểu động mạch vào và do đó làm giảm GFR; và thúc đẩy độc tính trực tiếp trên tế bào gây ra bởi tình trạng giảm oxy do co thắt DVR vùng tủy. Ngoài NO và angiotensin, nhiều chất trung gian hoạt mạch khác đóng một vai trò quan trọng trong việc giảm lưu lượng máu cục bộ sau khi dùng thuốc cản quang. Các thuốc gây ra dãn mạch vùng tủy nổi bật bao gồm adenosin, dopamin, NO, peptide natri lợi tiểu tâm nhĩ và prostaglandin E2. Các thuốc gây ra co mạch mạnh bao gồm vasopressin, angiotensin II và endothelin. Các thuốc khác có cả đặc tính dãn và co mạch là serotonin, bradykinin, leukotrien, histamin và catecholamin. Người ta vẫn chưa biết mỗi chất trung gian đóng một vai trò như thế nào trong cơ chế bệnh sinh của CI-AKI, nhưng sự mất cân bằng xảy ra giữa các chất trung gian co mạch và dãn mạch với ưu thế nghiêng về các chất trung gian co mạch. Hơn nữa, sự phân bố của các phân nhóm thụ thể trung gian trong vùng vỏ và vùng tủy có thể chịu trách nhiệm cho các đáp ứng huyết động ở các vùng khác nhau (xem Hình 7). Bởi vì những nghiên cứu này đã được thực hiện trên iodixanol nên sẽ rất thú vị nếu lặp lại những thí nghiệm này với thuốc cản quang có độ thẩm thấu thấp. Nghiên cứu bổ sung duy nhất được công bố trong lĩnh vực nghiên cứu này đã so sánh ảnh hưởng lên sự co thắt DVR của thuốc cản quang amidotrizoate có áp lực thẩm thấu cao với ioxaglate áp lực thẩm thấu thấp, iopromide áp lực thẩm thấu thấp và iodixanol đồng áp lực thẩm thấu. Tất cả 4 loại thuốc cản quang cho thấy tỷ lệ co thắt DVR từ 45% đến 63% và những khác biệt này không có ý nghĩa thống kê.
Khi tuổi cao, lưu lượng huyết tương đến thận cũng như GFR giảm và hệ số siêu lọc mao mạch giảm đáng kể do giảm cả tính thấm của mao mạch cầu thận và diện tích bề mặt để lọc. Tương tự, những bệnh nhân suy tim có giảm lưu lượng máu đến thận và GFR do kết quả của quá trình viêm và hoạt hóa hormon thần kinh. Do đó, bệnh nhân cao bị suy tim có nguy cơ tăng CI-AKI do lưu lượng máu đến thận đã bị giảm.
Sự giảm lưu lượng máu vi tuần hoàn cục bộ dẫn đến tình trạng thiếu oxy vùng tủy, tình trạng này càng nặng hơn nữa do gia tăng nhu cầu oxy của các tế bào ống thận. Nhu cầu oxy của các tế bào ống thận tăng lên này là hiện tượng xảy ra sau khi tiêm thuốc cản quang có nồng độ thẩm thấu cao hơn máu (tức là thuốc cản quang có độ thẩm thấu cao hoặc thấp), dẫn đến tăng thoáng qua lưu lượng huyết tương đến thận, GFR và lượng nước tiểu. Do áp lực thẩm thấu và tác dụng phóng thích endothelin, nhiều natri hơn được tái hấp thu bởi các tế bào ở ống lượn xa, điều này làm tăng nhu cầu tiêu thụ oxy, Phản ứng này hầu như không tồn tại khi dùng thuốc cản quang đồng áp lực thẩm thấu, đây là một lợi thế về mặt lý thuyết của loại thuốc cản quang này. Ngược lại, giảm thời gian tiếp xúc giữa thuốc cản quang và các tế bào ống thận là kết quả của việc tăng lưu lượng huyết tương đến thận, GFR và lượng nước tiểu biểu hiện lợi thế về mặt lý thuyết của thuốc cản quang có độ thẩm thấu cao và thấp hơn là thuốc cản quang đồng áp lực thẩm thấu. Hơn nữa, thuốc cản quang đồng áp lực thẩm thấu có độ nhớt cao hơn thuốc cản quang có áp lực thẩm thấu thấp, đồng thời với nồng độ i-ốt so sánh được đã cho thấy có liên quan đến việc tăng số lượng và khoảng thời gian ứ đọng i-ốt trong thận, tình trạng tổn thương tế bào và các biểu hiện của dấu ấn tổn thương thận qua các nghiên cứu trên động vật.
Hơn nữa, sự giảm nồng độ oxy trong máu ở thận và sự gia tăng hình thành các không bào (vacuoles) trong biểu mô vùng vỏ chủ yếu ở ống lượn gần và ống lượn xa, đã được chứng minh. Tuy nhiên, những nguy cơ và lợi thế này đã được lý thuyết hóa nhiều hơn; trong các nghiên cứu lâm sàng, không có nhiều sự khác biệt về tỷ lệ mắc CI-AKI giữa thuốc cản quang đồng áp lực thẩm thấu so với áp lực thẩm thấu thấp.
6 NHỮNG THAY ĐỔI LIÊN QUAN ĐẾN TUỔI TRÊN CHỨC NĂNG THẬN
Một trong những yếu tố nguy cơ quan trọng nhất của CI-AKI là tuổi tác. Những thay đổi về sinh lý thận theo thời gian dẫn đến giảm chức năng thận (Bảng 3), điều này có thể giải thích tại sao tuổi tác là một yếu tố nguy cơ mạnh đối với CI-AKI.
Bảng 3. Tổng quan y văn những thay đổi liên quan đến tuổi trên chức năng thận
| STT | Tác giả, tạp chí | Năm | Thiết kế | Kết luận |
| 1 | Bolignano và cộng sự Aging Res Rev | 2014 | Tổng quan | - Sự lão hóa của thận là do nhiều yếu tố |
| 2 | Muslem và cộng sự | 2017 | Hồi cứu | Tuổi >60 là một yếu tố dự báo độc lập cho suy chức năng thận và tử vong |
| 3 | Denegri và cộng sự Catheter Cardiovasc Interv | 2019 | Tiến cứu | Phân tầng nguy cơ sau thủ thuật bằng cách sử dụng thang điểm ACEF-7 đơn giản dự đoán kết quả dài hạn tốt hơn đáng kể so với dùng thang điểm nguy cơ thông thường |
| 4 | Weinstein và Anderson | 2010 | Tổng quan | GFR duy trì ở mức khoảng 140 mL/phút/1,73 m2 ho đến thập kỷ thứ tư; sau đó GFR giảm khoảng 8 mL/phút/1,73 m2 mỗi thập kỷ sau đó. |
| 5 | Fliser và cộng sự Kidney Int | 1997 | Tiến cứu | - GFR được bảo tồn khi tăng phân suất lọc cứu | trong trường hợp co mạch thận |
| 6 | Delp và cộng sự J Physiol | 2008 | Tiến cứu | - Suy giảm dãn mạch phụ thuộc nội mô gây ra bởi tuổi già là do tín hiệu NO bị thay đổi cơ chế |
ACEF: tuổi, creatinin và phân suất tống máu; BH4: tetrahydrobiopterin; GFR: độ lọc cầu thận. Nguồn: Morcos R, 2019
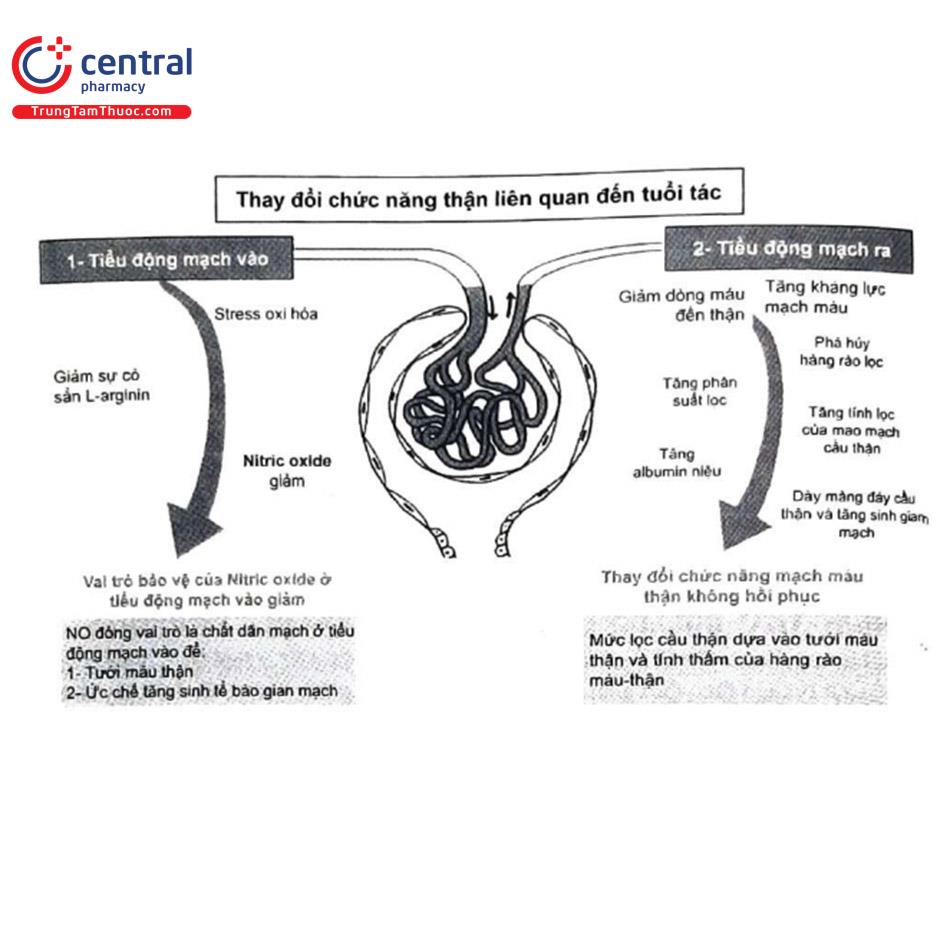
Độ lọc cầu thận được xác định bởi lưu lượng máu qua thận và tính thấm của hàng rào lọc cầu thận. Tuổi càng cao đi kèm với giảm lưu lượng huyết tương thận do tăng sức cản thành mạch của các tiểu động mạch ra (Hình 9). Do đó, sự giảm lưu lượng huyết tương thận gây ra sự gia tăng tổng thể phân suất lọc. Tăng phân suất lọc dẫn đến tăng lọc mao mạch cầu thận, có thể làm tổn thương hàng rào lọc và dẫn đến tăng Albumin niệu Theo thời gian, những quá trình này dẫn đến sự dày lên của màng đáy cầu thận và tăng sinh gian mạch không thể đảo ngược. Sự suy giảm NO (một chất dãn mạch ức chế sự phát triển của tế bào trung mô...) cũng được thấy khi tuổi cao do stress oxy hóa và suy giảm L-arginin.
Mức độ suy giảm GFR khác nhau giữa các nghiên cứu. Trong một tổng quan hệ thống, sự suy giảm hàng năm về eGFR dao động từ 0,4 đến 2,6 mL/phút/1,73 m % Tuy nhiên, hầu hết các nghiên cứu đều sử dụng eGFR để kiểm tra diễn tiến tự nhiên của chức năng thận. Trong một nghiên cứu của Fliser và cộng sự đã sử dụng phương pháp tiêu chuẩn vàng về thanh thải Inulin, GFR của một nhóm tình nguyện viên khỏe mạnh với độ tuổi trung bình là 68 ± 7 tuổi thấp hơn 85% so với một nhóm tình nguyện viên khỏe mạnh tương tự với độ tuổi trung bình là 26 ± 3
Sự giảm GFR theo tuổi và cơ bản về sinh lý bệnh cho việc suy giảm này làm tăng nguy cơ tổn thương thận cấp do những nguyên nhân khác.
7 CÁC YẾU TỐ NGUY CƠ TỔN THƯƠNG THẬN CẤP DO THUỐC CẢN QUANG
Việc xác định bệnh nhân có nguy cơ cao mắc CI-AKI có nghĩa là tỷ lệ nguy cơ/lợi ích của các lựa chọn điều trị được đưa ra để giải thích và chia sẻ với bệnh nhân, do đó, các chiến lược phòng ngừa trước thủ thuật cũng như quy trình theo dõi sau thủ thuật cần phải được thực hiện.
Bảng 4. Các loại thuốc cản quang
| Loại | Thuốc | Độ thẩm thấu | |
| Áp lực thẩm thấu cao | lonic monomers | lothalamate Diatrizoate Metrizoate | 1.400-2.000 |
| Áp lực thẩm thấu thấp | Nonionic | lsohexol | 600-800 |
| Đồng áp lực thẩm thấu | Nonionic | lodixanol lotrolan | 300 |
Hầu hết thông tin về các yếu tố dự đoán của CI-AKI được lấy từ các nghiên cứu ở bệnh nhân trải qua các thủ thuật can thiệp mạch vành. Các yếu tố nguy cơ hoặc thúc đẩy của CI-AKI đã được xác định bao gồm: (1) các đặc điểm lâm sàng của bệnh nhân (eGFR 60 mL/phút/1,73 m2, tuổi, đái tháo đường, thiếu máu, suy tim sung huyết, phân suất tống máu thất trái [LVEF] giảm); (2) bệnh cảnh lâm sàng (sốc, giảm thể tích tuần hoàn, thủ thuật khẩn cấp/cấp cứu, sử dụng đồng thời các thuốc gây độc cho thận, suy thận cấp do các nguyên nhân khác); và (3) các khía cạnh liên quan đến thủ thuật (sử dụng bóng đối xung động mạch chủ [IABP], liều lượng và loại thuốc cản quang (Bảng 4), đường vào động mạch). Có thể thấy rằng sự hiện diện của nhiều yếu tố trên cùng một bệnh nhân sẽ làm tăng nguy cơ mắc CI-AKI. Bảng 5 tóm tắt các yếu tố nguy cơ chính của CI-AKI.
Độ thẩm thấu, độ nhớt, thể tích và đường dùng của thuốc cản quang (Bảng 4) là các yếu tố quyết định chính của CI-AKI. Rõ ràng, nguy cơ xuất hiện CI-AKI cao hơn nhiều với các thuốc có áp lực thẩm thấu cao thế hệ thứ nhất. Hầu hết các ý kiến đều đồng thuận áp lực thẩm thấu cao có liên quan đến tổn thương thận cấp nhưng có một số ý kiến cho rằng độ nhớt quan trọng hơn áp lực thẩm thấu vì nó làm thay đổi tính chất lưu biến (theologic) của chất lỏng. Các nghiên cứu so sánh các thuốc có áp lực thẩm thấu thấp và đồng áp lực áp lực thẩm thấu cho thấy không có sự khác biệt về nguy cơ xuất hiện tổn thương thận cấp, do đó ủng hộ cho lý thuyết về độ nhớt hơn.
Các yếu tố quan trọng khác là thể tích thuốc cản quang được sử dụng, đường dùng và loại thủ thuật được thực hiện. Thể tích lớn hơn có xu hướng gây ra hiệu ứng thẩm thấu nhiều hơn, giảm GFR, thời gian ứ đọng trong ống thận lâu hơn và gây tổn thương trực tiếp cho tế bào ống thận's Tỷ lệ CI-AKI sau khi tiêm thuốc cản quang trong động mạch nhiều hơn so với tiêm tĩnh mạch. Chụp mạch (động mạch hoặc tĩnh mạch) chắc chắn có nguy cơ cao hơn nhiều so với chụp cắt lớp vi tính có cản quang.
Bảng 5. Các yếu tố nguy cơ chính của tổn thương thận cấp do thuốc cản quang
| Các yếu tố liên quan bệnh nhân | Các yếu tố liên quan thủ thuật |
Tuổi cao | Thể tích thuốc cản quang Đường dùng thuốc cản quang (đường động mạch so với đường tĩnh mạch) Loại thuốc cản quang (thuốc cản có áp lực thẩm thấu cao so với thuốc cản quang có áp lực thẩm thấu thấp hoặc đồng áp lực thẩm thấu) Các thủ thuật lặp lại trong một cửa sổ thời gian hẹp (thủ thuật phức tạp, can thiệp mạch vành qua da nhiều lần) |
Nguồn: Pistolesi V, 2018
Bảng 6. Thang điểm nguy cơ bệnh thận do thuốc cản quang của Mehran
| Các thông số | Điểm |
Tụt huyết áp | 5 |
| Điểm | Nguy cơ CI-AKI (%) |
| >6 6-10 11-16 >16 | 7,5 14 26,1 57,3 |
Nguồn: Mehran, 2005
Tỷ lệ mắc CI-AKI tăng theo tuổi, bệnh thận từ trước, bệnh thận do đái tháo đường, sử dụng đồng thời các thuốc độc với thận, mất nước, huyết động không ổn định, thiếu máu và các nguyên nhân khác của giảm tưới máu thận. Vì những yếu tố này có liên quan đến dự trữ thận thấp, dùng thuốc cản quang thêm vào làm tăng nguy cơ bị tổn thương thận cấp.
Một số mô hình dự đoán đã được đề xuất để xác định bệnh nhân có nguy cơ CI-AKI. Các mô hình này có kết hợp nhiều yếu tố bao gồm bệnh nhân, thủ thuật và các yếu tố liên quan đến thuốc cản quang, tổng hợp thành một điểm số sau cùng để dự đoán nguy cơ 6. Các tác giả đã xây dựng mô hình bằng cách sử dụng một số lượng lớn bệnh nhân trải qua can thiệp mạch vành. Một mô hình do Mehran và cộng sự đề xuất được trình bày trong Bảng 6'7. Mặc dù không được sử dụng rộng rãi nhưng chúng khá hữu ích trong dự đoán tổn thương thận cấp trên những bệnh nhân được can thiệp mạch vành. Một số mô hình dự đoán khác được trình bày trong Bảng 7.
Bảng 7. Một số mô hình dự đoán nguy cơ tổn thương thận cấp do thuốc cản quang
| Tác giả (năm) | Dân số | Các biến được đưa vào trong các mô hình | Điểm | Phân tầng nguy cơ(tổng điểm) |
| Bartholemew và cộng sự (2004) | Can thiệp mạch vành tại môt bệnh viện | Bệnh thận mạn | 2 | Thấp (<4) Trung bình (5-6) Cao (7-8) Rất cao (9-11) |
| Chen và cộng sự (2014) | Can thiệp mạch vành tại môt bệnh viện | Tuổi >75 | 4 5 4 6 4 3 7 3 3 | Thấp (<4) Trung bình (8-12) Cao (13-16) Rất cao (>17) |
| Gao và cộng sự (2014) | Chụp hoặc can thiệp mạch vành tại môt bệnh viện | Tuổi >60 | 2 2 2 2 4 1-6 1-3 | Thấp (0-4) Trung bình (5-8) Cao (9-11) Rất cao (>12) |
| Lin và công sự (2017) | Chụp hoặc can thiệp mạch vành tại môt bệnh viện | Tuổi >60 Creatinin huyết thanh >1,5 mg/dL Hạ huyết áp Đặt IABP | 1 1 1 1 | Thấp (0) Trung bình (1-2) Cao (>3) |
| Sukrisd và cộng sự (2019) | Can thiệp mạch vành tại môt bệnh viện | Phân suất tống máu thất trái <40% Bệnh ba nhánh mạch vành Đặt IABP | 2 1 3 | Thấp (0-2) Trung bình (3-6) |
| Ni và cộng sự (2017) | Chụp mạch | Tuổi >75 | 1 | Thấp (0-1) Trung bình (2-3) Cao (>4) |
| Duan và cộng sự (2017) | Chụp hoặc can thiệp mạch vành tại môt bệnh viện | Tuổi >75 NT-proBNP>1.500 pg/mL hs-CRP>7 mg/l Creatinin huyết thanh >1,5mg/dL Can thiệp mạch vành qua da tiên phát | 8 8 9 7 4 | Thấp (0-1) Trung bình (2-3) Cao (>4) |
| Mô hình dựa trên trí tuệ nhân tạo | ||||
| Gum và cộng sự (2013) | Can thiệp mạch vành tại 46 bệnh viện | 15 biến đã được chọn và thang điểm mạch vành tại nguy cơ được tính bằng công cụ tính toán dễ sử dụng https://bmc2.org/calculators/cin | Thấp (<1%) Trung bình (1-7%) Cao (>7%) | |
ABP: bóng đối xung động mạch chủ
8 DỰ HẬU NGẮN HẠN VÀ DÀI HẠN CỦA TỔN THƯƠNG THẬN CẤP DO THUỐC CẢN QUANG
CI-AKI có liên quan đến cả dự hậu bất lợi ngắn hạn và dài hạn. Nhiều nghiên cứu đã cho thấy bệnh nhân bị Cl-AKI có nguy cơ tử vong cao hơn hoặc thời gian nằm viện kéo dài và các biến cố tim mạch sớm hoặc muộn, đặc biệt là sau can thiệp mạch vành da. Sau thông tim, tỷ lệ tử vong nội viện và tử vong trong 1 năm tăng gấp 2 đến 5 lần ở những bệnh nhân bị CI-AKI so với nhóm chứng. Ngoài ra, trong một thử nghiệm quy mô lớn liên quan đến bệnh nhân STEMI, kết quả cho thấy CI-AKI sau can thiệp mạch vành qua da tiên phát có liên quan đến dự hậu trên tim mạch và xuất huyết ngắn hạn và dài hạn xấu hơn bao gồm tử vong trong 3 năm theo dõi. Tuy nhiên, do sự tương tác gây nhiễu của các yếu tố nguy cơ và các bệnh đi kèm khác ở những bệnh nhân trải qua các thủ thuật phức tạp, những phát hiện này không chứng minh được mối quan hệ nhân quả trực tiếp giữa CI-AKI và các kết cục chính
Trong mọi trường hợp, mức độ nghiêm trọng của CI-AKI dường như liên quan chặt chẽ đến các kết cục lâm sàng chính. Thật vậy, đã có nghiên cứu cho thấy tử vong nội viện là 7,1% ở bệnh nhân CI-AKI ít nghiêm trọng hơn và 35,7% ở bệnh nhân tổn thương thận cấp cần phải lọc máu. Hơn nữa, trong một phân tích hồi cứu bao gồm 27.608 bệnh nhân được điều trị can thiệp mạch vành, sự gia tăng creatinin huyết thanh tương đối hoặc tuyệt đối lớn hơn có liên quan đến những nguy cơ dự hậu lâm sàng bất lợi, chẳng hạn như tử vong nội viện 30 ngày và thời gian nằm viện.
Dữ liệu về mối liên quan giữa CI-AKI và nguy cơ tiến triển thành bệnh thận mạn còn rất ít. Sau can thiệp mạch vành, bệnh thận mạn tiến triển giai đoạn 4-5 đã được ghi nhận khoảng 0,3% ở những bệnh nhân có eGFR >30 mL/phút và bệnh thận mới được chấn đoán trong vòng 6 tháng kể từ lúc làm thủ thuật xảy ra ở khoảng 0,9% ở bệnh nhân có eGFR ban đầu >60 mL/phút. Tỷ lệ này cao hơn so với tỷ lệ mắc bệnh thận mạn ước tính hàng năm trong dân số chung!”. Ở bệnh nhân bị CI-AKI cần lọc máu, chỉ một tỷ lệ nhỏ (0,4-3,1%) không phục hồi được chức năng thận và phụ thuộc vào lọc máu. Trong mọi trường hợp, nên hướng dẫn bệnh nhân đến bác sĩ chuyên khoa Thận sau các đợt CI-AKI, đặc biệt là sau can thiệp mạch vành.
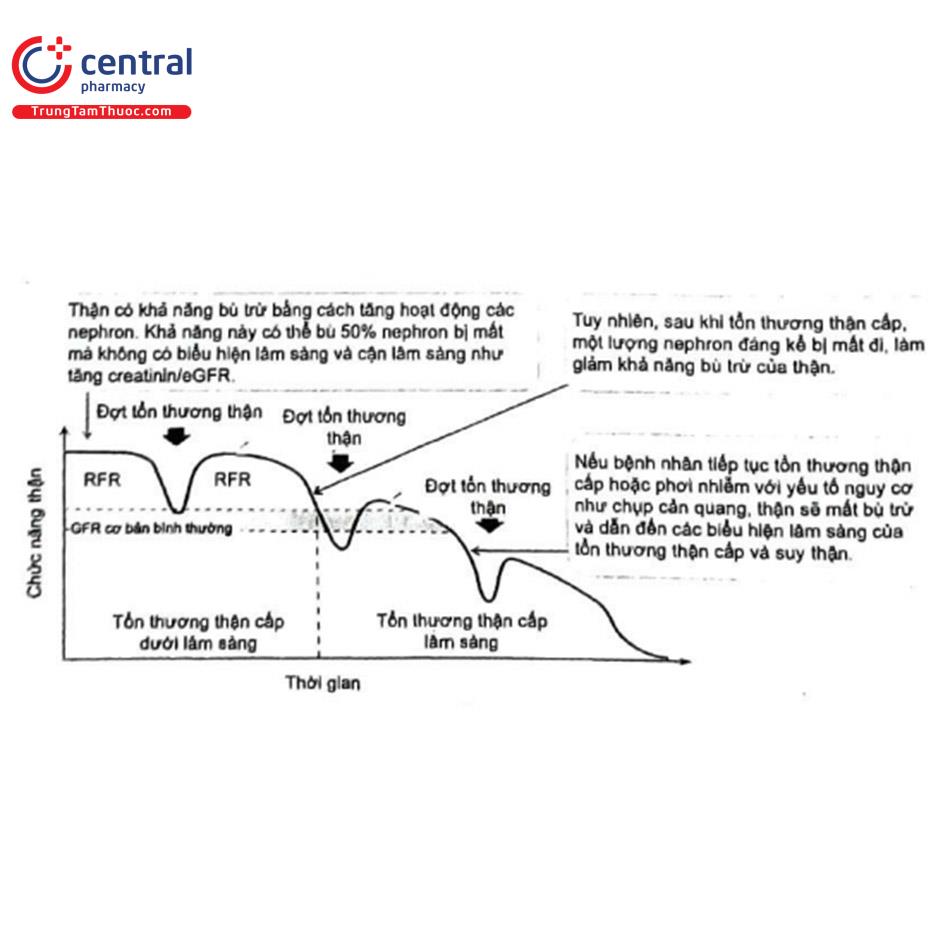
Tổn thương thận cấp do thuốc cản quang thường gây hậu quả lâu dài cho bệnh nhân. Tóm tắt diễn tiến của tổn thương thận cấp được trình bày trong Hình 10.
9 ĐẶC ĐIỂM LÂM SÀNG VÀ CÁC DẤU ẤN SINH HỌC MỚI TRONG DỰ ĐOÁN NGUY CƠ TỔN THƯƠNG THẬN CẤP DO THUỐC CẢN QUANG
9.1 Đặc điểm lâm sàng của tổn thương thận cấp do thuốc cản quang
Khám lâm sàng rất hữu ích để loại trừ các nguyên nhân khác gây ra bệnh thận cấp, chẳng hạn như thuyên tắc cholesterol (các dấu hiệu đặc trưng bao gồm ngón chân xanh và tím bầm dạng lưới) hoặc viêm thận mô kẽ do thuốc (thường kèm với phát ban điển hình). Bệnh nhân có thể có bằng chứng về suy giảm thể tích hoặc có thể bị suy tim mất bù.
Đặc điểm lâm sàng của CI-AKI thường có biểu hiện như sau:
(1) Tăng creatinin huyết thanh sớm, nhẹ: sự gia tăng creatinin huyết thanh thường được quan sát thấy trong vòng 24 đến 48 giờ sau khi tiếp xúc với thuốc cản quang có i-ốt và thường là nhẹ. Creatinin huyết thanh thường bắt đầu giảm về mức cơ bản trong vòng 3 đến 7 ngày sau tiếp xúc với thuốc.
(2) Không thiểu niệu: vì tổn thương thận cấp thường nhẹ, nên hầu hết bệnh nhân đều không thiểu niệu, nếu có xảy ra thường xuất hiện ngay sau khi làm thủ thuật. Thiểu niệu và tăng creatinin đáng kể hơn có thể thấy khi bị tổn thương thận cấp nặng hoặc tổn thương thận cấp xuất hiện trên những bệnh nhân mắc bệnh thận mạn từ trung bình đến nặng
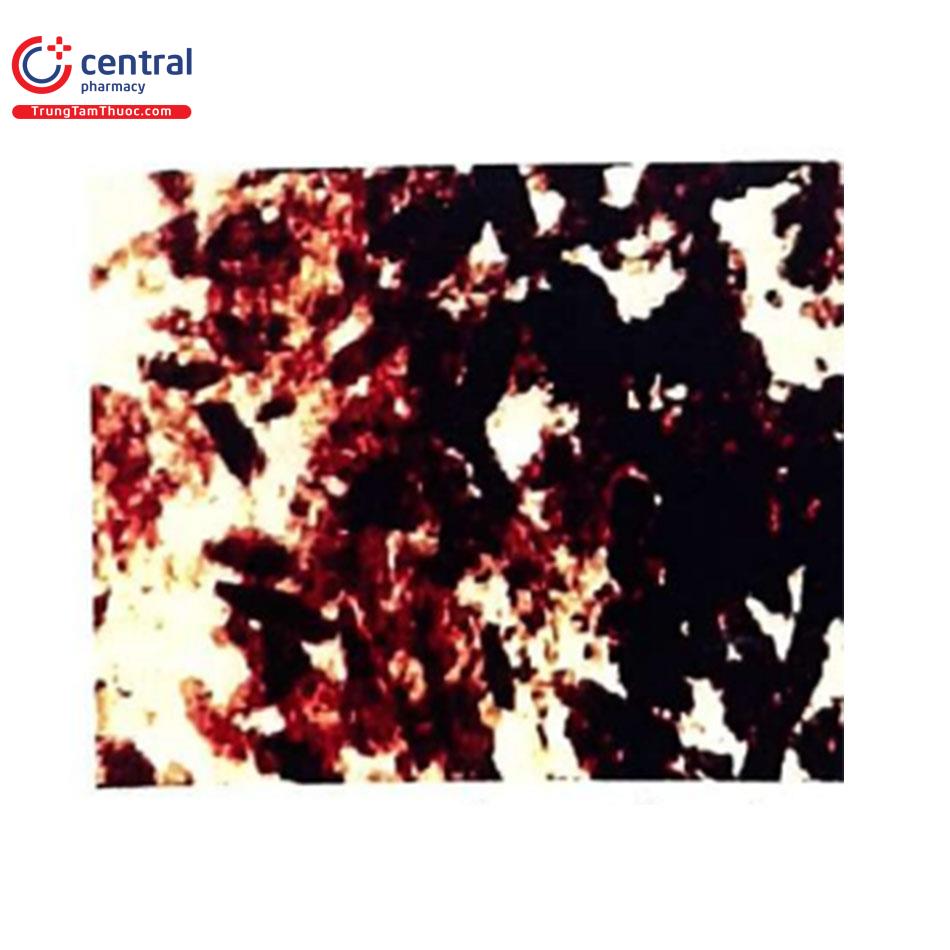
(3) Cặn lắng trong nước tiểu phù hợp với hoại tử ống thận cấp tính: xét nghiệm cặn lắng trong nước tiểu có thể tìm thấy những dấu hiệu kinh điển của tình trạng hoại tử ống thận cấp bao gồm cả trụ hạt màu nâu bùn (Hình 11), trụ tế bào biểu mô và tế bào biểu mô ống thận tự do (Hình 12). Tuy nhiên, khi không có các dấu hiệu này cũng không loại trừ khả năng bị tổn thương thận cấp liên quan đến thuốc cản quang.
Các biểu hiện khác của giảm GFR cũng có thể gặp như tăng Kali máu, toan chuyển hóa và tăng phosphate máu.

Các bệnh cảnh khác cần xem xét chẩn đoán phân biệt với bệnh thận do thuốc cản quang bao gồm:
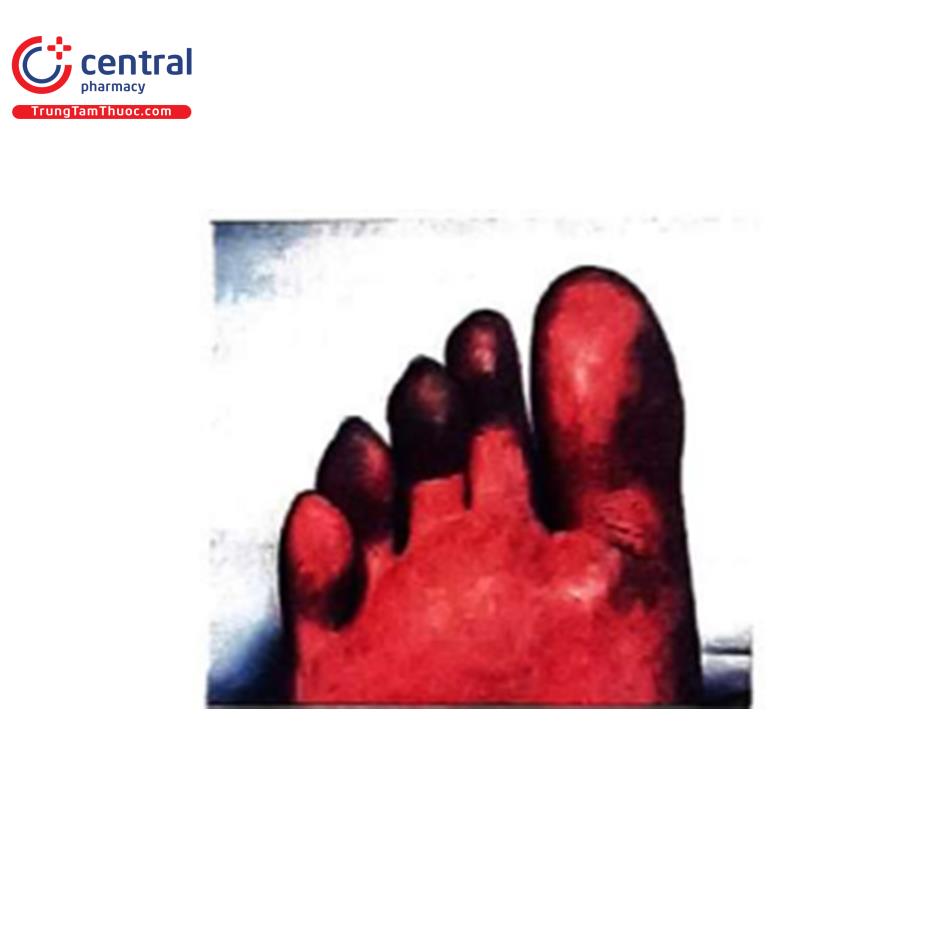
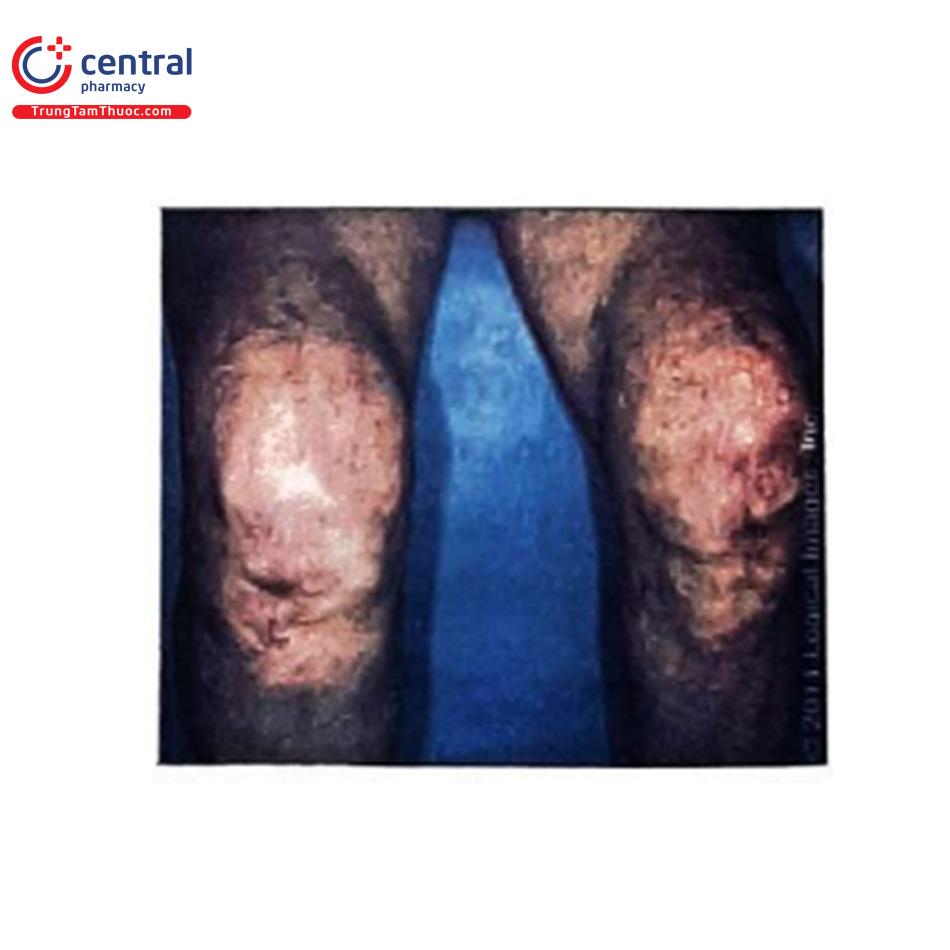
Suy thận do thuyên tắc xơ vữa: xảy ra hơn 1 tuần sau khi dùng thuốc cản quang; được biểu hiện bằng ngón chân xanh (Hình 13), tím bầm dạng lưới (Hình 14), tăng bạch cầu ái toan thoáng qua, bệnh kéo dài và khả năng hồi phục thấp hơn so với khi bị CI-AKI.
Tổn thương thận cấp (bao gồm tăng ure huyết trước và sau thận): bệnh nhân có thể liên quan đến mất dịch do lợi niệu tích cực, nghiêm trọng hơn nếu thiếu dịch từ trước; tổn thương thận cấp thường là thiểu niệu và thời gian phục hồi được dự đoán trong 2-3 tuần.
Viêm thận mô kẽ cấp tính (sốt, phát ban da và tăng bạch cầu ái toan): bệnh nhân có thể có bạch cầu ái toan trong nước tiểu. Viêm thận thường do các loại thuốc như penicillin, Cephalosporin và thuốc kháng viêm không steroid (NSAID).
Hoại tử ống thận cấp: thiếu máu cục bộ do nguyên nhân trước thận: độc tố nội sinh chẳng hạn như hemoglobin, myoglobin và các chuỗi nhẹ; chất độc ngoại sinh chẳng hạn như thuốc kháng sinh, thuốc hóa trị liệu, dung môi hữu cơ và kim loại nặng.
9.2 Các dấu ấn sinh học mới trong dự đoán tổn thương thận cấp do thuốc cản quang
Thường có sự chậm trễ 24-48 giờ giữa thời gian tiếp xúc với thuốc cản quang và sự thay đổi creatinin huyết thanh. Sự chậm trễ này làm cho creatinin trở thành một chỉ số muộn về sự thay đổi chức năng thận. Do đó, yêu cầu có các dấu ấn tổn thương thận nhạy cảm hơn được đặt ra. Trên thực tế, một số dấu ấn sinh học của tổn thương ống thận đã được đánh giá.
Có khả năng tổn thương thận bắt đầu ngay sau khi dùng thuốc cản quang và các dấu ấn sinh học nhạy cảm có thể phát hiện tổn thương thận rất sớm!30 và do đó nhiều nỗ lực đã được thực hiện trong những năm gần đây để xác định các dấu ấn sinh học đặc biệt, sớm để cho phép chẩn đoán sớm tổn thương thận cấp và hy vọng cải thiện dự hậu cho bệnh nhân. Thuật ngữ dấu ấn sinh học (hoặc dấu hiệu sinh học) đã được định nghĩa là bất kỳ chất, cấu trúc hoặc quá trình nào hoặc các sản phẩm của nó có thể được đo lường trong cơ thể và ảnh hưởng hoặc dự đoán tỷ lệ kết cục hoặc bệnh tật, trong khi Nhóm Công tác về Định nghĩa Dấu ấn Sinh học của Viện Y tế Quốc gia đã xác định dấu ấn sinh học như một đặc tính được đo lường khách quan và được đánh giá như một chỉ số của các quá trình sinh lý, bệnh lý hoặc kết quả của điều trị .
Một đặc điểm mong muốn của bất kỳ dấu ấn sinh học là có độ nhạy, có thể định lượng được và có thể được phân tích nhanh chóng để cho phép đưa ra các quyết định lâm sàng (can thiệp) kịp thời. Ngoài ra, nó cũng sẽ có lợi nếu dấu ấn sinh học có thể đưa ra tiên lượng và kiểm tra hiệu quả của bất kỳ phương pháp điều trị nào. Về mặt này, kiến thức về cơ chế hoặc sinh lý bệnh của tình trạng bệnh là rất quan trọng để xác định các dấu ấn sinh học liên quan đến bệnh sẽ cung cấp thông tin về sự tiến triển của bệnh và hiệu quả của bất kỳ phương pháp điều trị nào được chứng minh bằng sự thay đổi mức độ của dấu ấn sinh học. Tính cấp thiết đối với các dấu ấn sinh học mới trong tổn thương thận được nhấn mạnh khi người ta thấy rằng khi creatinin huyết thanh thay đổi có ý nghĩa thì có thể 50% nephron đã bị thương.
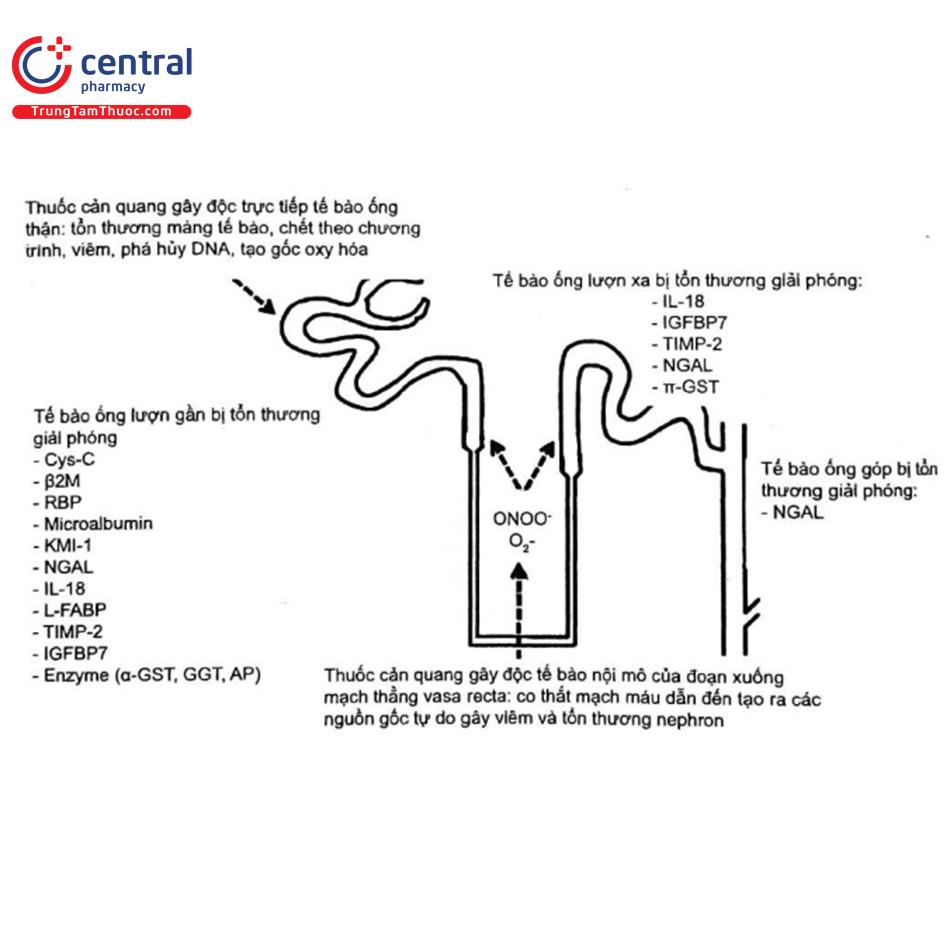
Các dấu ấn sinh học được nghiên cứu có thể là một biểu hiện của rối loạn chức năng thận, tức là sự thay đổi GFR (ví dụ: creatinin huyết thanh, Cys-C và microalbumin niệu) hoặc hậu quả của suy giảm chức năng ống thận (ví dụ, N-acetyl-6-d-glucosaminidase [NAG]) hoặc các protein được phóng thích do tổn thương thận (ví dụ: phân tử tổn thương thận-1 [KIM-1], lipocalin liên quan với gelatinase của bạch cầu trung tính [NGAL] và IL-18). Hình 15 cho thấy các vị trí nguồn gốc của một số dấu ấn sinh học tiềm năng này trong nephron thận 34.
Các đặc điểm của một dấu ấn sinh học lý tưởng đã được trích dẫn bởi nhiều tác giả và các đặc điểm này được trình bày trong Bảng 8'34. Vì các đặc điểm lâm sàng và điều trị CI-AKI cũng giống như đối với tổn thương thận cấp do các nguyên nhân khác nên các dấu ấn sinh học được nghiên cứu để dự đoán sớm các các loại tổn thương thận cấp cũng có thể được áp dụng để dự đoán CI-AK.
| Bảng 8. Các đặc điểm mong muốn của các dấu ấn sinh học tiềm năng của CI-AKI |
| Dễ dàng và đơn giản để đo lường và nhất quán trong các lần đo lặp lại Có thể điều chỉnh được độ nhạy đo lường Cung cấp kết quả nhanh chóng cụ thể cho tổn thương Xác định vị trí nguồn gốc tổn thương Cho phép chẩn đoán tổn thương thận cấp do thuốc cản quang, phân biệt được với tăng ure huyết trước thận và bệnh thận mạn Có thể dự đoán hoặc ít nhất ước tính thời gian khởi phát CI-AKI Đưa ra một dấu hiệu về mức độ nặng của tổn thương và phân biệt được giữa chức năng bình thường và bất thường Dự đoán kết quả của tổn thương thận liên quan đến phục hồi/yêu cầu phải lọc máu/tỷ lệ tử vong Cho phép can thiệp lâm sàng sớm nếu cần và theo dõi hiệu quả của can thiệp Tiết kiệm chi phí Có thể đo được ở dạng dịch sinh học với mẫu bệnh phẩm có thể được lấy một cách dễ dàng |
Nguồn: Andreucci M, 2016
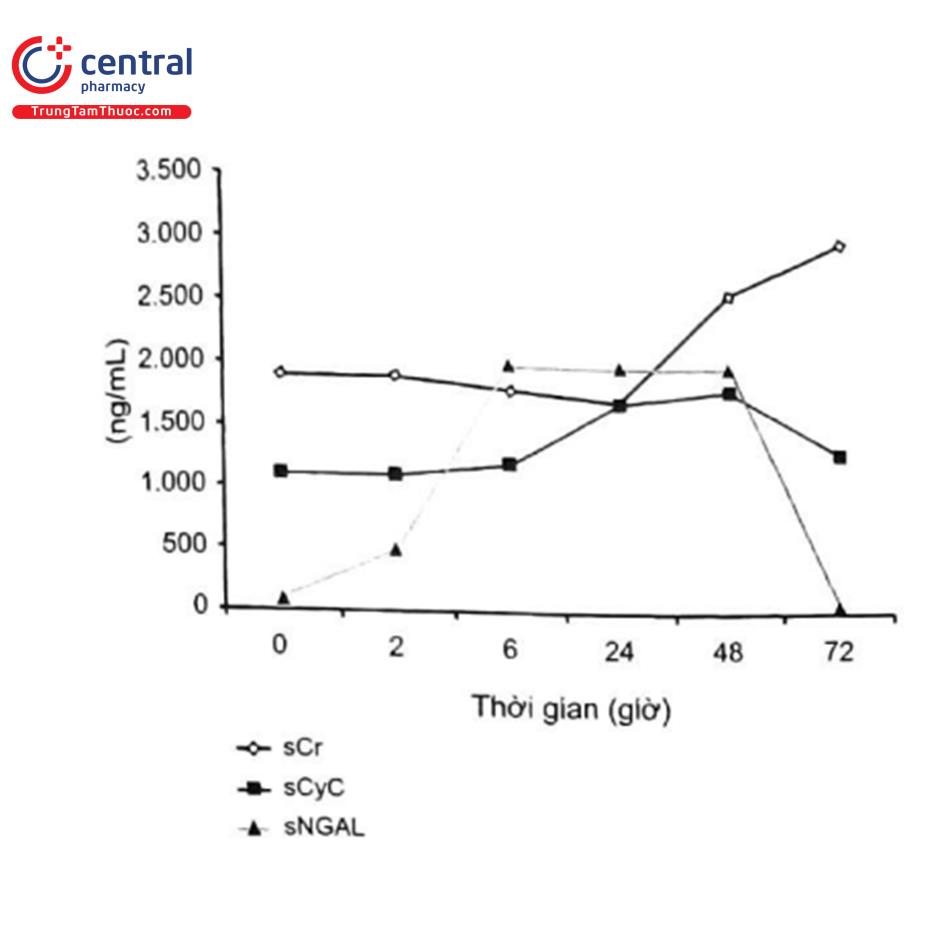
Dấu ấn sinh học được khảo sát nhiều nhất để chẩn đoán CI-AKI là NGAL. Nồng độ NGAL trong huyết thanh (sNGAL) và/hoặc nồng độ NGAL trong nước tiểu (uNGAL) đã được chứng minh dự đoán tổn thương thận cấp trên các trường hợp lâm sàng khác nhau 38-141 bao gồm cả CI-AKI142-144. Nhìn chung, NGAL được coi là một công cụ hữu ích tiềm năng cho cả chẩn đoán và tiên lượng sớm (trong vòng vài giờ) (dự đoán thời gian bắt đầu điều trị thay thế thận và tỷ lệ tử vong trong bệnh viện) của tổn thương thận cấp/45/46 Một ví dụ điển hình về động học của sNGAL (dấu hiệu tổn thương thận), sCr và sCyC (dấu hiệu thay đổi chức năng) được trình bày trong Hình 16
Kể từ khi được mô tả vào năm 2005, rất nhiều dữ liệu khoa học đã được thu thập liên quan đến cấu trúc và chức năng của renalase. Renalase là một flavoprotein (342 axit amin; khối lượng phân tử: 38 kDa) được mã hóa bởi gen RNLS nằm trên nhiễm sắc thể 10q23, biểu hiện chủ yếu ở các ống lượn gần, cơ tim, cơ xương, não và ruột non. Trong số 4 biến thể, chỉ có thể phát hiện được dạng renalase 1 trong máu người. Vai trò quan trọng của renalase bao gồm kiểm soát huyết áp bằng cách phân hủy catecholamin trong tuần hoàn thành aminochromes, cả trong máu và nước tiểu Renalase tham gia vào quá trình chu chuyển catecholamin ở ống thận và nước tiểu. Nó không chỉ được tiết ra ở các tế bào ống lượn gần và cầu thận mà còn có tác động mạnh mẽ đến việc điều hòa nồng độ natri và phosphat trong huyết tương. Đồng thời, renalase niệu được chứng minh là không phụ thuộc vào tình trạng thận chức năng''. Tuy nhiên, trong bệnh cảnh thiếu máu cục bộ thận cấp tính, nồng độ renalase trong nước tiểu giảm thoáng qua trong vòng 1 giờ đầu tiên sau biển cố thiếu máu cục bộ và sau đó trở về mức ban đầu. Trong trường hợp thiếu máu cục bộ thận kéo dài trên toàn bộ thận, nồng độ renalase trong nước tiểu sẽ giảm nặng và kéo dài, điều này có thể cho thấy tiềm năng renalase trong nước tiểu được sử dụng để làm một dấu hiệu của tổn thương thận cấp.
10 DỰ PHÒNG VÀ ĐIỀU TRỊ TỔN THƯƠNG THẬN CẤP DO THUỐC CẢN QUANG
Chiến lược dự phòng hiệu quả và điều trị tích cực là chìa khóa để giảm tỷ lệ mắc CI- AKI (Bảng 9).
| Bảng 9. Các chiến lược dự phòng CI-AKI |
| 1. Giảm độc tính tế bào trực tiếp của thuốc cản quang 1.1. Sử dụng thuốc cản quang hợp lý. - Chọn lựa loại thuốc cản quang tối ưu dựa trên tình trạng bệnh nhân (thuốc cản quang có áp lực thẩm thấu thấp/thuốc cản quang đồng áp lực thẩm thấu) - Thay thế thuốc cản quang có iốt không gây độc cho thận (chụp mạch với CO,, OCT dựa trên dextran) - Giảm thể tích thuốc cản quang - Tránh chụp mạch nếu có thể (thay thế bằng IVUS và MRA) 1.2. Bù nước dựa vào cá thể hóa được khuyến cáo Bù nước dựa trên áp lực tĩnh mạch trung tâm (CVP) - Bù nước dựa trên áp lực cuối tâm trương của thất trái (LVEDP) - Bù nước dựa trên phân tích vector trở kháng sinh học (BIVA) - Hệ thống RenalGuard |
| 2. Cải thiện tình trạng thiếu máu cục bộ thận do thuốc cản quang - Thuốc đối kháng thụ thể adenosin, theophyllin cho thấy tác dụng có lợi - KHÔNG có chất gây độc thận, Sildenafil và Tadalafil cho thấy tác dụng có lợi - Thuốc chẹn kênh canxi, amlodipin cho thấy tác dụng có lợi - Prostaglandin, Iloprost cho thấy tác dụng có lợi - Không có lợi ích chính xác của các thuốc dãn mạch khác |
3. Các chất chống oxy hóa |
| 4. Các chiến lược khác Nên dùng statin liều cao Áp dụng RIPC còn đang tranh luận |
Nguồn: Zhang F, 2020
10.1 Thuốc cản quang
Thể tích thuốc cản quang
Do độc tính trực tiếp của thuốc cản quang chủ yếu phụ thuộc vào các đặc tính hóa lý của thuốc cản quang, các bác sĩ lâm sàng nên lựa chọn thuốc cản quang cẩn thận, đặc biệt đối với những bệnh nhân có nguy cơ cao. Các nguyên tắc áp dụng đối với thuốc cản quang bao gồm chọn thuốc cản quang có i-ốt ít độc hại hơn và hạn chế thể tích dùng.
Như đã thảo luận ở trên, mối liên hệ giữa thể tích thuốc cản quang và nguy cơ Cl-AKI đã được ghi nhận rõ ràng. Vì lý do này, thể tích thuốc cản quang đã được đưa vào như một yếu nguy cơ có thể thay đổi được trong các công cụ đánh giá nguy cơ chính cho CI-AKI. Do đó, bất kể ước tính nguy cơ ở từng bệnh nhân, cần thực hiện mọi nỗ lực để tối ưu hóa các quy trình chẩn đoán và can thiệp, với mục đích là hạn chế thể tích thuốc cản quang, đồng thời tránh thực hiện nhiều thủ thuật trong một cửa sổ thời gian hẹp. Tỷ lệ thể tích thuốc cản quang trên độ thanh thải creatinin (CV/CrCI) >2 đã được xác định là một yếu tố dự báo độc lập của CI-AKI ở những bệnh nhân có eGFR <30 mL/phút/1,73 m2. Trên những bệnh nhân như vậy, CV/CrCl <1 là lý tưởng để giảm thiểu nguy cơ CI-AKI'35,156. Theo tác giả Cigarroa và cộng sự, thể tích thuốc cản quang tối đa có thể sử dụng được tính bằng công thức: [5 x trọng lượng cơ thể tính bằng kg (tối đa 300 mL)]/Creatinin huyết thanh (mg/dL)157. Tỷ lệ CV/CrCl >3,7 là một điểm cắt có độ nhạy và độ đặc hiệu tốt để xác định bệnh nhân có nguy cơ tiến triển CI-AKI trong 24 giờ sau thủ thuật trên dân số 3.179 bệnh nhân trải qua PCI's. Các tác giả khác đã đề xuất mức giới hạn thấp hơn (CV/CrCl <2,7) cho bệnh nhân cao tuổi trải qua thủ thuật TAVI'S.
Duffy và cộng sự đã phát triển một kỹ thuật mới gọi là hút xoang vành (coronary sinus aspiration) để lấy thuốc cản quang ra khỏi xoang vành trong quá trình chụp mạch vành với dụng cụ hút khá cồng kềnh 60. Tính khả thi và hiệu quả của kỹ thuật này đã được đánh giá ở 26 bệnh nhân suy thận (eGFR 15-60 mL/phút/1,73 m) được chụp mạch vành hoặc PCI. Kết quả cho thấy hút xoang vành làm giảm được thể tích thuốc cản quang sử dụng khoảng 32 ± 3% và làm giảm độc tính trên thận của thuốc cản quang, bằng chứng là eGFR không có những thay đổi đáng kể (41,8 ± 2,2 đến 41,1 ± 2,3 mL/phút/1,73 m). Xem xét tính khả thi và hạn chế của dụng cụ hút, Diab và cộng sự đã điều chỉnh một ống thông tắc qua bóng do Danenberg phát triển bằng cách sử dụng một sheath (đường kính trong 8,0 đến 8,5 F) để ổn định bóng trong xoang vành. Trong một nghiên cứu tiền cứu bao gồm 43 bệnh nhân đái tháo đường típ 2 và suy thận (SCr từ 1,5 đến 3,0 mg/dL) được chụp động mạch vành, các tác giả đã chứng minh rằng hút xoang vành làm giảm đáng kể 39,35 ± 10,47% thể tích thuốc cản quang và giảm tỷ lệ mắc CI-AKI ở những bệnh nhân được chụp mạch vành chương trình (5,5% so với 36,0%, p <0,03) Tuy nhiên, thời gian thủ thuật kéo dài đáng kể làm tăng những thách thức về thủ thuật và do đó làm hạn chế tính phổ biến của nó. Cho đến khi các thử nghiệm lâm sàng chất lượng cao hơn với cỡ mẫu lớn hơn nhắm đến kỹ thuật này được thực hiện thì hiện tại tính khả thi của hút xoang vành để giảm thể tích thuốc cản quang vẫn còn chưa rõ ràng.
Việc giảm thiểu thể tích thuốc cản quang cũng có thể đạt được bằng một dụng cụ điều chỉnh thuốc bằng tay có tính khả thi và an toàn hơn, được gọi là hệ thống AVERT163. Hiệu quả của hệ thống AVERT trong chụp mạch vành chẩn đoán lần đầu tiên được đánh giá trong một nghiên cứu ngẫu nhiên có đối chứng bao gồm 96 bệnh nhân. Kết quả của nghiên cứu cho thấy hệ thống AVERT làm giảm một cách hiệu quả 41% thể tích thuốc cản quang được sử dụng và hình ảnh mạch có thể chấp nhận được. Tuy nhiên, tỷ lệ mắc CI-AKI không được đánh giá trong nghiên cứu này. Sau đó, Mehran và cộng sự đã tiến hành một nghiên cứu tiến cứu đa trung tâm lớn hơn bao gồm 578 bệnh nhân bị suy giảm chức năng thận (eGFR 20-60 mL/ phút/1,73 m2) và có thêm ít nhất hai yếu tố nguy cơ CI-AKI trên những bệnh nhân được chụp mạch vành hoặc PCI. Trong nghiên cứu này, 292 bệnh nhân được chọn ngẫu nhiên để được bổ sung dịch cùng với hệ thống AVERT trong suốt thủ thuật và được so sánh với 286 bệnh nhân chỉ được bổ sung dịch. Phân tích cho thấy việc sử dụng hệ thống AVERT làm giảm 15,5% thể tích thuốc cản quang cho tất cả các thủ thuật (85,6 ± 50,5 mL so với 101,3 ± 71,1 mL, p<0,02) và 22,8% (114 + 55 mL so với 147 ± 81 mL, p<0,001) đối với bệnh nhân được PCI. Ngoài ra, chất lượng hình ảnh khi sử dụng hệ thống AVERT được chứng minh là chấp nhận được. Tuy nhiên, hệ thống AVERT không làm giảm tỷ lệ CI-AKI (27,0% so với 26,6%, p <0,70), có thể do thể tích thuốc cản quang giảm chưa được nhiều.
Ali và cộng sự đề xuất một quy trình khá phức tạp để thực hiện PCI mà không dùng thuốc cản quang ở 31 đối tượng với eGFR trung bình là 16 + 8 mL/phút/1,73 m ở thời điểm một vài ngày sau khi chụp mạch vành với thể tích thuốc cản quang tối thiểu (trung bình 13 mL). Thủ thuật được thực hiện dựa trên hình ảnh IVUS cũng như test đánh giá chức năng sinh lý mạch vành và lập bản đồ dựng hình mạch máu. Phân suất dự trữ lưu lượng và dự trữ lưu lượng mạch vành được ghi nhận lúc ban đầu để xác định chức năng sinh lý của các tổn thương và sau khi đặt stent để đánh giá kết quả cuối cùng. IVUS được sử dụng để xác định đoạn gần và xa của tổn thương, hướng dẫn lựa chọn stent, nong lại sau đặt stent và để xác định kết quả cuối cùng. Cách tiếp cận này dẫn đến PCI thành công, không có biến cố tim mạch bất lợi nặng và bảo tồn chức năng thận mà không cần điều trị thay thế thận trong thời gian theo dõi 79 ngày (khoảng tứ phân vị 33-207 ngày) ở tất cả bệnh nhân.
So với IVUS, chụp cắt lớp quang học nội mạch (OCT) với độ phân giải cao và xác định rõ đặc điểm cấu trúc của các tổn thương (ví dụ: canxi). Tuy nhiên, OCT yêu cầu máu phải được đuổi ra khỏi lòng mạch trong quá trình ghi nhận, điều này thường đạt được với thuốc cản quang. Tính khả thi của việc thực hiện OCT có thể được thực hiện bằng sử dụng một chất thay thế, chẳng hạn như dextran có trọng lượng phân tử thấp, đã được báo cáo trước đây!75. Kết quả OCT dựa trên dextran cho chất lượng hình ảnh tương đương và các phép đo gần như bằng nhau (hệ số hiệu chỉnh phải được sử dụng để giải thích sự khác biệt trên các đặc tính trơ của thuốc cản quang và dextran). Dextran được cho là không gây độc thận với thể tích <100 mL được sử dụng trong PCI có hướng dẫn OCT, tuy nhiên đã có báo cáo về AKI do dextran gây ra với lượng > 1L. Các tác dụng phụ khác bao gồm phản ứng phản vệ và rối loạn đông máu's. Do đó, cần phải đánh giá mức độ an toàn của cách tiếp cận này trước khi đưa ra khuyến cáo về việc áp dụng rộng rãi.
Loại thuốc cản quang
Về loại thuốc cản quang, trong khi việc sử dụng các thuốc không ion hóa như thuốc cản quang có áp lực thẩm thấu thấp (500-850 mOsmol/kg), đồng áp lực thẩm thấu (290 mOsmol kg) có liên quan đến việc giảm tỷ lệ CI-AKI so với các thuốc cản quang có ion hóa với áp lực thẩm thấu cao (1.500-1.800 mOsmol/kg) thì kết quả của các nghiên cứu so sánh thuốc cån quang có lực thẩm thấu thấp so với đồng áp lực thẩm thấu vẫn còn đang gây tranh cãi Trong thử nghiệm ngẫu nhiên có đối chứng (RCT) đầu tiên so sánh iohexol và iodixanol trên 129 bệnh nhân có nguy cơ cao kèm đái tháo đường và bệnh thận mạn được chụp động mạch vành hoặc động mạch chủ - đùi, iodixanol (thuốc cản quang đồng áp lực thẩm thấu) có liên quan đến tỷ lệ CI-AKI thấp hơn. Tuy nhiên, trong ba thử nghiệm tiếp theo, so sánh iodixanol với hai thuốc cản quang áp lực thẩm thấu thấp không ion hóa (ioversol và iopamidol) ở bệnh nhân đái tháo đường và bệnh nhân bệnh thận mạn không đái tháo đường cho thấy không có sự khác biệt nào được trên tỷ lệ mắc CI-AKI giữa các loại thuốc cản quang. Một phân tích tổng hợp tiếp theo với 25 RCT so sánh iodixanol với các thuốc cản quang có áp lực thẩm thấu thấp khác nhau, bao gồm 5.053 bệnh nhân (>70% có bệnh thận mạn hoặc đái tháo đường), ghi nhận có giảm nhẹ nguy cơ mắc CI-AKI nhưng không có bất kỳ sự khác biệt nào giữa các nhóm khi so sánh các kết cục thô (nguy cơ điều trị thay thế thận, kết cục tim mạch và tử vong). Trong một phân tích tổng hợp gần đây, bao gồm 10 thử nghiệm (2.839 bệnh nhân bệnh thận mạn giai đoạn 3 trải qua chụp mạch vành), việc sử dụng thuốc cản quang đồng áp lực thẩm thấu không cho thấy lợi ích đáng kể nào về mặt ngăn ngừa CI-AKI so với thuốc cản quang có áp lực thẩm thấu thấp. Theo đó, hướng dẫn KDIGO 2012 về AKI khuyến cáo sử dụng thuốc cản quang có áp lực thẩm thấu thấp hoặc đồng áp lực thẩm thấu thay vì thuốc cản quang có áp lực thẩm thấu cao, nhưng cũng chú ý rằng không có bằng chứng đáng tin cậy nào ủng hộ việc lựa chọn thuốc cản quang có áp lực thẩm thấu thấp hay thuốc cản quang đồng áp lực thẩm thấu
10.2 Bù dịch
Một quan điểm khác đề xuất rằng thay vì ngăn ngừa AKI bằng cách hạn chế sử dụng thuốc cản quang, cần chú ý nhiều hơn đến các yếu tố nguy cơ của CI-AKI. Trong nhiều trường hợp, việc dùng thuốc cản quang trên lâm sàng là không thể tránh khỏi, đặc biệt đối với bệnh nhân hội chứng vành cấp. Đối với những bệnh nhân như vậy, các yếu tố nguy cơ cần được đánh giá chi tiết và nên tích cực thực hiện các biện pháp phòng ngừa như bù dịch.
Trên cơ sở các bằng chứng gần đây, bù dịch trong giai đoạn chu phẫu là biện pháp dự phòng hiệu quả nhất cho bệnh nhân có nguy cơ Cl-AKI. Các khuyến cáo đề nghị những bệnh nhân không bị mất nước nên uống 500 mL nước trước khi được dùng thuốc cản quang. Ngoài ra, 2.500 mL nước muối sinh lý nên được truyền tĩnh mạch trong vòng 24 giờ sau khi tiếp xúc với thuốc cản quang để duy trì tốc độ tạo nước tiểu trên 1 mL/kg/giờ. Trong trường hợp bệnh nhân thuộc nhóm nguy cơ cao mà không có bất kỳ dấu hiệu suy tim nào, nên truyền nước muối sinh lý 6-12 giờ trước khi dùng thuốc cản quang với liều 1 mL/kg/giờ và tiếp tục thêm 12-24 giờ sau đó. Tuy nhiên, liệu thể tích nước muối sinh lý bù theo tiêu chuẩn như vậy có đủ để giảm tỷ lệ CI-AKI hay không vẫn còn được đặt ra. Ngoài ra, truyền dịch dự phòng có thể góp phần làm tăng nguy cơ suy tim, loạn nhịp tim và tử vong trong ngắn hạn ở những bệnh nhân có nguy cơ cao.
Trong một thử nghiệm mù đôi, ngẫu nhiên, tiến cứu trên 264 bệnh nhân bệnh thận mạn suy tim sung huyết, Qian và cộng sự cho thấy truyền dịch theo áp lực tĩnh mạch trung tâm là tốt hơn so với phương pháp điều trị tiêu chuẩn để dự phòng CI-AKI ở những bệnh nhân được chụp động mạch vành Hiệu quả tương tự khi đo áp lực cuối tâm trương thất trái (LVEDP) để hướng dẫn bù nước đã được xác định trong thử nghiệm POSEIDON18 Thử nghiệm POSEIDON đã chọn ngẫu nhiên 396 bệnh nhân bị suy thận từ trước (eGFR <60 mL/phút/1,73 m2 da) kèm >1 yếu tố nguy cơ (đái tháo đường, suy tim, tăng huyết áp và tuổi >75) được phân ngẫu nhiên 1:1 vào nhóm bù nước theo hướng dẫn đo LVEDP (n=196) hoặc nhóm bù nước theo tiêu chuẩn (n=200). Nhóm tiêu chuẩn được truyền liều 3 mL/kg trong 1 giờ trước khi thực hiện thủ thuật, tiếp theo là 1,5 mL/kg/giờ trong 4 giờ; nhóm bù nước theo hướng dẫn đo LVEDP được thực hiện cùng thời điểm trước thủ thuật, nhưng bù nước giai đoạn chu phẫu và sau thủ thuật được hướng dẫn bởi LVEDP. Tỷ lệ CI-AKI ở nhóm được hướng dẫn đo LVEDP giảm đáng kể so với nhóm tiêu chuẩn (nguy cơ tương đối [RR] =0,41, KTC 95%: 0,22-0,79, p = 0,005), song song với việc giảm tỷ lệ các biến cố bất lợi chính trong 6 tháng bao gồm kết hợp của tử vong do mọi nguyên nhân, nhồi máu cơ tim và chạy thận nhân tạo (RR: 0,32, KTC 95%: 0,13-0,79, p=0,008)
Thử nghiệm HYDRA được tác giả Maioli và cộng sự thực hiện nhằm mục tiêu là so sánh hiệu quả của thể tích dịch truyền tĩnh mạch theo liều tiêu chuẩn và liều gấp đôi trên những bệnh nhân có mức dịch cơ thể thấp, được đánh giá bằng cách sử dụng phân tích vectơ trở kháng sinh học (BIVA), với tiêu chí đánh giá là tỷ lệ mắc CI-AKI sau các thủ thuật chụp mạch vành chương trình’2. Tổng số có 303 bệnh nhân có mức BIVA thấp khi nhập viện được chọn ngẫu nhiên để được truyền nước muối với thể tích liều tiêu chuẩn (1 mL/kg/giờ trong 12 giờ trước và sau thủ thuật) hoặc nước muối thể tích liều gấp đôi (2 mL/kg/giờ). Nhóm bệnh nhân (n=715) với mức BIVA tối ưu được nhận thể tích liều tiêu chuẩn. Thể tích nước muối truyền giảm đi một nửa ở tất cả bệnh nhân có EF <40%. BIVA được lặp lại ngay lập tức trước khi làm thủ thuật chụp mạch ở tất cả các bệnh nhân. CI-AKI được định nghĩa là sự gia tăng nồng độ cystatin C≥10% so với mức ban đầu trong 24 giờ sau khi dùng thuốc cản quang. Kết quả cho thấy tỷ lệ mắc CI-AKI thấp hơn đáng kể (11,5% so với 22,3%, p= 0,015) ở những bệnh nhân được truyền nước muối thể tích liều gấp đôi so với những bệnh nhân được truyền nước muối thể tích liều tiêu chuẩn. Trước thủ thuật chụp mạch, 50% bệnh nhân được truyền nước muối thể tích liều gấp đôi đạt được mức BIVA tối ưu so với chỉ 27,7% ở nhóm liều tiêu chuẩn (p= 0,0001). Các phát hiện đều nhất quán ở tất cả các phân nhóm được chỉ định trước, ngoại trừ bệnh nhân có LVEF <40% (p tương tác = 0,01).
Yan và cộng sự đã sử dụng siêu âm tĩnh mạch chủ dưới (TVCU) để hướng dẫn bù nước ở bệnh nhân suy tim mạn tính với NYHA>2 có LVEF <50%183. 207 bệnh nhân trải qua chụp mạch vành hoặc PCI được chia thành hai nhóm: nhóm đối chứng (nước muối đẳng trương với tốc độ truyền 0,5 mL/kg/giờ trong 6 giờ trước và 12 giờ sau khi làm thủ thuật) và nhóm bù nước có hướng dẫn IVCU (nước muối đẳng trương với tốc độ 0,5, 1,0 hoặc 1,5 mL/kg giờ khi đường kính IVC tương ứng là >25, 20-25 hoặc <20 mm trong cùng một khoảng thời gian). Thể tích nước muối bù ở nhóm được hướng dẫn bằng IVCU cao hơn đáng kể so với nhóm đối chứng và tỷ lệ CI-AKI thấp hơn đáng kể (12,5% so với 29,1%, p=0,004). Ngoài ra, các biến cố tim mạch hoặc tai biến mạch máu não nặng trong thời gian theo dõi 18 tháng ít xảy ra hơn ở những bệnh nhân được truyền dịch có hướng dẫn của IVCU.
Những kết quả này chỉ ra rằng tình trạng dịch của bệnh nhân là một yếu tố quan trọng liên quan đến sự phát triển của CI-AKI và việc bù một thể tích dịch đầy đủ trong phạm vi an toàn theo các phương pháp hướng dẫn khác nhau có thể là một chiến lược dự phòng quan trọng. Một phương pháp bù nước không xâm lấn và tiết kiệm chi phí là bù nước qua đường uống đã được so sánh với bù nước qua đường tĩnh mạch. Uống nước có thể ngăn chặn sự giải phóng vasopressin và dẫn đến bài niệu nhanh chóng'84. Nó đã được chứng minh là không thua kém so với bù nước qua đường tĩnh mạch trong việc dự phòng CI-AKI135,186 Nghiên cứu NICIR được công bố gần đây của tác giả Sebastia và cộng sự là một nghiên cứu không thua kém giai đoạn III so sánh bù nước qua đường uống với bù nước qua đường tĩnh mạch ở bệnh nhân bệnh thận mạn giai đoạn IIIb trải qua chụp cắt lớp vi tính có thuốc cản quang (CECT) theo chương trình'. Các bệnh nhân được phân bổ ngẫu nhiên theo tỷ lệ 1: 1 để được điều trị dự phòng CI-AKI bằng cách uống 500 mL nước hai giờ trước và 2.000 mL trong 24 giờ sau khi thực hiện CECT hoặc bù nước qua đường tĩnh mạch Natri bicarbonat (166 mmol/L) 3 mL/kg/giờ bắt đầu một giờ trước và natri bicarbonat (166 mmol/L) 1 mL/ kg/giờ trong giờ đầu tiên sau CECT, đây cũng là phương pháp được đề xuất bởi Kong và cộng sự trên những bệnh nhân trải qua chụp mạch vành hoặc PC1188, 100 mL thuốc cản quang không ion hóa được sử dụng trong mọi trường hợp. Kết cục chính của nghiên cứu là tỷ lệ CI-AKI trong 48-72 giờ đầu tiên sau CECT và kết cục phụ là CI-AKI kéo dài, nhu cầu chạy thận nhân tạo và sự xuất hiện của các tác dụng phụ liên quan đến điều trị dự phòng kháng sinh học (BIVA), với tiêu chí đánh giá là tỷ lệ mắc CI-AKI sau các thủ thuật chụp mạch vành chương trình’2. Tổng số có 303 bệnh nhân có mức BIVA thấp khi nhập viện được chọn ngẫu nhiên để được truyền nước muối với thể tích liều tiêu chuẩn (1 mL/kg/giờ trong 12 giờ trước và sau thủ thuật) hoặc nước muối thể tích liều gấp đôi (2 mL/kg/giờ). Nhóm bệnh nhân (n=715) với mức BIVA tối ưu được nhận thể tích liều tiêu chuẩn. Thể tích nước muối truyền giảm đi một nửa ở tất cả bệnh nhân có EF <40%. BIVA được lặp lại ngay lập tức trước khi làm thủ thuật chụp mạch ở tất cả các bệnh nhân. CI-AKI được định nghĩa là sự gia tăng nồng độ cystatin C≥10% so với mức ban đầu trong 24 giờ sau khi dùng thuốc cản quang. Kết quả cho thấy tỷ lệ mắc CI-AKI thấp hơn đáng kể (11,5% so với 22,3%, p= 0,015) ở những bệnh nhân được truyền nước muối thể tích liều gấp đôi so với những bệnh nhân được truyền nước muối thể tích liều tiêu chuẩn. Trước thủ thuật chụp mạch, 50% bệnh nhân được truyền nước muối thể tích liều gấp đôi đạt được mức BIVA tối ưu so với chỉ 27,7% ở nhóm liều tiêu chuẩn (p= 0,0001). Các phát hiện đều nhất quán ở tất cả các phân nhóm được chỉ định trước, ngoại trừ bệnh nhân có LVEF <40% (p tương tác = 0,01).
Yan và cộng sự đã sử dụng siêu âm tĩnh mạch chủ dưới (TVCU) để hướng dẫn bù nước ở bệnh nhân suy tim mạn tính với NYHA>2 có LVEF <50%183. 207 bệnh nhân trải qua chụp mạch vành hoặc PCI được chia thành hai nhóm: nhóm đối chứng (nước muối đẳng trương với tốc độ truyền 0,5 mL/kg/giờ trong 6 giờ trước và 12 giờ sau khi làm thủ thuật) và nhóm bù nước có hướng dẫn IVCU (nước muối đẳng trương với tốc độ 0,5, 1,0 hoặc 1,5 mL/kg giờ khi đường kính IVC tương ứng là >25, 20-25 hoặc <20 mm trong cùng một khoảng thời gian). Thể tích nước muối bù ở nhóm được hướng dẫn bằng IVCU cao hơn đáng kể so với nhóm đối chứng và tỷ lệ CI-AKI thấp hơn đáng kể (12,5% so với 29,1%, p=0,004). Ngoài ra, các biến cố tim mạch hoặc tai biến mạch máu não nặng trong thời gian theo dõi 18 tháng ít xảy ra hơn ở những bệnh nhân được truyền dịch có hướng dẫn của IVCU.
Những kết quả này chỉ ra rằng tình trạng dịch của bệnh nhân là một yếu tố quan trọng liên quan đến sự phát triển của CI-AKI và việc bù một thể tích dịch đầy đủ trong phạm vi an toàn theo các phương pháp hướng dẫn khác nhau có thể là một chiến lược dự phòng quan trọng. Một phương pháp bù nước không xâm lấn và tiết kiệm chi phí là bù nước qua đường uống đã được so sánh với bù nước qua đường tĩnh mạch. Uống nước có thể ngăn chặn sự giải phóng vasopressin và dẫn đến bài niệu nhanh chóng'84. Nó đã được chứng minh là không thua kém so với bù nước qua đường tĩnh mạch trong việc dự phòng CI-AKI135,186 Nghiên cứu NICIR được công bố gần đây của tác giả Sebastia và cộng sự là một nghiên cứu không thua kém giai đoạn III so sánh bù nước qua đường uống với bù nước qua đường tĩnh mạch ở bệnh nhân bệnh thận mạn giai đoạn IIIb trải qua chụp cắt lớp vi tính có thuốc cản quang (CECT) theo chương trình'. Các bệnh nhân được phân bổ ngẫu nhiên theo tỷ lệ 1: 1 để được điều trị dự phòng CI-AKI bằng cách uống 500 mL nước hai giờ trước và 2.000 mL trong 24 giờ sau khi thực hiện CECT hoặc bù nước qua đường tĩnh mạch natri bicarbonat (166 mmol/L) 3 mL/kg/giờ bắt đầu một giờ trước và natri bicarbonat (166 mmol/L) 1 mL/ kg/giờ trong giờ đầu tiên sau CECT, đây cũng là phương pháp được đề xuất bởi Kong và cộng sự trên những bệnh nhân trải qua chụp mạch vành hoặc PC1188, 100 mL thuốc cản quang không ion hóa được sử dụng trong mọi trường hợp. Kết cục chính của nghiên cứu là tỷ lệ CI-AKI trong 48-72 giờ đầu tiên sau CECT và kết cục phụ là CI-AKI kéo dài, nhu cầu chạy thận nhân tạo và sự xuất hiện của các tác dụng phụ liên quan đến điều trị dự phòng.
Trong số 264 bệnh nhân được phân bố ngẫu nhiên từ tháng 1 năm 2018 đến tháng 1 năm 2019, có 114 bệnh nhân được bù nước bằng đường uống và 114 bệnh nhân được bù nước qua đường tĩnh mạch được đánh giá. Kết quả không tìm thấy sự khác biệt có ý nghĩa (p 0,05) giữa các nhóm về đặc điểm lâm sàng hoặc yếu tố nguy cơ. Tỷ lệ CI-AKI là 4,4% (KTC 95%: 1,49,9%) ở nhóm bù nước qua đường uống và 5,3% (KTC 95%: 2,0-11,1%) ở nhóm bù nước qua đường tĩnh mạch. Tỷ lệ CI-AKI kéo dài là 1,8% (KTC 95%: 0,2-6,2%) ở cả hai nhóm. Không có bệnh nhân nào cần phải lọc máu trong tháng đầu tiên sau CECT hoặc có các tác dụng phụ liên quan đến phương pháp bù nước.
Hệ thống RenalGuard là một dụng cụ cho phép tối ưu hóa quá trình bù nước qua đường tĩnh mạch bằng cách khớp thể tích truyền với lượng nước tiểu của bệnh nhân. Một giờ trước khi làm thủ thuật, truyền tĩnh mạch một thể tích dung dịch muối đẳng trương và một liều furosemide. Khi lượng nước tiểu đạt được là 300 mL/giờ, PCI được bắt đầu. Quá trình này được tiếp tục trong 4 giờ sau PCI. Khi đạt được lượng nước tiểu cao, thuốc cản quang sẽ bị pha loãng và do đó, các tác dụng có hại của nó đối với thận bị giảm đi. Các thử nghiệm ngẫu nhiên so sánh bù nước với hệ thống RenalGuard cho thấy giảm từ 53% đến 78% tỷ lệ CIAKI ở bệnh nhân bệnh thận mạn từ trung bình đến nặng được chụp mạch vành và PC1189,190 Do . đó, việc sử dụng RenalGuard nên được cân nhắc ở những bệnh nhân có nguy cơ cao CI-AKI.
10.3 Các thuốc dự phòng CI-AKI
Sodium bicarbonate
Kiềm hóa nước tiểu và cản trở sự hình thành ROS với natri bicarbonate thường được nghiên cứu để ngăn ngừa CI - AKI. Tuy nhiên, trong một phân tích tổng hợp của 22 nghiên cứu với 5.686 bệnh nhân, natri bicarbonat không vượt trội hơn so với nước muối đẳng trương19. Ngoài ra, trong thử nghiệm CINSTEMI, natri bicarbonat không tốt hơn bù nước tiêu chuẩn ở bệnh nhân STEMI được PCI tiên phát Thử nghiệm PRESERVE bao gồm 5.177 bệnh nhân mắc bệnh thận mạn và/hoặc đái tháo đường được chụp mạch vành hoặc không phải mạch vành, cũng kết thúc với kết quả trung tính (9,5% so với 8,3%, p=0,13) ở cả hai nhóm và trong phân tích dưới nhóm trên những bệnh nhân được PCI.
Statin
Các chứng cứ từ các nghiên cứu đã xác định vai trò bảo vệ của statin ở những bệnh nhân nguy cơ CI-AKI, có thể thông qua cơ chế chống viêm, chống oxy hóa và đẩy lùi chết tế bào theo chương trình và ức chế sự tiêu hủy tế bào biểu mô ống thận của thuốc cản Thử nghiệm PRATO-ACS cho thấy rosuvastatin liều cao (40 mg khi nhập viện, sau đó là 20 mg/ngày) làm giảm đáng kể tỷ lệ CI-AKI ở những bệnh nhân có hội chứng mạch vành cấp không ST chênh lên được chụp mạch vành. Điều thú vị là nghiên cứu sâu hơn cho thấy tác dụng có lợi của rosuvastatin trong việc ngăn ngừa CI-AKI chỉ xuất hiện ở những bệnh nhân có nồng độ CRP cao (7,2% so với 28,3%, OR 0,20, KTC 95%: 0,07 đến 0,54, p <0,002) nhưng không thấy ở nhóm bệnh nhân có CRP từ thấp đến trung bình. Điều này cho thấy tác dụng có lợi của statin đối với CI-AKI phần lớn phụ thuộc vào đặc tính chống viêm của nó!%. Bên cạnh rosuvastatin, Atorvastatin liều cao (80 mg/12 giờ khi nhập viện kèm với liều 40 mg khác 2 giờ trước khi làm thủ thuật, tiếp theo là 40 mg/ngày) cũng cho thấy tiềm năng lớn trong việc phòng ngừa CI-AKI. Do đó, những dữ liệu này ủng hộ việc sử dụng statin liều cao để giảm nguy cơ CI-AKI. Tuy nhiên, vẫn còn thiếu bằng chứng ủng hộ việc sử dụng statin liều cao, ngắn hạn như một chiến lược dự phòng độc lập đối với CL-AKI.
Các chất chống oxy hóa
Stress oxy hóa là một trong những cơ chế được công nhận của CI-AKI. Khi thận tiếp xúc với thuốc cản quang, ROS nội bào được tạo ra và tỷ lệ tổng hợp của nó lớn hơn tỷ lệ bài tiết, dẫn đến mất cân bằng oxy hóa - chống oxy hóa, gây ra sự peroxy hóa lipid của màng sinh học, thoái hóa protein nội bào và tổn thương DNA. Do đó, nghiên cứu lâm sàng về dự phòng CI-AK1 bằng việc loại bỏ các gốc tự do đã trở thành một chủ đề rất được quan tâm Hiện nay, một số chất chống oxy hóa có sẵn bao gồm N-acetylcystein (NAC) và sodium bicarbonate, đã được sử dụng rộng rãi để ngăn ngừa CI-AKI. NAC là một chất thu hồi gốc tự do có chứa các nhóm thiol, có thể thúc đẩy tổng hợp glutathion, điều chỉnh sự trao đổi chất của tế bào và có tác dụng chống stress và oxy hóa200. Hơn nữa, NAC cũng có thể làm giảm sản xuất angiotensin bằng cách ức chế hoạt động của men chuyển angiotensin và tăng biểu hiện enzym NO ở nội mạc mạch máu để thúc đẩy giải phóng NO2. Ngoài ra, nghiên cứu cũng khẳng định rằng natri bicacbonat có tác dụng chống oxy hóa và loại bỏ các gốc tự do. Tuy nhiên, vẫn còn thiếu bằng chứng chứng minh tính hiệu quả của chúng. Steven và cộng sự cho thấy truyền tĩnh mạch natri bicarbonat 1,26% không tốt hơn truyền tĩnh mạch Natri clorid 0,9% (9,5% so với 8,3%, OR: 1,16, KTC 95%: 0,96-1,41, p = 0,13) và 1.200 mg đường uống NAC không vượt trội so với giả dược đường uống (9,1% so với 8,7%, OR 1,16, KTC 95%: 0,96 đến 1,41, p = 0,13) trong việc ngăn ngừa CI-AKI'. Một kết quả tương tự cũng được thể hiện trong một thử nghiệm tiến cứu khác bao gồm 2.308 bệnh nhân có nguy cơ CI-AKI và trong đó hiệu quả của NAC đã được đánh giá. Kết quả cho thấy cả nhóm NAC (1200 mg đường uống) và nhóm giả dược đường uống có cùng tỷ lệ mắc CI-AKI (12,7% so với 12,7% OR: 1,00, KTC 95%: 0,81 đến 1,25, p=0,97)202. Do đó, những dữ liệu này không ủng hộ việc dùng NAC hoặc natri bicarbonate để phòng ngừa CI-AKI. Các chất chống oxy hóa mới khác, chẳng hạn như quercetin, Febuxostat và klotho tái tổ hợp có thể là những ứng cử viên lâm sàng đầy hứa hẹn để ngăn ngừa CI-AKI và cần được nghiên cứu thêm để kiểm tra tác dụng bảo vệ thận của những loại thuốc này.
Các thuốc dãn mạch
Dựa trên cơ sở giả thuyết rằng việc giảm co thắt mạch thận kéo dài do thuốc cản quang sẽ làm giảm thiếu máu cục bộ vùng tủy thận, một số nhóm thuốc dãn mạch đã được thử nghiệm, trong đó, thuốc đối kháng thụ thể adenosin được nghiên cứu rộng rãi nhất hiện nay. Adenosin được tạo ra từ quá trình thủy phân ATP sẽ kích hoạt thụ thể adenosin Al gây co mạch thận2%. Một phân tích tổng hợp bao gồm 1.412 bệnh nhân từ 16 thử nghiệm cho thấy theophyllin, một thuốc đối kháng thụ thể adenosin không chọn lọc, làm giảm đáng kể nguy cơ CI-AKI (RR: 0,48, KTC 95%: 0,26 đến 0,89, p = 0,02)207. Các kết quả tương tự cũng được báo cáo trong một số nghiên cứu tiến cứu nhỏ. Điều thú vị là 200 mg theophyllin được tiêm tĩnh mạch 30 phút trước khi tiếp xúc với thuốc cản quang. Kết quả cho thấy tác dụng có lợi của theophyllin trong việc dự phòng CI-AKI. Tuy nhiên, cỡ mẫu quá nhỏ để cung cấp đủ chứng cứ về việc kết hợp theophyllin vào thói quen thực hành lâm sàng. Bên cạnh đó, giảm sinh khả dụng của NO là một yếu tố chính khác gây ra co mạch thận ở bệnh nhân CI-AKI. Dimethylarginin không đối xứng (ADMA), một chất ức chế tổng hợp NO nội sinh, đã được ghi nhận trong huyết tương của bệnh nhân CI-AKI cao hơn đáng kể so với bệnh nhân không bị CI-AKI ở một nghiên cứu hồi cứu 664 trường hợp phẫu thuật tim”. Hơn nữa, Lin và cộng sự nhận thấy việc ức chế nồng độ ADMA ở thận bằng cách sử dụng dimethylarginin dimethyl amino hydroxylase có chứa adenovi- rus có thể làm giảm đáng kể CI-AKP. Các chất ức chế phosphodiesterase 5, chẳng hạn như sildenafil và tadalafil có thể cải thiện CI-AKI bằng cách ức chế chọn lọc sự chuyển hóa của guanosine monophosphate vòng (chất trung gian liên quan đến cảm ứng NO2 Amlodipin, một trong những thuốc chẹn kênh Canxi được sử dụng phổ biến nhất, có thể ức chế dòng chảy chậm qua màng tế bào của Ca2+ vào mạch máu cơ trơn và do đó có tác dụng dãn mạch. Gần đây, Yin và cộng sự đã tiến hành một nghiên cứu đoàn hệ hồi cứu, so sánh bao gồm 868 bệnh nhân có và 1.798 bệnh nhân không có dùng amlodipin trước khi sử dụng thuốc cản quang Kết quả cho thấy điều trị bằng amlodipin trước khi tiếp xúc thuốc cản quang sẽ làm giảm đáng kể tỷ lệ mắc CI-AKI (OR: 0,687, p = 0,015) và kéo dài thời gian sống còn (HR: 0,623, KTC 95%: 0,430-0,908, p=0,014). Giảm sự quá tải Ca” trong tế bào ống thận có thể là một cơ chế khác liên quan đến vai trò bảo vệ của . Amlodipin đối với CI-AKP- Ngoài ra, dùng iloprost dự phòng cũng có thể làm giảm tỷ lệ CI-AKI (OR: 0,29, KTC 95%: 0,12 đến 0,69, p = 0,005)ıs. Tuy nhiên, các thuốc dãn mạch khác bao gồm thuốc đối kháng thụ thể endothelin, dopamin và nifedipin dường như không mang lại hiệu quả trong việc dự phòng CI-AKP
Hiện tượng tiền thích nghi thiếu máu cục bộ từ xa (Remote ischemic preconditioning -RIPC)
Hiện tượng tiền thích nghi thiếu máu cục bộ từ xa (RIPC) là một chiến lược mới, không xâm lấn và hầu như không tốn kém dựa trên các giai đoạn ngắn của thiếu máu cục bộ - tái tưới máu được áp dụng ở các cơ quan xa để làm cho thận có khả năng chống lại các đợt thiếu máu cục bộ kéo dài tiếp theo. Er và cộng sự lần đầu tiên đề nghị RICP có thể dự phòng được CI-AKI ở 100 bệnh nhân nguy cơ cao được chụp mạch vành27. Sau đó, Lgarashi và cộng sự đã chứng minh được RIPC cũng có thể dự phòng CI-AKI ở những bệnh nhân có nguy cơ thấp đến trung bình. Trong cả hai thử nghiệm, RIPC được thực hiện bằng cách sử dụng băng quấn của máy đo huyết áp bơm lên trong 5 phút và xẹp xuống trong thời gian 5 phút với 4 chu kỳ như vậy trước khi làm thủ thuật. Mức áp lực bơm lên được thực hiện là tương đương với mức huyết áp tâm thu của bệnh nhân cộng thêm 50 mmHg. Đáng chú ý, cả hai thử nghiệm đều đánh giá nguy cơ CI-AKI bằng thang nguy cơ của Mehran. Một cách thuyết phục hơn, trong phân tích tổng hợp của Jiachang và cộng sự trên 1.167 bệnh nhân cho thấy tỷ lệ CI-AKI thấp hơn ở những bệnh nhân được thực hiện RIPC trước thủ thuật so với những người không thực hiện RIPC (13,5% so với 6,5%, p<0,001)21. Tuy nhiên, Moretti và cộng sự cho rằng RIPC không thể dự phòng CI-AKI ở bệnh nhân đái tháo đường. Điều này cho thấy rằng hiệu quả của RIPC trong việc dự phòng CI-AKI có liên quan đến các bệnh lý sẵn có của bệnh nhân20. Về mặt cơ học, vai trò bảo vệ của RIPC có liên quan đến việc giảm viêm, stress oxy hóa và chết tế bào theo chương trình22!. Điều thú vị là một nghiên cứu đã cho thấy renalase, một monoamin oxidase có nguồn gốc từ thận, tham gia vào quá trình bảo vệ thận qua trung gian tiền thích nghi thiếu máu cục bộ (IPC) bằng cách điều hòa yếu tố gây giảm oxy-la Mặc dù là những tiến bộ gần đây nhưng các ứng dụng lâm sàng tiềm năng của liệu pháp RIPC và liệu pháp renalase trên bệnh nhân có nguy cơ CI-AKI cần được nghiên cứu thêm.
| Bảng 10: Bảng 10. Khuyến cáo hướng dẫn châu u và Hoa Kỳ dự phòng CI-AKI sau PCI | ||||
| Chiến lược | Khuyến cáo điều trị tái tưới máu cơ tim theo ESC 2018 | Khuyến cáo PCI theo ACC/AHA/SCAI 2011 | ||
| Phác đồ | Nhóm khuyến cáo và mức chứng cứ | Phác đồ | Nhóm khuyến cáo và mức chứng cứ | |
| Bù nước muối đẳng trương | - Bù nước đầy đủ - 1 mL/kg/giờ trong 12 giờ trước và tiếp tục 24 giờ sau thủ thuật; 0,5 mL/kg/giờ nếu LVEF <35% hoặc NYHA >25. Phác đồ này nên được xem xét nếu thể tích thuốc cản quang dự kiến >100 mL | IC | - 1-1,5 mL/kg/giờ trong 3-12 giờ trước và tiếp tục 6-24 giờ sau thủ thuật - Bù nước đường tĩnh mạch thích hợp hơn qua đường miệng | IB |
| Bù nước muối đẳng trương thích hợp | Tốc độ truyền được điều chỉnh theo LVEDP hoặc lợi tiểu Furosemide tương ứng với thể tích nước muối truyền | IIbB | Không đề cập | |
| Dùng tối thiểu thể tích thuốc cản quang | Được khuyến cáo; tỉ lệ thể tích thuốc cản quang/GFE phải <3,7 | IB | Được khuyến cáo | IB |
| Dùng thuốc cản quang có áp lực thẩm thấu thấp hoặc đồng áp lực thẩm thấu | Được khuyến cáo | IA | Không đủ dữ liệu để điều chỉnh các khuyến cáo chuyên biệt | |
| Statin | Dùng trước thủ thuật Rosu- vastatin 40/20 mg hoặc Ator- vastatin 80 mg | IIaA | Không đề cập | |
| Nacetylcysteine | Không đề cập | Không sử dụng | IIIA | |
| Lọc máu dự phòng | - Tốc độ dịch thay thế 1.000 mL/giờ mà không gây ra mất dịch, bắt đầu 6 giờ trước khi làm thủ thuật - Có thể được xem xét trước những ca PC phức tạp ở những bệnh nhân có bệnh thận mạn giai đoạn 4 theo NKF | IIbB | Không đề cập | |
* Khuyến cáo cho bệnh nhân bị bệnh thận mạn tiến triển (NKF giai đoạn 3b và 4)
ACC: Trường môn Tim Hoa Kỳ; AHA: Hiệp hội Tim mạch Hoa Kỳ; CKD: bệnh thận mạn tính; ESC: Hiệp hội Tim mạch châu u; GFR: độ lọc cầu thận; LVEDP: áp lực cuối tâm trưởng thất trái LVEF: phân suất tống máu thất trái; NKF: Hội Thận Quốc gia; NYHA: Hiệp hội Tim mạch New York; PCI: can thiệp mạch vành qua da; SCAI: Hiệp hội Chụp và Can thiệp Tim mạch Hoa Kỳ. Nguồn: Neumann FJ, 2019223; Levine GN, 2011.
10.4 Vị trí đường vào và nguy cơ Cl-AKI
Bệnh thận do thuốc cản quang ở người cao tuổi
Mặc dù còn nhiều tranh cãi, việc thực hiện PCI qua đường động mạch quay có tỷ lệ chảy máu thấp hơn so với tiếp cận qua đường động mạch đùi. Phát hiện này quan trọng trong bối cảnh CI-AKI, do chảy máu nhiều có thể gây ra huyết động không ổn định làm ảnh hưởng đến tưới máu thận dẫn đến suy giảm chức năng thận và sau đó là tổn thương thận. Trong một phân tích tổng hợp của 6 nghiên cứu quan sát (tổng số 26.185 bệnh nhân) so sánh tỷ lệ mắc CI-AKI theo vị trí đường vào mạch máu cho PCI, phương pháp tiếp cận qua đường động mạch quay có liên quan đến tỷ lệ CI-AKI thấp hơn (OR=0,51, KTC 95%: 0,39-0,67,p<0,0001). Tương tự, nghiên cứu MATRIX-Access cũng cho thấy tính ưu thế của tiếp cận qua đường động mạch quay trong việc giảm nguy cơ CI-AKI (15,4% ở nhóm qua đường động mạch quay so với 17,4% ở nhóm qua đường động mạch đùi, OR = 0,87, KTC 95%: 0,77-0,98, p = 0,02).
10.5 Các dụng cụ hỗ trợ huyết động
PCI cho những bệnh nhân nguy cơ cao (choáng tim, suy tim sung huyết, hạ huyết áp,...) có thể làm tăng nguy cơ CI-AKI. Việc sử dụng các dụng cụ hỗ trợ thất trái trong thời gian ngắn nhằm duy trì ổn định huyết động và bảo vệ chức năng cơ quan đích đã cho thấy giảm được tỷ lệ CI-AKI ở những bệnh nhân này. Các dụng cụ hỗ trợ thất trái hiện có như ECMO (trao đổi oxy qua màng cơ thể), LABP (bóng đối xung động mạch chủ), dụng cụ hỗ trợ tâm thất qua da Tandem Heart TM, Percut Leather Heart Pump TM (PHP) và Impella® có thể phục vụ cho mục đích này. Trong số các dụng cụ này, Impella đã trở nên phổ biến gần đây và là dụng cụ duy nhất được phê duyệt ở Hoa Kỳ và châu u. Impella 2.5 và Impella CP được cấu tạo bằng một máy bơm thu nhỏ gắn ở đầu catheter có khả năng bơm tới 4 L máu/phút từ thất trái vào gốc động mạch chủ. Nó cũng chứa một ống dẫn duy nhất tạo điều kiện thuận lợi cho máu vào/ra qua van động mạch chủ232. Sau khi Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt dụng cụ vào năm 2008, nhiều nghiên cứu sổ bộ (PROTECT I, USpella và cVAD), các thử nghiệm ngẫu nhiên có đối chứng (PROTECT II, IMPRESS, IMPRESS trên bệnh nhân sốc nặng) và các nghiên cứu khác đã xuất hiện để đánh giá hiệu quả của dụng cụ Impella trong việc hỗ trợ huyết động cho các thủ thuật PCI nguy cơ cao, choáng tim, suy tim mất bù... Từ lâu, IABP là dụng cụ hỗ trợ thất trái được sử dụng rộng rãi nhất ở những bệnh nhân được PCI. Tuy nhiên, Dangas và cộng sự đã cho thấy sự vượt trội của Impella hơn IABP qua dữ liệu từ thử nghiệm PROTECT II, với tỷ lệ các biến cố nặng thấp hơn tại thời điểm 90 ngày sau PCI trên những bệnh nhân có nguy cơ cao”. Do không có các thử nghiệm ngẫu nhiên ngoài PROTECT II trong lĩnh vực PCI được hỗ trợ chọn lọc với Impella, vẫn còn một số điều không chắc chắn về tiềm năng đầy đủ của Impella để giảm các biến cố nặng ở những bệnh nhân có nguy cơ cao. Flaherty và cộng sự đã phân tích hồi cứu tỷ lệ AKI sau PCI ở những bệnh nhân LVEF giảm có hoặc không có hỗ trợ huyết động bằng Impella. Mẫu nghiên cứu bao gồm 230 bệnh nhân có EF dưới 35% không phụ thuộc vào chức năng thận ban đầu (2 nhóm 115 bệnh nhân, mỗi nhóm có và không có dụng cụ Impella). Chỉ 5,2% bệnh nhân ở nhóm Impella có AKI trong vòng 72 giờ sau thủ thuật so với 27,8% bệnh nhân ở nhóm không hỗ trợ Impella (p <0,001). Điều thú vị là phân tích cho thấy nhóm bệnh nhân bị suy giảm chức năng thận (GFR <60 mL/phút/1,73 m da) có tỷ lệ AKI cao hơn đáng kể ở nhóm không được hỗ trợ dụng cụ so với nhóm được hỗ trợ dụng cụ (p<0,05). Tuy nhiên, kết quả ghi nhận được từ một nghiên cứu trên những bệnh nhân trải qua PCI do nhồi máu cơ tim cấp có biến chứng choáng tim cho thấy việc sử dụng Impella có liên quan đến nguy cơ xuất huyết nặng và tử vong nội viện cao hơn so với LABP. Cuối cùng, với số dữ liệu hiện nay còn hạn chế nên buộc phải nghiên cứu thêm để xác định nhóm bệnh nhân nguy cơ cao nào được PC1 có thể có hoặc không có lợi từ việc sử dụng đồng thời phương pháp hỗ trợ tuần hoàn cơ học.
10.6 Điều trị thay thế thận
Ít hơn 1% bệnh nhân bị CI-AKI cần phải lọc máu, con số này cao hơn một chút ở những bệnh nhân có suy thận sẵn trước đó (3,1%) và ở những bệnh nhân được can thiệp mạch vành qua da cấp cứu do nhồi máu cơ tim (3%). Tuy nhiên, ở những bệnh nhân đái tháo đường và suy thận nặng, tỷ lệ phải lọc máu có thể tăng lên đáng kể, lên đến 12%. Những bệnh nhân được lọc máu thường có dự hậu xấu hơn với tỷ lệ tử vong nội viện là 35,7% (so với 7,1% ở nhóm không lọc máu) và tỷ lệ sống sót sau 2 năm chỉ là 19%.
Thuốc cản quang có tính ưa mỡ thấp, ít liên kết với protein huyết tương và chuyển đổi sinh học tối thiểu. Chúng nhanh chóng đạt trạng thái cân bằng khi trao đổi qua màng mao mạch và có thể tích phân bố tương đương với thể tích dịch ngoại bào. Ở những bệnh nhân có chức năng thận bình thường, thuốc cản quang được bài tiết qua cầu thận đầu tiên và sự giảm nồng độ trong huyết tương của thuốc tuân theo một hàm số mũ gồm hai giai đoạn: giai đoạn phân phối và giai đoạn thải trừ. Ở bệnh nhân suy thận, giá trị thanh thải ở thận giảm. Ví dụ, 50% thuốc cản quang có độ thẩm thấu thấp (iomeprol) được thải trừ trong vòng 2 giờ ở người khỏe mạnh, so với 16-84 giờ ở bệnh nhân suy thận nặng.
Ở những bệnh nhân đã được lọc máu, các vấn đề thường được ghi nhận khi sử dụng thuốc cản quang bao gồm quá tải thể tích, độc tính trực tiếp của thuốc cản quang đối với các nephron không chức năng còn lại và các mô cơ quan khác. Những vấn đề này được đặt ra để làm cơ sở cho việc xem xét tính cần thiết phải lọc máu cấp cứu và loại bỏ thuốc cản quang.
Thuốc cản quang có thể được loại bỏ khỏi máu một cách hiệu quả bằng cách lọc máu ngắt quãng hoặc liên tục và một lần lọc có hiệu quả sẽ loại bỏ 60-90% thuốc cản quang. Dựa trên những quan sát này, một số nghiên cứu đã khảo sát giá trị dự phòng của chạy thận nhân tạo ở bệnh nhân bệnh thận mạn có nguy cơ cao bị AK. Hai phân tích tổng hợp cho thấy điều trị thay thế thận không những không làm giảm tỷ lệ CI-AKI so với dự phòng thông thường, mà nguy cơ CI-AKI có xu hướng cao hơn khi chạy thận nhân tạo. Lý do tại sao điều trị thay thế thận không có lợi trong việc dự phòng CI-AKI vẫn chưa rõ ràng. Có lẽ do tổn thương thận đã xảy ra sớm sau khi dùng thuốc cản quang khiến việc loại bỏ thuốc cản quang bằng điều trị thay thế thận không còn hiệu quả nữa. Thật vậy, giảm tưới máu thận và rất có thể là thiếu máu cục bộ xuất hiện trong những phút đầu tiên sau khi tiêm thuốc cản quang.
Các lợi ích có thể có của việc chạy thận nhân tạo dự phòng đã được đề nghị cho những bệnh nhân bị bệnh thận nặng hơn. 82 bệnh nhân có sCr ban đầu trung bình ổn định là 4,9 mg/dL và độ thanh thải creatinin <15 mL/phút/1,73 m, được chỉ định ngẫu nhiên chạy thận nhân tạo ngắt quãng (sớm ngay sau khi chụp mạch vành hoặc trong vòng 12 giờ) so với không chạy thận nhân tạo (nhóm chứng). Kết quả cho thấy cần phải điều trị thay thế thận tạm thời chiếm 35% ở nhóm chứng và 2% nhóm chạy thận nhân tạo ngắt quãng (p<0,001). 13% bệnh nhân ở nhóm chứng, nhưng không có bệnh nhân nào trong nhóm chạy thận nhân tạo ngắt quãng cần phải lọc máu lâu dài sau khi xuất viện (p = 0,018). Đối với những bệnh nhân không cần lọc máu lâu dài, 13 bệnh nhân trong nhóm chứng (37%) và 2 trong nhóm chạy thận nhân tạo ngắt quãng (5%) có sự gia tăng nồng độ creatinin huyết thanh >1 mg/dL so với ban đầu khi xuất viện (p<0,001). Kết luận của nghiên cứu cho thấy lọc máu dự phòng có hiệu quả trong việc cải thiện kết cục thận ở bệnh nhân suy thận mạn được chụp mạch vành.
Dựa trên những kết quả gây tranh cãi này, các hướng dẫn của KDIGO 2012 về AKI đề nghị rằng điều trị thay thế thận dự phòng không được sử dụng để loại bỏ thuốc cản quang ở những bệnh nhân có tăng nguy cơ CI-AKI.
11 KẾT LUẬN
Thuốc cản quang gây ra AK1 bao gồm một phổ các mức độ nghiêm trọng, nhưng nhìn chung có liên quan đến dự hậu ngắn hạn và lâu dài xấu, đặc biệt là sau các thủ thuật phức tạp được thực hiện trên những bệnh nhân mắc nhiều bệnh đi kèm. Do đó, bất kỳ chiến lược nào nhàm mục đích giảm nguy cơ của AKI (đánh giá nguy cơ cẩn thận, giảm thể tích thuốc cản quang, các protocol dự phòng) nên được thực hiện, đặc biệt ở những bệnh nhân có nhiều yếu tô nguy cơ. Những bệnh nhân này có thể được phân tầng thông qua các hệ thống tính điểm đơn giản và điều này nên được áp dụng rộng rãi nhiều hơn trong thực hành lâm sàng. Nhìn chung, để đánh giá tốt hơn hiệu quả của các chiến lược dự phòng tiềm năng đối với CI-AKI, những bệnh nhân trải qua các thủ thuật phức tạp không chỉ được phân tầng theo eGFR mà còn phải đánh giá tất cả các yếu tố nguy cơ có khả năng liên quan đến nguy cơ cao mắc CI-AKI. Hơn thế nữa, kết quả của các chiến lược phòng ngừa không nên được đánh giá chỉ liên quan đến tỷ lệ CI-AKI, mà còn phải chú ý đến dự hậu của bệnh nhân.
Trong mọi trường hợp, nên cân bằng giữa nguy cơ CI-AKI với lợi ích của việc dùng thuốc cản quang. Khi nào có thể, các phương pháp hình ảnh thay thế, không cần thiết dùng thuốc cản quang hoặc nhằm mục đích hạn chế thể tích thuốc cản quang, nên được được cân nhắc ở những bệnh nhân có nguy cơ cao.
Hiện nay, việc xác định thường quy những bệnh nhân có nguy cơ cao, chế độ bù nước thích hợp hoặc với nước muối đẳng trương hoặc là natri bicacbonat, ngưng các thuốc gây độc cho thận và dùng tối thiểu thể tích thuốc cản quang được xem như là các phương pháp dự phòng có thể được đề nghị cho thực hành lâm sàng hàng ngày. Lợi ích của các chiến lược khác, chẳng hạn như lựa chọn thuốc cản quang đồng áp lực thẩm thấu hoặc áp lực thẩm thấu thấp, NAC qua đường uống, statin và RIPC, cần được xác nhận bằng nhiều nghiên cứu thêm nữa. Cuối cùng, trên bệnh nhân bệnh thận mạn tiến triển, không có bằng chứng chắc chắn ủng hộ hiệu quả của việc sử dụng thường quy điều trị thay thế thận chu phẫu. Về vấn đề này, có ý kiến cho rằng cần phải cá thể hóa trong việc đánh giá từng trường hợp theo lâm sàng cụ thể.
12 Tài liệu tham khảo
1. Nguyễn Văn Tân, Nguyễn Văn Trí, Nguyễn Thanh Huân (2023). “Bệnh thận do thuốc cản quang ở người cao tuổi”, Cấp cứu các bệnh thường gặp ở người cao tuổi. Nhà xuất bản Y học, trang 391-444. Tải bản PDF tại đây
2. Bartels, E. D., Brun, et al. (1954) Acute Annria following intravenous pyelography in a pa- tient with myelomatosis. Acta Medica Scandinavica 150, 297-302.
3. Nash, K., Hafeez, et al. Hospital-acquired renal insufficiency. Am. J. Kidney Dis. 39, 930- 936 (2002).
4. McCullough, P. A., Choi, et al. (2016) Contrast-Induced Acute Kidney Injury. Journal of the American College of Cardiology 68, 1465-1473.
5. McDonald RJ, McDonald JS, Bida JP, et al. Intravenous contrast material-induced nephrop- athy: causal or coincident phenomenon? Radiology 2013; 267(1):106-118.
6. Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-in- duced nephropathy after percutaneous coronary intervention: development and initial vali- dation. J Am Coll Cardiol 2004;44:1393-9.
7. Stacul F, van der Molen A, Reimer P, et al. Contrast induced nephropathy: updated ESUR Contrast Media Safety Committee guidelines. Eur Radiol 2011; 21:2527-41.
8. Slocum NK, Grossman PM, Moscucci M, et al. The changing definition of contrast-induced nephropathy and its clinical implications: insights from the Blue Cross Blue Shield of Mich- igan Cardiovascular Consortium (BMC2). Am Heart J 2008;163: 829-34.
9. Bellomo R, Ronco C, Kellum JA, et al. Acute renal failure - definition, outcome mea- sures, animal models, fluid therapy and information technology needs: the Second In- ternational Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care 2004;8:R204-12.
10. Mehta RL, Kellum JA, Shah SV, et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007; 11:R31.
11. Group AKIW. Kidney Disease: Improving Global Outcomes (KDIGO) - Clinical practice guideline for acute kidney injury. Kidney Int Suppl 2012;2: 1-138.
11. Dharnidharka VR, Kwon C, Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis. Am J Kidney Dis 2002;40:221-6.
12. Briguori C, Visconti G, Rivera NV, et al. Cystatin C and contrast-induced acute kidney inju- ry. Circulation 2010;121:2117-22.
13. Quintavalle C, Anselmi CV, De Micco F, et al. Neutrophil gelatinase-associated lipocalin and contrast-induced acute kidney injury. Circ Cardiovasc Interv 2015;8:e002673.
14. Aspelin P, Aubry P, Fransson SG, et al. Nephrotoxic effects in high-risk patients undergoing angiography. N Engl J Med 2003;348:491-9.
Sreenivasan J, Zhuo M, Khan MS, et al. Anemia (hemoglobin 13 g/dL) as a risk factor for contrastinduced acute kidney injury following coronary angiography. Am J Cardiol 2018;122:961-5.
15. Nijssen EC, Rennenberg RJ, Nelemans PJ, et al. Prophylactic hydration to protect renal function from intravascular iodinated contrast material in patients at high risk of contrast-in- duced nephropathy (AMACING): a prospective, randomised, phase 3, controlled, open-la- bel, non-inferiority trial. Lancet 2017;6736:1-11.
16. Lorenzo Azzalini, Sanjog Kalra. Contrast-Induced Acute Kidney Injury-Definitions, Epidemiology, and Implications. Intervent Cardiol Clin 2020; 9: 299-309.
17. Azzalini L, Vilca LM, Lombardo F, et al. Incidence of contrast-induced acute kidney injury in a large cohort of all-comers undergoing percutaneous coronary intervention: comparison of five contrast media. Int J Cardiol 2018;273:69-73.
18.Azzalini L, Poletti E, Lombardo F, et al. Risk of contrast-induced nephropathy in patients undergoing complex percutaneous coronary intervention. Int J Cardiol 2019;290:59-63.
19. From AM, Al Badarin FJ, McDonald FS, et al. lodixanol versus low-osmolar contrast media for prevention of contrast induced nephropathy meta-analysis of randomized, controlled trials. Circ Cardiovasc Interv 2010;3:351-8.
20. Tsai TT, Patel UD, Chang TI, et al. Contemporary incidence, predictors, and outcomes of acute kidney injury in patients undergoing percutaneous coronary interventions: insights from the NCDR Cath-PCI registry. JACC Cardiovasc Interv 2014;7:1-9.
21. Inohara T, Kohsaka S, Miyata H, et al. Performance and validation of the U.S. NCDR acute
kidney injury prediction model in Japan. J Am Coll Cardiol 2016; 67:1715-22.
22. Gurm HS, Seth M, Dixon SR, et al. Contemporary use of and outcomes associated with ul- tra-low contrast volume in patients undergoing percutaneous coronary interventions. Cathe- ter Cardiovasc Interv 2019;93:222-30.
23. Slocum NK, Grossman PM, Moscucci M, et al. The changing definition of contrast-induced nephropathy and its clinical implications: insights from the Blue Cross Blue Shield of Mich- igan Cardiovascular Consortium (BMC2). Am Heart J 2008;163: 829-34.
24. Gurm HS, Seth M, Dixon S, et al. Trends in contrast volume use and incidence of acute kidney injury in patients undergoing percutaneous coronary intervention. JACC Cardiovasc Interv 2018; 11:509-11.
25. Marenzi G, Lauri G, Assanelli E, et al. Contrastinduced nephropathy in patients undergoing
primary angioplasty for acute myocardial infarction. J Am Coll Cardiol 2004;44:1780-5. 26. Maioli M, Toso A, Leoncini M, et al. Effects of hydration in contrast-induced acute kid- ney injury after primary angioplasty: a randomized, controlled trial. Circ Cardiovasc Interv 2011;4:456-62.
27. Azzalini L, Spagnoli V, Ly HQ. Contrast-induced nephropathy: from pathophysiology to
preventive strategies. Can J Cardiol 2016;32:247-55.
28. Maioli M, Toso A, Leoncini M, et al. Persistent renal damage after contrast-induced acute kid- ney injury: incidence, evolution, risk factors, and prognosis. Circulation 2012;125:3099-107. 29. Kirtane AJ, Doshi D, Leon MB, et al. Treatment of higher-risk patients with an indication. for revascularization: evolution within the field of contemporary percutaneous coronary in- tervention. Circulation 2016;134:422-31.
30. Demir OM, Lombardo F, Poletti E, et al. Contrastinduced nephropathy after percutaneous coronary intervention for chronic total occlusion versus non-occlusive coronary artery dis- ease. Am J Cardiol 2018;122:1837-42.

